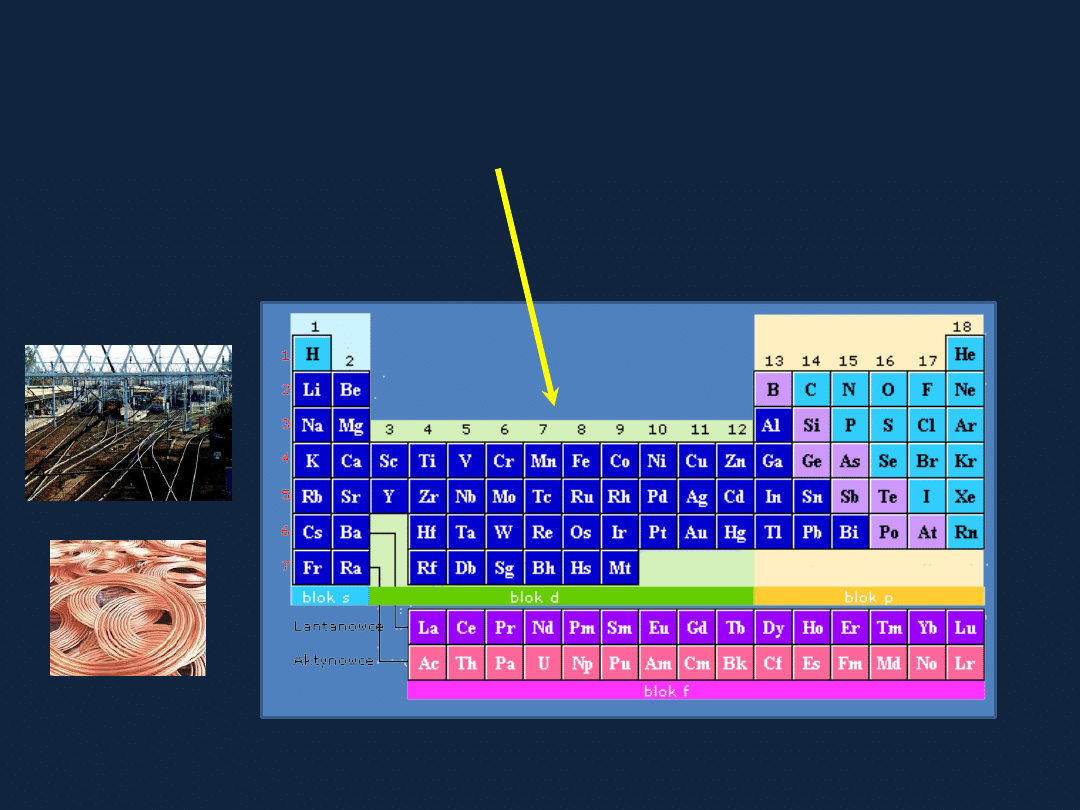
PIERWIASTKI BLOKU D
UKŁAD OKRESOWY PIERWIASTKÓW
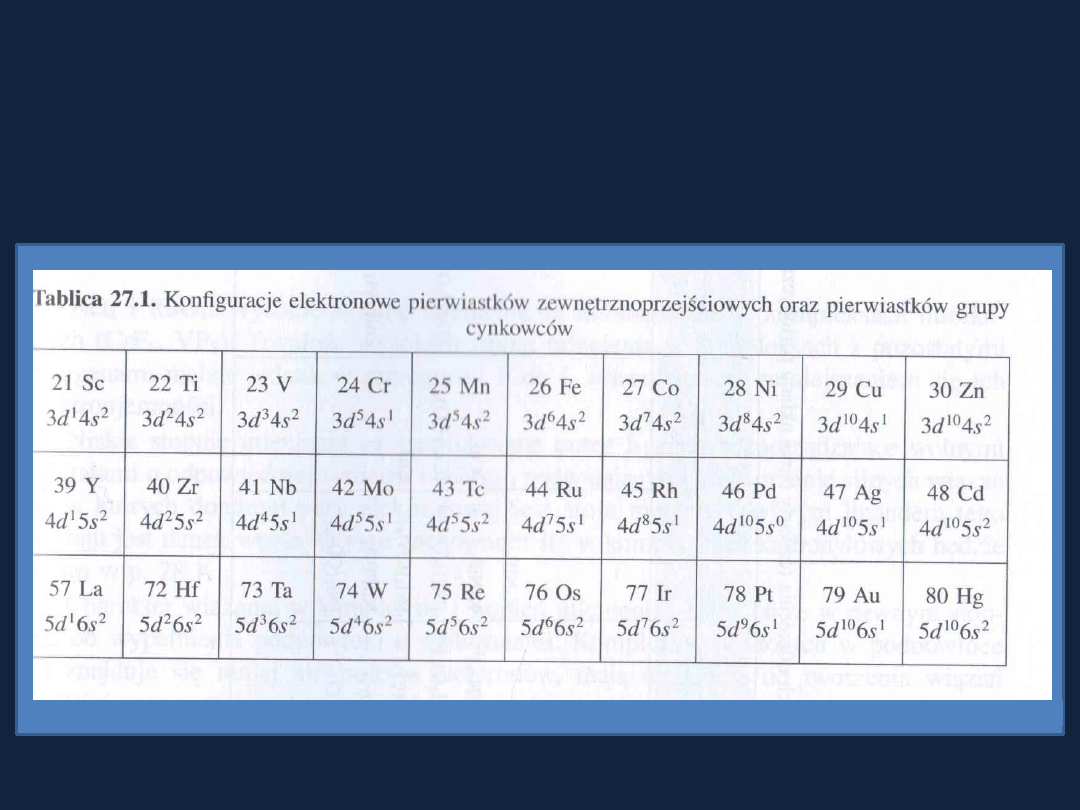
Tab. Str 27.1 str 831 Bielanski
Pierwiastki bloku d
– metale, dobre przewodniki prądu elektrycznego
i
ciepła, plastyczne, mogą tworzyć stopy z innymi metalami. Zazwyczaj
wykazują wysokie temperatury wrzenia i topnienia. Posiadają dużą gęstość.
Szczególna trwałość konfiguracji d
5
i d
10
.

Związki pierwiastków przejściowych są na ogół barwne – jest to
związane z możliwością przenoszenia elektronów na wyższe poziomy
energetyczne (potrzebna energia odpowiada energii promieniowania
światła w zakresie widzialnym).
NiCl
2
CoCl
2
CuSO
4
Fe
2
O
3
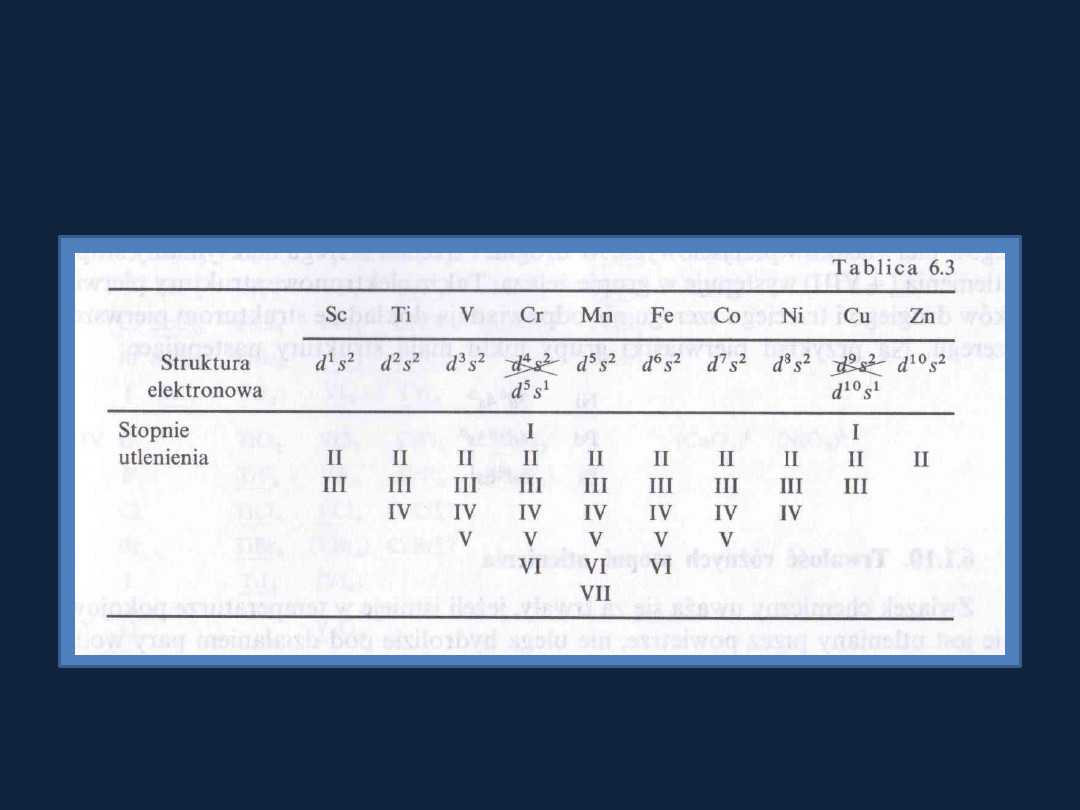
STOPIEŃ UTLENIENIA
Stopnie utlenienia pierwiastków przejściowych można porównad z ich strukturą
elektronową.
Tab. 6.3 str 303 Lee
Cząsteczki, w których metal występuje na wysokim stopniu utlenienia są
często dobrymi utleniaczami np. KMnO
4
.

Zmiana charakteru wybranych tlenków w zależności od stopnia utlenienia
metalu
Chrom
CrO (zasadowy)
Cr
2
O
3
(amfoteryczny)
CrO
3
(kwasowy)
Mangan
MnO (zasadowy)
Mn
2
O
3
(zasadowy)
MnO
2
(amfoteryczny)
Mn
2
O
7
(kwasowy)
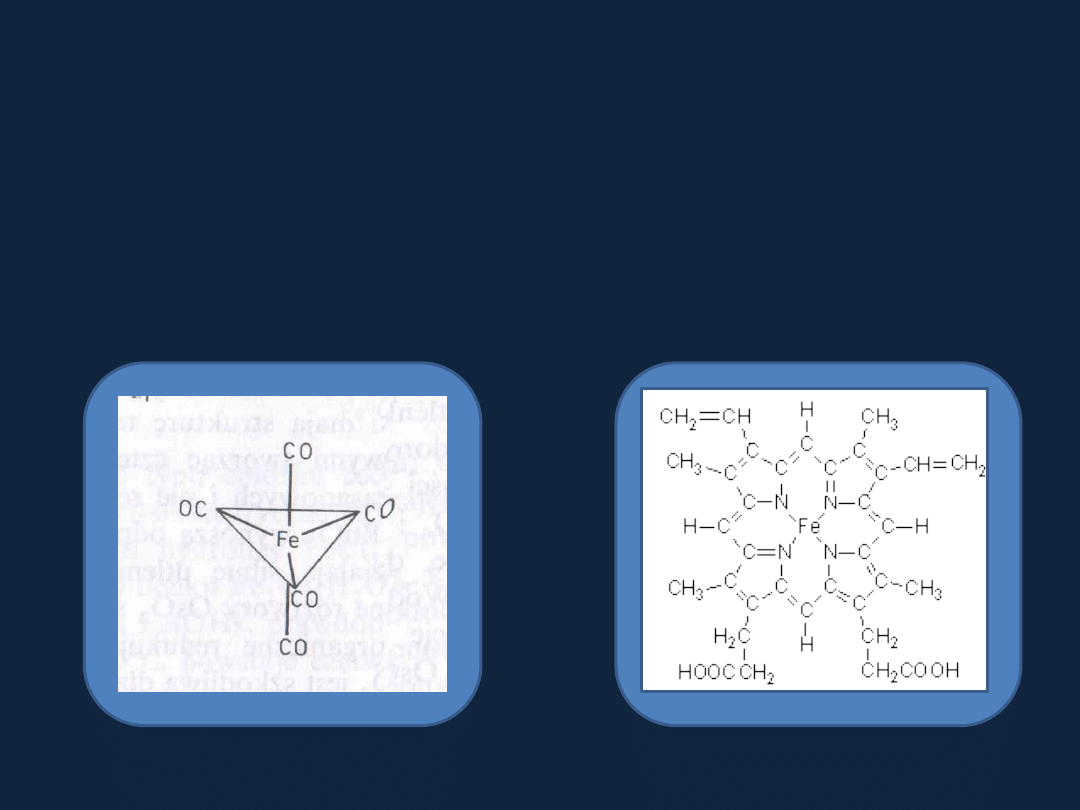
ZDOLNOŚĆ DO TWORZENIA KOMPLEKSÓW
Pierwiastki bloku d
tworzą wiele związków koordynacyjnych.
Wiąże się to z małymi rozmiarami i dużym ładunkiem jonów metali bloku d
oraz
obecnością w ich atomach pustych orbitali, które mają odpowiednią
energie do
przyjęcia wolnych par elektronowych oddawanych przez ligandy.
hemoglobina
Fe(CO)
5
Rys. 6.15a str 354 LEE
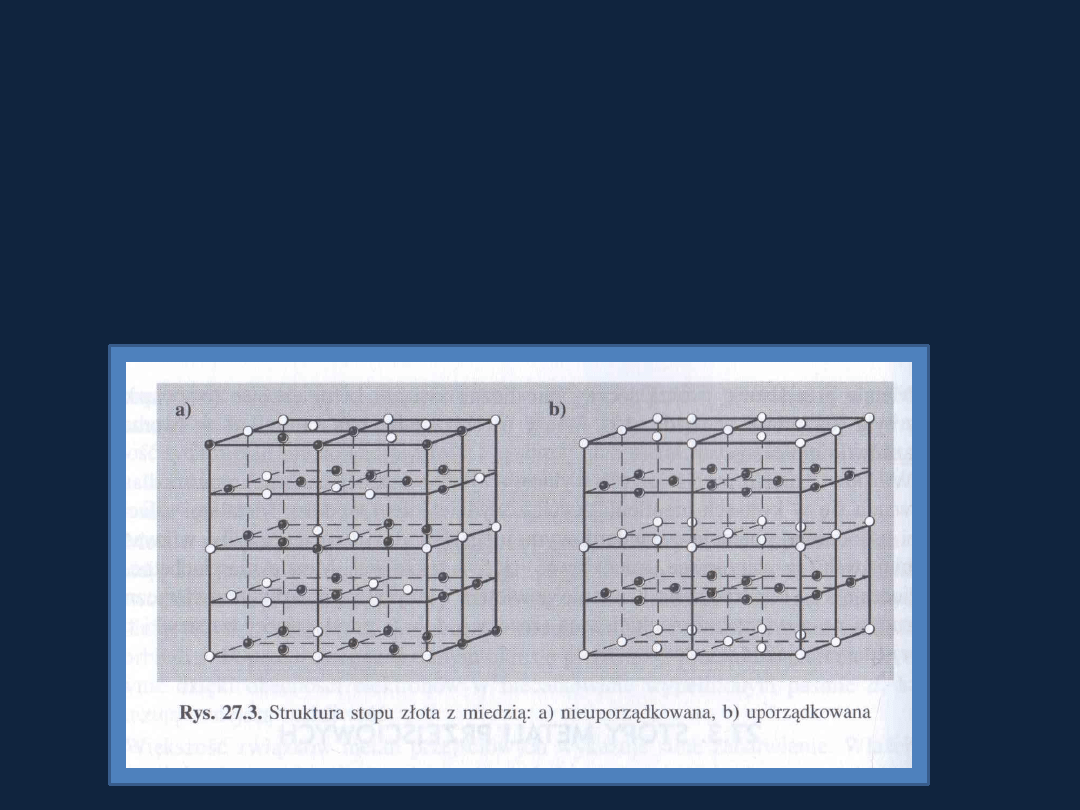
TWORZENIE STOPÓW
Zbliżone
rozmiary
atomów
–
możliwość
tworzenia
stopów
substytucyjnych.
Struktura
uporządkowana i nieuporządkowana.
Stopy szybko
schładzane cechują się z reguły nieuporządkowaną
strukturą.
Rys. 27.3 str 838 Bielanski

Przykłady popularnych stopów:
Brąz
– 90% miedzi, do 10% cyny – w starożytności
wytwarzanie
przedmiotów codziennego użytku, ozdób.
Mosiądz
– stop miedzi i cynku (do 40%). Może zawierać
dodatki innych metali, takich jak Pb, Al, Sn, Mn, Fe, Cr.
Z
mosiądzu
wytwarza
się
armaturę,
instrumenty
muzyczne,
łuski amunicji, monety, klamki, dzwony, okucia.
Nadaje
się do obróbki plastycznej na zimno.
Tombak
– Cu z Zn, zawiera powyżej 80% miedzi. Cechuje
się żółtą barwą przypominającą złoto, jest jednak mało
wartościowy.
Stal
– stop Fe i C (do ok. 2%), inne składniki to Cr, Cu,
Mo, Ti, W, itd.
Właściwości stali zależą od odmiany polimorficznej stopu:
γ-Fe martenzyt, α-Fe ferryt, Fe
3
C (cementyt)
– twardość.
Inne metale
też mogą tworzyć węgliki, co zwiększa
twardość stali.

ŻELAZO
WYSTĘPOWANIE
Rudy żelaza – Fe
2
O
3
hematyt, Fe
3
O
4
magnetyt, Fe
2
O
3
∙ nH
2
O limonit,
FeCO
3
syderyt, FeS
2
piryt.
OTRZYMYWANIE
Na skalę przemysłową żelazo otrzymuje się w wielkich piecach (wysokość
ok. 30m)
Metoda polega na redukcji rud tlenkowych koksem.
Zanieczyszczenia usuwane są przy użyciu wapna palonego, gliny skaleni
(w zależności od charakteru domieszek – kwasowy/zasadowy)
Wyprodukowanie 1 kg Fe = zużycie ok. 1,75 kg rudy, 0,75kg koksu i 0,25
CaCO
3
.
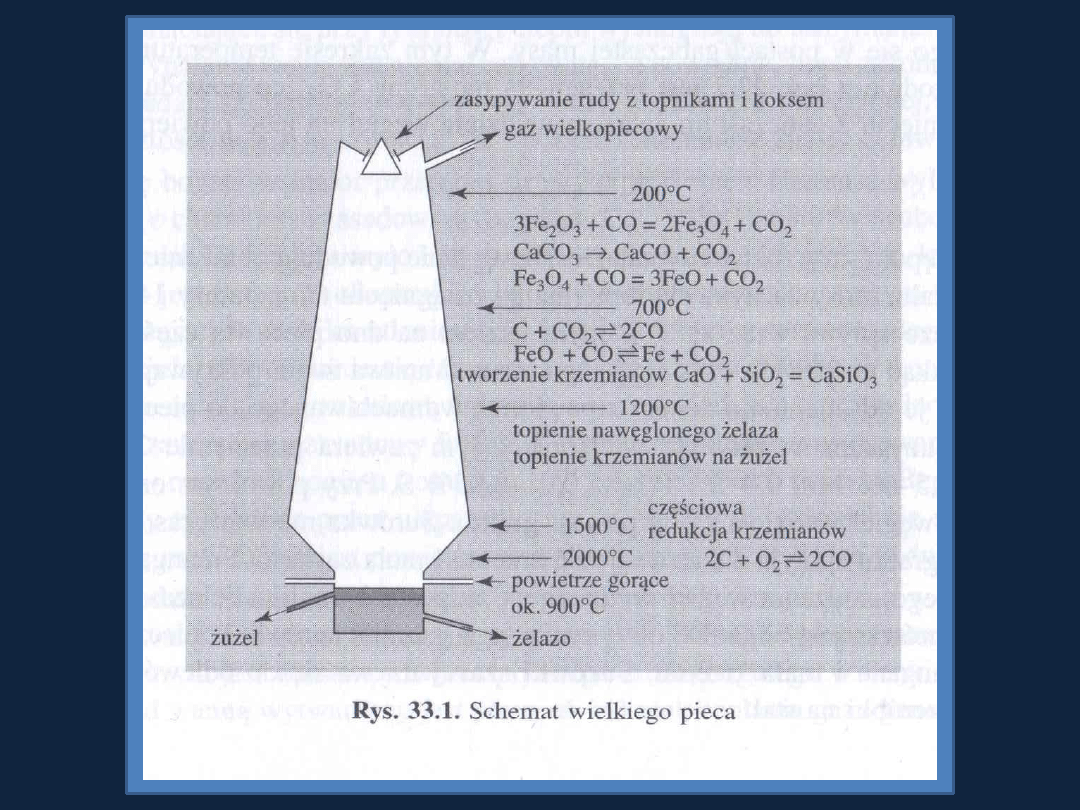
Rys 33.1 str 919
Bielanski

ALUMINOTERMIA
Proces metalurgiczny otrzymywania metali poprzez
redukcję ich
tlenków sproszkowanym lub zgranulowanym glinem.
Substraty
tworzą mieszankę termitową, która reaguje z wydzieleniem
dużych ilości ciepła, na skutek czego jej temperatura dochodzi do
3000K (wykorzystywana do produkcji manganu, chromu, wanadu).
Przykładowe reakcje:
Cr
2
O
3
+ 2Al
→ Al
2
O
3
+ Cr (wys. temperatura)
3MnO
2
+ 4Al
→ 3Mn + 2Al
2
O
3
(wys. temperatura)
Chrom
może być także otrzymywany przez redukcję minerału chromitu
węglem w piecu elektrycznym
FeCr
2
O
4
+ 4C
→ Fe + 2Cr + 4CO
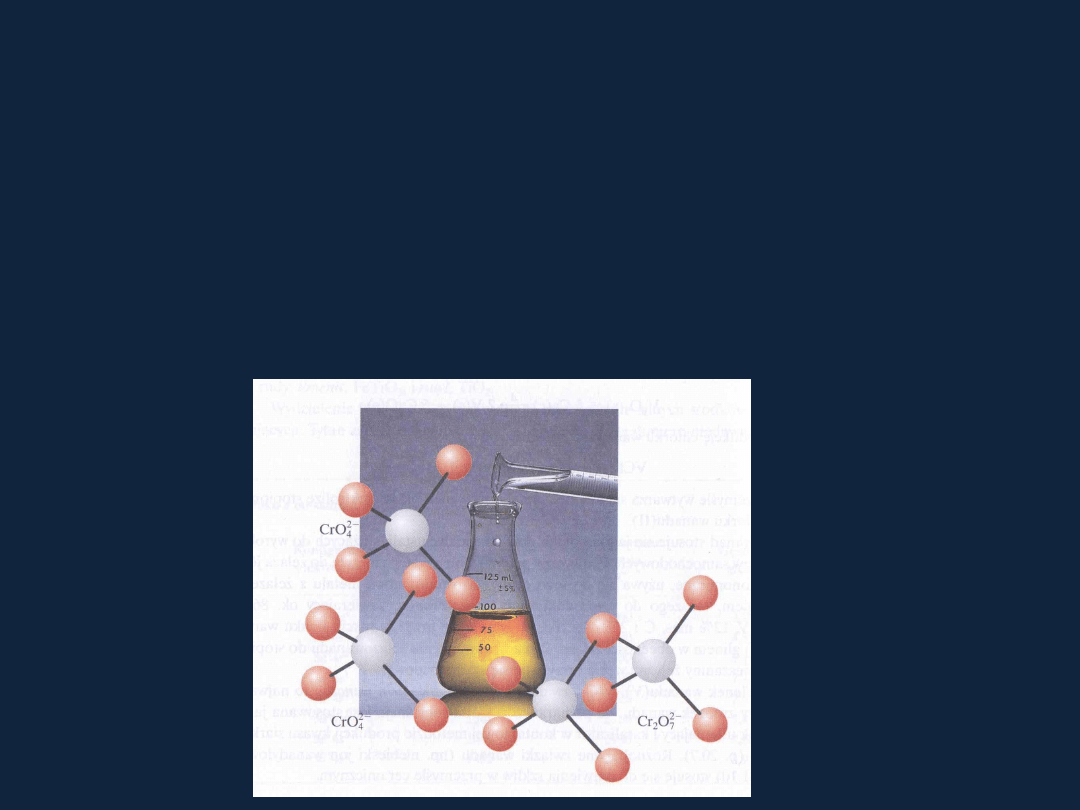
Chromiany
W
obecności kwasu jon chromianowy (żółty) przekształca się w jon
dichromianowy
(pomarańczowy)
2CrO
4
2-
+ 2H
+
→ Cr
2
O
7
2-
+ H
2
O
Zakwaszone roztwory
dichromianów mogą służyć jako użyteczne środki
utleniające
Cr
2
O
7
2-
+ 14H
+
+ 6e
→ 2Cr
3+
+ 7H
2
O
Rys. 21.11 str.
976 Atkins
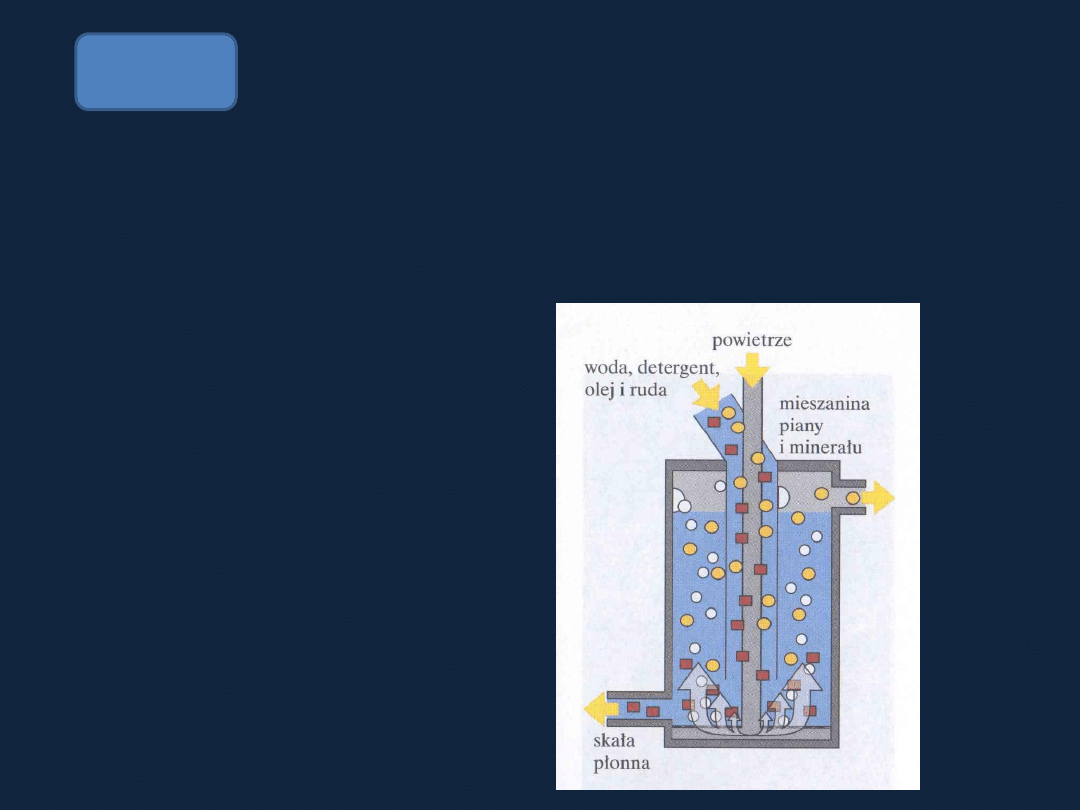
MIEDŹ
Otrzymywana
głównie z rud siarczkowych – chalkopirytu CuFeS
2
Ruda oddzielana jest od
materiału skalnego metodą flotacji pianowej
(wykorzystuje
się zjawisko zwilżania rud siarczkowych przez olej, a nie
wodę).
Olej zmieszany z detergentami
i
wodą jest wprowadzany do
złoża. Zwilżone cząstki minerału
wypływają
wraz z
pianą na
powierzchnię.
Rys 21.16
str 981
Atkins

Dalszy etap na prażeniu wzbogaconej rudy w powietrzu
2CuFeS
2
+ 3O
2
→ 2CuS + 2FeO + 2SO
2
Następnie przetapia się CuS przedmuchując sprężone powietrze przez
mieszaninę
CuS + O
2
→ Cu + SO
2
Odpadowy SO
2
może być wykorzystany jako surowiec do produkcji
kwasu siarkowego.

KOROZJA MIEDZI
Miedz w wilgotnym powietrzu w obecności CO
2
pokrywa się zieloną powłoką
„patyny”
2Cu + H
2
O + O
2
+ CO
2
→ Cu
2
(OH)
2
CO
3
Bladozielony produkt
– hydroksowęglan miedzi
W
obecności powietrza powierzchnia miedzi może pokrywać się
czerwoną warstwą Cu
2
O,
która może utleniać się do czarnego CuO.
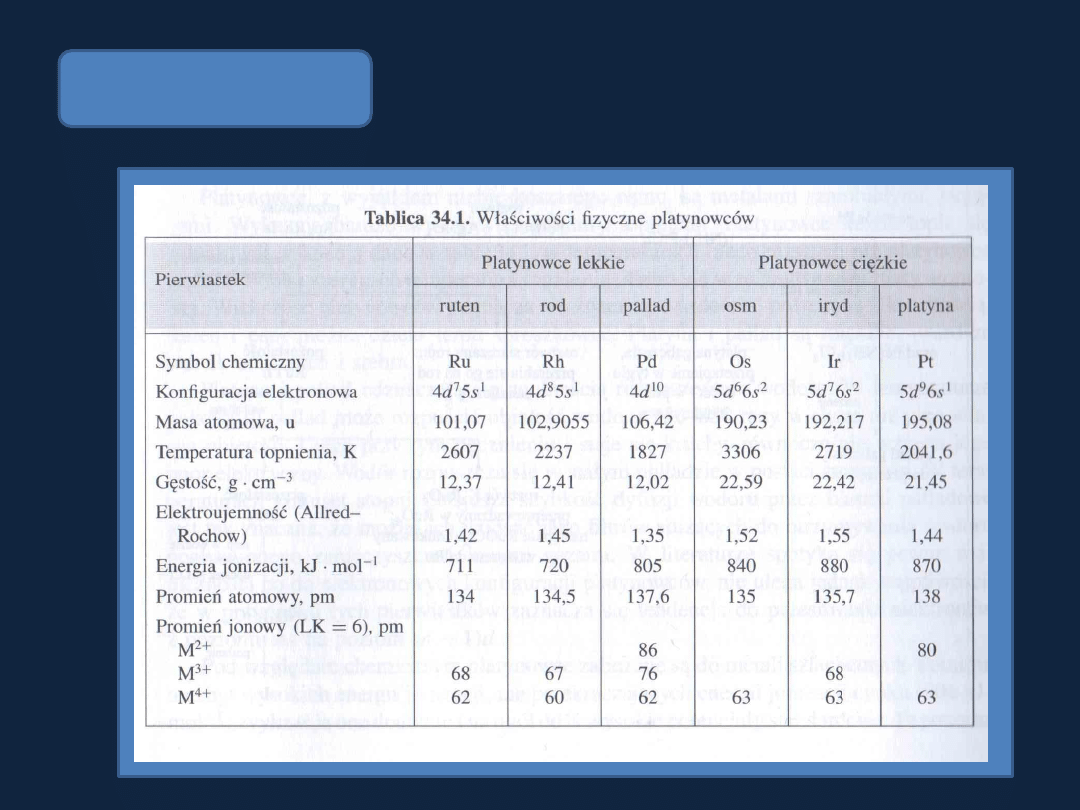
PLATYNOWCE
Tab. 34.1 str 949
Bielanski

WYSTĘPOWANIE
Platynowce
należą do pierwiastków o małym rozpowszechnieniu (2,5 ∙ 10
-6
%
skorupy ziemskiej) -
najwięcej Pd (około połowa).
Najczęściej występują w postaci rodzimej oraz jako zanieczyszczenia
siarczkowych i arsenkowych rud Ni i Cu.
Platynowce w stanie wolnym najlepiej
otrzymać przeprowadzając rozkład
termiczny ich
związków.
WŁAŚCIWOŚCI CHEMICZNE
Platyna i pallad
odznaczają się zdolnością do rozpuszczania wodoru.
Platynowce
są zaliczane do metali szlachetnych.
Mimo niezbyt wysokich energii aktywacji
wykazują wysokie potencjały
standardowe (o potencjale standardowym
oprócz energii jonizacji decyduje
także ciepło sublimacji).
Kwas azotowy reaguje tylko z palladem.
Działaniu wody królewskiej ulegają
platyna, pallad i czysty osm.
Platynowce w
podwyższonych temperaturach ulegają działaniu F i Cl oraz
reagują z S i P.

ZASTOSOWANIE
Najszersze zastosowanie
wśród platynowców – Pt.
Odporność na wysokie temperatury oraz odporność chemiczną powoduje,
że platynę wykorzystuje się do wyrobu tygli i parownic używanych
w procesach chemicznych.
W
związku ze swoją niską reaktywnością platyna używana jest
w jubilerstwie,
będąc metalem cenniejszym od złota i srebra.
Różne procesy katalityczne – np. proces otrzymywania H
2
SO
4
, faza
aktywna w katalizatorach samochodowych.
Wzorzec kilograma wykonanego ze stopu platyny z irydem (przechowywany
w
Międzynarodowym Biurze Miar i Wag w Sèvres koło Paryża.
Wyszukiwarka
Podobne podstrony:
ChOiN II JG wyklad 3
ChOiN II JG wyklad 2
ChOiN II JG wyklad 7
ChOiN I JG wyklad 6
ChOiN I JG wyklad 5
ChOiN I JG wyklad 2
ChOiN I JG wyklad 3
ChOiN I JG wyklad 1
ChOiN I JG wyklad 4
Syllabus -Negocjacje jako sposób, Prywatne, psychologia wsfiz, semestr II, Negocjacje wykłady
pytania testowe i chemia budowlana -zestaw3, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
Położnictwo wykład 4, Pielęgniarstwo, rok II, położnictwo, wykłady
BO II stacjonarne wykład nr 09
PRAWO FINANSOWE 29.04.2012, II rok, Wykłady, Prawo finansowe
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
DROGA I PRĘDKOŚĆ STATKU, Akademia Morska Szczecin, SEMESTR II, NAWIGACJA, wykłady II sem
więcej podobnych podstron