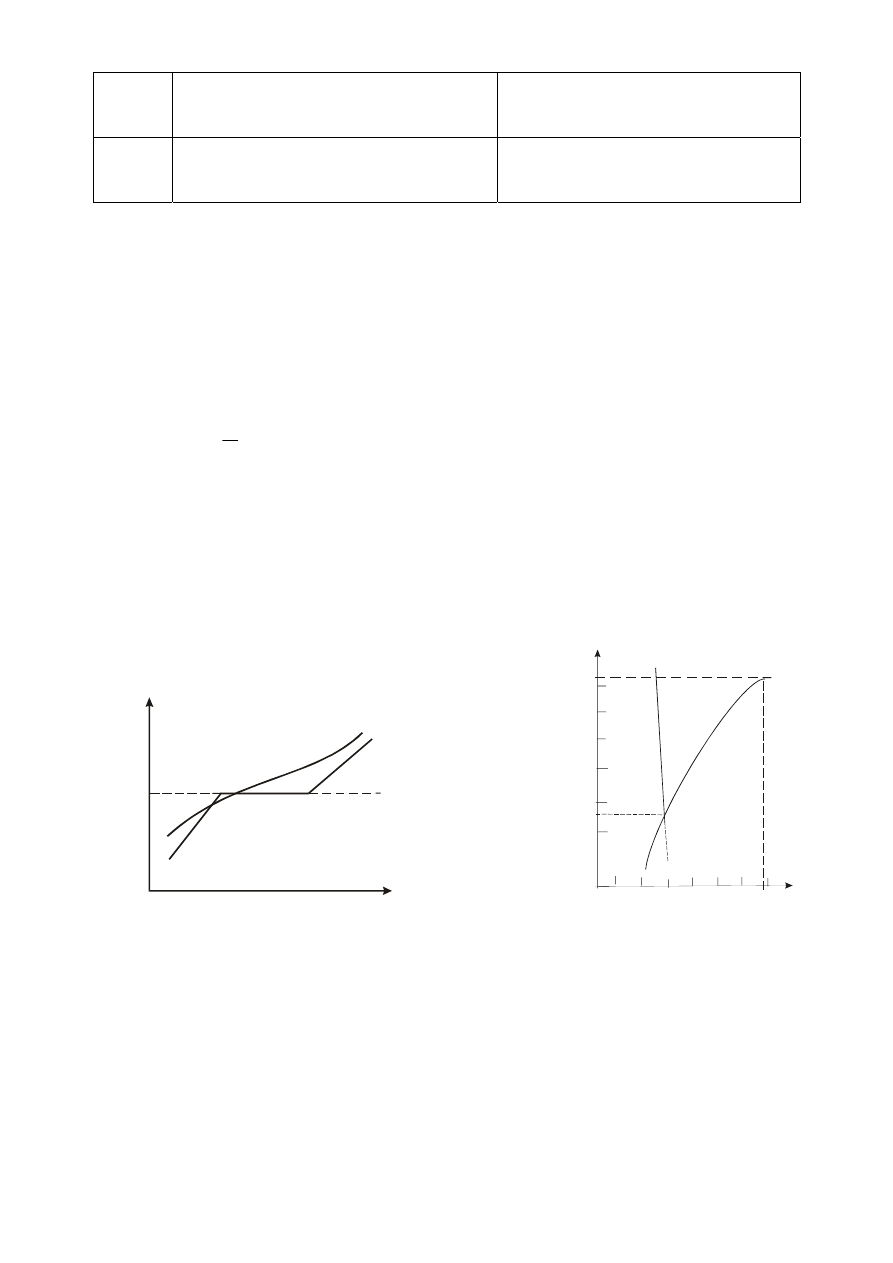
Nr pary
Imię i nazwisko studenta
Wydział
grupa
data Nazwisko
prowadzącego Zaliczenie
C3.
Wyznaczanie ciepła topnienia lodu metodą kalorymetryczną
Topnienie jest przemianą fazową ciała stałego w ciecz. Proces ten związany jest z pochłanianiem
ciepła Q oraz ze zwiększaniem się entropii*.
*entropia – funkcja stanu, charakteryzująca kierunek przebiegu spontanicznych
procesów w układach termodynamicznych. Jej jednostką jest dżul/kelwin [J/K].
Ze zmianą entropii związane jest ciepło przemiany fazowej. Jest to tzw. ciepło utajone, które
w przypadku przejścia ze stanu stałego w ciekły, nazywa się ciepłem topnienia.
Ciepło topnienia jest to ilość ciepła, potrzebna do stopienia 1 kg substancji w temperaturze
topnienia:
m
Q
L
Q
=
. Jednostką jest J/kg.
Dla ciał krystalicznych – przy stałym ciśnieniu zewnętrznym, proces topnienia zachodzi
w określonej temperaturze, charakterystycznej dla danego ciała, zwanej temperaturą topnienia.
Dostarczane z zewnątrz ciepło jest zużywane na osłabienie wiązań międzycząsteczkowych, a nie na
zwiększanie energii cieplnych drgań atomów (stąd nazwa: ciepło utajone), na skutek czego,
w procesie topnienia ciał krystalicznych temperatura ciała nie ulega zmianie (rys.1 - linia 1).
W temperaturze tej ciało może współistnieć w postaci stałej i ciekłej.
Dla ciał bezpostaciowych (np. szkła, żywicy, polimeru) proces topnienia nie odbywa się w stałej
temperaturze, a podczas ich ogrzewania ciała stopniowo miękną (rys.1 - linia 2).
Krzepnięcie - jest procesem odwrotnym do topnienia i zachodzi w tej samej temperaturze.
t
Q
t
top
2
1
CIAŁO STAŁE
CIECZ
1
10
10
10
10
10
10
10
3
4
5
6
7
2
P
a
100
200
300
400
500
600
700
T
K
1
2
3
P
KRYSZTAŁ
(lód)
CIECZ
(woda)
GAZ
(para wodna)
Rys.1
Rys.2
Temperatury, zarówno topnienia jak i wrzenia zależą od ciśnienia (rys. 2). Punkt P, nazywany
punktem potrójnym, określa warunki, w których ciało może istnieć równocześnie w trzech fazach.
W niniejszym ćwiczeniu wyznaczamy ciepło topnienia lodu metodą kalorymetryczną, czyli przy
użyciu kalorymetru. Korzystamy z zasady bilansu cieplnego, która mówi, że:
w układzie izolowanym ciała o wyższej temperaturze tracą taką ilość ciepła, jaką zyskują ciała o
niższej temperaturze.
Do kalorymetru o masie m
k
i cieple właściwym c
k
, zawierającego m
w
wody o cieple
właściwym c
w
i temperaturze pokojowej t
p
wrzucamy kawałek lodu o masie m
l
i temperaturze
topnienia t
top
= 0
o
C. Następuje proces wymiany ciepła, po czym ustala się temperatura końcowa
układu t
k
, odpowiadająca stanowi równowagi termodynamicznej.

W procesie tym:
ciepło pobiera: lód - w procesie topnienia: Q
1
= m
l
L
Q
,
oraz woda powstała z lodu, na ogrzanie się do t
k
:
Q
2
= m
l
c
w
(t
k
– t
top
)
ciepło oddaje:
kalorymetr:
Q
3
= m
k
c
k
(t
p
– t
k
)
oraz woda o masie m
w
:
Q
4
= m
w
c
w
(t
p
– t
k
).
Ciepło pobrane równa się ciepłu oddanemu, a więc: Q
1
+ Q
2
= Q
3
+ Q
4
,
czyli:
m
l
L
Q
+ m
l
c
w
(t
k
– t
top
) = m
k
c
k
(t
p
– t
k
) + m
w
c
w
(t
p
– t
k
).
Po przekształceniu otrzymujemy wyrażenie na ciepło topnienia lodu:
(
)
(
)
(
top
k
w
l
k
p
w
w
k
k
Q
t
t
c
m
t
t
c
m
c
m
L
−
−
)
−
+
=
(1)
Wykonanie ćwiczenia
Przyrządy: kalorymetr, waga laboratoryjna, termometr, lód
1. Ważymy wewnętrzne naczynie kalorymetryczne wraz z przykrywką i mieszadłem (m
k
).
2. Do wewnętrznego naczynia kalorymetrycznego wlewamy wodę destylowaną w ilości równej
mniej więcej połowie jego pojemności i ponownie wyznaczamy masę tego układu (m
kw
).
Z różnicy mas (m
kw
–m
k
) obliczamy masę (m
w
) wody w kalorymetrze.
3. Zamknięte naczynie kalorymetryczne umieszczamy w obudowie kalorymetru i całość
nakrywamy osłonami izolacyjnymi. Do wnętrza, przez otwór w przykrywce, wkładamy
termometr, który pozostaje tam przez cały czas trwania eksperymentu.
4. Mierzymy temperaturę początkową (t
p
) kalorymetru z wodą.
5. Wyjęty z zamrażalnika lodówki kawałek lodu kładziemy na bibule i czekamy aż zacznie się
topić, tzn. aż osiągnie temperaturę równą t
top
=0
°C.
6. Lód osuszamy starannie bibułą i jak najszybciej przenosimy do wnętrza kalorymetru z wodą
(osłony izolacyjne oraz przykrywę wewnętrznego naczynia kalorymetrycznego zdejmujemy
chwilowo, wyłącznie na moment wprowadzania do kalorymetru kawałka lodu).
7. Mieszając wodę w kalorymetrze za pomocą mieszadełka, obserwujemy spadek temperatury
panującej wewnątrz układu. Obserwację przerywamy w momencie, gdy temperatura zacznie
wzrastać.
8. Najniższą zaobserwowaną temperaturę przyjmujemy jako temperaturę końcową układu (t
k
).
9. Wyjmujemy termometr z kalorymetru i wyznaczamy masę (m
kwl
) wewnętrznego naczynia
kalorymetrycznego wraz z przykrywką, mieszadłem oraz wodą (pierwotnie przez nas wlaną
oraz powstałą ze stopionego lodu). Z różnicy mas (m
kwl
–m
kw
) obliczamy masę (m
l
) lodu.
Opracowanie wyników
1. Wyniki pomiarów podstawiamy do wzoru (1) i obliczamy ciepło topnienia lodu L
Q
.
Przyjmujemy, że ciepło właściwe kalorymetru (aluminium) c
k
=0,896 kJ (kg K)
-1
, a ciepło
właściwe wody c
w
=4,19 kJ (kg K)
-1
.
2. Błąd pomiarowy (∆L
Q
) dla uzyskanej wartości ciepła topnienia lodu obliczamy metodą
różniczki zupełnej:
k
k
Q
p
p
Q
l
l
Q
w
w
Q
k
k
Q
Q
t
t
L
t
t
L
m
m
L
m
m
L
m
m
L
L
∆
+
∆
+
∆
+
∆
+
∆
=
∆
δ
δ
δ
δ
δ
δ
δ
δ
δ
δ
.

Obliczając pochodne cząstkowe otrzymujemy:
(
)
(
)
(
)
(
)
(
)
(
)
k
w
l
w
w
k
k
p
l
w
w
k
k
l
l
k
p
w
w
k
k
w
l
k
p
w
k
l
k
p
k
Q
t
c
m
m
c
m
c
t
m
m
c
m
c
m
m
t
t
m
c
m
c
m
m
t
t
c
m
m
t
t
c
L
∆
−
+
−
+
+
∆
+
+
∆
−
+
−
+
+
∆
−
+
∆
−
=
∆
2
Tabela
masa
kalorymetru
m
k
[kg]
masa wody
m
w
[kg]
masa lodu
m
l
[kg]
temperatura
początkowa
t
p
[
°C]
temperatura
końcowa
t
k
[
°C]
ciepło
topnienia
L
Q
[kJ kg
-1
]
Wyszukiwarka
Podobne podstrony:
c3 3 id 97126 Nieznany
c3 4 id 97127 Nieznany
c3 3 id 97126 Nieznany
c3 19 12 2010 id 97134 Nieznany
Portrety filozof c3 b3w id 3772 Nieznany
c3 nasiakliwosc id 97230 Nieznany
c3 19 12 2010 id 97134 Nieznany
Portrety filozof c3 b3w id 3772 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
więcej podobnych podstron