
1
BIOLOGICZNE SKUTKI PROMIENIOWANIA
JONIZUJĄCEGO
Monika Szymańska
Fundacja FORUM ATOMOWE
Centralne Laboratorium Ochrony Radiologicznej
Wstęp
Promieniowanie jest nieodłącznym elementem naszego życia. Światło i ciepło
pochodzące z reakcji jądrowych zachodzących na Słońcu jest niezbędne dla
funkcjonowania każdej formy życia. Niektóre materiały radioaktywne naturalnie
występują środowisku, a nasze organizmy zbudowane są m.in. z radionuklidów
takich jak: węgiel- 14, potas-40 i polon-210.
Od momentu odkrycia promieniotwórczości i promieni X minęło ponad 100 lat. W tym
czasie człowiek odkrywał nowe sposoby wykorzystania sztucznych źródeł
promieniotwórczych. Bardzo szybko dostrzeżono korzyści jakie płyną z zastosowania
promieniowania w życiu codziennym. Po raz pierwszy promieniowanie X
zastosowano w diagnostyce medycznej w sześć miesięcy po ich odkryciu. Jednak
promieniowanie niesie za sobą również skutki negatywne, o czym przekonali się po
raz pierwszy na początku XX wieku, lekarze obsługujący aparaty rentgenowskie. Od
tego momentu zapoczątkowano badania nad istotą promieniowania jego wszelkimi
zastosowaniami i skutkami jakie niesie na środowisko i organizmy żywe.
1. Działanie promieniowania na organizmy żywe.
Promieniowanie jonizujące jest elementem środowiska, a wiec każdy z nas jest
narażony na otrzymanie dawki od tła promieniowania, czyli od źródeł naturalnych
oraz źródeł sztucznych znajdujących się w naszym otoczeniu. Niektóre osoby są
ponadto zawodowo narażone na promieniowanie. Należą do nich m. in. operatorzy
akceleratorów i urządzeń do teleterapii, inspektorzy ochrony radiologicznej, personel
pracowni rentgenowskich i izotopowych. Przy napromienieniu żywego organizmu
okazuje się, że dawka pochłonięta to bardzo ważna informacja, ale - niestety - nie
wystarczająca do oceny narażenia. Na końcowy efekt wpływa bowiem wiele
czynników:
1.1. Czynniki od których zależy rodzaj oraz czas wystąpienia biologicznych
skutków promieniowania

2
wielkość pochłoniętej energii na jednostkę masy, czyli dawka pochłonięta,
rozkład dawki w czasie,
rodzaj promieniowania,
napromienienie całego ciała lub tylko jego części,
wielkość napromienionego obszaru ciała,
rodzaj narządu lub tkanki, jakie zostały napromienione,
rodzaj napromienienia: zewnętrzne czy wewnętrzne,
wiek, płeć i stan zdrowia (na ogół mężczyźni są bardziej wrażliwi na
promieniowanie niż kobiety, a dzieci i młodzież - bardziej niż dorośli),
wrażliwość osobnicza i gatunkowa.
1.1.1. Dawka pochłonięta, skuteczna, równoważnik dawki
Dawka jest miarą energii przekazanej przez promieniowanie jednostce masy
pochłaniacza. Dawka pochłonięta (D) jest miarą pochłaniania energii
promieniowania przez różne materiały, czyli różne ośrodki, w których rozchodzi się
promieniowanie. Takim ośrodkiem może być ciało ludzkie, ale może być również np.
powietrze, woda, ściana czy podłoga. Obecnie dawkę pochłoniętą wyrażamy w
grejach (Gy), czyli dżulach na kilogram (J/kg), dawniej w radach. Mając na uwadze
różnice w reakcji różnych tkanek na promieniowanie należy jeszcze wspomnieć o
pojęciu dawki efektywnej, która musi uwzględnić dawkę równoważną. Zgodnie ze
Słownikiem Specjalistycznych Terminów dostępnym na stronie Państwowej Agencji
Atomistyki, dawka skuteczna (E) jest to suma dawek równoważnych pochodzących
od zewnętrznego i wewnętrznego narażenia wyznaczona z uwzględnieniem
odpowiednich współczynników wagowych narządów i tkanek (Tab.1), obrazująca
narażenie całego ciała. Natomiast dawka równoważna (H) jest to dawka pochłonięta
w tkance lub narządzie wyznaczona z uwzględnieniem rodzaju i energii
promieniowania jonizującego
.
Tabela 1. Wartości wagowego czynnika dla różnych tkanek
Tkanka lub narząd
W
T
Gonady
0,20
Płuca
0,12
Jelito grube
0,12
Szpik czerwony
0,12
Żołądek
0,12
Wątroba
0,05
Tarczyca
0,05
Przełyk
0,05
Pęcherz moczowy
0,05
Gruczoły sutkowe
0,05

3
Skóra
0,01
Powierzchnia kości
0,01
Pozostałe
0,05
Całe ciało
1,00
Źródło: UNSCEAR 2000 „Sources and effects of ionizing radiation” Raport to the General Assembly, with
Scientific Annexes, Vol.1, Annex A, s.56
Dawka skuteczna może być rozumiana jako suma iloczynów dawek
równoważnych dla poszczególnych narządów i odpowiednich czynników
wagowych danego narządu i wyrażona wzorem:
E = ΣH
T
x w
T
w
T
wyraża
stosunek
ryzyka
wystąpienia
nowotworu
wywołanego
napromieniowaniem narządu lub tkanki T do ryzyka nowotworu po równomiernym
napromieniowaniu całego ciała taką samą wartością dawki (Tab.1)
w
R
jest to
wagowy współczynnik promieniowania
Tabela 2. Wartości wagowego współczynnika promieniowania
Rodzaj i zakres energii
promieniowania
w
R
Fotony, elektrony i miony wszystkich
energii
1
Neutrony, 10keV lub. 20 MeV,
protony.2 MeV
5
Neutrony 10-100 keV lub .2-20MeV
10
Neutrony 100 keV-2 MeV,
Cząstki , ciężkie jony, fragmenty
rozszczepienia wszystkich energii
20
Źródło: UNSCEAR 2000 „Sources and effects of ionizing radiation” Raport to the General Assembly, with
Scientific Annexes, Vol.1, Annex A, s.56
Dawka równoważna w narządzie (H
T
) jest to iloczyn dawki pochłoniętej w
określonym punkcie narządu i odpowiedniego współczynnika jakości
promieniowania, wyrażona wzorem
H
T
= D x w
R
Jednostką równoważnika dawki (H) oraz dawki skutecznej (E) jest siwert [Sv]:
1 Sv= 1 J/kg

4
Jednorazowe napromienienie daną dawką przyniesie inne skutki niż rozłożenie tej
dawki na kilka dni, tygodni, miesięcy, czy nawet lat. Niekorzystne zmiany wywołane
małymi mocami dawek (moc dawki jest to stosunek dawki pochłoniętej do czasu w
jakim była podana, np. Gy/h, Gy/h) mogą być skutecznie naprawiane przez
komórkowe mechanizmy naprawcze. Wiadomym jest również fakt, iż organizm jest w
stanie łatwiej tolerować dużą dawkę sumaryczną rozłożoną na więcej frakcji niż
naświetlanie kilkoma, relatywnie dużymi dawkami. W radioterapii tak dobierana jest
dawka sumaryczna oraz poszczególne dawki frakcjonowane i odstępy między nimi,
aby
stosunek
prawdopodobieństwa
miejscowego
wyleczenia
do
prawdopodobieństwa wystąpienia powikłań, był jak najbardziej korzystny dla
pacjenta. Jednocześnie, napromieniowanie dużej masy tkanek przyniesie bardziej
wyraźne ogólnoustrojowe efekty, zarówno w sensie pozytywnym jak i negatywnym,
niż skupienie całej energii promieniowania na wybranej, małej części ciała (z
pominięciem narządów krytycznych). Odnieść to możemy do przykładu pozytywnego
działania promieniowania: w terapiach stosowanych w celu podwyższenia odporności
organizmu poprzez naświetlanie całego ciała. A w przypadku szkód powodowanych
przez naświetlenie zbyt dużymi dawkami, w uszkodzonych tkankach powstają różne
substancje działające niekorzystnie na cały organizm, a ich ilość jest wprost
proporcjonalna do masy uszkodzonych tkanek.
1.1.2. Wrażliwość osobnicza
Przedstawiciele tego samego gatunku różnią się między sobą osobniczą
wrażliwością na promieniowanie. Jednocześnie wrażliwość ta może ulegać zmianie
u tego samego osobnika np. wraz z wiekiem. Nie należy zapominać o wrażliwości
gatunkowej, która także jest bardzo zróżnicowana. Wiadomym jest, że
przedstawiciele niższych grup taksonomicznych są bardziej odporni na działanie
promieniowania jonizującego (np. najbardziej wrażliwe są ssaki, a wśród nich
człowiek, a najmniej- wirusy i bakterie).
1.1.3. Dawka LD
Dawka LD
50/30
jest to miara wrażliwości organizmu na promieniowanie- oznacza
dawkę promieniowania, która powoduje śmierć połowy badanej populacji w ciągu 30
dni od ekspozycji. Przy ekspozycji całego ciała człowieka, LD
50/30
wynosi średnio
3,5Gy.
Oprócz dawki LD
50/30
rozróżniamy minimalną i maksymalną dawkę śmiertelną:
LD
min
minimalna dawka śmiertelna- jest to najmniejsza dawka promieniowania,
przy której pojawiają się przypadki śmierci w wyniku napromienienia danej
populacji.
LD
max
maksymalna dawka śmiertelna- oznacza minimalną dawkę, która
spowoduje śmierć wszystkich osób w napromienionej populacji.
5
1.1.4. Narażenie i napromienienie zewnętrzne i wewnętrzne- różnice
O narażeniu zewnętrznym mówimy, gdy źródło promieniowania znajduje się poza
organizmem człowieka, a o narażeniu wewnętrznym, gdy źródło jest wewnątrz
organizmu (w wyniku wchłonięcia substancji promieniotwórczej np. drogą oddechową
lub pokarmową).
Każde źródło promieniowania jonizującego stwarza możliwość napromienienia
(napromieniowania). Napromienienie oznacza pochłonięcie energii promieniowania,
i co za tym idzie- otrzymanie dawki promieniowania. W zależności od usytuowania
źródła względem organizmu może to być napromienienie zewnętrzne (np.
napromienienie pacjenta przy użyciu akceleratora lub zdjęcie rentgenowskie) lub
wewnętrzne (np. od potasu - 40 w naszych kościach, irydu-192 stosowanego w
brachyterapii lub jodu-131 stosowanego w terapii radioizotopowej do leczenia
nadczynności tarczycy). Natomiast przy pracy ze źródłami promieniotwórczymi mogą
powstać skażenia promieniotwórcze. Nazywamy tak obecność substancji
promieniotwórczej poza źródłem. Jeżeli np. podczas pracy w laboratorium rozsypie
się lub rozleje substancja promieniotwórcza to stół czy podłoga zostaną skażone i z
kolei mogą stać się przyczyną skażeń wewnętrznych ludzi, co spowoduje otrzymanie
dawki w wyniku napromienienia wewnętrznego. Substancje promieniotwórcze mogą
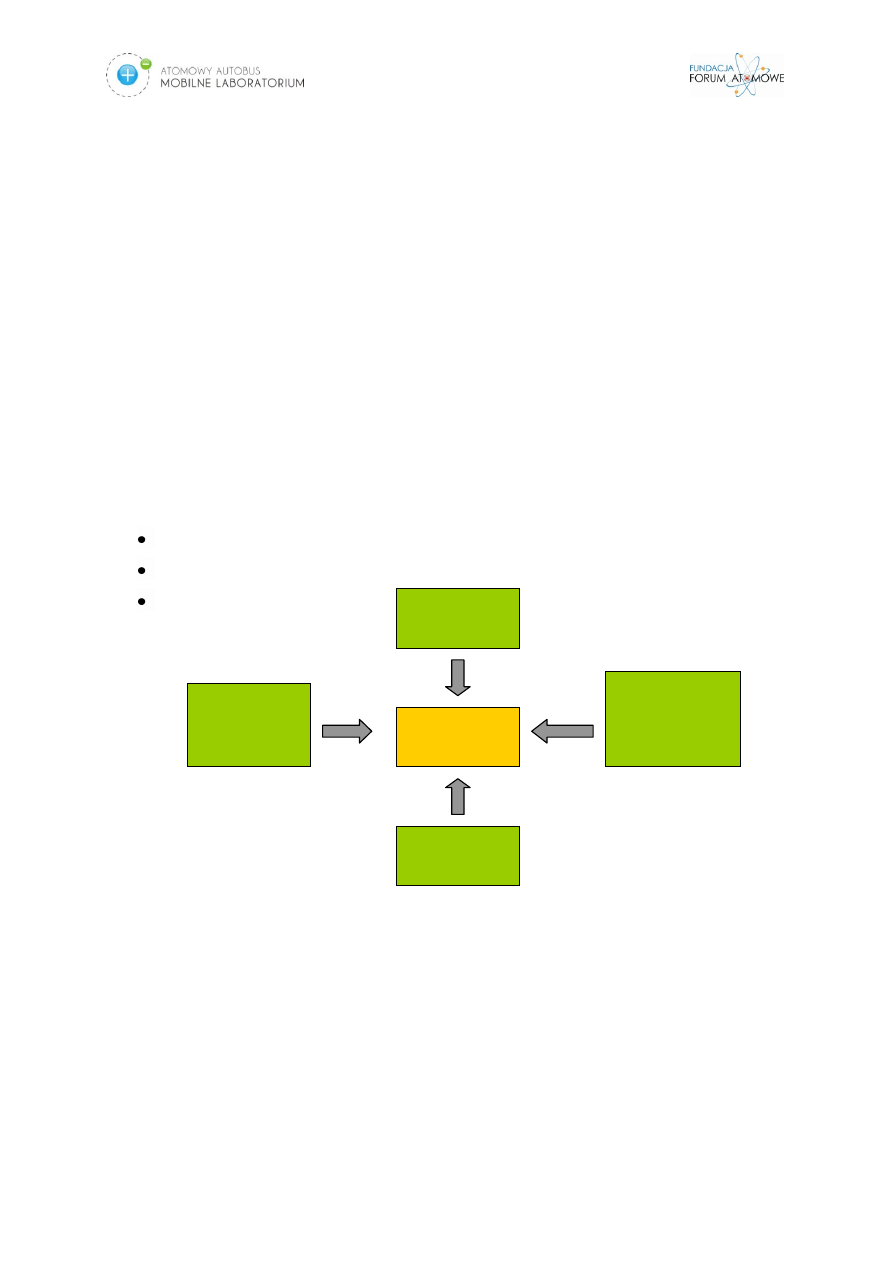
wnikać do organizmu trzema drogami. Są to:
układ pokarmowy,
układ oddechowy,
uszkodzenia skóry.
Rys. 1. Schemat przedstawiający różne drogi wnikania substancji promieniotwórczych do
organizmu.
Różne narządy i tkanki mają różną wrażliwość na promieniowanie. Z kolei
różne izotopy gromadzą się w różnych narządach i tkankach. I tak np. izotopy
jodu
gromadzą się przede wszystkim w
tarczycy
, a
radu i strontu
-
w kościach
. W
związku z tym wprowadzono pojęcie narządu krytycznego.
Inhalacja
(wdychanie)
Uszkodzenie
skóry
Przenikanie
przez kontakt
(bezpośrednie
wnikanie)
Ingestia
(spożycie)
ORGANIZM
6
1.1.5. Narządy krytyczne
To narządy lub tkanki, których uszkodzenie przez promieniowanie jest najgroźniejsze
dla napromienionego osobnika lub jego potomstwa (z uwzględnieniem
promienioczułości, ważności funkcji narządu oraz dawki, jak również gromadzenia
wybiórczego w przypadku skażenia wewnętrznego). I tak dla promieni X i gamma
narządem krytycznym będą: szpik kostny, gonady i soczewka oka. Dla wchłoniętego
promieniotwórczego izotopu jodu- tarczyca, a dla substancji alfa- promieniotwórczej
wprowadzonej do przewodu pokarmowego- śluzówka jelit. Promienioczułość
tkanek natomiast zależy od stopnia zróżnicowania komórek tkanki i ich aktywności
proliferacyjnej (proliferacja- namnażanie komórek). Najbardziej wrażliwe na
promieniowanie są komórki nie wyspecjalizowane i często dzielące się. Komórki,
które już osiągnęły swój stopień specjalizacji lub te, które dzielą się rzadko lub wcale
są względnie oporne na dawki promieniowania powodujące śmierć komórek nie
wyspecjalizowanych lub ulegających częstym podziałom. Promienioczułymi są więc
szpik i tkanka limfatyczna, komórki płciowe i komórki nabłonka jelit. Mniej wrażliwymi
są komórki mięśniowe, narządy miąższowe (np. wątroba), tkanka łączna (np. tkanka
kostna) i nerwowa. Tkanki posiadające bogate unaczynienie są bardzo dobrze
zaopatrywane w tlen, a to z kolei zwiększa ich promienioczułość. Jako przykład
można tu podać nowotwory złośliwe, które charakteryzują się m.in. właśnie bogatym
unaczynieniem i ta cecha wykorzystywana jest w radioterapii do walki z chorobą
nowotworową.
Warto pamiętać, że osłonięcie przed napromienieniem narządów, które są
szczególnie ważne dla funkcjonowania organizmu, a przy tym najbardziej
narażonych na uszkodzenie, może przyczynić się do zwiększenia lub zmniejszenia
szansy na przeżycie osoby, która została napromieniowana.
Oddziałując z materią promieniowanie jonizujące wywołuje zjawiska fizyczne, w tym
jonizację, której zawdzięcza swoją nazwę, a w żywych organizmach również zjawiska
biologiczne. Może powodować uszkodzenie komórek i z tego względu może być
szkodliwe. Ogólne skutki działania promieniowania na komórkę obejmują pełne
spektrum odpowiedzi: od braku jakiejkolwiek reakcji, poprzez przejściowe zmiany
czynnościowe lub morfologiczne, do zmian trwałych i wreszcie do śmierci komórki w
wyniku poważnych uszkodzeń.
1.2.1. Gęstość jonizacji
Poszczególne rodzaje promieniowania różnią się gęstością jonizacji na swej drodze
w pochłaniaczu, przy czym gęstość jonizacji zależna jest od tzw. liniowego
przekazu energii (LET od ang. Linear Energy Transfer) i dlatego wywierają
odmienny skutek w odniesieniu do napromieniowanych przez nie tkanek.
W przypadku cząstek o małych wartościach LET (mniejszych od ok. 5 keV/ m) liczba
komórek biorących udział w absorpcji dawki jest porównywalna z liczbą komórek w
naświetlanej tkance.
Jeżeli daną tkankę naświetlimy taką samą dawką, ale pochodzącej od cząstek
o dużej wartość LET (np. cząstek ), dla których LET jest rzędu 100 keV/ m, tylko
1.2. Działanie promieniowania na komórkę.
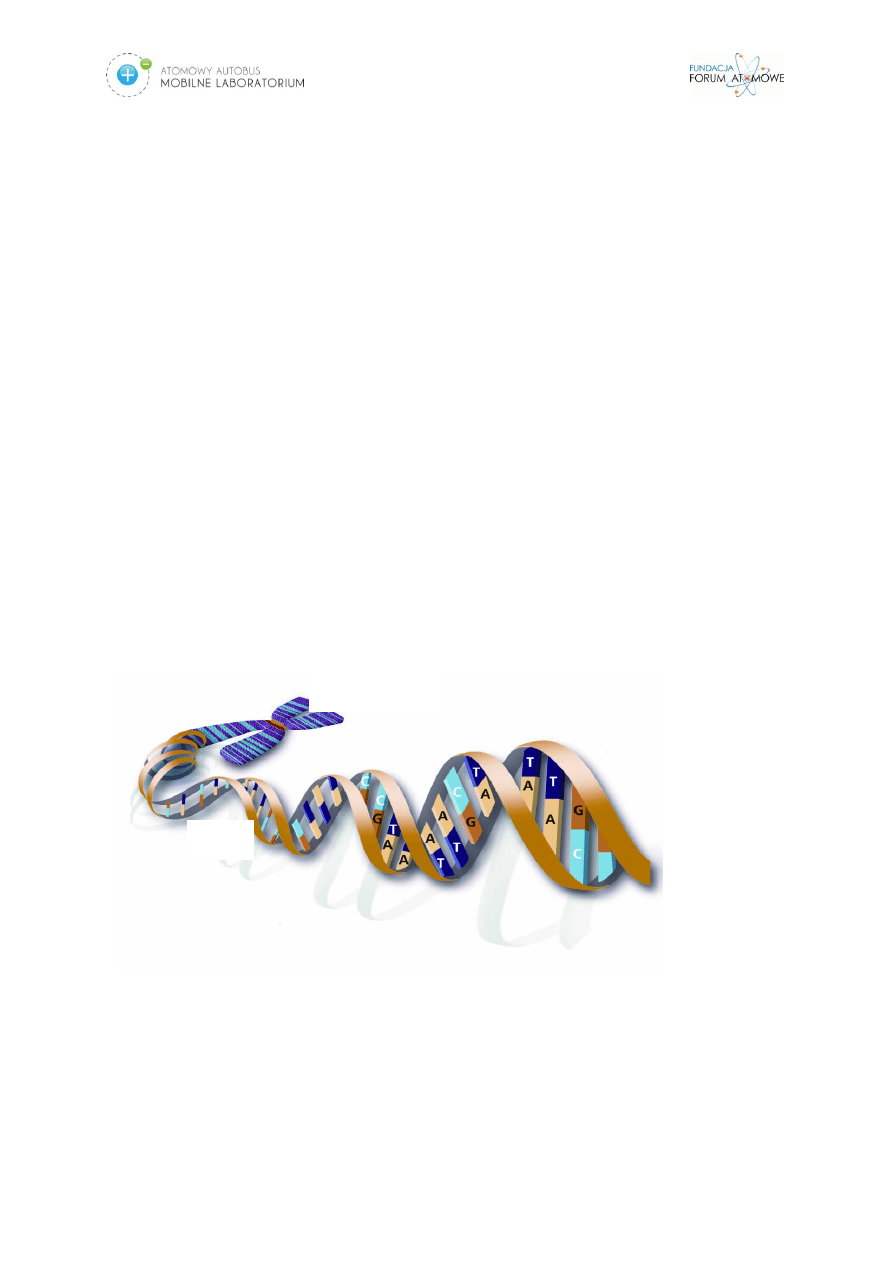
7
znikomy ułamek komórek podlega bezpośredniemu działaniu promieniowania.
Należy pamiętać również o tym, że im większa wartość LET tym komórki poddane
działaniu przechodzącej cząstki otrzymują większą dawkę. Cząstki o wysokim
wartościach LET charakteryzują się również wysokimi mocami dawek, co może mieć
poważne konsekwencje dla funkcjonowania komórki, a to z kolei może przełożyć się
na funkcjonowanie całego organizmu.
1.2.2. Działanie promieniowania na materiał genetyczny
Podstawową jednostką budulcową i funkcjonalną całego organizmu jest komórka.
Zespoły komórek tworzą tkanki, zespoły tkanek tworzą narządy, narządy tworzą
układy narządów, a wszystko składa się na organizm. Jedną z najważniejszych
cząsteczek dla funkcjonowania komórek, a co się z tym wiąże, także i całego
organizmu, jest DNA. DNA znajduje się w jądrze komórkowym, jest zdolna do
samodzielnego powielania, kontroluje strukturę i funkcje komórki, a co najważniejsze,
zawiera informację genetyczną danego organizmu. W chwili podziału komórkowego
DNA przybiera formę chromosomów, które można zaobserwować w mikroskopie
świetlnym. Promieniowanie jonizujące może powodować uszkodzenia materiału
genetycznego, a można wręcz stwierdzić, że DNA komórki stanowi „tarczę dla
promieniowania”. Takie uszkodzenia mogą rzutować nie tylko ma zdrowie i życie
osoby naświetlonej, ale także na jej przyszłe potomstwo (lub też możliwość jego
posiadania). Uszkodzenia, które powoduje promieniowanie jonizujące, to przede
wszystkim podwójnoniciowe pęknięcie helisy DNA (DNA składa się z dwóch nici,
tworząc helisę) (Rys.2.).
Rys. 2. Struktura DNA.
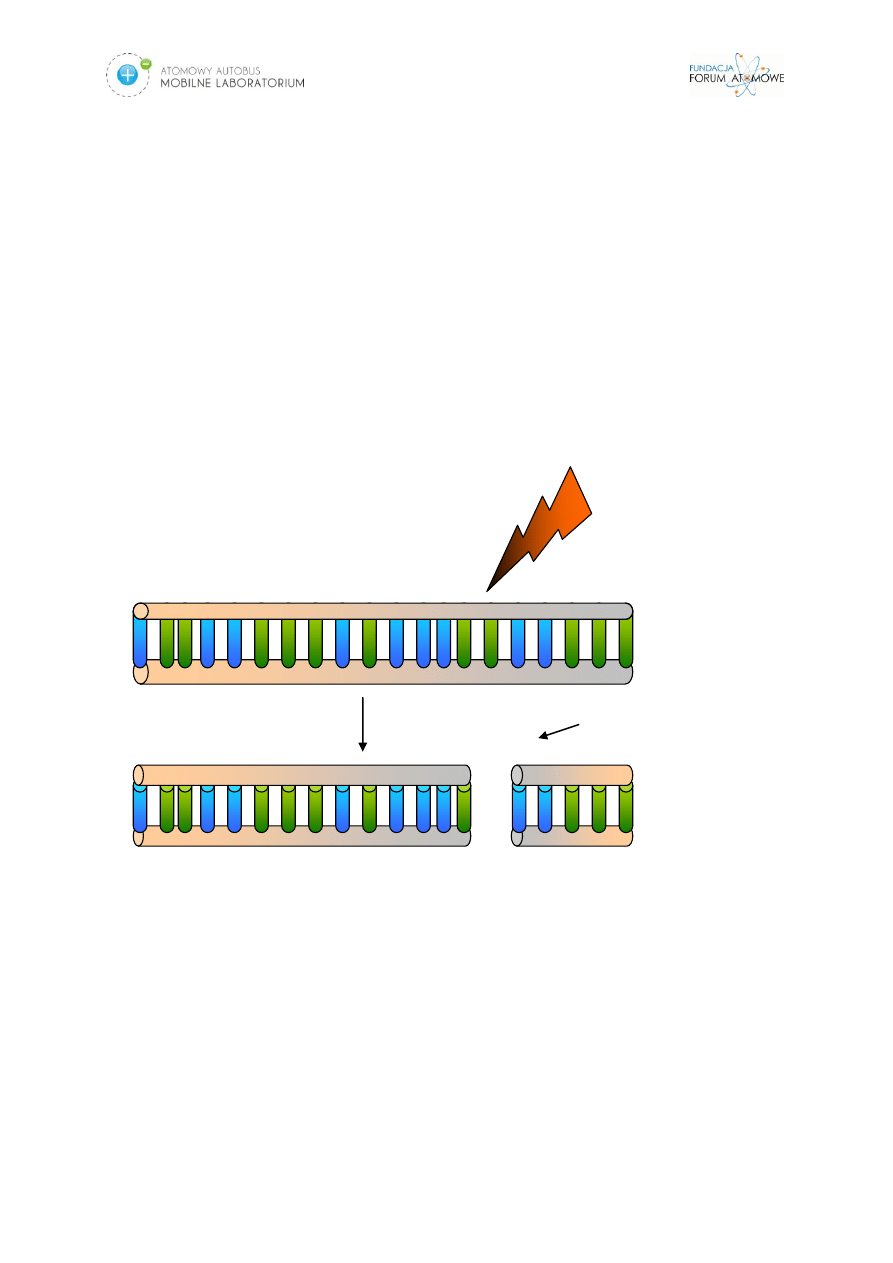
Podwójnonicowe pęknięcia DNA mogą powstać albo w wyniku
bezpośredniego działania promieniowania (Rys.3.) na cząsteczkę DNA, albo w
wyniku pośredniego działania promieniowania na inne cząsteczki (np. wody), z
których w wyniku jonizacji generowane są wysokoreaktywne wolne rodniki, które z
kolei uszkadzają DNA. W każdym jednak przypadku uszkodzenie DNA może mieć
Chromosom
DNA
8
Promieniowanie
Pęknięcie
podwójnoniciowe
DNA
negatywne skutki biologiczne, prowadzące do powstania mutacji lub rozwoju
choroby nowotworowej.
Oprócz tego, uszkodzenia DNA mogą powodowane toksyczne związki
chemiczne, a także uszkodzenia mogą powstawać w sposób spontaniczny. Niemniej
jednak zapis genetyczny jest bardzo trwały, o czym może świadczyć trwałość
gatunków i cech osobistych dziedziczonych przez potomstwo. Jest to możliwe dzięki
temu, ze uszkodzenia DNA są naprawiane przez komórkowe mechanizmy
naprawcze, które są wysoko konserwowane ewolucyjnie. Jednakże, jeżeli komórka
zdoła podzielić się zanim zdoła naprawić swe uszkodzenia popromienne, nowe
komórki mogą nie być identycznymi kopiami komórki macierzystej. Dzięki istnieniu
mechanizmów naprawczych, nie można stwierdzić wpływu dawek porównywalnych z
tłem pojedynczego osobnika, wpływ ten można stwierdzić ewentualnie dla całej
populacji.
Rys. 3. Powstawanie podwójnoniciowych pęknięć DNA w wyniku działania promieniowania
jonizującego.
Duże dawki promieniowania są zawsze szkodliwe, natomiast małe dawki mogą
dawać efekty korzystne. W zakresie małych dawek uszkodzenia naprawiane są
przez stosunkowo silne, indukowane przez promieniowanie komórkowe mechanizmy
obronne i naprawcze. Substancje chemiczne, czy inne czynniki wewnątrz- lub
1.3. Wpływ promieniowania na zdrowie

9
zewnątrzkomórkowe, powodują podobne uszkodzenia materiału genetycznego co
promieniowanie jonizujące, dzięki temu komórka jest ciągle w stanie „gotowości”, a to
stawia ją w korzystnej sytuacji. Jednak w miarę zwiększania mocy dawki wydajność
komórkowych mechanizmów obronnych maleje.
1.3.1. Skutki napromieniowania małymi dawkami
Napromienienie ciała małymi dawkami (poniżej 0,2Sv), które rozłożone są w czasie,
może przyczynić się do zwiększenia siły odpowiedzi immunologicznej, ale już
zastosowanie większej dawki może przynieść działanie negatywne. Jako przykład
można tutaj podać ludność Nagasaki, która została napromieniona dawką ok. 0,1Sv.
W przypadku tej populacji zaobserwowano zmniejszenie zapadalności na białaczki,
raka płuc i raka jelita grubego. Takie działanie promieniowania jonizującego
wykorzystuje się w terapii, polegającej na ekspozycji całego ciała lub jego połowy 3
razy w tygodniu przez 5 tygodni, na działanie dawki ok.0,1Gy. Taki rodzaj leczenia
może być stosowany jako metoda uzupełniające w leczeniu np. nowotworów.
Oczywiście istnieje koncepcja, że zbyt małe napromienienie organizmu jest
szkodliwe. Jeżeli komórka znajdzie się w sytuacji niedoboru czynników stresujących,
to może dojść do zmniejszenia sprawności jej mechanizmów obronnych i nie będzie
w stanie reagować na małe zagrożenia. Taki mechanizm jest prawdziwy w
odniesieniu do wybranych tkanek, jednak ciągle wymaga szerszych badań. Jak
pisano wcześniej, różne komórki, a co za tym idzie tkanki i narządy, charakteryzują
się większą lub mniejszą promienioczułością i dlatego odpowiedź organizmu na
promieniowanie nie jest rzeczą prostą, gdyż uwzględnia różne regulacyjne
mechanizmy tkankowe, narządowe i ogólnoustrojowe.
1.3.2. Napromieniowanie dużymi dawkami, skutki deterministyczne, choroba
popromienna, skutki stochastyczne
Skutki napromieniowania ciała dużymi dawkami, powyżej 1Sv, są dobrze znane.
Wiadomo, że im większa dawka tym większe uszkodzenia. Mniejsze dawki
uszkadzają tylko te tkanki, które charakteryzują się większą promieniowrażliwością,
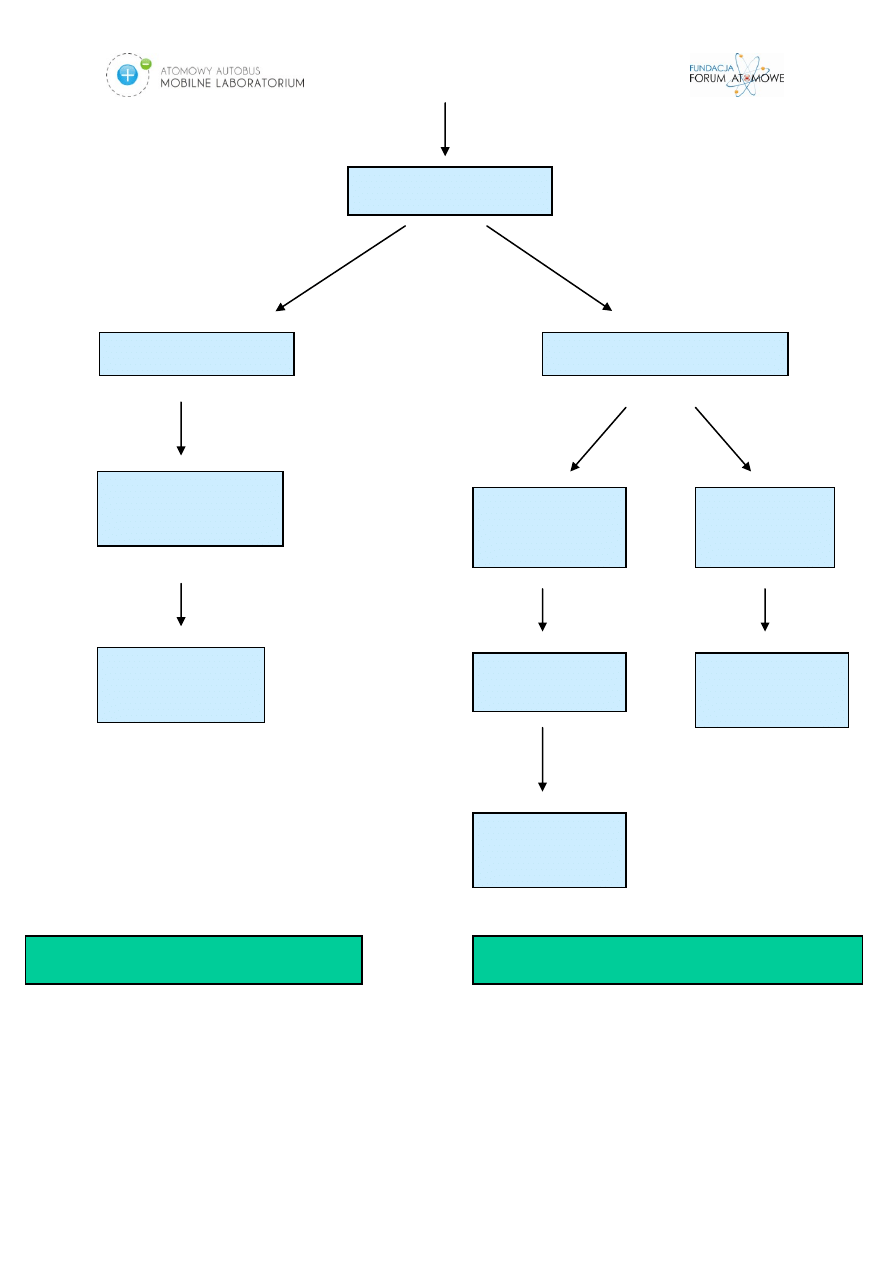
natomiast duże dawki uszkadzają wszystkie tkanki lub ich większość. Rysunek nr 8.
przedstawia biologiczne skutki promieniowania jonizującego.
10
Rys. 4. Schemat przedstawiający skutki biologiczne działania promieniowania jonizującego na
organizm.
SKUTKI STOCHASTYCZNE
SKUTKI DETERMINISTYCZNE
Uszkodzenia DNA
Śmierć komórek
Mutacje komórek
Zakłócenia
funkcji narządów
Komórki
somatyczne
Komórki
płciowe
Śmierć
organizmu
Nowotwory
Skutki
Genetyczne?
Śmierć
organizmu
PROMIENIOWANIE
11
1.3.2.1 Skutki deterministyczne
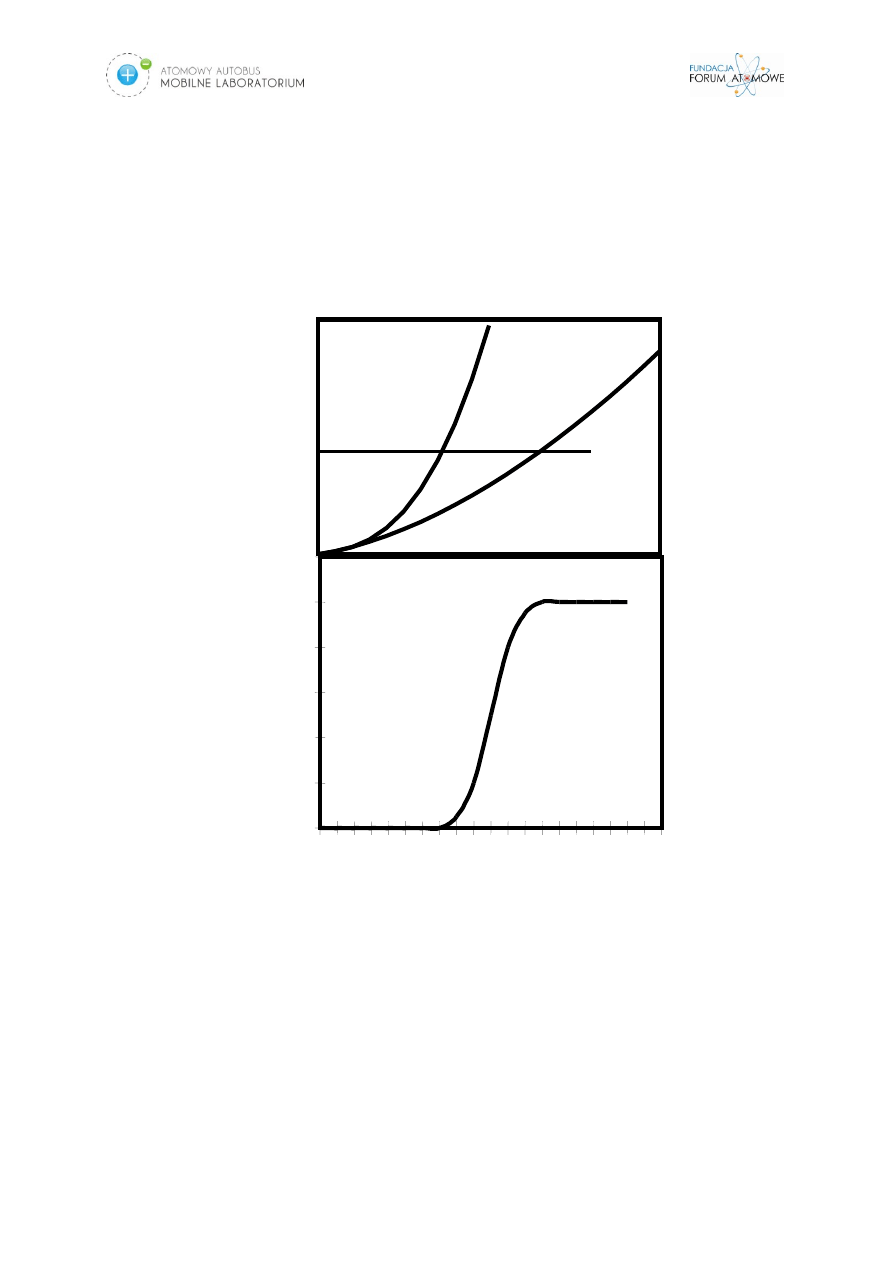
Skutki deterministyczne są to następstwa nieodwracalnego spadku komórek poniżej
poziomu niezbędnego do funkcjonowania szczególnie ważnych tkanek i narządów,
które w stosunkowo krótkim czasie, po przekroczeniu OKREŚLONEJ DAWKI
PROGOWEJ (Rys.5.)pojawiają się u wszystkich napromienionych osób.
Rys. 5. Zależność dawka- skutek dla skutków deterministycznych
0
1
2
3
4
5
6
7
8
9
10
Ostrość skutków
Częstość
skutków
Dawka
[Gy]

12
Tabela 4. Przykłady dawek progowych [Gy] dla niektórych skutków
deterministycznych indukowanych przez promieniowanie X lub gamma
1.3.2.2. Ostra choroba popromienna
Ostra choroba popromienna to zespół zmian ogólnoustrojowych występujących po
napromieniowaniu całego organizmu (lub większej jego części) dużą dawką,
poczynając od LD
50/30
. W zależności od wielkości dawki (Tab.5.), po okresie tzw.
zwiastunów (przed dojściem do pełnego obrazu choroby) z nudnościami i wymiotami,
pieczeniem poparzonej skóry, na pierwszy plan wysuwają się objawy:
Ostry zespół szpikowy (szpik kostny)- w wyniku zniszczenia szpiku kostnego
stale maleje we krwi ilość elementów morfotycznych (białe ciałka krwi,
czerwone ciałka krwi i płytki krwi), występują krwotoki i załamanie odporności
organizmu
Ostry zespół jelitowy (nabłonek przewodu pokarmowego)- do objawów
uszkodzenia szpiku kostnego dochodzą objawy ostrego zapalenia śluzówki
jelit (brak łaknienia, senność, wysoka temperatura i biegunka prowadząca do
odwodnienia organizmu)
Ostry zespół Centralnego Układu Nerwowego (CUN)- śródbłonek naczyń
krwionośnych w mózgu; pierwszymi objawami są pobudzenie naprzemiennie
z apatią, utrata równowagi i zaburzenie koordynacji ruchowej, drgawki i
śmierć wśród innych pozostałych objawów ostrej choroby popromiennej.
Przyczyną
zgonu
jest
obrzęk
mózgu
i
w
zrost
ciśnienia
wewnątrzczaszkowego.
Ostry zespól szpikowy
1,0
Trwała niepłodność u
mężczyzn
2,5 - 6,0
Trwała niepłodność u kobiet
3,5 - 6,0
Zmętnienie soczewki oka
0,5 - 2,0
Zaćma oczna
5,0
Rumień skóry
3,0
Sączące złuszczanie naskórka
20,0
Martwica skóry
50,0
Powstawanie wad rozwojowych
płodu
0,1 - 1,0
13
Tabela 5. Ostry zespół popromienny- przykłady dawek i objawów
Dawka
[Gy]
Rodzaj zespołu
Śmiertelność [%]
1- 10
Ostry zespół szpikowy
0- 9
10- 50
Ostry zespół jelitowy
90- 100
> 50
Ostry zespół CUN
100
1.3.2.3.Skutki stochastyczne
Następstwa działania promieniowania na organizm człowieka, które z dużym
opóźnieniem czasowym ujawniają się tylko u niektórych osób z ogółu
napromienionych. Nie można jednak przewidzieć, u której z pośród osób
napromienionych taką samą dawką, następstwa te wystąpią, a jeśli wystąpią, to czy
na pewno z powodu działania promieniowania.
Przykłady skutków stochastycznych:
Zwiększenie prawdopodobieństwa wystąpienia jednej ze znanych chorób
nowotworowych u osoby napromienionej
Zwiększenie prawdopodobieństwa wystąpienia jednej ze znanych wad lub
chorób dziedzicznych u potomstwa napromienionej osoby.
Różnice pomiędzy skutkami deterministycznymi i stochastycznymi przejawiają się
we wpływie dawki na częstotliwość (prawdopodobieństwo) ich występowania oraz
ostrość wywołanych objawów chorobowych. Po przekroczeniu dawki progowej
wzrost
dawki
powoduje
gwałtowny
wzrost
częstotliwości
skutków
deterministycznych.
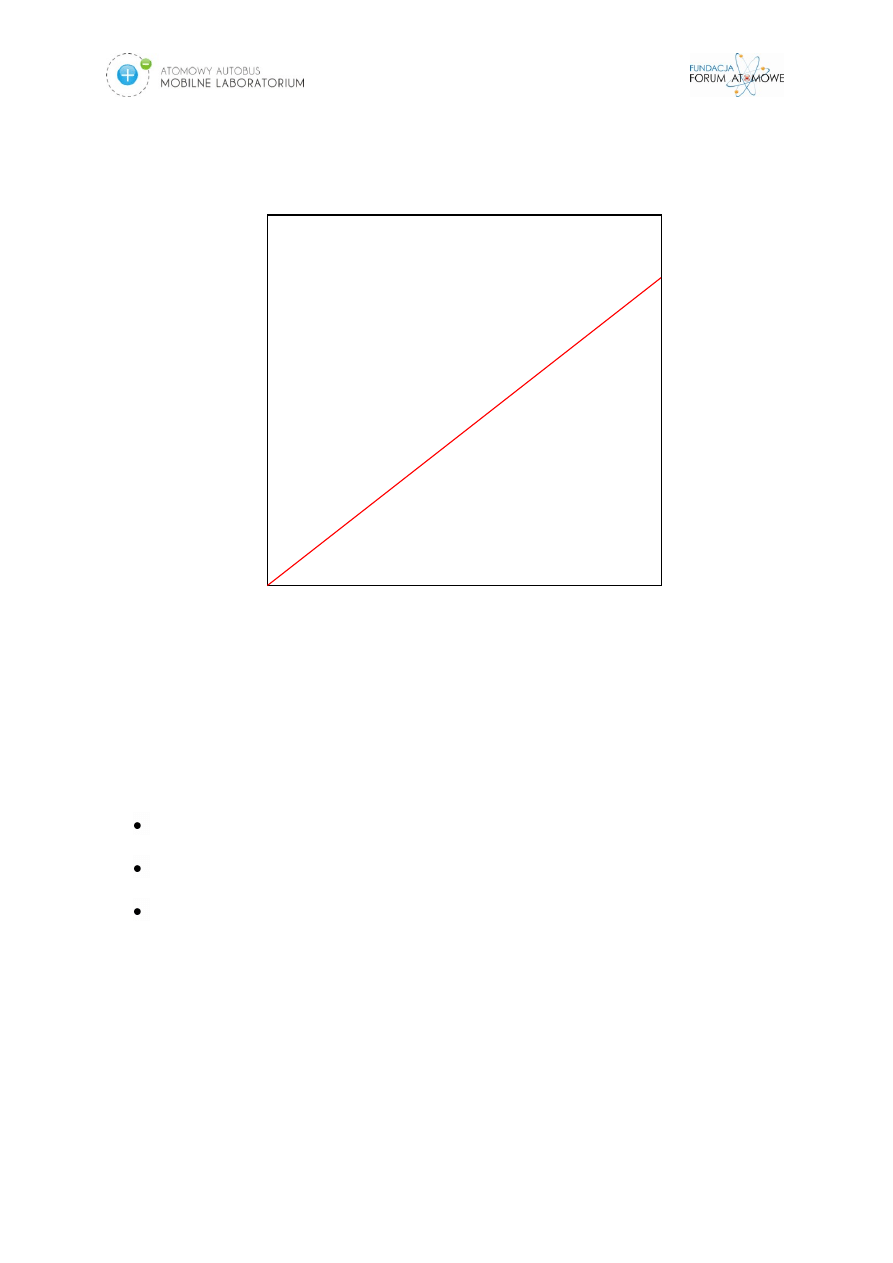
Charakterystyczną cechą skutków deterministycznych jest to, że ich ostrość
rośnie wraz ze wzrostem dawki promieniowania. Ostrość skutków stochastycznych
nie zależy od dawki chociaż, prawdopodobieństwo ich wystąpienia rośnie wraz ze
wzrostem wielkości dawki efektywnej (Rys.6). Skuteczna ochrona przed
deterministycznymi skutkami dużych dawek promieniowania polega na ograniczeniu
dawek pochłoniętych do wartości niższych od wartości dawek progowych. Ochrona
przed stochastycznymi skutkami promieniowania opiera się na zmniejszeniu
prawdopodobieństwa ich występowania do najniższego poziomu osiągalnego przy
rozsądnym uwzględnieniu czynników ekonomicznych i społecznych.
14
Rys. 6. Zależność dawka- skutek dla skutków stochastycznych
1.3.3. Działanie promieniowania na zarodek i płód
W okresie wczesnej ciąży napromienienie dużą dawką prowadzi najczęściej do
śmierci zarodka, ponieważ ludzki zarodek/płód jest bardziej promieniowrażliwy niż
dorosły człowiek.
Od 2 do 8 tygodnia ciąży może dojść do wzrostu częstości występowania wad
rozwojowych narządów i części ciała
Od 8-15 tydzień ciąży - wzrost częstości zmian strukturalnych mózgu, które
będą powodować niedorozwój umysłowy różnego stopnia
W drugiej połowie 2 trymestru i w 3 trymestrze ciąży promieniowanie nie
powoduje już anomalii rozwojowych, a jedynie zwiększa ryzyko zachorowania
na białaczkę przed 10 rokiem życia.
1.3.4. Dziedziczne skutki promieniowania
Około 13% wszystkich żywo urodzonych dzieci wykazuje mniej lub bardziej
poważne naturalne wady i choroby dziedziczne. Przyczyną pierwszych są
dominujące, recesywne i dziedziczone w związku z płcią, mutacje genowe w
komórkach rozrodczych jednego lub obojga rodziców. Choroby dziedziczne są
Efekty stochastyczne
Dawka [Gy]
C
zę
st
ość
wy
st
ąp
ie
ni
a e
fe
kt
u

15
następstwami wieloczynnikowymi, co oznacza, że wymagają zmutowania nie
jednego, ale wielu genów warunkujących wystąpienie danego zaburzenia
.
U potomstwa napromienionych osób nie stwierdzono, jak dotąd, występowania
żadnych skutków dziedzicznych mimo, że napromienienie ludzkich komórek
rozrodczych prowadzi do powstania w nich mutacji.
Przypuszczalnie dla tego typu następstw zależność dawka – skutek ma charakter
progowy i stąd wywołanie ich przez dawki mniejsze od 1 Gy nie powinno nastąpić.
1.3.5.Rakotwórcze działanie promieniowania
Za przyczynę skutków stochastycznych przyjmuje się mutacje w komórkach
macierzystych. Wiadomo, że nowotwory popromienne są jedynym rodzajem skutków
stochastycznych u ludzi i pojawiają się z dużym opóźnieniem czasowym, nazywanym
okresem utajenia. Najkrótszy okres utajenia występuje w przypadku białaczek i
wynosi dwa lata. W przypadku innych rodzajów nowotworów czas utajenie może
sięgać nawet 30 lat. Promieniowanie nie wywołuje żadnego charakterystycznego
nowotworu, a jedynie zwiększa prawdopodobieństwo występowania tych, które z
większą lub mniejszą częstością pojawiają się w całej populacji. Oczywiście
podatność na choroby nowotworowe wywołane promieniowaniem jonizującym zależy
od wielu czynników, takich jak: obszar napromienionego ciała, wiek, płeć. Jak już
wspominano, miejsca ciała, w których znajdują się narządy krytyczne czy komórki
silnie namnażające się, są bardziej podatne na rozwój nowotworu. Należy też mieć
na uwadze, że taka sama dawka zaabsorbowanego promieniowania może
spowodować wystąpienie nowotworu u jednego osobnika, a u drugiego już nie.
W tej sytuacji nie jest rzeczą możliwą wskazanie, który nowotwór został
wywołany przez napromieniowania, a który przez inne czynniki rakotwórcze
znajdujące się w środowisku. W porównaniu z takimi chemicznymi czynnikami
rakotwórczymi jak azbest, benzen czy niektóre składniki dymu tytoniowego,
promieniowanie jest SŁABYM czynnikiem rakotwórczym.
Przy analizowaniu wpływu promieniowania jonizującego na organizm ludzki
należy też mieć na uwadze to, że radionuklidy po wchłonięciu do organizmu są z
niego wydalane. Z tego względu, oprócz okresu połowicznego zaniku danego
izotopu, należy wziąć pod uwagę tzw. biologiczny okres połowicznego zaniku,
czyli czas po którym w wyniku procesów biologicznych pozostaje w organizmie
średnio połowa pochłoniętego radionuklidu. Biologiczny okres połowicznego zaniku
może być o wiele rzędów wielkości krótszy od fizycznego okresu połowicznego
zaniku (np. okresy zaniku dla trytu H
3
wynoszą: „biologiczny”: 10 dni, „fizyczny”:12,3
lat). Do organizmu mogą też dostać się takie radionuklidu, których „biologiczny” okres
połowicznego zaniku jest dłuższy, niż przeciętny czas trwania danego izotopu (np.
Sr
90
trwale osadza się w kościach).
2. Dozymetria biologiczna w przypadkach awaryjnych
W przypadku awarii urządzenia wytwarzającego promieniowanie jonizujące, błędnej
decyzji pracownika czy ataku terrorystycznego ocena dawki pochłoniętej metodami
dozymetrii fizycznej nie zawsze jest dokładna i możliwa do przeprowadzenia. W

16
wiarygodny sposób można ją jednak wykonać metodami dozymetrii biologicznej,
która zajmuje się rekonstrukcją dawki pochłoniętej na podstawie zmian wywołanych
przez promieniowanie jonizujące w komórkach i tkankach organizmu człowieka.
Znajomość dawek otrzymanych przez ofiary nadzwyczajnych zdarzeń radiacyjnych
umożliwia ocenę ryzyka wystąpienia w przyszłości niepożądanych skutków
zdrowotnych, głównie nowotworów. Natomiast w przypadku przekroczenia dawek
progowych dla skutków deterministycznych, znajomość dawki ułatwia lekarzom
wybór najbardziej odpowiedniej metody leczenia ewentualnych oparzeń czy
zespołów popromiennych.
2.1 Analiza aberracji chromosomowych
W przypadku promieniowania mutacje są często związane z tak dużymi ubytkami,
czy przemieszczeniami materiału genetycznego, że jest to widoczne na poziomie
chromosomu. Uszkodzenia chromosomów, nazwane aberracjami, pojawiają się
wkrótce po napromienieniu i utrzymują się przynajmniej do czasu pierwszego
podziału komórkowego (mitozy). Aberracje chromosomowe powstają w komórkach
każdej napromienionej tkanki, a ich częstość jest proporcjonalna do wielkości
pochłoniętej dawki. Aberracje można podzielić na stabilne (przekazywane komórkom
potomnym) i niestabilne (nie są przekazywane komórkom potomnym).
Analiza aberracji chromosomowych w limfocytach krwi opiera się na wyznaczeniu
liczby chromosomów dicentrycznych, które są względnie łatwo rozpoznawalne.
Zaletą tej metody jest to, że limfocyty dzielą się bardzo rzadko oraz krążą po całym
organizmie. Ustalenie dawki pochłoniętej możliwe jest na podstawie oznaczania
częstości chromosomów dicentrycznych w komórkach, które nie podzieliły się od
czasu napromienienia. Połowiczny okres życia limfocytów oszacowany został na
około 3,5 roku: to znaczy, że po tym czasie średnio połowa limfocytów zostanie
zastąpiona przez nowe komórki. Dlatego na podstawie wartości połowicznego okresu
życia limfocytów można oszacować wysokość dawki nawet wiele lat po
napromienieniu. Ze względu na to, że limfocyty krążą po całym organizmie, oceniana
dawka jest dawką otrzymaną na całe ciało Stwierdzenie, czy napromienieniu uległo
całe ciało, czy tylko jego część, umożliwia analiza rozkładu dicentryków
indukowanych w limfocytach napromienionej osoby. W przypadku napromienienia
całego ciała rozkład ten jest rozkładem Poissona, co oznacza, że wariancja równa
jest średniej. W przypadku częściowego napromieniowania ciała napromieniowane
komórki
mieszają
się
z
komórkami
nienapromienionymi.
Po napromienieniu dawką 0,1 Gy promieniowania rentgenowskiego (o mocy dawki 1
Gy/min) występuje około 6 dicentryków na 1000 komórek co szacuje się na dolną
granicę czułości. Górną granicą jest dawka 5 Gy ponieważ powyżej podział komórek
jest hamowany. Spontaniczne dicentryki powstają rzadko (średnio 1 dicentryk na
1000 limfocytów), a ich powstawanie nie zależy od takich czynników, jak: płeć, wiek,
stan zdrowia, nawyki żywieniowe, palenie tytoniu czy narażenie na toksyczne związki
chemiczne
Promieniowanie jonizujące może wywoływać również aberracje stabilne takie jak
translokacje. Stabilne aberracje chromosomowe- translokacje- nie „giną” podczas
podziału komórki i w sprzyjających dla nich warunkach mogą przetrwać przez wiele
pokoleń komórkowych. Wynika to z faktu, że stabilne translokacje nie mają wyraźnie
zmienionej struktury i bez trudności przechodzą do jąder komórek potomnych.
Dlatego ich poziom jest względnie stały w czasie i dokładna ocena dawki może być

17
przeprowadzona nawet kilka lat po napromienieniu. Translokacje można wykryć za
pomocą techniki prążkowania chromosomów lub fluorescencyjnej hybrydyzacji in situ
(FISH). Metoda prążkowania chromosomów wymaga analizy wzorów prążkowych i
jest niezwykle pracochłonna, stąd obecnie powszechnie stosowaną metodą analizy
translokacji jest wspomniany już FISH. Oznaczanie częstości translokacji w
limfocytach krwi obwodowej pozwala na retrospektywną ocenę dawek od 0,25 Gy do
5 Gy. Technika ta, jak wiele innych, ma swoje ograniczenia np. czułość metody
zmniejsza się wraz z wiekiem badanej osoby.
2.2.1.Analiza mikrojąder
Mikrojądra powstają wtedy, gdy fragment lub cały chromosom nie jest wcielany do
żadnego z jąder komórkowych powstających podczas mitozy (podziału komórki). Są
to drobne, okrągłe lub owalne twory, które można zobaczyć w pobliżu jądra
niektórych komórek, będących w interfazie (czyli okres w cyklu komórkowym,
podczas którego komórka nie dzieli się). Tak jak jądra komórkowe zwierają DNA, a
wielkość mikrojąder zależy od zawartości DNA i wynosi od 2 do 30% wielkości jądra
komórkowego. Mikrojądra liczy się w komórkach znajdujących się w drugiej
interfazie popromiennej, czyli komórki które podzieliły się tylko raz. Częstość
występowania mikrojąder jest proporcjonalna do dawki promieniowania. Podobnie
jak w przypadku dicentryków, w celu ustalenia dawki pochłoniętej analizuje się
limfocyty, które podzieliły się jeden raz od momentu napromienienia. Daje to
pewność, że mikrojądra tylko w niewielkim stopniu zostały usunięte z komórek. Wadą
testu mikrojądrowego jest mała czułość na niskie dawki promieniowania. Próg dawki
rozpoznawalnej leży między 0,2 - 0,3 Gy dla promieni Rentgena lub gamma.
1. B. Gostkowska; Sz. Rosiński; „Ochrona Radiologiczna”. Materiały
szkoleniowe dla operatorów akceleratorówi/ lub urządzeń do teleterapii.
Centralne Laboratorium Ochrony Radiologicznej, Warszawa, 2003.
2. L. Dobrzyński; W. Trojanowski; „Wybrane zagadnienia z radiobiologii
człowieka”. Raport nr 15, Świerk, 2002.
3. L. Dobrzyński, E. Droste, W. Trojanowski, R. Wołkiewicz; „Spotkanie z
promieniotwórczością”. Instytut Problemów Jądrowych im. A. Sołtana;
Świerk, 2005
4. Materiały szkoleniowe IAEA; „Radiation, People and the Environment”;
2007
5. www.if.pw.edu.pl
6. Maria Kowalska „Symetryczne aberracje chromosomowe jako
biologiczny dozymetr promieniowania jonizującego.” Postępy Techniki
Jądrowej, 2002, Vol.45 Z.1, 33-41
Literatura:
Wyszukiwarka
Podobne podstrony:
Biologiczne skutki promieniowania
Biologiczne skutki promieniowania
Karta pracy Biologiczne skutki promieniowania
Skutki biologiczne promieniowania jonizującego
Wpływ promieniowania jonizującego na materiał biologiczny
ORP biologiczne skutki działania promieniowania
Wpływ promieniowania jonizującego na struktury biologiczne organizmu
Wpływ promieniowania jonizującego na struktury biologiczne organizmu, Studia, Ochrona zdrowia public
4 Biologiczne skutki dzialania promieniowania
Wpływ promieniowania jonizującego na materiał biologiczny
3B Promieniowanie jonizujące
Dozymetria Promieniowania Jonizującego cz 1
PROMIENIOWANIE JONIZUJĄCE2
Promieniowanie jonizujące(1)
ORP uzasadnienie stosowania promieniowania jonizującego
więcej podobnych podstron