Metody instrumentalne w analizie ilościowej
Miareczkowanie konduktometryczne
Od czego zależy szybkość poruszania się jonów w roztworze (v)? .
Od czego zależy przewodnictwo roztworu (
)?Jaka jest definicja przewodnictwa właściwego (χ)?
Jaka jest definicja przewodnictwa równoważnikowego (
r
)?
E
u
v
, u – Ruchliwość jonów, E – Natężenie pola elektrycznego
l
U
E
, U – Różnica potencjału elektrycznego w [V], l – Odległość między elektrodami w [m]
I. Miareczkowanie
konduktometryczne
mocnego kwasu mocną zasadą:
1. Badany roztwór HCl rozcieńczyć w kolbie miarowej wodą destylowaną do kreski miarowej.
2. Roztwór HCl pobrać pipetą i przenieść do zlewki i wrzucić mieszadełko magnetyczne.
3. Umieścić w zlewce z badanym roztworem elektrody konduktometru.
4. Włączyć mieszadło magnetyczne na 2 minuty, wyłączyć i odczytać wartość początkową
roztworu
5. Miareczkować roztworem NaOH i odczytywać wartość
po każdym dodanym 1 cm
3
roztworu NaOH
6. Miareczkować do momentu zmiany trendu wartości
(kilka cm
3
roztworu NaOH za zmianą trendu)
7. Wyniki pomiarów zestawić w tabeli 1.
Roztwór kwasu
Roztwór
NaOH
1. Od rodzaju jonów
2. Stężenia jonów
3. Rodzaju rozpuszczalnika
4. Temperatury
5. Natężenia pola elektrycznego (E)
l
s
,
s – powierzchnia elektrod, l – odległość elektrod;
c
z
r
,
z – ładunek elektryczny jonu, c – stężenie w mol/dm
3
;
F
u
r
, u
– ruchliwość jonów, F = 96 500 C/mol;
Jon
u·10
-8
[m
2
·s
-1
·V
-1
]
H
+
36,30
OH
-
20,50
Li
+
4,01
Na
+
5,19
Cl
-
7,91
[mS
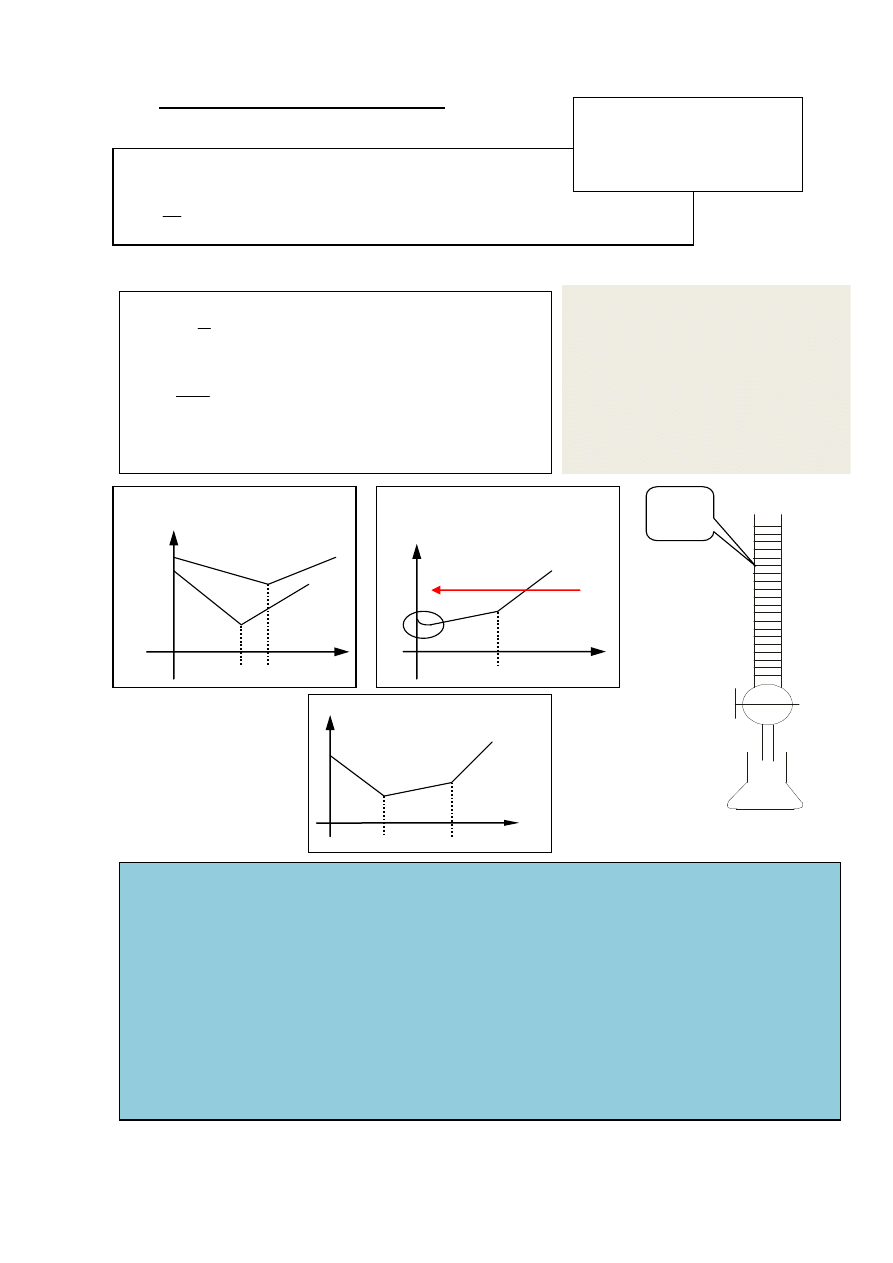
] Krzywa miareczkowania
mocnego kwasu mocną zasadą
PRM
1
PRM
2
V
z
PRM
1
PRM
2
V
z
[mS
] Krzywa miareczkowania
mieszaniny słabego i mocnego kwasu
mocną zasadą
PRM
1
PRM
2
V
z
PRM
1
PRM
2
V
z
[mS
] Krzywa miareczkowania
słabego kwasu mocną zasadą
CH
3
COOH + NaOH = Na
+
+ CH
3
COO- + H
2
O
CH
3
COOH = H
+
+ CH
3
COO
-
PRM V
z
PRM V
z
Tabela 1. Miareczkowanie konduktometryczne mocnego kwasu mocną zasadą:
Nr
pomiaru
1
2
3
4
5
6
7
8
9
10
11
12
13
14
V
z
[cm
3
]
[mS]
Tabela 2. Miareczkowanie konduktometryczne słabego kwasu mocną zasadą:
Nr
pomiaru
1
2
3
4
5
6
7
8
9
10
11
12
13
14
V
z
[cm
3
]
[mS]
Tabela 3. Miareczkowanie konduktometryczne mieszaniny słabego i mocnego kwasu mocną
zasadą:
Nr
pomiaru
1
2
3
4
5
6
7
8
9
10
11
12
13
14
V
z
[cm
3
]
[mS]
Otrzymany wynik: c
HCl
= ……………………..……………………………………………....,
Masa HCl w badanym roztworze: m
HCl
= ……………………………………..……….……..
Otrzymany wynik: c
CH3COOH
= …………………………………………………….…..……..,
Masa CH
3
COOH w badanym roztworze: m
CH3COOH
= ………………………………..….…
II. Miareczkowanie
konduktometryczne
słabego kwasu mocną zasadą:
1. Badany roztwór CH
3
COOH rozcieńczyć w kolbie miarowej wodą destylowaną do kreski miarowej.
1.
Dalszy tok postępowania tak, jak w punkcie I. Wyniki pomiarów zestawić w tabeli 2.
III. Miareczkowanie
konduktometryczne
mieszaniny słabego i mocnego kwasu mocną zasadą:
1. Roztwór mieszaniny HCl i CH
3
COOH pobrać pipetą i przenieść do zlewki, wrzucić mieszadełko
magnetyczne i miareczkować tak, jak punkcie I i II. Wyniki pomiarów zestawić w tabeli 3.
Wyniki pomiarów zestawić w tabeli 3.
Wyszukiwarka
Podobne podstrony:
analiza ilosciowa 6 id 60541 Nieznany (2)
analiza ilosciowa 2 id 60539 Nieznany
analiza ilosciowa 4 id 60540 Nieznany (2)
analiza ilosciowa 9 id 60543 Nieznany (2)
analiza ilosciowa 6 id 60541 Nieznany (2)
analiza ilosciowa 2 id 60539 Nieznany
Elementy analizy ilosciowej id Nieznany
analiza notatki 3 id 559208 Nieznany (2)
Analiza struktury id 61534 Nieznany (2)
Analiza czynnikowa id 59935 Nieznany (2)
Darfur analiza kryzysu id 13186 Nieznany
Analiza Finansowa 3 id 60193 Nieznany (2)
Analiza finansowhga id 60398 Nieznany (2)
IMW W02 analiza stanow id 21233 Nieznany
Analiza krancowa id 60743 Nieznany (2)
analiza skupien id 61367 Nieznany
Analiza termiczna id 61671 Nieznany (2)
Analiza biochemiczna id 59863 Nieznany
analiza wzory id 61812 Nieznany (2)
więcej podobnych podstron