ANALIZA OBJĘTOŚCIOWA
Argentometryczne oznaczanie Cl
-
Metoda Mohra
Substancja podstawowa:
(NaCl),
M = 58,5 g·mol
–1
kolby
NaCl
NaCl
NaCl
V
M
m
c
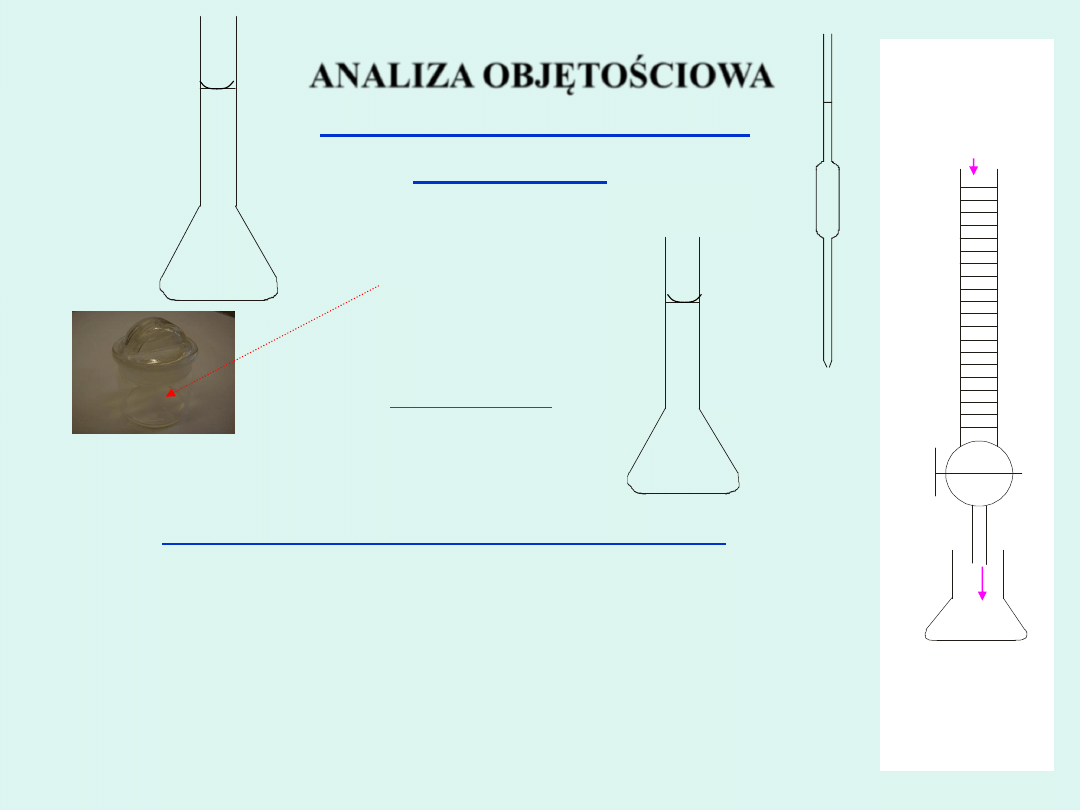
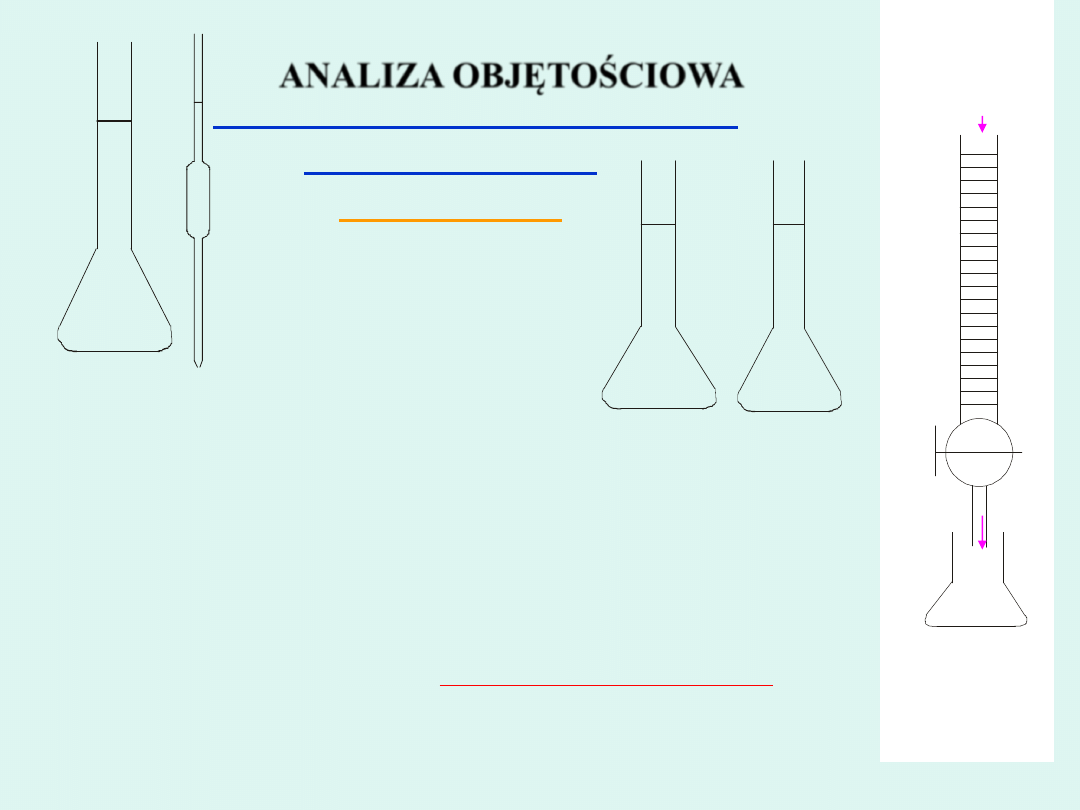
Kolba miarowa
Pipeta
Roztwór
AgNO
3
Cl
-
Biureta
Kolba stożkowa
ETAPY OZNACZENIA ARGENTOMETRYCZNEGO
1. Przygotowanie roztworu substancji podstawowej w kolbie miarowej
2. Oznaczenie stężenia roztworu AgNO
3
3
.
Oznaczenie stężenia roztworu Cl
-
Naczyńko wagowe
Cl
-
+ Ag
+
= AgCl
Jak w oznaczeniach argentometrycznych określa się punkt równoważności molowej?
(Roztwór NaCl,
K
2
CrO
4
)
CrO
4
2-
+ 2Ag
+
=
Ag
2
CrO
4
NaCl
AgNO
3
ANALIZA OBJĘTOŚCIOWA
Argentometryczne oznaczanie Cl
-
Metoda Mohra
Cl
AgNO
AgNO
Cl
V
c
V
c
3
3
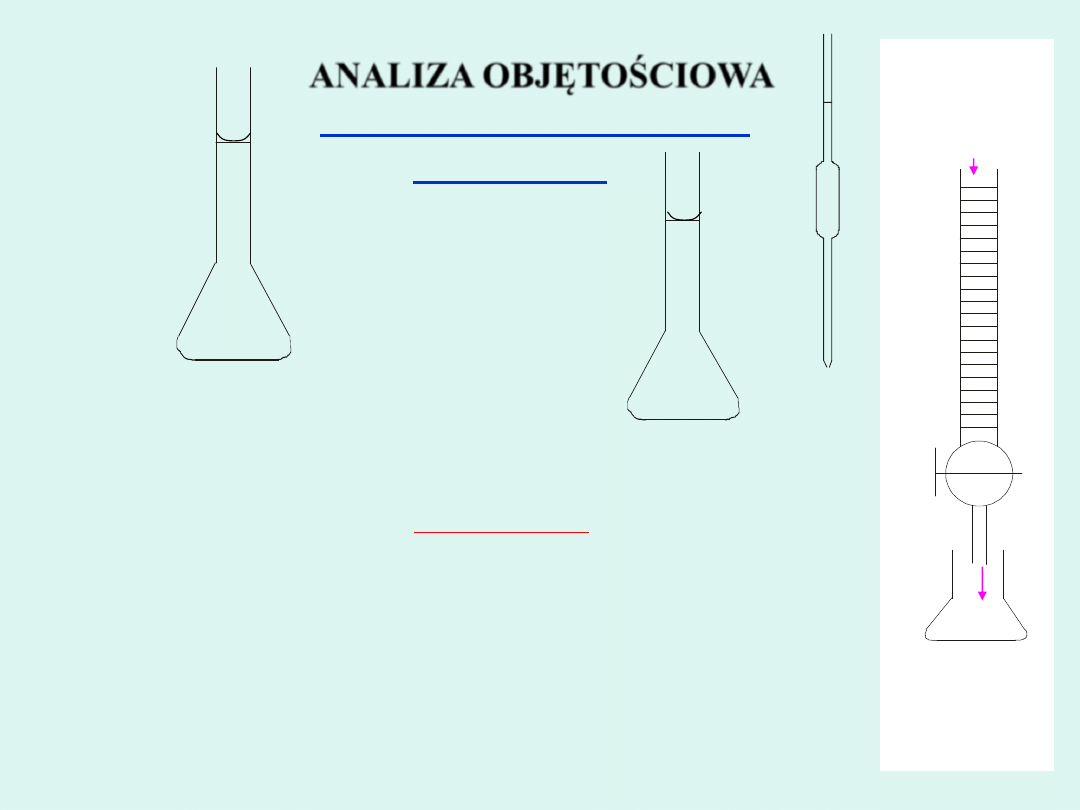
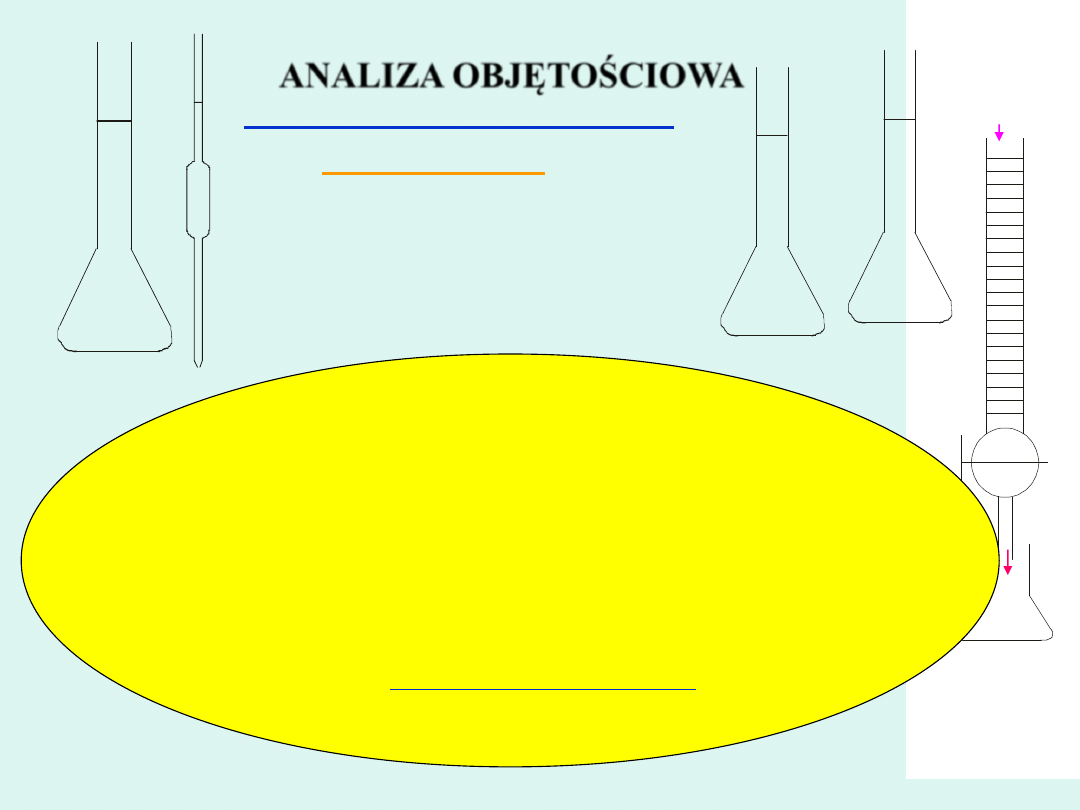
Kolba miarowa
Pipeta
Roztwór
AgNO
3
Cl
-
Biureta
Kolba stożkowa
Oznaczenie stężenia roztworu Cl
-
Cl
-
+ Ag
+
= AgCl,
CrO
4
2-
+ 2Ag
+
=
Ag
2
CrO
4
(Roztwór NaCl,
K
2
CrO
4
)
Oznaczenie Cl
-
i Br
-
przeprowadza się w roztworach obojętnych
1. W środowisku zasadowym
2 Ag
+
+ 2 OH
-
= Ag
2
O + H
2
O
2.
W środowisku kwaśnym
2 CrO
4
2-
+ 2H
+
= Cr
2
O
7
2-
+ H
2
O
AgNO
3
Cl
-
Ag
2
Cr
2
O
7
lepiej rozpuszczalny niż
Ag
2
CrO
4
(oba związki rozpuszczają się w kwasach)
Argentometryczne oznaczanie Cl
-
Metoda Mohra. Poprawka na rozpuszczalność Ag
2
CrO
4
(V
popr
)
Ag
2
CrO
4
lepiej rozpuszczalny niż
AgCl.
W PRM stężenie jonów Ag
+
jest niewystarczające do wytrącenia
Ag
2
CrO
4
.
AgCl Ag + Cl
Ag
CrO 2 Ag + CrO
2
4
4
2
Wytrącanie
Ag
2
CrO
4
. rozpoczyna się po dodaniu pewnego nadmiaru AgNO
3
.
Ten nadmiar można wyznaczyć doświadczalnie:
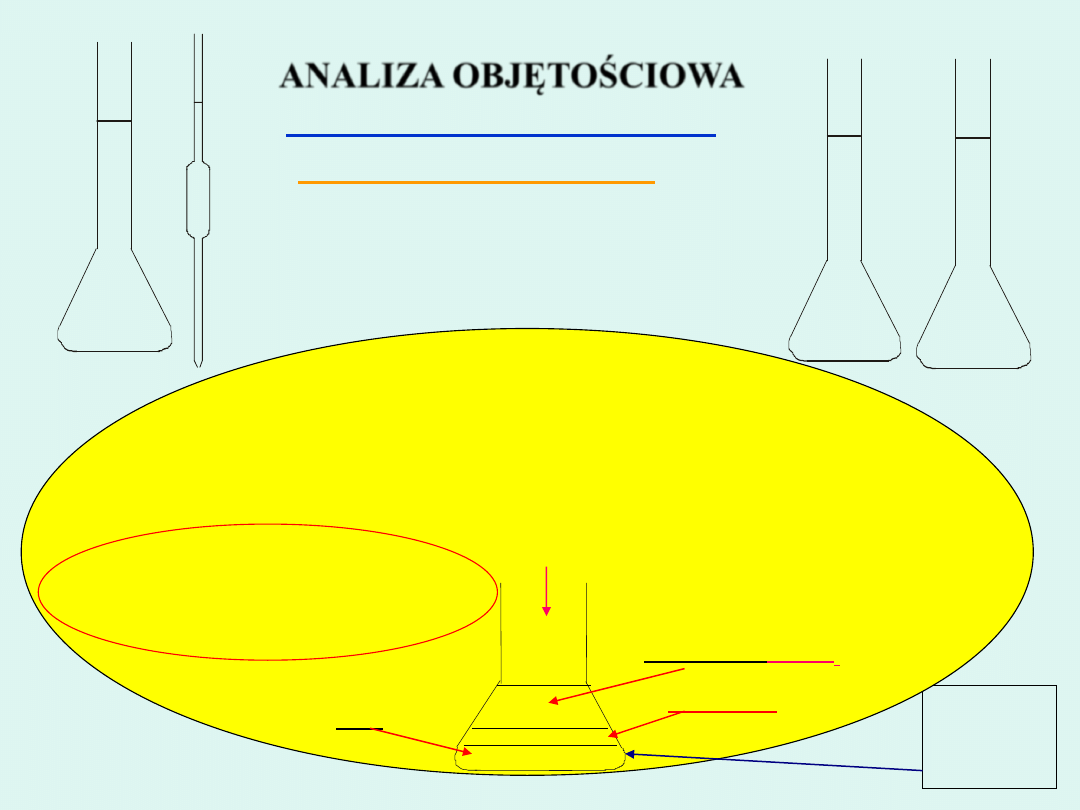
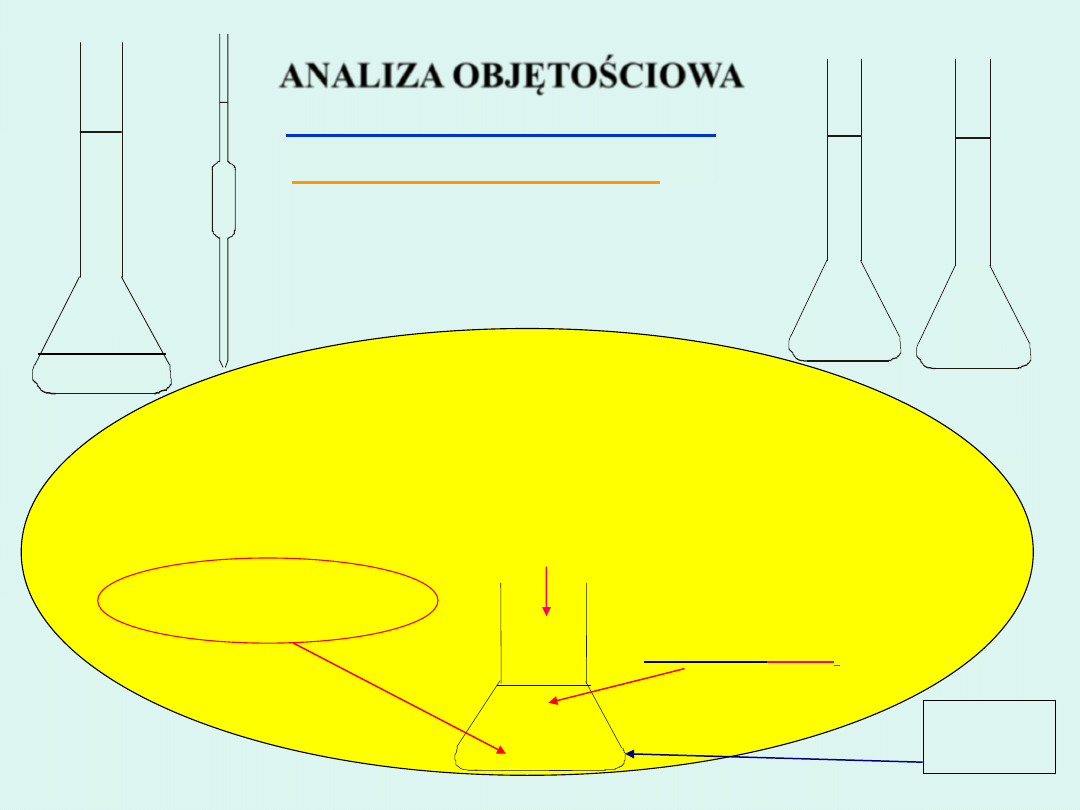
1.
Do kolby stożkowej wlać 25 cm
3
wody destylowanej
2.
Dodać 5 kropli
K
2
CrO
4
3.
Miareczkować roztworem AgNO
3
do pojawienia się trwałego czerwonobrunatnego
zabarwienia pochodzącego od wytrącającego się osadu
Ag
2
CrO
4
4.
Odczytać objętość zużytego roztworu AgNO
3
(
V
popr
)
ANALIZA OBJĘTOŚCIOWA
Argentometryczne oznaczanie Cl
-
Metoda Mohra
Cl
AgNO
popr
AgNO
Cl
V
c
V
V
c
3
3
)
(
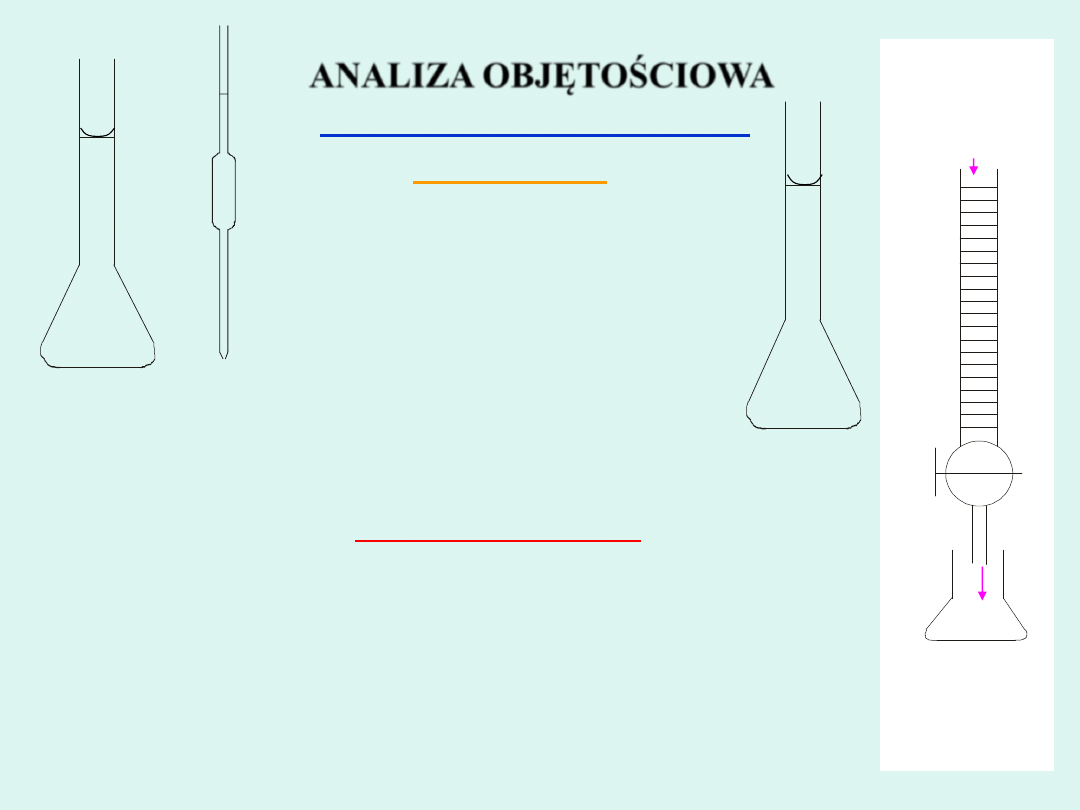
Roztwór
AgNO
3
Cl
-
Biureta
Kolba stożkowa
Oznaczenie stężenia roztworu Cl
-
Cl
-
+ Ag
+
= AgCl,
CrO
4
2-
+ 2Ag
+
=
Ag
2
CrO
4
(Roztwór NaCl,
K
2
CrO
4
)
AgNO
3
Cl
-
Obliczenie masy jonów Cl
-
w badanym roztworze:
Cl
Kolby
Cl
Cl
c
V
M
m

Argentometria
Przykład:
Jaką objętość roztworu AgNO
3
o stężeniu 0,1233 mol/dm
3
należy użyć do wytrącenia
chlorków z 0,2280 g soli kuchennej, zawierającej 0,79% zanieczyszczeń?
Dane:
c(AgNO
3
) = 0,1233 mol/dm
3
m
soli kuchennej
= 0,2280
%
zanieczyszczeń
= 0,79
M(NaCl) = 58,5 g/mol
Należy obliczyć:
V(AgNO
3
) = ?
Rozwiązanie:
g
m
M
M
m
NaCl
NaCl
Cl
Cl
1373
,
0
2289
,
0
9921
,
0
5
,
58
5
,
35
)
0079
,
0
1
(
Cl
AgNO
n
n
3
Cl
-
+ Ag
+
= AgCl,
CrO
4
2-
+ 2Ag
+
=
Ag
2
CrO
4
3
3
37
,
31
03137
,
0
1233
,
0
5
,
35
1373
,
0
3
3
cm
dm
c
M
m
V
AgNO
Cl
Cl
AgNO
ANALIZA OBJĘTOŚCIOWA
Argentometryczne oznaczanie Cl
-
, Br
-
i I
-
z roztworów kwaśnych
Metoda Volharda
Cl
SCN
SCN
AgNO
AgNO
Cl
V
c
V
c
V
c
3
3
Roztwór
NH
4
SCN
Cl
-
Biureta
Kolba stożkowa
Oznaczenie stężenia roztworu Cl
-
Cl
-
AgNO
3
Cl
-
+ Ag
+
nadmiar
= AgCl,
Ag
+
+ SCN
-
= AgSCN,
Fe
3+
+ 3 SCN
-
=
Fe(SCN)
3
(Roztwór Cl
-
,
AgNO
3,nadmiar
,
FeCl
3
SCN
-
ANALIZA OBJĘTOŚCIOWA
Argentometryczne oznaczanie Cl
-
Metoda Volharda
Roztwór
NH
4
SCN
Cl
-
Biureta
Kolba stożkowa
Cl
-
AgNO
3
Cl
-
+ Ag
+
nadmiar
= AgCl,
Ag
+
+ SCN
-
= AgSCN,
Fe
3+
+ 3 SCN
-
=
Fe(SCN)
3
(Roztwór Cl
-
,
AgNO
3,nadmiar
,
FeCl
3
SCN
-
1. Otrzymany w kolbie miarowej badany roztwór uzupełnić wodą
destylowaną do kreski miarowej i dokładnie wymieszać
2. Pobrać pipetą roztwór z kolby miarowej i przenieść ilościowo do kolby
stożkowej z korkiem szlifowym
3. Dodać 5 cm
3
roztworu HNO
3
o c = 2 mol/dm
3
i 5 cm
3
nitrobenzenu.
4. Dodać nadmiar AgNO
3
, zakorkować kolbę stożkową i wytrząsać 1
minutę
5. Dodać 3 cm
3
roztworu FeCl
3
i miareczkować roztworem NH
4
SCN do
momentu pojawienia się czerwonego zabarwienia
Fe(SCN)
3
Cl
SCN
SCN
AgNO
AgNO
Cl
V
c
V
c
V
c
3
3
ANALIZA OBJĘTOŚCIOWA
Argentometryczne oznaczanie Cl
-
Metoda Volharda (I sposób)
Cl
-
AgNO
3
Cl
-
+ Ag
+
nadmiar
= AgCl,
Ag
+
+ SCN
-
= AgSCN,
Fe
3+
+ 3 SCN
-
=
Fe(SCN)
3
(Roztwór Cl
-
,
AgNO
3,nadmiar
,
FeCl
3
SCN
-
3. Dodać 5 cm
3
roztworu HNO
3
o c = 2 mol/dm
3
i 5 cm
3
nitrobenzenu
4. Dodać nadmiar AgNO
3
, zakorkować kolbę stożkową i wytrząsać 1 minutę
5. Dodać 3 cm
3
roztworu FeCl
3
i miareczkować roztworem NH
4
SCN do
momentu pojawienia się czerwonego zabarwienia
Fe(SCN)
3
Za PRM nadmiar
SCN
-
nie reaguje
z Fe
3+
lecz z AgCl
AgCl
lepiej rozpuszczalny niż
AgSCN
Nitrobenzen
AgCl
Fe
3+
+ 3 SCN
-
=
Fe(SCN)
3
AgCl + SCN
-
= AgSCN + Cl
-
NH
4
SCN
ANALIZA OBJĘTOŚCIOWA
Argentometryczne oznaczanie Cl
-
Metoda Volharda (II sposób)
AgCl
AgNO
3
Cl
-
+ Ag
+
nadmiar
= AgCl,
Ag
+
+ SCN
-
= AgSCN,
Fe
3+
+ 3 SCN
-
=
Fe(SCN)
3
(Roztwór Ag
+
,
FeCl
3
SCN
-
1.
Do kolby miarowej z jonami Cl
-
dodać nadmiar AgNO
3
i po wytrąceniu
AgCl roztwór w kolbie dopełnić do kreski woda destylowaną, wymieszać
2.
Pobrać pipetą roztwór znad osadu i przenieść do kolby stożkowej
3.
Dodać 3 cm
3
roztworu FeCl
3
i miareczkować roztworem NH
4
SCN do
momentu pojawienia się czerwonego zabarwienia
Fe(SCN)
3
Nadmiar
NH
4
SCN
reaguje z Fe
3+
Fe
3+
+ 3 SCN
-
=
Fe(SCN)
3
Ag
+
+ SCN
-
= AgSCN
NH
4
SCN
Ag
+
Argentometryczne oznaczanie Cl
-
Metoda Volharda.
Przygotowanie mianowanego roztworu NH
4
SCN
AgNO
3
NH
4
SCN
Roztwór
NH
4
SCN
Kolba stożkowa
Biureta
AgNO
3
(AgNO
3,
FeCl
3
Ag
+
+ SCN
-
= AgSCN,
Fe
3+
+ 3 SCN
-
=
Fe(SCN)
3
_
3
3
_
SCN
AgNO
AgNO
SCN
V
c
V
c

Argentometryczne oznaczanie Cl
-
Metoda Volharda
Przykład:
Obliczyć % zawartość KI w próbce o masie 0,2496 g, którą rozpuszczono w wodzie i
zakwaszono kwasem azotowym(V), a po dodaniu 20 cm
3
roztworu AgNO
3
o stężeniu 0,1 mol · dm
-3
nadmiar AgNO
3
odmiareczkowano roztworem NH
4
SCN o stężeniu 0,0548 mol · dm
-3
, zużywając
9,1 cm
3
tego roztworu.
Dane:
V(AgNO
3
) = 20 cm
3
c(AgNO
2
) = 0,10 mol/dm
3
V(NH
4
SCN) = 9,1 cm
3
c(NH
4
SCN) = 0,0548 mol/dm
3
m
probki
= 0,2496 g
M(KI) = 167 g/mol
Należy obliczyć:
%(KI) = ?
Rozwiązanie:
)
(
3
3
SCN
SCN
AgNO
AgNO
KI
KI
c
V
c
V
M
m
SCN
SCN
AgNO
AgNO
I
c
V
c
V
n
3
3
g
m
KI
2492
,
0
)
0548
,
0
0091
,
0
1
,
0
02
,
0
(
166
9984
,
0
100
2496
,
0
2492
,
0
100
%
próbki
KI
KI
m
m
Wyszukiwarka
Podobne podstrony:
analiza ilosciowa 6 id 60541 Nieznany (2)
analiza ilosciowa 2 id 60539 Nieznany
analiza ilosciowa 9 id 60543 Nieznany (2)
analiza ilosciowa 7 id 60542 Nieznany (2)
analiza ilosciowa 6 id 60541 Nieznany (2)
analiza ilosciowa 2 id 60539 Nieznany
Elementy analizy ilosciowej id Nieznany
analiza notatki 3 id 559208 Nieznany (2)
Analiza struktury id 61534 Nieznany (2)
Analiza czynnikowa id 59935 Nieznany (2)
Darfur analiza kryzysu id 13186 Nieznany
Analiza Finansowa 3 id 60193 Nieznany (2)
Analiza finansowhga id 60398 Nieznany (2)
IMW W02 analiza stanow id 21233 Nieznany
Analiza krancowa id 60743 Nieznany (2)
analiza skupien id 61367 Nieznany
Analiza termiczna id 61671 Nieznany (2)
Analiza biochemiczna id 59863 Nieznany
analiza wzory id 61812 Nieznany (2)
więcej podobnych podstron