1
3. Biochemia - budowa białek
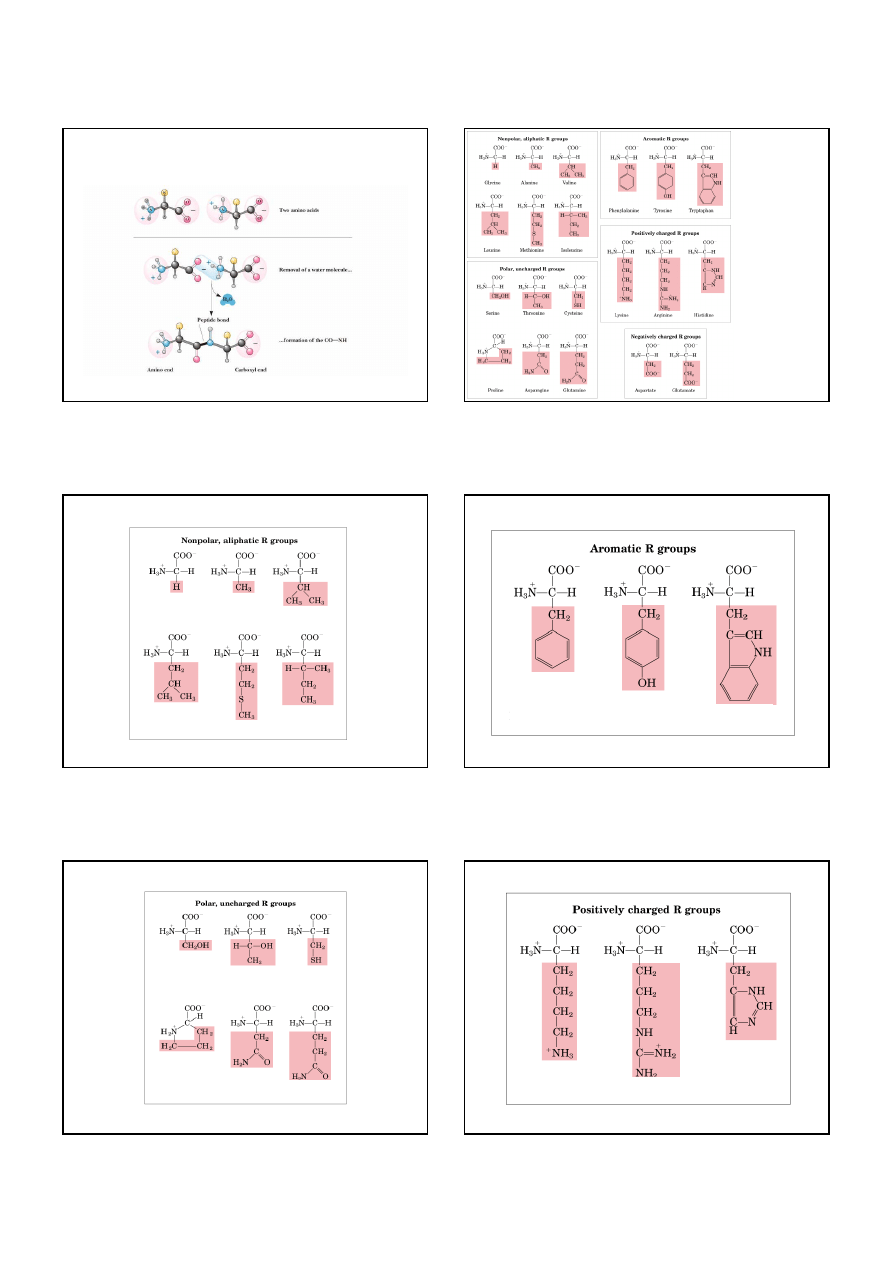
Hierarchiczna budowa komórki
komórka
struktury
subkomórkowe
makrocząsteczki
podjednostki
monomeryczne
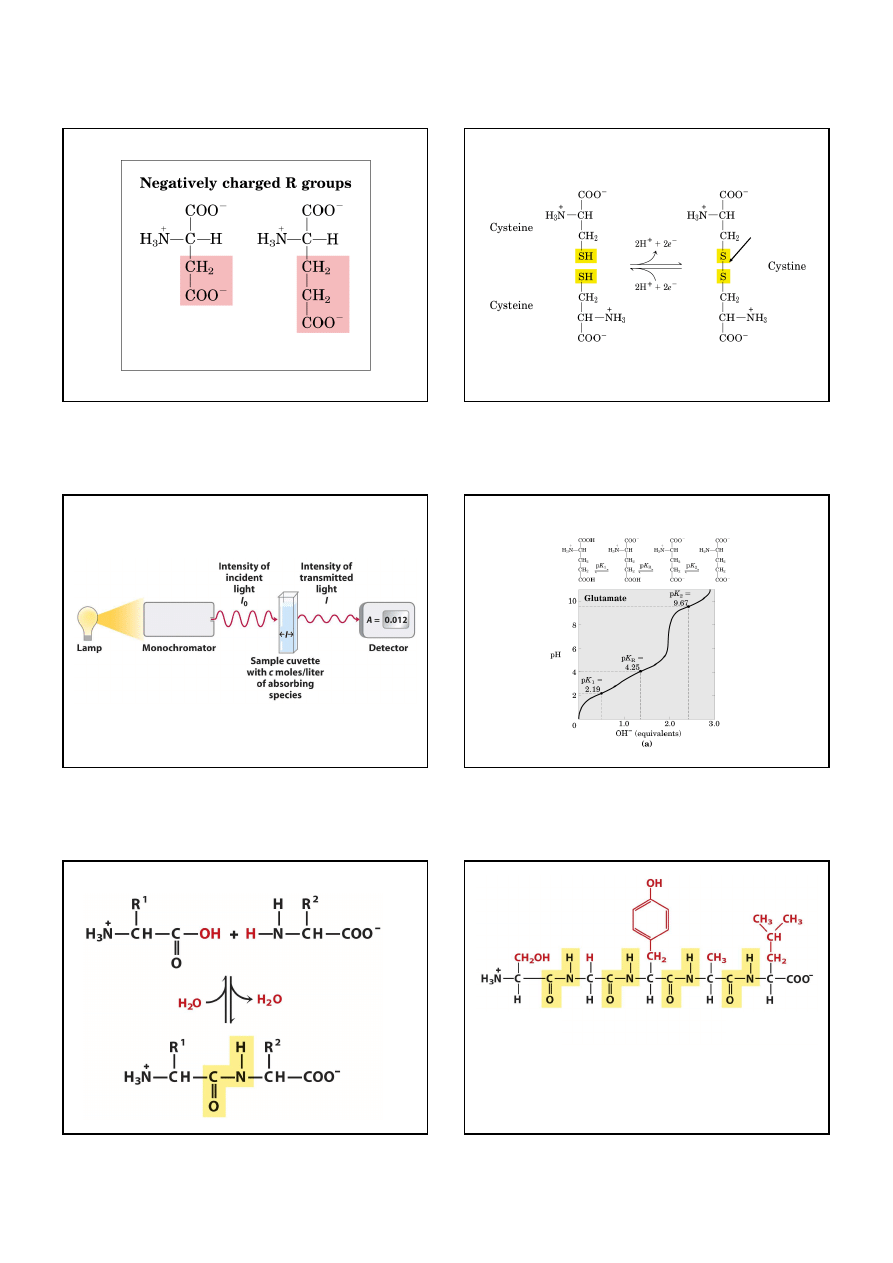
Aminokwasy – podstawowe jednostki budulcowe białek
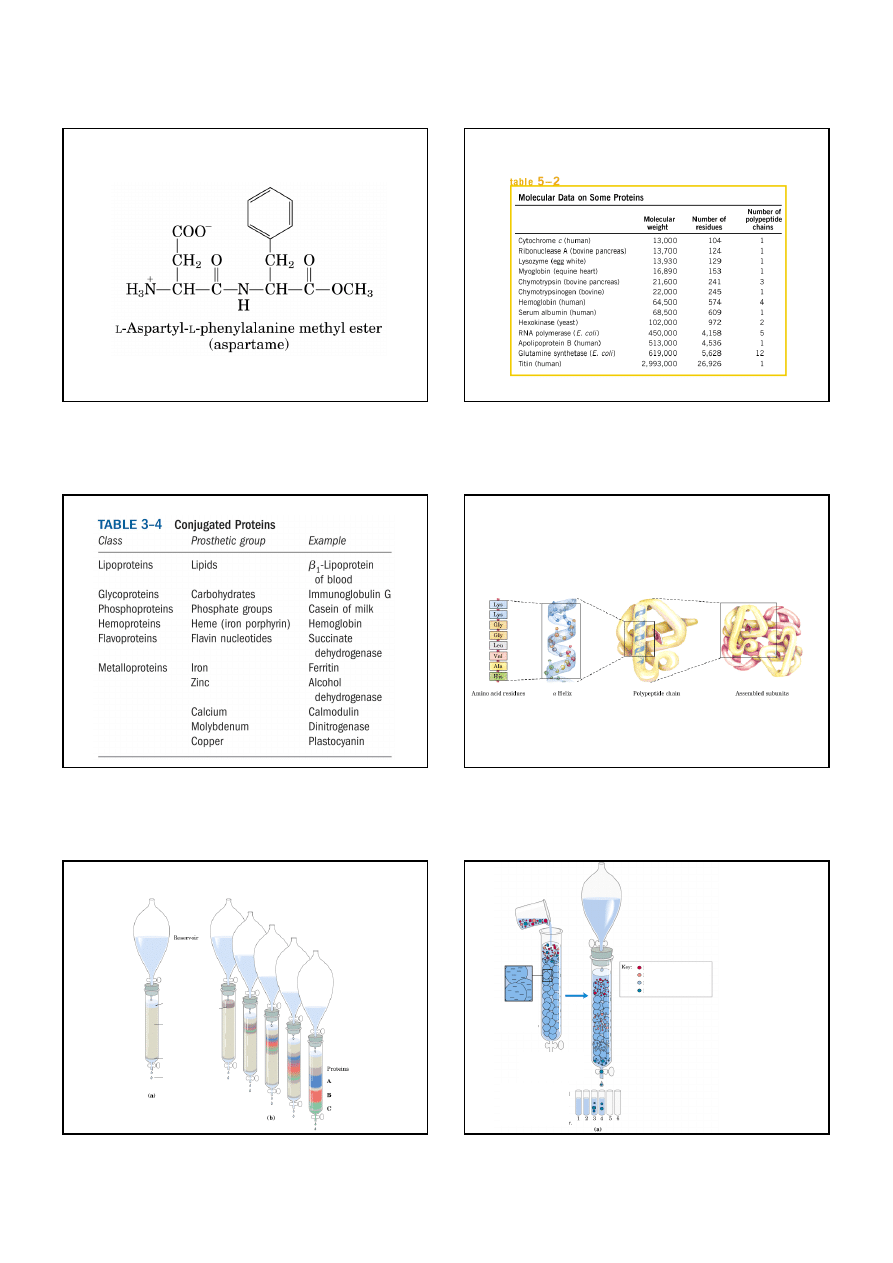
Struktura aminokwasu
grupa aminowa
grupa karboksylowa
Aminokwasy są stereoizomerami
Wszystkie aminokwasy wchodzące w skład bialek
są w konfiguracji L
2
Aminokwasy łączą się za pomocą wiązania peptydowego
Aminokwasy
Aminokwasy o niepolarnych, alifatycznych grupach bocznych
glicyna alanina walina
leucyna metionina izoleucyna
Niepolarne, aromatyczne grupy boczne
fenyloalanina tyrozyna tryptofan
Polarne, nienaładowane grupy boczne
seryna treonina cysteina
prolina asparagina glutamina
Dodatnio naładowane grupy boczne
lizyna arginina histydyna
3
Ujemnie naładowane grupy boczne
kwas asparaginowy kwas glutaminowy
cysteina + cysteina
→
→
→
→
cystyna
grupy tiolowe
mostek
disiarczkowy
Absorpcja w ultrafiolecie (280 nm): określanie stężenia białek
Miareczkowanie aminokwasu (kwasu glutaminowego)
Aminokwasy łączą się tworząc wiązanie peptydowe
N-koniec C-koniec
Peptyd zawiera N-koniec i C-koniec
Peptyd to polimer składający się z aminokwasów.
4
Aspartame (Nutrasweet®): słodzik
Właściwości niektórych białek:
masa cząsteczkowa 10 000 - 3 000 000;
ilość aminokwasów: 100 - 27 000.
Koniugaty białek
Struktura białek
pierwszorzędowa drugorzędowa trzeciorzędowa
czwartorzędowa
Struktura pierwszorzędowa: sekwencja aminokwasowa.
Struktura drugorzędowa: struktura łańcucha polipeptydowego (
α
αα
α
-helisa,
ββββ
- harmonijka).
Struktura trzeciorzędowa: ułożenie całego łańcucha polipeptydowego.
Struktura czwartorzędowa: ułożenie kilku łańcuchów polipeptydowych.
Rozdzielanie białek - chromatografia kolumnowa
roztwór
faza stała
eluent
Chromatografia jonowymienna
ładunek dodatni
ładunek ujemny
perełki z
ujemnymi
ładunkami
5
Chromatografia sita molekularnego
porowate
perełki
Chromatografia powinowactwa
białko
ligand
ligand związany
z polimerem
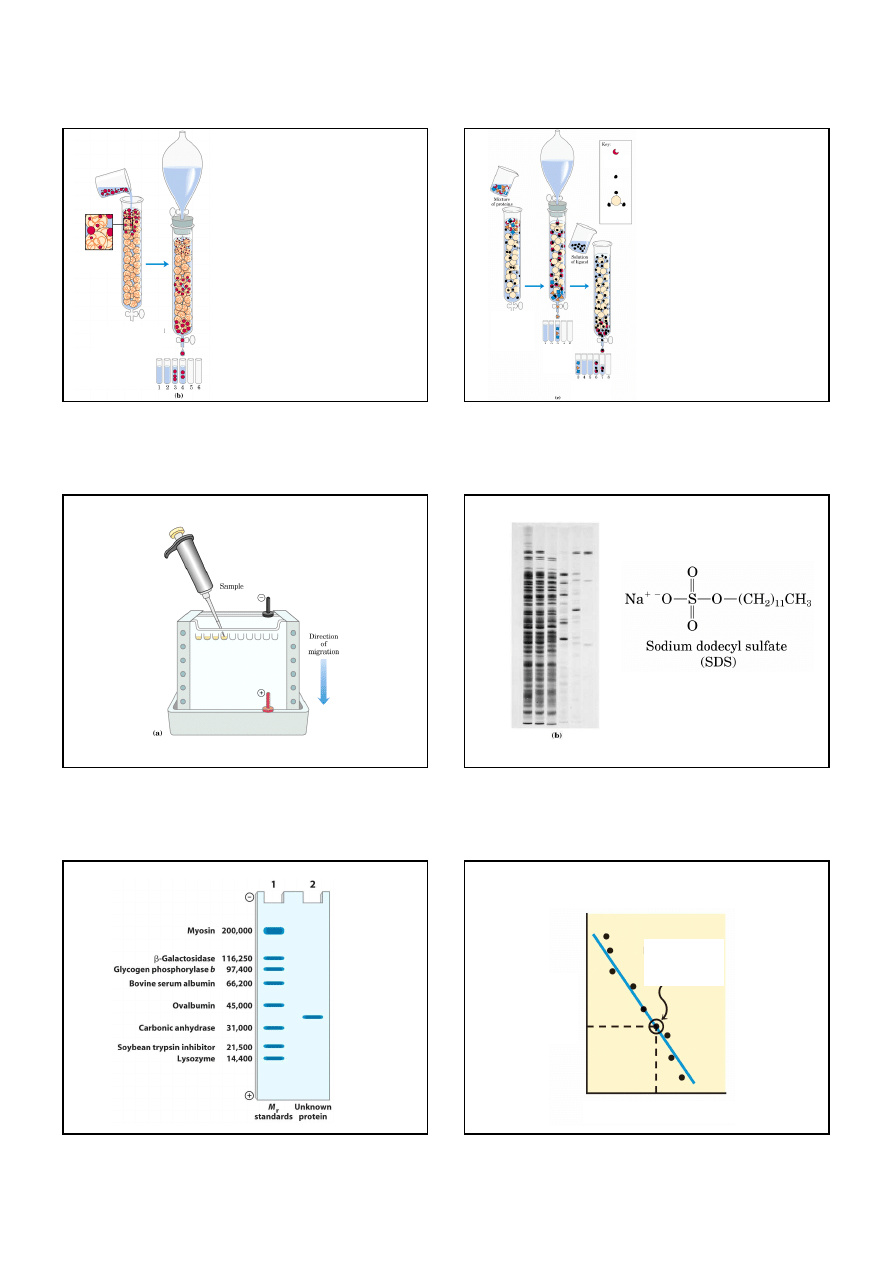
Elektroforeza: rozdział białek w żelu poliakrylamidowym
Detergent:
siarczan dodecylu sodu (SDS) powoduje
denaturację białek.
Elektroforeza: każde białko wędruje w postaci osobnego prążka
Elektroforeza: oznaczenie względnej masy cząsteczkowej
nieznane
białko
Log Mcz
względna migracja
6
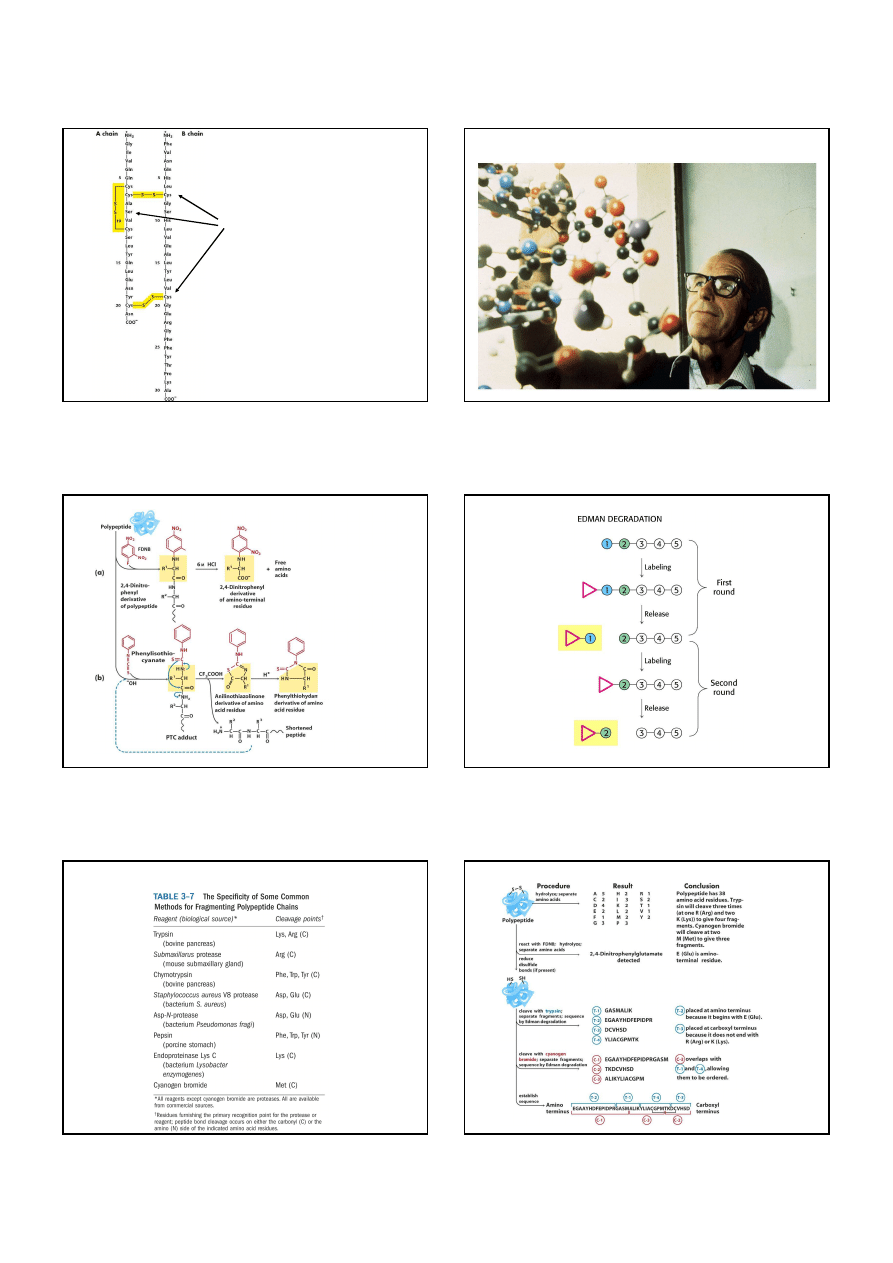
Sekwencja aminokwasowa
insuliny wołowej
mostki disiarczkowe
Sekwencjonowanie białek: Frederic Sanger określił sekwencję insuliny
Sekwencjowanie łańcucha polipetydowego
identyfikacja aminokwasu
N-końcowego
degradacja Edmana:
pozwala identyfikować
kolejne aminokwasy od
N-końca
Degradacja Edmana pozwala na określenie sekwencji aminokwasowej
Łańcuchy polipeptydowe trzeba podzielić na mniejsze fragmenty
Strategia sekwencjonowania białek
7
Sekwencja białka pokrywa się z sekwencją DNA
białko
DNA (gen)
Spektometria masowa białek:
Matrix-Assisted Desorption/Ionization Mass Spectrometry (MALDI)
pole elektryczne
kapilara próbka
próżnia
próbka
matryca
białko
detektor
jony najlżejsze
docieraja jako pierwsze
próba białka
poddana jonizacji
źródło
jonów
laser uruchamia zegar
MALDI-TOF (Time Of Flight)
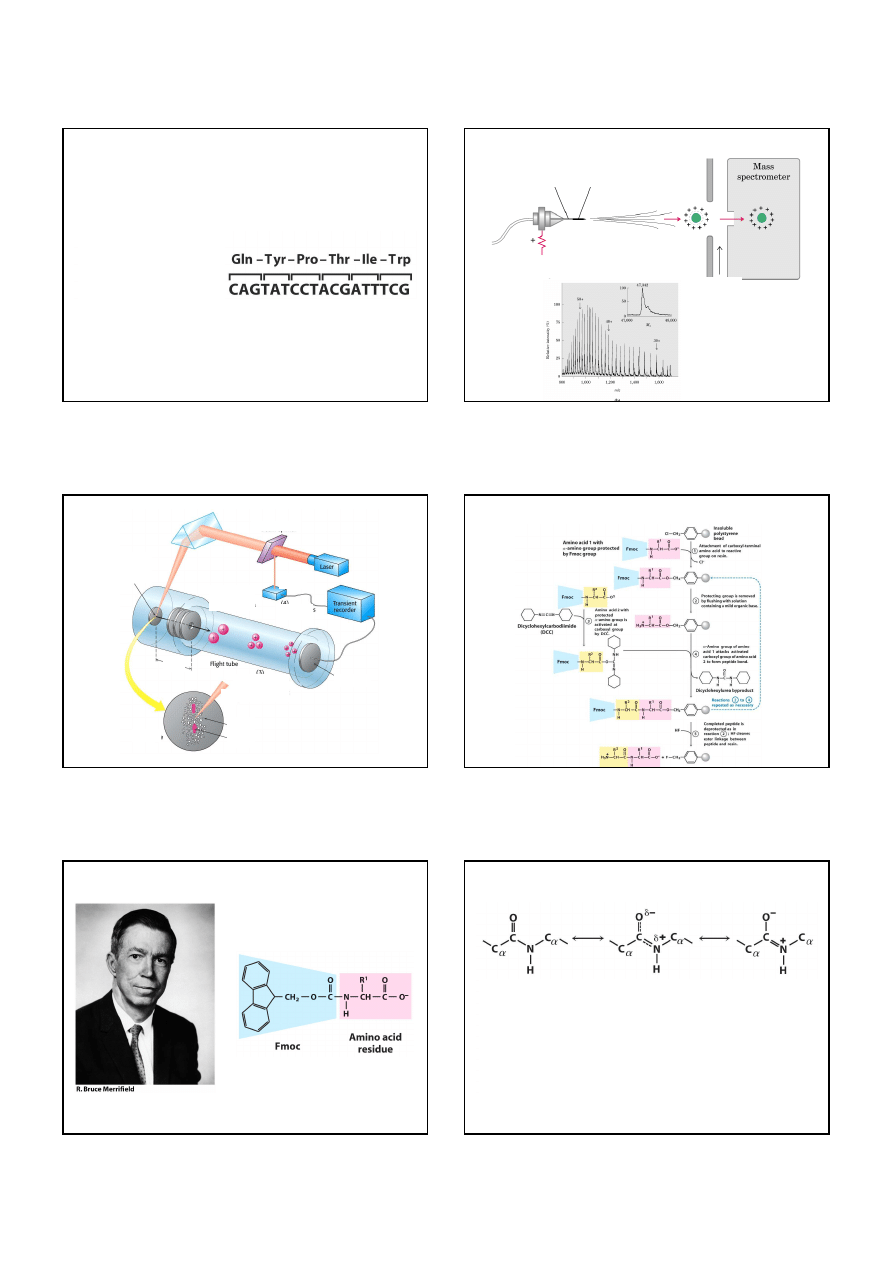
Małe peptydy można syntezować chemicznie
R. Bruce Merrifiled otrzymał peptydy na nierozpuszczalnej matrycy
za pomocą 9-fluorenometoksykarbonylo- pochodnych aminokwasów)
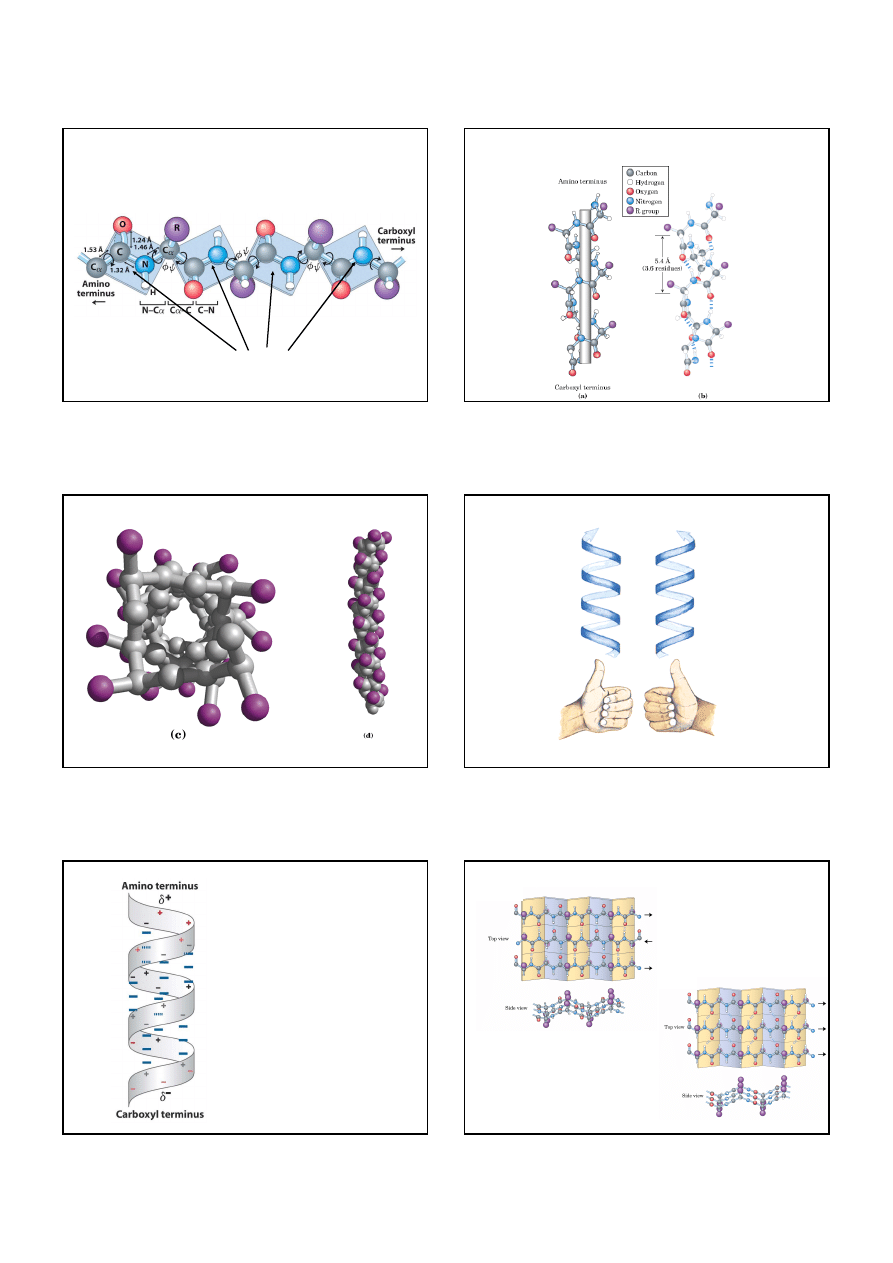
Struktura białek
Łańcuch peptydowy: karbonylowy atom tlenu
i amidowy atom azotu tworzą mały dipol.
Generalna większość wiązań peptydowych występuje
w konfiguracji trans.
8
Wiązanie peptydowe ma charaktery wiązania podwójengo
i nie może się obracać.
wiązania peptydowe
Drugorzędowa struktura białek : helisa
α
αα
α
Drugorzędowa struktura białek : helisa
α
αα
α
Helisa
α
αα
α
: zawsze prawoskrętna
lewoskrętna prawoskrętna
Dipol helisy
α
αα
α
Drugorzędowa struktura białek : harmonijka
ββββ
antyrównoległa
równoległa
Wiązania wodorowe między sąsiednimi
segmentami łańcuchów polipeptydowych
9
Drugorzędowa struktura białek : skręt
ββββ
Łączą końce 2 antyrównoległych segmentów
ββββ
-harmonijek
typI
typ II
Gly
helisa
α
αα
α
harmonijka
ββββ
skręt
ββββ
Prawdopodobieństwo udziału aminokwasów w danej strkuturze
Struktura drugorzędowa i właściwości białek fibrylarnych
Helisa
α
αα
α
: keratyna, składnik włosów i paznokci
Powstawanie loków
Kolagen: składnik ścięgien i chrząstek
Potrójna spirala: lewoskrętna, 3 reszty aminokwasowe na jeden obrót.
35% Gly, 11% Ala, 21% Pro i HyPro
To nie jest helisa
α
αα
α
!
reszty glicyny

10
Struktura włókien kolagenu
Kolagen (M.cz. 300 000 da)
Włókno kolagenu:
długość: 3000 A
średnica: 15 A
Gly-Xaa-Pro lub Gly-Xaa-HyPro
U ssaków wystepuje 30 rodzajów kolagenu.
Struktura kolagenu
łańcuchy
włókienka
kolagenu
włókna
kolagenu
cząsteczki kolagenu
(potrójne helisy)
Sieciowanie cząsteczek kolagenu: Lys, HyLys lub His
łańcuch
polipetydowy
łańcuch
polipetydowy
Lys bez grupy
εεεε
-aminowej
(norleucyna)
HyLys
dehydroksylizynonorleucyna
Kolagen: białko strukturalne, występujące w największej ilości
(do 50% suchej masy). Istnieje 12 rodzajów kolagenu.
Kolageny są syntezowane przez fibroblasty i komórki nabłonka
w postaci prokolagenów.
Prokolageny mają dodatkowe 150 aminokwasów na N-końcu
i 250 aminokwasów na C-końcu. Dodatkowe domeny stabilizują
kolagen w czasie tworzenia potrójnej helisy.
Włókna kolagenu tworzą się w retikulum endoplazmatycznym
i w aparacie Golgiego. W aparcie Golgiego następuje modyfikacja
prolin i lizyn oraz O-glikozylacja.
Modyfikacja prolin i lizyn:
- hydroksylacja prolin
- hydroksylacja lizyn
- oksydacja lizyn (do aldehydów, tworzą następnie mostki
sieciujące łańcuchy)
oddziałuje z typem I i II
?
XII
chrząstki
300 nm
XI
chrząstki
150 nm, C-koniec
globularny
X
chrząstki,
przeważnie z typem II
200 nm, N-koniec
globularny
IX
komórki śródbłonka
?
VIII
śródbłonek
450 nm, dimer
VII
tkanki śródmiąższowe,
przeważnie z typem I
150 nm, N i C-
koniec globularny
VI
tkanki śródmiąższowe,
przeważnie z typem I
390 nm,N-koniec
globularny
V
błony podstawowe
390 nm, C-koniec
globularny
IV
skóra, mięśnie
300 x 67 nm
III
chrząstki, ciała szkliste
często z typem I
300 x 67 nm
II
skóra, ścięgna, kości
300 x 67 nm
I
lokalizacja
struktura
typ
Rodzaje kolagenów

11
Fibroblast produkujący kolagen na warstwie kolagenu
Injekcje kolagenu w celu upiększającym
przed po
Struktury genów kodujących prokolagen typu II (chrząstki, ciała szkliste)
i prokolagen typu I (skóra, ścięgna kości)
Oba geny zawierają 52 eksony, z tym że niektóre eksony mogą
być połączone.
Osteogenesis imperfecta
(wrodzona łamliwość kości)
jest wynikiem mutacji
w obrębie genów kodujących
prokolageny.
Objawy: samoistne złamania,
deformacja kości, niski wzrost,
zaburzone ząbkowanie,
błękitne twardówki.
Synteza prokolagenu może być
obniżona, lub powstający kolagen
może mieć nieprawidłową
strukturę.
Przyczyną wrodzonej łamliwości kości może być utrata eksonów
w genie kodującym prokolagen.
Istnieją typy wrodzonej łamliwości kości.
Typy I i IV dają łagodniejsze objawy niż typ II,
który powoduje śmierć w okresie niemowlęcym.
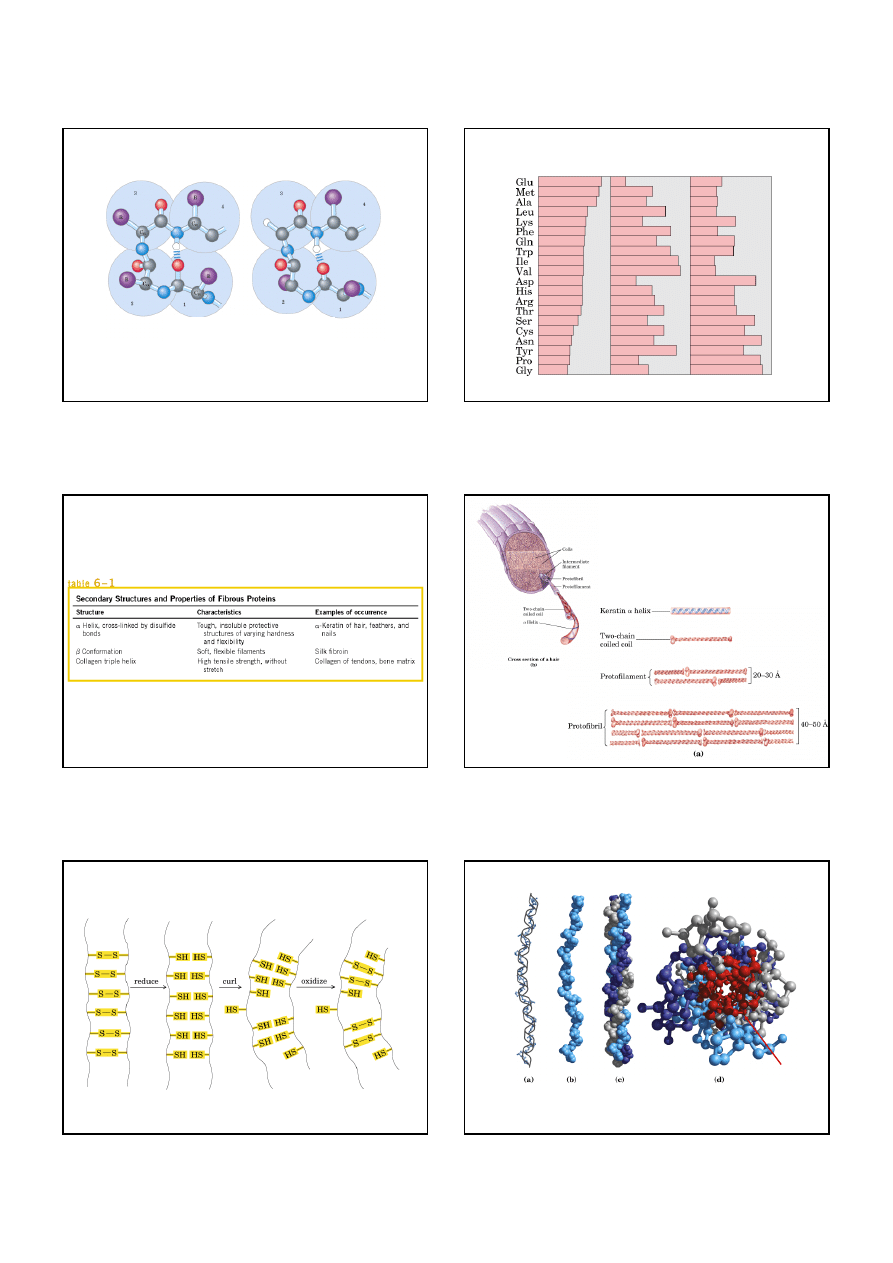
12
Integra
: dwuwarstowy system regeneracji skóry po oparzeniach
Składa się z 2 warstw: zewnętrzna to silikon, który chroni ranę.
Wewnętrzna warstwa to mieszanina bydlęcego
kolagenu i glikozaminoglikanów (siarczanu-6-chondroityny)
z chrząstki rekina.
Wewnętrzna warstwa umożliwia regenerację skóry działając
jak „rusztowanie”, podczas gdy zewnętrzna warstwa zabezpiecza
przed zakażeniem.
Glikozaminoglikany wchodzą w skład macierzy zewnątrzkomórkowej
Glikozaminoglikan powtarzająca się ilość disacharydów
jednostka
w łańcuchu
kwas hialuronowy
4-siarczan chondroityny
siarczan keratanu
służy jako smar w stawach
nadaje konsystencję oku
wchodzi w skład ścięgien
wchodzi w skład chrząstek
i ścięgien
wchodzi w skład kości,
a także rogów,kopyt i paznokci
Jak działa Integra
Dzień 0: oczyszczenie rany
Dzień 1: usunięcie martwej tkanki
Dzień 1: przyłożenie Integry
Dzień 14: utworzyła się naturalna skóra
Dzień 21: usunięcie silikonu
Dzień 21+: przeszczep naskórka
Dzień 25+: całkowita regeneracja skóry
autoprzeszczep skóry Integra

13
4-hydroksyprolina jest niezbędnym składnikiem kolagenu
Różnice w konformacji między proliną i 4-hydrokysproliną
4-hydroksyprolina powstaje w wyniku
działania hydroksylazy prolinowej
Askorbinian (witamina C) jest konieczny do hydroksylacji
reszt proliny w kolagenie
zawiera Fe
2+
Enzym zawierający Fe
3+
jest nieaktywny.
Askorbinian redukuje
Fe
3+
, czyli działa jako
antyutleniacz.
Kwas askorbinowy (witamina C) jest niezbędnym elementem
ludzkiej diety. Tylko człowiek, małpy, świnki morskie i niektóre
nietoperze nie potrafią syntezować witaminy C.
Brak witaminy C powoduje szkorbut.
szkorbut
wypadanie
zębów
blada
skóra
zapadnięte
oczy
James Lind, szkocki lekarz, wykazał w 1753,
że sok z cytryny leczy szkorbut
H.M.S. Salisbury
Kapitan James Cook korzystał z badań Linda
H.M.S. Resolution
H.M.S. Discovery
H.M.S. Endeavour
Biosynteza kwasu askorbinowego u roślin

14
Albert Szent-Gyorgyi wyizolował witaminę C z papryki w roku 1928
Odkrył też witaminę PP i wykazał, że ATP jest niezbędnym źródłem energii w mięśniach.
Nobel 1937.
Zawartość witaminy C w różnych owocach i roślinach
acerola
czarma
porzeczka
guava
papryka
owoce warzywa
zawartość
witaminy C
(mg/100g)
Acerola (Malpighia punicifolia; wiśnia z Barbados):
najwyższa zawartość witaminy C wśród roślin
Fibroina: składnik jedwabiu i nici pajęczych
antyrównoległe
harmonijki
ββββ
fibroina produkowana przez pająka
Białka w różnych konformacjach różnią się wielkością
Albumina (M.cz. 64 500): 585 reszt aminokwasowych
Mioglobina: pierwsze białko o znanej strukturze
15
Hem, obecny w mioglobinie, hemoglobinie, cytochromie
Pierścień protoporfirymowy
oraz jon żelazawy (6 wiązań koordynacyjnych)
W hemoglobinie i mioglobinie
jedno z prostopadłych wiązań koordynacyjnych
jest wykorzystane przez atom N histydyny.
Drugie może byc wykorzystane przez tlen.
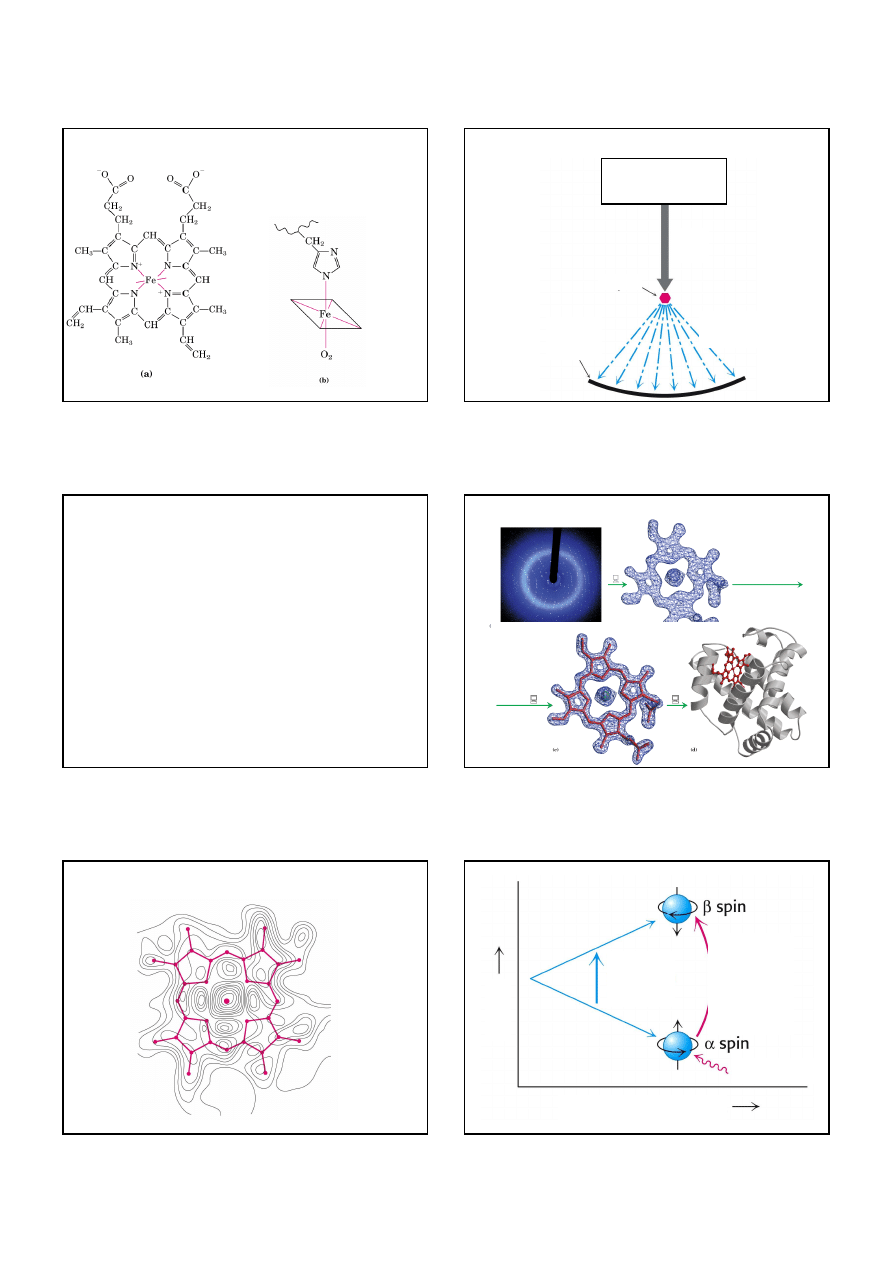
Badanie struktury białek: krystalografia rentgenowska
źródło promieni
rentgenowskich
kryształ
wiązka promieni
rentgenowskich
promienie
rozproszone
detektor
Badanie struktury białek: krystalografia rentgenowska
3 zasady:
1. Elektrony powodują rozproszenie promieni rentgenowskich.
Amplituda fali rozproszonej przez dany atom jest proporcjonalna
do liczby jego elektronów.
2. Fale rozproszone nakładają się.
Każdy atom bierze udział w rozpraszaniu promieni.
Fale rozproszone w wyniku nakładamia się mogą ulegać
wzmocnieniu lub wygaszeniu, w zależności od tego,
czy znajdują się w jednakowej, czy tez różnej fazie.
3. Sposób nakładania się fal zalezy od rozkładu przestrzennego atomów.
Badanie trójwymiarowej struktury białek:
dyfrakcja promieni rentgenowskich
Wycinek mapy gęstości elektronowej mioglobiny
Magnetyczny rezonans jądrowy
energia
natężęnie pola magnetyczego
rozdzielenie
energii (
∆∆∆∆
E)
przejście między
stanami spinowymi
daje linię NMR
napromieniowanie
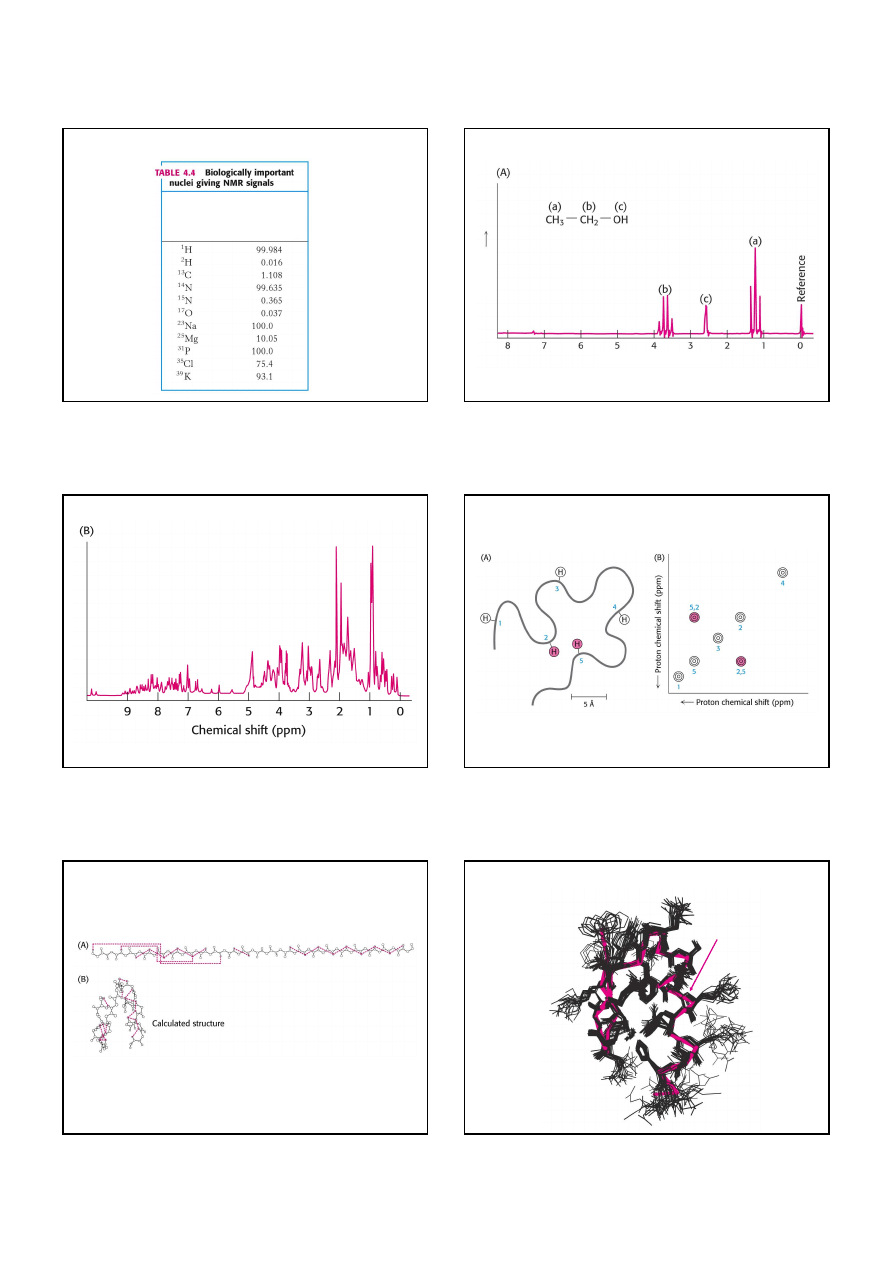
16
Biologicznie ważne jądra atomów dające sygnał NMR
jądro
występowanie izotopu
w przyrodzie
(% wagowy w puli
pierwiastka)
Magnetyczny rezonans jądrowy: alkohol etylowy
intensywność
przesunięcie chemiczne (ppm)
jądro znajdujące się w różnych
środowiskach zmienia stany
przy różniących się siłach pól
Magnetyczny rezonans jądrowy: 55-aminokwasowy peptyd
Jadrowy efekt Overhausera identyfikuje pary protonów znajdujące
się w bliskim sąsiedztwie
Struktura określona na podstawie obliczeń uzyskanych z widma NMR
Zestaw 25 struktur złożonych z 28-aminokwasowej
domeny palca cynkowego
przeciętne ułożenie
szkieletu białka

17
Magnetyczny rezonans jądrowy
Trójwymiarowa struktura niektórych małych białek
Udział rodzajów struktur w różnych białkach
Niektóre często występujące połączenia struktur
Niektóre często występujące połączenia struktur
Połączenia harmonijek w strukturze składającej sie wyłącznie z harmonijek
ββββ
skrzyżowane (nigdy niespotykane)
typowe
Struktura baryłki
ββββ
- wiele harmonijek
ββββ
przeciwciało
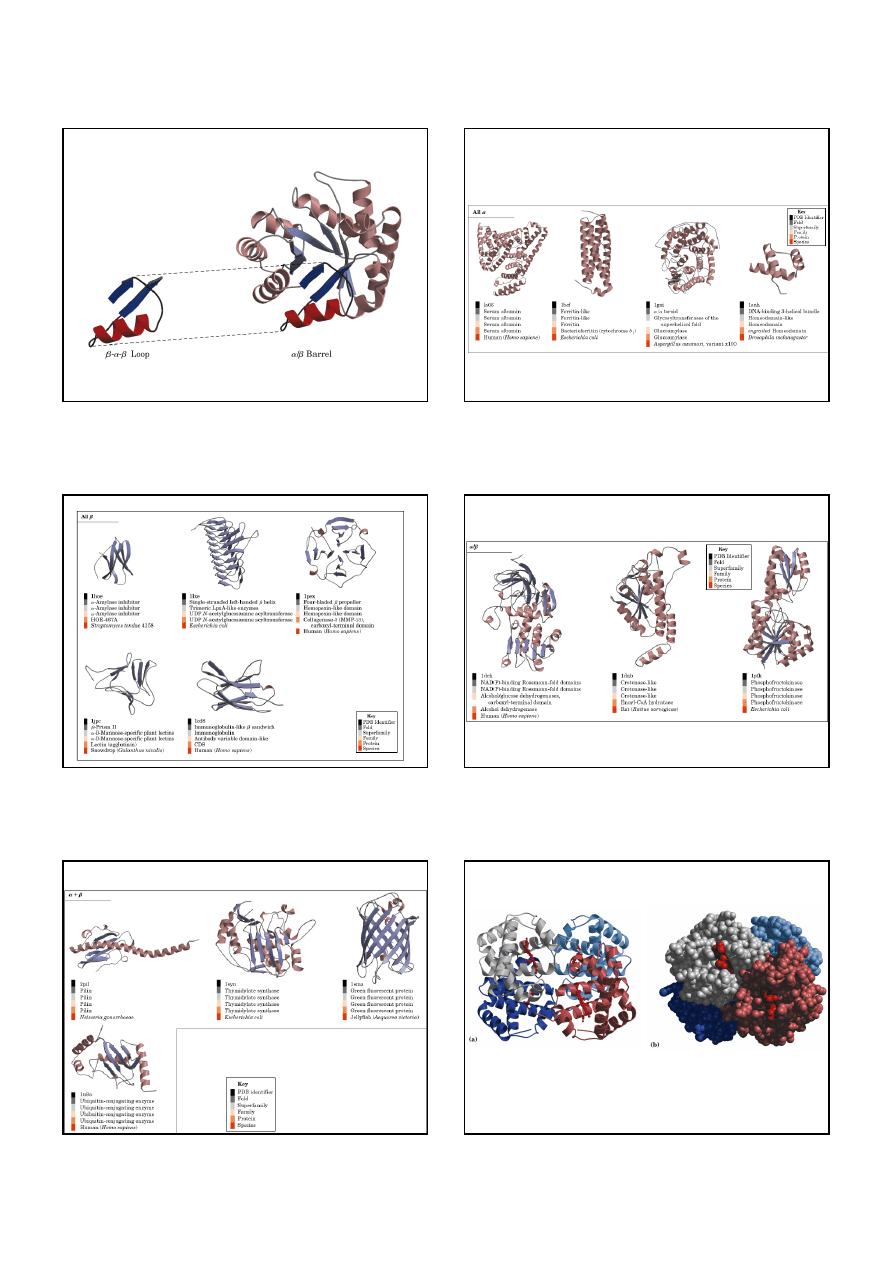
18
Duże motywy strukturalne powstają z małych motywów
Struktury wyłącznie
α
αα
α
Struktury wyłącznie
ββββ
Struktury
α
αα
α
/
ββββ
(
α
αα
α
i
ββββ
są wymieszane)
Struktury
α
αα
α
+
ββββ
(
α
αα
α
i
ββββ
są rozdzielone)
Struktura czwartorzędowa:
opisuje, z ilu podjednostek składa się białko
Deoksyhemoglobina (cztery podjednostki)
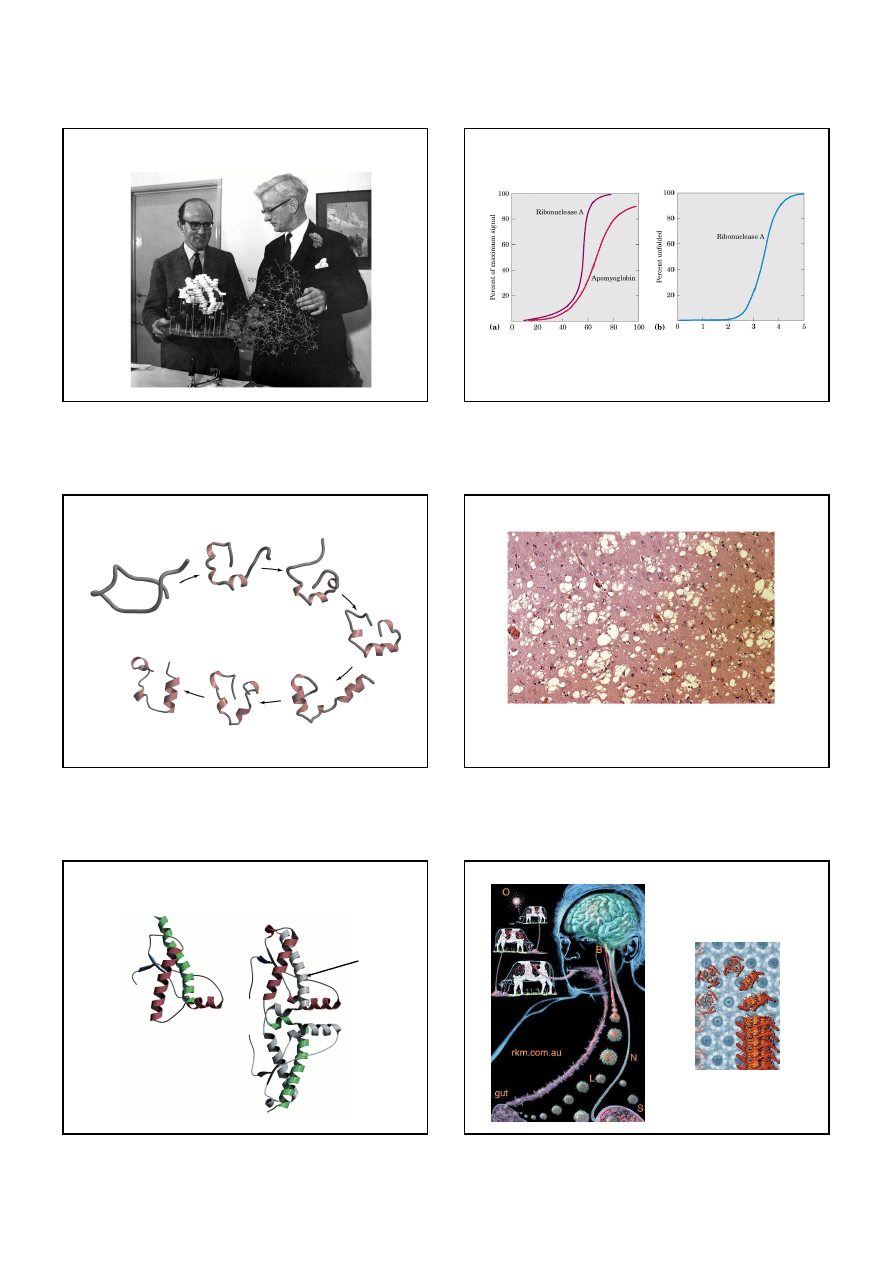
19
Max Perutz i John Kendrew określili strukturę hemoglobiny w roku 1959
Denaturacja białek
temperatura [°C] chlorowodorek guanidyny [M]
Symulacja fałdowania białka
Priony - białka, które mogą powodować nieprawidłowe fałdowanie
innych białek
Wycinek mózgu pacjenta zmarłego na chorobę Creutzfelda-Jakoba
(gąbczaste zwyrodnienie mózgu)
Białko PrP
C
: normalny składnik mózgu
Białko PrP
Sc
: zmieniona konformacja, przyczyna choroby
PrP
C
dimer PrP
Sc
druga podjednostka
zmiana konformacji:
Priony
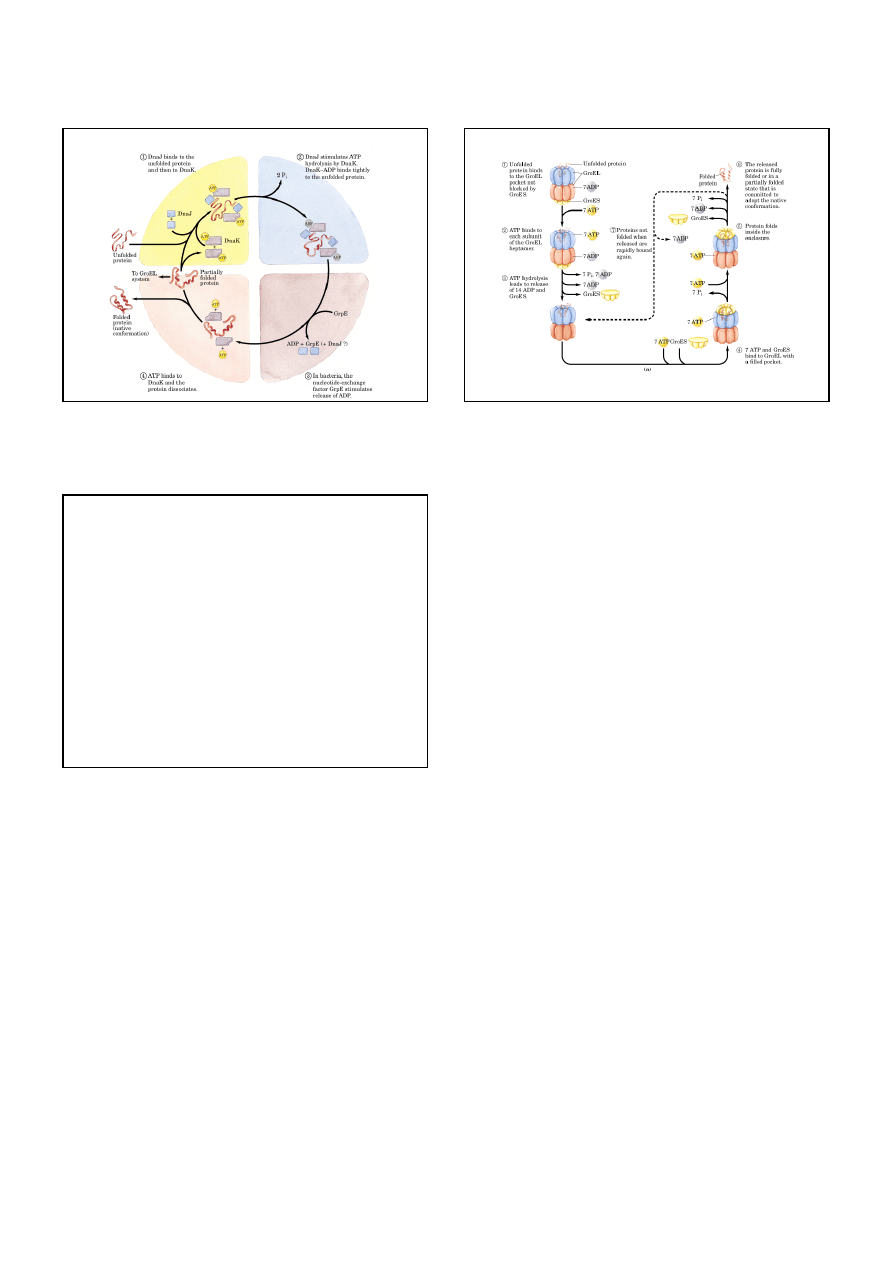
20
Białka opiekuńcze (szaperony) nadzorują prawidłowe fałdowanie
Rola białek opiekuńczych w fałdowaniu białek
03. Biochemia - białka
Tematy do zapamiętania
1. Aminokwasy: struktura i funkcja.
2. Aminokwasy: alifatyczne, polarne, zasadowe, kwaśne.
3. Wiązanie peptydowe.
4. Białka: struktura pierwszo-, drugo-, trzecio- i czwartorzędowa.
5. Chomatografia i elektroforeza.
6. Drugorzędowa struktura białek: helisa
α
αα
α
i harmonijka
ββββ
.
7. Keratyna: struktura i funkcja.
8. Kolagen: struktura i funkcja.
9. Rola witaminy C.
Wyszukiwarka
Podobne podstrony:
03a Biochemia bialka
04 Biochemia bialka funkcja
biochemia bialka
Białka NOTATKI Z WYKŁADÓW, Biochemia, Biochemia, Białka aminokwasy DNA
Biochemia białka
biochemia BIALKA SPRAWKO1, POLITECHNIKA ŁÓDZKA, BIOCHEMIA
Biochemia białka
03a Biochemia bialka
biochemia białka
biochemia białka do sprawozdania (1)
biochemia bialka(1)
biochemia białka
biochemia białka 2
Wyklad 03 Białka3
więcej podobnych podstron