
Białka
Agnieszka Kwiatkowska
Pielęgniarstwo
I rok, III grupa

Białka zbudowane są z aminokwasów połączonych
w łańcuch wiązaniami peptydowymi. Bardzo ważną
własnością tych wiązań jest to, że cząsteczki nimi
powiązane mają dużą możliwość rotacji wokół nich.
Pomimo, że w białkach wytępuje powszechnie
jedynie 20 aminokwasów to jednak różnorodność
tworzonych przez nie struktur białkowych jest
praktycznie nieograniczona. Wynika to między
innymi z faktu, że poszczególne aminokwasy silnie
różnią się właściwościami. I tak występują
aminokwasy posiadające ładunek elektryczny oraz
elektrycznie obojętne; hydrofilowe i hydrofobowe;
posiadające zdolność do tworzenia wiązań
wodorowych i mostków siarczkowych oraz nie
posiadające tych zdolności.

Oprócz tej różnorodności składników różna
może być też długość łańcucha białkowego:
może on zawierać od kilkudziesięciu do
kilkuset aminokwasów. Wszystkie powyższe
czynniki sprawiają, że na podstawie
znajomości wyłącznie sekwencji
aminokwasowej (struktury
pierwszorzędowej) bardzo trudno jest
określić dokładnie jaka jest struktura
przestrzenna całej molekuły danego białka.
Znajomość sekwencji aminokwasowej
pozwala jednak na przewidywanie struktur
tworzonych przez niektóre fragmenty białek.
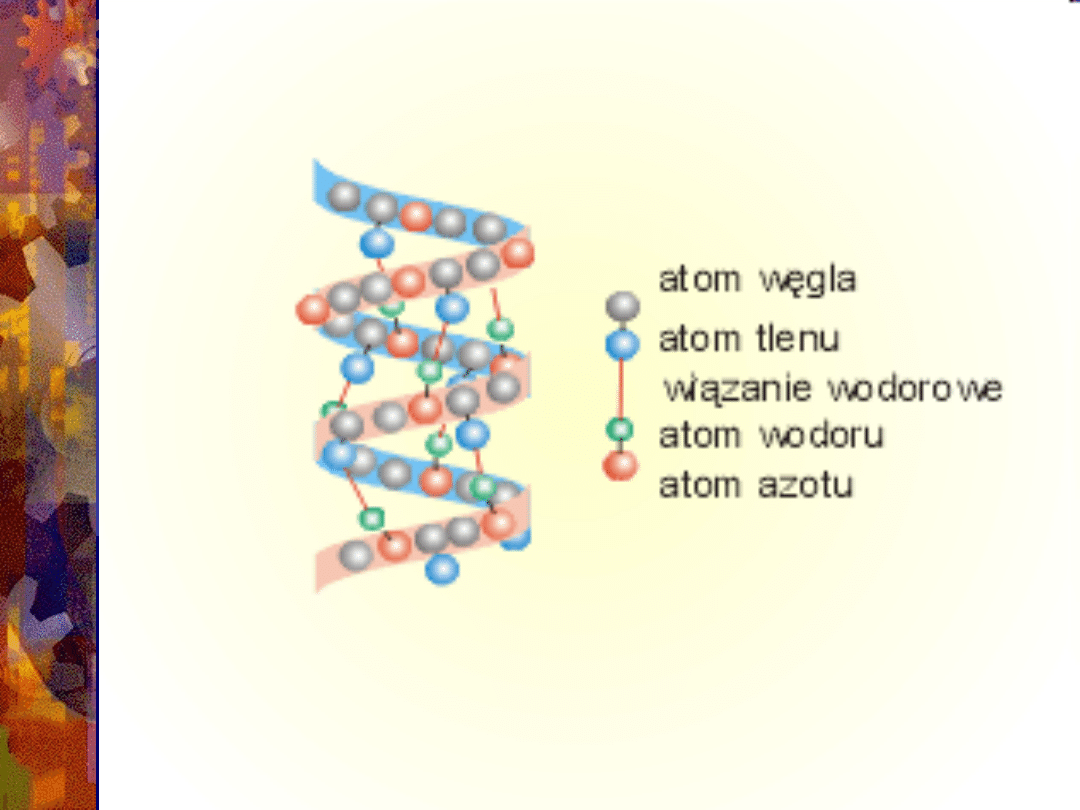

Łańcuchy polipeptydowe
przyjmują dwie regularne
struktury:
helisę alfa
harmonijkę beta.
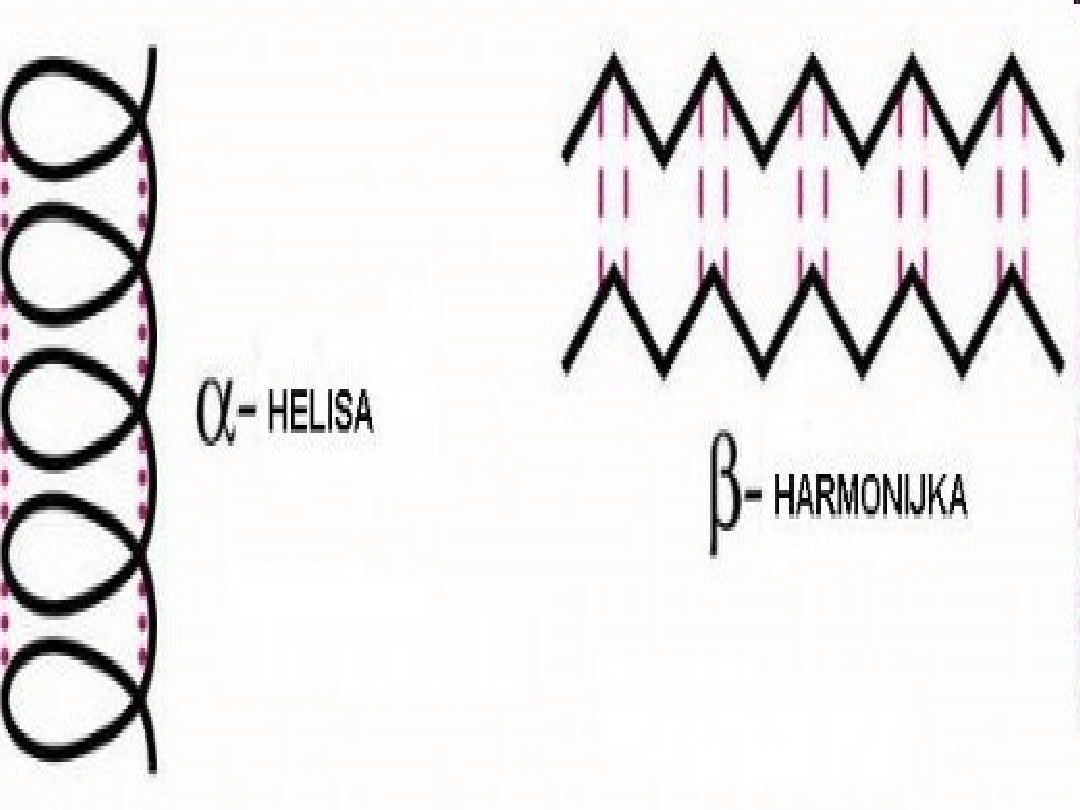

Harmonijka alfa:
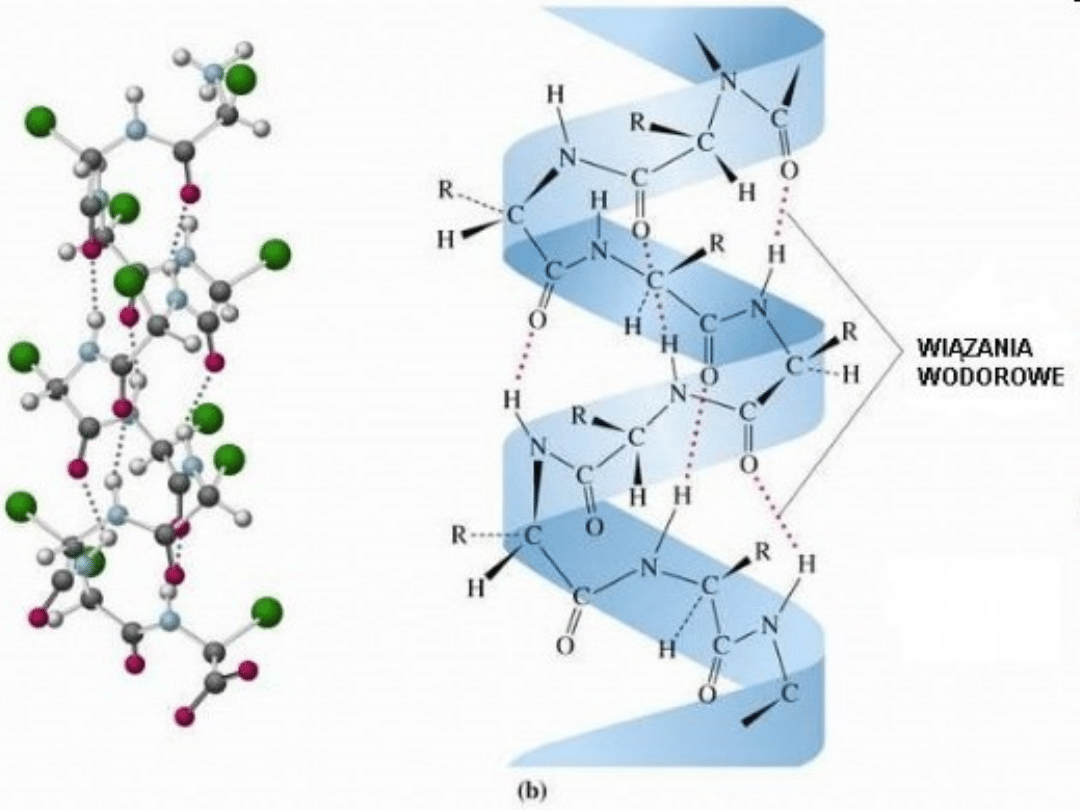

Helisa alfa ma kształt cylindra. Ciasno
skręcony łańcuch główny polipeptydu tworzy
wewnętrzną część cylindra, a łańcuchy
boczne aminokwasów wystają na zewnątrz w
ułożeniu helikalnym (śrubowym). Helisę
stabilizują wiązania wodorowe między
grupami NH i CO głównego łańcucha. Grupa
CO każdego aminokwasu wiąże się
wiązaniem wodorowym z grupą NH
aminokwasu, zajmującego w sekwencji
liniowej pozycję wysuniętą do przodu o
cztery reszty aminokwasowe.
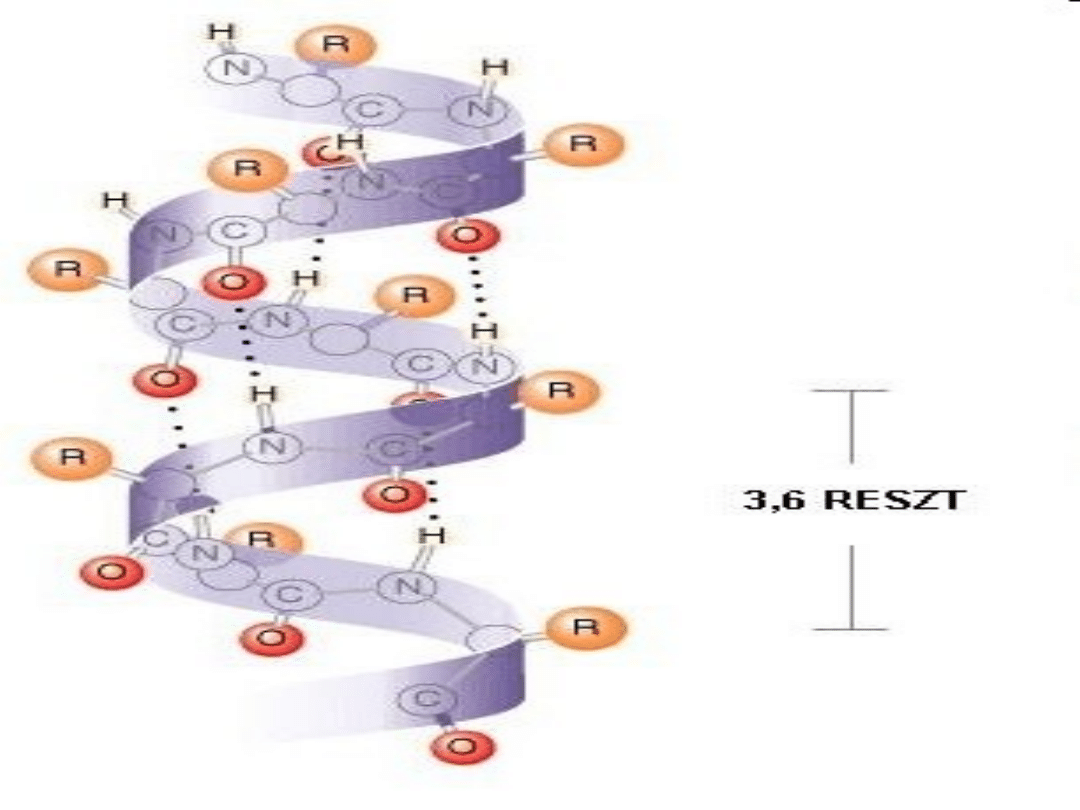

Każda reszta aminokwasowa jest
przesunięta w stosunku do sąsiedniej
o 0,15 nm wzdłuż osi helisy i
obrócona o kąt 100 stopni wokół osi.
Na jeden obrót helisy przypada więc
3,6 reszt aminokwasowych. Podobnie
jak każda śruba, helisa może być
prawoskrętna lub lewoskrętna;
występująca w białkach helisa alfa
jest prawoskrętna.

Zdarza się, że dwie lub więcej wydłużonych
helis alfa splata się wokół siebie, tworząc
bardzo stabilne helisy wyższego rzędu. Takie
helikalnie zwinięte helisy spotyka się w
miozynie i tropomiozynie mięśni, fibrynie
skrzepu krwi i w keratynie włosów. Helisy
wyższego rzędu pełnią w tych białkach rolę
mechaniczną, tworząc sztywne pęczki
włókien białkowych, jak w kolcach
jeżozwierza. Cytoszkielet jest bogaty w
filamenty pośrednie, które są również
zbudowane z dwuniciowych, helikalnie
zwiniętych helis alfa.


Harmonijka beta:
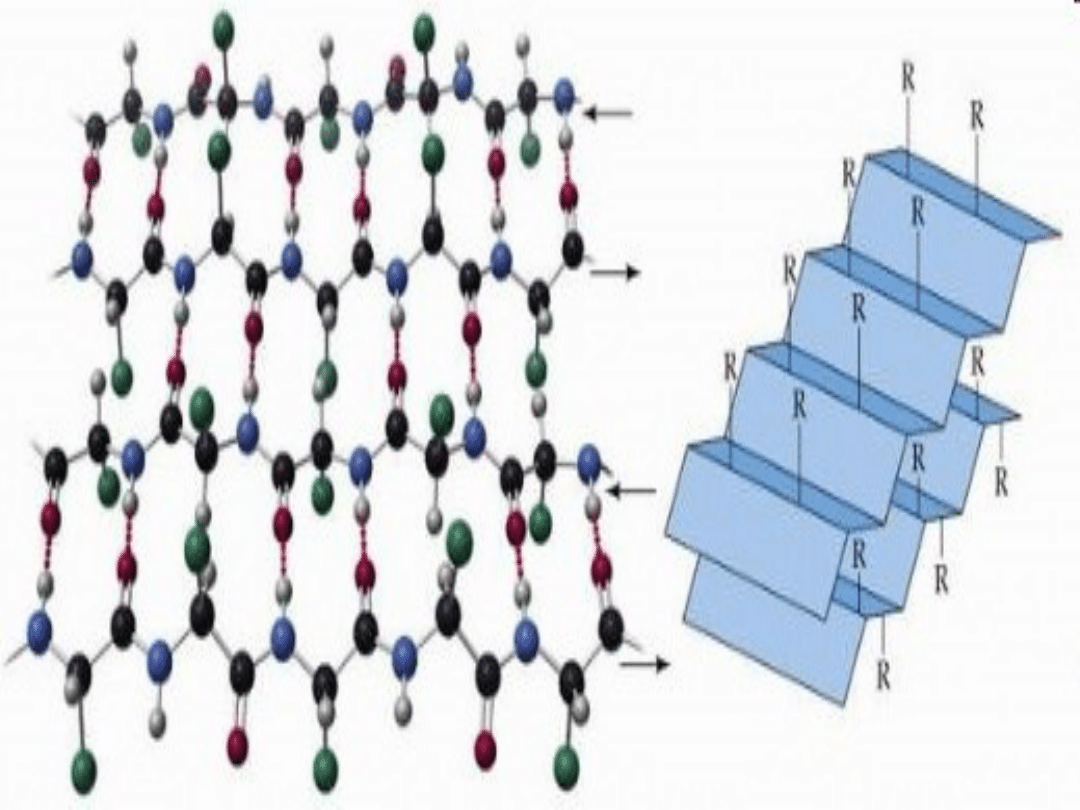

Harmonijka beta. W harmonijce tej
łańcuch polipeptydowy, zwany też nicią
beta, jest całkowicie rozciągnięty, w
odróżnieniu od ciasno upakowanej
helisy alfa. Odległość sąsiednich
aminokwasów wzdłuż osi długiej
cząsteczki wynosi 0,35 nm, podczas gdy
w helisie alfa- 0,15 nm. Różnica dotyczy
także wiązań wodorowych
stabilizujących strukturę przestrzenną.

Harmonijkę beta stabilizują wiązania
wodorowe pomiędzy grupami CO i NH,
należącymi do odrębnych łańcuchów
polipeptydowych, natomiast w helisie alfa
wiążą się wodorowo grupy CO i NH
aminokwasów należących do tego samego
łańcucha. Sąsiadujące ze sobą łańcuchy
harmonijki mogą być ułożone w jednym
kierunku (równolegle) lub w kierunkach
przeciwnych (antyrównolegle). Fibroina
jedwabiu na przykład jest zbudowana prawie
wyłącznie z antyrównoległych harmonijek
beta. Odcinki struktury beta są często
powtarzającym się motywem w białkach.

PODZIAŁ BIAŁEK :

Białka dzieli się na:
1. Proste, które nie zawierają
składnika niebiałkowego.
2. Złożone, zbudowane są z
białka i substancji
niebiałkowej.

Do białek prostych zalicza się:

1. białka włókniste czyli:
- keratyny- wyst. we włosach,
skórze,kopytach, rogach
- kalogeny- stanowią 80 % tkanki łącznej
- elastyny- wyst. w chrząstkach ,
wiązadłach
2. białka globularne czyli :
- albuminy- wyst. we krwi , jajach,
mięśniach
- globuliny- wyst. we krwi ,mleku
- prolaminy- białka zapasowe nasion roslin
- gluteliny- wyst. w nasionach

Do białek złożonych
zaliczamy:

1. Fosfoproteiny- wyst. w mleku,
żółtkach jaj
2. Lipoproteiny- wyst. w błonach
komórek
3. Mataloproteiny- wyst. we krwi
4. Hemoproteiny- wyst. we krwi , w
mięśniach
5. Glikoproteiny- wyst. we wszytkich
komórkach
6. Nukloproteiny- w jądrach
komórkowych

Dziękuję za uwagę.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
03a Biochemia bialka
04 Biochemia bialka funkcja
biochemia bialka
Białka NOTATKI Z WYKŁADÓW, Biochemia, Biochemia, Białka aminokwasy DNA
Biochemia białka
biochemia BIALKA SPRAWKO1, POLITECHNIKA ŁÓDZKA, BIOCHEMIA
03 Biochemia bialka
03a Biochemia bialka
biochemia białka
biochemia białka do sprawozdania (1)
biochemia bialka(1)
biochemia białka
biochemia białka 2
Bialka sprawko, Biochemia
Repetytorium Białka, Prywatne, biochemia, biochemia 1, biochemia, biochemia
więcej podobnych podstron