
Białka- struktura, poziomy organizacji,
denaturacja i
wysalanie
Ewa Adamska, Katarzyna Celmer, Joanna Bluma/ Pielęgniarstwo I
rok / Grupa I

Białka
• Składają się z azotu, węgla, wodoru,
tlenu i siarki,
• Podstawowe struktury tworzące to
aminokwasy połączone wiązaniem
peptydowym.
• Postać włókienkowa lub globularna,

• Jednostka budulcową białek są aminokwasy..
• Makrocząsteczki
• Struktura przestrzenna- przypadkowo
• złożony w przestrzeni łańcuch jest
• pozbawiony aktywności biologicznej
20
%
Stanowią 20% masy
ciała człowieka

Odgrywają zasadniczą rolę we wszystkich
procesach biologicznych.
- Katalizowanie wielu przemian w układach
biologicznych (enzymy, które też są
białkami)
- Uczestniczenie w transporcie wielu
małych cząsteczek i jonów( hemoglobina
przenosząca tlen)
- Ochrona immunologiczna (przeciwciała)
- Branie udziału w przekazywaniu
impulsów nerwowych (białka
receptorowe)
- Funkcja mechaniczno-strukturalna
związana z budową i funkcjonowaniem
mięśni, skóry i włosów.

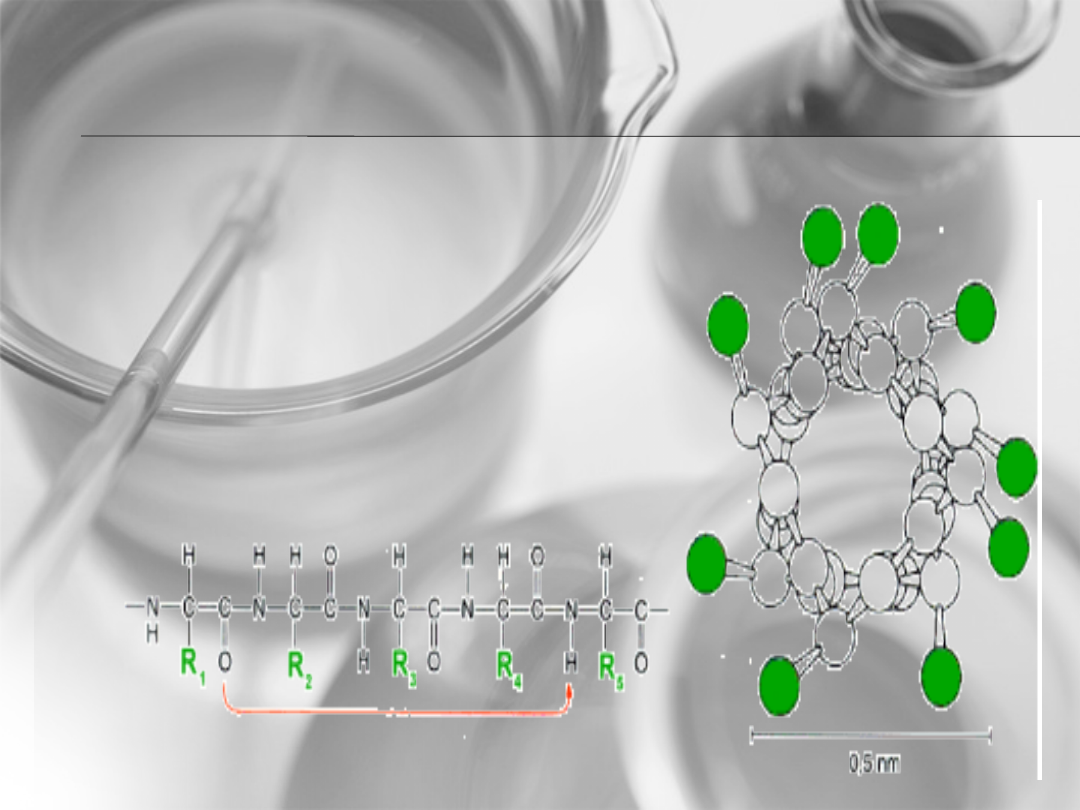
Struktura
pierwszorzędowa
Zwana również strukturą pierwotną
Liczba, kolejność i rodzaj aminokwasów w cząsteczce białka jest
uwarunkowana genetycznie i nosi nazwę struktury pierwszorzędowej

Struktura
drugorzędowa
• Odkryto dwa podstawowe, regularne
układy drugorzędowe. Są nimi :
a – helisa
β - harmonijka
Sposób i stopień skręcenia lub pofałdowania łańcucha
peptydowego
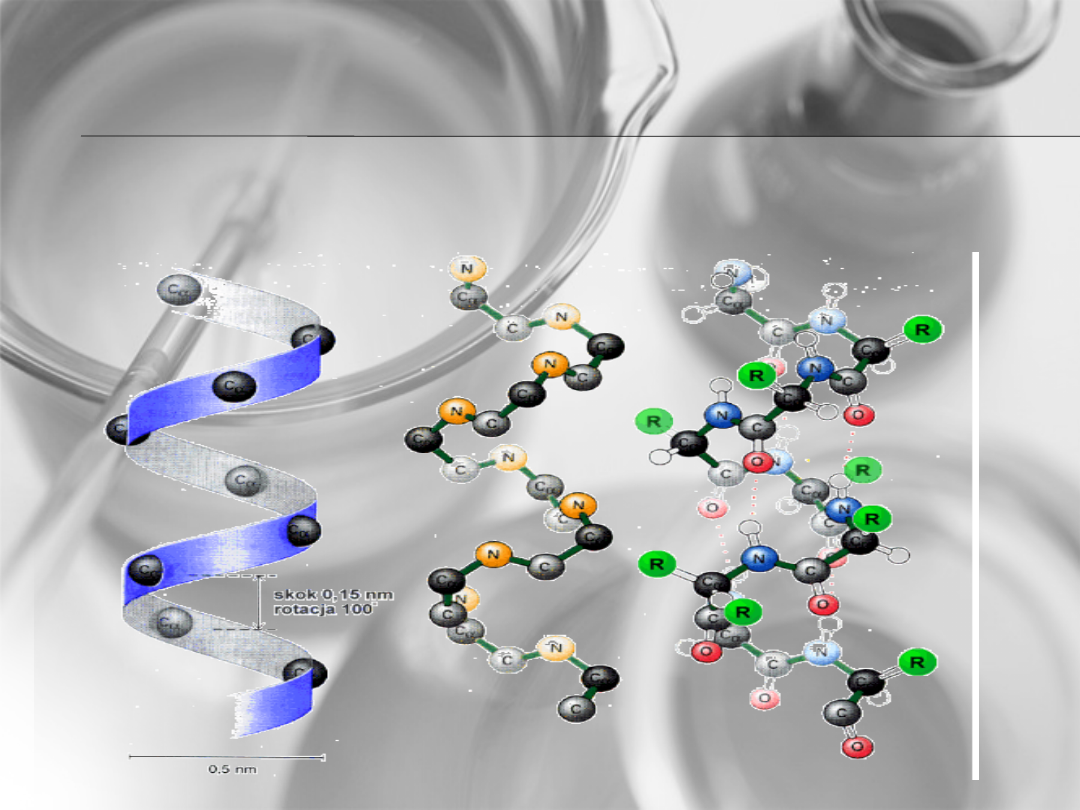
Struktura
drugorzędowa
Struktura a –helisy
Struktura
drugorzędowa
Wiązanie wodorowe w strukturze a –helisy
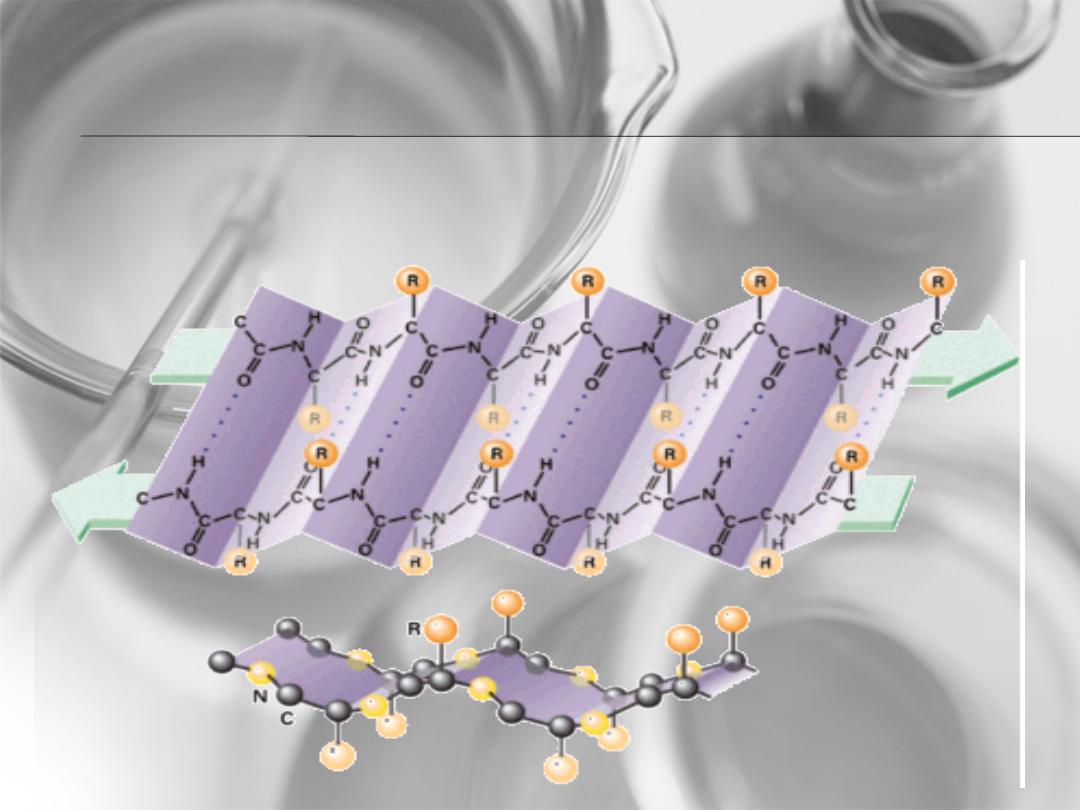
Struktura
drugorzędowa
Struktura β –harmonijki
Struktura
drugorzędowa
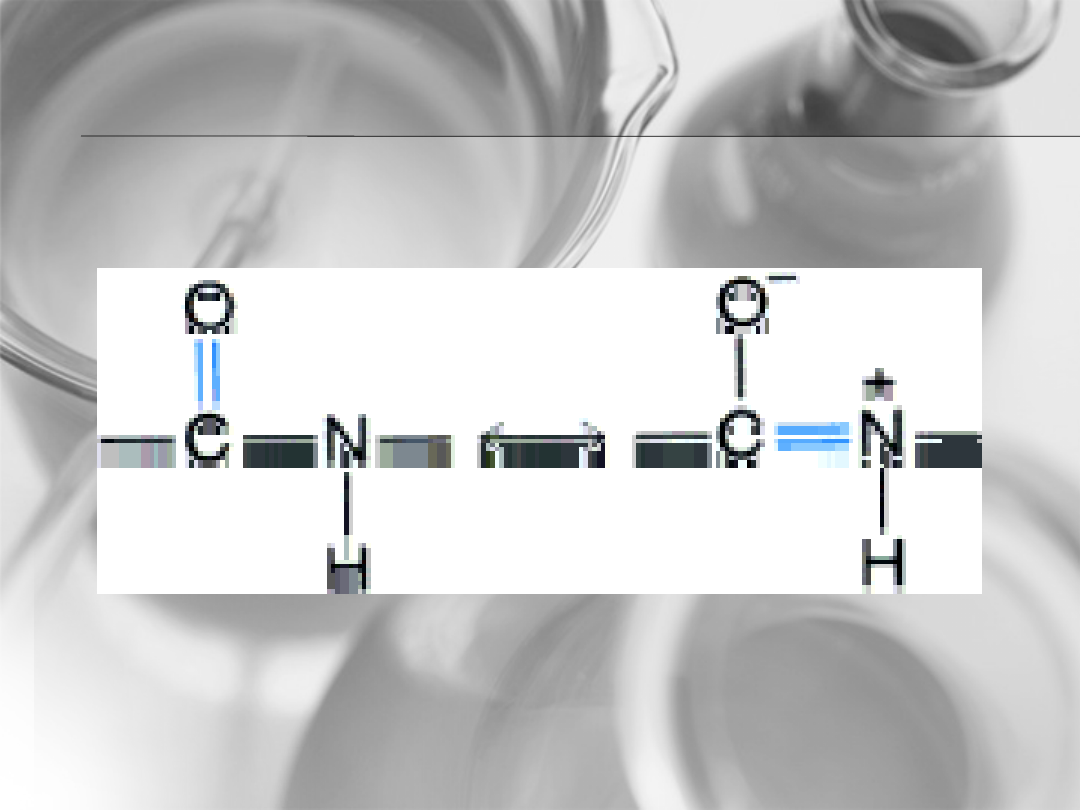
• Wiązania peptydowe

• Wiązania wodorowe stabilizujące
strukturę harmonijkową łączą ze sobą
różne łańcuchy białkowe, a nie- jak w
strukturze helisy- jeden łańcuch.
• Jeśli można określić czy białko tworzy
strukturę α czy β lub jak ułożony jest w
przestrzeni łańcuch polipeptydowy, to
możemy określić strukturę drugorzędową
białka.
• Struktura drugo- i trzeciorzędowa są
„usztywnione” przez pojawiające się
czasem mostki siarczkowe, wytwarzane
przez reszty cząsteczek cysteiny,
należącej do łańcucha białkowego.

Struktura
trzeciorzędowa
Związana z kształtem cząsteczki
białka
Ułożenie przestrzenne helisy α lub β
Białka globularne
Określana przez strukturę
pierwszorzędową
Pofałdowanie i zwinięcie spirali
białkowej w przestrzennie
zwarty układ.

Struktura
czwartorzędowa
Określana stopniem asocjacji i
polimeryzacji cząsteczek białkowych
w większe agregaty,
Utrwalona przez wiązania
disiarczkowe i chelatowe.
Przykład: hemoglobina

nie posiadają charakterystycznej dla
siebie temperatury topnienia
są na ogół rozpuszczalne w wodzie.
posiadają zdolność wiązania cząsteczek
wody. Efekt ten nazywamy hydratacją
ze względu na obecność zasadowych
grup NH2 oraz kwasowych COOH mają
charakter obojnaczy
odgrywają zasadniczą rolę we wszystkich
procesach biologicznych
Właściwości

• Białka proste zbudowane są
wyłącznie z aminokwasów:
- protaminy
- histony
- albuminy
- globuliny
- prolaminy
- gluteliny
- skleroproteiny
•Białka złożone:
- chromoproteiny
- nukleoproteiny
- lipidoproteiny
- glikoproteiny
- metaloproteiny
Podział białek

zmiany struktury cząsteczki białkowej
spowodowane zniszczeniem wiązań
stabilizujących struktury II-, III- i IV-rzędowe
białka. Białka o tak zmienionej strukturze są
zwykle trudniej rozpuszczalne w wodzie i
dlatego najczęściej białko zdenaturowane
wytrąca się z roztworu. Proces denaturacji białka
jest praktycznie nieodwracalny.
D e n a t u r a c j ę b i a ł k a s p o w o d o w a ć
m o g ą :
• podwyższona temperatura
• promieniowanie rentgenowskie i jonizujące
• sole metali ciężkich
• silne kwasy i zasady
• rozpuszczalniki organiczne
Denaturacja
białek

strącanie białek z roztworów poprzez
dodanie stężonego roztworu soli.
Proces jest wynikiem zaburzenia
otoczki solwatacyjnej i agregacji
cząsteczek białek w wyniku
łatwiejszego kontaktu pomiędzy
polarnymi grupami sąsiadujących
cząsteczek. Do wysalania stosuje się
sole metalu lekkiego (oprócz KCl) lub
amonu, np. siarczanu amonu. Proces
ten jest przejściem zolu w żel
(koagulacja), nie narusza struktury
białka (także czwarto- i
trzeciorzędowej) i jest odwracalny (nie
powoduje denaturacji)
Wysalanie
białka

DZIĘKUJEMY
ZA UWAGĘ
Document Outline
- Slide 1
- Białka
- Slide 3
- Slide 4
- Struktura pierwszorzędowa
- Struktura drugorzędowa
- Struktura drugorzędowa
- Struktura drugorzędowa
- Struktura drugorzędowa
- Struktura drugorzędowa
- Slide 11
- Struktura trzeciorzędowa
- Struktura czwartorzędowa
- Slide 14
- Podział białek
- Slide 16
- Slide 17
- Dziękujemy za uwagę
Wyszukiwarka
Podobne podstrony:
03a Biochemia bialka
04 Biochemia bialka funkcja
biochemia bialka
Białka NOTATKI Z WYKŁADÓW, Biochemia, Biochemia, Białka aminokwasy DNA
Biochemia białka
biochemia BIALKA SPRAWKO1, POLITECHNIKA ŁÓDZKA, BIOCHEMIA
Biochemia białka
03 Biochemia bialka
03a Biochemia bialka
biochemia białka
biochemia białka do sprawozdania (1)
biochemia bialka(1)
biochemia białka 2
Bialka sprawko, Biochemia
Repetytorium Białka, Prywatne, biochemia, biochemia 1, biochemia, biochemia
więcej podobnych podstron