1
4. Biochemia - funkcje białek
Odwracalne wiązanie ligandów przez białko:
białka wiążące tlen
Hemoglobina: białko przenoszące tlen
Hem: grupa prostetyczna wiążąca tlen
grupa prostetyczna: związek stale związany z białkiem,
który ma wpływ na funkcje białka
pierścień protoporfiryny IX
Hemoglobina jest tetramerem
Jon Fe
2+
w cząsteczce hemu wiąże cząsteczkę O
2
widok z boku
histydyna
(His97)
CO jest wiązany przez hem z powinowactwem większym, niż O
2
Struktura mioglobiny
reszty His:
His E7 (His64)
His F8 (His97)
CO jest wiązany przez hem
z powinowactwem większym, niż O
2
Cząsteczka O
2
jest wiązana pod kątem ok. 45°
Cząsteczka CO jest wiązana prostopadle
2
His E7 (His64) stabiluzuje cząsteczkę O
2
za pośrednictewm wiązania wodorowego
Hemoglobina jest podobna do mioglobiny
Hemoglobina składa się z 2 podjednostek
α
αα
α
i 2 podjednostek
ββββ
mioglobina
podjednostka
ββββ
hemoglobiny
Homologia sekwencji mioglobiny wieloryba oraz podjednostek
α
αα
α
i
ββββ
ludzkiej hemoglobiny
Duplikacja genów jest siłą sprawczą ewolucji.
Zduplikowane geny mogą zmienić funkcję lub zamilknąć.
Geny kodujące globinę są zorganizowane w grupach
Globina: białkowa część hemoglobiny. Tetramer.
Dorosły:
α
αα
α
2
δδδδ
2
,
α
αα
α
2
ββββ
2
Płód (3-9 miesięcy):
α
αα
α
2
γγγγ
2
Embrion (<8 tygodni):
ζζζζ
2
εεεε
2
,
ζζζζ
2
γγγγ
2
,
α
αα
α
2
εεεε
2
Formy płodowe mają wyższe powinowactwo wobec tlenu.
Ekspresja genów hemoglobiny zmienia się w czasie rozwoju człowieka

3
Wszystkie geny kodujące globiny powstały w wyniku duplikacji
i mutacji w „pragenie”, który miał 3 eksony.
Grupy (klastery)
α
αα
α
i
ββββ
zostały rozdzielone we wczesnym okresie
ewolucji kręgowców, następne geny powstały w wyniku duplikacji.
Geny kodujące globinę
zduplikowały się
i uległy dywergencji
(zróżnicowaniu)
Talasemie powstały w wyniku delecji w genach
α
αα
α
lub
ββββ
Talasemia (niedokrwistość śródziemnomorska),
spowodowana zaburzeniem stosunku liczby
jednostek hemoglobiny
α
αα
α
i
ββββ
. Brak genów
α
αα
α
objawia się w postaci oprzęku płodu.
Podjednostkowa budowa hemoglobiny
główne miejsca oddziaływania między podjednostkami
Hemoglobina zmienia konformację w wyniku związania tlenu
T (tense): deoksyhemoglobina R (relaxed): oksyhemoglobina
Zmiana konformacji T
→
→
→
→
R jest spowodowana
przez zmiany kluczowych aminokwasów w sąsiedztwie hemu
cząsteczka hemu:
wygięta
płaska
4
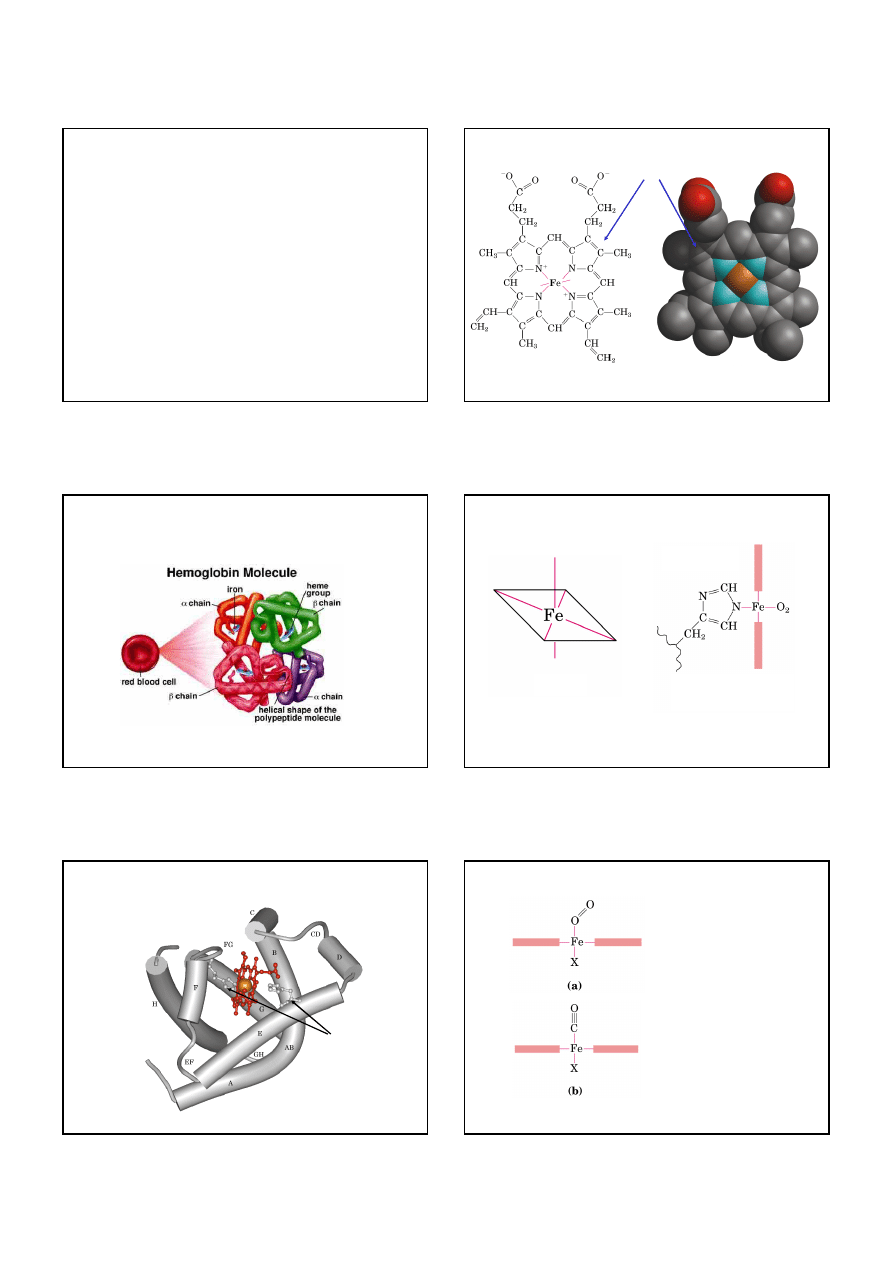
Wiązanie liganda:
Θ
Θ
Θ
Θ
: ułamek miejsc wiążących zajetych przez ligand
Θ
Θ
Θ
Θ
=
ilość zajętych miejsc wiążących
całkowita ilość miejsc wiążących
P + L = PL
K
a
=
[PL]
[P][L]
K
a
: stała asocjacji
=
[PL]
[PL] + [P]
Θ
Θ
Θ
Θ
=
K
a
[L][P]
K
a
[L][P] + [P]
=
K
a
[L]
K
a
[L] + 1
=
[L]
[L] +
1
K
a
K
d
= 1/K
a
stała dysocjacji
K
d
=
[P][L]
[PL]
Θ
Θ
Θ
Θ
=
[L]
[L] + K
d
Θ
Θ
Θ
Θ
=
[O
2
]
[O
2
] + K
d
Niech: połowa miejsc wiążących jest zajęta. Wtedy
K
d
= [O
2
]
Θ
Θ
Θ
Θ
=
[O
2
]
[O
2
] + [O
2
]
0.5
Θ
Θ
Θ
Θ
=
[O
2
]
[O
2
] +P
50
P
50
: cząstkowe ciśnienie
O
2
potrzebne do 50%
nasycenia hemoglobiny
Stałe asocjacji dla niektórych białek
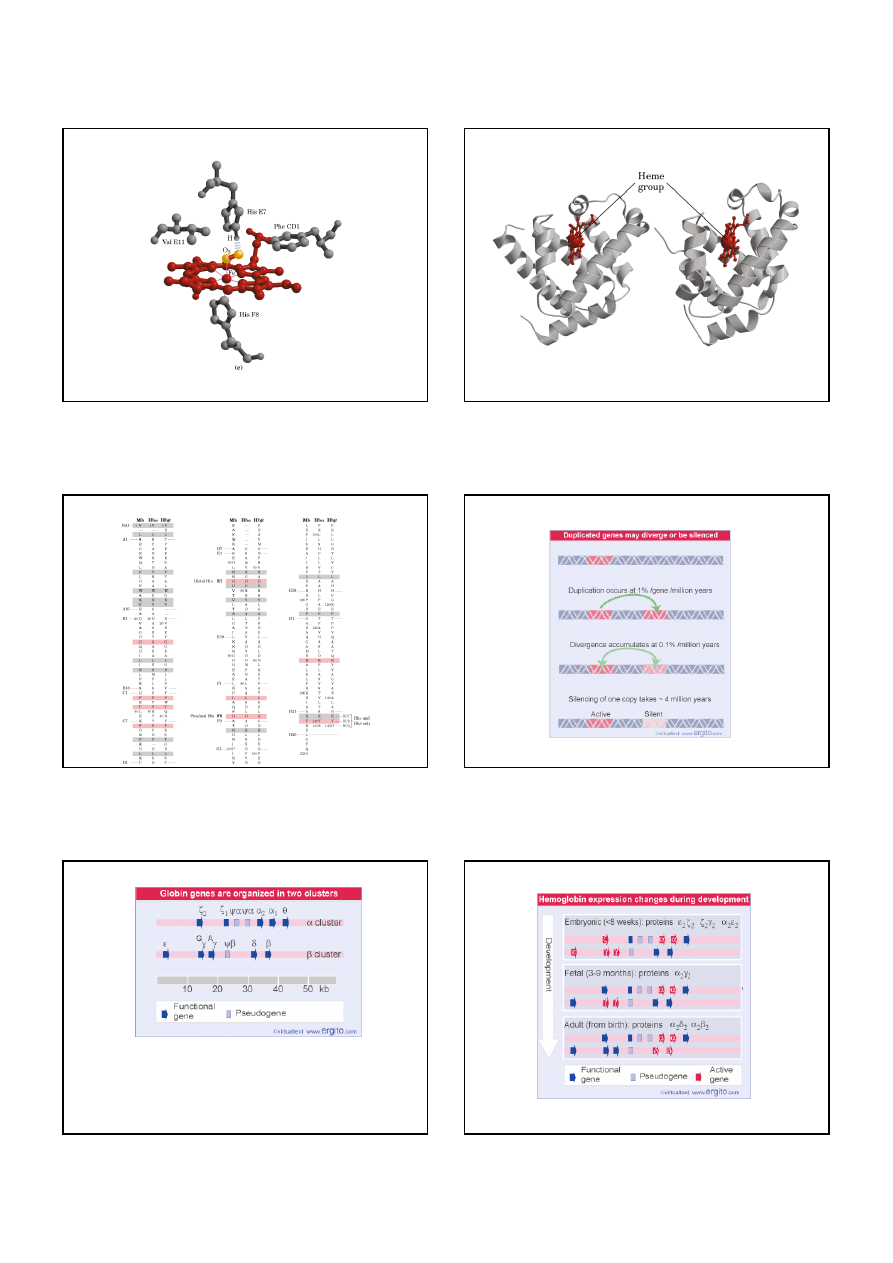
Przejście od stanu T do R powoduje wzrost powinowactwa
niskie
powinowactwo
wysokie
powinowactwo
przejście od niskiego
do wysokiego
powinowactwa
Stan T: związanie O
2
⇒
⇒
⇒
⇒ zmiana konformacji w 1 podjednostce
⇒
⇒
⇒
⇒ ułatwienie wiązania w 2 podjednostce.
Ostatnia (czwarta) cząsteczka O
2
wiąże się do podjednostki w konformacji R.
5
Kooperacyjne wiązanie tlenu w wyniku zmiany konformacji
Zmiany w konformacji białka po związaniu liganda
Zmiany w konformacji białka po związaniu liganda
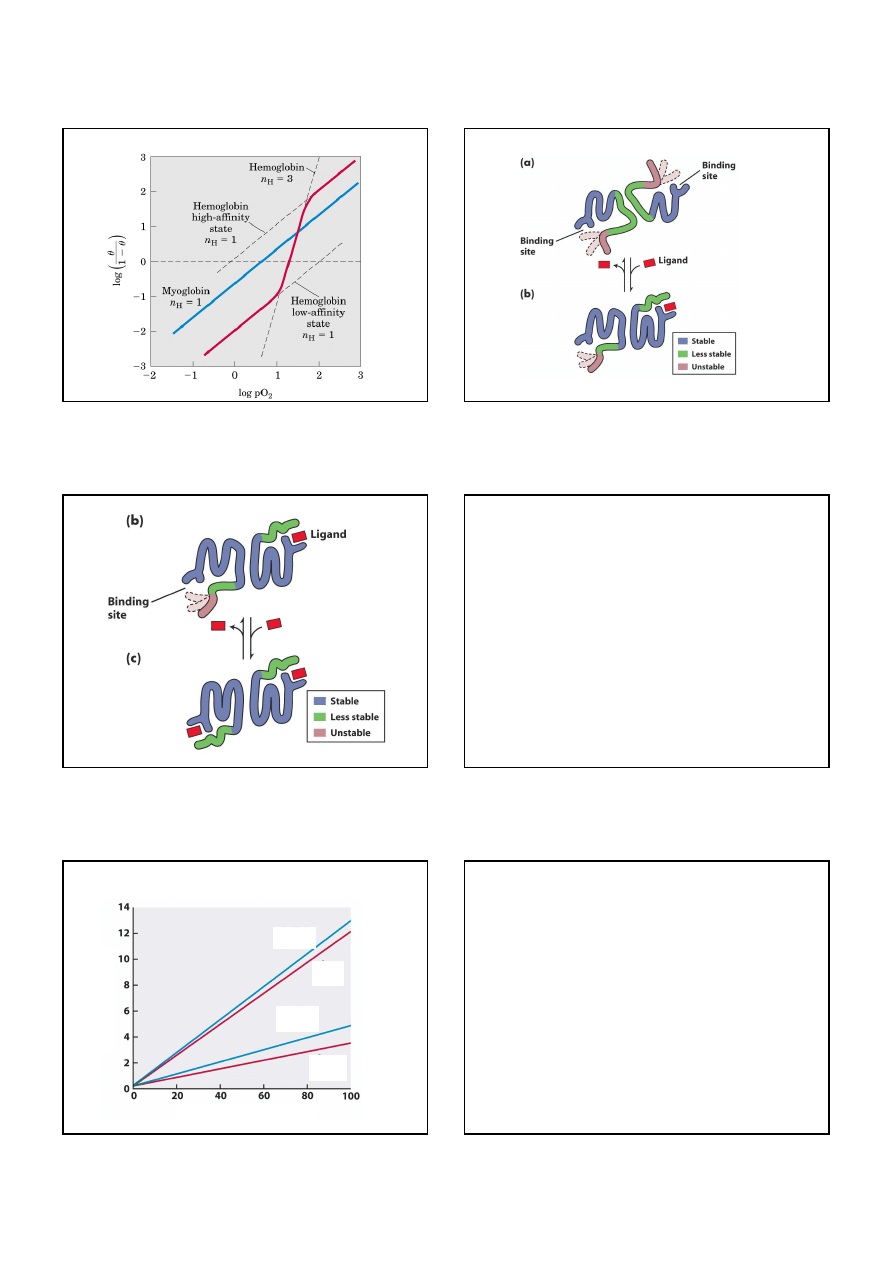
Tlenek węgla (CO): cichy zabójca
CO ma 250 razy większe powinowactwo wobec hemoglobiny niż tlen.
Powoduje połowę zgonów spowodowanych zatruciem.
Stężenie CO w powietrzu wynosi od 1 ppm w bezludnych obszarach
do 4 ppm w dużych miastach.
U zdrowych ludzi, ok. 1% hemoglobiny jest skompleksowane przez CO.
U palaczy, zawartość COHb może wynosić 15%.
<10% COHb: brak objawów
15% COHb: ból głowy
20-30% COHb: silny ból i zawroty głowy, senność, dezorientacja
30-50% COHb: silne objawy neurolgiczne
>50% COHb: utrata przytomności i śpiączka
Hemoglobina płodu ma wyższe powinowactwo wobec CO niż hemoglobina
osoby dorosłej.
Wysiłek fizyczny polepsza wiązanie CO
C
O
H
b
w
e
k
rw
i
(%
)
stężenie CO w powietrzu (ppm)
8 h,
lekki wysiłek
8h,
spoczynek
1 h,
lekki wysiłek
1 h,
spoczynek
Dlaczego utrata 50% hemoglobiny może spowodować śmierć?
CO nie tylko powoduje usunięcie hemoglobiny z obiegu,
ale również wpływa na powinowactwo pozostałych podjednostek
hemoglobiny wobec tlenu.
Związanie CO przez 2 podjednostki hemoglobiny powoduje
podwyższenie powinowactwa wobec tlenu
w 2 pozostałych podjednostkach.
⇓
⇓
⇓
⇓
Tetramer hemoglobiny z 2 związanymi cząsteczkami CO wiąże O
2
silnie w płucach, ale uwalnia niewiele O
2
w tkankach.
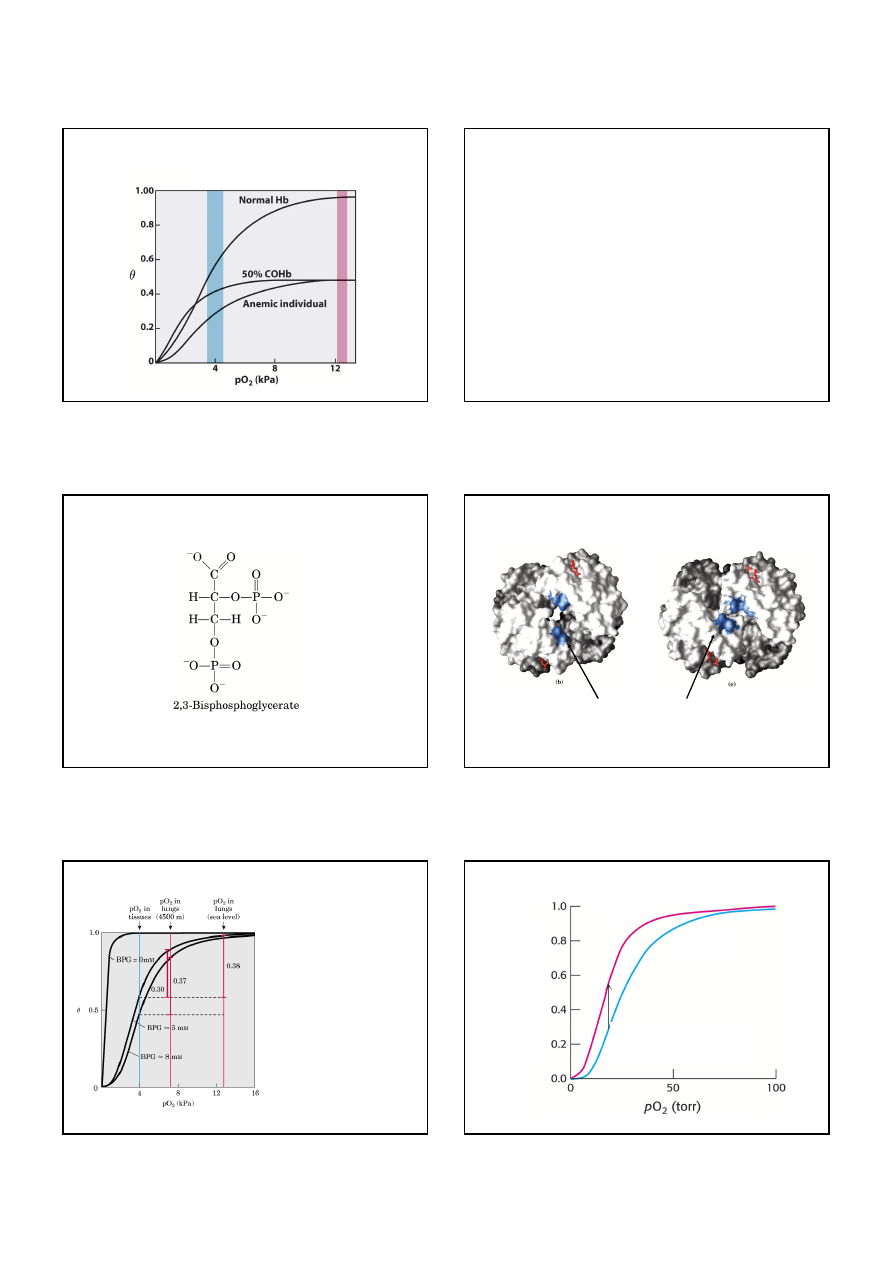
6
Wiązanie O
2
przez normalną hemoglobinę, hemoglobinę
osoby z anemią, i hemoglobinę o 50% nasyceniu CO
pO
2
w tkankach
pO
2
w płucach
Hemoglobina przenosi również H
+
i CO
2
CO
2
+ H
2
O
→
→
→
→
H
+
+ HCO
3
-
Dwutlenek węgla, produkowany w wyniku utleniania organicznego węgla
w mitochondriach, jest uwadniany do hydrowęglanu:
anhydraza
węglanowa
Obniżenie pH (wzrost stężenia jonów H
+
)
wpływa na obniżenie wiązania tlenu.
Tlen wiąże się do jonów Fe
2+
w hemie, a H
+
do
wielu reszt aminokwasowych (m.in. His146).
His146 w postaci uprotonowanej tworzy mostek jonowy z Asp94.
Taka para stabilizuje hemoglobinę w formie T.
Wiązanie tlenu przez hemoglobinę jest regulowane przez
2,3-bifosfoglicerynian (2,3-BPG)
2,3-bifosfoglicerynian zmiejsza powinowactwo
hemoglobiny wobec tlenu:
przykład heterotropowej modulacji allosterycznej
2,3-bifosfoglicerynian (2,3-BPG) stabilizuje formę T hemoglobiny
T R
2,3-BPG wiąże się do dodatnio naładowanych reszt,
stabilizując formę T hemoglobiny, co zmniejsza
powinowactwo wobec tlenu.
BPG wpływa na adaptację przenoszenia tlenu na dużych wysokościach
Poprzez obniżenie powinowactwa
hemoglobiny wobec O
2
,
BPG ułatwia uwalnianie O
2
w tkankach.
Hemoglobina płodowa (
γγγγ
) utraciła część miejsc wiążących BPG,
w wyniku czego jej powinowactwo wobec tlenu jest większe
erytrocyty
płodu
erytrocyty
matki
O
2
przepływa
z oksyhemoglobiny matki
do deoksyhemoglobiny płodu
u
ła
m
e
k
w
ys
yc
e
n
ia
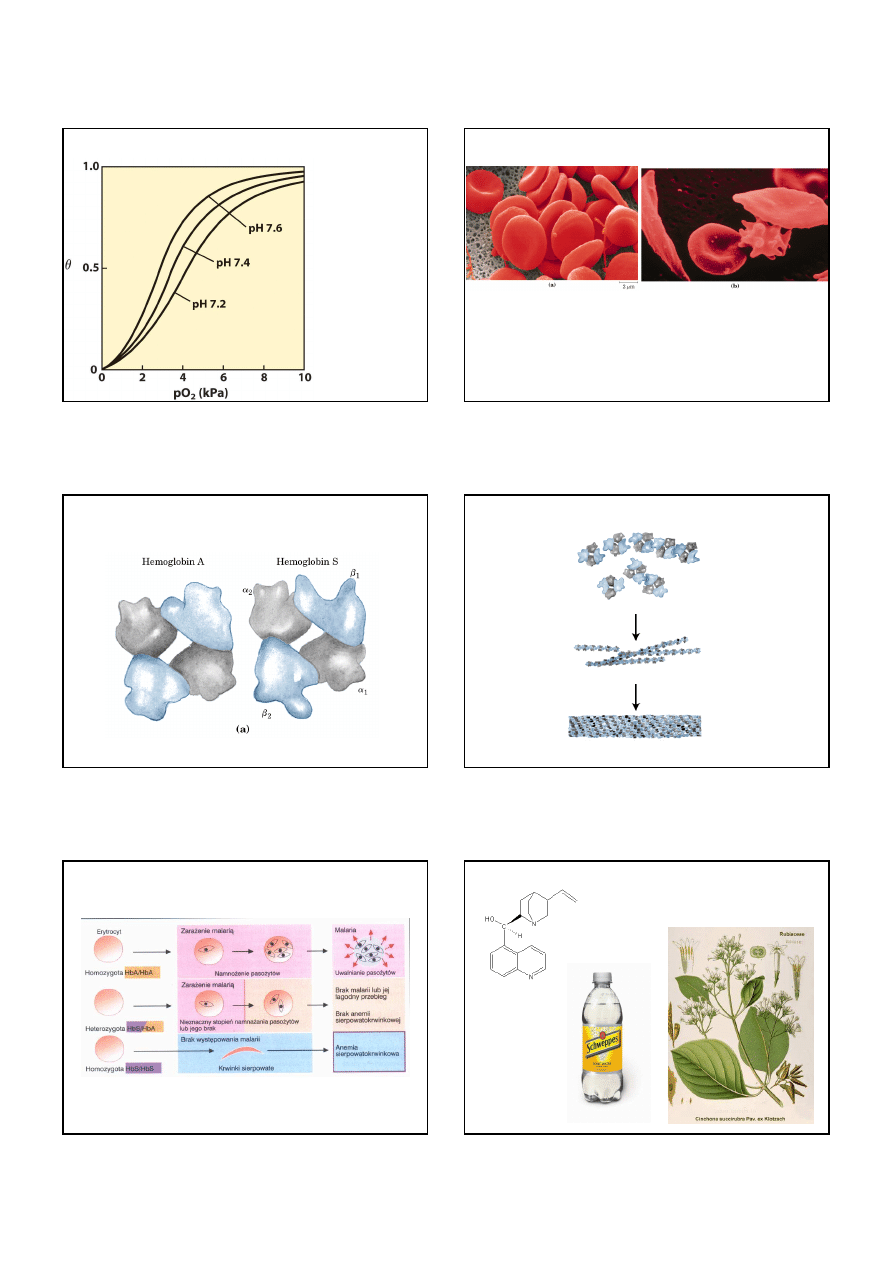
7
Wpływ pH na wiązanie tlenu przez hemoglobinę
pH: 7.6 w płucach
7.2 w tkankach
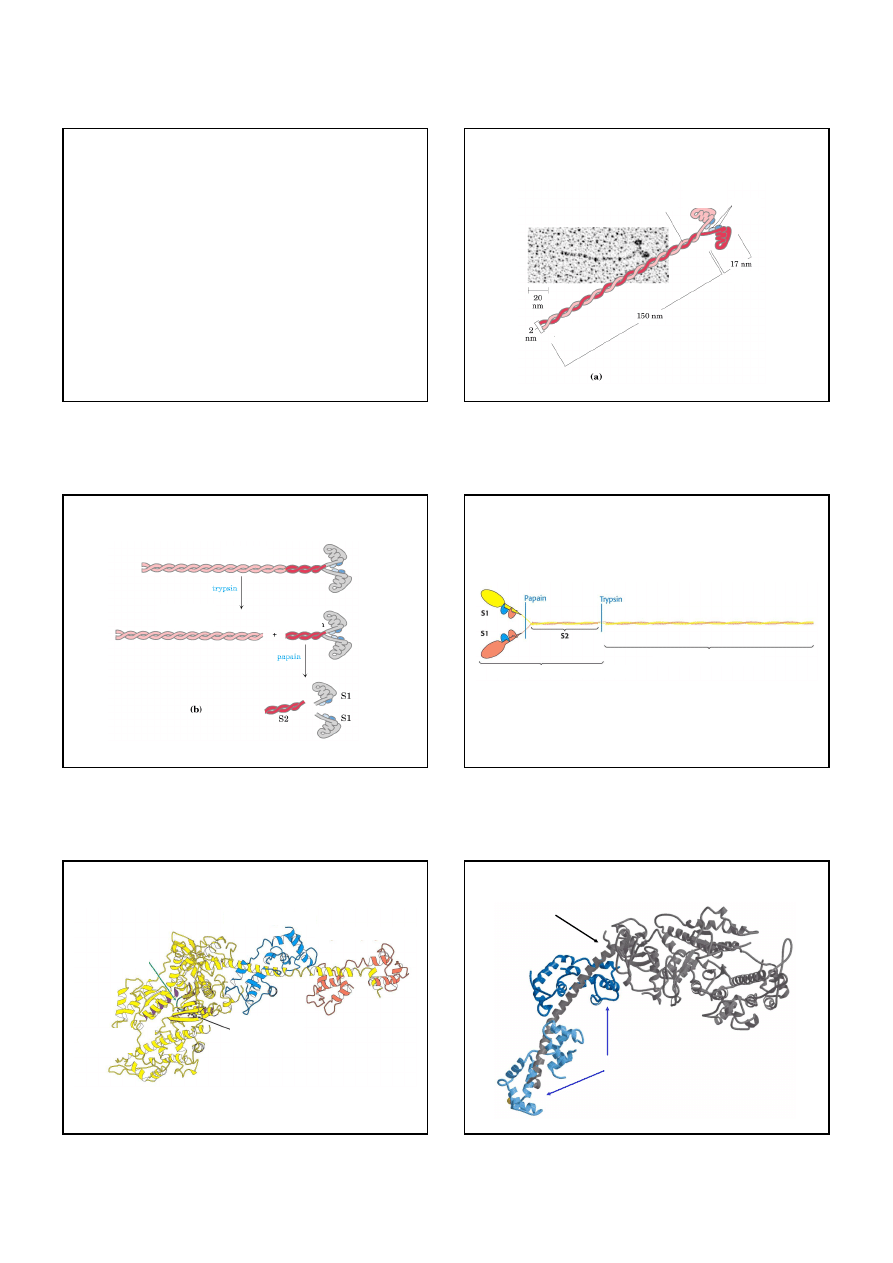
Anemia sierpowatokrwinkowa
prawidłowe krwinki
krwinki w anemii sierpowatej
(tylko w heterozygocie)
Przyczyna anemii sierpowatokrwinkowej:
mutacja Glu
→
→
→
→
Val w pozycji 6 łańcucha
ββββ
anemia sierpowata
Deoksyhemoglobina S agreguje w wyniku zwiększonej hydrofobowości
agregacja
powstawanie włókien
Heterozygoty dla mutacji w anemii sierpowatokrwinkowej
są relatywnie odporne na malarię.
Chinina
: pochodna tryptofanu,
ale zawierajaca układ chinolinowy zamiast indolowego.
Niszczy merozoity Plasmodium, które wywołują malarię,
tworząc kompleksy z DNA pasożyta.
8
Molekularne silniki
Fragment miozyny, w odpowiedzi
na związanie, hydrolizę i uwolnienie ATP,
przemieszcza się wzdłuż filamentu aktynowego.
Molekularne silniki: miozyna i aktyna
Miozyna (M.cz. 540 000): 2 ciężkie łańcuch (M.cz. 220 000)
i 4 lekkie łańcuchy (M.cz. 20 000)
dwie skręcone
helisy
α
αα
α
N-koniec
lekkie
łańcuchy
głowy
ogon
C-koniec
Budowa miozyny
miozyna
lekka meromiozyna
ciężka meromiozyna
Budowa miozyny
ciężka meromiozyna (HMM)
lekka meromiozyna (LMM)
Struktura miozyny
miejsce
wiązania aktyny
pętla P
miejsce wiązania
nukleotydu
niezbędny łańcuch
lekki
regulatorowy łańcuch
lekki
łańcuch ciężki
Budowa fragmentu S1 miozyny
lekkie łańcuchy
ciężki łańcuch

9
Dwuniciowa superhelisa miozynowa
Dwie helisy
α
αα
α
tworzą lewoskrętną
superhelisę, owijając się jedna
wokół drugiej.
Takie struktury są stabilizowane
oddziaływaniami hydrofobowymi
w punktach kontaktu między
helisami.
Dwa główne komponenty włókien mięśniowych: miozyna i aktyna
Dwa główne komponenty włókien mięśniowych: miozyna i aktyna
Budowa mięśni
podjednostki
G-aktyny
Miozyna tworzy dwubiegunowe struktury
zwane grubymi filamentami
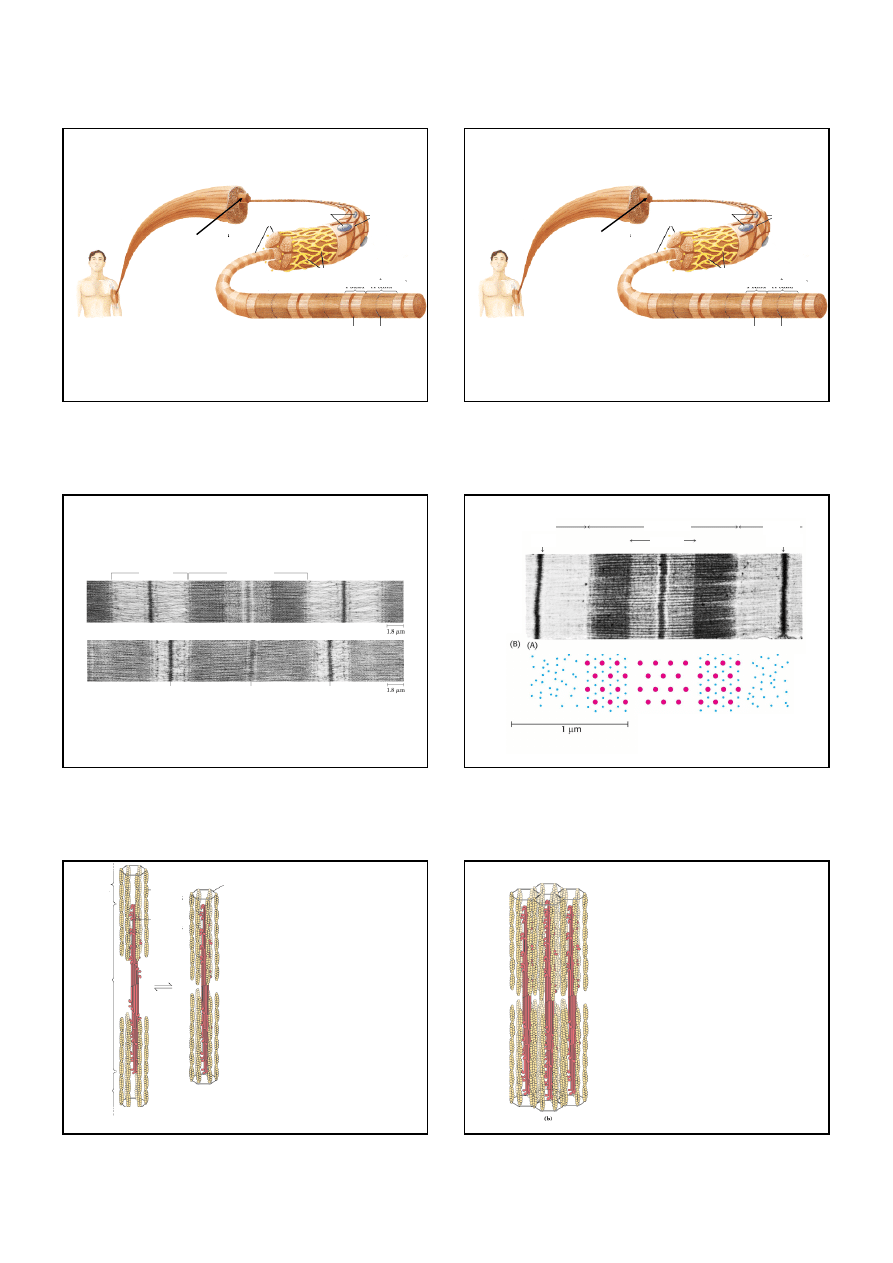
G-aktyna (monomer: M.cz. = 42 000)
tworzy polimery zwane F-aktyną.
Cienkie filamenty składają się z F-aktyny,
oraz troponiny i tropomiozyny.
Aktyna jest samoorganizującym się, podlegającym ciągłym zmianom
polimerem o dwóch różnych końcach
koniec ostry
koniec haczykowaty (aktyny F)
miejsce
wiązania
nukleotydu
Każdy monomer aktyny zbudowany jest z 4 domen.
Domeny te łączą się ze sobą i otaczają związany
nukleotyd: ATP lub ADP.
monomer
aktyny
(aktyna G)
Głowa miozyny może się wiązać z filamentem aktynowym
10
Budowa mięśnia szkieletowego
mięsień
wiązka włókien
mięśniowych
jądra
naczynia
kapilarne
miofibryle
miofibryl
retikulum
sarkoplazmatyczne
włókno
mięśniowe
pasmo I pasmo A
linia Z linia M
Włókno mięśniowe
: długa, wielojądrzasta komórka, 20 - 100
µµµµ
m średnicy.
Zawiera ok. 1000
miofibryli
, 2
µµµµ
m średnicy, składających się z cienkich i grubych filamentów
oraz innych białek.
sarkomer
Budowa mięśnia szkieletowego
mięsień
wiązka włókien
mięśniowych
jądra
naczynia
kapilarne
miofibryle
miofibryl
retikulum
sarkoplazmatyczne
włókno
mięśniowe
pasmo I pasmo A
linia Z linia M
Retikulm sarkoplazmatyczne
:
system płaskich membranowych pęcherzyków otaczający
każdy miofibryl.
Sarkomer
: podjednostka zdolna do skurczu, złożona z wiązek cienkich i grubych filamentów.
sarkomer
Włókno mięśniowe
skurcz
rozkurcz
pasmo I pasmo A
linia Z linia M
linia Z
Pasmo I: tylko cienkie filamenty.
Pasmo A: grube filamenty, oraz nakładające się cienkie i grube filamenty.
Linia Z: zakotwiczenie cienkich filamentów.
Linia M: region o dużej gęstości w środku grubych filamentów.
tylko
grube
filamenty
Budowa sarkomeru
tylko
grube
filamenty
grube
i cienkie
filamenty
tylko
cienkie
filamenty
pasmo I
pasmo A
pasmo I
linia Z
strefa H
linia Z
pasmo I
pasmo A
pasmo I
cienkie
filamenty
grube
filamenty
linia Z
rozkurcz skurcz
Mechanizm skurczu mięśni
linia Z
Cienkie filamnty wiążą si ę z linią Z z udziałem innych
białek:
α
αα
α
-aktyniny
,
desminy
i
wimentyny
.
Cienkie filamenty zawierają duże białko zwane
nebuliną
(7000 reszt aminokwasowych).
Linia M łączy grube filamenty, oraz inne białka:
paramiozynę
,
białko C
i
białko M
.
Titina
(największe znane białko, ponad 26 000 reszt aa)
wiąże grube filamenty z linią Z
linia M
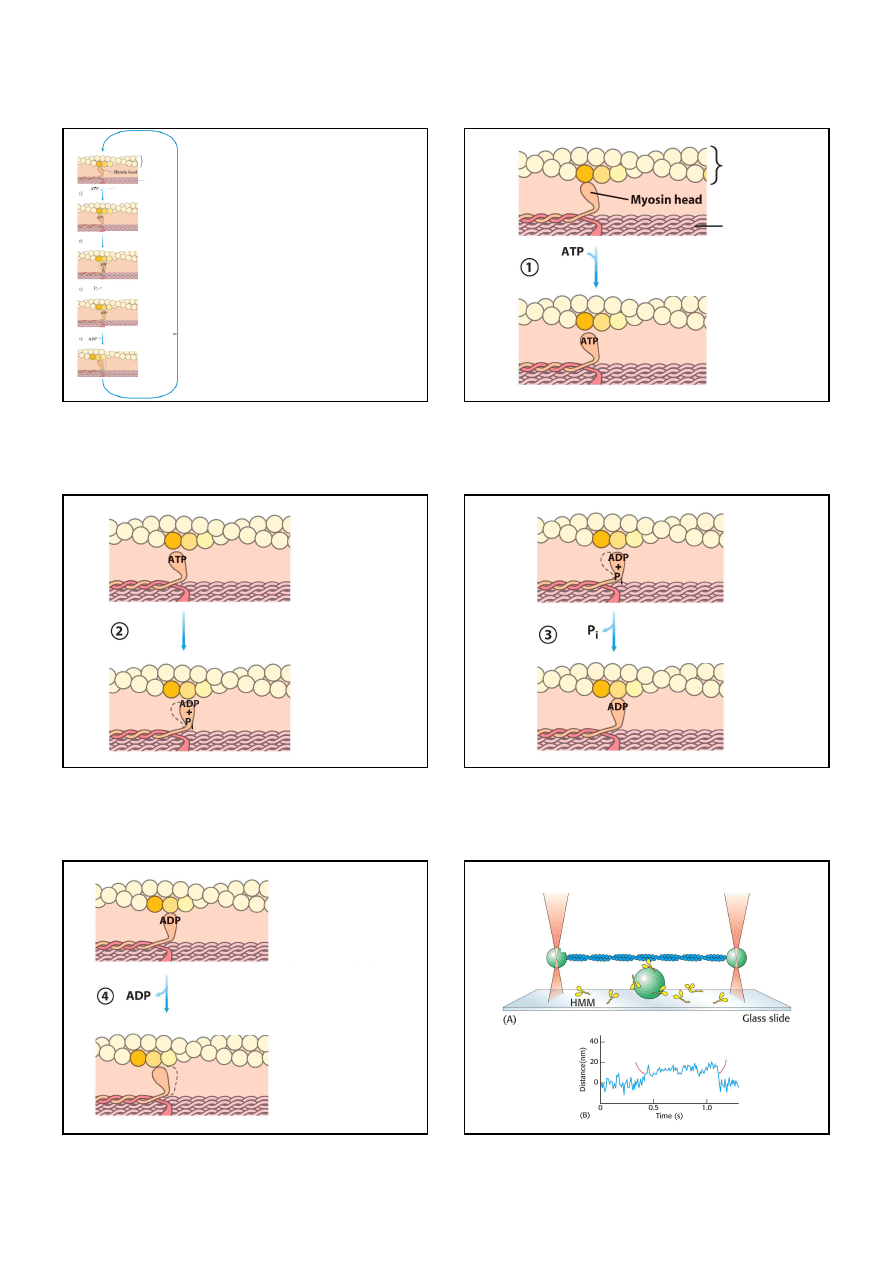
11
Mechanizm skurczu mięśni
cienki filament
gruby filament
1. ATP wiąże się do głowy miozyny, powodując dysocjację od aktyny
2. ATP jest hydrolizowane, ADP i P
i
pozostaje związane z głową miozyny,
następuje zmiana konformacji głowy.
3. Miozyna wiąże się z filamentem aktynowym, uwalniając P
i
.
4. Uwolnienie P
i
powoduje „eksplozję siły”: zmianę konformacji
miozyny, która powoduje wzajemne przesunięcie filamentów.
cienki filament
1. ATP wiąże się do głowy miozyny,
powodując dysocjację od aktyny
gruby filament
2. ATP jest hydrolizowane,
ADP i P
i
pozostaje związane z głową
miozyny,następuje zmiana
konformacji głowy.
3. Miozyna wiąże się z filamentem
aktynowym, uwalniając P
i
.
4. Uwolnienie P
i
powoduje „eksplozję siły”:
zmianę konformacji miozyny,
która powoduje wzajemne
przesunięcie filamentów.
Można obserwować ruch pojedynczego białka motorycznego
filament cienki
wiązka
lasera
suw
uwolnienie
Dodanie ATP
⇓
⇓
⇓
⇓
głowa miozyny ulega
zmianie konformacyjnej
⇓
⇓
⇓
⇓
przesunięcie filamentu
aktyny = przesunięcie
kulek
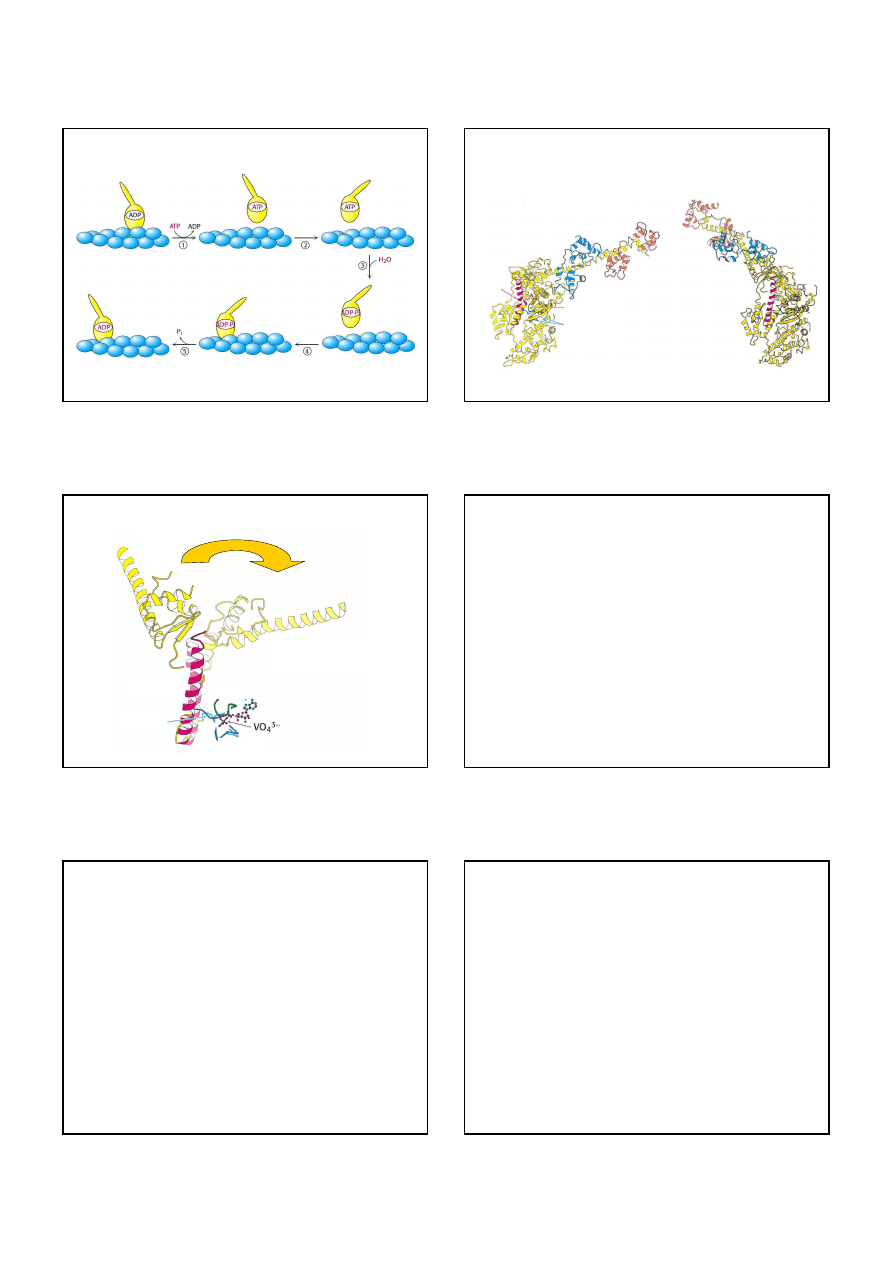
12
Ruch miozyny wzdłuż aktyny
Wymiana ADP na ATP:
1. Uwolnienie miozyny
2. Reorientacja ramienia dźwigni miozyny
Hydroliza ATP:
miozyna ponownie
wiąże się z aktyną
Uwolnienie P
i
:
przywrócenie orientacji
ramienia dźwigni miozyny
miozyna
aktyna
Związanie ATP przez fragment S1 miozyny powoduje zmianę konformacji
ramię dźwigni
helisa
przekaźnikowa
pętla P
przełącznik I
przełącznik II
kompleks miozyna-ADP-VO
4
3-
kompleks miozyna-ADP
VO
4=
3-
: analog stanu przejściowego hydrolizy ATP
Zmiany strukturalne ramienia dźwigni w miozynie
pozycja ramienia dźwigni,
gdy związany jest ADP
pozycja ramienia dźwigni,
gdy związany jest ADP-VO
4
3-
helisa
przekaźnikowa
przełącznik I
przełącznik II
pętla P
Enzymy
1850: Louis Pasteur stwierdził, że przemiana cukru w alkohole przez drożdże jest
katalizowana przez „fermenty”, nierozdzielalne od żywych komórek.
1897: Edward Buchner stwierdził, że ekstrakt z drożdży tez może fermentować
cukier do alkoholu.
Fryderyk Kuhne nazwał te cząsteczki enzymami.
1926: James Summer wyizolował wyizolował i wykrystalizował urokinazę i stwierdził,
że jest to białko.
1930: John Northrop i Moses Kunitz wykrystalizowali pepsynę i trypsynę, i stwierdzili,
że również są to białka.
J.B.S. Haldane napisał dzieło „Enzymy”, w którym zasugerował,
że słabe oddziaływania między cząsteczką enzymu i substratu mogą zmieniać
charakter substratu i katalizować reakcję.
Enzymy - klasyfikacja
Numer Klasa
Typ katalizowanej reakcji
1 Oksydorektazy
Transfer elektronów (jonów H
+
)
2 Transferazy Transfer grup w reakcjach
3 Hydrolazy Reakcja hydrolizy (przenoszenie aktywnych
grup na cząsteczkę wody
4 Liazy Dodawanie grup do podwojnych wiązań,
albo tworzenie podwójnych wiązń poprzez
usunięcie grup
5 Izomerazy Przenoszenie grup wewnątrz cząsteczki
6 Ligazy Tworzenie wiązań: C-C, C-S, C-O albo C-N
poprzez reakcje kondensacji z wykorzystaniem
energii ATP
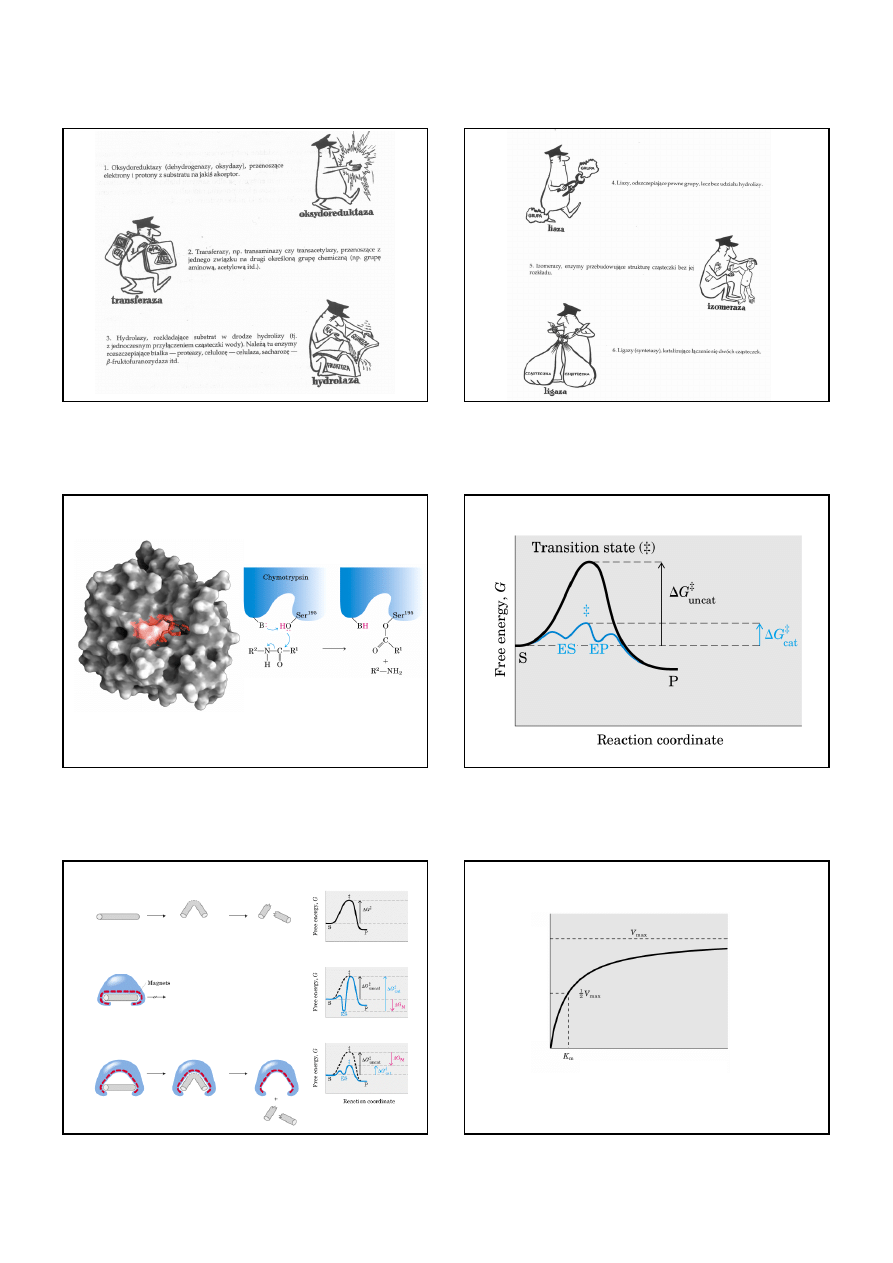
13
Wiązanie substratu do centrum aktywnego enzymu:
chymotrypsyna i fragment łańcucha polipeptydowego
Enzymy przyspieszają reakcję poprzez obniżenie
∆∆∆∆
G
+
,
swodobnej energii aktywacji
Jak działa enzym („kijkaza”)
substrat
(kijek)
stan pośredni
(wygięty kijek)
produkt
(złamany kijek)
Enzym stabilizujący substrat
Enzym stabilizujący stan pośredni
Wpływ stężenia substratu na początkową szybkość reakcji
początkowa
szybkość
reakcji, V
0
stężenie substratu [S]
K
m
: stała Michaelisa-Menten:
stężenie substratu, przy którym V
o
= 1/2 V
max
„Im mniejsza K
m
, tym szybciej działa enzym”
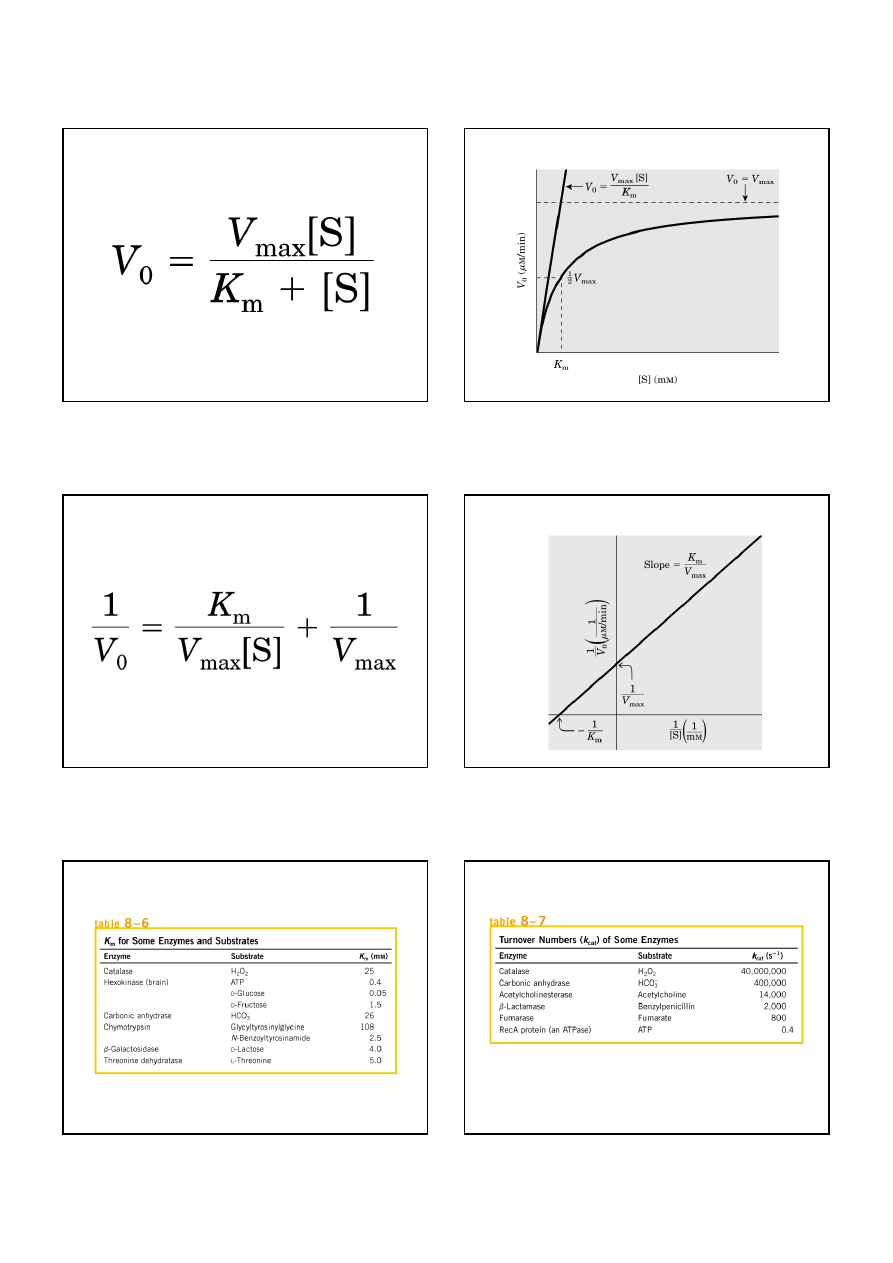
14
Równanie Michaelisa-Menten
Zależność szybkości początkowej od stężenia substratu
Wykres Lineweavera-Burka
K
m
dla niektórych enzymów i substratów
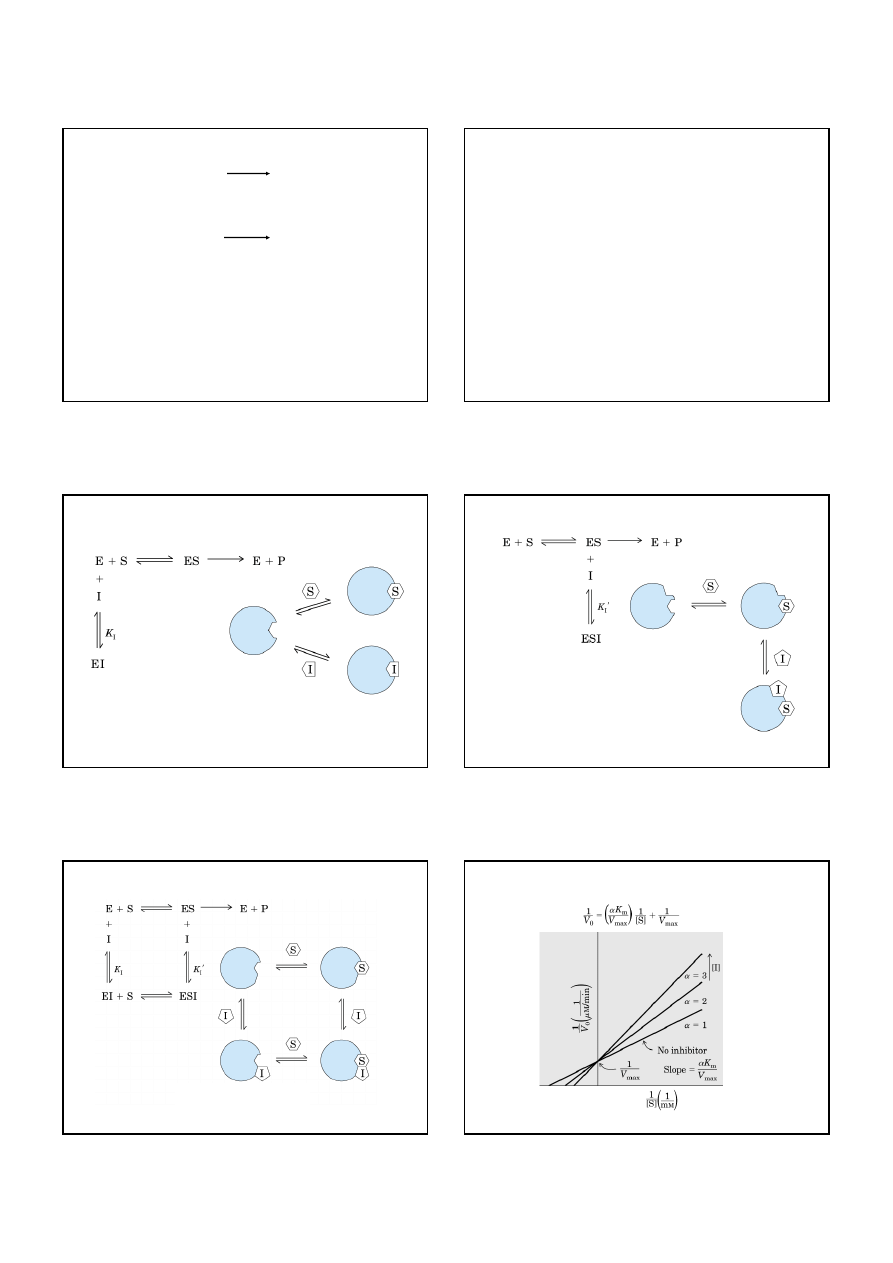
Liczba obrotów dla niekórych enzymów
k
cat
: jest równa stałej szybkości dla najwolniejszego etapu reakcji
15
Fizjologiczna wrażliwość na alkohol jako przykład znaczenia K
m
CH
3
CH
2
OH + NAD
+
CH
3
CHO
+ H
+
+ NADH
dehydrogenaza
alkoholowa
(wątroba)
aldehyd octowy
CH
3
CHO
+ NAD
+
CH
3
COO
-
+ H
+
+ NADH
dehydrogenaza
aldehydu octowego
kwas octowy
Objawy zatrucia alkoholem powoduje aldehyd octowy.
Większość ma 2 formy
dehydrogenazy aldehydu octowego
:
mitochondrialny o małej wartości K
m
i cytozolowy o dużej wartości K
m
.
U osób wrażliwych enzym mitochondrialny jest mniej aktywny
z powodu pojedynczego podstawienia aminokwasu.
Mniej aldehydu octowego zostaje wówczas przekształcone do octanu,
ponieważ enzym cytozolowy ma dużą wartość K
m
.
Nadmiar aldehydu octowego trawia do krwi wywołując
efekty fizjologiczne.
(wątroba)
potrzebna jest utleniona forma NAD (NAD
+
)
Lek na kaca (2KC) zawiera kwas fumarowy i bursztynowy,
dzięki którym następuje przyspieszenie procesu fosforylacji
oksydacyjnej.
W jej wyniku pojawia się większa ilość przenośnika elektronów
NAD w formie zredukowanej (NAD
+
).
Duża ilość NAD
+
umożliwia efektywne utlenianie aldehydu
octowego.
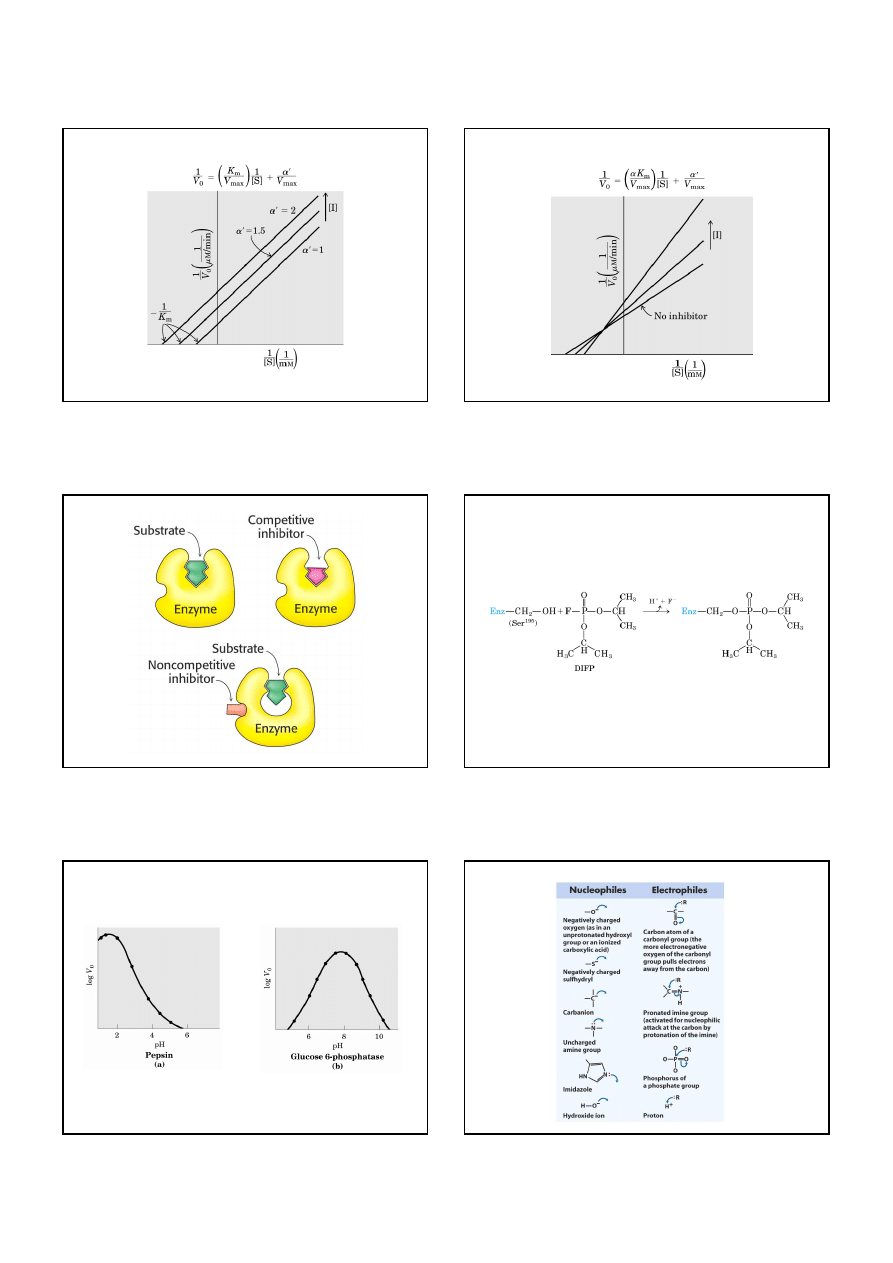
Inhibicja kompetycyjna
Inhibitory kompetycyjne wiążą się do tego samego
miejsca aktywnego enzymu.
Inhibicja niekompetycyjna
Inhibitory niekompetecyjne wiążą się do różnych miejsc,
ale inhibitor wiąże się tylko do kompleksu enzymu i substratu.
Inhibicja mieszana
Inhibitory mieszane wiążą się do różnych miejsc,
ale mogą się związać zarówno do enzymu,
jak i kompleksu enzymu z substratem.
Inhibicja kompetycyjna
16
Inhibicja niekompetycyjna
Inhibicja mieszana
Inhibitory nieodwracalne
Reakcja chymotrypsyny z DIFP nieodwracalnie hamuje enzym.
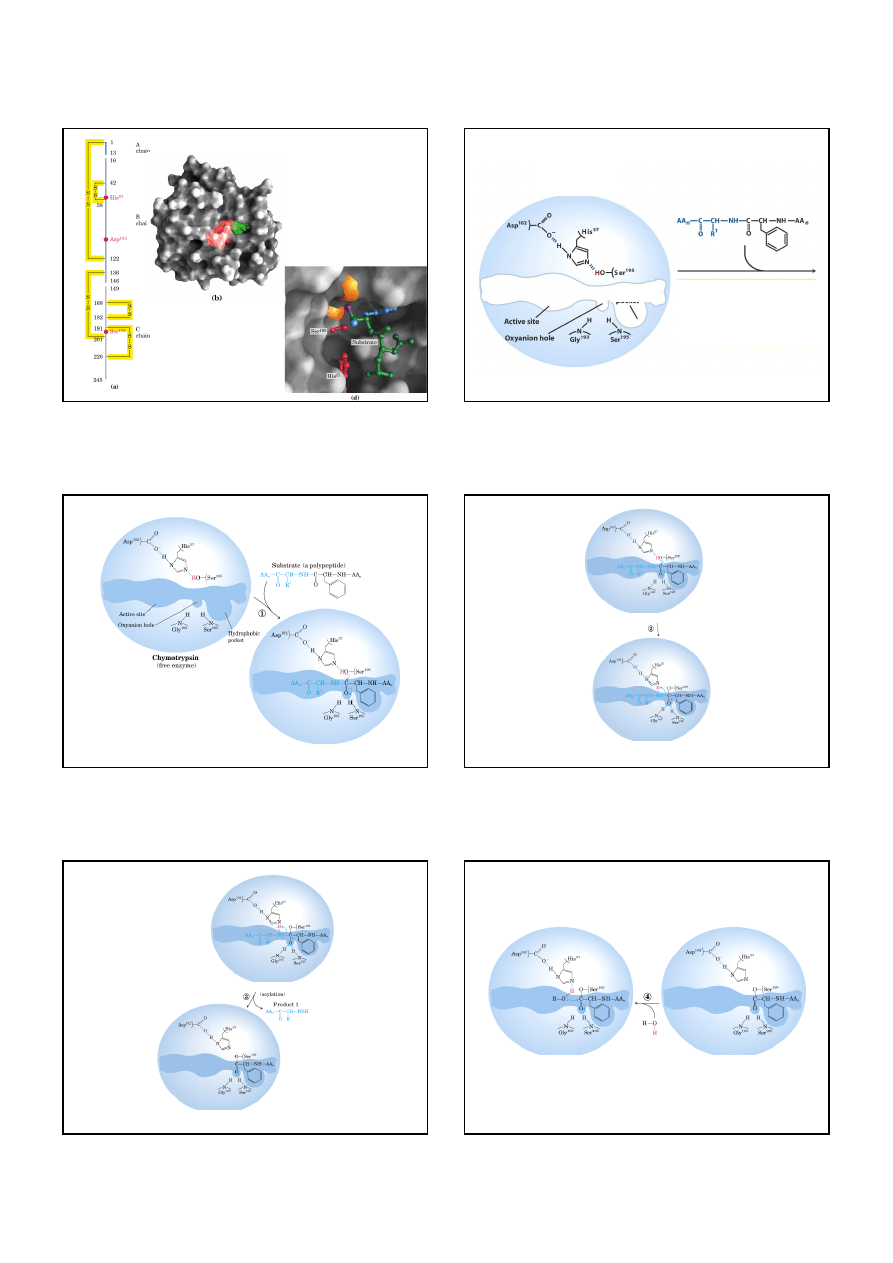
Wpływ pH na aktywność enzymu
Nukleofile i elektrofile
17
Chymotrypsyna jako przykład aktywności
enzymatycznej
substrat (polipeptyd)
chymotrypsyna
(wolny enzym)
Chymotrypsyna jako przykład enzymu katalizującego reakcję
Chymotrypsyna rozpoznaje duże reszty aminokwasowe
od strony C-końca aminokwasu hydrofobowego (Phe, Tyr).
Duża reszta aminokwasowa
wpasowuje się w
hydrofobową
kieszeń
enzymu
hydrofobowa
kieszeń
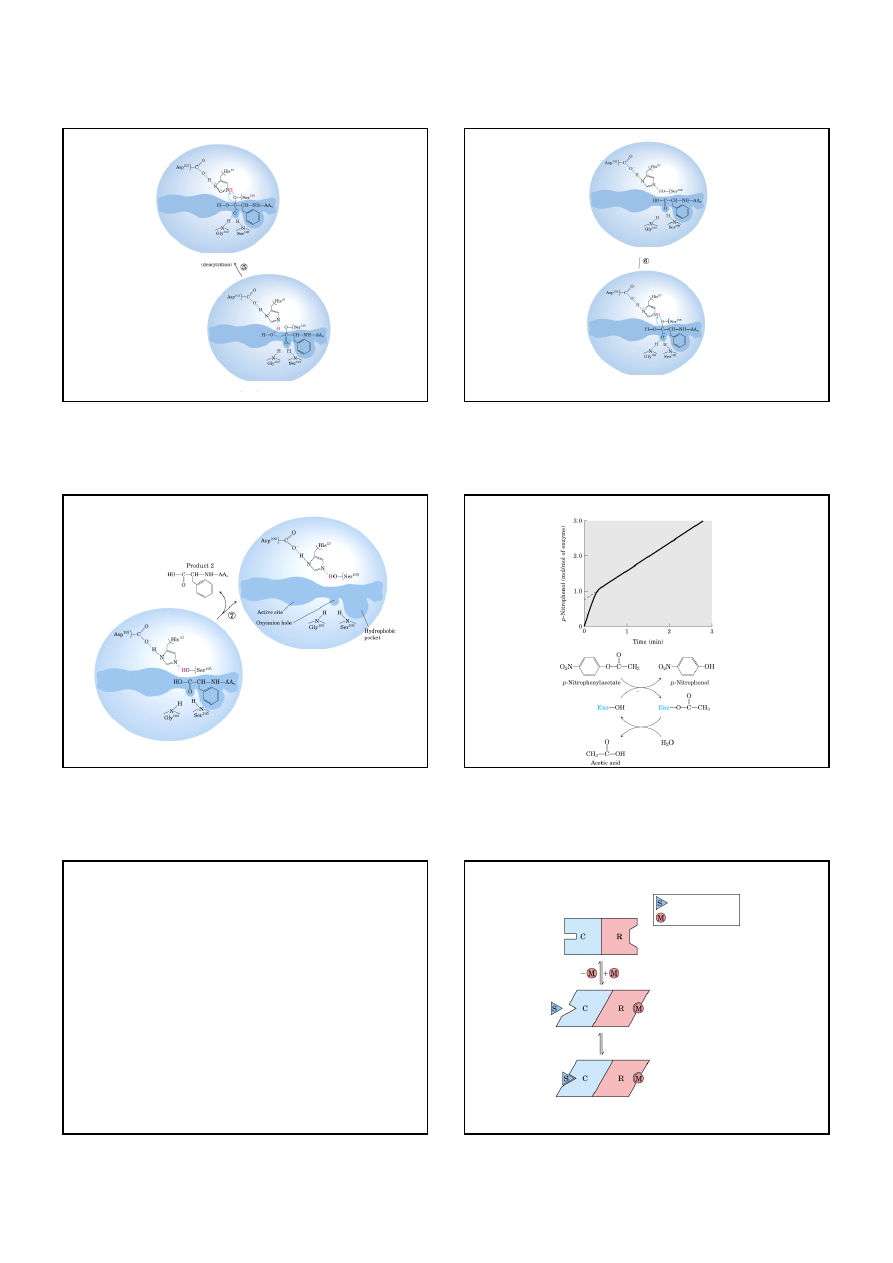
Etapy w hydrolizie wiązania peptydowego przez chymotrypsynę
Chymotrypsyna hydrolizuje wiązanie
peptydowe od C-końca aminokwasu
hydrofobowego (Phe, Tyr)
1. Utworzenie kompleksu
enzym-substrat
miejsce aktywne
2. Utworzenie kompleksu stanu przejściowego
o krótkim czasie życia
3. Acylacja seryny w chymotrypsynie
odłączenie uwolnionej
części łańcucha polipeptydowego
(wolny N-koniec)
acylowany enzym
acylowany enzym acylowany enzym
4. Hydroliza wiązania acylowego
18
acylowany enzym
5. Utworzenie kompleksu stanu
przejściowego
o krótkim czasie życia (deacylacja)
6. Powstanie kompleksu enzym-produkt
kompleks enzym-produkt
produkt 2:
fragment łańcucha polipeptydowego
z resztą hydrofobową na C-końcu
Dwa etapy reakcji katalizowanej przez chymotrypsynę mają różną szybkość
szybko
wolno
Enzymy podlegają regulacji
Dwa rodzaje regulacji aktywności enzymów:
1.
Regulacja allosteryczna
: mała cząsteczka wiąże się
odwracalnie do enzymu, modulując jego aktywność.
Takie cząsteczki są nazywane
modulatorami allosterycznymi
.
2.
Regulacja kowalencyjna
: mała cząsteczka wiąże się
kowalencyjnie do enzymu.
Wiązanie to jest zazwyczaj nieodwracalne.
Regulacja allosteryczna
substrat
pozytywny modulator
nieaktywny enzym
aktywny enzym
kompleks
aktywny enzym -
substrat
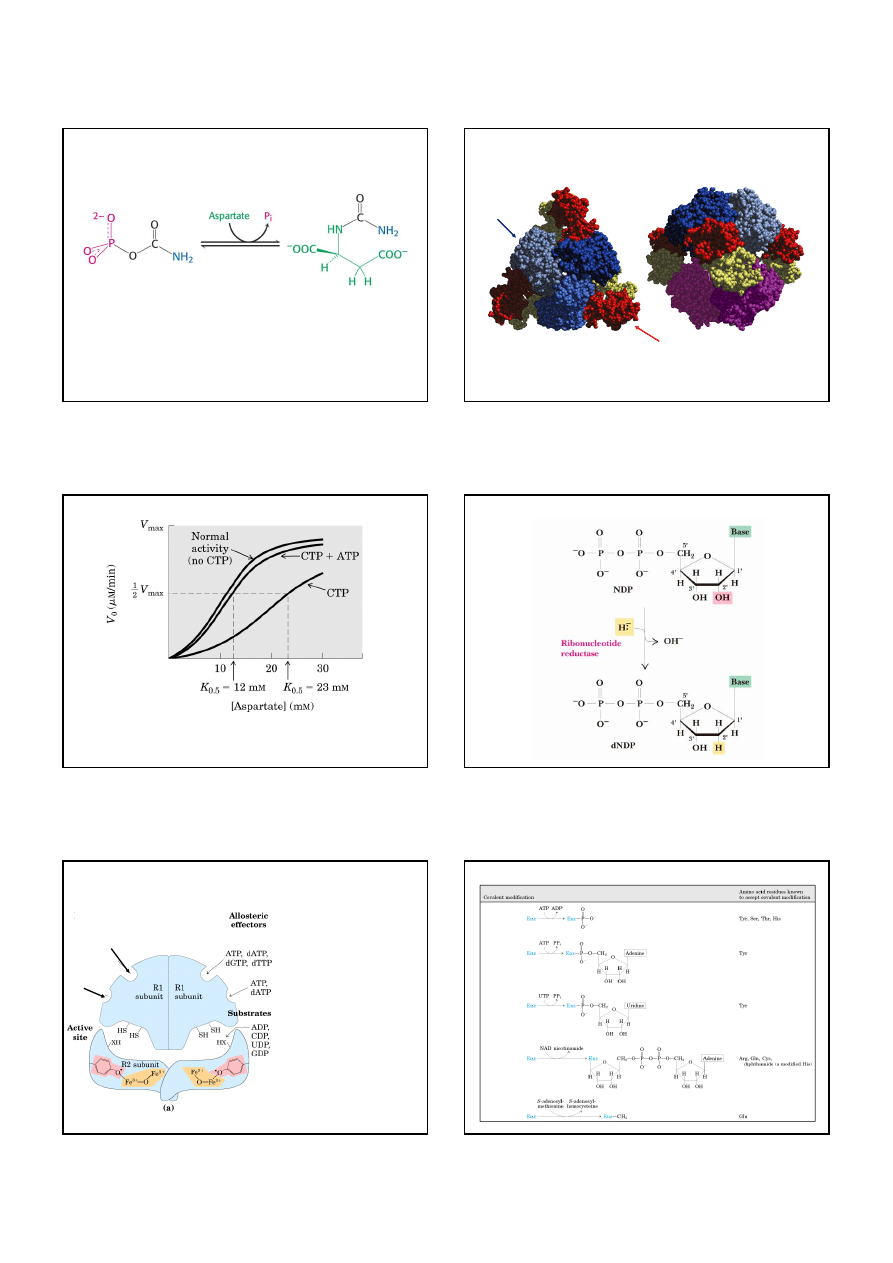
19
1. Synteza karbamoiloasparaginianu: decydujący etap
w biosyntezie pirymidyn
karbamoilotransferaza asparaginianowa
karbamoilofosforan
karbamoiloasparaginian
Regulacja karbamoilotransferazy asparaginianowej:
6 podjednostek regulatorowych, 6 katalitycznych
2x3 katalityczne
polipeptydy
2x3 regulatorowe
polipeptydy (wiążą CTP)
związanie CTP ⇒
⇒
⇒
⇒ zmiana konformacji
Regulacja karbamoilotransferazy asparaginianowej
CTP
hamuje aktywność,
ATP
zapobiega zmianom w konformacji powodowanym przez CTP.
Deoksynukleotydy powstają z rybonukleotydów
Reduktaza rybonukleotydowa
Występuje jako dimer, złożony
z podjednostek R1 i R2.
Podejnostka R1 składa się
z 2 rodzajów domen
regulatorowych.
W każdej podjednostce R1
są dwie reszty tiolowe,
a w podjednostce R2
reszta tyrozyny ze stabilnym
rodnikiem.
R2 zawiera również jon Fe
3+
,
który stabilizuje rodnik.
miejsce
specyficzności
substratowej
miejsce
całkowitej
aktywności
Przykłady reakcji modyfikujących enzymy
fosforylacja
adenylacja
urydylacja
ADP-rybozylacja
metylacja
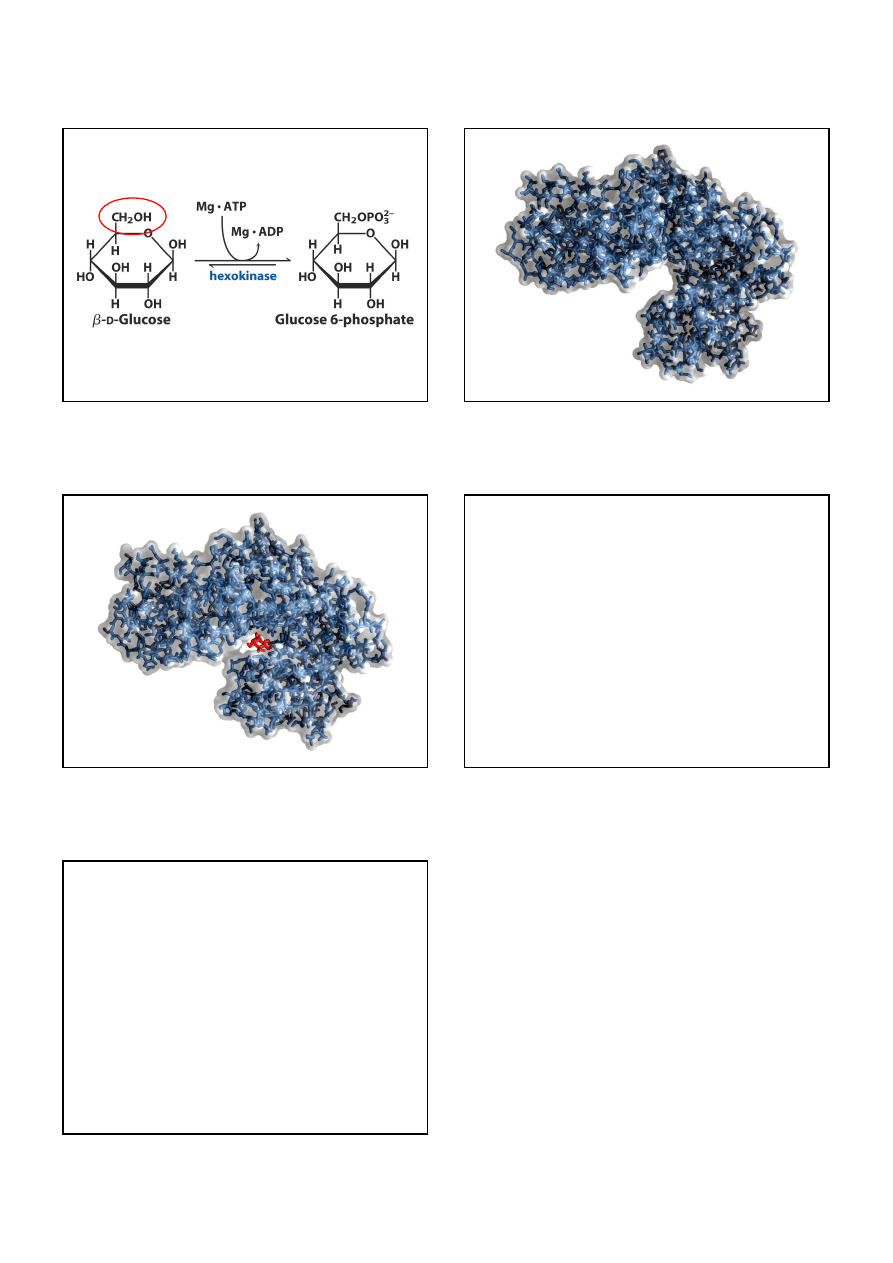
20
Heksokinaza przekształca glukozę w glukozo-6-fosforan
Reaktywność grupy hydroksylowej C-6 glukozy jest podobna
do reaktywności wody, ale enzym faworyzuje glukozę w stosunku
milion do 1.
Enzym rozróżnia glukozę od wody, ponieważ związanie prawidłowego substratu
powoduje zmianę konformacji.
Tylko taka heksokinaza jest katalitycznie aktywna
04. Biochemia - białka: funkcja
Tematy do zapamiętania
1. Mioglobina i hem: struktura i funkcja.
2. Hemoglobina: struktura i funkcja.
3. Wiązanie tlenu przez hemoglobinę.
4. Tlenek węgla: przyczyny toksyczności.
5. Anemia sierpowata.
6. Miozyna i aktyna: struktura i funkcja.
7. Budowa mięśni.
8. Włókno mięśniowe i sarkomer.
9. Mechanizm skurczu mięśni.
10. Enzymy: mechanizm działania.
11. Enzymy: inhibicja kompetecyjna i niekompetecyjna.
12. Enzymy: regulacja allosteryczna i kowalencyjna.
Wyszukiwarka
Podobne podstrony:
04 BIOCHEMIA
C 04,5 Rachunek różniczkowy funkcji wielu zmiennych
03a Biochemia bialka
biochemia bialka
Białka NOTATKI Z WYKŁADÓW, Biochemia, Biochemia, Białka aminokwasy DNA
Biochemia białka
biochemia BIALKA SPRAWKO1, POLITECHNIKA ŁÓDZKA, BIOCHEMIA
03 i 04 BIOCHEMIA kataliza kinetykaid 4367 ppt
Biochemia białka
BIOCHEMIA struktura i funkcje bialek
21 - 25.04.2001 białka osocza śpiączki, Pomoce naukowe, studia, biologia- wyklady
03 Biochemia bialka
04 BIOCHEMIA
C 04,5 Rachunek różniczkowy funkcji wielu zmiennych
03a Biochemia bialka
biochemia białka
biochemia białka do sprawozdania (1)
więcej podobnych podstron