Ć W I C Z E N I E Nr 52
MIARECZKOWANIE POTENCJOMETRYCZNE
Cel ćwiczenia: Ilościowe oznaczenie substancji miareczkowanej za pomocą pomiaru
SEM ogniwa stężeniowego.
Siłą elektromotoryczną ogniwa, (SEM), lub napięciem ogniwa w warunkach
bezprądowych, nazywamy różnicę potencjałów ogniwa otwartego, przez które nie płynie prąd.
SEM mierzymy w warunkach zrównoważenia napięcia ogniwa zewnętrznym źródłem napięcia
(metoda kompensacyjna Poggendorfa). SEM ogniwa jest w tych warunkach proporcjonalna do
oporu R
X
(patrz: ćwiczenie 51).
Metodę miareczkowania potencjometrycznego poznamy na przykładzie oznaczania
ilości AgNO
3
w roztworze. Zestawiamy ogniwo stężeniowe,
Ag |AgCl | r-r nas. AgCl
|| AgNO
1
Ag
)
m
(
+
3
| AgCl | Ag
2
Ag
)
m
(
+
1
Ag
)
m
(
+
jest stężeniem jonów Ag
+
w nasyconym roztworze AgCl, a
jest nieznanym
stężeniem jonów Ag
2
Ag
)
m
(
+
+
w roztworze AgNO
3
otrzymanym do miareczkowania.
Do prawego półogniwa, zawierającego roztwór AgNO
3
, dodajemy porcjami
określone ilości roztworu NaCl, o znanym stężeniu i dokładnie mieszamy roztwór. Po dodaniu
NaCl zachodzi reakcja:
AgNO
3
+ NaCl
→ NaNO
3
+ AgCl(s)
↓
(1)
Stężenie jonów Ag
+
w miareczkowanym roztworze maleje w wyniku wytrącania się
trudnorozpuszczalnej soli, AgCl.
Przed rozpoczęciem miareczkowania stężenie jonów srebra w miareczkowanym roztworze jest
większe niż w roztworze nasyconym:
1
Ag
2
Ag
)
m
(
)
m
(
+
+
>
.
W punkcie równoważnikowym stężenia jonów srebra w obu roztworach są jednakowe:
1
Ag
2
Ag
)
m
(
)
m
(
+
+
=
.
Po przekroczeniu punktu równoważnikowego stężenie jonów srebra w miareczkowanym
roztworze jest mniejsze niż w roztworze nasyconym:
−
+
+
≡
>
Cl
2
Ag
1
Ag
m
L
)
m
(
)
m
(
gdzie
jest iloczynem rozpuszczalności AgCl
1
Cl
1
Ag
)
m
(
)
m
(
L
−
+
⋅
=
Zgodnie z równaniem Nernsta zależność SEM ogniwa stężeniowego od molarności roztworów
jest następująca:
1
Ag
2
Ag
1
Ag
2
Ag
)
m
(
)
m
(
ln
F
RT
)
a
(
)
a
(
ln
F
RT
E
+
+
+
+
−
≅
−
=
(2)
Jak widać, wraz ze spadkiem stężenia
SEM ogniwa maleje i gdy
2
Ag
)
m
(
+
2
Ag
1
Ag
)
m
(
)
m
(
+
+
>
siła elektromotoryczna zmienia znak, E<0, co oznacza zmianę charakteru reakcji zachodzących
na elektrodach.
Schemat układu pomiarowego pokazano na rysunku.
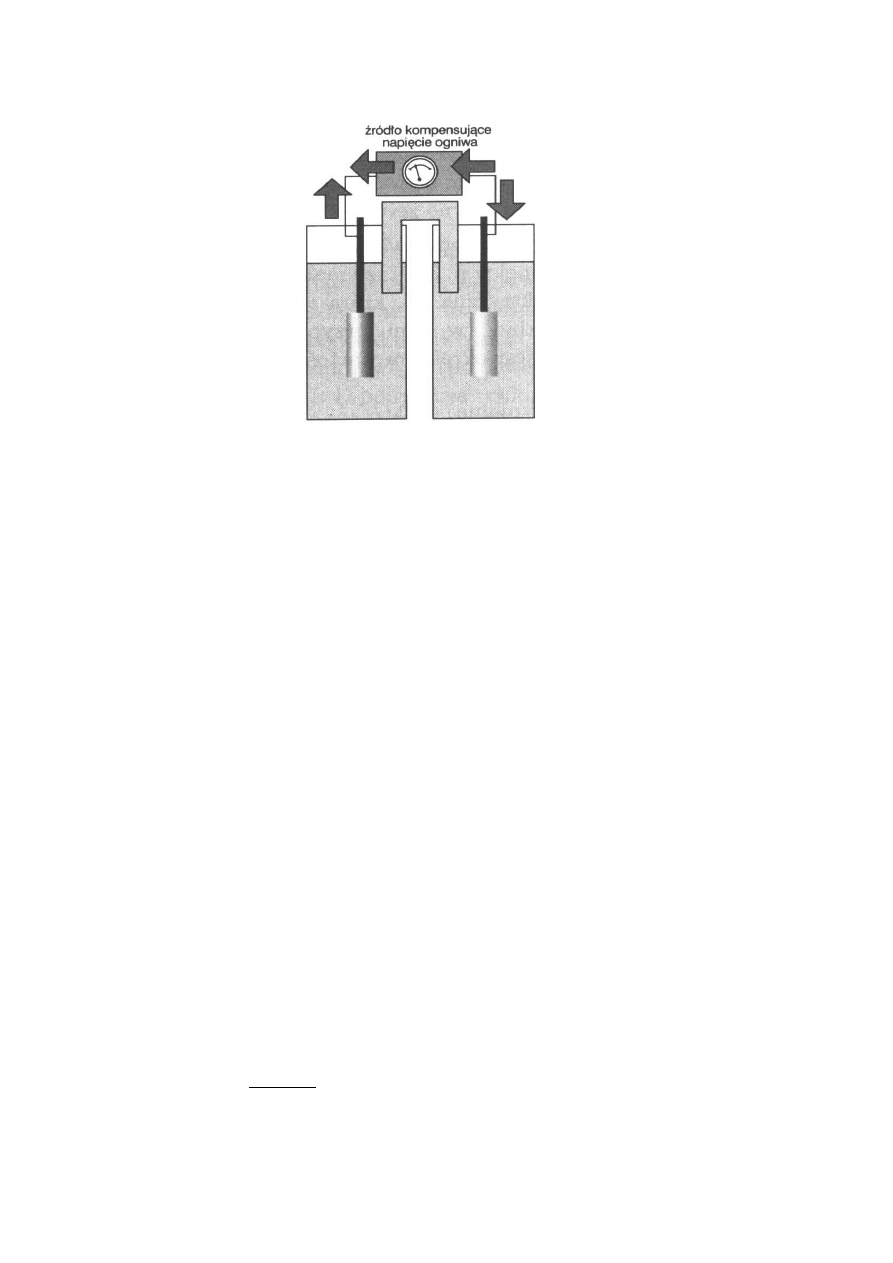
↓NaCl
AgCl AgNO
3
Wykonanie ćwiczenia
1. Pobrać klucz elektrolityczny, roztwór AgNO
3
do miareczkowania oraz stały AgCl.
2. Przygotować nasycony roztwór AgCl.
3. Elektrody chlorosrebrowe zanurzyć w roztworach AgNO
3
i AgCl.
4. Zamknąć obwód przełącznikiem K i ustawić na oporniku dekadowym taki opór R, aby przez
galwanometr nie płynął prąd (strzałka w pozycji „zero”). Zanotować wartość zmierzonego
oporu.
5. Do roztworu AgNO
3
dodawać porcjami z biurety, po 0,2 – 0,5 ml, roztwór NaCl. Po dodaniu
nowej porcji NaCl roztwór dokładnie wymieszać.
6. Ponownie zamknąć obwód przełącznikiem K i ustawić na oporniku dekadowym taki opór R,
aby przez galwanometr nie płynął prąd (strzałka w pozycji „zero”). Zanotować wartość
zmierzonego oporu
Uwaga ! Jeżeli po dodaniu kolejnej porcji NaCl nie można skompensować
SEM ogniwa należy zmienić położenie przełącznika K, gdyż został przekroczony punkt
równoważnikowy, co spowodowało zmianę znaku SEM i kierunku przepływu prądu.
7. Po zmianie położenia przełącznika K, dodawać porcjami, po 0,5 ml, jeszcze 2.0 ml roztworu
NaCl, skompensować SEM ogniwa i zanotować wartość zmierzonego oporu, zaznaczając
umownie jako wartość ujemną, (- R), zmianę kierunku prądu.
8. Po zakończeniu miareczkowania opłukać elektrody wodą destylowaną. Uporządkować
stanowisko pracy i oddać pobrany sprzęt.
Opracowanie wyników
1. Narysować wykres funkcji, R = f(V
NaCl
), na papierze milimetrowym.
Uwaga ! Wartości oporów po zmianie położenia przełącznika K traktujemy umownie
jako ujemne.
2. Narysować na papierze milimetrowym wykres pierwszej pochodnej:
)
V
(
f
V
R
NaCl
NaCl
=
Δ
Δ
3. Z wykresu wyznaczyć punkt równoważnikowy i obliczyć liczbę moli AgNO
3
w roztworze do
miareczkowania.
Document Outline
- Wykonanie ćwiczenia
- Uwaga ! Jeżeli po dodaniu kolejnej porcji NaCl nie można skompensować
- Opracowanie wyników
Wyszukiwarka
Podobne podstrony:
Fizjologia Cwiczenia 11 id 1743 Nieznany
Biologia Cwiczenia 11 id 87709 Nieznany (2)
cwiczenie 14 id 125164 Nieznany
8 Cwiczenia rozne id 46861 Nieznany
cwiczenia wzrost id 155915 Nieznany
cwiczenie III id 101092 Nieznany
Cwiczenie 5B id 99609 Nieznany
Cwiczenie nr 8 id 99953 Nieznany
cwiczenie 05 id 125057 Nieznany
F Cwiczenia, cz 3 id 167023 Nieznany
Cwiczenie 01 id 98935 Nieznany
Cwiczenie 12 id 99084 Nieznany
CWICZENIE 3 temat id 99386 Nieznany
CwiczenieArcGIS 02 id 125937 Nieznany
cwiczenia 09 id 124345 Nieznany
Cwiczenia czytania id 98475 Nieznany
cwiczenie 11 id 125145 Nieznany
więcej podobnych podstron