
Zagadnienie szczegółowe na egzamin z mikrobiologii:
METABOLIZM I HODOWLE BAKTERYJNE
podpunkty: 58 -100.
58) Podstawowe procesy metaboliczne bakterii.
•
Metabolizm => całokształt przemian zachodzących w komórce, przemian materii,
skomplikowany splot setek reakcji biochemicznych.
•
Podstawowe typy przemian materii cząsteczkowej:
•
proces pobierania pokarmu i odżywiania,
•
zdobywanie energii potrzebnej do przeprowadzania licznych reakcji endoergicznych,
•
budowa => synteza drobnocząsteczkowych składników komórki.
•
Polimeryzacji tych składników w makrocząsteczki => kwasy nukleinowe, białka, na
podstawie instrukcji zawartej w informacji genetycznej realizowanej w sposób zależny od
informacji otrzymanej ze środowiska.
•
Podstawowa funkcja organizmu => rozmnażanie, zapewnia kontynuację i ewolucje życia,
jest to odtwarzanie nowego identycznego lub prawie identycznego osobnika.
•
Odżywianie i oddychanie drobnoustrojów => w świecie drobnoustrojów jest ogromna
różnorodność typów oddychania i odżywiania:
•
Odżywianie – polega na pobieraniu przez mikroorganizm z otaczającego go środowiska
substancji pokarmowych, a w określonych przypadkach także promieniowania
elektromagnetycznego (słonecznego)
•
Kryterium podziału odżywiania drobnoustrojów ze względu na źródła odżywiania:
-
źródło węgla
-
źródło protonów i elektronów (lub samych protonów)
-
źródło energii
•
Pobrane składniki zapewniają:
-
budowę i odbudowę
-
dostarczanie pożywienia
•
Typy oddechowe drobnoustrojów:
-
Fermentacja – reakcje dostarczające energii, wymagające związków organicznych
jako akceptorów elektronów.
-
Oddychanie beztlenowe – w którym akceptorami elektronów są zw. nieorganiczne
(inne niż tlen), również dostarczające energii.
-
Oddychanie tlenowe – reakcje dostarczające energii, wymagające tlenu
atmosferycznego jako końcowego akceptora elektronów.
59) Podział bakterii ze względu na wykorzystywane źródło energii: fototrofy, chemotrofy.
•
FOTOTROFY: korzystają z energii świetlnej źródło energii Słońce, energia świetlna
zamieniana jest na energię wiązań chemicznych.
•
CHEMOTROFY: korzystają z energii chemicznej poprzez:
◦
utlenienie związków nieorganicznych: zredukowanych soli azotu, siarki, żelaza, wodoru
cząsteczkowego => CHEMOLITOTROFY.
▪
Chemolitotrofy:
•
bakterie nitryfikacyjne: utleniają N – NH4 do N – NH3
•
bakterie siarkowe: utleniają H2S, S,S2O3
•
bakterie żelazowe: utleniają Fe2 do Fe3
1

•
bakterie wodorowe: utleniają H2
◦
energia pochodząca z utlenienia związków organicznych: węglowodany itp. =>
CHEMOORGANOTROFY, wszystkie są heterotrofami, związki organiczne służą im
jako źródło węgla i energii.
▪
Chemoorganotrofy dzielą się na:
•
saprotrofy – wykorzystują martwą materię organiczną,
•
biotrofy – czerpią pokarm z żywych komórek
•
komensale – rozwijają się w zespole z innym żywym organizmem, nie
przynosząc mu ani korzyści ani szkody.
•
Rodzaje fototrofów:
◦
tlenowe: różne sinice – Cyanobacter np. Synechococcus, Anaboena.
◦
beztlenowe: Chlorobium (Chlorobi), Chromatium i Rhodobacter (Proteobacteria),
Heliobacterium (Firmicutes).
◦
FOTOTFORY OKSYGENOWE, są FOTOLITOAUTOTROFAMI, należą do
Cyanobacteria i wiążą CO2 w cyklu Celvina.
◦
FOTOTROFY ANOKSYGENOWE, mogą być FOTOORGANOHETEROTROFAMI
np. heliobakterie z typu Fermicutes, lub FOTOLITOAUTOTROFAMI np. zielone
bakterie siarkowe z typu Chlorobi.
◦
FOTOAUTOTROFY: autotrofy wykorzystujące energię świetlną.
◦
FOTOLITOTROFY: jako reduktory: H2S, S, tiosiarczan:
•
bakterie zielone m.in. rodzaj Chlorobium
•
bakterie purpurowe siarkowe
•
bakterie purpurowe bezsiarkowe (wykorzystują do redukcji NADP zw. organiczne; NADP
potrzebny jest do redukcji CO2
•
Rodzaje chemotrofów:
◦
CHEMOLITOAUTOTROFY, uzyskują energię z utleniania pierwiastków chemicznych
lub związków nieorganicznych, wiążą CO2 w Cyklu Calvina.
60) Podział bakterii ze względu na wykorzystywane donory elektronów: litotrofy, organotrofy.
•
bakterie wykorzystują jedno z dwóch dostępnych źródeł elektronów, służących do redukcji
NAD/NADP, gdyż NADH i NADPH są niezbędne w reakcjach biosyntezy.
•
LITOTROFY => wykorzystują jako donory wodoru związki nieorganiczne takie jak:
NH3 ,H2S ,S ,CO ,Fe2+.
•
ORGANOTROFY => związki organiczne jako donory wodoru.
•
FOTOLITOAUTOTROFY => energia światła i CO2 jako źródło węgla ;
◦
u roślin zielonych fotosyntetyzujących protistów i sinic, donorem elektronów jest woda.
◦
Fotosyntetyzujące bakterie purpurowe i bakterie zielone wykorzystują różne związki
nieorganiczne np. siarka, wodór.
•
FOTOORGANOHETEROTROFY => (np. helokobakterie) w warunkach beztlenowych na
świetle wykorzystują związki organiczne zarówno jako donory elektronów jak i źródło
węgla.
DODATEK:
Kryterium podziału: główne źródło węgla wykorzystywane przez organizmy w reakcjach
biosyntezy.
AUTOTROFY: organizmy samożywne, mogą wykorzystywać CO2, utlenione związki węgla: CO,
CO2, węglany, jako jedyne źródło węgla.
2

•
Pobierają w pokarmie jedynie utlenione związki węgla: kwas węglowy lub jego bezwodniki
-CO2.
•
Przy przetworzeniu je w związki organiczne musi je bakteria redukować.
•
Zredukowane związki organiczne zawierają w swoich wiązaniach chemicznych znacznie
więcej energii niż utlenione związki węgla z których powstały.
•
Proces redukcji związków powstających przy odżywianiu się CO2 pochłania energię i
wymaga jej dopływu z zewnątrz (energia świtała lub chemiczna).
CHEMOSYNTEZA: typ odżywiania, jest cecha wyłącznie bakteryjną.
•
Proces ten jest często tlenowy i wymaga obecności w podłożu zredukowanych związków
mineralnych np. sole amonowe, azotyny, siarczki, tiosiarczany itp.
HETEROTROFY: organizmy cudzożywne, wymagają w pokarmie przynajmniej jednego związku
organicznego, który służy im jako główne źródło węgla, do nich należą:
PROTOTROFY: niezbędny jest w pokarmie tylko jeden związek organiczny, służący jako źródło
węgla i energii oraz zestaw odpowiednich soli mineralnych;
•
związek prosty: octan, glukoza,
•
Związek jednowęglowy: metanol, mrówczan, metan.
•
Bakterie obecne w pokarmie, glebie, wodzie, nisze ekologiczne bogate w substancje
organiczne np., jelito grube => E. Coli (pałeczka okrężnicy).
AUKSOTROFY: potrzebują jeden związek organiczny, który wykorzystują jako źródło węgla i
energii i potrzebują jeszcze jakiegoś jednego lub więcej bardzo skomplikowanych związków
organicznych tzw. CZYNNIKÓW WZROSTOWYCH: aminokwasy, witaminy, zasady azotowe.
•
Do takich bakterii należy np. pałeczka duru brzusznego => Sallmonella typhi wymaga
tryptofanu.
PODSUMOWANIE: Typy pokarmowe drobnoustrojów:
1. Fotolitoautotrofy – promieniowanie słoneczne, donory elektronów
to zw.nieorganiczne
2. Fotoorganotrofy – źródło energii – promieniowanie słoneczne,
donory elektronó to zw.organiczne
3. Chemolitotrofy – źródło energii – reakcje biochemiczne, donory
elektronów – substancje nieorganiczne (chemoatotrofy)
4. Chemoorganotrofy – źródło energii – rozkład związków
organicznych, donory elektronów – substancje organiczne
61) Reakcje kataboliczne i anaboliczne.
•
Metabolizm => to ogół procesów biochemicznych zachodzących w organizmach żywych
warunkujących funkcjonowanie i wzrost.
•
ANABOLIZM: obejmuje reakcje biosyntez.
•
KATABOLIZM: reakcje rozkładu związków organicznych i nieorganicznych,
dostarczające zwykle energii.
•
CENTRALNE SZLAKI METABOLICZNE: glikoliza, szlak pentozowy, szlak Entnera-
Doudorffa, cykl Krebsa, pełnią podwójną funkcję => dostarczają dzięki reakcjom degradacji
związków organicznych nie tylko energii, ale także prekursorów niezbędnych do reakcji
szlaków anabolicznych.
62) Represja kataboliczna.
=> nie wiem czy o niej nie napisałam za mało dokładnie :-/
•
REPRESJA: zahamowanie ekspresji genu wskutek dołączenia cząsteczki represora, co
uniemożliwia transkrypcję; np. represja kataboliczna - polega na zahamowaniu ekspresji
3

genów kodujących białko enzymatyczne, katalizujące rozkład substancji pokarmowych, na
skutek wzrostu dostępności innego substratu, którego katabolizm jest bardziej wydajny
energetycznie. Przykładem jest zahamowanie genów operonu laktozowego u pałeczki
okrężnicy w obecności glukozy w pożywce.
•
Podstawowym źródłem węgla dla bakterii jelitowych jest glukoza.
•
Obecność glukozy w podłożu hamuje ekspresję operonów kodujących funkcje związane z
wykorzystaniem innych cukrów: galaktozy, laktozy, arabinozy, maltozy.
•
Jednym z czynników powodujących hamujący wpływ glukozy na wykorzystanie innych
cukrów jest:
◦
długotrwały, przeważnie niecałkowity efekt zahamowania syntezy enzymów biorących
udział w metabolizmie cukrów zwany REPRESJĄ KATABOLICZNĄ: jest to
mechanizm regulatorowy umożliwiający wyłączenie operonu lac przez glukozę obecną
w środowisku bakterii.
•
Zjawisko represji katabolicznej wiąże się bezpośrednio z koniecznością aktywacji
transkrypcji w promotorach operonów uczestniczących w katabolizmie cukrów, których
sekwencje -35 i -10 znacznie odbiegają od sekwencji kanonicznej.
•
W aktywacji tych operonów bierze udział kompleks cykliczny AMP (cAMP) i jego białka
receptorowego CRP zwanego również CAP.
Represja kataboliczna
–
operon laktozowy
• CAP
(ang. catabolite
activator protein) =
CRP
(ang. cAMP receptor
protein) – aktywator
• cAMP
– induktor
• glukoza
– inhibitor cyklazy
adenylanowej (cyklazy AMP)
•
synteza cAMP z ATP jest katalizowana w komórkach bakteryjnych przez cyklaze
adenylanową => przekształca ona ATP w cykliczny ATP.
•
Obecność glukozy w podłożu i transport jej pochodnej glukozofosforanu, do wnętrza wiąże
się ze zmniejszeniem stężenia fosforylowanej , czyli aktywnej formy cyklazy denylanowej,
co znajduje odzwierciedlenie w zmniejszeniu wewnątrzkomórkowego stężenia cAMP.
•
Represja kataboliczna – jej powodem jest „lenistwo” organizmów żywych. Bakterie mając
4

wiele możliwych substancji do metabolizowania wykorzystuje określone, kierując się jak
najmniejszym nakładem energetycznym. Do każdego pożywienia wykorzystują konkretną
reakcję. Bakterie potrafi wyczuć co się dzieje w ich otoczeniu. Potrafi mając do dyspozycji
glukozę i inne cukry wybrać glukozę. Wiąże się to z ekspresji pewnych genów, a tłumieniem
innych. Kluczem do wyżej opisanego procesu jest system fosfotransferazy napędzany przez
PEP. Enzym III występuje w kompleksie z cyklazą adenylową (AC). Póki glukoza
transportowana jest wydajnie do komórki AC jest nieaktywna. W tym czasie na poziomie
DNA operon laktozowy blokowany jest przez represor (kontrola negatywna). Kontrola
pozytywna wiąże się z obecnością białka CAP (CRP) powodującego chętniejsze „siadanie”
polimerazy na promotor. Żeby białko mogło usiąść na promotor musi by w kompleksie z
cAMP – a AC związana z enzymem III nie pozwala na jego syntez. Forma
zdefosforylowana enzymu III może wiązać AC. Brak aktywności AC wiąże się z brakiem
fosforylacji enzymu III. Operon jest blokowany z powodu braku cAMP. Dodatkowo
blokowany jest operator przy pomocy represora. Wyczerpanie zasobów glukozy zmusza do
wykorzystywania alternatywnych źródeł energii. Przy braku glukozy brak przenoszenia
fosforanu z enzymu II na glukoz. Enzym III pozostaje ufosforylowany i przyczynia si do
aktywacji AC. Odbywa się bardzo wydajne przekształcenie ATP w cAMP, które łącząc się z
CAP tworzy kompleks będący pozytywnym sygnałem transkrypcji. Kompleks cAMP-CAP
odpowiada za pozytywną regulację w przypadku następujących operonów E. Coli:
•
lac
•
gal
•
ara
•
mal
•
tra
•
dsd
•
hut
•
his
•
trp
•
ser
64) Oddychanie tlenowe, beztlenowe, fermentacja.
•
Przetwarzanie energii chemicznej => proces biologiczny, w którym ebergia chemiczna
utlenionego substratu organicznego jest przez organizm wykorzystywana do
przeprowadzania endoergicznych reakcji albo przekształcana w energię cieplna,
mechaniczną, świetlną lub elektryczną – nazywamy ODDYCHANIEM.
•
W procesach biologicznych utleniania możemy wyróżnić trzy podstawowe mechanizmy:
1. oddychanie tlenowe – w którym ostatecznym biorcą elektronów jest tlen cząsteczkowy.
2. Oddychanie beztlenowe – w którym ostatecznym biorcą elektronów jest pochodzący z
zewnątrz związek organiczny (np. fumaran) lub utleniony związek nieorganiczny (np.
azotan, siarczan, węglan).
3. Odrębną formą beztlenowego procesu jest – fermentacja, w której część cząsteczki substratu
oddechowego jest utleniona, a cześć – odbierają od niej elektrony – redukowana.
•
ODDYCHANIE TLENOWE = UKŁAD OKSYDO-REDUKCYJNY:
◦
Związki redukujące => oddają elektrony drugiej grupie związków, redukują je.
◦
Druga grupa to związki utleniające, będą je utleniały.
◦
Zdolność do pobierania i oddawania elektronów, wyrażamy tzw. potencjałem oksydo-
5

redukcyjnym (redoks).
◦
Związki o niższym potencjale będą oddawały elektrony sąsiedniemu w szeregu
związkowi o wyższym potencjale.
◦
Związkiem o najwyższym potencjale jest tlen.
◦
Związki, które przekazują elektrony od najbardziej zredukowanego dawcy do
najbardziej utlenionego biorcy elektronów => nazywamy PRZENOŚNIKAMI
ELEKTRONÓW ( z dehydrogenazy: NAD, flawoproteina, ubichinon, cytochromy i
oksydazę cytochromową → tlen)
◦
oddychanie jest procesem katabolicznym, w którym utlenianie związków organicznych
lub nieorganicznych jest sprzężone z syntezą ATP w procesie fosforylacji oksydacyjnej,
zaś końcowym akceptorem elektronów są związki egzogenne.
◦
Energia zawarta w substracie oddechowym jest stopniowo uwalniana w serii
sprzężonych reakcji utleniania-redukcji, którym towarzyszy transport elektronów w
łańcuchu oddechowym, wykorzystanym do wypompowywania protonów na zewnątrz
błony cytoplazmatycznej.
◦
Ponieważ błona jest nieprzepuszczalna dla protonów, powoduje to powstanie siły
protonomotorycznej, która wykorzystywana jest do syntezy ATP, z udziałem syntazy
ATP.
◦
Oddychanie tlenowe daje bakteriom największy zysk energetyczny, bowiem tlen
charakteryzuje się wysokim potencjałem oksydoredukcyjnym.
◦
W obecności tlenu związki organiczne tak jak np. glukoza, są utleniane do CO2 i H2O,
podczas gdy w innych typach oddychania i utlenianie może nie by c całkowite, więc
wydajność ATP staje się mniejsza.
•
ODDYCHANIE BEZTLENOWE:
◦
Bakterie występują w środowiskach pozbawionych tlenu: zalane woda błota, muły
denne zbiorników wodnych lub wnętrze przewodu pokarmowego zwierząt => bakterie
beztlenowe.
◦
Bakterie przeprowadzające procesy oddychania beztlenowego jako ostateczne akceptory
elektronów utlenianie związki mineralne.
◦
Proces wieloetapowy i wyzwala się w nim znacznie więcej energii niż podczas
fermentacji, chociaż mniej niż przy oddychaniu tlenowym.
◦
W beztlenowym oddychaniu bakterii łańcuch oddechowy jest krótszy niż przy
oddychaniu tlenowym.
◦
Ostateczne akceptory elektronów w oddychaniu beztlenowym: azotany, siarczany,
tiosiarczany, węglany, ulegają redukcji do odpowiednich związków.
◦
Niektóre bakterie mogą też wykorzystywać związki organiczne jako ostateczne
akceptory elektronów.
◦
Rodzaje oddychanie beztlenowego:
▪
oddychanie azotanowe
▪
oddychanie siarczanowe
▪
oddychanie siarkowe
▪
CO2 jako akceptor elektronów
▪
oddychanie fumaranowe
▪
wykorzystanie DMSO i TMAO.
•
FERMENTACJA:
◦
Liczne bakterie w warunkach beztlenowych, gdy brak zewnętrznych akceptorów
wodoru, utleniają substrat w swoistym procesie fermentacji.
◦
W fermentacji substrat oddechowy zostaje rozbity i przekształcony, po czym jeden
6
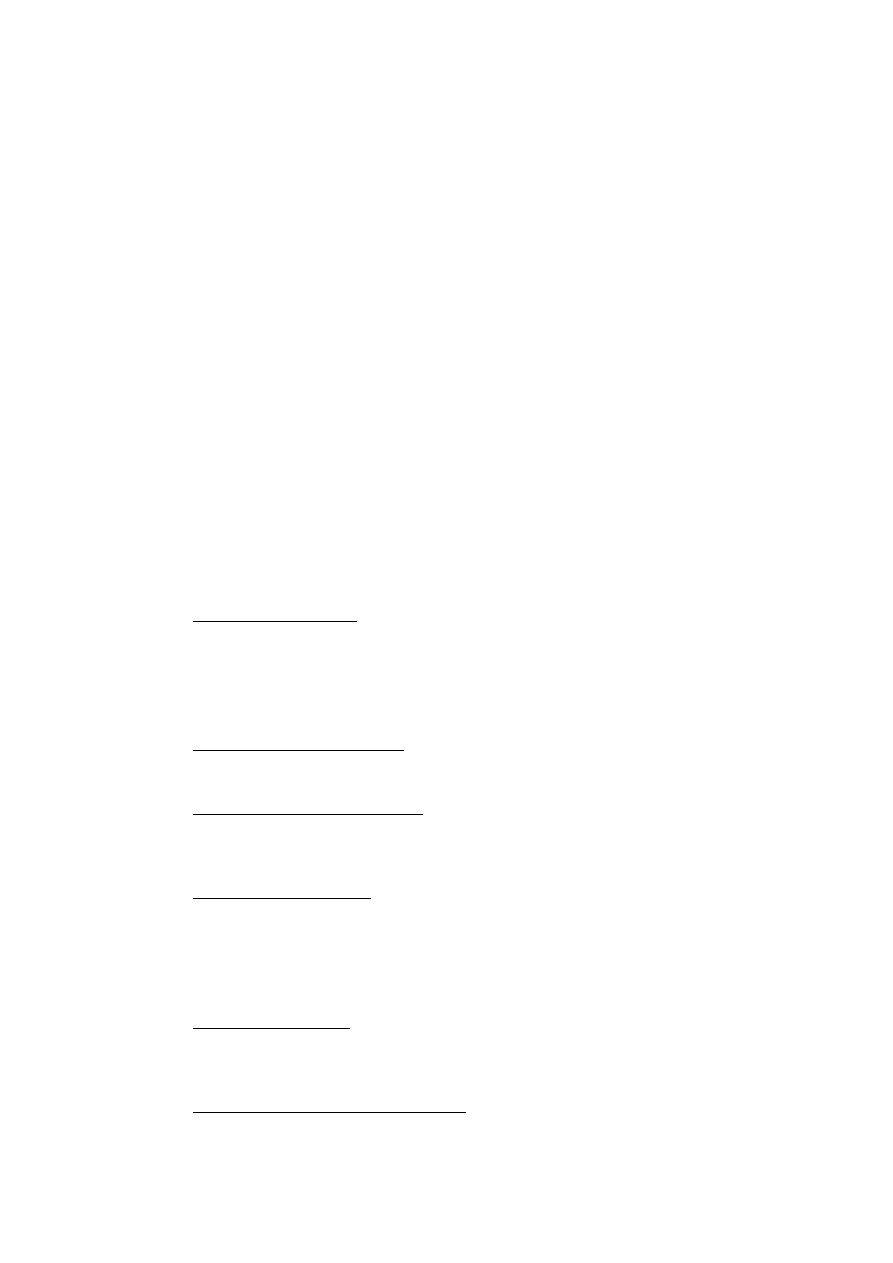
produkt ulega utlenieniu, a drugi redukcji.
◦
Jest to reakcja dysproporcjonacji: C6H12O6 → 2 CH3CH2OH + 2CO2
▪
gdzie przekształceniu cząsteczki substratu towarzyszy wytwarzanie produktów i
bardziej utlenionych i bardziej zredukowanych niż substrat.
◦
Podobny typ reakcji spotykam także w przemianach związków siarkowych u
Desulfovibrio sulfodismutans: S2O3 2- + H2O → SO4 2- + HS- + H+
◦
W przebiegu fermentacji brak etapów pośrednich przenoszeni elektronów.
◦
NAD przenosi elektrony i protony oderwane przez dehydrogenazę od związku
utleniającego wprost na związek organiczny, odgrywający rolę ostatecznego akceptora
wodoru.
◦
Uwalniana jest tylko cześć energii.
◦
Energia i w tym procesie jest odkładana w ATP, ale ten ostatni tworzy się w drodze
fosforylacji substratowej.
◦
Tylko wyjątkowo fermentacja może przebiegać bez wykorzystania fosforylacji
substratowej , kiedy ATP powstaje kosztem energii pompy wodorowej lub sodowej.
◦
Do uzyskania tej samej ilości energii co w oddychaniu tlenowym w czasie fermentacji
bakteria musi zużyć wiele razy większą ilość substratu.
◦
Produkty fermentacji: energia zmagazynowana w ATP, związki organiczne bardziej
zredukowane niż substrat i bardziej utlenione: gazy, CO2, H2, kwasy organiczne.
◦
W fermentacji substrat oddechowy zostaje rozbity i przekształcony, jeden produkt ulega
utlenieniu, a drugi redukcji. W przebiegu fermentacji brak jest produktów pośrednich
przenoszenia elektronów, NAD przenosi elektrony i protony oderwane przez
dehydrogenazę od związku utlenianego wprost na związek organiczny odgrywający rolę
ostatecznego akceptora wodoru. Rodzaje
[skrót z ćwiczeń, dalej będzie bardziej szczegółowy opis :-D]
▪
Fermentacja mlekowa:
•
homofermentacja – właściwa, jedynym produktem jest kwas mlekowy
(Lactobacillus lactis, L.casei, Streptococcus lactis, Streptococcus faecalis)
•
heterofermentacja – oprócz kwasu mlekowego powstaje również etanol
(Lactobacillus plantarum, L. brevis, L.fermentum)
▪
Fermentacja Bifidobacterium
– (jest to beztlenowa pałeczka jelitowa G(+)), powstaje
kwas mlekowy i kwas octowy
▪
Fermentacja Enterobacteriaceae
– Bakterie tej grupy mogą oddychać beztlenowo
fermentując cukry lub wykorzystywać azotany tworząc kwas mlekowy (E. coli,
Salmonella, Shigella)
▪
Fermentacja alkoholowa
– przeprowadzana przez drożdże (Saccharomyces
cerevisiae):
•
Sarcina ventriculi przeprowadza fermentację mieszaną: powstaje etanol, kwas
octowy, CO2 i H2.
•
Zygomonas mobilis – etanol i CO2
▪
Fermentacja masłowa
– przeprowadzana przez bezwzględne beztlenowce jak
Clostridium butylinum, C. pasteurianum. Powstają kwasy: masłowy, bursztynowy,
octowy, oraz etanol, CO2 i H2
▪
Fermentacja acetonowo – butanolowa
– powstaje butanol i aceton. Przeprowadzana
przez Clostridium acetobutylicum i C. butylicum
7
▪
Fermentacja propinowa
– powstaje kwas propinowy, octowy i bursztynowy, oraz
CO2. Przeprowadzana przez Propionibacterium, gramdodatnie pałeczki względnie
tlenowe żyjące w jelicie.
65) Reakcje glikolizy.
•
Glikoliza (zwana tez szlakiem Embdena-Mayerhofa-Parnasa=EMP) jest najbardziej
rozpowszechnionym sposobem rozkładu glukozy.
•
Występuje u organizmów eukariotycznych i prokariotycznych, może zachodzić zarówno w
warunkach tlenowych jaki i beztlenowych.
•
ETAPY:
1. heskokinaza katalizuje przekształcenie glukozy w glukozo-6-fosforan.
2. Fosfofruktokinaza fosforyluje z udziałem ATP fruktozo-6-fosforan do fruktoza-1,6-
bisfosforanu => np. u Propionibacterium freundenreichii, fosforylacja zachodzi z udziałem:
dikinazy pirofosforan:fosfofruktoza, dawcą grupy fosforanowej jest pirofosforan.
3. Aldoza fruktozo-1,6-bisfosforanowa katalizuje rozszczepienie fruktozo-1,6-bisfosforanu do
aldehydu 3-fosfoglicerynowego i fosforanu dihydroksyacetonu →
4. Który w wyniku działania izomerazy zostaje przekształcony w aldehyd 3-fosfoglicerynowy.
5. Utlenienie aldehydu 3-fosfoglicerynowego z udziałem dehydrogenazy i NAD+ jako
akceptora elektronów, dochodzi przy tym do jednoczesnego włączenia fosforanu, w wyniku
czego powstaje 1,3-bisfosfoglicerynian-acylofosforan o wysokim potencjale przenoszenia
grupy fosforanowej.
6. Przenosi on fosforan na ADP (fosforylacja substratowa) w wyniku czego powstaje jedna
cząsteczka ATP i 3-fosfoglicerynian.
7. Który zostaje przekształcony w 2-fosfoglicerynian.
8. A ten po odwodnieniu zostaje przekształcony w fosfoenolopirogronian, związek
charakteryzujący się wysokim potencjałem przenoszenia grupy fosforanowej i powstaje
kolejna cząsteczka ATP oraz pirogronian, końcowy produkt tego szlaku.
8

•
REAKCJA: wchodzi 1 cząsteczka glukozy:
glukoza + 2ADP + 2Pi + 2NAD+ → 2 PIROGRONIAN + 2ATP + 2NADH+ +2H+
•
szlak EMP ma swój udział w metabolizmie energetycznym i dostarcza, także związków
pośrednich do szlaków biosyntez.
•
Glikolizę poprzedza fosforylacja (przyłączenie reszty fosforanowej) i wewnętrzna
przebudowa cząsteczki glukozy, w wyniku czego staje się ona podatna na działanie enzymu
rozszczepiającego ją na 2 cząsteczki cukrów trójwęglowych (trioz).
•
Zyski energetyczny: fosforylacja substratowa: 2 cząsteczki ATP w czasie przekształcenia
aldehydu fosfoglicerynowego w kwas pirogronowy, więc 4 cząsteczki ATP na 1 cząsteczkę
zużytej glukozy.
•
Koszt: wstępne przemiany cukru do fruktoza-1,6-bisfosforanu zużywają 2 cząsteczki ATP,
czyli zyski NETTO to 2 cząsteczko ATP na jedną cząsteczkę glukozy.
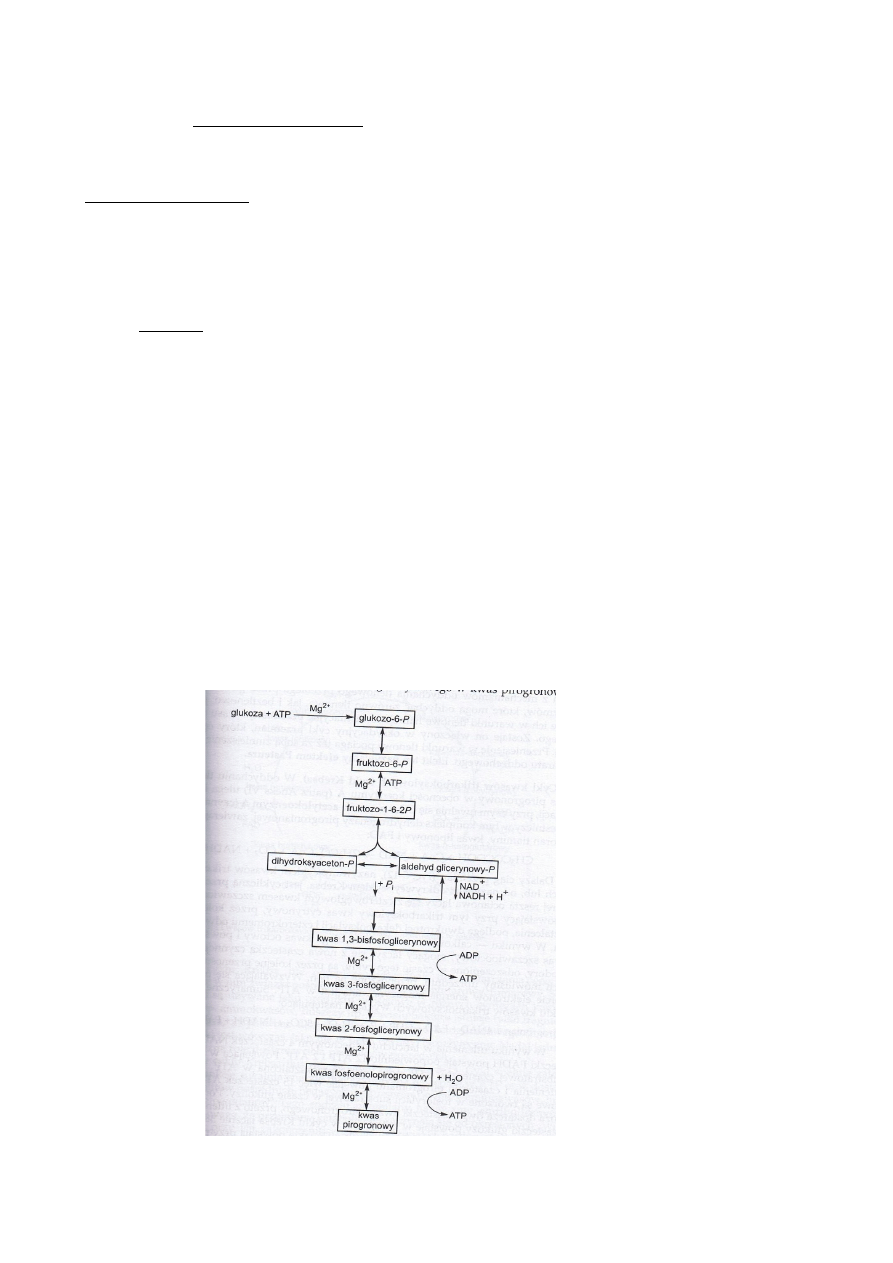
66) Reakcje cyklu kwasów trójkarboksylowych = cykl Krebsa.
•
W oddychaniu tlenowym kwas pirogronowy w obecności koenzymu A ulega
dekarboksylacji, przy czym uwalnia się CO2 i powstaje acetylo-koenzym A => czynny
octan.
•
Uczestniczy w tym kompleks dehydrogenazy pirogronianowej zawierający pirofosforan
tiaminy, kwas liponowy i FAD:
CH3COCOOH + CoA + NAD → CH3CO*CoA + CO2 + NADH2
•
dalszy ciąg przemian to CYKL KREBSA będący cykliczną przemianą, w której reszta
octanowa łączy się z czterowęglowym kwasem szczawiooctowym, a powstający przy tym
trikarboksylowy kwas cytrynowy przez kolejne przekształcania, podlega dwukrotnej
dekarboksylacji i czterokrotnemu odwodorowaniu.
•
Całkowitemu utlenieniu ulega kwas octowy i powstaje znów kwas szczawiooctowy mogący
łączyć się z nowa cząsteczką czynnego octanu.
•
Wodory odszczepione w tym cyklu są przenoszone przez kolejne przenośniki na tlen
•
Wyzwalająca się przy transporcie elektronów energia magazynowana jest w ATP.
•
ETAPY:
1. Wieloenzymatyczny układ zwany dehydrogenazą pirogronianową, utlenia pirogronian z
wytworzeniem CO2 i acetylo-konezymu A, złożonego z koenzymu A połączonego z
octanem wysokoenergetycznym wiązaniem tioestrowym.
2. Acetylo-CoA ulega kondensacji ze szczawiooctanem, reakcja katalizowana przez syntazę
cytrynianową.
3. Powstający cyrtynian jest przekształcany przez akonitazę w izocytrynian.
4. Który jest utleniany przez dehydrogenazę izocytrynianową i NADP (u niektórych bakterii
NAD) do alfa-ketoglutaranu i CO2.
5. Kompleks enzymatyczny dehydrogenaza alfa-ketoglutaranowa prowadzi do oksydacyjnej
dekarboksylacji alfa-ketoglutaranu.
6. Powstaje bursztynylo-CoA, a wolna energia jego wiązania tioestrowego zostaje
wykorzystana do utworzenia, w zależności od bakterii, ATP lub GTP (E. coli) w wyniku
fosforylacji substratowej => E. Coli, reakcję tę katalizuje tiokinaza bursztyninowa, która ma
aktywność zarówno transferazy acylowej jak i kinazy.
7. Powstający bursztynian jest utleniany do fumaranu ( z udziałem FAD i dehydrogenazy
bursztynianowej związanej z błonami).
8. Fumaran w obecności fumarazy ulega hydratacji do jabłczanu.
9. Jabłczan zostanie utleniony przez NAD i dehydrogenazę jabłczanową do szczawiooctanu
(mogący łączyć się z nowa cząsteczką czynnego octanu).
9
•
Enzymy cyklu są zlokalizowane w cytoplazmie.
•
REAKCJA: pirogronian +4 NAD +FAD + GDP + Pi + 2H2O → 3CO2 + 4 NADH + FADH
+ GTP
•
ROLA: dostarczenie energii magazynowanej w ATP, powstają związki pośrednie będące
prekursorami syntezy aminokwasów, lipidów i węglowodanów.
•
U wielu bakterii tylko fragment C.K bez dehydrogenazy kwasu alfa-ketoglutarowego.
•
Koszt: w wyniku jednego obrotu cyklu uwalniają się 2 cząsteczki CO2, redukowane zostają
3 cząsteczki NADP lub NAD i jedna FAD.
•
Zysk: syntetyzowana jest jedna cząsteczka ATP lub GTP w wyniku fosforylacji substratowej
i zregenerowana zostaje jedna cząsteczka szczawiooctanu.
•
Wchodząca do cyklu grupa acetylowa ulega całkowitemu utlenieniu.
•
NADH i FADH2 mogą zostać utlenione w łańcuchu oddechowym, dostarczając ATP w
wyniku fosforylacji oksydacyjnej.
•
U większości bakterii dehydrogenaza izocytrynianowa jest swoista wobec NADP.
10
67) Przebieg przemian cyklu kwasów trójkarboksylowych u bakterii beztlenowych (dokładnie
u
E.
Coli
w warunkach beztlenowych).
[punkt jest niepełny bo nic na ten temat nie mogłam znaleźć, tyle co w
skrypcie było to napisałam, dlatego odnoście E.coli :-(]
•
Gdy bakteria znajdzie się w warunkach, w których brak tlenu cykl Krebsa przebiega
odmiennie i nie można mówić o ciągu reakcji utleniania cytrynianu.
•
Można tu jednak wyróżnić dwa ramiona, przy czym jedno z nich utlenia cytrynian do alfa-
ketoglutaranu (2-oksoglutaranu),
•
A drugie edukuje asparaginian do fumaranu, ten z oklei ulega przemianie w bursztynian i
ostatecznie bursztynylo-CoA
•
pierwsza przemiana katalizowana jest przez liazę, a druga przez dehydrogenazę
asparaginianu.
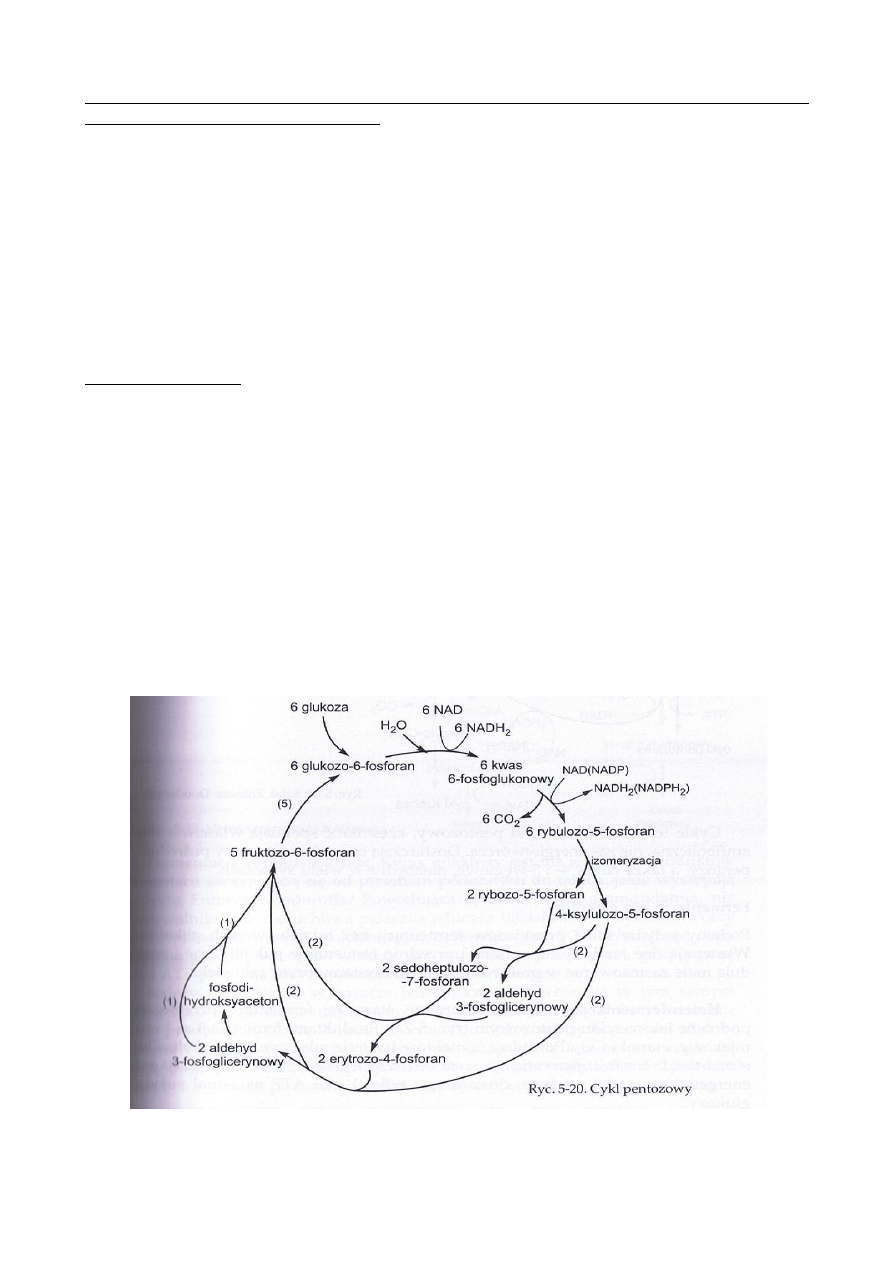
68) Cykl pentozowy.
[ z „Życia bakterii”, bo nie wiedziałam jak dokładnie miał być on zrobiony, w skrypcie jest o nim jedno
zdanie jak co uzupełnię :-)]
•
glukoza podlega tu jednorazowej fosforylacji, tworząc glukozo-6-fosforan.
•
Ten ulega oksydatywnej dehydrogenacji dając, najpierw kwas 6-fosfoglukonowy, a
następnie przez dekarboksylację i kolejną dehydrogenację fosforan pentozy.
•
Dalsze przemiany polegają na łączeniu się i rozłączeniu jednostek cukrowych, przy czym
powstają tu przejściowo cukry siedmiocząsteczkowe = sedoheptuloza, czterowęglowe =
erytroza, trzywęglowe = aldehyd glicerynowy, a w wyniku końcowym, z powrotem glukoza.
•
Z 6 cząsteczek glukozy wchodzących do cyklu, jedna podlega całkowitemu utlenieniu, a 5
regeneruje się i ponownie wchodzi do cyklu.
•
Wydajność energetyczna tego cyklu jest również duża, utlenienie cząsteczki glukozy daje tu
36 cząsteczek ATP.
•
Cykl pentozowy przez związki trójwęglowe (aldehyd glicerynowy) może się łączyć z
cyklem Krebsa.
11
69) Energetyka tych procesów.
[to już było, ale teraz zebrane do kupy :-D]
•
W oksydacyjnej karboksylacji z dwóch cząsteczek pirogronianu, po ich oksydacyjnej
dekarboksylacji otrzymuje się dwie cząsteczki NADH równoważne 6 ATP. Ze spalenia
dwóch cząsteczek octanu otrzymuje si w cyklu Krebsa i łańcuchu oddechowym 24 ATP.
Całkowity zysk oddychania wynosi 38 ATP na cząsteczek glukozy.
<= ze skryptu.
ŁAŃCUCH ODDECHOWY:
•
w wyniku utleniania, 4 cząsteczki NADH i 1 cząsteczka FADH, powstaje odpowiednio 12
ATP i 2 ATP.
•
Powstająca w fosforylacji substratowej cząsteczka GTP może zostać przekształcona w ATP.
•
W wyniku utleniania jednej cząsteczki pirogronianu powstaje, więc 15 cząsteczek ATP, a
dodatkowe są tworzone w fosforylacji substratowej w czasie glikolizy.
CYLK KREBSA:
•
ponieważ glukoza dostarcza 2 cząsteczki kwasu pirogronowego, przeto z utlenienia jednej
cząsteczki glukozy powstaje w glikolizie i cyklu Krebsa 38 cząsteczek ATP.
CYLK PENTOZOWY:
•
Wydajność energetyczna tego cyklu jest również duża, utlenienie cząsteczki glukozy daje tu
36 cząsteczek ATP.
GLIKOLIZA:
•
fosforylacja substratowa: 2 cząsteczki ATP w czasie przekształcenia aldehydu
fosfoglicerynowego w kwas pirogronowy, więc powstają 4 cząsteczki ATP na 1 cząsteczkę
zużytej glukozy.
•
wstępne przemiany cukru do fruktoza-1,6-bisfosforanu zużywają 2 cząsteczki ATP, czyli
zyski NETTO to 2 cząsteczko ATP na jedną cząsteczkę glukozy.
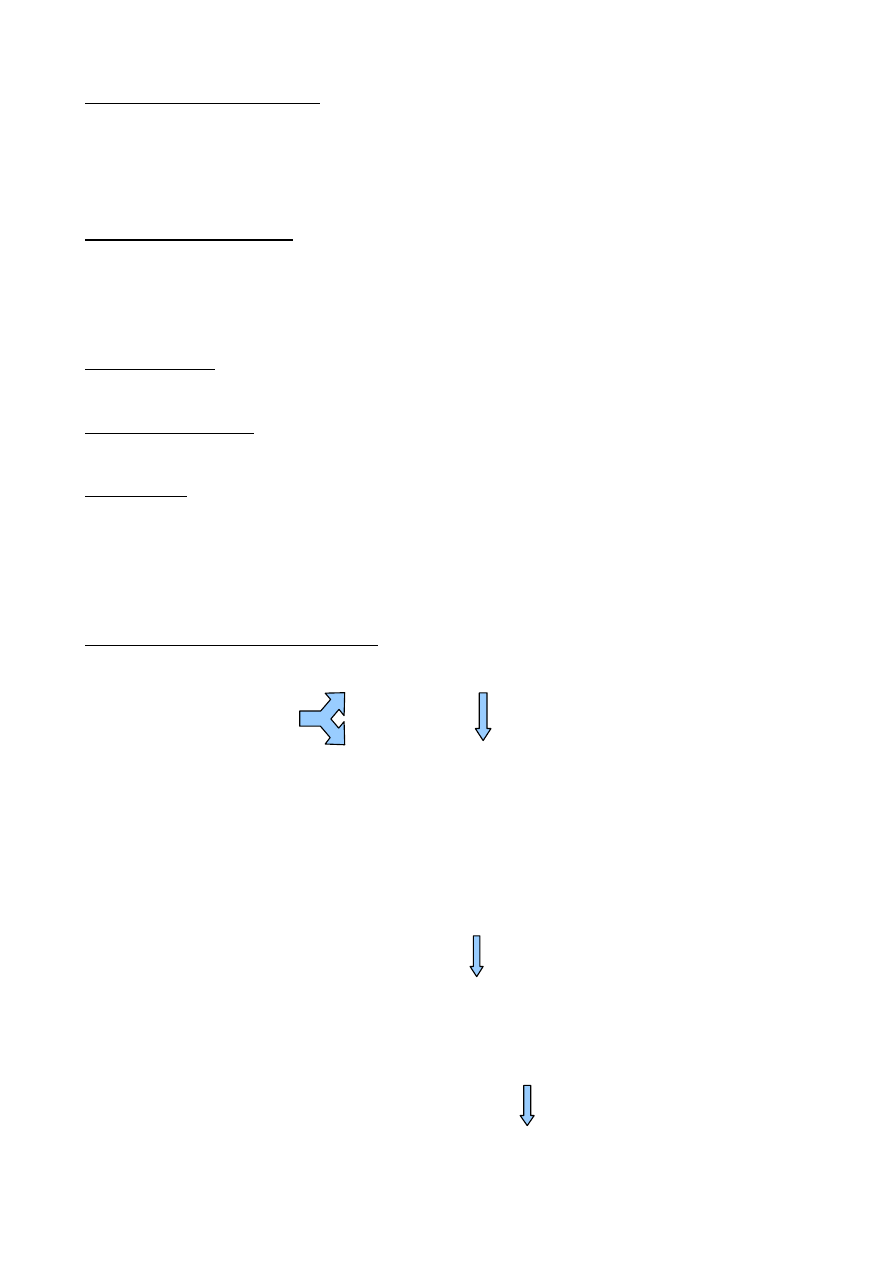
70) Łańcuchy oddechowe (przykłady).
E. Coli – w błonach. warunki tlenowe
cyt b556 → cyt 0
S → NADH → FPiFes → Q O2
oksydazy cytochromowe
cyt b558 → cyt d
warunki mikroaerofilne
w warunkach beztlenowych
+5 2e- +3
NO3- → NO2-
Pseudomonas aeruginosa - dokonuje redukcji azotanu do azotynu przenosząc elektrony z substratu
poprzez:
reduktaza NO3-
S → NADH → FP → cyt b1 → cyt c559 ----------->
azotowa
NO2-
Desulfovibrio desulfuricans - wykorzystując elektrony pochodzące z:
reduktaza
H2 → dehydrogenaza → cyt c3 ---------------------------> SO4 2-
siarczanowa
12

3+ 3- SO3 2-
Przyswajanie azotu: NO2- ----------->NH4 +
reduktaza azotynowa
N2 ----------------> NH4+
nitrogenaza
DODATEK → TYPY ODDYCHANIA
Oddychanie azotanowe (dysymilacja, redukcja azotanów):
1. Amonifikacja azotanów (częściowa redukcja azotanów do
amoniaku):
1 2 3 4
2HNO3 +4H+ -2H2O 2HNO2 +4H-H2O 2HN – OH 4H+ 2HN2OH +2H+ -2H2O 2NH3
rodnik
nitroksylowy
1)reduktaza azotanowa
2)reduktaza azotynowa
3)hydroksylamina
4)reduktaza hydroksylaminy
Akceptorem wodoru i elektronów są azotany. Proces, w którym końcowym produktem jest
amoniak albo jon NH4. Azotany są redukowane do azotyn, które następnie są redukowane do
amoniaku poprzez pośredni rodnik nitroksylowy.
2. Denitryfikacja (całkowita redukcja azotanów do N2, NO, N2O):
NO3 +2e + 2H+ NO2 + H2O
reduktaza azotanowa
dysymilacyjna
NO2 +e + 2H+ NO + H2O
reduktaza azotynowa
2NO +2e + 2H+ N2O + H2O
reduktaza tl.azotu
N2O +2e + 2H+ N2 + H2O
reduktaza podtlenku
azotu
Amonifikacja i denitryfikacja można nazwać redukcją dysymilacyjną azotanu.
Proces denitryfikacji jest niekorzystny w glebach mających stosunki powietrznowodne (dużo
wody i powietrza). Denitryfikacja będzie natomiast korzystna tam gdzie jest przeazotowanie gleby,
ponieważ w procesie denitryfikacji azot z gleby zostaje uwalniany do powietrza. Denitryfikacja jest
wykorzystywana przy oczyszczaniu ścieków, gdzie przez zastosowanie mikroorganizmów następuje
redukcja azotanu i uwalnianie azotu do atmosfery.
3. Denitryfikacja katalizowana przez Thiobacillus denitryficans (bakterie samożywne siarkowe,
utleniają siarkę):
6KNO3 + 2CaCO3 + 5S → 3K2SO4 + 2CO2 + 3N2 + 2CaSO4
13

Oddychanie azotanowe czyli tzw.dysymilacyja redukcja azotanów:
-
końcowym akceptorem wodorów i elektronów są azotany,
-
produkty: azotyny i amoniak lub azotyny, tlenki azotu, azot atmosferyczny
(denitryfikacja),
-
bakterie denitryfikacyjne,
-
względne lub bezwzględne,
Oddychanie siarczanowe:
-
końcowym akceptorem wodoru i elektronów są siarczany lub siarka,
-
produkt: siarczki,
-
bakterie siarczkowe: bezwzględne beztlenowce m. in. Desulfovibrio desufuricans,
Oddychanie węglanowe:
-
końcowym akceptorem wodoru i elektronów są węglany i CO2,
-
produkt: metan
-
bakterie metanogenne: (Archea) Mathanobacterium, Methanococcus,
71) Wytwarzanie ATP, typy fosforylacji.
•
W organizmach żywych energia jest magazynowana w specjalnych związkach organicznych
tzw. związkach wysokoenergetycznych => są to bezwodniki kwasowe lub tioestry,
najważniejszy ATP – adenozyno-5'-trifosforan.
•
W związku tym wstępują wiązania kowalencyjne, ale wolna energia hydrolizy (np.
odłączenia jednej grupy fosforanowej z ATP jest bardzo duża – 30 kJ/ml.
•
Powstawanie ATP jest związane z dołączeniem grupy fosforanowej do ADP, co określa się
terminem fosforylacja.
•
Energia niezbędna do wytwarzania ATP pochodzi z oksydoredukcyjnego (proces fizyczny
lub chemiczny).
Przy wykorzystaniu energii chemicznej dwa podstawowe mechanizmy tworzenia ATP:
1. fosforylacja substratowa => zachodzi w glikolizie i fermentacjach;
•
podczas utleniania fosforanu aldehydu glicerynowego odłączane są 2 elektrony, a
jednocześnie przyłączana jest druga reszta fosforanowa, z wytworzeniem 1,3-bis-
fosfoglicerynianu, zawierającego wiązania wysokoenergetyczne.
2. fosforylacja oksydatywna =>związana z transportem elektronów w łańcuchu
oddechowym;
•
energia wiązania wysokoenergetycznego a ATP pochodzi z procesów utleniania.
•
Procesy te zachodzą w błonie komórkowej u Prokaryota.
•
Przenoszeniu elektronów przez przenośniki towarzyszy przenoszenie jonów wodoru
(protonów).
•
Ponieważ protony są przy tym usuwane na zewnątrz błony, dochodzi do rozdzielenia
ładunków: ujemne pozostają po wewnętrznej stronie błony, a dodatnie H+, gromadzą
się po zewnętrznej stronie błony cytoplazmatycznej,
•
błona cytoplazmatyczna jest nieprzepuszczalna dla H+ i OH-, co prowadzi do
powstanie potencjału elektrycznego w błonie.
•
W tej fosforylacji energia uzyskiwana jest z energii translokacji protonów do wnętrza
komórki, czemu towarzyszy synteza ATP.
WYTWARZANIE ATP:
14

•
do syntezy jednej cząsteczki ATP wymagana jest translokacja 3 protonów
•
reakcje te są katalizowane przez enzym zwany H+-ATPazą.
•
Składa się ona z położonej w błonie cytoplazmatycznej częśći F0 oraz wystających do
cytoplazmy części F1*F0, jest to polimer kilkunastu białek (a, 3b, 10c) o ogólnej masie 160
kDa.
•
Tworzy ona coś w rodzaju kanału, przez który przepychany jest proton.
•
Część F1 to polimer 9 białek (3α , 3β , ɣ ,δ ,ε) o masie 378 kDa.
•
Przypuszczalnie z jej udziałem protony translokowane przez F0 są włączana w reakcje
kondensacji ADP i Pi.
•
Prawdopodobnie w tym samym czasie F1 zmienia konformacje.
•
Syntez ATP można porówna do wodnej elektrowni szczytowo –przepływowej. Podobnie jak
woda w elektrowni protony są pompowane na zewnątrz błony cytoplazmatycznej u bakterii
lub mitochondriów i chloroplastów u Eukaryota, by następnie „wlać się” do środka.
Zjawisko takie określane jako chemiosmoza wykorzystywane jest wtórnie do transportu
aktywnego, a także do produkcji ATP.
•
Kompleks syntazy ATP wykorzystuje gradient stężenia H+ i korzysta z niego przy produkcji
ATP.
•
Przepływ protonów do wnętrza komórki przez kompleks syntazy powoduje syntez ATP w
komórce; gdy ATP-aza rozkłada ATP do ADP oraz Pi protony wypływaj z komórki.
•
S
ynteza ATP jest skutkiem napędzania kompleksu syntazy (wprawiania w ruch jej wirnika
zbudowanego z podjednostek ɣ i ε ) wywołanego napływem H+ do wnętrza komórki przez
specyficzny kanał usytuowany bocznie (a nie jak powszechnie się sądzi – centralnie).
•
Poruszanie się ruchomej części kompleksu jest więc skutkiem gradientu protonów na błonie.
•
Ruchoma tuleja zbudowana z podjednostek określanych jako ɣ i ε i stabilizowana jest
przez tuleję tworzoną przez trzy podjednostki i trzy – 3α , 3β.
•
W obrębie części F1 podjednostki α i β tworzą trzy centra aktywne związane z wiązaniem i
aktywacją substratów oraz wytworzeniem ATP z ADP i Pi.
•
Ruch rotora pod wpływem gradientu protonów jest przeciwny do ruchu wskazówek zegara i
wymusza syntez ATP.
•
Pod wpływem ATP rozkładanego do ADP i Pi rotor obraca się zgodnie z ruchem wskazówek
zegara i towarzyszy temu usuwanie H+ na zewnątrz komórki.
•
Działanie kompleksu syntazy ATP można sprowadzi do dwóch możliwych przemian, a
mianowicie rozkładu i syntezy.
•
Oba procesy zachodzą w komórce w zależności od potrzeb organizmu; np. kompleks
syntazy u Mycoplasma genitalium pozbawiony jest domeny odpowiedzialnej za syntez –
występuje tylko domena o aktywności ATP-azy.
•
Podczas rozkładu ATP łączy się z domen; następuje hydroliza wiązania
wysokoenergetycznego w ATP skutkiem czego powstaje ADP oraz fosforan nieorganiczny i
dochodzi wyzwolenia energii, zużywanej następnie na transport H+ na zewnątrz błony.
15

•
Ruchowi wewnętrznego rdzenia towarzysz duże zmiany w konformacji statora. Syntezie
ATP towarzyszy odwrotna sekwencja zdarzeń – gradient protonów staje się źródłem energii
dla związania fosforanu nieorganicznego do ADP.
•
Konwersja energii na drodze fosforylacji jest bardzo dogodnym sposobem na regulację jej
dostępności dla procesów metabolicznych.
Skład rotora: F1ɣε – F0c10-c14
Skład statora: F1 3α3βδ – F0ab2
72) Przykłady wytwarzanie ATP na drodze fosforylacji substratowej.
[średnio wiem o co tu miało
chodzić, więc napisz tak ogólnie. Trochę o fosforylacjach substratowych jest przy poszczególnych cyklach :-) jeśli to nie to to soryyy
wielkie :-P]
•
Fosforylacja substratowa – reakcja chemiczna, która ma miejsce, gdy reszta fosforanowa
zostanie przeniesiona ze związku ufosforylowanego – substratu – bezpośrednio na ADP
przez enzymy, najczęściej z grupy kinaz. Ten sposób wytwarzania ATP nie wymaga udziału
tlenu i zachodzi np. w glikolizie oraz cyklu Krebsa. Ten sposób wytwarzania ATP jest
ewolucyjnie najstarszy, jednak ilość związków, które mogą wejść w reakcję fosforylacji
substratowej jest ograniczona.
•
Ogólne równinie reakcji: Substrat wysokoenergetyczny(ufosforylowany) + ADP → produkt
niskoenergetyczny + ATP.
•
FOSFORYLACJA SUBSTRATOWA W GLIKOLIZIE: Glikolizę poprzedza fosforylacja
(przyłączenie reszty fosforanowej) i wewnętrzna przebudowa cząsteczki glukozy, w wyniku
czego staje się ona podatna na działanie enzymu rozszczepiającego ją na 2 cząsteczki
cukrów trójwęglowych (trioz).
◦
Utlenienie aldehydu 3-fosfoglicerynowego z udziałem dehydrogenazy i NAD+ jako
akceptora elektronów, dochodzi przy tym do jednoczesnego włączenia fosforanu, w
wyniku czego powstaje 1,3-bisfosfoglicerynian-acylofosforan o wysokim potencjale
przenoszenia grupy fosforanowej. Przenosi on fosforan na ADP (fosforylacja
substratowa) w wyniku czego powstaje jedna cząsteczka ATP i 3-fosfoglicerynian.
•
FOSFORYLACJA SUBSTRATOWA W CYLKU KREBSA: podczas cyklu syntetyzowana
jest jedna cząsteczka ATP lub GTP w wyniku fosforylacji substratowej i zregenerowana
zostaje jedna cząsteczka szczawiooctanu.
◦
Powstaje bursztynylo-CoA, a wolna energia jego wiązania tioestrowego zostaje
wykorzystana do utworzenia, w zależności od bakterii, ATP lub GTP (E. coli) w wyniku
fosforylacji substratowej => E. Coli, reakcję tę katalizuje tiokinaza bursztyninowa,
która ma aktywność zarówno transferazy acylowej jak i kinazy. Powstający bursztynian
jest utleniany do fumaranu ( z udziałem FAD i dehydrogenazy bursztynianowej
związanej z błonami).
73) Wytwarzanie NADH.
[fantazja :-D bo co tu pisać to ja nie wiem]
•
Zredukowany NAD+ (NADH) jest utleniany na kompleksie I łańcucha oddechowego. W
wyniku przenoszenia elektronów przez kolejne elementy łańcucha oddechowego zostaje
wytworzony gradient elektrochemiczny zamieniany przez syntazę ATP na energia
16
zmagazynowaną w ATP.
•
Wytwarzanie NADH zachodzi podczas GLIKOLIZY i są wówczas tworzone 2 cząsteczki
NADH → Utlenienie aldehydu 3-fosfoglicerynowego z udziałem dehydrogenazy i NAD+
jako akceptora elektronów, dochodzi przy tym do jednoczesnego włączenia fosforanu, w
wyniku czego powstaje 1,3-bisfosfoglicerynian-acylofosforan o wysokim potencjale
przenoszenia grupy fosforanowej.
•
W cyklu Krebsa powstają sumarycznie 4 cząsteczki NADH → pierwszy raz na etapie
przekształcenia α-ketoglutaranu przez kompleks dehydrogenazy α-ketoglutaranowej do
bursztynylo-CoA. Drugi raz na etapie końcowym podczas przekształcania jabłczanu przez
dehydrogenaze jabłczanową do szczawiooctanu.
74) Oddychanie tlenowe i beztlenowe u E. Coli.
[zaczynam kochać ta bakterie :-P w skrypcie fajnie opisane, więc
przepisane :-P i nie tylko...]
•
W przypadku E. coli, w zależności od warunków może być realizowany metabolizm
tlenowy w obecności O2, lub beztlenowy – oparty na NO3-, jako ostatecznym akceptorze
elektronów.
•
Oderwane z substratu oddechowego protony są przekazywane za pośrednictwem
dehydrogenaz na związek nieorganiczny (w oddychaniu beztlenowym) lub na związek
organiczny (w oddychaniu tlenowym). Tak więc łańcuchy oddechowe transportują
elektrony, a transportowi temu towarzyszy wyrzut H+ na zewnątrz błony cytoplazmatycznej
prowadzący do jej polaryzacji będącej warunkiem integralności komórki a więc – istnienia.
•
E. coli może realizować dwie zasadnicze strategie podczas oddychania – tlenowy lub
beztlenowy.
•
W przypadku oddychania z obecnością O2 w atmosferze, niezależnie czy są to warunki
wybitnie tlenowe, czy te mikroaerofilne, ostatecznym akceptorem elektronów jest tlen.
•
Droga prowadząca elektrony do tlenu przy znacznej jego ilości przebiega przez NADH,
FPiFeS, Q, cytochrom b556 i cytochrom bo; w warunkach mikroaerofilnych występują inne
cytochromy, a mianowicie cytochrom b558 i cytochrom d.
•
W przypadku E. Coli w zależności od stężenia tlenu może ona wykorzystywać 2 rożne
oksydazy cytochromowe – oksydazę o (duże stężenie O2) lub oksydazę d (małe stężenie
O2).
17

•
W warunkach beztlenowych akceptorem elektronów jest jon azotanowy; ulega on redukcji
do jonu azotynowego w myl równania: NO3- + 2e → NO2-.
•
Zarówno w przypadku oddychania tlenowego jak i beztlenowego elektrony transportowane
są na łańcuch oddechowy zlokalizowany w błonie komórkowej komórek bakterii; bakterie
nie posiadaj struktur takich jak mitochondria typowe dla Eukaryota. Bakterie wbrew temu,
co twierdz niektórzy nie posiadaj mezosomów.
•
Typowy łańcuch transportu elektronów u E. Coli w warunkach dużego stężenie tlenu
wygląda następująco: flawoproteina, białko żelazowo-siarkowe, chinon, cytochromy i
oksydaza cytochromowa => w zależności od warunków środowiska , może być ten
łańcuch rozgałęziony (
schemat poniżej
) i to zarówno w miejscu działania dehydrogenaz jak
i końcowej oksydazy.
•
Jeżeli nie ma tlenu w środowisku E. Coli, podobnie jaki inne warunkowe tlenowce, potrafi
także wykorzystywać inne egzogenne akceptory elektronów, z udziałem różnych oksydaz.
•
Kontrola syntezy tych enzymów zależy w pierwszej kolejności od obecności tlenu, a także
dostępności określonego akceptora.
•
Jeśli w środowisku występują równocześnie określone akceptory, będą one wykorzystywane
w następującej kolejności (korzystnej energetycznie):
tlen>azotan>dimetylosulfotlenek>tlenektrimetyloaminy>fumaran
•
W warunkach beztlenowych, gdy brak jest innych egzogennych akceptorów elektronów, E.
Coli przeprowadza fermentację kwasów mieszanych, w której wykorzystuje endogenne
akceptory, a ATP syntetyzuje podczas fosforylacji substratowej.
[nie pisze o niej, bo nie ma na
rozpisce :-)]
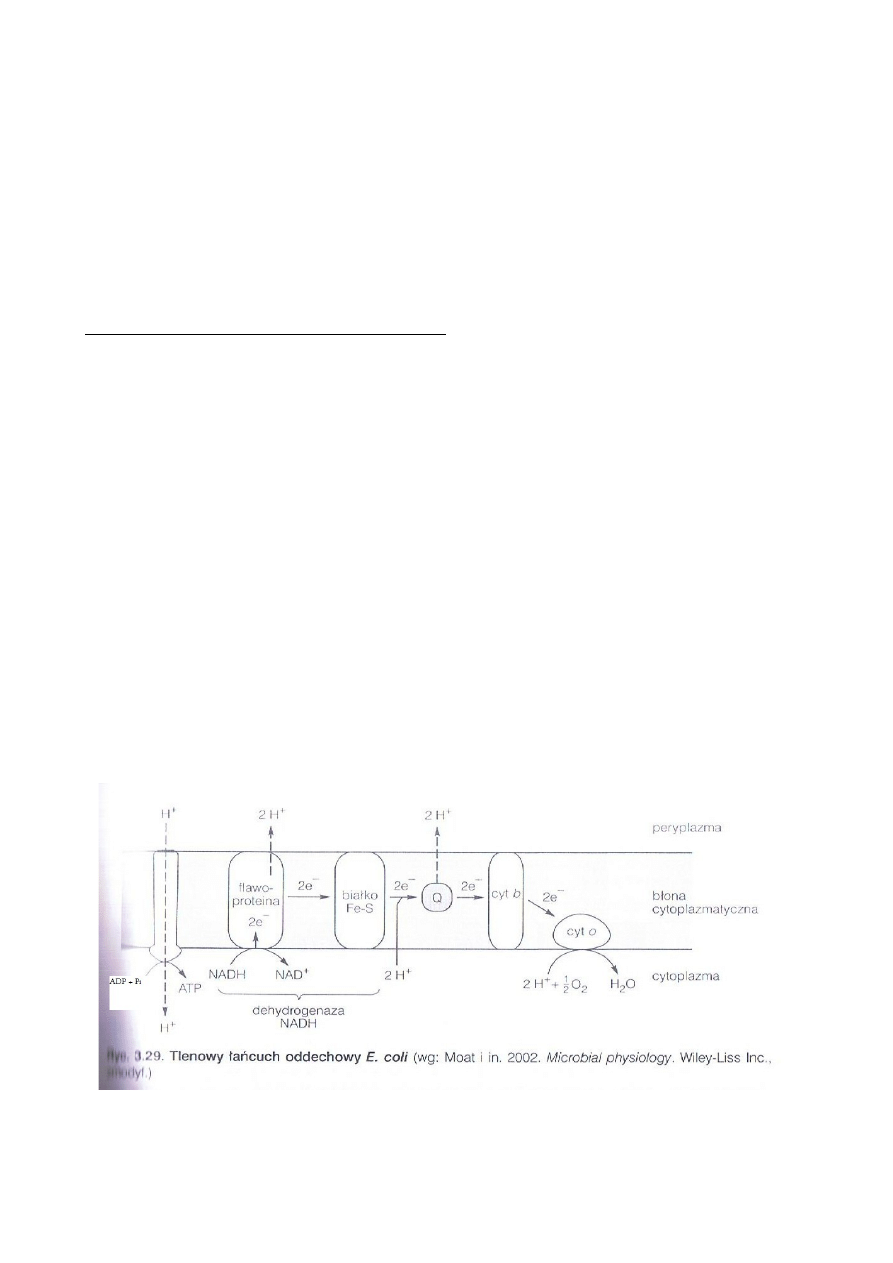
75) Fermentacja mlekowa, etanolowa, octowa.
•
Fermentacja jest zachodzącym w cytoplazmie beztlenowym procesem redoks, w którym
związki organiczne są zarówno donorami, jaki i akceptorami elektronów.
•
Utlenienie związku organicznego (np. cukru, kwasu organicznego) prowadzi do powstania:
◦
związków o wysokim potencjale przenoszenia grupy fosforanowej (takich jak:
bisfosfoglicerynian, fosfoenolopirogronian, acetylofosforan, butylyrofosforan), które są
zdolne do fosforylacji ADP z udziałem odpowiednich kinaz (fosforylacja substratowa).
◦
Związków, które służą jako endogenne akceptory elektronów.
◦
W procesie fermentacji elektrony i protony oderwane od utlenionego substratu są
przenoszone przez NADH wprost na endogenny akceptor: brak jest etapów pośrednich
ich przenoszenie przez łańcuch transportu elektronów, jak to jest w oddychaniu.
◦
ATP powstaje tu w wyniku fosforylacji substratowej, z udziałem odpowiednich kinaz:
a.fosfoglicerynianowej, b.pirogronianowej, c.octanowej, d.maślanowej;
18

a) 1,3-bisfosfoglicerynian + ADP → 3-fosfoglicerynian + ATP
b) fosfoenolopirogronian + ADP → pirogronian + ATP
c) acetylofosforan + ADP → octan + ATP
d) butyrylofosforan + ADP → maślan + ATP
◦
produktami końcowymi fermentacji są różne krótkołańcuchowe kwasy karboksylowe
(mrówczan, octan, mleczan itp.) CO2, H2O, etanol. Glicerol, acetoina, 2,3-butanediol.
•
FERMENTACJA MLEKOWA:
◦
ten typ fermentacji można zaliczyć do fermentacji glikolitycznych.
◦
2 TYPY:
▪
HOMOFERMENTACJA MLEKOWA=WŁAŚCIWA: w tej fermentacji heksozy
są rozkładane w czasie glikolizy do pirogronianu, który słuzy jako końcowy
akceptor elektronów i zostaje przekształcony przez dehydrogenazę mleczanową
zależną od NAD+:
glukoza → 2 pirogronian + NADH + H+ → mleczan + NAD+
Sumarycznie: glukoza + 2ADP + 2Pi → 2 MLECZAN + 2ATP
•
bakterie mlekowe: Lactococcus lactis, Lactobacillus lactis (pałeczka).
▪
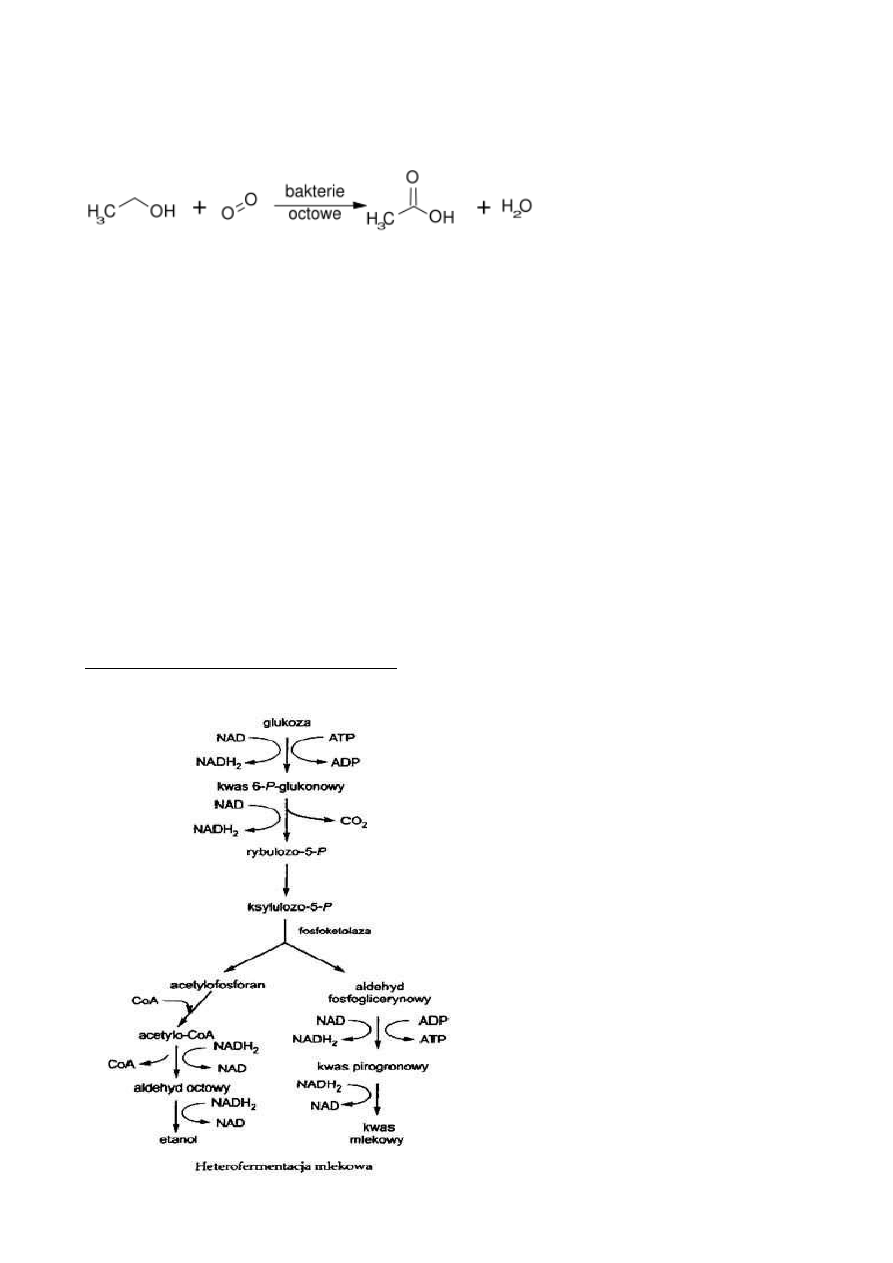
HETEROFERMANTACJA MLEKOWA: w tej fermentacji cukry są rozkładane
do mleczanu I innych produktów.
•
Heksozy po utlenienu w szlaku pentozawym do pentozo-5-fosforanów (powstają
przy tym 2 NADH I 1 CO2) sa przkształcane w ksylulozo-5-fosforan.
•
Związek ten jest rozszcepiany przez fosfoketolazę (z udziałem fosforu
nieorganicznego I pirofosforanu tiaminy), do aldehydu 3-fosfoglicerynowego i
acetylofosforanu.
•
Aldehyd 3-fosfoglicerynowy, w wyniku rekacji takich jak w glikolizie , zostaje
przkształcony w pirogronian, przy czym powstaje ATP I kolejna cząsteczka
NADH.
•
Pirogronian jest akceptorem i zostaje zredukowany do mleczanu, drugiejo już po
CO2, produktu tej fermentacji
•
Dwie cząsteczki NAD+ zostają zregenerwoane w wyniku redukcji
acetylofosforanu (poprzez acetylo-CoA) do etanolu, następnego produktu
fermentacji.
•
Równanie: glukoza + ADP + Pi → mleczan + etanol + CO2 + ATP
•
Lactobacillus brecis, Leuconostoc mesenteroides
•
Często heterofermentacja mlekowa zachodzi w środowisku roślinnym.
▪
FERMENTACJA MLEKOWA TYPU ENTEROBACTERIACEAE:
•
zwana też fermentacją kwasów mieszanych, przeprowadzają ją niektóre
bakterie należące do tej właśnie rodziny: Escherichia, Proteus, Salmonella,
Shigiella.
•
Jej produktami są różne kwasy karboksylowe: octowy, mlekowy, bursztynowy,
mrówkowy.
19
•
Bakterie tej grupy mogą oddychać beztlenowo fermentując cukry lub
wykorzystywać azotany tworząc kwas mlekowy.
•
FERMENTACJA ETANOLOWA:
◦
Przeprowadzają ją głównie grzyby, drożdże np. Saccharomyces cerevisiae, a także
niektóre bakterie z rodzaju Zymomonas.
◦
Drożdże wykorzystują do tego celu glikolizę, natomiast Zymomonas sp. (Zymomonas
mobilis), szlak Entnera-Doudoroffa.
◦
Powstający pirogronian jest przekształcany (z udziałem dekarboksylazy pirogornianowej
zwierającej pirofosforan tiaminy jako koenzym) w aldehyd octowy:
pirogronian + H+ → aldehyd octowy + CO2
◦
jak widać, aldehyd octowy powstaje tu w wyniku dekarboksylacji pirogronianu,
natomiast u bakterii mlekowych – wskutek redukcji acetylo-CoA.
◦
Aldehyd octowy stanowi akceptor elektronów i jest redukowany do etanolu przez
dehydrogenazę alkoholową zależną od NAD:
aldehyd octowy + NADH + H+ → etanol + NAD+
◦
Reakcja sumaryczna fermentacji alkoholowej wygląda następująco:
glukoza + 2Pi + 2 ADP + 2H+ → 2 etanol + 2CO2 + 2ATP+2H2O
◦
Fermentacja etanolowa wykorzystywana jest do pozyskiwania wina, piwa, wódki.
◦
Należy równie pamiętać o udziale fermentacji alkoholowej w produkcji pieczywa;
powstający obok C2H5OH CO2 nadaje strukturze ciasta pulchności.
◦
Etanol przyczynia się do konserwacji napojów, zabezpiecza je przed psuciem się.
•
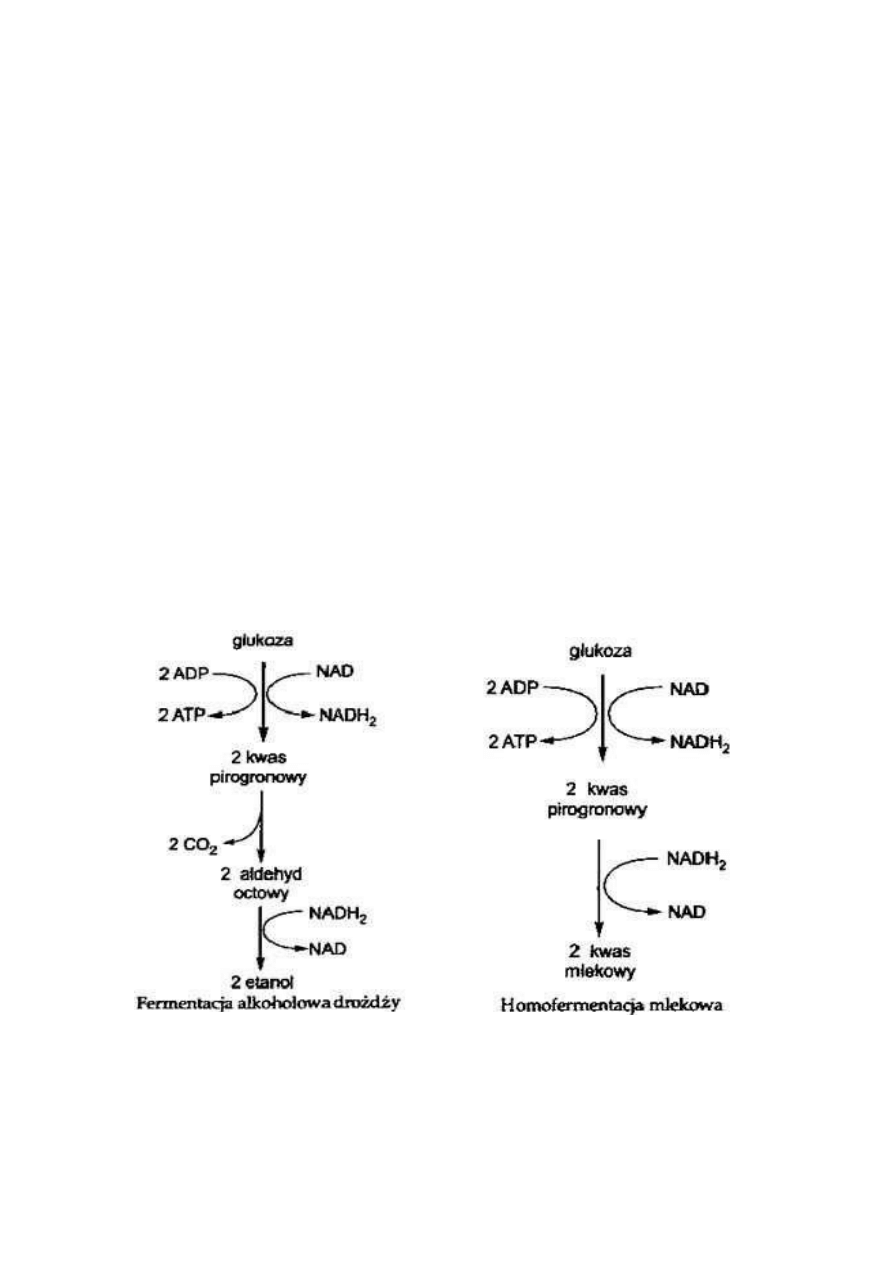
FERMENTACJA OCTOWA:
◦
Fermentacja octowa to metoda otrzymywania kwasu octowego z alkoholu etylowego z
20
wykorzystaniem odpowiednich bakterii. Nie jest procesem właściwej fermentacji, gdyż
zachodzi w warunkach tlenowych, stąd jest pseudofermentacją.
◦
Reakcja fermentacji octowej:
◦
Pod wpływem enzymów wytwarzanych przez bakterie octowe etanol utlenia się z
wykorzystaniem tlenu z powietrza do kwasu octowego z wydzieleniem wody.
◦
Charakterystyka bakterii octowych:
•
należą do rodzaju Acetobacter,
•
Etanol może by utleniany do kwasu octowego, przy udziale bakterii Acetobacter;
pożywką dla tej bakterii jest etanol, a produktem przeprowadzanej przez nie
fermentacji – ocet. Przy produkcji octu wiórki bukowe zalewa się etanolem i
zaszczepia Acetobacter.
•
mają kształt krótkich pałeczek i mogą występować pojedynczo, po dwie lub w łańcuszkach,
•
są ścisłymi tlenowcami, mogą na powierzchni pożywki tworzyć kożuszek,
•
nie mają wysokich wymagań odżywczych,
•
są mezofilami,
•
mają zdolność utleniania alkoholu etylowego do kwasu octowego, co wykorzystywane jest
w przemyśle do produkcji octu.
•
nie wytwarzają przetrwalników.
76) Proces kiszenia kapusty, mechanizm.
[jak łatwo i przyjemnie ukisić se kapuch w domku :-P albo ogóra...:-] ]
•
Kiszenie kapusty i ogórków jest
przykładem
heterofermentacji.
•
Proces ten przebiega w kilku etapach.
•
Pierwszy etap polega na dostarczeniu
pożywki mikroorganizmom. Pożywką tą
jest kapusta (względnie ogórki), którą po
uprzednim szatkowaniu zalewa si 2-3%
roztworem NaCl.
•
Na początku kapustę szczelnie się
przykrywa i dociska.
•
Mikroorganizmy, które biorą udział w
procesie kiszenia pochodzą z
powierzchni samej kapusty, a także z
powietrza.
•
Proces fermentacji mlekowej w
konserwowaniu kapusty zachodzi za
sprawą nie jednego gatunku lecz –wielu.
•
We wstępnej fazie kiszenia można
znaleźć przedstawicieli bakterii
21

mlekowych, bakterii grupy coli, tlenowe bakterie przetrwalnikujące, drożdże.
•
Początkowo pH kiszonki jest bliskie neutralnego, potem zaczyna spada w związku z
gromadzeniem się kwaśnych produktów fermentacji.
•
Obniżające się pH jest w tym przypadku czynnikiem dokonującym selekcji gatunków
bakterii; niektóre bakterie dobrze znoszą zakwaszenie, przy czym wzrost innych jest
zahamowany.
•
Obniżające się pH pozwala na wyeliminowanie z dalszych przemian laktozododatnich
(lac+) bakterii z grupy coli, mogących doprowadza do gnicia substratu, a także stanowić
zagrożenie dla człowieka.
•
To dzięki wzrostowi kwasowości kiszona kapusta, a także inne produkty uzyskane na
drodze fermentacji mają określone walory smakowe i zapachowe; możliwe jest to tylko
dzięki wzrostowi określonych szczepów bakteryjnych.
•
Przykładem bakterii dobrze wzrastającej w niskim pH jest Leuconostoc mesenteroides.
•
Bakterie produkuj różne substancje takie jak kwas mrówkowy, octowy, propionowy,
masłowy, bursztynowy, a także etanol i CO2. Powyższe substancje mogą ze sob reagować
dając w efekcie różne zapachy, odmienne od zapachu substancji wyjściowych (ester ma inny
zapach ni tworzące go kwas i alkohol).
•
Opisane dotychczas przemiany zachodzą we wczesnych etapach kiszenia; mamy z nimi do
czynienia na etapie ogórków małosolnych.
[mniam:-D]
•
Drugi etap przygotowywania kiszonek to właściwa fermentacja mlekowa; jej efekty można
zobaczy, poczuć i posmakować już po 10-16 dniach kiszenia.
•
Za przemiany prowadzące do uzyskania smacznych produktów kiszenia odpowiadaj
głównie: Lactobacillus plantarum (posiada zdolność rozkładu acetoiny), Lactobacillus
brevis.
•
Bakterie te przeprowadzają heterofermentację mlekową, efektem której jest obecność w
kiszonce, prócz kwasu mlekowego, występującego w stężeniu 1,5-1,8%, kwasu octowego
oraz etanolu.
•
Końcowym efektem kiszenia jest pH wynoszące około 3,5. Wysoka kwasowość jest efektem
konserwującym, chroni produkty spożywcze przed psuciem i pozwala na ich długotrwałe
przechowywanie.
•
Podczas omawiania kiszenia nie sposób nie zwróci uwagi na wypieranie jednych bakterii
przez drugie w tym procesie. Jednakże efekt końcowy jest wynikiem oddziaływania nie
jednego gatunku, lecz wielu różnych bakterii. Na powierzchniach kiszonych produktów
mogą pojawiać się charakterystyczne kożuchy. Są to kolonie bakterii tlenowych
preferujących powierzchniowe warstwy kiszonek.
77) Związki prekursorowe.
=> ale o co chodzi to ja nie mam pojęcia, nie wiem czego prekursorowe...?
78) Transport protonów przez błonę cytoplazmatyczną.
•
Zjawisko to można obserwować podczas oddychania – łańcuch oddechowy: energia zawarta
w substracie oddechowym jest stopniowo uwalniana w serii sprzężonych reakcji utleniania-
redukcji, którym towarzyszy transport elektronów w łańcuchu oddechowym, wykorzystany
do wypompowania protonów na zewnątrz błony cytoplazmatycznej.
•
Tak więc, łańcuchy oddechowe transportuj elektrony, a transportowi temu towarzyszy
wyrzut H+ na zewnątrz błony cytoplazmatycznej prowadzący do jej polaryzacji będącej
warunkiem integralności komórki, a więc – istnienia.
•
Przenoszenie protonów przez błonę odbywa się dzięki enzymom obecnym w błonach,
tłoczącym protony z jednej strony na drugą podczas zachodzenia łańcucha transportu
elektronów i określanych nazwą pompy protonowe.
22

•
Ponieważ błona jest nieprzepuszczalna dla protonów, powoduje to powstanie siły
protonomotorycznej, która jest wykorzystywana do syntezy ATP z udziałem syntetazy ATP.
•
Energia uwalniana podczas transportu elektronów w łańcuchu oddechowym zużywana jest
do przenoszenia protonów przez wewnętrzną błonę cytoplazmatyczną. Energia potencjalna
gromadzona jest w postaci gradientu pH i potencjału elektrycznego w poprzek błony.
Zgromadzona w tej formie energia wykorzystywana jest przez kompleks enzymatyczny
syntazy ATP, który pozwala protonom przejść przez błonę zgodnie z gradientem stężeń.
Enzym ten zamienia jednocześnie energię gradientu pH i elektrycznego na energię wiązań
chemicznych ATP, wytwarzanego przez przyłączenie do ADP reszty kwasu
ortofosforowego, czyli reakcji fosforylacji. Niezwykłość reakcji syntezy ATP związana jest
z obracaniem się części enzymu napędzanej przepływającymi protonami, przypominając
działanie silnika elektrycznego. Obrót części enzymu odłącza wytworzoną cząsteczkę ATP.
79) Siła protonomotoryczna i jej znaczenie dla komórki bakteryjnej.
•
Siła protonomotoryczna, źródło energii generowanej przez gradient elektrochemiczny
nierównomiernego rozmieszczenia protonów wokół błony rozdzielającej dwa przedziały
komórkowe, wykorzystywanej u organizmów do podtrzymywania ich procesów
życiowych bezpośrednio lub (najczęściej) za pośrednictwem ATP, do syntezy którego
jest siłą napędową.
•
Podczas transportu elektronów w łańcuchu oddechowym odbywa si pompowanie H+ na
zewnątrz błony komórkowej u bakterii, a u Eukaryota – na zewnątrz błony mitochondriów i
chloroplastów. Skutkiem pompowania jest gradient protonów po obu stronach błony, a co za
tym idzie gradient pH; z tym gradientem wiąże się tzw. siła protonomotoryczna.
Wykorzystywana jest ona do transportu aktywnego, a także do wytwarzania ATP
przez kompleks enzymatyczny stntazy ATP.
•
Ruchy bakterii: Wić bakteryjna nie generuje siły ruchu (jak u wici i rzęsek eukariontów), ale
tylko ją przenosi. Siła napędowa jest wytwarzana przez motor, który jest umiejscowiony w
błonie cytoplazmatycznej (w ciałku podstawowym). ATP nie jest potrzebny do rotacji wici –
źródłem energii dla rotacji jest siła protonomotoryczna istniejąca w poprzek
cytoplazmatycznej błony. Siła rotacji powstaje przez współdziałanie białek motA i motB.
=> znaczenie dla komórki bakteryjnej.
80) System ATPazy, jego znaczenie dla energetyki komórki bakteryjnej.
•
Wszystko dokładnie opisane przy podpunkcie 71. → wytwarzanie ATP, więc nie powtarzam
:-)
DODATEK:
Łańcuch transportu elektronów u prokariotów
W przeciwieństwie do ogólnego podobieństwa w strukturze i działaniu łańcucha oddechowego w
komórkach eukariotycznych, u bakterii i archeanów istnieje o wiele większa różnorodność
enzymów biorących udział w przenoszeniu elektronów. Jako akceptor elektronów może być użyte
wiele substancji chemicznych. Podobnie jak u eukariotów transport elektronów przez kolejne
przenośniki prowadzi do przenoszenia protonów przez błonę i wytwarzania gradientu
elektrochemicznego. Przebieg fosforylacji oksydacyjnej został dobrze poznany na przykładzie
Escherichia coli u bakterii, jednak u archeanów przebieg procesu jest stosunkowo mało poznany.
Główną różnicą w fosforylacji oksydacyjnej pomiędzy komórkami eukariotycznymi a
prokariotycznymi jest używanie przez bakterie i archeany wielu rożnych substancji jako donora lub
23

ostatecznego akceptora elektronów. Pozwala to na wzrost organizmów prokariotycznych w wielu
różnych warunkach środowiska. Na przykład, u E. coli, fosforylacja oksydacyjna może być
napędzana przez liczne pary związków utlenianych i redukowanych, które zostały wymienione w
tabeli. Potencjał redoks obrazuje ile energii uwalniane jest podczas utleniania lub redukcji, dla
redukcji wartość potencjału jest ujemna a dla utleniania wartości są dodatnie
E. coli może do wytwarzania energii metabolicznej używać związki takie jak mrówczany, wodór,
kwas mlekowy jako donory elektronów i azotany, DMSO lub tlen jako akceptory. Wyższy potencjał
redoks oznacza uwolnienie większej ilości energii podczas reakcji. Niezwykłą parę tworzą
bursztynian/fumaran przy których potencjał redoks jest niema równa zeru. Dlatego też przy
utlenianiu bursztynianu konieczny jest silny utleniacz w postaci tlenu lub fumaran może być
zredukowany do bursztynianu przy użyciu silnego reduktora, czyli mrówczanu. Te alternatywne
reakcje są katalizowane przez odpowiednio dehydrogenazę bursztynianu lub reduktazę fumaranu.
Niektóre prokarionty używają par związków o niskim potencjale redoks. Na przykład bakterie
nitryfikacyjne, takie jak Nitrobacter, utleniają azotyny do azotanów, przekazując elektrony na tlen.
Niewielka ilość energii uwalniana podczas reakcji wystarcza do przenoszenia protonów przez błonę
i syntezy ATP, lecz nie wystarcza do wytworzenia NADH lub NADPH niezbędnych do procesów
anabolicznych. Ten problem zostaje rozwiązany dzięki oksydoreduktazie azotynowej, która
wytwarza wystarczająco duża siłę protonomotoryczną, aby wymusić odwrotny przebieg łańcucha
transportu elektronów, powodując wytwarzanie NADH.
Użycie odpowiednich donorów lub akceptorów elektronów przez prokarionty regulowane jest przez
czynniki środowiskowe. Elastyczność procesów metabolicznych jest możliwa dzięki używaniu
przez wielu oksydaz i reduktaz tej samej pulu ubichinonu. Pozwala to wielu zestawom enzymów
współdziałać, poprzez współdzielenie ubichinonu obecnego w błonach jako związku pośredniego.
Łańcuch oddechowy o strukturze modułowej umożliwia łatwą zmianę zestawów enzymów.
Po za metaboliczną różnorodnością, prokarionty posiadają także zestaw izoenzymów – różnych
enzymów, katalizujących te same reakcje. Na przykład, u E. coli występują dwie różne oksydazy
ubichinonu, używające tlenu jako akceptora elektronów. W warunkach dobrej dostępności tlenu
komórka używa oksydazy o niskim powinowactwie do tlenu, która jest zdolna do przeniesienia
dwóch protonów na każdy elektron. Gdy poziom tlenu spadnie komórka przenosi elektrony na tlen
poprzez oksydazę, która nie bierze udziału w wytwarzaniu gradientu elektrochemicznego, jednak
posiada wysokie powinowactwo do tlenu.
Z wikipedii:
[nie wydaje mi się kompletna głupotą i chyba warto przeczytać:-)]
Syntaza ATP, nazywana także kompleksem V, jest ostatnim enzymem biorącym udział w szeregu
reakcji fosforylacji oksydacyjnej. Enzym ten został znaleziony we wszystkich żywych
organizmach, zarówno prokariotycznych, jak i eukariotycznych. Enzym zużywa energię
zgromadzoną w postaci gradientu elektrochemicznego do syntezy ATP z ADP i fosforanu
nieorganicznego (Pi). Do syntezy jednej cząsteczki ATP potrzebne jest przejście przez syntazę od 3
do 4 protonów, w niektórych komórkach ilość protonów może się zmieniać, w zależności od
warunków.
Reakcja fosforylacji jest reakcją odwracalną, a przewaga jednego z kierunków reakcji zależy od siły
protonomotorycznej. Przy braku gradientu protonowego, syntaza ATP przeprowadza reakcję
hydrolizy ATP, przenosząc jednocześnie protony przez błonę. Gdy jednak siła protonomotoryczna
jest odpowiednio duża, zachodzi odwrotna reakcja, protony przepływają zgodnie z gradientem
stężeń, a ADP łączone jest z Pi z wytworzeniem ATP. Bardzo podobny enzym H+-ATPaza obecna w
błonie wakuoli, wywołuje obniżenie pH wnętrza organellum, przenosząc protony i jednocześnie
24

hydrolizując ATP.
Syntaza ATP jest dużym kompleksem, kształtem przypominającym grzyb. U ssaków kompleks
syntazy składa się z 16 podjednostek o łącznej masie około 600 kDa. Domena będąca białkiem
błonowym określana jest nazwą Fo i zawiera pierścień zbudowany z podjednostek c oraz kanał
jonowy. Trzon wraz z przytwierdzoną do niego częścią kulistą, określany jest nazwą F1, jest
miejscem syntezy ATP. Domena F1 składa się z sześciu podjednostek, należących do dwóch grup:
trzech podjednostek α i trzech podjednostek β. Trzon łączący część kulista z domeną błonową
zawiera tylko jedną podjednostkę γ. Podjednostki α i β wiążą nukleotydy, jednak tylko
podjednostka β katalizuje reakcję syntezy ATP. Wystająca z domeny F1, skierowany w stronę błony,
to przypominająca pręt podjednostka kotwicząca zespół podjednostek α i β w głównej części
kompleksu.
Protony przepływając przez kanał jonowy domeny Fo powodują obracanie się zestawu
podjednostek c. Obroty prawdopodobnie powodowane są zmianami w jonizacji aminokwasów w
pierścieniu podjednostek c, co wywołuje zmiany elektrostatyczne , które napędzają pierścień
podjednostek c przy kanale jonowym. Obroty pierścienia przenoszone są przez, tworzącą oś,
podjednostkę γ do wnętrza podjednostek α i β, które nie mogą się obracać ze względu na tworzącą
stojan długa podjednostkę w kształcie pręta. Ruch obrotowy podjednostki γ wewnątrz kulistej
struktury podjednostek α i β dostarcza energii do centrów aktywnych na podjednostkach β,
powodując oderwanie cząsteczek ATP.
Mechanizm syntezy ATP. ATP zaznaczono kolorem czerwonym, ADP i fosforan różowym, a
obracającą się podjednostkę γ kolorem czarny.
Reakcja syntezy ATP zachodzi dzięki mechanizmowi zmian konformacyjnych, centrum aktywne
podjednostki β występuje w dwóch cyklicznie zmieniających się stanach. W stanie pierwszym jest
otwarte i może przyłączyć cząsteczkę ADP i Pi. Gdy oba substraty zostaną przyłączone białko
zmienia kształt, powodując połączenie cząsteczek. Powstała cząsteczka ATP ma wysokie
powinowactwo do enzymu i jest z nim silnie związana. Ostatni etap polega na powrocie enzymu do
stanu pierwszego, centrum aktywne otwiera się, uwalniając cząsteczkę ATP i pozostając otwarte dla
kolejnych substratów. Synteza ATP nie wymaga dostarczenia energii. Energia obrotów podjednostki
γ konieczna jest do oderwania wytworzonej cząsteczki ATP (otwarcia centrum aktywnego).
U części bakterii i archeanów, synteza ATP napędzana jest nie przepływem protonów przez błonę
komórkową, lecz jonów sodowych. Archenany takie jak Methanococcus posiadają także syntazę
A1Ao, formę enzymu o niewielkim podobieństwie sekwencji aminokwasów do białek syntazy ATP
obecnych u pozostałych bakterii i komórek eukariotycznych. Prawdopodobnie u części gatunków
forma syntazy A1Ao napędzana jest jonami sodu, jednak jest możliwe, że jest tak u wszystkich
organizmów z tą postacią enzymu.
81) Charakterystyka bakterii fotosyntetyzujących.
•
Wszystkie bakterie fotosyntetyzujące, nawet bezwzględne autotrofy, mogą asymilować
związki organiczne.
•
Pobieranie związków organicznych może u nich zaspokoić 10% zapotrzebowania na węgiel.
•
Oba procesy, asymilacja CO2 oraz pobieranie związków organicznych może zachodzić w
komórce jednocześnie.
•
Są to, poza sinicami = cyjanobakteriamini, Prochlorales, beztlenowce wymagające w
podłożu obecności swoistych dawców elektronów np. zredukowane związki siarki.
•
Nieco odmienna budowa chlorofilu oraz organelli fotosyntetycznych wymaga stosunkowo
słabszego naświetlania, przy czym światło absorbowane charakteryzuje się dłuższą falą niż
25

u roślin.
•
Bakterie fotosyntetyzujące dzielimy na: sinice i Prochlorales, bakterie zielone
(Chlorobiaceae, Chloroflexaceae) oraz purpurowe bakterie bezsiarkowe
(Rhodospirillaceac).
•
SINICE (CYJANOBAKTERIE Cyanobacteria, Cyanophyta, Schizophyta ):
◦
zawierają chlorofil a
◦
zamiast chlorofilu b występują u nich fikobiliny (zwykle fikocyjanina, rzadziej
fikoerytryna)
◦
wszystkie wiążą CO2 w cyklu Calvina; nie mają pełnego cyklu Krebsa, który pełni u
nich tylko rolę anapleurotyczną, część z nich wiąże N2.
◦
Dzielimy je na: Chroococcales, Pleutocapsales, Oscillatoriales, Nostocales,
Stogonematales.
[coś więcej o tych grupach „Życie bakterii str. 202]
◦
są pospolite często występują w wodach słodkich i morzach, a także w glebie i na
wilgotnych skałach.
◦
Powodują coroczne zakwity wód „glonowe”
◦
nitkowate sinice w płytkich, przybrzeżnych wodach jeziorni mórz tworzą duże,
warstwowo ułożone zbiorowiska wzrostu => stromatolity.
◦
Czynności życiowe:
▪
Sinice to w większości organizmy samożywne, mające zdolność wytwarzania
związków organicznych na drodze fotosyntezy.
▪
Niektóre sinice mają zdolność asymilacji azotu atmosferycznego. Asymilacja jest
możliwa dzięki tzw. heterocystom, tj. komórkom otoczonym grubą ścianą
komórkową i posiadającym uwsteczniony aparat fotosyntetyczny (brak produkcji
tlenu). W takich warunkach nitrogenaza (enzym asymilujący azot) może działać
poprawnie. Związany azot przesyłany jest przez tzw. plasmodesmy (łączenie
heterocysty z protoplastami sąsiadujących komórek).
▪
Zdolności te sprawiają, że sinice mogą być organizmami pionierskimi. Można je
spotkać w prawie każdym środowisku na Ziemi, są odporne na długotrwałe susze
czy wysokie temperatury gorących źródeł, a nawet wysokie zasolenie czy
kwasowość podłoża. Do termofili należą m.in. Mastigocladus laminosus,
Oscillatoria filiformis, Phormidium laminosum, Synechococcus lividus.
▪
Sinice współżyją również z roślinami bądź jako epifity, bądź jako endofity
(Anabaena azollae w paproci Azolla) jak i ze zwierzętami i protistami (w Paulinella
chromatophora). Endosymbiotyczne sinice nazywane są cyjanellami, a cały
organizm cyjanomem. Niektóre gatunki współtworzą porosty.
▪
Sinice mają budowę prokariotyczną.
▪
W peryferyjnej części komórki znajdują się tylakoidy, które zawierają tylko chlorofil
a. Występują w nich również inne barwniki takie jak: niebieska fikocyjanina,
czerwona fikoerytryna, żółty karoten.
▪
Barwników zazwyczaj jest więcej niż chlorofilu a toteż sinice mają
charakterystyczne sino-zielone zabarwienie.
26

▪
Produktem asymilacji jest skrobia zwana skrobią sinicową. Jako ciekawostkę można
dodać że nieliczne gatunki sinic nie posiadają barwników asymilacyjnych – są
heterotrofami.
▪
Materiał genetyczny zlokalizowany jest w nukleoidzie. W budowie wyróżnia się
ścianę komórkową (delikatną), a na zewnątrz błonę zewnętrzną jak u innych bakterii
Gram-ujemnych. Dookoła zewnętrznej błony komórkowej wytwarzane są grube
pochwy śluzowe.
▪
Liczne sinice tworzą kolonie bądź w postaci nieregularnych skupień, bądź nici.
Wyróżnia się dwa typy nici sinicowych:
•
typ pleurokapsalny – nić zbudowana jest z komórek otoczonych całkowicie
ścianą komórkową.
•
typ trychomowy – wszystkie komórki sinic tkwią w wspólnej ścianie
komórkowej.
•
BAKTERIE ZIELONE:
Chlorobiaceae:
◦
drobne, krótkie, owalne pałeczki (0,7-0,9x 1,5 μm ).
◦
nieruchliwe i nieprzetrwalnikujące.
◦
bezwzględnie beztlenowe, niezdolne do oddychania, bezwzględnie autroficzne.
◦
zawierają chlorofil o typie Chlorobium.
◦
Niektóre tworzą charakterystyczne skupienia komórkowe: nieruchliwe pałeczki
Chlorobium: Clathrochloris – pałeczki zawierające siarkę, tworzące skupienia
komórkowe; Pelodictyon – nieruchliwe, rozgałęzione pałeczki ułożone jak sieć, brak
siarki.
◦
Donorem elektronów redukujących są siarkowodór, tiosiarczan i wodór.
Prawdopodobnie również kwasy organiczne takie jak mlekowy, octowy, propionowy,
◦
Są zdolne również do wiązania azotu atmosferycznego.
Chloroflexaceae:
◦
przedstawicielem jest nitkowata, pełzająca bakteria zielona: Chloroflexus aurantaicus.
◦
Może także rosnąc jako heterotrof w warunkach tlenowych i w ciemności.
◦
Należą tu także grube, pełzające nitkowate bakterie: Oscillochloris i Chloronema.
Heliobacteriaceae:
◦
brązowozielone anoksygenne fototrofy,
◦
tylko u nich spotykany bakteriochlorofil g.
◦
beztlenowo rosną fototroficznie i nie oddychają; są względnymi autotrofami, zużywając
do wzrostu heterotroficznego tylko mleczany i pirogroniany.
◦
Należą tu: Heliobacterium – pełzające pałeczki oraz Heliobacillus – urzęsiona.
◦
Dwa gatunki Heliobacterium tworzą endospory.
◦
Mają 16S rRNA podobnego do Clostridium.
27

BAKTERIE PURPUROWE:
•
Purpurowe bakterie siarkowe:
◦
Chromatiaceae, należą tu bakterie o niejednolitej przynależności systematycznej:
Chromatium – bez wakuoli gazowych, zawierają siarkę w komórce. Thiospirilium –
spiralne pałeczki. Thiocapsa i Thiopolycoccus – kuliste, polarni urzęsione.
Ectothiorhodospira – spiralna komórka, polarnie urzęsiona, gromadząca siarkę
pozakomórkowo. Lamprobacter – pałeczki wyposażone w wakuole gazowe.
Lamprocystis – kuliste, urzęsione komórki. Thiodictyon – nieruchliwe pałeczki,
stykające się ze sobą.
◦
Bakterie te zawierają bakteriochlorofil i karotenoidy.
◦
Są to beztlenowce, prawie wszystkie poruszają się za pomocą polarnie umieszczonych
rzęsek.
◦
Donorem elektronów są dla nich siarkowodór, siarka i wodór.
◦
Przy dużej zawartości siarkowodoru w podłożu utleniają go jedynie do siarki, często
gromadzą ją wewnątrzkomórkowo, w postaci kropelek.
◦
Donorami wodoru mogą być także kwasy organiczne => ilości dwutlenku węgla
wydalana w czasie fotosyntezy może być większa niż asymilowana.
◦
Purpurowe bakterie siarkowe mogą wykorzystywać więc niektóre związki organiczne,
jednak nie jako budulec, a jedynie donory wodoru dla procesu fotosyntezy.
◦
Głównym źródłem ich pożywienia jest nadal CO2, a źródłem energii – promieniowanie
świetlne.
◦
Są zdolne do wiązania N2.
•
Purpurowe bakterie bezsiarkowe:
◦
Rhodospirillaceae: Gram-ujemne, nieprzetrwalnikujące, ruchliwe formy, zaopatrzone w
biegunowo ułożone rzęski.
◦
Rhodomicrobium vannielli – bakterie te mają bakteriochlorofil i karotenoidy, mogą się
odżywiać autotroficznie lub heterotroficznie, gdy rosną w obecności tlenu (przy braku
światła), jako donory wodoru wykorzystują różne związki organiczne.
◦
Niektóre wykorzystują siarkę, siarkowodór i wodór do przeprowadzania fotosyntezy.
◦
Związek organiczny (alkohol) ulega przy tym tylko częściowemu utlenieniu ( do
kwasu).
◦
Można te bakterie hodować jako fototrofy na świetle i beztlenowo lun jako typowe
heterotrofy w ciemności i w obecności tlenu.
◦
Są zdolne w określonych warunkach do asymilowania pewnej ilości CO2 nawet w
ciemności. Proces ten zachodzi tylko w obecności tlenu i octanu => koszt energii
utleniania octanu.
◦
Bakterie purpurowe bezsiarkowe, hodowane na świetle w atmosferze CO2 i kwasów
organicznych, wydzielają dużą ilość wodoru.
◦
Wydzielanie wodoru jest hamowane przez azot.
◦
Mają zdolność wiązania azotu atmosferycznego.
28
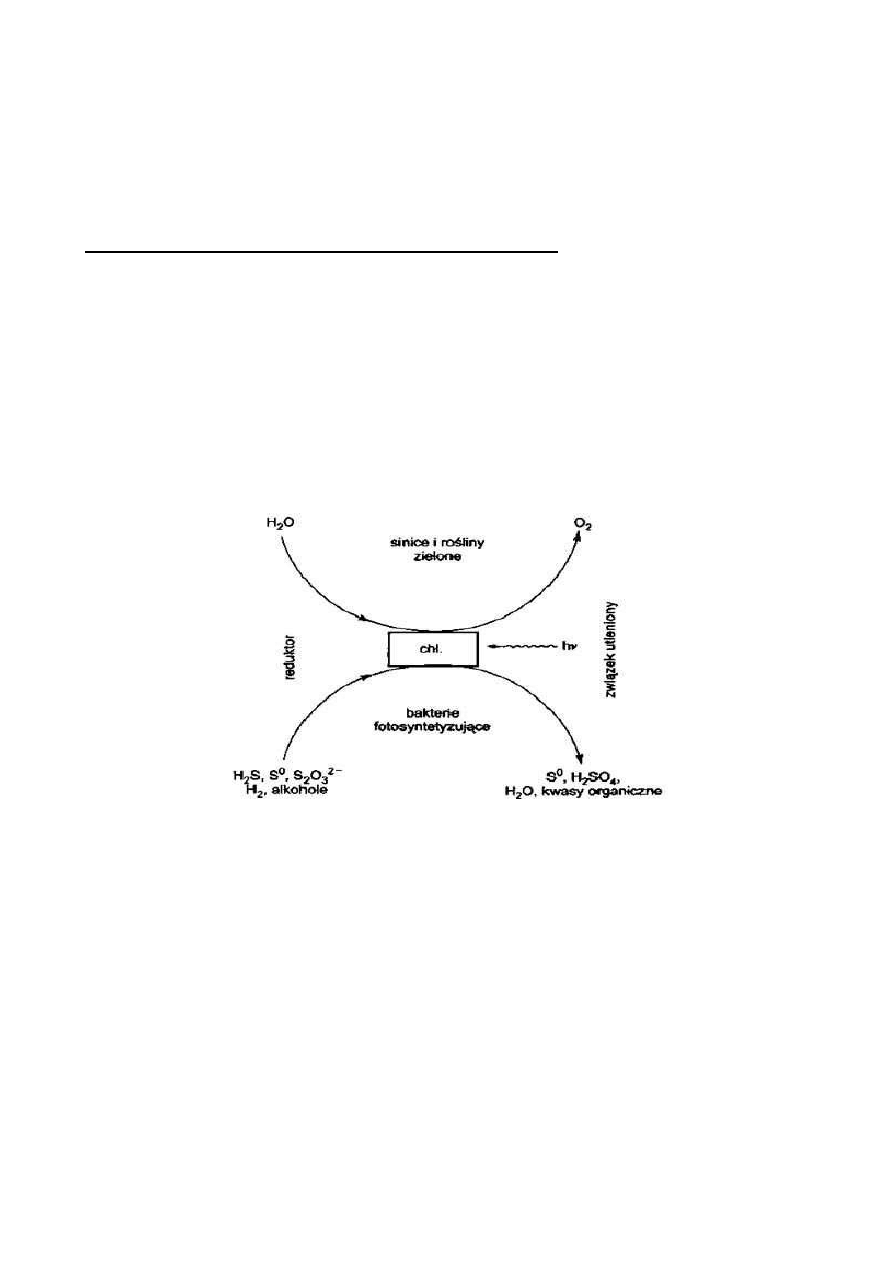
REAKCJE SUMARYCZNE DLA WSZYSTKICH BAKTERII:
CO2 + 2H2S → (CH2O) + 2S + 2H2O
3CO2 + 2S + 5H20 → 3(CH2O) + 2H2SO4
2CO2 + Na2S2O3 + 3H2O → 2(CH2O) + Na2SO4 + H2SO4
CO2 + 2H2 → (CH2O) + H2O
82) Fotosynteza bakterii i roślin/sinic, różnice i podobieństwa.
=> ze skryptu :-)
•
Bakteryjne organizmy fotosyntetyzujące „boją się” powietrza.
•
Żyją w zbiornikach wodnych, gdzie szukaj miejsc z małą ilością tlenu a jednocześnie takich,
gdzie dociera jeszcze światło. Powyższe wymogi spełniaj płytkie zbiorniki z dużą
zawartością różnych substancji w stanie rozkładu.
•
Procesy fotosyntezy bakteryjnej są beztlenowe, nie ma tu miejsca na tlen. Dla
fotosyntetyzujących organizmów bakteryjnych tlen jest substancją toksyczną stąd – w
przeciwieństwie do sinic i roślin zielonych wykorzystujących H2O – jako donor elektronów
wykorzystuj one H2S.
•
Ogólnie wzór fotosyntezy sinic i roślin zielonych przedstawia się następująco:
6CO2 + 12H2O --> C6H12O6 + 6H2O + 6O2.
•
Prochlorales jest zieloną bakterią siarkową wykorzystującą jako źródło elektronów
siarkowodór. Jon siarczkowy jest utleniany, a w konsekwencji powstaje siarka odkładana w
cytoplazmie. Przebieg fotosyntezy z wykorzystaniem siarkowodoru obrazuje poniższe
równanie: 6CO2 + 12H2S C6H12O6 + 6H2O + 12S
Porównanie fotoredukcji u roślin/sinic i bakterii:
•
Bakterie posiadaj bakteriochlorofil przypominający bardzo chlorofil roślin
.
•
Różnice występujące w budowie są nieznaczne, ale na tyle duże by spowodować
zauważalne różnice w widmie absorpcji obu.
•
U bakterii siarkowych zielonych maksimum absorpcji przesunięta jest powyżej 700 nm, a u
bakterii purpurowych mamy do czynienia ze znacznym przesunięciem maksimum absorpcji
do wartości około 900 nm.
•
Wykorzystanie innych niż woda donatorów protonów prowadzi do określonych
29

konsekwencji. Efektem utleniania H2S jest siarka. Jeżeli dawcą protonów jest siarka
powstają siarczany, a jeżeli alkohole – kwasy organiczne.
•
Fotosyntez umownie dzieli się na fazę świetlną, w której produkowana jest siła redukcyjna
w postaci NADPH i ATP, a także na faz ciemn (cykl Calvina- Bensona), w której zachodzi
redukcja CO2 do związków organicznych.
•
Podział obu faz ma zastosowanie czysto teoretyczne, bowiem w rzeczywistości oba typy
przemian pozostają w ścisłej od siebie zależności.
•
Ważną cechą różniącą rośliny zielone od bakterii zdolnych do fotosyntezy jest to, że
bakterie posiadają system barwników fotosyntetycznie aktywnych wbudowany w błony
cytoplazmatyczne.
•
Rośliny zielone posiadają dwa fotosystemy skonstruowane tak, że tworzą regularne,
powtarzalne układy w tylakoidach chloroplastów. Taka konstrukcja aparatu
fotosyntetycznego pozwala na uzyskiwanie znacznych ilości związków
wysokoenergetycznych stanowiących składnik tzw. siły redukującej.
•
Fotosystem PS II wykorzystuje jako źródło elektronów cząsteczki H2O, zaś fotosystem PS I
korzysta z elektronów płynących z PS II.
•
U roślin elektrony z PS I idą na NADP+ i dokonują jego redukcji do NADPH.
•
Przepływ elektronów przez szereg przenośników powoduje, że równocześnie odbywa się
transport H+ na zewnątrz błony tylakoidów.
•
Powstały gradient protonów po obu stronach błony tylakoidów służy napędzaniu syntezy
ATP. Synteza ATP odbywa się przy udziale kompleksu syntazy ATP.
•
Bakterie posiadają tylko jeden fotosystem – brak im fotosystemu odpowiadającego PS I u
roślin.
•
Niesie to określone konsekwencje, a mianowicie brak możliwości wytwarzania w prosty
sposób NAD(P)H. Istnieje natomiast możliwość produkcji znacznych ilości ATP w procesie
fosforylacji cyklicznej.
•
ATP powstaje w taki sam sposób jak przy oddychaniu – siłą napędową jest powstający
gradient H+.
•
Metod na obejście braku bezpośredniej syntezy NAD(P)H jest wykorzystywanie do
produkcji zredukowanego nukleotydu energii zgromadzonej w ATP.
•
O ile rośliny korzystają ze stosunkowo mało kosztownej strategii pobierania protonów z
H2O, o tyle sposób wytworzenia siły redukującej u bakterii jest przedsięwzięciem
kosztownym i wiąże się z wydatkiem energetycznym równym rozpadowi dwóch cząsteczek
ATP do ADP w przeliczeniu na każde dwa przenoszone elektrony; bowiem elektrony w celu
wytworzenia NADPH są transportowane przez przenośniki uszeregowane odwrotnie niż
zwykle, a mianowicie zgodnie ze spadkiem potencjału redoks – od „+” do „–”, a więc ze
spadającym powinowactwem do elektronów.
•
Pojawia się odwrócenie normalnego stanu – elektrony muszą przepływać w przeciwnym
kierunku („pod prąd”) wbrew naturalnym skłonnościom, a to wymaga dużego nakładu
energii.
•
Podobny mechanizm wytwarzania siły redukującej występuje u bakterii
chemosyntetyzujących z rodzajów Nitrosomonas i Nitrobacter.
WYTWARZANIE ENERGII → FOTOFOSFORYLACJA mechanizm:
[opis bardziej dokładny z
książki, wydaje mi się, że istotny, ale nie ujęty w skrypcie ze względu na ufność w naszą biochemiczną wiedzę :-)]
•
Kwant światła padając na chlorofil wzbudza cząsteczkę i przeprowadza elektron osłony w
stan migracji.
•
Elektron taki może się przyłączyć do każdego akceptora o dostatecznie silnej wyrażonej
zdolności przyjmowanie elektronu.
30

•
W chloroplastach i chromatoforach elektrony mogą być przenoszone na pośrednie
przenośniki, aż do końcowego akceptora.
•
Temu przepływowi towarzyszy wyzwalanie energii, zmagazynowanej w ATP.
•
Układ chlorofilowy działa zatem jak rodzaj baterii świetlnej, przetwarzającej energię
promienista w energię chemiczną.
•
Proces syntezy ATP w czasie fotosyntezy nazywamy fotofosforylacją.
•
Fotofosforylacja ma inny przebieg u sinic i u Prochlorales, a inny u bakterii anoksygennych
(nie wytwarzających tlenu), jak bakterie purpurowe i zielone wyposażone też w inne
barwniki.
•
Przebieg fotofosforylacja u sinic: czynne przy tym są dwa fotosystemy: I - cykliczny i II –
niecykliczny.
•
Systemy te różnią się umieszczonymi w błonie reaktywnymi centrami i łańcuchami
przepływu elektronów.
•
Reaktywne centrum I zawiera chlorofil a tzw. „długich fal”, P-700, którego cząsteczki są
ułożone w błonie w sposób uporządkowany w wyniku czego pochłaniają one dłuższe fale
690-705 nm.
•
Wybite z niego elektrony wędrują na pierwszy akceptor, którym jest niskowoltażowa,
wolnorodnikowa forma chlorofilu a.
•
Akceptor przekazuje elektron na ferredoksynę, która z kolei przekazuje je na NADP –
konieczny w procesie wiązanie CO2, albo na cytochrom b – skąd przez cytochrom f i
plastocyjaninę elektrony wracają do chlorofilu P-700, zamykając cykl.
•
Przenoszeniu elektronów towarzyszy przesunięcie trzech protonów przez błonę,
wytworzenie w niej potencjału elektrochemicznego, a w konsekwencji utworzenie 2
cząsteczek ATP z udziałem pompy protonowej ATPazy.
•
Reaktywne centrum II, niecyklicznego fotosystemu II, tzw. P-680, zwiera tez chlorofil a,
który absorbuje krótsze fale.
•
U Prochlorales występuje, także jak u roślin zielonych chlorofil b, a u sinic, u których brak
chlorofilu b występują brązowe lub czerwone fikobiliny.
•
Elektorny wybite z chlorofilu P-680 są przenoszone na pierwotny akceptor I
(prawdopodobnie jest to feofityna – chlorofil bez Mg)
•
Następnie elektrony przechodzą na plastochinon, cytochromy i plastocyjaninę, a w końcu na
chlorofil P-700.
•
Jest on bowiem utleniony, gdyż część elektronów została zużyta do redukcji NADP.
•
Chlorofil P-700 zostaje przez elektrony fotosystemu II ponownie zredukowany, a utleniony
pozostaje chlorofil P-680 fotosystem II.
•
Sinice wykształciły mechanizm ponownej redukcji P-680, elektrony niezbędne do tego
procesu pochodzą z wody.
•
Woda podlega fotolizie , elektrony przechodzą z wody na P-680, regenerując go, protony
przechodzą do wody, zaś pozostałe utlenione rodniki łączą się do wody utlenionej. W
wyniku działania katalazy jako jeden z produktów ubocznych powstaje tlen cząsteczkowy.
•
Po unieczynnieniu systemy II przez inhibitory lub brak tlenu, fotosynteza opiera się o
system I, przestają wtedy korzystać z wody jako źródło redukujących elektronów, a
zaczynają używać H2S – wydalają przy tym siarkę pozakomórkowo.
Fotofosforylacja u sinic i Prochlorales:
31
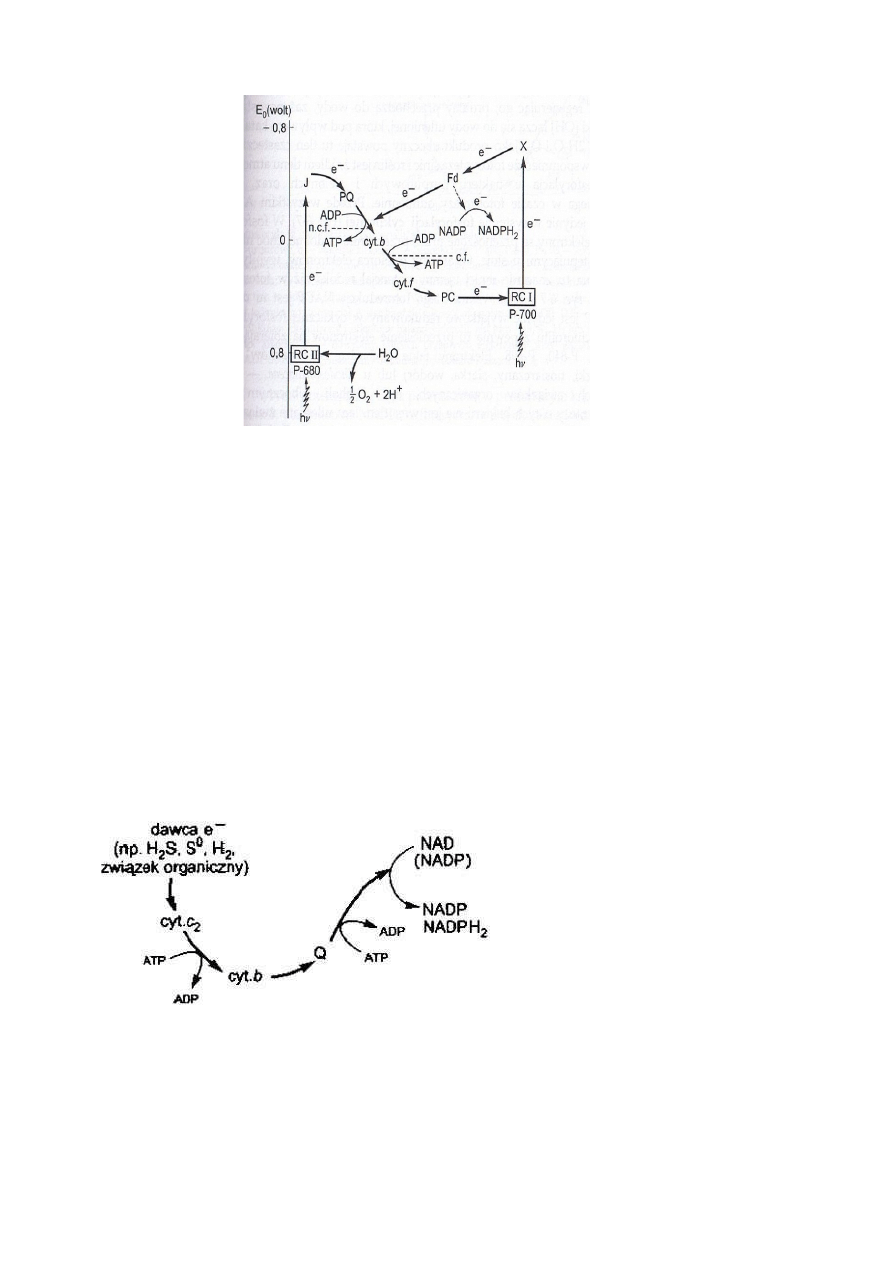
•
Fosforylacja u bakterii purpurowych i zielonych oraz heliobakterii: przebiega
odmiennie, ATP jest tworzony jedynie w systemie fosforylacji cyklicznej.
•
Podczas fosforylacji cyklicznej elektrony są przenoszone przez przenośniki podobnie jak u
sinic.
•
Ostateczny odbiorca elektronów ma tu znacznie mniej ujemny potencjał redoks niż u sinic,
dlatego tez fotoredukcja NADP jest utrudniona, NADP jest jedynie wyjątkowo redukowany
w cyklicznej fosforylacji.
•
Regenerację chlorofilu, zapewnia tu przeniesienie elektronów na zbierający kompleks P-
870, P-840, P-798.
•
Elektrony takie pochodzą ze związków mineralnych: siarczki, tiosiarczany, siarka, wodór.
•
Uboczny produktem fotosyntezy u tych bakterii nie jest tlen, lecz utlenione związki
mineralne: siarczany woda, lub organiczne kwasy (Rhodospirillaceae).
•
Redukcja NADP do NADPH2, niezbędna do zredukowania produktu wiązania CO2, ze
względu na mała aktywność systemu fosforylacji cyklicznej, wymaga tu dodatkowego
źródła siły redukującej.
•
Pochodzi ona z tzw. odwrotnego łańcucha przepływu elektronów(
schemat poniżej
),
elektrony pochodzą z dawcy: H2S, H2 lub związki organiczne u Rhodospirillaceae.
•
Przechodzą na cytochrom, następnie
z użyciem energii z ATP i wbrew
potencjałowi Eh, są przenoszone w
przeciwnym kierunku przez
cytochrom b, ubichinon na NADP.
•
W fotosyntezie u tych bakterii
redukcja NADP wymaga więc
dodatkowo sporo energii, toteż
proces ten jest energetycznie mniej
wydajny.
Faza ciemna fotosyntezy:
•
Faza ciemna fotosyntezy jest cyklem przemian noszącym u roślin nazwę cyklu Calvina-
Bensona.
•
Sumarycznie równanie streszczające przemiany fazy ciemnej przedstawia rysunek poniżej.
32
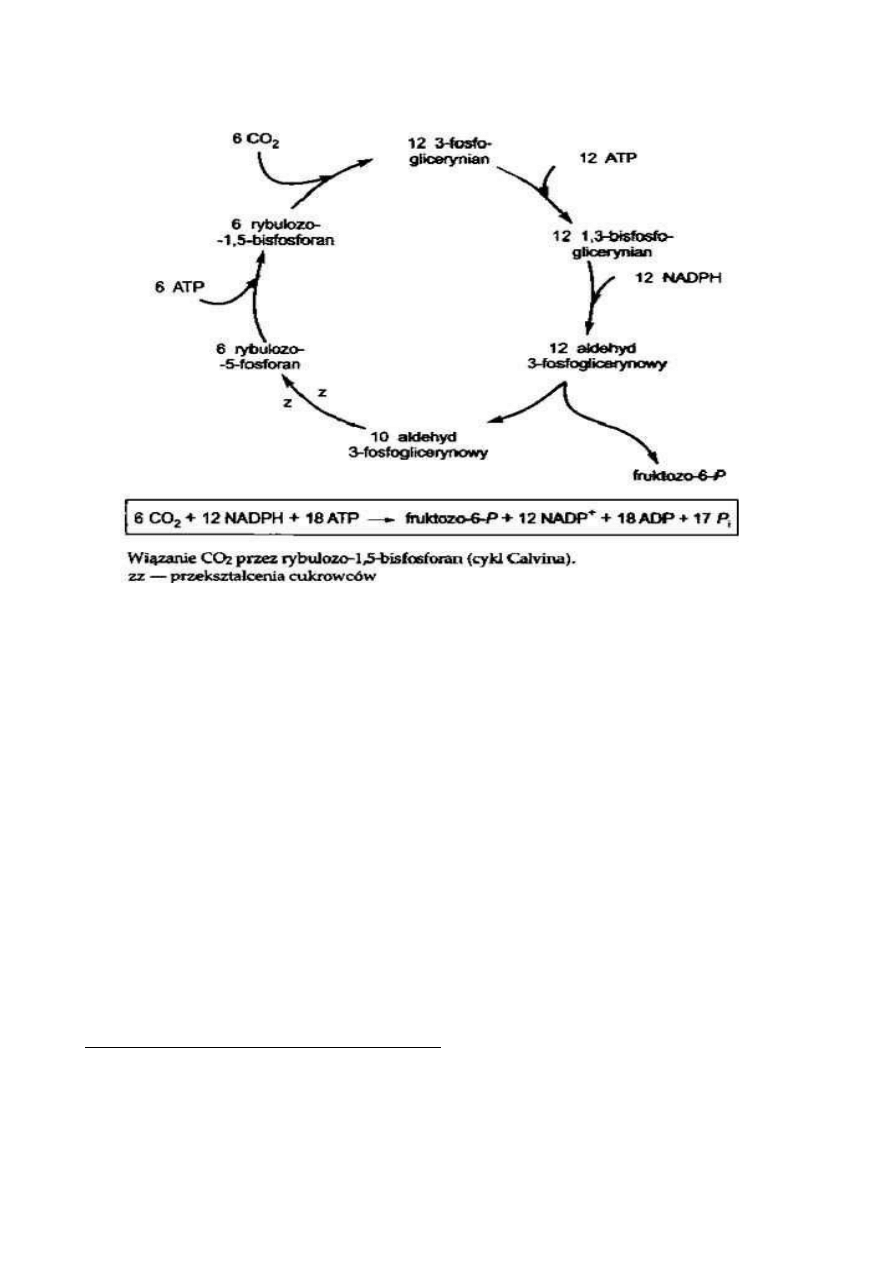
•
U bakterii może zachodzi klasyczny cykl Calvina lub może dojść do odwrócenia cyklu
przemian związanych z odwróceniem cyklu Krebsa – zamiast wydalania CO2 może
odbywać się jego asymilacja.
•
Po prześledzeniu przemian zachodzących w fotosyntezie dochodzi się do wniosku, że
sensem tego wszystkiego jest konwersja energii świetlnej na energię związków
organicznych.
•
Cykl ten znajdujemy u sinic, Prochlorales, purpurowych bakterii bezsiarkowych, licznych
chemolitotrofów, a także wszystkich roślin,
•
CO2 przyłączany jest do związku pięciowęglowego: rybyloza-1,5-bisfisforanu.
•
Następuje redukcja produktu karboksylacji (przyłączenia CO2) i wewnętrzne
przekształcenia, prowadzące do regeneracji rybulozy i wytworzenia cząsteczki cukru.
•
Akceptorem CO2 jest pochodna rybulozy – 1,5-bisfosforybuloza, a enzymem katalizującym
tą reakcję jest karboksylaza 1,5-bisfosforybulozy. Enzym ten przyłącza CO2 do 1,5-
bisfosforybulozy dając nietrwały związek 6-węglowy, który natychmiast rozpada się na
dwie cząsteczki kwasu 3-fosfoglicerynowego. Kwas 3-fosfoglicerowy jest następnie
fosforylowany na koszt ATP do kwasu 1,3-bisfosfoglicerynowego, który z udziałem
NADPH ulega redukcji do poziomu cukrów, tj. do aldehydu 3-fosfoglicerynowego.
•
Na każdą reakcję karboksylacji i redukcji zostaje zużyta energia zawarta w 2 NADPH i 3
ATP.
83) Fotofosforylacja u bakterii
Halobacterium
.
•
Bakterie te przeprowadzają mechanizm wykorzystywania energii świetlnej bez udziału
chlorofilu.
33

•
W środowiskach silnie zasolonych znaleziona bakterie należące do rodzajów:
Halobacterium i Halococcus.
•
Bakterie te mają odmiennie zbudowaną błonę cytoplazmatyczną => błona purpurowa: w
ich lipidowej błonie występują w postaci „łat” skupienia białka – bakteriorodopsyn.
•
Białko to związane jest z światłoczułym związkiem karotenowym – retinalem.
•
Halobacterium salinarum jest tlenowcem i w obecności tlenu tworzy ATP w procesie
oddechowym.
•
Przy obniżonym ciśnieniu tlenu i na świetle wykorzystuje do syntezy ATP reakcję
fotochemiczną, zachodzącą w błonie purpurowej.
•
Wiązanie między grupą aminowa lizyny białka a grupą aldehydową retinalu może
przyłączać lub odłączać protony.
•
Przy naświetlaniu odłącza się od niego proton i przechodzi na zewnątrz błony poza
komórkę.
•
W rezultacie tworzy się w błonie silny potencjał elektrochemiczny.
•
Czynny jest w tym procesie potencjał chemiosmotyczny, dzięki któremu syntetyzowany jest
ATP.
•
W czasie naświetlania błona purpurowa podlega przemianie chemicznej, ujawniającej się
jako „wybielanie”.
•
Następnie przy udziale partonów z cytoplazmy komórki błona ta jest ponownie
regenerowana do postaci zredukowanej.
•
Halobacterium jest zatem zdolna do korzystania z energii świetlnej do uzyskania energii w
postaci ATP, nie jest jednak autotrofem.
•
Niezbędnym źródłem węgla jest dla niej kwas organiczny i aminokwasy.
•
Żyjąc w środowisku silnie naświetlony zawiera w błonie cytoplazmatycznej duże ilości
karotenoidów, nadające jej barwę różową i chroniące wnętrze komórki przed uszkodzeniami
fotochemicznymi.
•
Efektem fotosyntezy jest nie tylko uzyskanie energii, ale i synteza związku organicznego.
•
Proces uzyskiwania energii na świetle jest zbliżony do fotosyntezy, jednak nie towarzyszy
mu asymilacja CO2.
84) Bioluminescencja – struktura genetyczna i mechanizm regulacji operonu
lux
. + 85)
Znaczenia autoinducera w regulacji operonu
lux
.
•
Proces bioluminescencji jest rodzajem pracy fizycznej związanej ze świeceniem.
•
Świecenie tego typu charakteryzuje bruzdnice, świetliki, a takeż bakterie. Do tych ostatnich
możemy zaliczy: · Photobacterium phosphoreum
· Photobacterium luciferi
· Vibrio fischeri
· Vibrio harvei.
•
Bioluminescencja związana jest z obecnością enzymu lucyferazy (oksydoreduktaza, która
jest monooksygenazą flawinową, który przeprowadza reakcję utleniania
długołańcuchowego aldehydu – dekanalu (dziesięciowęglowy związek) – do kwasu
dekanowego poprzez nietrwałą formę cyklicznego nadtlenku. (
schemat poniżej
)
•
Do wystąpienia świecenia oprócz lucyferazy i tlenu, niezbędna jest obecność dekanalu, a
także FMNH2, który powstaje w wyniku redukcji FMN przez NADH, z udziałem reduktazy
flawinowej => oksydoreduktazy NADH/FMN.
•
Kompleks lucyferaza-FMNH2-O2-RCHO przeprowadza
reakcję pod schematem
:
34

•
W czasie tego złożonego procesu flawina ulega wzbudzeniu elektronowemu, a jej powrót do
stanu podstawowego powoduje emisję świtał.
•
Molekularną podstawą świecenia jest obecność u bakterii operonu lux zbudowanego z
ponad 7 kb; odpowiada on za kodowanie enzymu lucyferazy i enzymów syntetyzujących
dekanal. Geny w obrębie omawianego operonu mają następujące nazwy:
· lux A
· lux B
· lux C
· lux D
· lux E
•
Lux A i Lux B – kodują podjednostki alfa i beta lucyferazy.
•
Pozostałe geny koduj enzymy uczestniczce w syntezie dekanalu.
•
Bakterie świecą, ale tylko wtedy, gdy jest ich dużo. Potrafią wyczuwa zagęszczenie swojej
populacji. Posiadaj tzw. zmysł tłoku (ang. quorum sensing).
•
Najczęstszym miejscem występowania bakterii zdolnych do bioluminescencji jest skóra ryb
lub narządy świetlne u kałamarnic.
•
Do aktywacji operonu lux potrzebny jest czynnik będący aktywatorem transkrypcji.
•
Białko o takiej funkcji jest kodowane przez gen lux R i nosi aktywatora Lux R.
•
Bardzo interesującym jest fakt, że obecność białka Lux R nie jest wystarczającym
warunkiem do uaktywnienia transkrypcji genów uczestniczących w świeceniu.
•
Do tego, aby geny bioluminescencji były transkrybowane potrzebny jest produkt genu lux I
– kodujący tzw. autoinducer => reguluje ekspresje operonu.
35

•
Pod wpływem autoinducera, ze związku pochodnego S-adenozylometioniny powstaje
homolakton seryny.
•
Homolakton seryny jest wydzielany przez komórki bakteryjne na zewnątrz; w cytoplazmie
stężenie tego związku jest niewielkie.
•
Pojedyncza komórka produkuje niewielkie ilości homolaktonu seryny, stąd bardzo łatwo
ulega on rozcięczeniu w środowisku.
•
Ma to istotne znaczenie dla bakterii ponieważ stężenie homolaktonu jest drugim obok
autoinducera elementem regulacji świecenia.
•
Homolakton seryny jest aktywatorem aktywatora Lux R. Jest on produkowany przez
pojedyncze komórki w tak małych stężeniach, że komórki nie świecą.
•
Dopiero odpowiednio duże zagęszczenie homolaktonu seryny staje się sygnałem do
aktywacji białka Lux R, uaktywnienia transkrypcji genów lux A, lux B, lux C, lux D i lux E;
ostatecznym efektem powyższych przemian jest świecenie.
86) Bakterie nitryfikacyjne.
•
Grupa ta obejmuje dwa odmienne typy:
1. bakterie utleniające tylko NH3 do NO2-,
2. bakterie utleniające wyłącznie NO2- do NO3-.
Typ 1. bakterie utleniające tylko NH3 do NO2-:
•
Należą tu: Nitrosomonas, małe pałeczki, wyposażone w polarną rzęskę; Nitroscoccus,
ziarniaki; Nitrosolobus, pleomorficzne, ruchliwe komórki, często z błoniastymi przedziałami
wewnątrz komórki; Nitrosporia, spiralnie skręcone pałeczki; Nitrosvibrio, drobne
zakrzywione pałeczki.
•
Wszystkie (oprócz Nitrosporia) wykazują w komórkach obecność błon ułożonych
warstwowo, równolegle do błony komórkowej => przypuszczalnie w nich zachodzą procesy
transportu elektronów do utlenionego substratu NH4+.
•
Są to autotrofy, rosną w pożywkach mineralnych, o pH ok. 8.
•
Cecha charakterystyczną jest wzrost na granicy dwóch faz, zwykle na powierzchni ciał
stałych.
•
Są one bardzo oporne na wysuszanie => w wysuszonej glebie mogą przetrwać w stanie
anabiozy nawet wiele lat.
•
Proces utleniania amoniaku, ze względu na zbyt + potencjał redoks NH4+ , nie może być
wykorzystywany do redukcji NAD lub NADP.
•
Redukcja NAD zachodzi tu w reakcji odwrotnego łańcucha przepływu elektronów, z
wykorzystanie energii ATP.
•
Wytwarzający się w trakcie chemosyntezy kwas azotowy jest silnie toksyczny dla bakterii.
•
Gromadzący się w komórkach jon NO2- musi być czynnie przez nie wydalany.
•
Produkowany przez nie kwas azotawy silnie hamuje reakcję utleniania w której powstaje,
jest wydzielany poza komórkę co wymaga zużycia 30% produkowanej energii.
2NH4+ + 3O2 → 2HNO2 + 2H2O + 2 H+ reakcja zachodzi przy pomocy monooksydazy
amonowej, zysk 66 kcal/mol
Typ 2. bakterie utleniające wyłącznie NO2- do NO3-:
•
Należą do nich: Nitrobacter, Nitrococcus i Nitrospina.
•
Nitrobacter i Nitrococcus zawierają tez błoniaste twory, rożnie rozmieszczone wewnątrz
cytoplazmy.
36

•
Żyją w środowisku lekko alkalicznym, pH ok. 7,7.
•
Wiążą one CO2 korzystając z energii utlenienia azotynów do azotanów.
•
Są względnymi autotrofami zdolnymi do wzrostu heterotroficznego.
•
Wolny amoniak hamuje silnie chemosyntezę Nitrobacter.
•
Bakterie nitryfikacyjne rosną w pożywkach czysto mineralnych, toksyczny dla nich jest
pepton ze względu na zawartość wolnych aminokwasów.
•
Utlenianie NO2
-
hamowane przez jon amonowy, tak więc bakterie obu etapów w glebie są
od siebie zależne.
2HNO
2
+ O
2
→ 2NO
3
-
+ 2H
+
zysk 17 kcal/mol
Odnośnie dwóch typów bakterii nitryfikacyjnych:
•
Bakterie te nie przeprowadzają glikolizy oraz cyklu Krebsa.
•
Protony wodoru z procesu utleniania bezpośrednio biorą udział w łańcuchu oddechowym,
natomiast do syntezy NADH2(do cyklu Calvina) potrzebna jest energia z ATP.
87) Warunki wzrostu bakterii.
[z ćwiczeń :-) najlepsze źródło :-)]
Dla zapewnienia optymalnego wzrostu i rozmnażania się drobnoustrojów, muszą zostać
zapewnione odpowiednie warunki w pożywkach, w których hoduje się kultury bakteryjne. Dobór
pożywki zależy od właściwości badanych drobnoustrojów id celu, jaki chce uzyskać
eksperymentator.
Pożywki są to płynne lub zestalone mieszaniny złożone z odpowiednio dobranych
składników i służące do hodowli drobnoustrojów w warunkach laboratoryjnych (sztucznych).
Do warunków, które musi spełniać pożywka należą:
-
odpowiednia wartość odżywcza
-
optymalny odczyn pH
-
izotoniczność – odpowiednie ciśnienie osmotyczne, roztwory hipotoniczne powodują
pęcznienie komórek, hipertoniczne – kurczenie się plazmy komórkowej i oddzielenie od ściany
komórkowej.
-
przejrzystość – żeby można było wizualnie stwierdzić czy bakterie rosną w pożywce, obecność
bakterii objawia się zmętnieniem pożywki
-
sterylność
Pochodzenie poszczególnych składników podłoży jest różne np.:
· źródłem węgla i energii są najczęściej węglowodany (np. glukoza, laktoza, maltoza, skrobia,
celuloza), a także glicerol, mannitol oraz niektóre kwasy organiczne. Dodaje się je w ilości 0,5-2%.
· źródłem azotu – uniwersalnym źródłem azotu jest dodawany do pożywek pepton. Innym źródłem
azotu stosowanym w sztucznych podłożach są różne ekstrakty (mięsny, drożdżowy), a także sole
amonowe, wodorotlenek amonu oraz azotany. Często dodaje się czyste białko, bądź wolne
aminokwasy.
Oprócz tych składników w podłożach powinny znajdować się:
· składniki mineralne – należą do nich zarówno sole mineralne, jak i pierwiastki śladowe. Sole
dodawane do pożywki to: fosforan potasu utrzymujący właściwy odczyn pH (zwiększona
pojemność buforowa), a także NaCl (sól kuchenna, dodawana w ilości 3-5g/l) reguluje ciśnienie
osmotyczne.
· pierwiastki – dodawane do podłoża należą do następujących grup: pierwiastki biogenne: O,H, P,S
(składniki budulcowe komórki), pierwiastki biorące udział w procesach życiowych komórki: Na, K,
Mg, Ca, Fe, mikroelementy biorące udział w reakcjach komórkowych: Zn, Mn, Cu, Co.
· substancje wzrostowe – są to zarówno roztwory syntetyczne witamin, a także ekstrakty roślinne i
zwierzęce oraz sok pomidorowy, wyciąg glebowy, brzeczka słodowa, wyciąg ziemniaczany.
37

· substancje różnicujące i wybiórcze (pkt. 90).
· czynniki zestalające – w przypadku pożywek o konsystencji stałej dodaje się do podłoża agar (jest
to polisacharyd, który ma właściwości żelujące, dodaje się go w ilości 1,5-3%) lub żelatynę
(substancja białkowa, bogata w kolagen, dodaje się w ilościach 12-15%).
88) Pożywki mikrobiologiczne ich rodzaje , przykłady.
Podział pożywek według pochodzenia składników i ich charakteru chemicznego:
•
Naturalne – zawierają składniki pochodzenia naturalnego (wyciąg z tkanek zwierzęcych, i
roślinnych, krew, jajo). Obecnie są rzadziej stosowane.
•
Syntetyczne – zawierają ściśle określone pod względem jakościowo – ilościowym składniki
chemiczne.
•
Mieszane (półsyntetyczne) – zawierają składniki naturalne i określone związki chemiczne.
Podział pożywek według wymagań spożywczych drobnoustrojów:
•
Minimalne (proste, zwykłe, podstawowe) – zawierają minimum potrzebne dla wzrostu
bakterii, podstawowe składniki odżywcze. Przykłady: Agar zwykły, bulion zwykły.
•
Wzbogacone (złożone, specjalne) – służą do izolacji i hodowli wybrednych bakterii.
Zawierają krew, cukier, witaminy, surowicę, płyn puchlinowy i in. Przykłady: agar z krwią,
bulion cukrowy, podłoże MacConkey’a.
Pożywki wybiórcze i różnicujące (należą do pożywek złożonych):
•
Pożywki wybiórcze (selektywne) – posiadają tak dobrany skład chemiczny i jakościowy, że
rozmnażają się na nich tylko wybrane, poszukiwane przez nas bakterie. Wzrost innych
składników jest zahamowany przez obecne w pożywce inhibitory.
•
Pożywki wybiórczo – różnicujące (identyfikacyjne) – posiadają tak dobrany skład
chemiczny i jakościowy, że oprócz hamowania wzrostu niepożądanych przez nas bakterii,
umożliwiają identyfikację biochemiczną poszczególnych kolonii. Identyfikacja ta jest oparta
o cechy biochemiczne danych mikroorganizmów, np. zdolność do rozkładu lub syntezy
jakiegoś związku.
Podział pożywek według konsystencji:
•
Płynne – np. bulion, pożywka mineralna
•
Stałe – np. agar bulionowy, podłoże żelatynowe. Podłoża stałe wykorzystywane są do
izolacji czystych kultur, sprawdzania ich czystości, liczenia drobnoustrojów, badania
morfologii kolonii mikroorganizmów. Podłoża stałe najczęściej zestala się agarem –
wielocukrem otrzymywanym z krasnorostów. Agar rozpuszcza się w wodzie w temperaturze
95 – 99 stopni C, krzepnie w 45 – 48 stopni C. Jest na ogół oporny na działanie
drobnoustrojów i tylko bakterie morskie rozkładają go.
Żelatyna jest stosunkowo prostym białkiem otrzymywanym z chrząstek. Niska temperatura
rozpuszczania i podatność na rozkład przez mikroorganizmy powodują, że nie jest obecnie
powszechnie stosowana. W przypadku niektórych bakterii samożywnych podłoża zestala się
krzemionką, ponieważ może szkodzić im obecność związków organicznych.
•
Półpłynne – zawiera 0.15, 0.2 % agaru.
PRZYKŁADY:
Podłoże McConkey’a (wybiórczo – różnicujące):
Służy do wstępnej kontroli obecności pałeczek z rodziny Enterobacteriaceae w produktach
38

spożywczych, ściekach, kale i moczu. Czynnikami wybiórczymi w tym podłożu są fiolet
krystaliczny i sole żółci, które hamują wzrost większości bakterii Gram dodatnich. Podłoże pełni
również rolę różnicującą pozwalając odróżnić bakterie rozkładające laktozę z wytworzeniem
produktów kwaśnych od nie rozkładających laktozy (lub rozkładających ją z wytworzeniem
produktów obojętnych). Kwaśne produkty powstające na skutek rozkładu laktozy powodują spadek
pH środowiska hodowli, co stwierdza się dzięki obecności indykatora pH – czerwieni obojętnej.
Bakterie laktozo - dodatnie tworzą czerwone kolonie, bakterie laktozo ujemne rosną w postaci
kolonii białoróżowych lub jasnożółtych, obserwuje się też zmianę zabarwienia podłoża pod nimi z
czerwonej na żółtą.
Podłoże Chapmana (wybiórczo – różnicujące):
Służy do izolacji i różnicowania szczepów gronkowcowych.
Czynnikiem wybiórczym jest tu wysokie stężenie NaCl, na tym podłożu są w stanie rosnąć tylko
organizmy halofilne, w tym gronkowce. Czynnikiem różnicującym jest mannitol. Szczepy
rozkładające mannitol z wytworzeniem produktów kwaśnych powodują spadek pH środowiska
hodowli, co powoduje zmianę zabarwienia wskaźnika – czerwieni fenolowej z
czerwonego/różowego na żółty. Szczepy mannitolo - dodatnie rosną w postaci żółtych kolonii,
ulega również zmianie zabarwienie podłoża pod nimi z różowego na żółty. Szczepy mannitolo -
ujemne rosną w postaci białych – do różowych kolonii i nie zmieniają zabarwienia podłoża.
Podłoże krwawe:
Służy do izolacji paciorkowców. Jest to podłoże agarowe z krwią. Służy do określenia zdolności
bakterii do rozkładu krwinek czerwonych. Kolonie bakteryjne mogą być otoczone strefą hemolizy
typu
α
,
β
lub
γ
.
α
- częściowo rozpuszczają krwinki powodując zazielenienie otaczającego je podłoża. Strefa
hemolizy niewielka, o słabej przejrzystości.
β
- całkowite rozpuszczenie krwinek, powstaje duża, przejrzysta strefa wyraźnie odgraniczona od
podłoża niezhemolizowanego.
γ
- bakterie nie wykazują zdolności hemolitycznych.
Agar czekoladowy:
Jest to podłoże agarowe z krwią, podgrzane po dodaniu krwi do ok. 80C, wskutek czego krwinki
zostają zniszczone, a hemoglobina zmieniona przez ogrzewanie staje się łatwiej przyswajalna.
89) Pożywki selekcyjne i różnicujące.
•
Podłoża różnicujące: są to podłoża gdzie może rosnąć kilka lub kilkanaście gatunków
drobnoustrojów, ale każdy z nich wytwarza charakterystyczne, łatwe do zróżnicowania
kolonie, co pozwala na ich szybką i dalszą, już ukierunkowaną, szczegółową identyfikację.
Stałe podłoża różnicujące często są jednocześnie wybiórczymi dla określonej grupy, rodzaju
drobnoustrojów i są nazywane wybiórczo-różnicującymi.
•
Podłoża wybiórczo-różnicujące (elekcyjne): np.
◦
podłoża do hodowli bakterii z rodziny Enterobacteriaceae: MacConkey, Endo, SS,
Levina; podłoża do hodowli maczugowców: podłoże Clauberga z tulerynem potasu
◦
podłoże do hodowli gronkowców: podłoże Champamana
◦
podłoże do hodowli grzybów i pleśni: podłoże Saburoda
•
Podłoża wybiórcze (-namnażające [selekcyjne] ): są to podłoża z dodatkiem takim
substancji, które umożliwiają wzrost tylko pewnych określonych gatunków bakteryjnych
czy grzybiczych a jednocześnie hamują wzrost innych gatunków. Podłoża te pozwalają na
39

wyizolowanie jednego lub kilku gatunków bakteryjnych czy grzybiczych z materiału, w
którym znajduje się cała masa drobnoustrojów. Np. podłoże z dodatkiem fioletu
krystalicznego, które umożliwia wzrost tylko bakterii Gram-ujemnych, podłoże do hodowli
prądków – Lowenssteina-Jensena, rożne podłoża selektywne do hodowli bakterii z rodzaju
Campylobacter, Yersinia, Vibrio, gatunków Listeria monocytogenes, Helicobacter pylori,
itd.; wiele z nich zawiera antybiotyki jako składnik selekcjonujący drobnoustroje.
90) Na czym polega mechanizm selekcji, a na czym różnicowania.
•
substancje różnicujące – te, które po dodaniu do pożywki ulegają pod wpływem wzrostu
drobnoustrojów rozkładowi (np. cukry – następuje zmiana barwy pożywki) lub też wskazują
na obecność produktów metabolizmu bakterii (np. wytwarzanie siarkowodoru, tworzenie
indolu).
•
substancje wybiórcze (selekcyjne) - dodaje się po to, żeby hamując wzrost pewnych grup
mikroorganizmów umożliwić jednocześnie rozwój flory pożądanej (mogą to być: sole
kwasów żółciowych, fiolet krystaliczny, błękit brylantowy, antybiotyki).
91) Typy hodowli bakteryjnych. + 93) Fazy wzrostu bakterii w hodowli stacjonarnej.
TYPY HODOWLI BAKTERYJNYCH
-statyczne
-ciągłe
-zsynchronizowane
•
Hodowla statyczna – bakterie wysiane rozwijają się do czasu wyczerpania składników
odżywczych lub zatrucia się produktami własnej przemiany materii.
•
W hodowlach statycznych wyróżniamy następujące fazy:
◦
Faza lag (zastoju) – tuż po wysianiu bakterii do nowego podłoża. W tej fazie liczba
bakterii nie wzrasta, czasem nawet nieco spada. W tym czasie bakterie przystosowują się
do nowego środowiska. Komórki rosną, wzrasta zawartość białka, DNA, aktywność
metaboliczna. Faza ta jest tym dłuższa, im uboższe jest nowe środowisko w stosunku do
poprzedniego i im starsza jest hodowla, z której pochodzą bakterie (bakterie
przeniesione z fazy logarytmicznej zaczynają się rozmnażać niemal natychmiast
redukując fazę lag prawie do 0)
◦
Faza wzrostu logarytmicznego – liczba komórek wzrasta w postępie logarytmicznym.
Ta faza jest głównym okresem wzrostu hodowli. Jej trwanie zależy od czynników
środowiskowych i cech danej bakterii.
◦
Faza stacjonarna – liczba żywych bakterii niemal się nie zmienia, tempo podziałów
jest zwolnione, istnieje równowaga pomiędzy komórkami nowo powstającymi a
zamierającymi, kształt komórek bywa zmieniony, powstają formy rozdęte i nieregularne
40
◦
Faza zamierania – ilość żywych komórek spada w postępie geometrycznym na skutek
gromadzenia się produktów przemiany materii i wyczerpywania się składników
odżywczych. Podziały następują bardzo rzadko. W warunkach bardzo niekorzystnych
spadek liczby żywych komórek następuje bardzo szybko, mówimy wtedy o fazie śmierci
logarytmicznej. => 92) Krzywa wzrostu hodowli stacjonarnej.
•
Hodowla ciągła – ma miejsce w warunkach, gdy następuje stały i regulowany dopływ
świeżej pożywki i równoczesny odpływ zużytej pożywki zawierającej produkty
metaboliczne. Hodowle takie stosujemy w badaniach eksperymentalnych, w przypadku
biologicznej produkcji związków chemicznych, w technologii ścieków.
•
Hodowla zsynchronizowana – wszystkie osobniki dzielą się równocześnie. Uzyskuje się to
przez zmianę temperatury, stymulację światłem, ograniczenie składników odżywczych lub
wyselekcjonowanie komórek o jednakowych rozmiarach za pomocą filtrowania.
94) W jaki sposób można obliczyć miano bakterii.
•
Miano bakterii => liczna żywych komórek bakteryjnych w jednostce objętości np.
pożywki.
41
•
Posiew ilościowy => stosuje się w przypadku konieczności oznaczenia liczby
drobnoustrojów w badanym materiale. Przygotowując próbę badanego materiału do
posiewu ilościowego należy zastosować metodę kolejnych rozcieńczeń. W tym celu należy
odważyć lub odmierzyć określoną ilość produktu (1 lub 10 cm3 / g), po ewentualnym
rozdrobnieniu umieścić w naczyniu i zalać 9 lub 90 cm3 roztworu rozcieńczalnika (w
przypadku hodowli płynnych po prostu przenosimy odpowiednią objętość hodowli do
rozcieńczalnika). Po dokładnym wymieszaniu uzyskuje się rozcieńczenie wyjściowe 10-1
(1:10). Kolejne rozcieńczenie 10-2 (1:100) sporządza się przenosząc 1 cm3 zawiesiny do
kolejnej probówki z 9 cm3 rozcieńczalnika. Sposób wykonania kolejnych rozcieńczeń jest
identyczny, a ich liczba zależy od rodzaju badanego materiału. Po sporządzeniu
odpowiedniego rozcieńczenia wykonujemy posiew ilościowy (murawowy). Po okresie
inkubacji do pomiarów bierze się te płytki na których liczba kolonii mieści się w granicach
od 30 do 200.
◦
Zakładając, że pojedyncza kolonia powstaje z jednej komórki bakteryjnej, można
określić liczbę żywych komórek obecnych w 1 ml badanej hodowli (miano bakterii)
posługując się następującym wzorem:
n
N =
R
×
V
gdzie:
N – oznacza miano hodowli bakteryjnej (liczba bakterii w 1 ml)
n – liczbę kolonii, które wyrosły na płytce przy danym rozcieńczeniu
R – rozcieńczenie
V – objętość próby
◦
Na podstawie uzyskanych wyników można obliczyć miano bakterii w poszczególnych
fazach wzrostu hodowli.
95) Metody otrzymywanie czystych kultur bakteryjnych.
•
Posiew izolacyjny (redukcyjny) – umożliwia uzyskanie czystej kultury bakterii, na
prawidłowo posianej płytce po całonocnej inkubacji można zaobserwować pojedyncze
kolonie bakterii. Każda kolonia to potomstwo jednej bakterii, aby była widoczna gołym
okiem, kolonia bakteryjna musi zawierać około 107 komórek. Posiew redukcyjny zwykle
stosuje się do przesiewania bakterii z podłóż stałych.
96) Metody hodowli beztlenowców.
•
Hodowle beztlenowe: Bakterie będące ścisłymi beztlenowcami można hodować tylko po
wyeliminowaniu tlenu z otoczenia. Można to osiągnąć przez:
-
odpowietrzenie pożywki przez zagotowanie (przed posiewem!) i umieszczenie w szczelnie
zamkniętym naczyniu, podobny efekt można uzyskać wprowadzajac na powierzchnię pożywki
(płynnej) warstewkę oleju parafinowego.
-
hodowanie w eksykatorach i kloszach anaerobowych
-
metoda chemiczna - wykorzystanie związków absorbujących tlen (np.chlorek miedziawy)
-
dodatek do podłoża czynników redukujących, jak kwas askorbinowy, tioglikolan, cysteina,
może zmniejszać toksyczne działanie tlenu atmosferycznego lub całkiem mu zapobiegać
-
na podłożach zestalonych można zastosować posiew wgłębny
-
hodowla z dodatkowym posiewem drobnoustroju tlenowego, który zużywa tlen do swojego
42

rozwoju (metoda biologiczna)
97) Cechy charakterystyczne bakterii beztlenowych.
•
Bakterie beztlenowe - są to bakterie, które mogą przeprowadzać reakcje metaboliczne z
wydzieleniem energii jedynie w warunkach braku tlenu.
•
Niektóre beztlenowce bezwzględne giną nawet przy bardzo niskim stężeniach tlenu.
•
Do wzrostu tych drobnoustrojów używana jest pożywka z tioglikolanem sodu lub
Tarroziego-Wrzoska.
•
Obecnie do hodowli częściej korzysta się z tzw. gas paków - szczelnych pojemników w
których atmosteryczny 02 reaguje na katalizatorze palldowym z wytwarzanym po
zamknięciu wodorem.
•
Bezwzględne beztlenowce (obligatoryjne anaeroby): Rozwijają się jedynie w środowisku
beztlenowym. Energię uzyskują na drodze fermentacji lub oddychania beztlenowego. Brak
im katalazy i dysmutazy, nie mogą rozkładać nadtlenku wodoru i innych nadtlenków.
Do grupy tej zalicza się: przetrwalnikujące laseczki (Clostridium) przeprowadzające
fermentację masłową lub wytwarzające toksyny, które występują w odpowietrzanych
konserwach oraz głębokich warstwach żywności, np. mięsie, serach; zasiedlające żwacz
ziarniaki (Ruminococcus) i pałeczki (Bacteroides); bakterie metanogenne czynne w procesie
beztlenowego oczyszczania ścieków). Spośród grzybów jedynie nieliczne (Mucor)
przeprowadzają w warunkach beztlenowych fermentację alkoholową.
•
Względne beztlenowce (fakultatywne anaeroby): Do względnych beztlenowców należy
wiele różnorodnych gatunków bakterii, grzybów i pierwotniaków. Obecność tlenu może być
dla tych mikroorganizmów korzystna, brak tlenu nie wyklucza jednak możliwości ich
rozwoju, posiadają katalazę i dysmutazę (np. bakterie Escherichia coli, Shigella sp.,
Salmonella sp., Pseudomonas sp., drożdże Saccharomyces cerevisiae). Mikroorganizmy te
zależnie od warunków wzrostu uzyskują energię zarówno na drodze oddychania tlenowego,
jak i beztlenowego. Względne beztlenowce rozwijają się w produktach żywnościowych
szczelnie opakowanych, ale nie odpowietrzonych, np. porcjowane kawałki mięsa, ryby na
tackach w woreczkach z tworzyw sztucznych.
•
Beztlenowe tolerujące tlen: Tlen nie jest im konieczny, jednak jego obecność nie wpływa
ujemnie na ich wzrost.
98) Charakterystyka bakterii z rodzaju
Clostridium
.
Rodzaju Clostridium:-
G(+)
-
beztlenowe laseczki tworzące endospory
-
brak katalazy i cytochromów
-
liczne gatunki zawierają dużo enzymów flawinowych, które powodują, że w zetknięciu z tlenem
atmosferycznym powstaje toksyczny dla komórki nadtlenek wodoru
-
spory u Clostridium są zwykle znacznie szersze, niż komórki wegetatywne , które w zależności
od położenia endospory przybierają różne kształty.
-
przeprowadzają fermentację wielu substratów: Clostridia sacharolityczne – przeprowadzają
fermentację cukrów. Należą tu Clostridium butyricum, C. acetobutylicum, C. celulosae, C.
pasteurianum. Niektóre Clostridia z tej grupy, np. Clostridium pasteurianum wiążą azot
atmosferyczny. Clostridia peptolityczne – rozkładają białka i aminokwasy. Należą tu C.
histolyticum, C. sporogenes, C. tetani, C. botulinum. Clostridia rozkładające kwas moczowy –
43

C. acidi-urici.
- rozmiary komórek zależą od gatunku i są rożne, przetrwalniki owalne lub okrągłe nadają
komórkom, pogrubiając je charakterystyczny kształt rakiety tenisowej (pałeczki dobosza, osełki)
- większość gatunków jest orzęsiona – typ perytrychalny, bardzo ruchliwe, nieliczne wytwarzają
otoczki, substancja zapasowa wielocukry podobne do skrobi
- komórki z 24 godz. hodowli są gramdodatnie
- mimo iż są beztlenowcami można wyróżnić trzy grupy o rożnej wrażliwości na tlen:
gatunki lub typy bezwzględnie (obligatoryjnie) beztlenowe – zawartość tlenu w
atmosferze powyżej 0,5% zabija je
gatunki umiarkowanie obligatoryjnie beztlenowe – 3% tlenu
gatunki aerotolerancyjne – mogą rosnąć słabo w warunkach zwykłej atmosfery
- żaden z gatunków nie tworzy przetrwalników w obecności tlenu
- endospory są ciepłooporne
- mimo, że nie mają zbyt wysokich wymagań hoduje się je na pożywkach agarowych z dodatkiem
krwi – obserwacje właściwości hemolitycznych, pożywkach zapewniających niski potencjał
oksydoredukcyjny – podłoże VL, czasem na pożywkach wybiorczych z antybiotykami, na
podłożu Wilson-Blaira – redukcja siarczanów:
- bakterie istotne z klinicznego punktu widzenia hoduje się w temp. 35-37°C, inne 30-40°C
- kolonie – duże 3-8 mm średnicy, płaskie, okrągłe lub o nieregularnym kształcie, brzeg może być
postrzępiony, powierzchnia matowa, szorstka, barwa szarawa-szarożołtawa
- powodują hemolizę typu β
- do wykrywania aktywności metabolicznej wykorzystuje się te same pożywki co w przypadku
innych bakterii, ale hoduje się je w słojach do hodowli beztlenowej:
agar z żołtkiem jaja kurzego – lecytynaza, lipaza, proteza
pożywka z żelatyną i kazeiną – właściwości proteolityczne
testy komercyjne
chromatografia gazowa – kwasy tłuszczowe
- szeroko rozpowszechnione – gleba, niekt. żyją w przewodzie pokarmowym (C. perfringens),
zanieczyszczają produkty żywnościowe (kurz, ziemia)
- w większości mezofilne, ale np. C. botulinum typu E żyje w temp. 3,3°C, także termofilne (C.
thermoaceticum, C. thermohydrosulfuricum) 60 i 75°C
- gatunki saprofityczne o uzdolnieniach biochemicznych i gatunki chorobotwórcze np. C. botulinum
(wywołuje też silne zatrucia pokarmowe)
- gatunki o uzdolnieniach proteolitycznych – procesy gnilne produktów białkowych w warunkach
beztlenowych (np. konserw mięsnych – H2S i NH3), psucie serów podpuszczkowych – tzw.
biała zgnilizna (amoniak)
- gatunki zdolne do fermentacji rożnych węglowodanów: bakterie fermentacji masłowej (np. C.
butyricum), przekształcające cukry w lotny kwas masłowy i produkty gazowe, spotykane są w
glebie, paszach, nawozie, wadliwych kiszonkach, mleku, serach dojrzewających
- rodzaj liczy obecnie 150 gatunków, 20 ma znaczenie dla człowieka, np.:
Clostridium botulinum – laseczka jadu kiełbasianego – botulizm klasyczny
(zatrucie pokarmowe toksyną znajdującą się w artykułach żywnościowych),
botulizm niemowląt (źródło – mod), botulizm przyranny
Clostridium tetani – laseczka tężca
Clostridium difficiale – poantybiotykowe rzekomobłoniaste zapalenie jelita
grubego
Clostridium perfringens, C. novyi, C. septicum, C. histolyticum, C.
bifermentans, C. sordelli – laseczki zgorzeli gazowej – rozpływna martwica
mięśni lub tkanki łącznej z tworzeniem gazu i znamionami ogólnej toksemii, na
skutek zakażenia rozleg
łych ran.
44

99) Charakterystyka bakterii z rodzaju
Bacillus
.
Rodzaj Bacillus:
- tlenowce lub względne beztlenowce, mezofilne lub termofilne, bardzo aktywne biochemiczne,
- komórki laseczek mają rożne rozmiary – grubość 0,5-1,2 μm, długość 2,5-10 μm.
- tworzą przetrwalniki owalne (znaczenie kliniczna dla człowiek), położone centralnie w komórce i
nie zmieniające jej kształtu,
- przetrwalniki nie barwią się barwieniu Grama,
- większość gatunków orzęsiona, niektóre wytwarzają otoczki,
- przetrwalniki są wytwarzane tylko w warunkach tlenowych,
- wszystkie gatunki wytwarzają katalazę,
- mają małe wymagania pokarmowe, dobrze namnażają się w prostych pożywkach,
- w płynnych tworzą kożuszek lub błonkę na powierzchni,
- tolerują duże stężenie NaCl, duży zakres pH (1-10), zakres temperatur 5-57°C, hoduje się je
zwykle w temperaturze niższej o 10-15°C od temperatury maksymalnej dla danego szczepu,
- kolonie proste, duże (3-10 mm), płaskie, o matowej powierzchni, postrzępionych brzegach, ale
mogą być i kolonie błyszczące i śluzowe,
- na agarze z krwią – hemoliza typu β, a strefa wokół kolonii zwykle bardzo duża
- do identyfikacji i rozróżniania gatunków wykorzystuje się:
cechy morfologiczne komórki (wielkość, kształt, położenie przetrwalnika,
otoczka, rzęski, ruch)
właściwości biochemiczne i biologiczne (lecytynaza, hemoliza typu β)
wrażliwość na penicylinę
- występują w powietrzu, wodzie, glebie, na roślinach, w kurzu
- mogą być przenoszone do produktów żywnościowych: mięso i jego przetwory, produkty
mleczarskie, zbożowe, owocowo-warzywne, przyprawy
- powodują psucie się rożnych produktów, hydrolizują skrobię (śluz, ciągliwość miękiszu pieczywa,
nieprzyjemny zapach), kwaśne zepsucie konserw owocowo-warzywnych, wady serów (gorzki
smak, wzdęcia), speptonizowany skrzep mleka („na słodko”), psucie mleka zagęszczonego
- przetrwalniki przetrzymują proces pasteryzacji - poważny problem przemysłu konserwowego
- liczą obecnie 90 gatunków
- gatunki chorobotwórcze:
Bacillus anthracis (laseczka wąglika – u ludzi trzy rodzaje choroby: skórna, tak
zwana czarna krosta, płucna tzw. „choroba sortowaczy wełny”, jelitowa bardzo
rzadka)
Bacillus cereus – zatrucia pokarmowe po spożyciu produktów białkowych
(głownie zwierzęcych), skrobiowych, warzyw
100) Wpływ czynników fizycznych i chemicznych na wzrost bakterii.
Całe ćwiczenie 7 było poświęcone temu zagadnieniu, więc wklejała całości :-) jak kto chce niech
sobie wykasuje :-)
Fizyczne metody ograniczania wzrostu bakterii:
Nasycona para wodna:
-
gotowanie (10 min.) - zabija formy wegetatywne, nie endospory
-
autoklawowanie (30 min. 120ºC 1 atm.) – zabija wszystko
-
pasteryzacja (15sek. 72ºC) – zabija wszystkie bakterie w mleku, winie, napojach
Wpływ medium na zabijanie:
45

- kwaśne pH: większa podatność na sterylizację termiczną
- obecność cukrów, białek i tłuszczu: obniżenie wydajności zabijania
- zasolenie: zmienny wpływ
Suche ciepło:
-
opalanie
-
spalanie
-
sterylizacja gorącym powietrzem – mało skuteczna, 2-4 h powyżej 140ºC
-
Filtracja (soki, wino).
Chłodzenie (lodówka, zamrażarka; hamuje wzrost bakterii, nawet psychrofile nie rosną w
temperaturze niższej niż -12ºC.
Liofilizacja – wysuszanie z zamrażaniem – suszenie w próżni, w niskiej temperaturze. Można w
ten sposób również przechowywać bakterie i wirusy.
Ciśnienie osmotyczne (solenie, cukier). 14% - 25% roztwór soli. Cukier w dużym stężeniu (50%)
– hamowanie wzrostu bakterii.
Naświetlanie – promienie UV, jonizujące (np.γ). UV niszczy DNA i RNA:
W praktyce mikrobiologicznej wykorzystuje się najczęściej hamujące lub zabójcze działanie na
mikroorganizmy nadfioletowej części widma słonecznego o długości fali 250-260 nm, a więc tą
część widma, która jest najsilniej absorbowane przez kwasy nukleinowe. Źródłem promieniowania
są lampy kwarcowe, wypełnione oparami rtęci, emitujące w 95% promieniowanie o długości fali
258 nm. Promieniowanie UV jest wykorzystywane do niszczenia mikroorganizmów
występujących w powietrzu i na odkrytych powierzchniach zamkniętych pomieszczeń o niewielkim
zapyleniu (silosów, magazynów i chłodni, ładowni statków, laboratoriów). Ponieważ charakteryzuje
się słabą przenikliwością – nie przenika przez zwykłe szkło, stąd promieniowanie UV nie jest
wykorzystywane do wyjaławiania szkła i podłoży agarowych w szklanych naczyniach. Efekt
biobójczy promieniowania zależy między innymi od objętości napromienianego powietrza,
wielkości powierzchni, odległości i ustawienia lamp UV. Czas emisji promieniowania nie powinien
być krótszy niż 30 min, odległość lampy od sterylizowanej powierzchni nie może przekraczać 3 m,
a lampy powinny być ustawione prostopadle do powierzchni.
Do sterylizacji sprzętu medycznego jednorazowego użytku, surowców i preparatów
farmaceutycznych oraz utrwalania produktów spożywczych (świeżych i suszonych owoców i
warzyw, mięsa drobiowego, ryb, przypraw i ziół, a zwłaszcza do niszczenia mikroorganizmów w
zamkniętych pojemnikach, np. w konserwach) wykorzystuje się niekiedy promieniowanie
jonizujące (X, gamma), które charakteryzuje się bardzo dużą przenikliwością, energią i aktywnością
biologiczną. Ponieważ stosowanie dawek promieniowania pow.10 kGy (radiopasteryzacja,
radiosterylizacja) powoduje zmiany właściwości organoleptycznych, odżywczych i zdrowotnych
produktów, stąd do ich sterylizacji stosuje się dawki promieniowania nie przekraczające tej wartości
(raduryzacja, radycydacja). Raduryzacja to zmniejszenie ogólnej liczby mikroorganizmów i
zahamowanie rozwoju form przeżywających ten zabieg; radycydacja – zmniejszenie liczebności
populacji mikroorganizmów patogennych (np. Clostridium, Salmonella) i zahamowanie produkcji
toksyn bakteryjnych (np. jadu kiełbasianego przez Clostridium botulinum). Stosowanie tych metod
jest dozwolone tylko w niektórych krajach UE.
Promieniowanie jonizujące: generacja wolnych rodników OH•, H•, które atakują
makrocząsteczki, uszkodzenia DNA i białek
-
hydratacja cytozyny i uracylu w cząsteczkach jednoniciowych
-
powstawanie wiązań krzyżowych między niciami w cząsteczkach dwuniciowych
-
tworzenie dimerów tyminy oraz tyminy i cytozyny
Dawka pochłonięta jest miarą pochłaniania promieniowania przez różne materiały. Ściślej – jest to
energia jaką traci promieniowanie, a pochłania ośrodek, przez który promieniowanie przechodzi,
przypadająca na jednostkę masy tego ośrodka.
1 Gy (ang. the Gray) = jednostka dawki pochłoniętej = 100 radów = 1J/kg
46

Dawka letalna >200 Gy dla bakterii, 10 Gy dla człowieka
D10 (ang. decimal reduction value): dawka promieniowania niezbędna do zabicia 90% komórek
Wędzenie – konserwacja mięsa i produktów rybnych. Zmniejszenie zawartości wody i nasycenie
produktów takimi substancjami jak fenole, krezole, aldehydy, kwas octowy, kwas mrówkowy.
Wysuszanie – Spory bakteryjne aby wykiełkować potrzebują określonej wilgotności, zazwyczaj
powyżej 10%.
Chemiczne metody ograniczania wzrostu bakterii:
Mechanizm działania związany jest w pierwszym rzędzie ze strukturą chemiczną i właściwościami
substancji biologicznie czynnej związku. W zależności od tych czynników, a także od koncentracji
efektem może być zahamowanie wzrostu i rozwoju mikroorganizmów (działanie statyczne) lub w
następstwie oddziaływania na zasadnicze struktury lub szlaki metaboliczne ich zabicie (działanie
bakterio- lub grzybobójcze). Polegać ono może na: uszkadzaniu lub zmianie przepuszczalności
ściany komórkowej i błony cytoplazmatycznej oraz wypływie do środowiska zewnętrznego
składników komórki; utlenianiu struktur komórkowych i zakłóceniu procesów metabolicznych
mikroorganizmów; tworzeniu kompleksów z białkami - blokowaniu grup funkcyjnych (-NH2, -SH,
-COOH); dezaktywacji enzymów; spowodowaniu koagulacji cytoplazmy i denaturacji białek
(cytoplazmatycznych, enzymatycznych, kwasów nukleinowych).
Wykorzystanie takich środków dezynfekcyjnych, jak: aldehydy (mrówkowy, glutarowy, formalina),
związki fenolowe i pochodne fenoli (fenol, lizol, kwas karbolowy), związki chloru (podchloryn
sodowy, chloramina T), jodofory (połączenia jodu z polimerami lub SPC (zw powierzchniowo
czynne)), związki azotu (pochodne biguanidyny kw. glutaminowego i pirydyny), metale ciężkie,
jest bardzo często ograniczone jedynie do dezynfekcji powierzchni roboczych nie mających
kontaktu z żywnością, a w niektórych krajach zakazane. Wynika to z ich toksyczności (alergie,
zakłócenia metabolizmu), wywoływania podrażnień skóry i błon śluzowych, słabej biodegradacji,
długotrwałego przykrego zapachu, działania korozyjnego, wysokiej presji selekcyjnej i możliwości
wykształcenia się form odpornych, uwarunkowania ich aktywności od czynników środowiskowych.
1. Fenole, krezole i lizol – działają na błonę bakteryjną i reagują z białkami.
Pochodną metylową fenolu jest krezol C6H4(CH3)OH, czyli hydroksytoluen. Ma silniejsze (10-
krotnie) działanie odkażające niż fenol. Mieszanina krezoli z mydłami żywicznymi to kreolina czyli
saprol, a mieszanina krezolu z mydłem potasowym to lizol.
2. Halogenki - są związkami fluoru, chloru, bromu i jodu (ta grupa pierwiatków nosi nazwę
halogeny od tworzące sole).
Związki chloru
Chlor jest gazem bardzo aktywnym chemicznie i silnie trującym dla wszystkich organizmów Łączy
się z grupami aminowymi aminokwasów i białek, wywołuje destabilizację białek
(Chlor był i nadal jest stosowany do produkcji bomb chemicznych. Chlorowe bomby chemiczne
zabijają nie tylko wszystkie organizmy, ale także niszczą całkowicie sprzęt wojskowy, zwłaszcza
metalowy).
Podchloryn wapnia i podchloryn sodu wchodzą w skład wielu środków piorących i czyszczących
do zastosowania w gospodarstwie domowym (np. ACE, Blux, Clorox - płyny). Związki te pod
wpływem kwasów i dwutlenku węgla uwalniają chlor. Podchloryn sodu w połączeniu z NaOH
tworzy silnie odkażający i żrący związek –alkaliczny roztwór podchlorynu sodu – antyforminę.
Antyformina stosowana jest w stomatologii do przepłukiwania kanałów zębowych.
Chloramina B – toluolosulfonochloramid sodu Zawiera 25% chloru. Działa odkażająco,
antyseptycznie, odwaniająco
Chlorheksydyna – środek bakteriobójczy i bakteriostatyczny szczególnie przydatny do zwalczania
47
bakterii gram-dodatnich. Nie drażni skóry i błon śluzowych. Ma duże znaczenie w antyseptyce
współczesnej. Używana jest do odkażania przewodów słuchowych, jamy nosowej, skóry jamy
ustnej i gardła narządów płciowych pęcherza moczowego, ran, sprzętu medycznego, materiałów
opatrunkowych, ponadto w stomatologii. Wchodzi w skład niektórych past do zębów, zalecanych
przy stanach zapalnych dziąseł i nieprzyjemnej woni z ust . Znana m.in. pod nazwą Sebidin
Chlorowanie wody
Cl2 + H2O H+ + Cl- + HOCl
HOCl – kwas podchlorowy, silnie
bakteriobójczy
HOCl H+ + OCl-
OCl- - podchloran, jeszcze silniej bakteriobójczy.
Aktywny tylko
w środowisku alkalicznym. Środek utleniający.
Związki jodu
Jod jest silnym środkiem antyseptycznym stosowanym do odkażania skóry nieuszkodzonej. Działa
bakteriobójczo, grzybobójczo i wirusobójczo, lecz drażni tkanki, wywołuje powierzchniową
nekrozę (martwicę) posmarowanej tkanki. Jod jest stosowany w formie 3-10% roztworu w 70% lub
95% alkoholu etylowym (jodyna). Jod reaguje z grupami aminowymi białek, hamując ich
aktywność. Wyzwala również tlen z roztworów wodnych co uzupełnia działanie odkażające.
Roztwory alkoholowe jodu denaturują białka strukturalne i enzymatyczne bakterii i grzybów. 7%
roztwór jodu w alkoholu zabija bakterie w ciągu 15 sekund.
Jodyna działa efektywnie na bakterie, endospory, grzyby i wirusy. Niszczy osłony bakteryjne.
W celu całkowitego rozpuszczenia jodu pierwiastkowego w roztworach alkoholowych i wodnych
dodaje się jodek potasu (np. w płynie Lugola).
Alkohole (etanol, izopropanol). Charakteryzuje je szerokie działanie biobójcze (formy
wegetatywne bakterii G+ i G-) uwarunkowane obecnością wody. Z tego też względu działają
najsilniej jako 50-70% roztwór wodny – w takich stężeniach wnikają głęboko w tkanki oraz do
komórek, działają dogłębnie. Wysokoprocentowe roztwory etanolu (lub propanolu, równie
skutecznego), tzn. powyżej 70% zbyt szybko denaturują białka wskutek czego działają
powierzchownie. Działanie odkażające alkoholu jest powodowane odciaganiem wody z komórek i
denaturacją białek strukturalnych oraz enzymatycznych. Alkohol uszkadza także otoczki lipidowe
bakterii.
Aktywność alkoholi wzrasta wraz ze wzrostem liczby molowej i liczby C w łańcuchu, a maleje w
obecności substancji organicznej. Są wykorzystywane do dezynfekcji systemów zamkniętych bez
konieczności płukania wodą, powierzchni roboczych, sprzętu i rąk.
Związki metali ciężkich. Metale ciężkie to metale, których gęstość przekracza 5 g/cm3. Zaliczamy
do nich m. in.: nikiel, miedź, kadm, ołów, rtęć i cynk.
Związki metali ciężkich zmieniają właściwości błon cytoplazmatycznych i inaktywują enzymy.
Związki rtęci
Rtęć nie działa bakteriobójczo, lecz bakteriostatycznie i fungistatycznie, bowiem jony rtęci
odwracalnie łączą się z grupami sulfhydrylowymi białek enzymatycznych. Po spadku stężenia
jonów rtęci w środowisku, zarodniki bakterii odzyskują zdolność do życia i wzrostu.
Sublimat, czyli chlorek rtęci (HgCl2 )był stosowany do odkażania ran (w rozcieńczeniu 1:5000),
jest stosowany do odkażania materiału siewnego i tkanek w hodowlach in vitro.
Wszystkie związki rtęci są toksyczne dla człowieka. Toksyczne są także opary metalicznej rtęci.
48

5. Substancje czynne powierzchniowo:
Mydła – detergenty anionowe
Czwartorzędowe związki amonowe – detergenty kationowe. (Sterinol, Dezogen).
Charakteryzuje je szerokie spektrum działania (bakterie G+ i G-, grzyby pleśniowe, drożdże,
wirusy, ameby; NIE działają na prątki gruźlicy i endospory ) i długotrwały efekt sterylizacyjny.
Ujemną stroną tych preparatów jest silna presja selekcyjna i możliwość uodpornienia się bakterii
G(-) (np. Proteus vulgaris i Serratia marcescens), co wymusza konieczność przemiennego ich
stosowania z preparatami o odmiennych mechanizmach działania (związkami nadtlenowymi,
podchlorynem). Ich aktywność ulega osłabieniu w obecności związków organicznych i mydła.
6. Kwasy organiczne, np. kwas benzoesowy
Działa silnie antyseptycznie, przeciwgrzybiczo, przeciwroztoczowo. Dawniej stosowano do
odkażania jamy nosowej, gardła i jamy ustnej.
7. Aldehydy, np. formaldehyd (roztwór wodny – formalina) Związek reaktywny, blokuje czynne
grupy, denaturuje białka i kwasy nukleinowe.
8. Gazy, np. tlenek etylenowy
tlenek etylenu : działanie alkalizujące (tworzy środowisko zasadowe)
dwutlenek siarki – dodaje się do soków
9. Związki nadtlenowe (kwas nadoctowy, nadtlenek wodoru, nadsiarczan potasowy).
Najpowszechniej stosowany kwas nadoctowy jest aktywny w stosunku do form wegetatywnych i
przetrwalnych bakterii. Ponieważ związek ten nie wykazuje właściwości korozyjnych i łatwo ulega
rozkładowi na produkty nieszkodliwe (woda, tlen, kwas octowy) dla produktów spożywczych,
może być stosowany do dezynfekcji systemów zamkniętych (np. w browarnictwie i winiarstwie)
bez konieczności przepłukiwania ich wodą. Taka procedura zapobiega powtórnemu skażeniu
systemu, gdy jakość mikrobiologiczna będącej do dyspozycji wody nie jest najlepsza. Ponadto
związek ten może być użyty do sterylizacji przedmiotów termowrażliwych i dezynfekcji rąk.
Woda utleniona – jest 3% roztworem nadtlenku wodoru H2O2. Silnie utleniający związek, łatwo
reaguje z białkami.
Woda utleniona pod wpływem enzymów – katalaz rozpada się do wody i tlenu. Tlen działa
przeciwbakteryjnie, przeciwgrzybiczo i przeciwgnilnie.
10. Związki srebra. Srebro przyłącza się do grup tiolowych, karboksylowych i aminowych białek
strukturalnych i enzymatycznych unieczynniając ich aktywność biochemiczną. Jony srebra łączą się
także z kwasami nukleinowymi. Sole srebra działają silnie przeciwbakteryjnie a w większych
stężeniach również nekrotycznie. Dodanie do wody metalicznego srebra zabija zawarte w niej
bakterie. W przypadku zastosowania roztworów soli srebrowych na skórę i błony śluzowe należy
podkreślić jedynie powierzchowne ich działanie antyseptyczne z powodu koagulacji białek; bariera
zdenaturowanego białka uniemożliwia głębsze wnikanie preparatu.
11. Nadmanganian potasu KMnO4 należy do grupy środków antyseptycznych utleniających. Pod
wpływem związków organicznych /np. białek/ ulega redukcji i wydziela tlen niszczący bakterie,
grzyby i pierwotniaki. Duże znaczenie antyseptyczne mają również wolne jony manganu. Działa
49
C
H
2
CH
2
O

ściągająco, przeciwzapalnie, przeciwropnie, bakteriobójczo, bakteriostatycznie, grzybobójczo,
fungistatycznie, przeciwwirusowo i przeciwpierwotniakowo. Odwania i odwadnia tkanki. Roztwory
stężone działają barwiąco i żrąco na skórę. Nadmanganian potasu unieszkodliwia jady
bezkręgowców i kręgowców.
50
Document Outline
- Oddychanie azotanowe czyli tzw.dysymilacyja redukcja azotanów:
- Łańcuch transportu elektronów u prokariotów
- Fizyczne metody ograniczania wzrostu bakterii:
- Nasycona para wodna:
- Chemiczne metody ograniczania wzrostu bakterii:
Wyszukiwarka
Podobne podstrony:
Hodowla bakterii
hodowla bakterii beztlenowych, Nauka ściągi
Metody hodowli bakterii beztlenowych
Metabolizm bakterii1, Mikrobiologia
mikro ćw 6, Ćwiczenie 6: Metabolizm bakterii - odżywianie
Ćwiczenie 4 Formy morfologiczne bakterii, Anaerostat i hodowla beztlenowców
Metody hodowli i identyfikacji bakterii
Hodowla i identyfikacja bakterii, Nieuporządkowane, Materiały tekstowe
Metabolizm bakterii1, Mikrobiologia
ćw metabolizm bakterii tabelka
Bakterie spiralne do druk
choroby wirus i bakter ukł odd Bo
więcej podobnych podstron