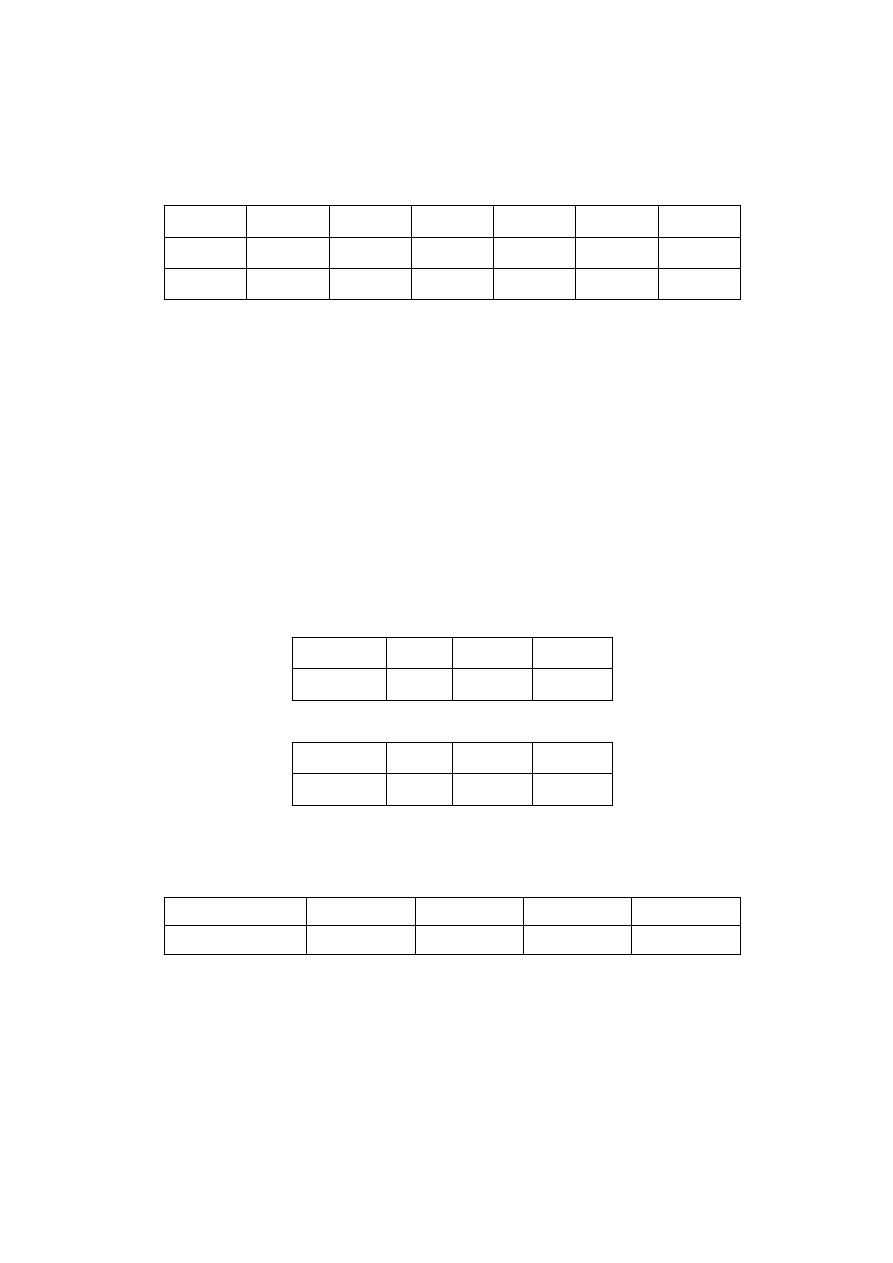
LISTA 12
Kinetyka – mechanizmy reakcji
1. Badano reakcję rozpadu termicznego etanu na eten i wodór, mierząc czas połowicznego
przereagowania w zależności od ciśnienia początkowego i temperatury. Otrzymano następujące
wyniki:
T [K]
900
900
950
1000
1500
1100
(p/p
o
)
t=0
0,15
0,30
0,30
0,30
0,30
0,30
τ
1/2
[s]
491,1
490,2
51,1
6,8
1,1
0,2
Obliczyć rząd reakcji, jej doświadczalną energię aktywacji oraz zmianę entropii aktywacji. Odp.: I
rząd; 320,7 kJ/mol; 38,34 J/(mol·K).
2. Reakcja rozkładu kwasu acetonodwukarbonowego CO(CH
2
COOH)
2
= CO(CH
3
)
2
+ 2CO
2
jest
reakcją pierwszego rzędu. Okres połowicznej przemiany w temp. 273,2 K wynosi 28180 min, a w
temp. 313,2 K – 120 min. Obliczyć czas, w którym kwas przereaguje w 70 % w temperaturze 323,2 K.
Odp.: 65,76 min.
3. W reakcji II rzędu A + B = P stężenia początkowe substratów wynoszą c
oA
= c
oB
= 0,1 mol·dm
-3
. W
temperaturze 300,2 K 90 % substratów przereagowało w ciągu 200 minut, a w temperaturze 320,2 K –
w ciągu 40 minut. Obliczyć czas potrzebny do przereagowania 99 % substratów w temperaturze 330 K
przy stężeniach początkowych substratów równych 0,01 mol·dm
-3
. Odp.: 2117 min.
4. Badając w temperaturze 1373 K reakcję termicznego rozkładu amoniaku na katalizatorze, który
stanowił drut wolframowy, znaleziono następujące wartości czasu połowicznej przemiany dla różnych
ciśnień początkowych NH
3
:
zakres wyższych ciśnień
t [s]
456
222
102
p·10
-3
[Pa]
35,3
17,3
7,73
zakres niskich ciśnień
t [s]
60
54
48
p·10
-2
[Pa]
21,3
10,65
5,3
Wyznaczyć rząd reakcji dla obu zakresów ciśnienia. Odp.: 0 rząd; I rząd.
5. Stała szybkości rozpadu termicznego N
2
O
5
(reakcja I rzędu) w fazie gazowej w zależności od
temperatury wynosi:
T [K]
273
298
318
338
k [s
-1
]
7,8·10
-7
3,3·10
-5
5,0·10
-4
5,0·10
-3
Obliczyć energię aktywacji, wartość czynnika częstości A występującego we wzorze Arrheniusa,
standardową zmianę entalpii i entropii aktywacji w 273 K.
Odp.: 104 kJ/mol; 5,23·10
13
s
-1
; 101 kJ/mol; 10 J/(mol·K).
6. W 338 K stała szybkości reakcji rozpadu N
2
O
5
w fazie gazowej wynosi 0,292 min
-1
, zaś energia
aktywacji 103,2 kJ. Obliczyć stałą szybkości reakcji i czas połowicznej przemiany w temp. 353 K.
Odp.: 1,39 min
-1
; 0,50 min.

7. Mutarotacja glukozy, która przebiega powoli w czystej wodzie, jest słabo katalizowana przez jony
hydroniowe oraz mocno przez jony hydroksylowe. Stałą szybkości tego procesu można w przybliżeniu
opisać następującym wzorem:
3
3
0
H O
H O
OH
OH
k
k
k
c
k
c
+
+
−
−
= +
⋅
+
⋅
w którym wymiar k jest podany w min
−
1
k
o
oznacza stałą szybkości reakcji w czystej wodzie, a
+
3
H O
k
i
k
OH
-
są to katalityczne stałe szybkości odpowiednich jonów. Stała szybkości k w roztworze 4,8·10
-3
mol·dm
-3
kwasu solnego wynosiła 6,00·10
-3
min
-1
, a w roztworze 2,47·10
-2
mol·dm
-3
HCl wynosiła
8,92·10
-3
min
-1
. Na podstawie tych danych należy obliczyć wartości k
o
i
+
3
H O
k
.
Odp.: 5,3·10
-3
min
-1
; 0,147 dm
3
·mol
-1
·min
-1
.
8. Dla reakcji autokatalitycznej
1
2
k
k
A
B
C
D
→
+
+
←
szybkość reakcji jest wyrażona jako:
1
2
A
A B
A C
dc
k c c
k c c
dt
υ
= −
=
+
. Stała szybkości reakcji k
1
= 1,5·10
-3
dm
3
mol
-1
·min
-1
oraz k
2
= 8·10
-3
dm
3
mol
-1
·min
-1
, a stężenie początkowe substratów c
oA
= c
oB
= 0,02 mol·dm
-3
. Ile wynosi stężenie A dla
maksymalnej wartości szybkości reakcji?
Odp.: 1,23·10
-2
mol·dm
-3
.
9. Michaelis i Menten w swojej klasycznej pracy na temat kinetyki inwersji sacharozy katalizowanej
enzymem inwertazą wyznaczali zmiany kąta skręcenia płaszczyzny polaryzacji światła przez
roztwory sacharozy, następujące w wyniku przebiegu reakcji. Roztwory, których pH utrzymywano za
pomocą buforu na wartości 4,7 zawierały zawsze jednakową ilość enzymu natomiast różne
początkowe ilości sacharozy. W jednej serii doświadczeń wykonanej w 298 K znaleziono wartości
początkowej szybkości reakcji (wyrażonej w umownych jednostkach stopniach kątowych na minutę
(
°⋅
min
–1
) jako funkcję początkowego stężenia sacharozy [S]
0
:
[S
o
] [mol
⋅
dm
–3
] 0,0052 0,0104 0,0208 0,0416 0,0833 0,1670 0,3330
υ
o
[
°⋅
min
–1
]
0,866
1,466
2,114
2,666
3,236
3,636
3,636
(
α
ο
–
α
∝
) [
°
]
0,293
0,630
1,190
2,247
4,560
9,350
18,570
Wartości podane w ostatnim wierszu tabeli przedstawiają zmianę kąta skręcenia płaszczyzny
polaryzacji światła po całkowitym przereagowaniu i pozwalają przeliczyć szybkość reakcji na wartość
wyrażoną w jednostkach [mol
⋅
dm
–3
⋅
s
–1
]. Obliczyć wartość stałej Michaelisa K
M
i maksymalną
szybkość reakcji w roztworze o danym stężeniu katalizatora.
Odp.: 1,94
⋅⋅⋅⋅
10
–2
mol
⋅⋅⋅⋅
dm
–3
; 1,90
⋅⋅⋅⋅
10
–3
mol
⋅⋅⋅⋅
dm
-3
⋅⋅⋅⋅
s
–1
.
10. Stała Michaelisa reakcji katalizowanej enzymatycznie w temp. 298 K wynosi 0,035 mol
⋅
dm
–3
.
Szybkość tej reakcji przy stężeniu substratu 0,110 mol
⋅
dm
–3
wynosi 1,15
⋅
10
–3
mol
⋅
dm
–3
⋅
s
–1
. Jaka jest
maksymalna szybkość tej reakcji? Odp.: 1,52
⋅⋅⋅⋅
10
–3
mol
⋅⋅⋅⋅
dm
–3
⋅⋅⋅⋅
s
–1
.
Wyszukiwarka
Podobne podstrony:
Lista 12 rozdzial 30 PL
Lista 12, rozdzial 30 EN
lista 12 2
Matematyka III (Ćw) - Lista 12 - Całki oznaczone, Zadania
Lista 12, Lista 12
Matematyka III (Ćw) Lista 12 Całki oznaczone Zadania
Lista 12
LISTA 12 Zwyczajne, liniowe równania różniczkowe II go rzędu o stałych współczynnikach
lista 12 1 id 269817 Nieznany
Matematyka III (Ćw) Lista 12 Całki oznaczone Odpowiedzi
LOG NST LISTA 12
lista 12 2
nasza lista 1 12
nasza lista 1 12
lista 12 1
lista 12 2
więcej podobnych podstron