1
CHEMIOTERAPIA
NOWOTWORÓW
Doc. dr hab. farm. Jacek Sapa
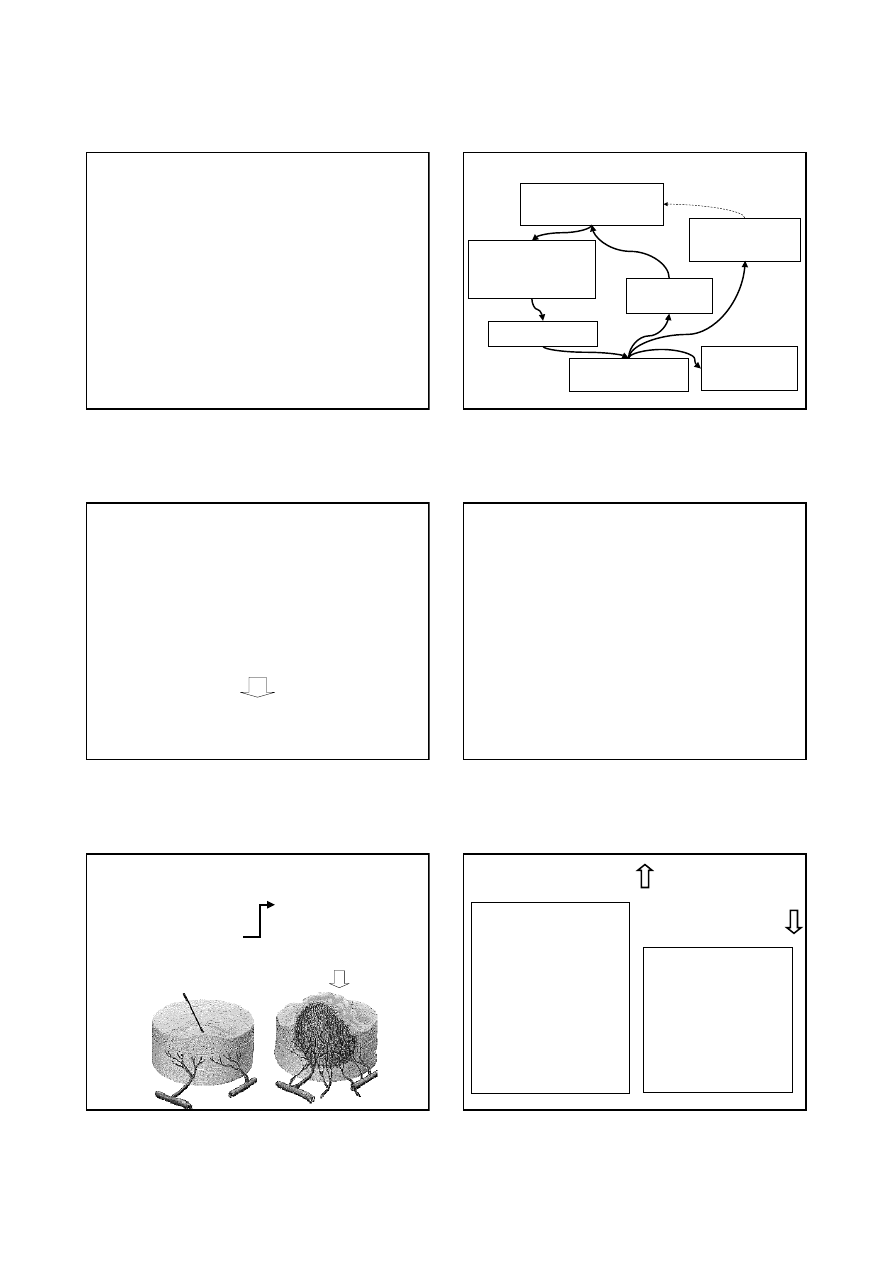
CYKL KOMÓRKOWY –
okres od jednego do drugiego podziału komórki
G
1
– faza wzrostu 1
wzrost komórki i różnicowanie określonych
struktur cytoplazmatycznych, ilość DNA stała,
synteza RNA i niektórych swoistych białek
S
faza aktywnej syntezy DNA,
tworzenie podwójnej
ilości DNA, garnitur chromosomowy
zostaje podwojony
i komórka przygotowuje się do podziału
G
2
– faza wzrostu 2
faza między syntezą DNA a mitozą
M – faza mitozy
zachodzi podział komórek
(profaza, metafaza, anafaza, telofaza)
Komórki nieklonogeniczne
nieproliferujące, opuszczają
cykl podziałowy, dojrzewają
różnicują się i umierają
(np. granulocyty)
Komórki klonogeniczne
proliferujące, które
regularnie przechodzą
przez cykl komórkowy
Komórki klonogeniczne
nieproliferujące, spoczynkowe
przechodzą do fazy spoczynkowej
G
0
. mogą pod wpływem
pewnych czynników wejść do cyklu
Cechy komórek nowotworowych wyróżniające
je od komórek normalnych
1. Niekontrolowana proliferacja
2. Brak różnicowania i utrata funkcji
3. Inwazyjność
4. Zdolność do tworzenia przerzutów
NOWOTWÓR
nieprawid
ł
owa tkanka rosnąca
niezależnie od mechanizmów kontroli
komórkowych
Apoptoza
samodestrukcyjny mechanizm komórki,
złożony z genetycznie zaprogramowanych
zjawisk biochemicznych prowadzących do
śmierci komórki
eliminacja w sposób celowany
niepotrzebnych lub uszkodzonych
komórek
komórki nowotworowe -
bardzo aktywne metabolicznie,
ulegają szybkim podziałom i
przemianom, w związku z tym
wymagają bardzo
dobrego unaczynienia
są w stanie przełączyć
swój fenotyp na tzw.
angiogenny, co prowadzi
do zaburzenia lokalnej
równowagi między
czynnikami stymulującymi
i hamującymi tworzenie
naczyń na korzyść tych
pierwszych
ANGIOGENEZA
Czynnik wzrostu fibroblastów (Fibroblast
Growth Factor
, FGF)
Naczyniowo-śródbłonkowy czynnik
wzrostu – VEGF
(
Vascular Endothelial Growth Factor
)
Łożyskowy czynnik wzrostu - PIGF
(
Placental
Growth Factor
)
Czynnik martwicy nowotworów-
– TNF-
(Tumor Necrosis Factor-
)
Czynnik stymulujący kolonie granulocytów
- G-CSF
Interleukina 8 (IL-8)
Czynnik wzrostu hepatocytów - HGF
(Hepatocyte Growth Factor)
Angiogenina
Transformujący czynnik wzrostu-
(TGF-)
Płytkowo-pochodny czynnik wzrostu
komórek śródbłonka - PDGF
(Platelet Derived
Endothelial cell Growth Factor)
Proliferyna
ENDOGENNE INHIBITORY
ANGIOGENEZY
Czynnik pŁytkowy-4 PF-4
(Platelet Factor-4)
Interferon-
(IFN-)
Trombospondyna
Tkankowy inhibitor metaloproteinaz
TIMP (Tissue Inhibitor of Metalloproteinases)
Prolaktyna
Angiostatyna
Łożyskowe białko związane z
proliferyną (Placental Proliferin-related
Protein)
Rozpuszczalny receptor zasadowego
czynnika wzrostu fibroblastów SFGF-R
ENDOGENNE STYMULATORY
ANGIOGENEZY
2
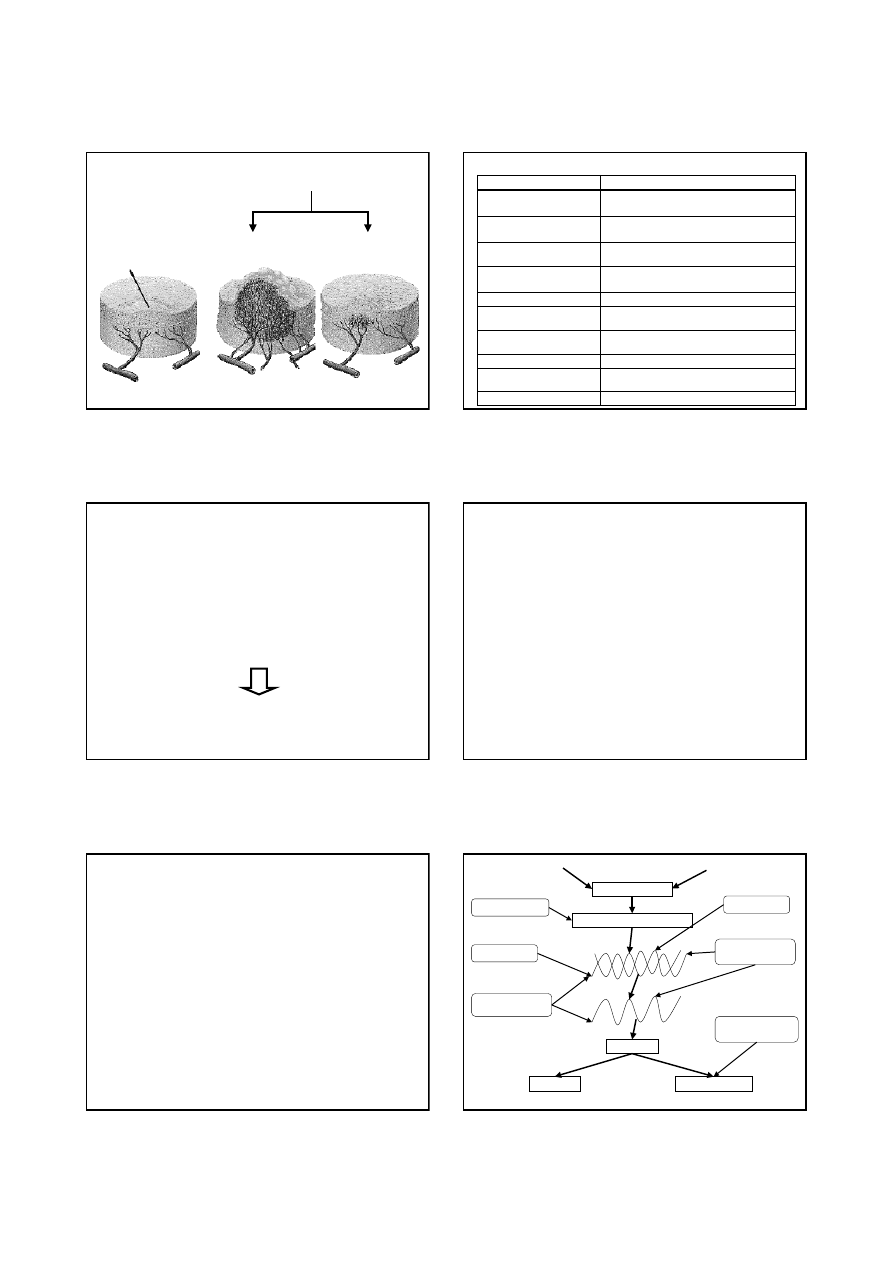
nowotwór
przedinwazyjny
angiogeneza
wzrost masy guza
redukcja
masy guza i naczyń
CHEMIOTERAPIA
+ INHIBITORY ANGIOGENEZY
hamowanie proliferacji śródbłonka
Płytkowy czynnik 4
nasilenie wytwarzania białka 10 indukowanego IFN-
g i/lub IL-12
Interleukina 12
zmniejszenie wytwarzania FGF
Interferon a
selektywne hamowanie proliferacji i migracji
komórek śródbłonka
Marimastat – inhibitor
metaloproteinaz
po połączeniu z integryną a
V
b
3
indukcja apoptozy
proliferujących komórek śródbłonka
Vitaxin – przeciwciało
monoklonalne a
V
b
3
inhibitor receptora 2 dla VEGF
SU 5416
antagonizm wobec VEGF
Przeciwciało monoklonalne
anty-VEGF
selektywne hamowanie proliferacji i migracji
komórek śródbłonka
TNP 470 (AGM 1470) inhibitor
metioniny, aminopeptydazy 2
hamowanie napływu jonów wapniowych do komórki
– ograniczenie proliferacji komórek śródbłonka
CAI
antagonista wapnia
Inicjacja stanu zapalnego w guzie-niszczenie
rosnących naczyń włosowatych
CM-101 – polisacharyd
egzotoksyna streptokokowa
m.in. antagonista TNF-a
Talidomid
INHIBITORY ANGIOGENEZY PODDAWANE PRÓBOM KLINICZNYM
Tworzenie przerzutów
1. intrawazacja
– przenikanie kom.
nowotworowych do układu krążenia
2. transport
3. ekstrawazacja
– przenikanie kom.
nowotworowych przez naczynia krwionośne
wzrost nowotworu w nowym
środowisku
Metody leczenia nowotworów
:
1. Zabieg chirurgiczny
2. Radioterapia
3. Chemioterapia
4. Hormonoterapia
5. Immunoterapia
6. Terapia genowa
Chemioterapia nowotworów
• Wyleczenie całkowite – nie zawsze możliwe
(oporność, ciężkie objawy niepożądane)
• Przejściowa remisja choroby, wydłużenie czasu
przeżycia
• Przerywane podawanie cytostatyków
• Komórki w fazie G
0
są niewrażliwe na cytostatyki
•Synchronizacja
• Polichemioterapia (opóźnienie rozwoju
oporności)
RYBONUKLEOTYDY
DEZOKSYRYBONUKLEOTYDY
BIAŁKA
ENZYMY
MIKROTUBULE
DNA
RNA
SYNTEZA PURYN
SYNTEZA PIRYMIDYN
BLEOMYCYNA
(uszkodzenie DNA)
CIS-PLATYNA
(wiązania krzyżowe DNA)
ALKALOIDY BARWINKA
TAKSANY
(hamowanie mikrotubuli)
METOTREKSAT
(hamowanie syntezy puryn)
CYTARABINA
(hamowanie polimerazy DNA
hamowanie funkcji RNA)
DOKSORUBICYNA
(hamowanie topoizomerazy II
hamowanie syntezy RNA)

3
ZASADY SKUTECZNEJ CHEMIOTERAPII
• Rozpoczynanie leczenia jak najwcześniej
mniejsza masa nowotworowa – większa wrażliwość na chemioterapię
W rozrośniętym nowotworze prawdopodobieństwo wytworzenia
lekoopornych klonów jest większe, przenikanie leku do tkanek
nowotworowych słabsze z powodu ich gorszego unaczynienia
• Dążenie do maksymalnego zniszczenia populacji
komórek nowotworowych
Jedna klonogeniczna komórka nowotworowa może zrodzić generację
komórek potomnych
masa nowotworu = 1g to stanowi > 10
9
komórek
CHEMIOTERAPIA daje możliwość zniszczenia 99.9% nowotworu
zniszczenie 99.9% 1g nowotworu pozostawi 1mg tj. 10
6
komórek!!!
ZASADY SKUTECZNEJ CHEMIOTERAPII
• Stosowanie maksymalnych tolerowanych dawek
chemioterapeutyków z przerwami, długotrwale
w odpowiedniej kolejności
Ograniczeniem stosowania dużych dawek jest działanie
uszkadzające prawidłowe szybko rosnące komórki (szpik,
komórki nabłonkowe, komórki immunokompetentne, gametocyty)
• Stosowanie terapii wspomagającej i ochronnej
• Terapia wielolekowa (polichemioterapia) – stosowanie
równocześnie kilku leków co daje lepsze wyniki
Wrażliwość nowotworów narządowych na
cytostatyki
DUŻA
nowotwory jądra, drobnokomórkowy rak płuca, mięsak Ewinga
mięsak z mięśni poprzecznie prążkowanych
UMIARKOWANA
rak piersi, rak jajnika, rak pęcherza, płaskonabłonkowe raki
głowy i szyi, mięsak kościopochodny
NIEWIELKA
rak trzustki, rak pęcherzyka żółciowego, rak żołądka,
rak jelita grubego i odbytnicy, rak nerki, mięsaki tkanek miękkich,
czerniak złośliwy, rak szyjki i trzonu macicy, rak tarczycy,
niedrobnokomórkowy rak płuca, chrzęstniakomięsak
OPORNOŚĆ NA CYTOSTATYKI
• Schemat zastosowany w niewłaściwym czasie
• Niewłaściwe kojarzenie cytostatyków
• Wytwarzanie przeciwciał inaktywujących
• Mutacja komórek nowotworowych
• Zmniejszenie aktywnego transportu leku do
komórki
• Wypompowywanie leku (P-glikoproteina)
• Inaktywacja cytostatyku (S-transferaza GSH)
• Zmiany struktur docelowych
• Zwiększona ekspresja białka
antyapoptotycznego
• Nasilona naprawa DNA
PRÓBY PRZEŁAMANIA OPORNOŚCI
• Kojarzenie metod chirurgicznych, chemioterapii,
radioterapii
• Miejscowe podawanie dużych dawek leku
• Łączenie cytostatyków o różnych punktach
uchwytu
• Werapamil, kompetycyjne wiązanie P-
glikoproteiny
LEKI ALKILUJĄCE
mają zdolność przyłączania, często przez wymianę atomu wodoru
bardzo reaktywnych rodników alkilowych do licznych grup funkcyjnych
w DNA
uszkodzenie biologicznej aktywności DNA
alkilacja prowadzi do zakłócenia procesów życiowych komórki.
Działania niepożądane :
układ krwiotwórczy – pancytopenia, małopłytkowość
układ chłonny – spadek odporności
tkanki nabłonkowe – nadżerki i owrzodzenia przewodu pokarmowego
wypadanie włosów
zaburzenia spermatogenezy i zaburzenia miesiączkowania
Możliwość powstania oporności krzyżowej
4
Pochodne iperytu azotowego:
•
chlormetyna (Nitrogranulogen)
•
cyklofosfamid (Endoxan)
•
ifosfamid (Holoxan)
•
trofosfamid (Trofosfamid)
•
mefalan (Alkeran)
•
chlorambucil (Leukeran)
Pochodne nitrozomocznika
oprócz działania alkilującego hamują również
pewne etapy enzymatyczne syntezy kwasów nukleinowych
karmustyna, lomustyna
semustyna, nimustyna,
fotemustyna
obecność jednej lub
dwóch grup chloroetylowych
streptozocyna, chlorozocyna
grupa chloroetylowa + reszta cukrowa
Łatwo przenikają przez barierę krew-mózg. Stosowane w
nowotworach pierwotnych i przerzutowych mózgu oraz
w ziarnicy złośliwej, czerniaku złośliwym innych
nowotworach narządowych
Kompleksy platyny
• CISPLATYNA (Blastolem, Platidiam,
Platinex)
• KARBOPLATYNA (Carboplatin,
Cycloplatin, Paraplatin)
• OKSALIPLATYNA (Eloxatin)
Rak jajnika, szyjki macicy, jądra, pęcherza
moczowego, oskrzela, głowy, szyi,
czerniak, mięsak
Antymetabolity
są związkami cechującymi się strukturalnym podobieństwem do
naturalnych metabolitów lub koenzymów występujących w
komórkowych układach biologicznych
hamują konkurencyjnie reakcje enzymatyczne lub zostają
wbudowane zamiast metabolitu w miejsce jednostki
budulcowej, niezbędnej do prawidłowych procesów życiowych
kom.
zahamowanie biosyntezy DNA, RNA, białek
śmierć komórki
są swoiste fazowo, zabijają komórki w fazie S
stosowane są w ostrej białaczce szpikowej i limfoblastycznej, w
oponowej postaci białaczki (metotreksat), w nowotworach
przewodu pokarmowego i innych narządów, są również
stosowane jako leki immunosupresyjne
Antymetabolity
Antagoniści kwasu foliowego – metotreksat,
edatreksat
Antagoniści pirymidyn – fluorouracyl, floksurydyna,
kapecytabina, tegafur, cytarabina, ralitreksed,
gemcytabina
Antagoniści puryn – merkaptopuryna, tioguanina
Inhibitory deaminazy adenozynowej – pentostatyna
Inne metabolity – fludarabina, kladrybina,
azacytydyna
Inhibitory topoizomerazy
5
Inhibitory topoizomerazy
Inhibitory
topoizomerazy I
• TOPOTEKAN
• IRINOTEKAN
• KAMPTOTECYNA
Inhibitory
topoizomerazy II
ETOPOZYD
TENIPOZYD
Inhibitory mitozy
hamowanie budowy
wrzeciona
mitotycznego
ALKALOIDY BARWINKA
WINKRYSTYNA
WINBLASTYNA
WINDEZYNA
WINORELBINA
stabilizacja mikrotubul
hamowanie mitozy
TAKSANY
PAKLITAKSEL
DOCETAKSEL
Antybiotyki cytotoksyczne
1. Aktinomycyny
2. Antracykliny
3. Bleomycyna
4. Mitomycyna
5. Mitoksantron
6. Amsakryna
Antracykliny
Antracykliny I generacji:
•
DAUNORUBICYNA (Cerubidin) - w ostrej białaczce
limfoblastycznej i szpikowej
•
DOKSORUBICYNA (Adriblastin) – w nowotworach
narządowych
Antracykliny II generacji:
•
AKLARUBICYNA
•
EPIRUBICYNA (Farmorubicyna), mniejsza
kardiotoksyczność
•
IDARUBICYNA (Zavedox), większa lipofilność
!!!KARDIOTOKSYCZNOŚĆ!!!
TALIDOMID –
DZIAŁANIE P/ZAPALNE, IMMUNOMODULACYJNE
HAMUJĄCE ANGIOGENEZĘ, POBUDZAJĄCE APOPTOZĘ W
KOMÓRKACH
NACZYŃ KRWIONOŚNYCH
MECHANIZMY DZIAŁANIA
Zahamowanie wytwarzania TNF
Zwiększenie syntezy IL-2 przez komórki jednojądrowe
Zwiększenie lub zmniejszenie syntezy IFN-γ
Zahamowanie wytwarzania IL-6, IL-10 i IL-12
Zwiększenie wytwarzania IL-4 i IL-5
Zwiększenie liczby limfocytów CD4+ i CD8+
Kostymulacja limfocytów T
Zahamowanie angiogenezy
Zwiększenie ekspresji cząstek adhezyjnych
Wpływ na ekspresję cząstek adhezyjnych na komórkach szpiczaka i
mikrośrodowiska
wzrost częstości podziałów komórkowych
blokada naprawy DNA - wzrost mutacji
hamowanie apoptozy
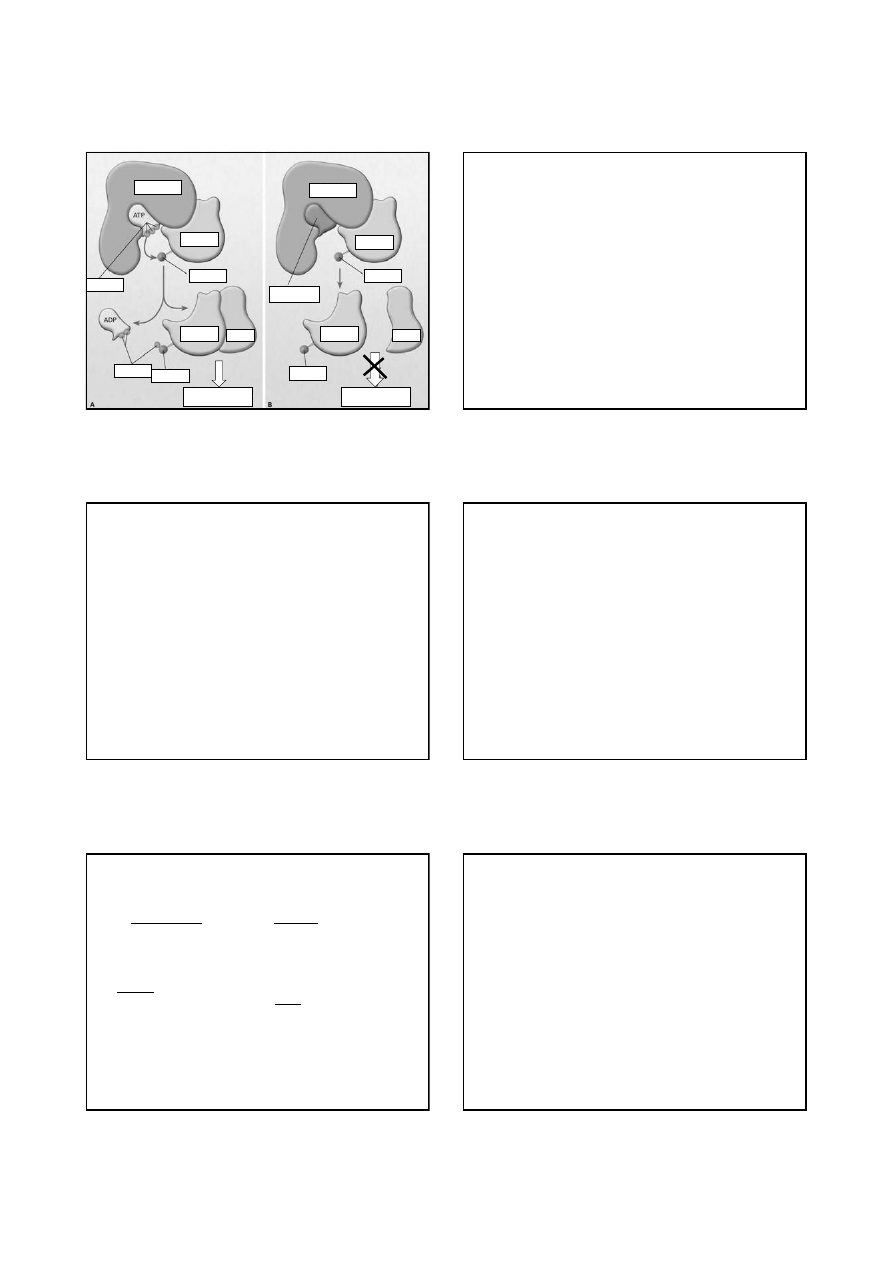
blokery
kinazy tyrozynowej
IMATINIB
DASATINIB
bcr
abl
bcr abl
proonkogen
koduje białko
kinazy tyrozynowej:
różnicowanie, podział,
adhezja komórek
onkogen
brak kontroli
genu
wzrost komórek
białaczkowych
Leczenie przewlekłej białaczki szpikowej
6
BCR-ABL
BCR-ABL
substrat
substrat
substrat
substrat
efektor
efektor
fosforan
fosforan
tyrozyna
tyrozyna
tyrozyna
tyrozyna
białaczka
białaczka
IMATINIB
IMATINIB (Glivec)
– hamuje kinazę tyrozyny BCR/ABL,
której obecność powoduje niekontrolowną proliferację
i zahamowanie apoptozy krwinek białych.
Stosowany jest doustnie w dawce 400-600 mg
Najczęstsze objawy niepożądane : nudności, wymioty,
obrzęki, kurcze mięśniowe, biegunka, bóle głowy,
rzadziej – małopłytkowość, neutropenia
Stosowany w przewlekłej białaczce szpikowej Ph+
oraz próbuje się stosować
w ostrej białaczce limfoblastycznej Ph+
Wstępne wyniki w PBS (opornej na IFN) :
odpowiedź hematologiczna –
95% chorych
pełna eradykacja komórek Ph+ u
40% chorych
NIEPOŻĄDANE NASTĘPSTWA
CHEMIOTERAPII
NOWOTWORÓW
SPOSOBY ICH ZWALCZANIA I
ZAPOBIEGANIA
Toksyczność cytostatyków, może prowadzić
do:
• uszkodzenia układu krwiotwórczego: leukopenia, skaza
krwotoczna spowodowana małopłytkowością,
niedokrwistość
• zniszczenia układu chłonnego, granulocytopenii:
osłabienie sił odpornościowych organizmu
• uszkodzenia tkanek nabłonkowych: biegunka,
owrzodzenia i nadżerki przewodu pokarmowego, zmiany
skórne i wypadanie włosów
• uszkodzenia kom. rozrodczych: zaburzenia
spermatogenezy lub zaburzenia miesiączkowania
• nadmierna zawartość moczanów i kwasu moczowego,
towarzysząca szybkiemu rozpadowi nowotworu: objawy
skazy moczanowej i niewydolności nerek
Powikłania chemioterapii, ze względu na czas wystąpienia
można podzielić na:
1.
1. natychmiastowe
•
nudności
•
wymioty
•
odczyny uczuleniowe
2. wczesne
•
objawy supresji szpiku
•
zapalenie błon śluzowych
jamy ustnej, przewodu
pokarmowego
•
biegunka
•
wypadanie włosów
3. opóźnione
• neuropatia obwodowa
• kardiomiopatia
• niedokrwistość
• zwłóknienie płuc
• uszkodzenie hepatocytów
• aspermia
4. późne
• hypogonadyzm
• przedwczesna menopauza
• bezpłodność
• azoospermia
• wtórne nowotwory (ostra
białaczka, chłoniaki,
nowotwory narządowe)
Cytostatyki pobudzają ośrodek
wymiotny umiejscowiony w
grzbietowo-bocznej cześci tworu
siatkowatego rdzenia
przedłużonego, w pobliżu dna
komory czwartej mózgu

7
• Leki o wysokiej emetogenności
(wymioty > 10 razy/dobę u ponad 90%)
duże dawki: cisplatyna, dakarbazyna,
daktynomycyna, chlormetyna, cyklofosfamid, cytarabina
• Leki o średniej emetogenności
(wymioty 5-10 razy/dobę u 30-90%)
fluorouracyl, metotreksat, mitomycyna,
antracykliny, ifosfamid, małe dawki
cyklofosfamidu
• Leki o niskiej emetogenności
(wymioty < 5 razy/dobę < 30%)
bleomycyna, alkaloidy barwinka,
paklitaksel, busulfan, chlorambucil, topotekan
ANTYHISTAMINIKI
I CHOLINOLITYKI
cyklizyna
dimenhydrynat
prometazyna
fenotiazyny
CHOLINOLITYKI
bromowodorek
hioscyny
ANTAGONIŚCI
rec. 5HT
2
lewomepromazyna
ANTAGONIŚCI rec. D
2
haloperidol
poch. fenotiazyny
metoklopramid
ANTAGONIŚCI rec. 5HT
3
granisetron (Kytril)
ondansetron (Zofran)
tropisetron (Navoban)
dolasetron (Anzemet)
palonosetron
benzodwuazepiny – lorazepam
kanabinoidy – nabilon
glikokortykosteroidy – deksametazon
(zmniejszenienie przepuszczalności bariery krew-mózg
dla substancji emetogennych, zmniejszenie w neuronach
pnia mózgu GABA, zmniejszenie enkefaliny i prostaglandyn)
• granulocytopenia
• małopłytkowość
• niedokrwistość hemolityczna
• niedokrwistość
makromegaloblastyczna
Postępowanie w granulocytopenii
• czynniki wzrostu granulocytów
(G-CSF)-filgrastim, lenograstim
• granulocytowo-makrofagowy czynnik wzrostu
(GM-CSF) – molgramostim (Leucomax)
Postępowanie w granulocytopenii
Wprowadzenie pegylowanych granulocytarnych czynników wzrostu.
Pegylacja polega na przyłączeniu do cząsteczki macierzystej glikolu
polietylenowego 20 kD, co powoduje powstanie cząsteczki o wydłużonym
półokresie trwania.
Pegfilgrastim (Neulasta, Amgen) – pegylowany filgrastim
(t
1/2
=46-62 godz. jednorazowe podanie w czasie cyklu
chemioterapii)
Leridistim – stymulator granulo- i trombopoezy
8
Postępowanie w małopłytkowości
•
przetaczanie koncentratów krwinek
płytkowych
• trombopoetyna (Tpo) – stymulator proliferacji
i różnicowania megakariocytów i płytek
• rekombinowana interleukina-11 (Neumega)-
stymulator
megakariopoezy, zwiększenie liczby płytek już
po 14 dniach leczenia
Postępowanie w niedokrwistości
•
przetoczenie koncentratu krwinek czerwonych
• erytropoetyna Epo – pobudzenie erytropoezy
• darbepoetyna i CERA (aktywator receptora Epo)
– (dłuższy okres półtrwania)
Ochrona komórek prawidłowych
(cytoprotekcja)
AMIFOSTYNA (ETHYOL)
fosfataza alkaliczna
w komórkach zdrowych
AKTYWNY TIOL
(stężenie 100-krotnie
wyższe w komórkach
prawidłowych)
ochrona przed uszkodzeniem DNA
Immunoterapia nowotworów
FORMY IMMUNOTERAPII NOWOTWORÓW:
•
Immunoterapia czynna – uzyskanie efektu
leczniczego poprzez wzmożenie reaktywności
immunologicznej pacjenta
1. Podanie antygenów nowotworowych (i.c.s.)
2. Aktywacja mechanizmów immunologicznych
preparatami immunostymulującymi np.
•
Cytokiny (aldesleukina, INF, TNF)
•
Zawiesina BCG – wlewy do pęcherza moczowego
•
Połączenie 5-FU i lewamizolu (i.c.n.)
Rituksymab
– chimeryczne przeciwciało IgG
1
kappa, w którym
region zmienny pochodzi z mysiego przeciwciała anty-CD20
Działa cytotoksycznie na limfocyty B CD20+
Zmniejszenie o 90% limfocytów B w ciągu 3 dni po podaniu
Stosowany dożylnie w dawce jednorazowej 375 mg/m
2
/tydzień przez 4 tygodnie
Zastosowanie :
terapia lekoopornych i nawrotowych postaci chłonniaków z linii B
oraz chłonniaków o dużym stopniu złośliwości
Działania niepożądane:
gorączka, dreszcze, nudności, wymioty,
zaczerwienienie skóry, pokrzywka, ból głowy, duszność,
skurcz oskrzeli, obniżenie ciśnienia.
Premedykacja farmakologiczna przed podaniem : paracetamol, leki p/histaminowe,
glikokortykosteroidy
Alemtuzumab
– humanizowane przeciwciało monoklonalne
klasy IgG
1
skierowane przeciwko antygenowi CD52, obecnemu
na powierzchni prawidłowych i nowotworowych limfocytów T i B
Powoduję lizę komórek CD52+ w mechanizmie
cytotoksyczności zależnej od przeciwciał
i poprzez aktywację układu dopełniacza
Stosowany dożylnie 30 mg 3 x w tygodniu przez 12 tygodni
ZASTOSOWANIE :
przewlekła białaczka limfocytowa oporna na analogi puryn,
chłonniaki nieziarnicze o małym stopniu złośliwości
Działanie niepożądane :
dreszcze, gorączka, nudności,
spadek ciśnienia, limfocytopenia, immunosupresja,
mielosupresja
9
Gemtuzumab ozogamycin
– humanizowane przeciwciało
monoklonalne anty-CD33 (CD33 występuję u ponad 80% chorych na OBS)
klasy IgG
4
sprzężone z cytotoksycznym antybiotykiem kalicheamycyną
Kompleks antygen-przeciwciało jest internalizowany
przez komórkę docelową a kalicheamycyna uwalniana
w komórkach białaczkowych przyłącza się do DNA powodując
jego pękanie i w efekcie śmierć komórki
Stosowany dożylnie 9 mg/m
2
dwukrotnie w odstępie 14 dni
ZASTOSOWANIE:
nawrotowa ostra białaczka szpikowa u chorych >60 lat
z antygenem CD33
trwają próby z zastosowaniem w młodszym wieku i w innych
postaciach białaczek
Działanie niepożądane :
dreszcze, gorączka, nudności, wymioty,
bóle głowy, mielosupresja, hepatotoksyczność, zapalenie
błon śluzowych
Proteasom
jest kompleksem enzymów, znajdującym się w cytoplazmie
komórki, który degraduje białka przeznaczone do usunięcia.
Kluczową rolę w procesie hamowania wzrostu nowotworu
odgrywa czynnik jądrowy NF-κB
Bortezomib
jest silnym, odwracalnym w działaniu i swoistym
inhibitorem proteasomu. Zahamowanie działania proteasomu
prowadzi bezpośrednio do apoptozy komórek nowotworowych,
poprzez wpływ hamujący na ich wzrost, rozprzestrzenianie się
oraz angiogenezę.
Zablokowanie proteasomu prowadzi do zahamowania
aktywacji jądrowego czynnika NF-κB
(nuklear transcription
factor)
i do zahamowania rozwoju nowotworu.
Bortezomib
, hamując czynność proteasomu 26S, wpływa na
mechanizmy regulacyjne komórek nowotworowych i w
konsekwencji :
• bezpośrednio indukuje apoptozę komórek szpiczaka
plazmocytowego
• hamuje aktywację czynnika transkrypcyjnego NF-κB w komórkach
szpiczaka i jego mikrośrodowiska
• zmniejsza adherencję komórek szpiczakowych do komórek
podścieliska szpiku
• blokuje syntezę i międzykomórkowe oddziaływanie IL-6, będącej
podstawowym czynnikiem wzrostu komórek szpiczakowych
Wyszukiwarka
Podobne podstrony:
lipoproteiny dla analityki
Pytania egzaminacyjne dla Analityki Medycznej studia PODYP
biofizyka dla analityki medycznej i rok - pomiar wielkosci biofizycznych cz.1, I rok, I rok, biofizy
Zagadnienia dla analityki
Słowniczek dla Analityki Medycznej, PATOMORFOLOGIA, SŁOWNICZKI
1 zadania dla analityka
lipoproteiny dla analityki
Prezentacja wynikowa 2011 dla analityków 16 marca 2012 godz 16 00
Geometria analityczna, Matematyka dla Szkoły Podstawowej
Analityka zadania lista1 dla stud
egz, e (5), EGZAMIN Z CHEMII ANALITYCZNEJ DLA II ROKU CHEMII 2003/2004
egz, e (7), EGZAMIN Z CHEMII ANALITYCZNEJ DLA II ROKU CHEMII 2003/2004
Błocki Z Funkcje Analityczne Dla Sekcji Nieteoretycznych
Sprawozdanie chemia 6 Reakcje dla poszczególnych kationów III grupy analitycznej
Elementy algebry liniowej z geometrią analityczną dla informatyków
Elementy algebry liniowej z geometrią analityczną dla informatyków
więcej podobnych podstron