
Biochemia 2015/2016
Analityka medyczna II rok
Ćwiczenie: Lipoproteiny
osocza
mgr Agnieszka Wosiak

Funkcje lipidów w organizmie
ludzkim
• stanowią wydajne źródło energii
• izolacja termiczna
• izolacja elektryczna
• tworzą składniki komórkowe
występujące w błonach komórkowych,
mitochondriach
• Lipidy pod postacią lipoprotein są
transportowane w osoczu krwi do
większości tkanek celem ich
zużytkowania, bądź do tkanki
tłuszczowej, gdzie są
magazynowane.

Lipidy osocza w organizmie
ludzkim
Wyróżniamy 5 głównych klas lipidów osocza krwi:
• Triacyloglicerole – estry glicerolu i długołańcuchowych,
nasyconych i nienasyconych kwasów tłuszczowych
(zawierają 45% kwasów tłuszczowych osocza) – stanowią
największą grupę lipidowych składników pokarmowych
• Fosfolipidy – jedna z grup hydroksylowych glicerolu
zestryfikowana jest resztą fosforanową lub podstawiona
zasadą azotową (35% kwasów tłuszczowych)
• estry cholesterolu (15% kwasów tłuszczowych)
• wolny cholesterol (niezestryfikowany)
• wolne kwasy tłuszczowe (niezestryfikowane
długołańcuchowe kwasy tłuszczowe nasycone lub
nienasycone) – stanowią mniej niż 5% całkowitej ilości
kwasów tłuszczowych w osoczu, ale są najbardziej aktywną
frakcją lipidów osocza.
Nierozpuszczalne w wodzie lipidy, aby mogły być
transportowane w osoczu krwi do tkanek i narządów muszą
tworzyć kompleksy z amfipatycznymi lipidami i białkami,
tzw. lipoproteiny.

Lipoproteiny osocza
Wyróżniamy 5 klas lipoprotein o
znaczeniu diagnostycznym (poza WKT):
• Chylomikrony
• VLDL (lipoproteiny o bardzo małej
gęstości, lub pre β-lipoproteiny)
• IDL (lipoproteiny o pośredniej gęstości)
• LDL (lipoproteiny o małej gęstości, lub
β-lipoproteiny)
• HDL (lipoproteiny o dużej gęstości lub
α-lipoproteiny)
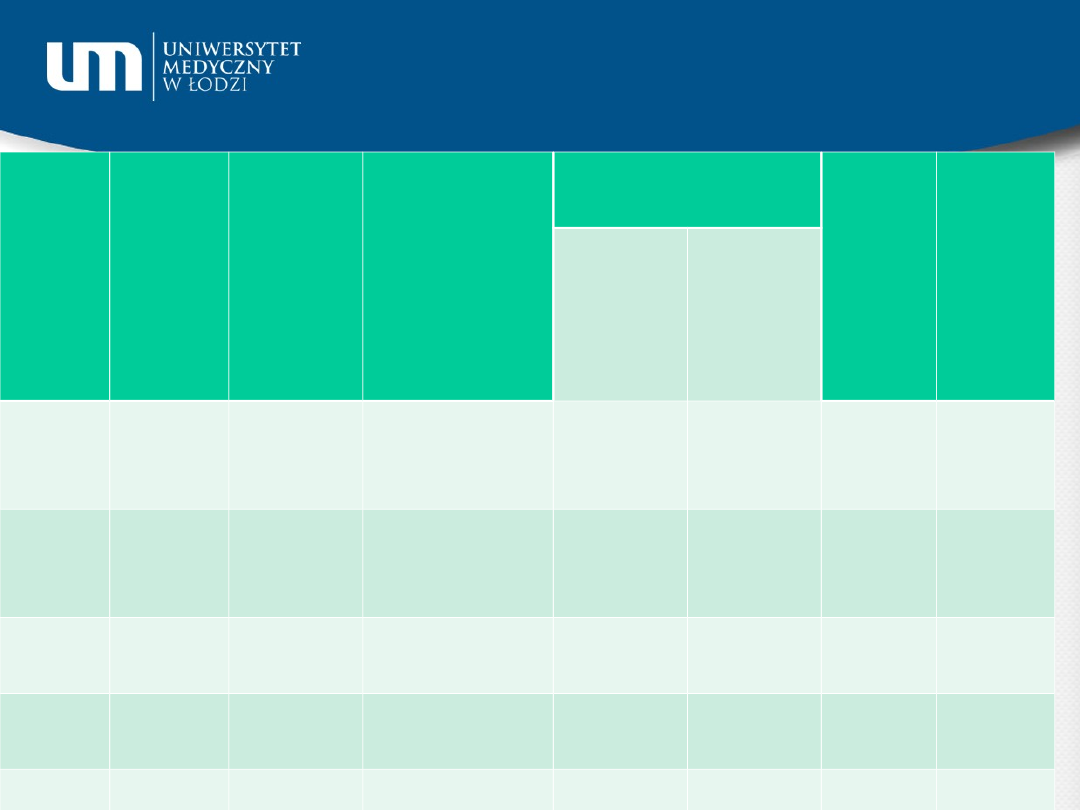
Klasa
lipop
rotei
n
Źródł
o
Średni
ca
cząste
czki
(nm)
Gęstość
(g/ml)
Skład
Głów
ne
lipidy
Apopr
oteiny
Białko
(%)
Lipidy
(%)
Chylo
mikro
ny
Jelito
90-1000
<0,95
1 – 2
98 – 99
TG
(86-
94%)
A, B-
48, C,
E
VLDL
Wątrob
a
30-90
<1,006
5 - 10
90 – 95
TG
(55-
65%)
B-100,
C, E
IDL
VLDL
25-35
1,006 –
1,019
15-20
85-80
TG,
CHOL
B-100,
C, E
LDL
VLDL
20-25
1,019 –
1,063
20-24
80-76
CHOL
B-100
HDL
Wątrob
ajelito,
VLDL,
chylo
mikron
y
5-25
1,063 –
1,210
45-50
55-50
FOSFO
LIPIDY,
CHOL
A, C,
D, E
Porównanie klas lipoprotein
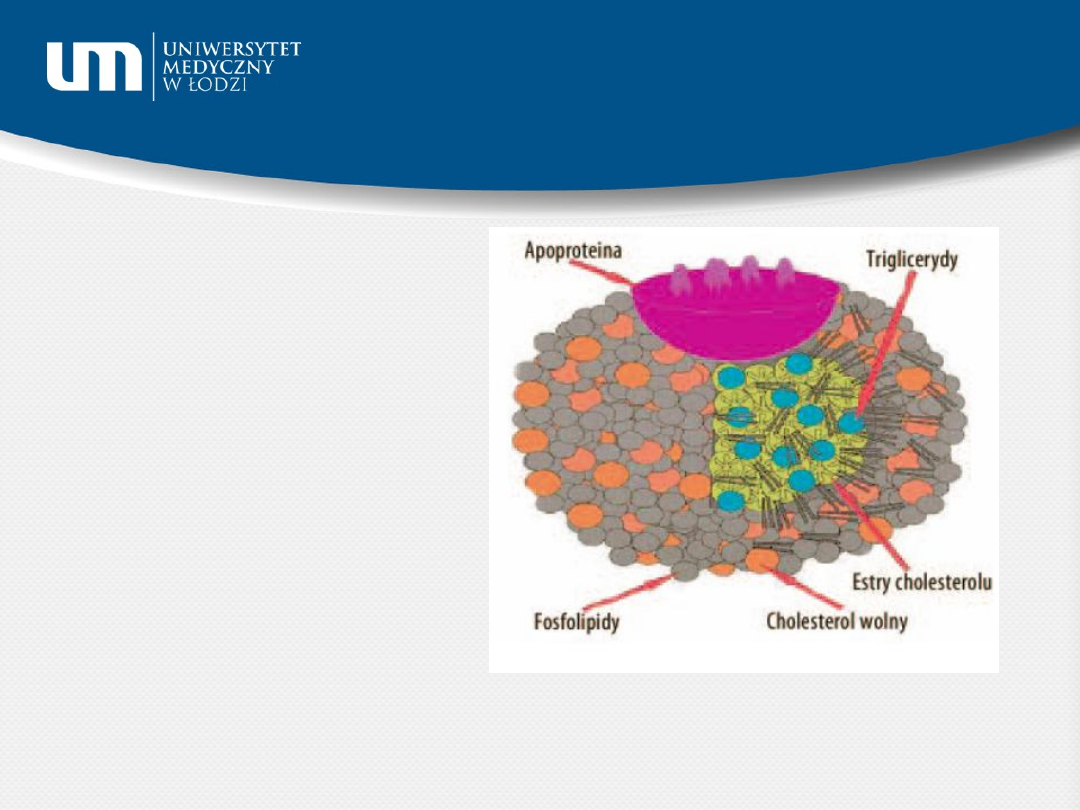
Schemat budowy cząsteczki
lipoproteinowej
- hydrofobowy
rdzeń lipidowy
- pojedyncza
warstwa
powierzchniowa
- apolipoproteiny
(integralne, np.
apoB
obwodowe, np.
apo C)
http://www.phmd.pl/fulltxthtml.php?
ICID=451197

Apolipoproteiny lipoprotein
osocza
• apo AI – główna apolipoproteina HDL
• Apo B48 – główna apoproteina
chylomikronów, syntetyzowana w
jelicie
• Apo B100 – główna apoproteina LDL
i VLDL, syntetyzowana w wątrobie
• Apo CI, CII, CIII – przenoszone
pomiędzy różnymi lipoproteinami
• Apo E – bogata w argininę, obecna
na VLDL, HDL, chylomikronach.

Funkcje apolipoprotein
1. Regulują aktywność enzymów
uczestniczących w przemianach lipoprotein:
• Są kofaktorami dla enzymów:
Apo CII – kofaktor pozawątrobowej lipazy
lipoproteinowej
Apo AI – kofaktor acylotransferazy
lecytyna:cholesterol (LCAT)
Apo CI, E – aktywatory LCAT
• Są inhibitorami enzymów:
Apo AII – inhibitor LCAT
Apo CIII – inhibitor LPL,
-hamuje wiązanie apoE z receptorami hepatocytów

Funkcje apolipoprotein
2. Są ligandami dla receptorów
lipoprotein w tkankach:
Apo AI – ligand dla receptorów HDL
Apo B100, apo E – ligand dla receptora
LDL
Apo E – ligand dla receptora
remnantów
3. Uczestniczą w przenoszeniu
lipidów
Apo D – białko przenoszące estry
cholesterolu w HDL

Pierwotne lipoproteiny –
chylomikrony i VLDL
Chylomikrony
• Są wytwarzane przez komórki jelita,
powstają w układzie
odprowadzającym chłonkę z jelita
• Uczestniczą w transporcie lipidów
(głównie triacylogliceroli)
dostarczanych z pokarmem z jelita
do większości tkanek (głównie mięśni
szkieletowych), gdzie są utleniane,
lub do tkanki tłuszczowej gdzie są
magazynowane

Pierwotne lipoproteiny –
chylomikrony i VLDL
VLDL
• Są wytwarzane przez hepatocyty
wątroby z lipidów pochodzenia
endogennego.
• Rola w transporcie lipidów (głównie
triacylogliceroli) z wątroby do tkanek
pozawątrobowych.

VLDL
• Zwiększona synteza VLDL w wątrobie
zachodzi podczas:
1.Stanu sytości, a nie głodzenia!
2.Karmienia pokarmami o dużej zawartości
węglowodanów
3.Dużego stężenia WKT w osoczu podczas
głodzenia
4.Spożywania etanolu
5.Występowania dużego stężenia insuliny, a
małego stężenia glukagonu

Pierwotne lipoproteiny –
chylomikrony i VLDL
• Lipoproteiny pierwotne po dostaniu
się przez układ limfatyczny do
krążenia posiadają apolipoproteinę B
(chylomikrony – B48, VLDL – B100).
Chylomikrony zawierają dodatkowo
apoA.
• Dopiero w układzie krążenia dochodzi
do przyłączenia apo C i E,
dostarczonych przez HDL, oraz utraty
przez chylomikrony apo AI i AII, które
przechodzą do HDL.
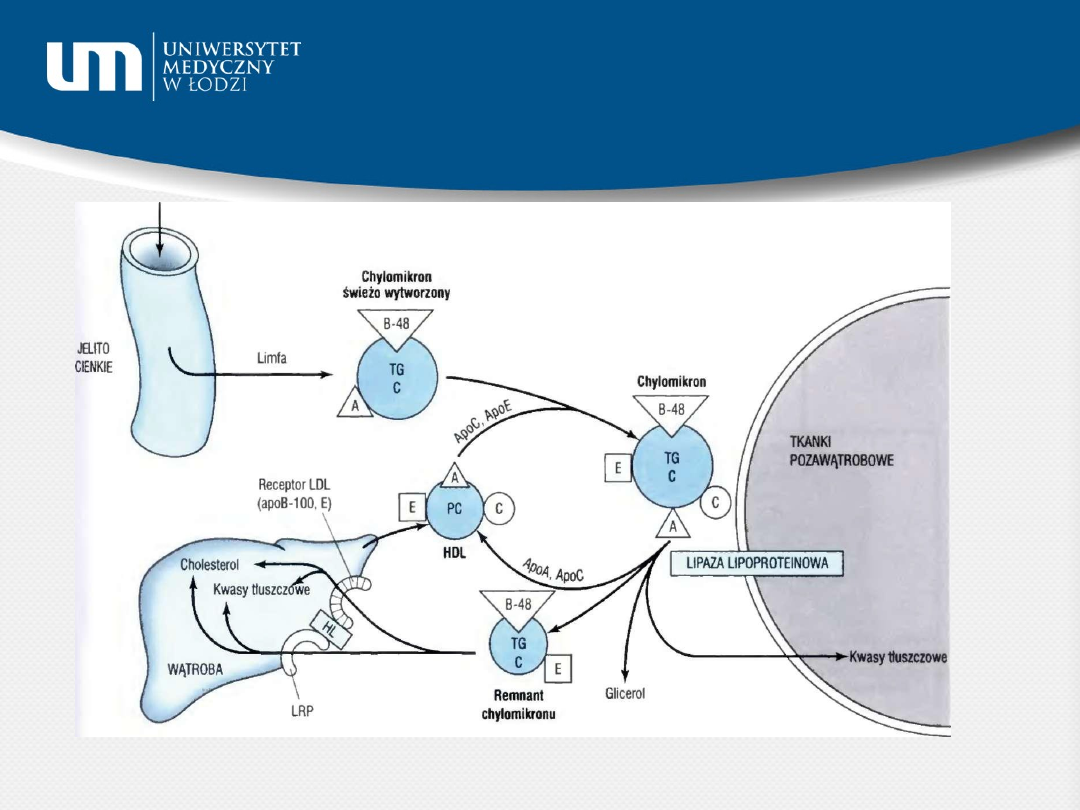
Pierwotne lipoproteiny –
chylomikrony i VLDL
Ilustrowana Biochemia Harpera, R. K. Murray
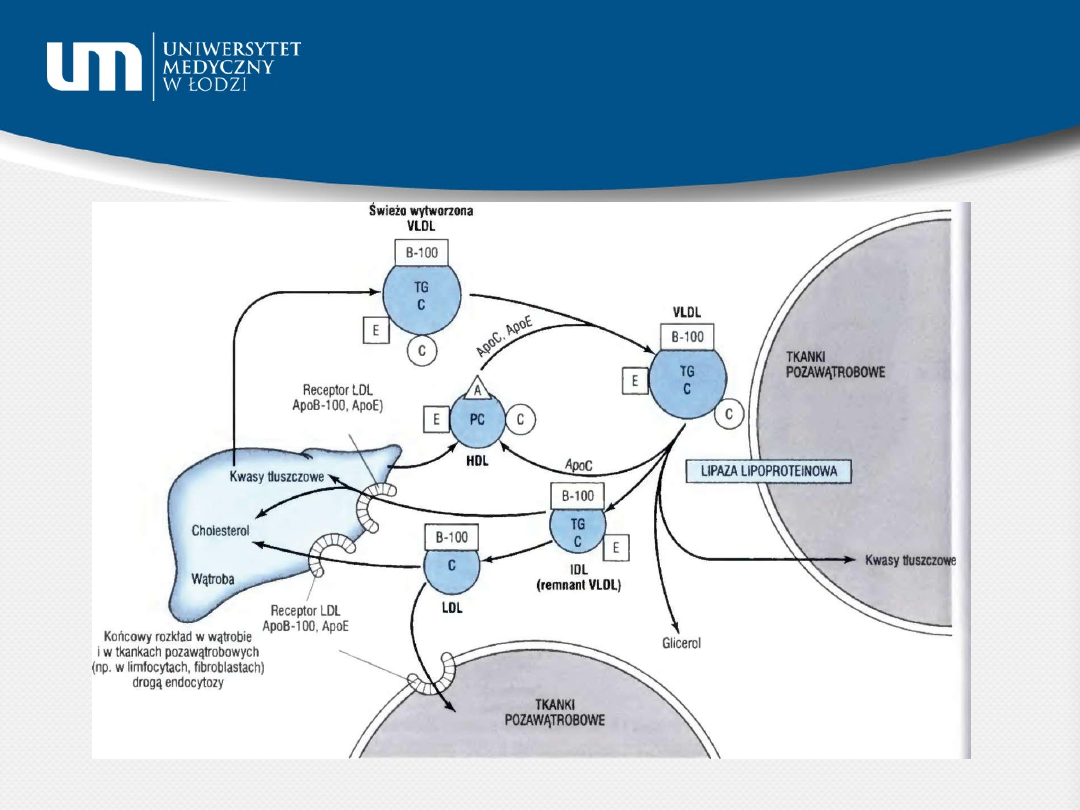
Pierwotne lipoproteiny –
chylomikrony i VLDL
Ilustrowana Biochemia Harpera, R. K. Murray

Metabolizm chylomikronów i
VLDL
• Główną rolę w przemianach
chylomikronów i VLDL odgrywa
pozawątrobowa lipaza lipoproteinowa
(LPL)!!

Lipaza lipoproteinowa
osocza (LPL)
• Synteza:
W komórkach tłuszczowych, skąd jest
przekazywana do śródbłonka naczyń gł.
tkanki tłuszczowej, mięśnia sercowego i
mięśni szkieletowych.
• Występowanie:
Zakotwiczony jest w śródbłonku naczyń
włosowatych proteoglikanowym łańcuchem
siarczanu heparanu.
We krwi występuje w niewielkich ilościach.
• Aktywność:
Do aktywności wymaga obecności kofaktorów
(fosfolipidy, apo C-II)

Lipaza lipoproteinowa
osocza (LPL)
• Rola:
Katalizuje reakcję hydrolizy TG chylomikronów i VLDL
uczestnicząc w przemianach tych lipoprotein.
Lipoproteiny dostarczają enzymowi kofaktorów i substratu
(TG).
Po przyłączeniu się lipoprotein do enzymu na powierzchni
śródbłonka naczyń dochodzi do hydrolizy triacylogliceroli
do monoacyloglicerolu i wolnych kwasów tłuszczowych.
Następnie większość uwolnionych monoacylogliceroli i WKT
z chylomikronów i VLDL jest pobierana przez tkanki
(głównie mięśnie szkieletowe i mięsień sercowy) i
wykorzystywana do wytworzenia energii, lub powtórnie
estryfikowana do TG i magazynowana (w przypadku
tkanki tłuszczowej).
Tylko niewielka ilość WKT wraca do krwioobiegu, gdzie jest
wiązana z albuminą i transportowana do innych tkanek
obwodowych.

Lipaza lipoproteinowa
osocza (LPL)
• W wyniku działania lipazy lipoproteinowej
lipoproteiny pierwotne zostają przekształcone
w remnanty, czyli resztkowe lipoproteiny.
Chylomikrony >>LPL>> utrata ok. 90 % TG i
apo C >> remnanty chylomikronów
(mniejsze, bogatsze w CH i estry CH) >>
transportowane z krwią do wątroby.
VLDL >>LPL>> remnanty VLDL (IDL –
lipoproteiny o pośredniej gęstości)>>
transportowane do wątroby, lub w wyniku
dalszych przemian przekształcane w LDL.

Udział wątroby w
metabolizmie lipoprotein
• Uczestniczy w wychwytywaniu remnantów
lipoprotein za pośrednictwem receptorów na
powierzchni hepatocytów swoistych dla
apoprotein obecnych na powierzchni
remnantów.
- Remnanty chylomikronów są wychwytywane
przy udziale receptora swoistego dla apo E
- IDL za pośrednictwem receptorów LDL
(wiążących apoB100 i apoE)
• Na drodze endocytozy remnanty dostają się
do wnętrza komórek wątroby, gdzie zachodzi
hydroliza i metabolizm estrów cholesterolu i
triacylogliceroli zawartych w remnantach.

Lipoproteiny wtórne – LDL
• Większość powstaje wtórnie z VLDL (w wyniku
przekształcenia VLDL w IDL i ostatecznie w LDL –
wewnątrznaczyniowa lipoliza VLDL)
• Niewielka ilość bezpośrednio jest wytwarzana przez
wątrobę
• Zawierają większość cholesterolu osoczowego.
• Uczestniczą w transporcie cholesterolu i jego estrów z
wątroby do innych narządów w celu ich regeneracji (gł.
nerek, mięśni, kory nadnerczy).
• Są metabolizowane za pośrednictwem receptora LDL
(receptor B/E).
• Wysokie stężenie LDL w osoczu dodatnio
koreluje z występowaniem miażdżycy naczyń
wieńcowych. („zły cholesterol”)

LDL
Nadmiar frakcji LDL usuwana jest z
osocza przez komórki fagocytarne.
Przeładowane cholesterolem
pochodzącym z LDL makrofagi i inne
komórki stają się przyczyną zmian
miażdżycowych w naczyniach
krwionośnych, poprzez zahamowanie
ich migracji i zatrzymanie w ścianie
naczyń tętniczych.

LDL
• Zbiór heterogennych cząstek:
- duże, lekkie LDL (fenotyp A LDL) – dominuje u
ludzi z niezaburzonym metabolizmem lipidowym
- małe, gęste LDL (fenotyp B LDL) – dominuje u
osób z zespołem metabolicznym, otyłością,
insulinoopornością i cukrzycą typu 2
- małe, gęste LDL zawierają mniej cholesterolu, a
więcej białka, dłużej przebywają w krążeniu i są
bardziej podatne na modyfikacje oksydacyjne
– fenotyp B wiąże się z podwyższonym stężeniem
lipoprotein bogatych w TG (VLDL i IDL) oraz
obniżonym stężeniem cholesterolu w HDL i
sprzyja rozwojowi miażdżycy.

HDL
• Stanowią heterogenną grupę cząstek
• powstają we krwi z produktów rozpadu innych
lipoprotein,
• są też syntetyzowane i wydzielane zarówno w wątrobie,
jak i w jelicie w postaci drobnych dyskoidalnych
prekursorów.
Rola:
• Uczestniczą w metabolizmie VLDL i chylomikronów,
poprzez dostarczanie im apolipoprotein C i E,
niezbędnych do ich katabolizmu.
• Uczestniczą w transporcie zwrotnym cholesterolu z
tkanek obwodowych bezpośrednio do wątroby lub
poprzez resztkowe chylomikrony i VLDL, albo przez
wychwytywanie LDL w wątrobie.
= Oczyszczanie tkanek i osocza z cholesterolu („dobry
cholesterol”)

HDL
• Stężenie HDL zmienia się odwrotnie
proporcjonalnie do stężenia
chylomikronów i VLDL oraz wprost
proporcjonalnie do aktywności LPL w
osoczu.
• Stężenie HDL w osoczu jest odwrotnie
proporcjonalne do częstości
występowania miażdżycy naczyń
wieńcowych.
• Miejscem końcowej degradacji głównej
apolipoproteiny HDL (apo A) jest wątroba,
oraz prawdopodobnie również jelito.

LCAT – acylotransferaza
lecytyna:cholesterol
• Syntetyzowana w wątrobie, skąd jest następnie uwalniana
do krążenia.
• Substratem dla tego enzymu jest cholesterol (zawarty w
HDL i pozostałych lipoproteinach oraz cholesterol błon
komórkowych).
• Katalizuje reakcję estryfikacji cholesterolu. Odpowiada za
powstawanie większości estrów cholesterolu osocza.
cholesterol + lecytyna >>LCAT>>
ester cholesterolu + lizolecytyna
• Aktywatorem LCAT jest apoAI obecna na HDL, apoCI i apoE,
zaś inhibitorem apoAII.
• Układ LCAT uczestniczy w usuwaniu nadmiaru
niezestryfikowanego cholesterolu z lipoprotein i tkanek.
• Poprzez estryfikację cholesterolu w HDL odpowiada za jego
transport zwrotny do wątroby.

WKT osocza
• Pochodzenie:
- Lipoliza TG w tkance tłuszczowej
- Działanie lipazy lipoproteinowej
osocza w czasie wychwytu TG osocza
przez tkanki
• Występowanie w osoczu:
- Połączenie z albuminami osocza,
które odpowiadają za transport WKT
w osoczu krwi.
Są to głównie wielonienasycone
długołańcuchowe kwasy tłuszczowe

WKT osocza
• W warunkach sytości WKT występują w
surowicy w małym stężeniu (ich stężenie
maleje tuż po jedzeniu).
• W stanie całkowitego głodu stężenie WKT
osocza jest największe.
• Są szybko usuwane z krwi, na skutek
pobierania WKT osocza przez tkanki, a
następnie część z nich jest utleniana celem
pokrycia zapotrzebowania energetycznego
organizmu (dominuje w stanie głodu),
pozostała część ulega estryfikacji i w tej
postaci jest magazynowana (dominuje w
stanie sytości).

Pokarmowa i endogenna
pula cholesterolu
• Cholesterol syntetyzowany jest we
wszystkich tkankach (zawierających komórki
jądrzaste) z acetylo-CoA. Jest prekursorem
wszystkich innych steroidów w organizmie
(kortykosteroidy, hormony płciowe, wit D,
kwasy żółciowe).
• Ponad połowa cholesterolu organizmu
człowieka pochodzi z syntezy (w 10% w
wątrobie, w 10% w jelicie), pozostała część
jest dostarczana do organizmu z pokarmem.

Rola reduktazy HMG-CoA w
syntezie cholesterolu
• Biosynteza cholesterolu odbywa się w 5
etapach, a jej szybkość jest regulowana już
na początku szlaku przemian.
• Pierwszym etapem jest synteza
mewalonianu.
- Z acetylo-CoA w reakcji katalizowanej przez
syntazę HMG-CoA powstaje HMG-CoA.
- HMG-CoA jest następnie redukowany do
mewalonianu w reakcji katalizowanej przez
reduktazę HMG-CoA.
• Etap reduktazy HMG-CoA jest głównym
momentem ograniczającym szybkość
biosyntezy cholesterolu.

Rola reduktazy HMG-CoA w
biosyntezie cholesterolu
•
Reduktaza HMG-CoA jest hamowana w
mechanizmie sprzężenia zwrotnego pod wpływem
działania mewalonianu (będącego bezpośrednim
produktem jej aktywności) i cholesterolu (będącego
głównym końcowym produktem szlaku).
• Insulina i hormony tarczycy pobudzają aktywność
reduktazy HMG-CoA, natomiast glukagon i
glikokortykoidy hamują.
• Wzrost ilości cholesterolu w komórce na skutek
pobierania lipoprotein bogatych w cholesterol (LDL)
za pośrednictwem receptorów również hamuje akt.
reduktazy.
• Zwiększenie podaży cholesterolu w pokarmach
hamuje wątrobową biosyntezę cholesterolu.

Cholesterol – występowanie
• Występuje w tkankach i lipoproteinach
osocza jako wolny cholesterol i w połączeniu
z długołańcuchowymi kwasami
tłuszczowymi jako estry cholesterolu.
• Wolny cholesterol jest amfipatycznym
lipidem, będącym strukturalnym
składnikiem błon i zewnętrznej warstwy
lipoprotein.
• Cholesterol zestryfikowany tworzy postać
zapasową cholesterolu, jest transportowany
do tkanek w rdzeniu lipoprotein osocza (gł.
LDL).

Cholesterol – wydalanie
• Z tkanek wolny cholesterol jest usuwany
przy udziale HDL w transporcie zwrotnym do
wątroby.
• W wątrobie jest eliminowany z organizmu z
żółcią w formie niezmienionej albo po
przekształceniu w sole kwasów żółciowych,
skąd trafia do jelita.
• Niewielka ilość cholesterolu i soli kwasów
żółciowych jest wydalana z kałem, gdyż
znaczna część jest wchłaniana w jelitach do
krążenia wrotnego, wychwytywana przez
wątrobę i ponownie wydalana z żółcią
uczestnicząc w tzw. krążeniu jelitowo-
wątrobowym.

Miażdżyca tętnic
• Etiopatogeneza:
Charakteryzuje się odkładaniem w ścianie
naczyń tętniczych złogów cholesterolu i
jego estrów z lipoprotein tworzących tzw.
blaszki miażdżycowe prowadzące do
zwężenia światła tętnic i niedokrwienia
tkanek.
• Czynniki ryzyka:
- podwyższony poziom cholesterolu w VLDL,
IDL lub LDL i obniżony poziom cholesterolu
HDL
- podwyższony poziom triacylogliceroli
osocza

Miażdżyca tętnic
• Jak obniżyć ryzyko tej patologii?
- stosowanie diety bogatej w jedno- i
wielonienasycone kwasy tłuszczowe (nasilają
katabolizm LDL poprzez silne pobudzanie rec
LDL)
- zdrowy styl życia (niepalenie, ruch i
zapobieganie otyłości)
regularny wysiłek fizyczny przyczynia się do
obniżenia LDL i stężenia TG osocza oraz
podwyższenia HDL.

Miażdżyca tętnic
Powikłania:
- Zawał serca (główna przyczyna zgonów w
większości krajów!!!)
- Choroba niedokrwienna serca
- Udar mózgu
- Zmiany otępienne
- Chromanie przestankowe
Jak im zapobiegać??
- farmakoterapia??

Diagnostyka laboratoryjna
zaburzeń gospodarki
lipidowej
• LIPIDOGRAM (stężenie - wartości pożądane)
- Cholesterol całkowity
(150-200 mg/dl; 3,88-5,18 mmol/l)
- Cholesterol frakcji LDL
(<135 mg/dl, <3,5 mmol/l)
- Cholesterol frakcji HDL
(M: 37-70 mg/dl; 0,9-1,8 mmol/l
K: 40-80mg/dl; 1,1-2,1mmol/l)
- Triglicerydy (< 200 mg/dl, <2,3 mmol/l)

CHOL - LDL
• Wyliczany ze wzoru Friedewalda:
CHOL–LDL(mmol/l) = TCH – TG/2,2 – CHOL-HDL
CHOL–LDL(mg/dl) = TCH – TG/5 – CHOL-HDL
Wzoru nie można stosować u osób z
hipertriglicerydemią
(TG>400mg/dl, >4,6 mmol/l)
oraz u osób, które nie były na czczo podczas
pobierania krwi do badania lipidogramu

Czynniki ryzyka ChNS
• Wysokie ryzyko:
CHOL całk. / HDL – CHOL > 5
LDL – CHOL / HDL – CHOL > 4
HDL – CHOL < 35 mg/dl u M
HDL – CHOL < 42 mg/dl u K
↑ TG przy ↓ CHOL – HDL

Materiał badany
• Osocze (krew pobrana na EDTA)
• Surowica (krew pobrana na skrzep)
Przechowywanie próbek:
3 dni w temp. +4°C
4 miesiące w temp. -20°C (optymalnie:
-70°C)

Metody wykorzystywane do
frakcjonowania lipoprotein
• Ultrawirowanie (metoda referencyjna –
wysokie koszty)
• Elektroforeza lipoprotein (metoda
półilościowa – różnicowanie fenotypów
hiperlipoproteinemii według klasyfikacji
Fredricksona)
• Metoda strąceniowa (najpopularniejsza)
• Test zimnej flotacji (do oceny zaburzeń
związanych z podwyższonym stężeniem TG)

Przygotowanie pacjenta do
badań
• Zachować w okresie poprzedzającym badanie
(1-2 tyg) normalną dietę i stałą masę ciała
(unikanie głodówek) oraz zwyczajowy tryb
życia.
• Nie pić alkoholu 2-3 dni przed badaniem
• Ostatni posiłek – dozwolona jest sucha bułka
+ herbata
• Pobierać krew na czczo – po 14-16 h głodzeniu
• Nie przyjmować leków wpływających na
gospodarkę lipidową (beta blokery, diuretyki)

Przygotowanie pacjenta do
badań
• Unikać stazy podczas pobierania krwi
(zwiększa stężenie)
• Szybko oddzielić surowicę od skrzepu
lub osocze od elementów morfotycznych
• Badanie należy przeprowadzić przy
braku choroby , urazu i jakiejkolwiek
przyczyny wtórnej dyslipoproteinemii
• Pacjent 30 min przed badaniem
powinien pozostawać w spoczynku

Rozpoznanie hiperlipidemii
• Wyniki oznaczeń lipidowych są podwyższone
przynajmniej w 2 badaniach wykonanych
w odstępie 2-3 tyg.
• Oznaczenia cholesterolu powinny być
wykonywane nie wcześniej niż:
3 tyg po przebyciu łagodnych chorób
6 tyg-3 miesiące po przebyciu ostrych chorób,
zawału serca, zabiegów chirurgicznych

Kliniczne źródła zmienności
stężenia lipidów
• Zawał serca
• Udar mózgu
• Nadciśnienie
• Niewydolność nerek
• Cukrzyca
• Ciąża
• Zakażenia
• Leki
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
Wyszukiwarka
Podobne podstrony:
Pytania egzaminacyjne dla Analityki Medycznej studia PODYP
biofizyka dla analityki medycznej i rok - pomiar wielkosci biofizycznych cz.1, I rok, I rok, biofizy
Zagadnienia dla analityki
Słowniczek dla Analityki Medycznej, PATOMORFOLOGIA, SŁOWNICZKI
CYTOSTATYKI dla analityki
1 zadania dla analityka
Prezentacja wynikowa 2011 dla analityków 16 marca 2012 godz 16 00
Geometria analityczna, Matematyka dla Szkoły Podstawowej
Analityka zadania lista1 dla stud
egz, e (5), EGZAMIN Z CHEMII ANALITYCZNEJ DLA II ROKU CHEMII 2003/2004
egz, e (7), EGZAMIN Z CHEMII ANALITYCZNEJ DLA II ROKU CHEMII 2003/2004
Błocki Z Funkcje Analityczne Dla Sekcji Nieteoretycznych
Sprawozdanie chemia 6 Reakcje dla poszczególnych kationów III grupy analitycznej
Elementy algebry liniowej z geometrią analityczną dla informatyków
Elementy algebry liniowej z geometrią analityczną dla informatyków
więcej podobnych podstron