
Ogólne zasady nazewnictwa
Nazwy związków nieorganicznych możemy tworzyć na dwa sposoby. Sposób pierwszy
posiada następujące reguły:
B, Si, C, Sb, As, P, N, H, Te, Se, S, I, Br, Cl, O, F Należy zachowywać odpowiednie
końcówki, ale o tym szerzej podczas omawiania konkretnych związków.
1. Podajemy
pierwiastki wchodzące w skład związku według malejącej
elektroujemności. W grupach 13-17 elektroujemność rośnie w następującym szeregu:
2. Następnie podajemy wartościowości pierwiastków zapisując je w nawiasie rzymskimi
cyframi. Pomijamy je, jeśli dany pierwiastek występuje tylko na jednym stopniu
utlenienia - np. tlenek glinu, tlenek wapnia. Podanie niepotrzebnej wartościowości jest
określane jako błąd, gdyż w nazwach nie zapisujemy zbędnych informacji.
Następujące pierwiastki tworzą związki przeważnie tylko na jednym stopniu
utlenienia (podanym) i nie podajemy ich wartościowości, chyba że mają inną niż
podana:
litowce(I), berylowce(II), skandowce(III), B(III), O(-II), F(-I), Al(III), Si(IV),
Zn(II), Ag(I), Cd(II), Bi(III)
Drugim sposobem jest podanie pierwiastków według tej samej kolejności co poprzednio,
poprzedzając je krotnościami poszczególnych pierwiastków we wzorze sumarycznym.
Sposób ten ma zastosowanie, gdy stopień utlenienia pierwiastka nie jest całkowity - np.
czterotlenek trójołowiu Pb
3
O
4
. Do oznaczenia krotności pierwiastków stosuje się
odpowiednie przedrostki. Jeśli w związku występuje jeden atom pierwiastka, to przedrostek
przeważnie się pomija, o ile nie wprowadza to niejednoznaczności. O ile to możliwe, staramy
się stosować pierwszy sposób nazywania związków, a do tego odwołujemy się w
ostateczności.
W chemii nieorganicznej zgodnie z zaleceniami IUPAC oraz Polskiego Towarzystwa
Chemicznego można stosować polskie lub greckie przedrostki liczbowe. W chemii
organicznej obowiązują wyłącznie przedrostki greckie. W tym artykule będziemy używali
przedrostków polskich tam gdzie to możliwe.
Myślę, że po tym krótkim wstępie możemy przejść do nazywania konkretnych związków
chemicznych.
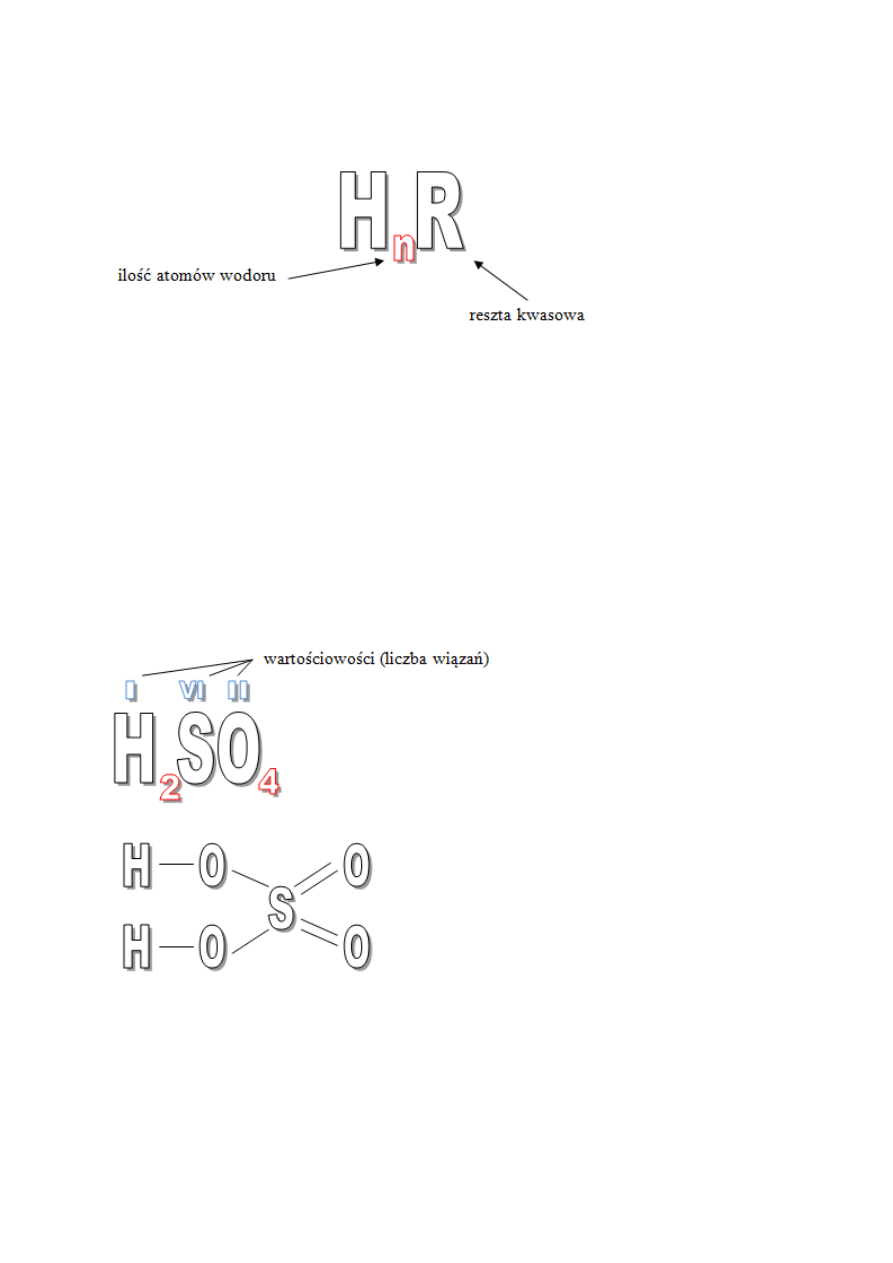
Kwasy to związki zbudowane z wodoru i reszty kwasowej. Wzór ogólny kwasów
przedstawia się następująco:
Kwasy można podzielić na dwie grupy: kwasy tlenowe i kwasy beztlenowe.
Kwasy tlenowe to kwasy, które jak sama nazwa wskazuje zawierają w swojej cząsteczce atom
tlenu. Ilość atomów tlenu zawiera się w przedziale 1-6. Oprócz atomu tlenu w reszcie
kwasowej znajduje się jeszcze atom pierwiastka kwasotwórczego. Pierwiastkiem takim jest na
ogół niemetal, na przykład siarka, fosfor bądź azot. Może to być również półmetal, na
przykład krzem lub nawet metal o dużej wartościowości, jak Mn(VII) w kwasie HMnO
4
.
Nazwy kwasów tlenowych tworzymy od nazwy pierwiastka centralnego podając w nawiasie
jego wartościowość oraz dodając końcówkę –owy. Dla kwasów, których pierwiastki posiadają
tylko jedną wartościowość nie podaje się jej wartości w nazwie. Przykładem może być kwas
zawierający w swojej cząsteczce atomy: wodoru, tlenu i siarki (VI). Zapiszmy wzór
sumaryczny i strukturalny takiego kwasu:
Kwas ten składa się z 4 atomów tlenu, 1 atomu siarki i 2 atomów wodoru. Jego nazwa to:
kwas siarkowy (VI).
Najważniejszymi kwasami tlenowymi w chemii nieorganicznej są:
H
2
SO
3
– kwas siarkowy (IV)
H
2
SO
4
– kwas siarkowy (VI)

H
2
CO
3
– kwas węglowy
H
3
PO
3
– kwas fosforowy (III)
H
3
PO
4
– kwas fosforowy (V)
HNO
2
– kwas azotowy (III)
HNO
3
– kwas azotowy (V)
HClO – kwas chlorowy (I)
HClO
2
– kwas chlorowy (III)
HClO
3
– kwas chlorowy (V)
HClO
4
– kwas chlorowy (VII)
Kwasy beztlenowe to kwasy, które nie zawierają atomu tlenu w cząsteczce. Są to wodne
roztwory wodorków niemetali, które znajdują się w szesnastej i siedemnastej grupie układu
okresowego, np. HCl, HBr.
Nazwę kwasu beztlenowego tworzymy w ten sposób, że do nazwy pierwiastka dodajemy
końcówkę –wodorowy, np. HBr – kwas bromowodorowy.
Najpopularniejsze kwasy beztlenowe to:
HCl – kwas chlorowodorowy (chlorek wodoru)
H
2
S – kwas siarkowodorowy (siarczek diwodoru)
HCN – kwas cyjanowodorowy (cyjanek wodoru)
Nomenklatura tlenków
Możemy tutaj zastosować obydwa powyższe sposoby, jednak zalecane jest stosowanie
pierwszego. Nomenklatura tlenków jest bardzo prosta. Popniżej nieco przykładów.
N
2
O
5
- tlenek azotu(V)
N
2
O
4
- czterotlenek dwuazotu (bo istnieje także NO
2
- nazwa tlenek azotu(IV) jest
niejednoznaczna)
Cr
2
O
3
- tlenek chromu(III)
FeO - tlenek żelaza(II)
Fe
2
O
3
- tlenek żelaza(III)
Mn
2
O
7
- tlenek manganu(VII)
MgO - tlenek magnezu
CaO - tlenek wapnia
Al
2
O
3
- tlenek glinu
Pb
3
O
4
- czterotlenek trójłowiu
Nomenklatura wodorotlenków
Nazewnictwo w wodorotlenkach jest podobne jak w tlenkach. Pierwsze, co to określamy, że
jest to wodorotlenek, a następnie nazwę metalu oraz jego wartościowość. Wartościowości nie
podajemy, jeśli metal leży w I lub II grupie głównej układu okresowego, lub też, jeśli dany
metal nie może tworzyć innych związków o innej wartościowości. Możemy oczywiście
stosować sposób drugi (z przedrostkami) kierując się zasadami jak w tlenkach.

Fe(OH)
3
- wodorotlenek żelaza(III)
TlOH - wodorotlenek talu(I)
Zn(OH)
2
- wodorotlenek cynku
Ca(OH)
2
- wodorotlenek wapnia
Al(OH)
3
- wodorotlenek glinu
Nomenklatura kwasów
Nazwy kwasów tworzymy poprzez podanie atomu centralnego, dodanie przyrostka "-owy" i
podanie wartościowości (w przypadku kwasów tlenowych). W przypadku kwasów
beztlenowych (wodorków kwasowych) do nazwy pierwiastka dodajemy przyrostek "-
owodorowy". Częściej niż nazewnictwo systematyczne kwasów stosuje się jednak
nazewnictwo zwyczajowe. Jeśli w kwasie występuje więcej niż jeden atom danego
pierwiastka, to poprzedzamy go odpowiednią krotnością.
Stopień utlenienia pierwiastka w kwasie można policzyć z wzoru (2*O - H) / n, gdzie O - to
liczba atomów tlenu, H - liczba atomów wodoru, n - liczba atomów danego pierwiastka w
kwasie.
HNO
3
- kwas azotowy(V) lub kwas azotowy
HNO
2
- kwas azotowy(III)
H
2
SO
4
- kwas siarkowy(VI) lub kwas siarkowy
H
2
SO
3
- kwas siarkowy(IV)
HCl
aq
- kwas chlorowodorowy
H
2
CO
3
- kwas węglowy
H
3
BO
3
- kwas borowy
HBr - kwas bromowodorowy
HBrO
3
- kwas bromowy(V)
H
2
SeO
3
- kwas selenowy(IV)
HMnO
4
- kwas manganowy(VII)
Cząsteczki kwasów mogą zawierać różne ilości atomów tlenu. Z tego powodu w trudnych
przypadkach, o ile nie istnieje odpowiednie nazewnicwo zwyczajowe, stosuje się człon "-
okso-" do podania liczby atomów tlenu w związku (inaczej mówiąc - traktuje się dany
związek jak związek kompleksowy z ligandami tlenowymi). Zazwyczaj jednak istnieją
odpowiednie nazwy zwyczajowe, których można używać jako nazw systematycznych. Na
szególną uwagę zasługują przedrostki "meta-" i "orto-" używane w nazwach zwyczajowych.
Oznaczają one ilość wodoru w kwasie - "meta-" oznacza mniejszą zawartość, a "orto-"
większą.
H
3
PO
4
H
5
IO
6
- kwas sześciooksojodowy(VII)
H
4
P
2
O
7
- kwas siedmiooksodwufosforowy(V)
H
2
B
4
O
7
- kwas siedmiooksoczteroborowy
H
4
SiO
4
- kwas czterooksokrzemowy
Nomenklatura soli
Nazwę soli tworzymy poprzez podanie nazwy reszty kwasowej, wartościowości reszty
kwasowej, nazwy metalu i wartościowości metalu (lub nazwy jonu złożonego). Zasady

pomijania wartściowości są takie jak poprzednio tzn. robimy to zawsze wtedy, gdy nie ma to
wpływu na jednoznaczność nazwy.
Mg(NO
3
)
2
- azotan(V) magnezu
Fe
2
(SO
4
)
3
- siarczan(VI) żelaza(III)
Al
2
(SO
3
)
3
- siarczan(VI) glinu
Na
2
CO
3
- węglan sodu
CaCl
2
- chlorek wapnia
NH
4
NO
3
- azotan(V) amonu
KBrO
3
- bromian(V) potasu
NaSb(OH)
4
- tetrahydroksyantymonian(III) sodu
Sb
2
S
3
- siarczek antymonu(III)
K
2
CrO
4
- chromian(VI) potasu
K
2
Cr
2
O
7
- dwuchromian(VI) potasu
Wodorosole i hydroksysole nazywamy, tworząc nazwę anionu z przedrostkiem "wodoro-" i
odpowiednią krotnością, a nazwy hydroksysoli - jak związków kompleksowych (o czym
dalej).
KHSO
4
- wodorosiarczan(VI) potasu
KH
2
PO
4
- diwodorofosforan(V) potasu
K
2
HPO
4
- wodorofosforan(V) dwupotasu lub wodorofosforan(V) potasu
KAl(SO
4
)
2
- glinu potasu siarczan(VI)
DYSOCJACJA ELEKTROLITYCZNA
Jako pierwszy zjawisko dysocjacji elektrolitycznej odkrył szwedzki chemik Svante
Arrchenius. Wysunął on przypuszczenie, że niektóre związki chemiczne podczas
rozpuszczania w wodzie ulegają rozpadowi na kationy i aniony, co zostało potwierdzone
późniejszymi badaniami. Kationy i aniony ogólnie nazywa się jonami stąd też dysocjację
elektrolityczną można również nazwać dysocjacją jonową. Związki chemiczne ulegające
rozpadowi na jony pod wpływem wody są nazywane elektrolitami, w przeciwieństwie do
nieelektrolitów czyli substancji nie dysocjujących na jony. Elektrolitami są na ogół związki o
cząsteczkach z silnie spolaryzowanymi wiązaniami, które ulegają zerwaniu podczas
hydratacji cząsteczki, lub substancje o strukturze jonowej. Poniżej przykłady najczęściej
stosowanych elektrolitów oraz nieelektrolitów:
elektrolity:
HCl, HNO
3
, H
2
SO
4
, NaOH, Ca(OH)
2
, H
2
S, HF, CH
3
COOH, sole organiczne i nieorganiczne
nieelektrolity:
CH
3
OH, C
2
H
5
OH, cukry, CH
3
COCH
3
Elektrolity można również podzielić na:

elektrolity mocne, które są silnie zdysocjowane na jony i zawierają niewiele
cząsteczek niezdysocjowanych. Należą do nich:
o
prawie wszystkie sole
o
część kwasów nieorganicznych (HCl, HNO
3
, HClO
4
, H
2
SO
4
, HBr, HJ)
o
wodorotlenki potasowców i niektóre wodorotlenki berylowców
elektrolity słabe, które są zdysocjowane na jony tylko częściowo. Należą do nich:
o
część kwasów nieorganicznych (H
2
SO
3
, H
2
CO
3
, H
2
S, HCN)
o
część zasad (roztwór amoniaku, hydrazyna, hydroksyloamina)
o
niektóre kwasy i zasady organiczne (z wyjątkiem kwasów sulfonowych i
kwasu szczawiowego – H
2
C
2
O
4
)
Jak już wcześniej wspomniano dysocjacji elektrolitycznej ulegają związki o wiązaniu
jonowym lub atomowym spolaryzowanym. Przyczyną dysocjacji jest wzajemne
oddziaływanie pomiędzy jonami a cząsteczkami wody. Cząsteczki wody są dipolami. Na
jednym ich końcu zgromadzony jest ładunek dodatni, na drugim ujemny. Woda otaczając jon
kieruje się biegunem ujemnym ku kationowi lub biegunem dodatnim ku anionowi. Zjawisko
to nosi nazwę hydratacji.
Spróbujmy rozważyć proces dysocjacji na przykładzie chlorowodoru. W tym przypadku
wspólna para elektronów, która łączy atom wodoru z atomem chloru, staje się w momencie
rozerwania własną parą atomu chloru, a sam atom choru – jonem ujemnym. Atom wodoru,
pozbawiony wspólnych elektronów, zamienia się w jon H
+
. Dysocjacje elektrolityczną
przedstawia się równaniem chemicznym:
HCl→H
+
+Cl
−
Nie uwzględnia się cząsteczek wody, ponieważ ich liczba jest zmienna. Jedynie w przypadku
jonu H
+
stwierdzono, że nie występuje on samodzielnie, lecz jest połączony z jedną
cząsteczką wody, co często zaznacza się w równaniach:
HCl+H2O→H
3
O
+
+Cl
−
Jon H
3
O
+
, zwany jonem hydroniowym, powstaje z jonu H
+
i cząsteczki wody:

Stężenie procentowe
Stężenie roztworu - podaje ilość substancji rozpuszczonej w określonej ilości roztworu.
Najczęściej stosowanymi stężeniami jest stężenie procentowe i molowe.
Stężenie procentowe (c
%
) - podaje ilość gramów substancji rozpuszczonej w 100 g roztworu.
Np. roztwór 10% zawiera 10 g substancji w 100 g roztworu, czyli 10 g substancji
rozpuszczonej w 90 g rozpuszczalnika.
Stężenie procentowe roztworu możemy obliczyć układając proporcję lub korzystając ze
wzoru:
Zadanie 1
Oblicz stężenie procentowe roztworu, wiedząc, że w 450 g roztworu znajduje się 15 g
substancji.
Rozwiązanie:
Dane:
m
r
= 450 g
m
s
= 15 g
Szukane:
c
%
= ?
I sposób:
Z treści zadania wynika, że:
aby obliczyć stężenie procentowe, pytamy:
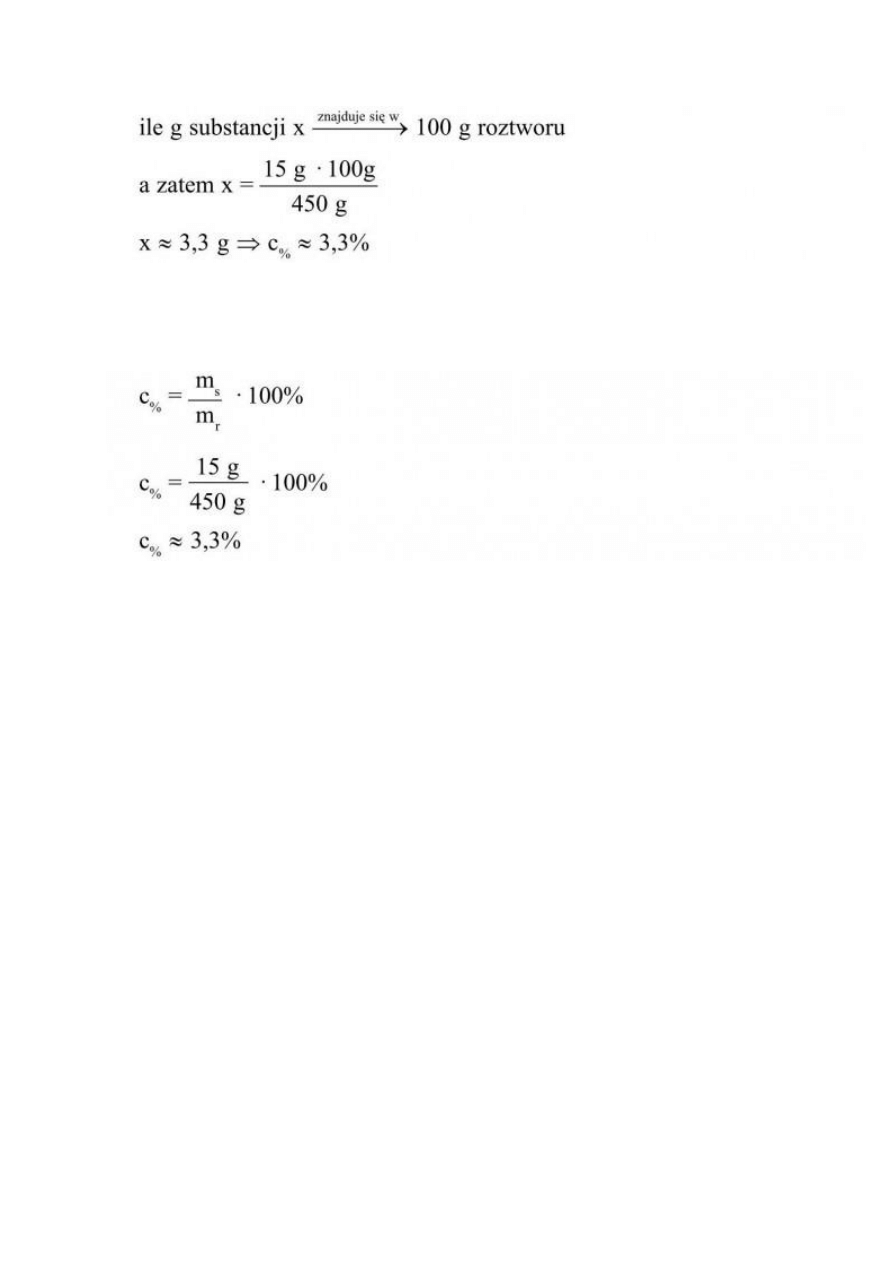
II sposób:
Do wzoru na stężenie procentowe podstawiamy dane:
Odp.: Stężenie procentowe tego roztworu wynosi ok. 3,3%.
Zadanie 2
Ile gramów soli kuchennej potrzeba do sporządzenia 250 g 10% roztworu?
Rozwiązanie:
Dane:
m
r
= 250 g
c
%
= 10%
Szukane:
m
s
= ?
I sposób:

II sposób:
Aby obliczyć masę substancji, przekształcamy wzór na stężenie procentowe:
Odp.: Do sporządzenia 250 g 10% roztworu potrzeba 25 g soli kuchennej.
Zadanie 3
Oblicz stężenie procentowe roztworu otrzymanego po rozpuszczeniu 15 g substancji w 185 g
wody.
Rozwiązanie:
Dane:
m
s
= 15 g
m
w
= 185 g
Szukane:
c
%
= ?

Odp.: Stężenie procentowe tego roztworu wynosi 7,5%.
Zadanie 4
W ilu gramach wody należy rozpuścić 10 g substancji, aby otrzymać roztwór 25%?
Rozwiązanie:
Dane:
m
s
= 10 g
C
%
= 25%
Szukane:
m
w
= ?
I sposób:

II sposób:
Odp.: Aby otrzymać roztwór 25%, trzeba rozpuścić 10 g substancji w 30 g wody.
Zadanie 5
Oblicz stężenie procentowe roztworu otrzymanego w wyniku rozpuszczenia 40 g substancji w
200 cm3 etanolu o gęstość 0,78 g/cm
3
.
Rozwiązanie:
Dane:

Szukane:
Odp.: W wyniku rozpuszczenia 40 g substancji w 200 cm3 etanolu otrzymano roztwór 20%
Stężenie molowe
Stężenie molowe roztworu (c
mol
) - podaje liczbę moli substancji rozpuszczonej w 1 dm
3
roztworu.
Np. roztwór 5-molowy zawiera 5 moli substancji rozpuszczonej w 1 dm
3
roztworu.
Stężenie molowe możemy obliczyć z proporcji lub ze wzoru:
Podstawiając za „n” do wzoru na stężenie molowe powyższy iloraz otrzymujemy wzór:

Zadanie 1
Oblicz stężenie molowe roztworu wiedząc, że w 1,5 dm
3
roztworu znajduje się 6 moli
substancji rozpuszczonej.
Rozwiązanie:
Dane:
Odp.: Stężenie molowe tego roztworu wynosi 4 mol/dm
3
.
Zadanie 2
Ile moli substancji znajduje się w 2 dm
3
roztworu o stężeniu 0,5 mol/dm
3
?
Rozwiązanie:
Dane:
V
r
= 2 dm
3
c
mol
= 0,5 mol/dm
3

Szukane:
n = ?
Odp.: W 2 dm
3
roztworu o stężeniu 0,5 mol/dm
3
znajduje się 1 mol substancji rozpuszczonej.
Zadanie 3
W jakiej objętości 2-molowego roztworu znajduje się 2,5 mola substancji?
Rozwiązanie:
Dane:
c
mol
= 2 mol/dm
3
n = 2,5 mola
Szukane:
V
r
= ?

Odp.: 2 mole substancji znajdują się w 1,25 dm
3
2-molowego roztworu.
Zadanie 4
Oblicz stężenie molowe roztworu, wiedząc, że w 3 dm
3
roztworu znajduje się 156 g siarczku
sodu.

Odp.: Stężenie molowe tego roztworu wynosi ok. 0,7 mol/dm
3
.

Zadanie 5
Ile gramów NaOH znajduje się w 200 cm
3
0,1-molowego roztworu?
Rozwiązanie:
Aby rozwiązać to zadanie, możemy zamiast z proporcji skorzystać ze wzoru na stężenie
molowe, z którego obliczymy masę substancji:
Odp.: W 200 cm
3
0,1-molowego roztworu znajduje się 0,8 g NaOH.

Wyszukiwarka
Podobne podstrony:
analiza notatki 3 id 559208 Nieznany (2)
analiza ilosciowa 6 id 60541 Nieznany (2)
Analiza struktury id 61534 Nieznany (2)
analiza ilosciowa 2 id 60539 Nieznany
Analiza czynnikowa id 59935 Nieznany (2)
Darfur analiza kryzysu id 13186 Nieznany
Analiza Finansowa 3 id 60193 Nieznany (2)
Analiza finansowhga id 60398 Nieznany (2)
IMW W02 analiza stanow id 21233 Nieznany
Analiza krancowa id 60743 Nieznany (2)
analiza skupien id 61367 Nieznany
Analiza termiczna id 61671 Nieznany (2)
Analiza biochemiczna id 59863 Nieznany
analiza wzory id 61812 Nieznany (2)
analiza kationow 2 id 60685 Nieznany
analizaf 7I id 61960 Nieznany (2)
analiza chem 2 id 59885 Nieznany (2)
Analiza matematyczna 2 id 60894 Nieznany
więcej podobnych podstron