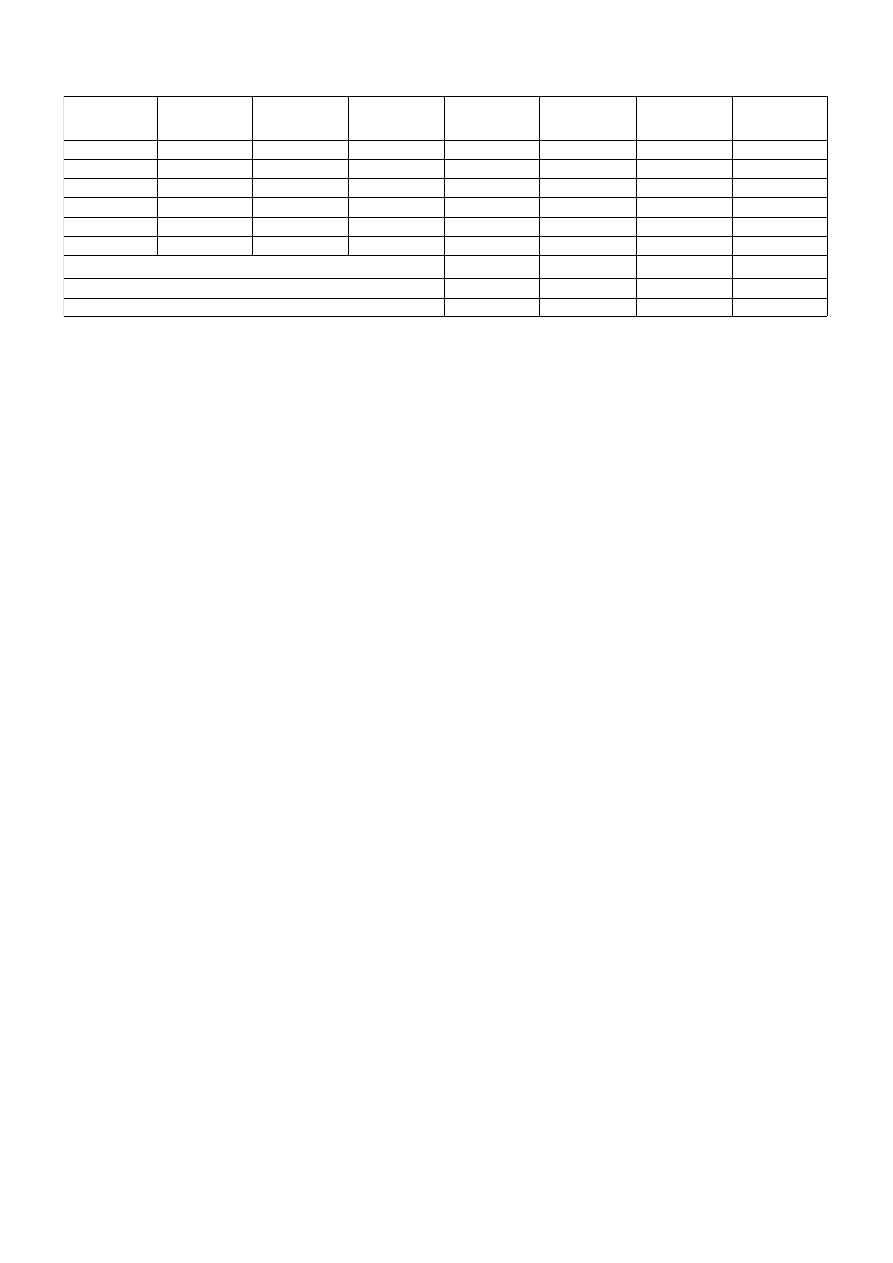
Współczynnika podziału Nernsta K
c
jest wielkością charakterystyczną dla danego układu dwóch
cieczy i składnika rozdzielającego się między te ciecze.
Współczynnika podziału Nernsta K
c
w stałej temperaturze przyjmuję wartość stałą, jest to stosunek
stężeń substancji rozpuszczonej w obu fazach ciekłych. W fazie wodnej substancja rozpuszczona
ulega dysocjacji, w organicznej asocjacji. Wartość współczynnika podziału wskazuję, w jakim
stopniu dana substancja dzieli się (rozpuszcza się w cieczach) między dwie ciecze. Różnice
rozpuszczalności wykorzystuję się w ekstrakcji do rozdziału mieszanin wieloskładnikowych.
Opracowanie wyników:
1. Stężenie kwasu octowego przed podziałem C
i
i po podziale
i
C w warstwie wodnej:
C
i
=(C
z
*V
z
)/V
k
i
C =(C
z
*V
z
)/V
k
V
k
- objętość roztworu kwasu octowego pobrana do miareczkowania
C
z
– stężenie zasady sodowej 0,1 mol/dm
3
V
z
- objętość roztworu zasady sodowej zużyta do miareczkowania
2. Stężenie kwasu octowego w warstwie chloroformowej
i
C :
i
C =C
i
-
i
C
3. Stopień dysocjacji kwasu octowego
i
w warstwie wodnej dla poszczególnych stężeń:
i
=0,003565-0,002812
i
C
4. Wykres zależności liniowej
lg[
i
C (1-
i
)]=f (lg
i
C )wyprowadzony ze zlogarytmowanej postaci równania
lg[
i
C (1-
i
)]=lgK
c
+1/n lg
i
C
Wnioski;
Znajomość współczynników podziału substancji pomiędzy nie mieszające się fazy ciekłe ma
ogromne znaczenie w ekstrakcji.
Celem ćwiczenia było wyznaczenie współczynnika podziału kwasu octowego pomiędzy wodę i
chloroform K
c
oraz stałej n. woda dużo lepiej rozpuszcza kwas octowy niż chloroform podczas
rozdzielania kwasu pomiędzy te dwie ciecze. Stwierdzam także, że kwas octowy występuje w
warstwie organicznej pod postacią cząsteczek asocjowanych, gdyż n>1 (n = 2,598).
0,34
0,53
-0,189
0,005357
0,9946
0,5259
-0,2791
0,55
0,50
0,048
0,005528
0,9945
0,4947
-0,3056
-1,323
0,66
0,58
0,073
0,005085
0,9949
0,5795
-0,2369
-1,140
0,80
0,69
0,115
0,004629
0,9954
0,6818
-0,1663
-0,939
0,87
0,78
0,085
0,004264
0,9957
0,7767
-0,1098
-1,071
1,09
0,96
0,130
0,003680
0,9963
0,9565
-0,0193
-0,886
Stałe równanie Nernsta
1/n
n
Metoda graficzna
0,3850
2,598
0,1288
1,345
Metoda najmniejszych kwadratów
0,3850
2,598
0,1288
1,345
c
i
[mol/dm
3
]
C
i
α
[mol/dm
3
]
c
i
β
[mol/dm
3
]
α
i
1-α
c
i
α
(1-α)
[mol/dm
3
]
lg[c
i
α
(1-α)]
lgc
i
β
lgK
c
K
c
Wyszukiwarka
Podobne podstrony:
Korelacja liniowa, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Fizyczna ćw 4, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Dane, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Sprawozdanie 2 Oznaczenie podst ?ch fizycznych
Fizyczna ćw 6, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Wyznaczanie charakterystyki elektrod, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki spr
Sprawozdanie ćwiczenie II, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania f
Aneta Kosinska sprawozdanie z fizy, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki spraw
doswiadczenie5 grajek, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyc
Spr5, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
cw 2, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Chemia fizyczna sprawozdanie (6 1) id 112219
SPRAWOZDANIE Z farmako, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
sprawko z ćwiczenia 11, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Chemia fizyczna - sprawozdanie (4-1), Chemia Fizyczna
Napiecie powierzchniowe, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
7[1].1(2), Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, s
SPRAWOZDANIE-4-1-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fi
więcej podobnych podstron