
PROFILAKTYKA CHOROBY NIEDOKRWIENNEJ SERCA
Rekomendacje Komisji Profilaktyki
Polskiego Towarzystwa Kardiologicznego
Opracowane przez zespół:
Przewodnicząca:
Prof. Barbara Cybulska
Instytut śywności i śywienia - Warszawa
Prof. Jerzy Adamus
Centralny Szpital Kliniczny WAM - Warszawa,
Dr Janusz Bejnarowicz
Instytut Kardiologii - Warszawa
Dr Marianna Janion
Wojewódzki Szpital Zespolony - Kielce
Prof. Zdzisława Kornacewicz-Jach
Pomorska Akademia Medyczna - Szczecin
Prof. Jerzy Kuch
Akademia Medyczna - Warszawa
Dr hab. Andrzej Pająk
Collegium Medicum UJ - Kraków
Spis treści:
1. Wprowadzenie
2. Występowanie czynników ryzyka choroby niedokrwiennej serca i umieralność w
Polsce
3. Ogólne zasady profilaktyki choroby niedokrwiennej serca i dowody na jej skuteczność
4. Profilaktyka pierwotna
4.1. Strategia populacyjna
4.2. Strategia zwiększonego ryzyka
4.2.1. Ocena zagrożenia IHD w oparciu o czynniki ryzyka
4.2.1.1. Palenie tytoniu
4.2.1.2. Zwiększone stężenie cholesterolu LDL
4.2.1.3. Niskie stężenia cholesterolu HDL
4.2.1.4. Podwyższone ciśnienie tętnicze
4.2.1.5. Hiperglikemia i cukrzyca
4.2.1.6. Wiek, płeć, menopauza
4.2.1.7. Obecność chorób na tle miażdżycy
4.2.1.8. Obciążenie rodzinne chorobami na tle miażdżycy
4.2.2. Zagrożenie IHD wynikające z obecności innych czynników ryzyka
4.2.2.1. Sposób żywienia i spożycie alkoholu
4.2.2.2. Mała aktywność fizyczna
4.2.2.3. Podwyższone stężenie trójglicerydów
4.2.2.4. Otyłość
4.2.2.5. Czynniki trombogenne

4.2.2.6. Zwiększone stężenie homocysteiny
4.2.2.7. Przerost lewej komory serca
4.3. Diagnostyka i klasyfikacja hiperlipidemii
4.4. Diagnostyka i klasyfikacja nadciśnienia tętniczego
5. Profilaktyka wtórna
6. Zwalczanie czynników ryzyka
6.1. Dieta
6.2. Zwalczanie palenia tytoniu
6.3. Ograniczanie spożycia alkoholu
6.4. Zwiększenie aktywności fizycznej
6.5. Leczenie hiperlipidemii
6.5.1. Leczenie hipercholesterolemii
6.5.2. Leczenie hiperlipidemii mieszanej
6.5.3. Leczenie hipertrójglicerydemii
6.5.4. Leczenie zespołu chylomikronemii
6.5.5. Farmakoterapia skojarzona hiperlipidemii
6.6. Leczenie nadciśnienia tętniczego
6.7. Redukcja masy ciała
6.8. Kontrola cukrzycy
6.9. Obniżanie aktywności czynników krzepnięcia krwi
6.10. Obniżanie stężenia homocysteiny
7. Ogólne zasady postępowania z pacjentem w profilaktyce choroby
niedokrwiennej serca
8. Piśmiennictwo
PROFILAKTYKA CHOROBY NIEDOKRWIENNEJ SERCA
Rekomendacje Komisji Profilaktyki
Polskiego Towarzystwa Kardiologicznego
1. WPROWADZENIE
Choroby układu krążenia, mimo poprawy notowanej od początku lat siedemdziesiątych
XX wieku, stanowią nadal najważniejszą przyczynę umieralności w krajach rozwiniętych
ekonomicznie. Wśród nich ważne miejsce zajmuje choroba niedokrwienna serca (IHD).
W Polsce w populacji mężczyzn w wieku 35-64 lata, w roku 1996 IHD była przyczyną
prawie połowy zgonów na choroby układu krążenia (1). Od czasu nagromadzenia się
dowodów na możliwość jej zapobiegania datują się opracowania wzorcowych zasad
postępowania profilaktycznego, przygotowywane i okresowo aktualizowane przez
międzynarodowe i narodowe towarzystwa kardiologiczne.
W 1998 roku ukazały się 2 niezależne międzynarodowe dokumenty dotyczące tego
zagadnienia. Pierwszy pt. "Coronary Heart Disease: Reducing the Risk. The scientific
background for primary and secondary prevention of coronary heart disease. A
worldwide view" został przygotowany przez Międzynarodową Grupę Roboczą dla
Profilaktyki Choroby Niedokrwiennej Serca, współpracującą z International
Atherosclerosis Society (IAS) (2). Dokument drugi noszący tytuł "Prevention of coronary
heart disease in clinical practice. Recommendations of the Second Joint Task Force of
European and other Societies on Coronary Prevention" przedstawia stanowisko

European Society of Cardiology, European Atherosclerosis Society, European Society of
Hypertension, International Society of Behavioural Medicine, European Society of
General Practice/Family Medicine i European Heart Network (3).
Stanowiska przedstawione w tych dwu dokumentach są rozbieżne w zakresie niektórych
istotnych zagadnień, co może być przyczyną dezorientacji lekarzy praktyków, dla których
przede wszystkim te dokumenty są przeznaczone. Uzasadnia to potrzebę zajęcia
stanowiska przez krajowe grupy ekspertów.
Polskie Towarzystwo Kardiologiczne opracowało i opublikowało w 1997 r. "Standardy
postępowania w chorobach układu krążenia" (4). Spośród 9 standardów 2 dotyczą
profilaktyki i leczenia najważniejszych czynników ryzyka choroby niedokrwiennej serca,
tj. nadciśnienia tętniczego pierwotnego i hiperlipidemii. Te dwa odrębne, lecz
uzupełniające się, stanowiska były podstawą popularyzacji w Polsce profilaktyki IHD i
innych chorób układu krążenia powstających na podłożu miażdżycy. Obecnie wymagają
one aktualizacji, zgodnie z postępem światowej kardiologii.
PROFILAKTYKA CHOROBY NIEDOKRWIENNEJ SERCA
Rekomendacje Komisji Profilaktyki
Polskiego Towarzystwa Kardiologicznego
2. WYSTĘPOWANIE CZYNNIKÓW RYZYKA CHOROBY NIEDOKRWIENNEJ SERCA
i UMIERALNOŚĆ W POLSCE
Polska cechuje się wysoką umieralnością na IHD, co pozostaje w związku z
rozpowszechnieniem czynników ryzyka. Najważniejsze z nich podane są w tabeli I. W
oparciu o tę tabelę przedstawiamy, bazując na dostępnych informacjach, występowanie
czynników ryzyka w populacji polskiej.
Ryzyko wystąpienia epizodu IHD zależy od obecności, nasilenia i współistnienia
czynników ryzyka
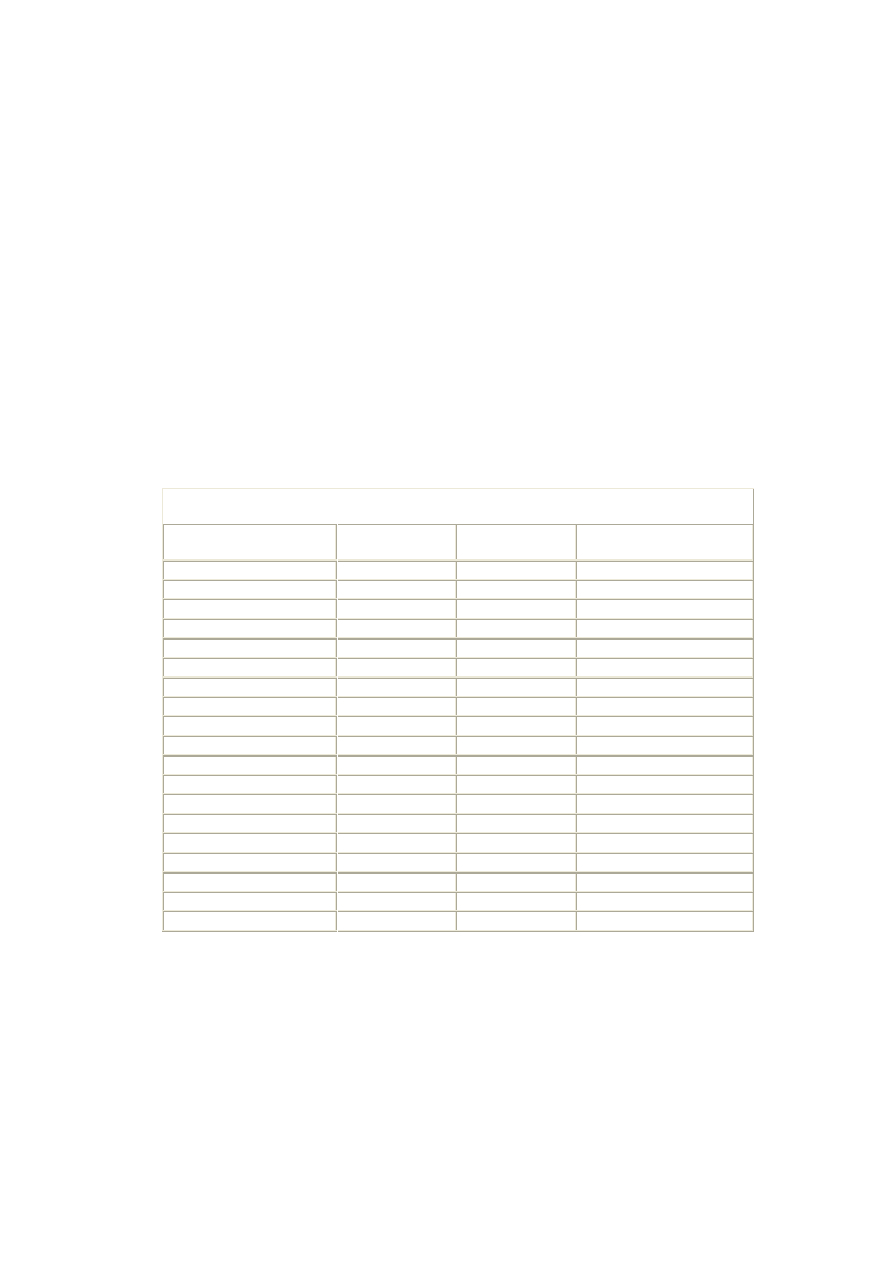
Tabela I. Najważniejsze czynniki ryzyka epizodu IHD
Styl życia
Cechy biochemiczne i
fizjologiczne
(poddające się
modyfikacji)
Cechy indywidualne
(nie poddające się modyfikacji)
Dieta obfitująca w
tłuszcze nasycone,
cholesterol i kalorie
Podwyższone stężenie
cholesterolu*
(LDL cholesterol)
Wiek:
mężczyzna >=45 lat*
kobieta >=55 lat*
Palenie tytoniu*
Podwyższone stężenie
trójglicerydów
Przedwczesna menopauza*
Wczesne występowanie w

Hiperglikemia/cukrzyca*
Czynniki trombogenne
Zwiększone stężenie
homocysteiny
Istniejąca u pacjenta IHD lub
choroby innych tętnic na tle
miażdżycy*
Modyfikacja z: K. Pyoaraalaa, G. De Backer, I. Graham, P. Poole-Wilson and D. Wood:
Prevention of coronary heart disease in clinical practice. Recommendations of the Task
Force of the European Society of Cardiology, European Atherosclerosis Society and
European Society of Hypertension. Europ. Heart J. 1994, 15, 1300-1331
Uwagi: tylko czynniki zaznaczone gwiazdką służą do oceny ryzyka ogólnego IHD wg
tabeli VIII.
Zgodnie z powszechnie akceptowaną, popartą faktami naukowymi, opinią żywienie
sprzyjające profilaktyce miażdżycy powinno cechować się niskim spożyciem nasyconych
kwasów tłuszczowych, cholesterolu i sodu, a wysokim spożyciem błonnika
pokarmowego, witamin i flawonoidów. W tabeli II porównano najważniejsze cechy
ż
ywienia wybranych populacji polskich z rekomendacjami Światowej Organizacji
Zdrowia. śywienie w Polsce w 1993 r. cechowało się, w porównaniu z rekomendacjami,
znacznie wyższym spożyciem tłuszczu ogółem i nasyconych kwasów tłuszczowych, zbyt
wysokim spożyciem cholesterolu (przez mężczyzn) i soli kuchennej, a niskim błonnika
pokarmowego.
Tabela II. Wybrane cechy żywienia populacji warszawskiej i Polski południowo-
wschodniej w 1993 r. w porównaniu z rekomendacjami Światowej Organizacji Zdrowia
Warszawa
Polska połudn-
wsch.
Rekomendacje
SOZ dla populacji
Granice
ś
redniego
spożycia
Wyszczególnienie
mężczyźni kobiety mężczyźni kobiety
niższa wyższa
Tłuszcz całkowity (%
energii)
41,0
39,2
36,7
34,4
15
30
Nasycone kwasy
tłuszczowe (% en.)
14,7
14,2
14,4
13,7
0
10
Wielonienasycone kw.
tłuszcz (% en.)
5,4
5,3
3,9
3,9
3
7
Cholesterol (mg/dzień)
433
302
460
327
0
300
Węglowodany całkowite
(% en.)
44,9
46,5
50,3
53,6
55
75
Wolne cukry (% en.)
6,6
7,0
-
-
0
10
Błonnik pokarmowy (g/24
godz.)
27
19
28,9
23,3
27
40
Białko (% en.)
14,9
14,3
12,9
12,0
10
15
Sól (g/24 godz.)
12
7,5
11,5
7,7
nie
ustalono
6
- Dane dla populacji Warszawy pochodzą z Badania Pol-MONICA Warszawa (9), dla
populacji Polski południowo-wschodniej z Badania Pol-MONICA Kraków (10). Wiek
badanych 35-64 lata.
- Średnie spożycie składników pokarmowych w indywidualnych przypadkach powinno
mieścić się w granicach ustalonych przez SOZ dla populacji. Systematyczne spożywanie
poniżej granicy niższej niesie za sobą ryzyko niedoborów, a powyżej granicy wyższej
ryzyko nadmiarów (11).
Objaśnienia użytych skrótów: en. - energii
Zmiany w spożyciu kwasów tłuszczowych w Polsce w okresie od 1950 do 1997 r.
przedstawione są na ryc. 1 (5). Zwraca uwagę znaczny wzrost ich spożycia między 1950
i 1991 rokiem, z przejściowym spadkiem w latach 1980-1982, co wiązało się z
trudnościami na rynku żywnościowym, oraz szybki spadek spożycia nasyconych kwasów
tłuszczowych na rzecz wzrostu nienasyconych kwasów tłuszczowych po roku 1989.
Ryc. 1. Zawartość kwasów tłuszczowych w spożytej żywności w Polsce na jednego
mieszkańca dziennie w latach 1050-1997 (5)
Ta znaczna zmiana w proporcji głównych grup kwasów tłuszczowych mogła przyczynić
się do spadku umieralności na choroby układu krążenia po roku 1991 (6, 7), co ilustruje
ryc. 2 (1).
Ryc. 2. Standaryzowana umieralność ludności Polski w wieku 35-64 lat (1)
spowodowana chorobami układu krążenia
Tabela III przedstawia porównanie średniego spożycia różnych produktów
ż
ywnościowych w Polsce ze spożyciem w Grecji, gdzie żywienie odpowiada zasadom
profilaktyki miażdżycy (dieta śródziemnomorska), a umieralność na chorobę
niedokrwienną serca jest niska (8). Zwraca uwagę uderzająco mała konsumpcja
tłuszczów zwierzęcych i znacznie większa niż w Polsce ryb, owoców, warzyw i nasion
strączkowych.
Tabela III. Porównanie spożycia produktów żywnościowych w Polsce z wzorcową dietą
ś
ródziemnomorską (Grecja) (8)
Grecja
g/dz./osobę
Polska
g/dz./osobę
Spoż. w Polsce
jako % spoż. w Grecji
Chleb
218
255
117
Mąka
30
52
173
Makaron
28
5
18
Ziemniaki
155
301
194
Warzywa
252
177
70
Przetwory warzywne
16
25
156
Nasiona strączkowe
16
3
19
Owoce
341
95
28
Przetwory owocowe
0
5
-
Cukier
40
89
223
Produkty cukiernicze
42
17
40
Mięso
175
187
107
Ryby
39
15
38
Mleko
112
317
283
Sery
84
64
76
Jaja
25
30
120
Masło
1
26
2600
Tłuszcze roślinne
89
17
19
Tłuszcze zwierzęce
0
16
-
- spożycie produktów żywnościowych w roku 1988
Palenie tytoniu w Polsce jest zjawiskiem powszechnym. Jak wykazano w badaniu Pol-
MONICA, w Warszawie w latach 1984, 1988 i 1993 papierosy paliło regularnie
odpowiednio 57, 52 i 50% mężczyzn oraz 33, 35 i 33% kobiet w wieku 35-64 lat (12). W
badaniu Pol-MONICA przeprowadzonym na terenie Polski południowo-wschodniej, w
tych samych latach uzyskano liczby dla mężczyzn 57, 57 i 54%, a dla kobiet 10, 17, i
20% (13). Wzrost częstości palenia wśród kobiet zamanifestował się w Polsce
południowo-wschodniej najsilniej w grupie wieku 35-44 lat (19, 35 i 39% odpowiednio w
wyżej podanych latach).
Ogólnopolskie badania spożycia tytoniu wskazują na trwający nieprzerwanie od
zakończenia drugiej wojny światowej wzrost spożycia aż do początku lat
osiemdziesiątych, kiedy to ukształtowało się ono na względnie stałym poziomie
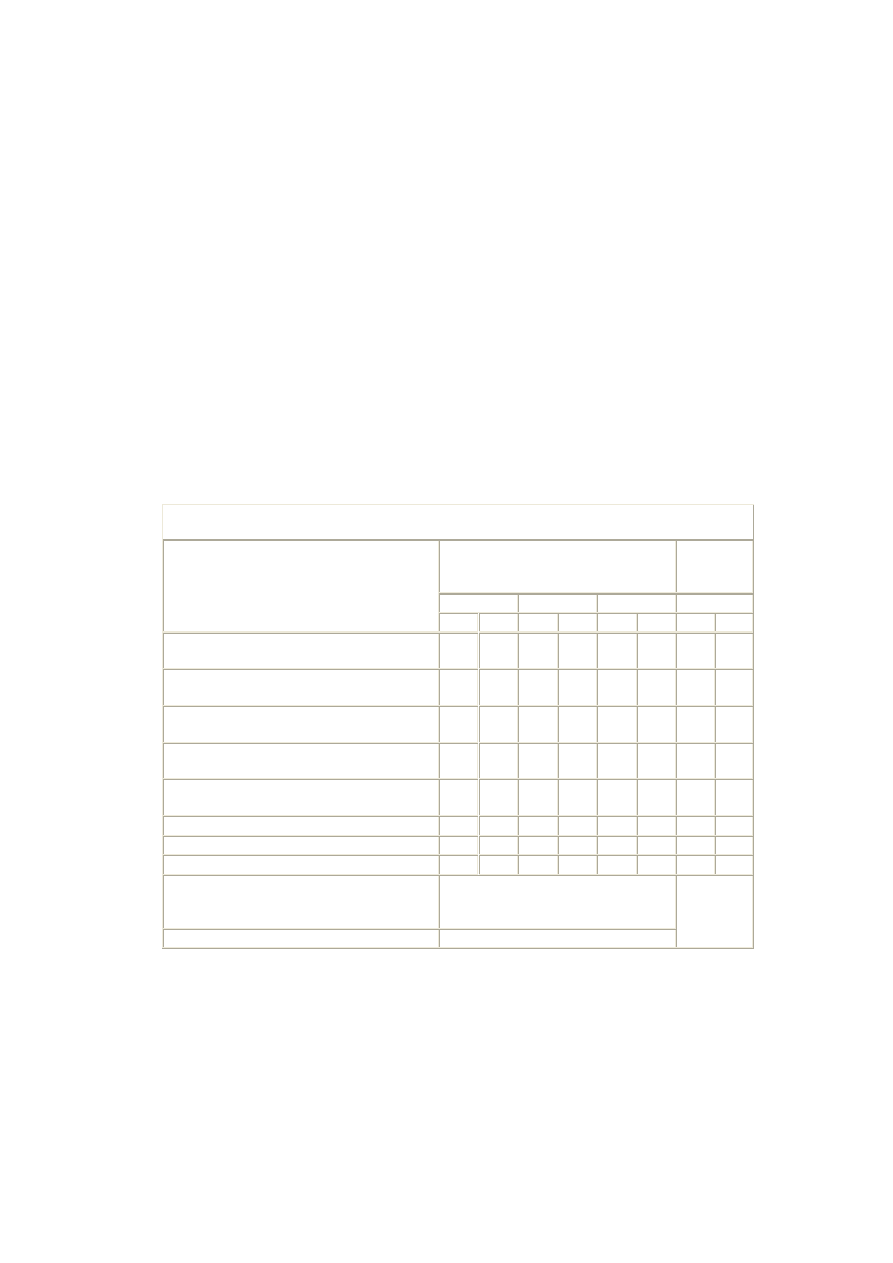
charakteryzującym się sprzedażą 94-96 miliardów papierosów rocznie, co w przeliczeniu
na dorosłego mieszkańca stawia Polskę w czołówce światowej listy konsumentów.
Obserwuje się jednak pewne pozytywne zmiany strukturalne palenia. Nastąpił wzrost
odsetka populacji mężczyzn nigdy nie palących. W 1982 r. 62% mężczyzn paliło
codziennie, w 1995 r. tylko 45%. Zmiany w populacji kobiet były mniej wyraźne (14).
Powszechnie znany jest także fakt dużego spożycia wysokoprocentowego alkoholu w
Polsce, którego nadkonsumpcja przyczynia się do nagłych zgonów sercowych. Brak
przekonania o dokładności danych statystycznych dotyczących spożycia alkoholu w
ostatnich latach powoduje, że to zagadnienie nie będzie rozwijane.
Od lat trwający dynamiczny rozwój motoryzacji, mechanizacji pracy, upowszechnianie
telewizji i zmechanizowanego sprzętu w gospodarstwie domowym powoduje
systematyczne zmniejszanie się aktywności fizycznej ludzi. Nic nie wskazuje na to,
ażeby ten duży spadek aktywności fizycznej został w znaczącej mierze skompensowany
wzrostem aktywnego wypoczynku.
Występowanie metabolicznych czynników ryzyka w populacji polskiej przedstawione jest
w tabeli IV. Zwraca uwagę wysoki odsetek hipercholesterolemii, nadciśnienia tętniczego,
otyłości i cukrzycy. Średnie stężenie fibrynogenu we krwi w populacji warszawskiej w
1993 r. wynosiło 322±89 mg/dl u mężczyzn i 319±79 mg/dl u kobiet, a w populacji Polski
południowo-wschodniej odpowiednio 335 i 343 mg/dl. Za stężenia referencyjne
przyjmuje się wartości 180-350 mg/dl. Aktywność koagulacyjna czynnika VII u mężczyzn
w Warszawie wynosiła 106,17%, a u kobiet 103,33%, natomiast w populacji Polski
południowo-wschodniej 101% dla obu płci (15).
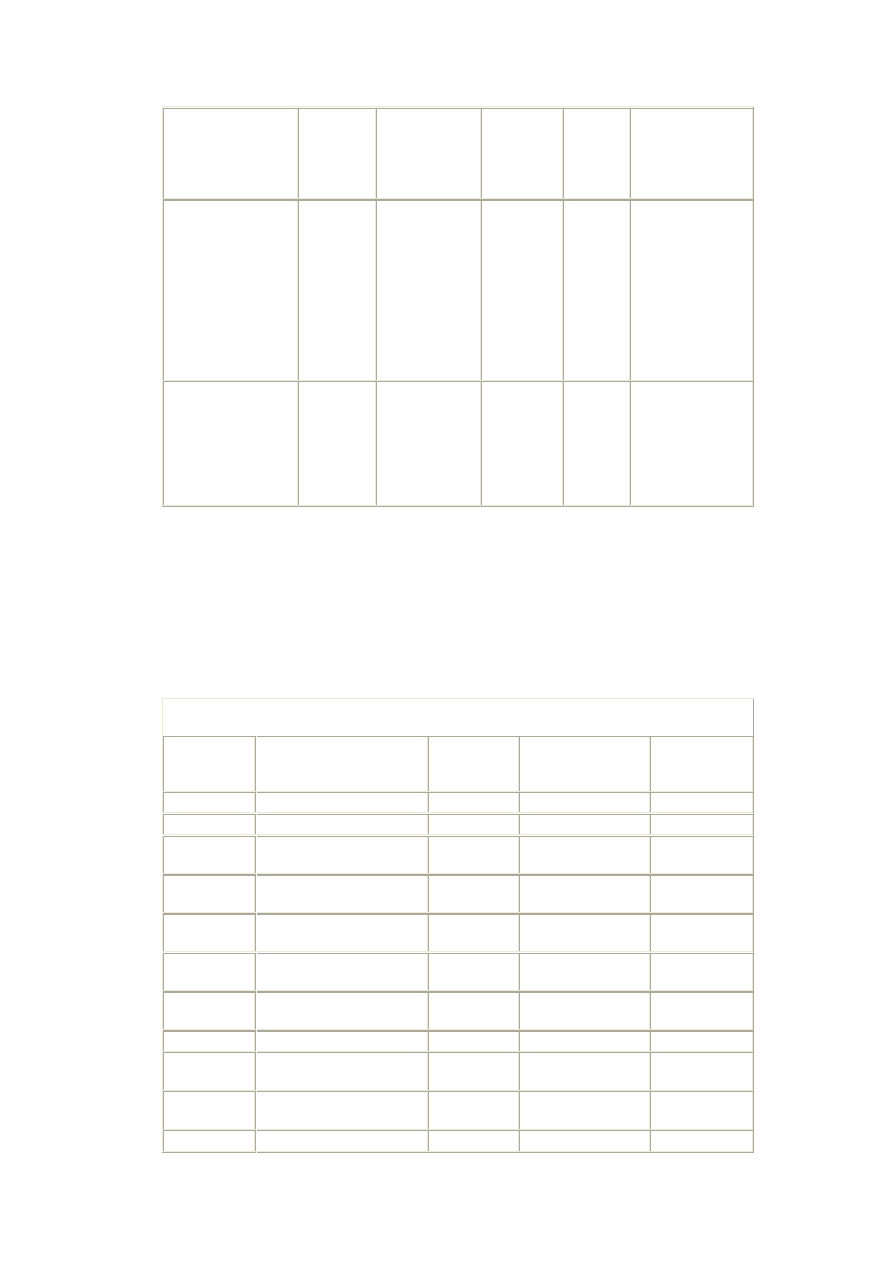
Tablela IV. Występowanie metabolicznych czynników ryzyka w populacji Warszawy i
Polski południowo-wschodniej (w procentach badanej populacji)
Warszawa
Polska
Płd.-
Wsch.
1984 r.
1988 r.
1993 r.
1993 r.
Wyszczególnienie
M
K
M
K
M
K
M
K
Cholesterol całkowity
>=200 mg/dl
65
66
66
72
70
67
64
63
LDL-chol
130-159 mg/dl
29
29
30
28
31
32
31
29
LDL-chol
>=160 mg/dl
18
19
24
28
30
24
19
22
Trójglicerydy
>=200 mg/dl
26
14
18
9
15
6
18
12
HDL-chol
=<34 mg/dl
5
3
8
1
4
1
1
1
Nadciśnienie tętnicze
62
54
50
47
46
36
44
43
BMI 25-29,9 kg/m
2
49
39
50
38
45
36
41
36
BMI 330 kg/m
2
19
28
20
29
22
29
15
36
Cukrzyca
6,4% w badanej populacji, wśród
mężczyzn dwa razy częściej niż u
kobiet
Upośledzona tolerancja glukozy
4,0%
- Uwagi: Wyniki badań lipidów, lipoprotein, nadciśnienia, nadwagi i otyłości pochodzą z
badania Pol-MONICA-Warszawa (12) i Pol-Monica Kraków (10). Za kryteria nadciśnienia
przyjęto ciśnienie krwi skurczowe >=140 mmHg lub rozkurczowe >90 mmHg, albo
aktualnie prowadzone leczenie z powodu nadciśnienia;
- Dane o częstości występowania cukrzycy pochodzą z badania populacji Warszawa-
Bielany, przeprowadzonych w 1996 r. przez J. Tatonia. Badanie dotyczyło mężczyzn i
kobiet w wieku 20. i więcej lat.
- Cukrzycę rozpoznawano na podstawie kryteriów WHO: Diabetes mellitus. Report of a
WHO Study Group. Technical Report Series 646. World Health Organization. Geneva,
1985.Objaśnienia użytych skrótów: M - mężczyźni, K - kobiety, chol - cholesterol, BMI -
indeks mały ciała

Umieralność na choroby układu krążenia, w tym IHD, rosła w Polsce od lat, osiągając
szczyt w 1991 roku. Następnie zaznaczyło się zmniejszenie liczby zgonów z tego
powodu (ryc. 2). Towarzyszyło temu zmniejszenie umieralności ogólnej (1). Było to
prawdopodobnie skutkiem wieloletnich programów oświatowych na rzecz profilaktyki
chorób układu krążenia i zaowocowało pożądanymi efektami w okresie przemian
politycznych i gospodarczych, kiedy wzrosła wiarygodność środków społecznego
przekazu i poprawiło się znacznie zaopatrzenie rynku artykułów żywnościowych w
produkty preferowane w żywieniu profilaktycznym. Ważną rolę mogło odegrać także
zmniejszenie odsetka mężczyzn palących papierosy, oraz poprawa leczenia tak
ważnych czynników ryzyka jak nadciśnienie i hiperlipidemia. Zapewne nie bez znaczenia
była też poprawa leczenia ostrych epizodów IHD. Podkreślenia wymaga, że poza
zmniejszeniem zgonów na IHD wystąpił także spadek zachorowalności na zawał serca
zarejestrowany po 1990 r. w badaniu Pol-MONICA w Warszawie (1) i po 1992 r. na
południu Polski (16). Może to wskazywać na skuteczność podjętych działań w zakresie
profilaktyki pierwotnej.
Powyższe obserwacje uzasadniają celowość dalszych wysiłków na rzecz rozwoju
profilaktyki kardiologicznej w Polsce. Utrzymanie dotychczasowego trendu spadkowego
umieralności na choroby układu krążenia daje szansę sukcesu porównywalnego z tym,
który uzyskały kraje najbardziej rozwinięte.
PROFILAKTYKA CHOROBY NIEDOKRWIENNEJ SERCA
Rekomendacje Komisji Profilaktyki
Polskiego Towarzystwa Kardiologicznego
3. OGÓLNE ZASADY PROFILAKTYKI CHOROBY NIEDOKRWIENNEJ SERCA i
DOWODY na jej SKUTECZNOŚĆ
Profilaktyka miażdżycy i jej głównych powikłań klinicznych polega na zwalczaniu
czynników ryzyka. Spośród czynników wymienionych w tabeli I, rezygnacja z palenia
papierosów, obniżanie stężenia cholesterolu LDL w surowicy, leczenie nadciśnienia i
zmniejszenie gotowości prozakrzepowej krwi uważane są za działania profilaktyczne o
udowodnionej skuteczności (17). Wysoce prawdopodobną skuteczność przypisuje się
leczeniu cukrzycy, otyłości, niskich stężeń cholesterolu HDL i zwiększaniu aktywności
fizycznej (17). Jest także możliwe, że eliminowanie psychospołecznych czynników
ryzyka, obniżanie stężenia trójglicerydów, lipoproteiny (a), homocysteiny, zmniejszanie
stresu oksydacyjnego i umiar w spożyciu alkoholu odgrywają pozytywną rolę w
zapobieganiu IHD (17). Pewne nadzieje wiąże się z hormonalną terapią zastępczą
(HTZ), jako metodą profilaktyki u kobiet po menopauzie. Dotychczas brak jest jednak
dowodów na możliwość redukcji epizodów wieńcowych z zastosowaniem tej metody w
dobrze kontrolowanych badaniach klinicznych. Jedyna tego typu praca ogłoszona
niedawno nie wykazała skuteczności tej metody w prewencji wtórnej IHD (18). Z tego
powodu w obu ostatnich rekomendacjach międzynarodowych na temat prewencji IHD (2,
3) brak jest stanowiska zalecającego HTZ w profilaktyce pierwotnej i/lub wtórnej.
Oczekuje się na wyniki badań, będących w toku realizacji.
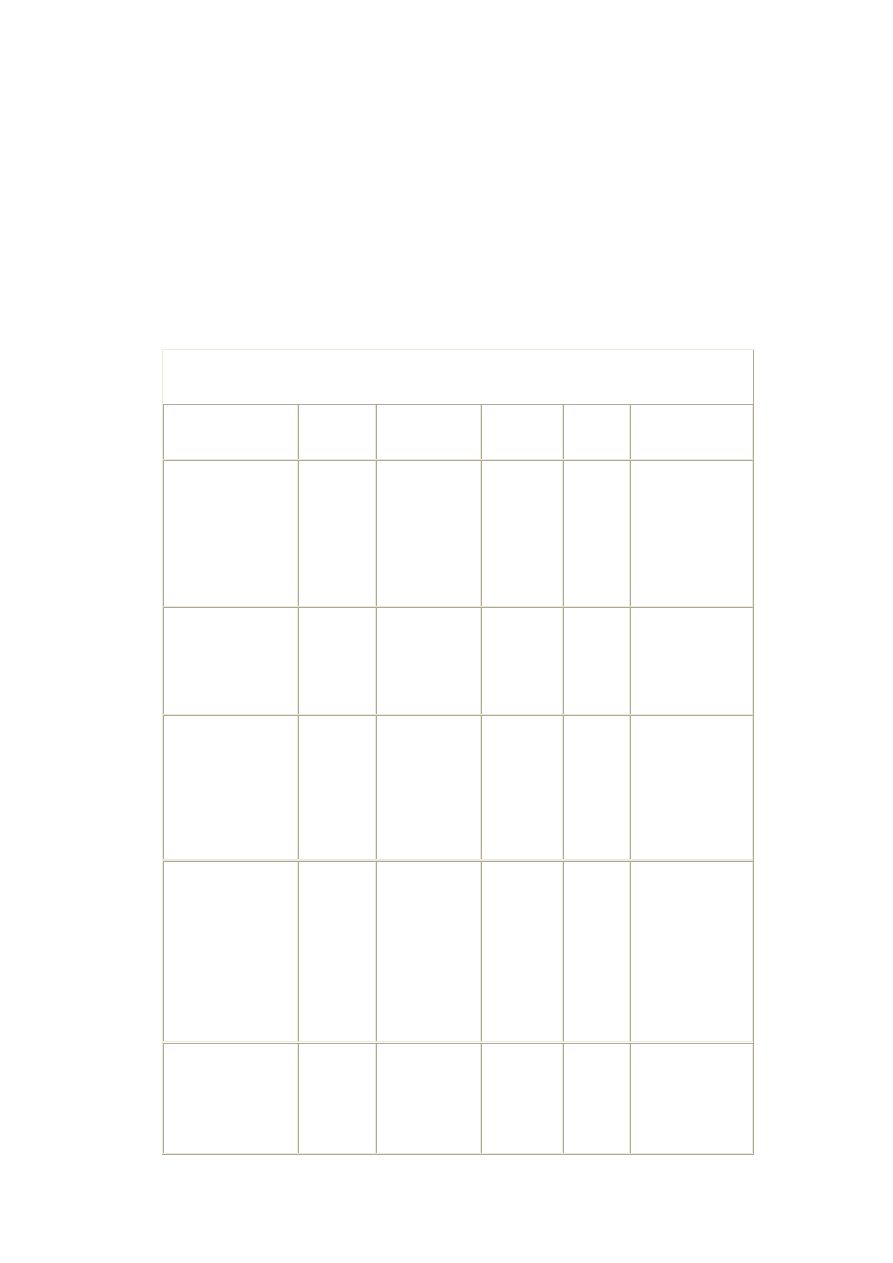
Należy podkreślić, że racjonalizacja żywienia wpływa pozytywnie na zdecydowaną
większość wymienionych czynników ryzyka i zmniejsza zagrożenie IHD. Dlatego dieta,
obok rzucenia palenia papierosów, należy do podstawowych metod profilaktyki.
Znaczną korzyść w postaci redukcji incydentów wieńcowych przynosi również obniżanie
stężenia cholesterolu LDL przy pomocy leków hipolipemizujących. Także leczenie
farmakologiczne nadciśnienia tętniczego zmniejsza ryzyko IHD.
Najważniejsze duże próby kliniczne dowodzące skuteczności profilaktyki pierwotnej i
wtórnej epizodów wieńcowych oraz badania wykazujące zahamowanie progresji
miażdżycy poprzez redukcję stężenia lipidów podane są w tabelach V i VI.
Wynika z nich jednoznacznie, że pod wpływem leczenia hipolipemizującego możliwe jest
zarówno znaczne zmniejszenie występowania epizodów wieńcowych, jak i spowolnienie
rozwoju miażdżycy w tętnicach wieńcowych. Warto dodać, że redukcja incydentów IHD
dotyczy obu płci.
Tabela V. Wpływ leków hipolipemizujących na redukcję stężenia lipidów i na
występowanie epizodów wieńcowych. Wyniki dużych randomizowanych badań
klinicznych
Badanie
Liczba
pacjentów
Leczenie
Czas
obserwacji
(lata)
Zmiana
stężenia
lipidów
Wynik
Pierwotna
prewencja
Helsinki Heart
Study (19)
4081
gemfibrozyl
1200 mg
5
\ LDL-
chol 9%
\ TG
45%
/ HDL-
chol 11%
• Zgony ogółem /
7% NZ
• Zgony sercowe
/ 25% NZ
• Zawał bez
zgonu \ 37%
• Zawał ze
zgonem \ 25%
WOSCOPS (20)
6595
prawastatyna
40 mg
4,9
(mediana)
\ LDL-
chol 26%
\ TG
12%
/ HDL-
chol 5%
• Zgony ogółem \
22% (p=0,051)
• Zgony
wieńcowe i zawał
bez zgonu \ 31%
AFCAPS/TexCAPS
(21)
6605
lowastatyna
20 mg, do 40
mg
>=5
\ LDL-
chol 25%
\ TG
15%
/ HDL-
chol 6%
• Ostry epizod
wieńcowy \ 37%
• Zawał ze
zgonem i bez
zgonu \ 40%
• Potrzeba
rewaskularyzacji \
33%
Wtórna prewencja
4S (22)
4444
simwastatyna
20 mg
redukcja dawki
do 10 mg lub
zwiększenie
do 40 mg
5,4
(mediana)
\ LDL-
chol 38%
\ TG
10%
/ HDL-
chol 8%
• Zgony ogółem \
30%
• Główne
epizody
wieńcowe \ 34%
• Zgony
wieńcowe \ 42%
• Potrzeba
rewaskularyzacji \
37%
CARE (23)
4153
prawastatyna
40 mg
5
(mediana)
\ LDL-
chol 28%
\ TG
14%
/ HDL-
chol 5%
• Zgony ogółem \
8,9% NZ
• Główne
epizody
wieńcowe \ 31%
• Zawał ze
zgonem lub bez
zgonu \ 25%
• Potrzeba
rewaskularyzacji \
27%
LIPID (24)
9014
prawastatyna
40 mg
6
(średnia)
\ LDL-
chol 27%
\ TG
13%
/ HDL-
chol 4%
• Zgony ogółem \
23%
• Zgony
wieńcowe \ 24%
• Zawał ze
zgonem lub bez
zgonu \ 29%
• Potrzeba
rewaskularyzacji \
24%
VA-HIT (25)
2531
gemfibrozyl
1200 mg
5,1
(mediana)
LDL-
chol: bez
zmiany
\ TG
31%
/ HDL-
chol 6%
• Zgony ogółem \
11% NZ
• Zawał bez
zgonu lub zgon z
powodu IHD \
22%
/ - wzrost
\ - spadek
NZ - nieznamienne; Pozostałe wyniki znamienne.
WOSCOPS - West of Scontland Coronary Prevention Study, AFCAPS/TexCAPS - Air
Force/Texas Coronary Atherosclerosis Prevention Study, 4S - Scandinavian Simvastatin
Survival Study, CARE - Cholesterol and Recurrent Events, LIPID - Long term
Intervention with Pravastatin in Ischemic Disease, VA-HIT - Veterans Affairs Cooperative
Study Program High Density Lipoprotein Cholesterol Intervention Trial.
Objaśnienia użytych skrótów: TG - trójglicerydy, chol - cholesterol, NZ - wynik
nieznamienny statystycznie
Tabela VI. Wpływ redukcji stężenia lipidów na progresję lub regresję miażdżycy tętnic
wieńcowych oraz występowanie epizodów wieńcowych. Badania angiograficzne.
Leczenie
Czas
obserwacji
(lata)
Wpływ na
miażdżycę
Redukcja
epizodów
wieńcowych
BECAIT (26) Dieta + bezafibrat
5
mniejsza progresja
21%
CCAIT (27) Dieta + lowastatyna
2
mniejsza progresja
-
CLAS (28)
Dieta +żywica + niacyna
2
mniej nowych
zmian
25%
CLAS (29)
Dieta + żywica + niacyna
4
regresja, mniejsza
progresja
43%
FATS (30)
Dieta + żywica + niacyna
2,5
regresja, mniejsza
progresja
80%*
FATS (30)
Dieta + żywica +
lowastatyna
2,5
regresja, mniejsza
progresja
70%
Lifestyle (31)
Dieta + kilka innych
modyfikacji stylu życia
1
regresja, mniejsza
progresja
-
LOCAT (32) Dieta + gemfibrozil
3
mniejsza progresja
-
LCAS
(33,34)
Dieta + fluwastatyna
2,5
mniejsza progresja
NZ
MARS (35)
Dieta + lowastatyna
2
regresja, mniejsza
progresja
24%
NHLBI Type Dieta + żywica
5
mniejsza progresja
33%

II (36)
POSCH (37)
Dieta + bypass jelitowy +
ż
ywica
9,7
regresja, mniejsza
progresja
35%*
SCRIP (38)
Dieta + leki + ćwiczenia
fizyczne
4
mniejsza progresja
39%*
STARS (39) Dieta
3
regresja, mniejsza
progresja
69%*
STARS (39) Dieta + żywica
3
regresja, mniejsza
progresja
89%*
UCSF-
SCOR (40)
Dieta + żywica + niacyna
+ lowastatyna
2
mniejsza progresja
-
* Wynik znamienny statystycznie
BECAIT = Bezafibrate Coronary Atherosclerosis Intervention Trial; CCAIT = Canadian
Coronary Atherosclerosis Intervention Trial; CLAS = Cholesterol-Lowering
Atherosclerosis Study; FATS = Familial Atherosclerosis Treatment Study; LCAS = Lipid
and Coronary Atherosclerosis Study; LOCAT = Lopid (gemfibrozil) Coronary
Angiography Trial; MARS = Monitored Atherosclerosis Regression Study; NHLBI =
National Heart, Lung, and Blood Institute; POSCH = Program on the Surgical Control of
the Hyperlipidaemias; SCRIP = Stanford Coronary Risk Intervention Project; STARS =
St. Thomas Atherosclerosis Regression Study; UCSF-SCOR = University of California,
San Francisco Specialized Center of Research
Istnieją również dowody na zmniejszenie ryzyka występowania epizodów wieńcowych u
pacjentów z nadciśnieniem tętniczym, pod wpływem leczenia hipotensyjnego niektórymi
lekami. Wykazano taki efekt w odniesieniu do diuretyków i beta-blokerów u ludzi nie
chorujących na IHD (41, 42, 43).
Co się tyczy wpływu blokerów kanałów wapniowych, to w opublikowanych ostatnio
badaniach niemożliwa była wiarygodna ocena ich wpływu na ryzyko IHD, u ludzi bez tej
choroby, ze względu na małą liczbę incydentów wieńcowych jakie wystąpiły w czasie
obserwacji. Dotyczyło to badań Systolic Hypertension in Europe; Syst-Eur (44),
Shanghai Trial of Nifedipine in the Elderly; STONE (45) oraz Systolic Hypertension in
China (46).
Dotychczas przeprowadzono tylko jedno badanie kliniczne o dużej liczebności,
oceniające działanie inhibitorów enzymu konwertującego angiotensynę (ACE) u
pacjentów z niepowikłanym nadciśnieniem tętniczym (47). W badaniu Captopril
Prevention Project (CAPPP), obejmującym prawie 11 000 pacjentów z nadciśnieniem
tętniczym, porównano wpływ leczenia kaptoprilem lub tiazydowym lekiem moczopędnym
w skojarzeniu z metoprololem (jako leczenie konwencjonalne), średnio przez około 6 lat,
na zachorowalność na choroby sercowo-naczyniowe oraz zgony z tego powodu.
Występowanie zawału serca ze zgonem i bez zgonu nie różniło się pomiędzy obu
grupami pacjentów. Natomiast w grupie przyjmującej kaptopril mniej było o 23%
(p=0,092) zgonów z przyczyn sercowo-naczyniowych, w porównaniu z leczonymi
konwencjonalnie. Zwraca uwagę, że chorzy na cukrzycę leczeni kaptoprilem rzadziej
chorowali na zawał serca ze zgonem i bez zgonu. Różnica z podgrupą chorych na
cukrzycę leczonych lekiem moczopędnym i metoprololem wynosiła 66% i była
znamienna (p=0,002). Wyjaśnienia wymaga więcej o 25% (p=0,044) udarów mózgu u
przyjmujących kaptopril.
Inhibitory ACE mogą zmniejszać ryzyko epizodów wieńcowych nie tylko poprzez
działanie hipotensyjne. W korzystnym działaniu tych leków mogą odgrywać rolę także
inne mechanizmy, jak regresja przerostu lewej komory i poprawa jej funkcji, korzystne
działanie na ścianę tętnicy w postaci poprawy funkcji śródbłonka (działanie
wazodylatacyjne), hamowanie progresji miażdżycy, zmniejszenie ryzyka pęknięcia
blaszki miażdżycowej (korzystna zmiana jej składu); pozytywny wpływ na układ
krzepnięcia i fibrynolizy.
U pacjentów z niewydolnością serca (meta-analiza 3 badań klinicznych obejmujących
około 9000 pacjentów) stwierdzono zmniejszenie występowania zawału serca o 23%
pod wpływem leczenia inhibitorami ACE (kaptopril, enalapril) (48).
Na uwagę zasługują niedawno opublikowane wyniki badania Heart Outcomes
Prevention Evaluation (HOPE) z zastosowaniem ramiprilu u ponad 9000 pacjentów z

dużym ryzykiem powikłań sercowo-naczyniowych (obecność IHD lub cukrzycy bądź
przebyty udar mózgu) bez dysfunkcji lewej komory lub niewydolności serca (49). Z
badania wyłączono osoby z niekontrolowanym nadciśnieniem tętniczym. Po 5 latach
obserwacji spośród tych, którzy przyjmowali lek 6,1% zmarło z przyczyn sercowo-
naczyniowych. Odsetek pacjentów w grupie placebo wynosił 8,1%. Tak więc redukcja
ryzyka zgonu z tych powodów wyniosła 26% (p<0,001).
Leczeni ramiprilem mieli znamiennie mniej zawałów serca, zabiegów
rewaskularyzacyjnych, rzadsze występowanie niewydolności serca oraz mniej zgonów
ogółem. Obie grupy chorych nie różniły się między sobą wartością ciśnienia tętniczego
przed przystąpieniem do badania (średnie RR 133/76 mmHg u przyjmujących ramipril i
137/78 mmHg w grupie placebo) oraz w trakcie jego trwania (odpowiednio 136/76 mmHg
i 139/77 mmHg).
Badanie HOPE jest pierwszym badaniem klinicznym, którego wyniki sugerują, że
inhibitory ACE mogą zmniejszać zagrożenie epizodem wieńcowym, nie tylko w związku
z działaniem hipotensyjnym i/lub związanym z regresją przerostu lewej komory i
poprawą jej funkcji.
Mniej jest danych na temat wpływu leków hipotensyjnych na ryzyko wystąpienia
kolejnych epizodów wieńcowych u chorych na IHD ze współistniejącym nadciśnieniem
tętniczym. Wykazano, że beta-blokery u takich pacjentów zmniejszają zarówno ryzyko
zawału, jak i zgonu z przyczyn sercowo-naczyniowych (50). Brakuje natomiast
jednoznacznych dowodów na skuteczność pod tym względem blokerów kanałów
wapniowych. Zaobserwowano jedynie tendencję do zmniejszania ryzyka zawału u
pacjentów otrzymujących werapamil i diltiazem, oraz zwiększone ryzyko chorych
leczonych krótko działającymi preparatami nifedypiny (51). Badania z zastosowaniem
długo działających leków z tej grupy są dopiero w toku realizacji.
Na uwagę zasługuje, że w większości badań korzyść zależy od stopnia redukcji ciśnienia
krwi. Dobrym potwierdzeniem są wyniki badania Hypertension Optimal Treatment (HOT)
(52). W podgrupie pacjentów o najniższym osiągniętym ciśnieniu rozkurczowym (równe i
poniżej 80 mmHg) stwierdzono tendencję do występowania mniejszej liczby epizodów
wieńcowych niż u pacjentów, którzy mieli wyższe wartości ciśnienia rozkurczowego po
leczeniu. W badaniu tym nie można było ocenić wpływu poszczególnych leków
hipotensyjnych na ryzyko wieńcowe, gdyż ponad 80% pacjentów stosowało więcej niż
jeden lek.
Przytoczone badania dotyczące wpływu leczenia hiperlipidemii lub nadciśnienia na
ryzyko IHD dotyczyły programów profilaktyki jednoczynnikowej. Zgodnie z powszechną
opinią profilaktyka wieloczynnikowa jest skuteczniejsza od jednoczynnikowej.
Ważkim argumentem na rzecz celowości wdrażania profilaktyki kardiologicznej na skalę
populacyjną jest spadek po 1970 roku standaryzowanych dla wieku wskaźników
umieralności na IHD we wszystkich krajach rozwiniętych, z wyjątkiem Grecji i Hiszpanii
(gdzie i tak są niske), oraz krajów Europy środkowo-wschodniej. Wynika to ze spadku
zachorowań oraz ze spadku śmiertelności ludzi już chorujących na IHD. Pierwszy efekt
zależy od korzystnej zmiany w zakresie rozpowszechnienia czynników ryzyka (skutek
działań profilaktycznych), drugi zaś od poprawy opieki kardiologicznej w ostrych stanach,
łącznie z rozwojem technik rewaskularyzacyjnych.
Wśród działań profilaktycznych, które w rozwiniętych krajach zachodnich wywarły
znaczący wpływ na umieralność z powodu IHD, należy w szczególności wymienić
racjonalizację żywienia, zmniejszenie odsetka ludzi palących papierosy oraz poprawę
wykrywalności i leczenia nadciśnienia tętniczego i hiperlipidemii.
PROFILAKTYKA CHOROBY NIEDOKRWIENNEJ SERCA

Rekomendacje Komisji Profilaktyki
Polskiego Towarzystwa Kardiologicznego
4. PROFILAKTYKA PIERWOTNA
Spis treści
4.1. Strategia populacyjna
4.2. Strategia zwiększonego ryzyka
4.2.1. Ocena zagrożenia IHD w oparciu o czynniki ryzyka
4.2.1.1. Palenie tytoniu
4.2.1.2. Zwiększone stężenie cholesterolu LDL
4.2.1.3. Niskie stężenia cholesterolu HDL
4.2.1.4. Podwyższone ciśnienie tętnicze
4.2.1.5. Hiperglikemia i cukrzyca
4.2.1.6. Wiek, płeć, menopauza
4.2.1.7. Obecność chorób na tle miażdżycy
4.2.1.8. Obciążenie rodzinne chorobami na tle miażdżycy
4.2.2. Zagrożenie IHD wynikające z obecności innych czynników ryzyka
4.2.2.1. Sposób żywienia i spożycie alkoholu
4.2.2.2. Mała aktywność fizyczna
4.2.2.3. Podwyższone stężenie trójglicerydów
4.2.2.4. Otyłość
4.2.2.5. Czynniki trombogenne
4.2.2.6. Zwiększone stężenie homocysteiny
4.2.2.7. Przerost lewej komory serca
4.3. Diagnostyka i klasyfikacja hiperlipidemii
4.4. Diagnostyka i klasyfikacja nadciśnienia tętniczego
4.1. Strategia populacyjna
W strategii populacyjnej mają zastosowanie głównie metody zmierzające do poprawy stylu życia,
w szczególności dotyczące żywienia, palenia papierosów, spożywania alkoholu i aktywności
fizycznej. W krajach o częstym występowaniu IHD, a dotyczy to także Polski, zalecenia dotyczące
poprawy stylu życia kierowane są do całej populacji. W celu ich upowszechnienia są lub powinny
być wykorzystywane przede wszystkim środki społecznego przekazu, szkoły, organizacje
samorządowe i społeczne. Jednostki organizacyjne służby zdrowia pełnią w tym zakresie głównie
rolę inicjatywną i opiniotwórczą.
W opublikowanym w 1998 r. raporcie "Food, Nutrition and Cardiovascular Disease Prevention in
the European Union", opracowanym przez European Heart Network (53) stwierdzono, że w
związku ze starzeniem się populacji może wzrosnąć liczba osób z chorobami układu krążenia, co
stanie się nie tylko dużym obciążeniem dla budżetów ochrony zdrowia w krajach członkowskich
Unii Europejskiej, lecz przyczyni się także do zwiększenia liczby ludzi cechujących się niższą
jakością życia. Raport ten, przeznaczony głównie dla polityków, wskazuje na palącą potrzebę
przeciwdziałania temu zjawisku.
Cele żywieniowe dla krajów europejskich przedstawiono w tabeli VII. Porównanie wskazań z tabeli
VII z charakterystycznymi cechami żywienia populacji polskiej (tabela II) wskazuje, że zalecenia
grupy ekspertów European Heart Network mają zastosowanie także w odniesieniu do naszego
kraju, co ma szczególne znaczenie w aspekcie naszych starań o członkostwo w Unii Europejskiej.
Ciągle wysoka umieralność na choroby układu krążenia w Polsce wymaga podjęcia
skoordynowanych działań dotyczących pierwotnej profilaktyki tych chorób. Agendy rządowe
odpowiedzialne za ochronę zdrowia powinny wystąpić z odpowiednimi inicjatywami.
Tabela VII. Cele żywieniowe dla populacji krajów europejskich (53)
Tłuszcz całkowity
<35% energii w krajach o spożyciu powyżej 40% energii (cel
pośredni)

<30% energii w krajach o mniejszym spożyciu (cel ostateczny)
Nasycone kwasy tłuszczowe
(łącznie z kwasami trans)
<10% energii
Nienasycone kw. tłuszczowe
w tym kw. wielonienasycone
<25% energii w krajach o wysokim spożyciu tłuszczu (cel
pośredni)
<20% energii w krajach o niższym spożyciu tłuszczu (cel
ostateczny)
5-10% energii
Kwasy tłuszczowe trans
obniżyć spożycie
Cholesterol
<300 mg/dzień
Skrobia
>50% energii
Cukry proste
obniżyć spożycie
Błonnik pokarmowy
zwiększyć spożycie
Sól
<6 g/dzień
Potas
nie sprecyzowano zaleceń
Witaminy antyoksydacyjne
zwiększyć spożycie w postaci produktów żywnościowych
Owoce i warzywa
>400 g/dzień
Chleb, inne produkty zbożowe i
ziemniaki
zwiększyć spożycie jeżeli jest niskie, utrzymać jeżeli wysokie
Ryby
zwiększyć spożycie jeżeli jest niskie, utrzymać jeżeli jest
wysokie
Mięso i produkty mleczarskie
zmniejszyć spożycie tłustych mięs i pełnotłustych produktów
mleczarskich, jeżeli jest wysokie
Uwaga! Cele dotyczące spożycia tłuszczu całkowitego, kwasów tłuszczowych i skrobi wyrażone
są w procentach dziennego spożycia ogółu kalorii
4.2. Strategia zwiększonego ryzyka
Strategia zwiększonego ryzyka dotyczy poszczególnych osób, jeżeli cechują się one ryzykiem
IHD większym niż przeciętne w populacji (tabela VIII). Przy ryzyku ogólnym łagodnym oraz w
większości przypadków ryzyka umiarkowanego wystarczającą metodą postępowania powinna być
modyfikacja stylu życia. Przy ryzyku dużym i bardzo dużym w rachubę wchodzi także stosowanie
leków. Profilaktykę pierwotną u pacjentów z dużym i bardzo dużym ryzykiem powinien prowadzić
lekarz podstawowej opieki zdrowotnej. Powinien on także mieć obowiązek udzielania porady
dotyczącej zasad profilaktyki osobom z ryzykiem łagodnym i umiarkowanym.
4.2.1. Ocena zagrożenia IHD w oparciu o czynniki ryzyka
Zasady oceny stopnia ryzyka IHD podane są w tabeli VIII. Opierają się one na szacunku liczby i
nasilenia czynników ryzyka, takich jak: palenie papierosów, podwyższone stężenie cholesterolu
LDL, niskie stężenia cholesterolu HDL, podwyższone ciśnienie tętnicze, cukrzyca, wiek, płeć,
obecność chorób na tle miażdżycy u pacjenta i obciążenie rodzinne chorobami na tle miażdżycy.
Te czynniki ryzyka zostały ściślej określone także w tabeli VIII.
W tabeli VIII pominięto następujące czynniki ryzyka: dieta obfitująca w tłuszcze nasycone,
cholesterol i kalorie, nadmierne spożycie alkoholu, mała aktywność fizyczna, zwiększone stężenie
trójglicerydów, otyłość, czynniki trombogenne i zwiększone stężenie homocysteiny.
Czynniki te, z nielicznymi wyjątkami, pomijane są także w ocenie stopnia ryzyka ogólnego IHD w
rekomendacjach opracowywanych przez europejskie, międzynarodowe i amerykańskie grupy
ekspertów. Uzasadnienie takiego postępowania zostanie podane na dalszych stronach tego
opracowania.

Ryzyko wystąpienia epizodu choroby niedokrwiennej serca należy określić u każdego człowieka
powyżej 20. roku życia, posługując się tabelą VIII
Tabela VIII. Kategorie ryzyka epizodu choroby niedokrwiennej serca
Ryzyko
łagodne
Ryzyko umiarkowane
Ryzyko duże
Ryzyko bardzo duże
• jeden lub dwa
łagodne czynniki
ryzyka
• jeden umiarkowany
czynnik ryzyka
• jeden silny
czynnik ryzyka
lub
• dwa
umiarkowane
czynniki ryzyka
• przynajmniej jeden bardzo
silny czynnik ryzyka (w
szczególności IHD)*
lub
• przynajmniej dwa silne
czynniki ryzyka
lub
• przynajmniej trzy
umiarkowane czynniki ryzyka
Łagodne
czynniki ryzyka
- LDL-chol: 130-
159 mg/dl
(3,4-4,1 mmol/l)
(TC: 200-239
mg/dl; 5,2-6,2
mmol/l)
- RRS: 140-159
mmHg i/lub
RRR: 90-99
mmHg
Umiarkowane czynniki
ryzyka
- palenie papierosów
- LDL-chol: 160-210 mg/dl
(4,1-5,4 mmol/l)
(TC: 240-300 mg/dl; 6,2-
7,8 mmol/l)
- HDL-chol
=<35 mg/dl u mężczyzn
(0,9 mmol/l)
=<40 mg/dl u kobiet (1,0
mmol/l)
- RRS: 160-179 mmHg
i/lub
RRR: 100-109 mmHg
- mężczyzna >=45 lat
- kobieta >=55 lat
- przedwczesna
menopauza
- przedwczesne
występowanie IHD
lub
chorób tętnic obwodowych
na tle miażdżycy u
krewnych 1-go stopnia
- krewni mężczyźni <55 r.
ż
ycia
- krewne kobiety <65 r.
ż
ycia
Silne czynniki
ryzyka
- 20 lub więcej
papierosów
dziennie
- LDL-chol >210
mg/dl
(5,4 mmol/l)
(TC: >300 mg/dl;
7,8 mmol/l)
- RRS >=180
mmHg i/lub
RRR >=110
mmHg
Bardzo silne czynniki ryzyka
- choroba niedokrwienna
serca
- klinicznie udokumentowane
choroby innych tętnic
- hiperlipidemia rodzinna
- cukrzyca
* ChNS: przebyty zawał serca, dusznica bolesna, przebyty zabieg rewaskularyzacyjny na
tętnicach wieńcowych, angiograficznie stwierdzona miażdżyca tętnic wieńcowych.
Stężenie LDL-chol oblicza się z formuły Friedewalda: LDL-chol (mg/dl) = TC (mg/dl) - HDL-chol
(mg/dl) - TG (mg/dl)/5 lub LDL-chol (mmol/l) = TC (mmol/l) - HDL-chol (mmo/l) - TG (mmol/l) 2,2.
W celu zmiany wartości cholesterolu wyrażonej w mg/dl na mmol/l należy zastosować dzielnik
38,7. Dla uzyskania wyniku TG w mmol/l stosuje się dzielnik 88,5. Formuła Friedewalda nie ma
zastosowania, jeżeli stężenie TG przekracza 400 mg/dl (4,5 mmol/l).
Objaśnienia użytych skrótów: TC - cholesterol całkowity, TG - trójglicerydy, chol - cholesterol,
RRS - ciśnienie tętnicze skurczowe, RRR - ciśnienie tętnicze
Poniżej omówione zostaną poszczególne czynniki ryzyka.

4.2.1.1. Palenie tytoniu
Zarówno liczba wypalanych papierosów, jak i czas trwania tego nałogu są uznanymi czynnikami
ryzyka IHD. Dotyczy to także cygar i fajki. Palenie wywiera silny miażdżycorodny wpływ na tętnice
poprzez uszkodzenie śródbłonka tętnic, zwiększoną gotowość zakrzepową krwi i niekorzystny
wpływ na lipoproteiny osocza.
Z uszkodzeniem śródbłonka łączy się upośledzona produkcja tlenku azotu i zwiększona
penetracja lipoprotein do ściany tętnicy. Efektem zaburzonej produkcji tlenku azotu jest
zwiększenie gotowości tętnic do skurczu. Do uszkodzonego śródbłonka przylegają monocyty.
Ponadto występuje adhezja płytek krwi. Nasilona produkcja czynników wzrostu prowadzi do
proliferacji komórek mięśni gładkich.
Zwiększona gotowość zakrzepowa u palaczy papierosów jest wynikiem wzrostu stężenia
fibrynogenu, aktywacji płytek, wzrostu stężenia czynnika VII, obniżenia plazminogenu.
W zakresie lipoprotein osocza obserwuje się zmniejszenie stężenia cholesterolu HDL. Wolne
rodniki dymu papierosowego są odpowiedzialne za oksydacyjną modyfikację LDL. Z tym ostatnim
mechanizmem łączy się również zmniejszona aktywność antyoksydacyjna surowicy u palaczy.
Wiadomo, że palacze mają mniejsze zawartości witamin antyoksydacyjnych (E i C) we krwi w
porównaniu z ludźmi niepalącymi.
W ocenie ryzyka ogólnego IHD należy brać pod uwagę zarówno fakt palenia tytoniu, jak i liczbę
wypalanych papierosów.
Podkreślenia wymaga, że nie tylko czynne, ale także bierne palenie papierosów zwiększa
zagrożenie IHD.
4.2.1.2. Zwiększone stężenie cholesterolu LDL
Zwiększone stężenie cholesterolu LDL od dawna zalicza się do najważniejszych czynników
ryzyka IHD, bowiem z tej frakcji ogólnego cholesterolu surowicy tworzą się ogniska
ateromatyczne. LDL po przeniknięciu do ściany tętnicy, oksydacyjnej modyfikacji przez wolne
rodniki i przyswojeniu przez makrofagi stają się najważniejszym składnikiem ogniska
miażdżycowego. Intensywność przenikania LDL do ściany tętnicy zależy głównie od ich stężenia
w surowicy, przepuszczalności śródbłonka tętniczego i ciśnienia krwi. Stąd przy małych
stężeniach cholesterolu LDL, zdrowym śródbłonku i prawidłowym ciśnieniu tętniczym, miażdżyca
rozwija się wolno lub nie rozwija się wcale, nie dając objawów klinicznych. Bardzo liczne badania
dowiodły, że obniżanie stężenia cholesterolu LDL w surowicy zmniejsza istotnie ryzyko epizodu
wieńcowego (tabela V).
Podkreślenia wymaga, że ryzyko IHD wzrasta semilogarytmicznie wraz ze wzrostem stężenia
cholesterolu LDL, poczynając od zdecydowanie niskich wartości. Nie udało się dotychczas
określić jednoznacznie wartości progowej poniżej której ryzyko byłoby niezależne od cholesterolu
LDL. Jednakże rekomendacje najważniejszych towarzystw naukowych, tj. International
Atherosclerosis Society (IAS) (2), American Heart Association (AHA) (54) oraz Towarzystw
Europejskich (3), przyjmują jako dolną granicę stężenia cholesterolu całkowitego (TC), od której
szacuje się ryzyko, wartość 200 mg/dl (5,2 mmol/l). Odpowiada to w przybliżeniu zawartości
cholesterolu LDL w surowicy 130 mg/dl (3,4 mmol/l). IAS oraz Towarzystwa Europejskie za
czynnik zwiększonego ryzyka przyjmują stężenie TC w szerokich granicach od 200 do 300 mg/dl
(5,2-7,8 mmol/l), co w przybliżeniu odpowiada stężeniu cholesterolu LDL od 130 do 210 mg/dl
(3,4-5,4 mmol/l). Powyżej tych wartości ryzyko IHD jest duże. Natomiast AHA stężenia TC w
granicach 200-239 mg/dl (5,2-6,2 mmol/l) lub LDL-chol 130-159 mg/dl (3,4-4,1 mmol/l) uznaje za
związane z łagodnie zwiększonym ryzykiem, natomiast stężenia TC w granicach 240-279 mg/dl
(6,2-7,2 mmol/l), co odpowiada LDL-chol od 160 mg/dl (4,1 mmol/l) do około 200 mg/dl (5,2
mmol/l), za związane z umiarkowanie zwiększonym ryzykiem, a wartości TC równe i powyżej 280
mg/dl (7,2 mmol/l) za związane z dużym ryzykiem.
Biorąc pod uwagę powyższe, przyjęto w tym opracowaniu (tabela VIII):
- stężenia cholesterolu LDL w granicach 130-159 mg/dl (TC w przybliżeniu 200-239 mg/dl), za
łagodny czynnik ryzyka,
- stężenia cholesterolu LDL w granicach 160-210 mg/dl (TC w przybliżeniu 240-300 mg/dl), za
umiarkowany czynnik ryzyka,
- stężenia cholesterolu LDL powyżej 210 mg/dl (TC w przybliżeniu 300 mg/dl), za silny czynnik
ryzyka.

4.2.1.3. Niskie stężenia cholesterolu HDL
W ocenie ryzyka IHD trzeba także wziąć pod uwagę stężenie cholesterolu HDL. Mężczyźni ze
stężeniem cholesterolu HDL równym i poniżej 35 mg/dl (0,9 mmol/l) i kobiety równym i poniżej 40
mg/dl (1,0 mmol/l) mają zwiększone zagrożenie tą chorobą (2).
Lipoproteiny HDL mają właściwości przeciwmiażdżycowe. Wśród kilku mechanizmów takiego
działania najważniejsze to transport zwrotny cholesterolu (z makrofagów w ścianie tętnicy) do
wątroby oraz właściwości przeciwutleniające, dzięki enzymowi - paraoksonazie, związanej z
apolipoproteiną AI.
4.2.1.4. Podwyższone ciśnienie tętnicze
Nadciśnienie tętnicze należy do najważniejszych czynników ryzyka IHD. Nadciśnienie zwiększa
ryzyko zgonu wieńcowego, nagłego zgonu oraz zawału serca bez zgonu u obu płci. Zależność
ryzyka głównych epizodów wieńcowych od ciśnienia tętniczego jest ciągła, tzn. obserwuje się ją
zarówno w zakresie wartości prawidłowych, jak i uznawanych za nadciśnienie. Nie ma wartości
progowej dla ciśnienia tętniczego, podobnie jak dla stężenia cholesterolu, od której zaczyna się
wzrost ryzyka.
Związek nadciśnienia tętniczego z IHD zależy zarówno od jego wpływu na sam rozwój miażdżycy,
jak też od działania na blaszkę miażdżycową. Nadciśnienie może być bowiem czynnikiem
wyzwalającym pęknięcie blaszki, a tym samym epizod wieńcowy.
Do głównych mechanizmów aterogennego działania nadciśnienia tętniczego można zaliczyć
uszkodzenie ściany tętnicy i nasiloną penetrację lipoprotein. Wysokie ciśnienie powoduje
bezpośrednio uraz mechaniczny tętnicy, jak też uszkadza ją za pośrednictwem chemicznych
mediatorów (angiotensyna II, endotelina-1). Szczególną rolę przypisuje się angiotensynie II, która
jest stymulatorem syntezy różnych czynników wzrostu (proliferacja komórek mięśni gładkich, a co
za tym idzie hipertrofia ściany naczyniowej) oraz białek adhezyjnych (adhezja leukocytów do
powierzchni tętnicy). Angiotensyna II stymuluje produkcję anionu ponadtlenowego, który
degraduje tlenek azotu oraz jest promotorem degradacji bradykininy, która stymuluje uwalnianie
tlenku azotu. Poza tymi efektami angiotensyna II stymuluje, wraz z innymi czynnikami, produkcję
endoteliny-1 (silny czynnik skurczowy i stymulator proliferacji komórek mięśni gładkich (SMC)). Na
podstawie tych odkryć angiotensynie II przypisuje się silne właściwości aterogenne.
Uszkodzenie ściany tętnicy oraz nasilona filtracja osocza, w wyniku nadciśnienia, ułatwia
penetrację aterogennych lipoprotein do błony wewnętrznej. U części pacjentów dodatkowo na
aterogenezę mają wpływ zaburzenia metaboliczne, takie jak aterogenna dyslipidemia (małe, gęste
LDL, obniżone stężenie HDL) i/lub nieprawidłowa tolerancja glukozy. Dotyczy to nadciśnienia
przebiegającego z hiperinsulinemią (55). Nadciśnienie jest wtedy elementem zespołu
metabolicznego, do którego niektórzy włączają także otyłość brzuszną.
Podkreślenia wymaga, że współistniejące z nadciśnieniem inne czynniki ryzyka działają
synergistycznie, nasilając rozwój miażdżycy i jej powikłań. Jak wynika z 12-letniej obserwacji Pol-
Monica Warszawa ryzyko zgonu spowodowanego IHD u mężczyzn i u kobiet z odosobnionym
nadciśnieniem tętniczym jest odpowiednio 5-krotnie i 8-krotnie większe w porównaniu z ludźmi
bez nadciśnienia. Natomiast u mężczyzn i kobiet z nadciśnieniem tętniczym i współistniejącymi
sześcioma innymi czynnikami ryzyka (TC/HDL-chol powyżej 5,0; stężenie TG powyżej 200 mg/dl;
palenie papierosów; BMI powyżej 30,0; obecność choroby sercowo-naczyniowej; dodatni wywiad
rodzinny dotyczący chorób układu krążenia) zagrożenie zgonem na IHD jest odpowiednio 67-
krotnie i 73-krotnie większe, w porównaniu z osobami bez nadciśnienia i bez innych czynników
ryzyka.
W tabeli IX przedstawiono definicje i klasyfikację nadciśnienia według zaleceń WHO/IHS (56), a w
tabeli X częstość występowania poszczególnych kategorii ciśnienia tętniczego w populacji
mężczyzn i kobiet Warszawy w wieku 35-64 lat (Pol-Monica).
Zwraca uwagę fakt, że w badanej populacji dominowało nadciśnienie łagodne, w leczeniu którego
największe zastosowanie ma modyfikacja stylu życia.
Tabela IX. Definicja i klasyfikacja ciśnienia tętniczego
Kategoria
Skurczowe
(mmHg)
Rozkurczowe
(mmHg)
Optymalne
<120
<80
Normalne
<130
<85
Wysokie normalne
130-139
85-89
Nadciśnienie 1 stopnia (łagodne)
Podgrupa: graniczne
140-159
140-149
90-99
90-94
Nadciśnienie 2 stopnia (umiarkowane)
160-179
100-109
Nadciśnienie 3 stopnia (ciężkie)
>=180
>=110
Izolowane nadciśnienie skurczowe
Podgrupa: graniczne
>=140
140-149
<90
<90
1999 Word Health Organization - International Society of Hypertension Guidelines for the
Management of Hypertension.
J. Hypertension, 1999, 17, 905-918
Tabela X. Częstość występowania (%) poszczególnych kategorii ciśnienia tętniczego, w
populacji Warszawy w wieku 35-64 lat*
Mężczyźni
Kobiety
Kategorie ciśnienia
1984 r.
1993 r.
1984 r.
1993 r.
Ciśnienie prawidłowe**
(RRS <130 i RRR <90)
20,1
40,0
29,4
51,6
W tym: ciśnienie optymalne
(RRS <120 i RRR <90)
7,5
22,4
12,5
34,3
Ciśnienie prawidłowe wysokie**
(RRS: 130-139 i RRR: 85-89)
18,3
16,1
17,6
15,4
Nadciśnienie łagodne (I stopień)
(RRS: 140-159 i/lub RRR: 90-99)
21,2
16,0
18,8
11,6
W tym graniczne:
(RRS: 140-149 i/lub RRR: 90-94)
16,0
13,5
9,7
10,2
Nadciśnienie umiarkowane (II stopień)
(RRS: 160-179 i RRR: 100-109)
16,5
12,8
12,4
8,8
Nadciśnienie ciężkie (III stopień)
(RRS >=180 i RRR >=110)
10,1
6,7
9,3
3,4
Izolowane nadciśnienie skurczowe
(RRS <140 i RRR <90)
13,8
8,4
11,8
9,2
W tym graniczne
(RRS: 140-149 i RRR <90)
7,8
3,9
10,2
5,9
* kategorie ciśnienia wg zaleceń WHO/ISH (56) oraz Polskiego Towarzystwa Nadciśnienia
Tętniczego (57);
** do kategorii tych zaliczono 0,3% i 1,8% zbadanych mężczyzn w roku 1984 i 1993 oraz 1,1% i
3,2% kobiet z nadciśnieniem prawidłowo kontrolowanym.
Objaśnienie użytych skrótów: RRS - ciśnienie tętnicze skurczowe,
RRR - ciśnienie tętnicze rozkurczowe
4.2.1.5. Hiperglikemia i cukrzyca
Cukrzyca jest dobrze znanym czynnikiem ryzyka miażdżycy. U chorujących na cukrzycę typu 2
obserwuje się 2-4-krotnie zwiększone występowanie chorób naczyniowych na tle miażdżycy.
Na uwagę zasługują niedawno opublikowane wyniki badania fińskiego, w którym w okresie 7 lat
obserwowano występowanie zawału serca u chorych na cukrzycę typu 2 oraz u ludzi bez tej
choroby, którzy przebyli uprzednio zawał serca lub na niego nie chorowali. Okazało się, że ryzyko
wystąpienia zawału serca u chorych na cukrzycę bez zawału w wywiadzie, było podobne do
ryzyka osób, które nie miały cukrzycy natomiast chorowały uprzednio na zawał (22,2% vs 18,8%)
(59).
Mechanizmy, w wyniku których cukrzyca ułatwia rozwój tej choroby w tętnicach wieńcowych, nie
są w pełni poznane. Do dyskutowanych mechanizmów należą: nasilenie oksydacyjnej modyfikacji

LDL i glikacja tych lipoprotein, glikacja białek ściany tętnicy, uszkodzenie śródbłonka i zwiększenie
gotowości zakrzepowej krwi.
Poza tym w cukrzycy typu 2 do wzrostu ryzyka IHD przyczynia się współistniejąca u części
pacjentów dyslipidemia (która charakteryzuje się hipertrójglicerydemią i małymi stężeniami
cholesterolu HDL) oraz nadciśnienie tętnicze. Stężenia cholesterolu LDL albo mieszczą się w
prawidłowych granicach, albo są łagodnie zwiększone. Należy podkreślić, że w tym typie cukrzycy
występuje akumulacja w osoczu aterogennych lipoprotein, takich jak małe, gęste LDL,
szczególnie podatne na oksydacyjną modyfikację i glikację, oraz remnanty chylomikronów.
Zgodnie z kryteriami Światowej Organizacji Zdrowia (ŚOZ) cukrzycę rozpoznaje się na podstawie
następujących cech (58):
1. stężenie glukozy w osoczu krwi żylnej na czczo >=126 mg/dl (7,0 mmol/l), co odpowiada
wartości >=110 mg/dl (6,1 mmol/l) we krwi włośniczkowej
lub
2. stężenie glukozy w osoczu krwi żylnej lub w krwi włośniczkowej po doustnym obciążeniu 75 g
glukozy równe lub większe niż 200 mg/dl (11,1 mmol/l).
Za upośledzoną tolerancję glukozy SOZ przyjmuje stężenie glukozy w osoczu krwi żylnej na
czczo mniejsze niż 126 mg/dl (we krwi włośniczkowej mniejsze niż 110 mg/dl) lecz po obciążeniu
doustnym 75 g glukozy przekraczające 140 mg/dl (7,8 mmol/l) zarówno w osoczu krwi żylnej, jak i
włośniczkowej.
Dla potwierdzenia diagnozy cukrzycy należy powtórnie oznaczyć stężenie glukozy na czczo i/lub
po doustnym obciążeniu glukozą.
American Diabetes Association (60) oraz International Diabetes Federation (European Diabetes
Policy Group 1998-1999) (61) wcześniej niż ŚOZ przyjęły wartość glikemii w osoczu krwi żylnej na
czczo >=126 mg/dl (7,0 mmol/l) jako podstawę rozpoznania cukrzycy. Wynik należy potwierdzić w
powtórnym badaniu. Jak już napisano poprzednio odpowiada to wartości glikemii >=110 mg/dl
(6,1 mmol/l) w krwi włośniczkowej.
4.2.1.6. Wiek, płeć, menopauza
Metaboliczne czynniki ryzyka IHD nasilają się z wiekiem. Także ryzyko występowania IHD
wzrasta z wiekiem. U mężczyzn szybki wzrost ryzyka widoczny jest do około 60 roku życia. W
późniejszym wieku zagrożenie tą chorobą także się zwiększa, ale w stopniu wolniejszym. Ta
zależność ma swoje implikacje terapeutyczne, gdyż większej korzyści ze zwalczania czynników
ryzyka mogą spodziewać się ludzie przed 60. rokiem życia niż ludzie starzy. W tym opracowaniu
przyjęto, wzorem ekspertów amerykańskich, wiek równy lub powyżej 45 lat dla mężczyzn oraz
równy i powyżej 55 lat dla kobiet jako umiarkowany czynnik ryzyka.
Zagrożenie IHD kobiet przed menopauzą jest małe i w praktyce dotyczy osób o wysokim stopniu
podatności genetycznej. Po menopauzie różnica zgonów na IHD pomiędzy kobietami i
mężczyznami ulega stopniowo wyrównaniu.
4.2.1.7. Obecność chorób na tle miażdżycy
Obecność IHD u pacjenta należy do bardzo silnych czynników prognostycznych wystąpienia
ostrego epizodu wieńcowego w postaci zawału serca ze zgonem lub bez zgonu i nagłej śmierci
sercowej.
Wykazano, że duży związek z przyszłym epizodem ma przebyty zawał serca, dusznica bolesna,
cechy niedokrwienia w EKG spoczynkowym, dodatni test wysiłkowy, zmiany miażdżycowe w
obrazie angiograficznym tętnic wieńcowych.
Ryzyko wystąpienia nowych epizodów wieńcowych (niestabilnej choroby wieńcowej lub ostrego
zawału serca) w ciągu 10 lat jest kilkakrotnie większe u chorych z uprzednio występującymi
klinicznymi znamionami IHD niż u ludzi bez takich dowodów tej choroby (2).
Duże zagrożenie IHD stwarza także obecność miażdżycy tętnic obwodowych, przebyty udar
mózgu i napadowe przemijające niedokrwienie mózgu.
4.2.1.8. Obciążenie rodzinne chorobami na tle miażdżycy
Przedwczesne występowanie IHD i innych chorób naczyniowych na tle miażdżycy u krewnych

pierwszego stopnia, tj. u mężczyzn przed 55 rokiem życia i u kobiet przed 65 rokiem życia, uznaje
się za niezależny czynnik ryzyka (3). Nie wiadomo jednak w jakim stopniu obciążenie rodzinne
chorobami powstającymi na tle miażdżycy wpływa na ryzyko IHD niezależnie od odziedziczonego
wpływu innych podstawowych czynników ryzyka, takich jak np. zaburzenia przemiany lipidów,
nadciśnienie tętnicze i inne.
4.2.2. Zagrożenie IHD wynikające z obecności innych czynników ryzyka
Oprócz czynników zagrożenia ujętych w tabeli VIII, na podstawie których przyjęto w tym
opracowaniu oszacowanie ryzyka ogólnego IHD, w tabeli I wymienione są także inne ważne
czynniki związane z zagrożeniem tą chorobą, których nie uwzględniono w tabeli VIII. Należą do
nich dieta obfitująca w tłuszcze nasycone, cholesterol i kalorie, nadmierne spożycie alkoholu,
mała aktywność fizyczna, podwyższone stężenie trójglicerydów we krwi, otyłość, czynniki
trombogenne i homocysteina. Poniżej omówiono ich znaczenie dla rozwoju IHD.
4.2.2.1. Sposób żywienia i spożycie alkoholu
Ludzie cechujący się wysokim spożyciem tłuszczów zwierzęcych, produktów o dużej zawartości
cholesterolu oraz niskim spożyciem warzyw i owoców mają również większe ryzyko IHD niż
ż
ywiący się prawidłowo. Zależy to głównie od niekorzystnego wpływu nasyconych kwasów
tłuszczowych na stężenie cholesterolu w surowicy i na krzepnięcie krwi, oraz od ochronnego
działania wysokiego spożycia witamin antyoksydacyjnych i flawonoidów zawartych w warzywach i
owocach. Ludzie żywiący się nieracjonalnie mają większe ryzyko IHD niż żywiący się prawidłowo,
nawet przy takim samym stężeniu cholesterolu całkowitego i ciśnieniu tętniczym.
Z powyższego wynika, że wadliwe żywienie zwiększa zagrożenie IHD poprzez wpływ na różne
czynniki ryzyka tej choroby, z których stężenie cholesterolu we krwi jest czynnikiem wymiernym i
najlepiej udokumentowanym. Z tego powodu żywienie nie zostało wykorzystane w tabeli VIII dla
oceny ryzyka ogólnego IHD.
Duże spożycie wysokoprocentowego alkoholu (powyżej 70-80 g dziennie) zwiększa znacznie
zagrożenie nagłym zgonem. Istnieją badania sugerujące, że spożywanie małych ilości zmniejsza
zagrożenie IHD.
Dokładne mechanizmy wpływu alkoholu na rozwój miażdżycy są ciągle przedmiotem dyskusji.
Istnieją dowody wskazujące, że "kardioprotekcyjny" efekt alkoholu zależy od bezpośredniego
wpływu na wzrost stężenia cholesterolu HDL, na zmniejszenie agregacji płytek i/lub krzepnięcia
bądź na nasilenie fibrynolizy. Z drugiej strony inni badacze wyrażają opinię, że korzystny wpływ
na ryzyko IHD mają głównie inne składniki napojów alkoholowych niż sam alkohol. Składnikami
tymi są substancje polifenolowe, które mogą działać jako antyoksydanty lub inhibitory płytek.
Mniejsza umieralność na IHD w zależności od spożycia alkoholu wydaje się być szczególnie
wyraźnie związana ze spożywaniem czerwonego wina. Czerwone wino, jak wiadomo, zawiera
duże ilości polifenoli (flawonoidy).
4.2.2.2. Mała aktywność fizyczna
Badania epidemiologiczne wykazują, że mała aktywność fizyczna jest niezależnym czynnikiem
ryzyka IHD, przede wszystkim w wyniku niekorzystnego wpływu na stężenie cholesterolu HDL
(mniejsze stężenia) oraz na krzepnięcie (większe stężenia fibrynogenu i czynnika VII). Z drugiej
strony ćwiczenia fizyczne (częstość, czas trwania i intensywność) odwrotnie korelują z
umieralnością ogólną, co stwierdzono w badaniach obserwacyjnych.
Mechanizmy poprzez które ten pozytywny efekt ćwiczeń fizycznych jest osiągany nie są
całkowicie wyjaśnione. Zarówno w badaniach epidemiologicznych, jak i klinicznych obserwuje się
korzystny wpływ na lipidy osocza (wzrost cholesterolu HDL, redukcja zawartości w osoczu małych
gęstych LDL), obniżenie ciśnienia krwi (szczególnie u ludzi z granicznym nadciśnieniem),
poprawę tolerancji glukozy, wzrost wrażliwości tkanek na insulinę. Aktywność fizyczna ma także
istotne znaczenie dla utrzymania należnej masy ciała.
Z powyższego wynika, że mała aktywność fizyczna zwiększa ryzyko IHD głównie poprzez wpływ
na inne czynniki zagrożenia, z których najważniejsze zostały włączone do tabeli VIII.

4.2.2.3. Podwyższone stężenie trójglicerydów
Podwyższone stężenie trójglicerydów (TG) we krwi jest również uznawane za czynnik ryzyka IHD
i wymaga leczenia. Wynika to z faktu współwystępowania ze zwiększonym poziomem TG
czynników, które bezpośrednio są związane z zagrożeniem miażdżycą. Należą do nich:
dominacja w osoczu nieprawidłowych cząsteczek LDL (małe, gęste LDL), obniżone stężenie HDL,
nasilona lipemia poposiłkowa, czemu towarzyszy retencja w osoczu częściowo
skatabolizowanych lipoprotein poposiłkowych - tzw. "remnantów" chylomikronów, oraz
zwiększone stężenie fibrynogenu, czynnika VII i inhibitora aktywatora plazminogenu (PAI-1).
Oznacza to nasilone ryzyko zakrzepu.
Należy dodać, że małe, gęste LDL są bardziej aterogenne niż normalne cząsteczki LDL, łatwiej
bowiem przenikają do ściany tętnicy i są bardziej podatne na oksydacyjną modyfikację. Również
wspomniane wyżej remnanty chylomikronów są miażdżycorodne, wykazując pod tym względem
właściwości podobne do LDL.
Podwyższone stężenie TG na czczo najczęściej jest wynikiem wzmożonej syntezy i/lub retencji
VLDL w osoczu. Wielkość tych cząsteczek jest bardzo zróżnicowana. Bardziej aterogenne są
małe VLDL, wykazujące większą skłonność do przenikania do ściany tętnicy. Te cząsteczki
dominują przy stężeniach TG w granicach 150-400 mg/dl (1,7-4,5 mmol/l) i szczególnie te
stężenia uważa się za zwiększające ryzyko IHD (2). Przy stężeniach wyższych dominują większe
cząsteczki VLDL i/lub chylomikrony.
Hipertrójglicerydemia może być także, jednak znacznie rzadziej, wywołana zespołem
chylomikronemii. Wtedy najczęściej obok obecności chylomikronów w osoczu na czczo (co jest
zjawiskiem nieprawidłowym) zwiększone jest również stężenie VLDL.
Stężenie TG w zespole chylomikronemii jest bardzo duże (zwykle powyżej 1000 mg/dl; 11
mmol/l). Duże może być także stężenie cholesterolu całkowitego. Zespół chylomikronemii
występuje albo jako pierwotne zaburzenie lipidowe, albo w następstwie źle kontrolowanej
cukrzycy insulinozależnej, czy też nadużywania alkoholu. Zespół ten stanowi duże zagrożenie
ostrym zapaleniem trzustki i dlatego powinien być intensywnie leczony.
Za prawidłowe stężenia TG przyjmuje się wartości poniżej 180 mg/dl (2,0 mmol/l), a u chorych na
cukrzycę poniżej 150 mg/dl (1,7 mmol/l).
4.2.2.4. Otyłość
Otyłości towarzyszy zwiększone zagrożenie IHD i udarem mózgu. Odpowiedzialne za to są
przede wszystkim często jej towarzyszące metaboliczne konsekwencje, takie jak zwiększone
stężenie VLDL (trójglicerydy), zmniejszone stężenie cholesterolu HDL, występowanie małych
gęstych LDL, retencja we krwi lipoprotein poposiłkowych, tj. remnantów lipoprotein bogatych w
trójglicerydy, cukrzyca i nadciśnienie tętnicze.
Należy podkreślić, że te metaboliczne zaburzenia dotyczą otyłości brzusznej (wisceralnej),
charakteryzującej się nadmiernym nagromadzeniem tkanki tłuszczowej wewnątrz jamy brzusznej,
i mogą zależeć od hiperinsulinemii i zwiększonej oporności tkanek na insulinę. Warto również
pamiętać, że w otyłości wisceralnej jest zwiększona tendencja do tworzenia się zakrzepu, na
skutek zwiększonego stężenia fibrynogenu, czynnika VII i PAI-1.
Miernikiem nadwagi i otyłości jest tzw. wskaźnik masy ciała (BMI), który oblicza się, dzieląc
aktualną masę ciała w kg przez kwadrat wzrostu w metrach. BMI w granicach 20,0-24,9 oznacza
masę ciała prawidłową, 25-29,9 nadwagę, 30-39,9 otyłość i >=40 kg/m
2
ciężką otyłość (62). W
tabeli XI podano wartości masy ciała w kg według podziału na masę prawidłową, nadwagę i
otyłość. Do oceny otyłości brzusznej służy wskaźnik talia/biodra (waist/hip ratio, WHR). Aby
obliczyć WHR należy zmierzyć obwód pacjenta na poziomie talii oraz na poziomie krętarzy.
Otyłość brzuszna występuje wówczas gdy WHR u mężczyzn przekracza 1,0 a u kobiet jest
wyższy niż 0,85.
Na obecność nadmiaru tłuszczu w jamie brzusznej, z podobną dokładnością jak WHR, wskazuje
obwód brzucha w okolicy talii. Na podstawie tego określa się czy ryzyko powikłań metabolicznych
otyłości jest zwiększone (BMI >=25 kg/m
2
, obwód w talii u mężczyzny >=94 cm, a u kobiety >=80
cm), czy duże (BMI >=30 kg/m
2
, obwód w talii u mężczyzny >=102 cm, a u kobiety >=88 cm) (2).
Tabela XI. Zakresy należnej masy ciała, nadwagi i otyłości dla mężczyzn i kobiet

Wzrost
Należna
masa ciała
Nadwaga
Otyłość
cm
kg
kg
kg
145
42-52,9
53-62,9
>=63
148
44-54,9
55-65,9
>=66
150
45-55,9
56-67,9
>=68
152
46-57,9
58-68,9
>=69
154
47-58,9
59-70,9
>=71
156
49-60,9
61-72,9
>=73
158
50-61,9
62-74,9
>=75
160
51-63,9
64-76,9
>=77
162
53-65,9
66-78,9
>=79
164
54-66,9
67-80,9
>=81
166
55-68,9
69-82,9
>=83
168
56-70,9
71-84,9
>=85
170
58-71,9
72-86,9
>=87
172
59-73,9
74-88,9
>=89
174
61-75,9
76-90,9
>=91
176
62-76,9
77-92,9
>=93
178
63-78,9
79-94,9
>=95
180
65-80,9
81-96,9
>=97
182
66-82,9
83-98,9
>=99
184
68-84,9
85-101,9
>=102
186
69-85,9
86-103,9
>=104
188
71-87,9
88-105,9
>=106
190
72-89,9
90-107,9
>=108
192
74-91,9
92-110,9
>=111
Pomiar wzrostu bez butów, pomiar masy ciała bez ubrania.
4.2.2.5. Czynniki trombogenne
Badania prospektywne wykazały, że zwiększone stężenie fibrynogenu w osoczu oraz zwiększona
aktywność czynnika VII są związane z nasilonym ryzykiem chorób sercowo-naczyniowych.
Szczególnie wyraźny związek istnieje pomiędzy zwiększonym stężeniem fibrynogenu i
zagrożeniem IHD. Wśród mechanizmów łączących fibrynogen z aterotrombozą wymienia się
wpływ na reologię krwi, nasilenie agregacji płytek (fibrynogen łączy się z receptorami
glikoproteinowymi na błonie płytkowej, co jest wstępnym warunkiem agregacji płytek in vivo),
zwiększone tworzenie trombiny oraz stymulację migracjii i proliferację komórek mięśni gładkich
ś
ciany tętnicy. Tak więc zwiększone stężenie fibrynogenu, niezależnie od przyczyny (genetyczna,
proces zapalny czy inny powód) oznacza stan prokoagulacyjny, który może wpływać na tworzenie
się zakrzepów śródściennych i wewnątrznaczyniowych po uszkodzeniu ściany tętnicy.
Stężenie fibrynogenu wykazuje dodatni związek z wiekiem, paleniem papierosów, cukrzycą,
otyłością (brzuszną), stężeniem cholesterolu LDL, stężeniem trójglicerydów (u kobiet) i
menopauzą. Ujemna (odwrotna) zależność występuje między stężeniem fibrynogenu i stężeniem
cholesterolu HDL, aktywnością fizyczną i przyjmowaniem estrogenów. Referencyjne stężenia
fibrynogenu mieszczą się w granicach 180-350 mg/dl.
Nasilona aktywność czynnika VII łączy się ze zwiększoną masą ciała, zwiększonym stężeniem
trójglicerydów i cholesterolu LDL, dużym spożyciem tłuszczu oraz z małą aktywnością fizyczną.
Obserwacje te wskazują na możliwość obniżenia zwiększonych stężeń fibrynogenu i czynnika VII
dzięki odpowiednim zmianom stylu życia.
Ryzyko zakrzepowe zależy nie tylko od stężenia czynników krzepnięcia, lecz także od aktywności

fibrynolitycznej. Ważną rolę odgrywa w tym stężenie PAI-1. Zwiększone stężenie tego inhibitora
towarzyszy hiperinsulinemii, hipertrójglicerydemii, otyłości brzusznej i cukrzycy
insulinoniezależnej.
4.2.2.5. Czynniki trombogenne
Badania prospektywne wykazały, że zwiększone stężenie fibrynogenu w osoczu oraz zwiększona
aktywność czynnika VII są związane z nasilonym ryzykiem chorób sercowo-naczyniowych.
Szczególnie wyraźny związek istnieje pomiędzy zwiększonym stężeniem fibrynogenu i
zagrożeniem IHD. Wśród mechanizmów łączących fibrynogen z aterotrombozą wymienia się
wpływ na reologię krwi, nasilenie agregacji płytek (fibrynogen łączy się z receptorami
glikoproteinowymi na błonie płytkowej, co jest wstępnym warunkiem agregacji płytek in vivo),
zwiększone tworzenie trombiny oraz stymulację migracjii i proliferację komórek mięśni gładkich
ś
ciany tętnicy. Tak więc zwiększone stężenie fibrynogenu, niezależnie od przyczyny (genetyczna,
proces zapalny czy inny powód) oznacza stan prokoagulacyjny, który może wpływać na tworzenie
się zakrzepów śródściennych i wewnątrznaczyniowych po uszkodzeniu ściany tętnicy.
Stężenie fibrynogenu wykazuje dodatni związek z wiekiem, paleniem papierosów, cukrzycą,
otyłością (brzuszną), stężeniem cholesterolu LDL, stężeniem trójglicerydów (u kobiet) i
menopauzą. Ujemna (odwrotna) zależność występuje między stężeniem fibrynogenu i stężeniem
cholesterolu HDL, aktywnością fizyczną i przyjmowaniem estrogenów. Referencyjne stężenia
fibrynogenu mieszczą się w granicach 180-350 mg/dl.
Nasilona aktywność czynnika VII łączy się ze zwiększoną masą ciała, zwiększonym stężeniem
trójglicerydów i cholesterolu LDL, dużym spożyciem tłuszczu oraz z małą aktywnością fizyczną.
Obserwacje te wskazują na możliwość obniżenia zwiększonych stężeń fibrynogenu i czynnika VII
dzięki odpowiednim zmianom stylu życia.
Ryzyko zakrzepowe zależy nie tylko od stężenia czynników krzepnięcia, lecz także od aktywności
fibrynolitycznej. Ważną rolę odgrywa w tym stężenie PAI-1. Zwiększone stężenie tego inhibitora
towarzyszy hiperinsulinemii, hipertrójglicerydemii, otyłości brzusznej i cukrzycy
insulinoniezależnej.
4.2.2.6. Zwiększone stężenie homocysteiny
Od 1962 roku, kiedy wykryto homocysteinurię, przebiegającą z ciężką miażdżycą, podejrzewano,
ż
e wysokie stężenie homocysteiny w osoczu jest czynnikiem ryzyka tej choroby. Wyniki badań
epidemiologicznych i klinicznych, szczególnie ostatniej dekady, potwierdzają związek pomiędzy
stężeniami homocysteiny a częstością występowania IHD, chorób naczyń obwodowych i/lub
mózgowych. Ten "nowy" czynnik ryzyka został ostatnio opisany w polskim piśmiennictwie (63).
Homocysteina jest aminokwasem powstającym w organizmie z metioniny, która pochodzi z białka
diety. Jako związek szkodliwy jest ona szybko metabolizowana albo w procesie metylacji z
powrotem do metioniny, albo na drodze katabolizmu do cysteiny. W obu reakcjach biorą udział
witaminy z grupy B. W pierwszej jest to kwas foliowy i kobalamina (witamina B
12
), w drugiej
fosforan pirydoksalu (witamina B
6
).
Przyczyną zwiększonego stężenia homocysteiny w osoczu, tj. hiperhomocysteinemii, mogą być
mutacje genów odpowiedzialnych za syntezę enzymów biorących udział w metabolizmie
homocysteiny (hiperhomocysteinemia rodzinna) lub niedobór wyżej wymienionych witamin
(hiperhomocysteinemia nabyta). Szczególne znaczenie przypisuje się niedoborowi kwasu
foliowego.
Rola homocysteiny w rozwoju miażdżycy jest złożona. Jednym z ważniejszych mechanizmów jest
uszkodzenie śródbłonka naczyniowego, z powodu właściwości cytotoksycznych tego
aminokwasu. Równie ważne w procesie aterogenezy i rozwoju zakrzepu są właściwości
trombogenne homocysteiny. Osoby z hiperhomocysteinemią mają zwiększoną skłonność płytek
do agregacji, obniżone stężenie antytrombiny III, a wyższe czynnika VII i białka C reaktywnego.
Trzeci mechanizm to zdolność homocysteiny do modyfikacji LDL, co powoduje ich przyswajanie
przez makrofagi. Homocysteina z powodu cytotoksycznego działania na komórki, w tym ściany
tętniczej, hamuje aktywność dysmutazy nadtlenkowej, co z kolei ma wpływ na zwiększoną
zdolność utleniania LDL przez te komórki.
Istnieją pewne rozbieżności odnośnie stężenia homocysteiny, które można uznać za
podwyższone. Eksperci Międzynarodowego Towarzystwa Miażdżycowego (2) przyjęli jako

nieprawidłowy poziom homocysteiny w surowicy na czczo powyżej 12 mmol/l, a eksperci
American Heart Association (64) powyżej 10 µmol/l.
Na obecnym etapie wiedzy nie zaleca się rutynowych pomiarów stężenia homocysteiny u
wszystkich, natomiast wskazane jest jego oznaczanie u chorych na IHD, szczególnie jeśli inne
czynniki ryzyka są nieobecne lub występują w słabym nasileniu. Z tego też powodu homocysteina
nie została włączona do tabeli VIII, na podstawie której szacuje się ogólne ryzyko IHD.
4.2.2.7. Przerost lewej komory serca
Przerost lewej komory (LVH), zgodnie z raportem American Collage of Cardiology (17), jest
niezależnym czynnikiem ryzyka IHD. Jednak nie został on uwzględniony ani w rekomendacjach
Międzynarodowego Towarzystwa Miażdżycowego (2), ani Towarzystw Europejskich (3).
Prawdopodobnie wynika to z faktu częstego współwystępowania LVH z innymi uznanymi
czynnikami ryzyka, takimi jak nadciśnienie tętnicze i otyłość.
W badaniu Framingham u ludzi w starszym wieku (59-90 lat) bez jawnej klinicznie IHD okazało
się, że masa lewej komory (ocena echokardiograficzna) pozostaje w znamiennym związku z
późniejszą zapadalnością na tę chorobę (65) po wykluczeniu innych czynników ryzyka.
Należy podkreślić, że występowanie LVH wzrasta wraz z wiekiem (66). Zależność LVH od wieku
utrzymuje się po uwzględnieniu wpływu innych czynników, takich jak nadciśnienie tętnicze,
otyłość, obecność IHD oraz wad serca.
U chorych po zawale serca LVH jest związana z niepomyślnym rokowaniem, co prowadzi do
częstszego występowania ponownych zawałów i śmiertelności (67).
Osoby z LVH powinny mieć dobrze kontrolowane ciśnienie krwi oraz, w przypadku otyłości,
zredukowaną masę ciała. Podkreślenia wymaga, że leki hipotensyjne ze wszystkich grup
zmniejszają masę lewej komory, jednak skuteczniejsze pod tym względem są inhibitory enzymu
konwertującego angiotensynę (68).
4.3. Diagnostyka i klasyfikacja hiperlipidemii
Pożądane jest oznaczanie stężenia cholesterolu całkowitego (TC) co 5 lat, począwszy od 20 roku
ż
ycia. Jeśli stężenie TC jest mniejsze niż 200 mg/dl badanie to należy powtórzyć za 5 lat.
Pełen profil lipidowy powinien być wykonany u pacjentów z chorobami sercowo-naczyniowymi,
umiarkowanym lub ciężkim nadciśnieniem tętniczym, u wszystkich ze stężeniem TC >= 230 mg/dl
(6 mmol/l) oraz w cukrzycy, u ludzi z BMI 30,0, a także u palących papierosy.
Dla rozpoznania zaburzeń lipidowych oznaczenia TG, TC i cholesterolu HDL trzeba wykonać co
najmniej dwukrotnie, najlepiej w odstępie dwóch tygodni. Zbadanie zawartości TG w surowicy
wymaga, aby pacjent był na czczo (około 14 godzin).
Co się tyczy pacjenta po zawale serca, to wyniki są wiarygodne tylko w ciągu pierwszych 24
godzin od wystąpienia objawów choroby. Później bowiem dochodzi do znacznego spadku
stężenia lipidów. Dlatego, jeśli nie wykonano badania w odpowiednim czasie, trzeba odczekać co
najmniej 4-6 tygodni. Taka sytuacja dotyczy także innych ostrych chorób (infekcje, zabiegi
operacyjne). Po krótkich ostrych infekcjach wystarczy dwutygodniowe odczekanie z oznaczeniem.
Dla rozpoznania rodzaju hiperlipidemii (z wyjątkiem zespołu chylomikronemii) należy poznać
zawartość cholesterolu LDL i stężenie TG całkowitych. Nie oznacza się zawartości TG we frakcji
VLDL, czy w chylomikronach.
Aby wyliczyć ile cholesterolu zawiera frakcja LDL trzeba znać stężenia TC, TG i cholesterolu HDL.
Do obliczenia stężenia LDL-chol służy wzór Friedewalda:
LDL-chol (mg/dl) = TC (mg/dl) - HDL-chol (mg/dl) - TG (mg/dl)/5
lub
LDL-chol (mmol/l) = TC (mmol/l) - HDL-chol (mmol/l) - TG (mmol/l)/2,2
Ostatnia wartość w równaniu odejmowana od stężenia TC, tj. TG (mmol/dl)/5 lub TG (mmol/l)/2,2,
określa w przybliżeniu zawartość cholesterolu VLDL.
W celu uzyskania wyniku stężenia cholesterolu w mg/dl trzeba jego wartość w mmol/l pomnożyć
przez 38,7. Dla uzyskania wyniku TG w mg/dl należy zastosować mnożnik 88,5.
Wzór Friedewalda nie nadaje się do wyliczenia zawartości cholesterolu LDL u pacjentów ze
stężeniem TG powyżej 400 mg/dl (4,5 mmol/l), gdyż wówczas stosunek zawartości TG do

cholesterolu we frakcji VLDL jest zmieniony i nie można określić ile cholesterolu znajduje się w
VLDL.
Dla rozpoznania zespołu chylomikronemii należy wykonać tzw. test zimnej flotacji.
Wykonanie pełnego lipidogramu daje możliwość rozpoznania rodzaju hiperlipidemii, co jest
wysoce przydatne przy wyborze metody leczenia. Klasyfikację hiperlipidemii podajemy w tabeli
XII. Podział ten jest zgodny z zasadami klasyfikacji przyjętymi w raportach międzynarodowych (2,
3).
Jak widać z tabeli XII podwyższone stężenie TC może występować w hipercholesterolemii,
hiperlipidemii mieszanej i hipertrójglicerydemii, włącznie z zespołem chylomikronemii. W
hipercholesterolemii jest to zależne od zwiększonej ilości cholesterolu LDL, w hiperlipidemii
mieszanej od cholesterolu LDL i cholesterolu VLDL lub cholesterolu IDL (remnanty), w
hipertrójglicerydemii od cholesterolu VLDL, a w należącym także do niej zespole chylomikronemii
od cholesterolu chylomikronów i cholesterolu VLDL.
Tabela XII. Klasyfikacja hiperlipidemii
Hipercholesterolemia Hiperlipidemia
mieszana
Hipertrójglicerydemia
Zespół
chylomikronemii
LDL-chol
>=130 mg/dl
>=130 mg/dl
w normie
w normie
Trójglicerydy
w normie
>=180 mg/dl
>=180 mg/dl
zazwyczaj >1000
mg/dl
Cholesterol
całkowity
>=200 mg/dl
>=200 mg/dl
prawidłowy
lub podwyższony
na ogół wysoki
Chylomikrony
-
-
-
+
Uwaga: - Hiperlipidemia mieszana może rzadko zależeć od tzw. dysbetalipoproteinemii (choroba
remnantów);
- W zespole chylomikronemii stwierdza się wysokie stężenia trójglicerydów i cholesterolu
całkowitego oraz dodatni test zimnej flotacji;
- W celu przeliczenia stężenia cholesterolu na mmol/l należy podzielić wartość podaną w tabeli
przez 38,7, trójglicerydy przelicza się dzieląc przez 88,5.
Objaśnienia użytych skrótów: chol - cholesterol
Podwyższone stężenie TG we krwi występuje w hiperlipidemii mieszanej (trójglicerydy VLDL),
hipertrójglicerydemii (trójglicerydy VLDL) i zespole chylomikronemii (trójglicerydy chylomikronów i
trójglicerydy VLDL).
Hiperlipidemia pierwotna dotyczy znacznej większości przypadków hiperlipidemii, a wtórna tylko
niewielkiej części, pomimo to nie można bagatelizować potrzeby wykluczenia hiperlipidemii
wtórnej. Do najczęstszych jej przyczyn należy otyłość (brzuszna), alkoholizm, cukrzyca,
niedoczynność tarczycy, choroby nerek i wątroby, bulimia i jadłowstręt psychiczny. Hiperlipidemia
wtórna może być także wywołana przyjmowaniem niektórych leków, takich jak diuretyki tiazydowe
i pętlowe, doustne środki antykoncepcyjne, hormony sterydowe, retinoidy.
Przed rozpoczęciem leczenia hiperlipidemii konieczne jest wykluczenie powyższych przyczyn na
podstawie badania klinicznego i testów laboratoryjnych. W przypadkach hiperlipidemii wtórnej
zasadnicze znaczenie ma leczenie choroby podstawowej. Należy podkreślić, że obie najczęstsze
przyczyny zaburzeń lipidowych, jakimi są otyłość i cukrzyca, zostały zaliczone do czynników
ryzyka miażdżycy, co dodatkowo zwiększa znaczenie ich kontroli w profilaktyce tej choroby.
4.4. Diagnostyka i klasyfikacja nadciśnienia tętniczego
Za nadciśnienie tętnicze przyjmuje się wartości ciśnienia skurczowego równe i większe niż 140
mmHg i/lub ciśnienia rozkurczowego równe i większe niż 90 mmHg u osób nie przyjmujących
leków hipotensyjnych. Klasyfikacja nadciśnienia według stopnia nasilenia została podana w tabeli
IX.
Zgodnie z zaleceniami WHO/ISH (56) rozpoznanie nadciśnienia tętniczego powinno być
postawione na podstawie kilku pomiarów dokonanych przy różnych okazjach. Pomiarów ciśnienia
tętniczego należy dokonywać w pozycji siedzącej, przestrzegając następujących zasad: - pacjent
powinien odpoczywać kilka minut w cichym pomieszczeniu przed rozpoczęciem pomiaru,
- trzeba używać standardowych mankietów z komorami powietrznymi o rozmiarach 12-13 cm na

35 cm, lub większymi w przypadku osób otyłych, a mniejszymi u dzieci,
- dla określenia ciśnienia rozkurczowego należy używać V fazy Korotkowa (znikanie tonu),
- w trakcie pierwszej wizyty powinno się dokonywać pomiarów na obu ramionach,
- u osób starszych, pacjentów z cukrzycą i we wszystkich stanach, w których dochodzi często do
ortostatycznych spadków ciśnienia trzeba ciśnienie mierzyć także w pozycji stojącej,
- mankiet aparatu do mierzenia ciśnienia zawsze powinien być umieszczony na poziomie serca,
niezależnie od pozycji w jakiej znajduje się pacjent.
Pełna diagnostyka nadciśnienia tętniczego, uwzględniająca rokowanie w tej chorobie wymaga
ponadto:
- określenia przyczyn (nadciśnienie pierwotne czy wtórne),
- wykrycia czynników ryzyka IHD i innych chorób sercowo-naczyniowych,
- wykrycia uszkodzenia narządów docelowych,
- wykrycia chorób współistniejących.
Pomocna w realizacji tych zadań jest tabela XIII, w której podano podział czynników wpływających
na rokowanie w nadciśnieniu tętniczym. Należy podkreślić, że w tabeli tej zawarte są prawie
wszystkie czynniki ryzyka IHD, wyszczególnione w tabeli I. Oprócz nich umieszczono także
czynniki ryzyka i stany patologiczne wiążące się w sposób szczególny z nadciśnieniem tętniczym.
Tabela XIII. Czynniki wpływające na rokowanie w nadciśnieniu tętniczym (56)
Czynniki ryzyka chorób
sercowo-naczyniowych
Uszkodzenie
narządów docelowych
Choroby
współistniejące
I. Stosowane w klasyfikacji
ryzyka
• Wartość skurczowego i
rozkurczowego ciśnienia
tętniczego (stopień 1-3)
• Mężczyźni >55 r.ż.
• Kobiety >65 r.ż.
• Palenie papierosów
• Cholesterol całkowity >6,5
mmol/l (250 mg/dl)
• Cukrzyca
• Dodatni wywiad rodzinny w
kierunku wczesnego
występowania chorób sercowo-
naczyniowych
II. Inne czynniki wpływające
niekorzystnie na rokowanie
• Obniżony poziom cholesterolu
HDL
• Podwyższony poziom
cholesterolu LDL
• Mikroalbuminuria stwierdzana
u chorych na cukrzycę
• Upośledzona tolerancja
glukozy
• Otyłość
• Siedzący tryb życia
• Podwyższone wartości
fibrynogenu
• Pochodzenie z grupy
wysokiego ryzyka socjo-
ekonomicznego
• Pochodzenie z grupy etnicznej
o wysokim ryzyku
• Pochodzenie z rejonów o
wysokim ryzyku
• Przerost lewej komory
(elektrokardiograficzny lub
echokardiograficzny)
• Białkomocz lub niewielkiego
stopnia podwyższenie poziomu
kreatyniny (1,2-2,0 mg/dl)
• Ultrasonograficzne lub
radiologiczne cechy zmian
miażdżycowych (t. szyjne, t.
biodrowe, t. udowe, aorta)
• Uogólnione lub miejscowe
zwężenie tętnic siatkówki
• Choroby
naczyniopochodne
mózgu
• Udar niedokrwienny
• Krwawienie
ś
ródczaszkowe
• Przemijające ataki
niedokrwienne (TIA)
Choroby serca
• Zawał mięśnia
sercowego
• Dusznica bolesna
• Rewaskularyzacja
naczyń wieńcowych
• Zastoinowa
niewydolność serca
Choroby nerek
• Nefropatia cukrzycowa
• Niewydolność nerek
(poziom kreatyniny w
osoczu >=2 mg/dl)
Choroby naczyń
• Tętniak rozwarstwiający
• Objawowe choroby
naczyń tętniczych
Zaawansowana
retinopatia
nadciśnieniowa
• Krwotoki lub wysięki
• Obrzęk tarczy nerwu
wzrokowego
• Przerost lewej komory
(elektrokardiograficzny lub
echokardiograficzny)
Na podstawie tabeli XIV można sklasyfikować ogólne ryzyko chorób sercowo-naczyniowych u
pacjenta z nadciśnieniem. Ryzyko to dotyczy nie tylko IHD, lecz także udaru mózgu,
niewydolności serca i chorób nerek. Ocena ogólnego ryzyka w oparciu o dane zawarte w tabeli
XIV jest ważna dla wyboru sposobu leczenia nadciśnienia.
Tabela XIII. Czynniki wpływające na rokowanie w nadciśnieniu tętniczym (56)
Ciśnienie tętnicze (mmHg)
Inne czynniki ryzyka
i wywiad chorobowy
Stopień 1
(łagodne
nadciśnienie
tętnicze)
RRS 140-159 mmHg
lub
RRR 90-99 mmHg
Stopień 2
(umiarkowane
nadciśnienie
tętnicze)
RRS 160-179 mmHg
lub
RRR 100-109 mmHg
Stopień 3
(ciężkie nadciśnienie
tętnicze)
RRS >=180 mmHg
lub
RRR >110 mmHg
I. Brak innych czynników
ryzyka
Niskie ryzyko
Umiarkowane ryzyko
Wysokie ryzyko
II. 1-2 czynniki ryzyka
Umiarkowane ryzyko Umiarkowane ryzyko
Bardzo wysokie
ryzyko

III. 3 lub więcej
czynniki ryzyka
lub uszkodzenie
narządów docelowych
lub cukrzyca
Wysokie ryzyko
Wysokie ryzyko
Bardzo wysokie
ryzyko
IV. Choroby współistniejące
Bardzo wysokie
ryzyko
Bardzo wysokie
ryzyko
Bardzo wysokie
ryzyko
Objaśnienia użytych skrótów: RRS - ciśnienie tętnicze skurczowe, RRR - ciśnienie tętnicze
rozkurczowe
Grupa niskiego ryzyka chorób sercowo-naczyniowych obejmuje głównie mężczyzn powyżej 55.
roku życia i kobiety poniżej 65. roku życia z nadciśnieniem tętniczym 1 stopnia bez innych
czynników ryzyka. Wśród tej kategorii ryzyko wystąpienia głównych incydentów sercowo-
naczyniowych w ciągu następnych 10 lat jest zazwyczaj niższe niż 15%.
Grupa osób z ryzykiem umiarkowanym obejmuje chorych przede wszystkim z nadciśnieniem 2
stopnia i z współistniejącymi czynnikami ryzyka. W tej grupie osób ryzyko wystąpienia głównych
incydentów sercowo-naczyniowych w czasie 10-letniej obserwacji wynosi zazwyczaj 15-20%, przy
czym ryzyko to będzie zbliżone do 15% w grupie pacjentów z nadciśnieniem 1 stopnia i tylko z
jednym czynnikiem ryzyka. Będzie ono natomiast wyższe przy nadciśnieniu 2 stopnia lub przy
dwu współistniejących czynnikach ryzyka.
Do grupy wysokiego ryzyka należą pacjenci z nadciśnieniem łagodnym lub umiarkowanym, u
których stwierdza się współistnienie trzech lub więcej czynników ryzyka, cukrzycę, lub
uszkodzenie narządów nadciśnieniowo-pochodne oraz pacjenci z nadciśnieniem 3 stopnia bez
innych czynników ryzyka. U tych pacjentów ryzyko głównych powikłań sercowo-naczyniowych w
ciągu następnych 10 lat wynosi już 20-30%.
Do grupy bardzo wysokiego ryzyka zalicza się pacjentów z nadciśnieniem 3 stopnia oraz z
przynajmniej jednym współistniejącym czynnikiem ryzyka, jak również wszystkich chorych z
klinicznymi objawami chorób sercowo-naczyniowych lub chorób nerek.
Grupa ta charakteryzuje się najwyższym ryzykiem wystąpienia głównych incydentów sercowo-
naczyniowych, przekraczającym 30% w ciągu 10 lat.
PROFILAKTYKA CHOROBY NIEDOKRWIENNEJ SERCA
Rekomendacje Komisji Profilaktyki
Polskiego Towarzystwa Kardiologicznego
5. PROFILAKTYKA WTÓRNA
Osoby z istniejącą już IHD cechują się wyjątkowo dużym ryzykiem epizodu wieńcowego.
Z tego też powodu profilaktyce wtórnej IHD przyznaje się najwyższy priorytet (tabela
XV). Obniżenie stopnia ryzyka wymaga intensywnego zwalczania wszystkich czynników
zagrożenia równocześnie, według zasad podanych w następnym rozdziale.
Tabela XV. Priorytety profilaktyki IHD w praktyce lekarskiej (3)*
1. Pacjenci z ustaloną IHD lub innymi chorobami naczyniowymi na tle miażdżycy
2. Osoby zdrowe, ale z dużym ryzykiem wystąpienia IHD lub innych chorób
naczyniowych na tle miażdżycy (według tabeli VIII)

3. Bliscy krewni
• pacjentów z wczesnym początkiem IHD lub innych chorób naczyniowych na
tle miażdżycy
• osób zdrowych, ale ze szczególnie dużym ryzykiem wystąpienia IHD
4. Inne osoby przyjmowane przez lekarza w ramach normalnej praktyki
* w modyfikacji własnej
Ponadto w odniesieniu do prewencji wtórnej obowiązują specjalne zalecenia odnośnie
leków profilaktycznych:
o
kwas acetylosalicylowy - w dawce 75-160 mg na dobę - jako podstawowy lek
przeciwpłytkowy może być bezpiecznie stosowany u wszystkich pacjentów bez
przeciwwskazań do jego stosowania. Kwas acetylosalicylowy można
bezpiecznie stosować u chorych z cukrzycą i nadciśnieniem tętniczym,
zwracając uwagę na możliwość częstszego występowania powikłań
krwotocznych;
o
tiklopidyna - w dawce 250 mg dwa razy dziennie - może być stosowana razem z
kwasem acetylosalicylowym, zwłaszcza u pacjentów po implantancji stentu do
naczynia wieńcowego, przez okres minimum jednego miesiąca. W czasie terapii
powinna być monitorowana liczba białych krwinek;
o
klopidogrel - w dawce 75 mg na dobę - może być stosowany zwłaszcza u
pacjentów po zakrzepowych powikłaniach miażdżycy;
o
leki przeciwzakrzepowe - pochodne acenokumarolu, powinny być stosowane u
chorych z podwyższonym ryzykiem zakrzepowo-zatorowym, zwłaszcza po
przebytych zawałach serca przedniej ściany powikłanych wytworzeniem tętniaka
ze skrzepliną przyścienną, u chorych z niewydolnością serca i incydentami
zatorowo-zakrzepowymi w wywiadach oraz z napadowym i utrwalonym
migotaniem przedsionków;
o
leki beta-adrenolityczne - powinno się stosować u chorych po zawale serca,
zwłaszcza z dławicą wysiłkową, nadciśnieniem tętniczym i niewydolnością serca;
o
inhibitory enzymu konwertującego angiotensynę - u osób po zawale serca w
celu zmniejszenia niekorzystnych efektów remodelingu, z nadciśnieniem
tętniczym, a zwłaszcza u osób z pozawałową niewydolnością serca (frakcja
wyrzutowa <40%) i bezobjawową dysfunkcją skurczową i rozkurczową lewej
komory;
o
statyny - u osób wymagających obniżenia stężenia cholesterolu LDL.
Zastosowanie leku tej grupy wymaga uprzedniego zdiagnozowania typu
zaburzeń gospodarki lipidowej w oparciu o pełen lipidogram (cholesterol
całkowity, frakcję LDL, HDL, trójglicerydy, a w niektórych przypadkach test
zimnej flotacji).
W przypadkach wymagających obniżenia także poziomu trójglicerydów, pomocne może
być skojarzone leczenie statyną i fibratem.
PROFILAKTYKA CHOROBY NIEDOKRWIENNEJ SERCA
Rekomendacje Komisji Profilaktyki
Polskiego Towarzystwa Kardiologicznego

6. ZWALCZANIE CZYNNIKÓW RYZYKA
Spis treści
6.1. Dieta
6.2. Zwalczanie palenia tytoniu
6.3. Ograniczanie spożycia alkoholu
6.4. Zwiększenie aktywności fizycznej
6.5. Leczenie hiperlipidemii
6.5.1. Leczenie hipercholesterolemii
6.5.2. Leczenie hiperlipidemii mieszanej
6.5.3. Leczenie hipertrójglicerydemii
6.5.4. Leczenie zespołu chylomikronemii
6.5.5. Farmakoterapia skojarzona hiperlipidemii
6.6. Leczenie nadciśnienia tętniczego
6.7. Redukcja masy ciała
6.8. Kontrola cukrzycy
6.9. Obniżanie aktywności czynników krzepnięcia krwi
6.10. Obniżanie stężenia homocysteiny
6.1. Dieta
Racjonalizacja żywienia jest jedną z najważniejszych metod profilaktyki miażdżycy i jej klinicznych
powikłań. Dotyczy to zarówno profilaktyki pierwotnej, jak i wtórnej.
Racjonalizacja żywienia wprowadzona na skalę populacyjną kojarzy się ze zmniejszeniem umieralności
na IHD (np. Stany Zjednoczone, Finlandia, Norwegia), a zastosowanie modyfikacji dietetycznych w
ramach profilaktyki wtórnej powoduje redukcję zgonów wieńcowych (DART, Indian Study i Lyon Study),
zawałów serca bez zgonu (Indian Study i Lyon Study) oraz zgonów ogółem, co stwierdzono we
wszystkich 3 wymienionych badaniach (69, 70, 71, 72).
ś
ywienie zgodne z rekomendacjami WHO (tabela II) powoduje obniżenie stężenia lipidów w surowicy,
ciśnienia krwi i stężenia fibrynogenu. Takie żywienie skojarzone z większą aktywnością fizyczną spełnia
warunki profilaktyki otyłości i cukrzycy 2 typu. Jest także wysoce prawdopodobne, chociaż wymaga to
jeszcze zebrania dodatkowych dowodów, że wysokie spożycie warzyw i owoców zmniejsza podatność
lipoprotein na oksydacyjną modyfikację i ma znaczenie dla utrzymania stężeń homocysteiny na niskich
poziomach.
W profilaktyce pierwotnej, w szczególności stosowanej na skalę populacyjną, bardzo ważna jest
promocja zasad racjonalnego żywienia w sposób łatwo zrozumiały przez ludzi. W krajach rozwiniętych
opracowane są wizualne metody promocji. Do najbardziej popularnych należy piramida żywnościowa,
modyfikowana w różnych krajach w zależności od lokalnych warunków. W Polsce spopularyzowana
została tzw. "Piramida zdrowego żywienia", przystosowana w szczególności do potrzeb profilaktyki
miażdżycy. Struktura spożycia żywności zgodna z tą piramidą bliska jest zasadom diety
ś
ródziemnomorskiej.
W promocji racjonalnego żywienia bardzo pomocne są także, spopularyzowane w licznych krajach
zachodnich, krótkie opracowania wytycznych żywienia p.n. "Dietary guidelines". W Polsce
spopularyzowano podobne opracowanie pt. "10 zasad zdrowego żywienia".
U ludzi z dużym ryzykiem IHD, szczególnie w profilaktyce wtórnej, konieczne jest stosowanie bardziej
rygorystycznych i precyzyjniej sformułowanych wytycznych żywienia. Temu celowi dobrze służy
popularyzacja wśród pacjentów zasad podanych w tableli XVI.
Tabela XVI. Wybór produktów spożywczych w diecie obniżającej stężenie cholesterolu (2)*
Produkty zalecane
Produkty do spożywania
w umiarkowanych ilościach
Produkty
przeciwwskazane
Produkty
zbożowe
Pieczywo z pełnego ziarna.
Maca. Owsianka. Ryż.
Makaron. Płatki
kukurydziane. Musli. Kasze
gruboziarniste.
Rogaliki francuskie
(croissant)

Nabiał
Mleko odtłuszczone. Sery
chude np. chudy twaróg.
Jogurt odtłuszczony. Białko
jajek. Substytuty jaj.
Mleko półtłuste. Sery: Brie,
Camembert, Edamski, Gouda.
Jogurt niskotłuszczowy. Dwa całe
jaja na tydzień.
Pełne mleko. Śmietana.
Mleko skondensowane.
Zabielacze do kawy. Sery
pełnotłuste. Jogurt
pełnotłusty.
Zupy
Zupy warzywne. Chude
wywary mięsne.
Zupy zaprawiane
ś
mietaną i innymi
tłuszczami.
Ryby
Ryby (z rusztu, gotowane,
wędzone). Unikać skóry.
Ryby smażone na właściwym oleju.
Ikra. Ryby smażone na
innych tłuszczach niż
wymienione oleje.
Skorupiaki
Ostrygi.
Małże. Homary.
Krewetki, kalmary.
Mięso
Indyki, kurczaki. Cielęcina.
Króliki. Dziczyzna. (usunąć
skórę z drobiu)
Bardzo chuda wołowina. Jagnięta.
Szynka. Bekon. Kiełbasa z indyka
lub kurczaka. Wątroba 2 razy w
miesiącu.
Mięso z widocznym
tłuszczem. Kaczki. Gęsi.
Kiełbasy. Salami.
Pasztety mięsne i inne.
Tłuszcze
Oleje zawierające kwasy
jednonienasycone np. rzepakowy i
oliwa z oliwek. Oleje zawierające
kwasy wielonienasycone np.
słonecznikowy, kukurydziany,
krokoszowy, sojowy. Margaryny
miękkie (nieuwodornione) z tych
olejów. Margaryny o zmniejszonej
zawartości tłuszczu.
Masło. Smalec. Słonina.
Łój. Tłuszcz spod
pieczeni. Margaryny
twarde. Olej palmowy i
kokosowy. Tłuszcze
uwodornione.
Owoce i
warzywa
Warzywa świeże i
mrożone, zwłaszcza
strączkowe: fasola, groch,
soczewica. Kukurydza.
Ziemniaki. Owoce świeże i
suszone. Owoce
konserwowe (niesłodzone).
Soki owocowe i warzywne
Ziemniaki lub frytki smażone na
dozwolonym oleju.
Ziemnniaki pieczone,
frytki, warzywa lub ryż
smażone na
niewłaściwym tłuszczu.
Warzywa solone i
konserwowane. Chipsy.
Desery
Sorbety. Galaretki. Bezy.
Budynie na mleku chudym.
Sałatki owocowe.
Lody. Kremy. Budynie na
pełnym mleku. Sosy na
ś
mietanie lub maśle.
Wypieki
Ciasta i ciasteczka przygotowane
na tłuszczach nienasyconych.
Torty. Przemysłowe
wyroby cukiernicze (np.
ciastka, paszteciki,
babeczki)
Wyroby
cukiernicze
Marcepany. Chałwa. Nugat.
Czekolada. Toffi.
Karmelki. Batony
czekoladowe.
Orzechy
Włoskie. Migdały.
Kasztany.
Laskowe, ziemne, pistacjowe i
brazylijskie.
Orzechy kokosowe.
Orzechy solone.
Napoje
Kawa filtrowana lub instant.
Herbata. Woda. Napoje
bezkaloryczne,
bezalkoholowe.
Alkohol. Niskotłuszczowe napoje
czekoladowe.
Czekolada. Kawa ze
ś
mietanką. Gotowana
kawa. Kawa po turecku.
Sosy
Przyprawy Pieprz. Musztarda. Zioła.
Przyprawy korzenne.
Sosy sałatkowe niskotłuszczowe
(np. na bazie chudego jogurtu).
Majonezy. Sól dodana.
Sosy i kremy sałatkowe.
Sosy do mięsa i ryb
zawierające tłuszcz.
* w modyfikacji własnej
Uwaga: spośród dozwolonych tłuszczów szczególne walory mają te, którym przyznano Znak Profilaktyki
Cholesterolowej.

Kontrolowana jest w nich zawartość izomerów trans.
Zagadnieniem otwartym pozostaje stosowanie suplementów pokarmowych dla wzbogacenia diety w
składniki mające znaczenie w profilaktyce chorób układu krążenia. Według większości ekspertów
ż
ywienie oparte na zasadach opisanych w tym raporcie nie wymaga dodatkowego stosowania
suplementów. Odstępstwo od tej zasady poczyniono ostatnio odnośnie hiperhomocysteinemii, w której
oprócz diety zaleca się stosowanie witamin z grupy B, istotnych dla metabolizmu homocysteiny (2, 64).
Co się tyczy witamin antyoksydacyjnych, to badania obserwacyjne wskazywały, że ludzie spożywający
większe ilości witaminy E, w porównaniu z tymi, u których spożycie tych witamin jest małe, mają
mniejsze ryzyko IHD (73, 74). Spostrzeżenie to nie znalazło jednak potwierdzenia w randomizowanych
badaniach klinicznych. Spośród 4 (75, 76, 77, 78) opublikowanych prac z zastosowaniem witaminy E,
tylko w Cambridge Heart Antioxidant Study (CHAOS) (76) obserwowano, u pacjentów z
udokumentowaną miażdżycą tętnic wieńcowych, spadek występowania zawału serca bez zgonu o 77%.
Natomiast badania Alpha Tocopherol Beta Carotene Cancer Prevention Study (ATBC) (75), Heart
Outcomes Prevention Evaluation (HOPE) (77) oraz Gruppo Italiano per lo Studio della Suprawievenza
nell infarcto miocardio (GISSI) (78) dały wyniki negatywne. W ATBC stosowano 50 mg witaminy E
dziennie przez 5 lat, z kolei w CHAOS, HOPE i GISSI testowano duże dawki witaminy E, w pierwszym z
wymienianych badań 400 i 800 IU, w drugim 400 IU i w trzecim 300 mg, odpowiednio przez 510 dni, 4,5
roku oraz 3,5 roku. Badanie ATBC dotyczyło prewencji pierwotnej, CHAOS i GISSI prewencji wtórnej, a
HOPE prewencji wtórnej oraz pierwotnej dużego ryzyka.
W podsumowaniu na obecnym etapie wiedzy suplementację diety dużymi dawkami witaminy E uważa
się za nieuzasadnioną. Dotyczy to także beta-karotenu i witaminy C.
6.2. Zwalczanie palenia tytoniu
Zwalczanie nałogu palenia tytoniu należy do najważniejszych metod profilaktyki miażdżycy.
Interesujące jest, że w populacjach z małymi stężeniami cholesterolu (Japonia, Chiny), pomimo
znacznego rozpowszechnienia nałogu palenia, ryzyko chorób sercowo-naczyniowych jest małe. Może to
sugerować, że palenie tytoniu odgrywa rolę czynnika ryzyka miażdżycy pod warunkiem zwiększonego
stężenia LDL. Pomimo tej sugestii, niezaprzeczalnym faktem jest, że zaprzestanie palenia jest
skutecznym sposobem redukcji ryzyka IHD i innych chorób rozwijających się na tle miażdżycy. Z tego
powodu niepalenie tytoniu stanowi jeden z kanonów profilaktyki miażdzycy.
6.3. Ograniczanie spożycia alkoholu
Regularne spożywanie alkoholu, w ilości od 1 do 6 drinków dziennie, kojarzy się z mniejszą
umieralnością na IHD. Efekt ten jest niezależny od dawki w podanych granicach, tzn. że 1 drink i 6
drinków są w takim samym stopniu skuteczne. Przy wyższym spożyciu wzrasta zagrożenie nagłym
zgonem. Podkreślenia wymaga, że regularne spożywanie alkoholu wiąże się z niebezpieczeństwem
uzależnienia oraz efektów szkodliwych ze strony licznych narządów. Alkohol zwiększa ponadto
zawartość trójglicerydów w surowicy u ludzi z ich zwiększonym poziomem i pogarsza przebieg cukrzycy.
Z powyższych powodów za obowiązującą uznaje się zasadę nie zalecania alkoholu dla profilaktyki IHD
ludziom nie spożywającym regularnie alkoholu. Regularnie pijącym mężczyznom należy zwrócić uwagę,
aby nie przekraczali dziennie 2 drinków. Kobiety nie powinny przekraczać 1 drinka dziennie. Za 1 drinka
przyjmuje się kieliszek wódki (25 ml), 1 lampkę wina (100 ml) lub 0,33 l piwa 3,6%, co odpowiada 10 g
czystego etanolu.
6.4. Zwiększenie aktywności fizycznej
Ludzie o dużej aktywności fizycznej są mniej podatni na IHD. Domniemane mechanizmy wpływu wysiłku
fizycznego na ryzyko IHD zostały opisane w tym opracowaniu wcześniej. W ramach profilaktyki
pierwotnej u ludzi pracujących umysłowo, zaleca się uprawianie intensywnych ćwiczeń co najmniej 3
razy w tygodniu po 30 minut. Dla pacjentów objętych profilaktyką wtórną rodzaj i intensywność
aktywności fizycznej ustala się indywidualnie, biorąc pod uwagę wynik testu wysiłkowego.
6.5. Leczenie hiperlipidemii
Przed przystąpieniem do leczenia zaburzeń lipidowych, po ich prawidłowym rozpoznaniu, konieczne jest

ustalenie ogólnego ryzyka IHD (tabela VIII), a następnie stężenia LDL-chol, które należy uzyskać dla
skutecznej profilaktyki IHD (tabela XVII).
Tabela XVII. Stężenia lipidów, które należy osiągnąć w postępowaniu z pacjentem, w zależności od
stopnia ryzyka ogólnego IHD
Obniżenie poziomu
cholesterolu LDL poniżej
trójglicerydów poniżej
Ogólne ryzyko
mg/dl
mmol/l
mg/dl
mmol/l
Umiarkowane
160
4,1
180
2,0
Duże
130
3,4
180
2,0
180
2,0
w cukrzycy:
Bardzo duże
100
2,6
150
1,7
- Pożądane jest uzyskanie stężenia cholesterolu HDL powyżej 35 mg/dl (0,9 mmol/l) u mężczyzn i
powyżej 40 mg/dl (1,0 mmol/l) u kobiet;
- Oszacowanie ryzyka ogólnego według tabeli VIII.
Wysokie wymaganie co do docelowego stężenia cholesterolu LDL przy dużym ryzyku ogólnym, a
szczególnie w prewencji wtórnej, wydaje się uzasadnione w świetle wyników badania 4S, gdzie
największą korzyść odnieśli pacjenci, u których udało się osiągnąć najniższe wartości tego lipidu, w
wyniku leczenia simwastatyną (79).
Potrzebę dążenia do niskich stężeń cholesterolu LDL w prewencji wtórnej, tam gdzie jest to możliwe,
potwierdzają wyniki badań angiograficznych. W Post Coronary Artery Bypass Graft (Post CABG) Study,
w którym pacjenci byli randomizowani do osiągnięcia dwóch docelowych stężeń cholesterolu LDL
(niższego i wyższego) przy pomocy intensywnego i umiarkowanego leczenia lowastatyną, lepsze wyniki
odnośnie zahamowania progresji miażdżycy w pomostach wieńcowych uzyskano w grupie chorych, w
której stężenie cholesterolu LDL obniżono do wartości 93-97 mg/dl, niż w grupie z osiągniętym
stężeniem 132-138 mg/dl (80).
Potrzeba obniżania stężenia cholesterolu LDL poniżej 100 mg/dl u pacjentów z wysokim ryzykiem IHD
wywołuje pytanie o to, do jakich wartości można obniżyć to stężenie bez obaw o niekorzystne efekty. Na
podstawie przeglądu literatury słuszne wydaje się przyjęcie, że stężenia cholesterolu LDL niższe niż 100
mg/dl nie są sprzeczne z wymaganiami zdrowia. W różnych badaniach wykazano, że człowiek w chwili
urodzenia ma przeciętnie stężenie tej frakcji lipoprotein na poziomie około 30 mg/dl (81, 82). Stężenie to
szybko rośnie w ciągu pierwszych miesięcy życia, ale aż do okresu pokwitania nie przekracza średnio
wartości 100 mg/dl. Potem zawartość cholesterolu LDL we krwi dalej wzrasta. Niskie stężenia
cholesterolu LDL stwierdza się także w populacjach ludzi dorosłych, których sposób życia cechuje się
odmiennym modelem żywienia i/lub większą aktywnością fizyczną niż w populacjach zachodnich (83,
84). Kształtuje się opinia, że stężenia cholesterolu LDL znacznie przekraczające 100 mg/dl są wynikiem
przede wszystkim zachodniego modelu życia. Są one niefizjologiczne i aterogenne.
Warto także podkreślić, że w krajach ekonomicznie rozwiniętych pewien odsetek ludzi klinicznie
zdrowych cechuje się niskimi stężeniami cholesterolu LDL. Jak wynika z ryciny 3, w populacji
warszawskiej, mimo wysokiego średniego stężenia LDL-chol wynoszącego u mężczyzn 142 mg/dl a u
kobiet 138 mg/dl, dość duży odsetek ludzi ma stężenia poniżej 100 mg/dl (12).
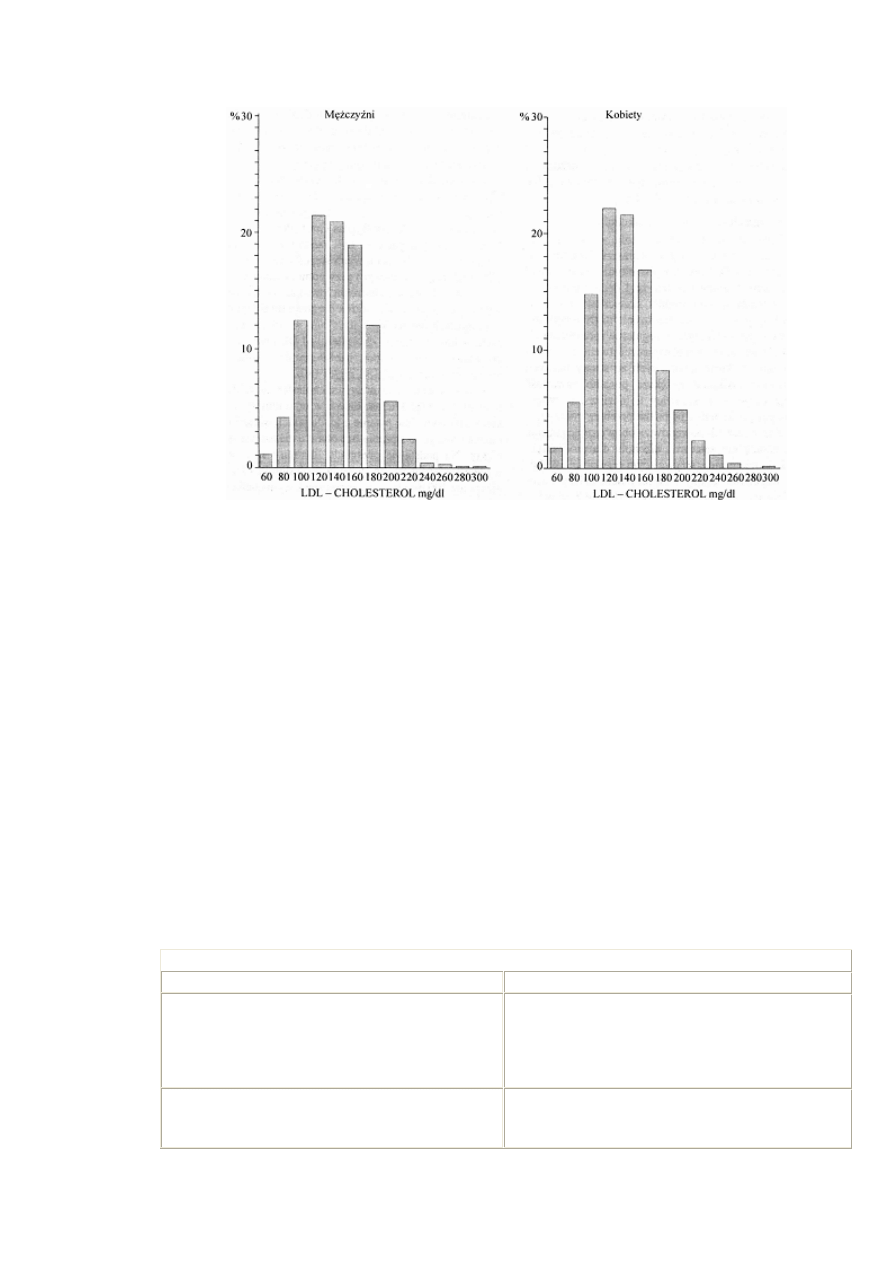
Na podstawie przedstawionego rozumowania należy przyjąć, że obawy przed obniżaniem stężenia
cholesterolu LDL poniżej 100 mg/dl nie są, w świetle aktualnych informacji, należycie uzasadnione.
U niewielkiej części chorych na IHD (ze współistniejącą hipercholesterolemią rodzinną), mimo
intensywnej farmakoterapii, nie udaje się osiągnąć optymalnego stężenia cholesterolu LDL (poniżej 100
mg/dl). Warto jednak wiedzieć, że nawet ograniczony efekt hipolipemizujący związany jest ze
zmniejszeniem zagrożenia epizodem wieńcowym.
6.5.1. Leczenie hipercholesterolemii
Leczenie zwiększonych stężeń cholesterolu LDL we krwi zaczyna się od diety wg wskazań jak w tableli
XVI. U pacjentów z łagodnym ogólnym ryzykiem IHD farmakoterapia nie jest stosowana. Przy ryzyku
umiarkowanym, farmakoterapia bywa stosowana, jeżeli dieta pozostaje mało skuteczna. Przed
podjęciem decyzji o zastosowaniu leków należy jednak intensywnie wdrażać dietę co najmniej przez 3
miesiące. W przypadkach dużego i bardzo dużego ryzyka leki są często potrzebne, a okres stosowania
samej diety skraca się do 4-8 tygodni. Chorzy na IHD oraz osoby z hipercholesterolemią rodzinną
wymagają zazwyczaj wdrożenia farmakoterapiii od początku z dietą.
Dieta realizowana w warunkach ambulatoryjnych powoduje średnią redukcję cholesterolu LDL o 8-10%.
Istnieje duże zróżnicowanie odpowiedzi hipolipemicznej na dietę pomiędzy pacjentami, wyrażające się
spadkiem stężenia tego lipidu od kilku do 40%. Wskazuje to na dobrą skuteczność samej diety w
niektórych przypadkach.
Wskazania do wyboru leków hipolipemizujących w różnych rodzajach hiperlipidemii przedstawione są w
tabeli XVIII.
Tabela XVIII. Wskazania do wyboru leków hipolipemizujących
Zaburzenia gospodarki lipidowej
Grupy leków
Hipercholesterolemia
(/LDL-chol)
• Inhibitory reduktazy HMG CoA (statyny)
• Leki przerywające krążenie kwasów żółciowych
(żywice)
• Fibraty
• Kwas nikotynowy
Hiperlipidemia mieszana
(/VLDL-TG oraz LDL-chol)
• Fibraty
• Inhibitory reduktazy HMG CoA
• Kwas nikotynowy

Hipertrójglicerydemia
/VLDL-TG
• Fibraty
• Kwas nikotynowy
Zespół chylomikronemii
(podwyższone VLDL i chylomikrony w osoczu na
czczo)
• Fibraty
• Kwas nikotynowy
• Oleje rybne (dodatkowo)
/ - wzrost
Lekami najsilniej obniżającymi stężenie cholesterolu LDL są inhibitory reduktazy hydroksymetylo-
glutarylokoenzymu A (HMG CoA), inaczej zwane statynami. Należą do nich lowastatyna, simwastatyna,
fluwastatyna, prawastatyna, ceriwastatyna i atorwastatyna. Z powodu dużej skuteczności statyny
powinny znajdować zastosowanie przede wszystkim u ludzi z dużym ryzykiem IHD, u których
wymagania odnośnie docelowych stężeń cholesterolu LDL są największe. Dotyczy to na pierwszym
miejscu wtórnej profilaktyki IHD oraz hipercholesterolemii rodzinnej.
Szczególna rola statyn w profilaktyce wtórnej IHD wynika z obserwacji, że leki te redukują zagrożenie
kolejnym epizodem wieńcowym (22, 23, 24). W stosunku do niektórych statyn wykazano, że przedłużają
ż
ycie pacjentów (22, 24). Inhibitory reduktazy HMG CoA mogą być także stosowane w profilaktyce
pierwotnej. Również u ludzi bez IHD statyny zmniejszają częstość występowania epizodów wieńcowych
(20, 21). Efekty kliniczne statyn w dużych randomizowanych badaniach przedstawiono w tabeli V.
Niedawno opublikowano wyniki badania Atorvastatin versus Revascularization Treatment (AVERT),
mniejszego liczebnie od prób klinicznych przedstawionych w tabeli V, w którym oceniono wpływ
agresywnego obniżania cholesterolu LDL, z zastosowaniem atorwastatyny (80 mg/dzień), na
wystąpienie epizodów niedokrwiennych, w porównaniu z angioplastyką skojarzoną z mniej intensywnym
leczeniem hipolipemizującym (85).
W badaniu AVERT uczestniczyło ogółem 341 pacjentów ze stabilną chorobą tętnic wieńcowych,
kwalifikujących się do angioplastyki. W pierwszej grupie chorych uzyskano średnie stężenie cholesterolu
LDL 77 mg/dl, a w drugiej 119 mg/dl. Leczeni tylko farmakologicznie przez 18 miesięcy mieli w tym
czasie o 36% mniej epizodów niedokrwiennych, niż pacjenci poddani angioplastyce (p=0,048). Później
też występowały u nich epizody niedokrwienne (p=0,03).
Badanie sugeruje, że u pacjentów ze stabilną chorobą tętnic wieńcowych agresywne obniżanie stężeń
cholesterolu LDL (redukcja do 77 mg/dl) może być przynajmniej tak skuteczne, jak angioplastyka w
połączeniu z mniej intensywnym leczeniem hipolipemizującym (redukcja LDL-chol do 119 mg/dl).
Obserwacja ta wymaga jednak potwierdzenia w większych badaniach klinicznych. Ponadto należy z
naciskiem podkreślić, że w badaniu AVERT uczestniczyli wyłącznie pacjenci ze stabilną chorobą tętnic
wieńcowych.
Redukcja incydentów wieńcowych wiązana jest ze stabilizującym działaniem statyn na blaszkę
miażdżycową, co sugerują dowody z badań in vivo u zwierząt doświadczalnych. Badania u królików
Watanabe (genetyczny model ciężkiej hipercholesterolemii) wykazały, że leczenie prawastatyną (86) i
ceriwastatyną (87) zmniejsza zawartość makrofagów w blaszkach miażdżycowych. Ich obecność tam
jest oznaką zapalenia. Stan zapalny przyczynia się do destabilizacji ognisk ateromatycznych, bowiem
komórki zapalne jakimi są makrofagi (i limfocyty T) powodują za pośrednictwem różnych mechanizmów
(88,89) erozję tkanki włóknistej oraz hamują jej rozwój. W wyniku tego może dojść do pęknięcia
pokrywy.
Chociaż ten stabilizujący wpływ statyn na blaszki miażdżycowe prawdopodobnie wynika głównie ze
zmniejszonego dopływu LDL do ściany tętnic, a co za tym idzie zahamowania odpowiedzi zapalnej, to
jednak w stabilizację ognisk ateromatycznych mogą być zaangażowane także "pozalipidowe"
mechanizmy tych leków, które zostały wykazane przede wszystkim in vitro. Do tzw. plejotropowych
(poza hipolipemimicznych) efektów inhobirorów reduktazy HMG CoA należą (90): hamowanie oksydacji
LDL, zmniejszanie akumulacji estrów cholesterolu w makrofagach, hamowanie wydzielania cytokin,
czynników wzrostu i czynnika tkankowego przez te komórki, aktywacja syntazy tlenku azotu w
komórkach śródbłonka, efekt antyagregacyjny, korzystny wpływ na układ krzepnięcia i fibrynolizy. Tak
więc statyny mają działanie antyoksydacyjne, przeciwzapalne i w pewnym stopniu przeciwkrzepliwe. O
działaniu przeciwzapalnym, poza wymienionym już hamowaniem wydzielania mediatorów zapalenia z
makrofagów, świadczy także wykazanie u ludzi leczonych tymi lekami redukcji stężenia białka C
reaktywnego (CRP) w osoczu (91).
Statyny przywracają upośledzoną zdolność tętnic do rozkurczu (88). Dzieje się to pośrednio przez
hamowanie oksydacji LDL (utlenione LDL, jak wykazano hamują syntezę tlenku azotu w śródbłonku i
powodują jego rozkład) oraz prawdopodobnie także bezpośrednio przez aktywację syntazy tlenku azotu.
Powrót zdolności tętnic do rozkurczu, już po kilku tygodniach, względnie miesiącach, leczenia statyną,
jest bardzo ważny z punktu widzenia pacjenta, gdyż może łączyć się z poprawą kliniczną, a więc

poprawą komfortu życia obserwowaną przez chorych.
To spostrzeżenie wspierają wyniki badań. Spośród nich warto wspomnieć obserwację dokonaną z
zastosowaniem Holtera u pacjentów otrzymujących statynę lub placebo. Przeprowadzone przed i po
leczeniu 6-miesięcznym, 48-godzinne zapisy EKG wykazały, że w grupie placebo niedokrwienie
(obniżenie odcinka ST) występowało równie często w obu badaniach, natomiast w grupie leczonej
statyną przeważający odsetek pacjentów nie miał ani jednego epizodu niedokrwienia w drugim badaniu
EKG (92).
Innym przykładem jest poprawa testu wysiłkowego, którą obserwuje się u pacjentów z wyjściowo
dodatnim wynikiem testu, po leczeniu statyną. Warto również zauważyć, że po przerwaniu leczenia
korzystny efekt zanika i powraca dodatni wynik próby wysiłkowej (93).
Przedstawione wyniki badań nad statynami wskazują, że u pacjentów z IHD są one lekami z wyboru dla
osiągnięcia docelowego stężenia cholesterolu LDL. Z obniżeniem stężenia tego lipidu można wiązać
najwięcej mechanizmów korzystnego działania statyn na redukcję epizodów wieńcowych.
Wracając do działania hipolipemizujacego, statyny zmniejszają w sposób umiarkowany także stężenie
trójglicerydów. Efekt ten zależy od dawki leku i od wartości początkowych stężenia trójglicerydów. Im
wyższe było stężenie początkowe, tym większa redukcja. Z tego powodu leki te mogą mieć
zastosowanie w tzw. hiperlipidemii mieszanej (podwyższone stężenie cholesterolu LDL i trójglicerydów).
Ponadto inhibitory reduktazy HMG CoA umiarkowanie zwiększają stężenie cholesterolu HDL.
Bezpieczeństwo terapii statynami wymaga kontroli funkcji wątroby oraz obserwacji w kierunku
ewentualnego wystąpienia miopatii (tabela XIX).
Tabela XIX. Zasady stosowania leków hipolipemizujących
Grupy leków -
przykłady
Zakres dziennej dawki
Efekty uboczne
(częściej
spotykane)
Przeciwwskazania
Inne uwagi
Tabletki/kapsułki
Dawka:
INHIBITORY
REDUKTAZY
HMG CoA
(STATYNY)
Zwyczajowa
Maksymalna
Lowastatyna
10-40 mg
80 mg
Simwastatyna
5-20 mg
40 mg
Prawastatyna
10-40 mg
40 mg
Fluwastatyna
20-40 mg
80 mg
Ceriwastatyna
0,1-0.3 mg
0,3 mg
Atorwastatyna
10-40 mg
40 mg
Ból głowy,
wzdęcia, zaparcia,
dyspepsja, wzrost
aktywności
enzymów
wątrobowych i
mięśniowych (1
miopatia),
wysypka. Objawy
te ustępują po
zaprzestaniu
leczenia.
Zwiększone ryzyko
miopatii, jeśli
statyny są
przyjmowane z
cyklosporyną,
kwasem
nikotynowym,
fibratami,
erytromycyną,
lekami
przeciwgrzybiczymi
azolowymi.
Simwastatyna i
lowastatyna
nasilają działania
antykoagulantów.
Uszkodzenie
funkcji wątroby,
kobiety w wieku
rozrodczym, jeśli
nie ma pewnej
antykoncepcji.
• Zbadać ALAT
przed leczeniem.
Monitorować
ALAT po raz
pierwszy po 6-8
tygodniach
leczenia, potem
przez pierwszy
rok co 3
miesiące, a
następnie co pół
roku. Odstąpić
od leczenia, jeśli
ALAT>=3x górna
granica normy.
• Ocenić CPK,
jeśli pacjent
skarży się na
bóle i osłabienie
mięśni. Odstąpić
od leczenia, jeśli
CPK>=10x górna
granica normy.
LEKI
PRZERYWAJĄCE
Proszek
Dawka
Różnego rodzaju
dolegliwości
Podwyższone
stężenie
Stosować
suplementy

Kolestipol
5-20 g
30 g
Cholestyramina
4-16 g
24 g
Podawać: 1 x dziennie
(mała dawka) lub 2 x
dziennie po zmieszaniu z
płynem. Dawkę należy
zwiększać stopniowo dla
zminimalizowania
objawów ubocznych.
nadbrzuszu,
nudności, wzdęcia,
wrzód trawienny z
krwawieniem.
Wzrost stężenia
trójglicerydów.
Zmniejszenie
wchłaniania kwasu
foliowego i leków.
niedrożność dróg
ż
ółciowych.
karmiących
piersią. Inne leki
przyjmować 1
godz. przed lub 4
godz. po żywicy.
FIBRATY
Tabletki
Fenofibrat
- postać
mikronizowana
3 x 100 mg
1 x 200 mg
Ciprofibrat
1 x 100 mg
Bezafibrat
- postać wolno
uwalniająca się
3 x 200 mg
1 x 400 mg
Gemfibrozyl
2 x 450 mg lub 2 x 600
mg
Uwaga! Wyżej podano
najczęściej stosowane
dawki leków.
Dyskomfort
brzuszny,
nudności,
pokrzywka, wzrost
aktywności
enzymów
wątrobowych, bóle
mięśniowe. Fibraty
nasilają efekt
antykoagulantów.
Zaburzenie
potencji,
wypadanie
włosów. Efekty
uboczne ustępują
po zaprzestaniu
leczenia.
Poważne
uszkodzenie
wątroby i nerek.
Nadwrażliwość na
lek, ciąża. Kamica
ż
ółciowa.
• Okresowo
monitorować
ALAT.
• Oceniać CPK,
jeśli wystąpią
bóle i osłabienie
mięśni.
• U pacjentów z
upośledzoną
funkcją nerek
podawać
zmniejszoną
dawkę i
monitorować
stężenie
kreatyniny.
• Jeśli pacjent
przyjmuje
doustnie lek
przeciwkrzepliwy,
należy ściśle
monitorować
czas
protrombinowy i
w razie potrzeby
zmniejszyć
dawkę
antykoagulanta.
KWAS
NIKOTYNOWY I
JEGO ANALOGI
Tabletki
Zaczerwienienie
skóry z uczuciem
gorąca
Upośledzenie
funkcji wątroby.
Dna. Świeży zawał
• Okresowo
monitorować
wskaźniki

wolno
uwalniających się
analogów),
zaburzenia
miarowości pracy
serca, hipotensja.
Leków tych nie stosuje się u dzieci, kobiet w wieku rozrodczym (jeśli nie ma pewnej antykoncepcji) i
matek karmiących piersią.
Inną grupą leków, skuteczną w obniżaniu cholesterolu LDL, są preparaty przerywające krążenie
kwasów żółciowych, inaczej zwane żywicami. Do leków z tej grupy należy cholestyramina i kolestipol.
ś
ywice są najbezpieczniejszymi lekami hipolipemizującymi, działają bowiem w przewodzie
pokarmowym, nie wchłaniając się z niego do krwi. Z tego powodu leki te można stosować u dzieci,
kobiet w ciąży i matek karmiących piersią, jeśli mają hipercholesterolemię rodzinną.
Fibraty (fenofibrat, fenofibrat mikronizowany, ciprofibrat, bezafibrat, gemfibrozyl) są lekami
zmniejszającymi przede wszystkim stężenie trójglicerydów i zwiększającymi stężenie HDL w osoczu.
Leki te wykazują również zróżnicowane działanie zmniejszające stężenie cholesterolu LDL.
Są one bardzo przydatne w leczeniu hipertrójglicerydemii. Mogą mieć także zastosowanie u pacjentów z
hiperlipidemią mieszaną (jako monoterapia lub w skojarzeniu ze statyną). Fibratami można również
leczyć umiarkowaną hipercholesterolemię (94) u ludzi objętych profilaktyką pierwotną.
Brak jest dotychczas dowodów z badań klinicznych, że fibraty mogą zmniejszać ryzyko epizodów
wieńcowych w zależności od redukcji cholesterolu LDL. Są natomiast dowody, że leki te powodują
znamienny spadek zagrożenia tymi epizodami u ludzi zdrowych i chorych na IHD, jeśli zmniejszają
stężenie trójglicerydów i/lub zwiększają stężenie cholesterolu HDL. Dotyczy to gemfibrozylu (profilaktyka
pierwotna i wtórna) (19, 25) oraz bezafibratu (profilaktyka wtórna) (95).
W badaniu the Veterans Affairs Cooperative Studies Program High-Density Lipoprotein Intervention
Trial (VA-HIT) u 2531 mężczyzn z IHD oceniono, w porównaniu z placebo, wpływ leczenia
gemfibrozylem na występowanie zawału serca bez zgonu i na zgony wieńcowe (25). Pacjenci podczas
przystępowania do próby mieli niskie stężenie cholesterolu HDL (<=40 mg/dl, tj. <=1,0 mmol/l). Stężenie
cholesterolu LDL nie przekraczało 140 mg/dl (3,6 mmol/l), a stężenie trójglicerydów nie było większe niż
300 mg/dl (3,4 mmol/l). Mediana czasu leczenia wynosiła 5,1 lat. Po roku zawartość cholesterolu HDL
była wyższa w grupie leczonej o 6%, w porównaniu z placebo, a stężenie trójglicerydów niższe o 31%.
Stężenie cholesterolu LDL nie różniło się między grupami.
W wyniku terapii gemfibrozylem nastąpiła redukcja zgonów spowodowanych IHD oraz zmniejszyło się
występowanie zawału serca bez zgonu łącznie o 22% (p=0,006). Korzystny efekt leku uwidocznił się po
2 latach.
Nie było wzrostu zgonów z powodu nowotworów. Autorzy pracy łączą redukcję epizodów wieńcowych
pod wpływem gemfibrozylu ze wzrostem stężenia cholesterolu HDL i spadkiem trójglicerydów.
Drugim opublikowanym niedawno badaniem wtórnej prewencji z zastosowaniem leku z grupy fibratów
jest Bezafibrate Infarction Prevention (BIP) Study, w którym porównano z placebo wpływ bezafibratu na
incydenty wieńcowe (95). W badaniu uczestniczyło 3122 chorych ze stężeniem cholesterolu całkowitego
pomiędzy 180 i 250 mg/dl, trójglicerydów <=300 mg/dl i cholesterolu HDL <=45 mg/dl. Bezafibrat
zwiększył stężenie cholesterolu HDL o 12% oraz obniżył stężenie trójglicerydów o 22% i cholesterolu
LDL o 5%, w porównaniu z placebo. Redukcja incydentów wieńcowych (zawał serca i nagły zgon
sercowy) w całej grupie leczonych pacjentów wynosiła 9% i była nieznamienna. Trzeba jednak dodać,
ż
e mieli oni stosunkowo małe ryzyko IHD, mimo obecności tej choroby, gdyż roczna śmiertelność
wynosiła tylko 1,5%. Na uwagę zasługuje natomiast, że w podgrupie chorych z wyjściowym stężeniem
trójglicerydów >=200 mg/dl wystąpiło znamiennie mniej (o 40%) incydentów wieńcowych. Podgrupa ta
stanowiła 10% wszystkich badanych.
W badaniach angiograficznych wykazano także, że gemfibrozyl zwalnia progresję miażdżycy u ludzi z
niskim stężeniem cholesterolu HDL po zabiegu wszczepienia pomostów aortalno-wieńcowych (LOCAT)
(32). Istnieje również obserwacja zahamowania rozwoju miażdżycy w tętnicach wieńcowych pod
wpływem bezafibratu (BECAIT) (26).
Należy mieć jednak na uwadze, że brak jest dowodów z dużych badań klinicznych na to, że leki te
zmniejszają zgony ogółem, tzn. że wydłużają życie pacjentów. Badania dotyczące tego problemu są w
toku.
Do plejotropowych działań fibratów znanych od dawna należy poprawa tolerancji glukozy oraz redukcja
stężenia fibrynogenu i kwasu moczowego. Ostatnio pojawiły się dowody na bezpośrednie
przeciwmiażdżycowe działanie tych leków na ścianę tętnicy (96).

Kwas nikotynowy ma właściwości obniżania zarówno poziomu trójglicerydów, jak i cholesterolu LDL,
może mieć więc zastosowanie we wszystkich typach HLP, jednakże liczne efekty niepożądane i
przeciwwskazania bardzo ograniczają jego użyteczność (tabela XIX). Dla zmniejszenia objawów
niepożądanych leczenie należy rozpoczynać od małych dawek.
W leczeniu hipercholesterolemii rodzinnej, zwłaszcza ciężkiej postaci homozygotycznej, może mieć
zastosowanie aferaza LDL. Lipoproteiny te usuwa się z krążenia raz na tydzień lub raz na dwa tygodnie.
6.5.2. Leczenie hiperlipidemii mieszanej
Postępowanie w hiperlipidemii mieszanej łączy ze sobą elementy leczenia hipercholesterolemii i
hipertrójglicerydemii. Stężenie cholesteroli LDL należy zmniejszyć według oceny stopnia ryzyka
ogólnego, tj. do poziomu poniżej 160 mg/dl przy ryzyku umiarkowanym, poniżej 130 mg/dl przy ryzyku
dużym, a poniżej 100 mg/dl w przypadkach bardzo dużego ryzyka. Stężenie trójglicerydów należy
zredukować poniżej 180 mg/dl. U chorych z cukrzycą zaleca się obniżanie trójglicerydów poniżej 150
mg/dl.
W przypadku nadwagi pacjent powinien obniżyć masę ciała. Należy dokonać korekty ewentualnych
przyczyn hiperlipidemii wtórnej, a więc dobrze kontrolować cukrzycę, zalecić unikanie alkoholu (u ludzi z
podwyższonym stężeniem trójglicery-dów podnosi on ich poziom w osoczu) oraz zastąpić tiazydowe leki
moczopędne, beta-blokery lub retinoidy (witamina A) lekami obojętnymi w stosunku do metabolizmu
lipidów lub też zmniejszyć dawkę.
W hiperlipidemii mieszanej obowiązuje dieta taka jak w hipercholesterolemii. Do leków, które mogą mieć
zastosowanie w tym dość często spotykanym zaburzeniu metabolizmu lipidów, należą fibraty, statyny i
kwas nikotynowy. Fibraty i kwas nikotynowy silniej niż statyny zmniejszają stężenie trójglicerydów i
podwyższają cholesterol HDL, natomiast statyny efektywniej redukują cholesterol LDL. Z tego powodu,
jeśli dominuje wzrost stężenia trójglicerydów nad zwiększeniem stężenia cholesterolu LDL, bardziej
celowe są fibraty, natomiast jeśli jest odwrotnie, to statyny, zwłaszcza u pacjentów z IHD lub po zawale
serca.
6.5.3. Leczenie hipertrójglicerydemii
Wszystkie metody początkowego postępowania w hiperlipidemii mieszanej mają również zastosowanie
w leczeniu hipertriglicerydemii endogennej (podwyższone stężenie VLDL). Należy do nich redukcja
masy ciała, unikanie alkoholu, korekta przyczyn i dieta hipolipemiczna. Lekami z wyboru w
hipertrójglicerydemii są fibraty. Można również zastosować kwas nikotynowy. Zarówno te pierwsze, jak i
ten drugi podnoszą stężenie cholesterolu HDL, co jest korzystnym zjawiskiem. Ponadto leki te
zmniejszają zawartość w osoczu małych gęstych LDL.
6.5.4. Leczenie zespołu chylomikronemii
W zespole chylomikronemii obowiązuje dieta bardzo niskotłuszczowa, chylomikrony tworzą się bowiem
z tłuszczu pokarmowego niezależnie od jego rodzaju. Do podstawowych zasad leczenia należy także
całkowita abstynencja alkoholowa. U pacjentów z jednocześnie podwyższonym stężeniem VLDL i
obecnością chylomikronów na czczo (hiperlipoproteinemia typu V) zastosowanie mają fibraty i kwas
nikotynowy. Efekt obniżający stężenie TG można nasilić, dodając preparat oleju rybnego w kapsułkach.
Zespół chylomikronemii u chorych na cukrzycę wymaga leczenia tej choroby insuliną.
6.5.5. Farmakoterapia skojarzona hiperlipidemii
Korzyść z podawania pacjentom leków hipolipemizujących z dwóch grup wiąże się z większą
skutecznością przy możliwości zastosowania mniejszych dawek, co ogranicza ewentualne objawy
niepożądane.
W hipercholesterolemii korzystne jest łączenie statyn z żywicami (bardzo dobry efekt redukujący
stężenie cholesterolu LDL). Trzeba pamiętać o odstępie czasowym przy przyjmowaniu obu leków.
W hiperlipidemii mieszanej skojarzenie statyny z fibratem jest wysoce korzystne dla profilu lipidowo-
lipoproteinowego. Statyna bowiem silnie obniża stężenie cholesterolu LDL a fibrat silnie redukuje
stężenie trójglicerydów, zmniejsza zawartość małych, gęstych LDL i znacznie zwiększa stężenie

cholesterolu HDL. Jednakże należy mieć na uwadze, że tego typu farmakoterapia powoduje wzrost
ryzyka miopatii. Do tego rodzaju terapii należy wybierać statyny o krótkim okresie półtrwania. Statynę
podaje się wieczorem po posiłku, a rano lek z grupy fibratów. Przeciwwskazaniem do kojarzenia statyny
z fibratem jest upośledzona funkcja nerek.
Pierwsza kontrola stężenia lipidów, po wprowadzeniu leczenia farmakologicznego, powinna być
wykonana po 8 tygodniach. Następne badania w okresie pierwszego roku farmakoterapii wykonuje się
co 3 miesiące, a w kolejnych latach co 3-6 miesięcy.
6. 6. Leczenie nadciśnienia tętniczego
Celem leczenia nadciśnienia jest zmniejszenie chorobowości i umieralności związanej z podwyższonym
ciśnieniem krwi, osiągniętej przy najmniejszej ilości objawów niepożądanych zależnych od prowadzonej
terapii hipotensyjnej. Większość międzynarodowych zaleceń postuluje obniżanie ciśnienia tętniczego
poniżej 140/90 mmHg.
Po określeniu ryzyka sercowo-naczyniowego pacjenta oraz ocenieniu narządów docelowych (tabela
XIII) należy ustalić czy trzeba podjąć natychmiastową farmakoterapię, czy też można monitorować
chorego, zalecając zmianę stylu życia. Zmiana stylu życia może stanowić wyłączne leczenie lub też
musi być prowadzona równolegle z leczeniem farmakologicznym. W jej skład powinno wchodzić
zaprzestanie palenia papierosów, redukcja masy ciała, ograniczenie spożycia alkoholu, zastosowanie
diety zgodnie z tabelą XVI, ograniczenie zawartości soli w diecie, wzrost aktywności fizycznej, oraz
uzyskanie pomocy w przezwyciężaniu sytuacji stresowych.
Zalecenia WHO/ISH dopuszczają 6 grup leków zarówno do rozpoczynania, jak i przewlekłego
stosowania w terapii hipotensyjnej (56). Są to diuretyki, leki blokujące receptory beta adrenergiczne,
inhibitory ACE, blokery kanałów wapniowych, antagoniści angiotensyny II i leki blokujące receptory alfa
adrenergiczne. Powyższe zalecenia podkreślają rozpoczynanie leczenia od małych dawek i stosowanie
najmniejszych skutecznych dawek leku, w celu zmniejszenia działań ubocznych. Często bardziej
korzystne jest dodanie małej dawki drugiego leku z innej klasy niż zwiększanie dawki leku już
stosowanego, lub zmiana leku, zwłaszcza, kiedy odpowiedź na podawany lek jest niedostateczna lub
stwierdza się jego złą tolerancję. Preferowane jest stosowanie leków długodziałających, skutecznych
przez 24 godziny przy podawaniu raz dziennie, co zapewnia lepsze przestrzeganie przez chorego
zaleceń lekarskich oraz zmniejszenie wahań ciśnienia, a tym samym bardziej łagodną i równą kontrolę
ciśnienia tętniczego. Zasady stosowania leków hipotensyjnych zostały opisane w stanowisku Polskiego
Towarzystwa Nadciśnienia Tętniczego pt. "Zasady postępowania w nadciśnieniu tętniczym" (57).
W grupie chorych z ryzykiem niskim i umiarkowanym (tabela XIV) należy rozpoczynać leczenie od
postępowania niefarmakologicznego, w pierwszym przypadku przez okres 6 miesięcy a w drugim 3
miesięcy i dopiero po tym okresie, przy niemożności uzyskania ciśnienia poniżej 140/90 mmHg,
rozważyć celowość zastosowania farmakoterapii. U osób z ryzykiem wysokim rozpoczęcie
farmakoterapii winno być przyspieszone, po względnie krótkim okresie leczenia niefarmakologicznego,
a u osób z ryzykiem bardzo wysokim natychmiast po rozpoznaniu nadciśnienia.
Specjalnej uwagi wymaga grupa chorych z wartościami w przedziale "wysokie prawidłowe", u których
stwierdza się jednocześnie cukrzycę i/lub niewydolność nerek. U tych pacjentów należy wcześniej
rozpoczynać skuteczne leczenie farmakologiczne, które zmniejsza progresję niewydolności nerek.
W doborze grupy leków należy uwzględnić wpływ danego leku na współistniejące czynniki ryzyka oraz
na choroby towarzyszące. Dobry kontakt lekarza z pacjentem jest podstawą skuteczności leczenia
nadciśnienia, stąd tak istotnego znaczenia nabiera dostarczenie pacjentowi wyczerpujących informacji
na temat ciśnienia tętniczego i nadciśnienia, ryzyka i rokowania, oraz korzyści z proponowanego
leczenia. Pacjent powinien rozumieć, dlaczego leczenie nadciśnienia jest tak ważne i zdawać sobie
sprawę, że terapia trwa zazwyczaj całe życie. Często zalecenie pacjentowi dokonywania pomiarów
ciśnienia w domu (należy pamiętać, że ciśnienie mierzone w warunkach domowych jest przeważnie o
10 mmHg niższe), a także angażowanie go w podejmowanie decyzji dotyczących wyboru strategii
leczenia zwiększa współpracę pacjenta z lekarzem.
Problem właściwego leczenia nabiera tym istotniejszego znaczenia, że jak wykazały badania Pol-
MONICA Warszawa (97) u znacznego odsetka chorych z nadciśnieniem tętniczym choroba ta nie była
wykryta, a jeżeli nawet była wykryta, to bądź nie podjęto leczenia, bądź podjęte leczenie było
niedostatecznie efektywne. W populacji w średnim wieku u 46% mężczyzn i 35% kobiet z wykrytym w
czasie badania przekrojowego nadciśnieniem, nadciśnienie to nie było uprzednio rozpoznane a u
dalszych 30% mężczyzn i 24% kobiet, mimo rozpoznania nadciśnienia, nie podjęto żadnego leczenia. U
24% mężczyzn i 45% kobiet z nadciśnieniem podjęto farmakoterapię, ale efektywność kontroli
nadciśnienia w populacji nie przekraczała 4% mężczyzn i 9% kobiet wśród ogółu chorych z

nadciśnieniem. Opracowywane wspólne wyniki Pol-MONICA i amerykańskiego badania ARIC wskazują,
ż
e obecna sytuacja w Polsce odnośnie efektywności kontroli nadciśnienia w populacji odpowiada
sytuacji, jaką obserwowano w USA przed 30 laty (98).
6.7. Redukcja masy ciała
Otyłość cechująca się wskaźnikiem masy ciała równym lub wyższym niż 30 kg/m
2
wymaga leczenia u
każdego człowieka. Nadwaga powyżej BMI 27 kg/m
2
powinna być leczona u ludzi z innymi czynnikami
ryzyka, co w szczególności dotyczy dyslipidemii i zaburzeń gospodarki węglowodanowej.
Dieta ubogokaloryczna zapewniająca deficyt energii około 1000 kcal jest podstawową metodą leczenia.
Ograniczenie spożycia tłuszczów i słodyczy jest najważniejszą cechą diety. Deficyt energii należy
osiągnąć, stosując dietę i ćwiczenia fizyczne. Leki anorektyczne (sibutramina) oraz hamujące
aktywność lipazy trzustkowej w przewodzie pokarmowym (orlistat) mogą być bardzo pomocne w
prowadzeniu leczenia. W przypadkach szczególnie opornych na leczenie można stosować przemysłowo
przygotowaną dietę, dostarczającą dziennie około 400 kcal.
Problemem zasadniczej wagi w leczeniu otyłości jest nie tylko uzyskanie zamierzonego efektu w postaci
redukcji masy ciała, lecz przede wszystkim możliwie długie utrzymanie uzyskanego rezultatu. Bardzo
liczne obserwacje dowodzą, że po zakończeniu kuracji odchudzającej zdecydowana większość
pacjentów tyje ponownie, a czynniki ryzyka miażdżycy ponownie się nasilają. Dlatego prowadzenie
leczenia otyłości powinno być rozłożone w czasie. Pacjentowi należy wyznaczać pośrednie cele do
osiągnięcia wyrażające się redukcją masy ciała, około 10%, a następnie utrzymanie osiągniętego celu.
Jeśli pacjent utrzyma masę ciała na zredukowanym poziomie przez okres 6 miesięcy i wykazuje chęć
dalszej współpracy, to można ponowić kurację, dążąc do redukcji masy ciała o dalsze 10%.
Redukcja masy ciała o 10% daje wymierne korzyści w postaci zmniejszenia intensywności
metabolicznych czynników ryzyka miażdżycy (tabela XX). Jak już wspomniano, efekt ten ustępuje jeżeli
pacjent tyje ponownie.
Tabela XX. Korzyści z obniżenia masy ciała o 10 kg
Umieralność:
•
Zmniejszenie umieralności ogólnej o ponad 20%
•
Zmniejszenie zgonów na cukrzycę o ponad 30%
•
Zmniejszenie zgonów z powodu nowotworów
kojarzących się z otyłością o ponad 40%
Ciśnienie krwi:
•
Obniżenie RRS o 10 mmHg
•
Obniżenie RRR o 20 mmHg
Cukrzyca:
•
Zmniejszenie stężenia glukozy na
czczo o 50%
Lipidy:
•
Zmniejszenie stężenia cholesterolu
całkowitego o 10%
•
Zmniejszenie cholesterolu LDL o 15%
•
Zmniejszenie TG o 30%
•
Zwiększenie cholesterolu HDL o 8%
Na podstawie: Obesity in Scotland. Integrating Prevention with weight Management. A National Clinical
Guideline recommended for use in Scotland by the Scottish Intercollegiate Guidelines Network
November, 1996
Objaśnienie użytych skrótów: RRS - ciśnienie tętnicze skurczowe,
RRR - ciśnienie tętnicze rozkurczowe, TG - trójglicerydy
6.8. Kontrola cukrzycy
Jak już wspomniano, cukrzyca zwiększa ryzyko IHD w bardzo dużym stopniu. Dotyczy to w
szczególności cukrzycy 2 typu. Dlatego wczesne rozpoznanie i prawidłowe leczenie cukrzycy jest
bardzo ważne w profilaktyce miażdżycy. Zasady leczenia cukrzycy są bardzo dobrze opisane w polskiej
literaturze medycznej i nie wymagają dodatkowego opisu w tym opracowaniu. Należy jednak podkreślić
bardzo duże znaczenie odchudzania w leczeniu cukrzycy 2 typu, oraz konieczność intensywnego
zwalczania wszystkich czynników ryzyka IHD, niezależnie od leczenia zaburzeń gospodarki
węglowodanowej. Dotyczy to w szczególności często współistniejących zaburzeń lipidowych.
Na dużą wagę zwalczania w cukrzycy także innych czynników ryzyka, niż hiperglikemia, wskazują

pośrednio wyniki niedawno opublikowanego klinicznego badania United Kingdom Prospective Diabetes
Study (UKPDS) (99, 100). W badaniu tym obniżano u chorych na cukrzycę typu 2 stężenie glukozy
różnymi metodami (insulina, pochodne sulfonylomocznika, metformina, dieta). Leczeni tylko dietą
redukującą poziom glukozy we krwi służyli za grupę kontrolną.
Okazało się, że intensywna kontrola glikemii przy pomocy pochodnych sulfonylomocznika i insuliny nie
miała znamiennego wpływu na powikłania sercowo-naczyniowe. Redukcja wystąpienia zawału serca ze
zgonem i bez zgonu oraz nagłego zgonu o 16% nie osiągnęła znamienności statystycznej (p=0,052)
(99). Uwagi natomiast wymaga znamiennie mniej zawałów serca (redukcja o 39%; p=0,021) oraz mniej
zgonów ogółem (redukcja o 36%; p=0,011) (100) w grupie leczonych metforminą. Być może, działanie
metforminy zmniejszające ryzyko sercowo-naczyniowe zależało od korzystnych efektów metabolicznych
tego leku. Warto też podkreslić, że pacjenci przyjmujący metforminę mieli mniejszy przyrost masy ciała
w okresie obserwacji niż ci, którzy byli leczeni insuliną i pochodnymi sulfonylomocznika.
Co się tyczy kontroli zaburzeń lipidowych u chorych na cukrzycę, to w ostatnich zaleceniach American
Diabetes Association (101) uznano za docelowe stężenie cholesterolu LDL równe i poniżej 100 mg/dl,
niezależnie od braku lub obecności IHD lub chorób innych tętnic na tle miażdżycy. Wynika to z
obserwacji, że ryzyko wystąpienia epizodu wieńcowego jest u chorych na cukrzycę bez IHD bardzo
podobne do ryzyka jakie mają osoby chorujące na IHD nie mające cukrzycy (59), oraz ze znaczenia
redukcji stężenia cholesterolu LDL u chorych na cukrzycę dla zmniejszenia zagrożenia epizodem
wieńcowym, co wykazano w badaniach klinicznych (102, 103). W badaniu 4S (prewencja wtórna IHD),
w podgrupie chorych na cukrzycę leczonych simwastatyną mniej było o 42% (p=0,001) epizodów
wieńcowych, w porównaniu z przyjmującymi placebo (102).
Również w badaniu CARE (prewencja wtórna IHD), w podgrupie pacjentów z cukrzycą leczonych
prawastatyną, wystąpiło o 25% mniej (p=0,05) epizodów wieńcowych (103).
W cukrzycy, poza redukcją stężenia cholesterolu LDL do wartości poniżej 100 mg/dl, należy także dążyć
do redukcji stężenia trójglicerydów poniżej 150 mg/dl. Trzeba podkreślić, że hipertrójglicerydemia, której
z reguły towarzyszy małe stężenie cholesterolu HDL i obecność w osoczu małych, gęstych LDL, jest
zaburzeniem lipidowym charakterystycznym dla cukrzycy typu 2. U tych chorych, spośród leków
hipolipemicznych, zastosowanie znajdują fibraty, ponieważ silnie obniżają poziom trójglicerydów i
dobrze zwiększają stężenie cholesterolu HDL. Fibraty ponadto zmniejszają zawartość w osoczu małych
gęstych LDL i fibrynogenu oraz poprawiają tolerancję glukozy.
Jak dotychczas istnieje jedno badanie kliniczne pod nazwą St. Marys, Ealing, Nortwick Park Diabetes
Prevention (SENDCAP) z zastosowaniem leku z tej grupy (bezafibrat) u chorych na cukrzycę, którzy
mieli także zaburzenia gospodarki lipidowej (104). Chorzy leczeni bezafibratem przez 3 lata mieli mniej
cech niedokrwienia w elektrokardiogramie spoczynkowym i mniej udokumentowanych zawałów serca
(łącznie), w porównaniu z tymi, którzy przyjmowali placebo (7% vs 23%; p=0,01). U aktywnie leczonych
znamiennie obniżył się poziom trójglicerydów i cholesterolu całkowitego w surowicy, a także zmniejszył
się stosunek cholesterolu całkowitego do cholesterolu HDL. Obserwowano również znamienne
zwiększenie się zawartości cholesterolu HDL.
W podsumowaniu u chorych na cukrzycę z hipercholesterolemią pierwszeństwo mają statyny, natomiast
jeśli z cukrzycą współistnieje hipertrójglicerydemia, to należy zastosować fibrat. W hiperlipidemii
mieszanej z dominującym wzrostem stężenia trójglicerydów nad zwiększonym stężeniem cholesterolu
LDL uzasadnione jest rozpoczęcie farmakoterapii od fibratu, jeśli jest odwrotnie to od statyny. Jeśli
monoterapia okaże się niewystarczająca dla osiągnięcia docelowych stężeń obu lipidów, można
zastosować terapię skojarzoną (statyna + fibrat), pamiętając o przeciwwskazaniach (przede wszystkim
upośledzona funkcja nerek).
Kwas nikotynowy nie ma zastosowania w leczeniu dyslipidemii u chorych na cukrzycę, ponieważ
pogarsza tolerancję glukozy. śywice mogą podnieść stężenie trójglicerydów.
6.9. Obniżanie aktywności czynników krzepnięcia krwi
Chociaż czynniki krzepnięcia należą do czynników ryzyka miażdżycy, to jednak nie są one badane
rutynowo w celu oceny ryzyka ogólnego. Nie ma także wskazań do ich odrębnego traktowania w
zasadach leczenia. Należy natomiast podkreślić, że odchudzanie i leczenie hiperlipidemii fibratami lub
kwasem nikotynowym obniża stężenie fibrynogenu. Zastosowanie aspiryny w profilaktyce wtórnej IHD
opisano wcześniej w tej pracy.
6.10. Obniżanie stężenia homocysteiny

Sugeruje się celowość stosowania suplementów witaminowych (kwas foliowy 400 µg, witamina B
6
- 2
mg i witamina B
12
- 6 µg) u pacjentów ze stężeniami homocysteiny w osoczu powyżej 10 mmol/l i
wysokim ryzykiem IHD (2).
PROFILAKTYKA CHOROBY NIEDOKRWIENNEJ SERCA
Rekomendacje Komisji Profilaktyki
Polskiego Towarzystwa Kardiologicznego
7. OGÓLNE ZASADY POSTĘPOWANIA z PACJENTEM w PROFILAKTYCE
CHOROBY NIEDOKRWIENNEJ SERCA
Schemat postępowania w profilaktyce IHD, w zależności od kategorii ryzyka,
przedstawiono na ryc. 4. Ma on ułatwić lekarzowi wyselekcjonowanie, z grupy ludzi
pozostających pod opieką, osób cechujących się zwiększonym ryzykiem IHD. Zadaniem
lekarza jest zastosowanie u nich metod profilaktyki według kategorii ryzyka.
Stopniowy rozwój miażdżycy, rozpoczynający się od wczesnej młodości, uzasadnia
potrzebę wdrożenia zasad profilaktyki w młodym wieku. Dlatego przyjęto, że u każdego
człowieka po ukończeniu 20 lat życia należy ocenić (wg tabeli I), występowanie
czynników ryzyka związanych ze stylem życia, takich jak sposób żywienia się, palenie
papierosów, spożycie alkoholu i aktywność fizyczna oraz obecność cech
indywidualnych, nie poddających się co prawda modyfikacji, ale wysoce przydatnych dla
określenia stopnia zagrożenia epizodem wieńcowym. Należą do nich wiek, płeć,
przedwczesna menopauza, wczesne występowanie w najbliższej rodzinie IHD lub innych
chorób naczyniowych na tle miażdżycy. Ponadto trzeba zbadać stężenie cholesterolu
całkowitego i glukozy, ciśnienie tętnicze i masę ciała. To postępowanie daje możliwość
wyodrębnienia osób o małym ryzyku IHD, u których nie zachodzi potrzeba
przeprowadzenia bardziej kosztownych badań diagnostycznych ani wprowadzenia
kosztownych metod profilaktycznych.
Należy mieć świadomość, że po opisanych etapach selekcji pozostanie mała grupa
osób, dla których czynnikiem ryzyka będzie wiek (mężczyźni w wieku 45 lat i powyżej,
kobiety 55 lat i powyżej) albo przedwczesna menopauza albo obarczające wywiady
rodzinne. Ludzie ci mogą mieć także łagodne nadciśnienie i/lub stężenie cholesterolu
całkowitego dochodzące do 229 mg/dl. Należy ich traktować jak osoby z ryzykiem
łagodnym, bowiem wiek lub obciążający wywiad rodzinny nie są wskazaniem do
intensywnego leczenia tego rzędu zwiększonego stężenia cholesterolu metodami innymi
niż dieta.
Wystarczy, jeśli ci ludzie będą korzystać ze strategii populacyjnej pierwotnej profilaktyki
IHD, ewentualnie wzmocnionej indywidualną poradą na temat zdrowego stylu życia.
Podkreślenia wymaga, że w tej grupie znajdą się zarówno osoby bez czynników ryzyka,
jak również te z ryzykiem łagodnym, wynikającym ze stężenia cholesterolu LDL w
granicach 130-159 mg/dl i/lub obecności łagodnego nadciśnienia tętniczego (tabela VIII).
Zgodnie z powszechnie przyjętym poglądem ryzyko łagodne może być skutecznie
zmniejszone przez zastosowanie zdrowego stylu życia. Jednakże obecność łagodnego
nadciśnienia wymaga leczenia. Osoby zaliczone do tej grupy powinny być okresowo
kontrolowane pod względem stężenia cholesterolu całkowitego, masy ciała i ciśnienia
tętniczego.
Wyjaśnienia wymaga przyjęcie wartości stężenia cholesterolu całkowitego 230 mg/dl
(ryc. 4 pkt. II i III), a nie 240 mg/dl (co odpowiada w przybliżeniu stężeniu cholesterolu

LDL 160 mg/dl), dla oddzielenia osób z łagodnym ryzykiem IHD od tych, którzy maja
większe ryzyko. Takie podejście zmniejsza prawdopodobieństwo, że część ludzi ze
stężeniem cholesterolu LDL powyżej 160 mg/dl zostałaby zaliczona do kategorii
łagodnego ryzyka, w sprzeczności z zasadą przyjętą w tabeli VIII, zgodnie z którą
powinni oni być zakwalifikowani do kategorii większego ryzyka.
Jeżeli opisane wyżej badanie czynników ryzyka uzasadnia przypuszczenie, że pacjent
ma ryzyko IHD większe niż łagodne, to zachodzi potrzeba wykonania pełnego
lipidogramu, tzn. oznaczenia stężenia cholesterolu całkowitego, trójglicerydów,
cholesterolu HDL i wyliczenia stężenia cholesterolu LDL, dla zakwalifikowania badanej
osoby do właściwej kategorii ryzyka (umiarkowane, duże lub bardzo duże).
Postępowanie terapeutyczne u tych ludzi wymaga kontroli lekarskiej dla uzyskania celów
terapeutycznych, wyszczególnionych w odpowiednich sektorach na rycinie 4.
Jak podano w tabeli XV, najwyższy priorytet w działaniach profilaktycznych przyznaje się
chorym na IHD lub inne choroby naczyniowe na tle miażdżycy. Wynika to z dużej
skuteczności i opłacalności (relacja efekty/koszty) profilaktyki wtórnej. Dlatego zasady
postępowania w profilaktyce wtórnej przedstawiono osobno w tabeli XXI.
Schemat postępowania we wtórnej profilaktyce choroby niedokrwiennej serca
Tabela XXI. Postępowanie z pacjentem po przebytym epizodzie wieńcowym i/lub z
chorobami innych tętnic na tle miażdżycy (profilaktyka wtórna)
Czynnik ryzyka
Rekomendacje
Palenie tytoniu
Cel: Całkowita rezygnacja
Zalecić całkowite zaprzestanie palenia.
Kontrolować wykonanie polecenia przy każdej
kolejnej wizycie.
Kontrola lipemii
Cele:
- LDL-chol <100 mg/dl (2,6 mmol/l)
- TG <180 mg/dl (2,0 mmol/l)
[Jeżeli cukrzyca, to
TG <150 mg/dl (1,7 mmol/l)]
Wdrożyć dietę Europejskiego Towarzystwa
Kardiologicznego wg materiałów instruktażowych
upowszechnionych przez Narodowy Program
Profilaktyki Cholesterolowej. Wykonać badanie
pełnego profilu lipidowego. Po zawale serca
badanie lipidów dopiero po 4-6 tygodniach.
Miarodajne może być także badanie w pierwszej
dobie zawału.
Jeżeli:
LDL-chol
<100 mg/dl
TG <180
mg/dl
to bez leków
LDL-chol: 100-
130 mg/dl
i/lub
TG: 180-300
mg/dl
to rozważyć leki
LDL-chol >130
mg/dl (3,4 mmol/l)
i/lub
TG >300 mg/dl (3,4
mmol/l)
to potrzebne leki
- HDL-chol >35 mg/dl
(09 mmol/l) u mężczyzn
i >40 mg/dl
(1,0 mmol/l) u kobiet
Leki stosować wg zasad podanych w rozdziale pt.
Leczenie hiperlipidemii
Kontrola ciśnienia tętniczego
Modyfikacja stylu życia - kontrola masy ciała,
zwiększona aktywność fizyczna, ograniczenie
spożycia soli i alkoholu u wszystkich z RRS >140
mmHg i/lub RRR >=90 mmHg
Cel: RR <140/90 mmHg
Dodać leki hipotensyjne, jeśli RRS nie obniży się
poniżej 140 mmHg i/lub RRR poniżej 90 mmHg po
3 miesiącach leczenia niefarmakologicznego lub
jeśli od początku RRS >=160 mmHg i/lub RRR
>100 mmHg.
Kontrola masy ciała
Zastosować dietę i ustalony indywidualnie wysiłek
fizyczny u pacjentów z BMI >27 kg/m
2
.
Zmniejszenie masy ciała jest szczególnie ważne u
pacjentów z nadciśnieniem, zwiększonym
stężeniem trójglicerydów lub glukozy.
Aktywność fizyczna
Cel minimalny:
30-60 minut
Ustalić indywidualnie, biorąc pod uwagę wyniki
testu wysiłkowego. Zachęcić do uprawiania
umiarkowanej aktywności fizycznej przez 30-60

3-4 razy w tygodniu
minut 3-4 razy w tygodniu (np. szybki spacer,
marsz, jogging, jazda na rowerze lub inny wysiłek
tlenowy) z jednoczesnym zwiększeniem normalnej
dziennej aktywności (chodzenie żwawym krokiem,
korzystanie ze schodów, praca w ogrodzie).
Leki
przeciwpłytkowe/antykoagulanty
Kwas acetylosalicylowy 75-160 mg na dobę. Inne
preparaty przeciwpłytkowe w uzasadnionych
przypadkach. Leki przeciwkrzepliwe (pochodne
acenokumarolu) u chorych ze zwiększonym
ryzykiem zatorowo-zakrzepowym (po zawale
przedniej ściany powikłanym wytworzeniem
tętniaka ze skrzepliną, u chorych z serca i
incydentami zatorowo-zakrzepowymi w wywiadach
oraz z napadowym i utrwalonym migotaniem
przedsionków).
Leki beta-adrenolityczne
Chorzy po zawale serca, zwłaszcza z dusznicą
wysiłkową, nadciśnieniem tętniczym i
niewydolnością serca.
Inhibitory enzymu
konwertującego angiotensynę
Chorzy po zawale i/lub z niewydolnością serca,
szczególnie z EF <=40% oraz osoby z
nadciśnieniem tętniczym.
Modyfikacja wg American Heart Association (Circulation 1995, 26, 291-293)
Objaśnienia użytych skrótów: chol - cholesterol, TG - trójglicerydy, RR - ciśnienie
tętnicze, RRS - ciśnienie tętnicze skurczowe, RRR - ciśnienie tętnicze rozkurczowe, BMI
- wskaźnik masy ciała, EF - frakcja wyrzutowa lewej komory
PROFILAKTYKA CHOROBY NIEDOKRWIENNEJ SERCA
Rekomendacje Komisji Profilaktyki
Polskiego Towarzystwa Kardiologicznego
8. PIŚMIENNICTWO
1. Rywik S., Broda G.: Epidemiologia chorób układu krążenia - wygrywamy czy
przegrywamy. W: Aktualne problemy zdrowotne. Zagrożenia i szanse. Pod red. H.
Kirschnera i J. Kopczyńskiego. Wydawnictwo IGNIS, Warszawa, 1999. - 2. Coronary
Heart Disease: Reducing the Risk. The scientific background for primary and secondary
prevention of coronary heart disease. The International Task Force for Prevention of
Coronary Heart Disease in cooperation with the International Atherosclerosis Society.
Nutr. Metab. Cardiovasc. Dis. 1998, 8, 205-271. - 3. Prevention of coronary heart
disease in clinical practice. Recommendations of the Second Joint Task Force of
European and other Societies on Coronary Prevention. Eur. Heart J. 1998, 19, 1434-
1503. - 4. Polskie Towarzystwo Kardiologiczne. Standardy postępowania w chorobach
układu krążenia. Kardiol. Pol., 1997, 46, Supl. 1. - 5. Sekuła W., Niedziałek Z., Figurska
K. i wsp.: Spożycie żywności w Polsce w latach 1950-1996 w przeliczeniu na energię i
składniki odżywcze. Prace Instytutu śywności i śywienia Nr 84, Warszawa, 1997. - 6.
Szostak W. B., Cybulska B.: Racjonalne żywienie w profilaktyce miażdżycy - mniej
smarujesz szybciej dojedziesz do Unii Europejskiej. Med. Metab., 1999, 3, 5-9. - 7.

Szostak W. B., Cybulska B.: śywienie - zagrożenia i szanse poprawy zdrowotności
społecznej. W: Aktualne problemy zdrowotne. Zagrożenia i szanse. Pod red H.
Kirschnera i J. Kopczyńskiego. Wydawnictwo IGNIS, Warszawa, 1999. - 8. Sekuła W.,
Lagion P., Morawska M. i wsp.: A comparison of the food and health in Greece and
Poland. śyw. Człow. Metab., 1997, 24, 3-16. - 9. Program Pol-Monica Warszawa.
Kompleksowa ocena stanu zdrowia ludności Warszawy w roku 1993 i jego zmian w
latach 1984-1993. Część VI. Podstawowe wyniki oceny sposobu żywienia populacji
prawobrzeżnej Warszawy. Instytut Kardiologii. Warszawa, 1995. - 10. Pająk A. i wsp.:
Wyniki badań przekrojowych przeprowadzonych w latach 1983-1984, 1987-1988 i 1992-
1993 w populacji mężczyzn i kobiet w wieku 35-64 lat, mieszkańców województwa
tarnobrzeskiego. Projekt Pol-Monica Kraków (dane niepublikowane). - 11. Diet, nutrition
and the prevention of chronic diseases. WHO Technical Report Series 797, World Health
Organization, Geneva, 1990. - 12. Program Pol-Monica Warszawa. Kompleksowa ocena
stanu zdrowia ludności Warszawy w roku 1993 i jego zmian w latach 1984-1993. Część
V. Podstawowe wyniki trzeciego badania przekrojowego przeprowadzonego w 1993 roku
oraz 10-letnie trendy poziomu czynników ryzyka w populacji prawobrzeżnej Warszawy
(1984-1993). Instytut Kardiologii, Warszawa, 1995. - 13. Pająk A.: Contribution of
smoking. East-West Life Expectancy Gap in Europe. Environmental and Non-
Environmental Determinants. Pod red. C. Hertzman, S. Kelly, M. Bobak. Kulwer
Academic Publishers, 1995, 109-118. - 14. Zatoński W.: Rozwój sytuacji zdrowotnej w
Polsce po roku 1988. Centrum Onkologii - Instytut im. Marii Skłodowskiej-Curie. Zakład
Epidemiologii i Prewencji Nowotworów. Warszawa, 1996. - 15. Pająk A., Broda G.,
Kawalec E. i wsp.: Constitutional, biochemical and lifestyle correlates of fibrinogen and
factor VII activity in Polish urban and rural populations. Int. J. Epidemiol. 1998, 27, 953-
960. - 16. Pająk A., Jamrozik E., Kawalec E. i wsp.: Zawał serca - zagrożenia i
postępowanie. Długofalowa obserwacja populacji 280 000 kobiet i mężczyzn - Projekt
Pol-Monica Kraków. Część III. Epidemiologia i leczenie zawału serca. Przegl. Lek.
1996,53, 767-778. - 17. Pasternak R. C., Grundy S. M., Levy D. i wsp.: Task Force 3.
Spectrum of risk factors for coronary heart disease. JACC, 1996, 27, 978-990. - 18.
Hulley S., Grady D., Bush T. i wsp.: Randomized trial of estrogen plus progestin for
secondary prevention of coronary heart disease in postmenopausal women. JAMA,
1998, 280, 605-613. - 19. Frick M. H., Elo O., Haapa K. i wsp.: Helsinki Heart Study:
primary-prevention trial with gemfibrozil in middle aged men with dyslipidemia. Safety of
treatment, changes in risk factors, and incidence of coronary heart disease. N. Engl. J.
Med. 1987, 317, 1237-1245. - 20. Shepherd J., Cobbe S. M., Ford I. i wsp.: for the West
of Scotland Coronary Prevention Study Group. Prevention of coronary heart disease with
pravastatin in men with hypercholesterolemia. N. Engl. J. Med. 1995, 333, 1301-1307. -
21. Downs J. R., Clearfield M., Weis S. i wsp.: for the AFCAPS/TexCAPS Research
Group. Primary prevention of acute coronary events with lovastatin in men and women
with average cholesterol levels. JAMA, 1998, 279, 1615-1622. - 22. Scandinavian
Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444
patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S).
Lancet 1994, 344, 1383-1389. - 23. Sacks F. M., Pfeffer M. A., Moye L. A. i wsp.: for the
Cholesterol and Reccurent Events Trial Investigators. The effect of pravastatin on
coronary events after myocardial infarction in patients with average cholesterol levels. N.
Engl. J. Med. 1996, 335, 1001-1009. - 24. Prevention of cardiovascular events and death
with pravastatin in patients with coronary heart disease and a broad range of initial
cholesterol levels. The Long-term Intervention with Pravastatin in Ischaemic Disease
(LIPID) Study Group. N. Engl. J. Med. 1998, 339, 1349-1357. - 25. Rubins H. B., Robins
S. J., Collins D. i wsp.: Gemfibrozil for the secondary prevention of coronary heart
disease in men with low levels of high-density lipoprotein cholesterol. N. Engl. J. Med.
1999, 341, 410-418. - 26. Ericsson C. G., Hemsten A., Nilsson J. i wsp.: Angiographic
assessment of effects of bezafibrate on progression of coronary artery disease in young
male postinfarction patients. Lancet 1996, 347, 839-853. - 27. Waters D., Higginson L.,
Gladstone P. i wsp.: Effects of monotherapy with an HMG-CoA reductase inhibitor on the
progression of coronary atherosclerosis as assessed by serial quantitative arteriography:
the Canadian Coronary Atherosclerosis Intervention Trial. Circulation 1994, 89, 959-968.
- 28. Blankenhorn D. H., Nessim S. A., Johnson R. L. i wsp.: Beneficial effects of
combined colestipol-niacin therapy on coronary atherosclerosis and coronary venous
bypass grafts. JAMA 1987, 257, 3233-3240. - 29. Cashin-Hemphill L., Mack W. J.,

Pogoda J. M. i wsp.: Beneficial effects of colestipol-niacin on coronary atherosclerosis. A
4-year follow-up. JAMA 1990, 264, 3013-3017. - 30. Brown G., Albers J. J., Fisher L. D.,
Schaefer S. M. i wsp.: Regression of coronary artery disease as a result of intensive
lipid-lowering therapy in men with high levels of apolipoprotein B. N. Engl. J. Med. 1990,
323, 1289-1298. - 31. Ornish D., Brown S. E., Scherwitz L. W. i wsp.: Can life style
changes reverse coronary heart-disease? Lancet 1990, 336, 129-133. - 32. Frick M. H.,
Syvanne M., Nieminen M. S. i wsp.: Prevention of the angiographic progression of
coronary and vein-graft atherosclerosis by gemfibrozil after coronary bypass surgery in
men with low levels of HDL cholesterol. Circulation 1997, 96, 2137-2143. - 33. Herd J.
A., Ballantyne C. M., Farmer A. i wsp.: Effects of fluvastatin on coronary atherosclerosis
in patients with mild to moderate cholesterol elevations (Lipoprotein and Coronary
Atherosclerosis Study [LCAS]. Am. J. Cardiol. 1997, 80, 278-286. - 34. Ballantyne C. M.,
Herd A., Ferlic L. L. i wsp.: Influence of low HDL on progression of coronary artery
disease and response to fluvastatin therapy. Circulation 1999, 99, 736-743. - 35.
Blankenhorn D. H., Azen S. P., Kramsch D. M. i wsp.: Coronary angiographic changes
with lovastatin therapy - the Monitored Atherosclerosis Regression Study (MARS). Ann.
Intern. Med. 1993, 119, 969-976. - 36. Brensike J. F., Levy R. I., Kelsey S. F. i wsp.: :
Effects of therapy with cholestyramine and diet on progression of coronary
atherosclerosis: results of the NHLBI type II coronary intervention study. Circulation,
1984, 69, 313-324. - 37. Buchwald H., Varco R. L., Matts J. P. i wsp.: Effect of partial
ileal bypass surgery on mortality and morbidity from coronary heart disease in patients
with hypercholesterolemia. Report of the Program on the Surgical Control of the
Hyperlipidemias (POSCH). N. Engl. J. Med. 1990, 323, 946-955. - 38. Haskell W. L.,
Alderman E. L. Fair J. M. i wsp.: Effects of intesive multiple risk factor reduction on
coronary atherosclerosis and clinical cardiac events in men and women with coronary
artery disease. The Standford Coronary Risk Intervention Project. Circulation 1994, 84,
975-990. - 39. Watts G. F., Lewis B., Brunt J. N. H. i wsp.: Effects on coronary artery
disease of lipid-lowering diet, or diet plus cholestyramine, in the StThomas
Atherosclerosis Regression Study (STARS) Lancet 1992, 339, 129-133. - 40. Kane J. P.,
Malloy M. J., Ports T. A. i wsp.: Regression of coronary atherosclerosis during treatment
of familial hypercholesterolemia with combined drug regimens. JAMA 1990, 264, 3007-
3012. - 41. MacMahon S., Rodgers A.: The effects of antihypertensive treatment on
vascular disease: reappraisal of evidence in 1994. J. Vasc. Med. Biol. 1994, 4, 265-271.
- 42. Collins R., MacMahon S.: Blood pressure, antihypertensive drug treatment and the
risk of stroke and of the evidence in 1994. Br. Med. Bull. 1994, 50, 272-298. - 43. SHEP
Cooperative Research Group. Prevention of stroke by antihypertensive drug treatment in
older persons with isolated systolic hypertension: final results of Systolic Hypertension in
the Elderly Program (SHEP). JAMA 1991, 265, 3255-3264. - 44. Staessen J. A., Fagard
R., Thijs L. i wsp.: for the Systolic Hypertension in Europe (Syst-Eur) Trial Investigators.
Randomized double-blind comparison of placebo and active treatment for older patients
with isolated systolic hypertension. Lancet 1997, 350, 757-764. - 45. Gong L., Zhang W.,
Zhu Y. i wsp.: Shanghai trial of nifedipine in the elderly (STONE)). J. Hypertens. 1996,
14, 1237-1245. - 46. Liu L., Wang J. G., Liu G. i wsp.: for the systolic Hypertension in
China (Syst-China) Collaborative Group. Comparison of active treatment and placebo for
older Chinese patients with isolated systolic hypertension. J. Hypertens. 1998, 16, 1832-
1829. - 47. Hansson L., Lindholm L. H., Niskanen L. i wsp.: for the CAPPP Study Group.
Principal results of the Captopril Prevention Project (CAPPP). Lancet 1999, 353, 611-
616. - 48. Garg R., Yusuf S.: Overview of randomized trials of angiotensin-converting
enzyme inhibitors on mortality and morbidity in patients with heart failure JAMA 1995,
273, 1450-1456 (Erratum, JAMA 1995, 274, 462). - 49. The Heart Outcomes Prevention
Evaluation Study Investigators. Effects of an angiotensin converting-enzyme inhibitor,
ramipril, on cardiovascular events in high-risk patients. N. Engl. J. Med. 2000, 342, 145-
153. - 50. Yusuf S., Peto R., Lewis J. i wsp.: Beta blockade during and after myocardial
infarction: an overview of randomized trials. Prog. Cardiovasc. Dis. 1985, 27, 335-371. -
51. Ad Hoc Subcommittee of the Liaison Committee of the World Health Organization
and the International Society of Hypertension. Effect of calcium antagonists on the risk of
coronary heart disease, cancer and bleeding. J. Hypertens. 1997, 15, 105-115. - 52.
Hansson L., Zanchetti A., Curruthers S. G. i wsp.: for the HOT Study Group. Effects of
intensive blood pressure lowering and low-dose aspirin in patients with hypertension:
principal results of the Hypertension Optimal Treatment (HOT) randomized trial. Lancet

1998, 317, 703-713. - 53. Food, nutrition and cardiovascular disease prevention in
European Union. European Heart Network - position paper. June 1998. - 54. Grundy S.
M., Balady G. J., Criqui M. H. i wsp.: Primary prevention of coronary heart disease:
guidelines from Framingham. A statement for Health Care Professionals from the AHA
Task Force on Risk Reduction. Circulation 1998, 97, 1876-1887. - 55. Hopkins P. N.,
Hunt S. C., Wu L.L.: Hypertension, dyslipidemia, and insulin resistence: links in a chain
or spokes on a wheel? Curr. Opinion Lipidol. 1996, 7, 241-256. - 56. 1999 World Health
Organization - International Society of Hypertension Guidelines for the Management of
Hypertension. Guidelines Subcommittee J. Hypertens. 1999, 17, 151-183. - 57. Zasady
postępowania w nadciśnieniu tętniczym. Stanowisko Polskiego Towarzystwa
Nadciśnienia Tętniczego. Nadciśnienie Tętnicze 2000, 4, B1-B34. - 58. Definition,
diagnosis and classification of diabetes mellitus and its complications. Report of WHO
Consultation. Part 1. Diagnosis and Classification of Diabetes Mellitus. World Health
Organization. Geneva 1999. - 59. Haffner S. M., Lehto S., Ronnemaa T. i wsp.: Mortality
from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects
with and without prior myocardial infarction. N. Engl. J. Med. 1998, 339, 229-234. -
60.The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus.
Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus.
Diabetes Care 1999, 22 (suppl. 1), S5-S19. - 61. A desktop guide to type 2 diabetes
mellitus. European Diabetes Policy Group 1999. Diab. Med. 1999, 16, 716-730. - 62.
Measuring obesity-classification and description of anthropometric data. Report of WHO
consultation on the epidemiology of obesity. śyw. Człow. Metab. 1989, 16, 205-213. - 63.
Cichocka A., Cybulska B.: Homocysteina - mniej poznany czynnik ryzyka chorób
sercowo-naczyniowych. Med. Metab. 1999, 2, 42-51. - 64. Malinow M. R., Bostom A. G.,
Krauss R. M.: A statement for Health Professionals from Nutrition Committee, American
Heart Association. Circulation 1999, 99, 178-182. - 65. Levy D., Garrison R. J., Savage
D. D. i wsp.: Prognostic implications of echocardiographically determined left ventricular
mass in Framingham Heart Study. N. Eng. J. Med. 1990, 332, 1561-1566. - 66. Levy D.,
Anderson K. M., Savage D. D. i wsp.: Echocardiographically detected left ventricular
hypertrophy, prevalence and risk factors. The Framingham Heart Study. Ann. Intern.
Med. 1988, 108, 2-13. - 67. Kannel W. B.: Epidemiologiczne konsekwencje przerostu
lewej komory. W: Przerost lewej komory i jego regresja. Pod red. F. H. Messerliego.
Science Press Ltd, London. Copyright for Polish Edition, Via Medica, Gdańsk 1999. - 68.
Schmieder R. E., Martus P., Klingbeil A.: Reversal of left ventricular hypertrophy in
essential hypertension. JAMA 1996, 275, 1507-1513. - 69. Burr M., Fehily A., Gilber J. i
wsp.: Effects of changes in fat, fish and fibre intakes on death and myocardial
reinfarction: diet and reinfarction trial (DART). Lancet 1989, 8666, 757-761. - 70. Singh
R., Rastogi S., Verma R. i wsp.: Randomized controlled trial of cardioprotective diet in
patients with recent acute myocardial infarction: results of one year follow-up. Br. Med. J.
1992, 304, 1015-1019. - 71. de Logeril M., Renaud S., Mamelle N. i wsp.: Mediterranean
alpha-linolenic acid rich diet in secondary prevention of coronary heart disease. Lancet
1994, 8911, 1454-1459. - 72. de Logeril M., Salen P., Martin J.-L. i wsp.: Mediterranean
diet, traditional risk factos and the rate of cardiovascular complications after myocardial
infarction. Final report of the Lyon Diet Heart Study. Circulation 1999, 99, 779-785. - 73.
Stampfer M. J., Hennekens C. H., Manson J. E. i wsp.: Vitamin E consumption and the
risk of coronary heart disease in women. N. Engl. J. Med. 1993, 328, 1444-1449. - 74.
Rimm E. B., Stampfer M. J., Ascherio A. i wsp.: Vitamin E consumption and the risk of
coronary heart disease in men. N. Engl. J. Med. 1993, 328, 1450-1456. - 75. Rapola J.
M., Virtamo J., Ripatti S. i wsp.: Effect of vitamin E and beta carotene on the incidence of
angina pectoris. JAMA 1996, 275, 693-698. - 76. Stephens N. G., Parsons A., Schofield
P. M. i wsp.: Randomised controlled trial of vitamin E in patients with coronary heart
disease: Cambridge Heart Antioxidant Study (CHAOS). Lancet 1996, 347, 781-786. - 77.
The Heart Outcomes Prevention Evaluation Study Investigators. Vitamin E
supplementation and cardiovascular events in high-risk patients. N. Engl. J. Med. 2000,
324, 154-160. - 78. GISSI - Prevenzione Investigators (Gruppo Italiano per lo Studio
della Suprawivenza nell infarto miocardio. Dietary supplementation with n-3
plyunsaturated fatty acids and vitamin E after myocardial infarction: results GISSI-
Prevenzione Trial. Lancet 1999, 354, 447-455. - 79. Pedersen T. R.: Aggressive lipid
lowering therapy a clinical imperative. Eur. Heart J. 1998, 19, suppl. M, M15-M21. - 80.
White C. W.: Benefit of aggressive lipid lowering therapy: insights from the Post

Coronary Artery Bypass Graft Study and other trials. Am. J. Med. 1998, 105 (1A), 63S-
68S. - 81. Thompson G. R.: Handbook of hyperlipidemia. Current Science, London 1989.
- 82. Szostak W. B., Marianowski L., Kłosiewicz-Latoszek L. i wsp.: Stężenie
cholesterolu HDL, apolipoproteiny B, cholesterolu całkowitego (TC) i triglicerydów (TG)
we krwi pępowinowej. śyw. Człow. Metab. 1984, 9, 231-236. - 83. Kasteloot J., Ndam E.
C. N., Kowo M. i wsp.: Serum lipid levels in Pigmy and Bantu population sample from
Cameroon. Nutr. Met. Cardiovasc. Dis. 1997, 7, 383-387. - 84. Intersociety Commission
for Heart Disease Resources, Atherosclerosis Study Group. Primary prevention of the
atherosclerotic diseases. Circulation 1970, 42, A55-A95. - 85. Pit B., Waters D., Brown
W. V. i wsp.: Aggressive lipid-lowering therapy compared with angioplasty in stable
coronary artery disease. N. Engl. J. Med. 1999, 341, 70-76. - 86. Shiomi M., Ito T.,
Tsukada T. i wsp.: Reduction of serum cholesterol levels alters lesional composition of
atherosclerosis in mature WHHL rabbits. Arterioscler. Thromb. Vasc. Biol. 1995, 15,
1938-1944. - 87. Shiomi M., Ito T.: Effect of cerivastatin sodium, a new inhibitor of HMG-
CoA reductase on plasma lipid levels, progression of atherosclerosis, and the lesional
composition in plaques of WHHL rabbits. Br. J. Pharmacol. 1999, 126, 961-981. - 88.
Weissberg O. L.: Atherosclerosis involves more than just lipids: plaque dynamics. Eur
Heart J. 1999, 1, suppl. T, T14-T18. - 89. Koening W.: Atherosclerosis involves more
than just lipids: focus on inflammation. Eur. Heart J. 1999, 1, suppl. T, T19-T26. - 90.
Cybulska B., Szostak W. B.: Statyny w prewencji wtórnej choroby niedokrwiennej serca.
Med. po Dyplomie, 2000, Wydanie Specjalne, marzec-kwiecień, 67-76. - 91. Ridker P.
M., Rifai N., Pfeffer M. A. i wsp.: Longterm effects of pravastatin on plasma concentration
of C-reactive protein. Circulation 1999, 100, 230-235. - 92. Andrews T. C., Raby K.,
Barry J. i wsp.: Effect of cholesterol reduction on myocardial ischaemia in patients with
coronary disease. Circulation 1997, 95, 324-328. - 93. Mansur A. P., Amires J. A. R.,
Cramelli B. i wsp.: Effect of cholesterol lowering therapy on positive exercise testing in
patients with hypercholesterolemia and normal coronary angiograms. Circulation 1997,
96, I762. - 94. Wilde M. I., Spencer C. M.: Treatment of lipid disordes. Dis. Managem.
Health Outcomes, 1998, 3, 293-311. - 95. Secondary prevention by raising HDL
cholesterol and reducing triglicerides in patients with coronary artery disease. The
Bezafibrate Infarction Prevention (BIP) Study. Circulation 2000, 102, 21-27. - 96. Linton
M. R. F., Fazio S.: Re-emergence of fibrates in the management of dyslipidemia and
cardiovascular risk. Curr. Atheroscler. Reports, 2000, 2, 29-35. - 97. Rywik S.:
Epidemiologia nadciśnienia tętniczego. W: Nadciśnienie tętnicze. Pod red. W.
Januszewicza, M. Sznajdermana, E. Szczepańskiej-Sadowskiej, A. Januszewicza.
Medycyna Praktyczna (w druku). - 98. Rywik S., Davis C. E., Pająk A. i wsp.: Poland and
US Collaborative study on Cardiovascular Epidemiology. Hypertension in the community:
prevalence, awareness, treatment and control of hypertension in the Pol-MONICA
Project and the US Atherosclerosis Risk in Community Study. Ann. Epidemiol. 1998, 8,
3-13. - 99. Intensive glucose control with sulphonylureas or insulin, compared with
conventional treatment and risk complications in patients with type 2 diabetes (UKPDS-
33). Lancet 1998, 352, 837-853. - 100. Effect of intensive blood glucose control with
metformin on complications of overweight patients with type 2 diabetes (UKPDS-34).
Lancet 1998, 352, 854-865. - 101. American Diabetes Association. Management of
dyslipidemia in adults with diabetes. Diabetes Care, 2000, 23, suppl. 1, S57-S60. - 102.
Haffner S. M., Alexander C. M., Cook T. J.: Reduced coronary heart disease and
diabetes or impaired fasting glucose levels. Subgroup Analyses in Scandinavian
Simvastatin Survival Study. Arch. Intern. Med. 1999, 159, 2661-2667. - 103. Goldberg R.
B., Mellus M. J., Sacks F. M. i wsp.: for the CARE investigators Cardiovascular events
and their reduction with pravastatin in diabetes and glucose intolerant myocardial
survivors with average cholesterol levels: subgroup analyses in Cholesterol and
Recurrent Events (CARE) trial. Circulation 1998, 98, 2513-2519. - 104. Elkels R. S.,
Diamond J. R., Poulter C. i wsp.: Cardiovascular outcomes in type 2 diabetes. A double-
blind placebo - controlled study of bezafibrate: the St. Marys, Ealing, Nortwick Park
Diabetes Cardiovascular Disease Prevention (SENDCAP) Study. Diabetes Care 1998,
21, 641-648.

Wyszukiwarka
Podobne podstrony:
Żywienie, Zalecenia dietetyczne w profilaktyce choroby niedokrwiennej serca, Zalecenia dietetyczne w
Profilaktyka choroby niedokrwiennej serca
PROFILAKTYKA CHOROBY NIEDOKRWIENNEJ SERCA
Choroba niedokrwienna serca
49 CHOROBA NIEDOKRWIENNA SERCA
wykład choroba niedokrwienna serca
Czynniki ryzyka choroby niedokrwiennej serca cz
Stres a rozwój choroby niedokrwiennej serca
Choroba niedokrwienna serca ppt 2009 ppt
Choroba niedokrwienna serca
LEKI W CHOROBIE NIEDOKRWIENNEJ SERCA
więcej podobnych podstron