
1
Cukry proste i zło
ż
one
Wyci
ą
g z kart charakterystyki substancji niebezpiecznych
-
α
-naftol – T+
-
etanol 96% – F
-
kwas siarkowy – C
-
benzydyna – T, N, R/M1
-
kwas octowy – C
-
kwas solny – C
-
odczynniki Fehlinga I – N
-
odczynniki Fehlinga II – C
-
odczynnik Nylandera – C
-
rezorcyna – Xn, N
-
odczynnik Benedicta – Xn
-
kwas siarkowy – C
-
kwas solny – C
Cukry proste (monosacharydy, jednocukry) to najprostsze w
ę
glowodany. S
ą
one syntetyzowane w
organizmach samo
ż
ywnych w procesie fotosyntezy i chemosyntezy. Ich nazewnictwo chemiczne opiera si
ę
na ilo
ś
ci atomów w
ę
gla w cz
ą
steczce, których mo
ż
e by
ć
od 3 do 7. St
ą
d mówimy o triozach posiadaj
ą
cych
3 atomy w
ę
gla i konsekwentnie o tetrozach, pentozach (zwyczajowe nazwy: arabinoza, ksyloza, ryboza),
heksozach (zwyczajowo: glukoza, fruktoza, galaktoza, mannoza) i heptozach, które maj
ą
odpowiednio 4, 5,
6 i 7 atomów w
ę
gla. Ogólny, sumaryczny wzór cz
ą
steczki monosacharydu to C
n
H
2n
O
n
. Ze wzgl
ę
du na
klasyfikacje chemiczn
ą
monocukry nale
żą
do polihydroksyketonów lub polihydroksyaldehydów, w
zale
ż
no
ś
ci od wyst
ę
puj
ą
cej w cz
ą
steczce grupy ketonowej lub aldehydowej. Charakterystyczna jest tak
ż
e
obecno
ść
w cz
ą
steczce cukru asymetrycznych atomów w
ę
gla, które poł
ą
czone z 4 ro
ż
nymi podstawnikami,
tworz
ą
tzw. centra chiralno
ś
ci. Efektem tego jest wyst
ę
powanie cz
ą
steczek cukrów w formach
stereoizomerów.
Charakterystyka fizykochemiczna: monosacharydy s
ą
substancjami krystalicznymi, bez zapachu, o
słodkim smaku. Dobrze rozpuszczaj
ą
si
ę
w wodzie a słabo w alkoholu etylowym. Daj
ą
reakcje wła
ś
ciwe
aldehydom i ketonom, np. redukuj
ą
odczynniki Tollensa i Fehlinga, utleniaj
ą
c si
ę
do kwasów aldonowych
(D-glukoza do kwasu D-glukonowego), redukowane tworz
ą
alditole (np. D-glukoza — sorbitol), z alkoholami
lub fenolami tworz
ą
glikozydy, a z innymi cz
ą
steczkami sacharydów — di-, oligo- lub polisacharydy;
monosacharydy ulegaj
ą
tak
ż
e reakcjom wła
ś
ciwym alkoholom — tworz
ą
estry z kwasami (np. glukozo-6-
fosforan), utleniaj
ą
si
ę
do kwasu uronowego (np. kwas glukuronowy). Wchodz
ą
tak
ż
e w skład glikolipidów,
glikoprotein oraz kwasów nukleinowych.
Cz
ą
steczki cukrów zło
ż
onych s
ą
budowane z 2 lub wi
ę
cej cz
ą
steczek monosacharydów poł
ą
czonych
wi
ą
zaniami glikozydowymi. W zale
ż
no
ś
ci od ilo
ś
ci buduj
ą
cych je jednostek cukrowych mówi si
ę
o:
oligosacharydach – zbudowane z 2-10 monosacharydów (po
ś
ród nich wyró
ż
nia si
ę
disacharydy –
zbudowane z dwóch monosacharydów) oraz polisacharydach – zbudowane z ponad 10 monosacharydów.
Cz
ą
steczki polisacharydów mog
ą
by
ć
proste lub rozgał
ę
zione. Poszczególne jednostki cukrowe poł
ą
czone
s
ą
w ła
ń
cuchu głównym wi
ą
zaniami typu
α
(1-4)- lub
β
(1-4)-glikozydowego a rozgał
ę
zienia powstaj
ą
przez
tworzenie wi
ą
za
ń
α
(1-6)-glikozydowych. Podczas hydrolizy wielocukry rozpadaj
ą
si
ę
na prostsze jednostki
cukrowe np. dekstryny (rozpad skrobi) lub celobioz
ę
(hydroliza celulozy) a ostatecznie na cukry proste.
Skrobia jest powszechnym materiałem zapasowym w komórkach ro
ś
linnych i dobrym
ź
ródłem energii dla
organizmów zwierz
ę
cych. Jest polisacharydem nie rozpuszczalnym w wodzie. Skrobia zawieszona w
wodzie po podgrzaniu p
ę
cznieje a jej ziarna ulegaj
ą
rozpadowi na rozpuszczaln
ą
w wodzie amyloz
ę
i
nierozpuszczaln
ą
amylopektyn
ę
, która w tych warunkach p
ę
cznieje, co decyduje o kleistej konsystencji
roztworu. Skrobia ulega hydrolizie pod wpływem st
ęż
onych kwasów natomiast w organizmach
ż
ywych za
rozpad ten prowadz
ą
amylazy – enzymy z klasy hydrolaz. Rozró
ż
nia si
ę
2 typy amylaz: endo- i
egzoamylazy. Do endoamylaz nale
ż
y
α
-amylaza (4-glukohydrolaza
α
1,4-glukanu), która rozcina cz
ą
steczk
ę
skrobi wewn
ą
trz ła
ń
cucha tworz
ą
c cz
ą
steczki o krótszych ła
ń
cuchach, tzw. dekstryny. Jedn
ą
z egzoamylaz
jest
β-
amylaza, odcinaj
ą
ca od nieredukuj
ą
cego ko
ń
ca ła
ń
cucha skrobi cz
ą
steczki maltozy.
Literatura:
„Biochemia” J. Berg, J. Tymoczko, L. Stryer, PWN, 2005
„Biochemia Harpera” R.K. Murray i in., Wydanictwo Lekarskie PZWL, 2006
Analiza jako
ś
ciowa monosacharydów
1. Reakcje kondensacji
Pod wpływem st
ęż
onych kwasów nieorganicznych cukry ulegaj
ą
dehydratacji z utworzeniem pochodnych
furfuralowych, przy czym heksozy tworz
ą
5-hydroksymetylenofurfural, a pentozy – furfural. Powstałe
zwi
ą
zki kondensuj
ą
z fenolami, chinonami czy aminami aromatycznymi tworz
ą
c poł
ą
czenia
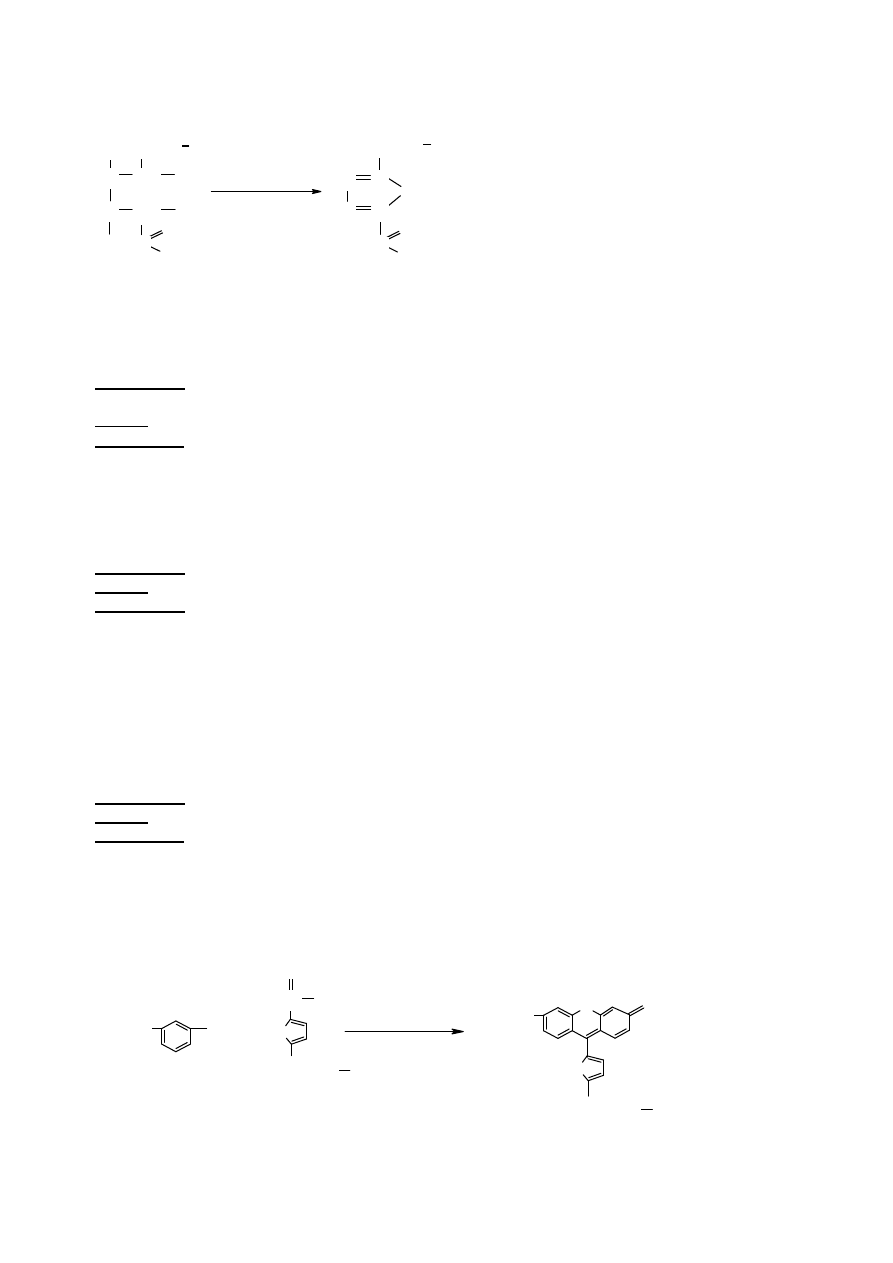
2
triarylometanowe o charakterystycznym zabarwieniu. Reakcje te s
ą
wykorzystywane do identyfikacji,
ró
ż
nicowania i oznacze
ń
ilo
ś
ciowych cukrów.
Dehydratacja
C
O
C
O
HC
HC
OH
OH
CH
OH
H (lub
CH
OH
HC
HC
C
C
O
H
H
+
- 3 H
2
O
H
H
pentoza (lub heksoza)
furfural (lub 5-hydroksymetylenofurfural)
CH
2
OH)
(lub
CH
2
OH)
1.1 Reakcja Molischa (kondensacja z fenolem)
Jest to najbardziej ogólna reakcja wykrywaj
ą
ca cukry i to zarówno te wolne jak i zwi
ą
zane. Jest jednak mało
specyficzna, gdy
ż
jej dodatni wynik mo
ż
e równie
ż
ś
wiadczy
ć
o obecno
ś
ci aldehydów i ketonów.
odczynniki: 1% glukoza, 20%
α
-naftol w 95% etanolu (przechowywa
ć
w ciemno
ś
ci w temp.
pokojowej), st
ęż
. H
2
SO
4
sprz
ę
t: 1 probówka szklana długa, pipeta szklana, pipety automatyczne, worteks
wykonanie: do 1 ml roztworu glukozy doda
ć
0,5 ml
ś
wie
ż
o przygotowanego roztworu
α
-naftolu i
wymiesza
ć
. Nast
ę
pnie podwarstwi
ć
1 ml st
ęż
onego H
2
SO
4
, nie miesza
ć
(do pipetowania
st
ęż
onego H
2
SO
4
u
ż
ywa
ć
szklanej pipety Pasteur’a). Na granicy faz pojawia si
ę
fiołkowo-
malinowe zabarwienie.
1.2 Reakcja Taubera (kondensacja z benzydyn
ą
– amin
ą
aromatyczn
ą
)
odczynniki: 0,5% arabinoza, 1% glukoza, 4% benzydyna w lodowatym kwasie octowym
sprz
ę
t: 2 probówki szklane długie, pipety automatyczne, worteks
wykonanie: do dwóch probówek odpipetowa
ć
po 0,5 ml roztworu benzydyny. Do jednej probówki
doda
ć
1 ml roztworu arabinozy, a do drugiej 1 ml roztworu glukozy, wymiesza
ć
i ogrzewa
ć
do
wrzenia. Pentozy w tych warunkach daj
ą
zabarwienie czerwone, a heksozy
ż
ółte lub brunatne.
1.3 Reakcja Seliwanowa (kondensacja z rezorcyn
ą
– fenodiol)
Pozwala na odró
ż
nienie aldoz od ketoz. Wa
ż
ne jest zachowanie odpowiednich warunków reakcji, tzn.:
st
ęż
enie u
ż
ytego kwasu solnego powinno wynosi
ć
12% a czas ogrzewania - 30 sekund. W tych warunkach
ketozy przechodz
ą
w hydroksymetylenofurfural, natomiast aldozy pozostaj
ą
niezmienione. Je
ż
eli u
ż
yje si
ę
bardziej st
ęż
onego kwasu lub wydłu
ż
y czas ogrzewania, to wówczas aldozy równie
ż
ulegaj
ą
dehydratacji i
daj
ą
odczyn dodatni – pojawia si
ę
czerwono-wi
ś
niowe zabarwienie.
odczynniki: 0,5% fruktoza, 1% glukoza, st
ęż
ony HCl, rezorcyna kryst
sprz
ę
t: 3 probówki szklane długie, pipety automatyczne, ła
ź
nia wodna, szpatułka, stoper, worteks
wykonanie: do pierwszej probówki odpipetow
ć
1 ml roztworu fruktozy, a do drugiej i trzeciej
probówki po 1 ml roztworu glukozy. Do wszystkich probówek doda
ć
po 0,5 ml st
ęż
onego HCl
(otrzymuje si
ę
roztwór o st
ęż
eniu 12%), ogrza
ć
do wrzenia w ła
ź
ni wodnej, a nast
ę
pnie probówki
pierwsz
ą
i drug
ą
utrzymywa
ć
we wrzeniu przez 30 sekund, natomiast probówk
ę
trzeci
ą
utrzymywa
ć
we wrzeniu przez 3 min. Mieszaniny ostudzi
ć
, doda
ć
kilka kryształków rezorcyny i
ogrza
ć
do wrzenia w ła
ź
ni wodnej. Porówna
ć
wyniki dla obu roztworów cukrów.
O
O
O
2
+
C
O
H
H lub (
CH
2
OH)
lub (
CH
2
OH)
H
O
rezorcyna
czerwonowisniowy
furfural lub
hydroksymetylenofurfural
OH
HO
HO
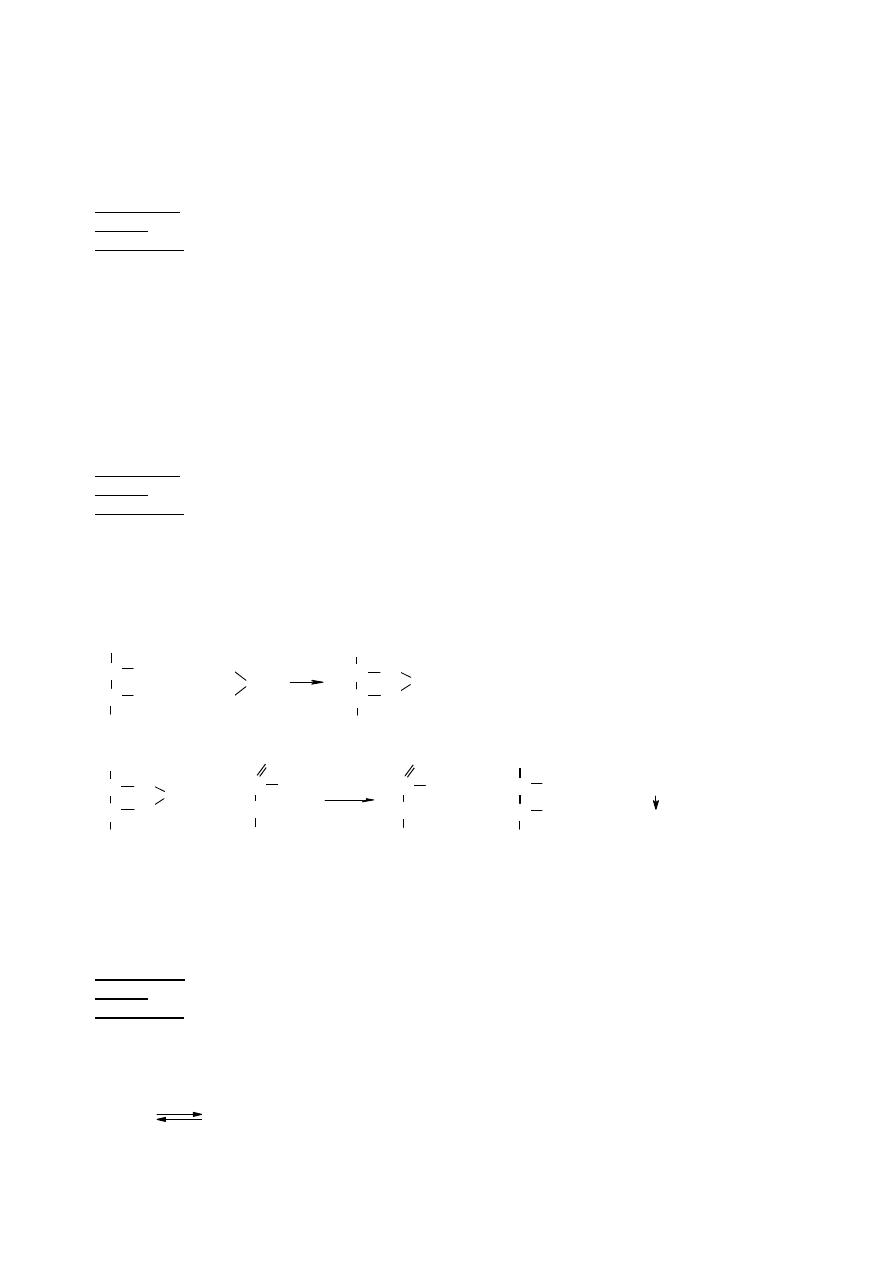
3
2. Wła
ś
ciwo
ś
ci redukcyjne cukrów
2.1 Próba Trommera
W próbie Trommera, w
ś
rodowisku alkalizowanym NaOH i w obecno
ś
ci CuSO
4
glukoza ulega utlenieniu do
kwasu glukonowego, a jony miedzi ulegaj
ą
redukcji z Cu
2+
do Cu
+
i powstaje brunatno zabarwiony osad
tlenku miedzi.
odczynniki: 1% glukoza, 0,5% fruktoza, 2M NaOH, 0,25M CuSO
4
sprz
ę
t: 2 długie probówki, ła
ź
nia wodna, pipety automatyczne
wykonanie: do jednej probówki odmierzy
ć
1 ml 1% roztworu glukozy a do drugiej - 1 ml 0,5%
roztworu fruktozy. Do obu probówek doda
ć
po 1 ml 2M NaOH, a nast
ę
pnie kroplami dodawa
ć
0,25M CuSO
4
jednocze
ś
nie ostro
ż
nie mieszaj
ą
c zawarto
ść
obu probówek. Zako
ń
czy
ć
dodawanie
CuSO
4
w momencie pojawienia si
ę
osadu w probówce. Obie probówki ogrzewa
ć
do wrzenia.
Zaobserwowa
ć
powstaj
ą
cy na dnie probówki brunatnoczerwony osad.
2.2 Odczyn Fehlinga
W odczynie Fehlinga redukcji ulegaj
ą
jony miedzi z Cu
2+
do Cu
+
. U
ż
ywa si
ę
odczynnika Fehlinga I, który
zawiera CuSO
4
oraz odczynnika Fehlinga II, który zawiera NaOH i winian sodowo-potasowy. Winian
sodowo-potasowy zapobiega wytr
ą
caniu si
ę
osadu Cu(OH)
2
, co mo
ż
e mie
ć
miejsce przy małym st
ęż
eniu
cukru. Sól ta wi
ąż
e jony Cu
2+
tworz
ą
c kompleksow
ą
sól kwasu winowego.
odczynniki: 1% glukoza, odczynnik Fehlinga I i II
sprz
ę
t: 2 długie probówki, palnik, worteks, pipety automatyczne
wykonanie: w jednej probówce zmiesza
ć
0,5 ml odczynnika Fehlinga I i 0,5 ml odczynnika
Fehlinga II. Do drugiej probówki nala
ć
1 ml roztworu glukozy. Zawarto
ść
obu probówek ogrzewa
ć
do wrzenia. Oba roztwory zla
ć
razem. Wyst
ę
puje zabarwienie lub brunatnoczerwony osad
wydzielonego Cu
2
O.
CuSO
4
+ 2NaOH
→
Cu(OH)
2
+ Na
2
SO
4
H C
H C
C O O K
O H
O H
H C
H C
O
O
C u
2 H
2
O
C O O K
C O O N a
C O O N a
+
H O
H O
C u
+
H C
H C
O
O
C u
C O O K
C O O N a
+
C
C H O H
R
H
O
+ H
2
O
C
C H O H
R
O H
O
+
H C
H C
C O O K
O H
O H
C O O N a
+
C u
2
O
c z e rw o n y o
o s a d
2.3 Odczyn Nylandera
Odczynnik Nylandera zawiera zasadowy azotan bizmutu, KOH i winian sodowo-potasowy, który spełnia tu
t
ę
sam
ą
rol
ę
, co w odczynie Felinga i co cytrynian w odczynie Benedicta. Pod wpływem cukrów redukcji
ulega Bi
3+
do Bi
0
.
odczynniki: 1% glukoza, odczynnik Nylandera
sprz
ę
t: probówka szklana długa, ła
ź
nia wodna, worteks, pipety automatyczne
wykonanie: do 5 ml 1% roztworu glukozy doda
ć
kilka kropel odczynnika Nylandera, wymiesza
ć
i
wstawi
ć
do wrz
ą
cej ła
ź
ni wodnej na 5 min. Wytr
ą
ca si
ę
czarny osad metalicznego bizmutu
Bi(OH)
2
NO
3
+ KOH
→
Bi(OH)
3
+ KNO
3
Bi(OH)
3
Bi
3+
+
3 OH
-
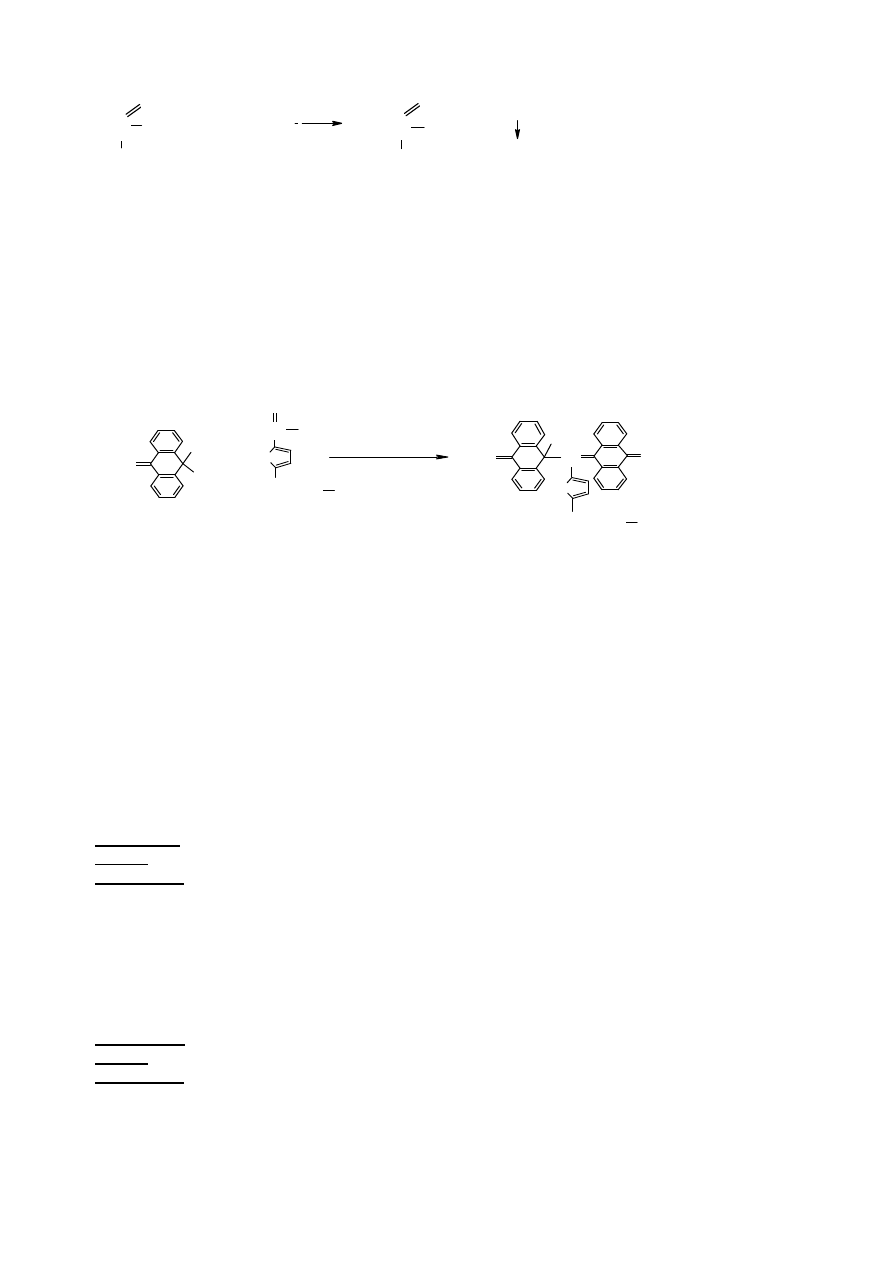
4
+ 2 Bi(OH)
3
winian
Na-K
+ 2 Bi
0
+ 3 H
2
O
OH
glukoza
kwas glukonowy
czarny osad
3 C
H
O
R
+
+
+
3 C
O
R
Oznaczanie ilo
ś
ciowe monocukrów
Metoda antronowa
Jest to kolorymetryczna metoda oznaczania zawarto
ś
ci cukru w roztworze wykorzystuj
ą
ca powstawanie
kompleksów pomi
ę
dzy furfuralowymi i hydroksymetylenofurfuralowymi pochodnymi cukrów a antronem.
Powstaj
ą
cy kompleks o barwie niebiesko-zielonej ma maksimum absorpcji przy długo
ś
ci fali 600 nm. Jest to
metoda niestechiometryczna wi
ę
c wymaga sporz
ą
dzenia krzywej kalibracyjnej.
O
O
2
+
C
O
H
H lu b (
C H
2
O H )
C
lu b (
C H
2
O H )
H
O
a n tro n
z ie lo n o n ie b ie sk i
fu r fu ra l lu b
h y d r o k s y m e ty le n o fu r fu r a l
O
H
H
H
O
Di- i polisacharydy - analiza jako
ś
ciowa
1. Odczyn Benedicta
W odczynie Benedicta redukcji ulegaj
ą
jony miedzi z Cu
2+
do Cu
+
. Odczynnik Benedicta zawiera CuSO
4
,
cytrynian trisodowy i Na
2
CO
3
. Cytrynian zapobiega wytr
ą
caniu si
ę
osadu Cu(OH)
2
, co mo
ż
e mie
ć
miejsce
przy małym st
ęż
eniu cukru. Zalkalizowanie za pomoc
ą
Na
2
CO
3
, a nie za pomoc
ą
NaOH powoduje,
ż
e
reakcja przebiega w pH nieco ni
ż
szym ni
ż
w próbie Fehlinga, w zwi
ą
zku z tym jony Cu
2+
nie s
ą
w tych
warunkach redukowane przez szereg zwi
ą
zków daj
ą
cych dodatni odczyn Fehlinga (kreatynina, kwas
moczowy). Reakcja Benedicta jest wi
ę
c bardziej specyficzna dla cukrów ni
ż
odczyn Fehlinga.
odczynniki: 0,5% glukoza, 0,5% maltoza, 0,5% laktoza, 0,5% sacharoza, odczynnik Benedicta.
sprz
ę
t: 4 probówki szklane długie, ła
ź
nia wodna, worteks, stoper, pipety automatyczne
wykonanie: do czterech probówek odpipetowa
ć
po 0,25 ml odczynnika Benedicta. Do ka
ż
dej z
nich doda
ć
po kilka kropli odpowiedniego roztworu cukru, wymiesza
ć
i wstawi
ć
do wrz
ą
cej ła
ź
ni
wodnej na 3-5 min. Po ozi
ę
bieniu wytr
ą
ca si
ę
pomara
ń
czowoczerwony osad Cu
2
O.
2. Hydroliza sacharozy
Sacharoza jest disacharydem składa si
ę
z cz
ą
steczki
α
-glukopiranozy i cz
ą
steczki
β
-fruktofuranozy. Pod
wpływem kationów H
+
i podwy
ż
szonej temperatury sacharoza rozpada si
ę
na monosacharydy (glukoz
ę
i fruktoz
ę
)
odczynniki: 0,5% sacharoza, 2 M HCl, 2 M NaOH
sprz
ę
t: 3 probówki szklane, ła
ź
nia wodna, worteks, stoper, pipety automatyczne
wykonanie: w probówce umie
ś
ci
ć
2 ml roztworu sacharozy, doda
ć
0,6 ml 2M roztworu HCl,
wstawi
ć
do wrz
ą
cej ła
ź
ni wodnej na 10 min. Po ochłodzeniu zoboj
ę
tni
ć
dodaj
ą
c 0,8 ml 2 M
roztworu NaOH.
Na zoboj
ę
tnionym hydrolizacie przeprowadzi
ć
reakcje Benedicta i Seliwanowa.
5
3. Analiza jako
ś
ciowa polisacharydów (reakcja z jodem)
Skrobia składa si
ę
z dwóch wielocukrów: amylozy i amylopektyny, które s
ą
zbudowane z poł
ą
czonych reszt
α
-D-glukopiranozy. Amyloza tworzy ła
ń
cuchy proste, w których cz
ą
steczki glukozy poł
ą
czone s
ą
ze sob
ą
wi
ą
zaniem
α
(1-4)-glikozydowym. Natomiast amylopektyna charakteryzuje si
ę
budow
ą
rozgał
ę
zion
ą
; oprócz
wi
ą
zania
α
(1-4) co 25-30 reszt glukozowych w głównym la
ń
cuchu wyst
ę
puj
ą
wi
ą
zania
α
(1-6), tworz
ą
ce
punkty rozgał
ę
zienia. W tych miejscach formuj
ą
si
ę
ła
ń
cuchy boczne zbudowane z 30-50 reszt
glukozowych. Z budowy wynikaj
ą
odmienne wła
ś
ciwo
ś
ci fizyczne obu wielocukrów. Amyloza barwi si
ę
jodem na kolor niebieski, a amylopektyna na fioletowy. Amyloza o konfiguracji liniowej nie jest zdolna do
tworzenia kompleksów z jodem. Aby cz
ą
steczki jodu mogły si
ę
wi
ą
za
ć
z cz
ą
steczk
ą
wielocukru musi ona
przyj
ąć
konfiguracj
ę
helisy, w której cz
ą
steczki jodu regularnie si
ę
rozło
żą
. Jedna cz
ą
steczka jodu przypada
wówczas na sze
ść
reszt glukozowych, czyli na jeden skr
ę
t helisy.
Glikogen podobnie jak skrobia zbudowany jest z
α
-D-glukopiranozy. W porównaniu ze skrobi
ą
składa si
ę
on z wi
ę
kszej liczby monomerów i tworzy bardziej rozgał
ę
zion
ą
helis
ę
. Rozgał
ę
zienia wyst
ę
puj
ą
w ła
ń
cuchu
przeci
ę
tnie, co dziesi
ęć
reszt glukozowych i zbudowane s
ą
z 10 – 20 monomerów glukozy.
Skrobia tworzy z jodem poł
ą
czenie fioletowo-niebieskie, za
ś
w przypadku glikogenu barwa pozostaje
brunatna.
odczynniki: 1% kleik skrobiowy, 1% glikogen, płyn Lugola
sprz
ę
t: 2 probówki długie, pipety automatyczne
wykonanie: do jednej probówki wla
ć
1 ml roztworu skrobi, a do drugiej 1 ml roztworu glikogenu.
Do obu probówek doda
ć
po 1 kropli silnie rozcie
ń
czonego roztworu jodu w jodku potasu (płyn
Lugola – barwa słomkowa)
4. Wpływ temperatury na reakcj
ę
skrobi i glikogenu z jodem
Barwa skrobi i glikogenu z jodem jest trwała w temperaturze pokojowej. Ogrzewanie powoduje rozkr
ę
cenie
si
ę
heliksu, adsorpcja jodu nie jest mo
ż
liwa, w efekcie zabarwienie znika. Jest to zjawisko odwracane.
sprz
ę
t: ła
ź
nia wodna
wykonanie: probówki z poprzedniego
ć
wiczenia zawieraj
ą
ce skrobi
ę
i glikogen, zabarwione
jodem, ogrza
ć
do wrzenia. Barwa zanika. Powraca ona po ozi
ę
bieniu probówek w strumieniu
zimnej wody.
5. Kwa
ś
na hydroliza skrobi
Podczas hydrolizy skrobia ulega rozpadowi na prostsze cukrowce, w
ś
ród których mo
ż
na wyró
ż
ni
ć
nast
ę
puj
ą
ce stadia po
ś
rednie:
a) stadium dekstryn (polisacharydy), w
ś
ród których wyró
ż
nia si
ę
kolejno: amylodekstryny barwiace
si
ę
jodem na kolor niebiesko-fioletowy, erytrodekstryny barwi
ą
ce si
ę
jodem na kolor brunatno-
czerwony, achrodekstryny nie daj
ą
ce z jodem zabarwienia
b) stadium maltozy i izomaltozy (disacharydy)
c) stadium glukozy (monosacharyd)
odczynniki: płyn Lugola, odczynnik Benedicta, 2 M NaOH, 1% kleik skrobiowy, 1 M H
2
SO
4
,
sprz
ę
t: 20 probówek szklanych długich, statyw, erlenmayerka, cylinder miarowy, ła
ź
nia wodna,
pipety, stoper
wykonanie: przygotowa
ć
20 probówek, ustawiaj
ą
c je w statywie w dwóch szeregach. Do jednego
szeregu probówek doda
ć
do ka
ż
dej po 5 kropli rozcie
ń
czonego roztworu jodu w jodku potasu
(płyn Lugola), a do drugiego szeregu po 0,75 ml 2 M roztworu NaOH. Do erlenmayerki odmierzy
ć
30 ml 1% roztworu kleiku skrobiowego i doda
ć
20 ml 1 M H
2
SO
4
; wymiesza
ć
i pobra
ć
2 ml płynu
do pierwszej probówki z płynem Lugola i 2 ml płynu do pierwszej probówki z roztworem NaOH.
Zawarto
ść
erlenmayerki ogrzewa
ć
we wrz
ą
cej ła
ź
ni wodnej; co 2 minuty pobiera
ć
po 2 ml płynu
i rozlewa
ć
do uprzednio przygotowanych probówek, zawieraj
ą
cych płyn Lugola i roztwór NaOH.
Hydroliz
ę
prowadzi
ć
do czasu a
ż
barwa z jodem zaniknie. Do szeregu probówek z roztworem
NaOH doda
ć
po 0,5 ml odczynnika Benedicta i gotowa
ć
przez 3-5 min w ła
ź
ni wodnej.
Obserwuj
ą
c zmiany barwy wyró
ż
ni
ć
stadia hydrolizy skrobi. Okre
ś
li
ć
etap, w którym pojawiaj
ą
si
ę
cukry redukuj
ą
ce.
6
6. Badanie aktywno
ś
ci
α
-amylazy
ś
liny
α
-Amylaza
ś
liny prowadzi reakcj
ę
rozpadu skrobi na dekstryny, podobnie jak ma to miejsce w przypadku
kwa
ś
nej hydrolizy. W efekcie tego w roztworze nie powstaj
ą
niebiesko zabarwione kompleksy skrobi z
jodem.
6.1 Wpływ temperatury
odczynniki: płyn Lugola, 1% kleik skrobiowy
sprz
ę
t: 4 probówki szklane krótkie, 3 probówki wirownicze na 2 ml, statyw, zlewka, mieszadło
magnetyczne, ła
ź
nia wodna, pipety, stoper
wykonanie:
Roztwór amylazy
ś
liny: wod
ę
podgrza
ć
do temperatury 40
°
C
w ła
ź
ni wodnej. Tak przygotowan
ą
wod
ą
wst
ę
pnie przepłuka
ć
usta, a nast
ę
pnie pobra
ć
kilka mililitrów wody do ust i płuka
ć
nimi usta
przez kilka minut. Roztwór
ś
liny wyplu
ć
do zlewki.
Oznaczanie aktywno
ś
ci: do probówki odebra
ć
3 ml uprzednio przygotowanego roztworu amylazy
ś
liny i ogrzewa
ć
przez 10 min we wrz
ą
cej ła
ź
ni wodnej. Nast
ę
pnie do trzech probówek odmierzy
ć
po 1 ml 1% zawiesiny skrobi (stale mieszaj
ą
cej si
ę
na mieszadle magnetycznym). Do pierwszej
probówki doda
ć
1 ml wyj
ś
ciowego roztworu amylazy, do drugiej – 1 ml ogrzewanego roztwór
amylazy, a do trzeciej kilka kropel wody. Prowadzi
ć
inkubacj
ę
przez 15 min w temperaturze 38°C,
w ła
ź
ni wodnej. Nast
ę
pnie probówki ostudzi
ć
w zlewce z zimn
ą
wod
ą
i do wszystkich doda
ć
po
kropli roztworu jodu w postaci płynu Lugola. Zawarto
ść
probówek przenie
ść
do probówek
wirowniczych na 2 ml i zwirowa
ć
przez 3 min. Porówna
ć
ilo
ść
otrzymanego osadu i wyci
ą
gn
ąć
wnioski o aktywno
ś
ci amylazy w poszczególnych próbkach.
6.2 Specyficzno
ść
substratowa
odczynniki: 1% kleik skrobiowy, 1% sacharoza
sprz
ę
t: 3 probówki szklane krótkie, statyw, zlewka, mieszadło magnetyczne, ła
ź
nia wodna,
pipety, stoper
wykonanie: do dwóch probówek odmierzy
ć
po 1ml roztworu amylazy
ś
liny. Do jednej doda
ć
1 ml
1% zawiesiny skrobi (stale mieszaj
ą
cej si
ę
na mieszadle magnetycznym), do drugiej – 1 ml 1%
roztworu sacharozy. Cało
ść
inkubowa
ć
przez 15 min w temperaturze 38°C, w ła
ź
ni wodnej.
Nast
ę
pnie probówki ostudzi
ć
i na obu roztworach przeprowadzi
ć
reakcj
ę
Trommera (patrz instr.
Cukry proste).
7. Reakcja celulozy z jodem
Zwarta struktura włókien celulozowych uniemo
ż
liwia trwał
ą
adsorpcj
ę
jodu. Pod wpływem jodu
pierwiastkowego włókna celulozowe barwi
ą
si
ę
na kolor
ż
ółtobrunatny, natomiast silnie p
ę
czniej
ą
w obecno
ś
ci kwasu siarkowego, co umo
ż
liwia wnikanie drobin jodu do wn
ę
trza micelli i jego adsorpcj
ę
na
cz
ą
steczkach celulozy. Powstaje wówczas intensywna barwa niebieska.
odczynniki: H
2
O dest., 60% H
2
SO
4
, płyn Lugola, lignina
sprz
ę
t: 2 szkiełka zegarkowe, pipety automatyczne, stoper
wykonanie: na dwóch szkiełkach zegarkowych umie
ś
ci
ć
skrawki ligniny. Jeden z nich zwil
ż
y
ć
1,5
ml wody destylowanej, a drugi 1,5 ml 60% roztworu H
2
SO
4
. Po upływie 2 minut oba skrawki
zabarwi
ć
płynem Lugola.
Odczynniki:
0,5% arabinoza, 0,5% fruktoza, 1% glukoza, 0,25M CuSO
4
, 2M NaOH, 4% benzydyna w lodowatym kwasie
octowym, 20%
α
-naftol w 95% etanolu, st
ęż
ony H
2
SO
4
, st
ęż
ony HCl, rezorcyna kryst., odczynnik Fehlinga I
i II, odczynnik Nylandera, odczynnik antronowy – 40 mg antronu w 25 ml st
ęż
onego H
2
SO
4
, 0,5% glukoza,
0,5% maltoza, 0,5% laktoza, 0,5% sacharoza, 1% sacharoza, 1% glikogen, 1% kleik skrobiowy, 2 M HCl, 2
M NaOH, 0,25 M CuSO
4
, 1 M H
2
SO
4
, 60% H
2
SO
4
, płyn Lugola, odczynnik Benedicta.
Wyszukiwarka
Podobne podstrony:
cw cukry
cw 9 cukry proste
cw.9-cukry proste
cw 8 cukry proste
cw 10 cukry zlozone
Analiza żywności ćw 18 cukry, Tż, Analiza żywności II, Sprawozdania
Analiza żywności ćw 18 cukry wykres
ćw 4 Profil podłużny cieku
biofiza cw 31
cukry cz 2 st
cukry
Kinezyterapia ćw synergistyczne
Cw 1 ! komorki
więcej podobnych podstron