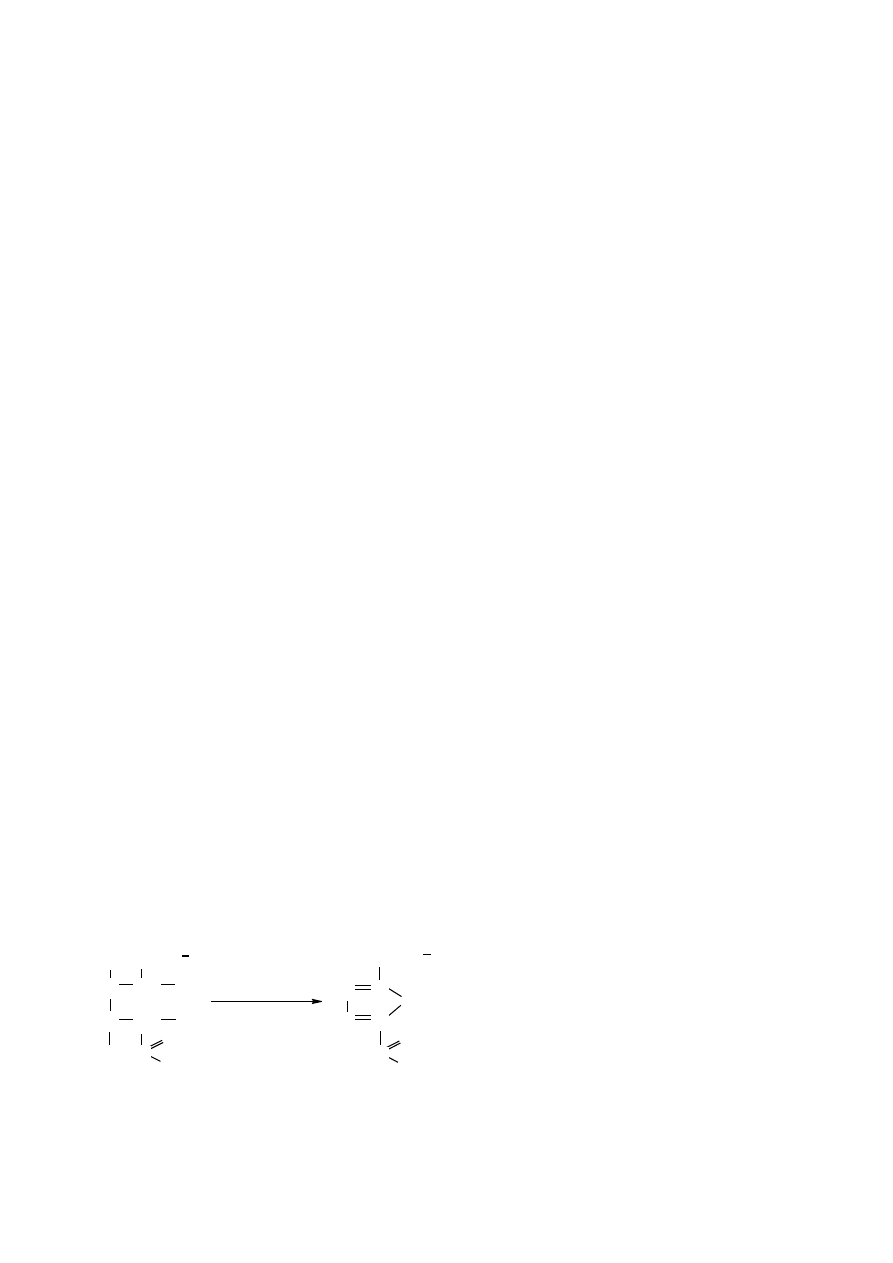
Ć
wiczenie 8
Cukry proste
Wyci
ą
g z kart charakterystyki substancji niebezpiecznych
-
α
-naftol – T+
-
etanol 96% – F
-
kwas siarkowy – C
-
benzydyna – T, N, R/M1
-
kwas octowy – C
-
kwas solny – C
-
odczynniki Fehlinga I – N
-
odczynniki Fehlinga II – C
-
odczynnik Nylandera – C
-
rezorcyna – Xn, N
Cukry proste (monosacharydy, jednocukry) to najprostsze w
ę
glowodany. S
ą
one syntetyzowane w
organizmach samo
ż
ywnych w procesie fotosyntezy i chemosyntezy. Ich nazewnictwo chemiczne opiera si
ę
na ilo
ś
ci atomów w
ę
gla w cz
ą
steczce, których mo
ż
e by
ć
od 3 do 8. St
ą
d mówimy o triozach posiadaj
ą
cych
3 atomy w
ę
gla i konsekwentnie o tetrozach, pentozach (zwyczajowe nazwy: arabinoza, ksyloza, ryboza),
heksozach (zwyczajowo: glukoza, fruktoza, galaktoza, mannoza), heptozach i oktozach, które maj
ą
odpowiednio 4, 5, 6, 7 i 8 atomów w
ę
gla. Ogólny, sumaryczny wzór cz
ą
steczki monosacharydu to C
n
H
2n
O
n
.
Ze wzgl
ę
du na klasyfikacje chemiczn
ą
monocukry nale
żą
do polihydroksyketonów lub
polihydroksyaldehydów, w zale
ż
no
ś
ci od wyst
ę
puj
ą
cej w cz
ą
steczce grupy ketonowej lub aldehydowej.
Charakterystyczna jest tak
ż
e obecno
ść
w cz
ą
steczce cukru asymetrycznych atomów w
ę
gla, które
poł
ą
czone z 4 ro
ż
nymi podstawnikami, tworz
ą
tzw. centra chiralno
ś
ci. Efektem tego jest wyst
ę
powanie
cz
ą
steczek cukrów w formach stereoizomerów.
Charakterystyka fizykochemiczna: monosacharydy s
ą
substancjami krystalicznymi, bez zapachu, o
słodkim smaku. Dobrze rozpuszczaj
ą
si
ę
w wodzie a słabo w alkoholu etylowym. Daj
ą
reakcje wła
ś
ciwe
aldehydom i ketonom, np. redukuj
ą
odczynniki Tollensa i Fehlinga, utleniaj
ą
c si
ę
do kwasów aldonowych
(D-glukoza do kwasu D-glukonowego), redukowane tworz
ą
alditole (np. D-glukoza — sorbitol), z alkoholami
lub fenolami tworz
ą
glikozydy, a z innymi cz
ą
steczkami sacharydów — di-, oligo- lub polisacharydy;
monosacharydy ulegaj
ą
tak
ż
e reakcjom wła
ś
ciwym alkoholom — tworz
ą
estry z kwasami (np. glukozo-6-
fosforan), utleniaj
ą
si
ę
do kwasu uronowego (np. kwas glukuronowy). Wchodz
ą
tak
ż
e w skład glikolipidów,
glikoprotein oraz kwasów nukleinowych.
Literatura:
„Biochemia” J. Berg, J. Tymoczko, L. Stryer, PWN, 2005
„Biochemia Harpera” R.K. Murray i in., Wydanictwo Lekarskie PZWL, 2006
1. Analiza jako
ś
ciowa monosacharydów
Reakcje kondensacji
Pod wpływem st
ęż
onych kwasów nieorganicznych cukry ulegaj
ą
dehydratacji z utworzeniem pochodnych
furfuralowych, przy czym heksozy tworz
ą
5-hydroksymetylenofurfural, a pentozy – furfural. Powstałe
zwi
ą
zki kondensuj
ą
z fenolami, chinonami czy aminami aromatycznymi tworz
ą
c poł
ą
czenia
triarylometanowe o charakterystycznym zabarwieniu. Reakcje te s
ą
wykorzystywane do identyfikacji,
ró
ż
nicowania i oznacze
ń
ilo
ś
ciowych cukrów.
Dehydratacja
C
O
C
O
HC
HC
OH
OH
CH
OH
H (lub
CH
OH
HC
HC
C
C
O
H
H
+
- 3 H
2
O
H
H
pentoza (lub heksoza)
furfural (lub 5-hydroksymetylenofurfural)
CH
2
OH)
(lub
CH
2
OH)
1.1 Reakcja Molischa (kondensacja z fenolem)
Jest to najbardziej ogólna reakcja wykrywaj
ą
ca cukry i to zarówno te wolne jak i zwi
ą
zane. Jest jednak mało
specyficzna, gdy
ż
jej dodatni wynik mo
ż
e równie
ż
ś
wiadczy
ć
o obecno
ś
ci aldehydów i ketonów.
1
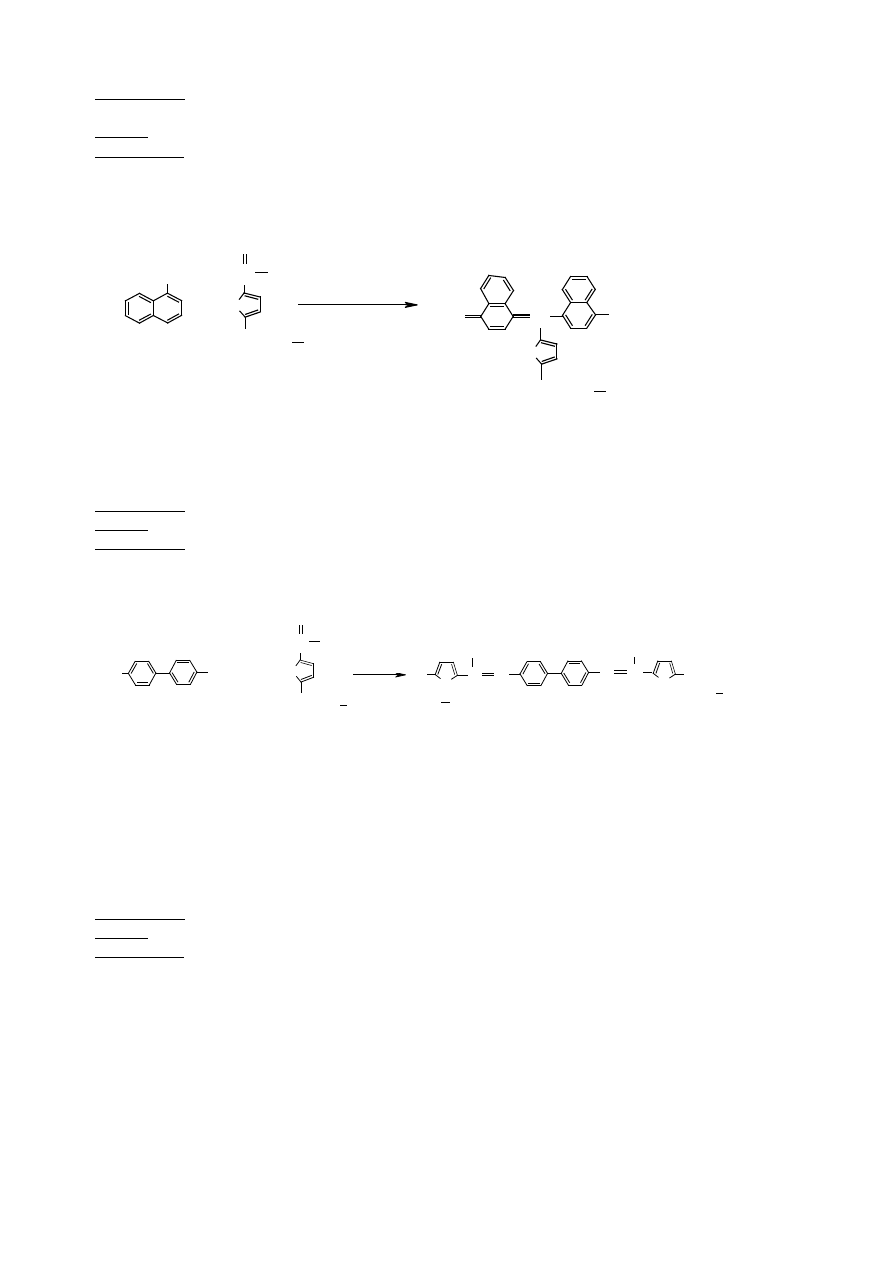
odczynniki
: 1% glukoza, 20%
α
-naftol w 95% etanolu (przechowywa
ć
w ciemno
ś
ci w temp.
pokojowej), st
ęż
. H
2
SO
4
sprz
ę
t
: 1 probówka szklana długa, pipeta szklana, pipety automatyczne, worteks
wykonanie
: do 1 ml roztworu glukozy doda
ć
0,5 ml
ś
wie
ż
o przygotowanego roztworu
α
-naftolu i
wymiesza
ć
. Nast
ę
pnie podwarstwi
ć
1 ml st
ęż
onego H
2
SO
4
, nie miesza
ć
(do pipetowania
st
ęż
onego H
2
SO
4
u
ż
ywa
ć
szklanej pipety Pasteur’a). Na granicy faz pojawia si
ę
fiołkowo-
malinowe zabarwienie.
O
OH
O
OH
2
+
C
O
H
H lub (
CH
2
OH)
C
lub (
CH
2
OH)
H
O
α −
naftol
fiolkowomalinowy
furfural lub
hydroksymetylenofurfural
1.2 Reakcja Taubera (kondensacja z benzydyn
ą
– amin
ą
aromatyczn
ą
)
odczynniki
: 0,5% arabinoza, 1% glukoza, 4% benzydyna w lodowatym kwasie octowym
sprz
ę
t
: 2 probówki szklane długie, pipety automatyczne, worteks
wykonanie: do dwóch probówek odpipetowa
ć
po 0,5 ml roztworu benzydyny. Do jednej probówki
doda
ć
1 ml roztworu arabinozy, a do drugiej 1 ml roztworu glukozy, wymiesza
ć
i ogrzewa
ć
do
wrzenia. Pentozy w tych warunkach daj
ą
zabarwienie czerwone, a heksozy
ż
ółte lub brunatne.
O
O
O
+
C
O
H
H lub (
CH
2
OH)
CH
2
OH)
furfural lub
hydroksymetylenofurfural
NH
2
H
2
N
benzydyna
2
- 3 H
2
O
N
C
H
N
C
H
H
H
CH
2
OH)
lub (
lub (
czerwony (lub zóltobrunatny)
1.3 Reakcja Seliwanowa (kondensacja z rezorcyn
ą
– fenodiol)
Pozwala na odró
ż
nienie aldoz od ketoz. Wa
ż
ne jest zachowanie odpowiednich warunków reakcji, tzn.:
st
ęż
enie u
ż
ytego kwasu solnego powinno wynosi
ć
12% a czas ogrzewania - 30 sekund. W tych warunkach
ketozy przechodz
ą
w hydroksymetylenofurfural, natomiast aldozy pozostaj
ą
niezmienione. Je
ż
eli u
ż
yje si
ę
bardziej st
ęż
onego kwasu lub wydłu
ż
y czas ogrzewania, to wówczas aldozy równie
ż
ulegaj
ą
dehydratacji i
daj
ą
odczyn dodatni – pojawia si
ę
czerwono-wi
ś
niowe zabarwienie.
odczynniki
: 0,5% fruktoza, 1% glukoza, st
ęż
ony HCl, rezorcyna kryst
sprz
ę
t
: 3 probówki szklane długie, pipety automatyczne, ła
ź
nia wodna, szpatułka, stoper, worteks
wykonanie
: do pierwszej probówki odpipetow
ć
1 ml roztworu fruktozy, a do drugiej i trzeciej
probówki po 1 ml roztworu glukozy. Do wszystkich probówek doda
ć
po 0,5 ml st
ęż
onego HCl
(otrzymuje si
ę
roztwór o st
ęż
eniu 12%), ogrza
ć
do wrzenia w ła
ź
ni wodnej, a nast
ę
pnie probówki
pierwsz
ą
i drug
ą
utrzymywa
ć
we wrzeniu przez 30 sekund, natomiast probówk
ę
trzeci
ą
utrzymywa
ć
we wrzeniu przez 3 min. Mieszaniny ostudzi
ć
, doda
ć
kilka kryształków rezorcyny i
ogrza
ć
do wrzenia w ła
ź
ni wodnej. Porówna
ć
wyniki dla obu roztworów cukrów.
2
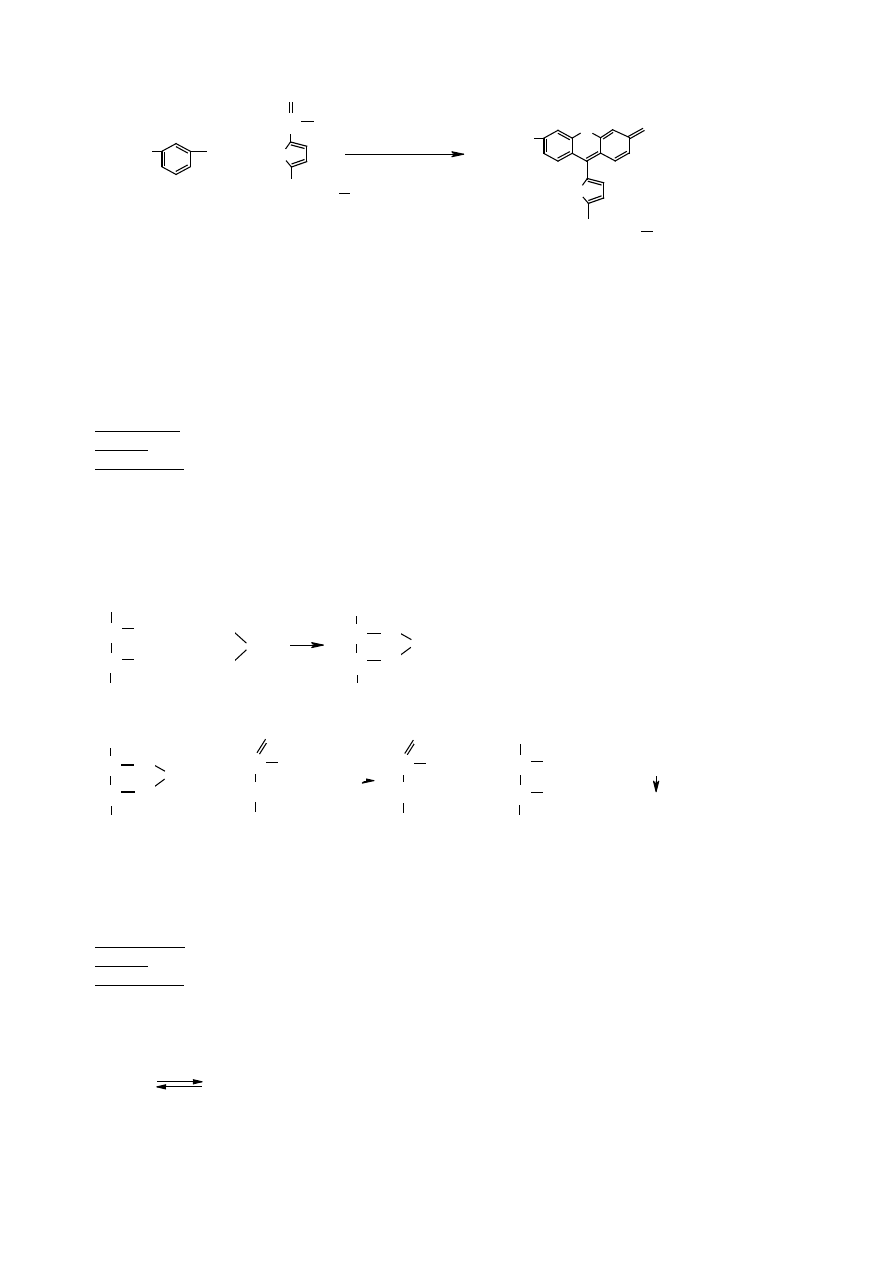
O
O
O
2
+
C
O
H
H lub (
CH
2
OH)
lub (
CH
2
OH)
H
O
rezorcyna
czerwonowisniowy
furfural lub
hydroksymetylenofurfural
OH
HO
HO
1.4 Odczyn Fehlinga
W odczynie Fehlinga redukcji ulegaj
ą
jony miedzi z Cu
2+
do Cu
+
. U
ż
ywa si
ę
odczynnika Fehlinga I, który
zawiera CuSO
4
oraz odczynnika Fehlinga II, który zawiera NaOH i winian sodowo-potasowy. Winian
sodowo-potasowy zapobiega wytr
ą
caniu si
ę
osadu Cu(OH)
2
, co mo
ż
e mie
ć
miejsce przy małym st
ęż
eniu
cukru. Sól ta wi
ąż
e jony Cu
2+
tworz
ą
c kompleksow
ą
sól kwasu winowego.
odczynniki: 1% glukoza, odczynnik Fehlinga I i II
sprz
ę
t
: 2 długie probówki, palnik, worteks, pipety automatyczne
wykonanie
: w jednej probówce zmiesza
ć
0,5 ml odczynnika Felinga I i 0,5 ml odczynnika Felinga
II. Do drugiej probówki nala
ć
1 ml roztworu glukozy. Zawarto
ść
obu probówek ogrzewa
ć
do
wrzenia. Oba roztwory zla
ć
razem. Wyst
ę
puje zabarwienie lub brunatnoczerwony osad
wydzielonego Cu
2
O.
CuSO
4
+ 2NaOH
→
Cu(OH)
2
+ Na
2
SO
4
HC
HC
COOK
OH
OH
HC
HC
O
O
Cu
2 H
2
O
COOK
COONa
COONa
+
HO
HO
Cu
+
HC
HC
O
O
Cu
COOK
COONa
+
C
CHOH
R
H
O
+ H
2
O
C
CHOH
R
OH
O
+
HC
HC
COOK
OH
OH
COONa
+
Cu
2
O
c z e rw o n y o
o s a d
1.5 Odczyn Nylandera
Odczynnik Nylandera zawiera zasadowy azotan bizmutu, KOH i winian sodowo-potasowy, który spełnia tu
t
ę
sam
ą
rol
ę
, co w odczynie Felinga i co cytrynian w odczynie Benedicta. Pod wpływem cukrów redukcji
ulega Bi
3+
do Bi
0
.
odczynniki
: 1% glukoza, odczynnik Nylandera
sprz
ę
t
: probówka szklana długa, ła
ź
nia wodna, worteks, pipety automatyczne
wykonanie
: do 5 ml 1% roztworu glukozy doda
ć
kilka kropel odczynnika Nylandera, wymiesza
ć
i
wstawi
ć
do wrz
ą
cej ła
ź
ni wodnej na 5 min. Wytr
ą
ca si
ę
czarny osad metalicznego bizmutu
Bi(OH)
2
NO
3
+ KOH
→
Bi(OH)
3
+ KNO
3
Bi(OH)
3
Bi
3+
+
3 OH
-
3
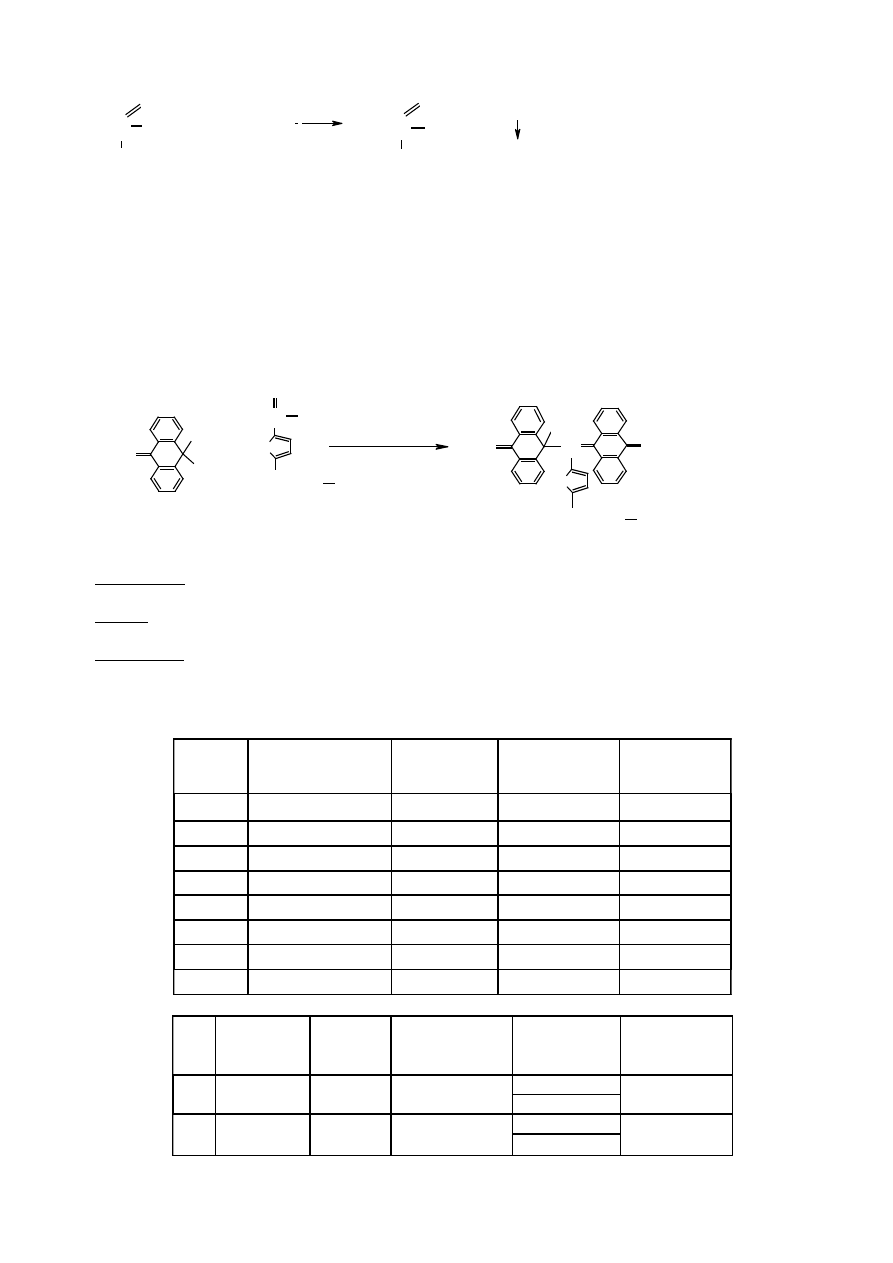
+ 2 Bi(OH)
3
winian
Na-K
+ 2 Bi
0
+ 3 H
2
O
OH
glukoza
kwas glukonowy
czarny osad
3 C
H
O
R
+
+
+
3 C
O
R
2. Oznaczanie ilo
ś
ciowe monocukrów
Metoda antronowa
Jest to kolorymetryczna metoda oznaczania zawarto
ś
ci cukru w roztworze wykorzystuj
ą
ca powstawanie
kompleksów pomi
ę
dzy furfuralowymi i hydroksymetylenofurfuralowymi pochodnymi cukrów a antronem.
Powstaj
ą
cy kompleks o barwie niebiesko-zielonej ma maksimum absorpcji przy długo
ś
ci fali 600 nm. Jest to
metoda niestechiometryczna wi
ę
c wymaga sporz
ą
dzenia krzywej kalibracyjnej.
O
O
2
+
C
O
H
H lub (
CH
2
OH)
C
lub (
CH
2
OH)
H
O
antron
zielononiebieski
furfural lub
hydroksymetylenofurfural
O
H
H
H
O
odczynniki
: 1% glukoza (roztwór wzorcowy), próbki badane (roztwory cukru o nieznanym
st
ęż
eniu), odczynnik antronowy
sprz
ę
t
: 20 probówek szklanych krótkich, szklana bagietka, pipety automatyczne, worteks, ła
ź
nia
wodna, czytnik do płytek titracyjnych, papier milimetrowy, stoper
wykonanie
:
a) w krótkich szklanych probówkach przygotowa
ć
zgodnie z tabel
ą
wzrastaj
ą
ce st
ęż
enia
roztworu wzorcowego do krzywej kalibracyjnej oraz dwa roztwory z próbek o
nieznanym st
ęż
eniu cukru; roztwory po przygotowaniu wymiesza
ć
.
Próbka
badana
Obj. roztworu
wzorcowego (
µ
l)
Obj. wody
(
µ
l)
St
ęż
enie cukru
(mg/ml)
A
600
∅
0
1000
1
5
995
2
10
990
3
20
980
4
30
970
5
40
960
6
50
950
7
60
940
Obj. próbki
badanej
(
µ
l)
Obj.
wody (
µ
l)
Rozcie
ń
czenie
próbki
A
600
St
ęż
enie
cukru (mg/ml)
P1
50
950
P2
50
950
4

b)
do 12-stu krótkich szklanych probówek odmierzy
ć
1,25 ml odczynnika antronowego i
przy ozi
ę
bianiu w zlewce z zimn
ą
wod
ą
ostro
ż
nie dodawa
ć
, mieszaj
ą
c bagietk
ą
szklan
ą
, 0,25 ml badanego roztworu. Cało
ść
umie
ś
ci
ć
we wrz
ą
cej ła
ź
ni wodnej lna 10
minut, po wyj
ę
ciu ozi
ę
bi
ć
pod bie
żą
c
ą
wod
ą
. Z ka
ż
dej probówki przenie
ść
po 100
µ
l
mieszaniny do dołków w płytce titracyjnej i zmierzy
ć
warto
ść
absorbancji przy
λ
= 600
nm wobec próby
ś
lepej przy u
ż
yciu czytnika do płytek titracyjnych. Wyniki st
ęż
enia
cukru dla badanych próbek odczyta
ć
w mg/ml z wykre
ś
lonej krzywej kalibracyjnej.
Odczynniki:
0,5% arabinoza, 0,5% fruktoza, 1% glukoza, 4% benzydyna w lodowatym kwasie octowym, 20%
-naftol w
95% etanolu, st
ęż
ony H
2
SO
4
, st
ęż
ony HCl, rezorcyna kryst., odczynnik Fehlinga I i II, odczynnik Nylandera,
odczynnik antronowy – 40 mg antronu w 25 ml st
ęż
onego H
2
SO
4
.
5
Wyszukiwarka
Podobne podstrony:
cw 9 cukry proste
cw.9-cukry proste
cw cukry
cw cukry
BCH Cukry proste
Cukry proste i z-o¬one, Studia II rok, Studia, PD materialy donauki, PD materialy donauki
Cukry proste i złożone, Chemia
cukry proste i zlozone budowa i wlasciwosci. (2), Prace pisemne
Ćw. WYK 2 proste
cukry proste sciaga
cw 2 zginanie proste
Ćw WYK 2, proste
41 44 CW komórka i proste formy życia
cw cukry
Cukry proste i złożone
więcej podobnych podstron