
UKŁAD IMMUNOLOGICZNY:
Funkcje:
Odporność na zakażenia
Odrzucanie przeszczepów
Zwalczanie nowotworów
Narządy/tkanki limfatyczne:
1.
Pierwotne:
Grasica (T)
Szpik kostny (B)
Kaletka Fabrycjusza (B)
2.
Wtórne:
Śledziona
Węzły chłonne
Tkanka limfoidalna związana z błonami śluzowymi (MALT: GALT, BALT, NALT, SALT)
Migdałki (nieotorbione)
Odpowiedź pierwotna na dany antygen pojawia się po 2 tygodniach, odpowiedź wtórna na ten sam antygen po 2-3
dniach.
Pierwotne narządy limfatyczne – funkcja:
Miejsce limfopoezy (rozwoju limfocytów)
Miejsce selekcji limfocytów pod względem tolerancji dla autoantygenów
Komórki uczą się rozpoznawać własne antygeny, kiedy trafią na obwód atakują tylko obce antygeny.
Limfocyty nabywają immunokompetencji – zdolności do reagowania z odpowiednimi antygenami.
Wtórne narządy limfatyczne – funkcje:
Tu dojrzałe limfocyty biorą udział w odpowiedzi immunologicznej, „oddziaływują” z antygenami i komórkami
pomocniczymi.
Obszary:
Grasicznozależne – zasiedlane przez limfocyty T
Grasicznoniezależne – limfocyty B
KALETKA FABRYCJUSZA -> strefa korowa i rdzeniowa
SZPIK KOSTNY – tkanka siateczkowata + naczynia krwionośne
Żółty – składa się głównie z komórek tłuszczowych, hematologicznie nieczynny
Czerwony – miejsce powstawania elementów morfotycznych krwi
U dziecka wypełnia wszystkie kości, u dorosłych tylko w kościach płaskich i nasadach kości długich
GRASICA – miejsce dojrzewania prekursorów limfocytów T; każdy płat składa się z wielu płacików oddzielonych
od siebie przegrodami łącznotkankowymi; żeby zanikła całkowicie, powinniśmy żyć 100-120 lat (inwolucja)
Rusztowanie grasicy – tkanka łączna, komórki zrębu.
W oczkach sieci utworzonej przez komórki zrębu:
Dojrzewające tymocyty
Komórki nabłonkowe – w korze to komórki opiekuńcze, ściśle otaczają tymocyty swymi wypustkami; funkcja:
Prezentują autoantygeny dojrzewającym limfocytom T – selekcja
Wydzielają hormony wpływające na rozwój tymocytów
Komórki dendrytyczne
Makrofagi
Ciałka Hassala – degradujące komórki nabłonkowe, najprawdopodobniej pełnią funkcję wydzielniczą
Rola grasicy:
Uczenie limfocytów T, aby po opuszczeniu grasicy potrafiły rozpoznawać obce antygeny prezentowane im przez
komórki w połączeniu z MHC
W grasicy nie ma obcych antygenów
Selekcja limfocytów:
1.
Pozytywna – przeżycie i proliferacja limfocytów T, po rozpoznaniu autoantygenów prezentowanych przez MHC
2.
Negatywna
90% limfocytów – „śmierć z zaniedbania” – brak rozpoznania antygenu.
Hormony grasicy – ułatwiają rozwój limfocytów i mogą być stosowane jako leki immunosupresyjne:
Tymozyna
Grasiczny czynnik humoralny
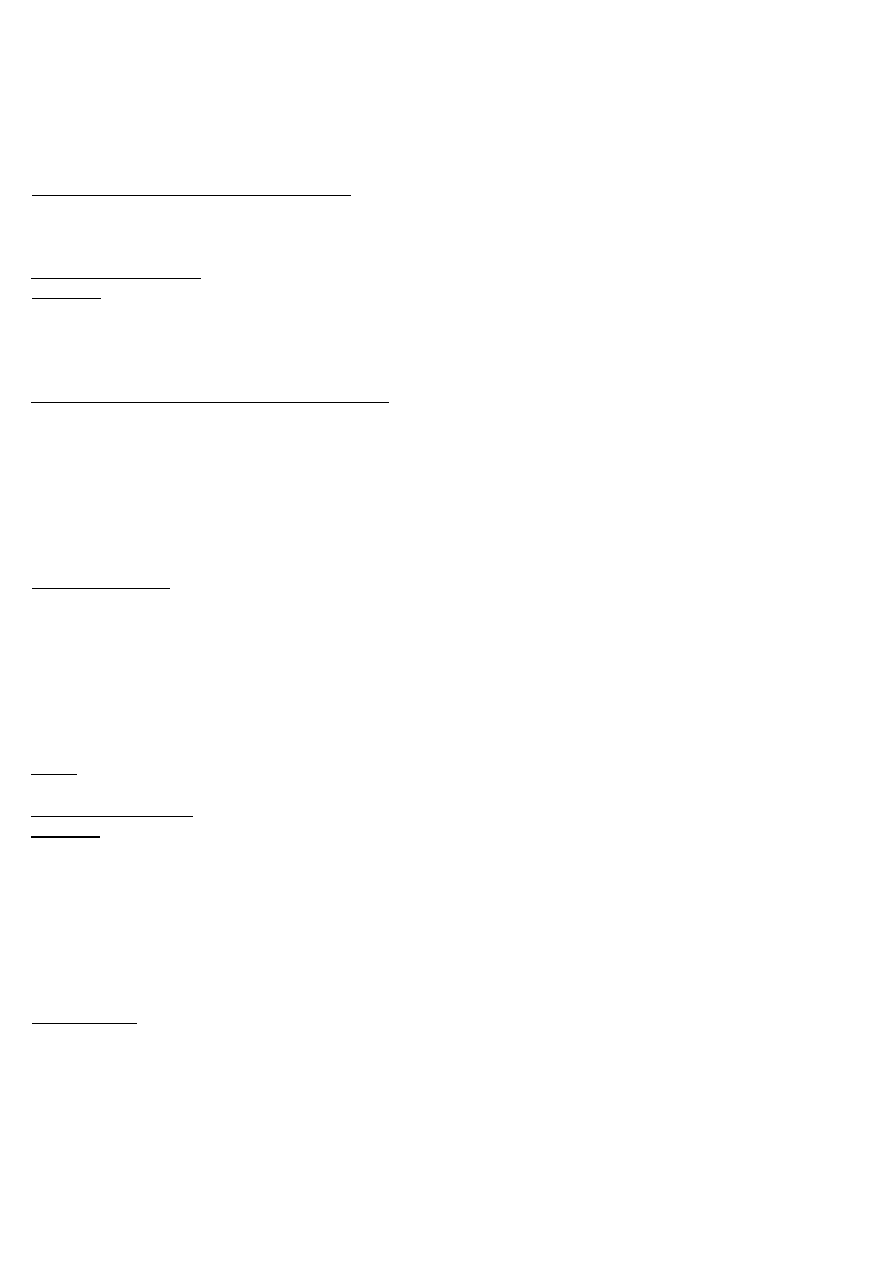
Tymopoetyna
Tymulina
Tymopoentyna
Tymostymulina
30% prawidłowo rearanżuje TCR-β -> selekcja B -> 10% tymocytów rozpoznaje MHC; 80% ginie – delecja
komórek -> selekcja pozytywna
WTÓRNE NARZĄDY LIMFATYCZNE:
Otorbione
Nieotorbione
GRUDKI CHŁONNE – to skupisko głównie limfocytów B + limfocyty T, makrofagi, komórki dendrytyczne
Funkcje:
Obrona przed inwazją patogenów (nabłonek układu oddechowego, czy moczowo-płciowego ma bezpośredni
kontakt ze środowiskiem zewnętrznym)
Po pobudzeniu antygenem w środku grudki pojawia się przejaśnienie – ośrodek lub centrum namnażania
limfocytów B
GRUDKI LIMFATYCZNE NIEOTORBIONE:
1.
Skupione:
Migdałki (NALT)
Kępki Peyera (jelito kręte) (GALT)
Ściana wyrostka robaczkowego (GALT)
2.
Pojedyncze/samotne:
Rozproszone w błonie śluzowej
Migdałki
KĘPKI PEYERA – wychwytują makrocząsteczki i mikroorganizmy ze światła jelita; występują też w wyrostku
robaczkowym i migdałkach
Występują głównie w jelicie krętym
U młodych przeżuwaczy i świń ciągną się na 2m jelita cienkiego i są miejscem produkcji limfocytów B (u owiec
przed urodzeniem pełnią rolę pierwotnego narządu limfatycznego)
Po usunięciu kępek Peyera owce mają niedostateczną liczbę limfocytów B, osłabiona produkcja Igs
GRUDKI LIMFATYCZNE -> B
OBSZARY MIĘDZYGRUDKOWE -> T
SALT – to keranocyty, komórki dendrytyczne, specjalna pula limfocytów T
WĘZŁY CHŁONNE – biorą udział w odpowiedzi immunologicznej; to filtry leżące na drodze płynącej limfy
Funkcje:
Filtracja limfy i zatrzymywanie zawartych w niej:
Antygenów (wolnych i obecnych w komórkach prezentujących antygen)
Drobnoustrojów
Komórek nowotworowych
Drobnych cząsteczek stałych
Proliferacja aktywnych limfocytów B i T
Biorą udział w odpowiedzi immunologicznej
ŚLEDZIONA – funkcje:
Podobnie jak w grudkach limfatycznych nieotorbionych i węzłach limfatycznych, w śledzionie limfocyty są
aktywowane przez antygeny (które docierają tu z krwią) i różnicują się w komórki efektorowe
Fagocytoza i niszczenie zużytych erytrocytów, krwinek białych i trombocytów
Współudział w wytwarzaniu bilirubiny
Magazynowanie krwi i krwinek
Grudki chłonne (w błonie śluzowej) odpowiadają na antygen (w płynach tkankowych); jak nie pomoże, antygeny
dostają się do limfy i odpowiedzialne za odpowiedź są węzły chłonne; jak to nie pomoże, antygeny dostają się do
krwi i za odpowiedź odpowiada śledziona.
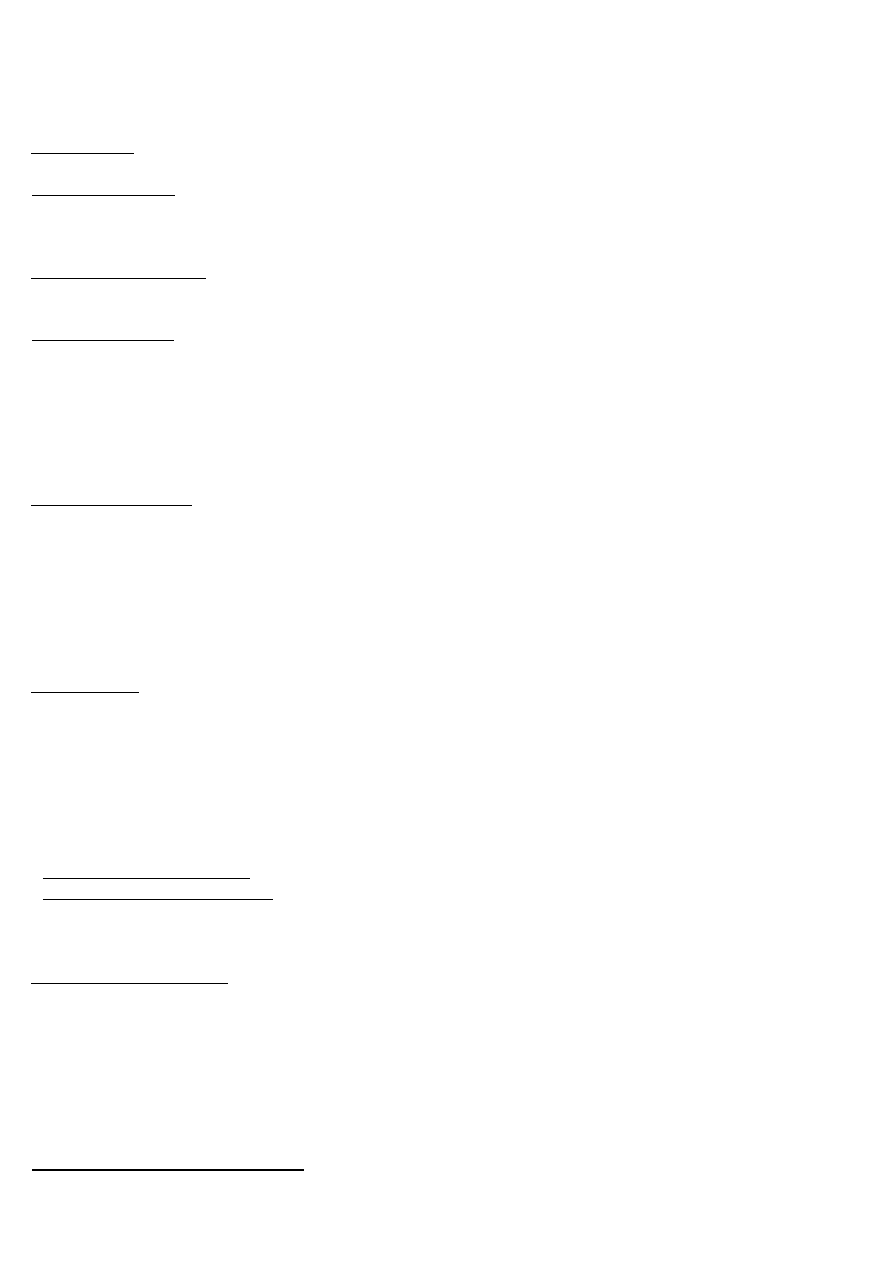
Słoniowacizna – choroba spowodowana przerostem skóry i tkanki podskórnej, najczęściej w kończynach dolnych i
w kroczu, związanych z zaburzeniami w odpływie chłonki.
-------------------------------------------------------------------------------------------------------------------------------------------
Immunologia – nauka zajmująca się odpornością organizmów na zarazki, toksyny i niektóre substancje chemiczne
PRZECIWCIAŁA – produkowane są w szpiku kostnym.
Przeciwciało łączy się z antygenem:
FAB REGION – łączenie swoiste
FC REGION – łączenie nieswoiste (dzięki temu połączeniu przeciwciała łączą się z komórkami żernymi)
Struktura przeciwciał:
2 identyczne łańcuchy lekkie (1 domena zmienna: V
L
, 1 domena stała: C
2
)
2 identyczne łańcuchy ciężkie (1 domena zmienna: V
H
, 3 domeny stałe: C
H
1, C
H
2, C
H
3)
Klasy przeciwciał:
IgG – 2-wartościowe; przy wtórnej odpowiedzi na antygen, jest ich najwięcej; najważniejsze w odpowiedzi
efektorowej poza błoną śluzową; najwięcej ich w surowicy
IgE – 2-wartościowe; zawsze podwyższone przy zakażeniu pasożytami
IgD – 2-wartościowe
IgM – 10-wartościowe za pomocą łańcucha J; główna klasa przeciwciał, przy pierwotnej odpowiedzi jest ich
najwięcej; najważniejsze w odpowiedzi efektorowej poza błoną śluzową
IgA – monomery, dimery, trimery; w błonie śluzowej opłaszczając drobnoustroje utrudniają ich kolonizację
Funkcje przeciwciał:
Wiążą się z AgS na powierzchni bakterii (opsonizacja) – opłaszczone bakterie są lepiej rozpoznawane przez
fagocyty
Aktywują białko układu dopełniacza, które powodują lizę bakterii
Igs powodują aglutynację (zlepianie) drobnoustrojów, przez co trudno przylepiają się do błony śluzowej i trudniej
przez nie przenikają
Neutralizują toksyny bakteryjne
Neutralizują wirusy, kiedy te znajdują się poza komórką
ANTYGENY:
1.
Autoantygeny – własne organizmu (autoAg)
Transplantacyjne (MHC)
Grupowe (np. AB0, Rh)
nowotworowe
2.
Obce
Drobnoustroje
Alergeny
EPITOP = DETERMINANTA ANTYGENOWA
Antygeny grasicznozależne – w odpowiedzi na nie limfocyty B potrzebują pomocy limfocytów Th
Antygeny grasicznoniezależne – jest ich o wiele mniej niż antygenów grasicznozależnych
o
MV<1000Da (aspirina, progesteron, penicylina) – nie są immunogenne
o
MV=1000-6000Da (insulina, ACTH) – mogą, ale nie muszą być immunogenne
o
MV>6000Da (albumina, toksyna tężca) – są immunogenne
Główne klasy antygenów:
Węglowodany (polisacharydy)
Lipidy – rzadko immunogenne
Mogą być połączone z nośnikiem białkowym:
Kwasy nukleinowe – trudno immunogenne
Mogą być połączone z nośnikiem DNA w natywnej formie, nie jest immunogenne:
Białka
Kompletne – białko lub wielocukry
Niekompletne - hapteny
Swoiste rozpoznawanie antygenów:
1.
Przeciwciała
2.
Receptory limfocytów:
T – TCR
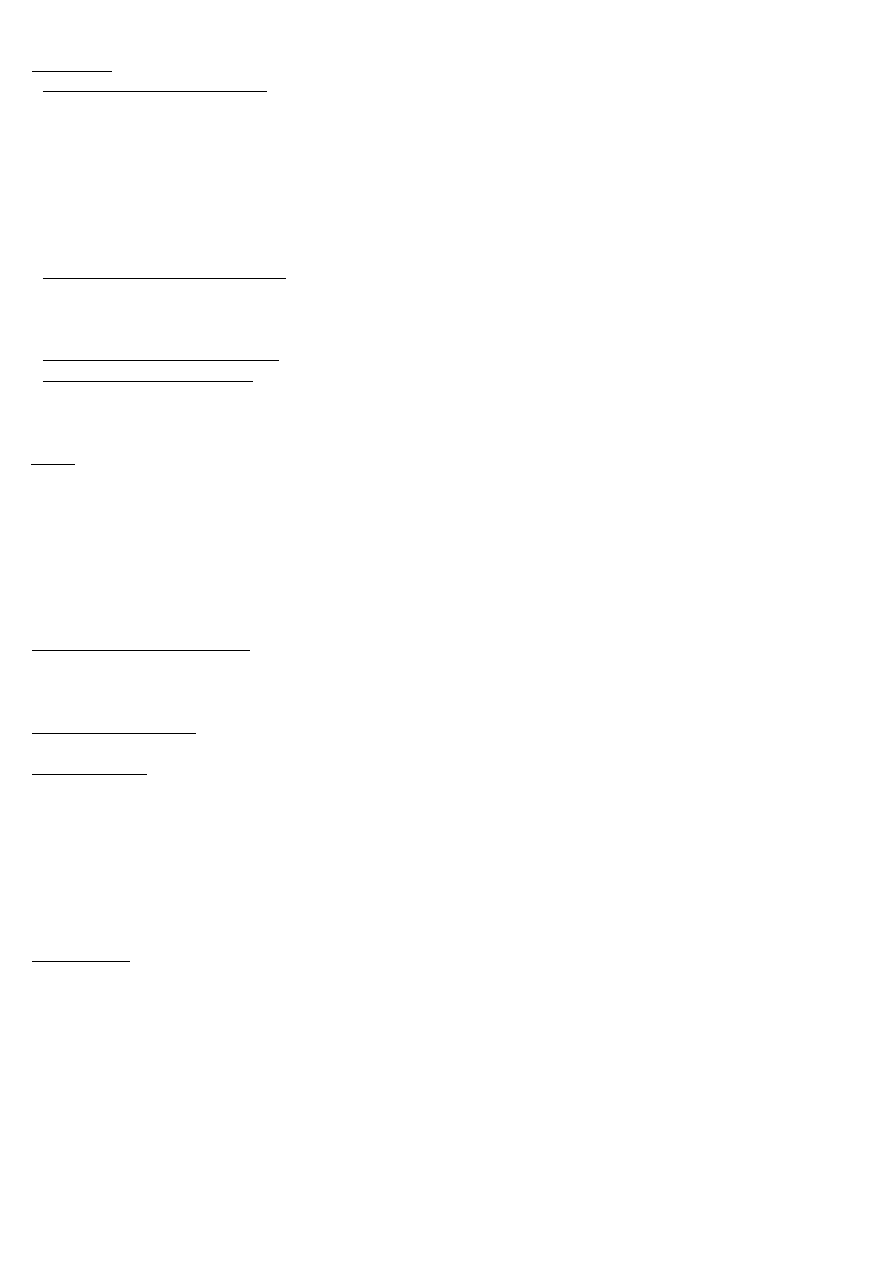
B – BCR
Antygeny:
1.
Antygeny wirusów i bakterii:
antygen kapsularny – otoczkowy (polisacharyd)
antygen somatyczny O
antygen rzęskowy (H, flagelina)
antygen fimbrii
toksyny i enzymy wydzielane przez bakterie
ściana komórkowa bakterii G+
ściana komórkowa bakterii G-
antygen somatyczny bakterii G- (fragment LPS – lipopolisacharydy)
2.
Antygeny wirusów i pasożytów:
białka otoczki wirusów
antygeny rozpuszczalne (np. nukleoproteiny)
Główna rola w odpowiedzi przeciwpasożytniczej – EOZYNOFILE.
3.
Antygeny nowotworowe (TSA)
4.
Antygeny transplantacyjne – antygeny zgodności tkankowej (część białkowa MHCI występuje na powierzchni
wszystkich jądrzastych komórek organizmu); odpowiada za odrzucanie przeszczepów – każdy osobnik ma inną
budowę MHCI; kodowane są przez zespół genów MHC – główny układ zgodności tkankowej (u ludzi HLA)
MHC – prezentacja antygenów własnych i obcych
1.
MHCI (prezentacja antygenów egzogennych przez makrofagi) – na:
Wszystkich jądrzastych komórkach organizmu
2.
MHCII – na
Makrofagach (APC)
Komórkach dendrytycznych (APC)
Limfocytach B (APC)
Komórkach nabłonkowych grasicy
Fagocytoza immunologiczna – fagocytoza z udziałem opsonii
Szpiczak – nowotwór limfocytów B
Poliklonalny mitogen – nieswoiście pobudza limfocyty B
ODPORNOŚĆ
1.
Nieswoista – naturalne bariery (np. skóra, błony śluzowe); niespecyficzna obrona wewnętrzna – nieswoiste
rozpoznawanie obcych struktur (taki sam mechanizm ze względu na wchodzenie drobnoustrojów) – odróżnia
„swoje” od „obcego”; bardzo szybka, niekiedy natychmiastowa; fagocyty
2.
Swoista – wytwarzanie swoistych limfocytów T i B i przeciwciał; pamięć immunologiczna limfocytów T i B
pamięci
Komórkowa
Humoralna
CYTOKINY – nazywane hormonami układu immunologicznego; małe białka do komunikacji komórek;
wytwarzane głównie przez leukocyty;
Efekt działania cytokin:
Wzrost/podziały komórek
Różnicowanie
Śmierć
Sekrecja innych cytokin
Grupy cytokin:
Interleukiny (Il)
Interferony (α, β, γ…)
Nadrodzina TNF
Czynniki krwiotwórcze
Chemokiny

-------------------------------------------------------------------------------------------------------------------------------------------
KOMÓRKI SZPIKU KOSTNEGO:
Multipotencjalne komórki macierzyste:
1.
Linia mieloidalna (fagocyty)
Granulocyty
Monocyty
Prekursory komórek tucznych
2.
Linia limfoidalna
Limfocyty
Prekursory limfocytów T
Prekursory komórek dendrytycznych
GRANULOCYTY:
1.
Neutrofile – jądro 2-5 segmentowane; jako pierwsze docierają do miejsca odczyny zapalnego; wyspecjalizowane
fagocyty; ok 65% leukocytów obwodowych=komórki wielojądrzaste lub polimorfonuklearne
2.
Eozynofile – jądro głównie z segmentów; zakażenia pasożytnicze, nadwrażliwość typu I
3.
Bazofile – reakcje alergiczne z komórkami tucznymi; posiadają receptory, do których przyłączają się IgE
4.
Makrofagi
AGRANULOCYTY:
1.
Limfocyty T i B (8-10μm) – mniejsze od granulocytów; duże niesegmentowane jądra; ok 25% leukocytów
obwodowych
2.
Monocyty <-> makrofagi – największe wśród krwinek białych (16-20μm); duże zdolności fagocytarne; 6%
leukocytów obwodowych
APC – komórki prezentujące antygen – pochłaniają antygen i prezentują go limfocytom Th w kontekście MHCII:
Monocyty/makrofagi
Komórki dendrytyczne – występują w tkance łącznej i nabłonkach różnych narządów; pochłaniają antygeny; jako
komórki APC są transportowane
Mieloidalne – mają wspólny prekursor z monocytami, ale mogą się też różnicować pod wpływem
odpowiednich cytokin
Limfoidalne – zdolne do fagocytozy i pinocytozy
Limfocyty B – mają receptory BCR i prezentują je limfocytom Th
2
, które mają dla nich cytokiny, dzięki którym
mogą proliferować w plazmocyty
Szczepionki z komórek dendrytycznych – wysoka efektywność prezentacji antygenu – dużo MHCII
1.
Pobieranie komórek dendrytycznych od pacjenta z nowotworem
2.
Karmienie ich in vitro antygenem nowotworów
3.
Szczepienie pacjenta
KOMÓRKI TUCZNE/MASTOCYTY – znajdują się w błonach śluzowych; charakteryzują się tym, że są
najeżone receptorami, zwłaszcza wzorcami molekularnymi na patogenach (LPS na G-, kwas tejchojowy na G+); ze
szpiku kostnego, niedojrzałe prekursory wraz z krwią docierają do tkanek, gdzie różnicują się w dojrzałe komórki
tuczne; najeżone receptorami TLR (jest ich kilka odmian); inicjatory reakcji zapalnej; funkcje i morfologia podobne
do bazofili - w granulocytach mediatory reakcji alergicznej i zapalnej (histamina, serotonina, enzymy, cytokiny);
powodują wzrost przepuszczalności naczyń (napływ składników osocza, m.in. dopełniacza), chemotaksja i
aktywacja przybyłych fagocytów
Płytki krwi i komórki śródbłonka naczyń – wydzielanie mediatorów zapalnych (naczynioruchowe,
chemotaktyczne i inne).
Komórki śródbłonka – wykazują ekspresję molekuł adhezyjnych, kontrolujących krążenie i rozmieszczenie
leukocytów.
Białka HSP – szoku cieplnego, powstaje na komórkach bakteryjnych, ale też naszego organizmu
LIMFOCYTY
Rozpoznanie antygenu przez receptory limfocytów T, B i NKT jest swoiste.
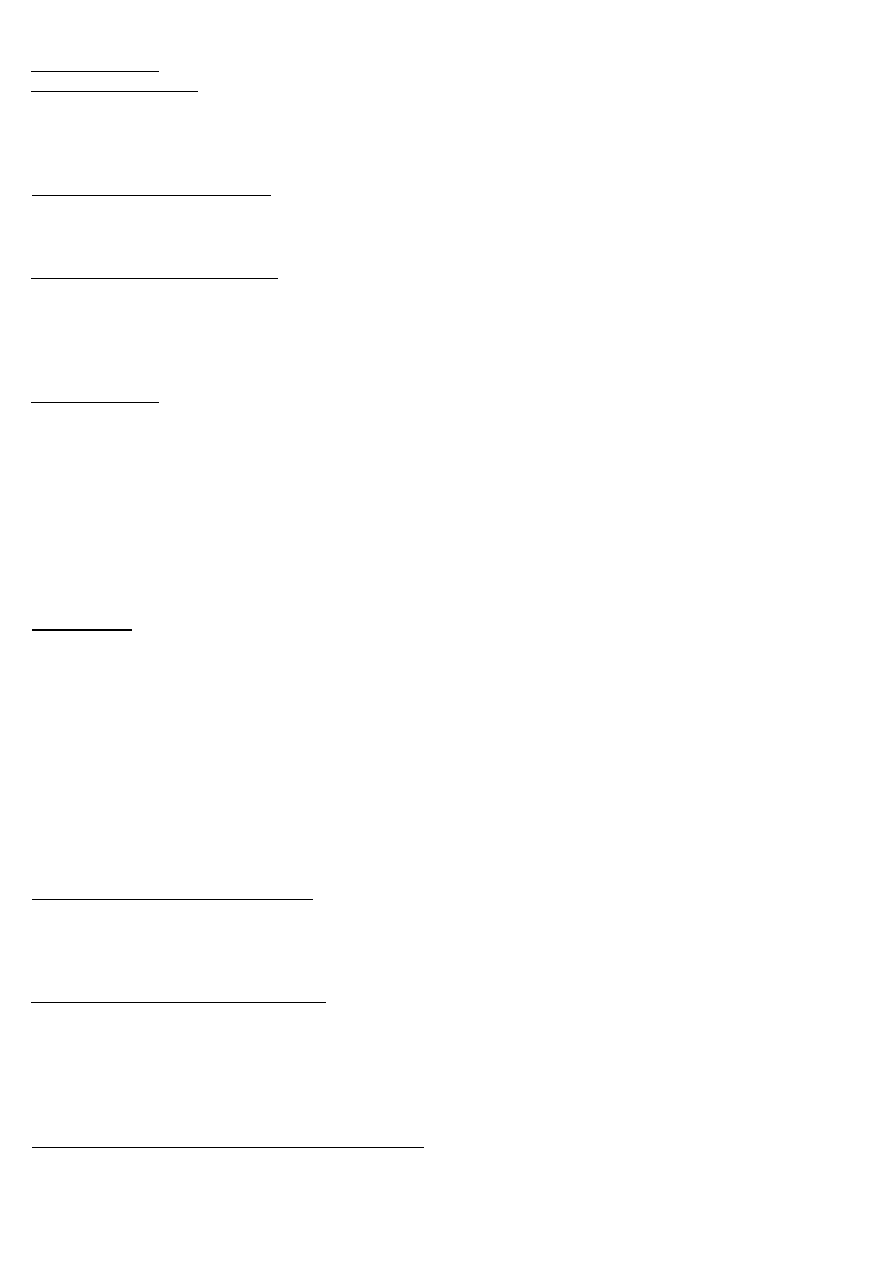
LIMFOCYTY B - w ośrodkach rozmnażania, po rozpoznaniu antygenów (+stymulacja cytokinami), różnicują się.
Dziewiczy limfocyt B:
Komórki plazmatyczne – szpik, błony śluzowe i śledziona; wytwarza swoiste Igs różnych klas; jedna komórka
plazmatyczna wydziela do 2 tysięcy Igs na sekundę; jest komórką reprezentującą antygen, receptor MHCI i
MHCII
Komórki B pamięci
BCP – receptory limfocytów B:
Receptor immunoglobulinowy – głównie IgM i IgD
Na komórkach pamięci – IgG, IgA lub IgE
Różnorodność limfocytów T i B:
Limfocyty T i B w czasie dojrzewania przechodzą wiele rearanżacji granulocytów. Proces ten ustala swoistość
antygenu limfocytów przed wędrówką do obwodowych narządów limfatycznych -> tysiące odmian receptorów
TCR i BCR.
Limfocyty są gotowe na rozpoznanie tysięcy różnych antygenów.
LIMFOCYTY T
Szpik kostny -> grasica -> węzeł chłonny
Marker CD3 i TCR
Krew, limfa i strefy grasicznozależne obwodowych narządów limfatycznych
Wspomagają odpowiedź immunologiczną przez kontakt bezpośredni z innymi komórkami i przez wydzielane
cytokiny
Receptory limfocytów T:
Receptor TCR – rozpoznają Ags prezentowane przez inne komórki organizmu w połączeniu z MHC; działa razem
z CD3
1.
Tαβ (90% limfocytów T w organizmie człowieka)
2.
Tγδ (10%)
Limfocyty T:
1.
Pomocnicze Th
TCD4+ (Th
1
; Th
2
; Th
17
)
2.
Regulatorowe Treg
TCD4+ CD25+ Foxp3+
Th
3
Th
1
Th
2
Niektóre TCD8+Tγδ
3.
Cytotoksyczne Tc
Tαβ CD8+
Niektóre Tαβ CD4-
Tγδ
Limfocyty pomocnicze – Th (CD4+):
Rozpoznają antygeny prezentujące przez APC za pomocą MHCI
Wydzielanie cytokin -> stymulacja odpowiedzi komórkowej (Th1) i humoralnej (Th2) (pomocnicze limfocyty B
przekształcają się w komórki plazmatyczne)
U alergików nadaktywność Th2 wpływa na aktywność eozynofilii, neutrofili, bo wydzielają te Il-4, Il-5, Il-6, Il-10
Limfocyty cytotoksyczne – Tc (CD8+):
Rozpoznają antygeny połączone z własnym MHCII lub obce MHCI za pomocą TCR
Niszczą komórki zakażone wirusami, nowotworami oraz komórkami przeszczepu – wydziela substancje, które
powodują otwory w błonach komórkowych -> zmienia się ciśnienie, komórka ginie
Mechanizm cytotoksyczny limfocytów Tc:
Zależny od ziaren cytolitycznych (perforyna granzyny)
Zależny od receptorów dla cząsteczek nadrodziny TNF (FasL, TNF, TRAIL)
Limfocyty regulatorowe – Treg (supresorowe – Ts):
TCD4+ CD25+ Foxp3+ - naturalne Treg rozwijają się w grasicy
Foxp3 to część transkrypcyjna charakterystyczna dla tej populacji (mutacja w genie kodującym Foxp3 -> zjawiska
autoimmunizacyjne i alergiczne)
Ich działalność może być pożyteczna lub niepożądana:
Hamowanie autoreaktywnych limfocytów T
Tolerancja na antygeny pokarmowe
Hamowanie nadmiernej, uszkadzającej tkanki, odpowiedzi przeciwzakaźnej – reakcji nadwrażliwości
Ochrona płodu przed odrzuceniem przez układ odpornościowy matki
Tolerancja na antygeny nowotworowe
LIMFOCYTY NK
Duże ziarniste limfocyty (5-15% limfocytów krwi)
CD56+ i CD16+ (receptor dla fragmentu Fc przeciwciał IgG)
Niszczą bezpośrednio komórki nowotworowe i zakażone wirusami
Wytwarzają INF-γ i tak jak INF-α indukuje w komórkach niezainfekowanych stan gotowości przeciwwirusowej
W układach doświadczalnych mogą wywierać efekt cytotoksyczny lub cytostatyczny w stosunku do niektórych
grzybów i bakterii
Receptory (wpływ na aktywność tych komórek):
Hamujące – rozpoznają własne zdrowe komórki – własne MHCI -> hamuje reakcje cytotoksyczne)
Aktywujące – rozpoznają zmienione komórki, np. pozbawione MHCI
Komórki NK mogą rozpoznawać antygeny opłaszczone przeciwciałami IgG -> FcR.
Komórki NK wydzielają substancje wywołujące śmierć komórki docelowej. Jest to tzw. Cytotoksyczna komórka
zależna od przeciwciał (ADCC; podobnie jak monocyty/makrofagi i neutrofile)
LIMFOCYTY NKT:
Mają cechy limfocytów T (TLR) i komórek NK (brak koreceptorów CD4 i CD8 i markera CD3 typowego dla
limfocytów T)
Za pomocą TCR rozpoznają głównie glikolipidy prezentujące im przez CD1 (a nie przez MHC)
Rola słabo poznana (prawdopodobnie reakcja cytotoksyczna i immunoregulacyjna)
-------------------------------------------------------------------------------------------------------------------------------------------
DOPEŁNIACZ
Dopełnienie roli przeciwciał - powiązanie mechanizmów swoistych i nieswoistych;
grupa ok. 30 białek surowicy i płynów tkankowych, aktywowane w reakcji łańcuchowej uszkodzenie błony
komórkowej - liza
Dopełniacz:
bakterie -> liza bakterii
fagocyty -> chemotaksja fagocytów -> opsonofagocytoza
bakterie -> opsonizacja bakterii -> opsonofagocytoza
Rola układu dopełniacza:
wspiera mechanizmy wrodzonej odporności immunologicznej poprzez:
bezpośrednie zabijanie drobnoustrojów za pośrednictwem lizy
chemotaksję fagocytów
ułatwianie procesu fagocytozy (opsonizacja drobnoustrojów)
Inne funkcje dopełniacza:
C3, C4 - opsonizacja
C3a, C5a - chemoatraktanty dla monocytów i neutrofilów
C3a, C5a, C4a - anafilatoksyny
degradacja mastocytów i bazofilów
stymulują syntezę metabolitów kwasu arachidonowego w wielu komórkach
Drogi aktywacji dopełniacza:
klasyczna - aktywowana przez związane z antygenem przeciwciała (zmienione konformacyjnie) IgG
(wyjątek Ig4) lub IgM
alternatywna
spontaniczna aktywacja w osoczu
aktywatory: bakterie (polisacharydy ścian), wirusy, grzyby, pierwotniaki, kompleksy immunologiczne;
szybka odpowiedź, zanim wytworzą się IgS
lektynowa - inicjowana przez MBP i fikoliny
Białka dopełniacza aktywowane są według określonej kolejności w reakcji łancuchowej.
Zmiana konformacyjna w obrębie jednego składnika dopełniacza aktywuje właściwości proteolityczne kolejnego
składnika, lub nadaje mu zdolność połączenia się z następnym składnikiem w łańcuchu aktywacji.
DROGA KLASYCZNA
Etapy klasycznej drogi aktywacji dopełniacza:
faza rozpoznania
faza amplifikacji (wzmocnienia)
faza ataku
Ig po związaniu z Ag zmienia konformację.
Budowa składnika C1:
(C1+tetramer C1r2s2)
C1 może być niekiedy aktywowany bez udziału przeciwciał, bezpośrednio przez niektóre wirusy, bakterie,
białko C-reaktywne
C4b2a=konwertaza C3 drogi klasycznej
C3-(konwertaza C3)->C3a+C3b
C3b+C4b2a=konwertaza C5
C5-(konwertaza C5)->C5a+C5b
C5b przyłacza kolejne białka C6,7,8,9=kompleks aktywujący błonę (C5b-9)->liza osmotyczna
[Do zabicia 1 bakterii E. coli potrzeba od kilkudziesięciu do kilkuset cząsteczek C5b-9.]
Mechanizmy regulujące, które zapobiegają nadmiernej aktywacji dopełniacza na drodze klasycznej:
krótki czas półtrwania składników dopełniacza
inhibitor C1, który wiąże C1r i C1s
czynnik I rozkładający C3b na nieaktywne C3c i C3d
czynniki regulujące związane z błonami komórkowymi
DROGA LEKTYNOWA
Lektynowa droga aktywacji dopełniacza związana z połączeniem cząsteczki cukru (mannozy, fruktozy, bądź też N-
acetyloglukozaminy) obecnej na powierzchni bakterii z lektyną wiążącą mannozę.
Po związaniu z węglowodanami proteazy serynowe - MASP-1 i -2 ulegają aktywacji.
W wyniku aktywacji: MASP-2 rozkłada C4 i C2.
DROGA ALTERNATYWNA
Uczestniczą w niej czynniki: B, D, H, I, P (properdyna) i składnik C3 dopełniacza.
Droga alternatywna wyzwalana jest przez niektóre struktury komórek drobnoustrojów:
lipopolisacharydy bakterii Gram-ujemnych (np. endotoksyny)
kwasy tejchojowe bakterii Gram-dodatnich (np. cząsteczki adhezyjne niektórych patogenów)
zymosan ze ścian komórkowych u drożdży
Etapy alternatywnej drogi aktywacji dopełniacza:

I.
połączenie z komórkami własnymi
C3 ulega spontanicznej hydrolizie i przechodzi w formę aktywną (C3i)
C3i łaczy się z czynnikiem B, z którego czynnik D (obecny w osoczu w formie aktywnej), odszczepia
fragment Ba
powstały kompleks C3iBb jest pozostającą w fazie płynnej konwertazą C3 drogi alternatywnej
pod jej wpływem dochodzi do rozkładu dalszych drobin C3
C3b na powierzchniach chronionych łaczy się z białkiem H, a powstały kompleks jest degradowany
przez czynnik I
II.
połaczenie z komórkami bakterii
na powierzchni aktywnych C3b staje się oporne na degradację proteolityczną (czynnik P)
takie C3b tworzy z czynnikiem B kompleks, który pod wpływem czynnika D uwalnia fragment Ba i staje
się aktywną konwertazą C3 (C3bBb)
ta konwertaza chroniona przez properdynę inicjije fazę amplifikacji rogi alternatywne, aktywując
ogromną liczbę drobin C3
większość z nich tworzy nowe konwertazy, a pozostałe dołączają do kompleksu C3bBb, przekształcając
go w C3bBbC3b, czyli w konwertazę C5
ODPORNOŚĆ NIESWOISTA/WRODZONA
naturalne bariery (np. skóra, błony śluzowe)
niespecyficzna obrona wewnętrzna - nieswoiste rozpoznawanie obcych struktur (taki sam mechanizm bez
wzgledu na rodzaj drobnoustroju); fagocyty
stara filogenetycznie, pewne elementy tej odporności są podobne u roślin i zwirząt
odróżnia "swoje" od "obcego"
bardzo szybka, niekiedy natychmiastowa, nie wymaga wstępnej aktywacji
receptory rozpoznające drobnoustroje są niezmienne w ciągu życia osobnika
jest selektywna - celem ataku nie są własne cząsteczki
nie pozostawia po sobie trwałej pamięci immunologicznej
rozwija sę niezależnie od odpowiedzi swoistej
Nieswoiste mechanizmy obronne:
skóra - bariera mechaniczna, złuszczający się naskórek, niskie pH (kwas mlekowy i kwasy tłuszczowe
gruczołów potowych i łojowych)
drogi oddechowe - rzęski, kaszel, kichanie, wydzieliny śluzowo-surowicze -> wydalanie drobnoustrojów,
przemywanie powierzchni
przewód pokarmowy - perystaltyka, złuszczanie się nabłonka, kwas solny, fizjologiczna flora bakteryjna ->
konkurencja o nisze, produkcja substancji przeciwdrobnoustrojowych - bakteriocyn
układ moczo-płciowy - niskie pH pochwy (bakterie kwasu mlekowego), przemywanie nabłonka przez mocz
krew, wydzieliny (łzy, wydzielina z nosa, ślina) - laktoferyna, transferyna (żelazo), interferony (działanie
antywirusowe), lizozym (muramidaza)
działające w całym organizmie - układ dopełniacza, białka osterj fazy, komórki żerne i NK
Rozpoznanie drobnoustrojów:
Charakterystyczne struktury drobnoustrojów, ropoznawane przez komórki odpowiedzi nieswoistej to tzw. wzorce
molekularne związane z patogenami - PAMP
PAMP (wzorce molekularne związane z patogenami):

nie występują u gospodarza
mają z reguły bardzo istotne znaczenie dla patogenu
charakteryzują duże grupy patogenów
składniki ściany komórkowej bakterii (lipopolisacharyd LPS, peptydoglikany, kwasy tejchojowe)
mannany w ścianie komórkowej drożdży
dwuniciowe DNA wirusów
niemetylowane sekwencje CpG w bakteryjnym DNA
Receptory rozpoznające wzorce - PRR:
Należą tu receptory Toll-podobne. Jest ich 10 - od TLR1 do TLR10.
Receptory Toll-poddobne:
komórki tuczne - na ich powierzchni jest kilka odmian TLR -> wzrost przepuszczalności naczyń
(napływ składników osocza, m.in. dopełniacza), chemotaksja i aktywacja przybyłych fagocytów
Receptory TLR a indukcja odpowiedzi immunologicznej:
TLR4 (m.in. na powierzchni komórek nabłonka dróg oddechowych) rozpoznaje LPS i kwasy tejchojowe
(bakterie w drogach oddechowych) -> wytwarzanie cytokin i defensyn -> przyciągnięcie fagocytów ->
niszczenie drobnoustrojów
makrofagi aktywowane przez TLR4 wytwarzają cytokiny prozapalne (Il-1, Il-6, Il-8, TNF)
Interferony:
wydzielane głównie w odpowiedzi na zakażenie wirusowe
typ I - alfa, beta, wytwarzane przez traktowane wirusem leukocyty (alfa) lub fibroblasty (beta)
typ II - gamma, immunologiczny, produkowane przez limfocyty T i NK
Działanie IFN-alfa/beta:
Nie wykazuje bezpośredniego działania przeciwwirusowego; w innych komórkach indukuje powstanie tzw. "stanu
przeciwwirusowego".
Aktywuje transkrypcję wielu genów, kodujących czynniki interferujące z replikacją wirusów oraz utrudniające
formowanie wirionów.
Funkcje makrofagów i granulocytów:
Przyciąganie fagocytów do miejsca działania bodźca - chemotaksja.
Mechanizmy zabijania drobnoustrojów:
tlenowe
pozatlenowe
Fagocytoza stymuluje pobudzenie procesów oddechowych i powstanie reaktywnych form tlenu - RFT:
nadtlenek wodoru H2O2
anion nadtlenkowy O2-
tlen singletowy (jeden z elektronów przeskakuje na orbitę o wyższej energii)
rodniki hydroksylowe -OH
kwas podchlorawy HOCl
toksyczne chloraminy powstają w wyniku reakcji kwasu podchlorawego z aminami: H2O2+Cl- -
(mieloperoksydaza)-> HOCl+OH- (mieloperoksydaza obecna jest w ziarnistościch neutrofilów i
monocytów, brak jej w makrofagach)
Białka bójcze w ziarnistościach neutrofilów:
BPI - działa na G-
katepsyna G (proteaza)
dfensyny (antybiotyki peptydowe)
lizozym
laktoferyna
elastaza - rozkłada biała ściany bakteryjnej
główne białko zasadowe MBP w ziarnistościach eozynofilów - toksyczne dla robaków pasożytniczych
(przywry, nicienie), pierwotniaków lub bakterii
ODPORNOŚĆ SWOISTA/NABYTA
organizm nabywa ją w ciągu życia
filogenetycznie młodsze od mechanizmów nieswoistych
limfocyty T i B
nie uwarunkowana genetycznie (TCR i BRC -> rearanżacje genów)
ich rozwój wymaga upływu określonego czasu
bardzo selektywne - zwracają się precyzyjnie przeciw określonemu patogenowi
tylko u kręgowców
swoistość, która jest selektywnością wkazywaną przez przeciwciała i limfocyty swoistego układu
immunologicznego w reagowaniu z homologicznymi epitopami antygenowymi
pamięć immunologiczna, która pozwala przeciwciałom i limfocytom zapamiętać ich homologiczny antygen
i później z nim reagować
Nabyta naturalnie:
po przebyciu bez- lub objawowego zakażenia
w wyniku przenikania przeciwciał przez łożysko lub z siarą
Nabyta nienaturalnie:
w wyniku szczepienia
w wyniku podania gamma-globulin
Odporność:
A.
Bierna
Pacjent dostaje gotowe przeciwciała
łożysko
podawanie Igs
B.
Czynna
Przeciwciała w organizmie pacjenta są wytwarzane pod wpływem obecności antygenu
zakażenia
szczepienie
Komórki uwikłane w odporność swoistą:
limfocyty T
limfocyty B
Odporność nabyta - dwa odłamy odporności swoistej:
1.
odporność komórkowa - limfocyty Th i Tc, makrofagi
2.
odporność humoralna - przeciwciała
Etapy odpowiedzi immunologicznej:

I.
Faza indukcji:
limfocyty+antygen=proliferacja i różnicowanie się w komórki efektorowe; kooperacja z komórkami
prezentującymi antygen oraz z innymi populacjami limfocytów
II.
Faza efektorowa:
Odpowiedź humoralna:
powstałe komórki efektorowe odpowiadają na antygen: limfocyty B uwalnianiem przeciwciał
Odpowiedź komórkowa:
Limfocyty Th naciekają (po 24-48h) miejsce podania antygenu/wtargnięcia patogenu, bezpośrednio
łacząc się z antygenami w błonie innej komórki i wydzielają tu wiele cytokin
aktywacja makrofagów (pobudzenie fagocytozy)
proliferacja limfocytów Tc (Il-2)
Antygeny:
T-zależne/grasiczozależne - w odpowiedzi na te Ags limfocyty B potrzeują pomocy limfocytów Th
T-niezależne/grasiczoniezależne - bezpośrednio indukują wytwarzanie Igs przez limfocyty B (np. LPS)
Za pomocą jakich receptorów limfocyty T i B rozpoznają antygeny?
TCR
Prezentacja antygenów z udziałem MHC I:
1.
cytoplazma
2.
białko endogenne+ubikwityna->proteasom (kompleks enzymów proteolitycznych)->proteoliza
3.
siateczka sarkoplazmatyczna -> połączenie oligopeptydów z MHC I
4.
transport MHCI-Ag w pęcherzykach wydzielniczych
Jedna cząsteczka MHC I lub II może związać w swoim rowku wiele peptydów różniących się sekwencją, ale
mających wspólne 2- aminokwasy, kotwiczące je.
Jedna komórka może jednocześnie prezentować kilka antygenów.
Ags wirusowe są prezentowane przez zakażone komórki w kontekście MHC I, a APC mogą je też prezentować z
MHC II.
Prezentacja antygenów z udziałem MHC II:
MHCII obecne są na komórkach dendrytycznych, makrofagach, limfocytach B
ekspresji ulegają również na wielu komórkach aktywowanych, tj. limfocyty T, komórki śródbłonka, komórki
nabłonka jelit, fibroblasty, czy keranocyty
Komórki dendrytyczne:
dendrytyczne wypustki
obecność w dużym stężeniu cząsteczek MHC I i II
słabe zdolności fagocytarne
wybitne zdolności indukowania proliferacji allogenicznych limfocytów, co wiąże się z obecnością
cząsteczek przekazujących sygnał kostymulujący
Limfocyty B:
prezentują antygen przede wszystkim po to, aby uzyskać pomoc od limfocytów T w wytwarzaniu
immunoglobulin
najskuteczniej prezentują antygeny, które rozpoznawane są przez jego receptory immunoglobulinowe
Makrofagi:
w przeciwieństwie do komórek dendrytycznych i limfocytów B nie mają cząsteczek MHC klasy II, ale w
trakcie aktywacji syntetyzują je pod wpływem INF-gamma
wyposażone obficie w lizosomy, nastawione są one na pełną degradację fagocytowanego materiału
odgrywają ważną rolę w prezentacji antygenów pochodzących z dużych fagocytowanych cząsteczek lub
bakterii, do czego nie są zdolne inne APC
Miejsca prezentacji przez APC:
Przez strefę grasiczozależną wnl w ciągu 1h przepływa do kilkunastu tysięcy limfocytów - jest szansa, że
odpowiedni limfocyt rozpozna antygen prezentowany przez przybyłą tu APC.
Prezentacja antygenu limfocytom Th:
Cel prezentacji, to aktywacja swoistego limfocytu Th -> proliferacja Th -> ekspansja klonalna -> wydzielane
cytokiny bedą wspomagać róznicowanie spoczynkowych limfocytów B i prekursorów limfocytów Tc w komórki
efektorowe
Proces aktywacji limfocytu zapoczątkowany jest poprzez tworzenie synapsy immunologicznej między limfocytem
Th i APC.
Do aktywacji Th niezbędne są 2 sygnały. [anergia - czynnościowa inaktywacja przy braku sygnału
kostymulującego]
Skutek aktywacji limfocytu - transformacja blastyczna G0-G1
Prezentacja antygenów za pomocą CD-1:
CD1 budową przypominają MHCI (łańcuch ciężki+B2-mikroglobulina)
CD1 - na APC i innych komórkach
zakażone makrofagi -> preentacja lipidów Mycobacterium tuberculosis -> zabicie przez Tc
Po wniknięciu antygenu do organizmu przez pierwsze kilka dni:
1.
faza utajona
2.
faza wzrostu miana przeciwciał
3.
faza plateau
4.
faza spadku miana przeciwciał
Pamięć immunologiczna:
Skłonność organizmu do przyspieszonej i bardziej efektywnej odpowiedzi immunologicznej podczas ponownego
kontaktu z antygenem, nawet po wielu latach od pierwszego kontaktu.
Hipotezy tłumaczące długotrwałość pamięci immunologicznej:
limfocyty pamięci są długowieczne
antygen wywołujący odpowiedź pierwotną pozostaje przez długi okres związany na powierzchni komórek
dendrytycznych - nieustannie stymulują rozpoznające go limfocyty
limfocyty pamięci są nieustannie pobudzone
Po wniknięciu antygenu egzogennego do organizmu przez pierwsze kilka dni:
pobudzenie/degradacja komórek tucznych
fagocytoza
prezentacja Ag we wtórnych tkankach limfatycznych
ekspansja klonalna Th (Th1 lub Th2)
ekspansja limfocytów B i/lub Tc
wytworzenie przeciwciał i/lub reakcja cytotoksyczna
Róznice
Odporność wrodzona nieswoista
Odporność nabyta swoista
Kinetyka
reakcji
immunologicznej
Rozwija się bardzo szybko (min);
bez wstępnej aktywacji
Rozwija się powoli, nawet do 6 dni
Pochodzenie receptorów
Nabyte w ewolucji, niezmienne,
dziedziczone z pokolenia na
pokolenie, rozpoznają struktury
wspólne i obecne na dużej liczbie
patogenów
Powstają de novo poprzez
rearanżację genów na skutek
kontaktu z nowym antygenem; nie
dziedziczą się
Typy receptorów
Toll-like lektynowe receptory
komórek NK
Poszczególne domeny struktur
patogenu
Rozpoznawanie
struktury
patogenu
Niezminne, obecne na dużej grupie
patogenów, np. LPS, sekwencja
CpG DNA, wirusowe, postaci
replikacyjne dsRNA, struktury
osłonki wirusów
Poszczególne domeny struktur
patogenu
Komórki
NK, DC, limfocyty γδT,
makrofagi, granulocyty, limfocyty
B-1a
APC, limfocyty T (CD4+, CD8+) i
B
Pamięć immunologiczna
brak
Trwała
Aktywacja
Rozwija się niezależnie od
swoistej, może być wspomagana
przez swoistą
Do rozwoju wymaga odpowiedzi
nieswoistej
Mechanizmy efektorowe
Cytotoksyczność (niezależna od
MHC, zależna od NK,
makrofagów, DC, komplementu,
wytwarzanie cytokin: IFN (α, β, γ),
rodziny TNF, interleukin,
chemokin,
cytokinozależna
odporność komórek
Cytotoksyczność
limfocytów
TCD8+, zależna od MHC,
przeciwciała, cytotoksyczność
oparta na komplemencie, zależna
od przeciwciał, aktywność cytokin
-------------------------------------------------------------------------------------------------------------------------------------------
Nadwrażliwość - stan wypaczonej odpowiedzi immunologicznej, prowadzący do uszkodzenia tkanek i
zapoczątkowujący proces chorobowy.
Nadwrażliwość typu I - u jej podłoża leżą reakcje alergenu z IgE związanymi z receptorami powierzchniowymi
komórek tucznych i bazofili; efekt: wydzielanie histaminy, leukotrienu i innych mediatorów.
Atopia - dziedziczna skłonność do nadmiernego wytwarzania IgE rozpoznającego antygeny powszechnie
występujące w środowisku; synonim choroby, u której podłoża leżą mechanizmy nadwrażliwości typu I (astma
oskrzelowa, alergiczny nieżyt nosa i spojówek, atopowe zapalenie skóry oraz niektóre postacie alergii
pokarmowych i pokrzywek).
Uogólnione reakcje anafilaktyczne (po użądleniu, penicyliny), choć są również związane z mechanizmem IgE
zależnym, nie są zaliczane do chorób atopowych; niedziedziczna; można odczulać.

Różnice między anafilaksją i atopią:
Atopia jest wrodzona, a anafilaksja nabyta
U atopików stwierdza się zawsze wysokie poziomy IgE, głównie przeciw alergenom wziewnym, natomiast
w anafilaksji jedynie po kontakcie z alergenem i tylko przez pewien czas
Odczulenie atopika jest niemożliwe, natomiast chorego z anafilaksją można odczulić
Pod względem klinicznym choroby atopowe nie różnią się od anafilaksji, gdyż w obu przypadkach działa ten sam
mechanizm.
Atopia jest czynnikiem ryzyka rozwoju anafilaksji, co oznacza, że atopik łatwiej uczuli się po aplikacji leków z
surowic itp.
Odczyny anafilaktyczne są istotnie częstsze u atopików niż u osobników nieatopowych.
Czynniki warunkujące występowanie alergii:
genetyczne - 40-80% obciążenia rodzinne; nie ma jednego genu, który warunkuje wystąpienie alergii -
współdziałanie wielu genów
środowiskowe (infekcyjne, toksyczne, zanieczyszczenia środowiska, ekspozycja na alergen)
Czynniki infekcyjne:
kontakt z określonymi mikroorganizmami stymulującymi wytworzenie Il-12 i IFN-gamma - osłabia
dominację lTh2; IgE, komórki tuczne, bazofile, eozynofile.
zakażenia pasożytnicze indukują mechanizmy odporności z udziałem Th2, ale stymulują też wytwarzanie
poliklonalnych IgE, przyczyniając się do blokowania receptorów FcεRI na komórkach tucznych i osłabienia
reakcji tych komórek na alergeny środowiska
odpowiedź immunologiczna indukowana przez zakażenia wirusowe (szczególnie nawracające)
charakteryzuje się aktywnością NK CD8+ i CD4+ oraz wydzielaniem INF, potencjalne właściwości
hamowania Th2.
Alergeny - to substancje powszechne w środowisku, obojętne dla osobników nieuczulonych, zdolne do wzbudzania
stanu alergii (wzrost IgE); molekuły od 10 do 40kDa - drobiny mniejsze nie mogą mostkować sąsiadujących
przeciwciał na komórce tucznej, większe nie przenikną przez błony śluzowe.
pneumoalergeny: pyłki, drobiny
trofoalergeny: jaja, mleko, ryby, barwniki pokarmowe
drogą kontaktu ze skórą: kosmetyki, wykładziny
czynniki anafilaktoidalne: leki zwiotczające, przeciwbólowe na bazie morfiny.
Rola limfocytów Th2 - uwolnienie Il-4
IgE - powinowactwo do receptorów na komórkach tucznych
Bazofile: komórki tuczne
MEDIATORY:
1. Mediatory preformowane:
aminy biogenne (histamina, serotonina)
zwiększenie przepuszczalności naczyń (rumień, obrzęk)
skurcz mięśni gładkich w drzewie oskrzelowym
podrażnianie zakończeń nerwów czuciowych
wzrost aktywności gruczołów egzokrynnych
nasilanie wydzielania innych mediatorów

spadek ciśnienia, przyspieszenie akcji serca
zaczerwienienie skóry
wstrząs anafilaktyczny (u psów objawy ze strony układu pokarmowego: biegunka, wymioty)
proteoglikany (heparyna, siarczan chondroityny)
neutralne proteazy serynowe
czynniki chemotaktyczne
2. Mediatory generowane:
prostaglandyny PGD2
zwiększenie przepuszczalności i rozszerzenie naczyń
skurcz oskrzeli
hamuje agregację płytek
czynnik chemotaktyczny dla neutrofili
leukotrieny
wzmagają adherencję leukocytów do śródbłonka
silnie chemotaktycznie na neutrofile
wzmagają kurczliwość mięśni gładkich
Czynnik aktywujący płytki krwi PAF
cytokiny
TNF
Il4, Il5, Il6
Udział eozynofilów:
główne białko zasadowe (MBP)
peroksydaza eozynofilowa
białko kationowe eozynofilów (ECP)
neurotoksyna eozynofilowa
Niszczy nabłonek, pogłębiając stan zapalny.
Odpowiedź na alergen - reakcja natychmiastowa i późna (nie zawsze występuje; leukotrieny, cytokiny).
-------------------------------------------------------------------------------------------------------------------------------------------
Test Elisa - to ilościowe oznaczanie antygenów lub swoistych przeciwciał w badanym materiale (surowicy); płytki
96-dołkowe, pipety wielokanałowe, płuczki automatyczne, czytniki do ELISA (spektrofotometryczny pomiar
absorbancji); to czuły test kolorymetryczny; Igs związane z enzymem - enzym katalizuje przemianę bezbarwnego
substratu w barwny produkt;
służy do oznaczania m.in.: białek ostrej fazy, haptoglobiny (bydło, trzoda chlewna), IgG, IgM, ACTH, mycoplasma
agalactiae - Ab, BVD (wirusowa biegunka bydła) - Ag lub AB, BRSV, HSV-1 i HSV-2 - choroba Ajewskiego -
ABIgG, HIV i TBE (kleszczowe zapalenie mózgu) - u ludzi.
Test Elisa bezpośredni - wykrywanie Ag z udziałem jednego przeciwciała związanego z enzymem.
Płytkę opłaszczamy lizatem komórkowym lub płynem ustrojowym, w którym poszukujemy antygenu
Ag+Ab E+S=odczyt
Test Elisa pośredni - z użyciem dwóch przeciwciał:
1.
pierwszorzędowe, nieznakowane (np. IgG swoiste dla jakiegoś białka)
2.
drugorzędowe, skierowane przeciwko klasie pierwszego przeciwciała, znakowane enzymem (np. anty-IgG)
Ag+Ab+AntiAb-E+S=odczyt

Test Elisa do oznaczania przeciwciał:
immobilizujemy Ag (np. wirusowy)
w surowicy szukamy i oznaczamy stężenie swoistych IgM lub IgG przeciwko Ag.
Test kanapkowy - może być pośredni (przeciwciała wtórne) lub bezpośredni; do wykrywania i ilościowego
oznaczania antygenu:
immobilizacja przeciwciała zawieszonego w buforze -> płukanie -> blokowanie wolnych miejsc na płytce (kazeina,
albumina, żelatyna)- ok. 2h -> płukanie -> nałożenie materiału badanego na płytkę-> płukanie -> nalewamy roztwór
przeciwciała skoniugowanego z enzymem (jest ono również specyficzne wobec poszukiwanego antygenu, ale
rozpoznaje inny region cząsteczki) -> płukanie -> dodajemy bezbarwny roztwór substratu dla enzymu (enzym
katalizuje przeniesienie bezbarwnego substratu w barwny produkt) - kilkanaście minut -> mierzymy pomiar
absorbancji w czytniku do ELISA.
Substraty w testach ELISA:
dla peroksydazy chrzanowej
ABTS - niebieskozielony - 405nm
TMB - niebieski - 450nm
fosfataza alkaliczna
PNPP - 405nm
Test ELISA może służyć do sprawdzenia skuteczności szczepienia – poziom Igs musimy oznaczyć przed
szczepieniem i 2 tygodnie po szczepieniu.
Kompetycyjny (rywalizacyjny, konkurencyjny) test ELISA:
Do oznaczania w badanym materiale antygenu
Test z „wyłapywaniem przeciwciała”:
Mieszanina – materiał badany , w którym poszukujemy antygenu + stała ilość Ig oczyszczonego (np.
komercyjnego), znakowanego enzymem.
Im więcej antygenu w badanym materiale, tym mniej znakowanych Ig przyłączy się do antygenu
immobilizowanego.
Testy konkurencyjne zazwyczaj są używane do wykrywania haptenów - brak zdolności do jednoczesnego
przyłączania dwóch przeciwciał.
Enzym - awidyna - przeciwciała biotynylowane
RIA - test radioimmunologiczny:
oznaczanie hormonów, alergenów
do wykrywania IgE przeciwko różnym alergenom (immobilizowany alergen nośnik + badana surowica -
wykrywanie swoiste dla IgE)
OWD - odczyn wiązania dopełniacza:
do wykrywania i miareczkowania antygenów oraz przeciwciał
używa się erytrocytów baranich - mierzy się stopień hemolizy
Etapy OWD:
1.
inkubacja badane inaktywowanej surowicy (wstawiamy na 30min do 56*C - dopełniacz nieaktywny),
mieszamy z Ag i dodajemy zewnętrzny dopełniacz; jeśli są przeciwciała, zwiążą się z Ag, a z nimi
dopełniacz
2.
dodanie układu wskaźnikowego; erytrocyty opłaszczone przeciwciałami
3.
pomiar stopnia hemolizy
Amboceptor - przeciwciała przeciw erytrocytom.
Źródło dopełniacza - surowica świnki morskiej.
OWD do diagnostyki: bruceloza, gorączka Q, zaraza stadnicza koni, nosacizna, chlamydioza
Odczyn Wassermana (WR) - przeciwko kile
Techniki immunodiagnostyczne:
precypitacja
aglutynacja
PRECYPITACJA
Antygeny co najmniej 2-wartościowe (dwie determinanty antygenowe) - przeciwciało wiąże się z dwoma
cząsteczkami antygenu.
Zachodzi najszybciej, a ilość precypitatu jest największa po zmieszaniu ze sobą równoważnych ilości Ag i Ig -
strefa ekwiwalencji.
Inne czynniki: temperatura, pH, stężenie elektrolitów - 0,85% NaCl, stosunek ilościowy Ag i Igs, obecność
dopełniacza (może powodować rozpuszczanie precypitatu.
Reakcja wiązania Ag rozpuszczalnego (białkowego) ze swoistymi przeciwciałami:
1.
w środowisku płynnym - odczyny jakościowe
pierścieniowa
odczyn flokulacyjny - stosuje się w serodiagnostyce kiły
o
kropla surowicy
o
kropla immunogennego Ag kardiolipinowego (występuje w błonie komórkowej krętka)
o
precypitat ma formę kłaczków (pod lupą), zachodzi w wąskim przedziale ekwiwalencji
o
trzeba wykonać próby kontrolne (+ i -)
2.
środowisko stałe (żelowe) - immunodyfuzja - swobodna dyfuzja rozpuszczalnego AG i Igs w żelu
test ilościowy - pojedynczy - 1. reagent zatopiony na stałe w żelu, 2. swobodnie dyfunduje, np. test
Manciniego - ilościowe oznaczanie przeciwciał np. w mleku, surowicy
surowica antyIgG (przeciwko bydła)
wylewamy na płytkę Petriego
wycinanie studzienek
nalewamy surowicę do studzienek
kilkadziesiąt godzin
pierścienie precypitacyjne - mierzymy
test jakościowy - podwójny
AGLUTYNACJA
Ag na powierzchni nośników, upostaciowiony; zlepianie aglutynogenów pod wpływem swoistych przeciwciał
(aglutynin), głównie IgM; powstały agregat, to aglutynat.
W organizmie zlepianie komórek patogenu - usuwanie, zapobieganie rozprzestrzenianiu.

Przeciwciała niekompletne - mniejszy kąt rozwarcia.
Zastosowanie:
aglutynacja limfocytów - określanie MHC
erytrocytów - grupy krwi
bakterii - diagnostyka mikrobiologiczna
Aglutynogeny:
komórki - noszą na powierzchni naturalny Ag: erytrocyty, leukocyty, bakterie, grzyby
sztuczne nośniki - cząsteczki lateksu/polistyrenu - niosące Ag obcy uprzednio opłaszczony na ich
powierzchni
Czynniki: pH, temperatura (ciepłe - 20*C - izoaglutyniny; zimne - 4*C), czas (15-60min), siła jonowa (im mniejsza
tym lepiej)
Aglutynacja:
1.
bezpośrednia - Igs reagują bezpośrednio z naturalnym Ag na powierzchni komórek
szkiełkowa - wykrywanie antygenu (grupy krwi, serologia bakterii - diagnostyka brucelozy -> odczynnik:
inaktywowane brucella+kropla surowicy)
probówkowa - miano przeciwciał (metoda półilościowa) skierowanych przeciwko danemu Ag w badanej
surowicy
o Aglutynacja:
H (rzęskowa, otoczkowa)
(grudkowa) - zwarte grudki opadają na dno
Vi - zlepianie endotoksyny, powstają zbite aglutynaty
o odczyn Widdla - dur brzuszny (Salmonella typhi); odczyn Weila-Felicka - dur/tyfus plamisty; odczyn Wrighta
- bruceloza
2.
pośrednia - Igs reagują z Ag rozpuszczonym na nośniku - hemaglutynacja/odczyn lateksowy
hemaglutynacja - erytrocyty baranie lub ludzkie 0Rh- nie mogą reagować z surowicą odpornościową
Antygeny grupowe:
układ AB0 (polisacharydy) - na wszystkich komórkach w organizmie
wyłącznie na erytrocytach: Rh, MNS
Anty-A, anty-B - izoaglutyniny
Próba krzyżowa:
próba podstawowa (surowica biorcy+krwinki dawcy)
próba dodatkowa (surowica dawcy+krwinki biorcy)
autokontrola (surowica biorcy+krwinki biorcy)
Odczyn Coombsa - wykrywa IgG, które wiążą się z erytrocytami, ale nie powodują aglutynacji
rozpoznawanie choroby hemolitycznej noworodków
niedokrwistość autoimmunohematolityczna
odczyny potransfuzyjne
1.
pośredni - przeciwciała w surowicy
2.
bezpośredni - na erytrocytach
Reakcje nadwrażliwości typu II (cytotoksyczne) - powodowane są przez IgG lub IgM.
Antygenami są przeważnie naturalne składniki błony komórkowej lub hapten (substancje wewnątrzpochodne)
zabsorbowane biernie na powierzchni komórek (erytrocyty, granulocyty, płytki krwi - najczęściej dotyczy).

Reakcje przeciwko erytrocytom:
niezgodne grupowo przetaczanie krwi
choroba hemolityczna u noworodków
Reakcje poprzetoczeniowe u ludzi:
niektóre układy grup krwi u człowieka charakteryzują się antygenami, które są względnie silnymi
immunogenami i takie antygeny przede wszystkim wywołują powstanie przeciwciał
do uczulenia dochodzi przez kontakt z identycznymi epitopami występującymi w sposób stały lub
przypadkowy na drobnoustrojach
U kotów trzy grupy krwi: A (nie zawsze mają izoaglutyniny anty-B, mniejsza reaktywność), B (duża
reaktywność immunologiczna przeciwciał) i AB - uwarunkowania rasowe i geograficzne.
Świnie - 15 układów grupowych, 79 Ag
Psy - największe ryzyko - DEA-2
Bydło - 11 układów grupowych, 79 Ag
Konie - 7 układów grupowych, 26 Ag
Hemoliza wewnątrznaczyniowa: IgM+dopełniacz
Hemoliza zewnątrznaczyniowa: IgG+fagocyty
Test większy - SB+KD
Test mniejszy - SD+KB
Aglutynacja - powtórzenie z innym dawcą
U koni - nie przekracza 2%
U mułów co 10 ciąża zagrożona - konflikt serologiczny.
Łożysko nie przepuszcza przeciwciał, niebezpieczeństwo pojawia się, gdy źrebię napije się siary.
Hemoliza indukowana lekami: niektóre substancje będące haptenami wiążą się z erytrocytami, granulocytami i
płytkami krwi, tworzy się Ag pełnowartościowy; niedokrwistość, trombocytopenia, granulocytopenia; penicylina,
chloropromazyna, fenacetyna, chinidyna, pyralgina.
Nadwrażliwość typu III - na skutek kompleksów immunologicznych (IC - immune complex); skutkiem są
uszkodzenia tkanek zależne od dopełniacza i komórek efektorowych.
Czynniki wpływające na odkładanie się IC w tkankach: rozpuszczalność Ag, wielkość IC, powinowactwo
przeciwciał, dopełniacz, miejscowe warunki mikrokrążenia i specyfika tkanki (szczególnie nerki); małe i duże
kompleksy - łatwo usuwane, średnie są najsilniejsze patogenowo.
Reakcje patologiczne:
1.
in situ - po miejscowym podaniu Ag (odczyn Arthusa; zewnątrzpochodne alergiczne zapalenie pęcherzyków
płucnych; blue eye u psów - adenowirus typu I)
2.
kompleksy krążą we krwi i osadzają się w różnych tkankach (choroba posuwnicza - 4-14 dni po podaniu
obcogatunkowej surowicy w okresie narastania stężenia swoistych przeciwciał -> kompleksy odkładają się
w naczyniach włosowatych ->odczyn zapalny -> gorączka, bóle i obrzęki stawów, przejściowy białkomocz)
Nadwrażliwość typu IV - nie biorą udziału przeciwciała; późna (kilka/kilkanaście dni po podaniu czynnika);
interakcja Ag z Th swoiście uczulonymi -> wydzielanie cytokin -> aktywacja komórek (makrofagi, limfocyty Tc,
czasem bazofile)
1.
nadwrażliwość kontaktowa i tuberkulinowa

odczyn tuberkulinowy - wtórna odpowiedź organizmu; badanie diagnostyczne stanu przeciwgruźliczej
odporności organizmu; inne antygeny: nosacizna - Maleina, choroba Johnego-Johinina, bruceloza -
brucelina, kiła - luetyna, histoplazmoza - histoplazmina, toksoplazmoza - toksoplazmina
kontaktowa - reakcja wypryskowa w miejscu kontaktu; Ag: chrom, nikiel, żywice epoksydowe, gumy,
leki; komórki Langerhansa - APC dla Th -> cytokiny -> makrofagi, monocyty -> cytokiny, enzymy
proteolityczne, prostaglandyny = grudka wysiękowa
2.
nadwrażliwość ziarniakowa (trąd) - rozwija się 21-28 dni, nagromadzenie i proliferacja makrofagów
Tolerancja immunologiczna - brak odpowiedzi humoralnej lub komórkowej na określony Ag.
Autotolerancja - tolerancja dotycząca własnych Ag.
Tolerancja centralna - obejmuje limfocyty T (zaprezentowanie własnych Ag niedojrzałym limfocytom T w grasicy
może dać początek jakiejś linii regulatorowej) i B (apoptoza, zmiana swoistości receptora, obniżenie ekspresji
receptora) w trakcie dojrzewania w narządach centralnych.
Tolerancja obwodowa - obejmuje dojrzałe limfocyty w krwi i tkankach; anergia - brak aktywacji limfocytów, które
nie otrzymały drugiego sygnału (Il-2), delecja, supresja; ekspozycja na autoantygen bez obecności limfocytu T -
anergia.
Tolerancja - mechanizmy:
tolerancja związana z limfocytami T (negatywna selekcja w grasicy, delecja w krwi obwodowej, anergia,
zachowanie aktywności i funkcji efektorowych limfocytów)
tolerancja związana z limfocytami B
sekwestracja autoantygenu (molekularna - limfocyt rozpoznaje ukryte epitopy, anatomiczna)
aktywna supresja
Limfocyty regulatorowe i aktywna supresja - hamowanie aktywności komórek przez interakcję z innymi
komórkami produkującymi supresyjne cytokiny lub z limfocytami idiotypowo swoistymi, które rozpoznają receptor
dla Ag.
Przeciwciała antyidiotypowe - mogą naśladować autoantygeny (choroba Grovesa-Basedowa).
Mimikra molekularna:
zapalenie rogówki spowodowane wirusem simplex typu I
gorączka reumatyczna
Choroby:
1.
narządowo swoiste: Hashimoto, Graves-Basedowa, Addison, stwardnienie rozsiane, pęcherzyca zwykła,
cukrzyca typu I
2.
narządowo nieswoiste: toczeń układowy, twardzica układowa
Podział ze względu na mechanizmy efektorowe:
zależne od mechanizmów komórkowych - aktywuje Th1 (Il-12, IFN-gamma): cukrzyca typu I, stwardnienie
rozsiane
od wytworzenia autoprzeciwciał - Th2 (Il-4, Il-5, Il-13), opsonizacja antygenu (komórek przez
autoprzeciwciała): kompleksy immunologiczne - toczeń układowy rumieniowaty
Środki immunomodulujące:
immunostymulacja (prewencja i leczenie chorób zakaźnych)

immunosupresja (przeszczepy, autoimmunizacyjne, alergie)
1.
fizyczne - usunięcie narządów limfatycznych, napromieniowanie
2.
farmakologiczne - glikokortykoidy, inhibitory niskocząsteczkowe, przeciwciała
Wyszukiwarka
Podobne podstrony:
cwiczenie9 id 125928 Nieznany
cwiczenia23 id 124959 Nieznany
cwiczenia 4 2 id 124428 Nieznany
Fizjologia Cwiczenia 3 id 17436 Nieznany
cwiczenie 4 2 id 125411 Nieznany
cwiczenie 9 id 125104 Nieznany
Immunologia ćwiczenia
Choroby skory koni cwiczenie id Nieznany
Cwiczenia 5 id 124444 Nieznany
opis cwiczenia id 336864 Nieznany
cwiczenie 5 id 101060 Nieznany
immunologia cw 3 id 212083 Nieznany
Cwiczenie 3 id 125305 Nieznany
CWICZENIE 6 2 id 99618 Nieznany
cwiczenie 5 id 125447 Nieznany
Cwiczenie 6 id 125101 Nieznany
cwiczenia2 4 id 124943 Nieznany
cwiczenie 2 id 125220 Nieznany
ćw1-metody izolacji Ig-wysalanie, immunologia, ćwiczenia
więcej podobnych podstron