2013-03-21
1
Kilka słów o zajęciach z chemii
w semestrze letnim 2012/2013
Szczegóły programu zawiera sylabus;
Chemia składa się z 3 elementów – wykład, laboratorium,
ćwiczenia;
Program wykładów:
pierwsze cztery – c.d. zagadnień z chemii ogólnej, przydatnych
w laboratorium i ćwiczeniach;
pozostałe – wiązanie chemiczne w związkach nieorganicznych;
Program ćwiczeń i laboratoriów – na zajęciach;
OK = 0,5*OE+0,3*L+0,2*C
Związki koordynacyjne
25 lutego 2013
Związki koordynacyjne
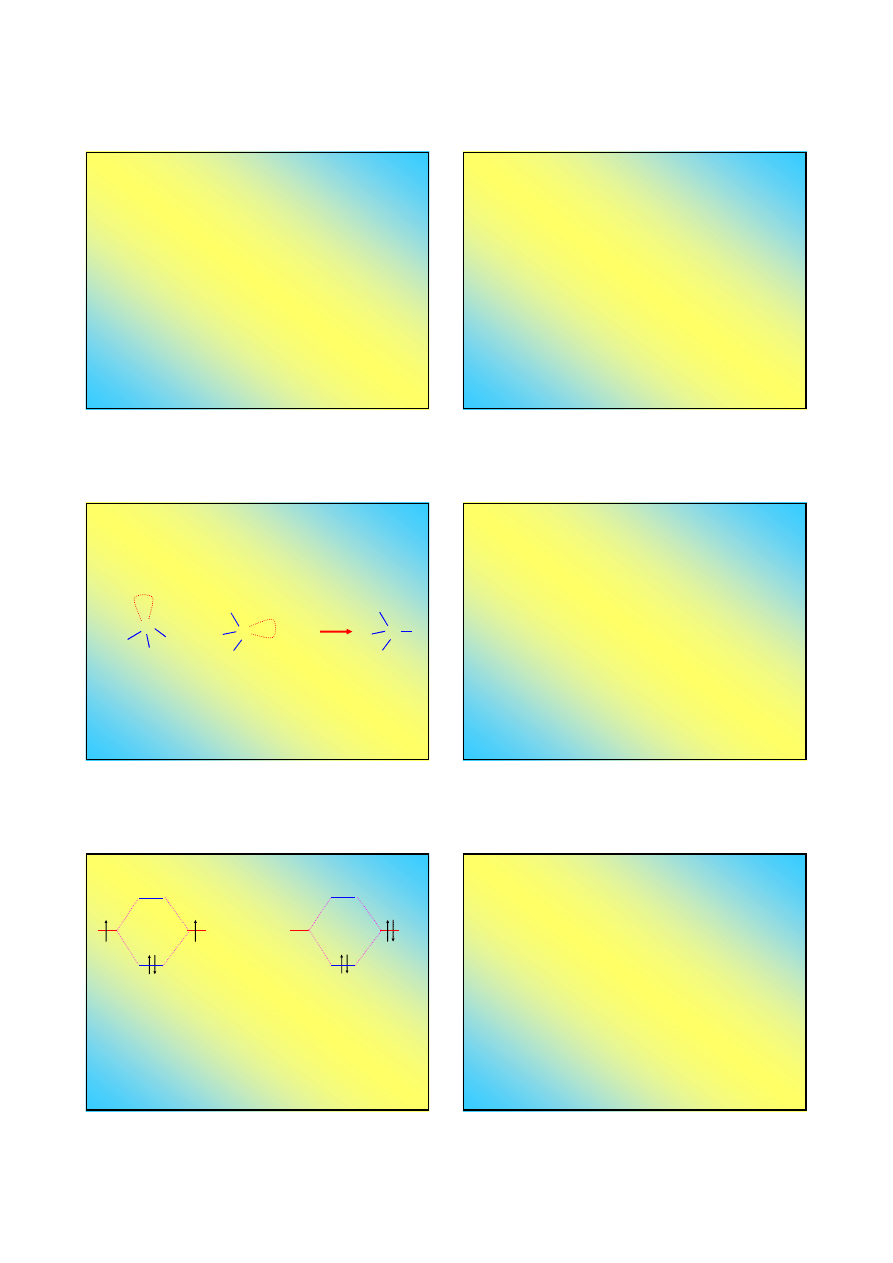
Kwasy i zasady według Lewisa:
Zasada
– donor pary elektronowej
Kwas
– akceptor pary elektronowej
N
H
H
H
Cząsteczka NH
3
ma wolną parę
elektronową
N
H
H
H
+ H
+
N
H
H
H
H
+
+
+
→
+
4
3
NH
H
NH
zasada kwas produkt
+
+
→
+
O
H
H
O
H
3
2
zasada kwas produkt
Kwasy i zasady według Lewisa
Zasady
– cząsteczki z wolną parą elektronową
lub jony ujemne:
NH
3
, H
2
O, OH
-
, Cl
-
, Br
-
, I
-
, SO
4
2-
, itd ...
Kwasy
- cząsteczki z deficytem elektronów lub
jony dodatnie ...
H
+
, Ag
+
, Me
n+
, BF
3
, SO
3
, itd ...
Wiązanie koordynacyjne
σ
(
π
)
σ
(
π
)*
"zwykłe” wiązanie
nakładają się dwa częściowo
zapełnione orbitale atomowe
(mogą być zhybrydyzowane)
σ
(
π
)
σ
(
π
)*
wiązanie koordynacyjne
nakładają się orbitale
atomowe: pusty i zapełniony
(mogą być zhybrydyzowane)
Tworzenie się wiązania koordynacyjnego jest reakcją
kwasowo
-
zasadową
(w sensie Lewisa)
Związki kompleksowe
inaczej związki koordynacyjne lub związki zespolone
Związki, w ktorych występuje wiązanie koordynacyjne
noszą nazwę związków kompleksowych lub
koordynacyjnych lub zespolonych.
Składają się z atomu centralnego, który jest
kwasem
Lewisa
i ma wolne orbitale zdolne do wytworzenia
wiązań. W roztworach jest nim „prawdziwy” jon, w
ciałach stałych atom o odpowiednim stopniu
utlenienia ...
... oraz ligandów, które są
zasadami Lewisa
i mają
pary elektronowe zdolne do wytworzenia wiązań
(jeden ligand może mieć więcej niż jedną parę!).
Liczba koordynacyjna - liczba wiązań w cząsteczce
(jonie) kompleksowym.
2 ≤ L.K. ≤ 12
2013-03-21
2
Liczba koordynacyjna
zależy od:
– rozmiarów jonu centralnego;
– ładunku jonu centralnego;
– rozmiarów ligandów, liczby par elektronowych, ładunku
Jak można poznać rozmiary atomów lub jonów ?
Promień atomowy
lub kowalencyjny oblicza się
biorąc pod uwagę odległości międzyjądrowe.
Promień jonowy
oblicza się przy założeniu, że
„większe” jony (aniony) stykają się z sobą, a
„mniejsze” (kationy) wypełniają pozostałą przestrzeń.
Promienie atomowe i jonowe
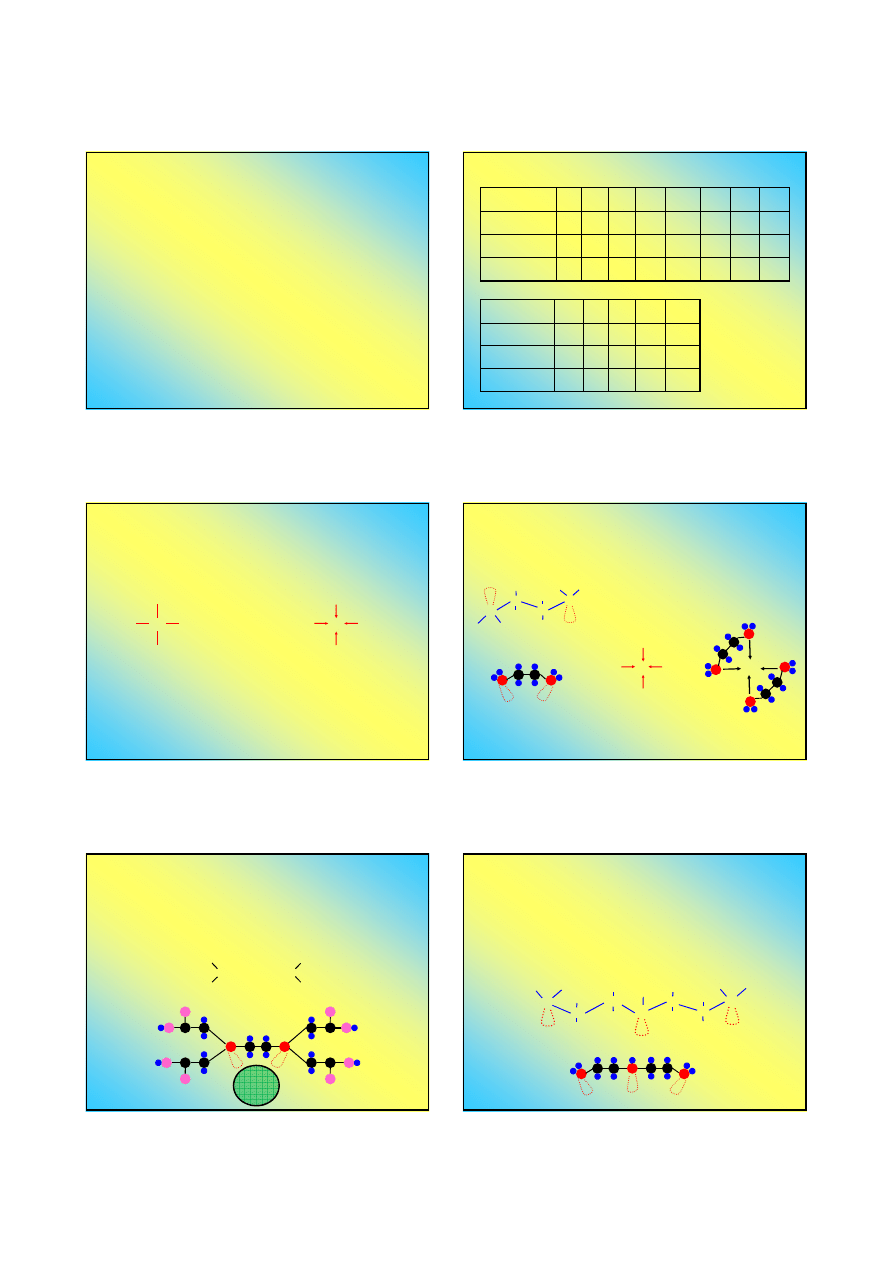
Pierwiastek
r
A
[pm]
r
j
[pm]
Jon
Pierwiastek
r
A
[pm]
r
j
[pm]
Jon
K
196
152
K
+
Na
154
116
Na
+
Sr
192
132
Sr
2+
La
169
117
La
3+
Ag
158
129
Ag
+
Zn
188
131
Zn
2+
Cu
138
91
Cu
+
~60
Cu
2+
O
73
126
O
2-
F
72
119
F
-
S
102
170
S
2-
I
133
206
I
-
Te
135
207
Te
2-
Wiązanie koordynacyjne
Wiązanie koordynacyjne ma na ogół charakter
częściowo jonowy (jest spolaryzowane)
X
A
A
A
A
M
L
L
L
L
„Zwykłe” wiązanie
Pary elektronowe
zaznacza się
kreskami
Wiązanie koordynacyjne
Pary elektronowe zaznacza się
strzałkami od donora do
akceptora, choć zwykle nie jest
to kierunek polaryzacji wiązań
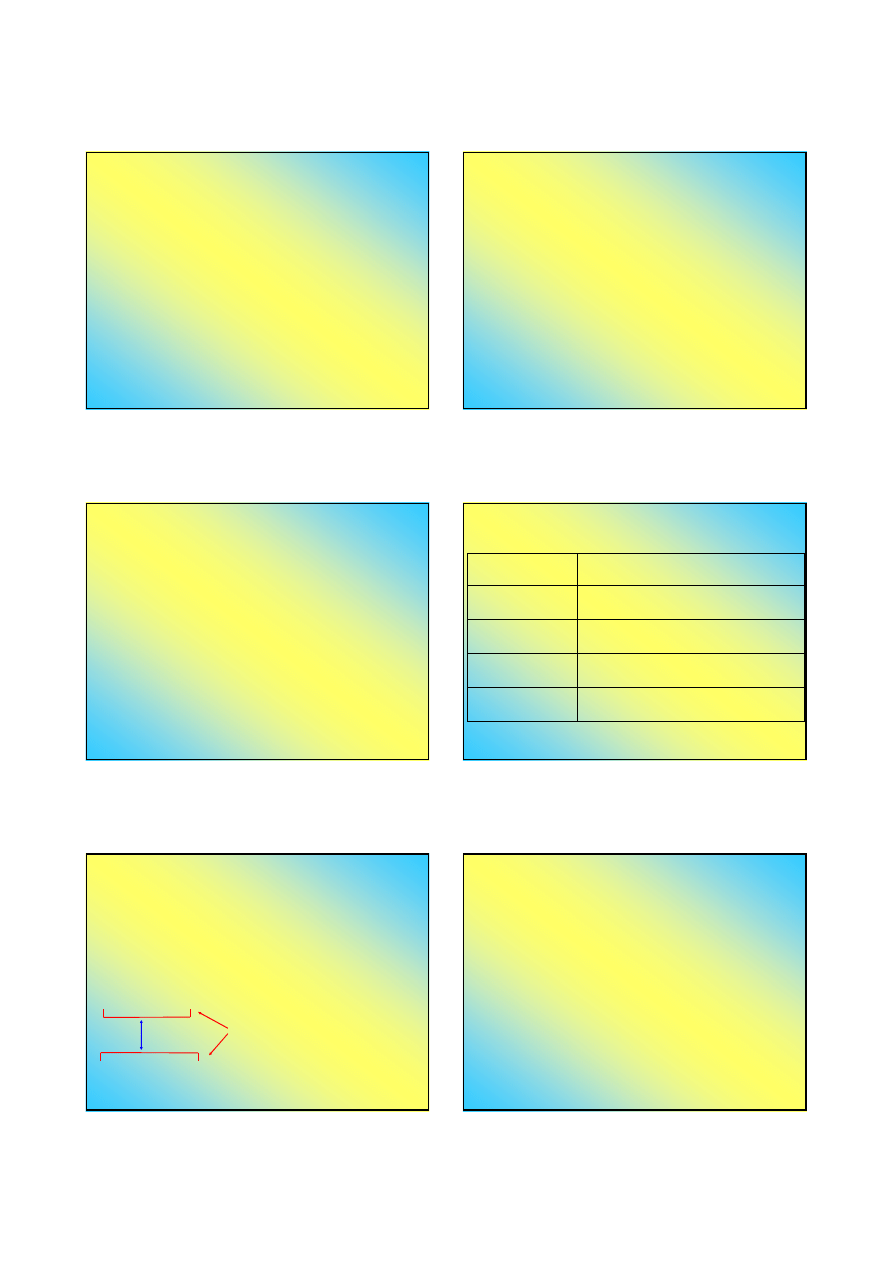
Kompleksy chelatowe (kleszczowe) (1)
Niektóre ligandy mają więcej niż jedną parę
elektronową, zdolną do wytworzenia wiązania
koordynacyjnego ...
N
N
C
C
H
H
H
H
H
H
H
H
etylenodiamina (en) ma dwie
pary elektronowe przy atomach
azotu grup aminowych
M
L
L
L
L
M
ML
4
L.K.=4
M(en)
2
L.K.=4
Kompleksy chelatowe (kleszczowe) (2)
Sól sodowa kwasu etylenodiaminoczterooctowego
(EDTA – ethylenediaminetetraacetic acid) tworzy
trwałe kompleksy chelatowe z metalami w
roztworach wodnych
HOOC—H
2
C
HOOC—H
2
C
CH
2
—COOH
CH
2
—COOH
N
—CH
2
—CH
2
—
N
Me
n+
Kompleksy (wielokleszczowe) (3)
Niektóre ligandy mają jeszcze więcej par
elektronowych, zdolnych do wytworzenia wiązania
koordynacyjnego ...
dietylenotriamina ma trzy pary elektronowe przy
atomach azotu grup aminowych
N
N
C
C
H
H
H
H
H
H
H
C
C
H
H
H
H
N
H
H
2013-03-21
3
Kształt kompleksu
*
Kształt jonu kompleksowego (cząsteczki z wiązaniami
koordynacyjnymi) jest określony przez liczbę
koordynacyjną, która zwykle wiąże się z typem
hybrydyzacji atomu centralnego ...
*
Niektóre orbitale atomu centralnego mogą pozostać
„puste”, niektóre mogą nie tworzyć w ogóle wiązań
L.K. kształt cząsteczki
2 liniowa, trójkątna
3 trójkątna, tetraedryczna
(piramida trygonalna)
4 tetraedryczna, kwadratowa płaska
5 bipiramida trygonalna, oktaedr
6 oktaedr
Nazwy związków kompleksowych
Związek (jonowy lub o znacznym udziale
wiązania jonowego) zaliczamy do związków
kompleksowych, jeśli przynajmniej jeden z
jonów, które go tworzą zawiera wiązania
koordynacyjne (ma charakter kompleksu)
Nazwy związków mających charakter soli
piszemy i czytamy zgodnie z „zasadami
ogólnymi”:
►
piszemy wzór: - kation - anion
►
czytamy nazwę: - anion – kation
Nazwy związków kompleksowych (2)
zalecenia IUPAC
Ligandy piszemy i czytamy w następującej kolejności grup:
proste aniony:
OH
-
,
O
2-
,I
-
,
Br
-
itd...
inne aniony nieorganiczne
SO
4
2-
,
HSO
4
-
,
SO
4
2-
,
PO
4
3-
...
aniony organiczne, np.
C
2
O
4
2-
, winiany, mleczany ...
H
2
O
(akwa),
NH
3
(amina)
inne obojętne ligandy nieorganiczne
(
NO
nitrozyl,
CO
karbonyl)
obojętne ligandy organiczne (
-CH
3
metylo,
-C
6
H
5
fenylo itd..)
Wewnątrz każdej z grup ligandy podajemy w porządku
alfabetycznym ...
Do podawania ilości ligandów używamy liczebników
greckich:
1 - (mono); 2 -
di-
(bis); 3 -
tri-
(tris); 4 -
tetra -
(tetrakis);
5 –
penta -
; 6 –
heksa –
Nie będzie uważane za wielki błąd podawanie ilości
ligandów przy pomocy liczebników polskich:
Nazwy związków kompleksowych - przykłady
K
4
[Fe(CN)
6
]
heksacyjanożelazian (II) potasu
K
3
[Fe(CN)
6
]
heksacyjanożelazian (III) potasu
[Co(NH
3
)
6
]Cl
3
chlorek heksaaminakobaltu (III)
[CoCl
2
(H
2
O)
2
]Br
bromek dichlorodiakwakobaltu (III)
Fe(CO)
5
pentakarbonylożelazo (0)
żelazocyjanek potasu
żelazicyjanek potasu
Izomeria związków kompleksowych
o
IZOMERIA - występowanie dwóch lub więcej
związków (izomerów), które mają taki sam
wzór sumaryczny, a różne wzory strukturalne
(i właściwości)
Izomeria jonowa
[Co(NH
3
)
5
Cl]SO
4
siarczan(VI) chloropenta-
aminakobaltu (III)
[Co(NH
3
)
5
SO
4
]Cl
chlorek siarczano(VI) penta-
aminakobaltu (III)
sfera
wewnętrzna
sfera
zewnętrzna
Izomeria związków kompleksowych (2)
Izomeria hydratacyjna
Hydraty
- związki, które zawierają w strukturze krystalicznej
cząsteczki wody w ilości określonej stechiometrycznie
[Cr(H
2
O)
6
]Cl
3
chlorek heksaakwachromu(III)
[Cr(H
2
O)
5
Cl]Cl
2
⋅
H
2
O
monohydrat chlorku chloropentaakwachromu(III)
[Cr(H
2
O)
4
Cl
2
]Cl
⋅
2H
2
O
bihydrat chlorku dichlorotetraakwachromu(III)
2013-03-21
4
Izomeria związków kompleksowych (3)
Izomeria koordynacyjna
Izomeria koordynacyjna
występuje wtedy, gdy anion i
kation są jonami kompleksowymi i wymieniają się
ligandami ...
[
Co
(NH
3
)
6
]
3+
[
Cr
(CN)
6
]
3-
heksacyjanochromian(III)
heksaaminakobaltu(III)
[
Cr
(NH
3
)
6
]
3+
[
Co
(CN)
6
]
3-
heksacyjanokobaltan(III)
heksaaminachromu(III)
Izomeria jonowa, hydratacyjna i koordynacyjna
są
określane wspólną nazwą
izomerii strukturalnej
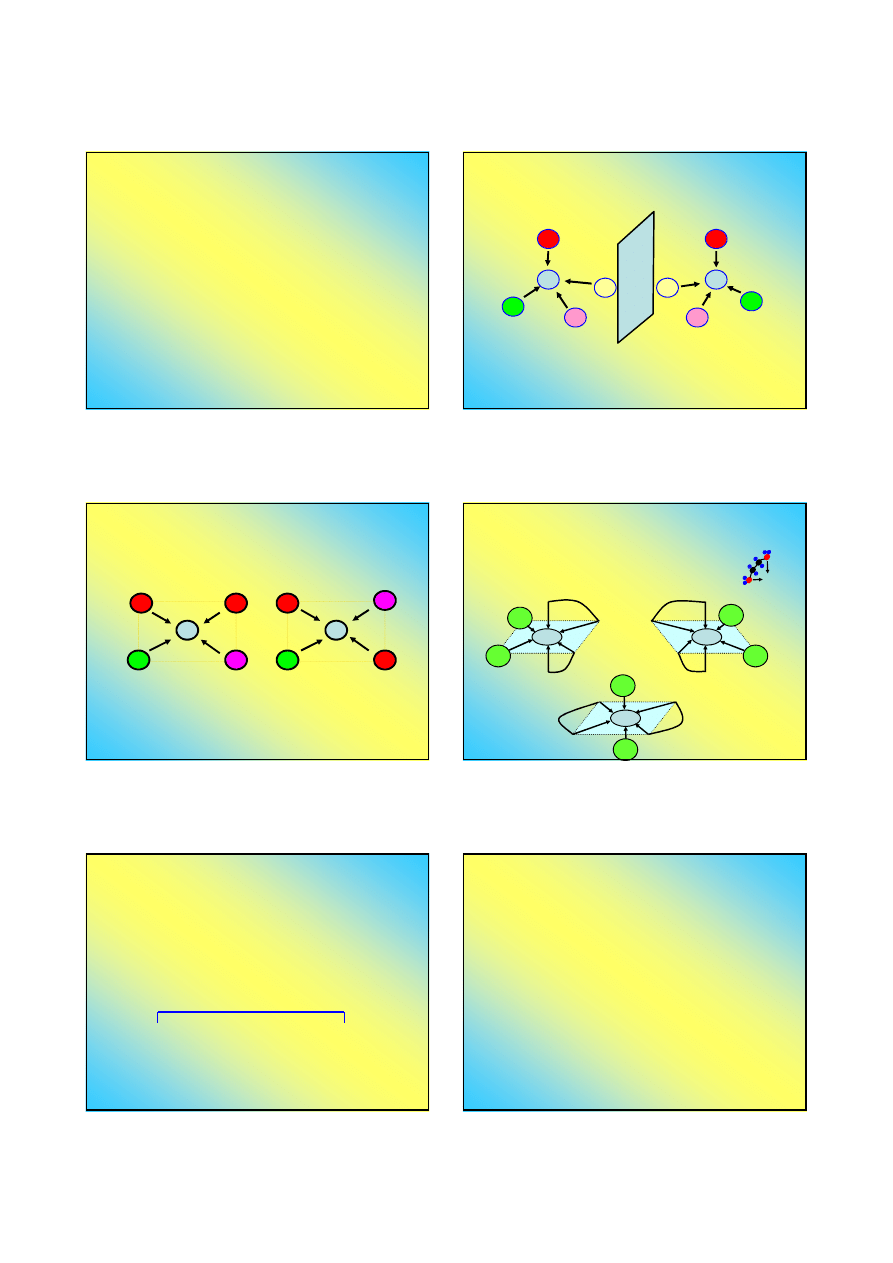
Stereoizomeria związków kompleksowych
Izomeria optyczna
◘
Izomeria optyczna polega na występowaniu dwóch
struktur związku, które stanowią swoje lustrzane odbicia
M
I
F
Cl
Br
Izomer „prawy” - D
M
F
I
Br
Cl
Izomer „lewy” - L
Nie da się otrzymać przez obrót izomeru "prawego"
izomeru "lewego" i odwrotnie ...
Warunkiem występowania izomerii optycznej jest LK
≥≥≥≥
4
oraz obecność co najmniej czterech różnych ligandów (nie
dotyczy kompleksów chelatowych)
Stereoizomeria związków kompleksowych
Izomeria geometryczna (cis-trans)
Warunkiem występowania izomerii geometrycznej
jest LK
≥
4, obecność co najmniej dwóch rodzajów
ligandów, w tym dwóch identycznych
M
Br
Br
Cl
I
M
Br
Br
Cl
I
cis
jednakowe ligandy
znajdują się po tej samej
stronie
płaskiego kompleksu
trans
jednakowe ligandy
znajdują się po
przeciwnych stronach
płaskiego kompleksu
Stereoizomeria związków kompleksowych
Izomeria optyczna + geometryczna
Oba rodzaje stereoizomerii mogą występować
równocześnie, np. w oktaedrycznym jonie
kompleksowym
[CoCl
2
(en)
2
]
+
Co
3+
Cl
-
Cl
-
en
en
Co
3+
Cl
-
Cl
-
en
en
Co
3+
Cl
-
Cl
-
en
en
CIS
optyczna
TRANS
L
D
G
E
O
M
E
T
R
Y
C
Z
N
A
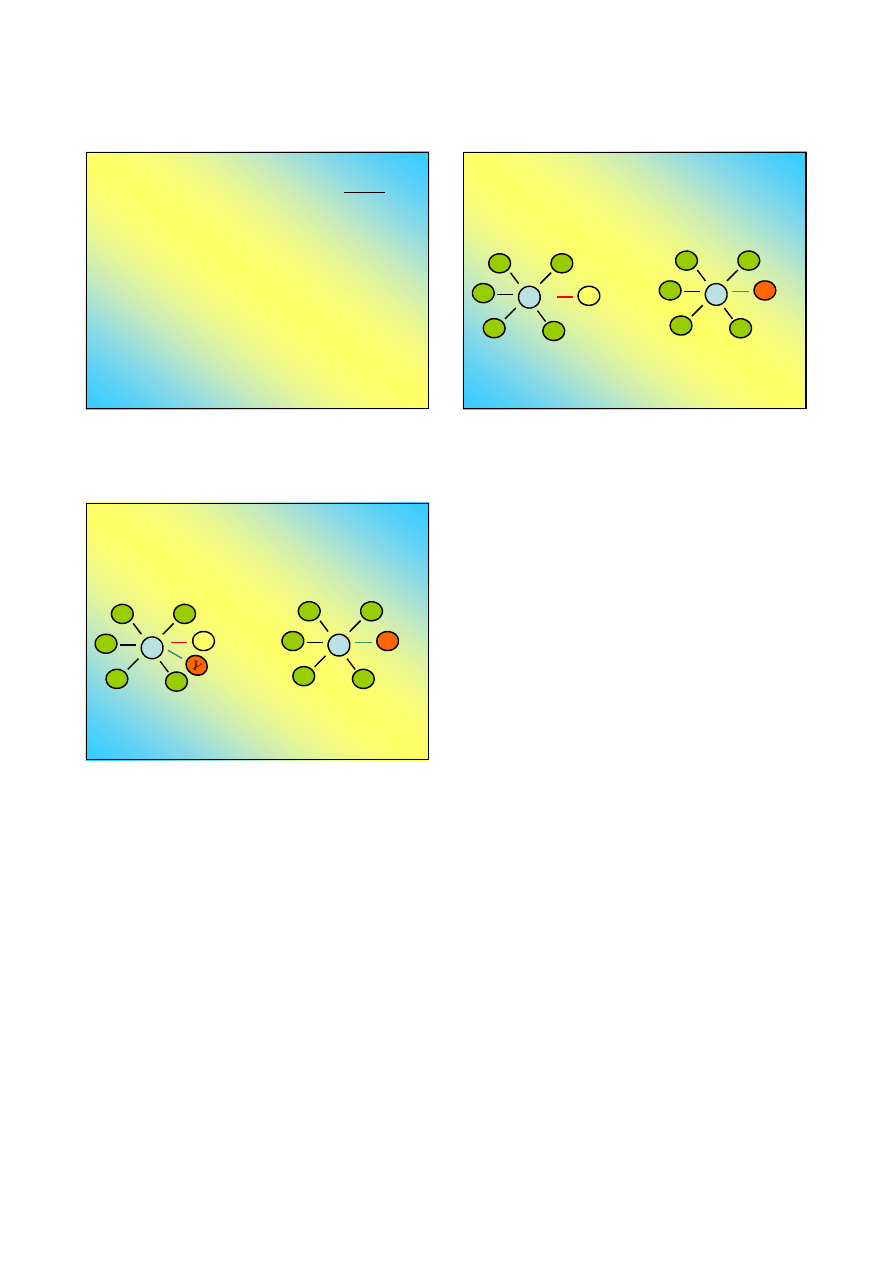
„Moc” wiązania koordynacyjnego
Trwałość związków kompleksowych
W zależności od ładunku, rozmiarów i kształtu
można uszeregować ligandy według malejącej
energii wiązań koordynacyjnych ...
Aniony:
CN
-
> SCN
-
> F
-
> Cl
-
> Br
-
> I
-
...
Cząsteczki obojętne:
NH
3
> RNH
2
> RR’NH > RR’R"N > H
2
O >
ROH > R
2
O > R
3
As > R
3
P > R
3
S ...
aminy
etery
Czynniki wpływające na trwałość związku
(jonu) kompleksowego
Pole elektrostatyczne
wokół jonu centralnego:
im wyższy ładunek jonu i im mniejszy jego
promień tym wyższa trwałość jonu
kompleksowego
Rozmieszczenie ładunku:
nie powinno być zbyt dużego przesunięcia
ładunku (najwyżej ±1 e) – „postulat obojętności”
(Pauling)
Rodzaj ligandów
- np. kompleksy chelatowe są
trwalsze od „zwykłych”
Pole elektryczne ligandów
działa stablizująco
na jon kompleksowy
2013-03-21
5
Trwałość związku (jonu) kompleksowego
Ujęcie ilościowe
♦
Określa się ją przy pomocy tzw. stałej trwałości, która
jest stałą równowagi reakcji tworzenia kompleksu:
+
+
→
←
+
n
x
n
MeL
xL
Me
]
[
[
]
x
n
n
x
trw
L
Me
MeL
K
]
[
]
[
]
[
⋅
=
+
+
xL
Me
MeL
n
n
x
+
→
←
+
+
]
[
[
]
+
+
⋅
=
n
x
x
n
nietrw
MeL
L
Me
K
]
[
]
[
]
[
Kompleks jest tym trwalszy im wyższa jest stała trwałości
Można również posługiwać się stałą równowagi reakcji
rozpadu kompleksu, czyli stałą nietrwałości:
Tworzenie się kompleksu
[
]
6
3
2
2
6
3
2
6
3
3
2
]
[
]
[
]
)
(
[
]
)
(
[
6
NH
Co
NH
Co
K
NH
Co
NH
Co
trw
⋅
=
→
←
+
+
+
+
+
W roztworze wodnym zazwyczaj tworzą się akwakompleksy
(hydratacja), a utworzenie aminakompleksu jest reakcją
stopniowej wymiany ligandów
Tworzenie się kompleksu
Wymiana ligandów (1)
[
]
[
]
[
]
[
]
3
2
6
2
2
2
3
5
2
1
NH
]
O)
[Co(H
O
H
)]
(NH
O)
[Co(H
K
⋅
⋅
=
+
+
O
H
)]
(NH
O)
[Co(H
NH
]
O)
[Co(H
2
2
3
5
2
3
2
6
2
+
→
←
+
+
+
O
H
]
)
(NH
O)
[Co(H
NH
)]
(NH
O)
[Co(H
2
2
2
3
4
2
3
2
3
5
2
+
→
←
+
+
+
[
]
[
]
[
]
[
]
3
2
3
5
2
2
2
2
3
4
2
2
NH
)]
(NH
O)
[Co(H
O
H
]
)
(NH
O)
[Co(H
K
⋅
⋅
=
+
+
Tworzenie się kompleksu
Wymiana ligandów (2)
[
]
[
]
[
]
[
]
3
2
2
3
4
2
2
2
3
3
3
2
3
NH
]
)
(NH
O)
[Co(H
O
H
]
)
(NH
O)
[Co(H
K
⋅
⋅
=
+
+
O
H
]
)
(NH
O)
[Co(H
NH
]
)
(NH
O)
[Co(H
2
2
3
3
3
2
3
2
2
3
4
2
+
→
←
+
+
+
O
H
]
)
(NH
O)
[Co(H
NH
]
)
(NH
O)
[Co(H
2
2
4
3
2
2
3
2
3
3
3
2
+
→
←
+
+
+
[
]
[
]
[
]
[
]
3
2
3
3
3
2
2
2
4
3
2
2
4
NH
]
)
(NH
O)
[Co(H
O
H
]
)
(NH
O)
[Co(H
K
⋅
⋅
=
+
+
Tworzenie się kompleksu
Wymiana ligandów (3)
[
]
[
]
[
]
[
]
3
2
4
3
2
2
2
2
5
3
2
5
NH
]
)
(NH
O)
[Co(H
O
H
]
)
O)(NH
[Co(H
K
⋅
⋅
=
+
+
O
H
]
)
O)(NH
[Co(H
NH
]
)
(NH
O)
[Co(H
2
2
5
3
2
3
2
4
3
2
2
+
→
←
+
+
+
O
H
]
)
[Co(NH
NH
]
)
O)(NH
[Co(H
2
2
6
3
3
2
5
3
2
+
→
←
+
+
+
[
]
[
]
[
]
[
]
3
2
5
3
2
2
2
6
3
6
NH
]
)
O)(NH
[Co(H
O
H
]
)
[Co(NH
K
⋅
⋅
=
+
+
Tworzenie się kompleksu
Wymiana ligandów (4)
[
]
[
]
[
]
[
]
6
3
2
6
2
6
2
2
6
3
6
5
4
3
2
1
trw
NH
]
O)
[Co(H
O
H
]
)
[Co(NH
K
K
K
K
K
K
K
⋅
⋅
=
⋅
⋅
⋅
⋅
⋅
=
+
+
O
H
6
]
)
[Co(NH
NH
6
]
O)
[Co(H
2
2
6
3
3
2
6
2
+
→
←
+
+
+
Sumaryczna reakcja jest sumą reakcji 1-6, a stała trwałości
jest iloczynem wszystkich kolejnych stałych
2013-03-21
6
Mechanizmy wymiany ligandów
Wysoka lub niska trwałość kompleksu nie jest
równoznaczna z większą lub mniejszą szybkością
jego tworzenia lub rozpadu (wymiany ligandów);
Kompleksy bierne
reagują powoli, a
kompleksy
labilne
szybko (< 1 min.);
Zależność szybkości reakcji wymiany ligandów od
stężeń reagentów może dostarczać informacji na
temat mechanizmu tej wymiany;
Wymiana ligandów jest procesem wieloetapowym;
Za sumaryczną szybkość reakcji wieloetapowej
odpowiada etap najwolniejszy ...
X
Y
ML
Y
X
ML
+
→
←
+
]
[
]
[
5
5
S
N
1
- Substytucja Nukleofilowa
jednocząsteczkowa
X
ML
X
ML
k
+
→
←
]
[
]
[
5
5
1
ETAP 1
powolny
]
[
]
[
5
5
2
Y
ML
Y
ML
k
→
←
+
ETAP 2
szybki
X
Me
L
L
L
L
L
Me
L
L
L
L
L
Y
]}
{[
v
5
1
X
ML
=
w tym przypadku szybkość reakcji
nie zależy
od stężenia
wprowadzanych „nowych” ligandów Y
S
N
2
- Substytucja Nukleofilowa
dwucząsteczkowa
]
[
]
[
5
5
1
XY
ML
Y
X
ML
k
→
←
+
ETAP 1
powolny
X
Y
ML
XY
ML
k
+
→
←
]
[
]
[
5
5
2
ETAP 2
szybki
Me
L
L
L
L
L
Y
]
[
]}
{[
v
5
1
Y
X
ML
⋅
=
w tym przypadku szybkość reakcji
zależy także
od
stężenia wprowadzanych ligandów Y
Me
L
L
L
L
L
X
Wyszukiwarka
Podobne podstrony:
01 aeid 3052 Nieznany (2)
NLP Magazine 01 id 320421 Nieznany
I CKN 316 01 1 id 208193 Nieznany
14 5id 15201 Nieznany (2)
domowe2 01 id 140222 Nieznany
CHORZOW1 TRAGEDIA 28 01 2006 id Nieznany
08 5id 7231 Nieznany
01 Uprawnienia w budownictwieid Nieznany
Cwiczenie 01 id 98935 Nieznany
03 5id 4121 Nieznany
HUR2006 01 id 207254 Nieznany
2 modul 5id 20554 Nieznany (2)
01 przedmowa zg6kmxuegzl2pilvqx Nieznany (2)
712[06] S1 01 Rozpoznawanie mat Nieznany
01 Wprowadzenieid 2669 Nieznany
1 5id 8373 Nieznany (2)
gazeta prawna 25 01 2005 (1382) Nieznany
01 Niezgodnaid 2863 Nieznany
19 5id 18138 Nieznany (2)
więcej podobnych podstron