1
Rola epidemiologii molekularnej w
ocenie czynników ryzyka występowania
chorób. Molekularne i cytogenetyczne
markery skutku biologicznego
i podatności osobniczej.
Epidemiologia
Analityczna – czynniki etiologiczne/
ryzyka
czynniki sprawcze, czynniki
osobnicze, ekspozycje środowiskowe,
styl życia
Opisowa- rozpowszechnienie choroby
Opis –w odniesieniu do osób, miejsca
i czasu, konsekwencje w odniesieniu
do populacji
Medycyna zapobiegawcza
Zdrowie publiczne
Przyczyna
Choroba
brak choroby
Epidemiologia
molekularna
?
Epidemiologia molekularna
• zajmuje się wpływem potencjalnych genetycznych
i środowiskowych czynników ryzyka, identyfikowanych na
poziomie molekularnym, na etiologię, rozpowszechnienie
i możliwość zapobiegania chorobom wśród osób
spokrewnionych i populacjach
• bazuje na epidemiologii klasycznej, ale wykorzystuje narzędzia
biologii molekularnej do oceny częstości występowania chorób
w populacji oraz do poszukiwania potencjalnych czynników
sprawczych
podstawowym założeniem jest istnienie kontinuum pomiędzy
narażeniem na czynniki toksyczne (kancerogeny), ich
metabolizmem (aktywacja lub deaktywacja), powstawaniem
adduktów z białkami lub kwasami DNA, zmianami w DNA
(uszkodzenia chromosomów, mutacje), gromadzeniem się
tych zmian i wreszcie pojawieniem się raka
Proces kancerogenezy w ujęciu
epidemiologii molekularnej
:
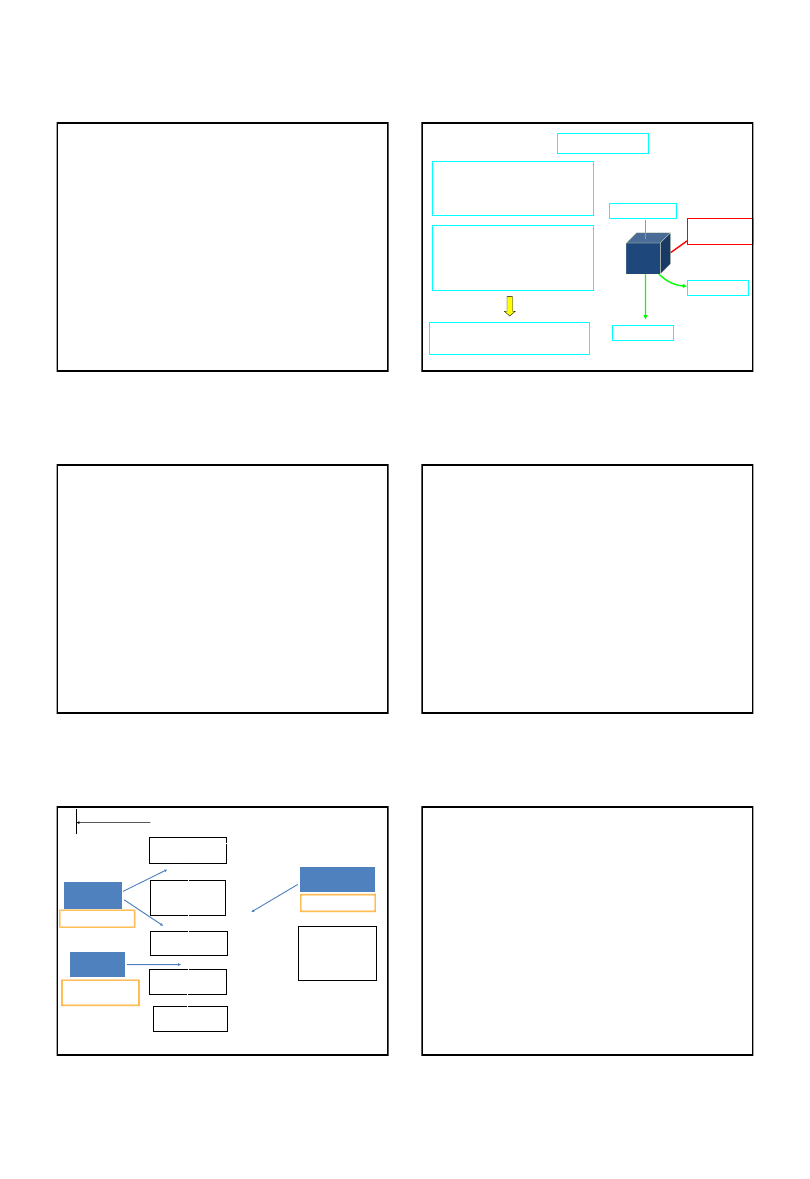
Znaczenie biologicznych markerów w pomiarze
ekspozycji i jej skutków (choroby)
dawka
wewnętrzna
dawka
biologicznie
skuteczna
wczesna reakcja
biologiczna
zmiana struktury
i funkcji
kliniczna postać
choroby
czynniki
środowiskowe
styl życia
EKSPOZYCJA
biomarkery
podatności
biomarkery
ekspozycji
biomarkery
skutku
addukty, wirusy
mutacje,
przeciwciała
geny, enzymy
diagnoza na poziomie
molekularnym
wg WHO
biomarkerem jest każdy pomiar interakcji
zachodzącej w systemach biologicznych z potencjalnymi
zagrożeniami, mogącymi mieć charakter chemiczny,
fizyczny lub biologiczny. Mierzona odpowiedź organizmu
wywołana tą interakcją może mieć charakter funkcjonalny,
fizjologiczny, biochemiczny na poziomie komórkowym lub
molekularny na poziomie sub-
komórkowym.

2
• Biomarkery ekspozycji są to obecne wewnątrz organizmu
mierzalne egzogenne substancje
lub ich metabolity lub też produkty
interakcji między czynnikiem szkodliwym i docelowymi komórkami lub
cząsteczkami.
• Biomarkery skutków to mierzalne biochemiczne, fizjologiczne,
behawioralne i inne
zmiany zachodzące wewnątrz organizmu, które - w
zależności od wielkości – mogą być rozpoznawane jako łączące się z już
obecnymi lub mogącymi się pojawić później zaburzeniami zdrowotnymi i
chorobami.
•Biomarkery wrażliwości są wskaźnikami wrodzonej lub nabytej
zdolności organizmu do odpowiedzi wywołanej ekspozycją na
specyficzny czynnik szkodliwy.
• biomarkery dawki wewnętrznej:
-
pomiar stężenia substancji egzogennej lub jej metabolitów w
poszczególnych tkankach (krew, mocz, mleko, płyn nasienny,
tkanki uzyskane za pomocą biopsji )
• biomarkery dawki biologicznie skutecznej:
-
oznaczanie adduktów substancji egzogennych lub ich
metabolitów z białkami lub DNA (krew, tkanki uzyskane za
pomocą biopsji, złuszczone komórki płuc)
Ocena ekspozycji
•addukty z białkami – brak systemów naprawczych -nie ulegają
naprawie:
-
głównie hemoglobina (erytrocyt żyje ~120 dni) - wskaźnik
narażenia skumulowanego; identyfikacja za pomocą
chromatografii gazowej z detekcją masową (GC-MS)
- albuminy (~ 28 dni)
metody immunochemiczne lub hydroliza przyłączonych związków
• addukty z DNA – charekter przedmutacyjny, mogą zostać
naprawione lub dać początekmutacjom
•Całkowita liczba LC ~ 50x10
9
, z tego tylko 2% LKOC, reszta w tkankach
i
narządach.
-LKOC to populacja
komórek o dominującej fazie G
0
, w
której procesy
biofizyczne i biochemiczne
są zminimalizowane.
•Skład LKO : L małe; 80 - 90% średnie; ~ 5%, duże do 15%,
~~70% LKOC to limfocyty-T,
pozostałe typu B,
T/B zmienia
się z wiekiem.
•W warunkach in vivo tylko 0.2% LKOC podlega stymulacji pod wpływem
antygenów i przechodzi do fazy syntezy DNA.
•Czas życia LC jest zróżnicowany:
-
90% LC jest długo życiowych (T
1/2
~ 3lata, kilka a nawet dziesiątki lat)
-
10 % jest krótko życiowych (T
1/2
~ 1-10 dni).
Limfocyty krwi obwodowej człowieka (LKOC)
•LKOC należą w 80% do grupy wymiennej, tzn opuszczają
krew obwodową, wędrują do śledziony, węzłów itp. i wracają do
KO.
średni czas obecności "wędrującego" limfocytu w KO
~ 30 min.
czas recyrkulacji grupy wymiennej ~ 12 godz,
Dlaczego Limfocyty krwi obwodowej człowieka (LKOC) informują o
uszkodzeniach DNA wywołanych ekspozycją środowiskową?
oznacza to, że uszkodzenie DNA prowadzące w konsekwencji
do mutacji lub aberracji chromosomowej wywołane
gdziekolwiek w organizmie, będzie prezentowane również w
krwi obwodowej człowieka
Ocena uszkodzeń DNA opiera się na ocenie obrazu w mikroskopie
fluorescencyjnym przy użyciu kamery cyfrowej i systemu automatycznej
analizy obrazu
% DNA
Moment ogonowy (tail moment )TM = %DNA x TL-DNA
TL-DNA
– długość ogona komety
Ocena uszkodzeń materiału genetycznego metodą
elektroforezy DNA jądrowego pojedynczych komórek
single cell gel electrophoresis - SCGE assay /COMET

3
Analiza cytogenetyczna
aberracji chromosomowych
Zaburzenia monitorowane w limfocytach krwi obwodowej:
II mitoza: częstość wymian chromatyd siostrzanych (SCE),
procent komórek ze znamiennie wyższym poziomem częstości wymian
(HFC – high frequency cells)
I mitoza: częstość aberracji chromosomowych (CSA), aberracji
chromatydowych (CTA), częstość wszystkich aberracji TAbF, procent
komórek z aberracjami - AbC.
OCENA PODATNOSCI
•ocena polimorfizmu genów odpowiedzialnych za procesy
biotransformacji i detoksykacji (transferaza S-glutationowa, N-
acetylotransferaza, indukcja enzymu CYP1A1)
• test kometowy zastosowany do oceny wydajności procesów
naprawczych
Wydajność naprawy DNA oceniona w oparciu o
odpowiedź komórek na dawkę pobudzającą
promieniowania i zmierzona szybką metodą kometową
może być pomocna w diagnozie który z pacjentów jest
bardziej podatny na terapię i jaką mocną dawkę można
dla niego zastosować
Epidemiologia molekularna
•Pozwala na lepsze zrozumienie patomechanizmów choroby
•określenie podatności genetycznej na podstawie markerów molekularnych,
a nie informacji zastępczych (np. rodzinna historia występowania choroby)
•poprawia trafność i redukuje błędy przy oszacowaniu narażenia
środowiskowego
• stwarza możliwość szacowania subklinicznych lub wczesnych wskaźników
choroby
• dostarcza nowych standardów dla epidemiologii opisowej : redukuje
niejednorodność w klasyfikacji choroby (testy molekularne stosowane do
identyfikacji przypadków choroby – grupy bardziej homogenne)
• poprawia dokładność badań analitycznych – wpływ czynników
genetycznych i środowiskowych oraz ich interakcji dla rozwoju choroby może
być znacznie precyzyjniej określony.
Wyszukiwarka
Podobne podstrony:
Epidemiologia molekularna wirusa HCV
04 22 PAROTITE EPIDEMICA
006 Epidemiologia AIDS wykład UNOFFICIAL
epidemiologia metody,A Kusińska,K Mitręga,M Pałka,K Orszulik 3B
epidemiologia, czynniki ryzyka rola pielegniarki rak piersi szkola, nauczyciel
Epidemiologia jako nauka podstawowe założenia
SWW epidemiologia 6
w4 orbitale molekularne hybrydyzacja
SWW epidem AIDS 2005
Biologia molekularna
Epidemiologia prezentacja 13
Miejsce i rola epidemiologii w medycynie
Epidemiologia prezentacja 7
W03b Komórkowe i molekularne podłoże zapaleń
więcej podobnych podstron