1
Katedra Biotechnologii w Ochronie Środowiska
Wydział Ochrony Środowiska i Rybactwa
UWM w Olsztynie
Przewodnik do ćwiczeń z
Genetyki
dla studentów II roku
kierunku Ochrona Środowiska
Sławomir Ciesielski
Dariusz Kaczmarczyk
Mirosław Łuczyński
Małgorzata Jankun
Paweł Woźnicki
www.genetics.wustl.edu/
Olsztyn 2013

2
Ć
wiczenia z przedmiotu Genetyka
•
Pa
ń
stwo studenci przychodz
ą
na zaj
ę
cia przygotowani teoretycznie oraz
wyposa
ż
eni w przybory do pisania, kalkulator oraz w przypadku
ć
wicze
ń
laboratoryjnych w białe fartuchy,
•
podczas ka
ż
dego
ć
wiczenia mo
ż
e si
ę
odby
ć
sprawdzian z
wiadomo
ś
ci dotycz
ą
cych poprzedniego i bie
żą
cego
ć
wiczenia,
•
zaliczenie
ć
wicze
ń
musi zako
ń
czy
ć
si
ę
przed letni
ą
sesj
ą
egzaminacyjn
ą
.
Kierownik przedmiotu:
dr hab. Sławomir Ciesielski
Katedra Biotechnologii w Ochronie
Ś
rodowiska ul. Słoneczna 45G
telefon: (+48) 895234119
e-mail: slavcm@uwm.edu.pl
Prowadz
ą
cy
ć
wiczenia:
dr in
ż
. Dariusz Kaczmarczyk
Katedra Biotechnologii w Ochronie
Ś
rodowiska ul. Słoneczna 45G
telefon : (+48) 895234144
e-mail:
d.kaczmarczyk@uwm.edu.pl

3
Szczegółowy program ćwiczeń
Ćwiczenie 1. Wprowadzenie: regulamin ćwiczeń i zasady zaliczania, plan ćwiczeń, literatura
do ćwiczeń z przedmiotu. Podstawy dziedziczenia: I i II prawo Mendla.
Ćwiczenie 2. Efekt plejotropowy genu. Geny letalne i subletalne na przykładzie dziedziczenia
kształtu płetw mieczyka Xiphophorus helleri - rozwiązywanie zadań, teoretyczne przykłady
krzyżówek pomiędzy osobnikami o różnych fenotypach.
Ćwiczenie 3. Chromosomy płci. Dziedziczenie cech sprzężonych z płcią – rozwiązywanie
zadań.
Ćwiczenie 4. Allele wielokrotne na przykładzie systemu grup krwi ABO u człowieka.
Czynnik Rh a konflikt serologiczny.
Ćwiczenie 5. Częstość występowania alleli i genotypów. Prawo Hardy-Weinberga.
Ćwiczenie 6. Efektywna liczebność populacji i współczynnik inbredu – rozwiązywanie zadań
rachunkowych.
Ćwiczenie 7. Genetyka muszki owocowej (Drosophila melanogaster). Wykorzystanie
programu komputerowego DrosophiLab (sala komputerowa).
Ćwiczenie 8. Geny autosomalne i sprzężone z płcią. Drosophila melanogaster jako obiekt
badań genetycznych (laboratorium).
Ćwiczenie 9. Modele doboru naturalnego w populacjach - symulacje komputerowe dotyczące
zmian frekwencji alleli w populacji pod wpływem doboru naturalnego (sala komputerowa).
Ćwiczenie 10. Analiza wyników hodowli muszki owocowej (ćwiczenie 8). Genotyp a
ś
rodowisko: wpływ zagęszczenia populacji na masę ciała Drosophila melanogaster -
zakładanie hodowli muszki owocowej (laboratorium).
Ćwiczenie 11. Zastosowania badań polimorfizmu sekwencji mikrosatelitarnych w genetyce –
przeprowadzenie rozdziału produktu PCR w żelu agarozowym.
Ćwiczenie 12. Dystans genetyczny. Analiza prążków uzyskanych w wyniku trawienia
restrykcyjnego (wykorzystanie wyników z poprzedniego ćwiczenia). (laboratorium).
Ćwiczenie 13. Kolokwium.
Ćwiczenie 14. Wpływ zagęszczenia populacji na masę ciała Drosophila melanogaster-
zamknięcie doświadczenia. Analiza wyników przy pomocy testu t-Studenta i wnioski
(laboratorium).
Ćwiczenie 15. Niepełna dominacja i addycja dwu loci genowych. Prawo Hardy'ego-
Weinberga dla dwuch loci genowych. Zaliczenie ćwiczeń.
Ćwiczenie 1
4
Ć
wiczenie 1. Podstawy dziedziczenia. Prawa Mendla
I prawo Mendla
Prawo czysto
ś
ci gamet: podczas tworzenia gamet u organizmów
diploidalnych allele oddzielaj
ą
si
ę
i w gametach wyst
ę
puj
ą
pojedynczo
Rodzice P AA x aa
Gamety G A a
Pokolenie 1. F1 Aa x Aa
Gamety G A, a A,a
Pokolenie 2. F2
Szachownica genetyczna (Punneta)
A a
A AA Aa
a Aa aa
I Prawo Mendla, dominacja pełna i kodominacja – zadania
Czarna barwa nasion u fasoli dominuje nad biał
ą
. Po skrzy
ż
owaniu ro
ś
lin o
czarnych nasionach z ro
ś
linami białonasiennymi otrzymano tylko czarne nasiona.
Jak
ą
barw
ę
nasion b
ę
dzie miało potomstwo ro
ś
lin otrzymanych w wyniku
krzy
ż
owania dwóch czarnonasiennych osobników F1?
Ż
ółta barwa nasion grochu dominuje nad barw
ą
zielon
ą
. Ro
ś
liny homozygotyczne
o
ż
ółtej barwie nasion skrzy
ż
owano z ro
ś
linami o nasionach zielonych, nast
ę
pnie
ro
ś
liny z pokolenia F1 powtórnie skrzy
ż
owano z:
a) zielononasienn
ą
form
ą
rodzicielsk
ą
b)
ż
ółtonasienn
ą
form
ą
rodzicielsk
ą
Prosz
ę
poda
ć
genotypy i fenotypy potomstwa uzyskane po krzy
ż
owaniu a i b.

Ćwiczenie 1
5
Skrzy
ż
owano ro
ś
lin
ę
lwiej paszczy o kwiatach czerwonych z ro
ś
lin
ą
o kwiatach
białych. W pokoleniu F1 wszystkie ro
ś
liny miały kwiaty ró
ż
owe. Jak b
ę
dzie wygl
ą
dało
pokolenie F2 (powstałe ze skrzy
ż
owania dwóch ro
ś
lin ró
ż
ni
ą
cych si
ę
z kwiatami z
pokolenia F1)?
Molinezja (Poecilia sphenops) wykazuje polimorfizm genetyczny pod
wzgl
ę
dem kształtu płetw. W locus L odpowiedzialnym za kształt płetw molinezji
znajduj
ą
si
ę
2 allele L i l. Niepełna dominacja L nad I sprawia,
ż
e 3 genotypom
odpowiadaj
ą
3 fenotypy przedstawione na rysunku:
fenotyp genotyp
A II
B LI
C LL
Skrzy
ż
owano molinezj
ę
o fenotypie A z osobnikiem o fenotypie C. W
pokoleniu F1 wszystkie ryby miały fenotyp B. Jakie b
ę
d
ą
proporcje fenotypów w
pokoleniu F2?
Normalne ubarwienie u karpia dominuje nad ubarwieniem bł
ę
kitnym.
Skrzy
ż
owano ryb
ę
normalnie ubarwion
ą
z bł
ę
kitn
ą
. W pokoleniu F1 wszystkie karpie
były normalnie ubarwione. Jakich fenotypów mo
ż
na spodziewa
ć
si
ę
w pokoleniu
F2? Jak sprawdzi
ć
, czy normalnie ubarwiony karp jest homozygot
ą
czy
heterozygot
ą
?
Skrzy
ż
owano pstr
ą
ga t
ę
czowego o ubarwieniu złocistym z osobnikiem o
ubarwieniu normalnym. W pokoleniu F1 otrzymano 100% ryb o ubarwieniu
po
ś
rednim (tzw palomino). Jakie b
ę
d
ą
proporcje fenotypów w pokoleniu F2?

Ćwiczenie 1
6
II prawo Mendla
Prawo niezale
ż
nego dziedziczenia cech: cechy warunkowane przez ró
ż
ne
pary genów dziedzicz
ą
si
ę
niezale
ż
nie i mog
ą
tworzy
ć
dowolne poł
ą
czenia u
osobników potomnych.
P AABB x aabb
G AB ab
F1 AaBb x AaBb
G AB, aB, ab, Ab AB, aB, ab, Ab
F2
AB aB ab Ab
AB AABB AaBB AaBb AABb
aB AaBB aaBB aaBb AaBb
ab AaBb aaBb aabb Aabb
Ab AABb AaBb Aabb AAbb
Zadania
Długa sier
ść
kotów perskich jest uwarunkowana genem recesywnym (p) w
stosunku do allelu krótkiej sier
ś
ci kotów syjamskich (P), za
ś
czarne umaszczenie
persów uwarunkowane jest allelem dominuj
ą
cym (B) w stosunku do genu
kawowego umaszczenia syjamczyków (b). Podaj mo
ż
liwe genotypy syjamczyków i
persów. Skrzy
ż
owano homozygotycznego persa z homozygotycznymsyjamczykiem.
Jak b
ę
dzie wygl
ą
dało pokolenie F1 i F2?
Br
ą
zowa barwa oczu człowieka (B), dominuje nad niebiesk
ą
(b),
prawor
ę
czno
ść
nad lewor
ę
czno
ś
ci
ą
. Br
ą
zowooki, prawor
ę
czny m
ęż
czyzna
po
ś
lubia niebieskook
ą
, prawor
ę
czn
ą
kobiet
ę
. Ich pierwsze dziecko jest
niebieskookie i lewor
ę
czne.
Je
ś
li urodz
ą
si
ę
inne dzieci, jakie cechy ( z wymienionych)
ujawni
ą
si
ę
? Wyja
ś
nij genotypy rodziców i dzieci.

Ć
wiczenie 1
7
Wiadomo
ś
ci wymagane na tym
ć
wiczeniu mo
ż
na odnale
źć
w
nast
ę
puj
ą
cych podr
ę
cznikach:
1. W. Gajewski. Genetyka ogólna i molekularna. PWN Warszawa, 1980, str. 125-
135
2. B. Rodkiewicz i G. Kerszman. Zarys genetyki. PWN Warszawa, 1987. str. 27- 40.
3. J. Maciejowski i J. Zi
ę
ba. Genetyka i ogólna hodowla zwierz
ą
t. Tom 1.PWN
Warszawa, 1972 str. 129-164.
4. B. Nowicki. Genetyka i metody doskonalenia zwierz
ą
t. PWR i L Warszawa,
1985. str. 30-40.
5. P.C. Winter, G.I. Hickey, H.L. Fletcher. Krótkie wykłady, genetyka. PWN
Warszawa, 2001. str. 139-149.
6. A. Sadakierska-Chudy, G. D
ą
browska, A. Goc. Genetyka ogólna. Wydawnictwo
Uniwersytetu Mikołaja Kopernika, Toru
ń
2004.

Ć
wiczenie 2
8
Ć
wiczenie 2. Efekt pleiotropowy genu. Geny letalne i
subletalne na przykładzie mieczyka (Xiphophorus helleri).
Mieczyk (Xiphophorus helleri) jest ryb
ą
akwariow
ą
pochodz
ą
c
ą
z tropikalnych
regionów Ameryki Południowej i
Ś
rodkowej oraz Meksyku. Ta niewielka,
jajo
ż
yworodna ryba wykazuje ogromny polimorfizm ubarwienia i pokroju ciała. Oprócz
form krótkopłetwych w akwariach spotykane s
ą
równie
ż
formy długopłetwe. Jedna z
tych form charakteryzuje si
ę
wydłu
ż
on
ą
płetw
ą
grzbietow
ą
(mieczyk
ż
aglopłetwy,
mieczyk Simpsona). Druga forma posiada wszystkie płetwy wydłu
ż
one, przy czym
charakterystyczne jest wydłu
ż
enie skrajnych promieni płetwy ogonowej oraz
pierwszych promieni płetwy grzbietowej (tzw. mieczyk lirogon lub widlak). Kształt
płetw mieczyka jest determinowany przez dwie pary alleli w dwu nie sprz
ęż
onych i
niezale
ż
nych loci genowych. Obie powy
ż
ej opisane mutacje maj
ą
charakter
dominuj
ą
cy i obni
ż
aj
ą
prze
ż
ywalno
ść
, odporno
ść
na choroby, tempo wzrostu i
płodno
ść
mieczyków w stanie heterozygotycznym (efekt subletalny). Zmutowane
dominuj
ą
ce allele w stanie homozygotycznym (w ka
ż
dym z dwu loci niezale
ż
nie)
uniemo
ż
liwiaj
ą
prze
ż
ycie organizmu ju
ż
w fazie embrionalnej (efekt letalny).
Zjawisko, w którym jeden locus genowy decyduje o kilku cechach (np. kształt
płetw i tempo wzrostu, barwa kwiatów-i barwa nasion, biała barwa sier
ś
ci,
czerwone oczy oraz nieostre widzenie) nazywamy pleiotropi
ą
lub efektem
pleiotropowym. Geny o charakterze letalnym i subletalnym zazwyczaj wykazuj
ą
siln
ą
pleiotropi
ę
w organizmie. Je
ż
eli pierwszy locus oznaczymy liter
ą
S (Simpson) a
drugi L (lirogon), to osobnik o fenotypie dzikim (krótkopłetwy) b
ę
dzie podwójn
ą
homozygot
ą
recesywn
ą
o genotypie ssll. Mieczyk Simpsona b
ę
dzie miał genotyp Ssll,
natomiast lirogon ssLl. Wszystkie mieczyki o genotypie SS lub LL b
ę
d
ą
zamierały w
trakcie rozwoju embrionalnego. Fenotyp podwójnej heterozygoty SsLI (mieczyk
welonowy) przedstawia si
ę
nast
ę
puj
ą
co: wszystkie płetwy silnie wydłu
ż
one, płetwa
grzbietowa w kształcie
ż
agla (jak u formy Simpson), płetwa ogonowa wydłu
ż
ona
równomiernie (tak skrajne jak i
ś
rodkowe promienie płetwy ogonowej wydłu
ż
one).
Zadanie
Badana populacja mieczyka składa si
ę
z 16 osobników krótkopłetwych, 14
ż
aglopłetwych, 4 lirogonów i 15 welonowych. Ryby te s
ą
potomstwem jednej pary:
samica lirogon x samiec
ż
aglopłetwy.

Ć
wiczenie 2
9
a) oblicz frekwencje alleli S i s oraz L i I,
b) Jaki b
ę
dzie rezultat krzy
ż
ówek mieczyka:
krótkopłetwy x welonowy,
welonowy x welonowy,
lirogon x lirogon,
krótkopłetwy x
ż
aglopłetwy

Ć
wiczenie 2
10

Ć
wiczenie 2
11
Ć
wiczenie 2. Chromosomy płci. Dziedziczenie cech sprz
ęż
onych z
płci
ą
.
Cechami sprz
ęż
onymi z płci
ą
nazywamy cechy zale
ż
ne od genów maj
ą
cych loci
w chromosomie płci X. Chromosom X ró
ż
ni si
ę
od wszystkich pozostałych
(autosomów) tym,
ż
e u jednej z płci nie ma swojego homologa. Innym chromosomem
płci wyst
ę
puj
ą
cym u ssaków jest chromosom Y. Ró
ż
ni si
ę
on od chromosomu X
kształtem, długo
ś
ci
ą
i, co najwa
ż
niejsze, z reguły nie zawiera loci odpowiadaj
ą
cych
tym, które spotykamy w chromosomie X.
Płe
ć
charakteryzuj
ą
ca si
ę
dwoma ró
ż
nymi chromosomami XY lub tylko jednym
X nazywamy płci
ą
heterogametyczn
ą
. Powstaj
ą
bowiem u niej dwojakiego rodzaju
gamety w równych ilo
ś
ciach: 50% z chromosomem X i 50% z Y.
Ple
ć
przeciwna do omówionej jest nazywana homogametyczn
ą
, ma dwa takie
same chromosomy płci (np. XX) i dlatego wszystkie wytwarzane przez ni
ą
gamety
zawieraj
ą
po jednym tym samym chromosomie płci (np. X).
U zwierz
ą
t płci heterogametycznej wszystkie cechy sprz
ęż
one z płci
ą
zale
żą
od
jednego tylko genu, a nie jak u płci homogametycznej od pary genów. Rozpatrzmy
tak
ą
cech
ę
na przykładzie hemofilii u psów. Hemofilia wywołana jest recesywnym
genem h. Dominuj
ą
cy gen tej pary H daje normaln
ą
krzepliwo
ść
krwi. Tak wi
ę
c,
wszystkie mo
ż
liwe fenotypy i genotypy spotykane u psów mo
ż
emy zapisa
ć
odpowiednimi symbolami w dwojaki sposób.
zdrowe nosiciele chore
samice HH Hh hh
samce H0 h0
U ssaków i wi
ę
kszo
ś
ci owadów samice s
ą
płci
ą
homogametyczn
ą
XX, a samce
heterogametyczn
ą
XY. Natomiast u ptaków i niektórych motyli samice maj
ą
tylko
jeden chromosom X a samce XX. Jak wynika z tych wyja
ś
nie
ń
gamety wytwarzane
przez zwierz
ę
ta płci heterogametycznej s
ą
dwojakiego rodzaju i od tego, która z nich
we
ź
mie udział w wytworzeniu (podczas procesu zapłodnienia) zygoty zale
ż
y płe
ć
zwierz
ę
cia. U ssaków, samce otrzymuj
ą
chromosom X wył
ą
cznie od swojej matki, u
ptaków jest odwrotnie - samice otrzymuj
ą
chromosom płci X.-tylko od ojca. a wraz z
nim geny koduj
ą
ce cechy sprz
ęż
one z płci
ą
.
Autosomalne cechy pozostaj
ą
ce pod wpływem płci cz
ę
sto s
ą
nazywane cechami
zwi
ą
zanymi z płci
ą
. Wynika to st
ą
d,
ż
e zwierz
ę
ta heterozygotyczne ze wzgl
ę
du na te

Ć
wiczenie 2
12
cechy maj
ą
mimo jednakowego genotypu ró
ż
ne fenotypy zale
ż
nie od płci. Na
przykład, je
ż
eli gen bezro
ż
no
ś
ci okre
ś
limy symbolem B. a rogato
ś
ci b - to u pewnych
ras owiec zwierz
ę
ta BB b
ę
d
ą
bezro
ż
ne niezale
ż
nie od płci, zwierz
ę
ta bb - rogate,
natomiast heterozygoty Bb samce b
ę
d
ą
rogate, a Bb samice - bezro
ż
ne. Tak wi
ę
c,
ten sam genotyp mo
ż
e dawa
ć
ró
ż
ne efekty fenotypowe zale
ż
nie od płci osobnika.

Ć
wiczenie 3
13
Ć
wiczenie 3. Geny autosomalne i sprz
ęż
one z płci
ą
– rozwi
ą
zywanie
zada
ń
Cechami sprz
ęż
onymi z płci
ą
nazywamy cechy zale
ż
ne od genów maj
ą
cych
loci w chromosomie płci X. Chromosom X ró
ż
ni si
ę
od wszystkich pozostałych
autosomów) tym,
ż
e u jednej z płci nie ma swojego homologa. Innym chromosomem
płci wyst
ę
puj
ą
cym u ssaków jest chromosom Y. Ró
ż
ni si
ę
on od chromosomu X
kształtem, długo
ś
ci
ą
i, co najwa
ż
niejsze, z reguły nie zawiera loci odpowiadaj
ą
cych
tym, które spotykamy w chromosomie X. Płe
ć
charakteryzuj
ą
ca si
ę
dwoma ró
ż
nymi
chromosomami XY lub tylko jednym Xnazywamy płci
ą
heterogametyczn
ą
. Powstaj
ą
bowiem u niej dwojakiego rodzaju gamety wrównych ilo
ś
ciach: 50% z chromosomem
X i 50% z Y.
Ple
ć
przeciwna do omówionej jest nazywana homogametyczn
ą
, ma dwa takie
same chromosomy płci (np. XX) i dlatego wszystkie wytwarzane przez ni
ą
gamety
zawieraj
ą
po jednym tym samym chromosomie płci (np. X).
U zwierz
ą
t płci heterogametycznej wszystkie cechy sprz
ęż
one z płci
ą
zale
żą
od jednego tylko genu, a nie jak u płci homogametycznej od pary genów. Rozpatrzmy
tak
ą
cech
ę
na przykładzie hemofilii u psów. Hemofilia wywołana jest recesywnym
genem h. Dominuj
ą
cy gen tej pary H daje normaln
ą
krzepliwo
ść
krwi. Tak wi
ę
c,
wszystkie mo
ż
liwe fenotypy i genotypy spotykane u psów mo
ż
emy zapisa
ć
odpowiednimi symbolami w dwojaki sposób.
zdrowe
nosiciele
chore
samice
HH
Hh
hh
samce
H0
h0
U ssaków i wi
ę
kszo
ś
ci owadów samice s
ą
płci
ą
homogametyczn
ą
XX, a
samce heterogametyczn
ą
XY. Natomiast u ptaków i niektórych motyli samice maj
ą
tylko jedenchromosom X a samce XX. Jak wynika z tych wyja
ś
nie
ń
gamety
wytwarzane przez zwierz
ę
tapłci heterogametycznej s
ą
dwojakiego rodzaju i od tego,
która z nich we
ź
mie udział w wytworzeniu (podczas procesu zapłodnienia) zygoty
zale
ż
y płe
ć
zwierz
ę
cia. U ssaków, samce otrzymuj
ą
chromosom X wył
ą
cznie od
swojej matki, u ptaków jest odwrotnie – samice otrzymuj
ą
chromosom płci X.-tylko od
ojca. a wraz z nim geny koduj
ą
ce cechy sprz
ęż
one z płci
ą
.

Ć
wiczenie 3
14
Autosomalne cechy pozostaj
ą
ce pod wpływem płci cz
ę
sto s
ą
nazywane
cechami zwi
ą
zanymi z płci
ą
. Wynika to st
ą
d,
ż
e zwierz
ę
ta heterozygotyczne ze
wzgl
ę
du na te cechy maj
ą
mimo jednakowego genotypu ró
ż
ne fenotypy zale
ż
nie od
płci. Na przykład, je
ż
eli gen bezro
ż
no
ś
ci okre
ś
limy symbolem B. a rogato
ś
ci b - to u
pewnych ras owiec zwierz
ę
ta BB b
ę
d
ą
bezro
ż
ne niezale
ż
nie od płci, zwierz
ę
ta bb -
rogate, natomiast heterozygoty Bb samce b
ę
d
ą
rogate, a Bb samice - bezro
ż
ne. Tak
wi
ę
c, ten sam genotyp mo
ż
e dawa
ć
ró
ż
ne efekty fenotypowe zale
ż
nie od płci
osobnika.

Ć
wiczenie 4
15
Ć
wiczenie 4. Allele wielokrotne na przykładzie sytemu grup krwi
ABO u człowieka. Czynnik RH a konflikt serologiczny.
Rozwi
ą
zywanie zada
ń
rachunkowych: obliczanie frekwencji alleli w
populacji na podstawie cz
ę
sto
ś
ci poszczególnych grup krwi.
A. Allele wielokrotne na przykładzie sytemu grup krwi ABO u człowieka.
Czynnik RH a konflikt serologiczny. Mechanizm dziedziczenia grup krwi u
człowieka
Dziedziczenie grup krwi w systemie ABO u człowieka zale
ż
y od
wyst
ę
powania kombinacji dwu z trzech alleli w jednym locus genowym. Dwa allele I
A
oraz I
B
s
ą
dominuj
ą
ce wobec trzeciego allelu i. Pomi
ę
dzy dominuj
ą
cymi allelami
IA i IB wyst
ę
puje zjawisko kodominacji (współdominacji). Polega to na
jednoczesnej ekspresji obu tych alleli w heterozygocie. Produktem ekspresji
allelu I
A
jest antygen A obecny w błonie komórkowej erytrocytu. Produktem
ekspresji allelu I
B
jest antygen B. Allel recesywny i jest odpowiedzialny
za brak antygenu w błonie komórkowej erytrocytu.
Osoby z grupa krwi A posiadaj
ą
antygen A w błonie komórkowej
erytrocytu, oraz przeciwciała (izoaglutyniny) anty-B, skierowane przeciw antygenowi
B. Osoby z grupa krwi B posiadaj
ą
antygen B oraz izoaglutyniny anty-A. Osoby z
grupa AB posiadaj
ą
oba antygeny w błonie erytrocytu i
ż
adnych izoaglutynin w
osoczu. Osoby z grupa krwi 0 posiadaj
ą
izoaglutyniny anty-A i anty-B w
osoczu, nie posiadaj
ą
natomiast
ż
adnych antygenów w błonie erytrocytu. Osoby z
grupa krwi A mog
ą
mie
ć
genotypy: I
A
I
A
oraz I
A
i osoby z grupa B: I
B
I
B
oraz I
B
i osoby z
grupa AB - tylko I
A
I
B
a osoby z grupa 0 tylko ii. W ten sposób sze
ść
ró
ż
nych
genotypów ( 3 homo- i 3 heterozygotyczne) daje w efekcie 4 fenotypy. Dzieje si
ę
tak
na skutek pełnej dominacji alleli IA oraz IB nad allelem i w odpowiednich
genotypach heterozygotycznych. W genotypie heterozygotycznym IAIB wyst
ę
puje
zjawisko kodominacji (jednoczesne wyst
ę
powanie obu antygenów w błonie
erytrocytu.
Wyst
ę
powanie czynnika Rh zale
ż
y od układu zale
ż
y pary alleli jednym locus
genowym. W tym locus wyst
ę
puj
ą
dwa allele: D oraz d. Wyst
ę
puje pełna dominacja
D nad d. Genotypy DD i Dd b
ę
d
ą
wiec miały wspólny fenotyp (Rh+), natomiast
homozygota recesywna dd b
ę
dzie miała fenotyp Rh-(brak czynnika Rh).
Wyst
ę
powanie konfliktu serologicznego wi
ąż
e si
ę
z odpowiedzi
ą
immunologiczn
ą

Ć
wiczenie 4
16
organizmu matki o fenotypie Rh- przeciwko krwinkom czerwonym dziecka o
fenotypie Rh+. W takiej sytuacji nast
ę
puje indukcja syntezy specyficznych
przeciwciał skierowanych przeciwko czynnikowi Rh w erytrocytach dziecka, gdy
ż
czynnik ten jest rozpoznawany w organizmie matki jako obcy antygen). W
trakcie ci
ąż
y wzrost koncentracji przeciwciał przeciwko czynnikowi RH we krwi matki
przebiega stopniowo, niemniej pierwsze dziecko rodzi si
ę
zwykle bez wi
ę
kszych
komplikacji. Poziom przeciwciał przeciw czynnikowi Rh we krwi matki o genotypie
dd po przebytej ci
ąż
y jest ju
ż
podwy
ż
szony (organizm nabył „odporno
ść
" na oby
antygen - czynnik Rh, podobnie jak to ma miejsce w przypadku wytwarzania si
ę
odporno
ść
naturalnej po przebytej chorobie). Przy kolejnej ci
ąż
y dojdzie do
szybkiego dalszego wzrostu koncentracji przeciwciał i w rezultacie nast
ą
pi
odpowiedz immunologiczna organizmu matki, polegaj
ą
ca na niszczeniu krwinek
dziecka posiadaj
ą
cego czynnik Rh w błonie erytrocytu (genotyp Dd).
Osoby z grup
ą
krwi Rh- stanowi
ą
15% całej populacji, natomiast osoby z
grup
ą
krwi Rh+ stanowi
ą
85% populacji.

Ć
wiczenie 5
17
Ć
wiczenie 5. Model Hardy’ego-Weinberga (H-W). Svmulowanie
losowego kojarzenia gamet w populacji panmiktvcznei.
Stosowanie testu
χ
2 (chi2) do okre
ś
lenia czy obserwacje
potwierdzaj
ą
prawo H-W.
Proces analizy zmienno
ś
ci genetycznej składa si
ę
:
- ze zbadania jednego lub wi
ę
cej typów markerów genetycznych,
- ilo
ś
ciowego wyra
ż
enia frekwencji fenotypów,
- wywnioskowania na tej podstawie frekwencji genotypów koduj
ą
cych zbadane
fenotypy. Nast
ę
pnie potrzebny jest okre
ś
lony model, który powi
ąż
e ze sob
ą
frekwencje genotypów z frekwencjami alleli i umo
ż
liwi wyciagni
ę
cie wniosków na
temat procesów, oddziałuj
ą
cych na badan
ą
populacj
ę
. U
ż
yteczno
ść
modelu polega
na tym, i
ż
pozwala on zidentyfikowa
ć
kluczowe obserwacje (lub eksperymenty)
które nale
ż
y poczyni
ć
, aby lepiej zrozumie
ć
stan obecny populacji oraz zaradzi
ć
ewentualnym kłopotom.
Najpowszechniej stosowanym modelem, wi
ążą
cym frekwencje genotypów z
frekwencjami alleli, jest model opracowany niezale
ż
nie przez G.H. Hardy'ego
(1908) oraz W. Weinberga (1908).
Model Hardy'ego-Weinberga opiera si
ę
na kilku wa
ż
nych zało
ż
eniach:
- liczebno
ść
populacji jest wielka i stała w kolejnych pokoleniach,
- kojarzenie si
ę
osobników jest losowe (populacja jest panmiktyczna, albo
bardzo dobrze wymieszana),
- organizmy s
ą
diploidalne,
- pokolenia nie zaz
ę
biaj
ą
si
ę
,
- rozród odbywa si
ę
drog
ą
płciow
ą
,
- wpływy mutacji, migracji i selekcji s
ą
zaniedbywalne.
W przypadku autosomalnych (tych, które nie s
ą
ulokowane na chromosomach płci)
loci genowych o dwóch allelach, model Hardy'ego-Weinberga przyjmuje posta
ć
:
(p + q)
2
= p
2
+ 2pq + q
2
= 1

Ć
wiczenie 5
18
gdzie p to frekwencja cz
ę
stszego allelu A podczas gdy q jest frekwencj
ą
rzadziej wyst
ę
puj
ą
cego allelu a, natomiast p +q = 1. Proporcje genotypów
b
ę
d
ą
odpowiadały rozwini
ę
ciu dwumianu (p + q)
2
.
AA Aa aa
p
2
2pq q
2
Model Hardy'ego-Weinberga zakłada,
ż
e je
ś
li zostan
ą
spełnione ww. zało
ż
enia, to
frekwencje alleli i genotypów w populacji nie b
ę
d
ą
si
ę
zmieniały z pokolenia na
pokolenie. Zgodnie z tym zało
ż
eniem, model mo
ż
e by
ć
stosowany do przewidywania
frekwencji genotypów na podstawie obecnej frekwencji alleli. Zastosowania modelu
Hardy'ego-Weinberga dostarczaj
ą
podstawy do oceny sił ewolucyjnych, wpływaj
ą
cych
na wachlarz genotypów w populacji. Je
ś
li stwierdzamy
ż
e obserwowane frekwencje
genotypów s
ą
inne ni
ż
frekwencje przewidywane przez model, mo
ż
na stawia
ć
hipotezy co do przyczyn tych odchyle
ń
. Id
ą
c dalej, mo
ż
na zaplanowa
ć
nowe
obserwacje lub eksperymenty, których celem b
ę
dzie wyja
ś
nienie procesów, które
spowodowały ró
ż
nice mi
ę
dzy obserwowanymi i przewidywanymi frekwencjami alleli w
populacji. Rozumowanie takie opiera si
ę
na przypuszczeniu, i
ż
w rezultacie
rozmaitych mechanizmów ekologicznych jedno lub wi
ę
cej zało
ż
e
ń
modelu nie jest
spełnione w przypadku obserwowanej populacji.
Jednym z zało
ż
e
ń
modelu Hardy'ego-Weinberga jest losowe kojarzenie si
ę
osobników w procesie rozrodu. To zało
ż
enie cz
ę
sto nie jest spełniane wskutek
najrozmaitszych zachowa
ń
rozrodczych. Wybiórcze krzy
ż
owanie si
ę
osobników to
wybór partnera rozrodczego na podstawie jego fenotypu. Dodatnie krzy
ż
owanie
wybiórcze wyst
ę
puje wtedy. gdy osobniki krzy
ż
uj
ą
si
ę
z podobnymi do siebie cz
ęś
ciej
ni
ż
gdyby było to wył
ą
cznie dziełem przypadku. Inbreeding to krzy
ż
owanie si
ę
ze sob
ą
osobników spokrewnionych, co stanowi szczególny przypadek pozytywnego
krzy
ż
owania si
ę
wybiórczego. Negatywne wybiórcze kojarzenie si
ę
wyst
ę
puje
wówczas, gdy cz
ęś
ciej ni
ż
wynikałoby to z przypadku osobniki krzy
ż
uj
ą
si
ę
z
partnerami niepodobnymi do siebie fenotypowo jak w przypadku "korzy
ś
ci rzadkich
samców" [rare-male advantage] Drosophila). Genetyczny podział populacji gatunku
jest równie
ż
odmian
ą
krzy
ż
owania wybiórczego, w którym na pul
ę
genow
ą
gatunku
składaj
ą
si
ę
pule genowe grupy subpopulacji (stad), których osobniki krzy
ż
uj
ą
si
ę
panmiktycznie w ramach subpopulacji (stad).
W niektórych przypadkach wpływ doboru naturalnego na frekwencje genotypów

Ć
wiczenie 5
19
nie jest zaniedbywalny. Dobrze znanym przykładem u człowieka jest korzystne
dostosowanie heterozygot w locus B-hemoglobiny, kiedy to genotyp +s (odporny na
malari
ę
, nie anemiczny) jest lepiej dostosowany ni
ż
++ (podatny na malari
ę
) i
genotyp ss (cierpi na anemi
ę
zwi
ą
zan
ą
z sierpowato
ś
ci
ą
erytrocytów).
Złamanie zało
ż
e
ń
prawa Hardy'ego-Weinberga mo
ż
e wynikn
ąć
z rozmaitych
innych mechanizmów ekologicznych. W rzeczywisto
ś
ci, model Hardy'ego-Weinberga
jest do
ść
odporny na niewielkie odst
ę
pstwa od jego zało
ż
e
ń
, co czyni go u
ż
ytecznym
w zastosowaniach praktycznych. Trzeba jednak zaznaczy
ć
, i
ż
je
ś
li obserwowane
frekwencje genotypowe spełniaj
ą
oczekiwania Hardy'ego-Weinberga, to nie musi to
koniecznie oznacza
ć
ż
e wszystkie zało
ż
enia modelu s
ą
spełnione.
Symulowanie losowego kojarzenia gamet w populacji panmiktvcznej.
Stosowanie testu
χ
2 (chi2) do okre
ś
lenia czy obserwacje potwierdzaj
ą
spodziewania H-W
Populacj
ę
okre
ś
lamy jako pamniktyczn
ą
, je
ż
eli kojarzenia nale
żą
cych do niej
osobników zachodz
ą
całkowicie losowo. Rozkład genotypów w populacji zale
ż
y od
wielu czynników. W najprostszym przypadku mo
ż
e on by
ć
losowy i bezpo
ś
rednio
wynika
ć
z frekwencji wyst
ę
puj
ą
cych w tej populacji alleli.
Załó
ż
my,
ż
e populacja spełnia nast
ę
puj
ą
ce warunki:
1. organizmy s
ą
diploidalne,
2. rozmna
ż
aj
ą
si
ę
płciowo,
3. pokolenia nie zachodz
ą
na siebie,
4. osobniki kojarz
ą
si
ę
losowo (populacja jest panmiktyczna),
5. populacja jest bardzo du
ż
a,
6. nie ma migracji,
7. nie ma mutacji,
8. dobór naturalny nie wpływa na badany locus.
Populacja b
ę
dzie spełniała te warunki tak
ż
e wtedy, gdy czynniki wymienione w
pkt. 6, 7 i 8 b
ę
d
ą
si
ę
równowa
ż
y
ć
. W takich warunkach proporcje genotypów, dla locus
o dwu allelach A i a, których frekwencje wynosz
ą
odpowiednio p i q, (przy czym p + q =
1), b
ę
d
ą
odpowiadały rozwini
ę
ciu dwumianu (p + q)2.
Ć
wiczenie 5
20
Powy
ż
sze stwierdzenie jest zwane prawem Hardy'ego i Weinberga. Prawo to
mówi,
ż
e je
ś
li zostan
ą
spełnione zało
ż
enia 1-8, to frekwencje alleli i genotypów w
populacji nie b
ę
d
ą
si
ę
zmieniały z pokolenia na pokolenie; dla dwu alleli frekwencje
genotypów b
ę
d
ą
odpowiadały rozwini
ę
ciu dwumianu (p + q)2.
Ka
ż
dy ze studentów losuje dwie. "gamety" z locus A i dwie z locus B, nast
ę
pnie
ka
ż
dy odczytuje swój "genotyp".
Jakie s
ą
liczebno
ś
ci poszczególnych genotypów w locus A a jakie w locus B?
Jakie s
ą
oczekiwane liczebno
ś
ci tych genotypów z równania Hardy'ego i
Weinberga?
Czy frekwencje obserwowane odpowiadaj
ą
oczekiwanym - sprawdzenie
za pomoc
ą
testu chi-kwadrat.
Test
χ
2 stosuje si
ę
do okre
ś
lania, czy obserwowane liczby osobników o danych
genotypach s
ą
takie same, jakich spodziewaliby
ś
my si
ę
na podstawie H-W (to
znaczy, czy spełniaj
ą
oczekiwania H-W, otrzymane warto
ś
ci z obu (obserwowane i
oczekiwane) kolumn podstawiamy do wzoru i obliczamy według modelu
∑
−
=
Exp
Exp
Obs
2
2
)
(
χ
gdzie: Obs to liczba obserwowanych osobników o okre
ś
lonym fenotypie
Exp to liczba oczekiwanych osobników o okre
ś
lonym fenotypie
suma (
Σ
) b
ę
dzie zawierała 3 składniki - odpowiednio dla trzech genotypów w
ka
ż
dym z badanych loci genowych (oddzielnie AA, Aa i aa oraz BB, Bb i bb).
Liczba stopni swobody, zwi
ą
zana z t
ą
wielko
ś
ci
ą
χ
2
, równa si
ę
liczbie klas
danych (w tym przykładzie trzy klasy, czyli liczby AA, Aa oraz aa) minus jeden, minus
liczba parametrów oszacowanych na podstawie danych (w tym przykładzie jeden
parametr, p, oszacowano na podstawie danych), czyli 3 - 1 - 1 = 1. Zauwa
ż
my,
ż
e
stopie
ń
swobody nie jest pomniejszany z powodu oszacowania na podstawie danych
wielko
ś
ci parametru q, gdy
ż
kiedy ju
ż
oszacowali
ś
my p. wówczas q mo
ż
na otrzyma
ć
z zale
ż
no
ś
ci q = 1 - p. Przy jednym stopniu swobody otrzymana wy
ż
ej warto
ść
χ
2
jest
wysoce istotna (P < 0,01).
Warto
ść
krytyczna statystyki
χ
2
na poziomie istotno
ś
ci a = 0,05 wynosi w tym
przypadku 3,84

Ć
wiczenie 5
21
Obliczanie frekwencji alleli w locus przy pełnej dominacji. Rozpatrujemy dwie
cechy:
1. barwa oczu: br
ą
zowe. piwne lub zielone - genotyp M lub Aa niebieskie lub szare
- genotyp aa
2. ucho: wolny koniec - genotyp BB lub Sb, przyro
ś
ni
ę
ty koniec - genotyp bb.
Ka
ż
dy ze studentów okre
ś
la genotyp s
ą
siada (na podstawie jego fenotypu)
jako Ax lub aa oraz Bx lub bb.(gdzie x oznacza dowolny allel z danego locus).
Zauwa
ż
my.
ż
e tylko homozygoty recesywne s
ą
wyró
ż
nialne (dotyczy to obu
badanych loci genowych). Obliczamy udział homozygot recesywnych (dla ka
ż
dej
cechy oddzielnie) w całej grupie studenckiej. Dodajemy równie
ż
w miar
ę
mo
ż
liwo
ś
ci wyniki z grup poprzednich, aby zwi
ę
kszy
ć
liczebno
ść
próby i
zminimalizowa
ć
bł
ą
d statystyczny. Przykładowo, je
ż
eli liczba homozygot w locus
A wynosiła 5 na 20 osób, to frekwencja homozygot recesywnych w próbie wynosi
5/20 czyli 0.25. Z równania Hardy'ego i Weinberga wiemy.
ż
e frekwencja
homozygot recesywnych w populacji wynosi q
2
, a zatem frekwencja allelu
recesywnego q =
√
q
2
= 0,5. Frekwencja allelu dominuj
ą
cego wynosi za
ś
p = 1-q = 0,5
Mamy ju
ż
frekwencje alleli A i a (p i q) oraz B i b (p
1
i q
1
). Mo
ż
emy teraz
obliczy
ć
, jaki procent w populacji stanowi
ą
heterozygoty - nosiciele cech
recesywnych. Obliczamy to ze wzoru:
liczba heterozygot Aa = 2pq
liczba heterozygot Bb = 2p1q1.
Ka
ż
dy ze studentów, szczególnie potencjalnych heterozygot w badanych loci
przypomni sobie jak wygl
ą
daj
ą
wspomniane cechy u jego rodziców i rodze
ń
stwa, a
nast
ę
pnie wyci
ą
gnie wnioski co do swojego genotypu w loci A i B.

Ć
wiczenie 6
22
Ć
wiczenie 6. Efektywna wielko
ść
populacji i współczynnik inbredu –
rozwi
ą
zywanie zada
ń
.
Efektywna wielko
ść
populacji:
f
m
f
m
e
N
N
N
N
N
+
=
*
4
gdzie: N
m
- liczba samców, N
f
- liczba samic
Współczynnik inbredu:
t
e
t
N
F
)
5
,
0
1
(
1
−
−
=
gdzie: F - współczynnik inbredu, t - liczba pokole
ń
, N
e
- efektywna wielko
ść
populacji
AA p
o
2
+P
o
q
o
F
t
Aa 2p
o
q
o
-2p
o
q
o
F
t
aa q
o
2
+P
o
q
o
F
t
Im wy
ż
sza warto
ść
współczynnika inbredu tym szybciej wzrasta nadwy
ż
ka
homozygot w populacji. Inbred nie ma wpływu na frekwencje alleli A i a, natomiast
ma znaczny wpływ na frekwencje poszczególnych genotypów AA, Aa, i aa.
Zadania
1) Oblicz efektywn
ą
wielko
ść
populacji, w której jest:
a) 150 samic i 50 samców,
b) 180 samic i 20 samców,
c) 280 samic i 20 samców,
d) 380 samic i 20 samców,
e) 170 samic i 30 samców.
2) Oblicz efektywn
ą
wielko
ść
populacji zło
ż
onej z 10 kur i 1 koguta.
3) Efektywna wielko
ść
pewnej populacji wynosi 20. Frekwencje alleli A i a wynosz
ą
odpowiednio 0,6 i 0,4.

Ć
wiczenie 6
23
4) Oblicz współczynnik inbredu oraz frekwencje genotypów w tej populacji w
dziesi
ą
tym pokoleniu. Oblicz to samo dla populacji licz
ą
cej 1000 samic i 1000
samców.
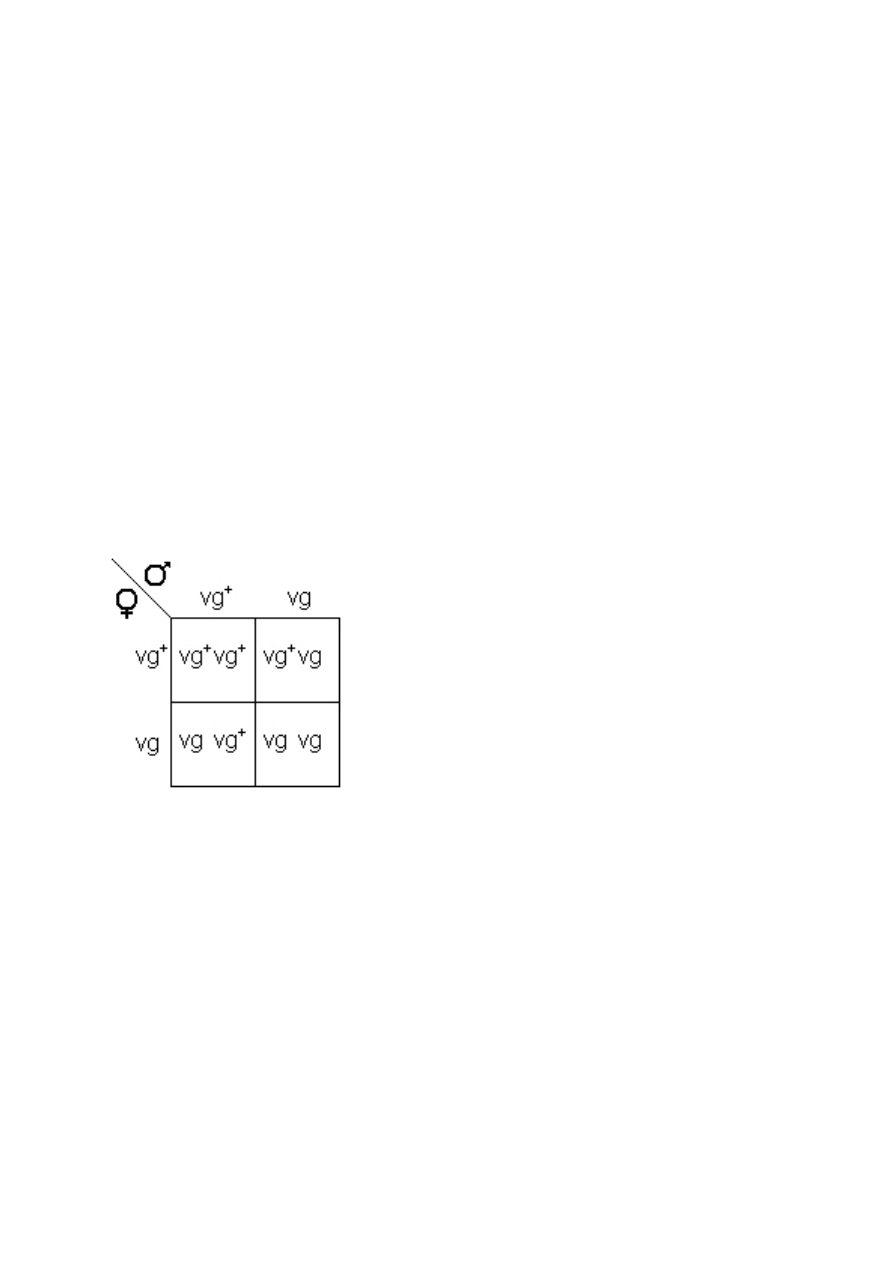
Ć
wiczenie 7
24
Ć
wiczenie 7. Genetyka muszki owocowej (Drosophila
melanogaster). Wykorzystanie programu komputerowego
drosophiLab.
DrosophiLab (autor programu: Hannes Jensen)
I Konstrukcja prostego eksperymentu
Przewodnik ten pozwala na przeprowadzenie prostego eksperymentu, w którym
analizowane b
ę
dzie dziedziczenie pojedynczego genu (vg – vestigial vings)
odpowiedzialnego za mutacj
ę
polegaj
ą
c
ą
na redukcji skrzydeł u D. melanogaster. Do
eksperymentu wybieramy rodziców, którzy s
ą
heterozygotami pod wzgl
ę
dem tego
genu. Jako,
ż
e rodzice nie wykazuj
ą
ż
adnej obecno
ś
ci tej mutacji mo
ż
emy si
ę
spodziewa
ć
, i
ż
25% pokolenia potomnego (F1) b
ę
dzie posiadało zredukowane
skrzydła (co ilustruje poni
ż
szy diagram)
Krok 1.
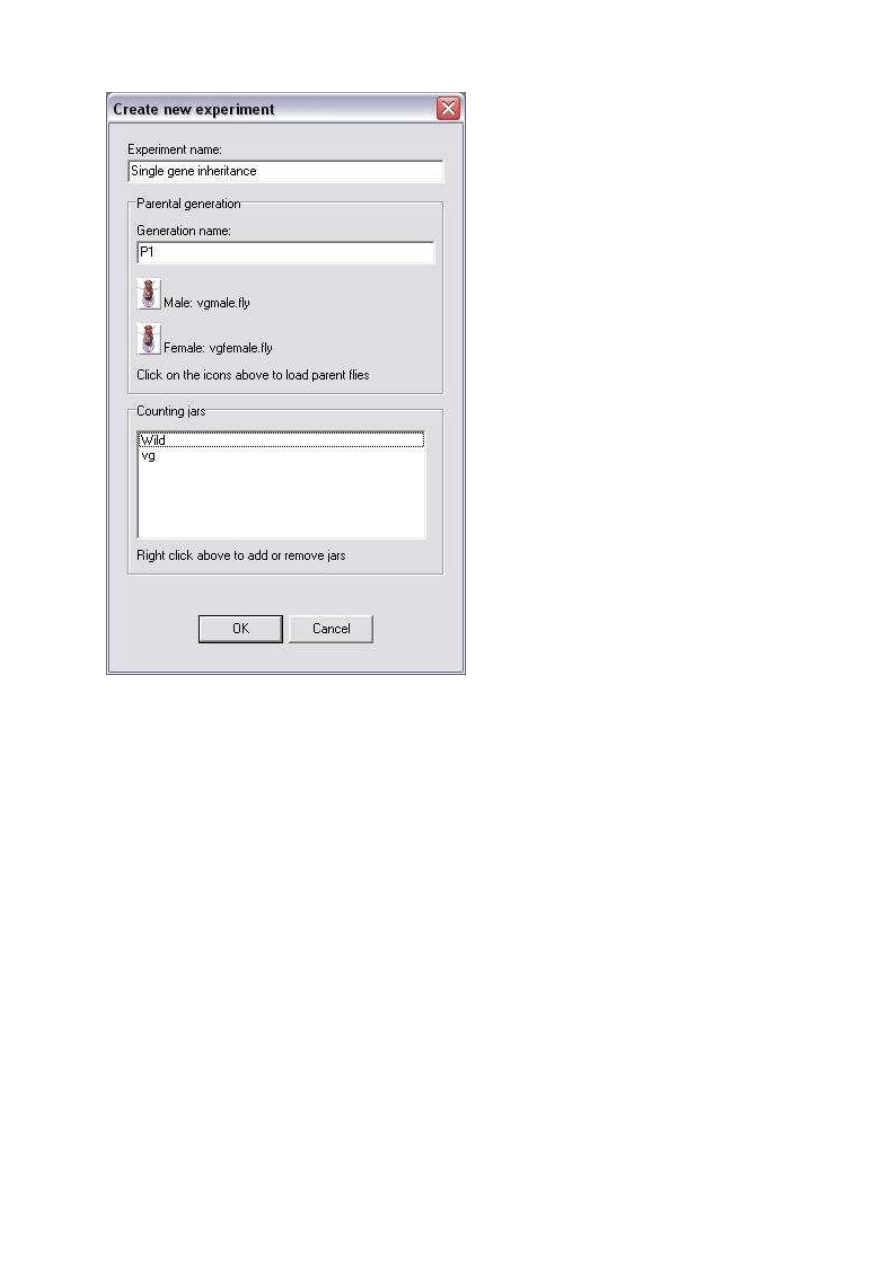
Uruchom program DrosophiLab i wybierz File> New Experiment. Wpisz nazw
ę
eksperymentu „mutacja vg” a nazw
ę
generacji zostaw bez zmian „P1”. Kliknij na ikon
ę
Male (samiec) i w oknie dialogowym wybierz vgmale.fly. Zrób te same czynno
ś
ci
wybieraj
ą
c samic
ę
(Female – vgfemale.fly).
Kliknij prawym przyciskiem myszy na białe pole opisane jako Counting jar (naczynie
do zliczania muszek) i wybierz Add jar (dodaj naczynie) wpisuj
ą
c jednocze
ś
nie nazw
ę
naczynia „forma dzika”. Dodaj jeszcze jedno naczynie i nazwij je jako „forma vg”.
Kliknij OK
ż
eby przej
ść
do drugiego kroku.
Ć
wiczenie 7
25
Krok 2.
Kolejny etap to rozpocz
ę
cie eksperymentu z wybranymi rodzicami. Osobniki te
ukazane s
ą
w formie małych ikon oznaczonych jako P1. Aby obejrze
ć
wybrane
muszki nale
ż
y przeci
ą
gn
ąć
je przy pomocy myszki na pole oznaczone Microscope.
Ogl
ą
dane osobniki mo
ż
na powi
ę
kszy
ć
poprzez przeci
ą
gni
ę
cie w dół suwaka
znajduj
ą
cego si
ę
po prawej stronie pola obserwacyjnego. Ponadto, ogl
ą
dane muszki
mo
ż
na obróci
ć
w dowolnym kierunku przytrzymuj
ą
c klawisz ctrl na klawiaturze. Aby
usun
ąć
muszk
ę
spod mikroskopu nale
ż
y klikn
ąć
Empty microscope. Nale
ż
y zwróci
ć
uwag
ę
, i
ż
obydwie muszki posiadaj
ą
normalne skrzydła. Aby zatwierdzi
ć
muszk
ę
jako rodzica klikn
ąć
na set as parent. Wybór muszki na rodzica jest potwierdzany
przez ró
ż
owe zabarwienie ikony muszki.
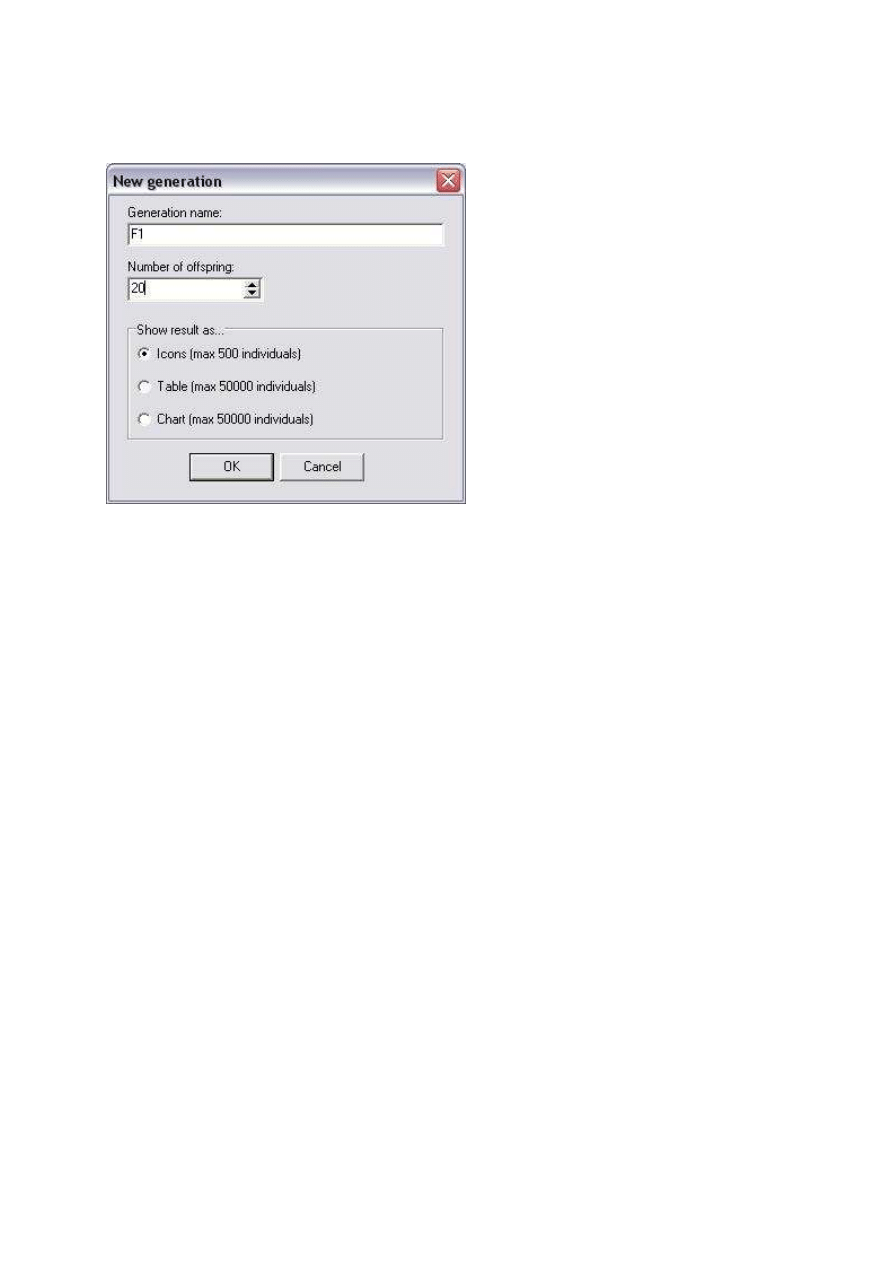
Z górnego paska dialogowego wybierz Experiment>New generation. Wprowad
ź
liczb
ę
potomstwa Number of offspring (tym razem niech to b
ę
dzie 20) i upewnij si
ę
,
ż
e poni
ż
ej zaznaczona jest opcja Icons (ikony). Inne mo
ż
liwo
ś
ci pokazania wyników
Ć
wiczenie 7
26
to Tabela (Table) lub wykres (Chart). Przejd
ź
do kolejnego kroku poprzez klikni
ę
cie
OK.
Krok 3.
Potomstwo wybranych rodziców (w formie małych ikon) powinno znajdowa
ć
si
ę
w
oknie oznaczonym jako F1.
Ka
ż
d
ą
potomn
ą
muszk
ę
przeci
ą
gnij przy pomocy myszki pod mikroskop i sprawd
ź
czy posiada ona normalne skrzydła czy te
ż
zredukowane. Muszki z normalnymi
skrzydłami bezpo
ś
rednio spod mikroskopu przeci
ą
gnij do naczynia „forma dzika”
natomiast muszki ze zredukowanymi skrzydłami przenie
ś
do naczynia „forma vg”.
Ile jest much z efektem mutacji vg a ile powinno by
ć
?
II Eksperyment. Dziedziczenie cech recesywnych.
Krok 1.
Utwórz muszki o podanym poni
ż
ej genotypie przy pomocy Edytora Chromosomów:
Tools>Chromosome Editor.
Samiec (zaznacz opcj
ę
Male!): (w+) (vg+/vg+), zapisz (File>Save) w katalogu Flies
(C:/Program Files\Drosohilab/Flies) jako dzikisamiec.fly .
Samica (zaznacz opcj
ę
Female!): (w/w) (vg/vg), zapisz jako bialookasamica.fly.
Krok 2.

Ć
wiczenie 7
27
Utwórz nowy eksperyment (File>New Experiment) i wybierz samca
(dzikisamiec.fly) i samic
ę
(bialookasamica.fly). Potwierd
ź
poprzez klikni
ę
cie
OK.
Krok 3.
Sprawd
ź
pod mikroskopem czy wybrałe
ś
odpowiednie osobniki, je
ś
li tak to zatwierd
ź
je jako rodziców. Kontynuuj prac
ę
Experiment>New generation, wpisz liczb
ę
osobników potomnych (100), zaznacz format wyniku jako ikony (opcja Icone) i kliknij
OK.
Krok 4.
Przeanalizuj wyniki, dodaj trzy naczynia do liczenia muszek (Experiment>Add
counting jar), i nazwij je kolejno: białe oczy, czerwone oczy, bez skrzydeł. Ile
osobników ma czerwone oczy (forma dzika), ile osobników ma białe oczy a ile
powstało osobników ze zredukowanymi skrzydłami?
Wyja
ś
nij otrzymane wyniki. Jakie genotypy i jakie fenotypy powinny posiada
ć
osobniki potomne?
Krok 5.
Powtórz krok 2 i 3, Z potomstwa otrzymanego w krok 4, wybierz po jednym
osobniku z czerwonymi oczami (forma dzika) oraz białymi oczami, wska
ż
je jako
osobniki rodzicielskie. Utwórz pokolenie F2 (Experiment>New Generation).
Wpisz liczb
ę
osobników potomnych (100), wyniki utwórz w formie tabeli (opcja
Table).
Jakich genotypów i jakich fenotypów mo
ż
emy si
ę
spodziewa
ć
? Jaki jest
empiryczny stosunek otrzymanych fenotypów?
Wykaz skrótów oznacz
ę
fenotypów u
ż
ywanych przez program DrosophiLab
w (white eyes) – białe oczy
rb (ruby eyes) – rubinowe oczy
t (tan body) –
ż
ółtobr
ą
zowe ciało
B (bar eyes) – ograniczona wielko
ść
oczu
al (aristaless antena) – urz
ę
sione czułki
Cy (curly wings) – podwini
ę
te skrzydła

Ć
wiczenie 7
28
b (black body) – czarne ciało
p (purple eyes) – purpurowe oczy
vg (vestigial vings) – zredukowane skrzydła
L (lobe eyes) – oczy ograniczone
c (curved wings) – zakrzywione skrzydła
jv (javelin bristles) – odstaj
ą
ce rz
ę
ski
se (sepia eyes) – oczy w kolorze sepii th (thread arista) – nitkowate czułki
cu (curly wings) – podwini
ę
te skrzydła, jednocze
ś
nie czarne ciało
sr (striped body) – pr
ąż
kowane ciało
ci (cubitus interruptus veins) – najwi
ę
ksze skrzydła poprzerywane, mniejsze w
zaniku
sv (shaven bristles) – rz
ę
ski krótkie lub w zaniku

Ć
wiczenie 8
29
Ć
wiczenie 8. Geny autosomalne i sprz
ęż
one z płci
ą
. Drosophila
melanogaster jako obiekt bada
ń
genetycznych
Przygotowanie hodowli
Do próbówki wsypa
ć
1 g IDM (Instant Drosophila Medium) (3,5-3,7ml obj
ę
to
ś
ci).
Doda
ć
5 ml wody destylowanej. UWAGA!
Ś
cianki próbówki musz
ą
pozosta
ć
suche.
Wszystkie naczynia musz
ą
by
ć
całkowicie suche. Oznakuj probówki swoimi
inicjałami, dat
ą
i zaznacz, jakie muchy tam hodujesz (gdzie Mel oznacza Drosophila
melanogaster - czyli muszka owocowa):
• Mel + (dzikie),
• Mel Vg (bezskrzydłe),
• Mel W (białookie),
• Mel W/Vg (białookie, bezskrzydle).
Je
ż
eli wykonujesz krzy
ż
ówki zaznacz w opisie płe
ć
poszczególnych u
ż
ytych
osobników.
Usypianie much przy u
ż
yciu anestetyku Fly Nap.
Preparat Fly Nap to nowoczesny anestetyk stosowany do usypiania much. W
przeciwie
ń
stwie wcze
ś
niej stosowanych
ś
rodków jak: CO2 , chloroform, jest on
nieszkodliwy dla owadów. Jego u
ż
ycie nie wpływa na prze
ż
ywalno
ść
larw, poczwarek
i osobników dorosłych. Muchy u
ś
pione preparatem Fly Nap pozostaj
ą
w stanie
narkozy przez okres 1-1,5 godziny. Jego prawidłowe zastosowanie uzale
ż
nione jest
jednak od przestrzegania poni
ż
szej instrukcji. Przy usypianiu much anestetykiem Fly
Nap mo
ż
na tak
ż
e skorzysta
ć
z rysunku zamieszczonego na s
ą
siedniej stronie.
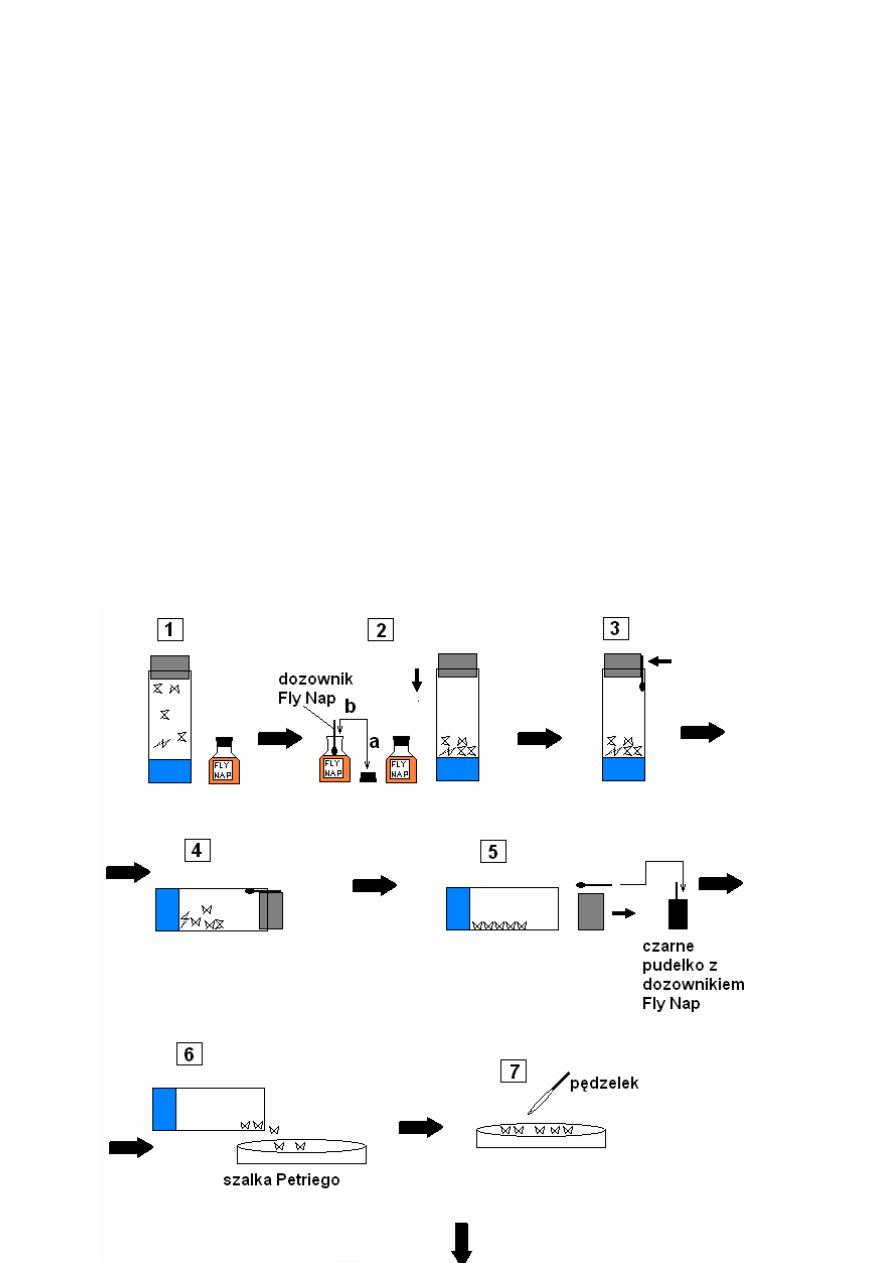
1. Prosz
ę
przygotowa
ć
:
a. butelk
ę
z preparatem Fly Nap i dozownik do preparatu Fly Nap,
b. czarne pudełko na dozownik Fly Nap,
c. płytk
ę
szklan
ą
(szalka Petriego),
d. próbówki z rozrobion
ą
po
ż
ywk
ą
wraz z korkiem,
e. p
ę
dzelek.
2. Odkr
ę
ci
ć
butelk
ę
z preparatem Fly Nap i umocz ko
ń
cówk
ę
dozownika Fly Nap
w preparacie. Po umoczeniu ko
ń
cówki dozownika DOKŁADNIE ZAKR
Ę
CI
Ć
Ć
wiczenie 8
30
butelk
ę
!
3. Strz
ą
sn
ąć
delikatnie muchy na dno próbówki.
4. Odsun
ąć
cz
ęś
ciowo korek próbówki i umie
ść
dozownik poni
ż
ej korka (czynno
ść
t
ą
trzeba wykona
ć
szybko aby muchy nie uciekły z próbówki).
5. Uło
ż
y
ć
próbówk
ę
z dozownikiem na stole w pozycji horyzontalnej.
6. Pozostawi
ć
dozownik Fly Nap pod korkiem próbówki na czas 8-iu minut.
7. Gdy muchy przestan
ą
si
ę
rusza
ć
usun
ąć
jednocze
ś
nie korek i dozownik Fly Nap.
Nast
ę
pnie dozownik umie
ś
ci
ć
w czarnym pudełku.
8. Wysypa
ć
muchy na szalk
ę
Petriego.
9. Z po
ś
ród much znajduj
ą
cych si
ę
w szalce wybra
ć
interesuj
ą
ce nas osobniki.
Selekcj
ę
much dokonujemy przy u
ż
yciu p
ę
dzelka.
10. Przy u
ż
yciu p
ę
dzelka przenie
ść
wyselekcjonowane osobniki do nowej próbówki.
11. Zatka
ć
próbówk
ę
i pozostawi
ć
j
ą
w pozycji horyzontalnej.
Ć
wiczenie 8
31
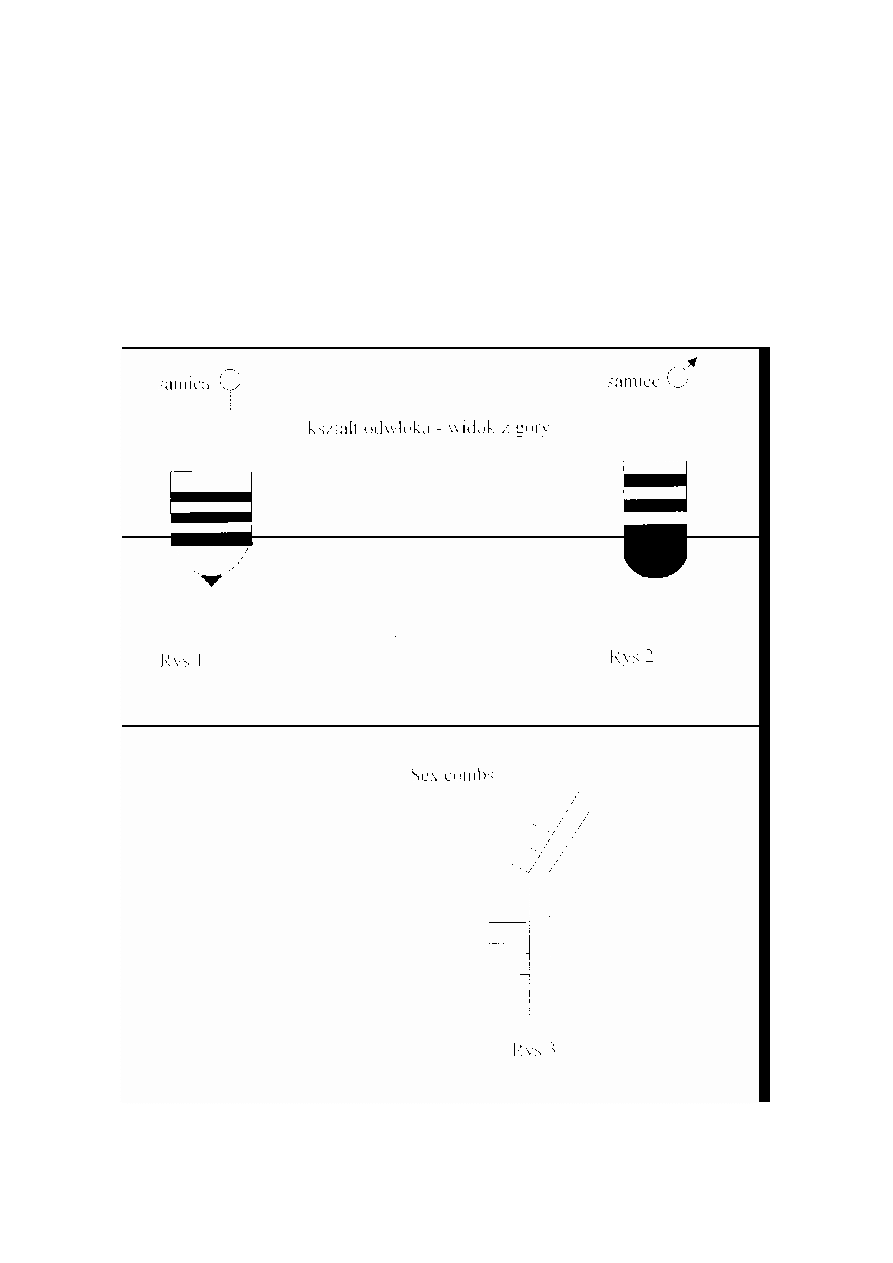
Odró
ż
nianie płci u Drosophila melcmogaster
1.
Samice s
ą
nieco wi
ę
ksze od samców.
2. Samice maja, pr
ąż
kowany odwłok, szeroki i zaostrzony na ko
ń
cu do składania jaj
(Rys. 1).
3. Koniec odwłoka samca jest okr
ą
gły i prawie czarny w porównaniu do pr
ąż
ków
samicy (Rys.2). U młodych muszek me wida
ć
tak wyra
ź
nej ró
ż
nicy.
4. U samców na pierwszej parze odnó
ż
y znajduj
ą
. si
ę
tzw. sex combs - szereg
g
ę
stych czarnych szczecinek (Rys.3).
Bierzemy pod uwag
ę
dwie cechy muszki owocowej wykazuj
ą
ce zmienno
ść

Ć
wiczenie 8
32
•
barwa oczu - biała (w) lub czerwona (+)
•
skrzydła - normalne (+) lub zredukowane (vg).
Nale
ż
y okre
ś
li
ć
, które z tych cech sa dominuj
ą
ce, a które recesywne oraz ktore
s
ą
autosomalne, a które sprz
ęż
one z płci
ą
. W tym celu ka
ż
da podgrupa wykona 2
ró
ż
ne krzy
ż
ówki miedzy osobnikami z ró
ż
nych linii hodowlanych muszki. Przy
analizowaniu wyników nale
ż
y uwzgl
ę
dni
ć
fakt, i
ż
niektóre samice mogły zosta
ć
zapłodnione ju
ż
w hodowli macierzystej, (je
ż
eli przebywały w niej dłu
ż
ej ni
ż
8
godzin od momentu opuszczenia poczwarki). Cz
ęść
potomstwa takiej samicy ( z
jaj zło
ż
onych najwcze
ś
niej) nie b
ę
dzie rezultatem zało
ż
onej przez nas krzy
ż
ówki.
Tej cz
ęś
ci potomstwa nie uwzgl
ę
dniamy w naszej analizie.
W ka
ż
dej podgrupie (połowa grupy) zakładane s
ą
dwie uzupełniaj
ą
ce si
ę
krzy
ż
ówki: bialooka bezskrzydła samica (Mel w/vg) z samcem o fenotypie
dzikim (Mel +) (czerwone oczy i normalne skrzydła) oraz krzy
ż
ówka odwrotna.
Trzecia hodowla b
ę
dzie zało
ż
ona wył
ą
cznie z muszek dzikich w liczbie: 3
samce i 3 samice.

Ć
wiczenie 9
33
Ć
wiczenie 9. Modele doboru naturalnego w populacjach -
symulacje komputerowe dotycz
ą
ce zmian frekwencji alleli w
populacji pod wpływem doboru naturalnego.
Współczynnik reprodukcji (R):
R = FxP, gdzie F oznacza liczb
ę
potomków przypadaj
ą
cych na jednego osobnika
rodzicielskiego a P to prawdopodobie
ń
stwo prze
ż
ycia potomka do wieku
reprodukcyjnego.
Warto
ść
przystosowawcza genotypu:
jest to stosunek współczynnika reprodukcji danego genotypu do współczynnika
reprodukcji najkorzystniejszego genoypu: W = R/Rmax.
Dobór przeciw homozygotom recesywnym:
(np. melanizm przemysłowy Biston betularia na obszarach
zanieczyszczonych). WAA = WAa = 1, Waa = 1-s
∆
q = -pq2s/1-sq2
p,q – frekwencje alleli A i a
∆
q – zmiana frekwencji allelu a
Dobór przeciw homozygotom dominuj
ą
cym i heterozygotom:
(np. forma nie-melanistyczna motyla Biston betularia na obszarach nie
zanieczyszczonych) WAA = WAa = 1-s, Waa = 1
∆
q = -pq2s/1-ps(1+q)
Dobór przeciw obu homozygotom:
(np. anemia sierpowata u człowieka na obszarach
malarycznych) WAa = 1, WAA = 1 – sAA, Waa = 1 - saa
Dobór przeciw heterozygotom:
WAa = 1, WAA = 1 + sAA, Waa = 1 + saa
∆
q = pq(qsaa-psAA)/1+p2sAA+q2saa
∆
q=0 – punkt równowagi
nietrwałej, przy niewielkim odchyleniu wyst
ę
puje tendencja do jego pogł
ę
bienia
(dodatnie sprz
ęż
enie zwrotne).
Dwa punkty równowagi trwałej: q=1, p=0 oraz q=0, p=1.
POPULUS
Celem
ć
wicze
ń
jest analiza wpływu naturalnej selekcji, dryfu genetycznego,

Ć
wiczenie 9
34
migracji, mutacji oraz ich kombinacji na cz
ę
sto
ść
wyst
ę
powania alleli w populacji.
W
ć
wiczeniu analizowana b
ę
dzie populacja myszy. Kolor sier
ś
ci myszy
kontrolowany jest przez jeden gen posiadaj
ą
cy dwa allele. W przypadku tej cechy
wyst
ę
puje nie pełna dominacja: homozygoty dominuj
ą
ce (AA) posiadaj
ą
sier
ść
koloru czarnego, heterozygoty (Aa) posiadaj
ą
sier
ść
koloru szarego a homozygoty
recesywne (aa) maj
ą
sier
ść
koloru białego. Zakłada si
ę
,
ż
e myszy
ż
yj
ą
na wyspie
bez drapie
ż
nika. Frekwencja obu alleli jest identyczna, chyba
ż
e podane jest
inaczej.
Symulacja I
Na bardzo du
żą
, odizolowana populacj
ę
myszy, swobodnie si
ę
krzy
ż
uj
ą
cych nie
działaj
ą
ż
adne czynniki mutagenne. Je
ś
li na wysp
ę
przedostanie si
ę
drapie
ż
nik (np.
mysz) bardziej zagro
ż
one s
ą
białe myszy. Celem symulacji jest okre
ś
lenie kierunku
ewolucji wobec działania powy
ż
szego czynnika selekcyjnego.
1. Uruchom program Populus i przejd
ź
do Model > Natural selections. Wybierz
Selection on Diallelic Autosomal Locus.
2. Zaznacz opcj
ę
genotypic frequencies vs. t.
3. Wybierz Fitness (przystosowanie) i okre
ś
l je dla ka
ż
dego genotypu:
AA przystosowanie 1.0
Aa przystosowanie 1.0
aa przystosowanie 0.7
4. Wybierz jedn
ą
pocz
ą
tkow
ą
frekwencj
ę
(One Initial Frequency) i wpisz 0.5. Ustaw
liczb
ę
generacji (Generations) na 130.
5. Naci
ś
nij View.
6. Odpowiedz na nast
ę
puj
ą
ce pytania:
a) Okre
ś
l linie dotycz
ą
ce poszczególnych genotypów. Jak nale
ż
y je
interpretowa
ć
?
b) Je
ś
li przystosowanie genotypów AA i Aa jest takie same dlaczego
frekwencja genotypu AA wzrasta a genotypu Aa obni
ż
a si
ę
?
c) Je
ś
li genotyp aa jest "zły" dlaczego nie zanikł zupełnie? Wró
ć
do Plot
Options i zaznacz "p vs. t". Pozwoli to zbada
ć
jak zmienia si
ę
frekwencja
allelu A (p) w czasie. Co mo
ż
na zaobserwowa
ć
?

Ć
wiczenie 9
35
d) Zmie
ń
pocz
ą
tkow
ą
frekwencj
ę
allelu A na 0.1 i zaznacz ponownie genotypic
frequencies vs. t (pozostaw reszt
ę
bez zmian). Przypuszczamy, i
ż
ilo
ść
białych myszy
(genotyp aa) przewy
ż
szała ilo
ść
ciemnych myszy na wyspie przed przybyciem
drapie
ż
nika. Dlaczego linia genotypu aa obni
ż
yła si
ę
tak szybko. Dlaczego
frekwencja genotypu Aa pocz
ą
tkowo wzrastała a potem si
ę
obni
ż
yła?
e) Jakie wnioski dotycz
ą
ce działania selekcji mo
ż
na wyci
ą
gn
ąć
na
podstawie przeprowadzonych symulacji.
Symulacja II
Symulacji poddana b
ę
dzie ta sama, du
ż
a, odizolowana, swobodnie krzy
ż
uj
ą
ca
si
ę
populacja myszy, w której nie wyst
ę
puj
ą
ż
adne mutacje wpływaj
ą
ce na kolor ich
sier
ś
ci. Najbardziej nara
ż
one na działanie drapie
ż
nika s
ą
osobniki białe, potem
czarne a na ko
ń
cu szare.
Wybierz opcj
ę
Selection on a Diallelic Autosomal Locus ustawiaj
ą
c reszt
ę
opcji jak
w poprzedniej symulacji (initial frequency 0.5) Przystosowanie (Fitness) ustaw w
nast
ę
puj
ą
cy sposób:
AA - 0.9
Aa - 1.0
aa - 0.7
Jakie s
ą
główne ró
ż
nice mi
ę
dzy wynikami tej a poprzedniej symulacji ?
Symulacja III
W niniejszej symulacji ta sama odizolowana populacja myszy, swobodnie
krzy
ż
uj
ą
ca si
ę
ma niewielk
ą
liczebno
ść
. Brakuje mutacji wpływaj
ą
cych na kolor
sier
ś
ci nie ma te
ż
ró
ż
nic w prze
ż
ywalno
ś
ci ró
ż
nych form barwnych.
1. Wybierz model Mendelian Genetics i Genetic Drift . Wybierz zakładk
ę
Monte
Carlo i ustaw opcj
ę
w nast
ę
puj
ą
cy sposób:
a) Runtime = 3N
generations b) Loci = 6

Ć
wiczenie 9
36
c) Initial frequency = 0.5
d) Population size = 500
2. Naci
ś
nij View. Linia ka
ż
dego koloru oznacza przypadkowo wybrany allel genomu
myszy. Allele te s
ą
niezale
ż
ne od siebie i nie wpływaj
ą
one na prze
ż
ywalno
ść
.
3. Przeprowad
ź
18 prób (Iterate): sze
ść
dla populacji 500 osobników, sze
ść
dla
populacji 50 osobników i sze
ść
dla populacji licz
ą
cej 5 osobników.
4. Dla ka
ż
dej próby zanotuj nast
ę
puj
ą
ce informacje:
a) Wielko
ść
populacji (Population size - N)
b) Liczb
ę
generacji do momentu osi
ą
gni
ę
cia frekwencji równej 1 lub zero przez
pierwszy z alleli (Fixation)
c) Kolor allelu który jako pierwszy osi
ą
gn
ą
ł frekwencj
ę
1 lub zero
d) W ilu przypadkach doszło najpierw do osi
ą
gni
ę
cia frekwencji 0 a w ilu
przypadkach frekwencji 1
5. Odpowiedz na nast
ę
puj
ą
ce pytania:
a) Czy we wszystkich próbach frekwencje alleli przebiegały w ten sam sposób?
Dlaczego tak, dlaczego nie?
b) Czy frekwencje poszczególnych alleli wygl
ą
dały tak samo w ró
ż
nych
próbach? Dlaczego tak, dlaczego nie?
c) Jak du
ż
e były ró
ż
nice w czasie osi
ą
gni
ę
cia przez pierwszy allel frekwencji 1 lub
zero?
d) Je
ś
li allele te nie s
ą
zwi
ą
zane z selekcj
ą
to dlaczego zmienia si
ę
ich
frekwencja?
e) Bardzo cz
ę
sto uwa
ż
a si
ę
dryft genetyczny zwi
ą
zany jest tylko z małymi
populacjami. Jednak
ż
e ma on równie
ż
wpływ na du
ż
e populacje ale wpływa
na nie w sposób mniej zauwa
ż
alny.
f) Symulacja ta pokazuje zmian
ę
frekwencji alleli w czasie. Czy mo
ż
na
powiedzie
ć
,
ż
e w taki sposób przebiega ewolucja?
g) Czy mo
ż
na przewidzie
ć
dla danej populacji kiedy dojdzie do utraty konkretnego
allelu?
Symulacja IV

Ć
wiczenie 9
37
Dryf genetyczny a selekcja.
W rzeczywisto
ś
ci dryf genetyczny i selekcja działaj
ą
zazwyczaj jednocze
ś
nie, s
ą
one
dwoma najwa
ż
niejszymi czynnikami ewolucyjnymi.
W omawianej populacji myszy wraz z przybyciem na wysp
ę
drapie
ż
nika selekcja
działa przeciwko białym myszom (aa), jednak
ż
e nie jest to cecha letalna - myszy
białych jest o 10% mniej ni
ż
ciemnych.
1. W opcji Mendelian Genetics zaznacz Drift and Selection. Wprowad
ź
dane:
a) N = 500, p = 0.1, Generations = 500
b) AA = 1.0 Aa = 1.0 aa = 0.9
2. Zanim sprawdzisz wynik rozwa
ż
: je
ś
li nie działa dryf genetyczny czy allel a
zostanie wyparty z populacji?
3. Naci
ś
nij View i zobacz co stanie si
ę
po 500 generacjach. Przeprowad
ź
5
symulacji obserwuj
ą
c za ka
ż
dym wyniki. Jaki jest wynik? Czy za ka
ż
dym razem
wyniki były takie same? Dlaczego warto
ść
allelu A osi
ą
gn
ę
ła 1?
4. Selekcja (obecno
ść
drapie
ż
nika) spowodowała
ż
e frekwencja allelu A wzrosła.
Jednak
ż
e jak wida
ć
było w symulacji pierwszej linia wzrostu frekwencji tego
allelu nie jest prosta. Wzrost jest bardzo niejednorodny - jest to wynikiem
działania dryfu genetycznego.
5. Teraz zmie
ń
wielko
ść
populacji na 50 i naci
ś
nij View. Co si
ę
dzieje w
mniejszej populacji?
6. Przeprowad
ź
5 symulacji. Czy otrzymane wyniki podobne s
ą
do tych, które były
uzyskane dla wi
ę
kszej populacji.
7. Gdy wielko
ść
populacji wynosiła 500 bez w
ą
tpienia mo
ż
na było zauwa
ż
y
ć
,
ż
e
frekwencja allelu A wzrastała do momentu przekroczenia warto
ś
ci 1.
Najprawdopodobniej sytuacja powtórzyła si
ę
, gdy wielko
ść
populacji wynosiła 50.
8. Czy populacja myszy na wyspie ewoluowała? Je
ś
li tak to jakie były
mechanizmy tej ewolucji?
9. Co otrzymane wyniki mog
ą
powiedzie
ć
o działaniu dryfu genetycznego i selekcji
w małej i du
ż
ej populacji?

Ć
wiczenie 10
38
Ć
wiczenie 10.
Analiza wyników hodowli muszki owocowej (
ć
wiczenie
8). Genotyp a
ś
rodowisko: wpływ zag
ę
szczenia populacji na mas
ę
ciała Drosophila melanogaster - zakładanie hodowli muszki
owocowej
A. Analiza wyników krzy
ż
ówek z
ć
wiczenia 8.
a) Geny autosomalne i sprz
ęż
one z płci
ą
. Analiza wyników do
ś
wiadczenia
1. Usypiamy muchy i rozdzielamy według płci.
2. Analizujemy fenotyp uzyskanych w pokoleniu F1 samców i samic.
3. Ustalamy, do której z rubryk tabeli z
ć
wiczenia 3 pasuj
ą
otrzymane wyniki.
4. Wyci
ą
gamy wnioski na temat mechanizmu dziedziczenia badanych dwu cech u
muszki owocowej.
B. Genotyp a
ś
rodowisko. Wpływ zag
ę
szczenia populacji na mas
ę
ciała muszki
owocowej (Drosophila melanogaster). Zało
ż
enie do
ś
wiadczenia
Ka
ż
da podgrupa zakłada 3 hodowle (ka
ż
da para po 1, o wy
ż
szym lub ni
ż
szym
zag
ę
szczeniu much)
• 2 samce + 2 samice (6 hodowli w całej grupie) (zag
ę
szczenie 1)
• 6 samców + 6 samic (6 hodowli w całej grupie) (zag
ę
szczenie 2)
Po 48h muchy rodzicielskie zostan
ą
usuni
ę
te z próbówek przez osob
ę
prowadz
ą
ca
ć
wiczenia. Wszystkie muchy potomne uzyskane po 2 tygodniach b
ę
d
ą
nale
ż
ały do
pokolenia F1.

Ć
wiczenie 11
39
Ć
wiczenie 11. Zastosowania bada
ń
polimorfizmu sekwencji
mikrosatelitarnych w genetyce – przeprowadzenie rozdziału
produktu PCR w
ż
elu agarozowym.
Przeprowadzony zostanie rozdział fragmentów DNA zawieraj
ą
cych mikrosatelity
OMM 1007, OMM 1008, OMM 1036 i OMM 1037, amplifikowane uprzednio technik
ą
PCR.
Rozdział produktu PCR zostanie przeprowadzony w
ż
elu agarozowym o st
ęż
eniu
1,5%.
WYKONANIE
Ć
WICZENIA
Przygotowane
ż
elu agarozowego. Uwaga wszystkie poni
ż
sze prace nale
ż
y
wykona
ć
w r
ę
kawiczkach lateksowych.
1. Wł
ą
cz wag
ę
elektroniczn
ą
wskazan
ą
prze prowadz
ą
cego
ć
wiczenia.
2. Umie
ść
kolb
ę
Erlenmeyer-a o pojemno
ś
ci 250 ml na wadze i wytaruj wag
ę
.
3. Za pomoc
ą
ły
ż
eczki wsyp do kolby 1,5g agarowy.
4. Za pomoc
ą
cylindra z napisem TBE odmierz 100 ml buforu 1X TBE i wlej do
kolby.
5. Umie
ść
magnes w kolbie.
6. Wł
ą
cz mieszadło elektromagnetyczne wskazane przez prowadz
ą
cego
ć
wiczenia, postaw kolb
ę
na mieszadle.
7. Ustaw cz
ę
stotliwo
ść
mieszania na 450 obr /min i mieszaj przez 1 minut
ę
.
8. Ustaw pokr
ę
tło pr
ę
dko
ś
ci mieszania na 0 i przenie
ś
kolb
ę
do kuchenki
mikrofalowej.
9. Zagotuj zawarto
ść
kolby. W momencie osi
ą
gni
ę
cia temperatury wrzenia
natychmiast wył
ą
cz kuchenk
ę
. Nie wolno dopu
ś
ci
ć
do wykipienia
zawarto
ś
ci kolby!
10. Załó
ż
r
ę
kawic
ę
kuchenn
ą
, wyci
ą
gnij kolb
ę
z mikrofalówki, postaw na stole pod
wyci
ą
giem, ustaw temperatur
ę
płyty mieszadła elektromagnetycznego na
150
o
C.

Ć
wiczenie 11
40
11. Prowadz
ą
cy doda do kolby 5
µ
l bromku etydyny.
Uwaga: bromek etydyny jest bardzo silnym mutagenem! Niebezpieczny jest
kontakt ze skór
ą
oraz wdychanie oparów.
12. Kolb
ę
trzeba przykry
ć
folia aluminiow
ą
(niebezpiecze
ń
stwo oparów bromku
etydyny!).
13. Ustaw kolb
ę
na mieszadle elektromagnetycznym, mieszaj 5 minut
cz
ę
stotliwo
ś
ci
ą
450 rpm w takcie mieszania przygotuj sanki do wylania
ż
elu
zgodnie ze wskazówkami prowadz
ą
cego.
14. Wył
ą
cz mieszadło elektromagnetyczne, pokr
ę
tło temperatury płyty ustaw na 0.
Przygotowanie rozdziału elektroforetycznego.
1. Je
ś
li w kolbie
ż
el zastygł, konieczne b
ę
dzie jego roztopienie. Zdejmij
aluminiow
ą
foli
ę
z szyjki kolby. Wstaw kolb
ę
do mikrofalówki i podgrzewaj j
ą
do momentu osi
ą
gni
ę
cia przez
ż
el temperatury wrzenia. Pami
ę
taj! Nie wolno
dopu
ś
ci
ć
do wykipienia zawarto
ś
ci kolby! W trakcie ogrzewania musisz
stale kontrolowa
ć
jej zawarto
ść
. B
ą
d
ź
gotowy do natychmiastowego
wył
ą
czenia mikrofalówki momencie zagotowania si
ę
ż
elu.
2. Prowadz
ą
cy
ć
wiczenia przygotuje sanki i wleje do nich odpowiedni
ą
obj
ę
to
ść
przygotowanego
ż
elu. Pami
ę
taj!
Ż
el agarozowym o st
ęż
eniu 1,5%
potrzebuje około 15 minut do zastygni
ę
cia.
Przygotowanie i naniesienie próbek do
ż
elu oraz przeprowadzenie elektroforezy
odcinków DNA zawieraj
ą
cych fragmenty mikrosatelitarne.
1. Prowadz
ą
cy
ć
wiczenia odmierzy za pomoc
ą
pipety automatycznej po 1
µ
l
buforu obci
ąż
aj
ą
cego dla ka
ż
dej przygotowywanej próbki. Nast
ę
pnie do
pierwszej kropli doda 0,3
µ
l wzorca masowego oraz 5
µ
l wody dejonizowanej.
2. Dodaj do pozostałych kropli buforu obci
ąż
aj
ą
cego 5
µ
l roztworu z próbek
przyniesionych przez prowadz
ą
cego. Zmie
ń
ko
ń
cówk
ę
pipety w momencie gdy
zako
ń
czysz sporz
ą
dzanie próbek pierwszego spo
ś
ród badanych fragmentów
mikrosatelitarnych.
3. Wstaw sanki do aparatu wskazanego przez prowadz
ą
cego. Nanie
ś
próbki do
studzienek w
ż
elu agarozowym.

Ć
wiczenie 11
41
4. Prowadz
ą
cy dobierze parametry napi
ę
cia i nat
ęż
ania pr
ą
du zasilaj
ą
cego aparat
do elektroforezy oraz czas trwania elektroforezy.
5. Aby rozpocz
ąć
elektroforez
ę
naci
ś
nij przycisk "run" na zasilaczu.
W trakcie trwania elektroforezy wysłuchaj uwa
ż
nie prezentacji prowadz
ą
cego
ć
wiczenia na temat zastosowania bada
ń
polimorfizmu sekwencji mikrosatelitarnych w
genetyce ryb.
Wizualizacja i interpretacja uzyskanych wyników.
1. Po zako
ń
czeniu elektroforezy prowadz
ą
cy przeniesie sanki z
ż
elem na
transiluminator, uruchomi komputer i program Kodak 1D Image Software. Przy
u
ż
yciu podł
ą
czonej do komputera kamery i drukarki wykona odbitk
ę
fotograficzn
ą
otrzymanego elektroforogramu.
2. Na postawie wzorca masowego i zostanie przeprowadzone szacowanie
długo
ś
ci zamplifikowanych fragmentów DNA.
3. Porównaj długo
ść
zamplifikowanych fragmentów i wyci
ą
gnij wnioski dotycz
ą
ce
ró
ż
nic długo
ś
ci analizowanych fragmentów.
Ć
wiczenie 12
42
Ć
wiczenie 12. Obliczanie dystansu genetycznego z zastosowaniem
modelu: wariancji
ś
rednich rozmiarów alleli (
δµ
2
) – zadania rachunkowe
Model wariancji kwadratów
ś
rednich rozmiarów alleli został opracowany przez roku
Goldstein i in. (1995) jest stosowany do oblicze
ń
dystansu genetycznego
istniej
ą
cego pomi
ę
dzy populacjami. Model ten umo
ż
liwia precyzyjne obliczenie
dystansu genetycznego istniej
ą
cego pomi
ę
dzy próbami o ró
ż
nej liczebno
ś
ci.
gdzie:
δ
- wariancja
µ
-
Ś
redni rozmiar alleli w badanym locus mierzony
liczb
ą
powtórze
ń
motywu podstawowego
x - populacja x, y – populacja y
Przykładowa frekwencja wyst
ę
powania alleli w locus mikrosatelitarnym w populacjach
X i Y
Frekwencja allelu
Rozmiar
allelu
(bp.)
Rozmiar
allelu (r.m.)
populacja X
populacja Y
98
49
0,24
0,06
102
51
0,08
0,14
106
53
0,32
0,01
110
55
0,14
0,32
114
57
0,18
0,20
118
59
0,04
0,12
126
63
0
0,15
Rozmiar ka
ż
dego allelu mno
ż
ymy przez jego frekwencj
ę
odpowiednio dla populacji X
i Y.
st
ą
d:
76
,
11
24
,
0
*
49
=
i
94
,
2
06
,
0
*
49
=
( )
2
2
)
(
y
r
j
x
µ
µ
δµ
−
=
∑

Ć
wiczenie 12
43
nast
ę
pnie podstawiaj
ą
c do wzoru
otrzymujemy:
czyli
Zadanie 1.
Na podstawie frekwencji alleli tabeli frekwencji alleli Oblicz dystans genetyczny
istniej
ą
cy pomi
ę
dzy nast
ę
puj
ą
cymi populacjami przy wykorzystaniu modelu wariancji
kwadratów
ś
rednich rozmiarów alleli.
A).
Frekwencja allelu
Rozmiar
allelu (bp.)
Rozmiar
allelu
(r.m.)
populacja X
populacja Z
98
49
0,24
0,23
102
51
0,08
0,10
106
53
0,32
0,36
110
55
0,14
0,14
114
57
0,18
0,16
118
59
0,04
0,01
2
2
))
45
,
9
08
,
7
4
,
11
6
,
17
53
,
0
14
,
7
94
,
2
(
)
36
,
2
26
,
10
7
,
7
96
,
16
08
,
4
76
,
11
((
)
(
+
+
+
+
+
+
−
+
+
+
+
+
=
δµ
( )
2
2
)
(
y
r
j
x
µ
µ
δµ
−
=
∑
12
,
9
2
=
δµ

Ć
wiczenie 12
44
B).
Frekwencja allelu
Rozmiar
allelu (bp.)
Rozmiar
allelu
(r.m.)
populacja Z
populacja Y
98
49
0,23
0,06
102
51
0,10
0,14
106
53
0,36
0,16
110
55
0,14
0,32
114
57
0,16
0,20
118
59
0,01
0
126
63
0
0,12
Zadanie 2.
Umie
ść
w odpowiednich miejscach dendrogramu populacje X, Y i Z. Uzasadnij swoj
ą
decyzj
ę
. Jak mo
ż
na zinterpretowa
ć
uzyskane wyniki?

Ć
wiczenie 12
45
Literatura
Goldstein D.B., Ruiz Linares A., Cavalli-Sforza L.L, Feldman M.W. 1995. An
evaluation of genetic distances for use with microsatellite loci. Genetics, 139:
463-471.

Ć
wiczenie 13
46
Ć
wiczenie 13. Kolokwium.
Na kolokwium obowi
ą
zuj
ą
wiadomo
ś
ci z
ć
wicze
ń
1 – 12.
]

Ć
wiczenie 15
47
Ć
wiczenie 14. Genotyp a
ś
rodowisko. Wpływ zag
ę
szczenia
populacji na mas
ę
ciała muszki owocowej
(Drosophilamelanogaster) - weryfikacja hipotezy przy pomocy testu
t-Studenta – wnioski.
PRZEPROWADZENIE
Ć
WICZENIA
Po 2 tygodniach w ka
ż
dej grupie do
ś
wiadczalnej oddzielnie:
-muchy usypiamy i rozdzielamy według płci,
-liczymy samce i samice,
-wa
ż
ymy oddzielnie samce i samice w ramach grupy do
ś
wiadczalnej,
-obliczmy
ś
rednia mas
ę
w próbie samców i samic dziel
ą
c całkowit
ą
mas
ę
próby
przez liczb
ę
much w próbie.
Je
ż
eli
ś
rednia masa muchy b
ę
dzie mniejsza ni
ż
0,5 mg lub wi
ę
ksza ni
ż
2 mg,
powtórzy
ć
wa
ż
enie.
Zanotowa
ć
uzyskane dane w zeszycie. Wszystkie obliczenia prowadzimy oddzielnie
dla samców i samic, poniewa
ż
ś
rednia masa samców jest o około 20% ni
ż
sza ni
ż
samic.
ZADANIE
Porównaj testem t-Studenta mas
ę
ciała samic z najmniejszego i najwi
ę
kszego
zag
ę
szczenia.
podgrupa
zag
ę
szczenie 2+2
zag
ę
szczenie 6+6
samce
samice
samce
samice
1
2
3

Ć
wiczenie 15
48
4
Warto
ść
statystyki t obliczon
ą
przez nas porównujemy z krytyczna warto
ś
ci
ą
z tabeli
,,poziom istotno
ś
ci dla testu dwustronnego dla poziomu istotno
ś
ci 0,05. Liczba stopni
swobody df=N
1
+N
2
-2, gdzie N
1
i N
2
to liczby powtórze
ń
, odpowiednio dla
zag
ę
szczenia 1 (2+2) i 2 (6+6)
X
1
, X
2
-
ś
rednie arytmetyczne
Sx - bł
ą
d standardowy
Bł
ą
d standardowy obliczamy ze wzoru:
2
2
1
1
N
S
N
S
S
x
+
=
gdzie S
1
i S
2
to wariancje, odpowiednio dla zag
ę
szczenia 1 (2+2) oraz 2 (6+6).
Aby obliczy
ć
Sx musimy mie
ć
najpierw S
1
i S
2
(wariancje). Obliczamy je ze wzoru:
1
/
)
(
2
2
−
−
=
∑
∑
N
N
X
X
S
Gdy obliczymy wariancj
ę
S
1
i S
2
, wstawiamy je do wzoru na bł
ą
d standardowy (N
1
i
N
2
s
ą
liczbami powtórze
ń
w ka
ż
dym zag
ę
szczeniu). Obliczamy ka
ż
d
ą
wariancj
ę
oddzielnie wstawiaj
ą
c dla S
1
odpowiednio X
1
i N
1
a dla S
2
- X
2
oraz N
2
. Gdy obliczymy
Sx, wstawiamy do wzoru na t i obliczamy warto
ść
statystyki t. Znajdujemy w tabeli
warto
ść
krytyczna.:
Liczba stopni swobody df = N
1
+ N
2
-2. Poziom istotno
ś
ci dla testu dwustronnego
α
= 0,05
Nast
ę
pnie mo
ż
emy zweryfikowa
ć
hipotez
ę
zerowa, która brzmi:
H
O
= ,,Brak jest istotnych ró
ż
nic pomi
ę
dzy
ś
rednimi masami ciała osobników
ż
yj
ą
cych w ró
ż
nych zag
ę
szczeniach".
Je
ż
eli obliczona przez nas warto
ść
statystyki t jest ni
ż
sza od warto
ś
ci krytycznej, to:
Nie ma podstaw do odrzucenia hipotezy zerowej.
x
S
X
X
t
2
1
−
=

Ć
wiczenie 15
49
Je
ż
eli obliczona warto
ść
t jest wy
ż
sza od krytycznej to:
Hipotez
ę
zerowa nale
ż
y odrzuci
ć
na rzecz hipotezy alternatywnej, która brzmi:
,,Wyst
ę
puj
ą
istotne ró
ż
nice pomi
ę
dzy
ś
rednimi masami ciała osobników
ż
yj
ą
cych w
ró
ż
nych zag
ę
szczeniach".
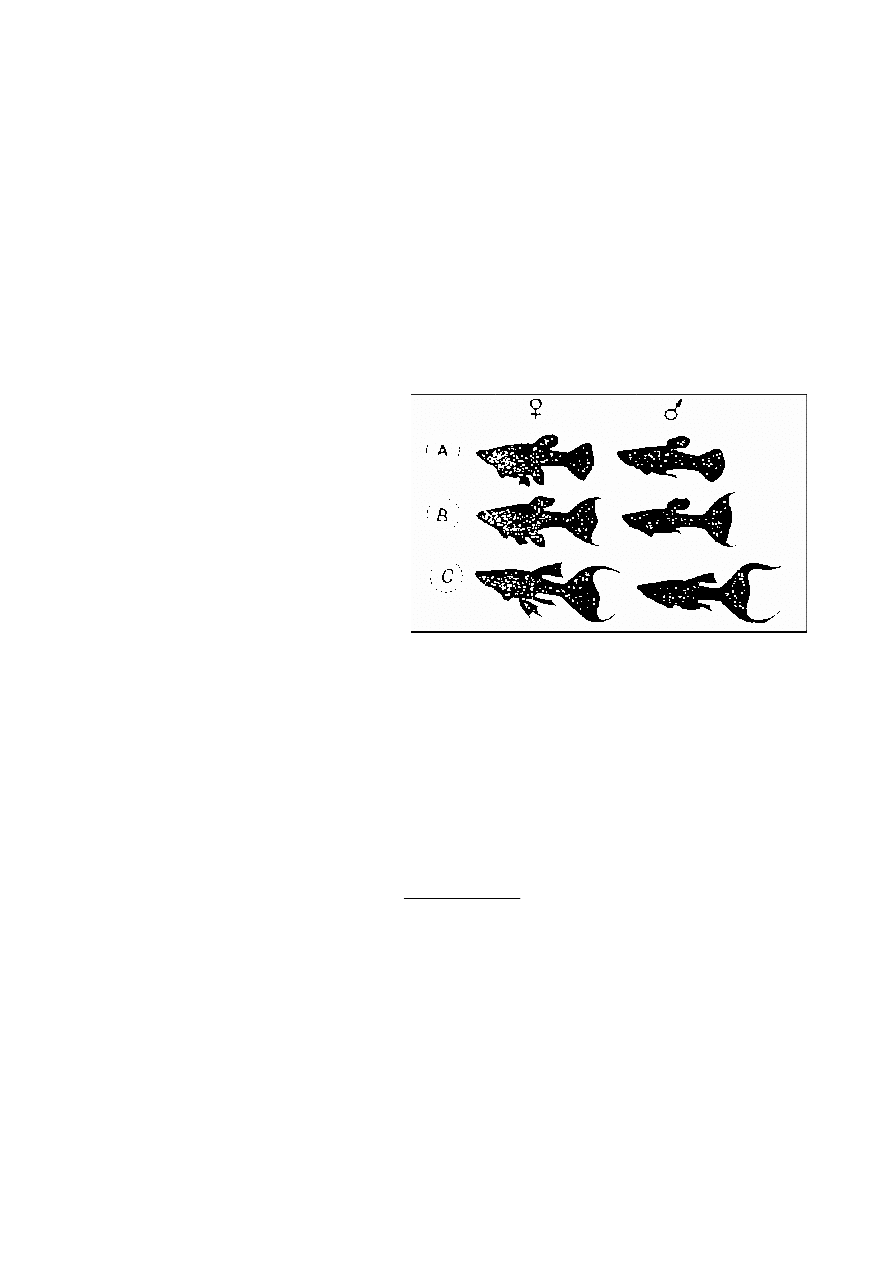
Ć
wiczenie 15
50
Ć
wiczenie 15. Niepełna dominacja i addycja dwu loci genowych.
Prawo Hardy'ego-Weinberga dla dwu loci genowych
Molinezja (Poecilia sphenops) wykazuje polimorfizm genetyczny pod wzgl
ę
dem
ubarwienia ciała oraz kształtu płetw. W locus L odpowiedzialnym za kształt płetw
molinezji znajduj
ą
si
ę
2 allele L i l.
Niepełna dominacja L nad 1 sprawia, ze 3 genotypom odpowiadaj
ą
3 fenotypy
przedstawione na rysunku:
fenotyp genotyp
A ll
B Ll
C LL
Frekwencje poszczególnych alleli (p i q) w populacji obliczamy korzystaj
ą
c z danych
do
ś
wiadczalnych (obserwowane cz
ę
sto
ś
ci fenotypów).
W przypadku cechy kształtu płetw:
N
n
n
p
lL
LL
2
2
+
=
P = f(L); q = r(l)
gdzie f to frekwencja allelu.
gdzie: n
LL
, n
Ll
to liczba osobników o odpowiednim genotypie i odpowiadaj
ą
cym mu
fenotypie, N to liczba badanych osobników.
Frekwencj
ę
allelu recesywnego (q) oblicza si
ę
z zale
ż
no
ś
ci p + q = 1
Równanie Hardy-Weinberga dla pary alleli w pojedynczym locus przyjmuje posta
ć

Ć
wiczenie 15
51
(p+q)2 =1, co po rozwini
ę
ciu daje: p2 + 2pq + q2 = 1
gdzie p = frekwencja allelu A natomiast q = frekwencja allelu a
Trzy wyra
ż
enia z lewej strony równania odpowiadaj
ą
oczekiwanym proporcjom
poszczególnych (3) fenotypów molinezji w badanej populacji (odpowiednio: p
2
homozygot LL, 2pq heterozygot i q
2
homozygot ll). Po pomno
ż
eniu ka
ż
dego z
tych wyra
ż
e
ń
przez N (liczba badanych osobników) otrzymamy odpowiednio
oczekiwane liczby osobników ka
ż
dego fenotypu wynikaj
ą
ce z równania Hardy-
Weinberga, ktore zapisujemy w prawej kolumnie. W lewej kolumnie zapisujemy
rzeczywiste (obserwowane) liczby osobników o okre
ś
lonych fenotypach.
Nast
ę
pnie otrzymane warto
ś
ci z obu kolumn podstawiamy do wzoru i obliczmy
według modelu
χ
2
(chi-kwadrat).
∑
−
=
Exp
Exp
Obs
2
2
)
(
χ
gdzie: Obs to liczba obserwowanych osobników o okre
ś
lonym fenotypie
Exp to liczba oczekiwanych osobników o okre
ś
lonym fenotypie
(w tym przypadku suma Z b
ę
dzie zawierała 3 składniki)
Warto
ść
krytyczna statystyki y1 na poziomie istotno
ś
ci a = 0,05 wynosi w tym
przypadku 3,84
(liczba stopni swobody: K - l - s = 3-1-1 = 1)
P + q= 1 stad p -zmienna niezale
ż
na: p + (1 - p) = 1, albo
q -zmienna niezale
ż
na: q + (1-q) = 1
Je
ż
eli obliczona warto
ść
statystyki przekroczy warto
ść
krytyczn
ą
(3,84) to istniej
ą
podstawy do odrzucenia hipotezy zerowej (ze populacja molinezji znajduje si
ę
w
równowadze Hardy- Weiberga) na rzecz hipotezy alternatywnej. W takim przypadku
nale
ż
y zastanowi
ć
si
ę
nad przyczynami takiej struktury genetycznej populacji. Jakie
czynniki mogły to wywoła
ć
?
Zadanie przykładowe
Za ubarwienie ciała odpowiadaj
ą
dwie pary alleli w dwu loci genowych. Fenotyp
ka
ż
dego osobnika jest sum
ą
oddziaływania alleli zlokalizowanych w locus M i N.
Takie współoddziaływanie dwóch lub wi
ę
cej loci genowych nazywamy addycj
ą
. W
ka
ż
dym z dwu loci (M i N) wyst
ę
puj
ą
u Poecilia sphenops po 2 allele, odpowiednio: M

Ć
wiczenie 15
52
i m oraz N i n. Dominuj
ą
ce allele M i N warunkuj
ą
melanistyczne (czarne) ubarwienie
ryb, natomiast allele recesywne m i n (allele dzikie) warunkuj
ą
srebrnoszare
ubarwienie ciała ryb. Fenotyp ka
ż
dego osobnika zale
ż
y od liczby alleli dominuj
ą
cych
(M i N) w obu loci genowych odpowiedzialnych za barw
ę
ciała (liczba ta mo
ż
e
wynosi
ć
0,1, 2, 3 lub 4). 9 mo
ż
liwych kombinacji genotypów daje w efekcie 5
fenotypów:
mmnn – fenotyp I
Mmnn – fenotyp II
mmNn
MMnn
MmNn – fenotyp III
mmNN
MMNn – fenotyp IV
MmNN
MMNN – fenotyp V
Ubarwienie ryb zmienia si
ę
tak
ż
e wraz z
wiekiem. Im ryby s
ą
starsze tym bardziej ujawnia si
ę
ubarwienie melanistyczne. U
bardzo młodych osobników fenotypy I II nie ró
ż
ni
ą
si
ę
od siebie -ryby s
ą
jednolicie
srebrzystoszare. U dojrzałych ryb w starszym wieku bardzo trudno odró
ż
ni
ć
fenotypy
IV i V - ryby te s
ą
jednolicie czarne. Najlepsze do analizowania zmienno
ś
ci
genetycznej ubarwienia s
ą
osobniki 2-4 centymetrowe. Ryby tej wielko
ś
ci daj
ą
si
ę
podzieli
ć
wyra
ź
nie na 5 ró
ż
nych fenotypów (w zale
ż
no
ś
ci od nat
ęż
enia ubarwienia
melanistycznego).
• Fenotyp I ryby jednolicie srebrzystoszare (niezale
ż
nie od wieku).
Fenotyp II ryby srebrzystoszare z mniej lub bardziej licznymi czarnymi plamami na
ciele (z wiekiem ich przybywa).
• Fenotyp III ryby o ciele czarnym z mniej lub bardziej licznymi rozja
ś
nieniami (z
wiekiem ich ubywa). T
ę
czówka oka i brzuch srebrzyste przez całe
ż
ycie.
• Fenotyp IV ryby prawie całkowicie czarne, prze
ś
wituj
ą
ce rozja
ś
nienia głownie w

Ć
wiczenie 15
53
t
ę
czówce oka i dolnej cz
ęś
ci pokryw skrzelowych (z wiekiem zanikaj
ą
ce i trudno
zauwa
ż
alne).
• Fenotyp V ryby całkowicie czarne (niezale
ż
nie od wieku).
W przypadku opisanej wy
ż
ej addycji 2 loci u molinezji przyjmujemy:
p - frekwencja alleli M i N (ł
ą
cznie)
q - frekwencja alleli m i n (ł
ą
cznie) w "podwójnym" locus MN
W przypadku cechy melanizmu frekwencja alleli M + N (p) wynosi zatem:
N
n
n
n
n
p
II
III
IV
V
25
,
0
5
,
0
75
,
0
+
+
+
=
gdzie n
i
to liczba osobników o fenotypie i w badanej populacji ryb.
N to liczba badanych osobników.
W tej sytuacji równanie Hardy-Weinberga przyjmuje posta
ć
:
[(P + q)
2
]
2
= 1 czyli (P + q)
4
= 1 gdzie: P = f(M + N) (frekwencja ł
ą
czna alleli M i
N)
q = f(m + n)
p + q = 1
po rozwini
ę
ciu otrzymujemy równanie:
p
4
+ 4p
3
q + 6p
2
q
2
+ 4pq
3
+ q
4
= 1
Pi
ęć
wyra
ż
e
ń
z lewej strony równania odpowiada oczekiwanym proporcjom
poszczególnych fenotypów molinezji w badanej populacji. Po pomno
ż
eniu ka
ż
dego z
tych wyra
ż
e
ń
przez N (liczba badanych osobników) otrzymamy odpowiednio
oczekiwane liczby osobników ka
ż
dego fenotypu wynikaj
ą
ce z równania Hardy-
Weinberga, które zapisujemy w prawej kolumnie. Po przeliczeniu ryb znajduj
ą
cych si
ę
w akwariach, w lewej kolumnie zapisujemy rzeczywiste (obserwowane) liczby
osobników o okre
ś
lonych fenotypach. Nast
ę
pnie otrzymane warto
ś
ci z obu kolumn
podstawiamy do wzoru i obliczmy według modelu
χ
2
∑
−
=
Exp
Exp
Obs
2
2
)
(
χ

Tablice
54
gdzie: Obs to liczba obserwowanych osobników o okre
ś
lonym fenotypie
Exp to liczba oczekiwanych osobników o okre
ś
lonym fenotypie (w tym
przypadku suma b
ę
dzie zawierała 5 składników).
Warto
ść
krytyczna statystyki
χ
2
na poziomie istotno
ś
ci a = 0,05 wynosi w tym
przypadku = 7,81 (liczba stopni swobody: K – l - s = 5 - 1 - 1 = 3)
p + q= 1 stad p -zmienna niezale
ż
na: p + (1 - p) = 1,
albo q -zmienna niezale
ż
na: q + (1 - q) = 1
Je
ż
eli obliczona warto
ść
statystyki
χ
2
przekroczy warto
ść
krytyczn
ą
(7,81) to
istniej
ą
podstawy do odrzucenia hipotezy zerowej (ze populacja molinezji znajduje si
ę
w równowadze Hardy-Weiberga) na rzecz hipotezy alternatywnej. W takim przypadku
nale
ż
y zastanowi
ć
si
ę
nad przyczynami takiej struktury genetycznej populacji. Jakie
czynniki mogły to wywoła
ć
?
Tablice
55
Zał
ą
cznik A
Tablica wartości t
Prawdopodobie
ń
stwo
Stopnie swobody
0.5
0.1
0.05
0.02
0.01
0.001
1
1,00
6,31
12,71
31,82
63,66
63,70
2
0,82
2,92
4,30
6,96
9,92
31,60
3
0,77
2,35
3,18
4,54
5,84
12,90
4
0,74
2,13
2,78
3,75
4,60
8,61
5
0,73
2,02
2,57
3,36
4,03
6,86
6
0,72
1,94
2,45
3,14
3,71
5,96
7
0,71
1,90
2,36
3,00
3,50
5,40
8
0,71
1,86
2,31
2,90
3,36
5,04
9
0,70
1,83
2,26
2,82
3,25
4,78
10
0,70
1,81
2,23
2,76
3,17
4,59
11
0,70
1,80
2,20
2,72
3,11
4,44
12
0,70
1,78
2,08
2,68
3,06
4,32
13
0,69
1,77
2,16
2,65
3,01
4,22
14
0,69
1,76
2,14
2,62
2,98
4,14
15
0,69
1,75
2,13
2,60
2,95
4,07
16
0,69
1,75
2,12
2,58
2,92
4,02
17
0,69
1,74
2,11
2,57
2,90
3,96
18
0,69
1,73
2,10
2,55
2,88
3,92
19
0,69
1,73
2,09
2,54
2,86
3,88
20
0,69
1,72
2,09
2,53
2,84
3,85
21
0,69
1,72
2,08
2,52
2,83
3,82
22
0,69
1,72
2,07
2,51
2,82
3,79
23
0,69
1,71
2,07
2,50
2,81
3,77
24
0,69
1,71
2,06
2,49
2,80
3,74
25
0,68
1,71
2,06
2,48
2,79
3,72
26
0,68
1,71
2,06
2,48
2,78
3,71
27
0,68
1,70
2,05
2,47
2,77
3,69
28
0,68
1,70
2,05
2,47
2,76
3,67
29
0,68
1,70
2,04
2,46
2,76
3,66
30
0,68
1,70
2,04
2,46
2,75
3,65
35
0,68
1,69
2,03
2,44
2,72
3,59
40
0,68
1,68
2,02
2,42
2,71
3,55
45
0,68
1,68
2,02
2,41
2,69
3,52
50
0,68
1,68
2,01
2,40
2,68
3,50
60
0,68
1,67
2,00
2,39
2,66
3,46
70
0,68
1,67
2,00
2,38
2,65
3,44
80
0,68
1,66
1,99
2,38
2,64
3,42
90
0,68
1,66
1,99
2,37
2,63
3,40
100
0,68
1,66
1,98
2,36
2,63
3,39
120
0,68
1,66
1,98
2,36
2,62
3,37
150
0,68
1,66
1,98
2,35
2,61
3,36
200
0,68
1,65
1,97
2,35
2,60
3,34
300
0,68
1,65
1,97
2,34
2,59
3,32
400
0,68
1,65
1,97
2,34
2,59
3,32
500
0,67
1,65
1,96
2,33
2,59
3,31
1000
0,67
1,65
1,96
2,33
2,58
3,30
Tablice
56
Zał
ą
cznik B
Tablica wartości chi-kwadrat (χ
2
)
Prawdopodobie
ń
stwo
Stopnie
swobody
0,99
0,95
0,5
0,25
0,1
0,05
0,025
0,01
0,005
1
-
-
0,45
1,32
2,71
3,84
5,02
6,63
7,88
2
0,02
0,10
1,39
2,77
4,61
5,99
7,38
9,21
10,60
3
0,11
0,35
2,37
4,11
6,25
7,81
9,35
11,34
12,84
4
0,30
0,71
3,36
5,39
7,78
9,49
11,14
13,28
14,86
5
0,55
1,15
4,35
6,63
9,24
11,07
12,83
15,09
16,75
6
0,87
1,64
5,35
7,84
10,64
12,59
14,45
16,81
18,55
7
1,24
2,17
6,35
9,04
12,02
14,07
16,01
18,48
20,28
8
1,65
2,73
7,34
10,22
13,36
15,51
17,53
20,09
21,96
9
2,09
3,33
8,34
11,39
14,68
16,92
19,02
21,67
23,59
10
2,56
3,94
9,34
12,55
15,99
18,31
20,48
23,21
25,19
11
3,05
4,57
10,34
13,70
17,28
19,68
21,92
24,72
26,76
12
3,57
5,23
11,34
14,85
18,55
21,03
23,34
26,22
28,30
13
4,11
5,89
12,34
15,98
19,81
22,36
24,74
27,69
29,82
14
4,66
6,57
13,34
17,12
21,06
23,68
26,12
29,14
31,32
15
5,23
7,26
14,34
18,25
22,31
25,00
27,49
30,58
32,80
16
5,81
7,96
15,34
19,37
23,54
26,30
28,85
32,00
34,27
17
6,41
8,67
16,34
20,49
24,77
27,59
30,19
33,41
35,72
18
7,01
9,39
17,34
21,60
25,99
28,87
31,53
34,81
37,16
19
7,63 10,12 18,34
22,72
27,20
30,14
32,85
36,19
38,58
20
8,26 10,85 19,34
23,83
28,41
31,41
34,17
37,57
40,00
21
8,90 11,59 20,34
24,93
29,62
32,67
35,48
38,93
41,40
22
9,54 12,34 21,34
26,04
30,81
33,92
36,78
40,29
42,80
23
10,20 13,09 22,34
27,14
32,01
35,17
38,08
41,64
44,18
24
10,86 13,85 23,34
28,24
33,20
36,42
39,36
42,98
45,56
25
11,52 14,61 24,34
29,34
34,38
37,65
40,65
44,31
46,93
26
12,20 15,38 25,34
30,43
35,56
38,89
41,92
45,64
48,29
27
12,88 16,15 26,34
31,53
36,74
40,11
43,19
46,96
49,64
28
13,56 16,93 27,34
32,62
37,92
41,34
44,46
48,28
50,99
29
14,26 17,71 28,34
33,71
39,09
42,56
45,72
49,59
52,34
30
14,95 18,49 29,34
34,80
40,26
43,77
46,98
50,89
53,67
40
22,16 26,51 39,34
45,62
51,80
55,76
59,34
63,69
66,77
50
29,71 34,76 49,33
56,33
63,17
67,50
71,42
76,15
79,49
60
37,48 43,19 59,33
66,98
74,40
79,08
83,30
88,38
91,95
70
45,44 51,74 69,33
77,58
85,53
90,53
95,02
100,42 104,22
80
53,54 60,39 79,33
88,13
96,58 101,88
106,63
112,33 116,32
90
61,75 69,13 89,33
98,64
107,56 113,14
118,14
124,12 128,30
100
70,06 77,93 99,33 109,14 118,50 124,34
129,56
135,81 140,17
Wyszukiwarka
Podobne podstrony:
wykład 7, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Genetyka, Genetyka ogólna (pokaz slajdó
Genetyka ogólna dla studentów cz 2
psychologia ogólna W5 2013
genetyka sciaga, Ochrona Środowiska, Ochrona Środowiska - różne
Socjologia Ogólna wykłady (2013), dr A Roter
Pedagogika ogolna wyklady 2013 Nieznany
przewodnik genetyka
Genetyka ogólna - pytania na egzamin, Genetyka, DNA, biologia molekularna, techniki
K Pedagogika mi-dzykulturowa, Pedagogika ogólna APS 2013 - 2016, I ROK 2013 - 2014, II semestr, 2) K
16 Test z teoriiiiiii, Pedagogika ogólna APS 2013 - 2016, I ROK 2013 - 2014, I semestr, Teoretyczne
Genetyka ogólna
przewodnik po komunikacji miejskiej 2013
NICIENIE - ROBAKI OBŁE PRZEWOU POKARMOWEGO, STUDIA (Ochrona Środowiska), IV semestr, Biologia sanita
Psychologia Ogólna B( 02 2013
genetyka wykład 1 ! 02 2013
Debata styczeń-luty 2014r.-stacjonarne, Pedagogika ogólna APS 2013 - 2016, I ROK 2013 - 2014, I seme
Tematy do egzaminu z Psychologii Ogólnej, Pedagogika ogólna APS 2013 - 2016, I ROK 2013 - 2014, I se
pytania., Pedagogika ogólna APS 2013 - 2016, I ROK 2013 - 2014, II semestr, 3) Psychologia rozwoju c
więcej podobnych podstron