
42. Przewlekłe niedokrwienie krezki: rozpoznanie i interwencje 791
Miażdżyca często obejmuje tętnice krezki (pień trzewny,
tętnicę krezkową górną i dolną), ale rzadko, dzięki dosko-
nałemu krążeniu obocznemu między trzewnymi łożyska-
mi naczyniowymi, powoduje objawowe niedokrwienie.
Najczęściej pacjenci zgłaszają się z poposiłkowym bólem
brzucha i utratą wagi. Chorzy z zaburzeniami czynnościo-
wymi jelit rzadko zgłaszają istotną utratę wagi.
U pacjentów z podejrzeniem przewlekłego niedokrwie-
nia krezki miażdżyca często obejmuje również inne ob-
szary naczyniowe (to znaczy powoduje chorobę wieńco-
wą, udar, chorobę naczyń nerkowych czy też miażdżycę
kończyn dolnych).
Choroba jednego z naczyń krążenia krezkowego może
spowodować objawowe niedokrwienie, szczególnie po
operacjach w obrębie jamy brzusznej i przerwać krążenie
oboczne.
Badania nieinwazyjne, takie jak ultrasonografia, angio-
grafia tomografii komputerowej i angiografia rezonansu
magnetycznego, to właściwe badania przesiewowe u pa-
cjentów z podejrzeniem przewlekłego niedokrwienia
krezki.
W celu uwidocznienia początku naczyń krezki należy wy-
konać inwazyjną angiografię w projekcji bocznej.
Wyniki ostatnich badań wskazują, że przezskórna implan-
tacja stentów jest leczeniem z wyboru w tej chorobie
pozwalającym osiągnąć porównywalną z leczeniem chi-
rurgicznym skuteczność oraz związanym z niższą zacho-
rowalnością i śmiertelnością. Kliniczne nawroty występu-
ją u 1 na 5 pacjentów, dlatego niezbędna jest uważna
obserwacja tej grupy chorych.
r ozdział
42 Przewlekłe niedokrwienie
krezki: rozpoznanie
i interwencje
Christopher J. White i Stephen R. Ramee
Punkty kluczowe
Chociaż najczęstszym zaburzeniem naczyniowym występu-
jącym w jelitach jest niedokrwienie, kliniczny zespół prze-
wlekłego niedokrwienia krezki (CMI, chronic mesenteric
ischemia) czy też przewlekłego niedokrwienia jelit wystę-
puje wyjątkowo rzadko. Zespół ten może być spowodowany
przez dysplazję włóknisto-mięśniową, chorobę Bürgera oraz
rozwarstwienie aorty, ale to miażdżyca pozostaje zdecydo-
wanie najczęstszą etiologią. Miażdżyca aorty z jednoczesny-
mi zmianami w ujściach naczyń trzewnych jest relatywnie
częstym angiograficznym znaleziskiem.
W badaniu populacyjnym dotyczącym częstości wystę-
powania zwężenia tętnic krezki u 553 zdrowych osób korzy-
stających z Medicare wykonano badanie ultrasonograficzne
jamy brzusznej, szukając zmian w naczyniach krezki.
1
Istot-
ne (> 50% średnicy naczynia) zwężenie naczynia krezki,
najczęściej (> 97%) izolowane zwężenie pnia trzewnego,
stwierdzono u 17,5% całej grupy pacjentów. Nie znaleziono
żadnego związku między wiekiem, rasą, płcią czy wskaźni-
kiem masy ciała a obecnością zwężenia tętnicy krezkowej.
Jedynie u 1,3% pacjentów zajęte było więcej niż jedno na-
czynie krezki.
W innym badaniu dotyczącym naturalnego przebie-
gu choroby opisano grupę 980 bezobjawowych pacjentów
z niedokrwieniem krezki, których monitorowo klinicznie.
2
Jedynie u 3 chorych ostatecznie wystąpiły objawy, a każ-
dy z nich miał zaawansowane zmiany w trzech naczy-
niach krezki. Nadmiernie rozbudowane krążenie trzewne,
w którym między tętnicą krezkową górną (SMA, superior
mesenteric artery) i tętnicą krezkową dolną (IMA, inferior
mesenteric artery) istnieją bardzo liczne połączenia, stanowi
najbardziej prawdopodobne wytłumaczenie rzadkiego wy-
stępowania CMI w praktyce klinicznej.

interwencje w obrębie dużych naczyń
792
obraz kliniczny
Choroba znacznie częściej dotyka kobiety (70%) niż mężczyzn.
Typowo pacjenci zgłąszają się z poposiłkowym uczuciem dys-
komfortu w jamie brzusznej i istotną utratą wagi (ryc. 42-1).
Dyskomfort w jamie brzusznej związany z jedzeniem powo-
duje, że pacjenci unikają posiłków, w związku z czym tracą
na wadze. Jednak pacjenci z gastropatią niedokrwienną mogą
również prezentować nietypowe objawy, takie jak wymioty,
biegunka, zaparcia, niedokrwienne zapalenie jelita grubego
oraz krwawienie z dolnego odcinka przewodu pokarmowego.
U większości osób miażdżyca występuje w innych łożyskach
naczyniowych, chorzy ci mogą mieć w wywiadzie zawał mięś-
nia sercowego, udar lub chromanie.
Pacjenci z atypowymi objawami mogą być bardzo trudni
do zdiagnozowania, ale właściwym podejściem jest podej-
rzewanie CMI u osób z innymi manifestacjami miażdżycy
oraz niewyjaśnioną utratą wagi. Często postawienie diagno-
zy jest opóźnione u pacjentów, którzy badani są w kierunku
nowotworu złośliwego jako prawdopodobnego wytłuma-
czenia dla utraty wagi. U pacjentów z zaburzeniami czyn-
nościowymi jelit rzadko dochodzi do istotnej utraty wagi, co
jest pomocne w odróżnianiu tych osób od chorych z CMI.
W wypadku klasycznych objawów i endoskopii wskazującej
na niedokrwienie jelita często stwierdza się istotne zwęże-
nie jednego lub większej liczby naczyń,
3
chociaż opisywano
również chorobę jednonaczyniową, zazwyczaj SMA, szcze-
gólnie jeśli połączenia obwodowe zostały przerwane w trak-
cie wcześniejszej operacji w obrębie jamy brzusznej.
rozPoznanie
Diagnoza kliniczna CMI stawiana jest na podstawie objawów
i obrazu anatomicznego. Nie ma żadnego laboratoryjnego
badania, które pozwala zidentyfikować CMI. Istnieje kilka
metod wykrywania zwężeń i niedrożności tętnic, do których
należy badanie ultrasonograficzne Doppler duplex oraz nie-
inwazyjna angiografia tomografii komputerowej (CTA, com-
puted tomographic angiography) i angiografia rezonansu ma-
gnetycznego (MRA, magnetic resonance angiography).
Wizualizacja naczyń krezki jest technicznie trudna, nie-
zbędne jest wykonywanie badania przez wykwalifikowane-
go i zaangażowanego operatora. Według danych dokładność
badania duplex w identyfikacji istotnych zwężeń pnia trzew-
nego i SMA sięga 90%.
4, 5
Przy względnie częstym stosowa-
niu obrazowania CTA i MRA w wypadku patologii brzusz-
nych możliwe jest postawienie „anatomicznej” diagnozy bez
wykonywania inwazyjnej angiografii.
6
Inwazyjna angiografia jest przydatna w diagnostyce, do
uwidocznienia ujść naczyń krezki jest potrzebny aortogram
w projekcji bocznej (ryc. 42-2). Sporadycznie widoczne jest
na aortogramie w projekcji przednio-tylnej bardzo powięk-
szone naczynie oboczne łączące gałąź IMA z SMA (łuk Rio-
lana), co wskazuje na zwężenie w proksymalnym odcinku
tętnicy krezki. Jeżeli u pacjentów objawowych stwierdza się
krytyczne (70%) zwężenie, właściwym postępowaniem jest
rewaskularyzacja. Jednak u pacjentów z granicznymi zmia-
nami lub niejasnymi objawami nie ma żadnego badania ob-
ciążeniowego wywołującego reakcję niedokrwienną.
leczenie
Tradycyjnie przeprowadzano chirurgiczną rewaskularyza-
cję, wykonując endarterektomię lub operację pomostowa-
nia. Jak można się jednak spodziewać, częstość występowa-
nia choroby wieńcowej w tej grupie pacjentów jest wysoka,
a śmiertelność okołooperacyjna waha się od 3,5% do 15%
(tab. 42-1).
7–22
Najwyższa częstość występowania powikłań
dotyczy pacjentów powyżej 70. roku życia.
21
Zmiany miażdżycowe w miejscach odejścia tętnic trzew-
nych od aorty są podobne jak w tętnicach nerkowych,
Ból brzucha
Ból poposiłkowy
Utrata wagi
Nudności/wymioty/uczucie pełności
Biegunka/zaparcia
Krew w kale/krwawienie z dolnego
odcinka przewodu pokarmowego
100
78
68
22
22
8
0
25
50
75
100
Procent
rycina 42-1. Początkowe objawy u pacjenta z przewlekłym niedokrwieniem krezki. (Źródło: Silva Ja, White CJ, Collins TJ, et al: Endovascu-
lar therapy for chronic mesenteric ischemia. J am Coll Cardiol 2006;47:944–950).
42. Przewlekłe niedokrwienie krezki: rozpoznanie i interwencje 793
a techniczne rozważania dotyczące przezskórnej wewnątrz-
naczyniowej angioplastyki (PTA, percutaneous transluminal
angioplasty) z implantacją stentu są zbieżne z rozwiązania-
mi przy zabiegach udrożniania tętnic nerkowych (ryc. 42-3).
Podobnie jak w zabiegach udrożniania tętnic nerkowych,
implantacja stentu pozwala uzyskać lepszą odległą drożność
niż sama PTA
23
. Metoda endowaskularna pozwala uniknąć
ogólnego znieczulenia i urazu operacyjnego, ponadto uważa
się, że obniża wczesną (zabiegową) śmiertelność i zachoro-
walność (tab. 42-2).
3, 17, 23–34
Ze względu na relatywnie rzadkie występowanie CMI nie
ma żadnych randomizowanych badań porównujących lecze-
nie chirurgiczne z terapią endowaskularną w tej chorobie.
W czasie 20-letnich (1977–1997) doświadczeń Cleveland
Clinic wśród 85 pacjentów z CMI leczonych chirurgicznie
śmiertelność okołooperacyjna wynosiła 8%, a jedna trzecia
pacjentów miała poważne powikłania zabiegu operacyjne-
go
16
. Zaawansowany wiek, nadciśnienie tętnicze, choroba
wieńcowa oraz zmiany w innych łożyskach naczyniowych
korelowały z powikłaniami chirurgicznymi. W odległej ob-
serwacji 23% chorych (n = 18) miało obiektywne cechy
restenozy, 21% (n = 16) – nawrót objawów CMI, a u 12%
(n = 9) wykonano ponowną rewaskularyzację naczynia do-
celowego. Co ciekawe, zastosowanie żyły jako pomostu na-
T
ętnica wątrobowa
wspólna
A
T
ętnica nerkowa
prawa
T
ętnica
śledzionowa
SMA
T
ętnica
nerkowa
lewa
B
Projekcja boczna
Pie
ń trzewny
T
ętnica krezkowa górna
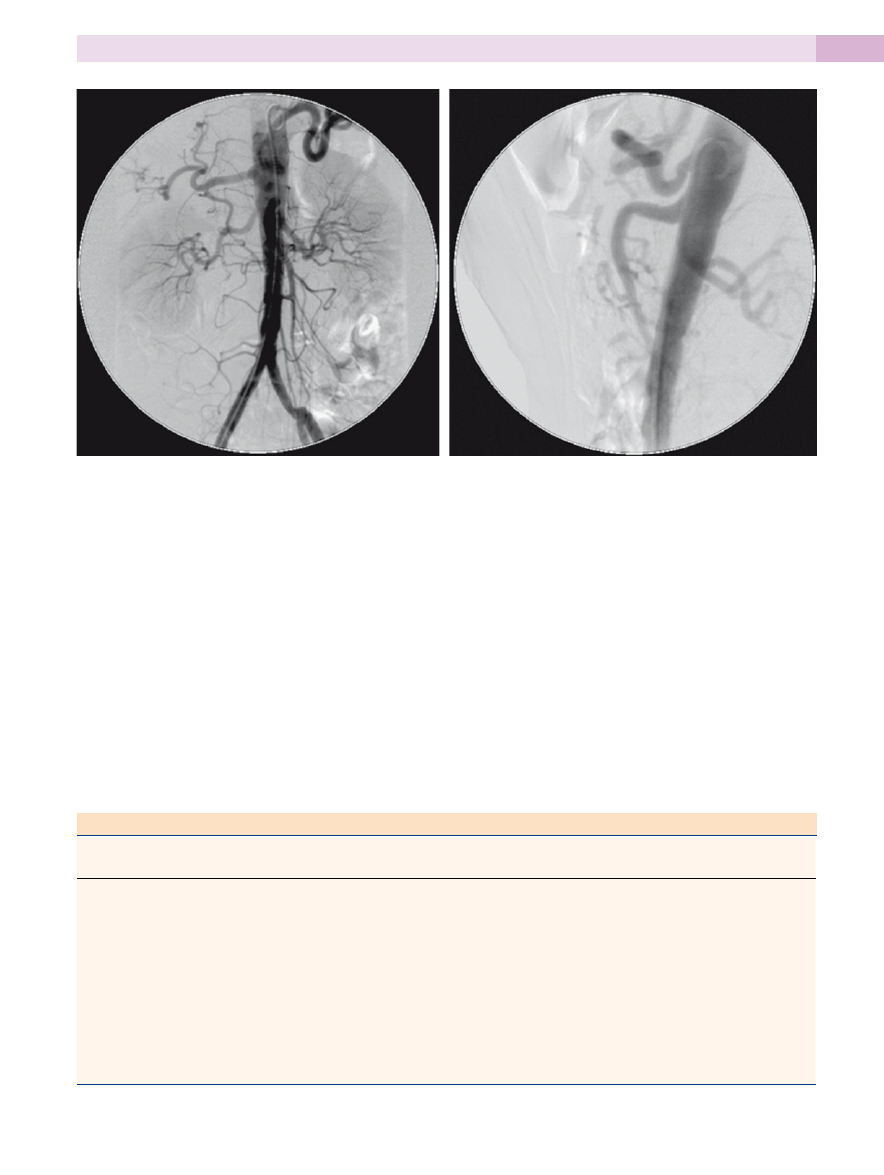
rycina 42-2. a, aortogram brzuszny w projekcji przednio-tylnej z uwidocznieniem gałęzi pnia trzewnego (tętnicy wątrobowej wspólnej
i śledzionowej), tętnic nerkowych i tętnicy krezkowej górnej (SMa). b, aortogram brzuszny w projekcji bocznej z uwidocznieniem począt-
ku pnia trzewnego i SMa.
autor (nr ref.)
rok
N
liczba
naczyń
Skuteczność
kliniczna (%)
30-dniowa śmier-
telność (%)
ustąpienie
objawów (%)
restenoza (%)
Kien (7)
1990
60
69
100
3,5
Na
25
Cormier (8)
1991
32
90
100
9
Na
9
Cunningham (9)
1991
74
194
100
12
86
Na
Mcafee (10)
1992
58
119
100
10
90
10
Caideron (11)
1992
20
36
100
0
100
0
Christensen (12)
1994
90
109
100
13
Na
Na
Gentile (13)
1994
26
29
100
10
89
11
Jonhson (14)
1995
21
43
100
0
Na
16
Moawad (15)
1997
24
38
100
4
78
23
Mateo (16)
1999
85
130
100
8
87
24
Sivamurthy (17)
2006
41
59
100
15
68
17
NA – brak zastosowania.
tabela 42-1. Wyniki chirurgicznego leczenia przewlekłego niedokrwienia krezki
interwencje w obrębie dużych naczyń
794
czyniowego wiązało się z gorszym wynikiem i drożnością
niż wówczas, gdy używano protezy dakronowej. Odsetek
5-letniego przeżycia wynosił 64% (95% przedział pewności
CI: 53–75%), a odsetek 3-letniego przeżycia wolnego od
zdarzeń wynosił 81% (95% CI: 72–90%).
W ramach obserwacji wykonano retrospektywne po-
równanie 3-letnich wyników doświadczeń Cleveland Cli-
nic z grupą leczoną przezskórnie z wynikami uzyskanymi
przez Mateo i wsp.
16
w grupie leczonej chirurgicznie; nie
udało się wykazać przewagi terapii endowaskularnej.
29
Okołooperacyjna śmiertelność na poziomie 8% nie różniła
się od 11% (3/28) odsetka śmiertelności w grupie podda-
nej angioplastyce i stentowaniu. U 2 zmarłych pacjentów
poddanych angioplastyce z implantacją stentu doszło do
zgorzeli jelita. Nie zaobserwowano różnicy w długości
hospitalizacji, co wskazuje, że pacjenci z grupy poddanej
stentowaniu musieli przechodzić ciężkie choroby towarzy-
szące, przez które obie grupy pacjentów być może nie były
porównywalne. W trakcie obserwacji odsetek restenozy
u pacjentów leczonych samą angioplastyką balonową wy-
nosił 33%, ale spadł do 11,5% u pacjentów po implantacji
stentu. Odległa drożność tętnicy i przeżycie w grupie le-
czonej chirurgicznie oraz w grupie poddanej terapii przez-
skórnej nie różniły się istotnie.
W ostatnio opublikowanej retrospektywnej analizie do-
tyczącej 14 pacjentów z CMI poddanych przez chirurgów
naczyniowych przezskórnej implantacji stentów wykaza-
no doskonały odsetek skuteczności zabiegowej, bez żadnej
okołooperacyjnej śmiertelności i poważnych zachorowań,
choć 53% osób wymagało ponownej interwencji w ciągu
13 miesięcy. Mimo wysokiego odsetka nawrotów chirurdzy
doszli do wniosku, że pacjentom z poważnymi niedoborami
żywieniowymi oraz pacjentom wysokiego ryzyka operacyj-
nego należy proponować leczenie przezskórne jako począt-
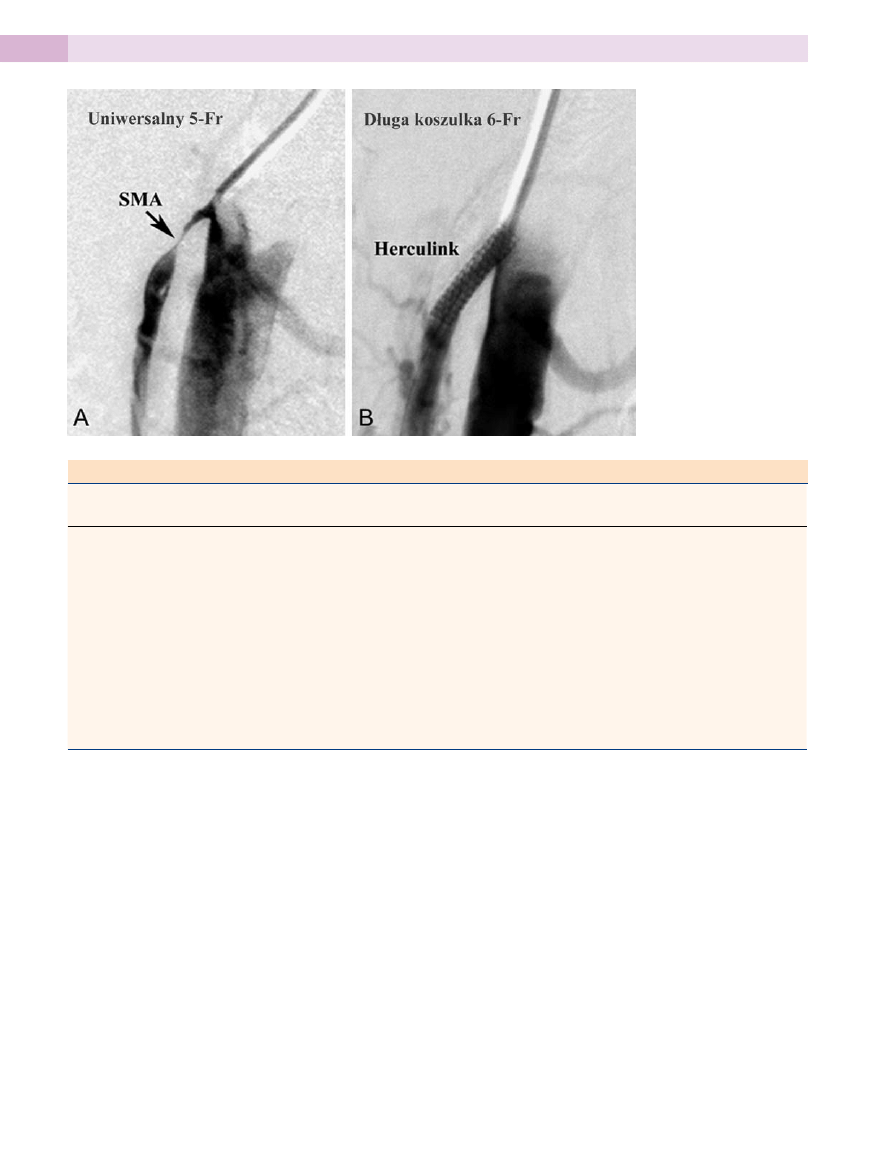
rycina 42-3. a, Wyjściowy
angiogram przedstawiający
ciasne zwężenie w prok-
symalnym odcinku tętnicy
krezkowej górnej (SMa)
uzyskany z dostępu przez
tętnicę ramienną. b, Końcowy
angiogram wykonany po
implantacji rozprężanego na
balonie stentu (Herculink,
Guidant Corporation).
autor (nr ref.)
rok
N
liczba
naczyń
Skuteczność
kliniczna (%)
30-dniowa śmier-
telność (%)
ustąpienie
objawów (%)
restenoza (%)
Matsumoto (3)
1995
19
20
79
0
52
Na
Hallisey (24)
1995
16
25
84
6
75
25
allen (25)
1996
19
24
95
5
79
Na
Maspes (26)
1997
23
41
90
0
75
12
Nyman (27)
1998
5
6
100
0
80
60
Sheeran (28)
1999
12
13
92
8
75
16
Kasirajan (29)
2001
28
32
100
11
66
27
aburahma (30)
2003
22
24
95
0
67
30
Sharafuddin (31)
2003
25
26
96
4
85
8
Landis (23)
2005
29
33
97
6,9
90
16,3
Sivamurthy (17)
2006
21
29
95,3
16
27
32
Silva (32)
2006
59
79
96
1,7
83
29
NA – brak zastosowania.
tabela 42-2. Wyniki leczenia przezskórnego w przewlekłym niedokrwieniu krezki
42. Przewlekłe niedokrwienie krezki: rozpoznanie i interwencje 795
kową metodę leczenia, a dopiero później, jeżeli konieczne
jest dalsze leczenie, należy rozważyć leczenie chirurgiczne.
Autorzy opublikowali największą pojedynczą serię 59
przypadków pacjentów z CMI z 79 leczonymi przezskór-
nie naczyniami w Ochsner Clinic.
32
Odsetek skuteczności
technicznej wynosił 96%, a u 88% chorych doszło do ustą-
pienia objawów. Odnotowano jeden okołooperacyjny zgon
(1,7%) i dwa powikłania w miejscu dostępu naczyniowego.
W trakcie obserwacji trwającej średnio 38 ± 15 miesięcy
17% pacjentów miało nawrót objawów, ale u żadnego z nich
nie doszło do ostrego niedokrwienia krezki. Wszystkich
pacjentów z nawrotem dolegliwości poddano ponownemu
leczeniu, które było skuteczne i pozbawione powikłań. Od-
setek restenozy w stencie po 14 ± 5 miesiącach uzyska-
ny dzięki zobrazowaniu 90% naczyń w CTA, inwazyjnej
angiografii i ultrasonografii Doppler duplex wynosił 29%
(zob. tab. 42-2). Odsetek ponownej rewaskularyzacji naczy-
nia docelowego wynosił 17%. Odsetki 5-letniego przeżycia
wolnego od zgonu, nawrotu objawów lub obydwu wynosiły
odpowiednio 72%, 79% i 57%.
wnioSki
Ze względu na rzadkie występowanie CMI trudno prze-
prowadzić randomizowane kontrolowane badania kliniczne
porównujące wyniki leczenia. W seriach przypadków wyka-
zano, że leczenie przezskórne z implantacją stentu związane
jest z najniższą zachorowalnością i w przybliżeniu jednako-
wymi odległymi wynikami jak leczenie chirurgiczne. We-
dług aktualnych zaleceń pacjenci, którzy są kandydatami
do operacji chirurgicznej bądź leczenia przezskórnego, po-
czątkowo powinni zostać poddani przezskórnemu leczeniu
z implantacją stentu.
Piśmiennictwo
1. Hansen KJ, Wilson DB, Craven TE, et al: Mesenteric artery disease in
the elderly. J Vasc Surg 2004;40:45-52.
2. Thomas JH, Blake K, Pierce GE, et al: The clinical course of asymp-
tomatic mesenteric arterial stenosis. J Vasc Surg 1998;27: 840-844.
3. Matsumoto AH, Tegtmeyer CJ, Fitzcharles EK, et al: Percutaneous
transluminal angioplasty of visceral arterial stenoses: Results and long-
term clinical follow-up. J Vasc Interv Radiol 1995;6:165-174.
4. Bowersox JC, Zwolak RM, Walsh DB, et al: Duplex ultrasonography
in the diagnosis of celiac and mesenteric artery occlusive disease.
J Vasc Surg 1991;14:780-786; discussion 786-788.
5. Zwolak RM, Fillinger MF, Walsh DB, et al: Mesenteric and celiac
duplex scanning: A validation study. J Vasc Surg 1998;27:1078-1087;
discussion 1088.
6. Chow LC, Chan FP, Li KC: A comprehensive approach to MR imaging
of mesenteric ischemia. Abdom Imaging 2002;27: 507-516.
7. Kieny R, Batellier J, Kretz JG: Aortic reimplantation of the superior
mesenteric artery for atherosclerotic lesions of the visceral arteries:
sixty cases. Ann Vasc Surg 1990;4:122-125.
8. Cormier JM, Fichelle JM, Vennin J, et al: Atherosclerotic occlusive
disease of the superior mesenteric artery: Late results of reconstructive
surgery. Ann Vasc Surg 1991;5:510-518.
9. Cunningham CG, Reilly LM, Rapp JH, et al: Chronic visceral isch-
emia: Three decades of progress. Ann Surg 1991;214:276-287; discus-
sion 287-288.
10. McAfee MK, Cherry KJ Jr, Naessens JM, et al: Influence of com-
plete revascularization on chronic mesenteric ischemia. Am J Surg
1992;164:220-224.
11. Calderon M, Reul GJ, Gregoric ID, et al: Long-term results of the
surgical management of symptomatic chronic intestinal ischemia.
J Cardiovasc Surg (Torino) 1992;33:723-728.
12. Christensen MG, Lorentzen JE, Schroeder TV: Revascularisation of
atherosclerotic mesenteric arteries: Experience in 90 consecutive pa-
tients. Eur J Vasc Surg 1994;8:297-302.
13. Gentile AT, Moneta GL, Taylor LM Jr, et al: Isolated bypass to the supe-
rior mesenteric artery for intestinal ischemia. Arch Surg 1994;129:926-
931; discussion 931-932.
14. Johnston KW, Lindsay TF, Walker PM, Kalman PG: Mesenteric arterial
bypass grafts: Early and late results and suggested surgical approach
for chronic and acute mesenteric ischemia. Surgery 1995;118:1-7.
15. Moawad J, McKinsey JF, Wyble CW, et al: Current results of surgical
therapy for chronic mesenteric ischemia. Arch Surg 1997;132:613-618;
discussion 618-619.
16. Mateo RB, O’Hara PJ, Hertzer NR, et al: Elective surgical treatment of
symptomatic chronic mesenteric occlusive disease: Early results and
late outcomes. J Vasc Surg 1999;29:821-831; discussion 832.
17. Sivamurthy N, Rhodes JM, Lee D, et al: Endovascular versus open
mesenteric revascularization: Immediate benefits do not equate with
short-term functional outcomes. J Am Coll Surg 2006;202:859-867.
18. Foley MI, Moneta GL, Abou-Zamzam AM Jr, et al: Revascularization
of the superior mesenteric artery alone for treatment of intestinal
ischemia. J Vasc Surg 2000;32:37-47.
19. Jimenez JG, Huber TS, Ozaki CK, et al: Durability of antegrade syn-
thetic aortomesenteric bypass for chronic mesenteric ischemia. J Vasc
Surg 2002;35:1078-1084.
20. Kihara TK, Blebea J, Anderson KM, et al: Risk factors and outcomes
following revascularization for chronic mesenteric ischemia. Ann Vasc
Surg 1999;13:37-44.
21. Park WM, Cherry KJ Jr, Chua HK, et al: Current results of open
revascularization for chronic mesenteric ischemia: A standard for
comparison. J Vasc Surg 2002;35:853-859.
22. Leke MA, Hood DB, Rowe VL, et al: Technical consideration in the
management of chronic mesenteric ischemia. Am Surg 2002;68:1088-
1092.
23. Landis MS, Rajan DK, Simons ME, et al: Percutaneous management
of chronic mesenteric ischemia: Outcomes after intervention. J Vasc
Interv Radiol 2005;16:1319-1325.
24. Hallisey MJ, Deschaine J, Illescas FF, et al: Angioplasty for the treat-
ment of visceral ischemia. J Vasc Interv Radiol 1995;6: 785-791.
25. Allen RC, Martin GH, Rees CR, et al: Mesenteric angioplasty in the
treatment of chronic intestinal ischemia. J Vasc Surg 1996;24:415-421;
discussion 421-423.
26. Maspes F, Mazzetti di Pietralata G, Gandini R, et al: Percutaneous
transluminal angioplasty in the treatment of chronic mesenteric isch-
emia: Results and 3 years of follow-up in 23 patients. Abdom Imaging
1998;23:358-363.
27. Nyman U, Ivancev K, Lindh M, Uher P: Endovascular treatment of
chronic mesenteric ischemia: Report of five cases. Cardiovasc Inter-
vent Radiol 1998;21:305-313.
28. Sheeran SR, Murphy TP, Khwaja A, et al: Stent placement for treat-
ment of mesenteric artery stenoses or occlusions. J Vasc Interv Radiol
1999;10:861-867.
29. Kasirajan K, O’Hara PJ, Gray BH, et al: Chronic mesenteric ischemia:
Open surgery versus percutaneous angioplasty and stenting. J Vasc
Surg 2001;33:63-71.
30. AbuRahma AF, Stone PA, Bates MC, Welch CA: Angioplasty/stent-
ing of the superior mesenteric artery and celiac trunk: Early and late
outcomes. J Endovasc Ther 2003;10: 1046-1053.
31. Sharafuddin MJ, Olson CH, Sun S, et al: Endovascular treatment of
celiac and mesenteric arteries stenoses: Applications and results. J Vasc
Surg 2003;38:692-698.
32. Silva JA, White CJ, Collins TJ, et al: Endovascular therapy for chronic
mesenteric ischemia. J Am Coll Cardiol 2006;47: 944-950.
33. Cognet F, Ben Salem D, Dranssart M, et al: Chronic mesenteric
ischemia: Imaging and percutaneous treatment. Radiographics
2002;22:863-879; discussion 879-880.
34. Matsumoto AH, Angle JF, Spinosa DJ, et al: Percutaneous translumi-
nal angioplasty and stenting in the treatment of chronic mesenteric
ischemia: Results and longterm followup. J Am Coll Surg 2002;194
(1 Suppl):S22-S31.
Wyszukiwarka
Podobne podstrony:
Ostre niedokrwienie krezki w TK, MEDYCYNA, RATOWNICTWO MEDYCZNE, BTLS+chirurgia
PRZEWLEKLE NIEDOKRWIENIE MOZGU
Dieta w przewleklym niedokwasnym niezycie zoladka
8 Przewlekłe niedokrwienie kk
Percepcja bólu u chorych z przewlekłym niedokrwieniem kończyn dolnych
Przewlekłe niedokrwienie kończyn dolnych 4
Chirurgia naczyniowa W2 16 12 2014 Przewlekłe niedokrwienie kończyn dolnych
Przewlekłe niedokrwienie kończyn dolnych
przewlekle niedokrwienie k d kurs II 16 02 2009
PRZEWLEKŁE NIEDOKRWIENIE KOŃCZYN DOLNYCH 2
Ostre niedokrwienie krezki w TK, MEDYCYNA, RATOWNICTWO MEDYCZNE, BTLS+chirurgia
więcej podobnych podstron