
Pobieranie i przygotowanie materiałów od chorych do badań immunofluorescencyjnych w kierunku zakażeń
wirusami oddechowymi
•
Celem badania jest wykazanie antygenów wirusów oddechowych w komórkach nabłonka dróg
oddechowych. Materiałem do badań jest pobrany dość energicznie wymaz z tylnej ściany gardła,
lub odessana wydzielina z dróg oddechowych. Wymaz z gardła powinien być pobrany jałowym
wacikiem i umieszczony w około 0,5-1 ml soli fizjologicznej. Wacik powinien być wykonany z czystej
waty, wszelkie komercyjne waciki zawierające węgiel aktywowany lub podłoża transportowe nie
nadają się do tego celu. Umieszczony w soli fizjologicznej wacik powinien być jak najszybciej
dostarczony do laboratorium.
•
W przypadku, gdy materiał nie może być dostarczony tego samego dnia do laboratorium (np. musi
być przesłany z innego miasta) najlepiej przesyłać go w postaci utrwalonych preparatów. W tym celu
pobrane od pacjenta komórki nabłonka tylnej ściany gardła należy zawiesić w niewielkiej ilości (0,5-
1,0 ml) soli fizjologicznej i umieścić w postaci kropli o średnicy 4-5 mm na szkiełku podstawowym.
Użyte do wykonania preparatu szkiełko powinno być dobrej jakości - nie grubsze niż 0,4 mm - w
przeciwnym razie występują znaczne trudności podczas oglądania w mikroskopie fluorescencyjnym.
Do badania w kierunku każdego wirusa konieczna jest jedyna kropla zawiesiny komórek. Na
pojedynczym szkiełku podstawowym można umieścić 3-4 krople. Tak przygotowane preparaty
należy pozostawić w temperaturze pokojowej do całkowitego wyschnięcia. Po wyschnięciu
preparaty należy utrwalić przez zanurzenie ich na 15 minut w acetonie. Utrwalone preparaty mogą
być dostarczone do laboratorium w ciągu kilku dni po pobraniu.
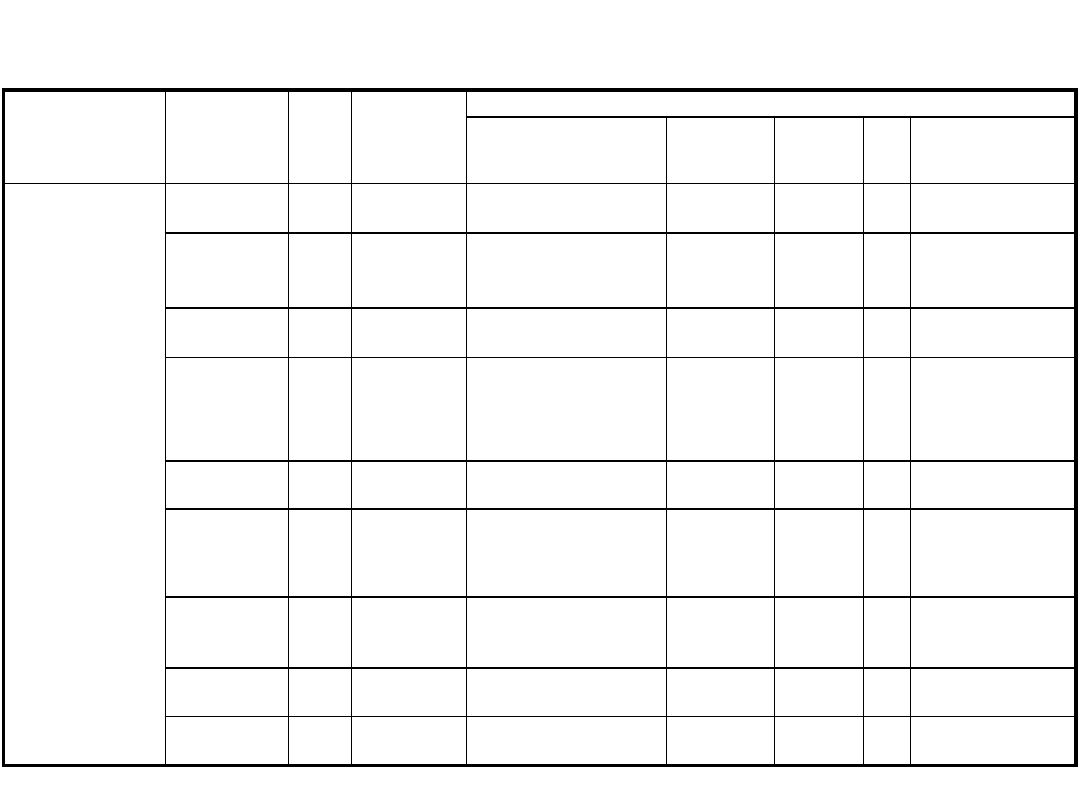
Materiały do diagnostyki zakażeń wirusowych
Zespół objawów
chorobowych
Wirus
wywołujący
Sezono
-wość
Badanie w
kierunku
obecności
przeciwciał
Materiały do badań bezpośrednich wirusologicznych i izolacji wirusa
krtań gardło jama
nosowo-gardłowa
Kał
Płyn
mózgowo-
rdzeniowy
Mocz
Inne
I Objawy zakażenia
ze strony dróg
oddechowych
Adenowirusy cały
rok
tak (pary
surowic)
wymaz z gardła
+ + + +
Wirus grypy A
i B
zima tak (pary
surowic)
wymaz z gardła
+ + + + też plwocina
i BAL
Wirus
paragrypy
cały
rok
nie
wymaz z gardła
+ + + + też BAL
RSV
zima tak
wymaz z jamy nosowo-
gardłowej
+ + + + oraz
popłuczyny i aspiraty z
jamy nosowo-gardłowej
Rinowirusy
cały
rok
nie
nos + + +
Wirus
nagminnego
zaplenia
przyusznic
cały
rok
tak (+ + +)
wymaz z gardła
z przewodu Stensena
+ +
CMV
cały
rok
tak
wymaz z gardła,
plwocina BAL
+ +
krew
heparynizowana
(5 ml)
Enterowirus
jesień,
wiosna nie
wymaz z gardła
HSV
cały
rok
tak
wymaz z gardła
i plwocina
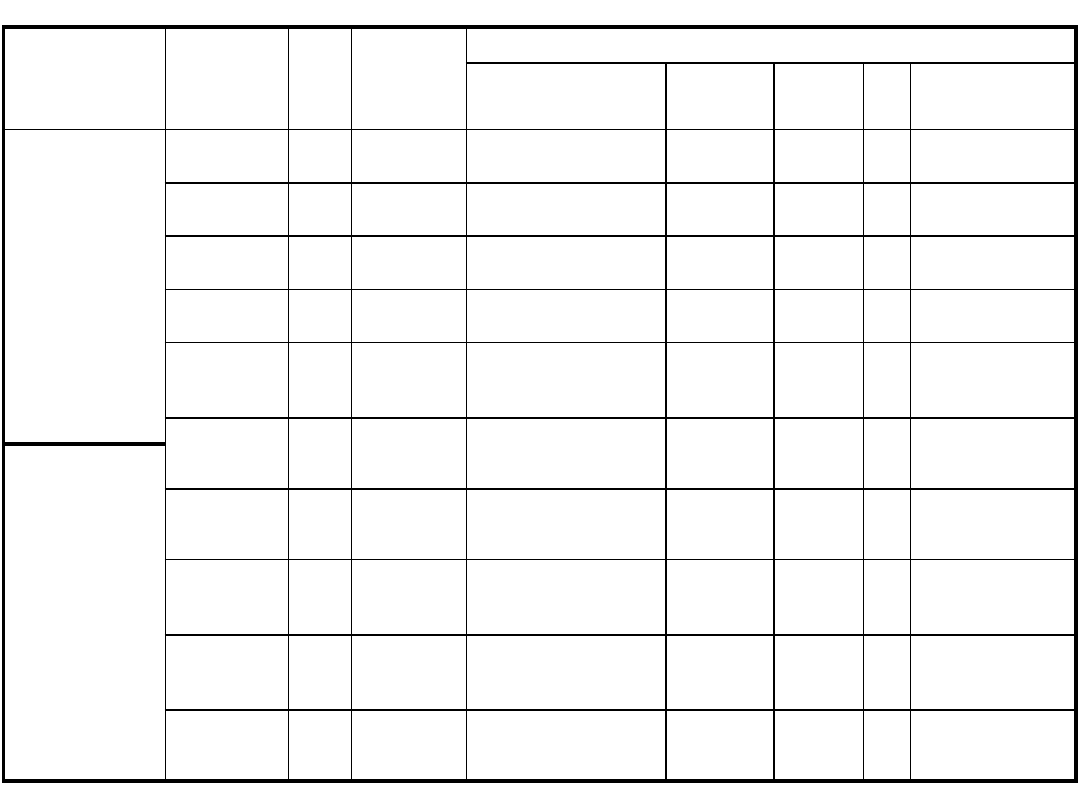
Zespół objawów
chorobowych
Wirus
wywołujący
Sezono
-wość
Badanie w
kierunku
obecności
przeciwciał
Materiały do badań bezpośrednich wirusologicznych i izolacji wirusa
Krtań gardło jama
nosowo-gardłowa
Kał
Płyn
mózgowo-
rdzeniowy
Mocz
Inne
II. Zakażenia
przebiegające z
wysypką:
1.plamisto-
grudkową
Adenowirus
cały
rok
tak
wymaz
z gardła
Wirus różyczki cały
rok
tak + + +
+ +
Wirus odry
cały
rok
tak + + +
wymaz
z gardła + +
+ +
Parwowirus
B19
cały
rok
tak + + +
płyn owodniowy
(PCR)
Enterowirus
jesień,
lato
nie
wymaz
z gardła
+ + +
wymaz
z odbytu, kał
+ +
Wirus
paragrypy
cały
rok
nie
wymaz
z gardła
2.pęcherzykową
RSV
zima
tak
aspiraty, popłuczyny,
wymaz
z nosogardzieli
HSV
cały
rok
tak
płyn
z pęcherzyków
+ + + (IF)
VZV
cały
rok
tak
płyn
z pęcherzyków
+ + + (IF)
Enterowirusy
lato,
jesień
nie
+ +
+ + +
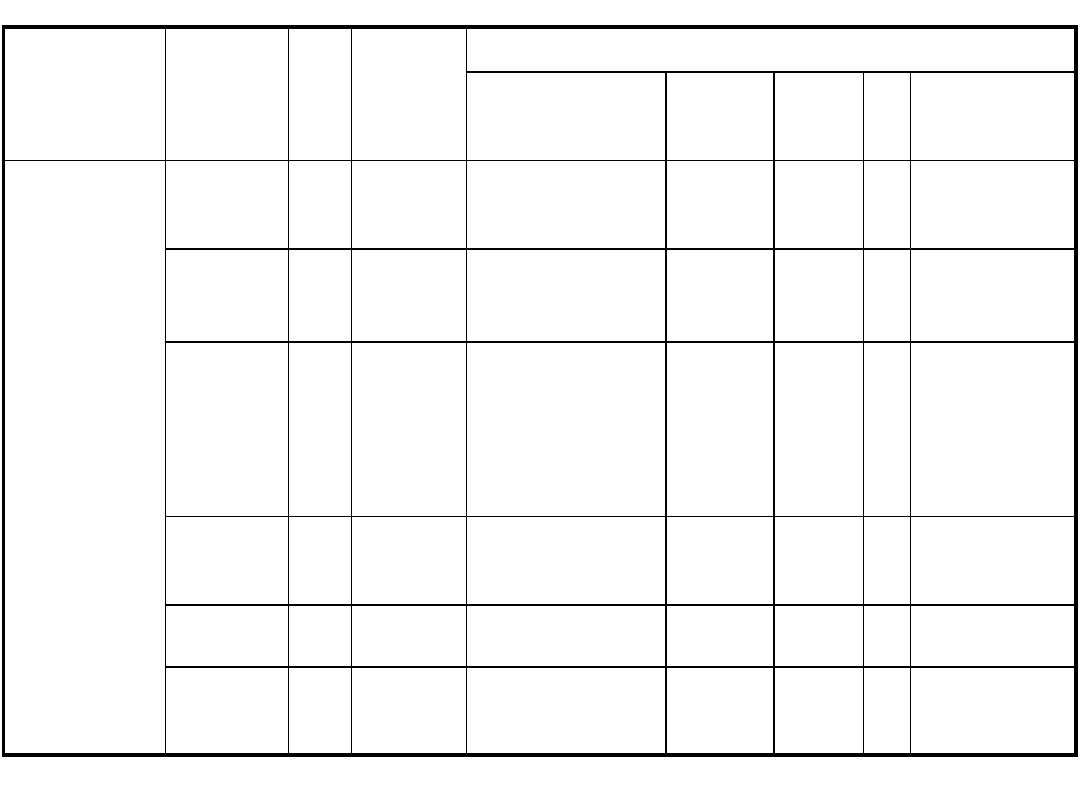
Zespół objawów
chorobowych
Wirus
wywołujący
Sezono
-wość
Badanie
w kierunku
obecności
przeciwciał
Materiały do badań bezpośrednich wirusologicznych i izolacji wirusa
Krtań gardło jama
nosowo-gardłowa
Kał
Płyn
mózgowo-
rdzeniowy
Mocz
Inne
III. Zakażenia
przebiegające z
objawami ze strony
ośrodkowego
układu nerwowego
1.zapalenie opon
mózgowo-
rdzeniowych
i mózgu
2.porażenia
3.poliomyelitis
HSV
cały
rok
tak
wymaz
z gardła
+ + + +
płyn mózgowo-
rdzeniowy –
wykrywanie
przeciwciał
Arbowirusy
lato,
jesień
tak
płyn mózgowo-
rdzeniowy –
wykrywanie
przeciwciał
Enterowirusy
(Polio 1, 2, 3)
(Coxsackie A
1, 2, 4, 7, 9,
Coxsackie B 2-
5) (ECHO 2, 4,
6, 9,11, 30)
Enterowirus 71
lato,
jesień
nie
wymaz
z gardła
+ + +
kał, wymaz
z odbytu +
+
+ + + +
Wirus
nagminnego
zapalenia
przyusznic
cały
rok
tak
wymaz z gardła + +
(przewód Stensena)
+ +
+ +
Polyomawirus
(JC)
cały
rok
nie
biopsja mózgu (ME)
Wirus odry
cały
rok
tak
płyn mózgowo-
rdzeniowy –
wykrywanie
przeciwciał
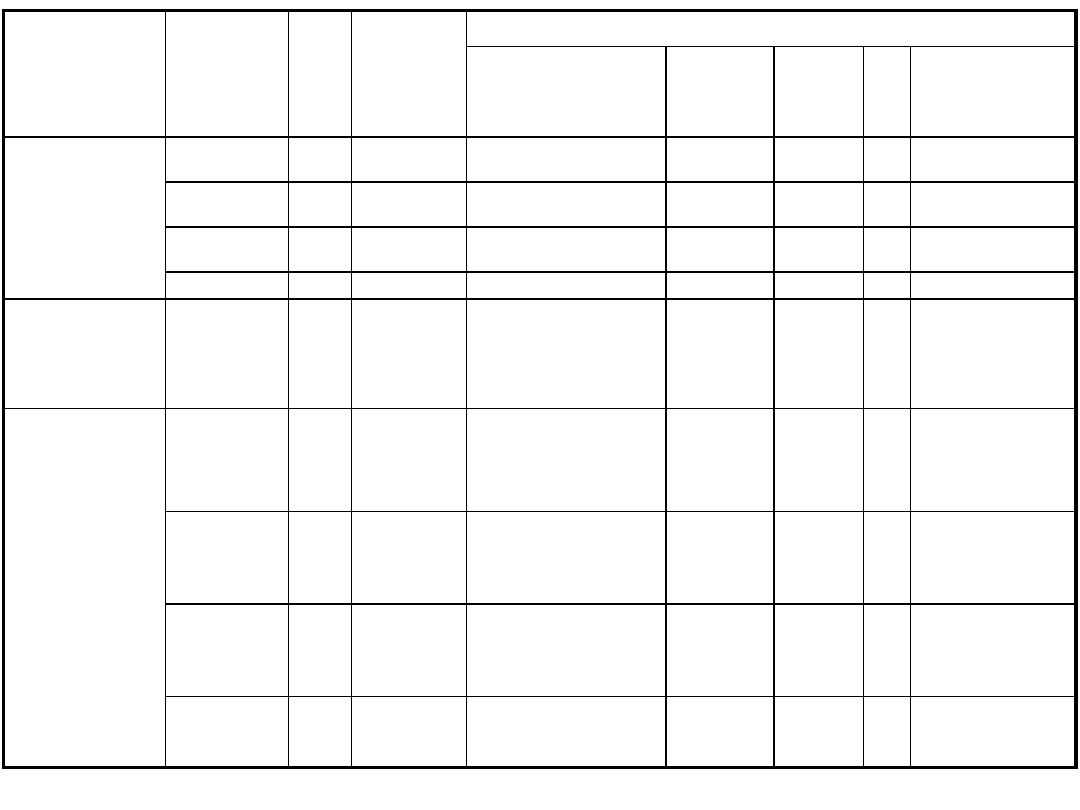
Zespół objawów
chorobowych
Wirus
wywołujący
Sezono
-wość
Badanie
w kierunku
obecności
przeciwciał
Materiały do badań bezpośrednich wirusologicznych i izolacji wirusa
Krtań gardło jama
nosowo-gardłowa
Kał
Płyn
mózgowo-
rdzeniowy
Mocz
Inne
IV. Zakażenia
przebiegające z
objawami ze strony
układu
pokarmowego
Rotawirusy
zima,
wiosna
+ + + +
EIA, lateks
Adenowirusy
40,41
cały
rok
+ + + +
EIA, lateks
Astrowirusy
cały
rok
EIA
Wirus Norwalk wiosna
ME
V. Zakażenia
przebiegające z
objawami ze strony
układu sercowo-
naczyniowego
Coxsackie B
lato,
jesień
wymaz
z gardła
+ + +
Płyn z worka
osierdziowego + +
+ +
VI. Zapalenia
spojówki i/lub
rogówki
Adenowirusy cały
rok
tak
Zeskrobiny ze zmian
spojówkowych i/lub
rogówkowych + +
+ + (hodowla i IF)
HSV
cały
rok
tak (tylko
w przypadku
pierwotnego
zakażenia)
Zeskrobiny ze zmian
spojówkowych i/lub
rogówkowych + +
+ + (hodowla i IF)
VZV
cały
rok
tak (tylko
w przypadku
pierwotnego
zakażenia)
Zeskrobiny ze zmian
spojówkowych i/lub
rogówkowych + +
+ + (hodowla i IF)
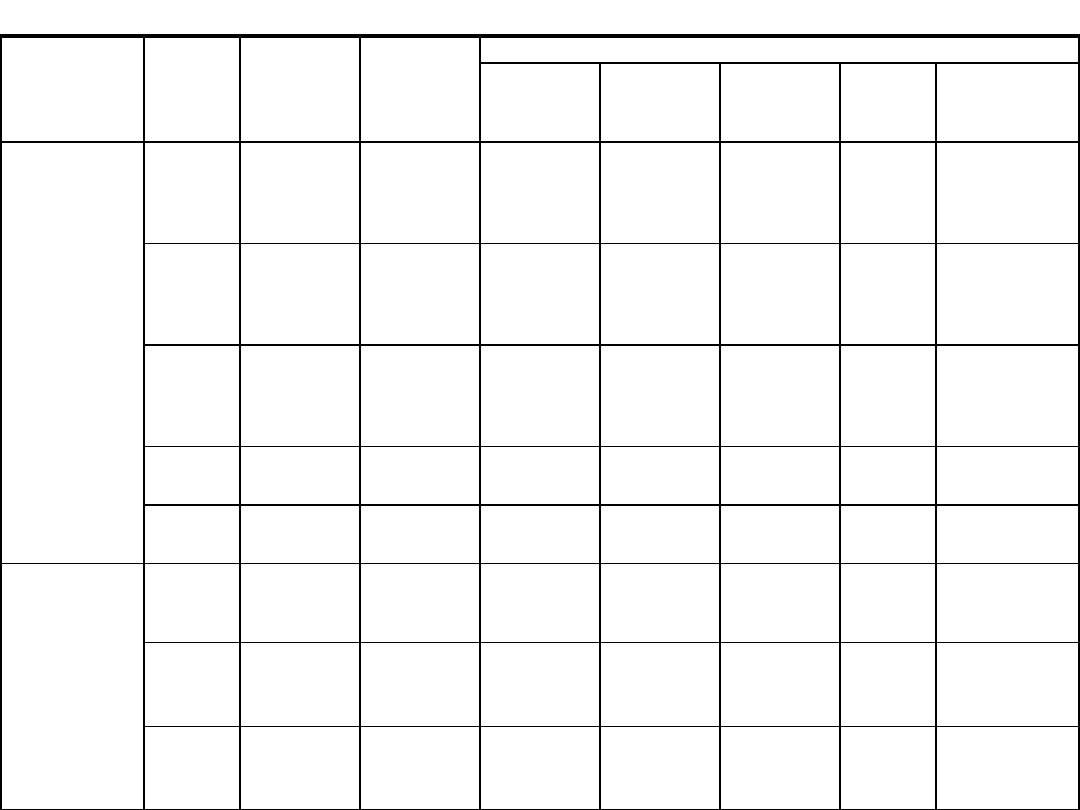
Wirus odry
cały
rok
tak
Zespół objawów
chorobowych
Wirus
wywołujący Sezonowość
Badanie w
kierunku
obecności
przeciwciał
Materiały do badań bezpośrednich wirusologicznych i izolacji wirusa
Krtań gardło
jama nosowo-
gardłowa
Kał
Płyn
mózgowo-
rdzeniowy
Mocz
Inne
VII. Zakażenia
u osób
poddanych
leczeniu
immunosupre-
syjnemu
CMV
cały rok
tak
+ + +
+ +
Krew
(antygenemia),
tkanki
+ + + +
HSV
cały rok
tak
+ +
Płyn z
pęcherzyków
+ + + +,
tkanki + + +
VZV
cały rok
Płyn z
pęcherzyków
+ + + +,
tkanki + + +
EBV
cały rok
tak
+ + + +
Tkanki (PCR)
HHV-6
cały rok
tak
Krew (PCR)
VIII. Zakażenie
wewnątrz-
maciczne
i
okołoporodowe
Wirus
różyczki
cały rok
tak (IgM)
+ +
CMV
cały rok
tak (IgM)
wymaz
z gardła
+ + +
+ + +
HSV
cały rok
tak (IgM)
wymaz
z gardła
+ + +
Płyn
z pęcherzyków

Metody diagnostyki zakażeń wirusowych w oparciu
o własności biologiczne (I), bezpośrednie wykrycie lub jego podjednostek
(M), jego białek (B) lub materiału genetycznego(G) oraz odpowiedzi
immunologicznej (S)
Grupa
Metoda
Omówienie metody
Wady i ograniczenia
I
Izolacja
Zdolność wywoływania
zmian w zakażonych
organizmach lub
hodowlach komórkowych;
potwierdzenie obecności
aktywnego patogenu.
Zróżnicowanie wymagań wirusów pod
względem zakażania i patogenności dla
określonych gospodarzy linii komórkowych,
zarodków ptasich; występowanie wielu
wirusów zakażających dane komórki lub
wywołujących podobne objawy – konieczna
dalsza identyfikacja
M1
Mikroskopia
elektronowa
Bezpośrednie
zaobserwowanie wirusa
w badanym materiale (gdy
co najmniej 10
6
cząstek
wirusowych)
Konieczna znaczna liczba cząstek wirusów
w badanym materiale; możliwa tylko ocena
budowy wirionów
M2
Bierna
aglutynacja
Zlepianie przez wirusa lub
jego antygeny
opłaszczonych swoistymi
przeciwciałami krwinek lub
lateksu
Konieczna znaczna liczba cząstek wirusów
w badanym materiale; nieswoiste reakcje
wywołane przez substancje aglutynujace
krwinki
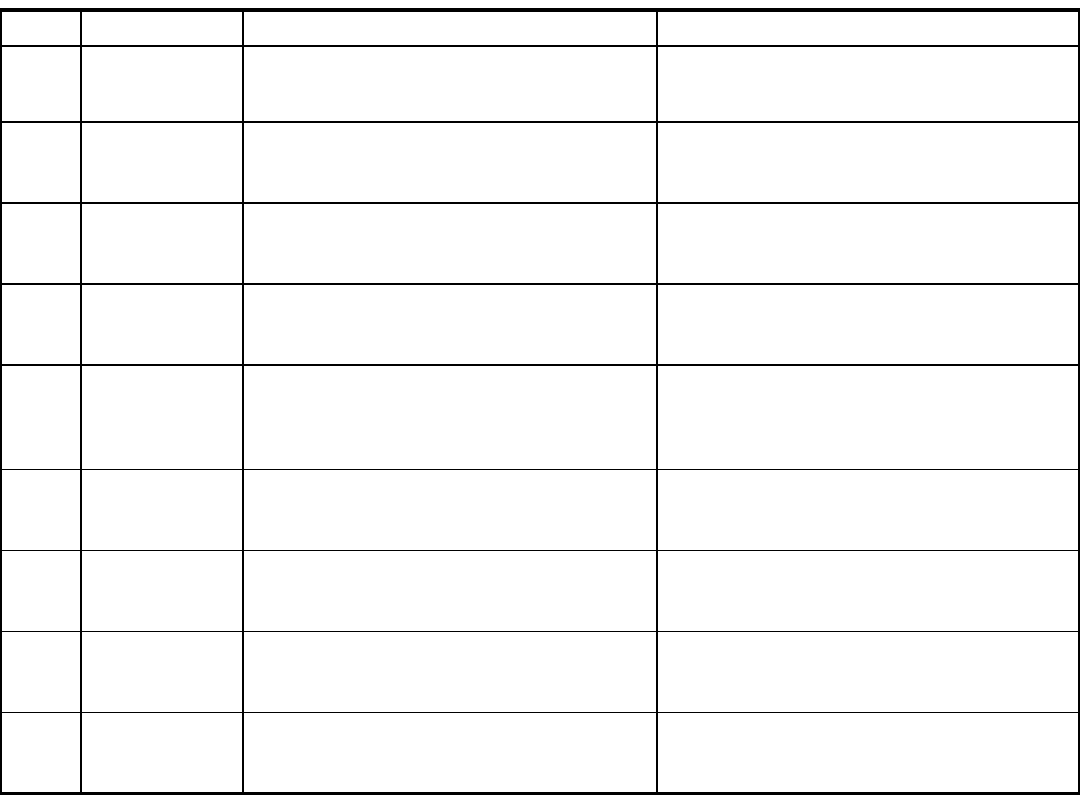
Grupa
Metoda
Omówienie metody
Wady i ograniczenia
B1
Immunofluore-
scencja
Wiązanie znakowanych przeciwciał
Przeciwciała monoklonalne mogą wykrywać
tylko wybrane subpopulacje wirusa
B2
Wykrywanie
enzymów
wirusa
Wykrywanie reaktywności odwrotnej
trnskryptazy jako potwierdzenie obecności
posiadających ją retrowirusów
Brak możliwości identyfikacji wirusa
B3
ELISA
Wiązanie antygenu przez przeciwciała i
wykrywanie innymi swoistymi przeciwciałami;
wysoka czułość
Możliwość wykrywania wybranych
subpopulacji wirusa
G1
Hybrydyzacja
DNA lub RNA
Wykrywanie sekwencji nukleotydów przez
związanie komplementarnego znakowanego
fragmentu kwasu nukleinowego
Wrażliwa na nukleazę
G2
Amplifikacje
genomu
Powielanie określonego obszaru genomu;
identyfikacja produktu metodami:
elektroforeza genomu, hybrydyzacja DNA lub
RNA, metody immunoenzymatyczne
Wrażliwe na nukleazy i inhibitory polimeraz
S1
OZH
Blokowanie przez przeciwciała występujących
na niektórych wirusach receptorów dla
krwinek
Inhibitory, brak hemglutynin u wielu wirusów,
brak rozróżniania klas immunoglobulin
S2
neutralizacja
Eliminacja zakaźności przez związanie z
wirusem przeciwciała; różnicowanie ściśle
spokrewnionych antygenowo wirusów
Długi czas wykonania; trudności z doborem
podłoża, w którym namnaża się wirus
S3
ELISA
Wiązanie znakowanych antyimmunoglobulin
z kompleksem antygen-przeciwciało; metoda
ilościowa, różnicowanie klas immunoglobulin
Fałszywie dodatnie wyniki w klasie IgM przy
obecności RF
S4
Western blot
Wykrywanie przeciwciał dla antygenów
rozdzielonych elektroforetyczni i związanych z
nośnikiem
Denaturacja epitopów przestrzennych
antygenów
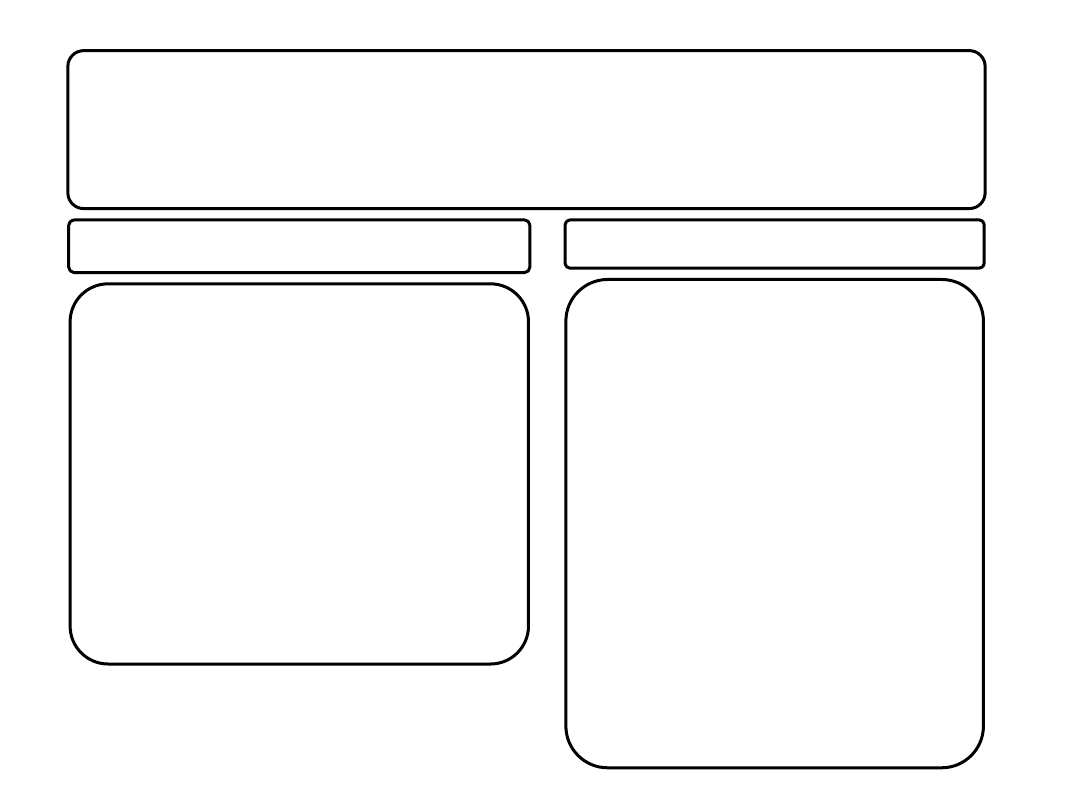
Zakażenie HCMV kobiety ciężarnej
seropozytywnej
0,5-1,5% płodów ulega zakażeniu w wyniku
reaktywacji infekcji matki
0,1% noworodków wykazuje po urodzeniu
objawy kliniczne:
- upośledzenie słuchu
- opóźniony rozwój
seronegatywnej
1-5% kobiet ulega pierwotnej infekcji
30-40% płodów ulega zakażeniu
10% zakażonych noworodków
manifestuje ciężkie objawy choroby:
powiększenie wątroby i śledziony,
trombocytopenię, hiperbilirubinemię,
uszkodzenie centralnego układu
nerwowego, zapalenie płuc, drgawki i/lub
paraliż, ślepotę
U 90% tych dzieci oraz 5-15% nie
wykazujących objawów choroby po
urodzeniu występują późne następstwa
zakażenia: głuchota, upośledzenia
umysłowe, zmiany w zachowaniu,
anomalie dotyczące uzębienia i inne
Wyszukiwarka
Podobne podstrony:
Materiały do cwiczenia nr 11
Enzymologia materiały do ćwiczeń
Materiały do ćwiczeń z geologii
Materiały do ćwiczeń nr 1
Materiały do cwiczenia nr 5
Materiały do ćwiczeń nr 2
Materiały do ćwiczeń z geologii te co umieć
Materialy do cwiczen, biochemia
materialy do cwiczen 1, Studia FIR, Podstawy zarządzania
XX materiały do ćwiczeń z historii wych 2
Ćwiczenia, Instrukcja do ćwiczenia 7, Instrukcja do ćwiczenia 11:
Materiały do cwiczenia 10
MATERIALY DO CWICZENIA BIOLOGIA CYTOMETR
socjololgia ludności - materiały do zajęć 11, socjologia, Socjologia Ludności, notatki UJ z tekstów,
Kula K, Słowikowska Hilczer J Medycyna rozrodu z elementami seksuologii Materiały do ćwiczeń
KiK materiały do ćwiczeń
materiały do wykładów w 11 Profilaktyka w środowisku szkolnym
więcej podobnych podstron