
1
Choroby zwierząt futerkowych
Spis treści:
Ogólna charakterystyka …………..2
Wykłądy…………………………………..28
Ćwiczenia………………………………..60

2
Ogólna charakterystyka hodowli zwierząt futerkowych
-pochodzenie zwierząt futerkowych
- postanowienia Komisji Stałej Europejskiej Konwencji o Ochronie Zwierząt Hodowlanych
- hodowla mięsożernych zwierząt futerkowych w Polsce i na świecie
Gromada: Ssaki (Mammalia)
Rząd: Zajęcokształtne (Lagomorpha)
zając szarak Lepus europaeus
królik Oryctolagus cuniculus
Rząd: Drapieżne (Camivora)
Rodzina: psowate (Canidae)
lis polarny Alopex lagopus
lis pospolity Vulpes vulpes
jenot Nyctereutes procyonoides
Rodzina: łasicowate (Mustelidae)
norka amerykańska
Mustela vison
tchórzofretka Mustela putorius
Rząd: Gryzonie (Rodentia)
Rodzina: nutriowate (Capromyidae)
nutria Myocastor coypus
Rodzina: szynszylowate (Chinchillidae)
szynszyla duża Chinchilla laniger
Lis pospolity (Vulpes vulpes)
ssak łożyskowy z rodzinypsowatych, rzędu drapieżnych występuje na półkuli północnej, w części Azji, Europie i północnej Afryce
w
górach sięga w Europie do 2700 m n.p.m., a w Azji do 4000-5000 m n.p.m. w Polsce rozpowszechniony jest w całym kraju w XIX wieku
został wprowadzony do Australii, gdzie jest obecnie jednym z największych szkodników
Biotop
- biotopem lisa są lasy, pola, łąkiw dużych kompleksach
-trzyma się raczej na obrzeżach lub w enklawach śródleśnych
Pokarm
Lis jest zwierzęciem wszystkożernym z przewagą. pokarmu mięsnego. Rodzaj pokarmu jest dostosowany do dynamiki
populacji
ofiar i waha się w zależności od biotopu i typu krajobrazu Podstawowym pokarmem lisa są gryzonie myszowate, ale żywi się
również owadami, ślimakami, robakami,
okazyjnie zającami lub królikami, ptakami, padliną, jagodami i innymi owocami.
Dojrzałość płciową lisy osiągają
pod koniec 1 roku życia. Okres godowy przypada na styczeń –luty

3
Ciąża trwa około 51-54 dni, w miocie najczęściej 4-6 młodych, które rodzą się wczesną wiosną ślepe i głuche, z ciemnym wełnistym
futrem. Niekiedy samiec pomaga w wychowaniu przynosząc upolowane zwierzęta. Młode ssą do 8 tygodnia, samodzielność osiągają po
3-5 miesiącach. Dojrzałość płciową uzyskują w 9-10 miesiącu życia.
Długość życia lisa na swobodzie wynosi około 10-12 lat. Wiek do 2 lat można ocenić po starciu górnego zęba trzonowego (M') i siekaczy w
żuchwie. Ustalenie dokładnego wieku lisów jest możliwe na podstawie liczenia (pierścieni) cementu i zębiny na szlifach zębów.
Behawior: Lis prowadzi życie samotne łączenie w pary jest raczej sezonowe, chociaż obserwowano już wielokrotnie udział samca
w
karmieniu nie tylko samicy, ale
i młodych w pierwszych tygodniach życia. W ciągu wiosny i lata lis prowadzi życie raczej osiadłe,
jesienią i zimą -koczownicze. Ma bardzo dobrze rozwinięte zmysły słuchu, wzroku, węchu i dotyku, co ułatwia mu polowanie na drobne
gryzonie i owady. Zarejestrowano 28 różnych głosów wydawanych przez lisy, z których najbardziej znane jest ich poszczekiwanie w czasie
cieczki.
Vulpes vulpes vulpes Lis o mocnej budowie, długim włosie, intensywnie rudej sierści i cienkich nogach (Skandynawia)
Vulpes vulpes crucigera Bardzo zmienny kolorystycznie Europa Środkowa
Vulpes vulpes silacea Lis średniej wielkości, jaskraworudy, srebrzystoszary ogon (Półwysep Iberyjski)
Vulpes vulpes montanaLis o bardzo gęstym, jasnym futrze (Alpy, Himalaje)
Vulpes vulpes fulvaduży, intensywnie rudoczerwony, stopy owłosione (Kanada, USA)
Rozród hodowlanych lisów pospolitych rozpoczyna się w styczniu i trwa do marca.
Faza przedrujowa (styczeń)
Faza rujowa (styczeń/marzec)- ruja właściwa trwa 1-3 dni
Faza porujowa
Faza spokoju (polowa maja/koniec grudnia)
zdolność rozrodcza samic utrzymuje się do 7 roku życia
ciąża trwa 50-56 dni (średnio 53 dni) liczebność zwierząt w miocie: 4-6
Lis polarny, piesiec (Alopex lagopus)
Ssak z rodziny psowatych, występujący na obszarach na północ od kręgu polarnego. Najczęściej występuje w ubarwieniu letnim brązowo-
szarym, a zimą śnieżnobiałym lub stalowoniebieskim. Posiada dobrze rozwinięty zmysł węchu, wzroku i słuchu. Bardzo wytrzymały na
zimno, aktywny przy temperaturze dochodzącej do minus 70°C.Okres godowy trwa od lutego do kwietnia.
Ciąża trwa 49-57 dni.
Porody przypadają na maj/czerwiec.
Samica rodzi 2-12 (przeciętnie 3-5) młodych, które osiągają dojrzałość płciową w wieku 10-11 miesięcy.
Hodowla
Lis polarny hodowany jest na fermach lisich od ponad 50 lat. Nazywany jest potocznie lisem niebieskim. W wyniku selekcji i krzyżowania
otrzymano szereg odmian barwnych.
Obecnie hoduje się następujące odmiany:lis polarny niebieski, lis polarny biały, lis polarny białopyski, lis polarny cienisty
Lis polarny
Wygląd:
długość ciała 65-72 cm lciężar ciała: samice 12-15 kg
samce 13-17 kg
Na jesieni ciężar ciała lisów niebieskich jest największy i może on wynosić ponad 30 kg (lisy fińskie)
Rozród lisów polarnych przypada na połowę lutego i trwa do końca kwietnia.

4
Faza przedrujowa (luty)
Faza rujowa (luty/ koniec kwietnia: niekiedy I dekada maja)
ruja właściwa trwa 4-5 dni
Faza porujowa
Faza spokoju (polowa maja/koniec grudnia)
Zdolność rozrodcza samic utrzymuje się do 6 roku życia.
Ciąża trwa 50-56 dni (średnio 53 dni)
Liczebność miotu: 8-10 (niekiedy 16-17).
Jenot (Nyctereutes procyonoides)
ssak należący do rzędu drapieżnych i rodziny psowatych. inne nazwy: szop usuryjski, junat, lis japoński
Występowanie: Występuje w Azji i Europie, choć jego pierwotnym obszarem występowania był Daleki Wschód.Ze względu na swoje
wartościowe futro został zaklimatyzowany na Ukrainie, Białorusi i Litwie. Stąd samorzutnie rozprzestrzenił się po Polsce i Europie.
Obecnie spotykany również w Skandynawii, Rumunii, Niemczech.W Polsce występuje stosunkowo od niedawna .Jego obecność w
środowisku naturalnym stwierdzono po raz pierwszy w 1955 roku. Występuje na terenie całego kraju, najliczniej w północno-wschodnich
województwach, populacja jenotów ma tu charakter trwały i zwarty.
Tryb życia: Jest drapieżnikiem,
ale dużą część jego pożywienia
stanowią też rośliny.
Odżywia się głównie
pokarmem pochodzenia zwierzęcego (gryzonie oraz jaja i pisklęta ptaków gniazdujących na ziemi, ślimaki, owady, skorupiaki i drobne
kręgowce), pobiera także, zwłaszcza jesienią, znaczne ilości pokarmu roślinnego. Poluje głównie nocą. W dzień ukrywa się w norach.
Rzadko jednak kopie je sam, przeważnie wykorzystuje nory wykopane przez borsuka lub lisa. Biotop:
Jenot
zajmuje
najchętniej
tereny lasów liściastych położone w pobliżu zbiorników wodnych. Spotkać go też można w lasach mieszanych i przybrzeżnych
zaroślach.W zasadzie bytuje do wysokości 300 m n.p.m. choć spotykano go na wysokości 700 m n.p.m.
Behawior:
Jenoty są aktywne nocą, tylko w czasie lata można je spotkać rano i wieczorem. Dnie spędzają w norach, legowiskach
w gęstych trzcinach czy zaroślach. W czasie żerowania przeszukują brzegi zbiorników wodnych, chodzą po płyciznach.
W
razie
niebezpieczeństwa warują, starając się wtopić w tło otoczenia. Czasem zamykają oczy i udają martwe.
Węch mają doskonały, wzrok i słuch dość słaby. Część zimy jenoty przesypiają, mniej więcej od końca grudnia do końca stycznia, czasem
lutego. Na zimę jenoty tyją, zwierzęta, które nie zgromadziły dostatecznego zapasu tłuszczu nie zasypiają na zimę i zazwyczaj giną.
Rozród: Młode jenoty osiągają dojrzałość
płciową w wieku 8-10 miesięcy.
Są to zwierzęta monogamiczne.
Sezon godowy rozpoczyna się w początkach lutego i w zależności od klimatu i pogody w różnych strefach geograficznych trwa do końca
kwietnia.
Kopulacja ma miejsce w nocy lub wczesnym rankiem i trwa od 6-7 do 20 min.Cieczka u suk trwa od kilku godzin do 6
dni. W czasie cieczki dochodzi do 2-3 (maksymalnie 5) kopulacji. Ciąża trwa 57-65 dni (średnio 61 dni).W ciągu roku bywa tylko 1 miot - w
kwietniu i maju. W miocie rodzi się 6-7 szczeniąt,maksymalnie 15-16 .Laktacja trwa 45-60 dni, lecz młode już w wieku 1 miesiąca
zaczynają korzystać z pokarmu dostarczonego przez dorosłe zwierzęta. Młode rodzą się ślepe, pokryte krótkim, gęstym,
ciemnobrunatnym włosem puchowym.
Dwumiesięczne jenoty mają już umaszczenie zbliżone do dorosłych. Jenoty żyją
przeciętnie 1,5-2,0 lat, maksymalnie 10-11 lat.Naturalnymi wrogami jenota są: wilk ryś orzeł bielik i lis (dla szczeniąt)
Podgatunki
N. p. procyonoides – Azja, N. p. koreensis – Korea, N. p. orestes – Yunnan, N. p. ussuriensis – Rosja, N. p. viverrinus – Japonia, N. p.
albus - Japonia
Cechy biologiczne rodziny psowatych
LIS POSPOLITY
LIS POLARNY
JENOT
Ciężar ciała
F: 4,0-6,0
M: 4,4-7,0
F: 3,0
M: 3,5
Lato: 4,0-6,0
Zima: 6,0-10,0
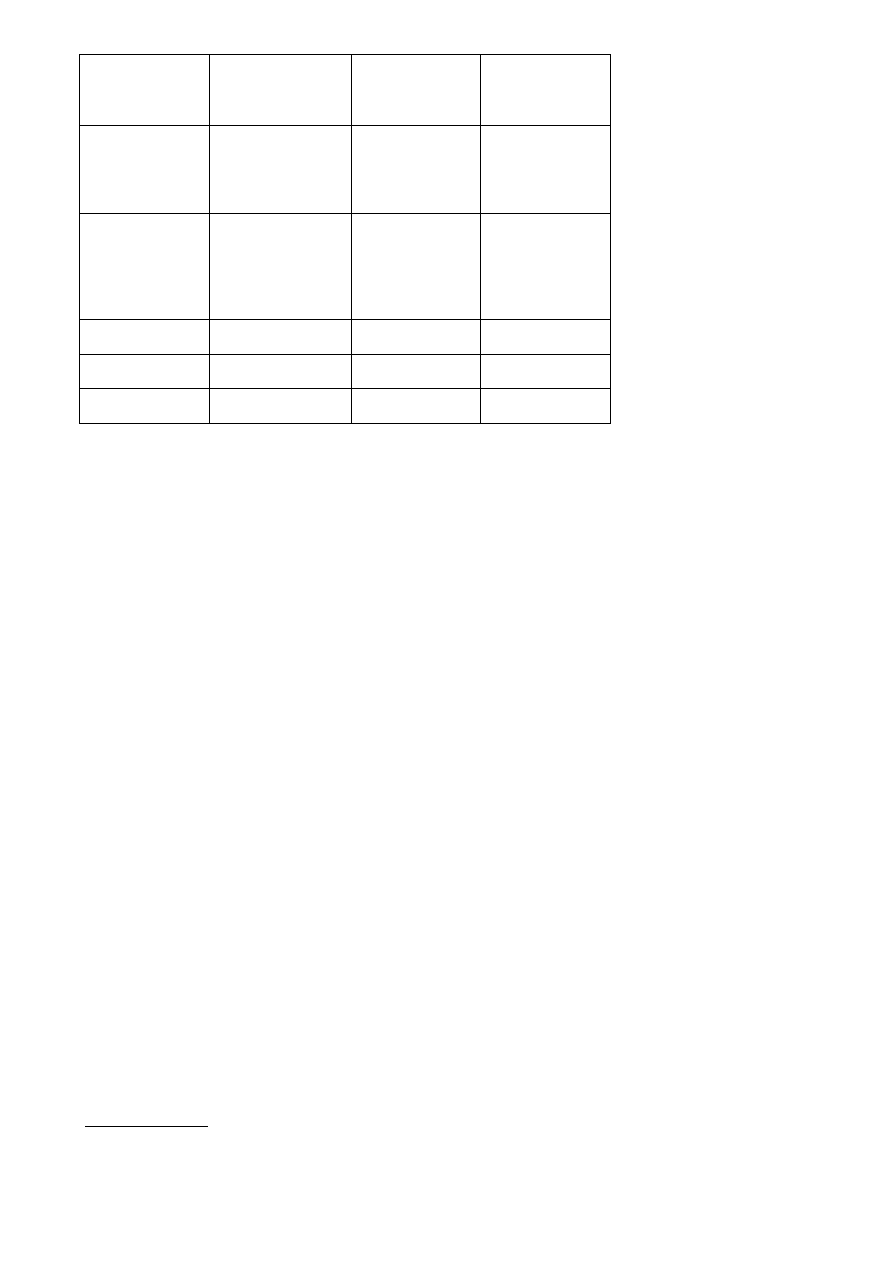
5
Zasięg terytorialny
F: 0,54-8,8 km2M: 0,63-
10 km2
20-30 km2(do 120
km2)
10 km2
Aktywność
biologiczna
zmierzch/noc
zmienna
nocna
Tryb życia
dowolny,
(poligamia/monogamia,
okres godowy, opieka
rodzicielska 2 lub 1
samotniczy, w
okresie rozrodu
poligamia, opieka
rodzicielska 2 lub 1
pary/rodziny,
monogamia, opieka
rodzicielska 2
Wielkość miotu
2-7
1-11
5-7
Termin odsadzania
2-3 miesiąc
5-9 tydzień
7-9 tydzień
Odłączenie od stada
5-7 miesiąc życia
2 tyg.-3 miesiąc życia 6 miesiąc życia
Rodzina łasicowate
Łasica (Mustela nivalis)
Gronostaj (Mustela erminea)
Łasica (Mustela frenata)
Kuna domowa Martes foina
Kuna świerkowa Martes americana
Kuna wodna Martes pennanti
Tchórz czarnołapy (Mustela nigripes)
Tchórz stepowy(Mustela putorius eversmanii)
Norka amerykańska - Mustela vison
Rozmieszczenie geograficzne norki obejmuje prawie cały kontynent Ameryki Północnej, od Alaski po Florydę. Sprowadzona została do
Europy jako zwierzę fermowe około 1925 r. do Niemiec. Zbiegłe z hodowli osobniki dały początek wolnym populacjom w wielu krajach
Europy Środkowej i Skandynawii Norka żyje w zarośniętych brzegach zbiorników wodnych zarówno stojących jak i płynących. W górach
dochodzi do 1500 m n.p.m.
Podstawowy pokarm norki stanowią drobne ssaki, żaby, raki, ryby, owady wodne, w lecie okazyjnie także dzikie ptactwo wodne i
domowe. Norka znakomicie pływa i nurkuje, pod wodą przebywa około 1-2 minut. Wrogiem norki jest wydra, poza tym włóczące się psy
i ptaki drapieżne. Niszę ekologiczną norki europejskiej zajmuje w większości krajów europejskich norka amerykańska - Mustela vison
Na fermach norka amerykańska może żyć do 7-10 lat. W wolnej przyrodzie żyje znacznie krócej. Okres krycia u norek amerykańskich
przypada na marzec (owulacja indukowana).
Ciąża średnio 49 dni). Liczba młodych w miocie wynosi 4-6 sztuk, nawet do 10. Okres laktacji trwa 2-2,5 miesiąca, wcześniej jednak, bo już
pod koniec pierwszego miesiąca życia, młode zaczynają próbować pokarm mięsny. trwa od 46 do 71 dni
Odmiany barwne (mutacyjne) norek
NORKA STANDARDOWA grupy barwne: czarne, brązowe, białe, niebieskie plamiste
Czarne odmiany norek
Duże natężenie barwnika czarnego we włosach, natomiast barwnik brązowy jest całkowicie wyeliminowany. Silny melanizm występuje
również w naskórku płytki nosowej, błon śluzowych, podniebienia i pazurów. Przedstawiciel: norka Jet black (NN) – homozygotyczna, co
jest przyczyną do osłabionej żywotności.

6
Niebieskie odmiany norek
Brak brązowego barwnika we włosach, natomiast pigment czarny występuje w różnym nasileniu dając wrażenie niebieskości lub
zabarwienie szarometaliczne. Przedstawiciele odmiana jasnoniebieska:
platyn srebrzystoniebieski, platyn stalowoniebieski
Przedstawiciele odmiana ciemnoniebieska: norka aleucka – włos pokrywowy czarny z odcieniem granatu, podszycie niebieskie
– niekorzystna cecha: obniżona odporność na wirus AMDV
Brązowe odmiany norek
Zróżnicowana koncentracja barwnika brązowego, z całkowitym brakiem barwnika czarnego.
Zależnie od koncentracji barwnika we włosach występuje znaczne zróżnicowanie barwne od ciemnego brązu (pastele) do jasnego beżu
(palomino). Wśród pasteli występuje dość często pewna anomalia polegająca na skłonności do śrubowego skręcania głowy. Pastel
brązowooki (królewski) Najczęściej hodowana brązowa odmiana norek. Barwa włosów pokrywowych jest ciemno-orzechowo-brązowa, a
barwa podszycia niebiesko-szara. Zwierzęta tej odmiany są duże, plenne i żywotne.
Plamiste odmiany norek
Do tej grupy należą odmiany o nierównomiernym rozmieszczeniu barwnika we włosach w poszczególnych partiach skóry.
Należą tu również odmiany, u których występuje duży kontrast barwny pomiędzy pokrywą a podszyciem. Do plamistych odmian
barwnych hodowanych w Polsce należą krzyżaki (Black cross): pigmentowane włosy występują na głowie wzdłuż linii grzbietowej aż do
nasady ogona oraz w poprzek ciała przez kończyny przednie. Tak symetrycznie rozmieszczone włosy tworzą znak krzyża
Białe odmiany norek
W tej grupie mutantów we włosach zostały wyeliminowane oba typy barwników Wyróżniamy odmiany:
białe niealbinotyczne – brak barwników we włosach a ich obecność w skórze (białe ciemnookie)
albinosy (białe czerwonookie)
Norka biała niealbinotyczna Biała Hedlunda śnieżnobiała, czarnooka o doskonałej strukturze okrywy włosowej norki należące do tej
odmiany są prawdopodobnie głuche i mają słabo rozwinięty zmysł powonienia
Fretka (Mustela putorius furo)
niewielki drapieżnik z rodziny łasicowatych fretka jest udomowioną formą tchórza (prawdopodobnie tchórza zwyczajnego, choć nie
wyklucza się tchórza stepowego krzyżówka fretki z tchórzem zwyczajnym znana jest pod nazwą tchórzofretka tchórz, fretka i
tchórzofretka - krzyżują się swobodnie wydając płodne potomstwo Od lat 80. XX-wieku rośnie popularność fretki jako zwierzęcia
domowego. Znalazło to wyraz we włączeniu
fretek (obok psów i kotów) do grupy zwierząt podróżujących z paszportami dla zwierząt
domowych w krajach UE.
W Portugalii obowiązuje zakaz hodowania (bez odpowiedniej zgody) i przewożenia fretek ze względu na ryzyko hybrydyzacji pomiędzy
fretkami domowymi i dzikimi.
Fretka występuje w wielu odmianach barwnych. Najczęściej spotykane to: tchórzowata czyli
ciemnobrązowe łapki, maska oraz włosy okrywowe, podszycie białe. Odmiana ta jest z wyglądu najbardziej zbliżona do tchórza
dzikiegopastelowa - często, mylnie określana jako cynamonowa to fretka jasnobrązowa z kremowym lub białym podszerstkiem
cynamonowa - o rudym ubarwieniu albinos - biała z czerwonymi oczami panda - biała głowa i tułów w kontrastowym kolorze rzadziej
spotykane są fretki łaciate, jednobarwne (poza albinosem) oraz syjamskie ciąża trwa ok 42 dniw miocie ok. 10 młodych samica może mieć
do dwóch miotów rocznie fretki żyją przeciętnie 6-10 lat, a w sprzyjających warunkach 8-12 lat. Podobnie jak pozostałe
gatunkirodzaju Mustela fretka była i nadal jest cennym zwierzęciem
futerkowym. Bywa również wykorzystywana jako
zwierzę laboratoryjne.Fretki od wieków używane były do polowań na króliki. Były również hodowane w Europie przed upowszechnieniem
się kota domowego jako zwierzęta domowe tępiące myszy.Samiec fretki (albinos) widnieje na słynnym obrazie Leonarda da Vinci „Dama
z łasiczką”.
Cechy biologiczne rodziny łasicowatych
NORKA
TCHÓRZOFRETKA
Ciężar ciała
F: 0,6 kg
M: 1,2 kg
F: 0,8 kg
M: 1,25
Zasięg terytorialny
F: 0,5-3,0 km2
F: 0,3-0,8 km2

7
M: 2,5-6,0 km2
M: 0,2-3,55 km2
Aktywność
biologiczna
zmierzch/noc
noc
Tryb życia
samotniczy, poligamia, okres godowy
4-6
Wielkość miotu
4-6
5-10
Termin odsadzania
6 tydzień życia
3 tydzień życia
Odłączenie od stada
3-4 miesiąc (niektóre samice 11 miesiąc
życia)
2-3 miesiąc życia
Nutria (Myocastor coypus)
Gryzoń, przedstawiciel liczącej 8 gatunków rodziny nutriowatych (Capromyidae).
Region biogeograficzny, z którego pochodzi gatunek: Ameryka Południowa
W Europie i Stanach Zjednoczonych hodowana jako cenne zwierzę futerkowe.
W Polsce hodowana od 1926 roku.
Obecne rozmieszczenie w Polsce: punktowe.
Rozmieszczenie koreluje z występowaniem ferm hodowlanych.
Liczebność dzikiej populacji trudna do oceny ze względu na częste ucieczki z hodowli; surowe zimy najprawdopodobniej redukują
liczebność dzikiej populacji do zera.
Rozmnaża się w ciągu całego roku.
Ciąża trwa 128-135 dni.
Samica rodzi najczęściej 4-7 młodych. Mają one otwarte oczy i są dość samodzielne.
Zazwyczaj 2 mioty rocznie.
Żyje parami do 10 lat.
Występując licznie może wyrządzać szkody, uszkadzając groble, niszcząc przybrzeżną roślinność, szkółki leśne i sady.
Mroźne zimy radykalnie redukują liczebność zdziczałych osobników.
Szynszyla (Chinchilla laniger)
Żyje w koloniach zamieszkujących terenyskaliste w górach Chile, Argentyny i Boliwii, gdzie żywi się roślinnością wysokogórską.
Dziś istnieje 14 odmian mutacyjnych, z tego ponad 12 mieszańców międzyodmianowych. Z czasem może ich być więcej.
Szynszyle żyją na wysokości od 3000 do 5000 m. n.p.m - wyżej od świnek morskich. -Ich nazwa pochodzi od plemienia Indian Chinchila,
którzy na nie polowali. Po pewnym czasie Chinchlilów podbili Inkowie a tych potem Hiszpanie. Konkwiskadorzy zauważyli niezwykłe
właściwości szynszylich skór, co spotęgowało zabijanie tych zwierząt. Dodatkowo na szynszyle polowały lisy i węże co omal nie
prowadziło do wyginięcia szynszyli pod koniec XIX wieku. W 1918 zakazano polowania na te gryzonie. Pięć lat potem do USA powrócił
pasjonat i badacz szynszyli Mathias Chapman z jedenastoma osobnikami – co uważa się za początek ferm szynszyli.
Pierwsza hodowla szynszyli w Polsce powstała w 1956 roku.
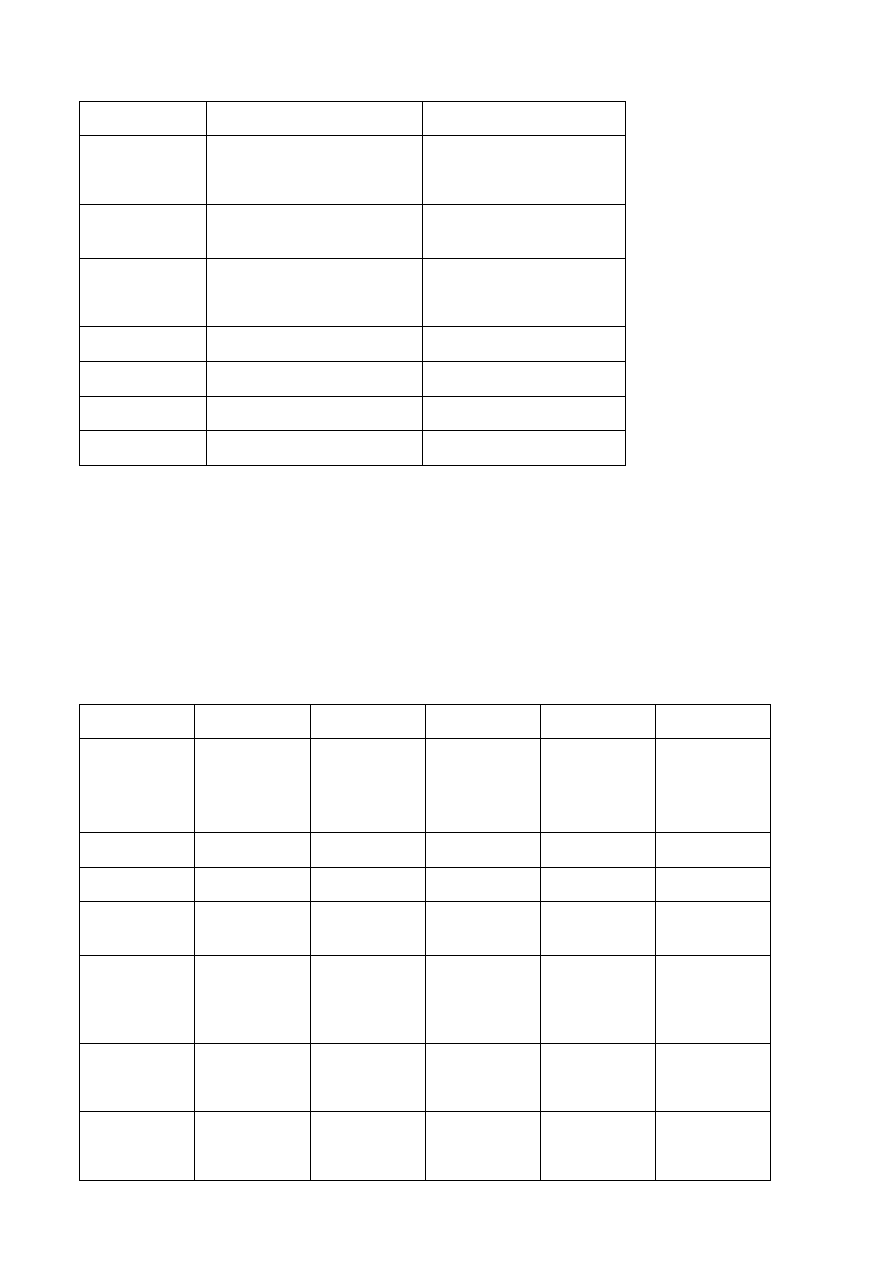
8
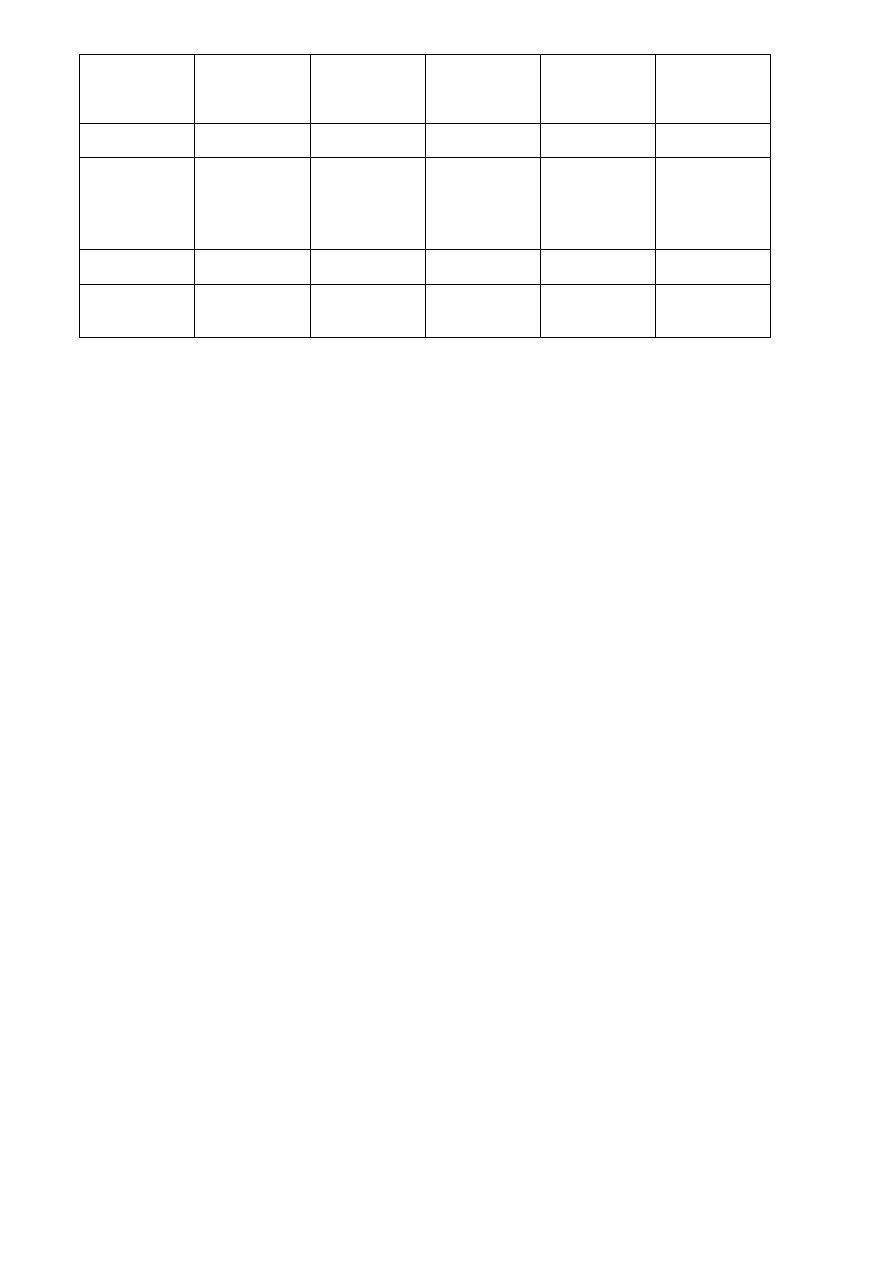
Cechy biologiczne roślinożernych zwierząt futerkowych
NUTRIE
SZYNSZYLE
Ciężar ciała
F: 5-6 kg
M: 6-7 kg
F: 0,8 kg
M: 0,5 kg
Aktywność
biologiczna
zmierzch/noc
noc
Tryb życia
gromadny - 2-15 zwierząt
w stadzie, poligamia
gromadny, monogamia
Wielkość miotu
5-6
2-3
Termin odsadzenia
8 tydzień
6-8 tydzień
Dojrzałość płciowa
6 miesiąc
8 miesiąc
Długość życia
powyżej 7 lat
powyżej 10 lat
Fizjologiczne parametry życiowe zwierząt futerkowych
Lisy
Norki
Nutrie
Szynszyle
Króliki
Ciepłota
młode 39,5-40,50C
dorosłe 39,0-40,00
C
39,7-40,80 C
36,8-38,00 C
37,00 C
38,8-40,00 C
Tętno
100-160
110-300
125-175
150-300
130-325
Oddechy
12-60
35-160
32-120
100-150
30-60
Typ cyklu
płciowego
Mono-estryczny
Mono-estryczny
Poli-estryczny
Poli-estryczny
Poli-estryczny
ruja
polarny II-IV
pospolity I-III
20 II-30 III
cały rok co 28-46
dni
cały rok co 30-45
dni
cały rok
krycie
pospolity II
polarny III
marzec
wiosna jesień
listopad-maj
wiosna jesień
Długość ciąży
50-56
(53)
46-71
128-135
111-112
30-31
9
miot
Pospolity 3-6/1-10
polarny 8-12/3-16
4-8/2-10
4-7
1-2
4-10, małe rasy-
małe mioty
Termin odsadzenia 6-10 tydz.
8-10 tydz,
10-12 tydz.
8 tydz.
6-8 tydz.
I ruja po porodzie
10 m-cy
8-10 m-cy
12-24 h
24 h
w czasie ciąży,
szczyt popędu 26-
29 dzień po
porodzie
dojrzałość płciowa
8-10 m-c
8-10 m-c
7-9 m-c
8 m
4-6 m-c
zdolność do
rozrodu
6-7 lat
5 lat
4 lata
8-12 lat
4-5 lat
Kluczowe punkty w ocenie zagrożenia mikrobiologicznego oraz zastosowanie profilaktyki ogólnej i swoistej na fermach zwierząt
futerkowych.
Celem wprowadzania profilaktyki ogólnej i swoistej na fermy zwierząt jest obniżenie ryzyka wystąpienia chorób lub w przypadku ich
powstania niedopuszczenie do rozprzestrzeniania się choroby na fermie poprzez redukcję bezpośredniego kontaktu zwierząt chorych i
zdrowych.
System zarządzania ryzykiem biologicznym
•System edukacyjny – uświadamianie i oszacowanie stopnia ryzyka
••Stworzony do poprawy kontroli nad chorobami zakaźnymi
•Narzędzie ograniczające wystąpienie ryzyka
Termin System zarządzania ryzykiem biologicznym określa ogólne działania które pozwalają na ocenę warunków utrzymania zwierząt ,
ocenę warunków na fermie na podstawie oceny ryzyka wystąpienia chorób zakaźnych i ich rozprzestrzeniania w fermie
System zarządzania ryzykiem biologicznym wprowadzono aby pomóc hodowcom w zrozumieniu strategii zapobiegania chorobom
zakaźnym, poprzez system edukacyjny, który zapozna hodowców z czynnikami warunkującymi powstawanie i szerzenie chorób zakaźnych
w stadzie, oraz zapozna ich z możliwościami które pozwolą na zminimalizowanie ryzyka lub już ewentualnych strat powstałych w wyniku
wybuchu choroby zakaźnej.
•Nie jest możliwa całkowita eliminacja ryzyka wystąpienia choroby
–Relacje pomiędzy:
drobnoustrojami a zwierzętami
zwierzętami a środowiskiem
–Likwidacja ekspozycji nośniki zarazka wektory mechaniczne i biologiczne
System zarządzania ryzykiem biologicznym wskazuje że ryzyko wystąpienia danej choroby nie może być całkowicie wyeliminowane,
jednakże ryzyko to może znajdować się pod naszą kontrolą (naszą czyli hodowcy lub lekarza. Jednakże aby sprawować taką kontrolę
należy posiadać odpowiednią wiedzę dotyczącą relacji pomiędzy drobnoustrojami a makroorganizmem, pomiędzy zwierzętami a
środowiskiem ich bytowania, oczywiście odnośnie samego czynnika zakaźnego i możliwości likwidacji ekspozycji czyli czynników
środowiskowych, które umożliwiają kontakt patogenu z organizmem wrażliwym. Poznanie tych czynników pozwoli nie tylko
zminimalizować ryzyko wystąpienia danej choroby u zwierząt ale także u człowieka – gdy mamy do czynienia z chorobą odzwierzęcą.
Likwidacja ekspozycji czyli zespołu czynników środowiskowych które umozliwiają kontakt patogenu z organizmem wrazliwym. Na
ekspozycje skladają się nosniki zarazka: pokarm, woda, wydzieliny, wydaliny, kurz, naskórek oraz wektory mechaniczne i biologiczne.
Wektor mechaniczny słuzy zarazkom jedynie za środek transportu, zaś w wektorze biologicznym zarazek namnaza się lub przechodzi
cykle rozwojowe. Mucha domowa – Salmonella , Escherichia coli, Pasteurella tularensis), komary kleszcze - P. tularensis, myszy, szczury -
wscieklizna, salmoneloza,
Współżycie pomiędzy drobnoustrojami i zwierzętami
•Relacje obojętne

10
•Synergizm
•Komensalizm
•Antagonizm/pasożytnictwo
Współżycie pomiędzy drobnoustrojami i zwierzami ma rożne formy. Do najważniejszych z nich należą: relacje obojętne, synergizm
antagonizm komensalizm symbioza i pasożytnictwo. Komensale – ich obecnosc w immunologicznie sprawnym organizmie nie przynosi
szkody, np. gronkowiec bialy – skóra. Symbionty – obopólna korzyść – E. coli produkcja wit z gr B. Ale komensale i symbiony należa do
pasozytow względnych czyli mogą wywoływac chorobę ale w pewnych ścisle określonych warunkach (uzjadliwienie się na skuteg zmian w
genpomie lub gdy odpornośc ulegnie obniżeniu),. Osobną grupe stanowia pasozyty, które mogą się namnazac głownie w organizmie
żywym i szybkopoza nim giną. Warunkiem przezcycia patogenów jest mozliwość transmisji z organizmu zakazonego na organizm zdrowy.
Wpływ środowiska na występowanie chorób
•Choroby wrodzone
•Choroby metaboliczne
- choroby niedoborowe
- masowe intoksykacje
Wpływ środowiska na występowanie chorób:
A wiec oprócz chorob infekcyjnych których czynnikiem przyczynowym są priony, pasozyty czy drobnoustroje, istnieją choroby wrodzone i
metaboliczne, które nie szerza się za posrednictwem bezpośredniego kontaktu zwierzat . Do nich nalezą choroby zwiazane z
niekorzystnym wplywem srodowiska takie jak choroby niedoborowe (rzadko u lisow czy norek, niekiedy hipowitaminozy w wyniku
unieczynnienia witamin w karmie – np vit B1 przez tiaminaze obecna w miesie ryb) lub masowe intoksykacje – błąd człowieka.
Drogi transmisji
•Transmisja czynników zakaźnych
Zwierzę zwierzę
Zwierzę człowiek
•Sposoby transmisji
Zakażenie:
–aerogenne -chlamydofiloza
–alimentarne –salmoneloza
–bezpośrednie -zabiegi wet. szczepienia
–wektory chorób zakaźnych
Aby zrozumieć system zarządzania ryzykiem biologicznym należy poznać, przeanalizować drogi transmisji czynników zakaźnych, które
mogą dotyczyć zwierząt ale również i człowieka w układzie zwierzę-człowiek (i tu mówimy o chorobach odzwierzęcych). Czynniki zakaźne
rozprzestrzeniają się ze zwierzęcia na inne zwierzę, czy człowieka różnymi drogami. Wiele czynników zakaźnych rozprzestrzenia się więcej
niż jedną drogą.
System zarządzania ryzykiem biologicznym skupia się głównie nad tym jak ograniczyć lub zlikwidować możliwość bezpośredniego
kontaktu z czynnikiem zakaźnym
Kontakt bezpośredni
•Nośniki zarazka
– krew, ślina, wydaliny
–otwarte rany, błony śluzowe, skóra
11
•Choroby przenoszone drogą płciową
–krycie –ciąża
Transmisja zarazka przez kontakt bezpośredni wymaga obecności czynnika zakaźnego w środowisku lub wewnatrz zakażonego
organizmu. Wówczas zwierzeta wrazliwe ulegają ekspozycji po kontakcie z otwartą raną, błonami śluzowymi, skórą czy krwia, sliną. Stad
czeste zakażenia u nowonarodzonych szczeniat po kontakcie z matka, u której zakażenie ma przebieg niejawny, np. herpeswiroza.
Zakażenie może również zostac przeniesione na potomstwo za pośrednictwem komórek płciowych (zakażenie seminalne) – białaczka u
bydła, ale istnieje również cały szereg chorób przenoszonych drogą płciową podczas krycia lub jako zakażenie śródmaciczne.
Wtórne źródło zakażenia
Miejsca skupienia zarazka poza organizmem
•gleba
•pasza
•woda
•narzędzia do pielęgnacji i chwytania
•sprzęt fermowy
Najczestrzym wtórym żródłem zakażenia są pasze i woda zanieczyszczone drobnoustrojami chorobotwórczymi , np. mieszanki paszowe
zanieczyszczone Salonellozą lub prionami powodującymi gabczaste encefalopatie, następnie skarmiani epadliną lub odpadami
drobiowymi czy rybami skażonymi toksyna botulinową, lub pasze zawierające endospory laseczek tężca, za posrednictwem wody szerzą
się leptospirozy. Sprzet uzywany do pielęgnacji zwierzat pośredniczy w przenoszeniu zwlaszcza chorób pasożytniczych i grzybiczych
(świerzb)
Drogi transmisji
•Dotyczą wszystkich czynników zakaźnych.
•Zwierzęta muszą ulec ekspozycji na czynniki zakaźne aby doszło do zakażenia.
•Zrozumienie i poznanie różnych dróg transmisji zarazków jest pierwszym krokiem do zarządzania ryzykiem biologicznym.
Każda choroba posiada swoje drogi transmisji czyli rozprzestrzeniania się w stadzie, stąd przerwnie dróg transmisji ma sens jeżeli
mówimy o zapobieganiu chorobom zakaźnym. Każda choroba ma swoją specyficzną drogę transmisji. Stąd tez poznanie tych dróg (czy to
będzie droga kropelkowa czy pokarmowa) ułatwi objęcie tych chorob kontrolą.
Transmisja chorób zakaźnych
•Nie wszystkie zwierzęta wykazują kliniczne objawy choroby
•Poznanie wszystkich
dróg transmisji pozwoli na rozwój strategii zwalczania danej choroby.
Jednakże należy podkreślić ze nie wszystkie zwierzeta wykazują obecnośc objawow klinicznych choroby (grzybice) a mogą stanowić
źródło zakażenia dla innych zwierzat, Dla prawie wszystkich chorób zakaźnych zachodzi zależność pomiędzy dawką zakaźną a natężeniem
procesu zapalnego. Niskie dawki zakaźne są przyczyna powstania zakażeń subklinicznych lub chorób o lekkim przebiegu.Stad też tak
wazne jest poznanie drog transmisji chorób aby skutecznie przeciwdzialać ich powstawaniu.
Ogólne zasady zapobiegania chorobom zakaźnym
•Zasięg fermy
•Identyfikacja zwierząt
•Protokoły zdrowotności zwierząt
•Źródło zwierząt nowo zakupionych
Jest kilka ogólnych zasad które powinny zostac wprowadzone na fermy w celu zapobieżenia wybuchu choroby na fermie, zwlaszcza takiej
która rozprzestrzenia się wieloma drogami. Do tych zasad należy znajomość obszaru fermy, a co za tym idzie sąsiedztwa czli okolicznych
farm czy dzikich populacji zwierząt (ten punkt dotyczy chodowli nutrii), następnie identyfikacja czyli oznakowanie zwierząt, protokoly
zdorowtności zwierzat gdzie zapisywane są: wykonywane zabiegi lekarskie i profilaktyczne, rozpoznane choroby, ewentualne okresy
izolacji czy kwarantany zwierząt, tu także powinny znależć się informacje dotyczące ilości zwierząt w miocie i ilości zwierzat
odchowanych, co jest niezwykle przydatne do przeprowadzenia przyszlego remontu stada

12
•Wybijanie chorych zwierząt
•Likwidacja zwłok
•Izolacja/kwarantanna
•Leczenie
Wybijanie chorych zwierząt
Działanie radykalne, które stosuje się w stosunku do zwierząt chorych na choroby zakaźne o dużej zakaźności i z reguły kończące się
śmiercią, czyli szybko rozprzestrzeniające się na fermie i stanowiące duże zagrożenie dla stada, a czasem i dla ludzi. Wybijanie jest
również uzasadnione gdy leczenie jest bezskuteczne lub ekonomicznie nieuzasadnione. Zwierzęta u których mimo leczenia rokowanie
odnośnie zejścia procesu chorobowego jest wątpliwe mogą stanowić rezerwuar zarazka, stąd też powinny zostać poddane eutanazji.
Zwierzęta padłe mogą również stanowić źródło zakażenia dla innych zwierząt stąd też powinny niezwłocznie zostać usuniete z fermy.
Ponadto zwierzęta padłe służą jako pożywienie dla zwierząt, ptaków padlinożernych i w ten sposób choroba może rozprzestrzenic się na
dalsze odległosci.
Likwidacja zwłok
Zwłoki zwierząt padłych i wybitych musza zostać unieszkodliwione w taki sposób by nie stanowiły źródła zakażenia. Zwierzęta padłe
najczęściej przekazuje się do zakładów utylizacyjnych lub zakopuje, a ciala zwierzat oskórowanych można utylizować w celu otrzymania
maczki mięsno-kostnej.
Izolacja zwierząt chorych
Izolacja zwierzat chorych eliminuje mozliwosc zakażenia zdrowych osobników w drodze kontaktu bezpośredniego oraz zmniejsza
niebezpieczenstwo szerzena sie się zakażenia za posrednictwem środowiska. Izolacja zapobiega ich transmisji na obsługe fermy oraz
personel
Zwierzętra nowowprowadzone do fermy powinny zostac poddane kwarantannie, ponieważ może okazać się iż są nosicielami jakis
czynników zakaźnych, a przetransportowanie w nowe miejsce może przyczynic się do rozwoju jawnej postaci choroby.
Leczenie
Leczenie przyczynowe – etiotropowe, skierowane na czynnik wywołujacy chorobę – przy uzyciu antybiotykow, surowic odpornościowych,
szczepionek stosowanych leczniczo
leczenie objawowe, którego celem jest zminimalizowanie objawow chorobowych , leczenie bodźcowe, pobudzające mechanizmy
odporności nieswoistej.
•Ograniczenie kontaktu z innymi zwierzętami
•sąsiednie fermy–zwierzęta dzikie, ptaki–włóczące się psy i koty
•Stan ogrodzeń
•Ustalenie protokołów bioochrony dla personelu oraz maszyn opuszczających
Ograniczenie kontaktu z innymi zwierzetami czyli w pierwszej kolejności zwrócenie uwagi na stan ogrodzen, przez które zwierzeta dzikie
lub walęsające się psy lub koty moglyby dostac się na fermę. Poza tym utrzymujac dobry stan ogrodzen minimalizujemy ryzyko ucieczki
zwierząt z fermy.
Musimy również ustalić protokoły bioochrony dla urządzen mechanicznych oraz personelu fermowego. Po pierwsze stworzenie bramek
ze środkiem odkażającym, który będzie zapobiegał przed wejsciem zarazków na fermę (na butach czy poprzez opony kół) a z drugiej
strony bramki uniemozliwą rozprzestrzenienie się zarazków poza fermę.
•Oznakowanie poszczególnych zwierząt
- pozwala na śledzenie statusu zdrowotności
13
identyfikacja czyli oznakowanie zwierząt, protokoly zdorowtności zwierzat gdzie zapisywane są: wykonywane zabiegi lekarskie i
profilaktyczne, rozpoznane choroby, ewentualne okresy izolacji czy kwarantany zwierząt, tu także powinny znależć się informacje
dotyczące ilości zwierząt w miocie i ilości zwierzat odchowanych, co jest niezwykle przydatne do przeprowadzenia przyszlego remontu
stada
•Szkolenie personelu w kierunku odróżniania stanu zdrowia od choroby u zwierząt
•codzienny przegląd zwierza
•czyszczenie i dezynfekcja sprzętu, ubrań oraz butów
•Przeprowadzanie badań sekcyjnych u zwierząt padłych z nieznanych przyczyn
•Przechowywanie szczepionek i antybiotyków.
•Wykonywanie podstawowych zabiegów pielęgniarskich przez odpowiednio przeszkolony personel.
Promienie słoneczne mogą dezaktywować szczepionkę czy preparaty lecznicze stad też szczepienie czy leczenie nie będzie skuteczne.
Warunki przechowywania szczepionek i antybiotyków są podane na opakowaniu. Reprodukcja
•Programy reprodukcji zwierząt
•zapłodnienie sztuczne
•zapłodnienie naturalne
Źródłem zakażenia może być również nasienie wywołując choroby kryjne które prowadza do ronień lub zaburzeń w rozrodzie. Dlatego tez
sztuczne zapłodnienie wydaje się bezpieczne rozpatrując je pod kątem źródła zakażenia, oczywiście pod warunkiem ze zostalo ono
pozyskane z odpowiedniego źródła i sprawdzone pod względem mikrobiologicznym. Oczywiście sam zabieg inseminacji powinien
bycprzeprowadzony w higienicznych warunkach.
Natomisat jeżeli na fermach stosuje się zapłodnienie naturalne, przed okresem krycia samce powinny być przebadane pod kątem chorób
zakaźnych. Bufor do przechowywania i mrożenia nasienia.
Immunoprofilaktyka swoista
MECHANIZMY ODPORNOŚCI
NIESWOISTE SWOISTE
• wrodzone • nabyte
• niespecyficzne • wybiórcze
• filogenetycznie starsze • filogenetycznie młodsze
• mało precyzyjne • precyzyjne
•szybkie • wolniejsze
GRANULOCYTY LIMFOCYTY T i B
NK
LIMFOCYTY T i B
Odporność swoista
Czynna Bierna

14
naturalna sztuczna naturalna sztuczna
Mechanizmy odpornościowe można podzielić na:
Typ odporności Przykłady
Odporność nieswoista (wrodzona naturalna) Fagocytoza, interferon, dopełniacz, naturalne bariery anatomiczne
Odporność nabyta
Naturalna przebycie zakażenia
Czynna
Sztuczna uodpornienie za pomocą różnego rodzaju szczepionek
Naturalna przeciwciała IgG matki w surowicy noworodka
Bierna
Sztuczna podanie surowicy odpornościowej, np. przeciwtężcowej
Czynniki zwiększające podatność na choroby zakaźne
§Urazy skóry, błon sluzowych
§§Szczepienia
§§Warunki utrzymania zwierząt: zagęszczenie, nieodpowiednia wilgotność, temperatura oraz oświetlenie pomieszczeń, zapylenie,
drażniące składniki powietrza (amoniak).
§§Choroby o przebiegu ostrym.
§§Niedobory żywieniowe: niedobór kaloryczny, niedobór białka, składników mineralnych, witamin.
1.Urazy skóry, błon sluzowych stanowia wrota zakażenia dla wirusa wscieklizny, zarodników tężca
2.Szczepienie – po iniekcji szczepionki zwłaszcza przeciwko chorobom wirusowym nastepuje przejsciowa immunosupresja co zwieksza
podatność na zachorowania lub uaktywnienie zakażeń utajonych
3. są przyczyna stresu powodującego obnizenie odporności a w efekcie zwiekszoną podatność na zakażenie i choroby
4.Indukują często przejscie zakażenia utajionego lub bezobjawowego w zakażenie jawne. U zwierzat chorych na nosówke często wtórnie i
rownoczesnie rozwija się salmoneloza.
5.Wpływają na wiele składowych odporności humorlanej i komórkowej powodując zaburzenia w odporności naturalnej i nabytej
Czynniki zwiększające podatność na choroby zakaźne
§Wpływy atmosferyczne: temperatura, wilgotność powietrza, opady atmosferyczne i wiatry.
§§Nadmierna eksploatacja.
§§Wiek i płeć zwierząt.
§§Pasożyty.
15
§§Bodźce środowiskowe (stresory)
Eksploatacja – czyli duzy wysiłek fizyczny, brak odpoczynku wpływaja
negatywnie na
odporno.ść przeciwzakaźną
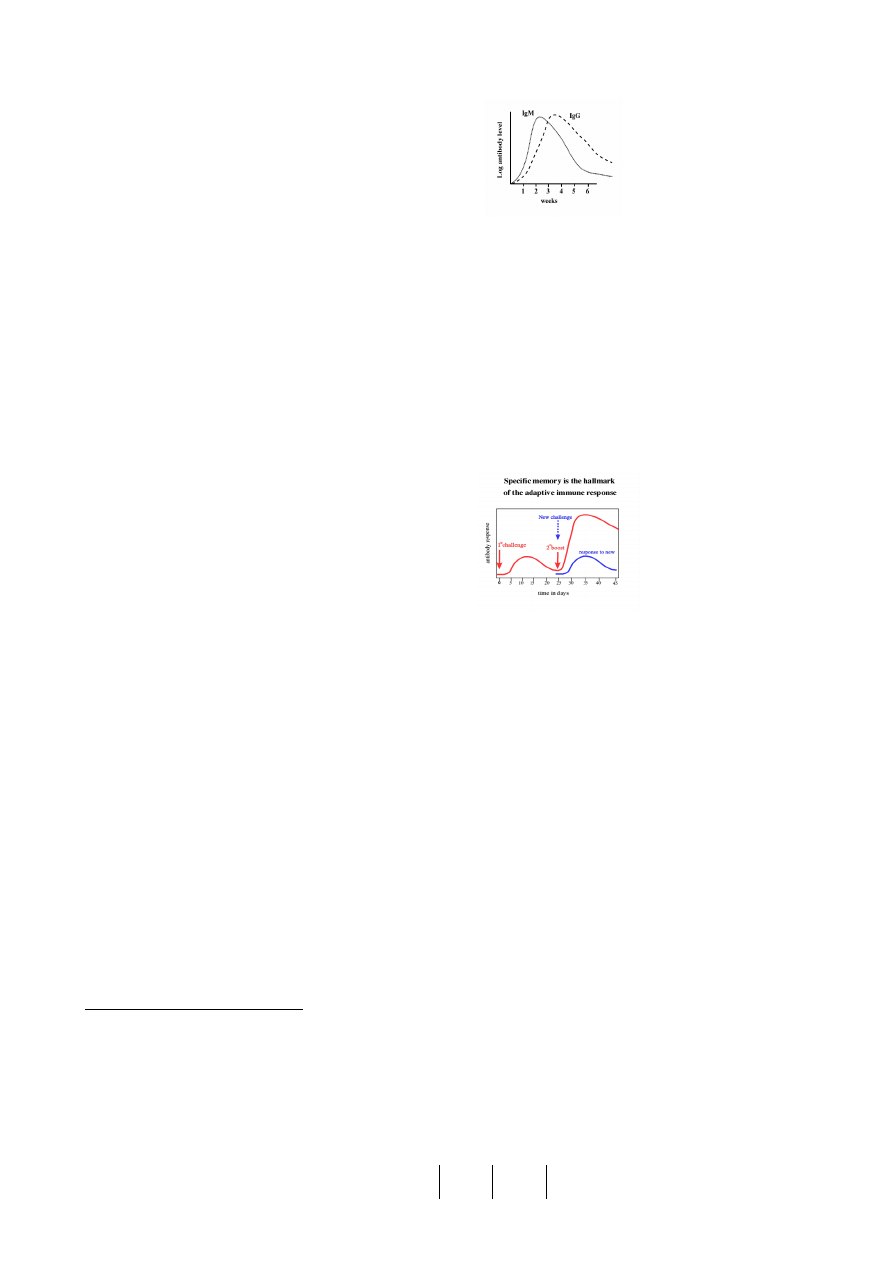
Pierwotna odpowiedź immunologiczna •Primary immune response
develops in the weeks
following first exposure to an antigen –Mainly IgM antibody
Charakter odpowiedzi imm. zależy od tego czy zwierze kontaktuje się z antygenami zawartymi w szczepionce bądź drobnoustrojem po raz
pierwsszy czy kolejny. Pierwotna odp. Imm pojawia się po pierwszej ekspozycji na antygen, z reguły po kilku-kilkunastu dniac, przy czym
początkowo miano przeciwciał jest niskie, wartośc max. Osiąga mniej więcej po 2 tyg, a nastepnie powili spada. W zakażeniach
wirusowych miano przeciwciał utrzymuje się dłużej niż w bakteryjnych. Najpierw pojawiają się Immunogl kl M, w dalszej kolejności
przeciwciala klasy IgG i IgA.
Wtórna odpowiedź immunologiczna •Secondary immune response is faster and more powerful ••Predominantly IgG antibody
Powtórna ekspozycja na ten sam antygen, nawet w małej dawce
wywołuje wtórną odpowiedź,
która jest skutkiem istnienia komórek pamięci immunol.
Pojawiających się w nastepstwie
pierwszego kontaktu z antygenem. W odpowiedzi wtórnej swoiste
przeciwciała, głównie IgG
pojawiają się w surowicy po 2-4 dniach, osiągając szybko wysokie
miano i utrzymują się dłużej w
krwioobiegu niż podczas odpowiedzi pierwotnej.
Najważniejsze cechy odpowiedzi immunologicznej:
•swoistość - wytwarzanie odpowiedzi skierowanej wobec ściśle określonego antygenu (czyli zarazek lub jego fragment zawarty w
szczepionce)
•istnienie pamięci immunologicznej pozwalającej na nasiloną odpowiedź zwana anamnestyczną – przy powtórnym wprowadzeniu
antygenu do organizmu
Cechy te zależą od etapu rozwoju filogenetycznego oraz dojrzalosci immunologicznej organizmu do wytwarzania odporności. Proces
immunologicznego dojrzewania jest zaprogramowany genetycznie i przebiega w grasicy.
•Najwyzsza sprawność do pobudzenia mechanizmow odpornosciowych przypada na okres dojrzewania anatomicznego i obniża się wraz z
wiekiem.
•Pełna dojrzalość immunologiczna •psy i lisy: 6 tydzień życia •Koty: 10-12 tydzien zycia
•norki, tchorzofretki, króliki, •nutrie: 6-10 tydzień życia
Pełna dojrzalość immunologiczna psy i lisy osiagają w wieku około 6 tyg życia, koty 10-12 tydzien, norki tchorzofretki króliki nutrie 6-10
tydz.
Potencjał immunologiczny siary i mleka
•Sposób przekazania odporności biernej
•Poziom immunoglobulin u fretki
Sposób przekazania odporności biernej z matki na potomstwo zależy od budowy łozyska. U zwierzat futerkowych tylko 5-10%
immunoglobulin przenika przez łozysko, reszta jest przekazywana wraz z siarą.
IgA IgM
IgG

16
Płód
brak 5%
24h po porodzie
22%
9 dzień życia
29%
13%
77%
% poziomu immunoglobulin w surowicy osobnika dorosłego
Potencjał immunologiczny siary i mleka
•Interferencja odporności czynnej
•Optymalny termin szczepień
•Potencjał immunologiczny siary
Odporność przekazana przez matke może przeciwdziałać nabywaniu odporności czynnej przez noworodki. Swoiste przeciwciała
przekazane przez łozysko oraz za pośrednictwem siary hamują wytwarzanie przeciwciał dla antygenów homologicznych w organizmie
szczeniąt. Co wiecej nastapi także zobojetnianie antygenów szczepionkowych przez swoiste przeciwciała matczyne oraz blokowanie im
dostepu do komórek immunologicznie kompetentnych – producentów przeciwcia ł w organizmie szczenięcia. Oznacza to ze szczepić
należy w określonym wieku, żeby zminimalizowac efekt supresyjny odporności biernej przekazanej im przez matke. U zwierząt
gospodarskich istnienie transferu odporności z matki na płód wykorzystuje się do zwiekszenia potencjału immunologicznego siary. W
tym celu immunizuje się cięzarne matki w ostatnim trymestrze ciązy, dwukrotnie.
Długość ciązy – krótka; zwierzeta stresogenne-poronienia po szczepieniu ciezarnych samic
Czynniki wpływające na czas utrzymywania się odporności matczynej:
••stan odporności matki
••wielkość puli immunoglobulin i limfocytów T przekazanych noworodkowi z siarą
••czas podania pierwszych porcji siary
••ilość pobranej siary
••zdolności wchłaniania siary z jelit noworodka
Oprócz_dojrzałości_immunologicznej_efektywność_szczepień_zalezy_od:
••rodzaju antygenu w użytego szczepionce, który posiada zdolność do pobudzania wytwarzania przeciwciał (immunogenność)
••zdolności do swoistego wiązania się z przeciwciałami
••Przykład silnego antygenu•wirus zawarty w szczepionce wściekliznowej, parwowirusowej lub anatoksyna botulinowa
••Słaby antygen o niskiej immunogenności•koronawirus, rota i herpeswirus.
•Szczepionki zawierające komponenty o słabych właściwościach antygenowych muszą być stosowane w dużych dawkach i przy użyciu
adiuwantów
W praktyce obserwuje się wystepowanie odczynow miejscowych a nawet ropni po zastosowaniu amerykanskiej szczepionki Entox oraz
szwedzkiej Nord-camtrip (zap. Jelit norek, anatoksyna Cl. Botulinum, Pseudomonas aeruginosa) Adiuwantem jest wodorotlenek gliny
który wywoluje stany zapalne w miejscu podania u malych psow rasowych, lisow i norek. Dlatego wprowadzono adiuwanty olejowe które
maja mniejsze dzialanie uboczne
••U zwierząt mięsożernych przeciwciała przeciwko nosówce przekazywane przez matkę na potomstwo zarówno z siarą (ok. 90%) jak i
przez łożysko (10%) mogą zanikać między 6 a 16 tygodniem życia, najczęściej około 12 tygodnia.
••Przeciwciała przeciwko wirusowej chorobie Rubartha (zakaźne zapalenie mózgu lisów) zanikają około 6 tygodnia życia

17
••Matki szczepione przed kryciem, a także mające styczność z zarazkami znajdującymi się stale w środowisku zewnętrznym, mają
wysokie miana przeciwciał.
••Szczenięta od tych matek powinny być szczepione nie wcześniej niż około 10 tygodnia życia, ponieważ wysoki poziom przeciwciał
matczynych może być przeszkodą w powstaniu pełnej odporności.
••Wcześniejsze szczepienie przed 10 tygodniem życia wymaga powtórnego uodpornienia zwierząt po okresie 3 tygodni.
Okres pełnej dojrzałości immunologicznej i zanikania przeciwciał matczynych:
••8-10 tydzień życia u lisów, norek i psów
••10-12 tydzień życia u kotów
•Jest to optymalny termin wykonania pierwszych szczepień profilaktycznych.
•Szczepienie należy powtórzyć po 3-4 tygodniach.
Jednakze wprzypadku zagrozenia choroba zakaźną lekarz weterynarii sprawujący opiekę nad zwierzętami decyduje o terminie i kolejności
wykonywania szczepień. W przypadku autoszczepionek należy wczesniej wykonac próbę na kilkunajsłabszych zwierzętach.
Efektywność szczepień zależy od:
•dojrzałości immunologicznej organizmu, związanej z wiekiem
•rodzaju użytego antygenu
•zjawiska immunosupresji i sprawności układu odpornościowego
Istnienie pamięci immunologicznej i swoista czynna odpowiedź organizmu na dany antygen wskazują iż rozważanie na temat czy
szczepimy szczepionka pojedyncza czy skojarzona nie ma praktycznego znaczenia, szczególnie gdy używamy wysoce oczyszczonych
antygenów. Jedynie w sytuacjach zagrożenia choroba zakaźna lub kiedy istnieje konieczność szczepienia zwierząt zarobaczonych lub
niedożywionych, leczonych wcześniej antybiotykami istnieją wskazania do wykonywania szczepień przy użyciu szczepionek
monowalentnych.
Przyczyny niepowodzeń szczepień
••Szczepienie zwierząt w okresie inkubacji choroby.
••Immunosupresja organizmu.
••Mala immunogenność lub utrata aktywności szczepionki.
••Brak odpowiedzi immunologicznej na antygen szczepionkowy, obniżona reaktywność oraganizmu na komponenty szczepionkowe.
••Obecność odporności matczynej.
••Przełamanie działania ochronnego przez duże dawki patogenu lub jego bardzo zjadliwe szczepy.
1.Skuteczna odporność pojawia się po tygodniu – dwóch od podania szczepionki, zaszcxzepienie w okresie inkubacji choroby nie
zapobiegni ezachorowaniu ponieważ swoista odpornośc nie zdaży si erozwinać
2.Odpowiedz imm w okresie immunosupr jest słaba, szczepienie wiec nie daje spodziewanych rezultatów, immunosupresja towrzyszy
często zwierzetom wyniszczonym, głodzonym
3.Przechowywanie niezgodne ze wskazaniami producenta może spowodowac utrate jej aktywności, szczepionki traca immunogenność
po upływie terminu wazności, szczepionki liofilizowane tracą aktywnosc gdy uzyjemy inego rozpuszczalnika niż zaleca producent lub ni
euzyjemy ich bezposrednio po rozpuszczeniu
4. Stad tez nie wskazane jest szczepienie zwierzat charłaczych, xle odzywionych ponieważ sprawnosc mech odpornosciowych jest slabsza
•Wiek zwierząt w jakim należy rozpocząć szczepienia szczeniąt.
•Luka immunologiczna – okres życia, w którym nie ma już odporności matczynej, a odporność poszczepienna jeszcze się nie wytworzyła.
Na ten temat istnieje wiele rozbieżnych zdań. Generalnie idealnym rozwiązaniem jest szczepienie w takim wieku żeby odporność czynna
wywołana przez podanie szczepionki osiągnęła miana ochronne jeszcze przed zanikiem odporności matczynej

18
Parwowiroza – luka immunologiczna
Szczepienia szynszyli
•pseudomonadoza
•kolibakterioza
•jerszinioza
CHOROBY NIEZAKAŹNE
Choroby niezakaźne lisów i norek stanowią około 70 % przyczyn strat w hodowli.
Składają się na nie:
• zaburzenia w rozrodczości,
• choroby okresu okołoporodowego
• choroby odchowu szczeniąt
• choroby przemiany materii
O ile w przypadku chorób zakaźnych z reguły można znaleźć ich przyczynę, to w odniesieniu do chorób niezakaźnych trudno jest postawić
wczesne i pewne rozwiązanie gdyż przyczyn tych stanów chorobowych jest wiele. Są to okoliczności nakładające się wzajemnie i z reguły
dotyczą błędów chowu, żywienia i pielęgnacji.
Encefalopatia wątrobowa
Jest następstwem niewydolności wątroby w przebiegu przebytych ostrych lub przewlekłych chorób wątroby, objawiających się zespołem
zaburzeń neurologicznych, takich jak:
- niezborność ruchowa
- podniecenie, drgawki
- kręcenie się w koło lub wzdłuż osi długiej ciała
- upośledzenie widzenia
- w ostrej fazie choroby drgawki i śpiączka
¬Schorzenie o etiologii wieloczynnikowej.
¬ Objawy są często odwracalne, ponieważ w wielu przypadkach nie dochodzi do trwałych uszkodzeń mózgu, wątroby i nerek.
¬Encefalopatii wątrobowej towarzyszy niedobór witamin B1 i B12.
Mechanizm powstania zaburzeń neurologicznych ze strony CUN wiąże się z nagromadzeniem we krwi substancji toksycznych
(encefalotoksyn):
¬¬amoniaku
¬¬kwasu gamma aminomasłowego (GABA)
¬¬krótkołańcuchowych kwasów tłuszczowych, merkaptanów
¬¬różnych tzw. fałszywych neuroprzekaźników (tyramina, aktopamina, tryptofan) i endogennych ligandów receptorów benzodiazepin
¬Złożona patogeneza objawów chorobowych ze strony CUN ma miejsce wówczas, gdy substancje toksyczne we krwi nie są unieczynnione
w wątrobie (silne uszkodzenie komórek, marskość, zwyrodnienie, zapalenie) i krążeniem wrotnym dostają się do krwioobiegu.

19
¬¬Po przekroczeniu bariery krew-mózg przedostają się do centralnego układu nerwowego, powodując zaburzenia przemian
metabolicznych w mózgu i transportu chlorków w neuronach.
Dziedziczna tyrozynemia
¬Choroba po raz pierwszy została opisana w 1973 roku w USA.
¬Została nazwana pseudonosówką z powodu jej klinicznego podobieństwa do nosówki norek.
¬Tyrozynemia , dawniej tyrozynoza - choroba genetyczna będąca skutkiem recesywnej mutacji autosomalnej.
¬¬Istnieją 2 postacie choroby:
tyrozynemia I w której efektem tej mutacji jest brak enzymu hydroksylazy fumaryloacetooctanowej (FAH)
oraz tyrozynemia II z niedoborem aminotransferazy tyrozynowej TAT.
¬¬W moczu pojawia się nadmiar tyrozyny i jej metabolitów.
¬Skutkiem jest uszkodzenie narządu wzroku, a także uszkodzenie wątroby z rozwojem raka wątroby oraz uszkodzenie nerek z krzywicą
hipofosfatemiczną.
¬Leczenie: dieta eliminacyjna uboga w tyrozynę i fenyloalaninę
Objawy kliniczne
¬¬obrzęki i nadżerki na opuszkach łap
¬¬owrzodzenia na nosie
¬¬ślepota
¬¬uszkodzenie nerek
¬Badania biochemiczne krwi
- niedobór enzymów wątrobowych – aminotransferazy tyrozynowej TAT
- 20-100 krotny wzrost poziomu tyrozyny we krwi
Młode norki zachorowania pojawiają się w 6-7 tygodniu życia
¬surowiczy wypływ z oczu
¬zmętnienie rogówki
¬Po 24-48 godzinach:
¬zapalenie spojówek, wrzody rogówki, wrzodziejące zapalenie skóry poduszek łap
¬padnięcia po 2-3 dniach od zaobserwowania pierwszych objawów choroby
¬Pierwsze objawy choroby mogą pojawić się również w wieku 3 miesięcy, 6 miesięcy a nawet przed ubojem (forma jesienna).
¬przebieg kliniczny choroby jest mniej ostry a zwierzęta padają po miesiącu od wystąpienia pierwszych objawów choroby
¬utrudnieniem w rozpoznaniu tej choroby jest zbliżony do normalnego poziom TAT
Zaburzenia metaboliczne procesów powodują niewystaczające zmiany w wydzielaniu tyrozyny i fenyloalaniny, co powoduje ze
poziom TAT pochodzenia wątrobowego jest normalny
¬Tyrozyna w postaci kryształów wewnątrz komórek uszkadza strukturę lizosomów i przez to powoduje wydzielanie enzymów
proteolitycznych i czynników chemotaktycznych.
¬Infiltracja neutrofili powoduje przewlekły stan zapalny.
20
Zmiany anatomo-patologiczne
¬nerki są blade, nieznacznie powiększone lub ich rozmiar jest mniejszy wraz z nieregularną strukturą torebki.
¬poszerzenie kanalików nerkowych w następstwie zbliznowacenia i zalegania moczu.
¬obecność kryształków w miedniczce nerkowej oraz pęcherzyku żółciowym.
¬wrzody rogówki z przewlekłym ropnym zapaleniem zrębu rogówki
¬zmiany zapalne oraz martwica poduszek łap i nosa
¬owrzodzenie grzbietowej części języka
Leczenie i zapobieganie
¬Dieta uboga w fenyloalaninę i tyrozynę!
¬Eliminacja z hodowli zaatakowanego przychówka oraz osobników rodzicielskich.
¬Dobra dokumentacja hodowli – podstawą eliminacji ze stada zagrożonych chorobą norek.
¬Choroba występuje tylko u osobników homozygotycznych pod względem tej cechy.
¬Wszystkie norki homozygotyczne są bezobjawowymi nosicielami i powinny być usunięte ze stada.
¬Z tego powodu rodzeństwo chorych zwierząt, osobniki rodzicielskie oraz potomstwo powinny być ubijane.
Choroba żółtego tłuszczu
Nieropne zapalenie tkanki podskórnej tłuszczowej
¬Choroba występuje najczęściej u norek ale znana jest tez u innych gatunków zwierząt, np. świń które żywione są dużą ilością tłuszczu
rybiego i paszami oleistymi.
Etiologia
¬Przyczyną choroby jest nadmiar tłuszczu w karmie, zwłaszcza wielonienasyconych kwasów tłuszczowych obecnych w rybach, tłuszczu z
drobiu i końskim oraz w tranie, przy jednoczesnym niedoborze witaminy E i nie konserwowaniu karmy przeciwutleniaczami.
¬Długie przechowywanie w stanie zamrożenia, bez udziału przeciwutleniaczy powoduje jełczenie tłuszczów i ich toksyczne oddziaływanie
na organizm.
¬Zniszczeniu ulegają egzogenne kwasy tłuszczowe i witaminy.
¬Ponadto, tłuszcz utleniony może niszczyć wartościowe składniki pokarmowe: biotynę, ryboflawinę, kwas askorbinowy, kwas
pantotenowy. ¬Tłuszcz utleniany wchodzi również w interakcję z białkami, tworzy nierozpuszczalne polimery zmniejszające
przyswajalność białek.
¬Zjełczałe tłuszcze na skutek eliminowania witaminy E, selenu i niektórych aminokwasów prowadzą do wystąpienia dystrofii mięśni
szkieletowych, a także serca.
Objawy kliniczne
Przebieg ostry
¬młode norki – brak apetytu, początkowo silne podniecenie, a następnie osłabienie, śpiączka i zejście śmiertelne
¬norki dorosłe – spadek kondycji, zmniejszenie apetytu, biegunka, ciemne zabarwienie kału i moczu, drgawki, porażenie kończyn tylnych,
obrzęki w okolicy pachwin i podbrzusza
Obraz krwi:
leukocytoza, anizocytoza, polichromazja, spadek poziomu hemoglobiny
Zmiany anatomopatologiczne

21
¬tkanka podskórna galaretowato nacieczona o brązowym zabarwieniu tłuszczu.
¬w jamach ciała zwiększona ilość krwisto-żółtego płynu
¬śledziona powiększona z krwawymi wylewami
¬mięsnie szkieletowe żóławo zabarwione i zwyrodniałe
Leczenie i zapobieganie
¬Wyeliminować z żywienia złej jakości tłuszcze
¬Karmę należy konserwować – antyutleniacz Rendox
¬Wprowadzić do żywienia witaminę E (15-30 mg/1kg karmy) i selen
¬Korzystne jest skarmianie świeżą wątrobą, chudym mięsem i kiełkami zbożowymi
CHOROBY UKŁADU MOCZOWEGO
¬kamica moczowa (urolithiasis)
¬zapalenie pęcherza moczowego (cystitis)
Kamica moczowa
Czynniki usposabiające:
¬Zasadowy odczyn moczu (norma pH 6,4-7,5)
¬żywienie karmą przemysłową z dużym udziałem składników mineralnych
¬zakażenia bakteryjene dróg moczowych (Micrococcus sp., Proteus mirabilis, Staphylococcus aureus, E. coli)
Kamica struwitowa
¬Złogi magnezowo-amonowo-fosforanowe - najczęściej o ostrych krawędziach
¬Złogi powstają w wyniku zakażenia dróg moczowych przez drobnoustroje rozkładające mocznik (Proteus mirabilis).
¬Występują one w moczu alkalicznym i tworzą kamienie odlewowe miedniczki i kielichów oraz kamienie pęcherzowe.
¬Radiologicznie dają cienie o słabym wysyceniu.
¬Powstają również kamienie o budowie mieszanej - w wyniku zaburzeń przemiany materii, do których dołącza się cz. struwitowa
powstała wskutek zakażenia
¬Złogi lub kamienie mogą być przyczyną niedrożności układu moczowego wywołanej obecnością kamienia w miedniczce, moczowodzie
lub pęcherzu moczowym.
¬Kamienie struwitowe mogą przejściowo lub trwale zablokować odpływ moczu, doprowadzić do zniszczenia nerki (wodonercza)
lub zakażenia.
Objawy kliniczne
¬Kamica moczowa może występować u 6-8 tygodniowych norcząt ale pełny obraz chorobowy występuje w wieku 3-4 miesięcy.
¬Przebieg choroby może być ostry lub przewlekły.
¬Szczególne nasilenie procesu chorobowego obserwuje się u samic w drugiej połowie ciąży i laktacji.

22
¬Stopniowa utrata apetytu i kondycji, utrudnione oddawanie moczu z domieszką krwi lub ropy.
¬W końcowej fazie – porażenie zadu, śpiączka uremiczna i zejście śmiertelne.
Zmiany anatomo-patologiczne
¬wychudzenie zwłok (zapach moczu)
¬obecność ziarenek piasku lub kamieni w cewce moczowej i/lub pęcherzu moczowym
¬zgrubienie ściany pęcherza moczowego oraz zmiany zapalne na błonie śluzowej
¬wodonercze
Rozpoznanie
¬objawy kliniczne i zmiany sekcyjne
¬badanie fizykochemiczne i bakteriologiczne moczu
¬przy masowym wystąpieniu kamicy w stadzie - badania biochemiczne krwi (profil nerkowy)
¬USG, RTG
Badania biochemiczne
¬profil kontrolny (ogólny) - sód, potas, chlorki, mocznik, kreatynina, bilirubina, AST, ALT, fosfataza alkaliczna, gamma-
glutamylotransferaza GGT, albumina, białko całkowite, wapń, fosfor, kwas moczowy
¬profil nerkowy - sód, potas, mocznik, kreatynina
¬profil wątrobowy - transaminazy (alaninowa i asparaginianowa) gamma-glutamylotransferaza (GGT), fosfataza alkaliczna, bilirubina,
albumina
¬profil kostny - białko całkowite, albumina, wapń, fosfor, fosfataza alkaliczna
¬profil sercowy - transaminazy (asparaginianowa i alaninowa), kinaza kreatynowa, dehydrogenaza mleczanowa, potas
¬profil lipidowy - cholesterol, triglicerydy, cholesterol HDL
¬profil tarczycowy - TSH, w T4
Leczenie i postępowanie
¬brak skutecznego leczenia
¬zmiana higieny karmy
¬obniżenie pH moczu
¬antybiotyki (tetracykliny)
¬witamina A
¬samice w ostatnich dniach ciąży można poddać zabiegowi chirurgicznemu ratując w ten sposób około 30% szczeniąt, ale bardzo rzadko
ich matkę
Zapobieganie
¬Obniżenie pH karmy
¬-kwas foliowy H3PO4 w ilości 0,6-1% całości karmy
-chlorek amonu NH4Cl w ilości 1g/kg m.c.
Nie obserwuje się albo bardzo rzadko występowanie kamicy w fermach, gdzie konserwuje się karmę pirosiarczynem sodu i
antyutleniaczem

23
Rendox
ZATRUCIA POKARMOWE MIĘSOŻERNYCH ZWIERZĄT FUTERKOWYCH
Straty w hodowli:
-zaburzenia w reprodukcji (brak rui, obniżenie plenności, częste ronienia, rodzenie martwych szczeniąt, bezmleczność lub niska laktacja)
-obniżenie przyrostów masy ciała, zahamowanie rozwoju
-wysoka śmiertelność zwierząt młodych.
Podstawową przyczyną zatruć pokarmowych jest brak higieny żywienia
-odpowiedni stan sanitarny pasz i karmy oraz pomieszczeń i urządzeń służących do transportu, przechowywania, przygotowywania i
zadawania karmy.
Niewłaściwe zabezpieczenie surowców pochodzenia zwierzęcego - namnażanie się bakterii saprofitycznych i chorobotwórczych (toksyny),
toksyczne produkty w procesie rozpadu substancji białkowych (proces gnicia) i rozkładu tłuszczów (proces hydrolizy i oksydacji).
Głównym mechanizmem chorobotwórczego działania są toksyny
-uwalniane bezpośrednio do surowców paszowych (intoksykacje) w czasie intensywnego namnażania się bakterii i grzybów
-lub dopiero po wniknięciu zarazka do organizmu (toksoinfekcje) - egzotoksyny (enterotoksyny gronkowcowe, termolabilna LT i
termostabilna enterotoksyna ST oraz cytotoksyny - E. coli, toksyna botulinowa, mykotoksyny) lub endotoksyny (LPS) w wyniku rozpadu
komórki bakteryjnej
ZATRUCIA POKARMOWE TOKSYNAMI BIOLOGICZNYMI
-Enterotoksyny LT i ST – zaburzają transmisję elektrolitów z naczyń krwionośnych do światła jelit, efektem jest biegunka, zmiany
degeneracyjne w kom. bł. śluzowej p. pokarmowego.
-Enterotoksyny gronkowcowe (A, B, C1, C2, C3, D, E, G i H) - są superantygenami, wywołują stany immunosupresji, stan zapalny bł.
śluzowej jelit, hamują absorpcję wody ze światła jelit (biegunka).
-Endotoksyny (LPS) - powoduje zapalenie i uszkodzenie wielu narządów wewnętrznych (śledziona, wątroba, płuca, OUN, p. pokarmowy
oraz zaburza odpowiedź immunologiczną (np nadmierne uwalnianie IL-1 przez zaburzone czynnościowo makrofagi).
Mykotoksykozy
Zatrucia mykotoksynami wytwarzanymi przez grzyby pleśniowe, namnażające się na produktach roślinnych lub paszach pochodzenia
roślinnego.
-Są niewrażliwe na działanie wysokich temperatur.
-Przebiegają w formie ostrej lub przewlekłej.
-Postać ostra rozwija się w wyniku przyjęcia w krótkim czasie wysokiej dawki toksyny.
-Przechowywanie zbóż w temp. w 15-300C i względnej wilgotności substratów w granicach 14-25%, stanowią sprzyjające warunki do
wzrostu grzybów i wytwarzania mykotoksyn.
W różnym stopniu wykazują działanie kancerogenne, mutagenne, teratogenne i estrogenne.
W zależności od dawki i okresu podawania powodują
-utratę łaknienia i wymioty (deoksyniwalenol - womitoksyna)
-zaburzenia funkcjonalne w narządach wewnętrznych: wątroba (aflatoksyny), nerki (ochratoksyny A)

24
-zaburzenia płodności (zearalenon)
-zmiany w obrazie ilościowym i jakościowym krwi obwodowej
Mykotoksykozy
u samic mogą być przyczyną zapaleń macicy, zamieralności zarodków lub płodów oraz ronień
-wszystkie mykotoksyny powodują zmniejszenie wykorzystania paszy i ogólnym pogorszeniem zdrowotności zwierząt
-jako silne immunosupresory hamują nieswoistą i swoistą odpowiedź immunologiczną, szczególnie typu komórkowego
-efektem zwiększona wrażliwość zwierząt na infekcje oraz mniejsza skuteczność szczepionek stosowanych w swoistej
immunoprofilaktyce lisów i norek
AFLATOKSYKOZY
-Grupa wtórnych metabolitów toksynotwórczych szczepów Aspergillus flavus i Aspergillus parasiticus.
-W Polsce, podobnie jak i w innych krajach Europy, w 12,7% próbek badanych pasz wykazano obecność aflatoksyn.
-W warunkach naturalnych występuje 6 rodzajów aflatoksyn: B1, B2 i B2a oraz G1, G2 i G2a
-Prócz tego wydalane są z mlekiem aflatoksyny M1 i M2 będące produktami rozpadu aflatoksyn w organizmach zwierzęcych.
-Aflatoksyny powodują zmiany w strukturze składników DNA i indukują mutacje genowe.
-Hamują syntezę wielu białek, szczególnie enzymów metabolicznych i białek strukturalnych .
-Wywierają silne działanie immunosupresyjne.
Dzienne spożycie przez norkę 5µg aflatoksyny przez okres czterech tygodni wywołuje:
-procesy degeneracyjne w wątrobie (martwica i stłuszczenie)
-stany zapalne błony śluzowej żołądka, jelit i macicy
Przyczyną zejścia śmiertelnego jest kumulacja tłuszczów w komórkach wątroby w wyniku zaburzonego ich metabolizmu.
Aflatoksykoza u mięsożernych zwierząt futerkowych manifestuje się
-brakiem apetytu
-ogólnym osłabieniem
-zahamowaniem przyrostów masy ciała
-wyniszczeniem
-w końcowym stadium choroby stwierdza się objawy żółtaczkowe oraz zaburzenia w reprodukcji
AFLATOKSYKOZY
-Następstwem hepatotoksycznego oddziaływania aflatoksyn są zaburzenia w układzie krzepnięcia (wydłużenie czasu krzepnięcia,
zaburzenie wytwarzania protrombiny, skazy krwotoczne).
-W krwi stwierdza się wzrost fosfatazy zasadowej i cholesterolu.
-Bezpośrednią przyczyną zejść śmiertelnych jest rozległe zwyrodnienie tłuszczowe i martwica wątroby.
Rozpoznanie i postępowanie
-przyżyciowe rozpoznanie jest dość trudne ze względu na brak objawów typowych.
-wstępne rozpoznanie można postawić na podstawie wyników badań sekcyjnych i histopatologicznych.

25
*W odróżnieniu od egzotoksyn bakteryjnych mikotoksyny są związkami chemicznymi o niskiej masie cząsteczkowej, nie mającymi z reguły
właściwości immunogennych.
*W związku z tym ich obecność można stwierdzić prawie wyłącznie przy pomocy metod chromatograficznych (chromatografia
cienkowarstwowa lub powinowactwa), a tylko niekiedy przy użyciu testów immunoenzymatycznych np. test ELISA.
*Sama obecność szczepów grzybów toksynotwórczych czy też nie toksynotwórczych nie jest równoznaczna z obecnością lub brakiem
mykotoksyn; konieczne są testy stwierdzające kontaminację badanego materiału samymi toksynami.
*Brak leczenia przyczynowego.
*Po rozpoznaniu w pierwszej kolejności odstawić porażoną paszę oraz zastosować leczenie objawowe z uwzględnieniem preparatów
witaminowych, mineralnych, szczególnie selenu.
*Jako adsorbent podaje się węgiel aktywowany.
*W profilaktyce nieswoistej podstawowe znaczenie ma kontrola toksylogiczna pasz, zwłaszcza importowanych z krajów o klimacie
tropikalnym.
FUZARIOTOKSYKOZY
Zatrucia w wyniku zjadania paszy zawierającej toksyczne produkty grzybów z rodzaju Fusarium
Produkują toksyny
-estrogenne (zearalenon)
-wywołujące wymioty (trichoteceny)
-toksyny o dzialaniu hepato- i nefrotoksycznym (fumonizyny)
-upośledzające hemopoezę (T-2 i jej pochodna HT-2)
Fuzariotoksyny wraz z paszą dostają się do przewodu pokarmowego, a następnie drogą hematogenną osiągają narządy wewnętrzne.
Zróżnicowana patogeneza fuzariotoksykoz wynika z odmiennych właściwości uwalnianych toksyn.
Przebieg zatrucia zależy od wieku zwierzęcia oraz ilości i rodzaju toksyny.
Najbardziej podatne są zwierzęta młode i samice ciężarne.
ZEARALENON
-Zearalenon jest drobnocząsteczkowym związkiem pochodnym kwasu fenolorezorcynowego - niesteroidowym makrolidem pozbawionym
właściwości antygenowych.
-Pasza zwierająca zearalenon posiada właściwości estrogenne przy czym najbardziej podatne na jej działanie są zwierzęta
monogastryczne.
-Obecność pierścienia fenolowego w cząsteczce zearalenonu umożliwia wiązanie się z komórkowymi receptorami estrogenów
występującymi w macicy, pochwie, jajnikach i jajowodzie, przez co wzmaga się proliferacja komórek oraz dochodzi do zwiększonej
syntezy RNA i białek w komórkach układu rozrodczego.
-we wczesnym okresie ciąży zearalenon powoduje zamieranie zarodków
-w późniejszym okresie ciąży - ronienia lub rodzenie martwych płodów, zapalenie macicy oraz permanentną ruję
W badaniach eksperymentalnych wykazano, że zearalenon w dawce 30 mg/kg karmy podawany przez 28 dni (przed okresem uboju)
powodował u norek niedorozwój lub degenerację jajników.
ZANIECZYSZCZENIA CHEMICZNE

26
*Zatrucie metalami ciężkimi
-Przemysł, motoryzacja i chemizacja przyczyną wzrostu skażenia środowiska naturalnego różnymi związkami chemicznymi.
-Związkami zanieczyszczającymi środowisko i gromadzącymi się w łańcuchu pokarmowym zwierząt i człowieka są metale ciężkie - „metale
toksyczne”.
-U lisów i norek najczęściej zatrucia rtęcią i ołowiem.
Zatrucie rtęcią
-Ważnym problemem są skażenia powietrza, szczególnie parami rtęci oraz zanieczyszczenia wód i w efekcie duża koncentracja rtęci w
rybach.
-Ryby oraz odpady rybne stosowane w żywieniu lisów i norek stwarzają potencjalne możliwości wystąpienia u nich zatruć rtęcią.
-Zatrucia tzw. rtęcice obserwowano u ludzi, kotów (obok bydła są najbardziej wrażliwe na zatrucia rtęcią) i ptaków morskich
spożywających w dużej ilości ryby.
Rtęć i jej związki mogą dostawać się do organizmu
-z wdychanym powietrzem (pary rtęci)
-drogą pokarmową: rtęć metaliczna
-przez skórę i błony śluzowe
-Pary rtęci z krwi w dużej część przenikają do tkanki mózgowej.
-Natomiast związki nieorganiczne rtęci po dostaniu się drogą pokarmową odkładają się głównie w nerkach (90%), w wątrobie, kościach,
szpiku, włosach.
-W organizmie związki organiczne szybko przechodzą w nieorganiczne.
-Z organizmu rtęć jest wydalana głównie z moczem, w mniejszej ilości z kałem.
Mechanizm działania toksycznego rtęci
-uszkodzenie błon komórkowych, nerek, OUN i ścian naczyń włosowatych
-zapalenie płuc
-działanie teratogenne i embriotoksyczne na zarodki
Zatrucie rtęcią
-Norki są b. wrażliwe na zatrucia rtęcią metylowaną, odporne na jej formy nieorganiczne występujące w karmie.
-Karmione paszą zawierającą 5 ppm rtęci metylowanej wykazują po 25 dniach objawy przewlekłej choroby rtęciowej, która kończy się
zejściem śmiertelnym 30-37 dniem jej podawania.
-U norek po zatruciu rtęcią obserwuje się anoreksję, brak koordynacji ruchów, utratę masy ciała, paraliż, napadowe drgawki, głośny pisk.
Po uchwyceniu za ogon u chorych norek stwierdza się charakterystyczne krzyżowanie kończyn.
Rozpoznanie
-oznaczanie obecności rtęci w paszach i treści przewodu pokarmowego, krwi, narządach miąższowych (przede wszystkim w nerkach) oraz
we włosach.
Zatrucia ołowiem
-Źródłem Pb i jego związków - zanieczyszczone powietrze, skażone rośliny zbożowe, szczególnie rosnące w okolicach dróg o dużym
natężeniu ruchu.

27
-Pb wnika drogą pokarmową (wchłanianie od 10-25% dawki - najłatwiej sole, najtrudniej ołów metaliczny); drogą oddechową
(wchłanianie jest 10 razy łatwiejsze), nieuszkodzoną skórę (połączenia organiczne).
-Zatrucie Pb u mięsożernych zwierząt futerkowych po spożyciu karmy zanieczyszczonej Pb, wody i dodatków dodawanych do paszy.
-Dodatkowym jego źródłem są farby ołowiowe z powierzchni klatek, gazy spalinowe, pył glebowy, osady ścieków przemysłowych
używane do użyźniania gleby
-Ołów po wchłonięciu odkłada się: wątrobie, nerkach, płucach i sercu -. tzw. pula szybkowymienna, w dalszej kolejności skóra i mięśnie -
pula o średniej szybkości wymiany.
-Pulą wolnowymienną są kości, w mniejszym stopniu zęby i włosy (stężenie Pb zwiększa się przez całe życie).
-Eliminacja Pb z ustroju głównie poprzez układ moczowy (ok. 76%), z kałem 16%.
-Najbardziej toksyczne są związki ołowiu rozpuszczalne w płynach ustrojowych, które po wchłonięciu z przewodu pokarmowego dostają
się żyłą wrotną do wątroby, skąd część ich zostaje wraz z żółcią wydalona do dwunastnicy, a następnie z kałem na zewnątrz.
-Pozostała część w stanie niezmienionym przenika do krwi i łączy się z jej białkami, głównie białkami erytrocytów (do 98%), wywołując
objawy zatrucia.
-Zawartość Pb we krwi jest czułym wskaźnikiem zagrożenia organizmu.
-Interakcje zachodzące między Pb a innymi pierwiastkami mają istotny wpływ na zaburzenia metabolizmu pierwiastków niezbędnych do
życia.
-Wzrost stężenia Pb przyśpiesza wydalanie z organizmu Fe i Cu.
-Ołów hamuje syntezę ceruloplazminy uczestniczącej w metabolizmie Fe i Cu.
Działanie toksyczne ołowiu polega na zaburzaniu funkcji układów
-krwionośnego i krwiotwórczego: zaburzenie syntezy hemu, upośledzenie erytropoezy, uszkodzenie i zwężenie naczyń włosowatych.
-nerwowego: zaburzenia strukturalno-czynnościowe OUN, wypieranie Cu, Zn, Fe z enzymów mózgowych, zmniejszenie szybkości
przewodnictwa nerwowego, działanie na ukł. wegetatywny p. pokarmowego i układu naczyniowego
- pokarmowego: zaburzenia perystaltyki, napady kolki ołowiczej, owrzodzenia
-rozrodczego: u samic zaburzenia owulacji, u samców uszkodzenia jąder, upośledzenie spermatogenezy, zmiany jakościowe plemników
-Ołów nagromadzony w tkankach nie powoduje początkowo zatrucia.
-Przejście od stanu nietoksyczności do zmian patologicznych jest stopniowe i dlatego ustalenie toksycznych dawek ołowiu jest trudne.
-Niebezpieczne są głównie przewlekłe zatrucia - pasze o niewielkiej ilości Pb podawane przez dłuższy czas.
- Brak często wyraźnych objawów klinicznych przy znacznej kumulacji Pb w tkankach.
Objawy przewlekłego zatrucia Pb u lisów i norek
-anoreksja
-brak koordynacji mięśniowej
-sztywność
-drżenia
-odwodnienie
-konwulsje
-śluzowo-ropny wypływ ze spojówek
Rozpoznanie
28
-wywiad toksykologiczny
-charakterystyczne objawy i zmiany sekcyjne
-badania laboratoryjne:
–
przyżyciowo: oznaczanie zawartości Pb w krwi – norma stężenia Pb we krwi ludzi i zwierząt wynosi od 10-40 mg/100
ml
–
pośmiertnie: oznaczanie Pb w wątrobie, nerkach, mięśniach oraz włosach
WYKŁADY
CHOROBY ZAKAŹNE LISÓW I NOREK
Zakażenia parwowirusowe norek
-Parwowirusy u norek i lisów należą do podgrupy parwowirusów kocich, rodzaju Parvovirus (Parvoviridae).
-Są to najmniejsze bezotoczkowe wirusy zawierające jednoniciowy, liniowy DNA. Kapsyd (3 białka strukturalne VP1, VP2,
VP3 i dwa regulacyjne (NS1, NS2)
-Znaczne pokrewieństwo genomów parwowirusów norek, kotów, psów i lisów niebieskich (95% homologii)
-Niewielkie różnice występujące w obrębie genu kodującego białko VP2 determinują wąskie spektrum zakaźne zarazka,
które ogranicza się do danego gatunku zwierząt.
Choroba aleucka norek (morbus aleutica lutreolarum, aleutian disease)
Przewlekła i nieuleczalna choroba norek powodująca duże straty ekonomiczne w hodowli.
W zapowietrzonych fermach obserwuje się niską plenność, częste ronienia i wysoką śmiertelność osesków w pierwszych
dniach po urodzeniu oraz liczne padnięcia kilkumiesięcznych norek.
Etiologia choroby
-Bezotoczkowy parwowirus AMDV (Aleutian Mink Disease Parvovirus) posiadający jednoniciowy, liniowy DNA.
-Wirus AMDV nie posiada właściwości hemaglutynacyjnych, a po wniknięciu do organizmu nie indukuje syntezy swoistych
przeciwciał neutralizujących.
-Wśród szczepów wirusa AMDV wyróżnia się szczepy o wysokiej, średniej i niskiej zjadliwości.
-Wirus AMDV jest oporny na działanie eteru, chloroformu, fluorokarbonu, butanolu, czterochlorku węgla oraz na
enzymatyczny wpływ proteaz i nukleaz.
-W 85
C ginie po 30 min., w 950C po 15 min., a w 99,5
C po 3 min.
-Dość szybko inaktywuje go 2-5% Polena JK, 0,5% NaOCl, 3% formalina, 2% NaOH, 2% chloramina oraz czynniki utleniające i
promienie ultrafioletowe.
Źródło zakażenia
-Naturalny rezerwuar - dzikie norki, szopy, sobole, lisy, fretki, koty, króliki i myszy.
-Przenoszenie wirusa AMDV - droga pozioma i pionowa.
-Zakażenie poziome - głównie drogą inhalacyjną, rzadziej pokarmową i kontakt bezpośredni (np. pogryzienia, kopulacja).
29
W transmisji wirusa główną rolę odgrywa droga pionowa i ma zasadniczy wpływ na endemiczne występowanie choroby w
fermach zapowietrzonych.
Pierwotne i zasadnicze źródło zakażenia- zwierzęta chore i bezobjawowi nosiciele wirusa.
-Przy zakażeniu szczepem wysoko zjadliwym, wirus jest obecny we wszystkich wydzielinach i wydalinach od 10 dnia aż do
momentu zejścia śmiertelnego.
-Przy zakażeniu szczepem słabo zjadliwym wirus nieregularnie pojawia się w kale, natomiast brak go w ślinie.
Wtórne źródło zakażenia -niesterylne narzędzia, strzykawki oraz rękawice używane podczas wykonywania zabiegów
lekarskich, zanieczyszczona karma i woda oraz sprzęt do poskramiania i pielęgnacji zwierząt
Patogeneza choroby
-Wirus AMDV ma szczególny tropizm do tk. limfoidalnej, w której ulega ciągłej i intensywnej replikacji. Głównymi
komórkami docelowymi u norek dorosłych są limfocyty B i T, w mniejszym stopniu śledziona, węzły chłonne oraz
sporadycznie jednojądrzaste komórki krwi obwodowej i szpiku kostnego.
-W okresie postnatalnym miejscem replikacji wirusa u osesków są aktywnie dzielące się komórki nabłonka pęcherzyków
płucnych II0.
-Efektem tego jest spadek produkcji surfaktantu i rozwój śródmiąższowego zapalenia płuc.
Patogeneza choroby
-U zakażonych osesków pochodzących od matek seropozytywnych oraz norek dorosłych rozwija się przewlekła postać
choroby, związana z trwałą infekcją (persistent infection) prowadzącą do dysfunkcji układu immunologicznego.
- Zakażone norki są trwałymi nosicielami i siewcami zarazka.
-Obecność przeciwciał przeciwwirusowych powoduje powstanie kompleksów immunologicznych, które odkładając się w
naczyniach krwionośnych nerek, wątroby i śledziony wywołują ich stan zapalny.
-Ciągła indukcja odpowiedzi humoralnej prowadzi do intensywnego rozplemu komórek plazmatycznych (plazmocytów) oraz
produkcji swoistych p-ciał. Plazmocyty wnikając do śledziony, nerek, wątroby i węzłów chłonnych powodują zmiany
morfologiczne i czynnościowe tych narządów.
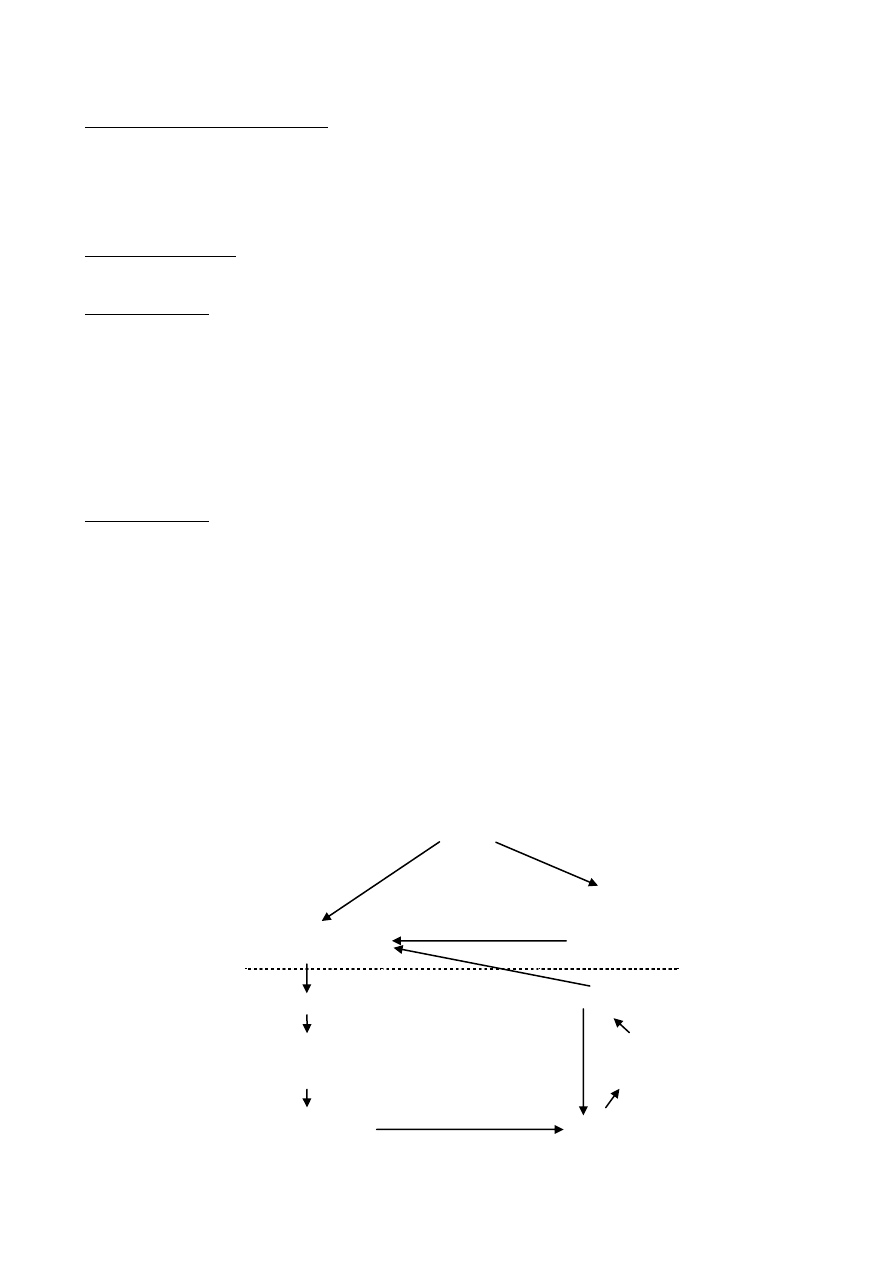
SUGEROWANA KOLEJNOŚĆ ZJAWISK W PATOGENEZIE CHOROBY
ALEUCKIEJ NOREK (WG KARSTAD)
WIRUS
TRWAŁE ZAKAŻENIE
plazmocytoza
kompleks antygenu z
przeciwciałem
przeciwciała dla
wirusa
przeładowanie u. s. ś.
autoprzeciwciała
uszkodzenie
lizosomów (wątroba i
nerki)
CHOROBA
AUTOIMMUNOLOGICZNA
plazmocytoza
denaturacja
enzymatyczna
autoantygeny
-W wyniku dysfunkcji nerek i wątroby rozwija się mocznica, będąca bezpośrednią przyczyną zejść śmiertelnych.

30
-Nadmierne tworzenie kompleksów immunol. przeciąża układ siateczkowo-śródbłonkowy i uszkadza lizosomy komórek
wątroby, nerek i śledziony. Efektem procesu chorobowego pierwotnie wywołanego przez wirus jest zaburzenie tolerancji
immunol. i tworzenie się autoprzeciwciał przeciwko antygenom własnym (zmienione białka cytoplazmy oraz błon
uszkodzonych lizosomów-autoantygeny).
-Autoantygeny stymulują syntezę autoprzeciwciał i tworzą dodatkowe kompleksy immunologiczne, które są przyczyną
dalszej syntezy przeciwciał, proliferacji komórek plazmatycznych oraz produkcji autoprzeciwciał, co pogłębia zmiany
chorobowe powstałe pierwotnie w wyniku działania kompleksów utworzonych z połączenia się wirusa ze swoistym
przeciwciałem.
-Gammopatia związana z uogólnioną plazmocytozą, nadmierną syntezą przeciwciał oraz autoprzeciwciał.
-Silna supresja UI wywołana trwałą infekcją zwiększa podatność na wtórne infekcje bakteryjne (Pasteurella sp., Salmonella
sp., Streptococcus sp.)
Rozwój i przebieg procesu chorobowego zależy od: (Objawy kliniczne choroby)
-Zjadliwości wirusa.
-Szczepy o wysokiej zjadliwości powodują 90-100% śmiertelność osesków oraz wywołują klasyczną postać choroby u
wszystkich genotypów norek dorosłych.
-Szczepy o średniej i niskiej zjadliwości wywołują zachorowania u 50-70% osesków z 30-50% śmiertelnością. Szczepy o
średniej i niskiej zjadliwości u dorosłych norek klasyczną postać wywołują jedynie u odmiany aleuckiej.
-Genotypu ->Najbardziej podatne są homozygotyczne norki aleuckie, u których występuje syndrom Chediak Higashi, będący
przyczyną wrodzonych niedoborów immunologicznych odpowiedzialnych za zwiększoną podatność na infekcje.U dorosłych
norek aleuckich niezależnie od zjadliwości szczepu choroba przebiega w postaci przewlekłej i progresywnej i kończy się
zejściem śmiertelnym. U pozostałych genotypów norek szczepy o średniej i niskiej zjadliwości wywołują przewlekłą i
nieprogresywną postać cechującą się niskim poziomem swoistych przeciwciał, brakiem wzrostu poziomu gammaglobulin
lub przejściową gammopatią oraz bezobjawowym jej przebiegiem. Niekiedy u norek dorosłych odmiany niealeuckiej
zakażenia szczepami o niskiej zjadliwości maja charakter zakażeń nietrwałych, a przebieg choroby jest bezobjawowy.
-Wieku zwierzęcia
-Choroba aleucka przebiega w postaci ostrej (płucnej) i przewlekłej (klasycznej).
*Postać ostra-płucna rozwija się u osesków do 3 tygodnia życia pozbawionych swoistych przeciwciał. Występuje głównie w
fermach, do których po raz pierwszy choroba została zawleczona. Klinicznie manifestuje się głęboką depresją i silną
dusznością (śródmiąższowe zapalenie płuc) oraz wysoką śmiertelnością.
*Postać klasyczna: okres inkubacji 24-120 dni.
-Pierwszym symptomem jest zwiększone pragnienie norek, przy zachowanym apetycie.
-W miarę rozwoju brak apetytu, spadek masy ciała, odwodnienie, nastroszenie i zmatowienie włosa.
-Patognomonicznym objawem są krwawienia z jamy ustnej i odbytu, prowadzące do silnej anemii (widoczna bladość
błon śluzowych i opuszek kończyn).
-Występują też ronienia oraz zaburzenia ze strony przewodu pokarmowego w postaci biegunki.
-Kał konsystencji półpłynnej jest częściowo zmieszany z nie strawioną karmą i zawiera domieszkę krwi, która po strawieniu
nadaje mu ciemne zabarwienie przypominające kolor smoły.
-W wyniku dysfunkcji nerek i wątroby rozwija się mocznica będąca bezpośrednią przyczyną zejść śmiertelnych.

31
-Norki zakażone wirusem AMDV wykazują zwiększoną podatność (supresja UI) na wtórne zakażenia bakteryjne
(pastereloza, salmoneloza i streptokokoza) będące często bezpośrednią przyczyną padnięć.
Zmiany sekcyjne
-U osesków są zlokalizowane głównie w płucach, które są bezpowietrzne, silnie przekrwione o konsystencji mięsistej z
punkcikowatymi wybroczynami na powierzchni.
-U norek dorosłych stwierdza się wychudzenie i zanik tkanki tłuszczowej o różnym nasileniu, odwodnienie i zażółcenie
tkanek oraz nadżerki i owrzodzenia błony śluzowej jamy gębowej, żołądka, a niekiedy opuszek palcowych.
-Typowe dla choroby aleuckiej zmiany anatomopatologiczne występują w śledzionie, nerkach, wątrobie i węzłach
chłonnych.
*Śledziona jest koloru ciemnoczerwonego, kilkakrotnie powiększona.
*Węzły chłonne są powiększone, konsystencji miękkiej, przekrwione z licznymi wybroczynami.
*Wątroba jest koloru mahoniowo-brązowo-żółtego, powiększona, konsystencji tęgiej, na przekroju z szaro-czerwonymi
ogniskami.
Najbardziej charakterystyczne zmiany są w nerkach:
*w początkowym stadium są ciemnoczerwone i znacznie powiększone
*przy dłużej trwającym procesie chorobowym są szarobiaławe lub żółtawe z licznymi wybroczynami w warstwie korowej
*dość często są one mniejsze od normalnych, pomarszczone i mają nierówną powierzchnię pokrytą bliznami
*pod torebką nerek obserwuje się torbiele wypełnione przezroczystym płynem
Rozpoznanie choroby
•
Wstępne - wywiad, objawy kliniczne i zmiany sekcyjne.
Częste ronienia, spadek plenności i płodności, wysoka śmiertelność osesków oraz liczne upadki kilkumiesięcznych
norek mogą nasuwać podejrzenie choroby.
Ostateczne rozpoznanie musi być potwierdzone badaniami laboratoryjnymi.
•
Materiał do badań wirusologicznych: limfocyty T i B, szpik, płuca, wątroba, śledziona, węzły chłonne kreskowe i nerki
•
Wirus AMDV intensywnie namnaża się w pierwotnych hodowlach komórek nerek kotów. Do izolacji najbardziej przydatną
jest linia komórkowa nerek kotów CRFK (Crandell feline kidnej cells), a zwłaszcza linia CCC klonu 81. W hodowlach
komórkowych wirus nie wywołuje zmian cytopatycznych.
•
Charakterystyczne zmiany w obrazie krwi: wzrost liczby CD8 (Tc cells) oraz zaburzenia stosunku Th do Tc, które można
wykazać metodą cytometrii przepływowej. Natomiast w surowicy wzrost poziomu gammaglobulin i białka całkowitego, przy
jednoczesnym spadku albumin.
W rutynowej diagnostyce do oznaczania hipergammaglobulinemii stosowany jest test jodowy.
•
U wszystkich genotypów norek zakażonych szczepem o wysokiej zjadliwości istotny wzrost poziomu surowiczych
gammaglobulin ma miejsce po 2-3 tygodniach od zakażenia i utrzymuje się on na wysokim poziomie przez cały okres
trwania choroby.
•
U norek odmiany niealeuckiej zakażonych szczepem wirusa o średniej i małej zjadliwości występuje niska lub okresowo
umiarkowana gammopatia, a wyniki testu jodowego są wątpliwe lub ujemne.
Wyniki fałszywie ujemne testu jodowego występują u młodych zwierząt oraz u norek dorosłych w początkowym stadium
zakażenia lub choroby.
Wyniki fałszywie dodatnie testu jodowego są notowane u norek niewłaściwie żywionych (schorzenia wątroby), przy innych
procesach chorobowych oraz po szczepieniach profilaktycznych (hipergammaglobulinemia poszczepienna).
•
Stąd test jodowy jest przydatny jedynie do ogólnej oceny sytuacji epizootycznej i stanu zdrowia zwierząt, natomiast nie
może stanowić podstawy do określenia odsetka zakażonych wirusem AMDV norek w fermach hodowlanych.
W rutynowej diagnostyce przydatne są metody pośrednie - wykazanie swoistych przeciwciał w surowicy norek.

32
Wzrost miana przeciwciał oraz czas ich utrzymywania zależą od genotypu norki i zjadliwości wirusa.
•
Pojawiają się one około 10 dnia po zakażeniu i niezależnie od stopnia zjadliwości wirusa u odmiany aleuckiej na zbliżonym
poziomie utrzymują się przez cały okres trwania choroby.
•
U pozostałych genotypów norek zakażonych szczepami o średniej lub niskiej zjadliwości miano przeciwciał stopniowo
obniża się lub utrzymuje się na niskim poziomie przez cały okres zakażenia.
Przy masowym badaniu próbek surowicy najbardziej przydatna jest immunoelektroforeza przeciwprądowa.
•
Metoda ta cechuje się wysoką czułością i swoistością, nieskomplikowaną procedurą pozyskiwania antygenu (supernatant z
homogenatów wątroby, śledziony i węzłów chłonnych kreskowych), łatwością i krótkim czasem wykonywania testu oraz
niskim kosztem w porównaniu do innych testów.
•
Liczba wyników fałszywie dodatnich uzyskiwanych za pomocą tej metody kształtuje się poniżej 5%. Jedną z przyczyn jest
pobranie surowic do badań przed upływem 21 dni od momentu szczepienia norek przeciwko wirusowemu zapaleniu jelit i
nosówce.
Ostatnio wprowadzany jest do rutynowej diagnostyki test ELISA
W diagnostyce AMDV stosowane są techniki biologii molekularnej, a zwłaszcza łańcuchowa reakcja polimerazowa PCR.
•
Jest ona metodą czułą w wykrywaniu wirusowego DNA w leukocytach we wczesnym okresie zakażenia norek w porównaniu
z innymi metodami biologii molekularnej.
Badania histopatologiczne
•
Postać ostra
śródmiąższowy obrzęk oraz przerost i rozrost komórek nabłonka pęcherzyków płucnych II st
W komórkach tych obserwuje się kwasochłonne wewnątrzjądrowe ciałka oraz stwierdza się obecność błon
szklistych powstałych w wyniku defektu metabolicznego komórek nabłonkowych pneumocytów II0 (niedobór surfaktantu).
•
Postać przewlekła
zmiany zwyrodnieniowe w hepatocytach, przerostowe zapalenie przewodów żółciowych oraz intensywny naciek
plazmocytów i komórek jednojądrzastych wokół naczyń krwionośnych
Infiltrację komórek plazmatycznych i limfoidalnych obserwuje się także w śledzionie, węzłach chłonnych, mózgu i oponach
mózgowych.
Postępowanie
Zgodnie z Ustawą o ochronie zdrowia zwierząt oraz zwalczaniu chorób zakaźnych zwierząt z dnia 11 marca 2004
roku choroba aleucka należy do chorób podlegających obowiązkowi rejestracji.
•
Brak leczenia przyczynowego. Podstawowym elementem postępowania przeciwepizootycznego jest izolacja i eliminacja z
fermy chorych norek jako pierwotnego źródła zakażenia oraz dewastacja zarazka w środowisku zewnętrznym przy użyciu
środków dezynfekcyjnych.
•
Ze względu na brak swoistej profilaktyki jedyną i skuteczną metodą zwalczania i zapobiegania chorobie aleuckiej jest
wczesna i swoista diagnostyka.
•
Zwierzęta należy badać przed kryciem (styczeń-luty) oraz po odsadzeniu (maj-czerwiec). Likwidacja norek zakażonych
ogranicza straty hodowlane w fermach zapowietrzonych oraz pozwala uniknąć ryzyka zawleczenia choroby do dotychczas
wolnych ferm.
Nosówka(febris catarrhalis et nervosa vulpium et mustelarum, distemper)
Zakaźna i wysoce zaraźliwa choroba wirusowa przebiegająca z objawami nieżytu błon śluzowych układu oddechowego i
przewodu pokarmowego, a niekiedy zmian skórnych oraz zaburzeń OUN.
Epidemiologia
-Występuje w ciągu całego roku, głównie czerwiec-październik - obecność zwierząt młodych, najbardziej podatnych na
chorobę.
-Szczenięta od matek nie uodpornionych są podatne już w okresie ssania.

33
-Lisy w stosunku do norek wykazują znacznie większą wrażliwość na nosówkę, a szczenięta mogą chorować już w wieku 3-4
tygodni (podatność gatunkowa).
Etiologia choroby
-Wirus należy do rodzaju Morbillivirus (rodzina Paramyxoviridae), zawiera jednoniciowy RNA. Ściśle spokrewniony z
wirusem odry, pomoru bydła i małych przeżuwaczy, wirusem nosówki fok i delfinów.
-Występuje w postaci jednego serotypu, lecz są znaczne różnice w zjadliwości izolatów. Klinicznie manifestuje się to różnym
okresem inkubacji, czasem trwania, nasileniem objawów, neurotropizmem oraz śmiertelnością u poszczególnych gatunków
zwierząt.
-Otoczka wirusa zawiera białko H (hemaglutynina) i białko F (ang. fusion protein) oraz wewnątrz membranowe białko M.
Hemaglutynina umożliwia przyleganie wirusa do komórki, natomiast białko F ułatwia zarazkowi rozprzestrzenianie się
pomiędzy komórkami. Białko M odgrywa ważną rolę w morfogenezie i replikacji wirusa.
Wirus namnaża się w hodowlach komórek nerek psa, fretki i cielęcia, w hodowli fibroblastów zarodka kurzego oraz
komórkach nabłonkowych. Po 3-12 dniach wywołuje efekt cytopatyczny - wielojądrzaste komórki olbrzymie, zmiany
destrukcyjne komórek oraz ciałka wtrętowe
-Pod wpływem promieni słonecznych wirus ginie po 2-3 dniach.
-W wydzielinach i wydalinach ulega inaktywacji w ciągu kilku dni.
-W 21oC ginie po 120 min, 37oC-60 min., 45oC-10 min, a w 56oC po 2-3 minutach.
-Znaczna oporność na wysuszenie i działanie niskich temperatur. W stanie zliofilizowanym w 4oC zachowuje zjadliwość 12
miesięcy, a zamrożonym przez lata.
-Szczególnie szybko niszczy eter i chloroform. Środki dezynfekcyjne zawierające czwartorzędowe zasady amoniowe
inaktywują wirus w 40C w ciągu 10 minut.
Wirus inaktywuje także 3% NaOH, 0,5% fenol, 0,1% formalina.
Źródło zakażenia
-Pierwotne - zwierzęta chore, w okresie wylęgania choroby oraz bezobjawowi nosiciele wydalający zarazek z wydzielinami i
wydalinami. Szczególne niebezpieczeństwo stanowią ozdrowieńcy w wygasłym ognisku nosówkowym lub wprowadzeni do
fermy wolnej od choroby.
U ozdrowieńców wirus wydalany jest z moczem przez ok. 120 dni.
-Heterologiczne źródło - psy, które są zasadniczym rezerwuarem wirusa nosówki w fermach zwierząt futerkowych.
-Zakażenie drogą aerogenną, alimentarną, przez kontakt bezpośredni lub pośredni (osoby obsługujące oraz zanieczyszczony
sprzęt fermowy i karma pochodząca z fermy zapowietrzonej.
-Możliwość zakażenia drogą pionową.
W obrębie fermy szerzeniu się choroby ułatwia
-rozsadzanie miotów i wykonywanie tatuaży, w okresie krycia przenoszenie zwierząt z klatki do klatki, krycie obcymi
samcami będącymi w okresie inkubacji choroby
-mniejszą rolę odgrywają ptaki oraz bytujące w fermie gryzonie
Patogeneza choroby
-U zwierząt futerkowych nie została dokładnie poznana. Wirus nosówki wykazuje wysokie powinowactwo do tkanki
limfoidalnej i wywołuje u zakażonych zwierząt stan immunosupresji.

34
-Po wniknięciu namnaża się początkowo w migdałkach i węzłach chłonnych śródpiersiowych. W 3-6 dniu obecny w
makrofagach i limfocytach krwi obwodowej i występuje przez ok. 14 dni.
-Drogą hematogenną do innych skupisk tkanki limfatycznej i w 6-9 dniu jest obecny we wszystkich narządach limfatycznych,
komórkach nabłonkowych przewodu pokarmowego, dróg oddechowych, układu moczowego oraz w skórze.
-Wynikiem intensywnej replikacji w limfocytach T i B jest limfopenia prowadząca do zaburzeń w UI.
- Rozwijająca się immunosupresja uaktywnia zakażenia latentne lub uzjadliwia się flora komensaliczna. U lisów wtórne
zakażenia przez Escherichia coli i Salmonella sp., które komplikują pierwotny obraz kliniczny i anatomo-patologiczny
choroby.
Objawy kliniczne choroby
W dużych fermach choroba szerzy się ogniskowo, a na dynamikę jej rozprzestrzeniania zasadniczy wpływ ma:
•
zjadliwość wirusa
•
gatunek zwierzęcia
•
stan odporności zwierzęcia
•
warunki żywieniowe i środowisko.
Jeżeli źródłem zakażenia są zwierzęta tego samego gatunku wówczas choroba rozprzestrzenia się znacznie szybciej.
Okres inkubacji 4-30 dni.
-Choroba przebiega w postaci ostrej nieżytowej i rozpoczyna się padnięciami pojedynczych zwierząt w miocie, bez
widocznych objawów klinicznych.
-Pierwszym objawem nasuwającym podejrzenie nosówki jest utrata apetytu i zmniejszenie żywotności zwierząt, które są
osowiałe i wykazują niechęć do ruchu - najczęściej leżą w klatce lub domku zwinięte w kłębek.
-W tej fazie zakażenia u chorych zwierząt pierwszy wzrost temperatury ciała (40-41
C), limfopenia, obrzęk i zapalenie
spojówek oraz zmętnienie rogówki oka.
-W zwężonej szparze powiekowej, w wewnętrznym kącie oka pojawia się niewielka ilość surowiczego a następnie ropnego
wysięku, wyraźnie widocznego rano podczas karmienia zwierząt.
-Wraz z rozwojem choroby powieki ulegają zlepieniu ropną wydzieliną oraz pojawia się wyciek z nosa - początkowo
surowiczy, później śluzowy, śluzowo-ropny i ropny.
-Wyciek zaklejając otwory nosowe, utrudnia znacznie oddychanie i powoduje duszność. W tym czasie jest szybkie
rozprzestrzenianie choroby i liczne upadki.
-Objawom tym mogą towarzyszyć zaburzenia ze strony OUN, najczęściej jednak dominują zaburzenia żołądkowo-jelitowe,
zwłaszcza u młodych szczeniąt.
-Kał jest płynny, cuchnący, koloru żółtawobrunatnego, niekiedy z domieszką krwi. Następstwem tych zaburzeń są częste
wpochwienia jelit lub wypadnięcia prostnicy.
-Zejście śmiertelne w ostrej postaci następuje po 3-7 dniach, natomiast w atypowej lub podostrej choroba trwa ok. 6
tygodni.
-Wskaźnik śmiertelności u lisów dorosłych wynosi 75-85%, natomiast u szczeniąt dochodzi do 100%.
Postać nerwowa
•
występuje u zwierząt które przebyły nieżytową postać choroby
•
pojawia się najczęściej w końcowej fazie ostrego przebiegu choroby lub dopiero w okresie pozornego zdrowienia (3-4
tydzień trwania choroby)
•
niekiedy u części zwierząt postać nerwowa nosówki występuje od początku rozwoju procesu chorobowego
•
wczesnym symptomem zaburzeń nerwowych jest nadmierna pobudliwość i niepokój zwierząt

35
•
następnie ruchy przymusowe, skurcze toniczno-kloniczne głównie kończyn i szczęk z obfitym wytwarzaniem piany w jamie
ustnej i „kłapaniem” żuchwy, niezborności ruchów i porażenia kończyn oraz zaburzenia czucia prowadzące do
samookaleczeń
•
postać ta trwa ok. 14-15 dni i kończy się zejściem śmiertelnym
Okres wylęgania 3-6 miesięcy.
•
U norek dorosłych jest to wynikiem przewlekłego przebiegu choroby, związanego ze zwiększoną odpornością zwierząt na
zakażenie.
•
Szczególnie odporne na zachorowania są samice ciężarne, u których pomimo zakażenia w okresie krycia, kliniczne objawy
choroby ujawniają się dopiero po porodzie.
•
Klasyczna postać nosówki rozpoczyna się pojedynczymi zachorowaniami zwierząt, u których pierwszym objawem
klinicznym jest obrzęk i surowicze zapalenie spojówek.
•
Po 2-3 dniach wypływ z worka spojówkowego zmienia się w ropny, szpara oczna jest zwężona, natomiast powieki zlepione
są wysiękiem.
•
Ponadto pojawia się ropny wysięk z otworów nosowych, który je dość często zakleja.
•
Charakterystycznym objawem nosówki u norek jest osutka pęcherzykowa zlokalizowana wokół spojówek, nosa, pyszczka
oraz na krawędziach małżowin usznych. Utrzymuje się ona krótko, pęcherzyki pękają i z wysięku tworzą się strupki koloru
ciemnobrązowego.
•
W dalszym przebiegu pojawiają się zgrubienia i pofałdowania skóry karku oraz wykwity z wysiękiem i wypadaniem włosów
po wewnętrznej stronie ud, w dolnej części jamy brzusznej rozciągające się aż do okolicy mostka.
•
Dodatkowo u samców notuje się ropne zapalenie napletka.
•
Bardzo charakterystycznym objawem w tym okresie jest obrzęk i zgrubienie opuszek palcowych (kilkakrotnie powiększone).
Jest to tzw. choroba twardej łapy (ang. hard pad disease), która kończy się prawie zawsze zejściem śmiertelnym.
Manifestuje się zaczerwienieniem, obrzękiem i hyperkeratozą opuszek kończyn i lusterka nosa. Skóra w tych miejscach
szorstka, spękana, a na nosie sucha.
•
W końcowym okresie pojawiają się zaburzenia ze strony przewodu pokarmowego w postaci całkowitej utraty apetytu i
biegunki oraz zmętnienie i zapalenie rogówki, prowadzące niekiedy do ślepoty.
•
Nosówka u norek trwa 2-3 tygodnie i prowadzi do ogólnego wyniszczenia zwierząt i do śmierci.
•
Wskaźnik śmiertelności zależy od wieku i odmiany norek. U dorosłych pasteli oraz u szczeniąt wszystkich genotypów wynosi
on 100%, standardów 50%, a pozostałych odmian 10-15%.
U części zwierząt obserwuje się pozorne polepszenie ogólnego stanu zdrowia, po czym pojawiają się nawroty choroby w
postaci zaburzeń ze strony OUN:
•
drgawki kloniczno-toniczne
•
rytmiczne skurcze mięśni głowy
•
kończyn, tiki nerwowe
•
zaburzenia równowagi
•
niedowłady zadu
Tym objawom towarzyszą często przeraźliwe piski oraz wydobywa się piana z pyszczka.
Postać nerwowa trwa 2-3 tygodnie, a wskaźnik śmiertelności wynosi do 50%.
Zmiany sekcyjne
Zarówno u lisów jak i norek są mało charakterystyczne.
•
W ostrej i niepowikłanej postaci zmiany ograniczają się zwykle do obrzęku węzłów chłonnych głównie krezkowych i tkanki
siateczkowo-śródbłonkowej błony śluzowej jelit.
•
Węzły chłonne krezkowe są powiększone, na przekroju koloru ciemnowiśniowego. Błona śluzowa żołądka i dwunastnicy
jest silnie przekrwiona.
•
Zmianom tym, szczególnie u norek, towarzyszy miąższowy przerost śledziony, która jest koloru wiśniowego.
•
Stwierdza się powiększenie i zaczerwienienie migdałków oraz nieżytowe zapalenie płuc z obecnością punkcikowatych
wybroczyn w miąższu.
•
Zmiany makroskopowe w OUN, niezależnie od stopnia nasilenia objawów nerwowych, są słabo wyrażone. Obserwuje się
jedynie silne nastrzykanie naczyń mózgu oraz pojedyncze punkcikowate wybroczyny.
•
Przy postaci podostrej i przewlekłej pierwotny obraz zmian ulega zatarciu w wyniku wtórnych zakażeń bakteryjnych.
Wówczas obserwuje się rozległe odoskrzelowe zapalenie płuc z obecnością ognisk ropnych, ropne zapalenie opłucnej oraz
krwotoczne zapalenie błony śluzowej przewodu pokarmowego
Rozpoznanie choroby

36
Wczesne rozpoznanie zapobiega rozprzestrzenianiu się w fermie, umożliwia szybką likwidację choroby oraz zmniejsza straty
hodowlane.
•
Wstępnie - wywiad, dane epizootyczne oraz w pełni rozwinięte objawy kliniczne
•
Ostatecznie - badania laboratoryjne
•
Przyżyciowo w ostrej postaci swoisty antygen wirusowy jest obecny w rozmazach krwi, preparatach odciskowych z błon
śluzowych nosa, napletka i pochwy, a przede wszystkim ze spojówek. Można go wykazać testem immunofluorescencji.
•
Wirus 3-14 dniem po zakażeniu jest obecny w leukocytach, a pomiędzy 5 dniem a 3 tygodniem w komórkach nabłonkowych
błon śluzowych.
W postaci podostrej i przewlekłej – brak jest wirusa w leukocytach oraz komórkach nabłonkowych – ujemny wynik testu
immunofluorescencji.
•
Badania na obecność ciałek wtrętowych Lentza mają ograniczoną przydatność w rozpoznawaniu nosówki - pojawiają się
nieregularnie i w rozmazach z worka spojówkowego dopiero między 11 a 18 dniem, a w limfocytach krwi 8-11 dnia po
zakażeniu.
•
Negatywne wyniki testu immunofluorescencji oraz badań cytochemicznych można zweryfikować stosując test PCR w celu
wykazania kwasu nukleinowego wirusa.
•
W diagnostyce przyżyciowej postaci ostrej nosówki mało przydatne są badania serologiczne, ponieważ przeciwciała
przeciwwirusowe pojawiają się dopiero w 7-9 dniu po zakażeniu. Dość często w wyniku supresyjnego oddziaływania wirusa
na UI poziom swoistych przeciwciał jest niski.
Diagnostyka pośmiertna: badanie histopatologiczne, immunocytochemiczne i próba biologiczna.
•
W preparatach histologicznych z mózgu, płuc, nabłonka żołądka i pęcherza moczowego stwierdza się ciałka wtrętowe
Lentza.
•
Test immunofluorescencji bezpośredniej przy użyciu przeciwciał poliklonalnych - obecność antygenu wirusowego w
preparatach odciskowych z węzłów chłonnych, płuc, pnia mózgu oraz nabłonka żołądka i pęcherza moczowego.
•
Badania immunofluorescencyjne można dodatkowo uzupełnić testem PCR w celu wykazania obecności kwasu
nukleinowego wirusa.
•
Izolacja wirusa z materiału chorobowego nie ma praktycznego zastosowania w diagnostyce nosówki - jest czasochłonna i
kosztowna.
W rutynowej diagnostyce nosówki najbardziej miarodajna jest próba biologiczna wykonana na fretkach.
-Do inokulacji używa się nierozcienczonej krwi, popłuczyn wymazów z jamy nosowej, 20% zawiesinę narządów
wewnętrznych, zwłaszcza śledziony.
-Materiał wprowadza się fretkom podskórnie w ilości 2 - 3 ml lub 1 ml donosowo po uprzedniej narkozie.
-W przypadku obecności wirusa w badanym materiale po 7-9 dniach po zakażeniu pojawiają się objawy chorobowe w
postaci braku apetytu, wzrostu temperatury ciała oraz zapalenia spojówek.
-Po 10-11 dniach zakażone zwierzęta padają
W rozpoznaniu różnicowym u lisów należy uwzględnić:
•
zakaźne zapalenie mózgu u lisów
•
salmonelozę
•
chorobę Aujeszkyego
•
U norek należy uwzględnić pseudomonadozę.
Zakaźne zapalenie mózgu u lisów
W odróżnieniu od nosówki brak jest objawów nieżytowych błon śluzowych, natomiast objawy nerwowe pojawiają się już na
początku choroby
W przypadkach wątpliwych ostatecznie decydują badania laboratoryjne.
Salmoneloza
Zwykle chorują zwierzęta młode o najsłabszej kondycji, brak tendencji do szybkiego rozprzestrzeniania się wśród zwierząt
starszych i dobrze wyrośniętej młodzieży.
-Przy nosówce znacznie szybciej pojawia się surowicze bądź ropne zapalenie spojówek oraz ropny wyciek z nosa.

37
-Ostateczne decydują badania bakteriologiczne.
Należy pamiętać o wtórnej salmonellozie przy nosówce
Choroba Aujeszkyego
-Objawy nerwowe pojawiają się na początku choroby i w ciągu 1-2 dni następuje zejście śmiertelne.
-Objawom nerwowym towarzyszy zwykle uporczywy świąd skóry prowadzący do rozległych uszkodzeń okrywy włosowej,
skóry oraz mięśni.
Pseudomonadoza
-Pojawia się u norek nagle, ma szybki przebieg i cechuje się wysokim wskaźnikiem zachorowalności i śmiertelności.
-Sekcyjnie stwierdza się charakterystyczne krwotoczne zapalenie płuc.
Nosówka
Postępowanie
•
Brak leczenia przyczynowego.
•
Jedyną skuteczną metodą w zwalczaniu nosówki w fermach zapowietrzonych jest natychmiastowa likwidacja wszystkich
zwierząt z objawami choroby oraz szczepienia interwencyjne pozostałych zwierząt.
•
Duże znaczenie w zwalczaniu choroby ma właściwe żywienie zwierząt w okresie trwania epizootii oraz zabiegi sanitarne w
celu dewastacji zarazka w środowisku zewnętrznym.
Skuteczną metodą zapobiegania nosówki jest coroczna swoista immunoprofilaktyka zwierząt stada podstawowego oraz
młodzieży.
•
Stado podstawowe szczepi się w połowie grudnia, a młodzież od matek uodpornionych powyżej 10-13 tygodni życia
(odporność bierna u szczeniąt utrzymuje się 10-13 tygodni).
•
Szczenięta pochodzące od matek nieuodpornionych przeciwko tej chorobie powinny zostać poddane swoistej
immunoprofilaktyce w wieku 6-7 tygodni życia.
Odporność poszczepienna pojawia się w 10-12 dniu po immunizacji i trwa około 1 roku.
Myksomatoza królików (myksomatosis cuniculi; infectious myxoma of rabbits)
Zakaźna i wysoce zaraźliwa choroba królików domowych i dziko żyjących, przebiegająca ze zmianami na skórze w postaci
miejscowych obrzęków błony podśluzowej i tkanki podskórnej, usytuowanych głównie w okolicy naturalnych otworów
ciała.
Epidemiologia
•
W latach pięćdziesiątych wirus umyślnie przeniesiono do Australii, gdzie wcześniej celowo sprowadzone króliki z Europy
stały się „plagą” w rolnictwie. Przez przypadek wirus został przeniesiony do Europy i rozprzestrzenił się na cały kontynent
oraz Wielką Brytanię, powodując duże spustoszenie wśród dzikich królików.
•
Wirus występuje również w centralnej i południowej Ameryce oraz w USA (Kalifornia).
•
Na zakażenie naturalne wrażliwe są dzikie króliki żyjące w Europie oraz hodowlane i udomowione króliki należące do
gatunku Oryctolagus.
•
U królików europejskich wirus wywołuje uogólniony proces chorobowy z 95-100% śmiertelnością.
•
Zwiększoną odporność naturalną wykazują zające i choroba ma przebieg subkliniczny.
•
Sezonowość występowania choroby - największe nasilenie w sierpniu, wrześniu i październiku, co związane jest z
największą aktywnością biologiczną owadów jako głównych przenosicieli wirusa. W pozostałych miesiącach notuje się
najczęściej pojedyncze przypadki zachorowań.
Etiologia choroby
•
Wirus z rodzaju Leporipoxvirus, rodziny Poxviridae, ściśle spokrewniony z wirusem Shope’a fibromatozy, zawiera podwójnie
skręcony DNA. Wywiera silny efekt immunosupresyjny, wrażliwy na procesy gnicia, pH w zakresie 4-12, działanie promieni
38
słonecznych, środki dezynfekcyjne: 2% formalina, 2% NaOH, 1-2% roztwór kwasu karbolowego i 2,5% kwasu siarkowego,
terpentyna, jodyna, eter i chloroform.
•
Inaktywacja wirusa w 57oC po 1 godz., w 100oC w ciągu kilkunastu minut. Wirus jest oporny na niskie temperatury oraz
wysychanie, zachowując zakaźność w nie wyprawionej skórze królika do 220 dni.
Źródło zakażenia
•
Naturalny rezerwuar - dziko żyjące króliki i zające - zakażenie przebiega w postaci bezobjawowej.
•
Pierwotnym i głównym źródłem zakażenia są chore króliki i bezobjawowi nosiciele wirusa. Chore zwierzęta wydalają
zarazek z moczem, śliną, kałem, wyciekiem z nosa i oczu.
•
Choroba szerzy się przez kontakt bezpośredni, za pośrednictwem paszy i wody zanieczyszczonej odchodami chorych
zwierząt, przez osoby z obsługi, środki transportu i sprzęt do pielęgnacji zwierząt skażone wirusem.
•
Zasadniczą rolę w rozprzestrzenianiu się zakażenia odgrywają owady krwiopijne, szczególnie komary, bolimuszka, muchy i
pchły – stąd sezonowość występowania.
•
Komary mogą przekazywać zakaźny wirus do 36 dnia po akcie ssania, natomiast pchły pozostają zakaźne po 3-miesięcznym
głodzeniu.
•
W przenoszeniu wirusa na duże odległości (500-1000 km) zasadniczą rolę odgrywają ptaki, ssaki drapieżne i zające, oraz
ludzie zajmujący się handlem zwierzętami i skórami.
Patogeneza choroby
•
Wirus po wstępnej replikacji w miejscu ukłucia przez owady krwiopijne przenika do regionalnych węzłów chłonnych gdzie
ulega wtórnej replikacji.
•
Efektem jest hiperplazja układu siateczkowo-histiocytarnego oraz zwiększona przepuszczalność naczyń włosowatych
•
Następnie wirus przenika do krwi wywołując wiremię i poprzez limfocyty rozprzestrzenienia się po całym organizmie.
•
Wirus namnaża się głównie w skórze okolicy oczu, nosa, jamy ustnej, wewnętrznej stronie małżowiny usznej, narządów
rozrodczych i odbytu.
•
Wirus wywiera silny efekt immunosupresyjny poprzez głęboką regulację ekspresji cząsteczek MHC klasy I oraz hamowanie
syntezy i uwalniania TNF-α przez makrofagi.
Objawy kliniczne
•
Okres inkubacji 5-14 dni, a przebieg zależy w dużym stopniu od ilości i zjadliwości wirusa, odporności rasowej i osobniczej
oraz warunków zoohigieniczych.
Choroba przebiega w postaci nadostrej, ostrej i przewlekłej guzowatej.
Postać nadostra notowana jest bardzo rzadko i charakteryzuje się nagłym zejściem śmiertelnym
•
jedynym objawem klinicznym towarzyszącym tej postaci jest silne zaczerwienienie spojówek
•
wskaźnik śmiertelności wynosi 100%.
Postać ostra zwykle na początku epizootii w fermach dotychczas wolnych
•
Cechuje się szybkim przebiegiem prowadzącym do krańcowego wyniszczenia i śmierci królika.
•
Charakterystycznym objawem jest pojawienie się 3-4 dnia obrzęków na głowie, powiekach i zewnętrznych narządach
płciowych.
•
W tkance podskórnej gromadzi się płyn o konsystencji ciągliwego śluzu oraz wzrost ciepłoty wewnętrznej do 420C.
•
Następnie tworzą się rozległe galaretowate obrzęki podskórne dookoła uszu, nosa, oczu oraz zewnętrznych narządów
płciowych.
W 6-8 dniu po zakażeniu pojawia się śluzowo-ropny, a następnie ropny wypływ z oczu.
•
W miarę rozwoju pojawia się silna duszność jako następstwo mechanicznych przeszkód i zapalenia płuc oraz szybko
postępujące wychudzenie, przy zachowanym apetycie.
•
Ropne zapalenie powiek i spojówek prowadzi do ślepoty.
•
Ostra postać zwykle kończy się zejściem śmiertelnym w ciągu 7-14 dni.
•
Wskaźnik śmiertelności wynosi około 100%.
39
Postać przewlekła guzowata występuje jako proces pierwotny lub rozwija się wtórnie u królików, które przeżyły ostrą
postać choroby
•
Po 10-15 dniach od zakażenia tworzą się galaretowate obrzęki na uszach, nosie i łapach.
•
Następnie gorące i bolesne obrzęki w okolicy krocza, kończyn, odbytu i narządów płciowych.
•
U samców - zapalenie jąder i okolicznych węzłów chłonnych.
•
W zaawansowanym stadium - trudności w oddychaniu, związane z zapalenia płuc lub obrzękiem zapalnym błony śluzowej
jamy nosowej.
•
W końcowym okresie wirus może atakować OUN, czego następstwem są porażenia.
•
Śmiertelność 25-90%, a średni czas przeżycia - 40 dni.
•
Przy łagodnym przebiegu choroba kończy się wyzdrowieniem w wyniku nabycia swoistej odporności.
Myksomatoza królików
•
Na początku lat 80 we Francji pojawiła się u królików szczepionych atypowa postać wywołana przez szczepy o słabszym
tropizmie do skóry, a zwiększonym do układu oddechowego.
•
W miejscu wniknięcia wirusa stwierdza się obecność małych guzków oraz silnych obrzęków na powiekach i zewnętrznych
narządach płciowych.
•
Przy wtórnych zakażeniach Pasteurella multocida przebieg tej postaci może być śmiertelny.
Zmiany sekcyjne
•
Obecność podskórnych guzków lub rozlanych zgrubień na wargach, w okolicy nosa, na powiekach, u podstawy małżowiny
usznej i w okolicy odbytowo-płciowej.
•
Ponadto występuje obrzęk płuc, niekiedy odoskrzelowe zapalenie płuc, rozrostowy obrzęk śledziony i zmiany zapalne w
układach rozrodczym i moczowym.
•
Badaniem histopatologicznym stwierdza się surowiczo-wytwórczy stan zapalny tkanki łącznej skóry, komórki śluzakowate
(zmodyfikowane histiocyty) zawierające w cytoplazmie ciałka wtrętowe, hypertrofię oraz proliferację komórek
nabłonkowych, hyperplazję komórek naskórka oraz proliferację komórek śródbłonka naczyniowego.
Rozpoznanie choroby
•
Wstępnie - charakterystyczne objawy kliniczne - galaretowate obrzęki w zmienionych chorobowo miejscach.
•
Ostateczne na podstawie badań laboratoryjnych.
•
Materiał do badań - chorobowo zmienione części skóry i tkanki podskórnej, galaretowate obrzęki lub włókniaki.
•
Ponieważ wirus wykazuje dość znaczną oporność na czynniki zewnętrzne, można go wykazać również w wysuszonych
skórach zdjętych z padłych lub zabitych zwierząt
•
W celu wykazania obecności wirusa wykonuje się próbę biologiczną na królikach, zakażając je dospojówkowo lub
podskórnie badaną zawiesiną.
Po 6-10-dniowym okresie inkubacji pojawiają się typowe galaretowate obrzęki w skórze dookoła oczu, warg i narządów
płciowych.
•
Królik ginie w ciągu 1-3 tygodni od zakażenia. Brak reakcji w ciągu 21 dni od zakażenia uważa się za wynik ujemny.
•
Obecność wirusa można wykazać, zakażając zarodki kurze, wprowadzając badaną zawiesinę na błonę kosmówkowo-
omoczniową.
•
Po 2-3 dniach powstają charakterystyczne ogniska zapalne świadczące o zakażeniu. Metoda ta pozwala na otrzymanie
dużych ilości wirusa, a ponadto określenie jego miana na podstawie liczby ognisk zapalnych.
•
Szybkie rozpoznanie na podstawie stwierdzenia cytoplazmatycznych ciałek wtrętowych w preparatach odciskowych z tkanki
chorobowo zmienionej lub worka spojówkowego
W diagnostyce przyżyciowej i pośmiertnej myksomatozy wykorzystywany jest również test bezpośredniej i pośredniej
immunofluorescencji.
•
Badania serologiczne mają ograniczoną wartość ze względu na powolny rozwój swoistej odpowiedzi humoralnej oraz
zróżnicowaną wysokość mian przeciwciał w surowicy. Najbardziej wiarygodne wyniki uzyskuje się w odczynie SN, OWD i
teście ELISA.
Rozpoznanie różnicowe
fibromatoza królików - nie ma charakteru epizootii i przebiega łagodnie
-charakteryzuje się ona powstawaniem zmian wytwórczych w postaci włókniaków zlokalizowanych na kończynach, przy
braku objawów ogólnych

40
-w następstwie zapalnego rozrostu tkanki łącznej podskórnej powstają guzy wielkości orzecha włoskiego, które ulegają
martwicy zapalnej
-zmiany te w ciągu kilku tygodni ulegają resorpcji, a przebycie zakażenia pozostawia trwałą odporność na ponowne
zakażenie oraz zakażenie wirusem myksomatozy
Postępowanie
Należy do chorób z listy OIE. W kraju zgodnie z Ustawą o ochronie zdrowia zwierząt oraz zwalczaniu chorób zakaźnych
zwierząt z dnia 11 marca 2004 roku myksomatoza należy do chorób podlegających obowiązkowi rejestracji.
Zwalczanie
polega na szybkiej likwidacji ogniska choroby i źródeł zakażenia
•Króliki chore, podejrzane o chorobę i o zakażenie należy uśpić, a zwłoki zniszczyć, ponieważ są źródłem zakażenia, które
może przenosić się wraz z powietrzem na okoliczne fermy.
• Po zlikwidowaniu ogniska choroby dokładna dezynfekcja klatek i pomieszczeń przy użyciu 5% formaliny, 1-2% NaOH, 2%
Virkonu.
•Nieswoista profilaktyka polega na przestrzeganie rygorów sanitarnych, stosowaniu preparatów owadobójczych oraz
odpowiednim zabezpieczeniu pomieszczeń hodowlanych przed możliwością zawleczenia wirusa, poprzez stosowanie siatek
ochronnych
•Swoista profilaktyka polega na systematycznym szczepieniu zwierząt przy użyciu szczepionek atenuowanych.
•W Polsce stosuje się szczepionkę, o nazwie Myxowac M, zawierającą atenuowany szczep wirusa myksomatozy królików.
•Szczepionka przeznaczona jest do uodporniania królików w hodowlach wolnych od myksomatozy.
•Stosowanie szczepionki zalecane jest również w hodowlach, w których stwierdzono sporadyczne przypadki myksomatozy.
Wówczas króliki chore należy zabić, a zdrowe poddać szczepieniu.
•W rejonach endemicznego występowania myksomatozy, pierwsze szczepienie należy wykonać u królików powyżej 4
tygodnia życia, z rewakcynacją po 3 tygodniach.
•Pełna odporność swoista pojawia się już po 8 dniach od momentu zaszczepienia i utrzymuje przez 5-6 miesięcy.
•Zwierzęta stada podstawowego przeznaczone do rozrodu musza być po 6 miesiącach powtórnie zaszczepione. Ma to na
celu utrzymanie w organizmie odpowiedniej ilości przeciwciał, które u samic ciężarnych przechodzą przez łożysko i w ten
sposób przekazywane są na płód.
WIRUSOWA KRWOTOCZNA CHOROBA KRÓLIKÓW (VIRAL HAEMORRHAGIC DISEASE OF RABBITS)
Wybitnie zaraźliwa choroba królików domowych, hodowlanych i dziko żyjących, charakteryzująca się dużą
wybroczynowością (skazą krwotoczną) we wszystkich narządach wewnętrznych, szczególnie w płucach i wątrobie, oraz
bardzo wysokim wskaźnikiem śmiertelności (70-100%).
Epidemiologia choroby
•
Krwotoczna choroba królików określana potocznie chińskim pomorem królików, jest stosunkowo nową jednostką
chorobową, opisaną po raz pierwszy w Chinach w 1984 r.
•
W latach następnych pojawiła się w Korei, Indiach, w krajach byłego ZSRR, Czechosłowacji.
41
•
W Polsce rozpoznana w latach 1986-1987. Obecnie niemal w całej Europie, Azji, krajach północnej Afryki, Australii i Nowej
Zelandii, Ameryce Środkowej i Południowej, USA i na Kubie.
•
Nasilenie w okresie jesienno-zimowym - prawdopodobnie większa liczba zwierząt w fermach hodowlanych oraz
niekorzystne warunki środowiskowe.
Początkowo uważano, że wirus VHD występuje w postaci jednego serotypu. We Włoszech stwierdzono dwa warianty
antygenowe wirusa VHD, charakteryzujące się brakiem reakcji z neutralizującym wirus przeciwciałem dla szczepu
standardowego oraz słabą reakcją z surowicą ozdrowieńców po zakażeniu szczepem standardowym.
Etiologia choroby
Kaliciwirus VHD (Viral Haemorrhagic Disease) należący do rodziny Caliciviridae. Wirus VHD jest małym bezotoczkowym wirusem
zawierającym jednoniciowy dodatnio spolaryzowany RNA
Do tej rodziny wirusów należy wirus wywołujący u zajęcy zespół EBHS (European Brown Hare Syndrome), który przebiega z
objawami nerwowymi w postaci drgawek i konwulsji oraz niepatogenny dla królików wirus RCV indukujący przeciwciała
reagujące krzyżowo z wirusem VHD
Wirus jest oporny na eter, chloroform i enzymy proteolityczne oraz działanie wysokiej temperatury, zamrażanie i pH 3. W temp.
pokojowej przeżywa 105 dni, w 600C 2 dni, a w 40C przez 225 dni.
Na ubraniu ochronnym personelu obsługującego zwierzęta wirus przeżywa ponad 3 miesiące. Homogenaty narządów
miąższowych w -200C nie tracą swojej zakaźności przez 2 lata.
Wirus w temperaturze 370C w ciągu godziny ulega inaktywacji pod wpływem 0,4% roztworu formaliny, natomiast w
temperaturze 40C w ciągu 12 godzin. Również jest on inaktywowany w ciągu godziny pod wpływem działania 1-2% NaOH
lub 1% formaliny.
Źródło zakażenia
Naturalnym rezerwuarem są króliki dziko żyjące.
Zasadnicze źródło - króliki chore wydalające w okresie wiremii duże ilości zarazka szczególnie ze śliną i wyciekiem z nosa oraz
ozdrowieńcy, które pozostają nosicielami i siewcami wirusa przez ponad 4 tygodnie
Wtórne źródło - ściółka oraz pasza i woda zanieczyszczone odchodami chorych zwierząt.
Ważną rolę w rozprzestrzenianiu się zakażenia odgrywają mechaniczni przenosiciele wirusa: ptaki, gryzonie, psy, koty oraz
personel zatrudniony przy obsłudze zwierząt, a także owady krwiopijne.
W warunkach naturalnych wirus VHD wnika do organizmu drogami aerogenną, pokarmową i przez uszkodzone
powłoki ciała.
Patogeneza choroby
Nie jest dokładnie poznana. Wirus wykazuje silny tropizm do hepatocytów i śródbłonka naczyń krwionośnych. Efektem
intensywnej replikacji w cytoplazmie komórek wątroby są zmiany martwicze w hepatocytach.
•
Efektem replikacji wirusa w śródbłonku naczyń jest jego uszkodzenie oraz w ciągu 30 godzin od zakażenia dochodzi do
rozwoju rozsianego wewnątrznaczyniowego wykrzepiania (DIC-disseminated intravascular coagulation) i tworzenia
mikrozakrzepów w wątrobie i nerkach.
•
Zaburzenia w krążeniu, procesów krzepnięcia oraz zmian ilościowo-jakościowych płytek krwi są przyczyną licznych
krwotoków w wątrobie, płucach,nerkach i tchawicy.
•
Wirus posiada też silne właściwości immunosupresyjne: hamuje aktywność komórek polimorfonuklearnych i
mononuklearnych oraz limfocytów T i B.
•
Supresyjne oddziaływanie wirusa na układ odpornościowy królików dowodzi ważnej roli i udziału zjawisk
immunologicznych w patogenezie tak gwałtownie przebiegającej choroby.
Objawy kliniczne choroby
Przebieg choroby zależy od wieku zwierzęcia, sprawności mechanizmów odpornościowych oraz zjadliwości wirusa

42
•
Szczególnie podatne na zakażenie są króliki ras mięsnych i angora, natomiast względnie oporne są króliki ras lekkich i
mieszańce wielorasowe oraz młode króliki do 2 miesiąca życia (odporność matczyna).
Okres inkubacji (16-72 godz.)
Przebieg choroby:
• najczęściej w postaci nadostrej i ostrej z 80-100% śmiertelnością
• w postaci podostrej z ok. 40-60% śmiertelnością
Postać nadostra
• nagłe upadki zwierząt bez widocznych objawów klinicznych choroby i przy zachowanym apetycie
• niekiedy tuż przed zejściem występują konwulsje oraz inne objawy ze strony układu nerwowego
• zejście w ciągu 48, niekiedy 16-36 godzin od momentu zakażenia
Postać ostra
występuje głównie u królików powyżej 2 miesięcy życia
•
manifestuje się gwałtownie narastającą dusznością, a u części chorych zwierząt pojawia się dodatkowo pienisty lub krwisty
wyciek z otworów nosowych, pyszczka, ewentualnie z dróg rodnych
•
u chorych zwierząt ulegają osłabieniu reakcje na bodźce, a zejścia śmiertelne, zwykle po 2 dniach od zakażenia,
poprzedzone są popiskiwaniem i gwałtownymi, nieskoordynowanymi ruchami oraz częściowym porażeniem
•
u królików, które przeżyły ostrą postać rozwija się żółtaczka i szybko dochodzi do zejść śmiertelnych
Postać podostra
•
charakteryzuje się częściową utratę apetytu, silną dusznością, tachykardią, przekrwieniem gałek ocznych, niekiedy pojawia
się biegunka i katar
•
króliki, które przechorowały nabywają trwałą odporność, która nie likwiduje nosicielstwa zarazka i takie zwierzęta stanowią
potencjalne źródło zakażenia
Zmiany sekcyjne
•
W postaci nadostrej często brak zmian w narządach wewnętrznych lub ograniczają się one jedynie do płuc.
•
W postaciach ostrej i podostrej stwierdza się uogólnioną skazę krwotoczną ze zmianami głównie w płucach, wątrobie,
śledzionie, jelitach oraz nerkach oraz obecność krwistego płynu przesiękowego w jamach ciała oraz w jamie nosowej
krwistej wydzieliny.
•
Tchawica wypełniona jest pienistą, krwistą wydzieliną, a jej błona śluzowa przekrwiona i obrzękła. Podobnie płuca są
przekrwione, obrzękłe z licznymi wybroczynami, wylewami krwawymi i ogniskami rozedmy.
•
Charakterystyczne zmiany są w wątrobie, która jest powiększona, barwy jasnożółto-czerwonej, o wyraźnie zaznaczonej
budowie zrazikowej i kruchej konsystencji. Na jej powierzchni widoczne są punkcikowate wybroczyny oraz ogniska
martwicy.
•
Śledziona jest powiększona, koloru ciemnofioletowego, przekrwiona zastoinowo, z ogniskami martwicy.
•
Grasica ma zatartą budowę zrazikową, jest również powiększona, przekrwiona, z licznymi ogniskami martwicy oraz
wybroczynami.
•
W nerkach obserwuje się silną wybroczynowość, przekrwienie, ogniskową martwicę oraz zawały krwawe.
•
Wybroczyny występują również w sercu oraz węzłach chłonnych.
•
Niekiedy stwierdza się nieżytowe zapalenie żołądka i jelit, odcinkową martwicę jelit cienkich, nieropne zapalenie mózgu i
rdzenia kręgowego, demielinizację, martwicę pęcherzyka żółciowego oraz uszkodzenie miąższowo-szkliste mięśnia
sercowego.
Rozpoznanie choroby
•
Wstępne - na podstawie gwałtownego przebiegu choroby, objawów klinicznych i wysokiego wskaźnika śmiertelności oraz
charakterystycznych zmian anatomopatologicznych.
•
Ostateczne - wyniki badań laboratoryjnych.
Przyżyciowo materiał do badań stanowi krew, pośmiertnie narządy miąższowe i węzły chłonne.
Najwyższą koncentrację wirusa stwierdza się w wątrobie, śledzionie i płucach.

43
Próby izolacji wirusa VHD z chorobowo zmienionego materiału w hodowlach komórkowych generalnie się nie
powiodły.
Stąd też w diagnostyce laboratoryjnej stosuje się:
•
badanie histopatologiczne
•
badanie immunohistologiczne
•
techniki mikroskopii elektronowej
•
odczyny hemaglutynacji
•
immunofluorescencji
•
test ELISA
•
metodę PCR i Western blot
W badaniach serologicznych do identyfikacji wirusa w chorobowo zmienionych narządach oprócz odczynu zahamowania
hemaglutynacji, powszechnie stosuje się test ELISA, który jest bardziej czuły i miarodajny, a ostatnio również metodę
immunoblottingu.
W rozpoznaniu różnicowym należy uwzględnić:
•
postać płucną pasterelozy
•
nietypową postać myksomatozy
•
enterotoksemię
•
bakteriemię z uogólnionym wykrzepianiem wewnątrznaczyniowym
•
zatrucia
•
udar cieplny
Postępowanie
Należy do chorób z listy OIE. W kraju zgodnie z Ustawą o ochronie zdrowia zwierząt oraz zwalczaniu chorób zakaźnych
zwierząt z dnia 11 marca 2004 roku wirusowa krwotoczna choroba królików należy do chorób podlegających obowiązkowi
rejestracji.
•
Jedynym skutecznym sposobem zapobiegania są szczepienia profilaktyczne przy użyciu inaktywowanej szczepionki
narządowej, która cechuje się dobrymi właściwościami immunogennymi w zakresie stymulacji swoistych przeciwciał.
•
Króliki szczepi się w wieku powyżej 12 tygodni życia.
•
Dostępną w handlu jest szczepionka Cunivac, którą podaje się podskórnie lub domięśniowo w dawce 0,5 ml dla królików o
masie ciała do 1 kg oraz 1 ml dla zwierząt większych i starszych.
•
Odporność poszczepienna powstaje w ciągu 10-14 dni po immunizacji i utrzymuje przez 5-7 miesięcy.
•
Zwierzęta stada podstawowego należy powtórnie zaszczepić po upływie 6 miesięcy.
•
Przeciwwskazaniem jest szczepienie królików o słabej kondycji, wykazujących objawy chorobowe oraz młodszych niż 4-6
tygodni.
Wirusowe zapalenie jelit norek (mink viral enteritis)
Ostra i zaraźliwa choroba norek przebiegająca zwykle w postaci epizootii i powodująca duże straty hodowlane, zwłaszcza u
szczeniąt i młodych norek.
Epidemiologia
•
W warunkach naturalnych występuje jedynie u norek. Najczęściej notowana jest w miesiącach letnich (lipiec-wrzesień) -
obecność młodzieży. Dorosłe norki chorują rzadziej, przebieg łagodniejszy
•
Najbardziej wrażliwe norki powyżej 8 tyg życia (zanik odporności matczynej). Szczenięta od matek nie uodpornionych
podatne już w 5-6 tyg życia, przebieg piorunujący (12-24 godz.) bezobjawowy, wskaźnik śmiertelności 80%. Wraz z wiekiem
przebieg łagodniejszy, wskaźnik śmiertelności 5-50%.
Etiologia choroby
•
Bezotoczkowy parwowirus MEV (Mink Enteritis Virus), morfologiczne oraz strukturalnie zbliżony do pozostałych
parwowirusów kocich.
•
Wirus MEV wykazuje ścisłe pokrewieństwo antygenowe oraz zbliżoną budowę genomu z wirusem panleukopenii kotów,
parwowirusem psów typu 2 oraz parwowirusem lisów niebieskich.
•
Wirus MEV wykazuje właściwości hemaglutynacyjne wobec krwinek czerwonych małpy Rhesus oraz świni.
44
•
Pod względem budowy antygenowej oraz struktury genomu wyróżniamy trzy typy wirusa MEV (MEV1, MEV2 i MEV3),
pomiędzy którymi występują reakcje krzyżowe.
•
Wirus MEV w glebie na terenie fermy, powierzchni zakażonych klatek oraz kale zachowuje zakaźność w 180C do 6 miesięcy,
w niższej ponad 1 rok.
•
Jest oporny na działanie eteru, chloroformu, fluorokarbonu, butanolu, czterochlorku węgla.
•
Wirus zachowuje właściwości zakaźne w pH 3-9
•
Jest dość oporny na temperaturę - w 50oC ginie po 2 godz., w 70
C po 30 minutach. Dość szybko inaktywuje 2% formalina,
3-5% chloramina, 2% NaOH, 1% aldehyd glutarowy, 1% Virkon i
-propiolakton, czynniki utleniające oraz promienie
ultrafioletowe
Źródło zakażenia
•
W transmisji wirusa główną rolę odgrywa droga pozioma, a zakażenie następuje drogą pokarmową.
•
Zakażenie najczęściej w wyniku wprowadzania na fermę zwierząt w okresie inkubacji choroby lub pochodzących z ferm
zapowietrzonych.
•
Wirus posiada zdolność pokonywania bariery łożyskowej - zakażenie możliwe drogą pionową.
Zasadnicze źródło - zwierzęta chore, ozdrowieńcy oraz bezobjawowi nosiciele i siewcy zarazka.
•
U chorych zwierząt wirus pojawia się w kale już 3-4 dnia po zakażeniu.
•
Norki po przechorowaniu lub ocaleniu w wyniku szczepień interwencyjnych są trwałymi nosicielami, a siewstwo zarazka
może trwać przez okres około 12 miesięcy.
Wtórne źródło - niesterylne narzędzia, strzykawki, rękawice używane do chwytania podczas wykonywania zabiegów
lekarskich, zanieczyszczona karma i woda oraz sprzęt do poskramiania i pielęgnacji zwierząt.
Choroba w fermie szerzy się przez kontakt bezpośredni lub drogą pośrednią.
Szerzeniu choroby sprzyja:
•
rozsadzanie miotów
•
wykonywanie tatuaży
•
zabiegi profilaktyczne
•
personel przenoszący wirusa na odzieży ochronnej
W transmisji wirusa na dalsze odległości ważną rolę odgrywają koty, szczury, owady oraz ptaki żerujące w fermie, a
także pokazy, wystawy i obrót zwierzętami hodowlanymi.
Patogeneza choroby
•
Komórki docelowe: tkanki płodów, nabłonek jelit i komórki układu krwiotwórczego. Replikacja wirusa powoduje lizę
komórek i uszkodzenie tkanek i narządów.
•
Wirus po wniknięciu drogą pokarmową namnaża się w komórkach nabłonka jelit, skąd drogą naczyń krwionośnych i limfy
przedostaje się do tkanek limfatycznych (silna limfopenia), a po osiągnięciu szpiku kostnego (neutropenia).
•
U matek ciężarnych przenika do zarodków lub płodów ulegając intensywnej replikacji. Efektem jest wczesne zamieranie
zarodków, resorbcja płodów lub ronienia.
Przebieg kliniczny choroby zależy od:
•
zjadliwości wirusa
•
odmiany norki
•
wieku norki
Czynniki ryzyka:
niedożywienie, brak wody, upały oraz nadpsuta lub nieodpowiednia karma
Okres inkubacji choroby wynosi 4-7 dni.
Objawy kliniczne choroby
•
Choroba rozpoczyna się brakiem apetytu, utratą ruchliwości i wzrostem ciepłoty wewnętrznej ciała (40-40,6oC).
•
Charakterystycznym objawem są nienormalne obfite wypróżnienia zwierząt - obecność dużych ilości kału pod klatkami.
Bardzo szybko pojawia się biegunka - norki słabną i wykazują chwiejny chód.
•
W miarę rozwoju choroby kał staje się płynny, ciągliwy, zabarwiony zielonkawo ze smużkami krwi, strzępkami włóknika i
licznymi złuszczającymi nabłonkami śluzówki jelitowej.

45
•
Domieszka włóknika w kale jest uważana za objaw charakterystyczny. Niekiedy w kale obserwuje się obecność czopków
śluzowych, zabarwionych czerwono lub łososiowo.
•
W końcowym etapie dołączają się wymioty w postaci pienistej wydzieliny z domieszką żółci oraz rozwija się depresja.
•
Zejście śmiertelne zwykle 3-4 dnia po wystąpieniu objawów klinicznych.
•
Przechorowanie daje długotrwałą odporność, lecz zwierzęta te są trwałymi nosicielami i siewcami wirusa i stanowią
potencjalne źródło zakażenia.
Zmiany sekcyjne
Charakterystyczne zmiany głównie w przewodzie pokarmowym, zwłaszcza górny odcinek jelit cienkich.
•
Ściana jelit jest pogrubiona, natomiast ich światło jest rozszerzone i wypełnione białawą treścią pokarmową z domieszką
śluzu i krwi o swoistym ckliwym zapachu.
•
Ponadto stwierdza się nieżytowe, krwotoczne do włóknikowego włącznie zapalenie błony śluzowej jelit o różnym nasileniu.
•
Węzły chłonne krezkowe są obrzękłe i przekrwione
•
Śledziona powiększona koloru ciemnoczerwonego z pojedynczymi wynaczynieniami podtorebkowymi.
Rozpoznanie choroby
Wczesne i prawidłowe rozpoznanie zapobiega rozprzestrzenianiu się choroby w fermie, umożliwia szybką jej
likwidację oraz zmniejsza straty hodowlane.
Wstępne rozpoznanie przyżyciowe:
•
wywiad epizootiologiczny
•
objawy kliniczne
•
badania krwi (silna limfopenia i neutropenia)
Ostateczne rozpoznanie
• badania laboratoryjne pośmiertnie
W preparatach histologicznych stwierdza się:
•
martwicę lub złuszczanie komórek nabłonkowych kosmków jelitowych
•
charakterystyczne cytoplazmatyczne kwasoodporne ciałka wtrętowe w komórkach nabłonkowych jelit
Ostateczne rozpoznanie
badania immunocytochemiczne oraz izolacja wirusa w hodowlach pierwotnych komórek nerek kotów (CRFK)
•
Po 24-72 godzinnej inkubacji w 37oC wirus wywołuje silne zmiany cytopatyczne oraz wytwarza wewnątrzjądrowe
kwasochłonne ciałka wtrętowe.
•
Obecność antygenu wirusowego w preparatach odciskowych lub w skrawkach tkanek utrwalonych formaliną można
wykazać w teście immunofluorescencji oraz teście ELISA.
•
Badania immunocytochemiczne mogą być uzupełnione testem PCR - wykazanie obecności kwasu nukleinowego wirusa.
W rozpoznaniu różnicowym u norek należy uwzględnić:
•
zatrucia pokarmowe
•
biegunki o etiologii bakteryjnej
W tych przypadkach choroba pojawia się nagle, dotyczy wszystkich norek bez względu na wiek i cechuje się
wysokim wskaźnikiem zachorowalności i śmiertelności.
Rozstrzygają badania bakteriologiczne i toksykologiczne.
Postępowanie
Zgodnie z Ustawą o ochronie zdrowia zwierząt oraz zwalczaniu chorób zakaźnych zwierząt z dnia 11 marca 2004
roku wirusowe zapalenie jelit norek należy do chorób podlegających obowiązkowi rejestracji.
•
Brak leczenia przyczynowego.
•
W leczeniu objawowym można stosować chemioterapię w celu zapobiegania wtórnym infekcjom bakteryjnym.
•
Celem zmniejszenia stanu odwodnienia zalecane jest podawanie 5% glukozy, izotonicznych płynów wieloelektrolitowych
oraz środków osłaniających jelita.
•
Jedyną skuteczną metodą w zwalczaniu MEV w fermach zapowietrzonych jest natychmiastowa likwidacja wszystkich
chorych norek oraz szczepienia interwencyjne pozostałych zwierząt nie wykazujących klinicznych objawów choroby.

46
•
Duże znaczenie w zwalczaniu choroby ma właściwe żywienie zwierząt w okresie trwania epizootii oraz dewastacja zarazka
w środowisku zewnętrznym.
Skuteczną metodą ochrony norek przed zakażeniem są coroczne szczepienia profilaktyczne zwierząt stada podstawowego
oraz młodzieży.
•
Odporność bierna u szczeniąt utrzymuje się przez okres 6-8 tygodni.
•
W uodpornianiu czynnym stosowane są szczepionki inaktywowane oraz żywe atenuowane.
•
Odporność poszczepienna pojawia się w 7-10 dniu po immunizacji i trwa około 1 roku.
Szczepienia profilaktyczne stada podstawowego przeprowadza się w pierwszej połowie stycznia.
•
Gdy samice były uodpornione szczepionką inaktywowaną wówczas szczenięta należy uodpornić wieku 7-8 tygodni życia.
•
Jeżeli szczepionką żywą, młode norki należy zaszczepić w wieku 12-13 tygodni.
•
Stosuje się szczepienia skojarzone zawierające: szczepy inaktywowane - wirus MEV, Clostridium botulinum typ C,
Pseudomonas aeruginosa oraz atenuowany szczep wirusa nosówki.
GRZYBICE SKÓRNE LISÓW I KRÓLIKÓW
Są aktualnym i ważnym problemem i powodują duże straty ekonomiczne związane z:
•
obniżeniem przyrostów masy ciała
•
zahamowaniem rozwoju zwierząt
•
ograniczeniem obrotu zwierzętami hodowlanymi
•
zmniejszeniem wartości użytkowej lub dyskwalifikacją skór pochodzących od zwierząt chorych i ozdrowieńców
Grzybice skórne lisów i królików należą do zoonoz.
Występowanie dermatomikoz u lisów
•
Gdy zostanie zawleczona do fermy wolnej chorują lisy w różnym wieku, przy stacjonarnym występowaniu głównie
szczenięta w wieku 6-8 tygodni, a niekiedy już 3-4 tygodniowe lisięta
•
U lisiąt odsadzonych i starszych wrażliwość na grzybicę jest zróżnicowana, nawet w obrębie tego samego miotu.
•
Bardziej podatne są lisy polarne, a mniej lisy srebrzyste (objawy chorobowe są słabiej wyrażone).
•
Grzybica skórna lisów występuje głównie w okresie letnim, co związane jest z dużą wrażliwością zwierząt młodych.
•
Pojawia się pod koniec maja lub w czerwcu i utrzymuje się z różnym nasileniem do końca sierpnia, a nawet do września.
Grzybice skórne lisów
•
Pojawia się najczęściej pod koniec maja lub w czerwcu i utrzymuje się z różnym nasileniem do końca sierpnia, a czasem do
września (duża wrażliwość zwierząt młodych). Czas utrzymywania zależy głównie od metod postępowania i sposobu
żywienia
•
Bardziej podatne na grzybicę są lisy polarne (dość często postać uogólniona), a mniej lisy srebrzyste, u których objawy
chorobowe są słabiej wyrażone (pojedyncze ogniska).
•
Po zawleczeniu do fermy dotychczas wolnej chorują lisy w różnym wieku, natomiast przy stacjonarnym występowaniu
głównie szczenięta w wieku 6-8 tygodni (zanikanie odporności biernej), a niekiedy już 3-4 tygodniowe lisięta (szczególnie od
samic z niską laktacją).
•
U lisiąt odsadzonych i starszych wrażliwość jest zróżnicowana, nawet w obrębie tego samego miotu.
Występowanie dermatomikoz u królików
•
W systemie chowu halowego zachorowania przez cały rok - trudności w utrzymaniu odpowiednich warunków
zoohigienicznych, szczególnie temperatury i wilgotności oraz nadmierne zagęszczenie zwierząt
•
W małych hodowlach i w gospodarstwach przydomowych występuje sporadycznie, zaś zachorowania najczęściej w lecie, co
związane jest z okresem rozrodu.

47
•
Jeśli grzybica skórna zostanie zawleczona do fermy uprzednio wolnej od tej choroby chorują króliki w różnym wieku,
natomiast w fermach gdzie występuje ona stacjonarnie chorują głównie 5-8 tygodniowe króliczęta.
Czynniki ułatwiające rozwój grzybic skórnych lisów i królików
W szerzeniu się dermatomikoz istotną rolę odgrywają czynniki środowiskowe:
•
nadmierne zagęszczenie zwierząt
•
złe warunki zoohigieniczne
•
nieprzestrzeganie zasad sanitarno-weterynaryjnych, zwłaszcza brak prowadzonej dezynfekcji w ognisku zapowietrzonym
Wraz z istniejącym źródłem zakażenia powodują one szybkie rozprzestrzenianie się choroby w fermie.
Rozprzestrzenianiu się choroby sprzyjają prace hodowlane:
•
rozsadzanie miotów
•
tworzenie grup produkcyjnych
•
wykonywanie tatuaży
•
zabiegów profilaktycznych.
Podczas wykonywania tych czynności dochodzi do mechanicznego przenoszenia zarodników grzyba pomiędzy
zwierzętami oraz przypadkowych otarć i mechanicznych uszkodzeń naskórka, które stają się wrotami zakażenia i ułatwiają
inwazję grzyba.
Kolejną grupę czynników stanowią błędy żywieniowe, szczególnie niedobory białka i nienasyconych kwasów tłuszczowych
oraz mikroelementów i witamin.
•
Niedobór białka powoduje zahamowanie wzrostu zwierząt oraz zaburzenia w prawidłowym rogowaceniu naskórka.
Objawom tym towarzyszy zwykle świąd, który może być przyczyną urazów mechanicznych i dodatkowych stanów zapalnych
skóry.
•
Niedobór wielonienasyconych kwasów tłuszczowych objawia się zmatowieniem włosa, nadmiernym złuszczaniem się
naskórka oraz sączącymi stanami zapalnymi skóry.
Powstałe na tle niedoborów wymienionych składników pokarmowych zaburzenia metaboliczne powodują
obniżenie odporności lokalnej, co ułatwia wnikanie zarodników grzyba w głąb skóry i rozwój klinicznych objawów choroby
W rozwoju dermatomikoz istotną rolę odgrywają niedobory mikroelementów:
•
żelaza
•
miedzi
•
cynku
•
witamin, szczególnie z grupy A i H
Bezwzględny lub względny niedobór pierwiastków oraz witamin (wzajemne wypieranie powoduje nadmiar jednych i
niedobór drugich, obecność substancji inaktywujących - tlenektrójmetyloaminy-Trioks, awidyna, tiaminaza, nadmiar
fitozanów w karmie).
Ich niedobór powoduje osłabienie odporności komórkowej, która odgrywa główną rolę w odporności przeciwgrzybiczej.
Podstawowym pierwiastkiem, którego niedobór może powodować lub pogłębiać istniejące już zmiany skórne jest cynk
(udział w syntezie białka i przemianie węglowodanowej skóry).
•
Niski jego poziom - może być wynikiem niedoborów pierwotnych lub jego niedostępnością biologiczną spowodowaną
nadmiarem związków fitynowych w pokarmie, a także wzajemnym wypieraniem się mikroelementów - duża zawartość
wapnia, miedzi i żelaza w pokarmie powoduje zaburzenia we wchłanianiu cynku.
Niedobór cynku powoduje zaburzenia w prawidłowym rogowaceniu naskórka.
Odpowiednia jego zawartość w dawce pokarmowej warunkuje prawidłowe funkcjonowanie komórkowych
mechanizmów odpornościowych, które odgrywają zasadniczą rolę w zakażeniach wywołanych dermatofitami.
Czynnikiem ryzyka jest długotrwałe stosowanie dodatków do paszy o zamierzonym lub niepożądanym działaniu
immunosupresyjnym.
•
Rozwijająca się pod ich wpływem immunosupresja jest wynikiem bezpośredniego działania uszkadzającego na szlaki
przemian w komórkach układu immunologicznego, toksycznego uszkodzenia komórek szpiku kostnego, hamowania
aktywności fagocytów i proliferacji limfocytów.
Inhibicyjny wpływ na UI wywierają infekcje wirusowe i bakteryjne.
48
•
Działanie immunosupresyjne wirusów polega m.in. na bezpośrednim uszkodzeniu komórek zaangażowanych w fagocytozie,
komórek prezentujących antygen oraz na zaburzeniu mechanizmów immunoregulacji prowadzącym do nadreaktywności
limfocytów T supresorowych. —
•
Immunosupresja wywołana infekcją bakteryjną jest efektem zaburzeń pochłaniania i zabijania w odczynie fagocytarnym,
działania toksycznego na komórki układu odpornościowego oraz indukcji poliklonalnej proliferacji limfocytów T.
•
W przypadku infekcji bakteryjnych stan immunosupresji dodatkowo pogłębiany jest stosowaniem antybiotyków o szerokim
spektrum działania w terapii przyczynowej tych schorzeń (najczęściej salmoneloza)
Etiologia dermatomikoz
•
Najczęściej występującą dermatomikozą u lisów i królików jest trychofitoza, której zasadniczym czynnikiem jest
Trichophyton mentagrophytes, cechujący się dużą zaraźliwością.
•
Sporadycznie występują zachorowania na tle T. verrucosum oraz M. canis i M. gypseum.
Spory dermatofitów cechują się znaczną opornością na czynniki środowiska zewnętrznego.
•
Artrospory T. verrucosum zachowują żywotność nawet po upływie 4-4,5 roku, zaś T. mentagrophytes i M. canis przez okres
1,5 roku.
Duża oporność dermatofitów na czynniki środowiska oraz środków odkażających ma zasadniczy wpływ na
stacjonarne utrzymywanie się grzybicy w fermach zapowietrzonych
Źródło zakażenia
Pierwotnym i zasadniczym - zwierzęta chore, bezobjawowi nosiciele i ozdrowieńcy.
•
U dorosłych lisów pojedyncze ogniska grzybicze mogą się utrzymywać na opuszkach palcowych i w pazurach, natomiast u
królików na skokach.
•
Zwierzęta te pozostawione do rozrodu stanowią potencjalne źródło zakażenia dla osesków oraz zwierząt
nowowprowadzonych z ferm wolnych od tej choroby.
•
Pierwotnym źródłem mogą być zwierzęta gospodarskie i domowe, a szczególnie psy i koty.
•
Permanentnym źródłem infekcji są szczury i myszy bytujące w fermach, u których nosicielstwo wynosi około 16% populacji.
Wtórne - klatki, wykotniki i gniazda wykotowe, sprzęt fermowy oraz ziemia spod klatek zanieczyszczona sporami.
Patogeneza choroby
•
Dermatofity posiadają wybitne powinowactwo do keratyny, stąd atakują i pasożytują na zrogowaciałych warstwach skóry,
pazurach i włosach.
•
W warunkach naturalnych do zakażenia dochodzi przez wtarcie spor grzyba w naskórek. Stąd pierwotne ogniska grzybicze
powstają głównie w miejscach najbardziej narażonych na otarcia i drobne skaleczenia
•
Spory po wniknięciu w naskórek lub okolicę mieszka włosowego pączkują i wytwarzają rozgałęzione nitki grzybni, które
przerastają naskórek bądź oplatają włosy jak siateczka i wrastają w nie.
•
Niektóre dermatofity wytwarzają substancje hamujące rozwój odporności przeciwgrzybiczej organizmu, do których m.in.
należą mannany (glikoproteidy), zawarte w ścianie komórkowej grzyba i uwalniane w czasie jego wzrostu.
•
Produkowane przy tym enzymy keratolityczne i produkty przemiany materii grzybów działają silnie drażniąco, co powoduje
miejscowe odczyny zapalne i hiperkeratozę naskórka.
•
Gromadzący się wysięk surowiczy skleja przerosłe komórki naskórka i tworzy charakterystyczne azbestowe strupy. Włosy
wypadają lub łamią się przy powierzchni skóry, w wyniku uszkodzenia ich struktury przez grzybnię.
Zmiany chorobowe rozwijają się powoli i są widoczne po 3-4 tygodniach od zakażenia.
Objawy kliniczne
Rozwój klinicznych objawów trychofitozy u lisów i królików zależy od sprawności mechanizmów odporności
przeciwgrzybiczej.
•
Kontakt organizmu z dermatofitem przy sprawnie funkcjonujących mechanizmach obronnych przyczynia się jedynie do
długotrwałego nosicielstwa.
•
Natomiast supresja odporności u zwierząt przebywających w środowisku zakażonym usposabia do zakażenia i rozwoju
jawnej postaci grzybicy skórnej.
Trychofitoza u lisów i królików przebiega w trzech postaciach klinicznych:
•
głębokiej (strupiastej)
•
powierzchownej (strzygącej)
•
poronnej (utajonej)
Wystąpienie postaci klinicznej choroby w dużej mierze zależy od wieku zwierząt.

49
Obraz kliniczny trychofitozy lisów
Postać głęboka
•
Występuje głównie u lisiąt oraz zwierząt dorosłych o osłabionej rezystencji.
•
Początkowo obserwuje drobne, guzkowate nacieki na pyszczku, wokół oczu, głowie, na krawędziach i wewnętrznej stronie
małżowiny usznej, na żuchwie, dolnych odcinkach kończyn i ogonie.
•
W dalszej kolejności w miejscach tych powstają ostro odgraniczone, owalne lub okrągłe wyłysienia pokryte początkowo
pęcherzykami a następnie drobnymi szaro-białymi, azbestowymi strupami.
•
U 3-4 tygodniowych szczeniąt dochodzi często do uogólnienia procesu i zmiany grzybicze obejmują całe partie skóry na
głowie, tułowiu, w okolicy pośladków i ogonie.
•
U lisów dorosłych przy postaci strupiastej zmiany grzybicze zlokalizowane są głównie na kończynach od wysokości stawów
łokciowych lub skokowych oraz ogonie.
•
Mają one charakter dość grubych tęgich strupów koloru szarego lub szaro-żółtawego, mocno zespolonych ze skórą.
•
Zmiany te u zwierząt nie leczonych mogą utrzymywać się przez okres kilku miesięcy.
•
U niektórych zwierząt obserwuje się stany zapalne opuszek i zmiany pomiędzy palcami.
Postać powierzchowna
•
Dominuje u lisów dorosłych, a jej przebieg jest na ogół łagodny.
•
Pierwszym klinicznie uchwytnym objawem jest zmatowienie i przerzedzenie włosa. W miejscach tych dochodzi do
hiperkeratozy i nadmiernego łuszczenia się naskórka, a następnie pojawiają się owalne lub okrągłe wyłysienia na skutek
wypadania lub ułamywania się włosów.
•
Zmiany chorobowe w postaci drobnych szaro-białych ognisk zlokalizowane są głównie na kończynach i ogonie, a niekiedy
także na opuszkach, w przestrzeniach międzypalcowych oraz grzbietowej powierzchni palców.
•
Wskutek obrzęku opuszek i stanów zapalnych fałdów międzypalcowych u lisów dorosłych obserwuje się często brak
apetytu, sztywny chód lub kulawiznę oraz stopniowe chudnięcie.
•
W przypadku wtórnych ropnych zakażeń bakteryjnych dochodzi nawet do zejść śmiertelnych.
•
Samce - osowienie i niechęć do krycia, u samic opóźniona lub zupełny brak rui.
•
U części lisów procesem objęte są pazury, które są zgrubiałe i nadmiernie wyrośnięte o szorstkiej, chropawej powierzchni,
na której pojawiają się białawe lub żółtawe plamy i są łamliwe. Skóra u ich nasady jest silnie zrogowaciała i miejscami
przekrwiona.
•
W zmienionych pazurach zarazek zachowuje żywotność przez długi okres czasu, co powoduje znaczne trudności w
eliminacji chorych zwierząt.
Postać poronna
•
Dominuje u lisów dorosłych, a jej przebieg jest na ogół łagodny.
•
Cechuje się ogniskowym przerzedzeniem i słabym osadzeniem okrywy włosowej. W miejscach tych stwierdza się nadmierne
rogowacenie i dość silne łuszczenie naskórka.
•
Zmiany te utrzymują się przez kilka tygodni i zwykle samoistnie ustępują.
Obraz kliniczny trychofitozy królików
Postać głęboka
•
Występuje u królików w wieku 5-8 tygodni.
•
Ogniska grzybicze w postaci owalnych wyłysień pokrytych szaro-białymi lub azbestowymi strupami pojawiają się najpierw
na czubku i grzbiecie nosa, wokół oczu, na małżowinach usznych oraz w okolicy łopatek.
•
Ogniska te stopniowo powiększają się i rozprzestrzeniają się na skórę grzbietu, pośladków i dolnych odcinków kończyn i
wówczas dochodzi do uogólnienia procesu chorobowego. U części zwierząt stada podstawowego zmiany grzybicze w
postaci drobnych szaro-białych ognisk mogą występować jedynie na skokach.
•
U zwierząt nie leczonych zmiany utrzymują się przez 3-4 miesiące, prowadząc do obniżenia przyrostów masy ciała, a nawet
charłactwa.
•
Straty przychówka spowodowane koniecznością eliminacji królików charłaczych mogą sięgać do kilkunastu procent.
Postać powierzchowna
•
Dominuje u królików dorosłych.

50
•
Pierwszym widocznym objawem jest zmatowienie i przerzedzenie okrywy włosowej oraz nadmierne łuszczenie się
naskórka.
•
Typowe ogniska grzybicze powstają początkowo na głowie i małżowinach usznych, a następnie na skórze grzbietu,
pośladków i dolnych odcinków kończyn.
•
W miejscach tych pojawiają się wyłysienia spowodowane ułamywaniem się lub wypadaniem włosów.
•
Zmiany te samoistnie ustępują po 2-3 miesiącach.
•
Dermatofity atakują również pazury, na których pojawiają się charakterystyczne białawe lub żółtawe plamy.
•
Następnie pazury kruszą się lub ułamują, a na opuszkach tworzą się szaro-żółtawe naloty.
•
Zmiany te utrzymują się przez wiele miesięcy.
•
U części królików stada podstawowego zmiany grzybicze w postaci drobnych szaro-białych ognisk mogą występować
również na skokach.
W chorobowo zmienionych pazurach oraz na skórze skoków zarazek zachowuje żywotność przez długi okres czasu,
co powoduje znaczne trudności w zwalczaniu trychofitozy
Postać poronna
•
Występuje wyłącznie u królików dorosłych.
•
Cechuje się ogniskowym przerzedzeniem okrywy włosowej i intensywnym łuszczeniem się naskórka, sporadycznie może
dochodzić także do wyłysień.
•
Zmiany te ulegają zwykle samowyleczeniu po upływie 4-5 tygodni od momentu ich wystąpienia.
Rozpoznanie choroby
Rozpoznanie trychofitozy opiera się na:
•
obrazie klinicznym
•
badaniu mikroskopowym zeskrobiny
•
badaniu hodowlanym zeskrobiny
•
Stwierdzenie obecności artrospor w preparatach mikroskopowych stanowi wystarczające dla praktyki weterynaryjnej
potwierdzenie rozpoznania grzybicy.
•
Jednakże ostateczne rozpoznanie trychofitozy jest możliwe na podstawie izolacji dermatofitów na podłożach hodowlanych
oraz ich identyfikacji.
W rozpoznaniu różnicowym należy uwzględnić:
•
świerzb uszny
•
świerzb drążący
•
Nużycę
Świerzb uszny
•
u lisów drapanie okolicy uszu, potrząsanie głową oraz wypływ z zewnętrznego otworu słuchowego
•
u królików dodatkowo strupy i krosty na wewnętrznej powierzchni małżowiny usznej
Świerzb drążący
•
zmiany chorobowe lokalizują się najczęściej na skórze kończyn, wewnętrznej stronie ud i u nasady ogona
•
początkowo tworzą się nieregularne wykwity pokryte krostami, a następnie otrębiaste strupy i ubytki włosów oraz
towarzyszy silny świąd (brak jego przy grzybicach), prowadzący do rozległych uszkodzeń skóry
•
wydostająca się wydzielina surowicza zlepiając okoliczne włosy, tworzy kilkumilimetrową skorupę
Ostatecznie rozstrzyga badanie mikroskopowe i hodowlane zeskrobiny pobranej z chorobowo zmienionych partii
skóry.
Nużyca
•
u zwierząt futerkowych, zwłaszcza królików, występuje dość rzadko i przebiegać może w postaci łuszczącej lub krostowatej
•
przy postaci łuszczącej zmiany w postaci wyłysień oraz intensywnie łuszczącego się naskórka zlokalizowane są głównie w
okolicy głowy
•
przy postaci krostowatej stwierdza się obecność twardych krost i guzków, z których po ich pęknięciu wydostaje się ropna
wydzielina, tworząca szarobrunatne strupy
Rozstrzyga badanie mikroskopowe i hodowlane.
Postępowanie
Leczenie i zwalczanie grzybicy skórnej zwierząt futerkowych, zwłaszcza w dużych fermach towarowych lub hodowlanych
jest trudne i mało skuteczne

51
•
duża oporność spor na środowisko i środki dezynfekcyjne
•
utrudnione wnikanie leków przeciwgrzybiczych
•
wysoka toksyczność i mała skuteczność
•
działanie supresyjne, toksyczne i teratogenne niektórych leków systemowych
W leczeniu i zwalczaniu grzybicy skórnej stosuje się:
•
izolację zwierząt chorych
•
leczenie miejscowe przy użyciu środków fungicydnych
•
leczenie ogólne polegające na podawaniu chemioterapeutyków i swoistych biopreparatów
•
Należy eliminować ozdrowieńców oraz przeprowadzać okresową dezynfekcję klatek i sprzętu fermowego.
•
Przy zwalczaniu grzybicy skórnej uwzględnić należy likwidacje pierwotnych i wtórnych źródeł zakażenia oraz poprawę
warunków sanitarno-zoohigienicznych i żywienia zwierząt.
•
Zasadniczym źródłem zakażenia dla lisów są zwierzęta przewlekle chore lub bezobjawowi nosiciele, pochodzące z fermy
zapowietrzonej.
•
Konieczność dokładnych oględzin zwierząt przeznaczonych do dalszej hodowli.
•
W postępowaniu tym należy uwzględnić również zwierzęta wprowadzane do fermy w której ta choroba dotychczas nie
występowała.
•
Eliminacja nosicieli oraz dezynfekcja klatek i sprzętu umożliwia unieszkodliwienie potencjalnych źródeł zakażenia.
Leczenie
W leczeniu trychofitozy lisów i królików stosuje się:
•
leczenie miejscowe (środki fungicydne)
•
leczenie ogólne (podawanie chemioterapeutyków lub swoistych biopreparatów)—
•
Postać powierzchowna nie przedstawia większego problemu - leczenie miejscowe wraz z dokładną dezynfekcją klatek
pozwala chorobę opanować.
•
Znacznie trudniejsza jest postać głęboka - wymaga dłuższego leczenia oraz dochodzi do nawrotu choroby.
•
Leczenie miejscowe (maści oraz kąpiele lub opryski) wraz z dokładną dezynfekcją klatek. Jest pracochłonne oraz mało
efektywne gdyż u znacznego odsetka zwierząt dochodzi do nawrotu choroby.
Najbardziej skuteczne są preparaty jodoforowe oraz Imaverol używane do kąpieli lub oprysków.
•
Preparaty jodoforowe powodują zażółcenie zwłaszcza białego włosa, które utrzymuje się do jednego miesiąca, a niekiedy
dłużej. Stąd też nie mogą być stosowane przed okresem zbliżajacego się skórowania.
•
Imaverol cechuje się dobrymi właściwościami fungicydnymi oraz niską toksycznością dla zwierząt. Może być stosowany w
leczeniu wspomagającym swoistą immunoterapie grzybic skórnych zwierząt futerkowych.
•
Leczenie miejscowe może być wspomagane doustnym podawaniem gryseofulwiny.
•
Jednakże ze względów ekonomicznych antybiotyk ten nie jest używany w szerszym zakresie u lisów.
•
Ponadto gryseofulwina nie może być podawana samicom w okresie krycia i w pierwszym okresie ciąży, ponieważ działa
toksycznie i teratogennie na płody.
Swoista profilaktyka
W profilaktyce, a także leczeniu trychofitozy największe znaczenie mają szczepionki.
Ich stosowanie jest najbardziej efektywną metodą w zwalczaniu grzybicy w fermach, w których choroba utrzymuje się
stacjonarnie.
• W kraju produkowana jest szczepionka Alopevac.
• Szczepienia profilaktyczne stada podstawowego przyczyniają się do wydatnego obniżenia wskaźnika zachorowalności u
przychówka w przypadku pojawienia się grzybicy w fermie.
• Ponadto brak zachorowań u najmłodszych zwierząt pochodzących od samic szczepionych w dużym stopniu ogranicza
straty przychówka.
•
Zdecydowanie lepsze wyniki terapeutyczne uzyskuje się kiedy oprócz leczenia miejscowego stosuje się doustnie
gryseofulwinę.
•
Względy ekonomiczne uniemożliwiają stosowanie antybiotyku, a ponadto gryseofulwina podawana samicom w okresie
krycia i w pierwszym okresie ciąży działa toksycznie i teratogennie na płody.

52
WYBRANE CHOROBY ZAKAŹNE KRÓLIKÓW
PASTERELOZA (PASTEURELLOSIS CUNICULORUM; RABBIT SEPTICAEMIA)
Zakaźna i zaraźliwa choroba królików domowych i dziko żyjących oraz zajęcy przebiegająca w kilku formach klinicznych.
Epidemiologia i etiologia
•
Szeroko rozpowszechniona i powoduje duże straty ekonomiczne w małych i dużych fermach.
•
Pojawia się najczęściej nagle i przebiega w postaci enzootii.
•
Pasteurella. multocida bytuje jako komensal na błonach śluzowych jamy nosowej, gardła, tchawicy i pochwy oraz w jamie
bębenkowej ucha środkowego.
Około 30-90% królików dorosłych jest nosicielami zarazka.
Etiologia
Przyczyną jest Gram-ujemna bakteria Pasteurella multocida należąca do rodzaju Pasteurella.
•
Na podłożach stałych może tworzyć kolonie S (gładkie), M (śluzowe) i R (szorstkie).
•
Szczepy szorstkie są bezotoczkowe i niezjadliwe.
•
Szczepy śluzowe i gładkie zawierają otoczkę i są wysoce zjadliwe.
•
Przewlekłą postać pasterelozy wywołują głównie szczepy tworzące kolonie śluzowe.
Na podstawie różnic w budowie antygenowej otoczki wyróżnia się 5 serotypów zarazka: A, B, D, E i F.
•
U królików najczęściej wystepuje serotyp A, rzadziej D.
•
Serotyp A występuje jako komensal górnych dróg oddechowych.
•
Zjadliwe szczepy serotypu A posiadają fimbrie za pomocą których kolonizują nabłonek.
•
Formy śluzowe pastereli należące do serotypu A zawierające w otoczce kwas hialuronowy są oporne na fagocytozę.
•
Serotyp A posiada słabe właściwości immunogenne, ze względu na wysoką homologię pomiędzy strukturą kwasu
hialuronowego zawartego w otoczce bakterii i komórkach makroorganizmu.
•
Słaba odpowiedź immunologiczna lub jej brak w przebiegu zakażeń wywołanych tymi szczepami warunkuje długotrwałe
utrzymywanie się infekcji w organizmie królika.
•
Formy szorstkie serotypu D są podatne na fagocytozę, natomiast są oporne na procesy wewnątrzkomórkowego zabijania.
•
Produkują one termochwiejną dermonekrotoksynę.
•
Szczepy P. multocida typu D wraz z Bordetella bronchiseptica wywołują zakaźne zanikowe zapalenie nosa.
•
B. bronchiseptica ułatwia kolonizację dróg oddechowych przez P. multocida.
•
Na podstawie różnic, głównie w budowie antygenów lipopolisacharydowych, wyróżnia się grupy serologiczne (serowary
zarazka) oznaczone cyframi arabskimi.
•
Większość szczepów P. multocida izolowanych od chorych królików należy do serowaru 12 i 3.
Pasterele w 21-270C i wilgotności względnej 32-77% przeżywają w:
•
kurzu 2-3 dni
•
suchym powietrzu 48-72 godzin
•
wodzie 8 dni
•
gnojowicy 6 dni
•
wydzielinie jamy nosowej 49 dni
•
zamrożonych w -200C tkankach lub we krwi przez lata
•
nawozie oraz w rozkładających się zwłokach kilka miesięcy
Pasterele są mało oporne na działanie promieni słonecznych oraz inaktywację cieplną:
w 600C giną po 30 min.
w 950C po 5 minutach
Dość szybko są inaktywowane pod wpływem:
•
0,2% formaliny (5 min)
•
0,5% fenolu (1 min.)
•
1% mleka wapiennego i chloraminy (10 min)
Są wrażliwe na antybiotyki z grupy penicylin, cefalosporyn, chloramfenikolu, enrofloksacyny, tetracyklin i
sulfonamidów potencjonowanych.

53
Źródło i drogi zakażenia
•
Pierwotne źródło zakażenia - chore zwierzęta wydalające zarazek z moczem, kałem, śliną oraz wydzieliną z nosa i dróg
rodnych.
•
Dla osesków głównym źródłem są bezobjawowo zakażone królice wydalające zarazek z wydzieliną z nosa lub mleko
pochodzące od matek chorych na zapalenie gruczołu sutkowego.
•
Zakażenie następuje głównie drogą aerogenną, rzadziej pokarmową lub przez uszkodzone błony śluzowe.
•
Zakażenie endogenne - autoinfekcja, następnie szerzy się drogą łańcuchowo-kontaktową.
•
Wtórne źródło zakażenia stanowi zanieczyszczona tymi bakteriami woda i karma (zakażenie egzogenne). Wskaźnik
zachorowalności wynosi ponad 70%.
Spadek odporności pod wpływem czynników stresogennych:
•
ciąża, laktacja
•
długotrwały i w niewłaściwych warunkach transport królików
•
inwazje pasożytnicze (kokcydioza)
•
niewłaściwa pasza lub gwałtowna jej zmiana
•
niedobory mineralno-witaminowe (białka i witamin A i E)
•
nieodpowiednie warunki bytowania: szczególnie duże wahania temperatury i przeciągi w pomieszczeniach halowych,
niesprawna wentylacja - nadmierna wilgotność i wysokie stężenie amoniaku, nadmierne zagęszczenie zwierząt
Rozwój choroby (patogeneza)
•
Po wniknięciu zarazek kolonizuje nabłonek gardła, skąd rozprzestrzenia się do jamy nosowej, a następnie dolnych dróg
oddechowych.
•
W przypadku nosicielstwa w uchu środkowym bakterie rozprzestrzeniają się przez układ limfatyczny do ucha
wewnętrznego.
•
Spadek odporności lokalnej (główna rola przeciwciał sIgA) - zarazek przedostaje się do krwi (posocznica) i tą drogą do
narządów wewnętrznych.
•
Mechanizm chorobotwórczego działania P. multocida polega na zdolności adhezji do komórek nabłonka dróg oddechowych
przy pomocy swoistych receptorów (fimbrii), inwazji w głąb tkanek zakażonego narządu, wysokiej oporności zarazka na
fagocytozę przez neutrofile oraz bakteriobójcze działanie surowicy i komplementu, a także produkcji egzo- i endotoksyn.
•
Szczepy typu A z uwagi na posiadanie fimbrii wykazują znacznie większy stopień adhezji.
•
Szczepy te posiadają w swojej otoczce kwas hialuronowy - zapewnia im oporność na działanie fagocytozy oraz warunkuje
brak lub słabą odpowiedź immunologiczną (mechanizm ucieczki zarazka z pod kontroli immunologicznej).
•
Obecność lipopolisacharydów w otoczce - niepodatność na bakteriobójcze działanie surowicy i składowych dopełniacza.
•
Szczepy typu D - wytwarzają ciepłochwiejną dermonekrotoksynę, jednego z najsilniejszych mitogenów.
•
W wyniku jej mitogennego oddziaływania na osteoblasty następują zaburzenia w osteogenezie kości w postaci rozplemu
tych komórek w obrębie zrębu kostnego małżowin nosowych.
•
Efektem tego jest zanik i deformacja małżowin.
•
Wywołuje również włóknikowo-ropne zapalenie opłucnej, płuc i worka osierdziowego oraz martwicę wątroby i zanik tkanki
limfoidalnej śledziony.
•
P. multocida po wniknięciu do organizmu indukuje wzmożony napływ leukocytów wielojądrzastych.
•
W przypadku braku swoistych przeciwciał, pełniących rolę opsonin, pasterelle nie ulegają fagocytozie, co sprzyja szybkiemu
rozprzestrzenianiu się zakażenia w organizmie.
•
Nabytą odporność protekcyjną zapewniają mechanizmy humoralne.
•
Zopsonizowane zarazki ulegają fagocytozie i inaktywacji.
•
Obecność swoistych przeciwciał uniemożliwia rozprzestrzenianie się zakażenia drogą hematogenną i w ten sposób chroni
organizm przed rozwojem zapalenia płuc.
•
Szczepionki inaktywowane indukują swoistą odporność humoralną.
•
Swoiste przeciwciała posiadają właściwości protekcyjne i w pełni hamują rozwój zakażenia.
•
W praktyce nie zawsze uzyskuje się porządane efekty terapeutyczne po podaniu swoistych przeciwciał, ze względu na
róznorodność serotypów zarazka obecnych we środowisku zewnętrznym.
•
Maksymalną protekcyjną odpowiedź immunologiczna uzyskuje się wówczas, gdy jest ona indukowana zarówno wobec
antygenów otoczkowych jak i leukotoksynie.
•
Jednakże leukotoksyna, która zapobiega rozwojowi objawów klinicznych choroby, nie stanowi składowej szczepionek
zabitych.
Objawy kliniczne
Rozwój i przebieg choroby uwarunkowany jest
•
rodzajem i stopniem zjadliwości szczepu zakażającego
•
wiekiem i statusem immunologicznym zwierząt
•
wystąpieniem czynników ryzyka
U królików pastereloza występuje w formie

54
•
pierwotnej, która może być dodatkowo wikłana przez bakterie Pseudomonas aeruginosa
•
wtórnej w przebiegu infekcji wywołanych przez wirus parainfluenzy-3 i mykoplazmy
U osesków zachorowania na pasterelozę występują bardzo rzadko (naturalna odporność bierna utrzymująca się do 21-25
dnia życia).
•
U osesków pozbawionych swoistych przeciwciał choroba przebiega w postaci nadostrej lub ostrej posocznicy.
•
Choroba pojawia się nagle.
•
Okres inkubacji wynosi około 12 godzin i cechuje ją szybki przebieg (12-18 godzin) bez rozwoju charakterystycznych
objawów klinicznych oraz wysoki wskaźnik śmiertelności wynoszący ponad 90%.
•
Najbardziej podatne są króliki w wieku 8-22 tygodni życia (zanik swoistej odporności biernej oraz stres adaptacyjny).
•
Okres inkubacji wynosi ponad 14 dni.
U młodych królików oraz zwierząt dorosłych P. multocida wywołuje szereg postaci klinicznych o przebiegu ostrym lub
przewlekłym:
•
posocznica
•
przewlekłe nieżytowe zapalenie nosa i zatok
•
ropnie w tkance podskórnej
•
ropne zapalenie ucha środkowego i wewnętrznego
•
ropne zapalenie mózgu
•
enzootyczne zapalenie płuc
•
infekcje układu rozrodczego i gruczołu sutkowego
•
ropne zapalenie otrzewnej i worka osierdziowego.
U zwierząt dorosłych i w dobrej kondycji przebieg choroby może być asymptomatyczny.
Pastereloza królików, szczególnie w hodowlach dotychczas wolnych od tej choroby, rozpoczyna się zwykle:
•
wzrostem temperatury ciała (41-420C)
•
objawami ogólnymi w postaci silnego osłabienia, braku łaknienia
•
nieżytem błony śluzowej nosa (wodnisty wyciek z otworów nosowych i częste kichanie)
•
w kolejnych dniach wyciek przybiera charakter śluzowo-ropny lub ropny oraz pojawia się kaszel
•
Dalszy przebieg pasterelozy uwarunkowany jest stanem odporności zwierząt oraz warunkami zoohigenicznymi fermy.
•
U królików ze sprawnym UI i przebywających względnie poprawnych warunkach choroba może mieć charakter lokalny w
postaci ropnego zapalenia błony śluzowej górnych dróg oddechowych lub objawy te mogą samoistnie ustępować.
•
Przy zaistnieniu czynników ryzyka rozwija się zapalenie płuc, które w dalszym okresie może mieć charakter endemiczny.
•
U chorych królików nasilający się kaszel i kichanie powodują trudności w oddychaniu, a następnie w wyniku rozwoju
włóknikowo-krwotocznego odoskrzelowego zapalenia płuc pojawia się silna duszność.
•
U młodych królików obserwuje się zahamowanie przyrostów masy ciała.
•
U dorosłych samic może występować ostre nieżytowe lub ropne zapalenie błony śluzowej macicy, któremu towarzyszy
surowiczy, śluzowy lub śluzowo-ropny wypływ z dróg rodnych.
•
U samic ciężarnych występują ronienia.
•
U samców rozwija się zapalenie jąder i najądrzy.
Ostra postać pasterelozy kończy się zwykle po kilku dniach zejściem śmiertelnym, natomiast u zwierząt, które
przeżyły rozwija się przewlekła postać choroby.
•
Przy postaci przewlekłej przebieg kliniczny i wskaźnik śmiertelności zależy od zjadliwości zakażającego szczepu i warunków
bytowania zwierząt.
•
U zwierząt chorych obserwuje się brak połysku i nastroszenie włosa, silne wycieńczenie oraz szybkie chudnięcie.
•
Objawom tym towarzyszy ropne zapalenie nosa i zatok, zapalenie gałki ocznej i biegunka.
•
Króliki stają się anemiczne.
•
W przebiegu przewlekłej postaci choroby rozwija się włóknikowe odoskrzelowe zapalenie płuc i opłucnej oraz zapalenie
osierdzia.
•
W jamie klatki piersiowej oraz w worku osierdziowym gromadzi się wysięk.
•
Często dochodzi do rozwoju zapalenia ucha środkowego i wewnętrznego, które objawia się obecnością żółtoszarego
wypływu w przewodzie słuchowym oraz kręczem szyi (torcicollis).
•
U części samic występuje przewlekły stan zapalny układu rozrodczego (pochwy i macicy), który manifestuje się spadkiem
plenności oraz ronieniami i ropnym zapaleniem gruczołu sutkowego.
•
U samców ropne zapalenie jąder i najądrzy oraz zaburzenia w płodności.
•
Chorobie towarzyszy tworzenie się ropni w tkance podskórnej i mięśniach.
•
Sporadycznie przewlekła postać pasterelozy może przebiegać bez wyraźnie zaznaczonych objawów klinicznych.
•
Rokowanie choroby jest z reguły niekorzystne.
•
Zwierzęta po trwającej kilka tygodni, a nawet miesięcy chorobie padają wskutek skrajnego charłactwa.
Zmiany sekcyjne

55
Postać ostra posocznicowa
•
silna wybroczynowość na błonach śluzowych i surowiczych oraz w wielu narządach wewnętrznych
•
nieżytowe lub ropne zapalenie błony śluzowej nosa i zatok (obecność dużej ilości ropy)
•
błona śluzowa nosa jest znacznie obrzękła, pokryta punkcikowatymi owrzodzeniami
•
płuca są powiększone, obrzękłe, przekrwione koloru jasnopurpurowo czerwonego i pokryte włóknikiem
•
w tkance płucnej stwierdza się obecność licznych wybroczyn towarzyszących krupowemu zapaleniu płuc
•
w tchawicy i jamie klatki piersiowej duża ilość krwistego płynu
Postać przewlekła oprócz charakterystycznych zmian w obrębie jamy nosowej stwierdza się:
•
ropne zapalenie tchawicy
•
surowiczo-włóknikowo lub włóknikowo-ropne odoskrzelowe zapalenie płuc, opłucnej i osierdzia
•
w wątrobie występują prosówkowe ogniska martwicze i ziarniniaki
•
ogólne charłactwo
•
liczne ropnie w tkance podskórnej, mięśniach, płucach, a także jądrach, macicy, mózgu, uchu środkowym, sercu
•
u samic ropne zapalenie macicy oraz gruczołu mlekowego
•
macica jest znacznie powiększona i w początkowym stadium choroby wypełniona surowiczym wysiękiem, zaś w
późniejszych etapach białą wydzieliną z dużą ilością neutrofilów
•
niekiedy na endometrium występują owrzodzenia
•
u samców obserwuje się ropne zapalenie jąder i najądrzy
Rozpoznanie
Wstępne rozpoznanie na podstawie
•
objawów klinicznych
•
zmian sekcyjnych
Ostateczne rozpoznanie
•
izolacja zarazka z narządów wewnętrznych, węzłów chłonnych i krwi
•
określenie jego serotypu i zdolności wytwarzania toksyn
•
Przyżyciowo materiał do badań bakteriologicznych stanowi ropa i wydzielina ropna, wymazy z nosa, aspiraty z oskrzeli,
krew w przypadku podejrzenia posocznicy.
•
Do badań pośmiertnych pobiera się wycinki narządów wewnętrznych, głównie płuc, a także śledziony, wątroby, nerek i
węzłów chłonnych.
•
Produkcje toksyn przez wyizolowane szczepy P. multocida wykrywa się badając efekt cytotoksyczny w hodowlach
tkankowych pod wpływem metabolitów hodowli płynnej bakterii.
•
Obecnie do wykrywania toksyny stosuje się test ELISA, pośredniej hemaglutynacji i odczyn precypitacji w żelu agarozowym
oraz sondy genowe, ukierunkowane na gen zarazka odpowiedzialny za produkcję toksyny.
W rozpoznaniu różnicowym należy uwzględnić:
•
gruźlicę
•
zakaźne zapalenie nosa
•
aspergilozę
•
toksoplazmozę
•
listeriozę
•
myksomatozę
•
zakażenia wywołane przez bakterie Bordetella bronchiseptica, Staphylococcus aureus, Pseudomonas aeruginosa, Klebsiella
pneumoniae oraz Chlamydia sp.
Postępowanie
•
Zwierzęta nie wykazujące klinicznych objawów należy zabezpieczyć swoistą surowicą odpornościową.
•
W terapii przyczynowej dobre wyniki uzyskuje się stosując domięśniowo przez okres 3-5 dni tetracykliny oraz sulfonamidy
potencjonowane.
•
Skuteczność leczenia zależy w dużym stopniu od warunków bytowania i żywienia zwierząt oraz systematycznej dewastacji
bakterii w środowisku zewnętrznym, a także czyszczeniu i odkażaniu klatek, poidełek, sprzętu i urządzeń fermowych.
•
Zwalczanie choroby w dużych fermach produkcyjnych powinno polegać na usunięciu chorych królików, które stanowią
potencjalne źródło zakażenia dla pozostałych zwierząt.
•
Usunięcie wszystkich zwierząt zakażonych jest bardzo trudne ze względu na występowanie bezobjawowego nosicielstwa, a
ponadto badaniem bakteriologicznym wymazów pobranych od nosicieli często uzyskuje się wyniki fałszywie ujemne.
•
Należy również poprawić warunki zoohigieniczne w fermie przez ograniczenie wahań temperatury otoczenia, utrzymanie
prawidłowej wilgotności oraz dobrej wentylacji.
•
Ponadto należy dokonywać okresowej dezynfekcji pomieszczeń i klatek dla zwierząt przy użyciu skutecznych środków
dezynfekcyjnych.
56
•
Wobec zwierząt nowo zakupionych należy zastosować ścisłą kwarantannę przez okres, co najmniej 14 dni, zabezpieczyć im
odpowiednie warunki bytowania oraz stosować właściwe żywienie.
•
W przypadku wystąpienia pasterelozy należy natychmiast wybić wszystkie zwierzęta chore, a grupy zwierząt, w których
wystąpiły zachorowania należy ściśle oddzielić od pozostałych.
•
W profilaktyce swoistej pasterelozy królików stosuje się czynne uodpornianie.
•
W kraju dostępna jest szczepionka inaktywowana Cunipastivac E, która zawiera wysoce immunogenne szczepy P. multocida
należące do serotypów 3 i 12.
•
Biopreparat ten stosuje się u królików powyżej 7 tygodnia życia, podskórnie w dawce 1 ml zwierzętom o masie ciała
powyżej 1 kg oraz 0,5 ml zwierzętom o masie ciała poniżej 1 kg.
•
W hodowlach zagrożonych pasterelozą szczepienia należy powtórzyć po upływie 2-3 tygodni.
•
Odporność swoista pojawia się w ciągu 2 tygodni po iniekcji szczepionki i utrzymuje się maksymalnie 3 miesiące.
•
Szczepionka Cunipastivac E dość skutecznie chroni zwierzęta przed ostrą formą pasterelozy, natomiast nie likwiduje
nosicielstwa zarazka oraz nie zapobiega chronicznej postaci zakaźnego nieżytu nosa, którego zasadniczym czynnikiem
przyczynowym jest Pasteurella multocida.
•
Cunipastivac E nie należy stosować u zwierząt chorych oraz u samic na 2 tyg. przed i 2 tyg. po porodzie.
•
Najwyższy stopień protekcji wyzwalają szczepionki sporządzone ze szczepów homologicznych stąd tez w profilaktyce
pasterelozy zalecane jest również stosowanie autoszczepionek.
•
Pierwszą dawkę autoszczepionki podaje królikom po odsadzeniu, natomiast drugą po upływie 3-4 tygodni.
•
Autoszczepionki znalazły również zastosowanie w zwalczaniu pasterelozy, zwłaszcza w fermach gdzie choroba ta występuje
endemicznie.
ZAKAŹNE ZAPALENIE NOSA(RHINITIS INFECTIOSA)
Zakaźny katar lub „nosówka królików”, jest zaraźliwą chorobą królików, przeważnie o przebiegu przewlekłym, stanowiącą
poważny problemem zdrowotny tak w małych, jak i dużych fermach hodowlanych.
Epidemiologia i etiologia
•
Zzn występuje na całym świecie i powoduje znaczne straty ekonomiczne w hodowli królików.
•
Przypuszcza się, że chorobę wywołuje infekcja mieszana przy współudziale czynników środowiskowych.
•
U chorych królików stwierdzono obecność przeciwciał skierowanych przeciwko wirusowi parainfluenzy-3.
•
Izolowano też bakterie takie jak: Escherichia coli, Streptococcus sp., Staphylococcus sp., Proteus sp., Klebsiella sp. i
Salmonella sp.
•
Obecnie główną rolę w etiopatogenezie zzn królików przypisuje się toksynogennym szczepom Pasteurella multocida oraz w
mniejszym stopniu Bordetella bronchiseptica, które wytwarzają dermonekrotyczną toksynę (DNT).
•
B. bronchiseptica jest Gram-ujemną pałeczką zasiedlającą układ oddechowy królików.
•
Do zakażenia dochodzi wkrótce po urodzeniu drogą oddechową i pokarmową lub poprzez kontakt bezpośredni.
•
B. bronchiseptica przeżywa w:
•
wilgotnej atmosferze i chłodzie przeżywa do 4 miesięcy
•
suchych miejscach 5-6 tyg.
•
glebie w lecie 6 tyg., w zimie 3 miesiące
B. bronchiseptica jest wrażliwa na działanie powszechnie stosowanych przeciwbakteryjnych środków
odkażających.
Źródło i drogi zakażenia
•
Zasadniczym źródłem toksynotwórczych szczepów Pasteurella multocida są zwierzęta chore oraz bezobjawowi nosiciele
zarazka.
•
Do hodowli dotychczas wolnej choroba zostaje najczęściej zawleczona poprzez wprowadzenie nowych zwierząt będących
nosicielami tych bakterii.
•
Drobnoustroje dostają się do organizmu przez błony śluzowe jamy nosowej, w której namnażają się intensywnie i uwalniają
toksyny powodujące powstawanie zmian o charakterze zapalnym.
Rozwój choroby (patogeneza)
Jest następstwem uaktywnienia się infekcji pod wpływem czynników ryzyka:
•
znaczne wahania temperatury
•
nadmierna wilgotność
•
przeciągi
•
duże stężenia amoniaku i siarkowodoru
•
pylista pasza
•
choroby pasożytniczebłędy żywieniowe, zwłaszcza niedobory mineralno-witaminowe.
57
Wystąpienie czynników ryzyka warunkuje też szybkie rozprzestrzeniane się choroby, która swym zasięgiem może
obejmować nawet wszystkie zwierzęta.
•
Bakterie w wyniku adhezji do błony śluzowej dróg oddechowych namnażają się i powodują utratę i zaburzenia
czynnościowe nabłonka urzęsionego.
•
Zjadliwe szczepy B. bronchiseptica wytwarzają pile, które są odpowiedzialne za adherencję zarazka oraz enzym cyklazę
adenylową zapobiegającą fagocytozie bakterii oraz wywołującą destrukcję nabłonka dróg oddechowych.
•
Zasadniczą rolę w etipatogenezie choroby odgrywają szczepy P. multocida i B. bronchiseptica wytwarzające
dermonekrotoksynę.
•
Toksyna DNT odgrywa zasadniczą rolę w patogenezie zakaźnego zanikowego zapalenia nosa (rhinitis atrophicans) u świń.
•
Ma ona charakter ciepłochwiejnej białkowej egzotoksyny składającej się z 3 polipeptydów.
•
U świń toksyna ta powoduje zanik małżowin nosowych, skrócenie trzewioczaszki i przodozgryz.
•
Podobnie jak u świń, u królików w przebiegu zzn obserwuje się wypływ z nosa, kichanie, różnego stopnia zaniki małżowin
nosowych oraz skrzywienie przegrody nosowej.
•
Zbliżony obraz kliniczny i anatomopatologiczny tych dwóch jednostek chorobowych sugeruje, że w etiopatogenezie zzn
królików również zasadniczą rolę odgrywa dermonekrotoksyna.
Objawy kliniczne
W dużym stopniu zależą od stanu odporności organizmu i wystąpienia czynników ryzyka.
•
Zakaźne zapalenie nosa ma najczęściej przebieg podostry lub przewlekły.
•
Pierwsze objawy pojawiają się po różnie długim okresie inkubacji.
•
Choroba manifestuje się wyciekiem z nosa, który początkowo jest wodnisty, a następnie przybiera charakter śluzowo-ropny
lub ropny i jest silnie cuchnący.
•
Wyciek ten zatyka otwory nosowe i króliki oddychają przez otwartą jamę gębową `
•
wzrost ciepłoty ciała powyżej 400C
•
posmutnienie
•
posklejana wysiękiem sierść na kończynach przednich
•
częste wycieranie pyszczka
•
zapalenie spojówek, kichanie i kaszel
•
obecność ropni podskórnych, strupów oraz ciastowatych obrzęków wokół oczu, które zniekształcają głowę
•
szybkie chudnięcie prowadzące do zejść śmiertelnych.
•
Przy cięższym przebiegu choroby zejścia śmiertelne następują w ciągu 2-8 dni, a wskaźnik śmiertelności może wynosić
nawet do 70%.
W przebiegu tych postaci może dochodzić do powikłań:
•
kręczu szyi (torcicollis)
•
nieżytowo-ropnego zapalenia płuc i opłucnej
•
ropnego zapalenia ucha środkowego
•
niekiedy również ropnego zapalenia mózgu i rdzenia kręgowego oraz macicy
Zmiany sekcyjne
Dotyczą głównie jam nosowych i mają charakter symetryczny:
•
rozszerzenie przewodów nosowych i zatok okołonosowych, które są wypełnione wysiękiem śluzowo-ropnym
•
różnego stopnia zaniki małżowin nosowych
•
skrzywienie przegrody nosowej
•
przekrwienie płuc, nerek i serca
•
zwyrodnienie wątroby (wątroba muszkatołowa)
•
obrzęk śledziony
•
W przypadku wtórnych zakażeń bakteryjnych zmiany anatomopatologiczne stwierdza się w odpowiednich narządach,
głównie płucach (zapalenie nieżytowo-ropne), uchu środkowym i mózgu.
W preparatach histopatologicznych obserwuje się:
•
obfite nacieki neutrofilów w błonie śluzowej i podśluzowej przewodów nosowych
•
eozynochłonność istoty międzykomórkowej blaszek kostnych i chrzęstnych zrębu małżowin
•
zmiany zwyrodnieniowe tkanki kostnej beleczek małżowin nosowych
•
nekrobiozę osteocytów
•
rozplem osteoklastów i osteoblastów
•
zmiany nekrobiotyczne w komórkach osteoblastów, manifestujące się wakuolizacją cytoplazmy oraz obkurczeniem i
hiperchomazją jąder komórkowych

58
•
w mięśniu sercowym występują zmiany o charakterze zwyrodnienia szklistego lub tłuszczowego, którym towarzyszy naciek
komórek jednojądrzastych
•
w wątrobie stwierdza się cechy przekrwienia oraz zwyrodnienia tłuszczowego lub wodniczkowego hepatocytów
•
w śledzionie i węzłach chłonnych krezki jelit stwierdza się rozplem komórek układu siateczki oraz rozrost grudek chłonnych
Rozpoznanie
Rozpoznanie choroby stawia się na podstawie:
•
objawów i zmian chorobowych
•
badania anatomopatologicznego
•
badania mikrobiologicznego
•
Do badań mikrobiologicznych pobiera się wymazy z nosa i migdałków od zwierząt z klinicznymi objawami choroby.
•
Wymazy w probówkach z podłożem transportowym przesyła się do laboratorium diagnostycznego.
•
Szczegółową diagnostykę P. multocida przedstawiono przy opisie pasterelozy.
•
Badanie bakteriologiczne do bezpośredniego wykrywania B. bronchiseptica polega na wykonaniu preparatów zabarwionych
metodą Grama.
•
Izolację bakterii dokonuje się między innymi na agarze z krwią z dodatkiem cefaleksyny lub podłożu MacConkeya z
dodatkiem glukozy i furaltadonu.
•
Posiewy inkubuje się w temperaturze 370 C przez 24-48 godzin.
W rozpoznaniu różnicowym należy uwzględnić:
•
niezakaźne zapalenie błony śluzowej nosa
•
zakaźne zapalenie błony śluzowej jamy ustnej
Postępowanie
•
Poprawa warunków bytowych łącznie ze stosowaniem immunoprofilaktyki i antybiotykoterapii umożliwiają nie tylko
poprawienie sytuacji zdrowotnej, ale minimalizują niekorzystne skutki ekonomiczne zzn i przyczyniają się do eliminacji
klinicznej postaci choroby.
•
Antybiotykoterapia musi być ukierunkowana na czynnik etiologiczny choroby, dlatego istnieje konieczność określenia
wrażliwości na antybiotyki szczepów P. multocida i B. bronchiseptica izolowanych od chorych sztuk.
•
Zadowalające efekty terapeutyczne uzyskuje się po stosowaniu tetracyklin.
BOTULIZM (JAD KIEŁBASIANY)
Klasyczny przykład intoksykacji lub toksykoinfekcji u lisów i norek
•
objawy ze strony OUN - niedowłady i porażenia wiotkie
•
najbardziej wrażliwe norki i lisy polarne, rzadziej chorują lisy pospolite - zwiększona odporność na toksynę
•
większe straty wśród przychówka niż u zwierząt dorosłych - współzależność letalnego wpływu neurotoksyny od masy ciała
zwierzęcia
G+ laseczka C. botulinum, ściśle beztlenowa, wytwarza endospory b. oporne na temp. (1000C, 1-2 godz.), wysuszenie i
różne czynniki chemiczne
•
Główny mechanizm chorobotwórczości egzotoksyna (neurotoksyna)
- wybitnie oporna na procesy gnilne – w zwłokach aktywna do 8 miesięcy
- niewrażliwa na działanie antybiotyków, enzymów jelitowych
- szybko inaktywuje środowisko zasadowe, wysoka temperatura (80-1000C - 30 min)
•
Antygenowe zróżnicowanie - 8 serotypów toksycznych (A, B, C, D, E, F, G i H) – lecz ten sam patomechanizm działania.
•
W składzie niektórych toksyn występują podtypy, np. A i F (podtyp Af), C1 i D (podtyp Cα) w mniejszym stopniu (podtyp Cβ),
C2 i D (podtyp D) oraz E i F (podtyp F).
•
Rezerwuar serotypów A, B, E, F i G - gleba zawierająca dużo substancji organicznych
•
Źródłem serotypów C i D - p. pokarmowy psów, kotów, świń i ptaków
Źródło zakażenia
-
odpady poubojowe - głównie drobiowe (nosicielstwo szczepów produkujących toksynę C)
-
padlina i ryby
-
warzywa zanieczyszczone C. botulinum
59
Przechowywana w nieodpowiednich warunkach karma - intensywne namnażanie się laseczek C. botulinum i
uwalnianie egzotoksyny.
•
norki - typ C (podtyp Cβ), średnio wrażliwe na typ A i B, stosunkowo oporne na typ E
•
lisy polarne typ C, średnio wrażliwe na typ A i E
•
lisy srebrzyste głównie typ A, wysoce oporne na typ C i E
Pewien odsetek lisów polarnych i srebrzystych wykazuje osobniczą odporność na toksynę botulinową - minimalna
dawka letalna/śmiertelna (107MLD) nie wywołuje jawnej postaci choroby
•
Neurotoksyna wytwarzana w środowisku zewnętrznym (intoksykacja), po wniknięciu spor zarazka do p. pokarmowego,
proces kiełkowania i wytwarzanie letalnej toksyny (toksoinfekcja).
•
Absorbcja neurotoksyny następuje w jelicie cienkim i częściowo grubym.
•
Mechanizm działania - blokowanie uwalniania acetylocholiny w synapsach mięśni powoduje ich porażenie wiotkie, bądź
przeciwdziałanie jej przechodzeniu z zakończeń nerwowych do włókien mięśniowych.
•
Blok nerwowo-mięśniowy jest bezpośrednią przyczyną śmierci w wyniku porażenia mięśni oddechowych.
Okres inkubacji uwarunkowany gatunkiem zwierzęcia oraz dawką wprowadzonej lub uwolnionej toksyny.
•
norki - kilka godzin, śmiertelność 80-100%,
•
lisy - 1-3 dni, śmiertelność 50-60%, niekiedy tylko ok. 20%
Przebieg bezgorączkowy, najczęściej w postaci nadostrej lub ostrej, rzadziej podostrej i przewlekłej
•
Postać nadostra najczęściej u norek - nagłe padnięcia wśród drgawek.
•
Postać ostra - objawy niedowładu i porażeń wiotkich będące następstwem niewydolności mięśni
- początkowo sztywny chód lub czołganie się zwierząt na brzuchu
- następnie porażenie mięśni gardła, przełyku i krtani - niemożliwość połykania, bezgłos
- w końcowym etapie porażenie tylnych partii tułowia i kończyn z zachowaniem ruchów mimowolnych (tzw.
pływanie leżących norek) lub bezwład i silna duszność typu brzusznego
Postać ostra
•
Śmierć następuje nagle, lub w stanie śpiączki, wśród drgawek.
•
U zwierząt z mniej wyrażonymi objawami obserwuje się jedynie przyjmowanie pozycji siedzącej z powłóczeniem tylnej
części ciała.
Postać podostra
•
Obserwuje się spontaniczne wyzdrowienia zwierząt, ale okres rekonwalescencji trwa wiele tygodni.
Badanie sekcyjne
- brak jest zwykle wyraźniejszych odchyleń od normy
- w żołądku obecność karmy podejrzanej o zawartość toksyny
- w płucach zmiany zachłystowego zapalenia jako efekt porażenia mięśni przełyku
Rozpoznanie
-
wykazanie obecności toksyny w karmie, w krwi chorych zwierząt, pośmiertnie test na myszkach zakażonych dootrzewnowo
surowicą i ekstraktem z jelit z dodatkiem antybiotyków
-
izolacja z treści jelit padłych zwierząt C. botulinum
-
wykrywanie genów C. botulinum kodujących wytwarzanie neurotoksyny w tkankach, próbkach gleby lub karmie metodę
PCR
Rozpoznanie różnicowe
- zatrucia środkami chemicznymi (brak z reguły porażeń wiotkich ciała).
Postępowanie
-W pierwszej kolejności odstawić podejrzaną karmę i możliwie jak najszybciej podać surowicę antytoksyczną (neutralizuje
tylko toksynę nie związaną).

60
-W terapii przyczynowej penicylina o przedłużonym działaniu oraz leczenie wspomagające - płyny nawadniające, witaminy z
grupy B.
Swoista profilaktyka
- szczepionka inaktywowana (swoista toksyna – anatoksyna)
Profilaktyka ogólna
- przestrzeganie rygorów sanitarnych, kontrolowanie jakości karmy, warunków transportu i przechowywania
-szczególnie niebezpieczne jelita drobiowe - zawierają laseczki C. boutulinum produkujące neurotoksynę typu C.
Przyczyny toksoinfekcji
-
brak prawidłowej obróbki karmy (zalecana obróbka termiczna)
-
skarmianie surowej karmy nie przetworzonej
-
zbyt wysokie pH bliskie obojętnemu na etapie pozyskiwania karmy w zakładach mięsnych (zaleca się szybkie obniżenia pH
do wartości 4,6-5,6)
ĆWICZENIA
Choroby niezakaźne
Choroby niezakaźne lisów i norek stanowią około 70 % przyczyn strat w hodowli.
Składają się na nie:
• zaburzenia w rozrodczości,
• choroby okresu okołoporodowego
• choroby odchowu szczeniąt
• choroby przemiany materii
Encefalopatia wątrobowa
Jest następstwem niewydolności wątroby w przebiegu przebytych ostrych lub przewlekłych chorób wątroby, objawiających się
zespołem zaburzeń neurologicznych, takich jak:
- niezborność ruchowa
- podniecenie, drgawki
- kręcenie się w koło lub wzdłuż osi długiej ciała
- upośledzenie widzenia
- w ostrej fazie choroby drgawki i śpiączka
Schorzenie o etiologii wieloczynnikowej.
Objawy są często odwracalne, ponieważ w wielu przypadkach nie dochodzi do trwałych uszkodzeń mózgu, wątroby i nerek.
Encefalopatii wątrobowej towarzyszy niedobór witamin B
1
i B
12
.
Mechanizm powstania zaburzeń neurologicznych ze strony CUN wiąże się z nagromadzeniem we krwi substancji toksycznych
(encefalotoksyn):
amoniaku
kwasu gamma aminomasłowego (GABA)
krótkołańcuchowych kwasów tłuszczowych, merkaptanów
różnych tzw. fałszywych neuroprzekaźników (tyramina, aktopamina, tryptofan) i endogennych ligandów receptorów
benzodiazepin
61
Złożona patogeneza objawów chorobowych ze strony CUN ma miejsce wówczas, gdy substancje toksyczne we krwi nie są
unieczynnione w wątrobie (silne uszkodzenie komórek, marskość, zwyrodnienie, zapalenie) i krążeniem wrotnym dostają się do
krwioobiegu.
Po przekroczeniu bariery krew-mózg przedostają się do centralnego układu nerwowego, powodując zaburzenia przemian
metabolicznych w mózgu i transportu chlorków w neuronach.
Ferma norek X
18000 zwierząt stada podstawowego i 95000 norcząt. (W całym przebiegu choroby padło około 10000 sztuk)
Żywienie: 40% ryby, 40% odpady drobiowe, 9% śruta ekskrudowana, 2% wysłodki buraczane, 1% płatków kukurydzy, 1% olej
sojowy, 5% mączki z krwi i piór
Konserwacja: siarczyn sodu (2kg/t karmy), przeciwutleniacz Rendox (200g/t)
Przechowywanie w temp. –30 C
Masowe zachorowania pojawiły się nagle i dotyczyły kilkuset zwierząt.
Brak apetytu i pragnienia, ataki epileptyczne, porażenia kończyn tylnych, kręcenie się wzdłuż długiej osi ciała, łzawienie,
światłowstręt, zapalenie spojówek.
Zejście śmiertelne w ciągu 2-5 dni.
Badaniem bakteriologicznym, wirusologicznym i próbą biologiczną wykluczono choroby zakaźne oraz zatrucia pokarmowe.
Badanie histopatologiczne
Uszkodzenie i zwyrodnienie mózgu, wątroby, nerek oraz kosmków jelitowych.
Rozpoznanie różnicowe
nosówka
zatrucie solą kuchenną
choroba Aujeszkyego
Przyczyna
Skarmianie dużą ilością ryb zawierających enzym tiaminazę powodujący rozkład witaminy B
1
w karmie.
Żywienie norek świeżą karmą ze zwiększoną ilością witaminy B
1
spowodowało wyleczenie.
Dziedziczna tyrozynemia
Choroba po raz pierwszy została opisana w 1973 roku w USA.
Została nazwana pseudonosówką z powodu jej klinicznego podobieństwa do nosówki norek.
Tyrozynemia , dawniej tyrozynoza -
choroba genetyczna będąca skutkiem recesywnej mutacji autosomalnej.
Istnieją 2 postacie choroby: tyrozynemia I w której efektem tej mutacji jest brak enzymu hydroksylazy fumaryloacetooctanowej
(FAH) oraz tyrozynemia II z niedoborem
aminotransferazy tyrozynowej TAT.
W moczu pojawia się nadmiar tyrozyny i jej metabolitów.
Skutkiem jest uszkodzenie narządu wzroku, a także uszkodzenie wątroby z rozwojem raka wątroby oraz uszkodzenie nerek z
krzywicą hipofosfatemiczną.
Leczenie: dieta eliminacyjna uboga w tyrozynę i fenyloalaninę
Objawy kliniczne
obrzęki i nadżerki na opuszkach łap
owrzodzenia na nosie
ślepota
uszkodzenie nerek
Badania biochemiczne krwi
- niedobór enzymów wątrobowych – aminotransferazy tyrozynowej TAT
- 20-100 krotny wzrost poziomu tyrozyny we krwi
Młode norki
zachorowania pojawiają się w 6-7 tygodniu życia
surowiczy wypływ z oczu
zmętnienie rogówki
Po 24-48 godzinach:
zapalenie spojówek, wrzody rogówki, wrzodziejące zapalenie skóry poduszek łap
padnięcia po 2-3 dniach od zaobserwowania pierwszych objawów choroby
Pierwsze objawy choroby mogą pojawić się również w wieku 3 miesięcy, 6 miesięcy a nawet przed ubojem (forma jesienna).
przebieg kliniczny choroby jest mniej ostry a zwierzęta padają po miesiącu od wystąpienia pierwszych objawów choroby
utrudnieniem w rozpoznaniu tej choroby jest zbliżony do normalnego poziom TAT
zaburzenia metaboliczne procesów powodują niewystaczające zmiany w wydzielaniu tyrozyny i fenyloalaniny, co powoduje ze
poziom TAT pochodzenia wątrobowego jest normalny
Tyrozyna w postaci kryształów wewnątrz komórek uszkadza strukturę lizosomów i przez to powoduje wydzielanie enzymów
proteolitycznych i czynników chemotaktycznych.
Infiltracja neutrofili powoduje przewlekły stan zapalny.
Zmiany anatomo-patologiczne
nerki są blade, nieznacznie powiększone lub ich rozmiar jest mniejszy wraz z nieregularną strukturą torebki.
poszerzenie kanalików nerkowych w następstwie zbliznowacenia i zalegania moczu.

62
obecność kryształków w miedniczce nerkowej oraz pęcherzyku żółciowym.
wrzody rogówki z przewlekłym ropnym zapaleniem zrębu rogówki
zmiany zapalne oraz martwica poduszek łap i nosa
owrzodzenie grzbietowej części języka
Leczenie i zapobieganie
Dieta uboga w fenyloalaninę i tyrozynę!
Eliminacja z hodowli zaatakowanego przychówka oraz osobników rodzicielskich.
Dobra dokumentacja hodowli – podstawą eliminacji ze stada zagrożonych chorobą norek.
Choroba występuje tylko u osobników homozygotycznych pod względem tej cechy.
Wszystkie norki homozygotyczne są bezobjawowymi nosicielami i powinny być usunięte ze stada.
Z tego powodu rodzeństwo chorych zwierząt, osobniki rodzicielskie oraz potomstwo powinny być ubijane.
Choroba żółtego tłuszczu
Nieropne zapalenie tkanki podskórnej tłuszczowej
Choroba występuje najczęściej u norek ale znana jest tez u innych gatunków zwierząt, np. świń które żywione są dużą ilością
tłuszczu rybiego i paszami oleistymi.
Etiologia
Przyczyną choroby jest nadmiar tłuszczu w karmie, zwłaszcza wielonienasyconych kwasów tłuszczowych obecnych w rybach,
tłuszczu z drobiu i końskim oraz w tranie, przy jednoczesnym niedoborze witaminy E i nie konserwowaniu karmy przeciwutleniaczami.
Długie przechowywanie w stanie zamrożenia, bez udziału przeciwutleniaczy powoduje jełczenie tłuszczów i ich toksyczne
oddziaływanie na organizm.
Zniszczeniu ulegają egzogenne kwasy tłuszczowe i witaminy.
Ponadto, tłuszcz utleniony może niszczyć wartościowe składniki pokarmowe: biotynę, ryboflawinę, kwas askorbinowy, kwas
Tłuszcz utleniany wchodzi również w interakcję z białkami, tworzy nierozpuszczalne polimery zmniejszające przyswajalność
białek.
Zjełczałe tłuszcze na skutek eliminowania witaminy E, selenu i niektórych aminokwasów prowadzą do wystąpienia dystrofii
mięśni szkieletowych, a także serca.
Objawy kliniczne
Przebieg ostry
młode norki – brak apetytu, początkowo silne podniecenie, a następnie osłabienie, śpiączka i zejście śmiertelne
norki dorosłe – spadek kondycji, zmniejszenie apetytu, biegunka, ciemne zabarwienie kału i moczu, drgawki, porażenie kończyn
tylnych, obrzęki w okolicy pachwin i podbrzusza
Obraz krwi:
leukocytoza, anizocytoza, polichromazja, spadek poziomu hemoglobiny
Zmiany anatomopatologiczne
tkanka podskórna galaretowato nacieczona o brązowym zabarwieniu tłuszczu.
w jamach ciała zwiększona ilość krwisto-żółtego płynu
śledziona powiększona z krwawymi wylewami
mięsnie szkieletowe żóławo zabarwione i zwyrodniałe
Leczenie i zapobieganie
Wyeliminować z żywienia złej jakości tłuszcze
Karmę należy konserwować – antyutleniacz Rendox
Wprowadzić do żywienia witaminę E (15-30 mg/1kg karmy) i selen
Korzystne jest skarmianie świeżą wątrobą, chudym mięsem i kiełkami zbożowymi
Choroby układu moczowego
kamica moczowa (urolithiasis)
zapalenie pęcherza moczowego (cystitis)
Kamica moczowa
Czynniki usposabiające:
Zasadowy odczyn moczu (norma pH 6,4-7,5)
żywienie karmą przemysłową z dużym udziałem składników mineralnych
zakażenia bakteryjene dróg moczowych (Micrococcus sp., Proteus mirabilis, Staphylococcus aureus, E. coli)
Kamica struwitowa
Złogi magnezowo-amonowo-fosforanowe - najczęściej o ostrych krawędziach
Złogi powstają w wyniku zakażenia dróg moczowych przez drobnoustroje rozkładające mocznik (Proteus mirabilis).
63
Występują one w moczu alkalicznym i tworzą kamienie odlewowe miedniczki i kielichów oraz kamienie pęcherzowe.
Radiologicznie dają cienie o słabym wysyceniu.
Powstają również kamienie o budowie mieszanej - w wyniku zaburzeń przemiany materii, do których dołącza się cz. struwitowa powstała
wskutek zakażenia.
Złogi lub kamienie mogą być przyczyną niedrożności układu moczowego wywołanej obecnością kamienia w miedniczce,
moczowodzie lub pęcherzu moczowym.
Kamienie struwitowe mogą przejściowo lub trwale zablokować odpływ moczu, doprowadzić do zniszczenia nerki (wodonercza)
lub zakażenia.
Objawy kliniczne
Kamica moczowa może występować u 6-8 tygodniowych norcząt ale pełny obraz chorobowy występuje w wieku 3-4 miesięcy.
Przebieg choroby może być ostry lub przewlekły.
Szczególne nasilenie procesu chorobowego obserwuje się u samic w drugiej połowie ciąży i laktacji.
Stopniowa utrata apetytu i kondycji, utrudnione oddawanie moczu z domieszką krwi lub ropy.
W końcowej fazie – porażenie zadu, śpiączka uremiczna i zejście śmiertelne.
Zmiany anatomopatologiczne
wychudzenie zwłok (zapach moczu)
obecność ziarenek piasku lub kamieni w cewce moczowej i/lub pęcherzu moczowym
zgrubienie ściany pęcherza moczowego oraz zmiany zapalne na błonie śluzowej
wodonercze
Rozpoznanie
objawy kliniczne i zmiany sekcyjne
badanie fizykochemiczne i bakteriologiczne moczu
przy masowym wystąpieniu kamicy w stadzie - badania biochemiczne krwi (profil nerkowy)
USG, RTG
Badania biochemiczne
profil kontrolny (ogólny) - sód, potas, chlorki, mocznik, kreatynina, bilirubina, AST, ALT, fosfataza alkaliczna, gamma-
glutamylotransferaza GGT, albumina, białko całkowite, wapń, fosfor, kwas moczowy
profil nerkowy - sód, potas, mocznik, kreatynina
profil wątrobowy - transaminazy (alaninowa i asparaginianowa) gamma-glutamylotransferaza (GGT), fosfataza alkaliczna,
bilirubina, albumina
profil kostny - białko całkowite, albumina, wapń, fosfor, fosfataza alkaliczna
profil sercowy - transaminazy (asparaginianowa i alaninowa), kinaza kreatynowa, dehydrogenaza mleczanowa, potas
profil lipidowy - cholesterol, triglicerydy, cholesterol HDL
profil tarczycowy - TSH, w T4
Leczenie i postępowanie
brak skutecznego leczenia
zmiana higieny karmy
obniżenie pH moczu
antybiotyki (tetracykliny)
witamina A
samice w ostatnich dniach ciąży można poddać zabiegowi chirurgicznemu ratując w ten sposób około 30% szczeniąt, ale bardzo
rzadko ich matkę
Potencjalna zdolność niektórych produktów spożywczych do zakwaszania lub alkalizowania
P
P
r
r
o
o
d
d
u
u
k
k
t
t
y
y
k
k
w
w
a
a
s
s
o
o
t
t
w
w
ó
ó
r
r
c
c
z
z
e
e
P
P
r
r
o
o
d
d
u
u
k
k
t
t
y
y
a
a
l
l
k
k
a
a
l
l
i
i
z
z
u
u
j
j
ą
ą
c
c
e
e
W
W
i
i
e
e
p
p
r
r
z
z
o
o
w
w
i
i
n
n
a
a
b
b
u
u
r
r
a
a
k
k
i
i
w
w
ą
ą
t
t
r
r
o
o
b
b
a
a
w
w
i
i
e
e
p
p
r
r
z
z
o
o
w
w
a
a
c
c
z
z
a
a
r
r
n
n
e
e
p
p
o
o
r
r
z
z
e
e
c
c
z
z
k
k
i
i
k
k
a
a
s
s
z
z
a
a
j
j
ę
ę
c
c
z
z
m
m
i
i
e
e
n
n
n
n
a
a
c
c
y
y
t
t
r
r
y
y
n
n
y
y
S
S
z
z
y
y
n
n
k
k
a
a
w
w
i
i
ś
ś
n
n
i
i
e
e
D
D
o
o
r
r
s
s
z
z
m
m
a
a
r
r
c
c
h
h
e
e
w
w
J
J
a
a
j
j
a
a
p
p
o
o
m
m
i
i
d
d
o
o
r
r
y
y
W
W
o
o
ł
ł
o
o
w
w
i
i
n
n
a
a
ś
ś
l
l
i
i
w
w
k
k
i
i
C
C
i
i
e
e
l
l
ę
ę
c
c
i
i
n
n
a
a
a
a
g
g
r
r
e
e
s
s
t
t
p
p
ł
ł
a
a
t
t
k
k
i
i
o
o
w
w
s
s
i
i
a
a
n
n
e
e
t
t
r
r
u
u
s
s
k
k
a
a
w
w
k
k
i
i
Zapobieganie
Obniżenie pH karmy
-
kwas foliowy H
3
PO
4
w ilości 0,6-1% całości karmy
-
chlorek amonu NH
4
Cl w ilości 1g/kg m.c.

64
Nie obserwuje się albo bardzo rzadko występowanie kamicy w fermach, gdzie konserwuje się karmę pirosiarczynem sodu i
antyutleniaczem Rendox
Zatrucia pokarmowe
Straty w hodowli;
zaburzenia w reprodukcji (brak rui, obniżenie plenności, częste ronienia, rodzenie martwych szczeniąt, bezmleczność lub niska
laktacja)
obniżenie przyrostów masy ciała, zahamowanie rozwoju
wysoka śmiertelność zwierząt młodych.
Podstawową przyczyną zatruć pokarmowych jest brak higieny żywienia
odpowiedni stan sanitarny pasz i karmy oraz pomieszczeń i urządzeń służących do transportu, przechowywania,
przygotowywania i zadawania karmy.
Niewłaściwe zabezpieczenie surowców pochodzenia zwierzęcego - namnażanie się bakterii saprofitycznych i chorobotwórczych (toksyny),
toksyczne produkty w procesie rozpadu substancji białkowych (proces gnicia) i rozkładu tłuszczów (proces hydrolizy i oksydacji).
Głównym mechanizmem chorobotwórczego działania są toksyny
uwalniane bezpośrednio do surowców paszowych (intoksykacje) w czasie intensywnego namnażania się bakterii i grzybów
lub dopiero po wniknięciu zarazka do organizmu (toksoinfekcje) - egzotoksyny (enterotoksyny gronkowcowe, termolabilna LT i
termostabilna enterotoksyna ST oraz cytotoksyny - E. coli, toksyna botulinowa, mykotoksyny) lub endotoksyny (LPS) w wyniku rozpadu
komórki bakteryjnej
Zatrucia toksynami biologicznymi
Enterotoksyny LT i ST – zaburzają transmisję elektrolitów z naczyń krwionośnych do światła jelit, efektem jest biegunka,
zmiany degeneracyjne w kom. bł. śluzowej p. pokarmowego.
Enterotoksyny gronkowcowe (A, B, C
1
, C
2
, C
3
, D, E, G i H) - są superantygenami, wywołują stany immunosupresji, stan zapalny
bł. śluzowej jelit, hamują absorpcję wody ze światła jelit (biegunka).
Endotoksyny (LPS) - powoduje zapalenie i uszkodzenie wielu narządów wewnętrznych (śledziona, wątroba, płuca, OUN, p.
pokarmowy oraz zaburza odpowiedź immunologiczną (np nadmierne uwalnianie IL-1 przez zaburzone czynnościowo makrofagi).
Mykotoksykozy
Zatrucia mykotoksynami wytwarzanymi przez grzyby pleśniowe, namnażające się na produktach roślinnych lub paszach pochodzenia
roślinnego.
Są niewrażliwe na działanie wysokich temperatur.
Przebiegają w formie ostrej lub przewlekłej.
Postać ostra rozwija się w wyniku przyjęcia w krótkim czasie wysokiej dawki toksyny.
Przechowywanie zbóż w temp. w 15-30
0
C i względnej wilgotności substratów w granicach 14-25%, stanowią sprzyjające
warunki do wzrostu grzybów i wytwarzania mykotoksyn.
u samic mogą być przyczyną zapaleń macicy, zamieralności zarodków lub płodów oraz ronień
-
wszystkie mykotoksyny powodują zmniejszenie wykorzystania paszy i ogólnym pogorszeniem zdrowotności zwierząt
-
jako silne immunosupresory hamują nieswoistą i swoistą odpowiedź immunologiczną, szczególnie typu komórkowego
-
efektem zwiększona wrażliwość zwierząt na infekcje oraz mniejsza skuteczność szczepionek stosowanych w swoistej
immunoprofilaktyce lisów i norek
W różnym stopniu wykazują działanie kancerogenne, mutagenne, teratogenne i estrogenne.
W zależności od dawki i okresu podawania powodują
-
utratę łaknienia i wymioty (deoksyniwalenol - womitoksyna)
-
zaburzenia funkcjonalne w narządach wewnętrznych: wątroba (aflatoksyny), nerki (ochratoksyny A)
-
zaburzenia płodności (zearalenon)
-
zmiany w obrazie ilościowym i jakościowym krwi obwodowej
Aflatoksykozy
Grupa wtórnych metabolitów toksynotwórczych szczepów Aspergillus flavus i Aspergillus parasiticus.
W Polsce, podobnie jak i w innych krajach Europy, w 12,7% próbek badanych pasz wykazano obecność aflatoksyn.
W warunkach naturalnych występuje 6 rodzajów aflatoksyn: B
1
, B
2
i B
2a
oraz G
1
, G
2
i G
2a
Prócz tego wydalane są z mlekiem aflatoksyny M
1
i M
2
będące produktami rozpadu aflatoksyn w organizmach zwierzęcych.
Aflatoksyny powodują zmiany w strukturze składników DNA i indukują mutacje genowe.
Hamują syntezę wielu białek, szczególnie enzymów metabolicznych i białek strukturalnych
Wywierają silne działanie immunosupresyjne.
Następstwem hepatotoksycznego oddziaływania aflatoksyn są zaburzenia w układzie krzepnięcia (wydłużenie czasu krzepnięcia,
zaburzenie wytwarzania protrombiny, skazy krwotoczne).
W krwi stwierdza się wzrost fosfatazy zasadowej i cholesterolu.

65
Bezpośrednią przyczyną zejść śmiertelnych jest rozległe zwyrodnienie tłuszczowe i martwica wątroby.
Rozpoznanie i postępowanie
-
przyżyciowe rozpoznanie jest dość trudne ze względu na brak objawów typowych.
-
wstępne rozpoznanie można postawić na podstawie wyników badań sekcyjnych i histopatologicznych.
W odróżnieniu od egzotoksyn bakteryjnych mikotoksyny są związkami chemicznymi o niskiej masie cząsteczkowej, nie
mającymi z reguły właściwości immunogennych.
W związku z tym ich obecność można stwierdzić prawie wyłącznie przy pomocy metod chromatograficznych (chromatografia
cienkowarstwowa lub powinowactwa), a tylko niekiedy przy użyciu testów immunoenzymatycznych np. test ELISA.
Sama obecność szczepów grzybów toksynotwórczych czy też nie toksynotwórczych nie jest równoznaczna z
obecnością lub brakiem mykotoksyn; konieczne są testy stwierdzające kontaminację badanego materiału samymi toksynami.
Brak leczenia przyczynowego.
Po rozpoznaniu w pierwszej kolejności odstawić porażoną paszę oraz zastosować leczenie objawowe z uwzględnieniem
preparatów witaminowych, mineralnych, szczególnie selenu.
Jako adsorbent podaje się węgiel aktywowany.
W profilaktyce nieswoistej podstawowe znaczenie ma kontrola toksylogiczna pasz, zwłaszcza importowanych z krajów o
klimacie tropikalnym.
Dzienne spożycie przez norkę 5µg aflatoksyny przez okres czterech tygodni wywołuje:
procesy degeneracyjne w wątrobie (martwica i stłuszczenie)
stany zapalne błony śluzowej żołądka, jelit i macicy
Przyczyną zejścia śmiertelnego jest kumulacja tłuszczów w komórkach wątroby w wyniku zaburzonego ich metabolizmu.
Aflatoksykoza u mięsożernych zwierząt futerkowych manifestuje się
brakiem apetytu
ogólnym osłabieniem
zahamowaniem przyrostów masy ciała
wyniszczeniem
w końcowym stadium choroby stwierdza się objawy żółtaczkowe oraz zaburzenia w reprodukcji
Fuzariotoksykozy
Zatrucia w wyniku zjadania paszy zawierającej toksyczne produkty grzybów z rodzaju Fusarium
Produkują toksyny
-
estrogenne (zearalenon)
-
wywołujące wymioty (trichoteceny)
-
toksyny o dzialaniu hepato- i nefrotoksycznym (fumonizyny)
-
upośledzające hemopoezę (T-2 i jej pochodna HT-2)
Fuzariotoksyny wraz z paszą dostają się do przewodu pokarmowego, a następnie drogą hematogenną osiągają narządy
wewnętrzne.
Zróżnicowana patogeneza fuzariotoksykoz wynika z odmiennych właściwości uwalnianych toksyn.
Przebieg zatrucia zależy od wieku zwierzęcia oraz ilości i rodzaju toksyny.
Najbardziej podatne są zwierzęta młode i samice ciężarne.
Zearalenon
Zearalenon jest drobnocząsteczkowym związkiem pochodnym kwasu fenolorezorcynowego - niesteroidowym makrolidem
pozbawionym właściwości antygenowych.
Pasza zwierająca zearalenon posiada właściwości estrogenne przy czym najbardziej podatne na jej działanie są zwierzęta
monogastryczne.
Obecność pierścienia fenolowego w cząsteczce zearalenonu umożliwia wiązanie się z komórkowymi receptorami estrogenów
występującymi w macicy, pochwie, jajnikach i jajowodzie, przez co wzmaga się proliferacja komórek oraz dochodzi do zwiększonej
syntezy RNA i białek w komórkach układu rozrodczego.
we wczesnym okresie ciąży zearalenon powoduje zamieranie zarodków
w późniejszym okresie ciąży - ronienia lub rodzenie martwych płodów, zapalenie macicy oraz permanentną ruję
W badaniach eksperymentalnych wykazano, że zearalenon w dawce 30 mg/kg karmy podawany przez 28 dni (przed okresem
uboju) powodował u norek niedorozwój lub degenerację jajników.
Zanieczyszczenia chemiczne
Zatrucie metalami ciężkimi
-
Przemysł, motoryzacja i chemizacja przyczyną wzrostu skażenia środowiska naturalnego różnymi związkami chemicznymi.
-
Związkami zanieczyszczającymi środowisko i gromadzącymi się w łańcuchu pokarmowym zwierząt i człowieka są metale
ciężkie - „metale toksyczne”.
U lisów i norek najczęściej zatrucia
rtęcią i ołowiem.

66
Zatrucia rtęcią
Ważnym problemem są skażenia powietrza, szczególnie parami rtęci oraz zanieczyszczenia wód i w efekcie duża koncentracja
rtęci w rybach.
Ryby oraz odpady rybne stosowane w żywieniu lisów i norek stwarzają potencjalne możliwości wystąpienia u nich zatruć rtęcią.
Zatrucia tzw. rtęcice obserwowano u ludzi, kotów (obok bydła są najbardziej wrażliwe na zatrucia rtęcią) i ptaków morskich
spożywających w dużej ilości ryby.
Norki są b. wrażliwe na zatrucia rtęcią metylowaną, odporne na jej formy nieorganiczne występujące w karmie.
Karmione paszą zawierającą 5 ppm rtęci metylowanej wykazują po 25 dniach objawy przewlekłej choroby rtęciowej, która
kończy się zejściem śmiertelnym 30-37 dniem jej podawania.
U norek po zatruciu rtęcią obserwuje się anoreksję, brak koordynacji ruchów, utratę masy ciała, paraliż, napadowe drgawki,
głośny pisk. Po uchwyceniu za ogon u chorych norek stwierdza się charakterystyczne krzyżowanie kończyn.
Rozpoznanie
-
oznaczanie obecności rtęci w paszach i treści przewodu pokarmowego, krwi, narządach miąższowych (przede
wszystkim w nerkach) oraz we włosach.
Rtęć i jej związki mogą dostawać się do organizmu
z wdychanym powietrzem (pary rtęci)
drogą pokarmową: rtęć metaliczna
przez skórę i błony śluzowe
Pary rtęci z krwi w dużej część przenikają do tkanki mózgowej.
Natomiast związki nieorganiczne rtęci po dostaniu się drogą pokarmową odkładają się głównie w nerkach (90%), w wątrobie,
kościach, szpiku, włosach.
W organizmie związki organiczne szybko przechodzą w nieorganiczne.
Z organizmu rtęć jest wydalana głównie z moczem, w mniejszej ilości z kałem.
Mechanizm działania toksycznego rtęci
-
uszkodzenie błon komórkowych, nerek, OUN i ścian naczyń włosowatych
-
zapalenie płuc
-
działanie teratogenne i embriotoksyczne na zarodki
Zatrucia ołowiem
Źródłem Pb i jego związków - zanieczyszczone powietrze, skażone rośliny zbożowe, szczególnie rosnące w okolicach dróg o
dużym natężeniu ruchu.
Pb wnika drogą pokarmową (wchłanianie od 10-25% dawki - najłatwiej sole, najtrudniej ołów metaliczny); drogą oddechową
(wchłanianie jest 10 razy łatwiejsze), nieuszkodzoną skórę (połączenia organiczne).
Zatrucie Pb u mięsożernych zwierząt futerkowych po spożyciu karmy zanieczyszczonej Pb, wody i dodatków dodawanych do
paszy.
Dodatkowym jego źródłem są farby ołowiowe z powierzchni klatek, gazy spalinowe, pył glebowy, osady ścieków
przemysłowych używane do użyźniania gleby
Ołów po wchłonięciu odkłada się: wątrobie, nerkach, płucach i sercu -. tzw. pula szybkowymienna, w dalszej kolejności skóra i
mięśnie - pula o średniej szybkości wymiany.
Pulą wolnowymienną są kości, w mniejszym stopniu zęby i włosy (stężenie Pb zwiększa się przez całe życie).
Eliminacja Pb z ustroju głównie poprzez układ moczowy (ok. 76%), z kałem 16%.
Najbardziej toksyczne są związki ołowiu rozpuszczalne w płynach ustrojowych, które po wchłonięciu z przewodu pokarmowego
dostają się żyłą wrotną do wątroby, skąd część ich zostaje wraz z żółcią wydalona do dwunastnicy, a następnie z kałem na zewnątrz.
Pozostała część w stanie niezmienionym przenika do krwi i łączy się z jej białkami, głównie białkami erytrocytów (do 98%),
wywołując objawy zatrucia.
Zawartość Pb we krwi jest czułym wskaźnikiem zagrożenia organizmu.
Interakcje zachodzące między Pb a innymi pierwiastkami mają istotny wpływ na zaburzenia metabolizmu pierwiastków
niezbędnych do życia.
Wzrost stężenia Pb przyśpiesza wydalanie z organizmu Fe i Cu.
Ołów hamuje syntezę ceruloplazminy uczestniczącej w metabolizmie Fe i Cu.
Ołów nagromadzony w tkankach nie powoduje początkowo zatrucia.
Przejście od stanu nietoksyczności do zmian patologicznych jest stopniowe i dlatego ustalenie toksycznych dawek ołowiu jest
trudne.
Niebezpieczne są głównie przewlekłe zatrucia - pasze o niewielkiej ilości Pb podawane przez dłuższy czas.
Brak często wyraźnych objawów klinicznych przy znacznej kumulacji Pb w tkankach.
Rozpoznanie
wywiad toksykologiczny
charakterystyczne objawy i zmiany sekcyjne
badania laboratoryjne:
przyżyciowo: oznaczanie zawartości Pb w krwi – norma stężenia Pb we krwi ludzi i zwierząt wynosi od 10-40 mg/100 ml
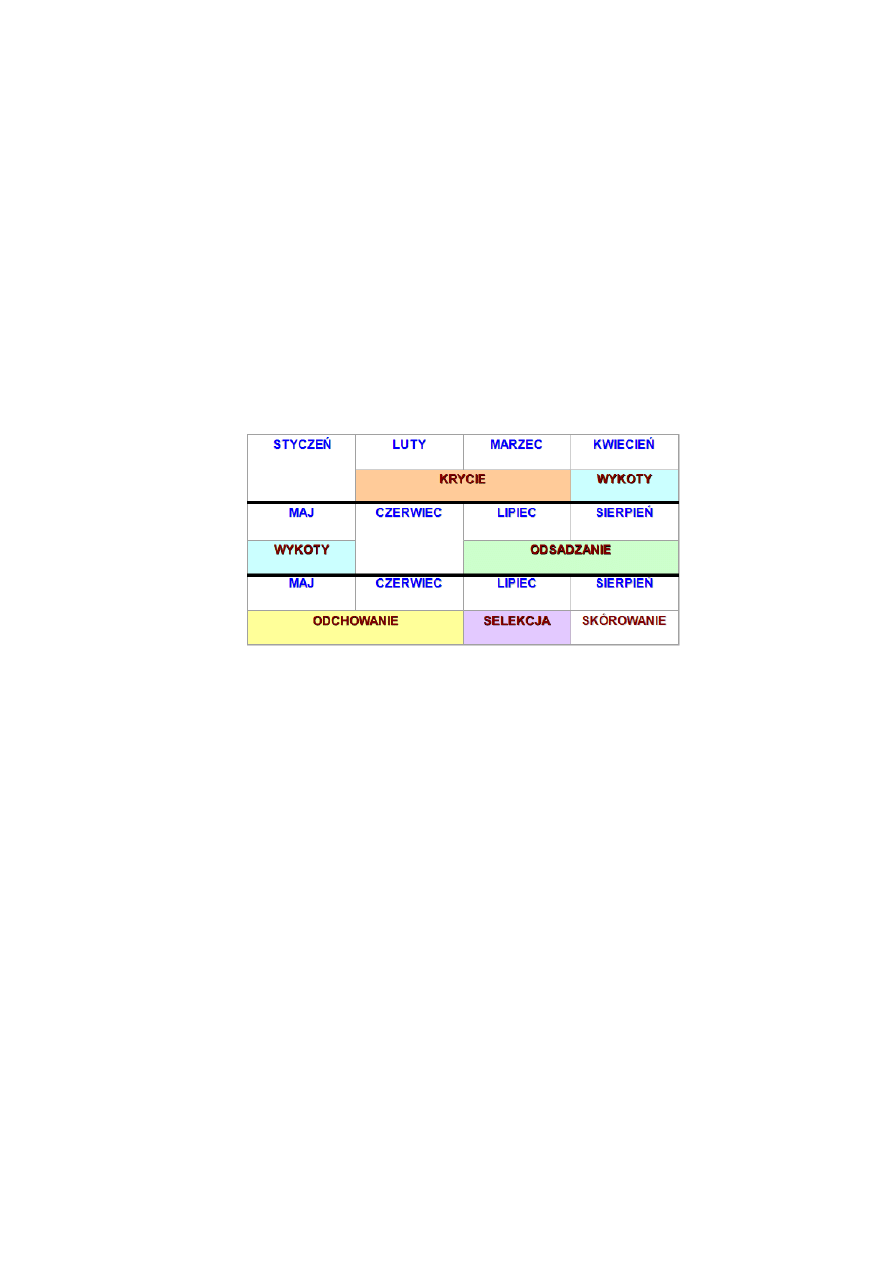
67
pośmiertnie: oznaczanie Pb w wątrobie, nerkach, mięśniach oraz włosach
Działanie toksyczne ołowiu polega na zaburzaniu funkcji układów
krwionośnego i krwiotwórczego: zaburzenie syntezy hemu, upośledzenie erytropoezy, uszkodzenie i zwężenie naczyń
włosowatych.
nerwowego: zaburzenia strukturalno-czynnościowe OUN, wypieranie Cu, Zn, Fe z enzymów mózgowych, zmniejszenie
szybkości przewodnictwa nerwowego, działanie na ukł. wegetatywny p. pokarmowego i układu naczyniowego
pokarmowego: zaburzenia perystaltyki, napady kolki ołowiczej, owrzodzenia
rozrodczego: u samic zaburzenia owulacji, u samców uszkodzenia jąder, upośledzenie spermatogenezy, zmiany jakościowe
plemników
Objawy przewlekłego zatrucia Pb u lisów i norek
-
brak koordynacji mięśniowej
-
sztywność
-
drżenia
-
odwodnienie
-
konwulsje
-
śluzowo-ropny wypływ ze spojówek
- anoreksja
Organizacja pracy w fermie norek
Szczepienia
Szczepienia lisów
•
Leptospiroza
•
Nosówka
Szczenienia królików
•
Myksomatoza
•
Pastereloza
•
Pomór królików
•
Zapalenie mózgu
Szczepienia norek
•
Nosówka
•
Enteritis
•
Botulizm
•
pseudomonadoza
Szczepienia szynszyli
•
Pseudomonadoza
•
E. coli
•
jerszinioza
Kluczowe punkty w ocenie zagrożenia mikrobiologicznego oraz zastosowanie
profilaktyki ogólnej i swoistej na fermach zwierząt futerkowych
.
Celem wprowadzania profilaktyki ogólnej i swoistej na fermy zwierząt jest obniżenie ryzyka wystąpienia chorób lub w przypadku ich
powstania niedopuszczenie do rozprzestrzeniania się choroby na fermie poprzez redukcję bezpośredniego kontaktu zwierząt chorych i
zdrowych.

68
System zarządzania ryzykiem biologicznym
•
System edukacyjny –
uświadamianie i oszacowanie
stopnia ryzyka
•
Stworzony do poprawy kontroli nad chorobami zakaźnymi
•
Narzędzie ograniczające wystąpienie ryzyka
Termin System zarządzania ryzykiem biologicznym określa ogólne działania które pozwalają na ocenę warunków utrzymania zwierząt ,
ocenę warunków na fermie na podstawie oceny ryzyka wystąpienia chorób zakaźnych i ich rozprzestrzeniania w fermie
System zarządzania ryzykiem biologicznym wprowadzono aby pomóc hodowcom w zrozumieniu strategii zapobiegania chorobom
zakaźnym, poprzez system edukacyjny, który zapozna hodowców z czynnikami warunkującymi powstawanie i szerzenie chorób
zakaźnych w stadzie, oraz zapozna ich z możliwościami które pozwolą na zminimalizowanie ryzyka lub już ewentualnych strat powstałych
w wyniku wybuchu choroby zakaźnej.
•
Nie jest możliwa całkowita eliminacja ryzyka wystąpienia choroby
–
Relacje pomiędzy:
drobnoustrojami a zwierzętami
zwierzętami a środowiskiem
–
Likwidacja ekspozycji
nośniki zarazka
wektory mechaniczne i biologiczne
System zarządzania ryzykiem biologicznym wskazuje że ryzyko wystąpienia danej choroby nie może być całkowicie wyeliminowane,
jednakże ryzyko to może znajdować się pod naszą kontrolą (naszą czyli hodowcy lub lekarza. Jednakże aby sprawować taką kontrolę
należy posiadać odpowiednią wiedzę dotyczącą relacji pomiędzy drobnoustrojami a makroorganizmem, pomiędzy zwierzętami a
środowiskiem ich bytowania, oczywiście odnośnie samego czynnika zakaźnego i możliwości likwidacji ekspozycji czyli czynników
środowiskowych, które umożliwiają kontakt patogenu z organizmem wrażliwym. Poznanie tych czynników pozwoli nie tylko
zminimalizować ryzyko wystąpienia danej choroby u zwierząt ale także u człowieka – gdy mamy do czynienia z chorobą odzwierzęcą.
Współżycie pomiędzy drobnoustrojami i zwierzami ma rożne formy. Do najważniejszych z nich należą: relacje obojętne, synergizm
antagonizm komensalizm symbioza i pasożytnictwo. Komensale – ich obecnosc w immunologicznie sprawnym organizmie nie przynosi
szkody, np. gronkowiec bialy – skóra. Symbionty – obopólna korzyść – E. coli produkcja wit z gr B. Ale komensale i symbiony należa do
pasozytow względnych czyli mogą wywoływac chorobę ale w pewnych ścisle określonych warunkach (uzjadliwienie się na skuteg zmian
w genpomie lub gdy odpornośc ulegnie obniżeniu),. Osobną grupe stanowia pasozyty, które mogą się namnazac głownie w organizmie
żywym i szybkopoza nim giną. Warunkiem przezcycia patogenów jest mozliwość transmisji z organizmu zakazonego na organizm
zdrowy.
Wpływ środowiska na wystepowanie chorób:
A wiec oprócz chorob infekcyjnych których czynnikiem przyczynowym są priony, pasozyty czy drobnoustroje, istnieją choroby wrodzone
i metaboliczne, które nie szerza się za posrednictwem bezpośredniego kontaktu zwierzat . Do nich nalezą choroby zwiazane z
niekorzystnym wplywem srodowiska takie jak choroby niedoborowe (rzadko u lisow czy norek, niekiedy hipowitaminozy w wyniku
unieczynnienia witamin w karmie – np vit B1 przez tiaminaze obecna w miesie ryb) lub masowe intoksykacje – błąd człowieka.
Likwidacja ekspozycji czyli zespołu czynników środowiskowych które umozliwiają kontakt patogenu z organizmem wrazliwym. Na
ekspozycje skladają się nosniki zarazka: pokarm, woda, wydzieliny, wydaliny, kurz, naskórek oraz wektory mechaniczne i biologiczne.
Wektor mechaniczny słuzy zarazkom jedynie za środek transportu, zaś w wektorze biologicznym zarazek namnaza się lub przechodzi
cykle rozwojowe. Mucha domowa – Salmonella , Escherichia coli, Pasteurella tularensis), komary kleszcze - P. tularensis, myszy, szczury
-wscieklizna, salmoneloza,
Drogi transmisji
•
Transmisja czynników zakaźnych
Zwierzę zwierzę
Zwierzę człowiek
Sposoby transmisji
Zakażenie:
–
aerogenne chlamydofiloza
–
alimentarne salmoneloza
–
bezpośrednie
zabiegi wet.
szczepienia
–
wektory chorób zakaźnych
–
Aby zrozumieć system zarządzania ryzykiem biologicznym należy poznać, przeanalizować drogi transmisji czynników
zakaźnych, które mogą dotyczyć zwierząt ale również i człowieka w układzie zwierzę-człowiek (i tu mówimy o chorobach
odzwierzęcych). Czynniki zakaźne rozprzestrzeniają się ze zwierzęcia na inne zwierzę, czy człowieka różnymi drogami. Wiele
czynników zakaźnych rozprzestrzenia się więcej niż jedną drogą.

69
–
System zarządzania ryzykiem biologicznym skupia się głównie nad tym jak ograniczyć lub zlikwidować możliwość
bezpośredniego kontaktu z czynnikiem zakaźnym.
Kontakt bezpośredni
•
Nośniki zarazka
–
krew, ślina, wydaliny
–
otwarte rany, błony śluzowe, skóra
•
Choroby przenoszone drogą płciową
–
krycie
–
ciąża
Transmisja zarazka przez kontakt bezpośredni wymaga obecności czynnika zakaźnego w środowisku lub wewnatrz zakażonego
organizmu. Wówczas zwierzeta wrazliwe ulegają ekspozycji po kontakcie z otwartą raną, błonami śluzowymi, skórą czy krwia, sliną. Stad
czeste zakażenia u nowonarodzonych szczeniat po kontakcie z matka, u której zakażenie ma przebieg niejawny,np. herpeswiroza.
Zakażenie może również zostac przeniesione na potomstwo za pośrednictwem komórek płciowych (zakażenie seminalne) – bialaczka u
bydła, ale istnieje również cały szereg chorób przenoszonych drogą płciową podczas krycia lub jako zakażenie śródmaciczne.
Wtórne źródło zakażenia
Miejsca skupienia zarazka poza organizmem
•
gleba
•
pasza
•
woda
•
narzędzia do pielęgnacji i chwytania
•
sprzęt fermowy
Najczestrzym wtórym żródłem zakażenia są pasze i woda zanieczyszczone drobnoustrojami chorobotwórczymi , np. mieszanki paszowe
zanieczyszczone Salonellozą lub prionami powodującymi gabczaste encefalopatie, następnie skarmiani epadliną lub odpadami
drobiowymi czy rybami skażonymi toksyna botulinową, lub pasze zawierające endospory laseczek tężca, za posrednictwem wody szerzą
się leptospirozy. Sprzet uzywany do pielęgnacji zwierzat pośredniczy w przenoszeniu zwlaszcza chorób pasożytniczych i grzybiczych
(swierzb)
Drogi transmisji
•
Dotyczą wszystkich czynników zakaźnych.
•
Zwierzęta muszą ulec ekspozycji na czynniki zakaźne aby doszło do zakażenia.
•
Zrozumienie i poznanie różnych dróg transmisji zarazków jest pierwszym krokiem do zarządzania ryzykiem biologicznym.
Każda choroba posiada swoje drogi transmisji czyli rozprzestrzeniania się w stadzie, stąd przerwnie dróg transmisji ma sens jeżeli
mówimy o zapobieganiu chorobom zakaźnym. Każda choroba ma swoją specyficzną drogę transmisji. Stąd tez poznanie tych dróg (czy to
będzie droga kropelkowa czy pokarmowa) ułatwi objęcie tych chorob kontrolą.
Transmisja chorób zakaźnych
•
nie wszystkie zwierzęta wykazują kliniczne objawy choroby
•
Poznanie wszystkich
dróg transmisji pozwoli na rozwój strategii zwalczania danej choroby
Jednakże należy podkreślić ze nie wszystkie zwierzeta wykazują obecnośc objawow klinicznych choroby (grzybice) a mogą stanowić
źródło zakażenia dla innych zwierzat, Dla prawie wszystkich chorób zakaźnych zachodzi zależność pomiędzy dawką zakaźną a
natężeniem procesu zapalnego. Niskie dawki zakaźne są przyczyna powstania zakażeń subklinicznych lub chorób o lekkim przebiegu.
Stad też tak wazne jest poznanie drog transmisji chorób aby skutecznie przeciwdzialać ich powstawaniu.
Ogólne zasady zapobiegania chorobą zakaźnym
•
Zasięg fermy
•
Identyfikacja zwierząt
•
Protokoły zdrowotności zwierząt
•
Źródło zwierząt nowo zakupionych
•
Wybijanie chorych zwierząt
•
Likwidacja zwłok
•
Izolacja/kwarantanna
•
Leczenie
•
Ograniczenie kontaktu z innymi zwierzętami
•
sąsiednie fermy
•
zwierzęta dzikie, ptaki
•
włóczące się psy i koty
•
Stan ogrodzeń
•
Ustalenie protokołów bioochrony dla personelu oraz maszyn opuszczających fermę
•
Oznakowanie poszczególnych zwierząt
•
- pozwala na śledzenie

70
•
statusu zdrowotności
•
Szkolenie personelu w kierunku odróżniania stanu zdrowia od choroby u zwierząt
•
codzienny przegląd zwierza
•
czyszczenie i dezynfekcja sprzętu, ubrań oraz butów
•
Przeprowadzanie badań sekcyjnych u zwierząt padłych z nieznanych przyczyn
•
Przechowywanie szczepionek
•
i antybiotyków.
•
Wykonywanie podstawowych
•
zabiegów pielęgniarskich
•
przez odpowiednio
•
przeszkolony personel
Jest kilka ogólnych zasad które powinny zostac wprowadzone na fermy w celu zapobieżenia wybuchu choroby na fermie, zwlaszcza takiej
która rozprzestrzenia się wieloma drogami. Do tych zasad należy znajomość obszaru fermy, a co za tym idzie sąsiedztwa czli okolicznych
farm czy dzikich populacji zwierząt (ten punkt dotyczy chodowli nutrii), następnie identyfikacja czyli oznakowanie zwierząt, protokoly
zdorowtności zwierzat gdzie zapisywane są: wykonywane zabiegi lekarskie i profilaktyczne, rozpoznane choroby, ewentualne okresy
izolacji czy kwarantany zwierząt, tu także powinny znależć się informacje dotyczące ilości zwierząt w miocie i ilości zwierzat
odchowanych, co jest niezwykle przydatne do przeprowadzenia przyszlego remontu stada.
Wybijanie chorych zwierząt
Działanie radykalne, które stosuje się w stosunku do zwierząt chorych na choroby zakaźne o dużej zakaźności i z reguły kończące się
śmiercią, czyli szybko rozprzestrzeniające się na fermie i stanowiące duże zagrożenie dla stada, a czasem i dla ludzi. Wybijanie jest
również uzasadnione gdy leczenie jest bezskuteczne lub ekonomicznie nieuzasadnione.
Likwidacja zwłok
Zwłoki zwierząt padłych i wybitych musza zostać unieszkodliwione w taki sposób by nie stanowiły źródła zakażenia. Zwierzęta padłe
najczęściej przekazuje się do zakładów utylizacyjnych lub zakopuje, a ciala zwierzat oskórowanych można utylizować w celu otrzymania
maczki mięsno-kostnej.
Izolacja zwierząt chorych
Izolacja zwierzat chorych eliminuje mozliwosc zakażenia zdrowych osobników w drodze kontaktu bezpośredniego oraz zmniejsza
niebezpieczenstwo szerzena sie się zakażenia za posrednictwem środowiska. Izolacja zapobiega ich transmisji na obsługe fermy oraz
personel Zwierzętra nowowprowadzone do fermy powinny zostac poddane kwarantannie, ponieważ może okazać się iż są nosicielami
jakis czynników zakaźnych, a przetransportowanie w nowe miejsce może przyczynic się do rozwoju jawnej postaci choroby.
Leczenie
Leczenie przyczynowe – etiotropowe, skierowane na czynnik wywołujacy chorobę – przy uzyciu antybiotykow, surowic
odpornościowych, szczepionek stosowanych leczniczo leczenie objawowe, którego celem jest zminimalizowanie objawow chorobowych ,
leczenie bodźcowe, pobudzające mechanizmy odporności nieswoistej.
Ograniczenie kontaktu z innymi zwierzetami czyli w pierwszej kolejności zwrócenie uwagi na stan ogrodzen, przez które zwierzeta dzikie
lub walęsające się psy lub koty moglyby dostac się na fermę. Poza tym utrzymujac dobry stan ogrodzen minimalizujemy ryzyko ucieczki
zwierząt z fermy.
Musimy również ustalić protokoły bioochrony dla urządzen mechanicznych oraz personelu fermowego. Po pierwsze stworzenie bramek ze
środkiem odkażającym, który będzie zapobiegał przed wejsciem zarazków na fermę (na butach czy poprzez opony kół) a z drugiej strony
bramki uniemozliwą rozprzestrzenienie się zarazków poza fermę.
identyfikacja czyli oznakowanie zwierząt, protokoly zdorowtności zwierzat gdzie zapisywane są: wykonywane zabiegi lekarskie i
profilaktyczne, rozpoznane choroby, ewentualne okresy izolacji czy kwarantany zwierząt, tu także powinny znależć się informacje
dotyczące ilości zwierząt w miocie i ilości zwierzat odchowanych, co jest niezwykle przydatne do przeprowadzenia przyszlego remontu
stada
Zwierzęta u których mimo leczenia rokowanie odnośnie zejścia procesu chorobowego jest wątpliwe mogą stanowić rezerwuar zarazka,
stąd też powinny zostać poddane eutanazji. Zwierzęta padłe mogą również stanowić źródło zakażenia dla innych zwierząt stąd też powinny
niezwłocznie zostać usuniete z fermy. Ponadto zwierzeta padłe słuza jako pozywienie dla zwierzat, ptaków padlinożernych i w ten sposób
choroba może rozprzestrzenic się na dalsze odległosci.
Promienie słoneczne mogą dezaktywować szczepionkę czy preparaty lecznicze stad też szczepienie czy leczenie nie bedzie skuteczne.
Warunki przechowywania szczepionek i antybiotyków są podane na opakowaniu.
Reprodukcja
•
Programy reprodukcji zwierzat
–
zapłodnienie sztuczne
–
zapłodnienie naturalne
Źródłem zakażenia może być również nasienie wywołując choroby kryjne które prowadza do ronień lub zaburzeń w rozrodzie. Dlatego tez
sztuczne zapłodnienie wydaje się bezpieczne rozpatrując je pod kątem źródła zakażenia, oczywiście pod warunkiem ze zostalo ono
pozyskane z odpowiedniego źródła i sprawdzone pod względem mikrobiologicznym. Oczywiście sam zabieg inseminacji powinien
bycprzeprowadzony w higienicznych warunkach.Natomisat jeżeli na fermach stosuje się zapłodnienie naturalne, przed okresem krycia
samce powinny być przebadane pod kątem chorób zakaźnych. Bufor do przechowywania i mrożenia nasienia.
Immunoprofilaktyka swoista
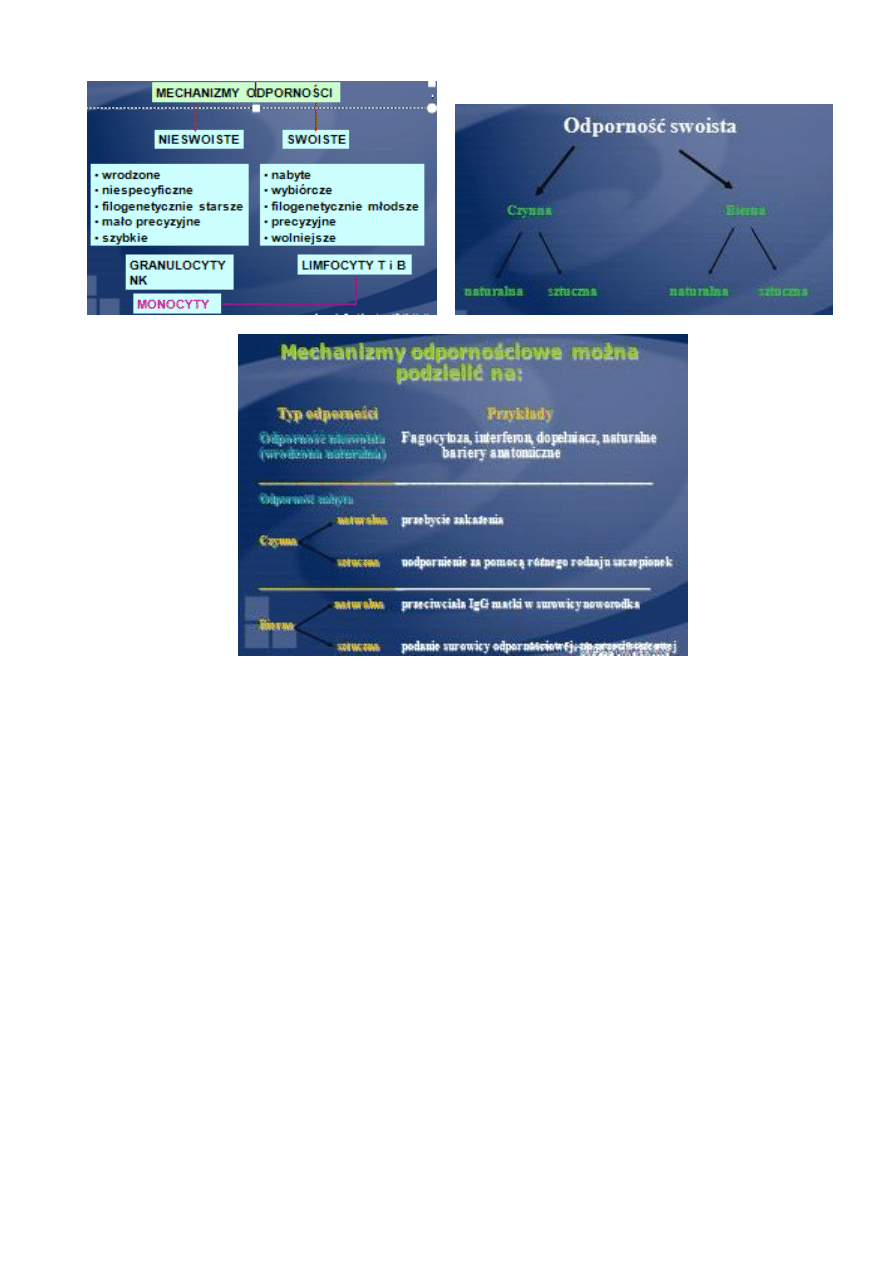
71
Czynniki zwiększające podatność na choroby zakaźne
Urazy skóry, błon sluzowych
Szczepienia
Warunki utrzymania zwierząt:
zagęszczenie, nieodpowiednia wilgotność, temperatura oraz oświetlenie pomieszczeń, zapylenie, drażniące składniki powietrza
(amoniak).
Choroby o przebiegu ostrym.
Niedobory żywieniowe:
niedobór kaloryczny, niedobór białka, składników mineralnych, witamin.
Wpływy atmosferyczne: temperatura, wilgotność powietrza, opady atmosferyczne i wiatry.
Nadmierna eksploatacja.
Wiek i płeć zwierząt.
Pasożyty.
Bodźce środowiskowe (stresory)
Urazy skóry, błon sluzowych stanowia wrota zakażenia dla wirusa wscieklizny, zarodników tężca
Szczepienie – po iniekcji szczepionki zwłaszcza przeciwko chorobom wirusowym nastepuje przejsciowa immunosupresja co zwieksza
podatność na zachorowania lub uaktywnienie zakażeń utajonych
są przyczyna stresu powodującego obnizenie odporności a w efekcie zwiekszoną podatność na zakażenie i choroby
Indukują często przejscie zakażenia utajionego lub bezobjawowego w zakażenie jawne. U zwierzat chorych na nosówke często wtórnie i
rownoczesnie rozwija się salmoneloza.
Wpływają na wiele składowych odporności humorlanej i komórkowej powodując zaburzenia w odporności naturalnej i nabytej
Eksploatacja – czyli duzy wysiłek fizyczny, brak odpoczynku wpływaja negatywnie na odporno.ść przeciwzakaźną
Pierwotna odpowiedź immunologiczna
•
Primary immune response develops in the weeks following first exposure to an antigen
–
Mainly IgM antibody
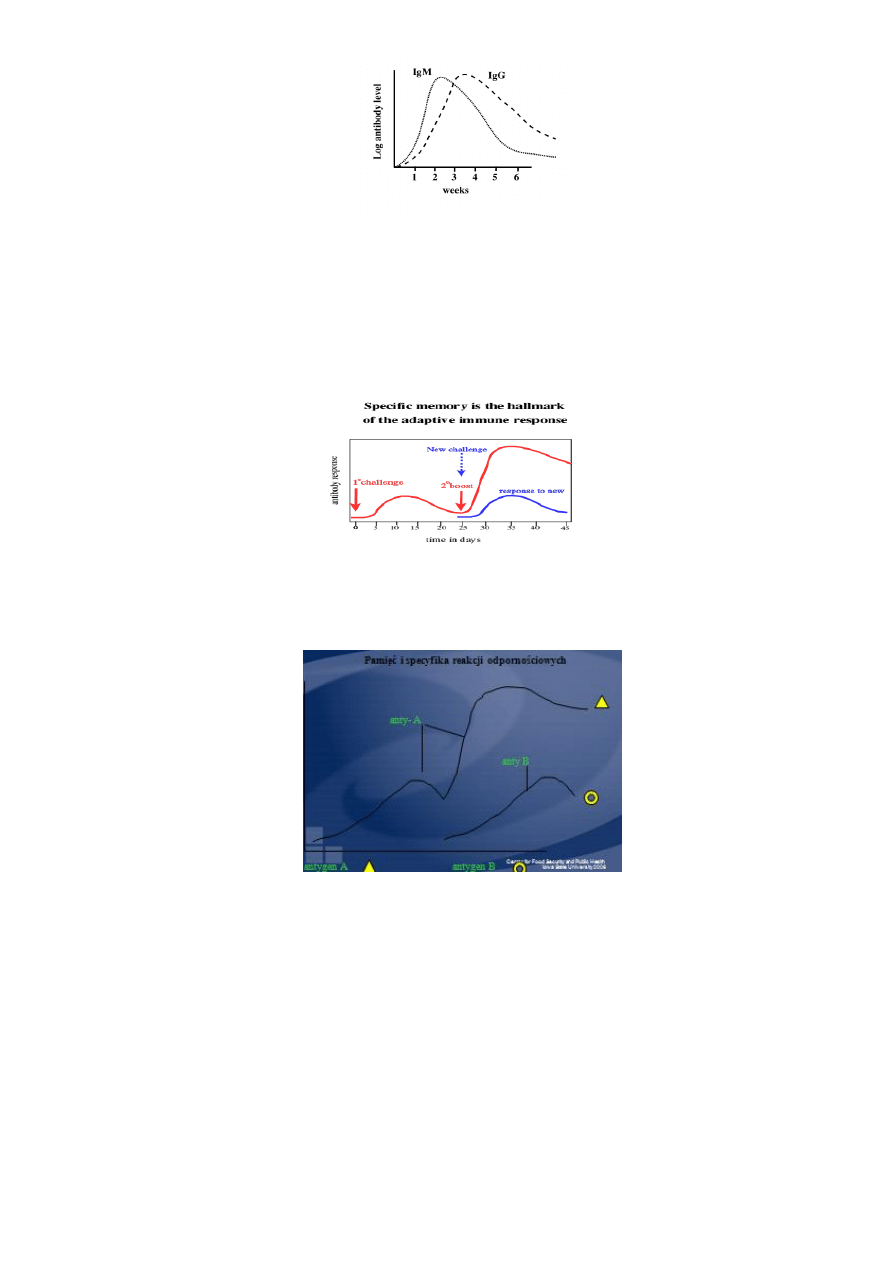
72
Charakter odpowiedzi imm. Zalezy od tego czy zwierze kontaktuje się z antygenami zawartymi w szczepionce bądź drobnoustrojem po raz
pierwsszy czy kolejny. Pierwotna odp. Imm pojawia się po pierwszej ekspozycji na antygen, z reguły po kilku-kilkunastu dniac, przy czym
początkowo miano przeciwciał jest niskie, wartośc max. Osiąga mniej więcej po 2 tyg, a nastepnie powili spada. W zakażeniach
wirusowych miano przeciwciał utrzymuje się dłużej niż w bakteryjnych. Najpierw pojawiają się Immunogl kl M, w dalszej kolejności
przeciwciala klasy IgG i IgA.
Wtórna odpowiedź immunologiczna
•
Secondary immune response is faster and more powerful
•
Predominantly IgG antibody
Powtórna ekspozycja na ten sam antygen, nawet w małej dawce wywołuje wtórną odpowiedź, która jest skutkiem istnienia komórek
pamięci immunol. Pojawiających się w nastepstwie pierwszego kontaktu z antygenem. W odpowiedzi wtórnej swoiste przeciwciała,
głównie IgG pojawiają się w surowicy po 2-4 dniach, osiągając szybko wysokie miano i utrzymują się dłużej w krwioobiegu niż podczas
odpowiedzi pierwotnej.
swoistość - wytwarzanie odpowiedzi skierowanej wobec ściśle określonego antygenu (czyli zarazek lub jego fragment zawarty w
szczepionce)
istnienie pamięci immunologicznej pozwalającej na nasiloną odpowiedź zwana anamnestyczną – przy powtórnym wprowadzeniu antygenu
do organizmu
Cechy te zależą od etapu rozwoju filogenetycznego oraz dojrzalosci immunologicznej organizmu do wytwarzania odporności. Proces
immunologicznego dojrzewania jest zaprogramowany genetycznie i przebiega w grasicy.
•
Najważniejsze cechy odpowiedzi immunologicznej:
•
swoistość - wytwarzanie odpowiedzi skierowanej wobec ściśle określonego antygenu (czyli zarazek lub jego fragment zawarty w
szczepionce)
•
istnienie pamięci immunologicznej pozwalającej na nasiloną odpowiedź zwana anamnestyczną – przy powtórnym
wprowadzeniu antygenu do organizmu
•
Najwyzsza sprawność do pobudzenia mechanizmow odpornosciowych przypada na okres dojrzewania anatomicznego i obniża
się wraz z wiekiem.
Pełna dojrzalość immunologiczna
•
psy i lisy: 6 tydzień życia
•
Koty: 10-12 tydzien zycia

73
•
norki, tchorzofretki, króliki, nutrie: 6-10 tydzień życia
Pełna dojrzalość immunologiczna psy i lisy osiagają w wieku około 6 tyg życia, koty 10-12 tydzien, norki tchorzofretki króliki nutrie 6-10
tydz.
Potencjał immunologiczny siary i mleka
•
Sposób przekazania odporności biernej
•
Poziom immunoglobulin u fretki
I
I
g
g
A
A
I
I
g
g
M
M
I
I
g
g
G
G
p
p
ł
ł
ó
ó
d
d
b
b
r
r
a
a
k
k
5
5
%
%
2
2
4
4
h
h
p
p
o
o
p
p
o
o
r
r
o
o
d
d
z
z
i
i
e
e
2
2
2
2
%
%
9
9
d
d
z
z
i
i
e
e
ń
ń
ż
ż
y
y
c
c
i
i
a
a
2
2
9
9
%
%
1
1
3
3
%
%
7
7
7
7
%
%
%
%
p
p
o
o
z
z
i
i
o
o
m
m
u
u
i
i
m
m
m
m
u
u
n
n
o
o
g
g
l
l
o
o
b
b
u
u
l
l
i
i
n
n
w
w
s
s
u
u
r
r
o
o
w
w
i
i
c
c
y
y
o
o
s
s
o
o
b
b
n
n
i
i
k
k
a
a
d
d
o
o
r
r
o
o
s
s
ł
ł
e
e
g
g
o
o
Sposób przekazania odporności biernej z matki na potomstwo zależy od budowy łozyska. U zwierzat futerkowych tylko 5-10%
immunoglobulin przenika przez łozysko, reszta jest przekazywana wraz z siarą.
•
Interferencja odporności czynnej
•
Optymalny termin szczepień
•
Potencjał immunologiczny siary
Odporność przekazana przez matke może przeciwdziałać nabywaniu odporności czynnej przez noworodki. Swoiste przeciwciała
przekazane przez łozysko oraz za pośrednictwem siary hamują wytwarzanie przeciwciał dla antygenów homologicznych w organizmie
szczeniąt. Co wiecej nastapi także zobojetnianie antygenów szczepionkowych przez swoiste przeciwciała matczyne oraz blokowanie im
dostepu do komórek immunologicznie kompetentnych – producentów przeciwcia ł w organizmie szczenięcia. Oznacza to ze szczepić
należy w określonym wieku, żeby zminimalizowac efekt supresyjny odporności biernej przekazanej im przez matke. U zwierząt
gospodarskich istnienie transferu odporności z matki na płód wykorzystuje się do zwiekszenia potencjału immunologicznego siary. W tym
celu immunizuje się cięzarne matki w ostatnim trymestrze ciązy, dwukrotnie.Długość ciązy – krótka; zwierzeta stresogenne-poronienia po
szczepieniu ciezarnych samic
Czynniki wpływające na czas utrzymywania się odporności matczynej:
•
stan odporności matki
•
wielkość puli immunoglobulin i limfocytów T przekazanych noworodkowi z siarą
•
czas podania pierwszych porcji siary
•
ilość pobranej siary
•
zdolności wchłaniania siary z jelit noworodka
Oprócz dojrzałości immunologicznej efektywność szczepień zalezy od:
•
rodzaju antygenu w użytego szczepionce, który posiada zdolność do pobudzania wytwarzania przeciwciał (immunogenność)
•
zdolności do swoistego wiązania się z przeciwciałami
•
Przykład silnego antygenu
•
wirus zawarty w szczepionce wściekliznowej, parwowirusowej lub anatoksyna botulinowa
•
Słaby antygen o niskiej immunogenności
•
koronawirus, rota i herpeswirus.
Szczepionki zawierające komponenty o słabych właściwościach antygenowych muszą być stosowane w dużych dawkach i przy
użyciu adiuwantów
W praktyce obserwuje się wystepowanie odczynow miejscowych a nawet ropni po zastosowaniu amerykanskiej szczepionki Entox oraz
szwedzkiej Nord-camtrip (zap. Jelit norek, anatoksyna Cl. Botulinum, Pseudomonas aeruginosa) Adiuwantem jest wodorotlenek gliny
który wywoluje stany zapalne w miejscu podania u malych psow rasowych, lisow i norek. Dlatego wprowadzono adiuwanty olejowe które
maja mniejsze dzialanie uboczne
•
U zwierząt mięsożernych przeciwciała przeciwko nosówce przekazywane przez matkę na potomstwo zarówno z siarą (ok. 90%)
jak i przez łożysko (10%) mogą zanikać między 6 a 16 tygodniem życia, najczęściej około 12 tygodnia.
•
Przeciwciała przeciwko wirusowej chorobie Rubartha (zakaźne zapalenie mózgu lisów) zanikają około 6 tygodnia życia.
•
Matki szczepione przed kryciem, a także mające styczność z zarazkami znajdującymi się stale w środowisku zewnętrznym, mają
wysokie miana przeciwciał.
•
Szczenięta od tych matek powinny być szczepione nie wcześniej niż około 10 tygodnia życia, ponieważ wysoki poziom
przeciwciał matczynych może być przeszkodą w powstaniu pełnej odporności.
•
Wcześniejsze szczepienie przed 10 tygodniem życia wymaga powtórnego uodpornienia zwierząt po okresie 3 tygodni.
Okres pełnej dojrzałości immunologicznej i zanikania przeciwciał matczynych:
•
8-10 tydzień życia u lisów, norek i psów
•
10-12 tydzień życia u kotów

74
Jest to optymalny termin wykonania pierwszych szczepień profilaktycznych.
•
Szczepienie należy powtórzyć po 3-4 tygodniach.
Jednakze wprzypadku zagrozenia choroba zkaaxna lekarz weterynarii sprawujący opiekęnad zwierzętami decyduje o terminie i kolejności
wykonywania szczepień. W przypadku autoszczepionek należy wczesniej wykonac próbę na kilkunajsłabszych zwierzętach.
Efektywność szczepień zależy od:
- dojrzałości immunologicznej organizmu,
związanej z wiekiem
- rodzaju użytego antygenu
- zjawiska immunosupresji i sprawności
układu odpornościowego
Istnienie pamięci immunologicznej i swoista czynna odpowiedź organizmu na dany antygen wskazują iż rozważanie na temat czy
szczepimy szczepionka pojedyncza czy skojarzona nie ma praktycznego znaczenia, szczególnie gdy używamy wysoce oczyszczonych
antygenów. Jedynie w sytuacjach zagrożenia choroba zakaźna lub kiedy istnieje konieczność szczepienia zwierząt zarobaczonych lub
niedożywionych, leczonych wcześniej antybiotykami istnieją wskazania do wykonywania szczepień przy użyciu szczepionek
monowalentnych.
Przyczyny niepowodzeń szczepień
•
Szczepienie zwierząt w okresie inkubacji choroby.
•
Immunosupresja organizmu.
•
Mala immunogenność lub utrata aktywności szczepionki.
•
Brak odpowiedzi immunologicznej na antygen szczepionkowy, obniżona reaktywność oraganizmu na komponenty
szczepionkowe.
•
Obecność odporności matczynej.
•
Przełamanie działania ochronnego przez duże dawki patogenu lub jego bardzo zjadliwe szczepy.
•
Wiek zwierząt w jakim należy rozpocząć szczepienia szczeniąt.
•
Luka immunologiczna – okres życia, w którym nie ma już odporności matczynej, a odporność poszczepienna jeszcze się nie
wytworzyła.
Na ten temat istnieje wiele rozbieżnych zdań. Generalnie idealnym rozwiązaniem jest szczepienie w takim wieku żeby odporność czynna
wywołana przez podanie szczepionki osiągnęła miana ochronne jeszcze przed zanikiem odporności matczynej
1.
Skuteczna odporność pojawia się po tygodniu – dwóch od podania szczepionki, zaszcxzepienie w okresie inkubacji choroby nie
zapobiegni ezachorowaniu ponieważ swoista odpornośc nie zdaży si erozwinać
2.
Odpowiedz imm w okresie immunosupr jest słaba, szczepienie wiec nie daje spodziewanych rezultatów, immunosupresja
towrzyszy często zwierzetom wyniszczonym, głodzonym
3.
Przechowywanie niezgodne ze wskazaniami producenta może spowodowac utrate jej aktywności, szczepionki traca
immunogenność po upływie terminu wazności, szczepionki liofilizowane tracą aktywnosc gdy uzyjemy inego rozpuszczalnika
niż zaleca producent lub ni euzyjemy ich bezposrednio po rozpuszczeniu
4.
Stad tez nie wskazane jest szczepienie zwierzat charłaczych, xle odzywionych ponieważ sprawnosc mech odpornosciowych jest
slabsza
Parwowiroza – luka immunologiczna
Podstawy hodowli zwierząt futerkowych
- rodzaje ferm zwierząt futerkowych
- zasady organizacji pracy hodowlanej
- etapy pracy hodowlanej
- ocena wartości użytkowej
- ocena wartości hodowlanej
- selekcja zwierząt, zasady remontu stada
- dokumentacja hodowlana i znakowanie zwierząt
- zasady klasyfikowania i sortowania skór
- lotowanie i sprzedaż aukcyjna skór

75
Etapy pracy hodowlanej
Zasady remontu stada
•
Każdego roku w stadzie lisów i norek rodzi się i odchowuje znacznie więcej zwierząt, niż potrzeba do zachowania ciągłości
pokoleń.
•
Każdego roku należy usunąć część zwierząt ze stada podstawowego ze względu na wiek, stan zdrowia lub niezadowalające
wyniki hodowli.
Etapy pracy hodowlanej
- ocena wartości użytkowej
- szacowanie wartości hodowlanej
- selekcja najlepszych osobników
- dobór par zwierząt do kojarzeń
Oznacza to ze trzeba przeprowadzić remont stada. Zwierząt do stada nie wybiera się losowoale według określonych kryteriów. Hodowca
na miejsce usuniętych osobników stara się wprowadzić zwierzęta lepsze od poprzednich. Stad tez w całym procesie pracy hodowlanej
można wyodrębnić kilka etapów.
Ocena wartości użytkowej
Wartość użytkowa – zdolność zwierząt do określonej produkcji, mierzonej ilością i jakością produktu uzyskanego w danym czasie.
Do głównych cech użytkowych zwierząt hodowlanych zaliczamy:
•
cechy pokroju
•
cechy reprodukcyjne
Mustela putorius furo
Mustela putorius furo (fretka domowa)
� samce przeciętnie ważą 2.5 funtów
� samice ważą przeciętnie 1.25 funta
� zwykle kupowane jako już wykastrowane lub ze stępującymi jądrami
� przeciętna długość życia 7-9 lat
Zależności terapeutyczne
� fretki są dobrymi zwierzętami do domu dla koneserów
� właściciele sami mogą stosować terapię płynową bardzo odpowiedzialnie
� suplementacja do żywienia podstawowego jest konieczna u fretek chorych
� doświadczalne podawanie antybiotyków w przeciwieństwie do procesu leczenia? Można stosować ale są odległe skutki.
Zależności lekowe
� niewłaściwe stosowanie może utrudniać wykonanie testów diagnostycznych
� antybiotyki maskują kliniczne objawy choroby
� antybiotyki mogą powodować powstanie specyficznych objawów chorobowych
� antybiotyki powinny być stosowane w sytuacjach ze wskazaniem (po badaniach bakteriologicznych i antybiotykooporności)
Zależności chirurgiczne
(lub JAK ZMNIEJSZYĆ % NIESPODZIEWANYCH ZGONÓW)
� używaj anestezji wziewnej bez premedykacji
� anestetyki injekcyjne są w skutkach nieprzewidywalne u fretek
� izofluran jest bezpieczny w podawaniu przez maskę lub po intubacji
� wskazane jest zastosowanie podgrzewanych poduszek podczas i po operacji
� u fretek występuje bardzo szybko hipotermia
� należy podawać płyny podczas zabiegów chirurgicznych za wyjątkiem sterylizacji i kastracji
Zależności i ścieżka diagnostyczna
(Fretka nie jest ani kotem ani psem!!!)
� fretki normalnie mają wysokie PCV i niskie WBC
� ciągła limfocytoza NIE OZNACZA CHŁONIAKA
� enzymy wątrobowe są zwykle wysokie jako wynik wycieńczenia – niedożywienia u fretek
� starsze fretki zwykle mają niewielkiego stopnia hypoproteinemię w takich chorobach jak przewlekłe chroniczne zapalenie jelit,
zakażenie koronawirusem czy też Helicobacter

76
� fretki z chorobami nadnerczy rzadko mają diagnozowane zaburzenia w rutynowych badaniach CBC/biochemia
Coronavirus u fretek
� JAVMA August 15
th
� bardzo często w USA i Kanadzie
� po raz pierwszy opisany w Waszyngtonie w marcu 1993
� epizootyczne nieżytowe zapalenie jelit (ECE)
� wysoka zachorowalność, niska śmiertelność
� bezobjawowi nosiciele
� często zakażenia w sklepach zoologicznych – młodzieży
� starsze zwierzęta mają cięższą postać choroby
� długotrwałe siewstwo wirusa
Diagnostyka
� objawy kliniczne i historia choroby
� histopatologia
� immunohistochemia
� zmiany anatomopatologiczne mało specyficzne
Patogeneza
� infekcja wirusowa wierzchołków kosmków jelitowych
� martwica komórek
� utrata powierzchni wchłaniania enzymów rąbka szczoteczkowego
� biegunka sekrecyjna
� zaburzenia wchłaniania
� zwiększona wydzielniczość śluzu
� ostra forma choroby
� zwyrodnienie wakuolarne i martwica wierzchołkowych części enterocytów
� zanik kosmków
� Postać chroniczna
� rozwija się do roku po zakażeniu
� zanik kosmków ze zlaniem się ich oraz zatarta struktura
� limfocytarne zapalenie jelit
Aleutian Disease (Choroba Aleucka)
� coraz częściej pojawiająca się choroba u fretek
� nowe postacie choroby
� nowe zachorowania osiągają prawie 100% śmiertelność i zachorowalność
� skryta choroba z długim okresem latencji
� nieszkodliwy parvovirus wywołuje nadwrażliwość układu immunologicznego
Klasyczna postać choroby
� Glomerulonephritis
� Rozsiane vasculitis
� Hypergammaglobulinemia
� Zaburzenia krzepnięcia
� Śmierć w ciągu 2-3 lat w przeciwieństwie do norek
Laboratorium
� gammaglobuliny powyżej >20% TP
� TP >7.5 podejrzenie
� komercyjnie dostępny test CIEP IFA, PCR, ISH dostępne ale cenowo nieopłacalne
� zwierzęta < 1 roku z paraliżem wstępującym
� Plasmacytic (meningo)myelitis
Przeżyją ale w ciągu 2 lat rozwija się klasyczna postać będąca przyczyną śmierci.

77
Helicobacter mustelae
� zakażenie ubikwitarne – wszystkie fretki zakażają się w wieku 2 tygodni
� wywołuje proces charłaczy u starszych fretek
� 10% ma objawy kliniczne choroby w ciągu swojego życia
� uszkodzenia żołądka spowodowane fizyczną destrukcją błony śluzowej łącznie z głębokim limfoplazmocytarnym zapaleniem
� współwystępuje z wrzodami żołądka
� większość uszkodzeń jest niezauważalna
� Przewlekłe zanikowe zapalenie żołądka z utratą produkcji kwasu solnego
� Bakterię uszkadzają błonę śluzową poprzez trzy mechanizmy
� bezpośredni efekt cytotoksyczny na błonę śluzową komórek cieśni
� oddziaływanie inhibicyjne na komórki produkujące kwas solny
� nieagresyjna choroba zapalna (lymphoplasmacytic gastritis)
Diagnoza
najczęściej pobranie materiału z odźwiernika - biopsja!!
� charakterystyczne L-P zapalenie żołądka
� barwienie srebrem (S+) wewnątrzkomórkowe bakterie
� mniej lub bardziej inwazyjne formy
� RT-PCR z kału
� endoskopia
– biopsja tkankowa
– hodowla
Guz komórek wyspy trzustki(Insulinoma)
� bardzo często spotykane guzy u fretek
� mogą być wydzielnicze lub niewydzielnicze
� nieprawidłowe wydzielanie insuliny wywołujące niedowład przednich kończyn, ślinienie się, napady zgięciowe i
śpiączka
� łagodny rozrost
Diagnoza
� wywiad i objawy kliniczne
� test tolerancji glukozy
� 60-80 g/dl – kwestionowane
� <60 pozytywne
� test insulinowy nie wykonywany
Carcinoma lub adenoma
40% fretek ma przypadki nawrotów w okresie 10 miesięcy
Chłoniak złośliwy (Lymphosarcoma)
Częsty proces złośliwy u fretek
� 1-2 years - młodzieńczy (Lymphoblastic) – postać trzewna
� 2-7 years - Lymphocytic – przerzuty do węzłów chłonnych
� 2-7 years – Immunoblastic – polimrficzny
Diagnoza
�
objawy kliniczne
�
specyficzne zmiany anatomopatologiczne w narządach
�
biopsja dużych węzłów lub organów
Prognoza
�
zła prognoza z wyjątkiem pierwotnych zmian skórnych
� chemioterapia jest jedną z dostępnych metod ale mniej niż 10% jest podatna
Chłoniaki atakują wiele organów: wątroba, nerki, płuca
Postać skórna
� niewiele przypadków
� długi okres przeżycia
� ma dobre prognozy co do rozwoju jeśli wcześnie zdiagnozowany

78
� postać skórna może być przerzutem odległym
Wrzody żołądka
� częste u fretek i innych łasicowatych spowodowane silnym stresem lub chorobami
� może towarzyszyć im zakażenie Helicobacter mustelae
Objawy kliniczne
� często niespecyficzne
� bez zmian
� letarg
� bruxism
� smołowate stolce
� mogą być znajdywane martwe zwierzęta
Ciała obce w przewodzie pokarmowym
� bardzo często u fretek
� wysoki indeks podejrzeń wobec fretek poniżej 1 roku życia
� występuje u znudzonych i zamykanych w klatce fretek
� guma, kauczuk, materiał, włosy – widoczne tylko w badaniu RTG ale <10 % przypadków
� badania kontrastowe dają pozytywny efekt w 20% przypadków
� nie czekaj na chirurgiczne potwierdzenie! Zdecyduj się na szybką diagnostykę i działanie.
Inny typ ran może powstać w wyniku badania ustami środowiska zewnętrznego.
Rozrostowe zapalenie okrężnicy
� rzadka choroba u młodych samców
� Ileobacter (Desulfovibrio) sp.
� zajęta okrężnica tylko u fretek
� często bolesne defekacje z bezpośrednim krwawieniem i wydalaniem śluzu
� Diagnoza
Objawy kliniczne i wywiad. Ścieńczała pokryta jakby brukiem okrężnica, bolesność okrężnicy podczas omacywania jamy brzusznej
� biopsja okrężnicy
Zmiany mikroskopowe
� rozrost niedojrzałych komórek gruczołowych
� wzrost komórek dna krypt
� zapalenie okrężnicy
� spotykane ropnie gruczołów w postaciach aktywnych
� wybroczyny
Barwienie srebrem uwidacznia liczne wierzchołkowe wewnątrzkomórkowe bakterie
Eozynofilowe zapalenie jelit
� rzadka choroba u młodych samców o nieznanej etiologii
� pasożyty, alergia? Przewlekłe powodujące chudnięcie choroba atakująca liczne organy
� mała liczba eozynofilów normalnie występująca w jelitach fretek i okrężnicy
� oceń zmiany architektury jelit przed wystawieniem diagnozy!
� zmiany mogą się pojawić w każdym organie jamy brzusznej
� spójrz na komórki Splendore- Hoeppli w długotrwającym ostrym przypadku

79
Sprawdź, może okazać się że biopsja wykaże inną przyczynę
Splenomegalia
� często spotykane zwłaszcza u starszych fretek
� typowa odpowiedź na zapalenie przewlekłe
� mniej niż 5% to zmiany neoplastyczne
� w 95% przypadków to łagodne pozaszpikowe wynaczynienia
� splenektomia jest postępowaniem chirurgicznym z wyboru u osłabionych fretek
Actinomyces sp
� Bardzo rzadka infekcja przewlekła
� Najprawdopodobniej powstała w wyniku wcześniejszego urazu/uszkodzenia
� Oporna na leczenie antybiotykami
Wścieklizna
Nie ma leczenia.
W większości wypadków należy prowadzić kwarantannę.
Szczepienie IM u wszystkich fretek począwszy od 15 tygodnia.
� Choroba rzadko spotykana
� mniej niż 50 przypadków zidentyfikowana do tej pory
� fretki zakażają się od skunksów, nietoperzy, nutrii
� występuje faza cicha i faza podniecenia
� należy wykluczyć wszystkie choroby nerwowe
Ciałka Negriego w mózgu u fretek
Nosówka
� 100% śmiertelności u fretek
� 12-45 dni rozwoju choroby
� najczęściej pojawia się u młodzieży i nowonarodzonych fretek jako zakażenie egzogenne
� diagnoza na podstawie objawów klinicznych, należy dokonać eutanazji wszystkich zwierząt
� pośmiertne badanie FA
Wydzielina wokół oczu oraz hiperkeratoza lusterka nosa. Ropna wydzielina wokół oczu u fretek
Hiperkeratoza lusterka nosa i poduszek palcowych. Biegunka, utrata wagi
Zapalenie płuc u fretki z CDV
Neural Tube Defects – defekt tkanki ektodermalnej
� Zmiana zabarwienia u fretek

80
� Różne stopnie:
� agnozja mózgu
� wady rozwojowe rdzenia kręgowego (dysrafia)
� Często towarzyszą mu:
� inne defekty urodzeniowe
� opóźnienie dojrzewania wewnątrzmacicznego
� bezmózgowie
� rozszczepienie czaszki i kręgosłupa
� zrost kręgosłupa szyjnego
� inne defekty urodzeniowe
Przypadki
Stłuszczenie wątroby
� często zmiana fizjologiczna
� podczas wyniszczenia i mobilizacji tłuszczu obwodowego
Stłuszczenie wątroby - 20% częściej ogniskowe niż rozsiane
� często wzrost ALT
� fretki nie mają syndromu stłuszczonej wątroby
� 20% wątroby wykazuje niewielki ogniska lipidozy które mogą być mylone z ogniskami nowotworzenia
Cysty nerkowe – ponad 25% fretek.
Policystyczna choroba nerek.
Lipidoza płuc – często u fretek, bez objawów klinicznych, mylona z nowotworem!!
Nowotwory
Nabłoniak gruczołów zapachowych – częsty nowotwór skórny, postać brodawkowata, złożony, leczenie chirurgiczne.
Guzy gruczołu mlekowego – liczne, zwierzęta ze wznowami, brak przerzutów, najczęściej łagodne, usunięcie chirurgiczne, dobra
prognoza!(?)!!!
Cysty apokrynowe/guz – mogą być spotykane w każdej częśći ciała ale najczęściej napletek, pochwa.
Zmiany neoplastyczne
Chordoma (struniak) – szkielet osiowy, najczęściej nasada ogona, bardzo inwazyjny, niski poziom złośliwości, złe rokowanie przy innej
lokalizacji
Squamous cell carcinoma – najczęściej żuchwa ale spotykany w każdym miejscu na skórze. Zła diagnoza przy lokalizacji w jamie ustnej.
Hemangiosarcoma
� Nowotwór pochodzenia naczyniowego. Niewielki stopień złośliwości w obrębie skóry. Gorsza prognoza jeśli
spotykany w obrębi trzewi.
Oponiak u fretki
Nowotwory mózgu – rzadkie
Nowotwory kości
� najczęściej kostniaki – kości płaskie i kości długie
� kości płaskie - osteosarkoma
Adrenal Teratoma
Obustronna, podatna na napromieniowanie, rzadki guz u fretek
Choroby królików
Enterotoksemia królików
enterotoxaemia cuniculorum
Jest to zakaźna choroba wywołana przez beztlenowce. Przebiega w postaci ostrej enterotoksemii lub zaburzeń ze strony przewodu
pokarmowego w postaci biegunki i zapalenia jelit – jelita ślepego i okrężnicy.
Etiologia
-
Clostridium spiriforme, C. perfringens typ E, C. welchii typ A, C. septicum, C. difficile
-
występuje na dużych fermach towarowych
-
brojlery królicze
-
chorują króliki młode 5-8 tygodniowe

81
Źródła i drogi zakażenia
rezerwuarem zarazka są powierzchniowe warstwy gleby
zakażenie drogą pokarmową, zachorowania pojawiają się nagle
bakterie stanowią mikroflorę przewodu pokarmowego, przejściowo, okresowe nosicielstwo
autoinfekcja w wyniku współdziałania czynników ryzyka – doustne podawanie antybiotyków linkomycyny i klindamycyny
stres związany z okresem odsadzenia, stres żywieniowy związany ze zmianą paszy oraz nadmiarem białka i węglowodanów
oraz niedoborem włókna
zakażenia rotawirusami, koronawirusami, E. coli, Eimeria sp., Cryptosporidia
Patogeneza
-
C. spiriforme wytwarza jota-podobną egzotoksynę
-
oporna na działanie enzymów przewodu pokarmowego i antybiotyków
-
inaktywują ją zasady, wysokie temperatury, antytoksyna C. perfringens typ E
-
zwiększa przepuszczalność naczyń krwionośnych – w obrębie jelita ślepego
-
powstawanie przesięku
-
biegunka z destrukcją kosmków jelitowych
-
syndrom złego wchłaniania
Enterotoxemia/colitis
Ostra lub podostra choroba
◦
Obfita, wodnista biegunka, +/- krew
◦
Młode, po odsadzeniu
◦
Większość głównych stresorów
odsadzanie
przemieszczanie
nagła zmiana karmy
antybiotyki (gram +)
Objawy kliniczne
Postać ostra
•
nagłe padnięcia dobrze odżywionych królików
•
wyjątkowo biegunka o słabym nasileniu – śmierć w ciągu 6-10 godzin
Postać podostra i przewlekła
•
osłabienie, brak łaknienia, nadmierne pragnienie
•
wodnista, cuchnąca biegunka – odwodnienie, wyniszczenie
•
infekcje dodatkowe – biegunka ciemnobrązowa
•
spadek ciepłoty ciała poniżej 36°C, porażenia, sinica, konwulsje
•
śmierć w ciągu 24-48 godzin
Barwienie Gram
•
Śrubowato zwinięty
•
kształt półokręgu
Powierzchnie surowicze
•
Wybroczyny
•
jelito ślepe
•
wyrostek robaczkowy, bliższa część okrężnicy, dalsza część jelita biodrowego
Zmiany anatomopatologiczne
-
pobrudzenie okolicy odbytu i kończyn rzadkim, zielonkawym, ciemnobrązowym kałem – postać ostra
-
jasny płyn w jamie otrzewnowej
-
węzły chłonne krezkowe powiększone i przekrwione
-
wątroba żółta, powiększona z ogniskami martwicy
-
jelito ślepe i okrężnica – rozdęte, z ciemnobrązowym, pienistym, silnie cuchnącym płynem
-
zapalenie krwotoczne błony śluzowej jelita ślepego
-
wybroczyny w jelicie biodrowym, owrzodzenia, naloty włóknika
-
wybroczyny na worku osierdziowym i grasicy
Rozpoznanie
badanie mikroskopowe i izolacja szczepu toksyno twórczego oraz określenie toksyny
kał, zeskrobina z błony śluzowej jelit cienkich i grubych
podłoże Wrzoska, Schaedlera, VL, Brewera
testy API
próba biologiczna na myszach
odczyn seroneutralizacji ze znanymi surowicami antytoksycznymi
PCR
Rozpoznanie różnicowe
-
Rotawirusy
-
E. coli
-
Cryptosporidia sp.
-
choroba Tyzzera

82
-
Eimeria sp.
Postępowanie
izolacja chorych królików
eutanazja zwierząt wyczerpanych
pochodne sulfonamidów, nitroimidazoli z tetracyklinami
cholestyramina (żywica jonowymienna) per os
5% glukoza, PWE
włóknik w karmie 18-20%
ograniczanie stresu
siarczan miedzi z paszą
dezynfekcja klatek 4% formaliną, opalanie lampą gazową
kwarantanna 14-28 dni
Kolibakterioza
colibacteriosis
Choroba zakaźna przebiegająca w postaci ostrej, manifestująca się zaburzeniami ze strony przewodu pokarmowego w postaci biegunki.
Etiologia
Escherichia coli
duże fermy towarowe
króliki w pierwszych dwóch tygodniach życia, po odsadzeniu
rola w etiologii zespołu jelitowego
zarazek ubikwitarny, zasiedla przewód pokarmowy, symbiont
2-3 tygodniowe króliki – duża ilość E. coli w jelicie ślepym, króliki odsadzone – brak E. coli
Enteropathy
Najczęściej 6-12 tydzień życia
Objawy kliniczne
◦
Anoreksja, depresja, odwodnienie, śluzowa biegunka
Ból brzucha
◦
Ścieranie zębów
◦
Zgarbiona postawa
Żródła i drogi zakażenia
droga endogenna (autoinfekcja) – zaburzenie równowagi flory jelitowej pod wypływem czynników sprzyjających i uzjadliwienia
E. coli
nagła zmiana paszy, zła jakość, nadmierne zagęszczenie, złe warunki bytowania, choroby pasożytnicze, antybiotyki
nadmierna zawartość białka, mało włóknika – na fermach królików żywionych zielonką
osseski zakażają samice śródmacicznie, przez pępowinę, z mlekiem
bezpośredni kontakt ze zwierzętami chorymi
zanieczyszczona pasza, woda, ściółka, klatki
per os
Patogeneza
EPEC – adhezja do nabłonka kosmków jelitowych, złuszczanie nabłonka i zanik kosmków
AEEC – ekspresja białek adhezyjnych intyminy, bfp, fimbrii, adhezja bakterii do enterocytów oraz stymulacja innych białek? ….
Akumulacja aktyny uszkadzająca enterocyty
EHEC – wytwarzanie enterohemolizyn oraz verotoksyn (toksyna Shiga) wywołując krwotoczne zapalenie jelita biodrowego, ślepego i
okrężnicy
Zespół krwotoczno-mocznicowy (HUS)
-
mikroangiopatyczna anemia hemolityczna
-
trombocytopenia
-
mikroangiopatyczna zakrzepica kanalików nerkowych
Objawy kliniczne
okres inkubacji 7-14 dni
króliki 4-6 tygodniowe, 1-2 tygodniowe oseski
postać jelitowa nowo narodzonych królików – posocznica
króliki ssące – biegunka o żółtym zabarwieniu, osowiałość, niechęć do ruchu, ssania, nastroszony włos, wysuszone błony
śluzowe
króliki odsadzone – silna wodnista biegunka, brak łaknienia, odwodnienie, spadek masy ciała, zahamowanie rozwoju
Zmiany anatomopatologiczne
postać posocznicowa u noworodków – ropnie w wątrobie
zanieczyszczenia okolicy odbytu żółtawym kałem
nadmierne wypełnienie żołądka niestrawionym mlekiem, skąpej ilości rozwodnionej żółtobrązowej treści w jelitach
wychudzenie i odwodnienie zwłok

83
jelita ślepe, grube – wodnista, cuchnąca, jasnobrązowa – krwista treść, ściana ścieńczała i pogrubiona
nieżytowe zapalenie błony śluzowej
obrzęk błony śluzowej, naloty dyfteroidalno – martwicowe
wybroczyny podłużne na błonie śluzowej jelita ślepego
wgłobienie jelit, wypadnięcie prostnicy
węzły chłonne krezkowe obrzękłe, przekrwione, soczyste
hiperplazja komórek kubkowych bez zmian zapalnych
Rozpoznanie
objawy kliniczne, zmiany sekcyjne
badania bakteriologiczne – kał, wymazy z odbytu, wycinki narządów miąższowych, podwiązane odcinki dwunastnicy, jelita
grubego, węzły chłonne krezkowe
izolacja E. coli i ocena obecności fimbrii i toksyn
posiew na MacConkey, Levin, SF, Eijkman
API 20E
aglutynacja szkiełkowa lub probówkowa, lateksowa, testy serologiczne koagulacji, ELISA
próba biologiczna
PCR
Rozpoznianie różnicowe
ostra forma kokcydiozy jelitowej
Clostridium sp.
salmoneloza
zespół jelitowy
choroba Tyzzera
zatrucia alimentarne
skarmianie nadpsutej paszy, nagła jej zmiana
Postępowanie
usunąć czynniki ryzyka u osesków
antybiotyki per os
poprawić warunki zoohigieniczne u królików odsadzonych, zabezpieczyć zwierzęta
enrofloksacyna, flumechina
odpowiednie żywienie matek i królicząt
sanityzacja, dezynfekcja
autoszczepionki – samicom przed kryciem
Zespół jelitowy
enteritis complex
Enteropatia śluzowata (mucoid entheropathy) występująca u królików w okresie odsadzania.
Etiologia
wieloczynnikowy
E. coli, Clostridium spiriforme, Eimeria sp., Haemophilus paracuniculus, toksyny bakteryjne, błędy żywieniowe
operacyjne podwiązanie jelita ślepego
nieregularne karmienie, nadmierna podaż białka i węglowodanów z niską ilością włóknika
niskie pH treści jelita ślepego
wtórna dysbakterioza
stres – odsadzenie, zagęszczenie
Patogeneza
nie poznana
skarmianie paszą wysokoenergetyczną osłabia motorykę jelita ślepego
zaleganie treści jelitowej
obniżenie pH w wyniku nadprodukcji i absorpcji lotnych kwasów tłuszczowych lub fermentacji węglowodanów
wzrost poziomu adrenaliny
nadmierna produkcja śluzu przez komórki kubkowe jelita cienkiego i grubego
zaburzenie antybiozy przewodu pokarmowego
uzjadliwienie i namnożenie drobnoustrojów
Objawy kliniczne
chorują zwierzęta w wieku 5-20 tygodni, wrażliwe w wieku 7-10 tygodni
apatia, brak apetytu, zwiększone pragnienie, normalna temperatura ciała, biegunka
odwodnienie, obrzęk gałek ocznych, zgrzytanie zębami, silna bolesność, powiększenie powłok brzusznych, spadek masy ciała
biegunka na przemian z obstrukcją
powstanie czopów śluzowych – zatkanie okrężnicy
Zmizny anatomopatologiczne
żołądek wypełniony treścią z pęcherzykami gazu
jelito czcze z obecnością wodnistego płynu
jelito ślepe wypełnione wysuszoną masą

84
w okrężnicy nadmierna ilość śluzu o galaretowatej konsystencji
rozrost komórek kubkowych błony śluzowej dwunastnicy, jelita czczego, biodrowego, okrężnicy
nieznaczny naciek komórek zapalnych
krypty jelitowe i błona śluzowa okrężnicy nabrzmiałe, pokryte śluzem
pojedyncze ogniska martwicy w nabłonku pęcherzyka żółciowego
Rozpoznanie
objawy kliniczne
badanie anatomopatologiczne
przyżyciowo duża ilość śluzu w kale
w okrężnicy obecność śluzu
rozrost komórek kubkowych jelita
Rozpozanie różnicowe
kokcydioza
Clostridium sp.
trichobezoary
Postępowanie
odstawić skarmianą paszę
dieta ze zwiększoną ilością włókna: 20-25% włókna, 15% białka, 2-3% tłuszczu
siano
PWE, glukoza
metoklopramid
tetracykliny, sulfonamidy potencjalizowane
ograniczenie stresu, unikać zmiany karmy, bilansować dawkę pokarmową
stosowanie probiotyków
Rozrostowe zapalenie jelit
proliferative enteropathy
Ileitis – zapalenie jelita biodrowego, jest to choroba przebiegająca z zaburzeniami ze strony układu pokarmowego będące skutkiem
rozrostu błony śluzowej jelit.
Etiologia
G- Lawsonia intracellularis – bakteria wewnątrzkomórkowa
izolowana z enteropatogennymi szczepami E. coli
świnie, chomiki, myszy, szczury, świnki morskie, owce, cielęta, konie, psy, koty, lisy polarne, jelenie, fretki, strusie, małpy
dotyczy wszystkich grup wiekowych
najbardziej wrażliwe króliki po odsadzeniu
Patogeneza
w jelitach cienkich umiejscawia się w komórkach nabłonkowych krypt jelitowych końcowego odcinka jelit cienkich, jelita
ślepego, okrężnicy
adhezyny – przyczepia się do enterocytów i po 3 godzinach przenika do cytoplazmy
substancja mitogenna powoduje rozrost i zapalenie błony śluzowej jelit
komórkowe i humoralne mechanizmy odpowiedzi immunologicznej
IFN-γ uwalniany przez Th1
Źródła i drogi zakażenia
pierwotnym źródłem zakażenia są chore króliki oraz bezobjawowi nosiciele
wydalanie zarazka z kałem
szerzy się przez kontakt bezpośredni, za pośrednictwem paszy, wody
gryzonie, ptaki
zakażenie drogą pokarmową
oseski zakażają się ssąc mleko matki
Objawy kliniczne
okres inkubacji 10-14 dni
czynniki usposabiające: stres, złe warunki zoohigieniczne, zmiana karmy, zagęszczenie
zakażenia E. coli, Eimeria sp.
zakażenia subkliniczne, bezobjawowe, sporadycznie postać ostra
osłabienie, wodnista biegunka, odwodnienie
choroba trwa około 1-2 tygodni
zakażenia mieszane – nagłe padnięcia
zakażenia subkliniczne – wodnista biegunka, zahamowanie przyrostów, obecność osobników charłaczych
Zmiany anatomopatologiczne
wychudzenie, odwodnienie
okrężnica, jelito ślepe, prostnica: półpłynny kał z dużą zawartością śluzu
postać nadżerkowa (wrzodziejąca): w śluzówce jelit wybroczyny i owrzodzenia oraz ogniskowy lub odcinkowy zanik
enterocytów z naciekiem komórek wielojądrzastych

85
postać rozrostowa (proliferacyjna): ściana jelit zgrubiała, poprzecznie pofałdowana, powierzchnia pokryta włóknikowo-
martwicowymi błonami koloru żółtego lub jasnobrązowego, polipowate twory
rozrostowe zapalenie jelit: wieloogniskowy lub rozlany przerost enterocytów oraz nabłonka błony śluzowej krypt jelitowych
infiltracja histiocytów, makrofagów, limfocytów, komórek plazmatycznych, heterofilów, WKO
drobnoustroje w cytoplazmie
Rozpoznanie
objawy kliniczne, zmiany sekcyjne
próbki kału, zmienione chorobowo odcinki jelit
barwienie solami srebra, HE, WS
immunohistochemia
mikroskopia elektronowa, PCR
Rozpoznanie różnicowe
-
rotawiroza i koronawiroza
-
salmoneloza
-
zespół jelitowy
-
kolibakterioza
-
enterotoksemia
-
kokcydioza
Salmoneloza
salmonellosis
Zakaźna i zaraźliwa choroba posocznicowa królików. Zoonoza.
Etiologia
G- Salmonella (46 grup serologicznych)
serowary A,B,C,D,E
Salmoenella enterica subsp. Enterica serowar Choleresuis, Enteritidis, Dublin, Typhimurium rzadko serowar Derby, Anatum,
Gallinarum-pullorum
wrażliwe na inaktywację cieplną giną w 50-60°C po 20 minutach, 100ºC kilka minut, promienie słoneczne
preparaty chlorowe, fenolowe, jodowe, alkohole
oporne na zamrażanie, wysychanie, pH 4,0-8,7
w nawozie, glebie, zwłokach żyją wiele miesięcy – lat
Źródła i drogi zakażenia
zwierzęta chore i ozdrowieńcy
nosiciele wydalają zarazek z kałem – choroba rozwija się jako autoinfekcja
droga łańcuchowo-kontaktowa poprzez wtórne źródła zakażenia
karma, woda, ściółka, sprzęt fermowy
zakażenie drogą pokarmową
drób, gołębie, myszy, szczury
samice ciężarne: uczynnienie zakażenia utajonego, ronienia, rodzenie martwych płodów, zejścia śmiertelne noworodków
Patogeneza
adhezja do komórek nabłonka jelita oraz penetracja w głąb błony śluzowej jelit
LPS – oddziaływanie na układ odpornościowy
rozległe stany zapalne błony śluzowej
przejście do naczyń chłonnych i krwionośnych – posocznica
bezobjawowe zasiedlenie błony śluzowej przewodu pokarmowego, węzłów chłonnych krezkowych, pęcherzyka żółciowego,
jajników – zakażenie utajone
endotoksyna: zapalenie i dysfunkcja narządów wewnętrznych
działanie inwazyjne bakterii, zaburzenia troficzne, zaburzenia immunologiczne
Objawy kliniczne
sezonowość (letnio-jesienny), młode króliki, ciężarne samice
autoinfekcja lub masowe zachorowania przez spożycie karmy
spadek apetytu, osłabienie, wzrost temperatury ciała, biegunka
przebieg nadostry (posocznica) – nagłe padnięcia bez objawów klinicznych
postać ostra – wodnista biegunka
ronienia, rodzenie martwych płodów
Zmiany anatomopatologiczne
wychudzenie, odwodnienie
błony śluzowe, surowicze, tkanka podskórna – zażółcona
punkcikowate wybroczyny na błonach śluzowych, pod błonami surowiczymi
postać ostra – nieżytowe zapalenie błony śluzowej żołądka i jelit
ogniska martwicy w wątrobie, śledzionie, nerkach
węzły chłonne krezkowe powiększone, przekrwione, soczyste
wątroba miękka, barwy gliniastożółtej z ogniskami martwicy
śledziona obrzękła, ciemnoczerwona, wybroczyny

86
nerki powiększone, szaroczerwone, punkcikowate wybroczyny
błona śluzowa macicy zgrubiała, szorstka pokryta włóknikiem
Rozpoznanie
wywiad epidemiologiczny, objawy kliniczne, zmiany sekcyjne
badania serologiczne – aglutynacja probówkowa, mikroaglutynacja, test mikroantyglobulinowy, ELISA
badania bakteriologiczne – narządy wewnętrzne, śledziona, wątroba, płuca, nerki, węzły chłonne, jelita, porobione płody
MacConkey, MSRV, z zielenią brylantową
API 20E, ID 32E
surowice mono- i poliwalentne
Rozpoznanie różnicowe
rotawirusy
koronawirusy
kolibakterioza
listerioza
pasterelloza
streptokokoza
Postępowanie
likwidacja żródeł zakażenia, ogniska choroby, dewastacja zarazka
eliminacja zwierząt chorych i ozdrowieńców
enrofloksacyna, sulfonamidy potencjalizowane trimetoprimem
preparaty furanowe, surowica odpornościowa
właściwe żywienie, warunki zoohigieniczne i sanitarne
autoszczepionki
izolacja ferm wolnych, dezynfekcja fermy, klatek, wykotników, poideł, deratyzacja
serologiczne badania przesiewowe
Pastereloza
pasteurellosis cuniculorum
Zakaźna i zaraźliwa choroba królików domowych i dziko żyjących oraz zajęcy.
Etiologia
G- Pasteurella multocida
5 serotypó zarazka (A, B, D, E, F) najczęściej typ A, rzadziej D
serotyp A jest komensalem górnych dróg oddechowych
ma słabe właściwości immunogenne – homologia pomiędzy kwasem hialuronowym otoczki bakteryjnej a komórką
makroorganizmu
serotyp D jest podatny na fagocytozę ale oporny na wewnątrzkomórkowe zabijanie
szczepy te wytwarzają dermonekrotoksynę PMT – Pasteurella multocida heat-labile toxin
grupy serologiczne – serowary 12 i 3
szczepy A:12 „snuffles”, A:3, D:3 dolne drogi oddechowe
średnio oporne na czynniki środowiskowe
0,2% formalina, 0,5% fenol, 1% mleko wapienne, chloramina
Epidemiologia
duże straty ekonomiczne w małych i dużych fermach 20-90%
pojawia się nagle i przebiega w postaci enzootii
bytuje jako komensal błon śluzowych jamy nosowej, gardła, tchawicy, pochwy, jamie bębenkowej ucha środkowego
30-90% królików jest nosicielami
u królików izoluje się czasami Pasteurella pneumotropica – niepatogenna, bezobjawowe zakażenia
Patogeneza
kolonizacja nabłonka gardła i rozprzestrzenianie się do jamy nosowej i dolnych dróg oddechowych
z ucha środkowego poprzez układ limfatyczny przenosi się do ucha wewnętrznego
spadek odporności – krew – posocznica, narządy wewnętrzne
mechanizm działania chorobotwórczego:
-
adhezja do komórek nabłonka – fimbrie, inwazja w głąb tkanek
-
produkcja egzo- i endotoksyn
-
oporność na fagocytozę neutrofili, komplement
-
dermonekrotoksyna zaburza osteogenezę kości w obrębie zrębu kostnego małżowin nosowych (zanik i deformacja małżowin)
-
włóknikowo-ropne zapalenie opłucnej, płuc, worka osierdziowego
-
martwica wątroby i zanik tkanki limfoidalnej śledziony
Źródła i drogi zakażania
zakażenie autogenne – autoinfekcja – spadek odporności organizmu
stres: ciąża, laktacja, transport, współistniejące choroby, inwazje pasożytnicze, niewłaściwe żywienie, złe warunki bytowania
chore zwierzęta wydalają zarazek z moczem, kałem, śliną, wydzieliną z nosa, dróg rodnych
zakażenie drogą aerogenną, pokarmową, przez uszkodzone błony śluzowe
źródłem zakażenia dla osesków są królice wydalające zarazek z mlekiem i wydzieliną z nosa

87
wtórne źródło zakażenia – woda, karma (zakażenia endogenne)
zachorowalność ponad 70%
jedna z najbardziej pospolitszych, najczęstszych chorób królików
zakażenie poziome i pionowe
Objawy kliniczne
W formie pierwotnej wikłana przez Pseudomonas aeuroginosa oraz formie wtórnej w przebiegu infekcji wirusem parainfluenzy-3 i
mykoplazmy.
Oseski – postać nadostra lub ostra posocznica
-
okres inkubacji 12 godzin
-
szybki przebieg 12-18 godzin
-
bez objawów klinicznych
-
śmiertelność 90%
Króliki 8-22 tygodni
-
okres inkubacji ponad 14 dni
-
posocznica
-
przewlekłe nieżytowe zapalenie nosa i zatok – snuffles
-
ropnie w tkance podskórnej
-
ropne zapalenie ucha środkowego i wewnętrznego
-
ropne zapalenie mózgu
-
enzootyczne zapalenie płuc
-
infekcje układu rozrodczego i gruczołu sutkowego
-
ropne zapalenie otrzewnej i worka osierdziowego
Conjunctivitis
Pasteurella multocida
Snuffles” - katar
◦
Surowiczy do śluzowo – ropnego wypływu z nosa
◦
Conjunctivitis – zapalenie spojówek
klinicznie infekcja objawia się okresowym śluzowo – ropnym wypływem z nozdrzy
infekcje przetrwałe
Objawy kliniczne
Postać ostra
wzrost temperatury do 41-42ºC
osłabienie, brak łaknienia, zahamowanie wzrostu
nieżyt błony śluzowej nosa – wodnisty wyciek, kichanie
wyciek śluzowo-ropny, ropny, kaszel
ropne zapalenie błony śluzowej górnych dróg oddechowych – dobre warunki chowu
włóknikowo – krwotoczne odoskrzelowe zapalenie płuc, kaszel, kichanie, duszność
ostre nieżytowe lub ropne zapalenie błony śluzowej macicy – surowiczy, śluzowy, śluzowo – ropny wypływ
zapalenie jąder i najądrzy
ronienia
Postać przewlekła
matowy, nastroszony włos
silne wycieńczenie, szybkie chudnięcie
ropne zapalenie nosa i zatok
zapalenie gałki ocznej
biegunka
włóknikowe odoskrzelowe zapalenie płuc i opłucnej
zapalenie osierdzia
wysięk w worku osierdziowym i jamie klatki piersiowej
zapalenie ucha środkowego i wewnętrznego – żółtoszary wypływ w przewodzie słuchowym, kręcz szyi
ropnie w tkance podskórnej i mięśniach
SEPSA może być rezultatem ropni zlokalizowanych w wielu narządach
“Wry neck” = Torticollis
◦
zapalenie przewodu słuchowego zewnętrznego, ucha środkowego, wewnętrznego
◦
Vestibular signs – objawy ze strony układu przedsionkowego
Bronchopneumonia
◦
włóknikowo ropne zapalenie opłucnej i płuc oraz tchawicy
Zmiany anatomopatologiczne
Postać posocznicowa
silna wybroczynowość na błonach śluzowych i surowiczych, narządach wewnętrznych
nieżytowe lub ropne zapalenie błony śluzowej nosa i zatok – obrzęk, punkcikowate owrzodzenia
płuca powiększone, obrzękłe, przekrwione, pokryte włóknikiem
wybroczyny, krupowe zapalenie płuc

88
w tchawicy, jamie klatki piersiowej – krwisty płyn
Postać przewlekła
ropne zapalenie tchawicy
surowiczo-włóknikowe lub włóknikowo-ropne odoskrzelowe zapalenie płuc, opłucnej i osierdzia
prosówkowate ogniska martwicy i ziarniniaki w wątrobie
charłactwo
ropnie w tkance podskórnej, mięśniach, płucach, jądrach, macicy, mózgu, uchu środkowym, sercu
macica powiększona, wypełniona surowiczym wysiękiem, białą wydzieliną – ropne zapalenie
owrzodzenia na endometrium
ropne zapalenie jąder i najądrzy
Zmiany histopatologiczne
martwica pęcherzyków płucnych
obrzęk tkanki międzyzrazikowej
złuszczanie się nabłonka oskrzelowego
infiltracja limfocytów, komórek olbrzymich w pęcherzykach płucnych
ropne zapalenie mózgu i rdzenia
zakrzepy w małych naczyniach krwionośnych
ogniskowe zwyrodnienie hepatocytów i komórek nadnerczy
zanik małżowin nosowych
Rozpoznanie
objawy kliniczne i zmiany sekcyjne
izolacja zarazka z narządów wewnętrznych, węzłów chłonnych, krwi
określenie serotypu i zdolności wytwarzania toksyn
ropa i wydzielina ropna, wymazy z nosa, aspiraty z oskrzeli, krew, wycinki narządów wewnętrznych (płuc, śledziony, wątroby,
nerek, węzłów chłonnych)
rozmazy i preparaty odciskowe – barwienie (Grama, błękit metylenowy, Giemsy)
hodowla – agar krwawy, MacConkey
próba biologiczna, hodowle tkankowe
ELISA, hemaglutynacja pośrednia, precypitacja w żelu agarowym
sondy genowe
Rozpoznanie różnicowe
gruźlica
zakaźne zapalenie nosa
aspergiloza
toksoplazmoza
listerioza
mykosomatoza
Bordetella bronchiseptica, Chlamydia sp.
Staphylococcus aureus, Pseudomonas aeruginosa
Klebsiella pneumoniae
Diagnoza
wstępna: objawy kliniczne
ostateczna: izolacja patogenu i identyfikacja
Leczenie
Enrofloxacin (Baytril) 5 mg/kg s.c. przez10 days
Ustępują objawy kliniczne
Nie likwiduje infekcji
Chirurgiczne opracowanie ropni
Postępowanie
surowica odpornościowa
i.m. 3-5 dni tetracykliny, potencjalizowane sulfonamidy
usunięcie chorych królików
poprawa warunków zoohigienicznych
dezynfekcja
kwarantanna
Cunipastivac E – u królików powyżej 7 tygodnia życia, s.c. 1 ml na zwierzę powyżej 1 kg, 0,5 ml na zwierzę mniejszej wagi,
powtórzyć po 2-3 tygodniach – nie likwiduje nosicielstwa, nie chroni przed postacią chroniczną
autoszczepionka – po odsadzeniu, powtórzyć 3-4 tygodnie później
Choroba Tyzzera
Tyzzer disease
Choroba bakteryjna występująca u różnych gatunków zwierząt, głównie zwierząt laboratoryjnych oraz królików ras mięsnych.
Etiologia
Clostridium piliforme

89
obligatoryjny patogen wewnątrzkomórkowy
hodowla wyłącznie na tkankach lub embrionach kurzych
oporna na czynniki środowiskowe, spory żyją w glebie 1-2 lata
1% kwas nadoctowy, 0,3% podchloryn sodu
myszy 1917 rok, koty, psy, szczury, chomiki, świnki morskie, króliki, naczelne
Źródła i drogi zakażenia
zwierzęta chore wydalające zarazek wraz z kałem
zakażenie drogą pokarmową
zakażenie drogą śródmaciczną
zakażone zwierzęta wydalają zarazek przez 1-2 tygodnie
Patogeneza
bakterie kolonizują przewód pokarmowy – jelito cienkie i ślepe
żyłą wrotną przedostają się do wątroby
bakteriemia – rozprzestrzenienie się na narządy wewnętrzne głównie serce
C. piliforme produkuje toksyny o działaniu letalnym
Rozpoznanie różnicowe
choroby przewodu pokarmowego o etiologii bakteryjnej, wirusowej, pasożytniczej
Objawy kliniczne
zwierzęta w wieku 6-12 tygodni
zachorowalność 50%, śmiertelność 100%
endemicznie – zakażenia subkliniczne
osłabienie, brak apetytu
obfita, wodnista biegunka
odwodnienie, wyniszczenie organizmu, śmierć w ciągu 1-2 dni
forma przewlekła – okresowa biegunka, chudnięcie, prowadzące do charłactwa i zejścia śmiertelnego
Zmiany anatomopatologiczne
silne odwodnienie
obrzęk i ścieńczenie ściany jelita ślepego, końcowego odcinka jelita biodrowego i bliższego okrężnicy
błona śluzowa jest szorstka, ziarnista, pokryta licznymi ogniskami nekrotycznymi
w błonie śluzowej jelita ślepego wybroczyny
światło jelit wypełnione jest wodnistą, brązową treścią
w pozostałych odcinkach jelit – liczne wybroczyny, ogniska nekrotyczne pokryte włóknikiem
patognomiczne – wieloogniskowe martwicowe zapalenie wątroby (bladoszare, czerwone ogniska nekrotyczne, 2-3 mm)
zapalenie mięśnia sercowego
w worku osierdziowym szare lub brązowe ogniska zwyrodnieniowe w postaci smug
postać przewlekła – zwężenie jelita biodrowego
Zmiany histopatologiczne
laseczki w enterocytach i błonie mięśniowej jelit, ogniska nekrotyczne, wybroczyny
ogniska martwicowe w wątrobie, bakterie w hepatocytach
nacieki komórkowe w mięśniu sercowym, obecność laseczek bakterii we włóknach mięśniowych
Rozpoznanie
objawy kliniczne, zmiany sekcyjne
badanie bakteriologiczne, serologiczne
PCR
tkanka wątrobowa, odcinki jelit – biodrowego
barwienie metodą Giemsy, nasycenie solami srebra – wewnątrzkomórkowo laseczki
ELISA, Western blot
Postępowanie
eutanazja zwierząt chorych
tetracyklina i oksytetracyklina, sulfonamidy
brak likwidacji infekcji
polepszyć warunki bytowe zwierząt – unikać sytuacji stresowych spowodowanych nadmiernym zagęszczeniem
Urazowe złamania rdzenia i dyslokacje
Silne mięśnie w przeciwieństwie do wyrażeni kruchego szkieletu
L7 najczęstsze zmiany
Całkowity paraliż funkcji motorycznych, utrata napięcia mięśni zwieracza odbytu
◦
leczenie bezskuteczne - eutanazja
Przypadki z nieznacznym paraliżem i porażeniem części mięśni
utrzymanie w ciasnym pomieszczeniu – ograniczanie ruchu
Kortykosterydy
pomoc i kontrola opróżniania pęcherza moczowego
Sączące Dermatitis

90
Przewlekłe zmiany sączące
◦
problem z zębami, złe utrzymanie
Objawy kliniczne
◦
zapalenie, wyłysienia, martwica
Niebieskie futro = “Blue Belly”
◦
Pseudomonas aeruginosa
Wrzodziejące Pododermatitis
Drażliwy staw skokowy
Powierzchnia podeszwy lub śródstopia (nstaw skokowy?)
◦
Ciśnienie stymulujące proces martwicy
◦
Kanciaste podłoże, złe warunki chowu, otłuszczenie, truchtanie
Leczenie
◦
Lite, czyste podłoże, miejscowo antybiotyki i środki antyseptyczne
Uterine Adenocarcinoma
Najczęstsze zmiany nowotworowe
◦
występowanie może osiągnąć 60% w chowie u samic ponad 5 lat
◦
powyżej 3 lat, wystepowanie około 4%
◦
choroba rozwija się w ciągu
5-20 miesięcy
◦
odległe przerzuty
Liczne guzy
Wczesne objawy
zmniejszenie reprodukcji
krwiste wypływy z pochwy
przerost gruczołu mlekowego
Diagnoza
omacywanie
Histopatologia
zróżnicowanie komórek gruczołowych w kształcie grona
rozrost podścieliska
ogniska nekrozy
Kamica moczowa
Etiologia
◦
dieta, infekcje (często)
Nienaturalny metabolizm Ca
◦
frakcja w moczu, poziom wydalania
Ssaki = 2%, króliki = 45-60%
◦
poziom w diecie – poziom w moczu
Objawy kliniczne
◦
anoreksja, utrata wagi, depresja, ból podczas oddawania moczu, anuria, dysuria
Diagnoza
◦
omacywanie, RTG, badanie moczu
Leczenie
◦
modyfikacja diety, płukanie pęcherza moczowego, cytostomia
Buphthalmia = “Blue Eye” lub glaucoma
Wada wrodzona, genetyka
◦
autosomalna recesywna
Przednia komora oka
◦
nienaturalnie wodnista ciecz; produkcja& powrót
Objawy
◦
wzrost wymiaru komory oka
◦
mętna rogówka
Różny początek
◦
zwykle 3-4 miesiące
◦
może wystąpić w 2-3 tygodniu życia
Postępuje
◦
wzrasta nieprzeźroczystość

91
◦
wrzodzenie, przerwanie, bliznowacenie
Nie ma dowodów bólu
◦
olbrzymie oko podczas okrywania niedojrzałą twardówką
Najczęściej u królików Nowozelandzkich białych
Stosowana jako model ludzkiej jaskry
Splay Leg - rozkroczność
Niemożność przywodzenia jednej lub większej ilości kończyn
Zwykle obserwowana około 4 miesiąca życia
Postępuje, ze złą prognozą
RTG – dysgeneza główek kości udowej
Mastitis
Zapalenie tkanki gruczołu mlecznego także zwane ciastowatym biustem
◦
powoduje choroby u młodych królicząt
◦
młode mogą być gryzione kiedy próbują ssać mleko, i karmiące matki porzucają młode – padają z głodu
Postępowanie poprzez usunięcie koncentratu z diety na 72 godziny
Kiedy przypadki choroby się rozprzestrzeniają, wyczyścić i zdezynfekować boksy porodowe
Mastitis = “Blue breast”
Występuje w laktacji lub w ciąży rzekomej
Spuchnięte, twarde, gorące, przebarwiony gruczoł
Temperatura i anoreksja
Leczenie
◦
antybiotyki
◦
przesadzenie młodych
Treponematosis
króliczy Syphilis, „choroba wentylacyjna
Treponema cunciculi
Choroba weneryczna, samice zakażają młode
Uszkodzenia
◦
Mokry, skorupiasty wypływ wywołujący owrzodzenia skóry & błon śluzowych
◦
Napletek, pochwa, odbyt, wargi, nos,powieki
Diagnoza
◦
mikroskopia ciemnego pola widzenia
◦
uwidocznione spirochety
Leczenie
◦
benzathine/procaine penicillin
◦
3 injekcje co 7 dni
◦
konieczność leczenia wszystkich królików
Rabbit Calicivirus Infection
Viral Hemorrhagic Disease, Viral Necrotizing Hepatitis
Wysoka zapadalność/śmiertelność
◦
95-100%, zwykle dorosłe
◦
tylko Oryctolagus wrażliwe
◦
występowanie
China (1984)
Europe (1985)
Mexico (1988-92)
Cuba (1993)
Australia (1995)
USA (2000)
Rozprzestrzenia się przez kontakt bezpośredni, wymioty, aerozol, robaki, produkty dla królików
Inkubacja 2-3 dni
Formy kliniczne
◦
śmierć bez objawów klinicznych
◦
forma ostra, bolesne oddychanie, śmierć
◦
krwisty wypływ z nosa, opisthotonus, piszczenien. Śmierć w ciągu 6-24 godzin od wystąpienia objawów

92
Choroba podlegajaca zgłaszaniu, kwarantanna i niszczenie
Szczepionki – nielegalne w USA
Przekrwienie płuc, obrzęk i wybroczynowość
DIC
Wybroczyny w narządach miąższowych
Rozległa martwica wątroby
Wewnątrzkomórkowe wtręty w wątrobie, śledzionie, nerkach
Wybrane choroby zakaźne lisów i norek hodowlanych.
Nosówka mięsożernych zwierząt futerkowych
febris catarrhalis
contagiosa et nervosa vulpium et mustelarium, dis temper
Występuje najczęściej u lisów i norek i jest jedną z najbardziej niebezpiecznych zaraźliwych chorób, wyrządzających duże straty we
wszystkich krajach o rozwiniętej hodowli.
Epidemiologia
Epizoocie nosówki lisów i norek - koniec lat 50 i 70
Epidemie 2005-2007, 2008
1980/90 - u dużych kotów (lwów, lampartów, tygrysów, jaguarów) oraz hien i szakali w parkach przyrody w Stanach
Zjednoczonych i Tanzanii (szopy i psy domowe)
Foki pospolite w 1988 r. u wybrzeży Danii, Szwecji i Irlandii, foki bajkalskie w jeziorze Bajkał
Istnieją przypuszczenia, że w zawiązku z możliwością częstego występowania zakażenia bezobjawowego u foki szarej, gatunek
ten może stanowić w basenie Morza Bałtyckiego rezerwuar zarazka dla bardziej wrażliwej na infekcję, żyjącej na tych samych
terenach, foki pospolitej
Przyczyny i źródła zakażenia
wirus z rodziny Paramyxoviridae, rodzaju Morbillivirus, który antygenowo jest blisko spokrewniony z wirusem odry u ludzi,
pomoru bydła i małych przeżuwaczy, wirusem nosówki fok oraz morbilliwirusem waleni i koni
powinowactwo do układu limfatycznego; uszkadzając tkankę limfatyczną powoduje wyczerpanie węzłów chłonnych (depletion)
i zanik grasicy, co w konsekwencji prowadzi do limfopenii i immunosupresji, wtórnych zakażeń i nierzadko szybkiej śmierci
zwierzęcia
jeden serotyp, wykazujący różne właściwości biologiczne, poszczególne izolaty jednakowo reagują ze swoistymi
przeciwciałami monoklonalnymi
zakażenie drogą aerogenną i alimentarną w wyniku bezpośredniego kontaktu z chorym zwierzęciem lub pośrednio poprzez różne
przedmioty (odzież ochronna, klatki, narzędzia pracy) oraz personel obsługujący zwierzęta
Patogeneza
po wniknięciu wirusa do organizmu dochodzi do jego replikacji w migdałkach i węzłach chłonnych śródpiersiowych oraz
makrofagach płucnych
po kilku dniach od zakażenia wirus wraz z krwią (wiremia pierwotna) przedostaje się najczęściej do: śledziony, grasicy, węzłów
chłonnych szyjnych i krezkowych, blaszki właściwej żołądka i jelit, szpiku kostnego i wątroby (namnaża się obficie w
komórkach gwiaździstych wątroby)
następnie po kilku dniach ponownie przenika do krwi (wiremia wtórna) i rozprzestrzenia wraz z zakażonymi limfocytami,
monocytami i płytkami krwi do płuc, pęcherza moczowego oraz mózgu
w okresie wiremii obserwuje się wyraźny wzrost ciepłoty wewnętrznej ciała (do 42°C u norek i około 41,5°C u lisów)
w mózgu wirus namnaża się głównie w astrocytach substancji białej, doprowadzając do rozwoju nieropnego zapalenia mózgu i
rdzenia (encephalomyelitis)
wirus w dużej ilości jest wydalany do środowiska zewnętrznego z moczem, kałem, wypływem z nosa i oczu, a przy zranieniach z
krwią
ozdrowieńcy wydalają zarazek głównie z moczem, nawet do 120 dni i stanowią niebezpieczne źródło zakażenia
wirus w formie niekompletnej może przebywać latami w mózgu i oku (błona naczyniowa) psów i lisów, wywołując u nich
często zaburzenia neurologiczne i padaczkę
Przebieg choroby
dynamika przebiegu nosówki u mięsożernych zwierząt futerkowych zależy od stopnia zjadliwości zarazka oraz stopnia
wrażliwości, jak też odporności zwierząt oraz żywienia i warunków chowu zwierząt
najbardziej wrażliwe są osobniki młode, pochodzące od nieszczepionych matek, bądź z chwilą zaniku odporności biernej, co u
większości zwierząt ma miejsce w wieku ok. 10. tygodnia życia
w dużych skupiskach zwierząt u poszczególnych osobników przebieg choroby może być podostry, ostry lub przewlekły,
manifestujący się często nietypowymi, o różnym nasileniu objawami klinicznymi
obserwuje się pojedyncze zachorowania zwierząt w poszczególnych klatkach, niekiedy w różnych miejscach na fermie
szczenięta pochodzące od nieuodpornionych matek mogą chorować nawet w wieku 3-5 tygodni. Wówczas mogą mieć miejsce
pojedyncze padnięcia bez widocznych dla hodowcy objawów choroby

93
przy zakażeniach mieszanych najpierw występuje ostra biegunka, zaburzenia neurologiczne ze strony centralnego układu
nerwowego (salmonelloza, toksoplazmoza), a dopiero później charakterystyczne objawy dla nosówki, jak: wypływ śluzowo-
ropny z worka spojówkowego i nosa, kaszel, drgawki kloniczno-toniczne, zmniejszony lub brak apetytu i osowienie
okres wylęgania się nosówki, który u lisów może wynosić od 4 do 30 dni, u norek i tchórzofretek od kilkunastu dni, nawet do
6 miesięcy, natomiast u dużych kotów od kilku dni do miesiąca, zaś u ssaków morskich najczęściej 10-14 dni
Objawy kliniczne
utrata apetytu, często biegunka, zmniejszona aktywność ruchowa, osowiałość (zwierzęta najchętniej leżą zwinięte w kłębek) oraz
obrzęk i zapalenie spojówek (conjunctivitisis)
w miarę rozwoju choroby występuje okresowy wzrost ciepłoty wewnętrznej ciała (40-41°C), z worka spojówkowego, a często i
z nosa, obserwuje się wypływ śluzowo-ropnej wydzieliny
nasilenie objawów zaburzeń żołądkowo-jelitowych
suchy kaszel, duszność oraz zaburzenia ze strony centralnego układu nerwowego. Występuje nadmierna pobudliwość, u lisów
tiki nerwowe kończyn, skurcze toniczno-kliniczne kończyn i szczęk, połączone ze ślinotokiem, niezborność ruchowa, porażenia
kończyn miednicznych, a przed agonią lub w czasie jej trwania przeraźliwe piski, szczególnie charakterystyczne u norek
u ciężarnych samic mogą występować ronienia
generalnie najcięższy przebieg choroby występuje u zwierząt nieszczepionych lub niedostatecznie uodpornionych (pół dawki
szczepionki), zarobaczonych lub przy wtórnych zakażeniach bądź po przebytych wcześniej chorobach bakteryjnych, wirusowych
i pasożytniczych
Śluzowo-ropne zapalenie spojówek u norki.
Objawy kliniczne
u norek, rzadziej u lisów, charakterystycznym objawem jest osutka pęcherzykowa na skórze wokół oczu (okulary), pyska, po
wewnętrznej stronie ud i na poduszkach łap, które są na początku zaczerwienione, pogrubiałe i obrzęknite, a następnie pojawiają
się zmiany w postaci hiperkeratozy, przypominającej chorobę twardej łapy u psów (hard pad disease)
śmiertelność u lisów wynosi: szczenięta100%, dorosłe 70--90%, zaś u norek i tchórzofretek dorosłych 50-70%, a u młodych
nawet 100%. U norek większa śmiertelność i groźniejszy przebieg występuje u odmian barwnych niż standardów, czego nie
obserwuje się u różnych odmian lisów
różne postacie kliniczne nosówki: nieżytową, jelitową, płucną, skórną i nerwową
u norek opisana jest postać apoplektyczna, tj. nagłe zejścia śmiertelne pozornie zdrowych zwierząt, zaś u lisów, podobnie jak u
psów, występują często objawy typowe dla encephalomyelitis (nieropne zapalenie mózgu i rdzenia kręgowego)
- w wyniku replikacji wirusa w mózgu może wystąpić demielinizacja włókien nerwowych i rozwój procesów
autoimmunologicznych, m.in. objawów padaczki
Obrzęk i powiększenie oraz objawy hiperkeratozy poduszek łapek u norki w przewlekłym przebiegu nosówki
Zmiany sekcyjne
w diagnostyce sekcyjnej brak jest typowych zmian, pozwalających jednoznacznie rozpoznać nosówkę
zwłoki padłych zwierząt są wychudzone, a skóra tułowia i kończyn pokryta jest złuszczonym naskórkiem
zmiany zapalne dotyczą wszystkich narządów, jednak są mało charakterystyczne dla rozpoznania
w przewodzie pokarmowym występują różne stany zapalne błony śluzowej żołądka i jelit
węzły chłonne krezkowe są powiększone, .śledziona nieznacznie powiększona, niekiedy o cechach przerostowych. W płucach
występują ogniska nieżytowego i śródmiąższowego, a nawet krupowego zapalenia płuc stwierdzonego u padłych fok. Obserwuje
się nastrzykanie naczyń mózgowych oraz pojedyncze punkcikowate wybroczyny na powierzchni mózgu
w przypadkach powikłanych bakteriami mogą pojawić się ogniska ropnego zapalenia płuc, powiększenie śledziony oraz
krwotoczny stan zapalny błony śluzowej jelit
Rozpoznanie
klasyczne rozpoznanie opiera się na danych z wywiadu epizootycznego, objawach klinicznych i zmianach
anatomopatologicznych oraz badaniach laboratoryjnych
przyżyciowo metodą immunofluorescencji można wykryć wirusa w wymazach z nosa, worka spojówkowego, narządów
rodnych, w leukocytach krwi, zaś pośmiertnie rozmieszczonego w narządach, jak: mózg, płuca, śledziona
PCR
badaniem histopatologicznym w płucach, mózgu, nabłonku żołądka i pęcherza moczowego można wykryć charakterystyczne
ciałka wtrętowe Lentza,
śródmiąższowe i nieżytowe zapalenie płuc, nieropne zapalenie mózgu, połączone z demielinizacją włókien nerwowych,
szczególnie móżdżku, w komorach mózgu i rdzeniu kręgowym
metody bezpośredniej izolacji wirusa nie mają w praktyce większego zastosowania, bowiem są czasochłonne, a efekt
cytopatyczny pojawia się po kilku lub kilkunastu dniach
próba biologiczna - młode, nieszczepione tchórzofretki lub inne wrażliwe na nosówkę zwierzęta
Dodatni wynik próby biologicznej tchórzofretek .Około 5 dnia po zakażeniu. Zwierzęta osowiałe, objawy świat-łowstrętu i śluzowo-
ropnego wypływu z worka spojówkowego
Zwalczanie
nie należy leczyć, a poddać eutanazji
profilaktyka, tj. szczepienie w okresie zimowym zwierząt stada podstawowego oraz w lecie w wieku około 10 tygodni życia
młodych szczeniąt

94
zwalczanie nosówki u zwierząt morskich i nieudomowionych jest bardzo trudne i praktycznie nieopracowane
za bezpieczne dla zwierząt szopowatych i łaszowatych uznaje się rekombinowane szczepionki zawierające wirus ospy kanarków
na terenach endemicznego występowania wirusa nosówki zaleca się coroczne szczepienia tymi szczepionkami, z powodu braku
odpowiedniej szczepionki nie zaleca się też szczepień zwierząt kotowatych
Kotowate
wśród kotowatych wrażliwe na zakażenie są zwierzęta należące do dużych gatunków (lew, tygrys, pantera,jaguar)
u kotowatych dominują ostre objawy ze strony układu nerwowego i przewodu pokarmowego, nigdy nie stwierdzono wystąpienia
zmian skórnych na poduszkach łap
u dorosłych hien objawy chorobowe nie są specyficzne, często mogą one przechodzić podkliniczne zakażenie, przenosząc wirusa
na inne gatunki zwierząt
chorują głównie młode hieny, u których obserwuje się: zapalenie układu oddechowego, apatię, wypływ z nosa i worka
spojówkowego, obecność krwi w kale, zaburzenia w koordynacji ruchów
nieudomowione zwierzęta łasicowate (skunks, borsuk i wydra), podobnie jak należące do tej rodziny fermowe zwierzęta
futerkowe (norki i tchórzofretki), należą do najbardziej wrażliwych na zakażenie wirusem nosówki i chorują z podobnymi
objawami
Inne gatunki
u szopowatych oprócz typowych dla psowatych objawów chorobowych bardzo często obserwuje się ropne zapalenie pęcherza
moczowego (pyuria) i czasem żółtaczkę
w przypadku dominowania objawów nerwowych u szopów powinno się zawsze w diagnostyce różnicowej wykluczyć
wściekliznę
u zwierząt niedźwiedziowatych i pandowatych objawy chorobowe to: ropny wypływ z nosa i worka spojówkowego, objawy
żołądkowo-jelitowe i nerwowe
u łaszowatych wrażliwe na zakażenie są dwa gatunki: łaskun chiński i binturong. Objawy ze strony układu pokarmowego zwykle
powodują silne odwodnienie, obserwuje się objawy nerwowe i miejscowe wyłysienia
u ssaków morskich wirus wykazuje duży neuro- i pneumotropizm, dominują objawy nerwowe i oddechowe (encephalomyelitis i
pneumonia)
u zwierząt płetwonogich choroba może objawiać się: śluzowo-ropnym wypływem z nosa i worka spojówkowego, gorączką,
dusznością, kaszlem, zapaleniem rogówki, rozedmą podskórną, mogą występować ronienia
Zakaźne zapalenie mózgu i rdzenia lisów (encephalomyelitis enzootica vulpis, foxencephalitis)
Mózgówka lisów jest chorobą zakaźna i zaraźliwą, przebiegającą w postaci ostrej z objawami ze strony układu nerwowego, przebiegająca
pod postacią enzootii, wywołujac duże straty u młodych zwierząt.
Bezotoczkowy wirus rodzaju Mastadenovirus rodziny Adenoviridae
-
jeden typ antygenowy wirusa
-
ma właściwości hemaglutynacyjne wobec krwinek ludzkich i szczurzych
-
ma działanie onkogenne
-
w hodowli komórkowej po 72 godzinach wywołuje efekt cytopatyczny, pojaiwją się wewnątrzjądrowe ciałka wtrętowe
-
2% NaOH, 4% lizol, 20% wapno chlorowane
Źródła zakażenia
psy, lisy kojoty, młode wilki, koty i niedźwiedzie
naturalnym rezerwuarem na fermie są psy, u których zarazek wywołuje zakażenia bezobjawowe (50%)
pierwotnym i zasadniczym źródłem zakażenia są zwierzęta chore, ozdrowieńcy, bezobjawowi nosiciele
wirus wydalany jest od 3 dnia po zakażeniu we wszystkich wydalinach i wydzielinach, głównie w ślinie i moczu
po wyzdrowieniu wirus wydalany jest z moczem przez kilka miesięcy
zakażenie naturalne szerzy się przez kontakt bezpośredni i pośredni, drogą pokarmową i drogą krycia
zakażenie pośrednie – karma, sprzęt, personel fermy
Patogeneza
wirus po namnożeniu w miejscu wniknięcia przedostaje się drogą krwi i limfy do komórek uśś oraz komórek śródbłonka naczyń,
wątroby i układu nerwowego
uszkodzenie śródbłonka prowadzi do zwiększonej przepuszczalności naczyń i zaburzeń krążenia krwi
niedokrwienie wątroby prowadzi do jej destrukcji
wirus oddziaływując bezpośrednio na komórki prowadzi do powstania zmian cytopatycznych w postaci tworzenia
wewnątrzjądrowych ciałek wtrętowych typu B (Cowdry)
Przebieg choroby
zależy od wieku i stanu odporności zwierząt, odporność bierna utrzymuje się do 12 tygodnia życia
chorują najczęściej zwierzęta młode do 12 miesięcy, u starszych zwierząt pojawia się przy niekorzystnych warunkach
żywieniowych i środowiskowych (zakażenie bezobjawowe)
występuje u lisów w miesiącach letnich (lipiec-październik), sprzyjają temu prace hodowlane polegające na rozsadzaniu miotów,
wykonywaniu tatuaży, wymianie stada podstawowego
okres inkubacji – kilka dni, 3-6 dni
u młodych lisów ma przebieg nadostry z normalną temperaturą ciała

95
Objawy kliniczne
gwałtowne skurcze toniczno-kloniczne z wydawaniem przeraźliwych pisków
rytmiczne skurcze mięśni żuchwy, przednich i tylnych kończyn
wyciek pienistej i gęstej śliny z jamy ustnej
sztywność karku, wykręcenie szyi do tyłu i na bok
atak trwa kilka minut i powtarza się co kilka minut lub godzin
śmierć w trakcie ataku (zw. Leżą zmęczone, brak reakcji na bodźce), kilka godzin, 1-3 dniach choroby
ruchy maneżowe, silna apatia na przemian z nadmierna pobudliwością
postać ostra – nagła utrata apetytu, osłabienie, wyciek z nosa, zaburzenia czynności przewodu pokarmowego, nadmierna
pobudliwość, drgawki mięśniowe, porażenia, choroba trwa kilka dni
Zmiany sekcyjne
objawy posocznicowe – wybroczyny pod błonami surowiczymi, opłucną płucną, tkance łącznej międzyzrazikowej grasicy,
wylewy krwawe pod nasierdziem, we wsierdziu, na przeponie
płyn surowiczo – krwisty w jamie brzusznej
surowicze lub krwiste nacieki pod błoną surowiczą pęcherzyka żółciowego, wątroby, węzłach chłonnych
zastoinowo-miąższowy obrzęk śledziony
przekrwienie i obecność wybroczyn w warstwie korowej nerek
nieżytowy do krwotocznego stan zapalny błony śluzowej żołądka i dwunastnicy
przekrwienie mózgu i opon mózgowych
Histopatologia
uszkodzenie naczyń, zmiany zapalne i wsteczne w narządach wewnętrznych
zmiany zwyrodnieniowe komórek wątroby z obecnością ciałek wtrętowych
nieropne rozsiane zapalenie mózgu
okołonaczyniowe nacieki komórkowe
Rozpoznanie
wywiad, objawy kliniczne i zmiany anatomopatologiczne
przyżyciowe we krwi chorych zwierząt stwierdza się: leukopenię, ↓ białka całkowitego, ↑ frakcji globulin
test IF bezpośredniej – antygen wirusa w ślinie i moczu
testy serologiczne są mało przydatne – OWD, precypitacji w żelu, hamowania hemaglutynacji, SN
OWD – badania przesiewowe ferm w celu wykrycia sztuk reagujących + i eliminacja ewentualnych nosicieli wirusa
pośmiertnie – próbki wątroby, płuc, nerek, mózgu i rdzenia
wykrywanie ciałek wtrętowych w komórkach nabłonkowych lub śródbłonkowych
próba biologiczna na młodych lisach – materiał wprowadza się do przedniej komory oka, po 4-5 dniach pojawia się niebiesko
białe zmętnienie rogówki
Zwalczanie
brak leczenia
likwiduje się wszystkie zwierzęta chore
właściwe żywienie zwierząt podczas epizootii oraz prowadzenie zabiegów sanitarnych
immunoprofilaktyka stada podstawowego oraz młodzieży – połowa grudnia stado podstawowe, młodzież 10-13 tydzień życia
diagnostyka różnicowa: postać nerwowa nosówki, leptospiroza, choroba Aujeszkego, zatrucia pokarmowe
Parwowirusowe zakażenie lisów (blue fox parvovirus infection)
Przebiega bezobjawowo, za wyjątkiem samic ciężarnych, u których jest przyczyną wczesnej embriolizy i mumifikacji zarodków lub
płodów. Następstwem tej choroby jest zmniejszenie płodności samic stada podstawowego.
Etiologia
Parwowirus BFPV (spokrewniony z parwowirusem norek MEV i wirusem panleukopenii kotów FPV) rodzina Parvoviridae
aglutynuje erytrocyty małpy i świni
replikację wirusa potwierdza się wykazując obecność ciałek wtrętowych w jądrze komórkowym oraz za pomocą OI,
hemaglutynacji i testu immunoenzymatycznego
oporny na działanie czynników środowiska zewnętrznego
ulega inaktywacji pod wpływem formaliny, środków utleniających, UV, β-propiolaktonu
Źródła i drogi zakażenia
rezerwuarem wirusa są lisy dorosłe, będące bezobjawowymi nosicielami zarazka
wirus pokonuje barierę łożyskową
podstawową rolę w jego transmisji odgrywa droga pionowa, śródmaciczna
stacjonarne występowanie choroby na fermach
droga pozioma nie jest poznana
Patogeneza
wykazuje tropizm do komórek o podwyższonej aktywności mitotycznej
po pokonaniu bariery łożyskowej przenika do zarodków lub płodów i w jego obrębie intensywnie się namnaża
namnażając się w jądrach komórkowych szybko dzielących się komórek powoduje ich lizę co prowadzi do embriolizy lub
mumifikacji zarodków albo płodów w pierwszych 21 dniach ciąży
Objawy kliniczne
POJAWIAJĄ SIĘ U SAMIC CIĘŻARNYCH

96
zamieranie i mumifikacja płodów do 21 dnia ciąży
zaburzenia kolejnych cykli rujowych
mała skuteczność krycia i inseminacji
nieliczne mioty, poronienia, przedwczesne porody
brak porodu mimo występujących objawów ciąży (obumarcie zarodków)
Zmiany sekcyjne
obumarcie zarodków oraz resorbcja lub mumifikacja (czarno szara barwa)
poprzeczne ciemnozielonkawe prążki na błonie śluzowej macicy – pozostałość po resorbcji zarodków
ogniskowe nacieki komórkowe złożone z limfocytów oraz nacieki okołonaczyniowe złożone z komórek plazmatycznych i
limfocytów w endometrium i głębszych warstwach macicy
Rozpoznanie
wywiad – zaburzenia rui, mała skuteczność krycia, inseminacji, małe mioty, brak porodów
izolacja i identyfikacja wirusa – OI, TI mrożonych skrawków płodów, kał roniących samic – ELISA, OH
PCR
wzrost swoistych przeciwciał – test zahamowania hemaglutynacji, ELISA
diagnostyka różnicowa: infekcje bakteryjne, pasożytnicze, działanie toksyn (okres przygotowawczy i rozrodu, krycie, żywienie)
Zwalczanie
brak leczenia
swoiste uodparnianie zwierząt stada podstawowego przed okresem krycia – połowa grudnia
odporność poszczepienna po 14 dniach, utrzymuje się do roku czasu
immunopotencjalizacja zwierząt ciężarnych około 20 dnia ciąży
Choroba Aujeszkyego (meningoencephalitis infectiosa Aujeszky, pseudorabies)
Zakaźna i zaraźliwa choroba ssaków i ptaków, przebiegająca u mięsożernych zwierząt futerkowych z objawami zaburzeń ze strony CUN
oraz uporczywego świądu skóry, kończąca się śmiercią.
Wirusowa, zaraźliwa choroba świń oraz innych gatunków zwierząt gospodarskich i wolno żyjących.
Świnie główne źródło zakażenia i jedyny przyrodniczy rezerwuar zarazka, lista O.I.E., w Polsce podlega rejestracji
Znaczenie ekonomiczne
zaburzenia w rozrodzie (do 100% padnięć noworodków i zwierząt do 14 dnia życia)
zahamowanie przyrostów m.c u młodych osobników
gorsze wykorzystanie karmy
zagrożenie dla innych gatunków zwierząt
W fermach, w których są zwierzęta różnych grup wiekowych - objawy nerwowe, oddechowe, zaburzenia w rozrodzie mogą występować
równocześnie
oprócz świń najbardziej wrażliwe - koty, owce, lisy
średnio wrażliwe- jenoty, psy, skunksy, norki, bydło
najmniej - myszy, szczury
zwierzęta wolnożyjące - jenoty, oposy, niższe naczelne - Rhesus i małpy karmazynowe
Przyjmuje się że człowiek jest odporny na zakażenie wirusem AD, w pełni niewrażliwe są pawiany, szympansy - wrodzona
odporność człowieka i “wyższych” naczelnych
Są twierdzenia, że wraz z rozprzestrzenianiem AD pojawiają się wysoce zjadliwe szczepy zdolne przełamać barierę
międzygatunkową świnia-człowiek.
Brak jednoznacznego dowodu naukowego przyczyną nieuznania AD jako zoonozę
Czynnik etiologiczny
Swoisty pantropowy Herpesvirus suis typ 1 (SHV-1)
rodzina Herpesviridae
podrodzina Alphaherpesvirinae
rodzaj Varicellovirus
Herpesvirus suis typ 1
Wiriony zawierają DNA i ponad 20 strukturalnych polipeptydów - najważniejsze glikoproteiny otoczkowe - determinują zjadliwość
szczepów, główna rola w odpowiedzi immunologicznej
1 serotyp AD, różnice między szczepami z różnych części świata (analiza restrykcyjna) - 3 genotypy (I-III) z szeregiem
podtypów, krajowe szczepy należą do genotypu I
dość wytrzymały na czynniki fizyczne - niskie temp. konserwują, wyższe łatwo unieczynniają
zimą wł. zakaźne 15-40 dni
w moczu i gnojowicy - do 3 tyg. latem i 10-15 tyg. zimą
w ziemi w chłodnych porach roku 5-6 tyg.
w kale traci zjadliwość w ciągu 1 tyg.
w materiale gnijącym 10-11 dni
w biotermicznie odkażanym nawozie - 5 dni latem i 12 dni zimą
w temp. pokojowej traci zjadliwość w ciągu 8 dni
w 60
o
C - po 30 min.
w 80
o
C - 3 min.
100
o
C – natychmiast

97
jest niestabilny od -18 do -25
o
C
bardzo stabilny w -65
o
C i niższych
pH 2-6 i 11-14 spadek miana zakaźnego w ciągu 1 godz.
Zalecane środki dezynfekcyjne
2% fenol (2-5 min)
3% lizol (10 min)
2% formol (3 godz)
szereg ogólnie dostępnych firmowych preparatów, dość oporny na sodę żrącą
Źródło i drogi zakażenia
Zwierzęta chore, ozdrowieńcy zakażone bezobjawowo, latentnie - główni siewcy i przenosiciele wirusa na inne tereny, miejsce zakażeń
latentnych: zwoje czuciowe OUN, tk. limfoidalna migdałków
Zwierzęta chore wydalają wirusa ze śliną /świnie 18-25 dni/
wydzieliną z nosa /świnie 8-17 dni/
mlekiem /świnie 2-3 dni lub dłużej w zależności od odporności maciory/
wydzieliną z pochwy i napletka /świnie do 12 dni/
nasieniem, wodami i błonami płodowymi, sporadycznie z moczem
brak izolacji wirusa z kału
Zjadliwe szczepy wirusa w postaci zakażeń bezobjawowych utrzymują się przez wiele lat nawet w stadach szczepionych -
przyczyną utrzymywania i nawrotów choroby w stadzie
Szczególne znaczenie zakażeń latentnych - utrzymują się przez całe życie, bez względu na występowanie objawów klinicz.,
stanu odporności
Reaktywacja latencji i wydalanie wirusa - pod wpływem stresorów - transport, przegrupowanie, przeładowanie pomieszczeń,
znaczne wahania temp. otoczenia, poród, inne choroby, stosowanie sterydów w stadach zakażonych
Świnie źródłem zakażenia dla:bydła, owiec, kóz, psów,kotów, zwierząt futerkowychi dzikich
największa koncentracja wirusa: mózg, rdzeń kręgowy, płuca, sporadycznie mięśnie(rzadko wiremia)
U innych gatunków zwierząt - zakażenia sporadyczne i kończą się śmiercią - chore zwierzę końcowym ogniwem łańcucha, nie stanowi
źródła zakażenia dla innych zwierząt
Biologicznym przenosicielem wirusa AD są szczury i myszy - zakażają się drogą aerogenną od świń i są przyczyną szerzenia się
zakażenia głównie w obrębie pojedynczych, odizolowanych ferm futerkowych
Drogi zakażenia
zakażenie ssaków, naczelnych od świń - błona śluzowa jam nosowych i gardła, uszkodzona skóra, per os - objawy nerwowe z
bardzo intensywnym świądem
zakażenie donosowo aerozolowe - zapalenie mózgu, po 24 godz. zwykle zejście śmiertelne
Patogeneza
Rozwój zakażenia zależy od:
zjadliwości szczepu
dawki wirusa (wyższa przy per os niż donosowo)
drogi zakażenia
gatunku i wieku zwierzęcia (wrażliwość zmniejsza się z wiekiem)
stanu odporności
Wirus AD cechuje poliorganotropizm /neuro-, pneumo-, wiscerotropizm/
Pierwotne miejsce namnażania - błona śluzowa jam nosowych, gardła, migdałków - zmiany zapalne, stąd regionalne węzły
chłonne i replikacja lub wirus wnika do zakończeń nerwowych
Wędruje w aksoplazmie nerwów: węchowego, trójdzielnego, językowo-gardłowego i błędnego oraz połączeń synaptycznych do
OUN, gdzie po dalszym namnożeniu przedostaje się odśrodkowo nerwami obwodowymi do innych narządów
ważnym mechanizmem szerzenia się wirusa jest zdolność przechodzenia z komórki do komórki na zasadzie adhezji i fuzji
komórek zakażonych i nie zakażonych
wirus może też rozprzestrzeniać się przez ciągłość tkanek (np. z migdałków do płuc)
u ciężarnych wirus zlokalizowany w komórkach jednojądrzastych wnika do macicy i płodów powodując ronienia
w patogenezie istotne znaczenie mają właściwości immunosupresyjne wirusa AD - uszkadza makrofagi płucne, niezdolne do
obrony przed wtórną infekcją bakteryjną
ważną rolę odgrywają też zakażenia latentne - wirusowe DNA związane jest z aparatem genetycznym komórki zakażonej
Pod wpływem stresu wirusowy DNA ulega reaktywacji - powstają kompletne wiriony (cząstki wirusa) - po replikacji
rozprzestrzeniają się po organizmie, zostają wydalone i zakażają wrażliwe zwierzęta
Wirus AD u dorosłych atakuje przede wszystkim górne drogi oddechowe oraz układ rozrodczy
Wnika też do nerwu węchowego, skąd dostaje się do OUN gdzie jest praktycznie poza zasięgiem swoistych przeciwciał (miejsce
latencji)
Objawy kliniczne
świnie - objawy nerwowe, oddechowe, zaburzenia rozrodu
bydło, owce, kozy, lisy, psy, koty, myszy, szczury, sporadycznie konie, poza objawami nerwowymi, bardzo silny świąd
myszy i szczury - inkubacja ok. 3 dni, objawy nerwowe z różnie nasilonym świądem, zejście śmiertelne w ciągu 2-3 dni
zwierzęta futerkowe - inkubacja 4-6 dni, p. pokarmowy główną drogą zakażenia - możliwe też drogi oddechowe, uszkodzona
skóra

98
Lisy
- osowiałość, brak apetytu, 40-41
0
C
- zmiany zachowania - niepokój, wystraszone spojrzenie, zwierzęta niespokojnie biegają po klatce, dominuje uporczywy świąd skóry -
okolica uszu, policzków, warg i żuchwy - rozległe uszkodzenia skóry
Tym objawom towarzyszy
obfity ślinotok
brak koordynacji ruchów
ataki epileptyczne z utratą świadomości powtarzające się w odstępach kilkuminutowych
w końcowym okresie niedowłady i porażenia
śmierć po 8-24 godzinach
Norki - objawy zwiastunowe jak u lisów, charakterystycznym objawem są trudności w przełykaniu, zwierzęta krztuszą się i drapią
przednimi kończynami język i podniebienie powodując uszkodzenia (obfite krwawienia z pyszczka)
Ponadto obserwuje się nadmierne ślinienie, gorączka, toniczno-kloniczne drgawki całego ciała - zwierzęta wydają przenikliwe
piski, nie zawsze świąd skóry
Zmiany anatomopatologiczne
Zmiana patognomoniczna
małe, wielkości główki od szpilki, żółtobiałe ogniska martwicowe w wątrobie, śledzionie,
Zmiany martwicowe na powierzchni łożyska u poronionych płodów, wcześnie padłych krwotoczno-martwicowe ogniska w
płucach
i migdałkach
zapalenie błony śluzowe przedsionka jamy nosowej
OUN - obrzęk mózgu, zwiększona ilość płynu, histopatologicznie ostre, nieropne, limfocytarne zapalenie opon mózgowych,
mózgu i zwojów nerwowych
Diagnostyka
Wstępne rozpoznanie
- endemiczne występowanie
- objawy kliniczne
charakterystyczny skokowy przebieg
w stadzie
zachorowania u kotów i psów
objawy świądu, których brak u świń
Ostateczne rozpoznanie
- badanie laboratoryjne
- materiał biologiczny - mózg, migdałki, wycinki płuc, śledziona od świeżo padłych zwierząt
- materiał schłodzić, nie zamrażać
Izolacja wirusa - hodowle komórek nerki świni, fibroblastów zarodka kurzego lub linie ciągłe (PK15, RK13)
Wykrywanie DNA wirusa - wykrywanie latencji - PCR - najlepszym materiałem biologicznym jest zwój nerwu trójdzielnego
Badania serologiczne (ELISA) - krew od stosownej liczby zwierząt
do określenia wielkości miana p-ciał odczyn SN - zwierzęta zakażone latentnie mogą być serologicznie ujemne
w piśmie przewodnim zaznaczyć, czy prowadzone są szczepienia i jaki rodzaj szczepionki jest stosowany (ferma
trzody chlewnej)
B. serologiczne zwierząt w stacjach unasieniania, punktach kopulacyjnych (zwierzęta gospodarskie)
muszą pochodzić ze stad wolnych od AD
badać serologicznie 1 raz w roku, w okresie kwarantanny, przed użytkowaniem rozpłodowym
Wyszukiwarka
Podobne podstrony:
TŁO KOBIETA Z BIAŁYM FUTERKIEM
Futerka cw2 part 2z2
futerka cw 2 part 1z2
Charakterystyka roślinożernych, Zootechnika SGGW, semestr V, zwierzęta futerkowe
Nazwa pierwiastka, Zootechnika SGGW, semestr V, zwierzęta futerkowe
Odchów młodzieży zwierząt futerkowych mięsożer nych
Ściąga na hodowla zwierząt futerkowych
futerka wyklay calosc, Studia zootechnika, Prewencja
ROZRÓD ROŚLINOŻERNYCH ZWIERZĄT FUTERKOWYCH, Zootechnika SGGW, semestr V, zwierzęta futerkowe
Choroby zwierząt futerkowych - wykłady, CHOROBY ZWIERZĄT FUTERKOWYCH
10 Wykonywanie błamów ze skór futerkowych
SCIAGA Wykłady, weterynaria, 4 rok, choroby zwierząt futerkowych
HODOWLA ZWIERZĄT FUTERKOWYCH, SGGW-egzam inż-zootech
epi-futerkowe, Epi, Epizootiologia
Futra wersja 2, Zootechnika SGGW, semestr V, zwierzęta futerkowe
CHÓW I HODOWLA ZWIERZĄT FUTERKOWYCH
więcej podobnych podstron