KRZEPNIĘCIE
Uszkodzenie naczynia (przerwanie ciągłości śródbłonka – raczej mechaniczne):
1.
hemostaza pierwotna – kolagen + płytki(3-5 min)
2.
hemostaza wtórna – czynnik XII, tworzenie zakrzepu(skrzep –in vitro), tworzenie sieci włóknika(do
10 min zhamowanie krwawienia)
3.
fibrynoliza – rozpuszczenie zakrzepu
Czynniki krzepnięcia krwi
czynniki grupy fibrynogenu
I, V, VIII, XIII
MW powyżej 300 000
wrażliwe na trombinę i plzminę
synteza:UŚŚ(ukł siateczkowo-
śródbłonkowego)
czynniki witaminoKzależne
II, VII, IX, X
podobieństwo strukturalne
kofaktor wit K
synteza: hepatocyty
czynniki kontaktu(aktywują się w
kontakcie z kolagenem)
XI, XIII, HMWK, PK
aktywacja związkami krzemu
Nabyte hipoprotrombinemie – niedobór nabyty II, VII, IX, X
PLT(płytki) - produkowane w szpiku i w płucach - 62% to prawidłowe(52% to szpik, 10% płuca)
- 5% to Large Platelets LP
- 33% to wymienialna pula śledzionowa
7-11 dni – życie płytki
Skazy osoczowe (koagulopatie):
1)wrodzone
•
hipoprotrombinemia,
•
afibrynogenemia, hipo-, dysfibrynogenemia
•
parahemofilia V
•
hemofilia ABC chromosom X
•
anomalia Hagemana XII
Test APTT – na hemofilię (czas kaolinowo-kefalinowy)
2)nabyte:
•
hipoptotrombinemia(awitaminozy K)
- choroby wątroby
- doustne leki przeciwzakrzepowe
- żółtaczka mechaniczna(upośledzenie wchłaniania witK)
- przewlekła antybiotykoterapia(ginie E.coli)
•
DIC
•
zespół pierwotnej fibrynolizy AFA
•
immunokoagulopatie(krążące koagulanty np. SLE- wzrost APTT) – hamują cz VIII
•
hiperheparynemia(z przedawkowania)
Oznaczenie PT(czas protrombinowy)
INR
BT –czas krwawienia
CT – czas krzepnięcia
APTT – czas częściowej tromboplastyny po aktywacji
PT – czas protrombinowy
TT – czas trombinowy
Skazy płytkowe:
150-350tys – norma
<100 trombocytopenia
<50 krwawienia
1)Trombocytopenia(<100tys)
a)upośledzenie produkcji w szpiku
b)skrócenie półtrwania
•
mechanizmy immunologiczne: polekowe, ostre infekcje
FUNGUS grH IIIL
1

•
zużycie: DIC, hipersplenizm
2)Trombocytemia(>500tys)
•
pobudzenie megakariocytu w szpiku
•
urazy, zabiegi chirurgiczne
•
splendektomia
3)Trombocytopatia(zmiana funkcji)
•
choroby rozrostowe szpiku
•
choroby nerek(mocznica)
•
leki przeciwzapalne, penicyliny
•
defekty genetyczne(receptor, ligand)
Choroba Von Villebranda , niedobór VII i wzrost APTT(jedyna skaza płytkowa gdzie APTT się wydłuża)
Badania przesiewowe i uzupełniające w zaburzeniach hemostazy
Płytkowe:
•
liczba płytek,
•
rozmaz krwi
•
czas krwawienia
•
badania czynnościowe(adhezja - kolagen, agregacja, reakcja uwalniania, cytometria przepływowa)
Naczyniowe:
•
czas krwawienia BT
•
badanie czynnościowe(test opaskowy)
•
badanie specjalistyczne(biopsja skóry)
Osoczowe
•
koagulogiczne:
- czas kaolinowo-kefalinowy(APTT) (tor wewnątrzpochodny)- oprócz VII
- czas rekalcynacji,
- PT, (tor zewnątrzpochodny)
- czas trombinowy,
- fibrynogen,
•
fibrynolityczne:
- cz. lizy euglobulin
- cz. trombinowy
- D-dimery(produkty degradacji fibrynogenu) – FDP
•
czynniki krzepnięcia
- krążące antykoagulanty
•
inhibitory krzepnięcia
- białko S i C,
- antytrombina III
- plazminogen
- aktywatory fibrynolizy
- inhibitory fibrynolizy
Markery fibrynolizy:
•
FDP
•
fibrynogen
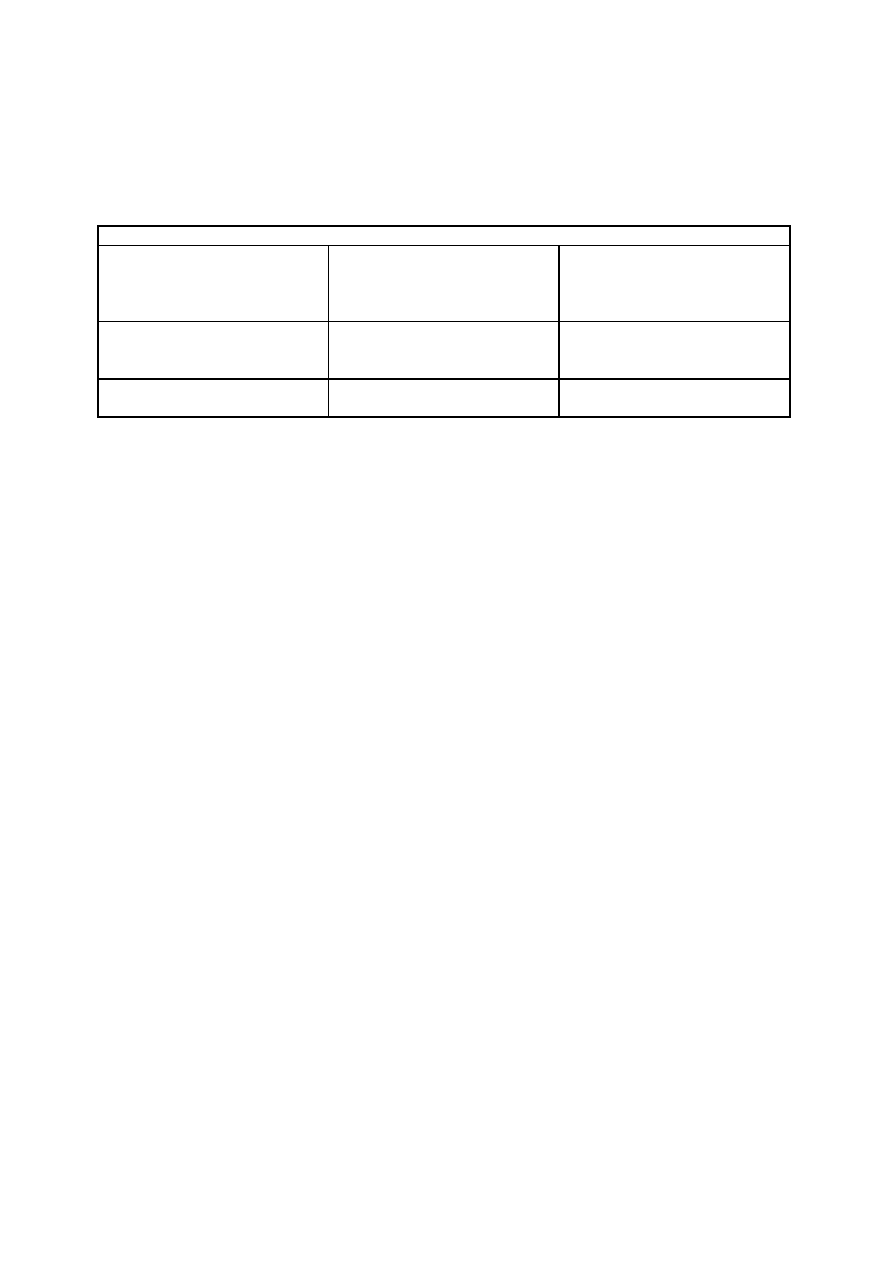
Badania laboratoryjne w przewlekłych krwawieniach
zaburzenie
PT(cz.protrombinowy) APTT(cz.kaolinowo-
kefalinowy)
TT(cz. trombinowy)
BT(cz. krwawienia)
skaza płytkowo-
włośniczkowa
N
N
N
W
choroba Von Willebranda
N
W
N
W
niedobór VII
W
N
N
N
krążące
antykoagulanty(spadek
VIII, IX, XI, XII i FWf)
N
W
N
N
choroby wątroby(spadek II, W
W
N
N
FUNGUS grH IIIL
2

V, X)
hypo dysfibrogenowy
W
W
W
N
Zespół DIC – czynniki przyczynowe:
•
Tromboplastyny tkankowe(zator owodniowy, patologiczna ciąża)
•
Osoczowe uczynnienie krzepnięcia(sepsa)
•
Zwolnienie przepływu krwi
Parametr
Faza niewyrównana
Faza wyrównana
Faza nadwyrównana
PLT(pierwszy objaw
DIC)
S(<100g/l)
S/N
N
Fb
S
N
W
D-dimer
WW
W
W
AT III
S
S/N
N (75-130%)
APTT
przedłużenie
N
skrócenie
PT
przedłużenie
N
przedłużenie
FM
dodatnie
dodatnie
ujemne
niewystarczająca
norma
nadkrzepliwość
Cytometria przepływowa, analiza przeciwciała anty-plt
p/ciała p/płytkowe – przyspieszają eliminację płytek w chorobach auto- i alloimmunologicznych
•
samoistna plamica małopłytkowa(ITP – Idiopatic Thrombocytopenic Purpura)
•
skaza małopłytkowa noworodków (NAT – Neonatal Alloimune Thrombocytopenia)
•
potransfuzyjna trombocytopenia
•
polekowa trombocytopenia
Triada Virchoffa:
•
uszkodzenie ściany
•
zmiany składu krwi
•
zaburzenia w krążeniu
Ale ich udział jest odmienny:
•
żylne---gł. skład krwi, białka osoczowe
•
tętnicze---dieta
Dieta wysokotłuszczowa i wysokowęglowodanowa ---zaburzenia metabolizmu lipidów—aktywacja płytek
i defekt fibrynolizy----zakrzepica tętnic—progresja miażdżycy i ch. niedokrwienna serca
Zakrzepica żylna (trombofilia)
•
ACPR oporność na aktywne białko C(inaktywuje V, VIII)
•
niedobór AT III i białka C i S
•
defekt fibrynolizy, spadek t-PA(aktywator) i wzrost PAI-1(inhibitor plazminogenu)
•
dysplazminogenemie
•
niedobór kofaktora II heparyny
Przedłużenie APTT i TT – wskazuje na zaburzenia krzepnięcia związane z :
•
obecnością heparyny
•
ch. wątroby
•
hiper-, hipofibrynoliza – dysfibrynogemia
Przedłużenie PT i APTT:
•
niedobór wit K, czyn. krzepnięcia II, V, X, VII
•
ch. wątroby
•
podawanie doustnych antykoagulantów
Przedłużenie APTT:
•
hemofilia
•
ch. Von Willebranda
•
obecność krążących antykoagulantów
Przedłużenie PT:
•
niedobór czynnika VII
Przedłużenie APTT, PT, TT
•
DIC
FUNGUS grH IIIL
3

NORMY:
APTT – 30-40s
PT – 11-13s
TT – 9-15s
BT – 3-7min
INR = PTbad/PTnorma
INR – 0,9-1,1 (2-3 – wskazanie do leczenia zakrzepicy)
Przygotowanie krwi do badań koagulogicznych:
Krew należy pobrać:
•
między 8-9 rano, na czczo
•
bez zastoju żylnego, z ż. łokciowej
•
do probówki z dodatkiem antykoagulantu 3,2%cytrynian sodu w stosunku 9:1(krew:antykoagukant)
Czas wykonania oznaczeń w osoczu:
< 2h od pobrania krwi
APTT(czas kaolinowo-kefalinowy)
norma: 27-40s
skrócenie:
•
nadkrzepliwość
wydłuzenie:
•
hemofilia A, B, C(niedobór VIII, IX, XI)
•
wrodzone niedobory innych czynników wewnatrzpochodnego toru krzepnięcia
•
inhibitory: heparyna, FDP
PT(czas protrombinowy) – tor zewnątrzpochodny
czas kontrolny(CP-K)
czas badany(CP-B)
•
procentowy wskaźnik protrombinowy (nie używany)
(CP-K/CP-B)×100
•
wsp.INR
CP-B/CP-K
Najczęściej wykorzystywany do monitorowania:
1 – dla osoby zdrowej
0,9 – 1,15 – norma
2,5-3 – doustne antykoagulanty
Norma 80-120%
skrócenie:
•
hiperprotrombinemia(I, VII)
•
ch. zakrzepowa
•
przedawkowanie wit D
•
środki nasenne i psychotropowe
wydłużenie:
•
zespół DIC
•
hipoprotrombinemia – awitaminoza wit K:
- zaburzenia wytwarzania wit K(antybiotyki)
- wchłanianie wit K (żółtaczka mechaniczna)
- wykorzystanie wit K (ch.watroby, doustne śr p/zakrzepowe)
Zakresy terapeutyczne INR
2,0-2,5 – zapobieganie zakrzepicy żył głębokich(pierwotna profilaktyka)
2,0-3,0 – leczenie zakrzepicy żył głębokich, zator tętnicy płucnej, przemijające niedokrwienie mózgu
3,0-4,5 – nawroty zakrzepicy żylnej, nawroty zatoru tętnicy płucnej, ch. tętnic i zawał serca, przeszczepy
tętnic, sztuczne zastawki serca
FUNGUS grH IIIL
4

TT- czas trombinowy
Norma: 12-16s
Wydłużenie:
•
hipo- i afibrynogenemia
•
DIC
•
ch. wątroby(przesunięcie albuminy/globuliny)
•
leczenie trombolityczne
•
leczenie heparyną
Fibrynogen
Norma: 1,8 – 3,5g/l(180 – 350mg/dl)
Wzrost:
•
fizjologicznie: miesiączka, ciąża
•
stany zapalne: ostre stany goraczkowe, ch. zakaźne
•
operacje, urazy
•
ch. nerek, kolagenozy, nowotwory, ch. niedokrwienna
Spadek:
•
ch. wątroby(marskość, martwica)
•
DIC, skazy fibrynolityczne (pokrwotoczne, pourazowe, pooparzeniowe, ostra białaczka
promielocytowa, nowotwory)
•
l-asparginaza
Antytrombina III
Norma: 75-130%
Spadek:
•
DIC
•
ch. wątroby
•
zespół nerczycowy
•
stany pooperacyjne
•
trombofilie
•
leki:długoterminowa terapia heparyną
•
antykoncepcja
Wzrost:
•
pogotowie zakrzepowe
Białko C
Norma:70-140% (metoda chromogenna)
Spadek:
•
DIC
•
przewlekłe choroby wątroby(marskość)
•
terapia doustna antykoagulantami(początek leczenia)
•
okres pooperacyjny
•
otyłość
•
leczenie l-asparginazą
•
wrodzone trombofilie:ilosciowe i jakościowe
Czynnik V Leiden – przyczyna: mutacja punktowa APC-R(w pozycji 506 Arginina na Glutaminę)
cz V zachowuje zdolność prokoagulacyjną – oporny na białko C –proteoliza przez APC
Xa
APC
FV-----------Va------Va nieaktywny------hamowanie krzepnięcia
Xa mutacja
V---------Va APC-R Va aktywny---------zakrzepica
APCRr = APTT – APCpacjenta/APTT-PVL(osocze zmutowane)
FUNGUS grH IIIL
5
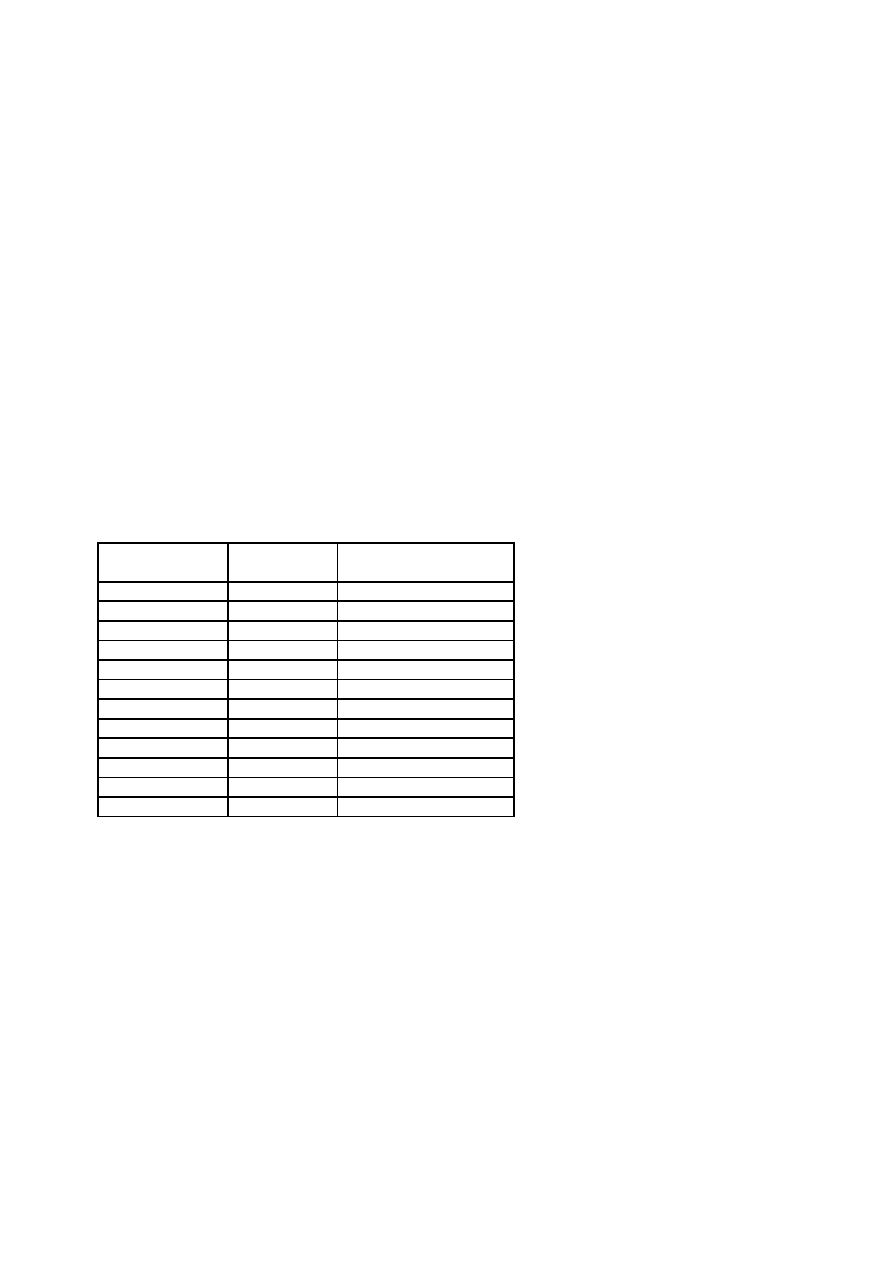
oporność cz.V na białko C(mut. V Leiden)
Białko C – zaczyna hamować cz V i VIII ale dopiero gdy:białko C +TR(trombina) + TRM(trombomodulina)
Przyczyny fenotypowej oporności na APC bez FVL(cz V Leiden) to:
•
wzrost fibrynogenu i cz VIII
•
ciąża
•
doustne leki antykoncepcyjne
•
hormonalna terapia zastępcza
Kliniczne wskazania do oznaczania D-dimerów:
1) DIC (wartości ok 60 000mg/ml)
•
patologia ciąży, posocznica
•
nowotwory
•
alkoholowa marskość watroby
•
zapalenie wątroby
•
uszkodzenia wielonarządowe
2)Zapalenie żył głębokich(DVT – wart ok 20 000mg/ml)
•
niskie D-D wykluczają DVT
•
wysokie niekoniecznie oznaczają DVT(należy wykonać badanie kliniczne)
3)Zatorowość płucna (PE – wart ok 10 000mg/ml)
•
postępowanie jak przy DVT
D – dimery
Norma: do 500mg/ml(metoda immunofluorescencji)
Różnicowanie:
Pierwotna
(AFA)
Wtórna fibrynoliza(DIC)
Plt
N
S
AtIII
N
S
ELT
skrócenie
N/przedłużenie
MN
nieobecne
obecne
FDP, D-D
WW
W
Ft
S
S
plazminogen
S
N
cz VII
N
S
fibrynopeptyd A
N
W
fibrynoliza
aktywna
N
APTT
W
W
PT
W
W
Termin „trombofilia” winno się używać w odniesieniu do tych dziedzicznych lub nabytych zaburzeń
hemostazy, które zwiększają ryzyko zakrzepicy, głównie w krążeniu żylnym.(bo w tętnicach to przeważnie
związane z miażdżycą)
Wskazania do badania w kierunku trombofilii – żylnej choroby zakrzepowej
•
zakrzepica żylna w wieku <40-45 r.ż.
•
nawracające zapalenie żył głębokich
•
zakrzepowe zapalenie żył powierzchniowych
•
zakrzepowe zapalenie żył o nietypowej lokalizacji(np. żż. krezkowych, wrotnych)
•
zakrzepowe zapalenie żył u noworodków
•
zespół pokumarynowy(martwica skóry – obniża się wtedy białko C)
•
zakrzepica tętnicza <30-35 r. ż
•
zator tętnicy płucnej(jedyna tętnica – ale to powikłanie)
Warunki wykonywania badań w kierunku trombofilii
•
po wystąpieniu objawów aktywnej zakrzepicy(spadek AT III, wzrost białkaS)
•
po zakończeniu leczenia heparyną(spadek AT III)
•
po odstawieniu doustnych antykoagulantów(spadek białek C i S)
FUNGUS grH IIIL
6
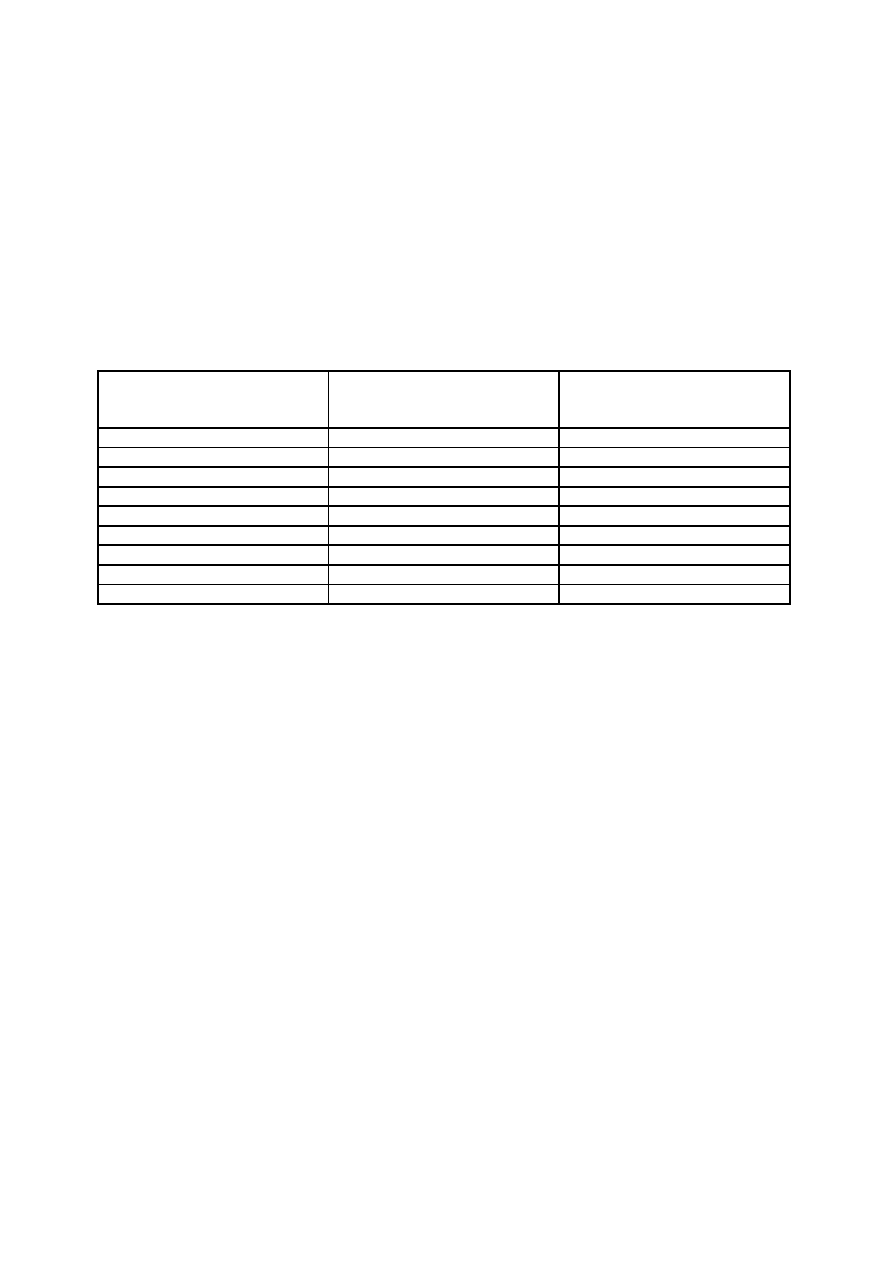
Schemat postępowania u pacjenta z podejrzeniem trombofilii:
1)wywiad
2)badanie fizykalne
3)badania podstawowe
•
morfologia krwi obwodowej(PLT)
•
transaminazy(ALT, AST)
•
ukł. krzepnięcia(APTT, PT, TT, Fib)
4)badania uzupełniające:
•
1-go rzutu:białka C i S, AT III, APC-R, LA(APTT- wzrost)
•
2-go rzutu : plazminogen, tPA, PAI, homocysteina, kofaktor II heparyny
Charakterystyka heparyny
UH (wielkocząsteczkowa
niefrakcjonowana)
•
calcyparyna
LMWH (drobnocząsteczkowa,
frakcjonowana)
•
fraxyparyna
mechanizm działania
II
Xa
monitorowanie APTT
niezbędne
zbędne
okres półtrwania
90min
3,5 godziny
wchłanianie
powolne
szybkie
różnice osobnicze
duże
brak
aktywność lipolityczna
wysoka
niska
działanie agregacyjne
notowane
bardzo rzadko
małopłytkowość
częsta
rzadko
zakres terapeutyczny
0,06-0,6J/ml
0,05- 1,2J/ml
Działanie pochodnych dwuhydroksykumaryny:
1. Działanie powolne i długotrwałe – MARCUMAR(nie stosuje się już!)
2. Działanie pośrednie – WARFARIN, ACENOCUMAROL, SINTROM, SYNCUMAR
Monitorowane wskaźniki:
1. heparyna – tor wewnątrzpochodny---APTT(czas kaolinowo-kefelinowy), płytki
2. antywitaminy K ----INR (czas protrombinowy)
3. trombolityki ---czas trombinowy(dawniej-obecnie się nie monitoruje)
4. doustne---INR
5. streptokinaza---fibryny
Monitorowanie leczenia p/zakrzepowego(zakresy terapeutyczne)
•
doustne antykoagulanty – PT(INR) początek co 2 dni, przez 2 tyg - 2×w tyg, potem 2× w
miesiącu (zakres terapeutyczny – 2,0-4,5)
•
heparyna – APTT – pierwsze 6-12h kilkakrotnie, ustalenie dawki:1×/dobę(z.t.:50-90sek
prawidłowo 27-35sek)
- TT – j.w. (z.t.: wydłużenie 2-3×)
- płytki – kontrola między 2 a 5 dniem leczenia
•
streptokinaza – TT – optimum terapii:2 – 3 × wydłużenie
fibryny poziom <100 – źle!!!
Laboratoryjna kontrola:
1. antykoagulanty
•
bezpośrednie – heparyna(UH, LMWH), hirudyna
•
pośrednie – pochodne dihydrokumaryny
działanie: powolne długotrwałe- Marcumar
pośrednie – Warfaryna, Sintrom
szybkie, krótkotrwałe – Tromoxekan, Relerte
2.dekstrany
3. trombolityki(aktywatory plazminogenu)
•
streptokinaza, urokinaza
•
tkankowy aktywator plazminogenu(najdroższy , ale najmniejsze powikłania)
FUNGUS grH IIIL
7

•
APSAC
•
SCU Pa
4.leki hipolipemiczne(nie na krzepnięcie tylko na obniżenie lipidów!)
5.leki antypłytkowe
•
antagoniści receptorów błonowych(tikopidyna-po udarach, α-blokery)
•
inhibitory kw C
20
– aspiryna, indometacyna
•
antagoniści kanału wapniowego – Verapamil
•
aktywatory cyklazy adenylowej – prostacyklina , iloprost
Działanie:
•
heparyna niefrakcjonowana ---cz X i II
•
LMWH – głównie X (nie wymaga monitorowania)
•
antykoagulanty doustne – II, X, IX, VII (monitorowanie!!)
Powikłania po przedawkowaniu Sintromu:
•
przedłużenie czasu protrombinowego i INR
•
postępowanie:
- powikłania średniociężkie – 10mg witK dożylnie(1mg/min) – po 2-3 dniach powrót do Sincumaru
- powikłania zagrażające życiu – osocze świeżo mrożone(źródło czynników grupy protrombiny)- 10-
15ml/kg m. c. i dopiero wstrzyknięcie wit K
(siarczan protaminy)
Szybkość obniżania się poziomu czynników zależy od ich okresu półtrwania:
•
VII – 4 – 6h
•
IX – 20-24h
•
białko C – 6-10h
•
X – 48-76h
•
II – 72-100h
Przy braku efektu leczniczego po heparynie – źródła błędów oznaczania APTT
in vivo
1. niedobór AT III (posocznice, DIC) – brak wydłużenia APTT
2.
antyheparynowe działanie LDL – trudności w uzyskaniu zakresu leczniczego czasu APTT w
hiperlipoproteinemiach(zwiększać dawkę heparyny)
in vitro
1.kontaminacja osocza PF 4 – antyheparynowe działanie powoduje utrudnienie ustalenia APTT
Zmniejszenie dawki:
•
starszy wiek(kobiety), niedowaga, gorączka
•
uszkodzenie nerek, nadczynność tarczycy
•
interakcja z innymi lekami:
- salicylany, sulfonamidy, antybiotyki
- niesterydowe leki p/zapalne
- leki hipolipemiczne
- sterydy anaboliczne
- leki antydepresyjne
Czynniki osłabiające:
•
niedoczynność tarczycy
•
dieta bogata w wit K
•
barbiturany, leki antykoncepcyjne
Rzutowanie ogólnoustrojowego uczynnienia krzepniecia i fibrynolizy na wyniki badania laboratoryjnego
DIC
1. agregacja płytek(spadek ilości krążących płytek
2. a) ostre uczynnienie krzepnięcia wewnątrzpochodnego(wydłużenie APTT)
b)uczynnienie krzepnięcia zewnątrzpochodnego(wydłużenie Quicka) – spadek V, VII, X
3. trombinogeneza, fibrynogeneza(wydłużenie czasu trombinowego)
Ostre uczynnienie ukł fibrynolizy – AFA
•
aktywacja plazminogenu
FUNGUS grH IIIL
8
•
skrócenie czasu lizy skrzepu
•
fibrynogenoliza
•
wydłużenie czasu trombinowego
•
proteoliza czynników
Ogólna diagnostyka skaz krwotocznych – objawy kliniczne
objawy kliniczne
skazy osoczowe
skazy płytkowo-włośniczkowe
wybroczyny i sińce
wybroczyny – rzadko,
sińce - pojedyncze
często, liczne wybroczyny i sińce
wylewy krwi domięśniowe,
dostawowe
częste
rzadkie
krwawienia miesięczne
często prawidłowe
często przedłużone i obfite
krwawienia po skaleczeniach
prawidłowe
przedłużone
krwawienia po usunięciu zęba
często, późne, obfite, długie
wczesne, skąpe, któtkie(24-48h)
krwawienia pooperacyjne
często, późne, bardzo
niebezpieczne
podczas zabiegu, mniej
niebezpieczne
efekt ucisku miejsca krwawiącego
nawroty
zatrzymanie
najczęstsze objawy skazy
wylewy krwi domięśniowo,
dostawowo, późne krwawienia
pourazowe
plamica, siniaki, krwawienia np z
nosa
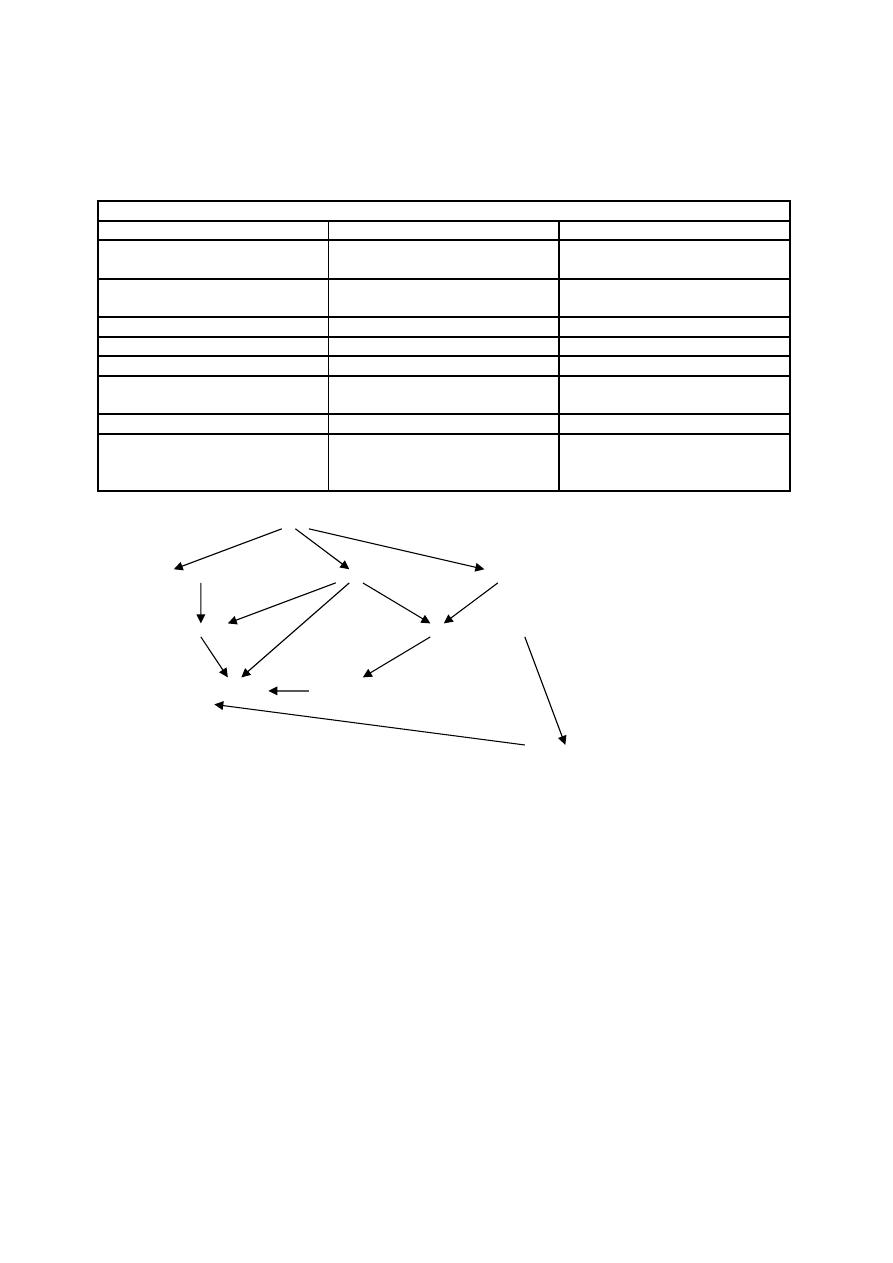
Patomechanizm skazy krwotocznej w ostrym uczynnieniu fibrynolizy
Plazmina
cz II, V, VIII, XIII
Fibrynogen
Fibryna
niedobór cz. krzepnięcia
prod. fibrynolizy i fibrynogenolizy
skaza krwotoczna
hamow. polimeryzacji
monomerów fibryny
hamow. adhezji i agregacji
Czynniki sprzyjające DIC:
•
prokoagulanty
•
inhibitory fibrynolizy
•
blokada USS
•
zwolnienie prądu krwi
•
kwasica.
•
hipowolemia
•
hiperlipemia
•
cz. naczynioskurczowe
•
cz. hamujące antykoagulanty
Stany kliniczne związane z DIC:
1. stany położnicze:
•
przedwczesne odklejenie łożyska
•
wewnątrzmaciczna zamartwica płodu
•
poronienia zakażone(rzucawka porodowa, zaśniad groniasty)
2. zakażenia(bakteryjne i wirusowe)
3. stany nowotworowe (białaczki – szczeg. promielocytarne, nowotwory złośliwe, zrakowacenia)
4. ostra niewydolność wątroby
5. oparzenia II
0
i III
0
6. zabiegi operacyjne i operacje z krążeniem pozaustrojowym
7. udar cieplny
FUNGUS grH IIIL
9

8. śpiączka cukrzycowa
9. hipotermia
10.przetoczenia krwi niezgodnej grupowo
Defekty genetyczne płytek(glikoproteiny dla adhezji i agregacji płytek) i defekty adhezji(receptory)
•
Bernard – Soulier – Syndrome(BSS)
- dziedziczenie AR
- mutacja GP Ia – V – IX
- fenotyp – olbrzymie płytki, trombocytopenie, brak adhezji, prawidłowa agregacja i degranulacja,
skaza skórno – śluzówkowa
•
Von Willebrand Diseae (vWFD)
- rola vWF w hemostazie:
- adhezja PLT do warstwy podśródbłonkowej przy wysokim przyściennym module
ścinania(GP/bα)
- ochrona cz. VIII przed proteolizą
- dziedziczenie wg Sedlera:
- typ 1 – autosomalny dominujący(łagodny)
- typ 2 – AR/ dominujący, jakościowy(4 podtypy)
- typ 3 – AR(ciężki)
- gen kodujący vWF – chromosom 12(52exony, 51introny), megakariocyty ,śródbłonek
Defekt agregacji
•
Trombostenia Glanzmanna
- dziedziczenie AR
- mutacja GP IIb IIIa(7 różnych mutacji)
- fenotyp – brak agregacji płytek pod wpływem ADP, prawidłowa adhezja i degranulacja
- intensywne krwawienia z nosa i dróg rodnych, śluzówek
- brak wpływu agregacyjnego heparyny
Choroby z towarzyszącą zakrzepicą:
•
miażdżyca, zawał serca, udar mózgu
•
hiperlipoproteinemia
•
niewydolność krążenia
•
cukrzyca
•
zespół nerczycowy
•
przewlekła choroba zapalna
•
pierwotna nadpłytkowość
•
nowotwory :jajnik, prostata, trzustka
Stany związane z ryzykiem zakrzepicy:
•
antykoncepcja, ciąża
•
okres pooperacyjny
•
palenie tytoniu
•
nadciśnienie otyłość
•
starszy wiek
•
zespół antyfosfolipidowy
•
nowotwory
Częstość występowania niedoborów najważniejszych białek antykoagulacyjnych:
1.
oporność na aktywowane białko C(czynnik V Leiden) – 12-64% defekt APCR
2. niewydolność ukł fibrynolizy(spadek tPA, wzrost PAI-1)
3. niedobór białka S, białka C i AT III – 5-8%
4. obecność p/ciał antyfosfolipidowych
5. hipo- i dysplazminogenne
6. dysfibrynogenemie
Najpierw test APCR!!!
Zaburzenia białek antykoagulacyjnych:
Typ-1 – zmniejszenie syntezy białka(spadek stężenia i aktywności)
FUNGUS grH IIIL
10
Typ-2 – jakościowy defekt czynności białka(spadek aktywności)
Zaburzenia hemostazy usposabiające do żylnej ch. zakrzepowo- zatorowej:
•
APCR – oporność na aktywowane białko C(cz. V Leiden)
•
niedobór AT III, białka C i S
•
defekt fibrynolizy(spadek – t-PA i wzrost PAI-I)
•
niektóre dysfibrynogenemie
•
dysplazminogenemie
•
niedobór kofaktora II heparyny
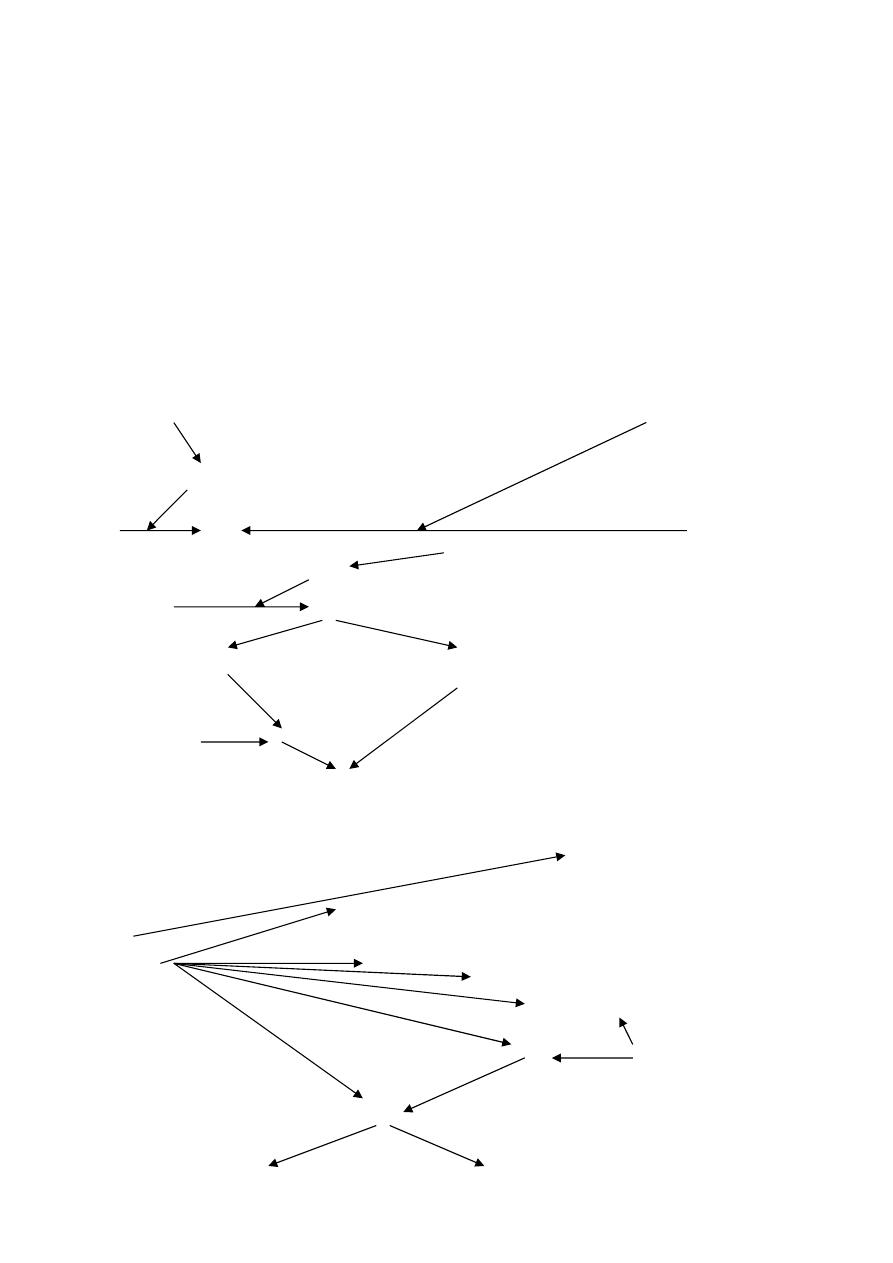
KASKADA PROCESU KRZEPNIĘCIA
tor wewnętrzny
tor zewnętrzny
uszk śródbłonka
uwalnia się czynnik III
kontakt XII pod wpływem HMWK i PK
który aktywuje VII
XIIa
VIIa
XIa +VIIIa
X
Xa
X
tor wspólny
kompleks protrombinazy
Xa +Va
trombinogeneza
II
IIa
XIII
fibrynopeptydy A i B
monomery fibryny
stabilizowany
XIIIa
trombiną i Ca
+2
stabilizacja
Fizjologiczne inhibitory krzepnięcia
Heparyna inaktywuje trombinę
tj cz. II i cz X, ale muszą mieć AT III
K
AT III
XIIIa
(w wątrobie oprócz
XIa
cz VIII i V)
IXa----VIIIa
Xa
białka S i
Va
białkoC
(inhibicyjnie na:)
najbardziej hamuje
IIa
FUNGUS grH IIIL
11
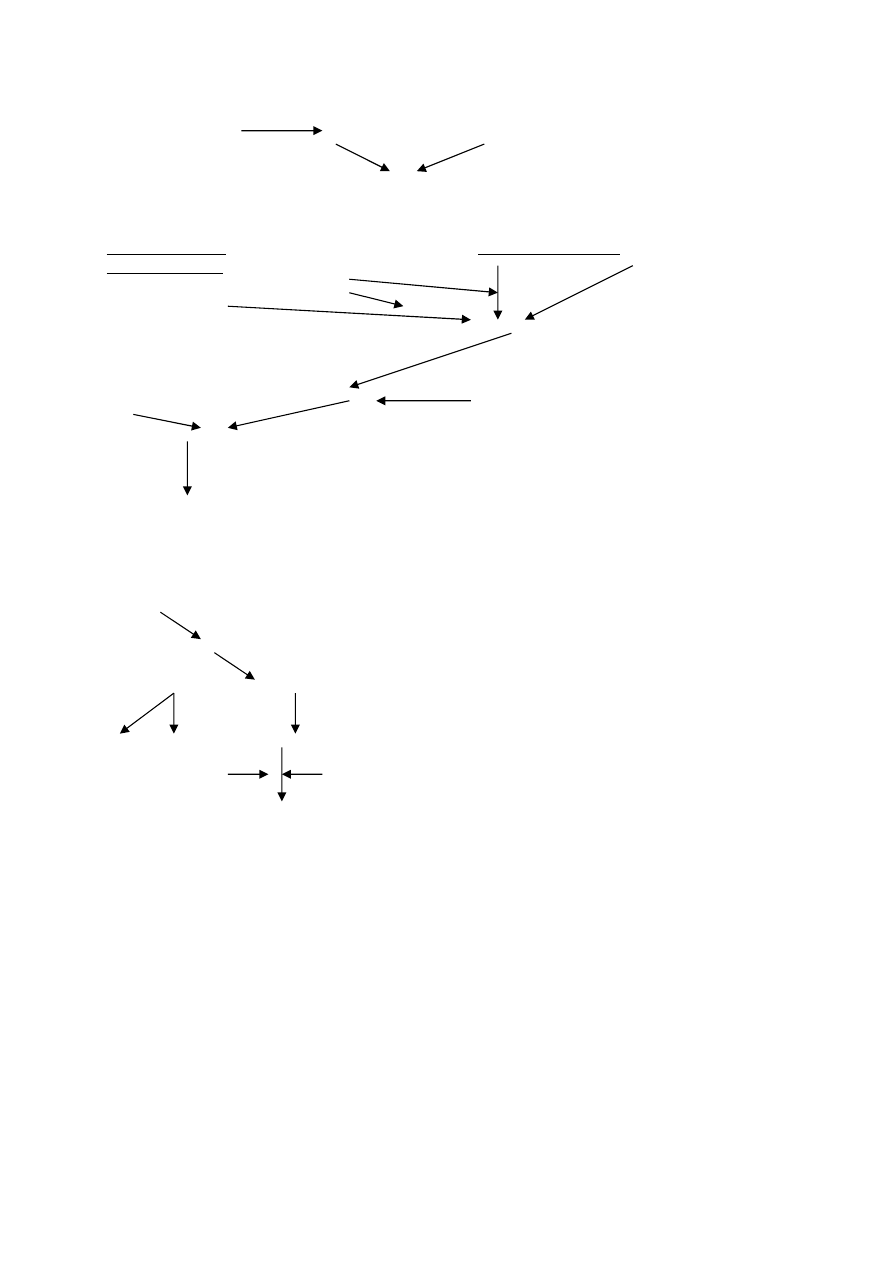
XIII
XIIIa
fibryna
stabilizacja
fibrynolityczny tor
tor wewnątrzpochodny
zewnątrzpochodny
u-PA(ureaza)
XIIa+HMWK
t-PA(tkankowy aktyw.
PAI
(dlatego krzepnięcie
plazminogenu) prod.
z fibrynolizą)
śródbłonek
plazminogen
fibryna
włóknik
plazmina
α-2-antyplazmina
rozpad fibryny
PAI-inhibitor aktywatora
tkankowego plazminogenu
FDP
D-dimery-----markery rozpadu włóknika
spadek PAI+wzrost t-PA= aktywacja
wzrost aktywności-to aktywacja krzepnięcia
przedwczesna
Powstawanie produktów degradacji (FDP) i fibryny stabilizowanej(D-D)
tor zewnątrzpochodny
FX-----FXa
protrombina-----trombina
fibrynogen------monomery fibryny
FpA
FpB
F XIII
Ca
+2
trombina
fibryna stabilizowana
FUNGUS grH IIIL
12
Wyszukiwarka
Podobne podstrony:
krzepniecieWyklad 2007
Krzepniecie Krwii
LEKI WPLYWAJACE NA KRZEPNIECIE I HEMOSTAZE, 000-Nasze Zdrowko, Leki i Witaminy
12 POMIAR CZASU KRZEPNIECIA ODLEWU I PARAMETROW TERMOFIZYCZNYCH FORMY PIASKOWEJ(1)
Kopia wykaz czynników krzepnięcia
LEKI WPŁYWAJĄCE NA KRZEPNIĘCIE 31.03.2011, farmakologia n
Krzepnięcie krwi
Niedobor czynnikow krzepniecia krwi u krow Radwinska(wyklad), Gospodarskie
krzepnięcie
Krzepnięcie prezentacja cz II
Krzepnięcie, Biochemia
Laboratorium Podstaw Fizyki spr Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu
Patofizjologia, Nadkrzepliwość występuje w przewlekłych zespołach wewnąt, Nadkrzepliwość występuje
04 - ukl krzepniecia, Biochemia - IV
Krzepnięcie krwi skazy krwotoczne
krzepniecie
krzepnięcie
więcej podobnych podstron