
Interpretacja badań koagulologicznych
- błąd czy patologia
Elżbieta Żero
- Product Manager ds. Hemostazy
i Analityki Ogólnej PZ Cormay
Hemostaza to złożony proces utrzymujący płynność krwi
krążącej i chroniący przed utratą krwi w wyniku przerwania ciągłości
naczyń. Zachowanie prawidłowej funkcji hemostazy zależy
od zachowania równowagi i współdziałania białek układu
krzepnięcia, układu fibrynolitycznego i elementów układu
krwawienia, czyli hemostazy pierwotnej takich jak naczynia
krwionośne i krwinki płytkowe (Rys. 1).
Układ krzepnięcia z wykorzystaniem osoczowych czynników krzepnięcia, czynnika
tkankowego i czynnika płytkowego prowadzi do przekształcenia fibrynogenu w fibrynę, która
tworzy skrzep.
Zadaniem układu fibrynolitycznego jest wytworzenie odpowiedniej ilości plazminy
z plazminogenu, zdolnej do rozpuszczenia powstałych skrzepów.
Do badania układu krzepnięcia stosuje się głównie testy oceniające czynność
poszczególnych torów: wewnątrzpochodnego (APTT), zewnątrzpochodnego
(PT) oraz testy badające czas wytworzenia skrzepu
po dodaniu nadmiaru trombiny (TT) i test oznacza-
jący poziom fibrynogenu.
Czas kaolinowo-kefalinowy (APTT - czas częścio-
wej tromboplastyny po aktywacji) jest miarą
wewnątrzpochodnego układu aktywacji protrombiny
i zależy od poziomu następujących osoczowych
czynników krzepnięcia: XII, XI, IX, VIII, X, V, II
i fibrynogenu oraz aktywności inhibitorów układu
krzepnięcia. Białka kofaktorowe toru wewnątrzpo-
chodnego jak prekalikreina (czynnik Fletchera), kini-
nogen wielkocząsteczkowy (czynnik Fitzgeralda,
HMWK), czynnik XII, I, XI, które w kontakcie z subs-
tancją o powierzchni ujemnie naładowanej jak glinka kaolinowa, celit, mikronizowane cząstki
krzemianu czy kolagen aktywują wewnątrzpochodny tor układu krzepnięcia. Odczynnik
do oznaczenia czasu APTT oprócz aktywatora zawiera także kefalinę - fosfolipid (FL), który
jako substytut krwinek płytkowych niezbędny jest do tworzenia kompleksu IXa + VIII + FL +
jony wapnia. Kompleks ten aktywuje czynnik X, a Xa tworzy kompleks Xa + V + FL + jony
wapnia przekształcający protrombinę w trombinę, która rozbija cząsteczki fibrynogenu
na monomery fibryny (FM). Monomery fibryny ulegają samoistnej polimeryzacji i tworzą
fibrynę rozpuszczalną, która po działaniu czynnika XIII tworzy fibrynę stabilizowaną (Rys.
2). Prawidłowo wykonane badanie APTT jest bardzo dobrym testem przesiewowym
badającym cały układ krzepnięcia oprócz poziomu czynnika VII. Otrzymany czas APTT, jeśli
mieści się w wyznaczonej dla danego laboratorium normie, świadczy o prawidłowym
poziomie wszystkich czynników krzepnięcia oprócz VII. Świadczy również o nieobecności
w osoczu: heparyny, produktów degradacji fibrynogenu i fibryny, antykoagulantów jak
przeciwciała skierowane przeciwko czynnikom krzepnięcia i przeciwciał antyfosfolipi-
dowych (Rys. 3). Stany kliniczne, w których mogą wystąpić przeciwciała antyfosfolipidowe
przedstawia Rys. 4. Wynik czasu APTT podawany w sekundach musi zawierać zakres
normy wyznaczony dla używanego odczynnika i metody odczytu powstającego skrzepu
HEMOSTAZA
s UKŁAD KRZEPNIĘCIA
s UKŁAD FIBRYNOLITYCZNY
s UKŁAD KRWAWIENIA
Rys.1
Rys.2
SCHEMAT UKŁADU KRZEPNIĘCIA
AKTYWACJA
- KOLAGEN
- SZKŁO
- KAOLIN
AKTYWACJA
- TROMBOPLASTYNY
TKANKOWE
XII
XI
IX
VIII+PF-3+Ca VII
X
V
II
TROMBINA (IIa)
FIBRYNOGEN (I)
MONOMERY FIBRYNY
FIBRYNA ROZPUSZCZALNA
FIBRYNA NIEROZPUSZCZALNA
samoistna polimeryzacja
XIII+Ca
APTT
Rys.3
PRZEDŁUŻONY CZAS APTT
(KAOLINOWO-KEFALINOWY)
s
NIEDOBÓR CZYNNIKA
LUB CZYNNIKÓW KRZEPNIĘCIA
s
KRĄŻĄCE ANTYKOAGULANTY
s
HEPARYNA
s
NISKI POZIOM FIBRYNOGENU
s
PRODUKTY DEGRADACJI
FIBRYNOGENU I/LUB FIBRYNY
Rys.4
CHOROBY I STANY KLINICZNE,
W PRZEBIEGU KTÓRYCH WYSTĘPUJĄ
PRZECIWCIAŁA ANTYFOSFOLIPIDOWE
Układowe choroby tkanki łącznej:
- toczeń rumieniowaty układowy
- reumatoidalne zapalenie stawów
- twardzina układowa
- pierwotny zespół Sjorgena
- zapalenie skóry i mięśni
- atropia łuszczycowa
- zesztywniające zapalenie stawów
kręgosłupa
- zapalenie tętnic olbrzymiokomórkowe
Zakażenia
- bakteryjne
- wirusowe
- pierwotniakowe
Nowotwory
- guzy lite
- białaczka włochatokomórkowa
- chłoniaki złośliwe
- makroglobulinemia Waldenstroma
Stosowanie leków
- chloropromazyna
- prokainamid
- eutosuksymid
- chlorotiazyd
- chinidyna
- fenytoina
- antybiotyki
Różne
- cukrzyca
- niedokrwistość Addisona-Biermera
Czytelnia
04
Biuletyn informacyjny PZ CORMAY 1 (14) / 2007
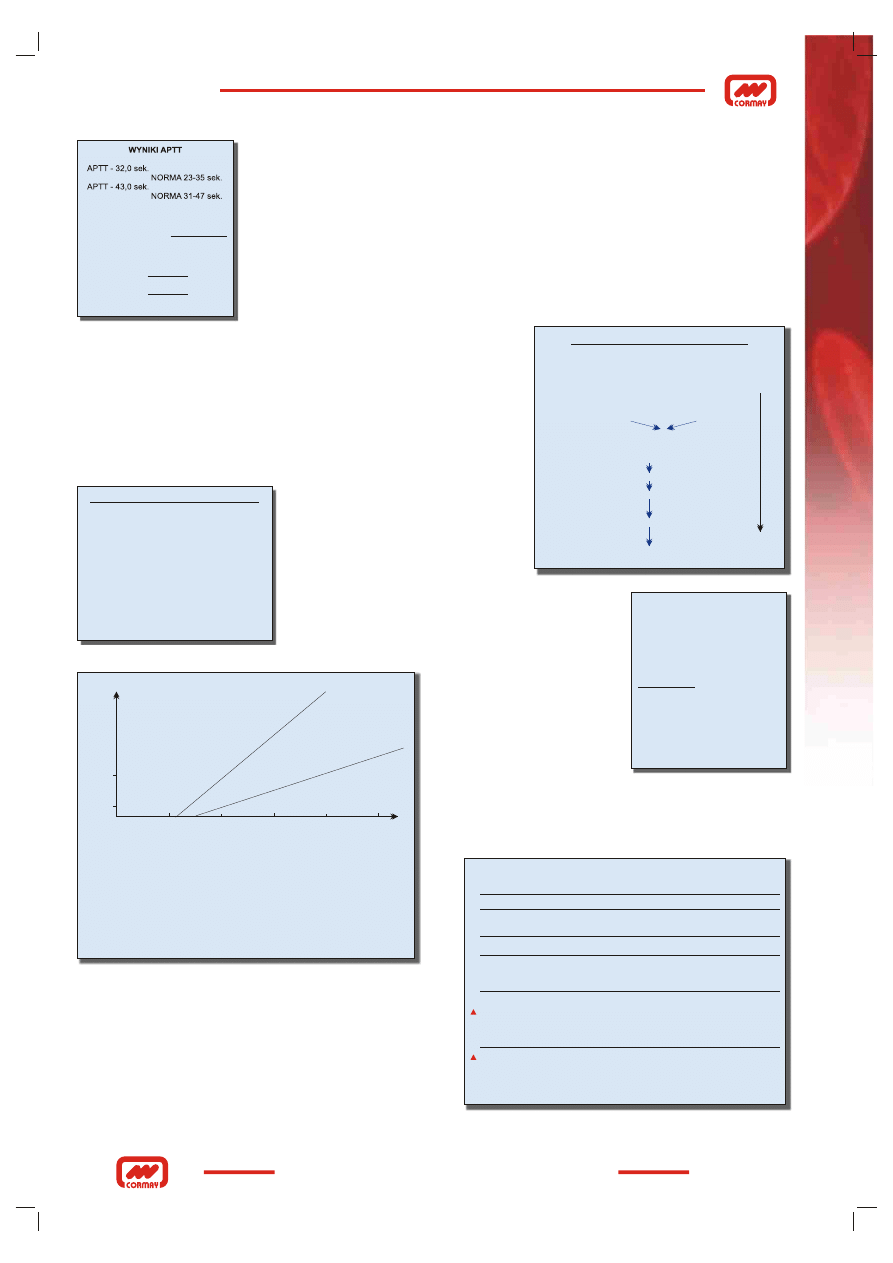
zastosowanej w używanej aparaturze. Podawanie wyniku w indeksie (RATIO), którego
norma zawsze wynosi 0,80 - 1,20, uzyskanego przez podzielenie otrzymanego czasu bada-
nego przez czas normalny (wyznaczony dla danego laboratorium), ułatwia porównywanie
wyników uzyskanych z różnych laboratoriów (Rys. 5).
Czas protrombinowy (PT) jest miarą aktywacji protrombiny poprzez zewnątrzpochodny
tor układu krzepnięcia. Reakcję inicjuje tromboplastyna tkankowa tworząca kompleks
z czynnikiem VII i jonami wapnia, który to kompleks z kolei aktywuje czynnik X, a dalszy
przebieg aktywacji przebiega jak opisano powyżej przy czasie APTT, aż do wytworzenia
skrzepu. Czas ten zależy od poziomu następujących osoczowych czynników: VII, X, V,
i fibrynogenu. Bez wpływu na wynik są pozos-
tałe czynniki krzepnięcia i liczba płytek (Rys.
6). Jest to badanie służące głównie do monitorowania terapii przeciwza-
krzepowej antagonistami witaminy K. Dla czynników krzepnięcia witamino-
K-zależnych jak VII, X, II, IX, białko C i białko S cechą charakterystyczną
jest posiadanie unikalnego aminokwasu (Gla) syntetyzowanego w obec-
ności witaminy K, a umożliwiającego wiązanie jonów wapnia i tworzenie
kompleksów z kwaśnymi fosfolipidami. Niedobór w organizmie witaminy K
powoduje, że czynniki krzepnięcia, białko C i białko S są nieaktywne.
Badany czas PT jest przedłużony, a INR
podwyższony we wrodzonych niedobo-
rach czynników VII, X, V, II i fibrynogenu,
w terapii antagonistami witaminy K,
w obecności przeciwciał antyfosfolipi-
dowych oraz innych sytuacjach klinicz-
nych (Rys. 7).
Duże rozbieżności w wynikach uzyskiwanych
w poszczególnych laboratoriach wymusiły standary-
zację stosowanej do badań tromboplastyny tkankowej
(Rys. 8). W 1977 roku Światowa
Organizacja Zdrowia (WHO)
uznała serię ludzkiej mózgowej
tromboplastyny za międzynaro-
dowy preparat referencyjny
(IPR), któremu przypisano
współczynnik ISI = 1,0 (Inter-
national Sensitivitiy Index).
Wszystkie preparaty tromboplastyny stosowane w diagnos-
tyce kalibrowane są wobec międzynarodowego wzorca.
Wyznaczony współczynnik ISI wykorzystywany jest do oblicza-
nia INR (International Noramalization Ratio). Sposób oblicza-
nia i podawania wyniku w INR przedstawia Rys. 9.
Brytyjskie Towarzystwo Hematologiczne opracowało zakresy
terapeutyczne dla różnych stanów klinicznych, w których
niezbędne jest włączenia terapii przeciwzakrzepowej antago-
nistami witaminy K (Rys. 10).
Rys.7
OBNIŻONY WSKAŹNIK PROTROMBINOWY
s WRODZONY NIEDOBÓR CZYNNIKA
I/LUB CZYNNIKÓW
s DOUSTNE ANTYKOAGULANTY -
CZYNNIKI WIT. K ZALEŻNE BEZ
AKTYWNYCH CENTR - VII, X, II, IX
s NISKI POZIOM FIBRYNOGENU
s WYSOKIE DAWKI HEPARYNY
s WYSOKI POZIOM PRODUKTÓW
Rys.6
SCHEMAT UKŁADU KRZEPNIĘCIA
AKTYWACJA
- KOLAGEN
- SZKŁO
- KAOLIN
AKTYWACJA
- TROMBOPLASTYNY
TKANKOWE
XII
XI
IX
VIII+PF-3+Ca VII
X
V
II
TROMBINA (IIa)
FIBRYNOGEN (I)
MONOMERY FIBRYNY
FIBRYNA ROZPUSZCZALNA
FIBRYNA NIEROZPUSZCZALNA
samoistna polimeryzacja
XIII + Ca
PT
Rys.5
///////////////////////////////////////////////////////////
Współczynnik APTT
RATIO APTT
////////////////////////////////////////////////////////////
RATIO APTT - =1,10
RATIO APTT - =1,10
czas badany
śr. czas normy
NORMA 0,80 - 1,20
32,0 sek.
29,0 sek.
43,0 sek.
39,0 sek.
Rys.9
WYNIK PT
Czas protrombinowy - 32,0 sek.
Wskaźnik protrombinowy - 44 %
///////////////////////////////////////////////////////////
///////////////////
////////////////////////////////////////////////////////////
////////////////////////////////////////////////////////////
% aktywności Quicka - 58 %
odczyt z krzywej kalibracyjnej
x 100 % = xx %
NORMA 12 - 18 sek.
NORMA 80 - 120 %
norma
czas badany
% activity (Quick percent)
ISI = International Sensivity Index
INR = International Normalized Ratio
Ratio = B/N
ISI
INR = (B/N)
Przykład:
1,26
INR = (22,0 sek/14,0 sek)
= 3,2
Norma INR 0,8 - 1,2
Zakres terapeutyczny 2,0 - 4,5
Excel
Excel S
PT [sck]
10 20 30 40 50
25
50
100
Rys.8
ZAKRESY TERAPEUTYCZNE INR
PROPONOWANE PRZEZ BRYTYJSKIE TOWARZYSTWO HEMATOLOGÓW
STAN KLINICZNY
INR
- ZAPOBIEGANIE ZAKRZEPICY ŻYŁ GŁĘBOKICH
- PO ZABIEGACH OPERACYJNYCH
- PO ZABIEGACH NA STAWIE BIODROWYM
- LECZENIE ZAKRZEPICY ŻYŁ GŁĘBOKICH
- ZATOR TĘTNICY PŁUCNEJ
- PRZEMIJAJĄCE NIEDOKRWIENIE MÓZGU
- NAWROTY ZAKRZEPICY ŻYLNEJ
ZATOR TĘTNICY PŁUCNEJ
ZAWAŁ SERCA
- PRZESZCZEPY TĘTNICZE
- WSZCZEPIANIE SZTUCZNYCH ZASTAWEK SERCA
STWIERDZONO, ŻE UTRZYMANIE INR NA POZIOMIE 2,0 - 3,0 JEST RÓWNIE
SKUTECZNE I NIE WIĄŻE SIĘ Z WYSOKIM RYZYKIEM POWIKŁAŃ
KRWOTOCZNYCH, JAKIE WYSTĘPUJE PRZY INR WIĘKSZYM NIŻ 4,0
2,0 - 2,5
2,0 - 3,0
2,0 - 3,0
3,0 - 4,5
Czytelnia
05
Biuletyn informacyjny PZ CORMAY 1 (14) / 2007
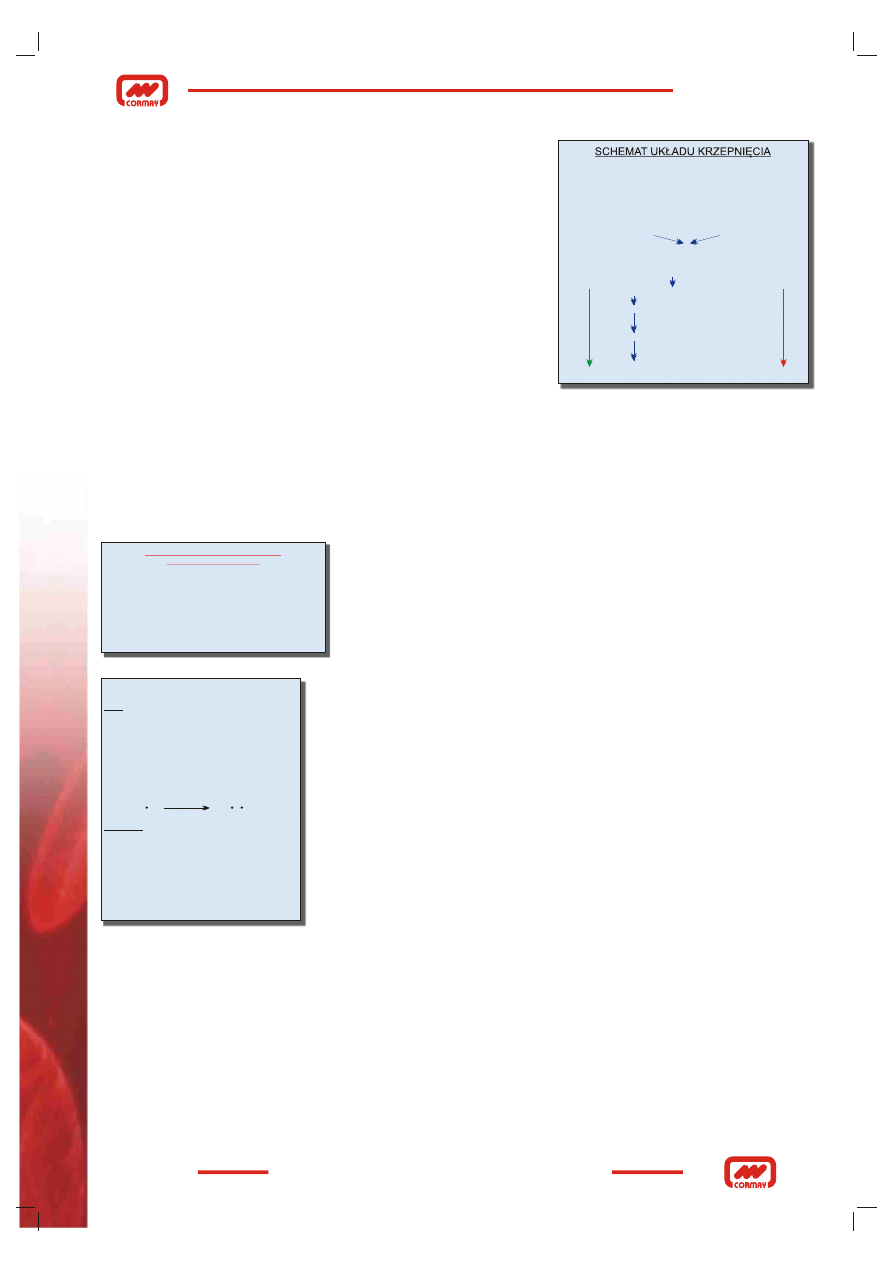
Czas trombinowy (TT) opiera się na pomiarze czasu wykrzepiania
osocza cytrynianowego, z pominięciem aktywacji wszystkich czynników
krzepnięcia oprócz fibrynogenu, po dodaniu w nadmiarze odczynnika
trombinowego (Rys. 11). Badanie to jest miarą przekształcenia fibrynogenu
w fibrynę, a wynik zależy od poziomu fibrynogenu, obecności lub nie niepra-
widłowych cząsteczek fibrynogenu, aktywności antytrombin, procesów
polimeryzacji i stabilizacji fibryny, aktywności układu fibrynolitycznego oraz
obecności w osoczu heparyny (Rys. 11). Wyniki podawane są w sekundach
i zależą od stężenia stosowanej trombiny, dlatego podanie normy
wyznaczonej w danym laboratorium jest obowiązkowe.
Oznaczanie poziomu fibrynogenu przebiega tą samą drogą jak TT,
ale osocze badane musi być wstępnie rozcieńczone w buforze w celu
zminimalizowania wpływu na wynik obecnej w osoczu heparyny lub antyko-
agulantów. Zasada oznaczania fibrynogenu metodą wykrzepieniową
została opracowana w 1957 roku przez Claussa. Czas krzepnięcia
rozcieńczonego osocza po dodaniu wysokich stężeń trombiny jest odwrotnie proporcjonalne do stężenia fibrynogenu.
Podwyższone stężenia fibrynogenu występują w ciąży i podczas miesiączki oraz podczas rozległych zabiegów
operacyjnych, po urazach, w przebiegu chorób nerek, w chorobach nowotworowych i innych stanach klinicznych.
Fibrynogen jest czynnikiem ryzyka choroby niedokrwiennej serca, a jako białko ostrej fazy wzrasta w stanach zapalnych.
Obniżony poziom fibrynogenu pojawia się miedzy innymi we wrodzonych niedoborach fibrynogenu, w chorobach
wątroby, w zespole rozsianego wykrzepiania śródnaczyniowego (DIC) i w skazach fibrynolitycznych.
Główne inhibitory układu krzepnięcia to antytrombina III (AT III) i białko C. Białka
te odgrywają istotną rolę w utrzymaniu równowagi układu krzepnięcia pomiędzy
aktywacją a wytworzeniem skrzepu.
Wrodzony lub nabyty obniżony poziom inhibitorów prowadzi do choroby
zakrzepowej (Rys. 12). AT III i białko C są białkami produkowanymi w wątrobie
i ich poziom może być znacznie obniżony w chorobach tego narządu. Spadek
poziomu tych białek obserwuje się miedzy innymi po zabiegach chirurgicznych,
po krwotokach, w zespole wykrzepiania śródnaczyniowego (DIC) i w innych
sytuacjach klinicznych. Antytrombina III produkowana jest w wątrobie, w śródbłonku
naczyń krwionośnych i w megakariocytach. Główna rola AT III to inaktywacja
czynnika IIa czyli trombiny, a także aktywnych form pozostałych czynników
krzepnięcia oprócz VIIa. Inhibitorowe działanie AT III na trombinę polega na
blokowaniu miejsc aktywnych głównie trombiny i aktywnego czynnika X (czynnika
Xa), a w mniejszym stopniu IXa, XIa, XIIa, kalikreiny i plazminy.
Najpowszechniej stosowanym lekiem u chorych z zakrzepicą żył głębokich lub
zagrożonych zespołem wykrzepiania śródnaczyniowego jest heparyna. Preparaty
heparyny niefrakcjonowanej, w postaci soli sodowej, wapniowej lub magnezowej
są niejednorodne. Lek ten jest mieszaniną cząsteczek o różnej długości łańcucha
cukrowego o ciężarze cząsteczkowym od 2.000 do 40.000 daltonów i mających
różną aktywność biologiczną. Heparyna nie wpływa hamująco na czynniki krzepnię-
cia krwi, ale znacznie przyspiesza inhibitorowe działanie AT III. Przyłączając się
do reszt lizynowych AT III tworzy stechiometryczny kompleks z tym białkiem.
Wówczas dochodzi do zmian konformacyjnych AT III, wskutek czego AT III łatwo
i bardzo szybko blokuje miejsca aktywne trombiny i innych aktywnych czynników krzepnięcia (Rys. 13). Kompleks AT III-
T-Heparyna działa niemal natychmiastowo, a szczyt aktywności biologicznej występuje bezpośrednio po dożylnym
wstrzyknięciu heparyny.
Niski poziom antytrombiny III jest wielkim niebezpieczeństwem dla chorego, ponieważ pozbawia go ochrony
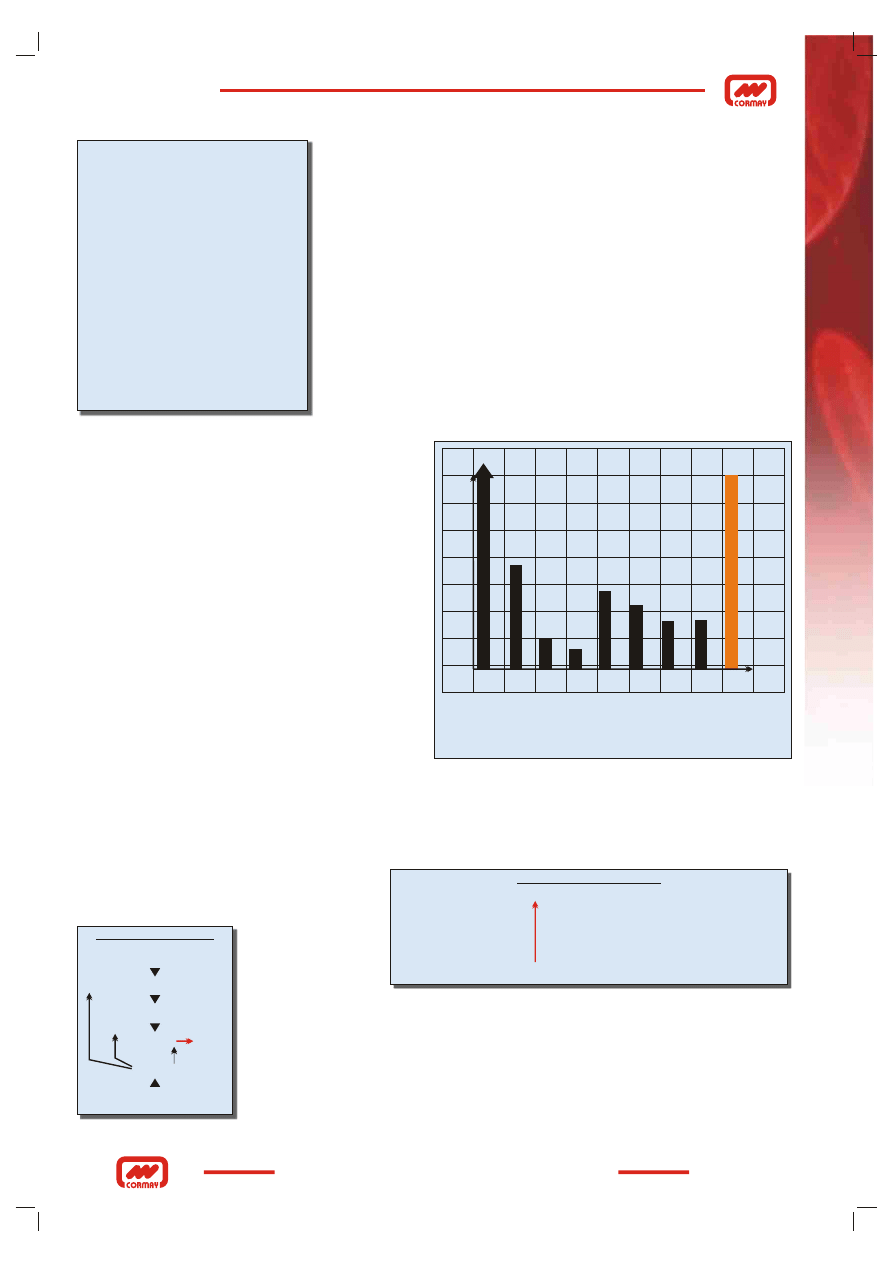
antykoagulacyjnej i dodatkowo uniemożliwia leczenie heparyną. Rys.14 przedstawia minimalny poziom aktywności
czynników krzepnięcia i AT III pozwalający na utrzymanie wystarczającej hemostazy. Z wykresu wynika, że znaczący
spadek aktywności czynników krzepnięcia nie jest tak groźny jak obniżenie aktywności AT III poniżej 70 %. Dane te nie
odnoszą się do złożonych zaburzeń krzepnięcia. Przyczyny nabytej niskiej aktywności AT III to zużycie, zmniejszone
Rys.13
INHIBITORY UKŁADU KRZEPNIĘCIA
AT III
PRODUKOWANA JEST W:
- WĄTROBIE
- ŚRÓDBŁONKU NACZYŃ
- MEGAKARIOCYTACH
ROLA:
INAKTYWUJE WSZYSTKIE AKTYWNE
CZYNNIKI KRZEPNIĘCIA OPRÓCZ VII
GŁÓWNIE TROMBINĘ
[AT III T] [AT III T H]
BIAŁKO C
- PRODUKOWANE JEST W WĄTROBIE
- WIT. K ZALEŻNE
- KOFAKTOR BIAŁKO S
ROLA:
INAKTYWUJE CZYNNIK Va i VIIIa
STYMULUJE UKŁAD
FIBRYNOLITYCZNY
HEPARYNA
1000x
Rys.11
AKTYWACJA
- KOLAGEN
- SZKŁO
- KAOLIN
AKTYWACJA
- TROMBOPLASTYNY
TKANKOWE
XII
XI
IX
VIII+PF-3+Ca VII
X
V
II
TROMBINA (IIa)
FIBRYNOGEN (I)
MONOMERY FIBRYNY
FIBRYNA ROZPUSZCZALNA
FIBRYNA NIEROZPUSZCZALNA
samoistna polimeryzacja
XIII + Ca
TT
F
Rys.12
OBNIŻONY POZIOM INHIBITORÓW
UKŁADU KRZEPNIĘCIA
s
WRODZONY
(CHOROBA ZAKRZEPOWA)
s
NABYTY
- W CHOROBACH WĄTROBY
- PO ZABIEGACH CHIRURGICZNYCH
- DIC -ZESPÓŁ ROZSIANEGO
KRZEPNIĘCIA ŚRÓDNACZYNIOWEGO
Czytelnia
06
Biuletyn informacyjny PZ CORMAY 1 (14) / 2007
wytwarzanie lub utrata inhibitora (Rys. 15).
Do monitorowania leczenia heparyną niefrakcjonowaną najbardziej przydatny
jest czas kaolinowo-kefalinowy (APTT). Terapeutycznemu stężeniu heparyny
we krwi odpowiada 1,5 - 2,5 krotne przedłużenie czasu APTT w porównaniu
do wartości przed leczeniem. Od czwartej doby podawania heparyny może
dojść do spadku liczby trombocytów.
Czas trombinowy przydatny jest tylko przy niskich stężeniach heparyny, przy
wyższych stężeniach staje się nieoznaczalny. Przy równoczesnym podawaniu
choremu heparyny i doustnego antykoagulanta zaleca się oznaczanie czasu
APTT i czasu protrombinowego.
Innym rodzajem preparatów są heparyny drobnocząsteczkowe (hepa-
ryna frakcjonowana). Preparaty te mają wiele zalet w porównaniu z heparyną
niefrakcjonowaną jak dłuższy okres półtrwania, lepszą dostępność biologiczną,
mniejszy wpływ na płytki krwi, mniejsze różnice w oddziaływaniu u poszczegól-
nych osób. Te właściwości pozwalają na stosowanie tylko jednej iniekcji leku
na dobę. Aż 75% cząsteczek heparyny drobnocząsteczkowej ma wysokie
powinowactwo do czynnika Xa , a tylko 25 % cząsteczek tej
heparyny ma zdolność wiązania się z AT III. Badania
kliniczne dowiodły, że pomimo małej aktywności antykoa-
gulacyjnej heparyny drobnocząsteczkowe są tak samo
skuteczne w profilaktyce i leczeniu powikłań zakrzepowo-
zatorowych jak heparyna niefrakcjonowana. W związku
z niską aktywnością antytrombinową, heparyny drobno-
cząsteczkowe w niewielkim stopniu przedłużają czas
APTT i czas trombinowy.
Białko C produkowane jest w wątrobie i jest biał-
kiem witamino-K-zależnym. Trombina (IIa) tworzy komp-
leks z białkiem endotelialnym oraz trombomoduliną i akty-
wuje białko C. Kompleks ten w obecności fosfolipidów
i białka S szybko degraduje czynnik Va i VIIIa.
Układ fibrynolityczny jest systemem wieloskładni-
kowym, w którym proenzym plazminogen pod wpływem
aktywatorów przekształca się w plazminę. Plazminogen
jest glikoproteiną syntetyzowaną w wątrobie z zakoń-
czeniem w postaci kwasu glutaminowego (Glu-PL). Akty-
watory układu fibrynolitycznego jak tkankowy aktywator plazminegenu - t-PA I i t-PA II oraz urokinaza na drodze
ograniczonej proteolizy odszczepiają peptydy od cząsteczki plazminogenu i powodują powstanie 2-łańcuchowej
plazminy. Natomiast inhibitorami aktywatorów t-PA I i t-PA II są PAI-1 i PAI-2. Głównymi inhibitorami przekształcania plaz-
minogenu w plazminę są α2-antyplazmina, α2-makroglobulina, α1-antytrypsyna (Rys. 16).
Układ fibrynolityczny ma za zadanie
rozpuszczanie śródnaczyniowych złogów fibryny.
Przejście nieaktywnego plazminogenu w aktywną
plazminę rozpoczyna
proces fibrynolizy.
Plazmina odszczepia
od cząsteczki fibryno-
genu wczesne frag-
menty X i Y i późne D i E nazywane FDP (produkty degradacji fibrynogenu). FDP oznacza się
w surowicy, ponieważ fragmenty te usytuowane są na zewnątrz cząsteczki fibrynogenu i
mogą być dostępne dla przeciwciał anty-D i anty-E opłaszczonych na cząsteczkach lateksu
(Rys. 17). Niecałkowite wykrzepienie fibrynogenu w badanej próbie powoduje zawyżanie
wyników lub wręcz daje wyniki fałszywie dodatnie.
Stopniowa degradacja fibryny przez plazminę powoduje uwalnianie do krwi cząstek
Rys.14
PRZYCZYNY NABYTEGO NIEDOBORU AT III
ZWIĘKSZONE ZUŻYCIE:
- ZESPÓŁ WYKRZEPIANIA ŚRÓDNACZYNIOWEGO (DIC)
- POSOCZNICA
- WSTRZĄS
- ZESPÓŁ HEMOLITYCZNO-MOCZNICOWY
- STAN PRZEDRZUCAWKOWY
- OPORNOŚĆ NA HEPARYNĘ
- OKRES POOPERACYJNY
- NASILONE ZABURZENIE ZAKRZEPOWO-ZATOROWE
ZMNIEJSZONE WYTWARZANIE:
- CHOROBY WĄTROBY
- TERAPIA L-ASPARGINAZĄ
- OKRES NOWORODKOWY
- WCZEŚNIACTWO
ZWIĘKSZONA UTRATA:
- OPARZENIA
- URAZ WIELONARZĄDOWY
- KRĄŻENIE POZAUSTROJOWE
- ZESPÓŁ NERCZYCOWY
- PLAZMAFEREZA
Rys.15
% prawidłowego poziomu w osoczu
Minimalna aktywność czynników układu krzepnięcia, pozwalająca
na utrzymanie wystarczającej hemostazy.
Dane te nie odnoszą się do złożonych zaburzeń krzepnięcia
70
60
50
40
30
20
10
II V VII VIII IX X XI AT III
Czynniki krzepnięcia inhibitor
Rys.16
UKŁAD FIBRYNOLITYCZNY
INHIBITORY
s
a ANTYPLAZMINA
2
s
a MAKROGLOBULINA
2
s
a ANTYTRYPSYNA
2
s
AT III
PLAZMINA
PLAZMINOGEN
AKTYWATORY
s
UROKINAZA
s
t-PA-I
s
t-PA-II
s
(STREPTOKINAZA)
INHIBITORY
AKTYWATORÓW
s
PAI-I
s
PAI-II
s
DZIAŁANIE PLAZMINY
TROMBINA
FIBRYNOGEN
MONOMERY FIBRYNY
FIBRYNA
PLAZMINA
PLAZMINOGEN
D-dimer
FDP
(X,Y,D,E)
BLOKADA POLIMERYZACJA
Rys.17
Czytelnia
07
Biuletyn informacyjny PZ CORMAY 1 (14) / 2007
Rys.20
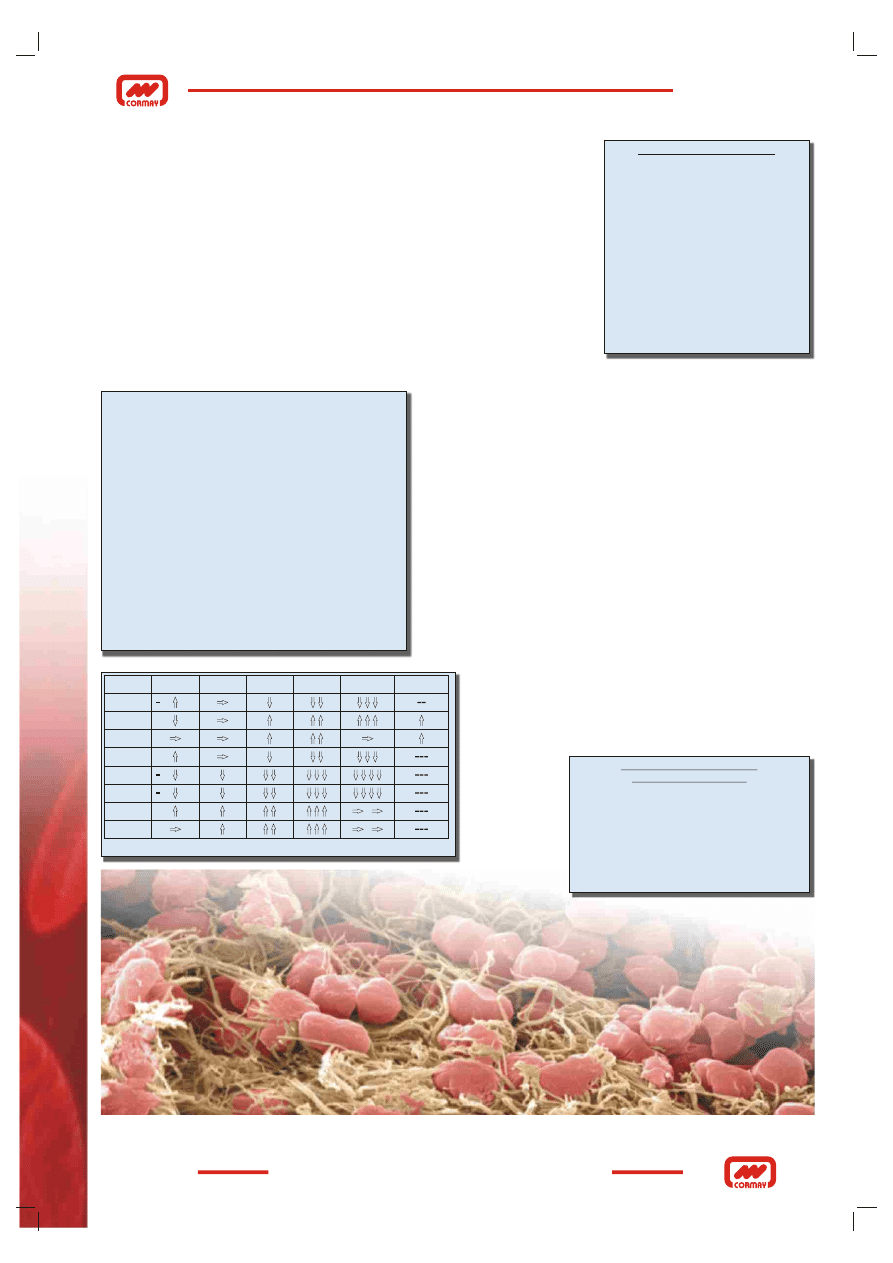
Badanie
DIC I
DIC II
DIC III
DIC IV Koagulopatia HEPARYNA
PT
APTT
TT
F
PŁYTKI
AT II
D-DIMER
FDP
D-Dimer, których poziom oznaczamy w osoczu (Rys. 18).
Badaniami pozwalającymi na wstępną ocenę całego układu fibrynolitycznego
są: czas lizy euglobulin i liza na płytkach fibrynowych. Bardziej szczegółowe
informacje można uzyskać oznaczając poszczególne białka, aktywatory, inhibitory
i inhibitory aktywatorów fibrynolizy jak plazminogen, t-PA, PAI, α2-antyplazminę,
α2-makroglobulinę, D-Dimery czy FDP.
Zespół wykrzepiania śródnaczyniowego (DIC) jest rezultatem zachwiania
równowagi układu krzepnięcia i układu fibrynolitycznego poprzez wzmożoną
aktywację jednego z tych układów w fazie początkowej i silną aktywacją obu
układów w fazie wtórnej. Niezależnie od etiologii (Rys. 19) nasilenie objawów zależy
od stopnia aktywacji całego układu hemostazy. Wyróżnia się umownie cztery etapy
nasilenia zaburzeń prowadzących do najniebezpieczniejszego z nich zwanym
koagulopatią (Rys. 20). Lekiem stosowanym do opanowania wykrzepiania poprzez
wiązanie powstającej trombiny i innych aktywnych czynników
przez AT III jest heparyna, w obecności której silnie wzmaga się
działanie AT III. Heparyna przedłuża czas APTT i czas trombinowy,
ale nie zmienia wyników poziomu fibrynogenu oznaczanego
metodą Claussa, nie ma wpływu na oznaczaną liczbę płytek, na
wyniki D-Dimerów, FDP i oznaczany poziom AT III. Dlatego te
badania odgrywają istotną rolę w monitorowaniu przebiegu i oce-
nie stopnia nasilenia DIC.
Czynniki wpływające na wyniki badań koagulologicznych
przedstawia Rys. 21.
Kontrola jakości w pracowniach koagulologicznych odgrywa
bardzo ważną rolę i powinna dotyczyć całego procesu
analitycznego bez pomijania kontroli przestrzegania zasad
postępowania przedanalitycznego, wykonywania badań, sposobu
formułowania i dostarczania wyniku lekarzowi. Wprowadzenie
kontroli jakości wewnątrzlaboratoryjnej, zewnątrz-
laboratoryjnej ponadto uczestnictwo w krajowej i między-
narodowej kontroli jakości jest sprawdzianem wiarygod-
ności wykonywanych badań.
PRZYCZYNY ZESPOŁU WYKRZEPIANIA WEWNĄTRZNACZYNIOWEGO (DIC)
Różne postacie wstrząsu
(septyczny, urazowy, krwotoczny itd..)
Infekcje
(bakterie Gram dodatnie i Gram ujemne, malaria, choroby wirusowe)
Powikłania położnicze
Przedwczesne odklejanie łożyska, poronienie, zator wodami płodowymi, rzucaw-
ka, ciąża obumarła)
Ciężka hemoliza
(nieprawidłowa transfuzja, zespół hemolityczno-mocznicowy)
Choroby nowotworowe
(prowadzące do przerzutów, zwłaszcza nowotwór płuc, trzustki, gruczołu krokowe-
go, żołądka, jelita grubego; białaczka promielocytarna)
Rozległe zabiegi chirurgiczne
(na płucu, trzustce, gruczole krokowym)
Zaburzenia i anomalie naczyniowe
(zespół Kassabacha-Merritta, tętniak aorty, phlegmasia cerulea dolens)
Rozległe uszkodzenie wątroby
Rys.19
PRODUKTY DEGRADACJI
FIBRYNOGENU
s
FRAGMENTY WCZESNE
X,Y
s
FRAGMENTY PÓŹNE
D,E
OZNACZANIE:
s
W SUROWICY
s
METODA LATEKSOWA Z PRZECIWCIAŁAMI
ANTY D
ANTY E
s
METODY IMMUNOENZYMATYCZNE
FIBRYNY
s
D-DIMERY
OZNACZANIE:
s
W OSOCZU
s
METODA LATEKSOWA Z PRZECIWCIAŁAMI
ANTY D-DIMER
s
METODY IMMUNOENZYMATYCZNE
Rys.18
CZYNNIKI WPŁYWAJĄCE
NA WYNIK BADANIA
s
Pobranie krwi – mikro skrzepy
technika nakłucia żyły, grubość igły,
technika wciągania krwi i mieszania,
zachowanie proporcji antykoagulant / krew,
domieszki heparyny lub innych płynów
s
Czas od pobrania do wykonania badania - spadek aktywności
s
Sposób przechowywania próbek - temperatura
s
Jakość odczynników, aparatury, pipet
s
Złe ustalenie normy, źle wykonane krzywe kalibracyjne
Rys.21
Czytelnia
08
Biuletyn informacyjny PZ CORMAY 1 (14) / 2007
Wyszukiwarka
Podobne podstrony:
krzepniecieWyklad 2007
Krzepniecie Krwii
LEKI WPLYWAJACE NA KRZEPNIECIE I HEMOSTAZE, 000-Nasze Zdrowko, Leki i Witaminy
12 POMIAR CZASU KRZEPNIECIA ODLEWU I PARAMETROW TERMOFIZYCZNYCH FORMY PIASKOWEJ(1)
Kopia wykaz czynników krzepnięcia
LEKI WPŁYWAJĄCE NA KRZEPNIĘCIE 31.03.2011, farmakologia n
Krzepnięcie krwi
Niedobor czynnikow krzepniecia krwi u krow Radwinska(wyklad), Gospodarskie
Krzepnięcie prezentacja cz II
Krzepnięcie, Biochemia
Laboratorium Podstaw Fizyki spr Skalowanie termopary i wyznaczanie temperatury krzepnięcia stopu
Patofizjologia, Nadkrzepliwość występuje w przewlekłych zespołach wewnąt, Nadkrzepliwość występuje
04 - ukl krzepniecia, Biochemia - IV
Krzepnięcie krwi skazy krwotoczne
krzepniecie
krzepnięcie
krzepniecie
więcej podobnych podstron