Postępy Biochemii 59 (2) 2013
219
Małgorzata Uzarska
1,*
Dorota Porowińska
1
Anna Bajek
1
Tomasz Drewa
1,2
1
Zakład
Inżynierii
Tkankowej,
Colle-
gium Medicum im. Ludwika Rydygie-
ra w Bydgoszczy, Uniwersytet Miko-
łaja Kopernika w Toruniu, Bydgoszcz
2
Oddział Urologii Ogólnej i Onkologicznej,
Specjalistyczny Szpitał Miejski im. Mikołaja
Kopernika w Toruniu, Toruń
*
Zakład Inżynierii Tkankowej, Collegium
Medicum im. Ludwika Rydygiera w
Bydgoszczy,
Uniwersytet
Mikołaja
Kopernika w Toruniu, ul. Karłowicza 24,
85-092 Bydgoszcz; tel.: (52) 585 38 23, e-mail:
m.uzarska@wp.pl
Artykuł otrzymano 8 marca 2013 r.
Artykuł zaakceptowano 21 marca 2013 r.
Słowa kluczowe: nabłonkowe komórki ma-
cierzyste, skóra, mieszki włosowe, gruczoły
łojowe
Wykaz skrótów: 3H-Tdr — trytowana tymidy-
na; ASCs — komórki macierzyste organizmów
dorosłych; BMP — białko morfogenetyczne
kości; BrdU — bromodeoksyurydyna; EPU
— naskórkowa jednostka proliferacji; FGF —
czynnik wzrostu fibroblastów; GFP — białko
zielonej fluorescencji; HFSCs — komórki ma-
cierzyste mieszków włosowych; IFE — prze-
dział międzymieszkowy; LRCs — komórki
zatrzymujące znacznik; MAPK — kinaza biał-
kowa aktywowana mitogenami; MCSP — pro-
teoglikan siarczanu chondroityny czerniaka
złośliwego; MSCs — mezenchymalne komór-
ki macierzyste; SGs — gruczoły łojowe; TACs
— komórki dzielące się przejściowo; TGF-β
—transformujący czynnik wzrostu beta; TNF
— czynnik martwicy nowotworów
Komórki macierzyste naskórka — biologia i potencjalne
zastosowanie w medycynie regeneracyjnej
STRESZCZENIE
K
omórki macierzyste uczestniczą w odnowie i regeneracji nabłonków różnych na-
rządów. Największym rezerwuarem nabłonkowych komórek macierzystych w or-
ganizmie jest skóra. Stanowi ona wyspecjalizowaną barierę chroniącą wnętrze ustroju
przed szkodliwym wpływem czynników fizycznych, chemicznych i biologicznych, a
jednocześnie zapewnia odbiór sygnałów pochodzących ze środowiska zewnętrznego.
Skóra uczestniczy również w licznych procesach fizjologicznych warunkujących zacho-
wanie homeostazy. Odnowa i regeneracja naskórka, stanowiącego zewnętrzną warstwę
skóry, możliwa jest dzięki obecności różnych populacji komórek macierzystych rezy-
dujących w mikrośrodowiskach (niszach) tworzących specyficzne warunki umożliwia-
jące zachowanie właściwości tych komórek. Dzięki temu, że komórki w niszy rzadko
ulegają podziałom, możliwe stało się ich odróżnienie od innych szybko proliferujących
komórek skóry. Na tej podstawie zlokalizowano komórki macierzyste w przedziałach
międzymieszkowych, w regionie wybrzuszenia mieszka włosowego, a także w obrębie
gruczołów łojowych. Wykazano ponadto, że mieszki włosowe stanowią niszę dla komó-
rek progenitorowych melanocytów oraz innych komórek macierzystych wywodzących
się z grzebienia nerwowego, jak również mezenchymalnych komórek macierzystych.
Obecność komórek macierzystych charakteryzujących się wysokim potencjałem proli-
feracyjnym i zdolnością do samoodnowy umożliwia zachowanie równowagi naskórka
w warunkach fizjologicznych oraz jego regenerację. Identyfikacja, izolacja i charaktery-
styka nabłonkowych komórek macierzystych konieczna jest do poznania i zrozumienia
podłoża szeregu chorób skóry, opracowania wydajnych metod ich leczenia, jak również
szerszego zastosowania tych komórek w medycynie regeneracyjnej, terapii genowej, czy
kosmetologii.
WPROWADZENIE
Nabłonki tworzą zewnętrzną warstwę skóry i wyściełają liczne narzą-
dy organizmu, tj. przewód pokarmowy, drogi oddechowe czy układ mo-
czowo-płciowy, oddzielając wnętrze ustroju od środowiska zewnętrznego.
Zachowanie homeostazy tej tkanki możliwe jest dzięki obecności multipo-
tencjalnych komórek macierzystych charakteryzujących się zdolnością do
samoodnowy i wysokim potencjałem proliferacyjnym [1]. Największym re-
zerwuarem nabłonkowych komórek macierzystych w organizmie jest skóra,
co czyni ją źródłem komórek o potencjalnym zastosowaniu terapeutycznym.
Szacuje się, że komórki macierzyste naskórka stanowią 1–10% wszystkich ko-
mórek warstwy podstawnej, nie licząc komórek macierzystych rezydujących
w mieszkach włosowych [2,3]. Ze względu na łatwą dostępność i szerokie,
potencjalne możliwości zastosowania w medycynie regeneracyjnej, terapii
genowej i kosmetologii nabłonkowe komórki macierzyste od wielu lat budzą
rosnące zainteresowanie badaczy z różnych dziedzin nauki [4]. Dlatego też
celem niniejszej pracy jest przedstawienie aktualnej wiedzy na temat biologii
komórek macierzystych naskórka i możliwości ich wykorzystania w szeroko
pojętej medycynie.
NASKÓREK JAKO BOGATE ŹRÓDŁO NABŁONKOWYCH
KOMÓREK MACIERZYSTYCH
Skóra jest największym narządem ludzkiego organizmu. Stanowi wielo-
funkcyjną barierę pomiędzy środowiskiem zewnętrznym, a ustrojem, zapew-
niając jednocześnie kontakt z otoczeniem. Umożliwia zachowanie homeosta-
zy poprzez ochronę przed promieniowaniem słonecznym, działaniem kseno-
biotyków oraz patogennych mikroorganizmów, jak również przez udział w
procesach termoregulacji, utrzymaniu równowagi wodno-elektrolitowej oraz
odpowiedzi immunologicznej [5,6]. Naskórek tworzący zewnętrzną warstwę
skóry, zbudowany jest z komórek nabłonkowych pochodzenia ektodermal-
nego, natomiast leżącą poniżej skórę właściwą i tkankę podskórną tworzą
komórki wywodzące się z mezodermy i grzebienia nerwowego. Odnowa tak
odmiennych typów komórek możliwa jest dzięki obecności różnych popula-
220
www.postepybiochemii.pl
cji komórek macierzystych rezydujących w tzw. niszach,
inaczej mikrośrodowiskach, zapewniających zachowanie
specyficznych właściwości tych komórek [7].
Komórki tworzące niszę izolują komórki macierzyste
naskórka przed sygnałami indukującymi różnicowanie,
czynnikami proapoptotycznymi oraz innymi bodźcami,
które mogłyby wpłynąć na ich równowagę. Środowisko
niszy hamuje również nadmierną proliferację, co chro-
ni DNA tych komórek przed uszkodzeniem i zapobiega
inicjacji transformacji nowotworowej [8]. Badania opiera-
jące się na wykorzystaniu cech charakterystycznych dla
komórek macierzystych pozwoliły na wyróżnienie kilku
populacji komórek macierzystych naskórka zlokalizowa-
nych w przedziałach międzymieszkowych (IFE, ang. in-
terfollicular epidermis), w regionie wybrzuszenia mieszka
włosowego (ang. bulge), a także w obrębie gruczołów ło-
jowych [9,10]. Mieszki włosowe stanowią ponadto niszę
dla komórek progenitorowych melanocytów oraz innych
komórek macierzystych wywodzących się z grzebienia
nerwowego [11].
ASyMETRyCZNE PODZIAły KOMóREK
MACIERZySTyCH NASKóRKA
Sugeruje się, że zachowanie stałej liczby komórek ma-
cierzystych naskórka, podobnie jak innych komórek ma-
cierzystych organizmów dorosłych (ASCs, ang. adult stem
cells), możliwe jest dzięki asymetrycznym podziałom
komórkowym, w wyniku których powstaje identyczna
komórka potomna zdolna do samoodnowy oraz komór-
ka progenitorowa, która podlega różnicowaniu podczas
kolejnych podziałów (Ryc. 1) [12]. U myszy opisano dwa
rodzaje podziałów asymetrycznych komórek macierzy-
stych naskórka, które różnią się między sobą orientacją
wrzeciona kariokinetycznego. W naskórku pobranym z
ogonów dorosłych osobników podczas podziału wrze-
ciono położone jest równolegle do błony podstawnej.
Obie komórki potomne pozostają czasowo w obszarze
niszy, po czym jedna z nich ulega oddzieleniu od błony
podstawnej, najprawdopodobniej na skutek działania
zewnątrzkomórkowych sygnałów indukujących zmiany
w syntezie integryn [13]. Podział, podczas którego wrze-
ciono układa się prostopadle do błony podstawnej zaob-
serwowano natomiast w czasie rozwoju zarodkowego
tych organizmów. Prostopadła orientacja wrzeciona ka-
riokinetycznego powoduje, że komórka związana z błoną
podstawną pozostaje w środowisku niszy, natomiast dru-
ga komórka ulega różnicowaniu [14]. Odmienny los ko-
mórek potomnych może być wynikiem oddalenia jednej
z nich od zewnątrzkomórkowych sygnałów warunkują-
cych zachowanie cech charakterystycznych dla komórek
macierzystych lub nierównomiernym rozmieszczeniem
czynników determinujących różnicowanie podczas po-
działu komórki macierzystej [15,16].
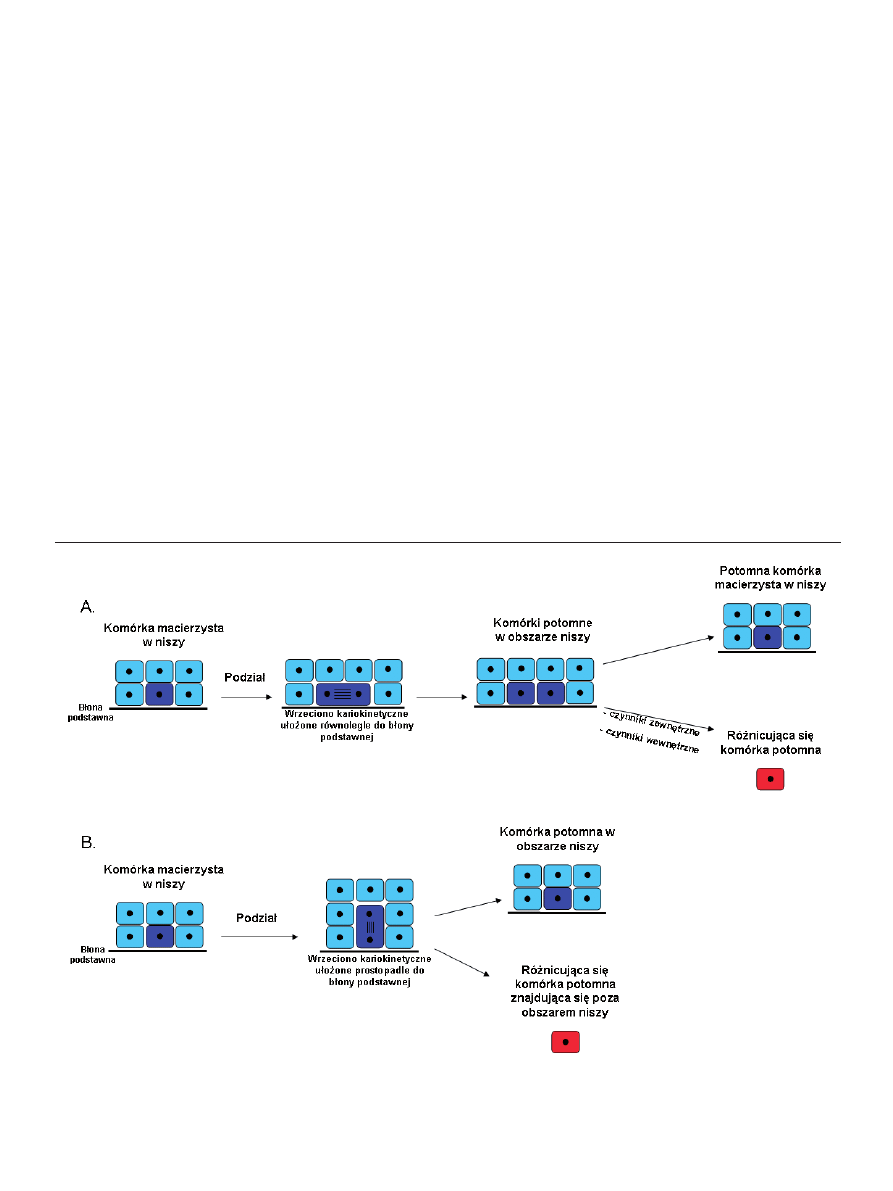
Rycina 1. Asymetryczne podziały komórek macierzystych skóry. (A) Wrzeciono kariokinetyczne położone równolegle do błony podstawnej. Obie komórki potomne
pozostają początkowo w obszarze niszy (kolor ciemnoniebieski), po czym jedna z nich podlega różnicowaniu (kolor czerwony). (B) Wrzeciono kariokinetyczne położone
prostopadle do błony podstawnej. Komórka położona w obszarze niszy pozostaje niezróżnicowana (kolor ciemnoniebieski), natomiast komórka oddalona od sygnałów
warunkujących zachowanie cech unikalnych dla komórek macierzystych, podlega różnicowaniu (kolor czerwony) [15,16].

Postępy Biochemii 59 (2) 2013
221
IDENTyFIKACjA KOMóREK
MACIERZySTyCH NASKóRKA
Komórki macierzyste naskórka charakteryzuje zdolność
do samoodnowy, wydłużony cykl komórkowy z jedno-
czesnym zachowaniem wysokiego potencjału proliferacyj-
nego, aktywacja pod wpływem uszkodzenia bądź innych
sygnałów indukujących podziały komórkowe oraz możli-
wość tworzenia wyspecjalizowanych struktur naskórka [4].
Wykorzystanie specyficznych właściwości nabłonkowych
komórek macierzystych umożliwiło opracowanie metod
pozwalających na ich identyfikację, izolację i charaktery-
stykę. Znakowanie DNA przy użyciu trytowanej tymidyny
(3H-Tdr, ang. tritiated thymidine) lub bromodeoksyurydy-
ny (BrdU, ang. bromodeoxyuridine) pozwala na odróżnienie
komórek szybko proliferujących od wolno dzielących się
komórek macierzystych. Na tej podstawie zidentyfikowa-
no populację tzw. komórek LRCs (ang. label-retaining cells),
które przez dłuższy czas zatrzymują wprowadzony do
DNA znacznik [2,17]. LRCs zaobserwowano także, dzięki
wykorzystaniu metod inżynierii genetycznej umożliwiają-
cych uzyskanie ekspresji genu kodującego białko zielonej
fluorescencji (GFP, ang. green fluorescent protein) w komór-
kach charakteryzujących się wydłużonym cyklem komór-
kowym [18,19] Możliwa jest również analiza potencjału
proliferacyjnego komórek naskórka w hodowli in vitro, po-
przez ocenę właściwości kolonii utworzonych przez wyizo-
lowane komórki. Analiza klonalna pozwala na wyróżnienie
trzech rodzajów klonów — paraklonów, meroklonów oraz
holoklonów. Paraklony zbudowane są z komórek zróżni-
cowanych, o bardzo ograniczonym potencjale proliferacyj-
nym. Tworzą one nieliczne, małe kolonie, których nie udaje
się subklonować. Meroklony powstają z komórek dzielą-
cych się przejściowo, budujących kolonie o nieregularnym
kształcie, z których tylko część komórek może być dalej klo-
nowana. Komórki macierzyste naskórka, charakteryzujące
się wysokim potencjałem proliferacyjnym tworzą natomiast
holoklony, zwarte kolonie o regularnym kształcie, które po
pasażu dają początek takim samym subklonom [20-22].
KOMÓRKI MACIERZYSTE W PRZEDZIAŁACH
MIĘDZYMIESZKOWYCH
Naskórek zbudowany jest z kilku warstw komórek za-
wierających keratynocyty znajdujące się na różnych etapach
zróżnicowania (Ryc. 2). Keratynocyty warstwy podstawnej
tworzą pojedynczy rząd komórek o cylindrycznym kształ-
cie, ułożonych prostopadle do błony podstawnej i ściśle z
nią związanych za pomocą hemidesmosomów. W miarę
dojrzewania keratynocyty przesuwają się ku górnym war-
stwom, aż docierają do warstwy rogowej, gdzie obumiera-
ją i ulegają złuszczeniu [23]. Wytworzenie uwarstwionego
naskórka wymaga współdziałania różnych szlaków sygna-
lizacji wewnątrzkomórkowej. Badania myszy wykazały,
że w procesie tym uczestniczy białko Notch, kinaza MAP
(MAPK, ang. mitogen-activated protein kinase) oraz liczne
czynniki transkrypcyjne, m.in. NF-κB, p63, AP-2, C/EBP,
IRF-6, GRHL3 oraz KLF4 [12]. Kluczowym etapem róż-
nicowania jest przejście komórek z warstwy podstawnej
do kolczystej, czemu towarzyszy zmiana ekspresji genów
kodujących białka strukturalne. W keratynocytach, które
oddzieliły się od błony podstawnej, zahamowaniu ulega
synteza keratyny 5 oraz 14, jednocześnie aktywowane są
geny kodujące keratynę 1 i 10. Komórki warstwy kolczystej
wykazują ponadto syntezę innych białek, które gromadzą
się pod powierzchnią błony komórkowej i uczestniczą w
późnych etapach różnicowania [24]. Dodatkowy wpływ na
różnicowanie keratynocytów mogą wywierać mechanizmy
epigenetyczne, tj. interferencja mikroRNA oraz metylacja
histonów [25].
NASKóRKOWE jEDNOSTKI PROLIFERACjI jAKO
MODEL ORGANIZACjI KOMóREK MACIERZySTyCH
PRZESTRZENI MIęDZyMIESZKOWyCH
Badania naskórka myszy wykazały, że komórki macie-
rzyste przedziałów międzymieszkowych są rozmieszczone
równomiernie w obrębie warstwy podstawnej tworząc licz-
ne, funkcjonalnie niezależne przedziały zwane naskórkowy-
mi jednostkami proliferacji (EPU, ang. epidermal proliferative
units). Zakłada się, że EPU zbudowane są z pojedynczej,
centralnie położonej komórki macierzystej, otoczonej przez
komórki dzielące się przejściowo (TACs, ang. transient am-
plifying cells), zlokalizowane na obrzeżach jednostki oraz z
różnicujących się keratynocytów, które opuszczają jednostkę
kierując się ku górnym warstwom naskórka (Ryc. 2) [26-28].
Taki model organizacji budzi jednak wiele wątpliwości.
Wyniki badań naskórka pochodzącego z ogonów mysich
sugerują, że keratynocyty warstwy podstawnej zdolne są
do podziałów symetrycznych i asymetrycznych, w czasie
których dochodzi do powstania dwóch niezróżnicowanych
komórek potomnych, dwóch komórek podlegających różni-
cowaniu, bądź po jednej z każdego rodzaju. Umożliwiłoby
to zachowanie homeostazy
bez udziału komórek macie-
rzystych w procesie odnowy
nieuszkodzonego naskórka
[29,30]. Badania nad ludzkimi
komórkami macierzystymi
obszarów międzymieszko-
wych są utrudnione ze wzglę-
du na brak możliwości znako-
wania DNA in situ oraz brak
markerów charakterystycz-
nych wyłącznie dla komó-
rek macierzystych naskórka.
Doświadczenia z wykorzy-
staniem skóry pochodzącej z
Rycina 2. Położenie komórek macierzystych w obrębie naskórkowych jednostek proliferacji. (A) Budowa naskórka prze-
strzeni międzymieszkowych. (B) Budowa naskórkowych jednostek proliferacji. Warstwa podstawna naskórka przestrzeni
międzymieszkowych zorganizowana jest w postaci heksagonalnych jednostek obejmujących położoną centralnie komórkę
macierzystą (kolor ciemnoniebieski), komórki dzielące się przejściowo (kolor jasnoniebieski) oraz różnicujące się keratyno-
cyty, które opuszczają jednostkę kierując się ku warstwie rogowej (kolor różowy) [28].
A
B
222
www.postepybiochemii.pl
napletka noworodków pozwoliły na identyfikację komórek
o cechach charakterystycznych dla komórek macierzystych
na szczytach brodawek skórnych [31,32]. Z kolei w naskór-
ku osób dorosłych międzymieszkowe komórki macierzyste
zlokalizowano w wpukleniach błony podstawnej (ang. rete
ridges) [33,34].
MARKERy KOMóREK MACIERZySTyCH
PRZEDZIAłóW MIęDZyMIESZKOWyCH
Identyfikacja komórek macierzystych przedziałów
międzymieszkowych możliwa jest dzięki wykorzystaniu
określonych markerów powierzchniowych i wewnątrzko-
mórkowych. jednym z wyznaczników komórek macierzy-
stych naskórka jest wysoka synteza β1-integryny, gliko-
proteiny przytwierdzającej komórki macierzyste do błony
podstawnej naskórka [31,35,36]. Na powierzchni komórek
macierzystych obserwuje się również zwiększoną syntezę
α6-integryny, równocześnie z niską syntezą keratyny 15 i
receptora transferyny (CD71) [34]. Innym markerem cha-
rakterystycznym dla komórek macierzystych przedziałów
międzymieszkowych jest Lrig1, białko transbłonowe wa-
runkujące zachowanie wolnego tempa proliferacji komórek
macierzystych IFE. Populację komórek wykazujących pro-
dukcję Lrig1 identyfikuje się na wczesnym etapie rozwoju
zarodkowego, w tym samym czasie, w którym następuje
formowanie mieszków włosowych [37].
Do określenia lokalizacji komórek macierzystych prze-
działów międzymieszkowych wykorzystano również
proteoglikan siarczanu chondroityny czerniaka złośli-
wego (MCSP, ang. melanoma-associated chondroitin sulfa-
te proteoglycan), który moduluje dostępność czynników
wzrostowych i adhezję komórek do macierzy zewnątrz-
komórkowej, co najprawdopodobniej wpływa na tworze-
nie skupisk komórek macierzystych w obrębie IFE [32].
Kolejnym potencjalnym markerem komórek macierzy-
stych naskórka może być czynnik transkrypcyjny p63
[38]. Występowanie tego białka nie jest jednak ograni-
czone wyłącznie do komórek macierzystych, co sugeru-
je, że jest ono raczej markerem TACs [39-41]. jako wy-
znacznik komórek macierzystych próbowano również
wykorzystać białka desmosomalne m.in. desmoplakinę
i desmogleinę [33]. Ponadto, komórki o wysokim poten-
cjale proliferacyjnym mają zdolność do usuwania barw-
nika fluorescencyjnego Hoechst 33342, który wiąże się z
DNA na zasadzie interkalacji. Dzięki temu wykazują one
niski poziom fluorescencji, co pozwala na wyróżnienie tej
specyficznej populacji komórek (ang. side population). Ko-
mórki naskórka, które nie wykazują fluorescencji, nie po-
siadają jednak cech komórek macierzystych [42]. Pomimo
intensywnych badań nie udało się do tej pory wyróżnić
markera unikalnego dla komórek macierzystych prze-
działów międzymieszkowych. Z tego względu przydat-
nym narzędziem do identyfikacji komórek macierzystych
naskórka może okazać się badanie ekspresji genów w ko-
mórkach warstwy podstawnej wykazujących właściwo-
ści komórek macierzystych [43].
KOMÓRKI MACIERZYSTE MIESZKÓW WŁOSOWYCH
Mieszki włosowe stanowią integralną część naskórka
człowieka odgrywając istotną rolę w fizjologicznej od-
budowie tej tkanki [44]. Rozwój mieszków włosowych
przypada na 8–12 tydzień rozwoju zarodkowego i zależy
od wzajemnego oddziaływania komórek epidermalnych
i mezenchymalnych. Proces ten kontrolowany jest przez
wiele białek, m.in. Wnt/β-kateninę, Sonic Hedgehog,
transformujący czynnik wzrostu beta (TGF-β, ang. trans-
forming growth factor-β), czynnik wzrostu fibroblastów
(FGF, ang. fibroblast growth factor) oraz czynnik martwicy
nowotworów (TNF, ang. tumor necrosis factor) [45]. Doj-
rzałe mieszki włosowe są strukturami wielowarstwo-
wymi, zbudowanymi z kilku różnych populacji komó-
rek [46]. Każdy mieszek podlega cyklicznym zmianom,
składającym się z trzech etapów: fazy wzrostu (anagen),
fazy przejściowej (katagen) i fazy spoczynku (telogen)
[44,47,48]. W fazie wzrostu ketratynocyty znajdujące się
w macierzy intensywnie proliferują, dając początek róż-
nym liniom komórkowym budującym łodygę oraz we-
wnętrzną osłonkę włosa. Faza przej-
ściowa wiąże się z regresją macierzy
i przesunięciem brodawki włosa ku
górnym warstwom skóry. Prowadzi to
ostatecznie do jego wypadnięcia i za-
początkowania fazy spoczynku, która
trwa dopóki nie nastąpi zainicjowanie
wytworzenia nowej macierzy włosa
[23,49]. Zdolność mieszków włoso-
wych do samoodnawiania swojej po-
pulacji możliwa jest dzięki rezydują-
cym w regionie wybrzuszenia komór-
kom macierzystym (Ryc. 3) [44,47].
MARKERy NABłONKOWyCH
KOMóREK MACIERZySTyCH
MIESZKóW WłOSOWyCH
Badania w zakresie izolacji oraz bio-
logii komórek macierzystych miesz-
ków włosowych trwają już od ponad
20 lat i prowadzone są głównie na mo-
delu mysim i ludzkim [50-52]. Termin
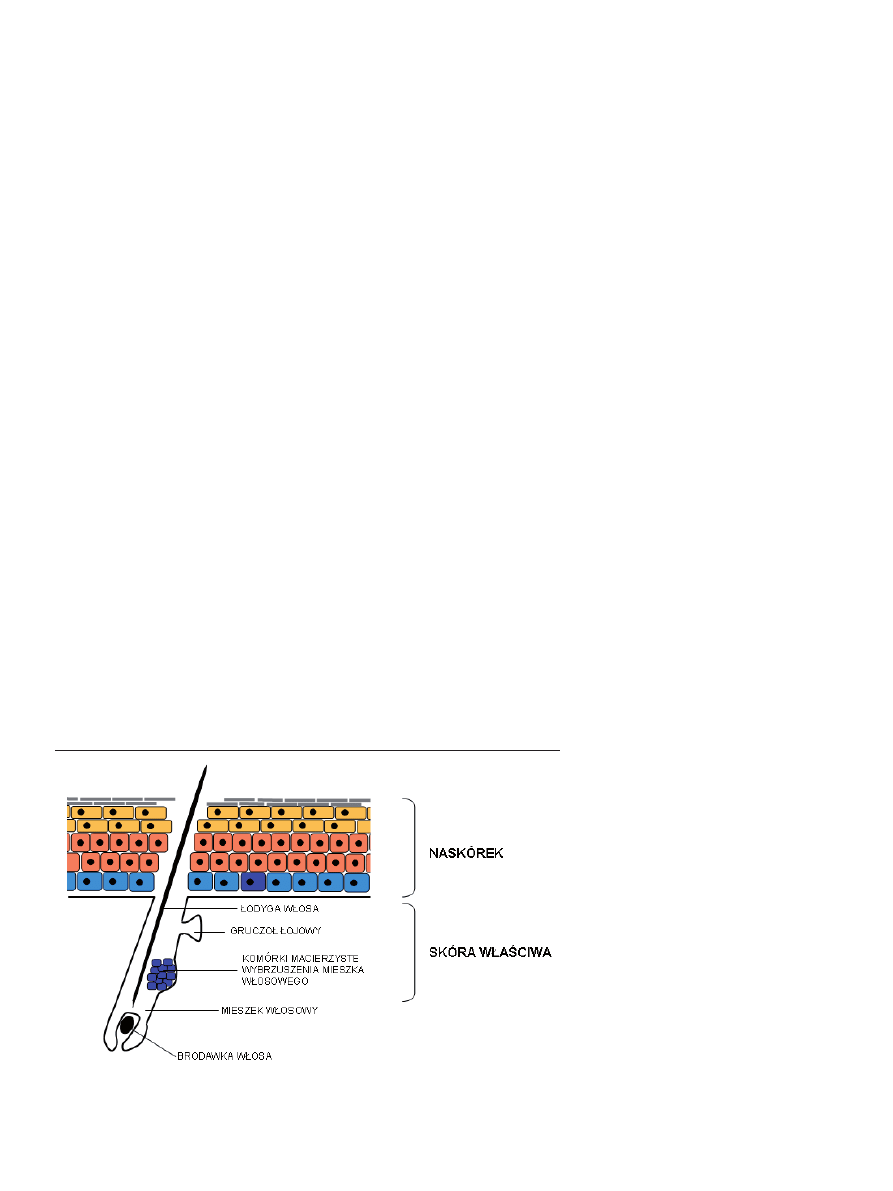
Rycina 3. Budowa mieszka włosowego. Komórki macierzyste rezydujące w obrębie wybrzuszenia mieszka
włosowego oznaczono kolorem ciemnoniebieskim [23].

Postępy Biochemii 59 (2) 2013
223
komórki macierzyste mieszków włosowych (HFSCs, ang.
hair follicle stem cells) najczęściej stosowany jest w odnie-
sieniu do populacji komórek nabłonkowych. Drugą gru-
pę komórek macierzystych mieszków włosowych stano-
wią mezenchymalne komórki macierzyste (MSCs, ang.
mesenchymal stem cells) zlokalizowane w torebce włók-
nistej włosa i jego brodawce oraz komórki o potencjale
zbliżonym do komórek embrionalnych [53-55]. Do tej
pory, pomimo intensywnych badań, nie zidentyfikowano
uniwersalnego i specyficznego markera charakterystycz-
nego dla komórek macierzystych mieszków włosowych.
Dodatkową komplikacją jest duża różnorodność popula-
cji komórek rezydujących w tym obszarze. Najczęściej fe-
notyp HFSCs opisywany jest na podstawie syntezy mar-
kerów wewnątrzkomórkowych, takich jak keratyna 15 i
19, czy białko p53, bądź markerów powierzchniowych —
β1-integryny, α6-integryny, CD34 oraz CD71 [51,56,57].
Fenotyp komórek macierzystych może jednak zmieniać
się w trakcie trwania hodowli w warunkach in vitro. Róż-
nice w zawartości wymienionych markerów mogą być
również spowodowane odmiennymi metodami izolacji
mieszków włosowych, w zależności od gatunku. Do spe-
cyficznych markerów HFSCs myszy i szczurów należą
keratyna 15, białko p63, β1-integryna, α6-integryna, oraz
CD34 [10,51,58-60]. Z kolei do powszechnie stosowanych
markerów ludzkich nabłonkowych komórek macierzy-
stych mieszków włosowych należą keratyna 15 i 19, p63,
β-katenina, folistatyna, α6-integryna, PHLDA1, CD200,
CD271 oraz czynniki transkrypcyjne Oct-4, Nanog i Pax3
[56,61-63].
Izolowanie komórek macierzystych mieszków wło-
sowych nastręcza wiele trudności, m.in. z powodu nie-
wielkich rozmiarów mieszków. W związku z tym zapro-
ponowano zastosowanie cytometrii przepływowej do
sortowania i izolacji komórek macierzystych z regionu
wybrzuszenia. Na podstawie przeprowadzonych badań
Ohyama scharakteryzował ludzkie komórki macierzyste
mieszków włosowych jako CD200+, CD24-, CD34-, CD71-
i CD146-. Obecnie uważa się, iż markerem powierzch-
niowym najlepiej opisującym ludzkie HFSCs jest CD200
[64]. Coraz częściej jednak przedstawiane są wyniki, w
których do identyfikacji komórek macierzystych miesz-
ków włosowych stosuje się markery inne, niż te używane
dotychczas. Sugeruje to istnienie wielu różnych populacji
nabłonkowych komórek macierzystych w obrębie miesz-
ków włosowych, przy czym nadal nie wiadomo, która z
tych populacji ma największe zdolności do różnicowania
i proliferacji [60,61].
MIESZKI WłOSOWE źRóDłEM
KOMóREK MACIERZySTyCH
Lokalizacja niszy komórek macierzystych w miesz-
ku włosowym przez długi czas pozostawała nieznana,
przede wszystkim dlatego, iż w niszy komórki pozostają
niemal nieaktywne mitotycznie. Obecność komórek ma-
cierzystych w obrębie wybrzuszenia mieszka włosowego
po raz pierwszy została potwierdzona przez Cotsarelis i
wsp. [2]. Od tego momentu wiele grup badawczych po-
czyniło podobne obserwacje, zarówno w odniesieniu do
mieszków włosowych człowieka, jak i tych pochodzą-
cych od gryzoni. Mieszki włosowe, będąc siedliskiem
różnych populacji komórek macierzystych, stanowią
obiecujące źródło ASCs zdolnych do wielokierunkowe-
go różnicowania i odpowiedzialnych za regenerację wło-
sów, gruczołów łojowych, czy naskórka [53,65,66]. Zaletą
mieszków włosowych jest możliwość mało inwazyjne-
go sposobu pobierania materiału do izolacji, co stwarza
możliwość wykorzystania mieszków jako alternatywne-
go źródła komórek macierzystych w dorosłym organi-
zmie [44,64,67,68].
KOMÓKI MACIERZYSTE GRUCZOŁÓW ŁOJOWYCH
Gruczoły łojowe (SGs, ang. sebaceous glands) powstają
podczas rozwoju zarodkowego jako wyrostki zlokalizo-
wane w górnej części mieszka włosowego, ponad regio-
nem wybrzuszenia. Odpowiadają za produkcję dojrza-
łych sebocytów (komórek łojowych), które na zasadzie
wydzielania holokrynowego uwalniają łój do torebki
mieszka włosowego [7,24]. Za utrzymanie homeostazy
gruczołów łojowych odpowiedzialne są aktywne mito-
tycznie komórki progenitorowe, zlokalizowane w war-
stwie podstawnej znajdującej się na obrzeżach tych struk-
tur. Stanowią one rezerwuar komórek umożliwiających
odnowę tkanki podczas normalnych cykli wzrostu wło-
sów [69]. Powstające w wyniku podziałów komórki po-
tomne kierowane są do centrum gruczołu, gdzie przestają
się dzielić i zaczynają różnicować w kierunku sebocytów,
które ostatecznie ulegają lizie w kanale łojowym [70]. Ko-
mórki macierzyste SGs są najsłabiej scharakteryzowane
spośród wszystkich populacji komórek macierzystych
naskórka.
W komórkach macierzystych gruczołów łojowych
stwierdzono obecność czynnika transkrypcyjnego Blimp1,
który został sklasyfikowany jako marker tych komórek
[71]. Gen kodujący ten czynnik nie ulega jednak selektyw-
nej ekspresji tylko w komórkach progenitorowych gru-
czołów łojowych, lecz również w komórkach mieszków
włosowych i przedziałów międzymieszkowych [70,72].
Blimp1 działając jako transkrypcyjny represor czynnika
c-Myc, hamuje podziały komórek i ich różnicowanie w
kierunku sebocytów [71]. Brak Blimp1 powoduje wzrost
zawartości c-Myc, co prowadzi do nadmiernej proliferacji
komórek macierzystych i hiperplazji gruczołów łojowych.
Blimp1 jest więc odpowiedzialny za utrzymanie komórek
macierzystych SGs w stanie niezróżnicowanym. Funkcję
taką odgrywa również czynnik Rac1, którego utrata sty-
muluje różnicowanie komórek macierzystych gruczołów
łojowych w sebocyty, uniemożliwiając utrzymanie home-
ostazy tych struktur [73,74]. Dodatkowym markerem ko-
mórek macierzystych SGs może być keratyna 15, jednak
nie wiadomo, czy jest to ta sama populacja komórek, w
której obserwuje się syntezę czynnika Blimp1 [75].
Sugeruje się, że komórki macierzyste gruczołów łojo-
wych mogą w odpowiednich warunkach różnicować się
w różne rodzaje komórek nabłonkowych rezydujących
w naskórku [76]. Wykazano, że u myszy o obniżonej od-
porności (ang. nude mice), formowały one gruczoły łojowe
oraz komórki przestrzeni międzymieszkowej, ale nie two-
rzyły mieszków włosowych [70]. Nie można jednak wy-
kluczyć, że poddane dodatkowej stymulacji mogłyby róż-

224
www.postepybiochemii.pl
nicować się również w komórki tworzące mieszki włoso-
we. Aktywacja β-kateniny w dojrzałych komórkach skóry
powoduje tworzenie mieszków włosowych z istniejących
gruczołów łojowych sugerując, że komórki macierzyste
występujące w obrębie tych struktur zdolne są do prze-
różnicowania, które umożliwia powstawanie wszystkich
rodzajów komórek mieszków włosowych [77].
HIERARCHIA KOMÓREK
MACIERZYSTYCH NASKÓRKA
Komórki macierzyste zlokalizowane w przedziałach mię-
dzymieszkowych mają mniejszą zdolność do samoodnowy
i różnicowania w porównaniu do komórek rezydujących
w obrębie wybrzuszenia mieszka włosowego. Charaktery-
zują się również niższym potencjałem proliferacyjnym w
hodowli in vitro [4]. Wykazano ponadto, że urazy w obrę-
bie przedziałów międzymieszkowych, które nie naruszają
struktury mieszka włosowego mogą zostać odbudowane,
natomiast uszkodzenie mieszków uniemożliwia regenera-
cję naskórka [78]. Co więcej, komórki mieszków włosowych
mogą dać początek wszystkim liniom komórek naskórka,
łącznie z komórkami przestrzeni międzymieszkowych [65].
Sugeruje to, że komórki macierzyste znajdujące się w wy-
brzuszeniu mieszków włosowych opuszczają swoją niszę i
zasiedlają inne obszary skóry, dając początek populacjom
komórek macierzystych przestrzeni międzymieszkowych i
gruczołów łojowych [79].
Nabycie i utrzymanie multipotencjalnych właściwości
komórek macierzystych mieszka włosowego wiąże się z
aktywacją szlaku sygnałowego Wnt/β-katenina. Inicja-
cja tworzenia mieszków włosowych następuje na skutek
oddziaływania pomiędzy komórkami epidermalnymi i
mezenchymalnymi podczas rozwoju zarodkowego. Ak-
tywacja szlaku Wnt/β-katenina w komórkach epidermal-
nych i jednoczesne zahamowanie szlaku białka morfoge-
netycznego kości (BMP, ang. bone morphogenetic protein)
przez mezenchymalne komórki macierzyste powoduje
syntezę czynnika transkrypcyjnego Lef1, co związane
jest z inicjacją tworzenia włosów [80]. Wykształceniu za-
wiązków włosa towarzyszy pojawienie się komórek wy-
kazujących koekspresję markerów NFATc1 i Sox9, cha-
rakterystycznych dla komórek macierzystych mieszków
włosowych oraz Lrig1, typowego dla komórek macierzy-
stych przestrzeni międzymieszkowych i gruczołów łojo-
wych. W dalszych etapach, w komórkach wykazujących
obecność Lrig1, zahamowana zostaje synteza NFATc1 i
Sox9. Komórki te tworzą najprawdopodobniej popula-
cję komórek macierzystych IFE i SGs w naskórku doro-
słych organizmów. Sugeruje to, że komórki macierzyste
mieszków włosowych, przestrzeni międzymieszkowych
i gruczołów łojowych powstają z jednej multipotencjalnej
komórki macierzystej [10].
Z kolei analiza klonalna wykazała, że komórki miesz-
ków włosowych nie uczestniczą w odbudowie uszkodzo-
nych przestrzeni międzymieszkowych [81]. Nie obserwuje
się również zaburzenia struktury IFE u myszy poddanych
ablacji komórek rejonu wybrzuszenia mieszka włosowego
[66]. Ponadto, poprzez zmianę szlaków sygnalizacji we-
wnątrzkomórkowej możliwe jest nadanie komórkom ma-
cierzystym przedziałów międzymieszkowych cech charak-
terystycznych dla komórek mieszka włosowego, takich jak
zdolność do tworzenia włosów [77]. jednoznaczne określe-
nie pochodzenia różnych populacji komórek macierzystych
naskórka oraz ich udziału w procesach regeneracji wymaga
identyfikacji specyficznego markera pozwalającego na wy-
różnienie określonej populacji komórek, spośród innych ko-
mórek macierzystych skóry.
PERSPEKTY ZASTOSOWANIA KOMÓREK
MACIERZYSTYCH SKÓRY W KLINICE
GOjENIE RAN, OPARZEń I OWRZODZEń SKóRy
Identyfikacja komórek macierzystych skóry umożli-
wia prowadzenie badań nad biologią, właściwościami i
zachowaniem tych komórek. Dokładna charakterystyka
komórek macierzystych naskórka ma istotne znaczenie w
zrozumieniu podłoża wrodzonych oraz nabytych chorób
skóry oraz procesów nowotworowych zachodzących w
obrębie tej tkanki. Może także posłużyć do opracowania
wydajnych metod leczenia schorzeń zaburzających struk-
turę i funkcję skóry. Kertynocyty i komórki macierzyste
naskórka pobrane od pacjenta i hodowane in vitro znajdują
zastosowanie w medycynie regeneracyjnej, do uzyskania
substytutów skórnych wspomagających gojenie ran, rozle-
głych oparzeń i owrzodzeń [82,83]. Obecnie najpowszech-
niejszym sposobem leczenia tego rodzaju uszkodzeń jest
autologiczny przeszczep skóry pobranej z niezmienionego
miejsca. Transplantacja może być jednak przeprowadzona
na ograniczonym obszarze i prowadzi do powstania dodat-
kowych ran w miejscu pobrania tkanki do przeszczepu. Z
kolei zastosowanie substytutów wytworzonych in vitro, po-
zwala na regenerację dużych uszkodzeń z wykorzystaniem
komórek uzyskanych z niewielkich fragmentów zdrowej
skóry pacjenta [84]. Obecność w hodowli szybko proliferu-
jących komórek macierzystych umożliwia uzyskanie dużej
liczby komórek i jednocześnie chroni przed odrzuceniem
przeszczepu [85]. Ponadto zastosowanie matryc z włókni-
ka pobudza proliferację keratynocytów, ułatwia przyjęcie
przeszczepionych komórek i przyspiesza gojenie rany [86].
Ograniczeniem tej metody jest jednak czas potrzebny do na-
mnożenia keratynocytów in vitro, podczas którego pacjent
narażony jest na infekcje, a także wysoki koszt leczenia [84].
REGENERACjA NARZąDóW I TERAPIA GENOWA
Niezwykle obiecujące wyniki uzyskano podczas badań
prowadzonych na komórkach macierzystych mieszków
włosowych. Przeprowadzone do tej pory doświadczenia
potwierdziły ich duży potencjał do różnicowania. Udo-
wodniono, że komórki pochodzące z regionu wybrzusze-
nia i z brodawki włosa mają zdolność do różnicowania w
neurony i komórki glejowe, dzięki czemu w przyszłości
mogą zostać wykorzystane w leczeniu schorzeń układu
nerwowego [87,88]. Ponadto, komórki macierzyste miesz-
ków włosowych ulegają różnicowaniu w komórki wykazu-
jące obecność markerów charakterystycznych dla nabłonka
wyściełającego drogi moczowe, co sugeruje ich potencjalne
wykorzystanie w regeneracji pęcherza moczowego [89-91].
Wydaje się, że komórki mieszków włosowych mogą także
posłużyć do rekonstrukcji tkanek budujących oko. Istnieją

Postępy Biochemii 59 (2) 2013
225
bowiem dowody na udane próby przeróżnicowania ko-
mórek macierzystych mieszków włosowych w nabłonek
rogówki [92]. Identyfikacja macierzystych komórek hema-
topoetycznych w obrębie brodawki włosa niesie za sobą
możliwość ich zastosowania w leczeniu chorób układu
krwiotwórczego [93]. Sugeruje się również wykorzystanie
komórek macierzystych regionu wybrzuszenia w terapii
łysienia, do odtworzenia utraconych mieszków włosowych
[94]. Charakterystyka komórek macierzystych melanocy-
tów rezydujących w obszarze mieszka włosowego może na-
tomiast dostarczyć wskazówek, które pomogą zapobiegać
siwieniu włosów [95].
Wyhodowane w warunkach laboratoryjnych i zmodyfi-
kowane komórki macierzyste skóry mogą zostać wykorzy-
stane w terapii genowej jako nośnik prawidłowej informacji
genetycznej [4]. Wprowadzenie nowych genów do komórek
macierzystych i ich późniejsza transplantacja stanowi atrak-
cyjną alternatywę w terapii wrodzonych chorób zaburzają-
cych strukturę włosów, do których należy dysplazja ekto-
dermalna, włosy paciorkowate (monilethrix), zespół Nether-
tona, czy zespół Menkesa, a także innych dermatoz m.in.
pęcherzowego oddzielania się naskórka [7]. Przeszczepie-
nie genetycznie zmodyfikowanych komórek, nie wykazu-
jących defektów wywołujących objawy chorobowe, umoż-
liwiałyby odtworzenie zdrowej tkanki. Tego typu leczenie
zostało z powodzeniem zastosowane u pacjentów chorych
na pęcherzowe oddzielanie się naskórka, wywołane muta-
cją w genie kodującym lamininę 5 [96].
PODSUMOWANIE
W warunkach homeostazy komórki macierzyste naskór-
ka rezydujące w przedziałach międzymieszkowych, miesz-
kach włosowych oraz w obrębie gruczołów łojowych, dają
początek unipotencjalnym komórkom progenitorowym
uczestniczącym w odnowie tych specyficznych struktur.
Uszkodzenie tkanki prowadzi do aktywacji komórek ma-
cierzystych i ich różnicowania w kierunku różnych linii, co
pozwala na szybką regenerację skóry. Możliwość izolacji i
hodowli komórek macierzystych w warunkach in vitro, poza
mikrośrodowiskiem niszy, stwarza perspektywy ich szero-
kiego zastosowania w klinice. Dzięki zdolności komórek
macierzystych do odtworzenia swoich multipotencjalnych
właściwości po transplantacji sugeruje się ich wykorzysta-
nie w terapii nabytych i wrodzonych schorzeń skóry, me-
dycynie regeneracyjnej oraz w terapii genowej. Charaktery-
styka i ocena potencjalnego zastosowania komórek macie-
rzystych wymaga jednak określenia specyficznego dla tych
komórek markera. Konieczne jest także poznanie wpływu
środowiska niszy na aktywność mitotyczną, zdolność do sa-
moodnowy i różnicowania komórek macierzystych, a także
możliwość różnicowania komórek macierzystych skóry w
komórki innych linii niż keratynocty.
PIŚMIENNICTWO
1. Van Keymeulen A, Blanpain C (2012) Tracing epithelial stem cells du-
ring development, homeostasis, and repair. j Cell Biol 197: 575-584
2. Cotsarelis G, Sun TT, Lavker RM (1990) Label-retaining cells reside in
the bulge area of pilosebaceous unit: implications for follicular stem
cells, hair cycle, and skin carcinogenesis. Cell 61: 1329-1337
3. Tani H, Morris Rj, Kaur P (2000) Enrichment for murine keratinocyte
stem cells based on cell surface phenotype. Proc Natl Acad Sci USA
97: 10960-10965
4. Barthel R, Aberdam D (2005) Epidermal stem cells. j Eur Acad Derma-
tol Venereol 19: 405-413
5. Proksch E, Brandner jM, jensen jM (2008) The skin: an indispensable
barrier. Exp Dermatol 17: 1063-1072
6. Baroni A, Buommino E, De Gregorio V, Ruocco E, Ruocco V, Wolf R
(2012) Structure and function of the epidermis related to barrier pro-
perties. Clin Dermatol 30: 257-262
7. Abbas O, Mahalingam M (2009) Epidermal stem cells: practical per-
spectives and potential uses. Br j Dermatol 61: 228-236
8. Moore KA, Lemischka IR (2006) Stem cells and their niches. Science
311: 1880-1885
9. Blanpain C, Fuchs E (2006) Epidermal stem cells of the skin. Annu Rev
Cell Dev Biol 22: 339-373
10. Watt FM, jensen KB (2009) Epidermal stem cell diversity and quie-
scence. EMBO Mol Med 1: 260-267
11. Sieber-Blum M, Grim M, Hu yF, Szeder V (2004) Pluripotent neural
crest stem cells in the adult hair follicle. Dev Dyn 231: 258-269
12. Blanpain C, Fuchs E (2009) Epidermal homeostasis: a balancing act of
stem cells in the skin. Nat Rev Mol Cell Biol 10: 207-217
13. Clayton E, Doupé DP, Klein AM, Winton Dj, Simons BD, jones PH
(2007) A single type of progenitor cell maintains normal epidermis.
Nature 446: 185-189
14. Lechler T, Fuchs E (2005) Asymmetric cell divisions promote strati-
fication and differentiation of mammalian skin. Nature 437: 275-280
15. Ray S, Lechler T (2011) Regulation of asymmetric cell division in the
epidermis. Cell Div 6: 12
16. Poulson ND, Lechler T (2012) Asymmetric cell divisions in the epider-
mis. Int Rev Cell Mol Biol 295: 199-232
17. Morris Rj, Potten CS (1999) Highly persistent label-retaining cells in
the hair follicles of mice and their fate following induction of anagen. j
Invest Dermatol 112: 470-475
18. Tumbar T, Guasch G, Greco V, Blanpain C, Lowry WE, Rendl M,
Fuchs E (2004) Defining the epithelial stem cell niche in skin. Science
303: 359-363
19. Morris Rj, Liu y, Marles L, yang Z, Trempus C, Li S, Lin jS, Sawicki
jA, Cotsarelis G (2004) Capturing and profiling adult hair follicle stem
cells. Nat Biotechnol 22: 411-417
20. Barrandon y, Green H (1987) Three clonal types of keratinocyte with
different capacities for multiplication. Proc Natl Acad Sci USA 84:
2302-2306
21. Rochat A, Kobayashi K, Barrandon y (1994) Location of stem cells of
human hair follicles by clonal analysis. Cell 76: 1063-1073
22. Papini S, Cecchetti D, Campani D, Fitzgerald W, Grivel jC, Chen S,
Margolis L, Revoltella RP (2003) Isolation and clonal analysis of hu-
man epidermal keratinocyte stem cells in long-term culture. Stem
Cells 21: 481-494
23. Braun KM, Prowse DM (2006) Distinctepidermal stem cell compart-
ments are maintained by independent niche microenvironments.
Stem Cell Rev 2: 221-231
24. Fuchs E, Nowak jA (2008) Building Epithelial Tissues from Skin Stem
Cells. Cold Spring Harb Symp Quant Biol 73: 333-350
25. Beck B, Blanpain C (2012) Mechanisms regulating epidermal stem
cells. EMBO j 31: 2067-2075
26. Mackenzie IC (1970) Relationship between mitosis and the ordered
structure of the stratum corneum in mouse epidermis. Nature 226:
653-655
27. Potten CS (1974) The epidermal proliferative unit: the possible role of
the central basal cell. Cell Tissue Kinet 7: 77-88
28. Kaur P (2006) Interfollicular epidermal stem cells: identification, chal-
lenges, potential. j Invest Dermatol 126: 1450-1458

226
www.postepybiochemii.pl
29. Clayton E, Doupé DP, Klein AM, Winton Dj, Simons BD, jones PH
(2007) A single type of progenitor cell maintains normal epidermis.
Nature 446: 185-189
30. jones PH, Simons BD, Watt FM (2007) Sic transit gloria: farewell to the
epidermal transit amplifying cell? Cell Stem Cell 1: 371-381
31. jensen UB, Lowell S, Watt FM (1999) The spatial relationship between
stem cells and their progeny in the basal layer of human epidermis: a
new view based on whole-mount labelling and lineage analysis. De-
velopment 126: 2409-2418
32. Legg j, jensen UB, Broad S, Leigh I, Watt FM (2003) Role of melanoma
chondroitin sulphate proteoglycan in patterning stem cells in human
interfollicular epidermis. Development 130: 6049-6063
33. Wan H, Stone MG, Simpson C, Reynolds LE, Marshall jF, Hart IR,
Hodivala-Dilke KM, Eady RA (2003) Desmosomal proteins, including
desmoglein 3, serve as novel negative markers for epidermal stemcell-
-containing population of keratinocytes. j Cell Sci 116: 4239-4248
34. Webb A, Li A, Kaur P (2004) Location and phenotype of human adult
keratinocyte stem cells of the skin. Differentiation 72: 387-395
35. jones PH, Watt FM (1993) Separation of human epidermal stem cells
from transit amplifying cells on the basis of differences in integrin
function and expression. Cell 73: 713-724
36. jones PH, Harper S, Watt FM (1995) Stem cell patterning and fate in
human epidermis. Cell 80: 83-93
37. jensen KB, Collins CA, Nascimento E, Tan DW, Frye M, Itami S, Watt
FM (2009) Lrig1 expression defines a distinct multipotent stem cell po-
pulation in mammalian epidermis. Cell Stem Cell 4: 427-439
38. Pellegrini G, Dellambra E, Golisano O, Martinelli E, Fantozzi I, Bon-
danza S, Ponzin D, McKeon F, De Luca M (2001) p63 identifies kerati-
nocyte stem cells. Proc Natl Acad Sci USA 98: 3156-3161
39. Parsa R, yang A, McKeon F, Green H (1999) Association of p63 with
proliferative potential in normal and neoplastic human keratinocytes.
j Invest Dermatol 113: 1099-1105
40. Reis-Filho jS, Torio B, Albergaria A, Schmitt FC (2002) p63 expression
in normal skin and usual cutaneous carcinomas. j Cutan Pathol 29:
517-523
41. Tsujita-Kyutoku M, Kiuchi K, Danbara N, yuri T, Senzaki H, Tsubura
A (2003) p63 expression in normal human epidermis and epidermal
appendages and their tumors. j Cutan Pathol 30: 11-17
42. Triel C, Vestergaard ME, Bolund L, jensen TG, jensen UB (2004) Side
population cells in human and mouse epidermis lack stem cell charac-
teristics. Exp Cell Res 295: 79-90
43. Tumbar T, Guasch G, Greco V, Blanpain C, Lowry WE, Rendl M,
Fuchs E (2004) Defining the epithelial stem cell niche in skin. Science
303: 359-363
44. jaks V, Kasper M, Toftgard R (2010) The hair follicle-a stem cell zoo.
Exp Cell Res 316: 1422-1428
45. Huelsken j, Vogel R, Erdmann B, Gotsarelis G, Birchmeier W (2001)
Beta-catenin controls hair follicle morphogenesis and stem cell diffe-
rentiation in skin. Cell 105: 533-545
46. Myung P, Andl T, Ito M (2009) Defining the hair follicle stem cell (Part
I). j Cutan Pathol 36: 1031-1034
47. Oh jH, Mohebi P, Farkas DL, Tajbakhsh j (2011) Towards expansion of
human hair follicle stem cells in vitro. Cell Prolif 44: 244-253
48. Wosicka H, Cal K (2010) Targeting to the hair follicles: Current status
and potential. j Dermatol Sci 57: 83-89
49. Schneider MR, Schmidt-Ullrich R, Paus R (2009) The hair follicle as a
dynamic mini organ. Curr Biol 19: 132-142
50. Taylor G, Lehrer MS, jensen Pj, Sun TT, Lavker RM (2000) Involve-
ment of follicular stem cells in forming not only the follicle but also the
epidermis. Cell 102: 451-461
51. Zhou j, jia L, yang y, Peng S, Cao y, Duan E (2004) Enrichment and
characterization of mouse putative epidermal stem cells. Cell Biol Int
28: 523-529
52. Klima j, Smetana K, Motlik j, Plzakova Z, Liu FT, Stork j, Kaltner H,
Chovanec M, Dvorankova B, Andre S, Gabius Hj (2005) Comparative
phenotypic characterization of keratinocytes originating from hair fol-
licles. j Mol Histol 36: 89-96
53. Richardson GD, Arnott EC, Whitehouse Cj, Lawrence CM, Reynolds
Aj, Hole N, jahoda CA (2005) Plasticity of rodent and human hair fol-
licle dermal cells: implications for cell therapy and tissue engineering.
j Investig Dermatol Symp Proc. 10: 180-183
54. Mignone jL, Roig-Lopez jL, Fedtsova N, Schones DE, Manganas LN,
Maletic-Savatic M, Keyes WM, Mills AA, Gleiberman A, Zhang MQ,
Enikolopov G (2007) Neural potential of a stem cell population in the
hair follicle. Cell Cycle 6: 2161-2170
55. Tiede S, Kloepper jE, Bodo E, Tiwari S, Kruse C, Paus R (2007) Hair
follicle stem cells: walking the maze. Eur j Cell Biol 86: 355-376
56. Kloepper jE, Tiede S, Brinckmann j, Reinhardt DP, Meyer W, Faessler
R, Paus R (2008) Immunophenotyping of the human bulge region: the
quest to define useful in situ markers for human epithelial hair follicle
stem cells and their niche. Exp Dermatol 17: 592-609
57. Kobayashi T, Shimizu A, Nishifuji K, Amagai M, Iwasaki T, Ohyama
M (2009) Canine hair follicle keratinocytes enriched with bulge cells
have the highly proliferative characteristics of stem cells. Veterinary
Deramtology 20: 338-346
58. Trempus CS, Morris Rj, Bortner CD, Cotsarelis G, Faircloth RS, Reece
jM, Tennant RW (2003) Enrichment for living murine keratinocytes
from the hair follicle bulge with the cell surface marker CD34. j Invest
Dermatol 120: 501-511
59. Blanpain C, Lowry WE, Geoghegan A, Polak L, Fuchs E (2004) Self-re-
newal, multipotency, and the existence of two cell populations within
an epithelial stem cell niche. Cell 118: 635-648
60. jensen UB, yan X, Triel C, Woo SH, Christensen R, Owens DM (2008)
A distinct population of clonogenic and multipotent murine follicular
keratinocytes residing in the upper isthmus. j Cell Sci 121: 609-617
61. yu H, Fang D, Kumar SM, Li L, Nguyen TK, Acs G, Herlyn M, Xu X
(2006) Isolation of a novel population of multipotent adult stem cells
from human hair follicles. Am j Pathol 168: 1879-1888
62. Huang E, Lian X, yang T, Chen W, yang L, yang T (2009) Characteri-
zation of rat hair follicle stem cells selected by vario magnetic activated
cell sorting system. Acta Histochem Cytochem 42: 129-136
63. Inoue K, Aoi N, Sato T, yamauchi y, Suga H, Eto H, Kato H, Araki
j, yoshimura K (2009) Differential expression of stem-cell-associated
markers in human hair follicle epithelial cells. Lab Invest 89: 844-856
64. Ohyama M (2007) Advances in the study of stem-cell-enriched hair
follicle bulge cells: a review featuring characterization and isolation of
human bulge cells. Dermatology 214: 342-351
65. Morris R, Liu y, Marles L, yang Z, Trempus C, Cotsarelis G (2004)
Capturing and profiling adult hair follicle stem cells. Nat Biotechnol
22: 411-417.
66. Ito M, Liu y, yang Z, Nguyen j, Liang F, Morris Rj, Cotsarelis G (2005)
Stem cells in the hair follicle bulge contribute to wound repair but not
to homeostasis of the epidermis. Nat Med 11: 1351-1354
67. jahoda CA, Reynolds Aj (2001) Hair follicle dermal sheath cells:
unsung participants in wound healing. Lancet 358: 1445-1448
68. Miyashita H, Hakamata y, Kobayashi E, Kobayashi K (2004) Charac-
terization of hair follicles induced in implanted, cultured rat keratino-
cyte sheets. Exp Dermatol 13: 491-498
69. Ghazizadeh S, Taichman LB (2001) Multiple classes of stem cells in
cutaneous epithelium: a lineage analysis of adult mouse skin. EMBO
j 20: 1215-1222
70. Lo Celso C, Berta MA, Braun KM, Frye M, Lyle S, Zouboulis CC, Watt
FM (2008) Characterization of bipotential epidermal progenitors de-
rived from human sebaceous gland: contrasting roles of c-Myc and
beta-catenin. Stem Cells 26: 1241-1252
71. Horsley V, O‘Carroll D, Tooze R, Ohinata y, Saitou M, Obukhanych T,
Nussenzweig M, Tarakhovsky A, Fuchs E (2006) Blimp1 defines a pro-
genitor population that governs cellular input to the sebaceous gland.
Cell 126: 597-609
72. Magnúsdóttir E, Kalachikov S, Mizukoshi K, Savitsky D, Ishida-yama-
moto A, Panteleyev AA, Calame K. (2007) Epidermal terminal diffe-
Postępy Biochemii 59 (2) 2013
227
Epidermal stem cells — biology and potential
applications in regenerative medicine
Małgorzata Uzarska
1*
, Dorota Porowińska
1
, Anna Bajek
1
, Tomasz Drewa
1,2
1
Department of Tissue Engineering, Nicolaus Copernicus University in Torun, Ludwik Rydygier Medical College in Bydgoszcz,
24 Karłowicza St., 85-092 Bydgoszcz, Poland
2
Urology Department, Nicolaus Copernicus Hospital, 17-19 Batory St., 87-100 Torun, Poland
*
e-mail: m.uzarska@wp.pl
Key words: epithelial stem cells, skin, hair follicle, sebaceous gland
ABSTRACT
Stem cells are involved in the renewal and regeneration of the epithelium of various organs. The largest reservoir of epithelial stem cells in the
human body is the skin. This organ is a specialized interior barrier protecting the body from the influence of physical, chemical and biological
factors, ensuring at the same time the reception of signals from the external environment. Skin is also involved in numerous physiological
processes which determine the homeostasis of the body. Renewal and regeneration of the epidermis which is the outer layer of the skin, is
possible by the presence of different populations of stem cells that reside in microenvironments (niches), that creates specific conditions to
preserve the biological properties of these cells. Because divisions of cells in niches are quite rare, it became possible to distinguish them from
other rapidly proliferating cells of the skin. On this basis, the stem cells in the interfollicular epidermis, bulge region of the hair follicles, and
within the sebaceous glands were located. Moreover hair follicles are suggested to be a niche for melanocyte progenitor cells and other mul-
tipotent stem cells derived from the neural crest, as well as mesenchymal stem cells. The presence of stem cells that are characterized by high
proliferative potential and the ability to self-renew allow maintaing homeostasis and regeneration of epidermis. Identification, isolation and
characterization of epithelial stem cells is necessary to understand skin diseases background, develop effective methods for their treatment
and for wider use of stem cells in regenerative medicine, gene therapy or cosmetology.
rentiation depends on B lymphocyte-induced maturation protein-1.
Proc Natl Acad Sci USA 104: 14988-14993
73. Arnold I, Watt FM (2001) c-Myc activation in transgenic mouse epi-
dermis results in mobilization of stem cells and differentiation of their
progeny. Curr Biol 11: 558-568
74. Waikel RL, Kawachi y, Waikel PA, Wang Xj, Roop DR (2001) Dere-
gulated expression of c-Myc depletes epidermal stem cells. Nat Genet
28: 165-168
75. Bieniek R, Lazar Aj, Photopoulos C, Lyle S (2007) Sebaceous tumours
contain a subpopulation of cells expressing the keratin 15 stem cell
marker. Br j Dermatol 156: 378-380
76. Blanpain C, Horsley V, Fuchs E (2007) Epithelial stem cells: turning
over new leaves. Cell 128: 445-458
77. Silva-Vargas V, Lo Celso C, Giangreco A, Ofstad T, Prowse DM, Braun
KM, Watt FM (2005) Beta-catenin and Hedgehog signal strength can
specify number and location of hair follicles in adult epidermis witho-
ut recruitment of bulge stem cells. Dev Cell 9: 121-131
78. Green H (1991) Cultured cells for the treatment of disease. Sci Am 265:
96-102
79. Alonso L, Fuchs E (2003) Stem cells of the skin epithelium. Proc Natl
Acad Sci USA 100 (Suppl 1): 11830-11835
80. Alonso L, Fuchs E (2003) Stem cells in the skin: waste not, Wnt not.
Genes Dev 17: 1189-1200
81. Levy V, Lindon C, Harfe BD, Morgan BA (2005) Distinct stem cell po-
pulations regenerate the follicle and interfollicular epidermis. Dev Cell
9: 855-861
82. Wood FM, Kolybaba ML, Allen P (2006) The use of cultured epithelial
autograft in the treatment of major burn injuries: a critical review of
the literature. Burns 32: 395-401
83. Atiyeh BS, Costagliola M (2007) Cultured epithelial autograft (CEA) in
burn treatment: three decades later. Burns 33: 405-413
84. Lapouge G, Blanpain C (2008) Medical applications of epidermal stem
cells. W: StemBook, Cambridge (MA): Harvard Stem Cell Institute;
dostępne online: http://www.ncbi.nlm.nih.gov/books/NBK27047/
85. Pouliot N, Redvers RP, Ellis S, Saunders NA, Kaur P (2005) Optimi-
zation of a transplant model to assess skin reconstitution from stem
cell-enriched primary human keratinocyte populations. Exp Dermatol
14: 60-69
86. Ronfard V, Rives jM, Neveux y, Carsin H, Barrandon y (2000) Long-
-term regeneration of human epidermis on third degree burns trans-
planted with autologous cultured epithelium grown on a fibrin ma-
trix. Transplantation 70: 1588-1598
87. Amoh y, Li L, Campillo R, Kawahara K, Katsuoka K, Penman S, Hof-
fman R (2005) Implanted hair follicle stem cells form Schwann cells
that support repair of severed peripheral nerves. Proc Natl Acad Sci
USA 102: 17734-17738
88. Hunt DP, Morris PN, Sterling j, Anderson jA, joannides A, jahoda C,
Compston A, Chandran S (2008) A highly enriched niche of precursor
cellswith neuronal and glialpotential within the hair follicle dermal
papillaof adult skin. Stem Cells 26: 163-172
89. Bajek A, Drewa T, joachimiak R, Marszałek A, Gagat M, Grzanka A
(2012) Stem cells for urinary tract regeneration. Central European jo-
urnal of Urology doi: 10.5173/ceju.2012.01.art2
90. Drewa T, joachimiak R, Bajek A, Gagat M, Grzanka A, Bodnar M,
Marszalek A, Dębski R, Chłosta P (2012) Hair follicle stem cells can be
driven into a urothelial-like phenotype: An experimental study. Int j
Urol doi: 10.1111/j.1442-2042.2012.03202.x.
91. Drewa T, Adamowicz j, Sharma A (2012) Tissue engineering for the
oncologic urinary bladder. Nat Rev Urol 9: 561-572
92. Błażejewska EA, Schlӧtzer-Schrehardt U, Zenkel M, Bachmann B,
Chankiewitz E, jacobi C, Kruse FE (2009) Corneal limbal microenvi-
ronment can induce transdifferentiation of hair follicle stem cells into
corneal epithelial-like cells. Stem Cells 27: 642-645
93. Shi C, Mai y, Cheng T (2004) Identification of hematopoietic cell po-
pulations from the dermal papillae of human hair follicles. Transplant
Proc 36: 3208-3211
94. Cotsarelis G (2006) Epithelial stem cells: a folliculocentric view. j In-
vest Dermatol 126: 1459-1468
95. Nishimura EK, Granter SR, Fisher DE (2004) Mechanisms of hair gray-
ing: incomplete melanocyte stem cell maintenance in the niche. Scien-
ce 307: 720-724
96. Mavilio F, Pellegrini G, Ferrari S, Di Nunzio F, Di Iorio E, Recchia A,
Maruggi G, Ferrari G, Provasi E, Bonini C, Capurro S, Conti A, Magno-
ni C, Giannetti A, De Luca M (2006) Correction of junctional epider-
molysis bullosa by transplantation of genetically modified epidermal
stem cells. Nat Med 12: 1397-1402
Wyszukiwarka
Podobne podstrony:
inz opr zal 2k12 termin2 id 219 Nieznany
Gor±czka o nieznanej etiologii
02 VIC 10 Days Cumulative A D O Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
45 sekundowa prezentacja w 4 ro Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
Mechanika Plynow Lab, Sitka Pro Nieznany
katechezy MB id 233498 Nieznany
2012 styczen OPEXid 27724 Nieznany
metro sciaga id 296943 Nieznany
Mazowieckie Studia Humanistyczn Nieznany (11)
cw 16 odpowiedzi do pytan id 1 Nieznany
perf id 354744 Nieznany
DO TEL! 5= Genetyka nadci nieni Nieznany
Opracowanie FINAL miniaturka id Nieznany
3 Podstawy fizyki polprzewodnik Nieznany (2)
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
więcej podobnych podstron