
Zagadnienie szczegółowe na egzamin z mikrobiologii:
KONTROLA WZROSTU BAKTERII I ANTYBIOTYKI
podpunkty: 101 -117.
101. Kontrola wzrostu bakterii
Skład ilościowy (liczebność) i jakościowy (różnorodność gatunkowa) mikroflory różnych
środowisk jest odmienny, niekiedy nawet bardzo specyficzny. Zależy on od właściwości
gatunkowych mikroorganizmów oraz od czynników ekologicznych: abiotycznych (fizycznych i
chemicznych) oraz biotycznych (dodatnich i ujemnych, bezpośrednich i pośrednich oddziaływań
jednych organizmów na drugie).
Oddziaływanie poszczególnych czynników środowiskowych przebiega zgodnie z prawami,
„minimum”, „maksimum” i „tolerancji”. To ostatnie mówi, że: „zarówno nadmiar, jak i niedobór
jakiegoś czynnika, tak w sensie ilościowym, jak i jakościowym, poza granice tolerancji organizmu,
powoduje zahamowanie wzrostu i rozwoju oraz śmierć komórki”.
Najważniejszymi czynnikami abiotycznymi wpływającymi na wzrost i rozwój drobnoustrojów, w
tym także na podłożach mikrobiologicznych w warunkach laboratoryjnych, są takie czynniki
fizyczne (temperatura), chemiczne (kwasowość, tlenowość) a także zawartość składników
odżywczych.
Szybkość wzrostu komórki bakteryjnej jest większa niż u innych organizmów. Bakteria w
optymalnych warunkach w hodowli laboratoryjnej podwaja swoją masę i dzieli się zwykle co kilka
– kilkanaście minut, np. Escherichia coli dzieli się co 18 – 20 minut. Bakterie glebowe i wodne
rosną zwykle wolniej. W naturalnych warunkach bakterie rosną wolniej, np. E. coli w jelicie
grubym dzieli się co ok. 12 godzin.
WARUNKI WZROSTU BAKTERII:
Odpowiednie składniki odżywcze
Odpowiednie pH:
Odpowiednia temperatura.
Napowietrzanie.
102. Sterylizacja, pasteryzacja, dezynfekcja, aseptyka, antyseptyka, bakteriostaza.
Sterylizacja (wyjaławianie) – w pojęciu mikrobiologicznym jest to proces zabicia drobnoustrojów
w każdej formie (wegetatywnej i przetrwalnej) znajdujących się w przedmiotach lub płynach.
Prawidłowo wysterylizowany materiał jest jałowy - nie zawiera żadnych żywych drobnoustrojów
(także wirusów). Sterylizuje się szkło, sprzęt laboratoryjny, pożywki bakteriologiczne, płyny do
hodowli tkankowych, bufory i roztwory związków chemicznych, środki opatrunkowe, bieliznę
operacyjną, narzędzia operacyjne i in. Metody sterylizacji dzielimy na fizyczne, mechaniczne i
chemiczne.
Pasteryzację, czyli jednorazowe podgrzanie materiału jałowionego do ok. 80C z wyłączeniem

ogrzewania po osiągnięciu żądanej temperatury (lub 62C przez 30 min., czasem 72C przez 16
sek.) Aby oprócz form wegetatywnych zabić również formy przetrwalne, stosuje się tyndalizację
(pasteryzację frakcjonowaną), czyli trzykrotną pasteryzację w aparacie Kocha w odstępach 24-
godzinnych. Podczas tych przerw następuje kiełkowanie form przetrwalnych, które ulegają
zniszczeniu podczas następnego podgrzania. Jałowi się w ten sposób na niektóre pożywki
bakteryjne i konserwy.
Dezynfekcja (odkażanie) – Najczęściej tym terminem określa się niszczenie bakterii
chorobotwórczych czynnikami chemicznym, proces eliminujący wegetatywne postacie
drobnoustrojów przez działanie na ich strukturę i przemianę materii. Tę metodę stosuje się w celu
odkażania powierzchni stołów i podłóg, powietrza, rąk. Duże znaczenia ma temperatura środków
odkażających – w temperaturze 0C tracą one właściwości odkażające, ponieważ zmniejsza się ich
zdolność do przenikania do komórek drobnoustrojów. Nie zapewnia całkowitego wyjałowienia
środowiska.
Aseptyka – utrzymanie jałowości, jest to działanie polegające na niezakażaniu drobnoustrojami
przedmiotów wyjałowionych.
Aseptyka – działania mające na celu uniemożliwienie zakażenia:
-
filtrowanie powietrza
-
UV
-
maski na usta
-
rękawiczki i fartuchy
-
sterylizacja narzędzi chirurgicznych
Antyseptyka – odkażanie ran, z zastosowaniem środków niegroźnych dla człowieka.
Bakteriostaza – warunki powodujące hamowanie wzrostu bakterii, nie ich śmierć (np. schowanie
hodowli do lodówki)
103. Mechanizm działania autoklawu
Sterylizacja cieplna z parą wodną pod ciśnieniem
Nasycona para wodna powoduje gwałtowną hydrolizę, denaturację i koagulację enzymów i struktur
komórkowych. Wyjaławianie jest rezultatem zarówno wysokiej temperatury, jak i aktywności
cząsteczek wody.
Wyjaławianie parą wodną przeprowadza się w autoklawach (aparatach ciśnieniowych),
wyposażonych w przyrządy do pomiaru temperatury i ciśnienia oraz odpowiednie elementy
zabezpieczające (zawory).
Autoklaw jest kotłem metalowym o podwójnych ścianach, zaopatrzonym w szczelnie zamykaną
pokrywę. W kotle zewnętrznym znajduje się woda. Wodę ogrzewa się. Aktualna temperatura pary
wytwarzanej z wody w autoklawie zależy od ciśnienia, ale temperatura przy danym ciśnieniu jest
znacznie niższa, jeśli znajduje się w komorze jakakolwiek ilość powietrza. Ponieważ efektywność
sterylizacji zależy od temperatury a nie od ciśnienia, należy zapewnić usunięcie powietrza ze
sterylizatora. Dla uzyskania nasyconej pary wodnej, co następuje po zupełnym wyparciu powietrza,
pozostawia się otwarty zawór, który się zamyka po ujściu powietrza. Od tej chwili manometr
wskazuje podnoszenie się ciśnienia i po uzyskaniu określonej wartości utrzymuje się go na stałym
poziomie. Para wodna dostaje się do komory sterylizacyjnej autoklawu z płaszcza przez otwory.
Istnieje ścisła zależność pomiędzy ciśnieniem i temperaturą w komorze sterylizacyjnej autoklawu.
Do kontroli parametrów pary w autoklawie służą manometr i termometr.
Nasyconą parą wodną możemy wyjaławiać zarówno roztwory wodne, np. pożywki których
składniki nie ulegają rozkładowi pod wpływem wysokiej temperatury, jak i materiały opatrunkowe,
narzędzia lekarskie, płyny elektrolitowe, niektóre leki a także zużyte pożywki wraz z hodowlami
mikroorganizmów. Jałowienie w autoklawie niszczy wszystkie formy drobnoustrojów, zarówno
wegetatywne jak i przetrwalne. Materiały należy zabezpieczyć przed powtórnym skażeniem.
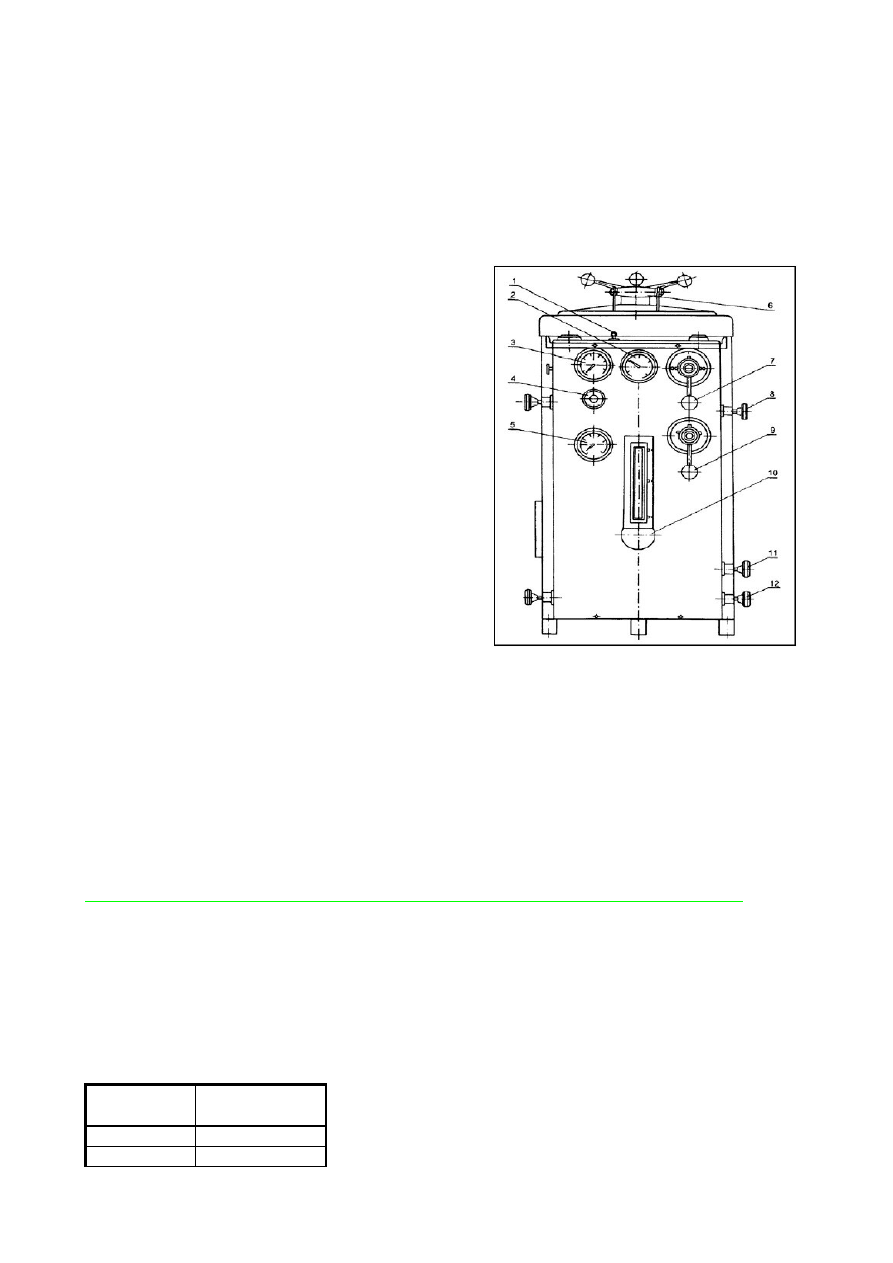
Prawidłowość procesu sterylizacji sprawdza się przy pomocy testów. Jednym ze wskaźników
prawidłowej sterylizacji są bardzo oporne na działanie wysokiej temperatury endospory
wytwarzane przez Bacillus stearothermophilus bądź niektóre szczepy bakterii z rodzaju
Clostridium, które poddane jałowieniu nie powinny wykiełkować.
Ze
sterylizacja
termiczną
związane
są
dwa
terminy:
Czas śmierci cieplnej - czas potrzebny do zabicia wszystkich drobnoustrojów tego samego gatunku
przy
określonej
temperaturze
i
składzie
pożywki.
Punkt śmierci cieplnej - temperatura, która zabija hodowlę bakteryjną w ciągu 10 minut.
1 Gałka zaworu bezpieczeństwa,
2 Manometr komory sterylizacyjnej,
3 Manometr kotła,
4 Zawór trójdrożny manometru,
5 Termometr tarczowy wskazujący temperaturę w komorze,
6 Rączka zamka pokrywy,
7 Dźwignia zaworu sterującego,
8 Zawór doprowadzający parę do kotła,
9 Dźwignia zaworu selekcyjnego,
10 Wskaźnik poziomu wody w komorze,
11 Zawór odpowietrzający komorę,
12 Zawór odprowadzający kondensat z komory sterylizacyjnej
104. Warunki autoklawowania (czas, temperatura, nadciśnienie, pary wodnej).
Zwykle stosowane temperatury sięgają 108-134 °C, zaś czas wyjaławiania wynosi 15-30 minut.
Czas sterylizacji zależy od objętości sterylizowanych płynów w kolbach lub innych naczyniach, im
mniejsza objętość płynów, tym krótszy czas. Zależność pomiędzy temperaturą a czasem procesu
termicznego jest logarytmiczna: jeśli w temperaturze 121C do zniszczenia określonej populacji
drobnoustrojów wystarcza czas ogrzewania 2 min., to w temperaturze 110C dla osiągnięcia tego
samego efektu potrzeba 20 min, a w temperaturze 100C aż 200min.
Stosunek ciśnienia i temperatury:
Temperatura
(C)
Nadciśnienie
(atm.)
112
0.5
117
0.7

121
1.0
134
2.0
Autoklaw – dwa kotły jeden drugim(w zewnętrznym gotuje się woda). Zbiera
się w nim para pod ciśnieniem stąd temperatura powyżej 100*C – niszczy się w
nim zarówno formy wegetatywne jak i przetrwalne.
Nastawy autoklawu:
100*C - ciśnienie ziemskie - 430 min
112*C - 0,5 atmosfery 30 min
116*C - 0,7 atmosfery
121*C - 1,0 atmosfera - 8 min
134*C - 2,0 atmofery - 10 sek
105. Sterylizacja suchym powietrzem, warunki (czas i temperatura)
Sterylizacja za pomocą gorącego powietrza
(tzw. „suche gorąco”) w sterylizatorach (160 – 210C)
Tą metodą jałowi się: szkło, substancje sproszkowane i oleiste (parafinę, wosk, glicerol, oleje),
narzędzia chirurgiczne i igły. Suche gorące powietrze powoduje utlenianie, a co za tym idzie
inaktywację i degradację składników komórkowych drobnoustrojów.
Wyjaławianie suchym gorącym powietrzem prowadzi się w sterylizatorach powietrznych,
stanowiących zamknięte komory z termoregulacją, stosując temperatury 160-200 stopni
utrzymywane w czasie od dwóch godzin do kilkunastu minut. Warunki sterylizacji zależą w
głównej mierze od wyjaławianego materiału i jego wytrzymałości termicznej. Materiał powinien
być suchy, czysty i zabezpieczony przed ponownym skażeniem, na przykład za pomocą
termoodpornej folii z tworzywa sztucznego.
Aby materiał został wyjałowiony, suche gorące powietrze musi przeniknąć do jego wnętrza - czas
potrzebny na zajście tego procesu nazywany jest czasem przenikania. Gdy materiał osiągnie
odpowiednią temperaturę, rozpoczyna się czas utrzymywania się, będący właściwym procesem
sterylizacji. Zwykle dla bezpieczeństwa oba czasy wydłuża się o połowę. Materiał powinien być
ułożony w sterylizatorze tak, by nie utrudniać dostępu gorącego powietrza.
Standardowo: 2 godziny w 160C.
Suszarki – nie ma w nich pary wodnej – wyjaławianie na sucho.
140* - 180min
150* - 150min
160* - 120min
170* - 60min
106. Sterylizacja przedmiotów i płynów termolabilnych
Wyjaławianie za pomocą promieni UV – stosuje się ją do niszczenia drobnoustrojów
znajdujących się w powietrzu i na powierzchniach przedmiotów. Tą metodą można jałowić
pomieszczenia. Używa się jej w szpitalach, aptekach, laboratoriach, chłodniach. Stosuje się światło
o długości fali 250 – 260 nm, którego bakteriobójcze działanie polega na niszczeniu struktury
kwasów nukleinowych, tworzenie się dimerów tyminowych w DNA, wywoływaniu mutacji.
Najwrażliwsze na tę metodę odkażania są formy wegetatywne bakterii, formy przetwalne i wirusy
wykazują dużą oporność.
Wyjaławianie za pomocą promieniowanie jonizującego - promieniowanie jest
skuteczniejsze niż UV, posiada możliwość głębokiej penetracji, dzięki czemu możliwe jest
wyjaławianie nim przedmiotów opakowanych. Jego działanie, podobnie jak promieniowania UV,
polega na uszkadzaniu struktury kwasów nukleinowych. Sterylizacja promieniowaniem
jonizującym przebiega zarówno w sposób bezpośredni, jak i pośredni, przez produkty radiolizy
wody
Ta metoda znajduje zastosowanie w konserwowaniu żywności i odkażaniu narzędzi lekarskich
jednorazowego użytku.
Wyjaławianie za pomocą ultradźwięków- np. sonifikacja – metoda prowadząca do dezintegracji
bakterii (ścian komórkowych, DNA pozostaje nienaruszone).
Mechaniczne metody sterylizacji
Filtracja – stosuje się ją gdy nie można jałowić płynu (np. pożywki) w podwyższonej
temperaturze, bo uległyby zniszczeniu zawarte w nim substancje, takie jak enzymy, cukry czy
antybiotyki. Żywe i zabite bakterie znajdujące się w płynie zatrzymują się na powierzchni filtrów.
Pory filtrów są zawsze mniejsze od najmniejszych bakterii. Sączenie napędzane jest podciśnieniem
wytworzonym za pomocą pompy próżniowej. Metodą filtracji można oczyszczać również
powietrze (np. w salach operacyjnych, boksach laminarnych) lub niektóre gazy (tlen, dwutlenek
węgla).
Korzyści wynikające z tej metody są znaczące - nie zmienia się pH roztworu, nie rozpadają się jego
składniki wrażliwe na temperaturę (termolabilne, na przykład witaminy, enzymy, białka surowicy).
Zestawy do sączenia należy wyjałowić za pomocą pary lub suchego gorącego powietrza.
Koniecznie jałowy musi być też pojemnik, do którego zbieramy roztwór, a dozowanie do opakowań
jednostkowych musi odbywać się w warunkach aseptycznych.
Filtry porcelanowe – nie przechodzą bakterie, przechodzą wirusy i bakteriofagi.
Filtry azbestowe i szklane – nie przechodzą bakterie, bakteriofagi i większe wirusy
Filtry membranowe wykonane z estrów celulozy – nie przepuszczają nawet małych wirusów.
Chemiczne metody sterylizacji
Dezynfekcja (odkażanie) – proces eliminujący wegetatywne postacie drobnoustrojów przez
działanie na ich strukturę i przemianę materii. Tę metodę stosuje się w celu odkażania powierzchni
stołów i podłóg, powietrza, rąk. Duże znaczenia ma temperatura środków odkażających – w
temperaturze 0C tracą one właściwości odkażające, ponieważ zmniejsza się ich zdolność do
przenikania do komórek drobnoustrojów.
Do chemicznych środków odkażających należą alkohole, aldehydy, chlorowce (jod, chlor), gazy
(dwutlenek siarki, tlenek etylenu), metale ciężkie (chlorek rtęci, azotan srebra), detergenty, fenole i
lizole.
Środki odkażające w zależności od stężenia mogą działać bakteriobójczo lub bakteriostatycznie.
Etanol w stężeniu 5 – 10% działa bakteriostatycznie, powyżej 70% bakteriobójczo.
Sterinol – jest to detergent hamujący rozwój drobnoustrojów, stosowany jako środek odkażający
skórę
Chloramina – zawiera ponad 30% czynnego chloru, działa silnie odkażająco, odwadniająco i
utleniająco, stosowana do dezynfekcji skóry, naczyń.
Lizol – ciekłe mydło krezolowe, silnie dezynfekujący, stosowany do niszczenia wegetatywnych
form bakterii, prątków gruźlicy i odwszawiania bielizny.
Formalina – silnie bakteriobójcza i wirusobójcza, znajduje zastosowanie przy odkażaniu narzędzi
laboratoryjnych i chirurgicznych
Nadtlenek wodoru – przy zetknięciu się z katalazą obecną w tkankach lub komórkach
drobnoustrojów, nadtlenek wodoru wydziela tlen atomowy działający silnie odkażająco. Stosowany
w odkażaniu skaleczeń i mniejszych ran.
107. Sterylizacja pomieszczeń
Wyjaławianie za pomocą promieni UV – stosuje się ją do niszczenia drobnoustrojów
znajdujących się w powietrzu i na powierzchniach przedmiotów. Tą metodą można jałowić
pomieszczenia. Używa się jej w szpitalach, aptekach, laboratoriach, chłodniach.
W praktyce mikrobiologicznej wykorzystuje się najczęściej hamujące lub zabójcze działanie na
mikroorganizmy nadfioletowej części widma słonecznego o długości fali 250-260 nm, a więc tą
część widma, która jest najsilniej absorbowane przez kwasy nukleinowe. Źródłem promieniowania

są lampy kwarcowe, wypełnione oparami rtęci, emitujące w 95% promieniowanie o długości fali
258 nm. Promieniowanie UV jest wykorzystywane do niszczenia mikroorganizmów występujących
w powietrzu i na odkrytych powierzchniach zamkniętych pomieszczeń o niewielkim zapyleniu
(silosów, magazynów i chłodni, ładowni statków, laboratoriów). Ponieważ charakteryzuje się słabą
przenikliwością – nie przenika przez zwykłe szkło, stąd promieniowanie UV nie jest
wykorzystywane do wyjaławiania szkła i podłoży agarowych w szklanych naczyniach. Efekt
biobójczy promieniowania zależy między innymi od objętości napromienianego powietrza,
wielkości powierzchni, odległości i ustawienia lamp UV. Czas emisji promieniowania nie powinien
być krótszy niż 30 min, odległość lampy od sterylizowanej powierzchni nie może przekraczać 3 m,
a lampy powinny być ustawione prostopadle do powierzchni.
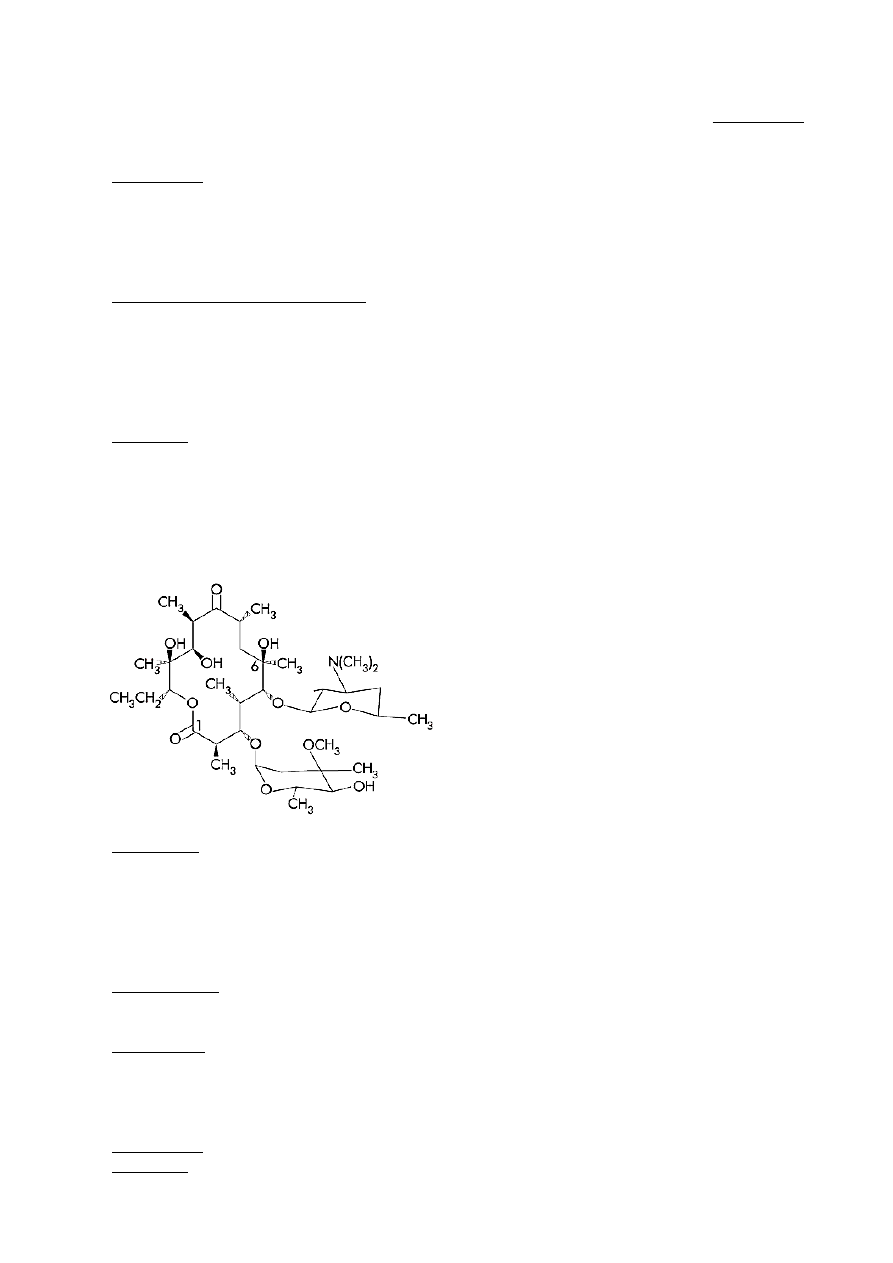
108. Antybiotyki i mechanizmy ich działania (beta laktany, tetracykliny,
aminoglikozydy, makrolidy, glikolipidy, polieny)
Antybiotyk to substancja chemiczna wytwarzana przez żywe drobnoustroje(bakterie,
grzyby) albo otrzymywana syntetycznie lub półsyntetycznie. Działają one wybiórczo, w niskich
stężeniach na inne drobnoustroje mają zdolność hamowania wzrostu i zabijania bakterii, grzybów i
niektórych pierwotniaków. Antybiotyki to produkt metabolizmy drobnoustrojów np. bakterie i
grzyby żyjące w glebie. W odróżnieniu od metabolitów podstawowych zalicza się je do
metabolitów wtórnych. Rola w środowisku polega na działaniu toksycznym względem innych
drobnoustrojów.Dobry antybiotyk nie może być toksyczny dla organizmu ani działać na niego
alergizująco. Antybiotyki powinny być chemicznie trwałe a także dobrze rozpuszczać się w wodzie,
soli fizjologicznej i kwasie żołądkowym. Ponadto, antybiotyki powinny wykazywać dobrą
przenikalność z przewodu pokarmowego do tkanek nie ulegając przy tym degradacji. Za początek
ery antybiotyków uznaje się datę ogłoszenia pierwszych doniesień o antybakteryjnych
właściwościach z Penicillium notatum (1940r.). Penicylina jest pierwszym antybiotykiem
zastosowanym klinicznie – w 1941 r. Florey i Chain podali penicylinę przeciwko infekcji
gronkowcowej.
Wytwarzanie antybiotyków
Większość znanych antybiotyków wytwarzają promieniowce, na drugim miejscu są grzyby, a na
trzecim bakterie. Antybiotyki są wtórnymi metabolitami wytwarzających je drobnoustrojów, co w
przeciwieństwie do metabolitów podstawowych oznacza, że nie są niezbędne do życia
drobnoustroju. Wtórny metabolizm może być natomiast bardzo korzystny dla drobnoustroju w
warunkach ograniczających wzrost. Wydalanie przez producenta antybiotyków do podłoża może
dawać mu przewagę w warunkach niszy ekologicznej. Począwszy od roku 1960 rozpoczęły się
badania nad modyfikacją chemiczną cząsteczek antybiotyków. Otrzymano w ten sposób cały szereg
antybiotyków półsyntetycznych.
Wartości aktywności antybiotyku:
MIC – najmniejsze stężenie hamujące ( takie stężenie mg/ml antybiotyku na 1ml pozywki , które
hamuje wzrost danego szczepu.101
MBC – najmniejsze stężenie bakteriobójcze
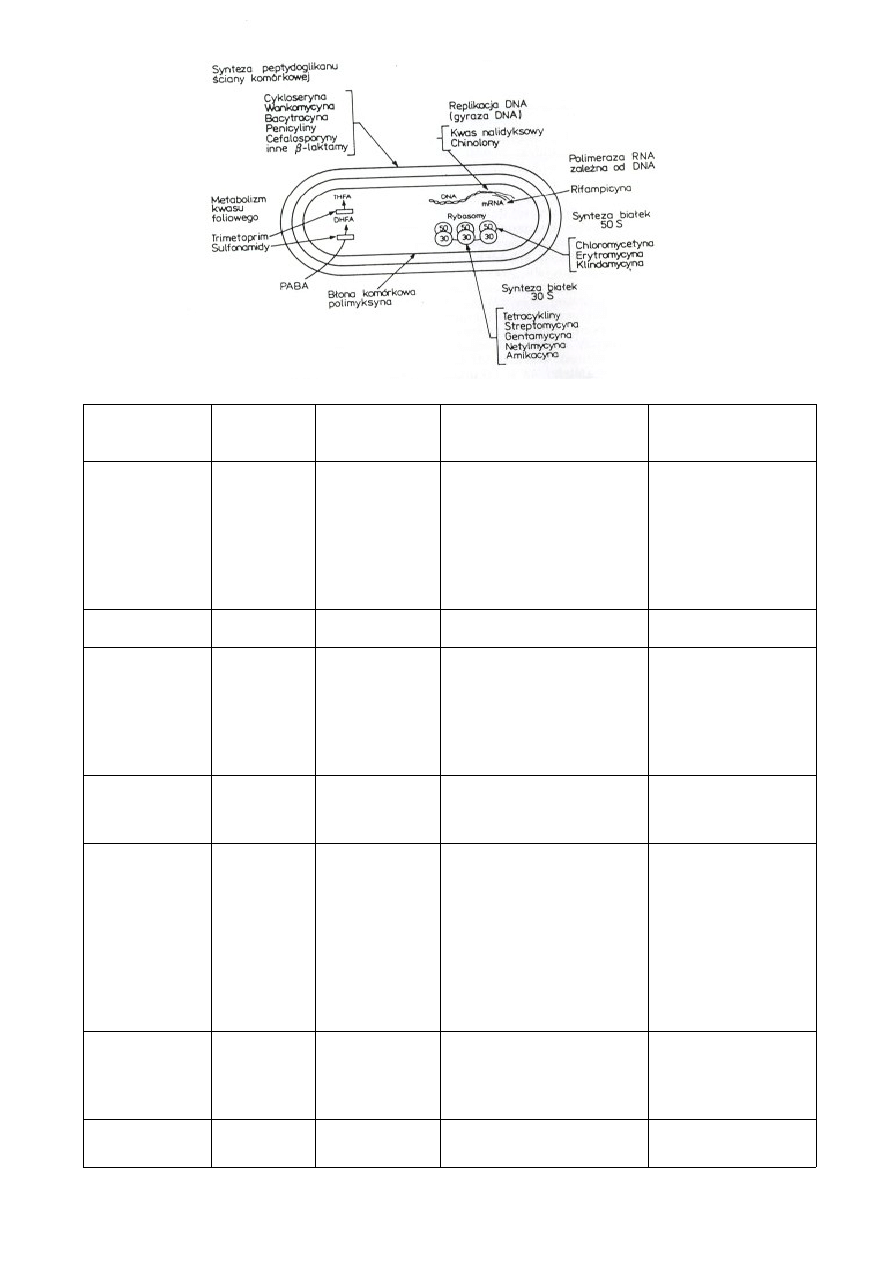
Antybiotyk
grupa
działanie
Mechanizm działania
Mechanizm
oporności
ampicylina
b-laktamy
Bakteriobójcze Hamuje syntezę ściany
komórkowej przez
blokowanie powstawania
mostków peptydowych
pomiędzy sąsiednimi
łańcuchami polisaharydów
ściany
Gen bla kodujący b-
laktamazę
hydrolizującą
pierścień b-
laktamowy
penicylina
b-laktamy
Bakteriobójcze -”-
-”-
kanamycyna
aminoglikoz
ydy
Bakteriobójcze Hamuje syntezę białek
przez blokowanie reakcji
translokacji
Inaktywacja
enzymatyczna przez :
fosfotransferazę ,
acetylotransferazę i
nukleotydylotransfera
zę aminoglikozydową
streptomycyna aminoglikoz
ydy
Bakteriobójcze Hamuje syntezę białka
wiążąc się do podjednostki
30s rybosomu
Fosfotransferaza
aminoglikozydowa
inaktywuje ja
Wankomycyna glikopeptydy Bakteriobójcze Hamuje polimeryzację
peptydoglikanu, łączy się
do dipeptydu D-Ala-D-Ala
Wytwarzanie
prekursora
D-Ala-O-D-Lac
( zamiast D-Ala-D-
Ala ) który nie wiąże
się z wankomycyną
(enterokoki) lub
grubsza ściana
(gronkowiec VRSA)
Polimyksyna
polimyksyny Bakteriobójcze Wiąże się do błon
komórkowych , zwiększa
ich przepuszczalność
Zmiana
przepuszczalności
osłon
komórkowych
walinomycyna oligopeptydy Bakteriobójcze Jonofor przenośnikowy ,
przenosi jony potasu przez

Antybiotyk
grupa
działanie
Mechanizm działania
Mechanizm
oporności
błony cytoplazmatyczne,
usuwa je (jest zbyt
toksyczna by stosować ją w
lecznictwie)
chloramfenikol chloramfeni
kole
Wiążą się do podjednostki
50s rybosomów hamuje
syntezę białek, hamuje
działanie transferazy
peptydylowej
Gen cat kodujący
acetylazę
chloramfenikolu
inaktywuje
antybiotyk
przez jego acetylację
ryfampicyna
bakteriostatycz
ne
Hamuje syntezę RNA
przez blokowanie podj. b
pol. RNA (stosowany w
gruźlicy)
Mutacja w genie
podjednostki
polimerazy
tetracyklina
tetracykliny bakteriostatycz
ne
Hamuje synteze białek
przez blokadę przyłączenia
aminoacylo-tRNA do
miejsca A na rybosomie
Usuwanie przez
białkowe pompy
błonowe
erytromycyna
makroloidy
bakteriostatycz
ne
Wiąże się z podjednostką
50s rybosomu Modyfikacja
rybosomów,102
uniemożliwia wydłużanie
powstającego transkryptu
inaktywacja
enzymatyczna,
usuwanie czynne z
komórek
Kwas
nalidyksowy
chionolony
bakteriostatycz
ne
Hamuje aktywność gyrazy
Antybiotyki b-laktamowe
Hamuja biosyntezę ściany komórkowej. Są analogami D-alanulo-D-alanin ,które zamiast
prawdziwych łączą się ze strukturę ściany w procesie jej powstawania. Działają tylko na bakterie
rosnące, nie mają wpływu na bakterie które już nie rosną. Są wytwarzane przez grzyby rodzaju
Penicillum, Cephalosporium i Aspergillus. Niektóre tez przez bakterie : Streptomycetes, Nocardia ,
Pseudomonas. Zalicza się tu pierwszy odkryty antybiotyk – PENICYLINĘ
Sulfonamidy
To analogi PABA – hamujące syntezę kwasu dihydropterynowego czyli pierwszego etapu
prowadzącego do powstania kwasu dihydrofoliowego. Działają bakteriostatycznie.
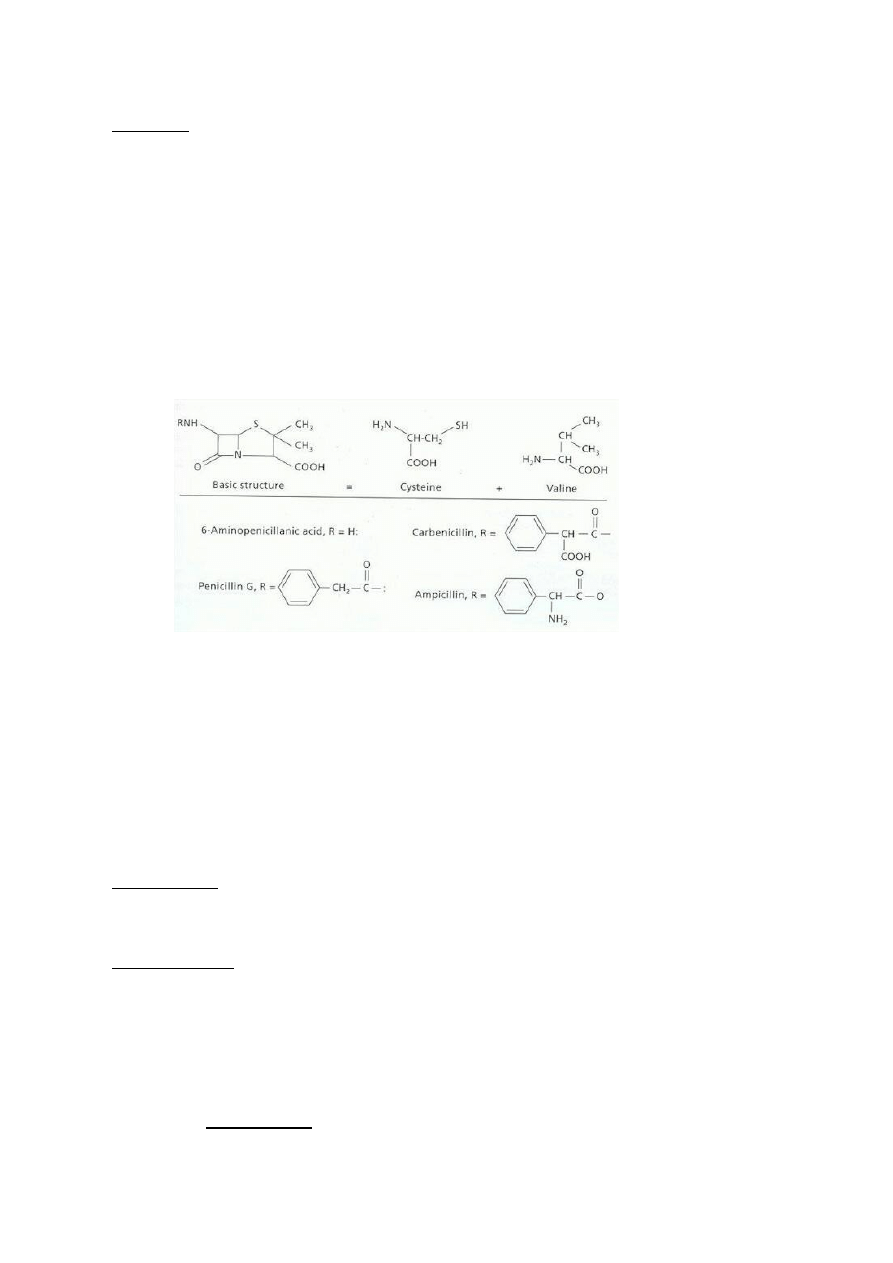
Podstawowe mechanizmy, według których działają antybiotyki:
1. Interferencja z replikacją DNA: mitomycyny, edeina, fleomycyna, chinolony jako inhibitory
gyrazy DNA
2. Interferencja z transkrypcją DNA – aktinomycyny, rifampicyna
3. Hamowanie biosyntezy białek: podjednostka 30S rybosomu – tetracykliny, streptomycyna,
gentamycyna; podjednostka 50S rybosomu – chloramfenikol, erytromycyna, klindamycyna
4. Uszkadzanie błony cytoplazmatycznej – antybiotyki polipeptydowe: polimyksyna B, nystatyna.
Podobnie działają również bakteriocyny!
5. Hamowanie biosyntezy sciany komórkowej: penicyliny i cefalosporyny, bacytracyna,
wankomycyna, cykloseryna
Antybiotyki przeciwbakteryjne
1. Penicyliny
– Wydzielane przez Penicillium notatum i P. chrysogenum. Wiążą transpeptydazy i
karboksypeptydazy uczestniczące w syntezie ściany komórkowej (tworzące mostki peptydowe
pomiędzy sąsiadującymi łańcuchami peptydoglikanu). Działają bakteriobójczo na dzielące się
komórki. Największą skuteczność wykazują wobec bakterii G(+). Należą do nich: penicylina G
i bardziej oporna na kwasy penicylina V (antybiotyki naturalne) i powstałe na ich wzór
metycylina, oksycylina, ampicylina, amoksycylina, karbanicylina. Penicyliny podaje się z
kwasem klawulonowym, który jest inhibitorem penicylinaz – enzymów rozkładających
pierścień β-laktamowy penicylin.
Półsyntetyczne pochodne penicylin charakteryzują się: odpornością na kwas żołądkowy,
odpornościa na penicylinazy przedłużonym czasem działania i poszerzonym o bakterie G(-)
spektrum działania. Otrzymuje się je rozszczepiając cząsteczkę penicyliny acylazą i
wprowadzając do powstałego kwasu 6-aminopenicylinowego jeden z licznych łańcuchów
bocznych.
MRSA jest skrótem od angielskiej nazwy methicyllin-resistant Staphylococcus aureus, czyli
gronkowiec złocisty oporny na metycylinę. Metycylinę stosowano do leczenia zakażeń
wywołanych przez Staphylococcus aureus we wczesnych latach 60., zanim zastąpiono ją mniej
toksycznymi pochodnymi, np. flukloksacyliną. Wiele szczepów MRSA jest również odpornych na
inne często stosowane antybiotyki, np. erytromycynę. Po raz pierwszy o wyizolowaniu S. aureus
opornego na metycylinę doniesiono w 1961 r. w Londynie; od tego czasu stosuje się nazwę MRSA.
Przez wiele lat kwestionowano kliniczne znaczenie MRSA, aż do znacznego zwiększenia się liczby
przypadków izolacji tych bakterii i doniesień o zakażeniach występujących w większości szpitali
we wczesnych latach 90. XX wieku. W niektórych angielskich szpitalach niemal połowa zakażeń
wywołanych przez S. aureus związana jest z MRSA.
2. Cefalosporyny
– Wydzielane przez gatunki grzyba Cephalosporium. Działają podobnie jaki
penicyliny, są pochodnymi kwasu aminocefalosporynowego a nie penicylinowego, jednak
również mają pierścień β-laktamowy. Są odporne na penicylinazy i mają szersze spektrum
działania.
3. Aminoglikozydy
– Są aminocukrami połączonymi wiązaniami glikozydowymi. Hamują syntezę
białek zmieniając kształt podjednostki 30S rybosomu – wiążą się z białkiem S12 podjednostki
30S. Działają bakteriobójczo. Należą tu streptomycyna wydzielana przez gatunki grzyba
Streptomyces, neomycyna, gentamycyna, kanamycyna, amikacyna (półsyntetyczna pochodna
kanamycyny). Streptomycyna jest skuteczna wobec bakterii G(-) i kwasoopornych
niewrażliwych na działanie penicyliny. Może ona jednak powodować u ludzi dosć poważne
skutki uboczne o charakterze alergii.
Mechanizmy oporności na aminoglikozydy: Enzym fosfotransferaza aminoglikozydowa
inaktywuje streptomycynę (dodanie grupy funkcyjnej). Inny mechanizm oporności na
streptomycynę – chromosomalny – polega na mutacji w genie rpsL kodującym białkoS12
rybosomu powoduje, że streptomycyna traci powinowactwo do tak zmienionego białka.
Enzymy takie jak fosfotransferaza aminoglikozydowa, acetylotransferaza aminoglikozydowa,
czy nukleotydylotransferaza aminoglikozydowa mają zdolność do inaktywacji kanamycyny.
Enzymy te występują w periplazmie opornych bakterii. Modyfikacja kanamycyny ma wpływ na
jej transport do wnętrza komórki bakteryjnej.
4. Tetracykliny
– Wydzielane przez promieniowce oraz przez Streptomyces aureofaciens. Zakłóca
proces połączenia się aminoacylo-tRNA do miejsca A rybosomu bakteryjnego (dotyczy to
podjednostki 30S). Działają bakteriostatycznie. Charakteryzują się szerokim spektrum
aktywności i są dobrze tolerowane przez ludzi.
W błonie bakterii opornych na tetracyklinę występuje białko o charakterze pompy, które
wyrzuca tetracykline z wnętrza komórki.
5. Chloramfenikol (chloromycetyna)
– Wydzielany przez Streptomyces venezuelae, obecnie
otrzymywany syntetycznie. Wiąże się do podjednostki 50S rybosomu i blokuje aktywność
transferazy peptydylowej. Działa bakteriostatycznie. Jest to antybiotyk bardzo stabilny,
skuteczny wobec wielu bakterii G(-), krętków, riketsji, promieniowców i dużych wirusów.
Enzym acetylaza chloramfenikolu występujący w cytoplazmie opornych bakterii modyfikuje
antybiotyk przez jego acetylację. Zmodyfikowany antybiotyk nie ma już zdolności do wiązania
się z rybosomem.
6. Makrolidy
– Są to związki posiadające makrocykliczny pierścień laktonowy i w związku z tym
charakteryzujące się dużymi rozmiarami. Wiążą się do podjednostki 50S rybosomu (dokładnie
do 23S rRNA) uniemożliwiając przesunięcie się rybosomu wzdłuż mRNA. Należy tu
karbomycyna A, pikromycyna, erytromycyna oraz jej półsyntetyczne pochodne -
klarytromycyna i azytromycyna.
Oporność na erytromycynę wywołują zmiany (metylacja) receptora rRNA.
Erytromycyna
7. Polipeptydy
– np. bacytracyna (z Bacillus subtilis), polimyksyna B, gramicydyna S,
rystocetyna. Są skuteczne głównie wobec bakterii G(-), powodują zwiększenie
przepuszczalności ich błony cytoplazmatycznej i zewnętrznej.
Są toksyczne zarówno dla komórek bakteryjnych jak i eukariotycznych ze względu
na wysokie powinowactwo do błony cytoplazmatycznej. Ogranicza to ich
użyteczność. Bacytracyna hamuje syntezę ściany komórkowej, polimyksyna B
uszkadza błonę komórkową
8. Wankomycyna
– jest glikopeptydem wytwarzanym przez Streptomyces orientalis. Hamuje
syntezę peptydoglikanu na etapie wcześniejszym niż leki β-laktamowe. Stosowana przeciwko
wieloopornym gronkowcom i w zakażeniach zastawek serca. Jest silnie toksyczna.
9. Rifampicyna
– Skuteczna głównie przeciwko bakteriom G(+). hamuje syntezę RNA przez
wiązanie się i blokowanie podjednostki β polimerazy RNA. Używana w terapii tuberkulozy i
leprozy. Działa bakteriostatycznie. Toksyczna.
Mutacja w genie rpoB powoduje, ze rifampicyna traci powinowactwo do podjednostki β
polimerazy RNA.
10. Cykloseryna
– blokuje racemazę elaninową budująca mostki peptydowe u bakterii G(+).
11. Chinolony
np. kwas nalidyksowy– blokują gyrazę DNA, oddziaływując z jej podjednostką A,
stabilizując przerwę w obu niciach DNA wprowadzaną przez gyrazę.
12. Nowobiocyna
– jest pochodną kumaryny, która hamuje syntezę DNA łącząc się z podjednostką
B gyrazy DNA i blokując jej aktywność ATP-azową, niezbędną dla działania enzymu.
13. Metronidazol
– pochodna nitroimidazolu, jest skutecznym czynnikiem przeciw drobnoustrojom
jedynie przy niskim potencjale oksydoredukcyjnym, w związku z czym używany jest przeciwko
bakteriom beztlenowym i niektórym patogennym pierwotniakom. W komórkach wrażliwych
beztlenowców grupa nitrowa ulega redukcji z wytworzeniem nietrwałych cytotoksycznych
pochodnych, które wprowadzają cięcia w DNA.
Leki przeciwgrzybiczne
1. Polieny – nystatyna (wytw. Streptomyces noursei), amfoterycyna B (Streptomyces nodosus).
Łączą się ze sterolami w błonach komórkowych grzybów czyniąc je łatwo przepuszczalnymi.
Bakterie nie są wrażliwe na polieny. Griseofulwina (Penicillium griseofulvum) działa na ścianę
komórkową i mikrotubule.
Leki antywirusowe
1. AZT (azydotymidyna) i jej pochodne - nukleozydowe inhibitory odwrotnej transkryptazy
2. Interferon – glikoproteina działa hamująco na replikację wirusów.
Leki przeciwko pierwotniakom
1. Fumagilina (Aspergilus fumigatus) – działa na etapie syntezy białek –
2. Cyklosporyna A (różne grzyby)
109. Przykłady antybiotyków o działaniu bakteriobójczym
Bakteriobójcze – powodują śmierć komórki z powodu nieodwracalengo wiązania się do struktur
komórki lub nieodwracalnie hamując jej najważniejsze procesy.
-
penicyliny, bacytracyna, cefalosporyny (działają tylko na komórki rosnące)
-wankomycyna
-antybiotyki aminoglikozydowe: gentamycyna, kanamycyna, neomycyna, streptomycyna
-nowobiocyna
110. Przykłady antybiotyków o działaniu bakteriostatycznym
Bakteriostatyczne – hamuja zdolność replikacji i podziału komórkowego, wzrost bez
zabijania komórki. Usunięcie antybiotyku z komórki powoduje dalszy wzrost bakterii.
-
chloramfenikol, tetracykliny, kwas nalidyksowy
-antybiotyki makrolidowe
111. Antybiotyki o szerokim i wąskim spektrum działania
SPEKTRUM DZIAŁANIA
ANTYBIOTYKÓW
S Z
E R
O K
I E
wąskie
anty
bioty
k
wyka
zuje
akty
wnoś
ć
zaró
wno
w
stos
unku
do
bakt
erii
G(+)
jak i
G(-)
antybiotyk wykazuje aktywność
jedynie w stosunku do wąskiej grupy
bakterii (nawet jednego gatunku)
am
pic
ylin
a,
chl
ora
mfe
nik
ol,
tetr
acy
klin
a
penicylina G, bacytracyna,
wankomycyna
112. Chemioterapia?(czy może chemioterapeutyki bo o chemio terapii nie mam
pojęcia co pisać)
Chemioterapeutyki
Pierwszym chemioterapeutykiem był salwarsan, wykorzystany w lecznictwie kiły. Związek ten nie
został odkryty przypadkowo, ale w wyniku zastosowania koncepcji Ehrlicha. Zaobserwował on, że
istnieją substancje (np. barwniki), które łączą się wybiórczo z komórkami zarazków, a nie wiążą się
ze skaładnikami komórek gospodarza. Na tej podstawie założył, że muszą istnieć też takie
substancje chemiczne, które łącząc się wybiórczo z komórkami zarazków będą dla nich toksyczne,
a dla gospodarza pozostaną obojętne. Tego typu związki chemiczne nazwano chemioterapeutykami.
1. Izoniazyd
(INH) – skierowany przeciwko Mycobacterium tuberculosis, działa jako bloker w
syntezie kwasów mykolinowych stanowiących część ściany bakteryjnej u M. tuberculosis.
Zwykle podaje się go z etambutolem i rifampicyną.
2. Etambutol
– przeciw mykobakteriom, działa blokująco na wcielanie kwasów mykolinowych do
ściany komórkowej
3. Sulfonamidy
– mają działanie bakteriostatyczne. Należą do nich sulfametaksazol, nitrofuranoid,

trimetoprim, biseptol. Ich działanie opiera się na podobieństwie do PABA – kwasu
paraaminobenzoesowego. Wywołują zaburzenia metaboliczne wynikające z niedoboru kwasu
foliowego, który jest prekursorem w syntezie DNA i RNA.
Synteza kwasu foliowego – kondensacja PABA z 2-amino4-hydroksy-tetrahydropteoryną,
katalizowana przez enzym, którego aktywność hamują sulfonamidy.
Sulfonamidy konkurują o to samo miejsce w enzymach z podobnym do nich PABA i jego
pochodnymi.
Sulfametaksazol – analog PABA, konkuruje z nim podczas syntezy kwasu dwuhydrofoliowego
Trimetoprim – podobny do części kwasu dwuhydrofoliowego, hamuje syntezę kwasu
tetrahydrofoliowego z dwuhydrofoliowego. Trimetoprim stosuje się w zakażeniach układu
moczowego.
Wrażliwość bakterii na sulfonamidy jest różna, w zależności od budowy chemicznej
chemioterapeutyku i od gatunku bakterii. Nawet bakteria najbardziej wrażliwe na działanie
sulfonamidów mogą stać się sulfonamidooporne.
PABA
sulfametaksazol
Kwas dwuhydrofoliowy
trimetoprim
Kwas tetrahydrofoliowy
Prekursory DNA, RNA
4. Związki sulfonowe
– pochodne p-diaminodifenylosulfonu. Działają podobnie jak sulfonamidy,
są jednak bardziej trujące. Hamują wzrost wielu ziarniaków, działają też na prątki kwasooporne.
5. Kwas salicylowy i kwas
p -aminosalicylowy (PAS)
Wodne roztwory, maści i przysypki
zawierające kwas salicylowy są stosowane jako środki bakteriobójcze i grzybobójcze. Roztwory
wodne (1%) kwasu salicylowego są używane do konserwacji mięsa i tłuszczów, a do
przetworów owocowych stosuje się salicylan sodowy. PAS, pochodna kwasu salicylowego, był
związkiem stosowanym w leczeniu gruźlicy. Kwas ten oraz jego sól sodowa działają silnie
bakteriostatycznie na prątki gruźlicy.
Chemioterapia – metoda systemowego leczenia
złośliwych za pomocą
W szerszym znaczeniu jest to używanie syntetycznych
W leczeniu nowotworów stosuje się także
hormonalne, leki celowane molekularnie (np.
, imatinib) i
Cytostatyki zabijają komórki dzielące się, stąd oprócz komórek nowotworowych zabija również
prawidłowe komórki organizmu.

Leczenie systemowe za pomocą cytostatyków może być prowadzone jedynie przez lekarzy
posiadających specjalizację z onkologii klinicznej. Leczenie musi być prowadzone na oddziałach
szpitalnych posiadających pracownie cytostatyków oraz odpowiednio wykwalifikowany personel.
Podział
•
metoda radykalna - ma na celu całkowitą eliminację komórek nowotworowych z
organizmu, co zagwarantuje skuteczność leczenia; stosowana głównie w leczeniu
•
metoda uzupełniająca - adiuwantowa - stosowana po radykalnym zabiegu operacyjnym.
Jej celem jest zlikwidowanie pozostałych po zabiegu w postaci mikroprzerzutów komórek
nowotworowych,
•
metoda wstępna - neoadiuwantowa, indukcyjna - stosowana przed zabiegiem operacyjnym
celem zmniejszenia masy guza i jego regionalnego zaawansowania, co ma umożliwić
przeprowadzenie radykalnego zabiegu operacyjnego lub zabiegu mniej okaleczającego, np.
kwadrantektomia zamiast
•
metoda regionalna - stosowana w przypadku niektórych typów nowotworów - miejscowe
podawanie cytostatyków, np. do
, do jamy
, do jamy
•
metoda paliatywna - stosowana w celu spowolnienia progresji choroby lub zmniejszenia
dolegliwości u chorych, u których wyleczenie nie jest możliwe.
•
metoda cytotoksyczna - oddziałująca toksycznie na komórki nowotworowe.
•
metoda antyangiogeniczna - oddziałująca toksycznie na sieć naczyń krwionośnych
dostarczających tlen i składniki pokarmowe do komórek nowotworowych, a odbierających
produkty przemiany materii. Zniszczenie tych naczyń krwionośnych prowadzi do śmierci
komórek nowotworowych w wyniku braku dostawy substancji odżywczych i tlenu.
Stosowane są tu
hamujące rozwój nowych
naczyń krwionośnych.
•
metoda metronomiczna - polegająca na podawaniu małych dawek leków cytostatycznych
w krótkich odstępach czasu.
•
metoda mioablacyjna z autologicznym przeszczepem szpiku kostnego - polegająca na
podaniu dużej dawki leków cytostatycznych, w wyniku działania której poza komórkami
nowotworowymi giną również krwinki. Przed zabiegiem pobiera się od pacjenta komórki
krwiotwórcze ze szpiku kostnego. Komórki te następnie podaje się pacjentowi po
chemioterapii w celu odtworzenia zabitych przy okazji leczenia krwinek.
Powikłania
•
•
•
•
•
•
•
•
i jej przydatków,
•
obniżenie odporności organizmu
•
spadek poziomu białych krwinek
•
spadek poziomu czerwonych krwinek
•
•
•
Leki wspomagające
W premedykacji stosowane sa leki przeciwwymiotne:

tropisetron pozwalające zmniejszyć nudności i wymioty towarzyszące chemioterapii. Niektóre
opracowania
wskazują na zalety stosowania zawartych w
w łagodzeniu
negatywnych skutków takich jak nudności i wymioty, i umożliwianiu pacjentowi odżywiania się.
Leki te wyszły już poza fazę badań naukowych, nie są stosowane w Polsce, mają rejestrację w
USA.
113. Bakteriocyny
Bakteriocyny – substancje antybiotyczne o charakterze
bakterie Gram- oraz Gram+, zdolne do zahamowania wzrostu organizmów pokrewnych, lub nawet
do ich zabicia, są one kodowane przez
bakteriocynogenne oraz DNA chromosomalne.
Bakteriocyny syntetyzowane są w rybosomach.
Bakteriocyny izolowane z:
•
E.coli - kolicyny
•
Pseudomonas aeruginosa - piocyny
•
Bacillus megaterium - megacyny
•
Serratia sp. - marcescyny
•
Proteus - proteocyny, proticyny
•
bakterii fermentacji mlekowej - laktocyny
•
Lactococcus lactis subsp. lactis - nizyna
•
Lactobacillus brevis - laktobrewina
•
Lactobacillus plantarum - laktolina
•
Lactobacillus bulgaricus - bulgarikan
•
Lactobacillus acidofilus - acidofilina
Plazmidy kodujące różne rodzaje kolicyny oznacza się symbolem Col, np. ColE1, ColV.
Od
różni je bardziej "swoiste" działanie. Zwykle hamują one wzrost niewielkiej
liczby gatunków, podczas gdy antybiotyki niszczą wiele grup bakterii.
Historia
Bakteriocyny zostały odkryte w 1925 r. przez belgijskiego mikrobiologa Andre Gratia i nazwane
principle V - czynnik wirulencji.
Lwoff wprowadził dwa pojęcia:
•
bakteriocynogenotypia - zdolność do wytwarzania bakteriocyn
•
bakteriocynotypia - sprawdzanie wrażliwości nieznanych szczepów na zestaw wzorcowy
bakteriocyn
Bakteriocyny były dzielone na grupy:
•
nieupostaciowane - białka nie osadzające się podczas zwykłego wirowania
•
upostaciowane - zdolne do sedymenatcji
Klasyfikacja bakteriocyn
Bakteriocyny bakterii Gram +
Klasa I
Lantybiotyki (lanthionine containing antibiotics) - termostabilne, policykliczne peptydy o masie
cząsteczkowej mniej niż 5 kDa, zawierają w swej budowie nietypowe aminokwasy: lantionina, 3-
metylolantionina, dehydroalanina, kwas dehydrobutylowy
•
Lantybiotyki typu A - wydłużone, elastyczne cząsteczki, których działanie opiera się na

tworzeniu porów w błonie cutoplazmatycznej wrażliwych komórek bakteryjnych.
•
Lantybiotyki typu B - sztywne, globularne cząsteczki o zróżnicowanym mechanizmie
aktywności. Najlepiej poznaną jest nizyna (Lactococcus lactis), która działa bakteriobójczo
na Staphylococcus aureus, Listeria monocytogenes, zapobiega rozwojowi przetrwalników,
hamuje rozwój komórek wegetatywnych Bacillus, Clostridium.
Klasa II
Bakteriocyny nielantybiotykowe - termostabilne białka o masie poniżej 10 kDa, podzielone na 4
podklasy.
•
II A - Bakteriocyny pediocynopodobne - posiadają silną aktywność wobec Listeria ssp
•
II B - Bakteriocyny dwupeptydowe - aby osiągnęły aktywność bakteriobójczą wymagane
jest jednoczesne działanie obu peptydów.
•
II C - Bakteriocyny sec-zależne - wydzielane są przy pomocy białek sec.
•
II D - Bakteriocyny odbiegające budową, mechanizmem działania i sekrecji od poprzednich
Klasa III
Bakteriocyny wysokocząsteczkowe - produkowane głównie przez Lactobacillus i Enterococcus, są
inaktywowane termicznie.
Klasa IV
Kompleksy białkowo - lipidowe i białkowo - węglowodanowe - do uzyskania pełnej aktywności
wymagają obecności części lipidowej lub węglowodanowej w cząsteczce.
Bakteriocyny bakterii Gram -
Kolicyny
Najlepiej poznanymi bakteriocynami są te wytwarzane przez E. coli - kolicyny. Kolicyna wiąże się
swoiście z receptorem umieszczonym w błonie zewnętrznej bakterii, a następnie jest wprowadzana
poprzez błonę zewnętrzną i wewnętrzną do cytoplazmy - w transporcie do komórki biorą udział
dwie grupy białek - Ton System oraz Tol System.
•
niektóre kolicyny tworzą w błonie cytoplazmatycznej wrażliwej komórki kanały, które
powodują obniżenie potencjału elektrochemicznego, np poprzez tworzenie kanałów
półprzepuszczalnych dla jonów potasu (kolicyna A)
•
Inne kolicyny mają działanie hydrolityczne wobec DNA, podobne do działania endonukleaz.
•
Pewna grupa kolicyn hamuje syntezę kwasu rybonukleinowego RNA
•
Kolicyna M - blokuje syntezę peptydoglikanu i LPS
Najlepiej poznanym plazmidem E. coli kodującym kolicynę jest Col E1, który został w pełni
zsekwencjonowany. Kaseta kolicynowa obejmuje geny:
•
cea - koduje kolicynę
•
imm - determinuje białko nadające swoistość antygenową
•
kil (H) - koduje białko lityczne uwalniające kolicynę z komórki
Cechą charakterystyczna jest to, że wytwarzanie kolicyny jest zabójcze dla producenta, uwolnienie
produktu genu cea przy współudziale produktu genu kil powoduje lizę komórki. Cały system jest
jednak w stanie nieaktywnym poprzez działanie białka LexA. Poza tym, komórki aktualnie nie
produkujące kolicyny są chronione przez produkt genu imm.
Mikrocyny
Syntetyzowane przez Enterobacteriaceae, niskocząsteczkowe peptydy, synteza nie jest śmiertelna

dla producenta. Podzielone na 2 podklasy:
•
peptydy o masie mniejszej niż 5 kDa - modyfikowane potranslacyjnie, atakują struktury
wewnątrzkomórkowe
•
peptydy o masie cząsteczkowej od 7 - 10 kDa - nie modyfikowane potranslacyjnie, działają
poprzez uszkodzenie błony komórkowej
Właściwości
Bakteriocyny wytwarzane są przez bakterie w sposób ciągły, w niewielkich ilościach, wzmożenie
ich syntezy można osiągnąć poprzez działanie promieni UV oraz mitomycyną C. Bakteriocyny są
bardzo silne biologicznie - przyjmuje się, że jedna cząsteczka zabija jedną wrażliwą komórkę
bakteryjną. Działanie bakteriocyn warunkuje obecność w ścianie komórkowej szczepów
wrażliwych odpowiednich receptorów, które zdolne są do ich wiązania, niektóre bakteriocyny
muszą przeniknąć przez błonę zewnętrzną bakterii Gram -, aby związać się z ich błoną komórkową.
Mechanizm działania niektórych bakteriocyn
Bakteriocyna
Szczep produkujący
Działanie
Diplokokcyna
Lactococcus lactis subsp
cremoris 346
zahamowanie syntezy DNA, RNA, ograniczenie
syntezy białek
laktostrepcyna 5
Lactococcus lactis subsp.
lactis
wypływ jonów, zakłócenie transportu urydyny,
zahamowanie syntezy DNA, RNA i białek
nizyna
Szczepy Lactococcus lactis
subsp. lactis
zaburzenie potencjału membranowego, wypływ
aminokwasów, kationów
pediocyna AcH
Pediococcus acidilactici H
zahamowanie syntezy ATP, osłabienie systemów
transportu
laktocyna 27
Lactobacillus helvelicus
481
wypływ jonów potasowych, napływ jonów
sodowych
leukonocyna S
Leuconostoc mesenteroides
OX
obniżenie siły protonomotorycznej
bawarycyna MN
Lactobacillus bavaricus
MN
zakłócenie potencjału membranowego, wypływ
karboksyfluoresceiny
mezenterycyna
Y105
Leuconostoc mesenteroides
zakłócenie potencjału membranowego, wyciek
aminokwasów
plantarycyna EF Lactobacillus plantarum
zakłócenie potencjału membranowego, zakłócenie
gradientu pH, wyciek kationów
laktokokcyna G
Lactococcus
lactis
LMG2081
zakłócenie
potencjału
membranowego,
zahamowanie syntezy ATP
plantarycyna JK Lactobacillus plantarum
zakłócenie potencjału membranowego, zakłócenie
gradientu pH, wyciek anionów
Zastosowanie
Ze względu na swoje właściwości antybakteryjne bakteriocyny mogą być wykorzystywane jako
naturalne konserwanty żywności - na chwilę obecną jedyną bakteriocyną stosowaną w technologii
żywności, już od 30 lat jest nizyna. Substancja ta uzyskała status GRAS - generally recognized as
safe i jest stosowana w około 50 krajach jako naturalny konserwant - oznaczona jest jako E 234.

Wykorzystywana jest przy produkcji serów dojrzewających, niektórych deserów, bitej śmietany,
serka mascarpone.
114. Mechanizmy oporności bakterii na antybiotyki
patrz też punkt 108
W wyniku masowego zastosowania antybiotyków obserwuje się szybkie narastanie szczepów
opornych na większość stosowanych antybiotyków. Początkowo wrażliwe bakterie mogą
przeobrazić się w bakterie oporne w wyniku adaptacji lub z przyczyn natury genetycznej. Adaptacja
polega na przystosowaniu się drobnoustrojów do obecności antybiotyku. Do tego typu
niewrażliwości dochodzi najczęściej wskutek niewłaściwego podawania antybiotyku (zbyt małe
dawki) lub też złego przenikania antybiotyku do ogniska chorobowego. O ile mechanizmy
genetyczne prowadzą do stałych zmian we wrażliwości, to mechanizmy adaptacyjne powodują
jedynie zmiany odwracalne, ustępujące po pewnym czasie.
Oporność uwarunkowana genetycznie może być wynikiem mutacji lub pobrania od bakterii
opornych materiału genetycznego, w którym zakodowana jest cecha lekooporności. Materiałem
genetycznym może być DNA pochodzenia chromosomalnego, przekazywany na drodze transdukcji
(fagi), koniugacji lub transformacji;, może być nim też DNA pochodzenia pozachromosomalnego
(plazmidy). Plazmidy są tworami replikującymi się autonomicznie, mogącymi występować w
komórce, lecz zazwyczaj nie będącymi dla niej niezbędne.
Podstawowe mechanizmy bakteryjnej oporności na antybiotyki:
1. enzymatyczna inaktywacja antybiotyku:
a) destrukcja – β-laktamazy rozkładają pierścień β-laktamowy
b) modyfikacja – dodanie grup funkcyjnych do antybiotyku powoduje, że staje się on
nieskuteczny. Do najczęstszych modyfikacji należą fosforylacja, acetylacja
2. Uniemożliwienie dotarcia do celu – antybiotyk nie jest transportowany do miejsca, gdzie ma
nastąpić jego działanie.
-
Zmniejszenie przepuszczalności błon - Dla niektórych antybiotyków przeszkodą jest
błona cytoplazmatyczna lub zewnętrzna u bakterii G(-). Poryny błony
cytoplazmatycznej nie przepuszczają np. rifampicyn.
-
W błonach bakterii opornych na tetracyklinę istnieje białko – pompa, która wyrzuca
wchodzące do komórki cząsteczki antybiotyku zmniejszając jego stężenie w komórce
3. Zmiana celu działania – modyfikacja białka, które stanowiło cel dla antybiotyku powoduje że
antybiotyk nie oddziaływuje z tym białkiem, np. modyfikacja białka 12 w podjednostce 30S
rybosomu prowadzi do oporności na streptomycynę.
4. Zmiana szlaku metabolicznego zablokowanego przez antybiotyk na inny zastępczy.
115. Mechanizm działania wody utlenionej i jodyny
2
O
2
przy rozjaśnianiu włosów.Szczególnie silnie niszcząco działa na
beztlenowe (
Niszczące działanie na bakterie ma
walencyjny), który wytwarza się na powierzchni skóry, wg
Silnie utleniający związek, łatwo reaguje z białkami. Woda utleniona pod wpływem enzymów –
katalaz rozpada się do wody i tlenu. Tlen działa przeciwbakteryjnie, przeciwgrzybiczo i
przeciwgnilnie.Duże lokalne stężenie rodników tlenowych ma niszczące działanie na większość
mikroorganizmów.
Po połączeniu się dwóch rodników tlenowych powstaje zwykły
2
), który nie
ma tak dużego wpływu na drobnoustroje (na
właściwie nie ma żadnego).

Odkażanie ran przy użyciu wody utlenionej znacznie zmniejsza niebezpieczeństwo przedostania się
bakterii do organizmu przez uszkodzony naskórek. Następująca podczas odkażania gwałtowna
reakcja niszcząca bakterie niszczy także komórki krwi wypływającej z rany, a także część komórek
ciała odsłoniętych przez uszkodzenie skóry. Skutkiem tego jest odczuwane pieczenie w odkażanej
okolicy ciała oraz widoczna charakterystyczna piana wywołana wydzielaniem się gazowego tlenu.
Jod jest silnym środkiem antyseptycznym stosowanym do odkażania skóry nieuszkodzonej. Działa
bakteriobójczo, grzybobójczo i wirusobójczo, lecz drażni tkanki, wywołuje powierzchniową
nekrozę (martwicę) posmarowanej tkanki. Jod jest stosowany w formie 3-10% roztworu w 70% lub
95% alkoholu etylowym (jodyna). Jod reaguje z grupami aminowymi białek, hamując ich
aktywność. Wyzwala również tlen z roztworów wodnych co uzupełnia działanie odkażające.
Roztwory alkoholowe jodu denaturują białka strukturalne i enzymatyczne bakterii i grzybów. 7%
roztwór jodu w alkoholu zabija bakterie w ciągu 15 sekund.
Jodyna działa efektywnie na bakterie, endospory, grzyby i wirusy. Niszczy osłony bakteryjne.
Jod rozpuszczony w etanolu ma ograniczoną trwałość. Reaguje z wodą obecną w roztworze (etanol
używany do sporządzania jodyny nie jest 100% i zawiera pewną ilość wody) dając
, który z kolei utlenia etanol do
. Jodowodór działa
drażniąco, dlatego też w celu zwiększenia trwałości preparatu wprowadza się jodek potasu. W
wyniku reakcji jodu cząsteczkowego z anionem jodkowym powstaje stosunkowo trwały anion
I
2
+ I
-
→ I
3
-
Zapobiega to tworzeniu się większych ilości jodowodoru. Jod jest silnym środkiem antyseptycznym
stosowanym do odkażania skóry nieuszkodzonej. Działa bakteriobójczo, grzybobójczo i
wirusobójczo, lecz drażni tkanki, wywołuje powierzchniową nekrozę (martwicę) posmarowanej
tkanki. Jod jest stosowany w formie 3-10% roztworu w 70% lub 95% alkoholu etylowym (jodyna).
Jod reaguje z grupami aminowymi białek, hamując ich aktywność. Wyzwala również tlen z
roztworów wodnych co uzupełnia działanie odkażające. Roztwory alkoholowe jodu denaturują
białka strukturalne i enzymatyczne bakterii i grzybów. 7% roztwór jodu w alkoholu zabija bakterie
w ciągu 15 sekund.
Jodyna działa efektywnie na bakterie, endospory, grzyby i wirusy. Niszczy osłony bakteryjne.
W celu całkowitego rozpuszczenia jodu pierwiastkowego w roztworach alkoholowych i wodnych
dodaje się jodek potasu (np. w płynie Lugola).
116. Do czego stosuje się czwartorzędowe związki amonowe
Czwartorzędowe związki amonowe – detergenty kationowe. (Sterinol, Dezogen). Charakteryzuje
je szerokie spektrum działania (bakterie G+ i G-, grzyby pleśniowe, drożdże, wirusy, ameby; NIE
działają na prątki gruźlicy i endospory ) i długotrwały efekt sterylizacyjny. Ujemną stroną tych
preparatów jest silna presja selekcyjna i możliwość uodpornienia się bakterii G(-) (np. Proteus
vulgaris i Serratia marcescens), co wymusza konieczność przemiennego ich stosowania z
preparatami o odmiennych mechanizmach działania (związkami nadtlenowymi, podchlorynem). Ich
aktywność ulega osłabieniu w obecności związków organicznych i mydła.
117. Bakteriobójcze działanie promieniowania ultrafioletowego- mechanizm
Wyjaławianie za pomocą promieni UV – stosuje się ją do niszczenia drobnoustrojów
znajdujących się w powietrzu i na powierzchniach przedmiotów. Tą metodą można jałowić
pomieszczenia. Używa się jej w szpitalach, aptekach, laboratoriach, chłodniach. Stosuje się światło
o długości fali 250 – 260 nm, którego bakteriobójcze działanie polega na niszczeniu struktury
kwasów nukleinowych, tworzenie się dimerów tyminowych w DNA, wywoływaniu mutacji.
Najwrażliwsze na tę metodę odkażania są formy wegetatywne bakterii, formy przetwalne i wirusy
wykazują dużą oporność.
Document Outline
- WARUNKI WZROSTU BAKTERII:
- Chemiczne metody sterylizacji
- Wytwarzanie antybiotyków
Wyszukiwarka
Podobne podstrony:
Teorie kontroli wzrostu
Kwasy organiczne i nieorganiczne alternatywa dla antybiotyków stymulujących wzrost
kontrola 5
Kontrola badań laboratoryjnych
Czynności kontrolno rozpoznawcze w zakresie nadzoru nad przestrzeganiem przepisów
Praktyczne zasady antybiotykoterapii
uwaga i kontrola poznawcza
T11 Wzrost gospodarczy
KONTROLA PAŃSTWOWA
więcej podobnych podstron