ZES TAW I
1.
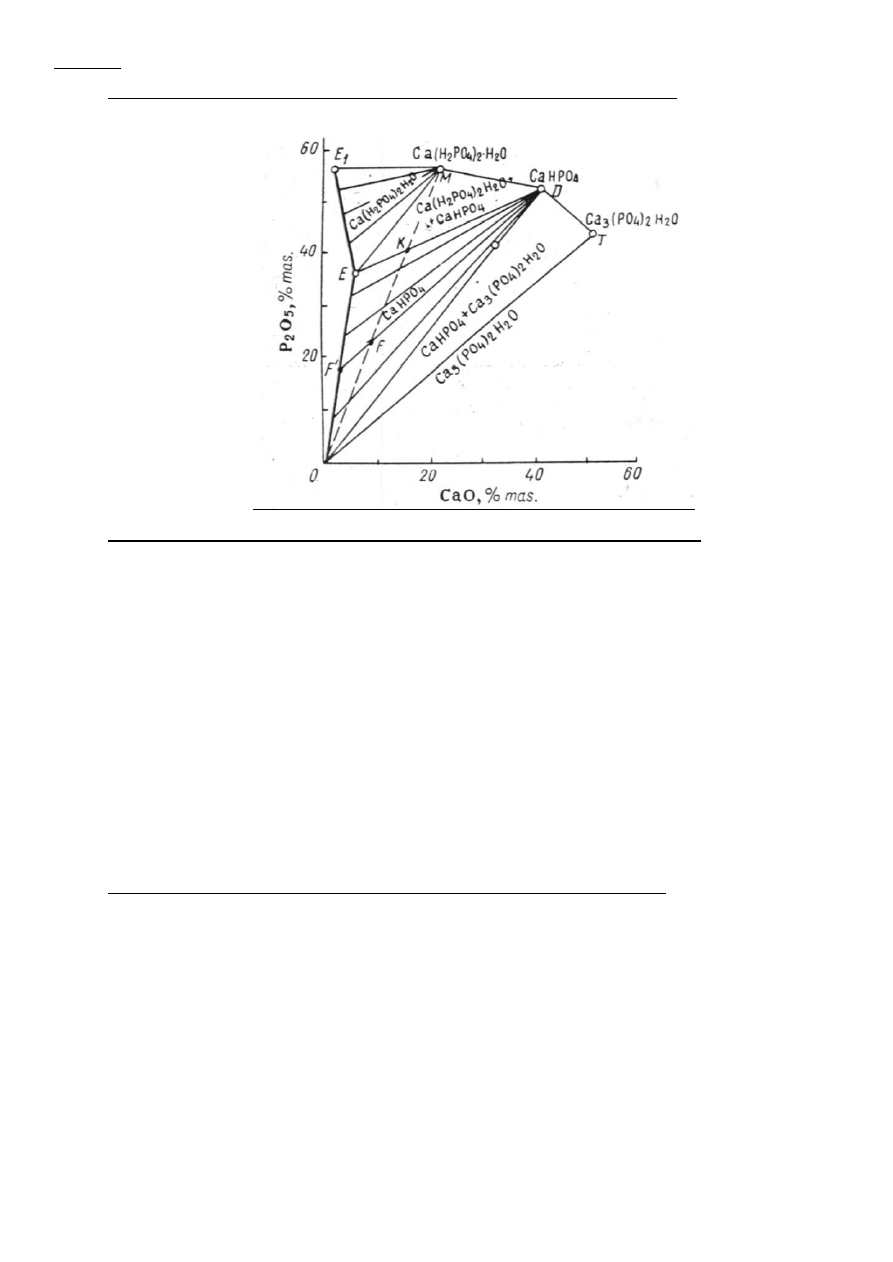
Omówić izotermę CaO-P2O5.Kiedy układ osiąga punkt eufeniczny(?) i jakie fazy wówczas występują ?
2.
Schemat ideowy otrzymywania HNO3 stężonego – reakcje i parametry operacji i procesów jednostkowych.
Kontaktowe utlenianie amoniaku
↓
Wydzielenie nadmiaru wody
↓
Utlenianie w gazach NO do NO
2
↓
Dotlenianie resztek NO za pomocą
stężonego HNO
3
↓
Ochładzanie gazów i stęż. kwasu
przed absorpcją
↓
Absorpcja NO
2
w stęż. kwasie azotowym
↓
Desorpcja NO
2
z nitroleum
↓
Otrzymanie ciekłego dimeru
N
2
O
4
↓
Synteza HNO
3
w autoklawie
↓
Bielenie HNO
3
4NH
3
+ 5O
2
= 4NO + 6H
2
O siatki platynowe, 850
0
C
2 HNO
3
+ NO = 3NO
2
+ H
2
O, wieże utleniające, 55-60% HNO
3
Temp. ok. 8
0
C
Temp. ok. 80
0
C
Chłodzenie solanką, tem -8 - -10
0
3.
Schemat ideowy produkcji siarki z H2S metodą Clausa – reakcje i parametry poszczególnych etapów
Stężony siarkowodór przerabia się na siarkę na kontakcie z aktywowanego boksytu.
Spalanie siarkowodoru w kotle-utylizatorze H
2
S + 3/2O
2
= SO
2
+ H
2
O
↓
Aparaty kontaktowe z boksytem 2H
2
S + SO
2
= 3S + 2H
2
O
↓
Wykroplenie ciekłej siarki
↓
Usunięcie SO
2
↓
Atmosfera

ZES TAW II
1.
Podać bilans napięciowy i energetyczny dla otrzymywania Al. Na jakie wskaźniki ma on wpływ ?
Bilans energetyczny elektrolizera:
U
s
= U
śr
∙ h
Uśr = Ut + Ue + U
A
+ U
K
+ Uo +U
eA
h- ilość płyt
Ue – spadek napięcia na elektrolizerze 35%
U
A
– napięcie na anodzie 13%
U
K
- napięcie na katodzie 10%
Uo – napięcie na oczyszczeniu 2%
U
eA
- napięcie efektu anodowego 2%
Efekt anodowy – gwałtowny wzrost napięcia na elektrolizerze wywołany brakiem zwilżalności anody.
Wskaźniki procesu elektrolizy na 1kg Al.
Zużycie: Al
2
O
3
~ 1,9 t , masy anodowej ~0,52t, kriolitu~0,05t, energii elektrycznej 15000 kWh, wydajność prądowa 0,87, wydajność
energetyczna 0,5.
2.
Schemat ideowy otrzymywania Cu metodą ogniową, reakcje i parametry.
A) Prażenie rud siarczkowych
↓
B) Wytapianie kamienia miedziowego
↓
C) Otrzymywanie miedzi czarnej (surowej)
↓
D) Rafinowanie ogniowe miedzi czarnej w piecach płomiennych
↓
E) Biegunowanie
↓
99%Cu
A) Przejście chalkopirytu w Cu
2
S oraz części żelaza w FeS
B) Temp. 1500
0
C
Cu
2
S + 2Cu
2
O = 6Cu + SO
2
2Cu + FeS = Cu
2
S + Fe
Cu
2
O + FeS = Cu
2
S + FeO, Jeżeli jest Malo FeS to część Cu przechodzi do żużla w wyniku reakcji: Cu
2
O +SiO
2
=
Cu
2
O∙SiO
2
C) Stopiony kamień miedziowy wlewa się do konwertora i przedmuchuje powietrzem o ciśnieniu 1 atm.
2FeS + 3O
2
+ 2SiO
2
= 2FeO∙SiO
2
+2 SO
2
Cu
2
S + 3/2O
2
= Cu
2
O + SO
2
Cu
2
O + FeS = Cu
2
S + FeO, następnie usuwa się FeS i zachodzą reakcje:
Cu
2
S + O
2
= 2Cu + SO
2
Cu
2
S + 3/2O
2
= Cu
2
O + SO
2
Cu
2
S + 2Cu
2
O = 6Cu + SO
2
D) Utlenienie i przeprowadzenie do żużla oraz odparowanie przez wdmuchiwanie powietrza domieszek metali:
Cu
2
O + M e = 2Cu + M eO
Cu
2
S + 2Cu
2
O = 6Cu + SO
2
3.
Schemat ideowy otrzymywania H2SO4 z siarki rodzimej, parametry procesu, reakcje, warianty technologiczne.
M etody wydobywania siarki:
Flotacyjno-filtracyjna wstępnym stadium jest flotacja, po której uzyskuje się
koncentrat zawierający ponad 80% siarki. Koncentrat odwadnia się na filtrach
próżniowych. Rafinacja polega na stopieniu i oddzieleniu siarki przez sedymentację lub
sączenie (140-155
0
C)
Ekstrakcyjna siarkę wymywa się ze wstępnie odwodnionej rudy za pomocą
siarczku amonu. Złoże po ekstrakcji przemywa się świeżym roztworem siarczku amonu i
wodą a następnie r-r rozdziela się przez ogrzewanie pod ciśnieniem na ciekłą siarkę, parę
wodną, amoniak i siarkowodór. Siarkę oddziela się od wody i poddaje krystalizacji. Z
gazów i pary wodnej powstaje na nowo siarczek amonu. Siarka jest bardzo czysta
(99,9%).
Frasha polega na przewierceniu nakładu i opuszczeniu rurociągów złożonych z
trzech koncentrycznych rur w odległości kilkudziesięciu metrów jeden od drugiego.
Rurami tymi wprowadza się do pokładu wodę pod ciśnieniem, przegrzaną do temp 165
0
C,
która topi siarkę w najbliższym otoczeniu odwiertu, oraz sprzężone i ogrzane powietrze,
które wydobywa stopioną siarkę na powierzchnię na zasadzie pompy mamutowej. Siarka
zastyga na powierzchni.
ZES TAW III
1.
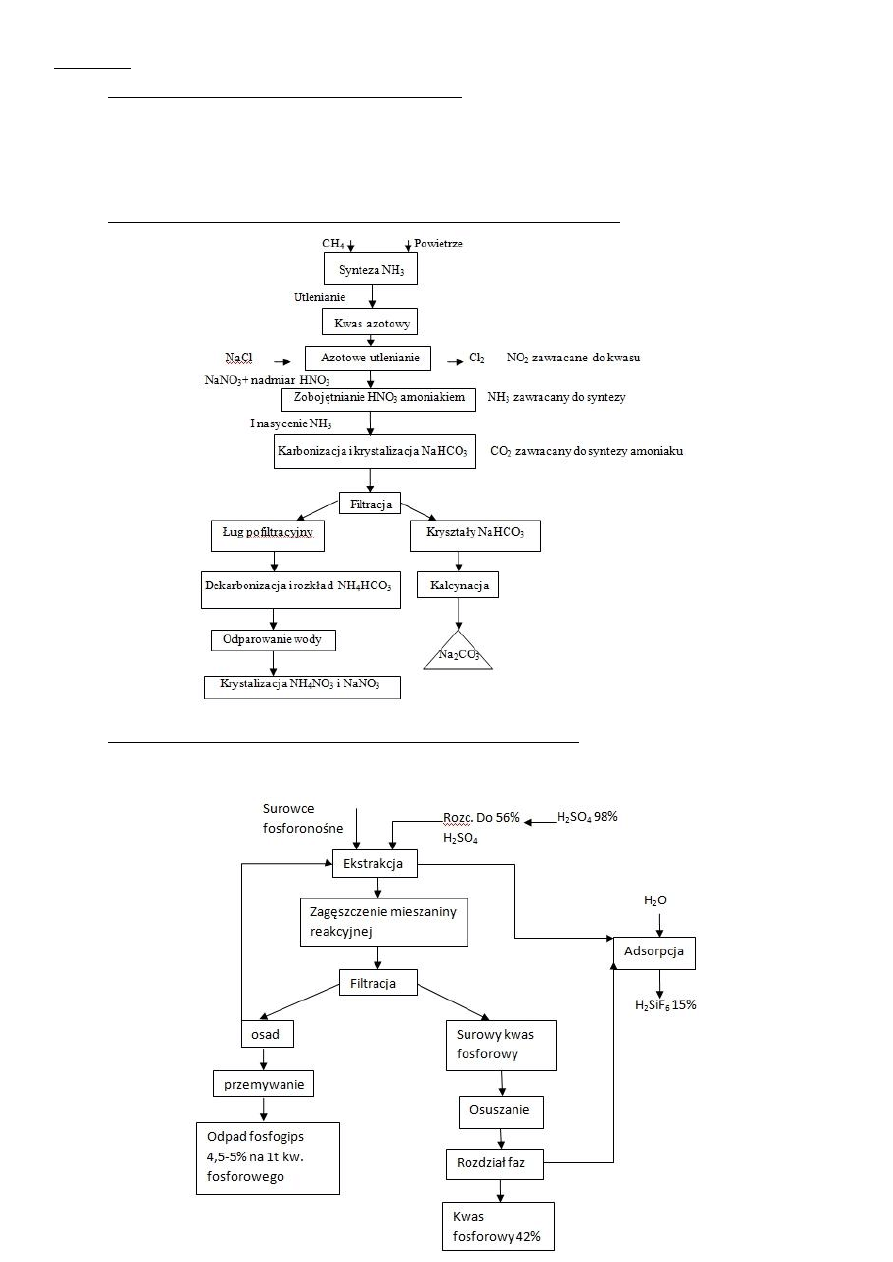
Kolumna Hoblera, opisać warunki w poszczególnych częściach.
Kolumna Hoblera to kolumna z wypełnieniem, podzielona na dwie części. W górnej części tzw. saturatorze, amoniak absorbuje się w roztworze
azotanu amonowego, zawierającym kwas azotowy. Następuje tu całkowite zobojętnienie kwasu azotowego i rozpuszczenie się amoniaku w
znacznym nadmiarze. Alkaliczny roztwór spływa długą rurą syfonową do drugiej części kolumny – skrubera. U dołu rury syfonowej następuje
mieszanie się amoniakalnego ługu z kwasem azotowym wprowadzonym w nadmiarze. Tworzy się tu najwięcej azotanu amonowego. Gorący
kwaśny roztwór od góry zasila skruber. W przeciwprądzie do roztworu płynie powietrze. W wyniku odparowania wody do powietrza następuje
zatężenie roztworu azotanu amonowego. Znaczna część ciepła reakcji wykorzystuje się do odparowania roztworu. Kwaśny roztwór w części
odpuszcza się do zbiorników końcowej neutralizacji, a w części pompuje do saturatora.
2.
Schemat ideowy otrzymywania HNO3 z syntezą amoniaku, podaj stężenia na każdym etapie.
3.
Schemat otrzymywania kwasu fosforowego metodą ekstrakcyjną. Temperatura 70
0
C
Reakcja ogólna:
Ca
3
(PO
4
)
3
F + 5H
2
SO
4
+ mH
2
O+n H
2
SO
4
= (n+3) H
3
PO
4
+ 5 CaSO
4
∙n H
2
O + HF
ZES TAW IV
1.
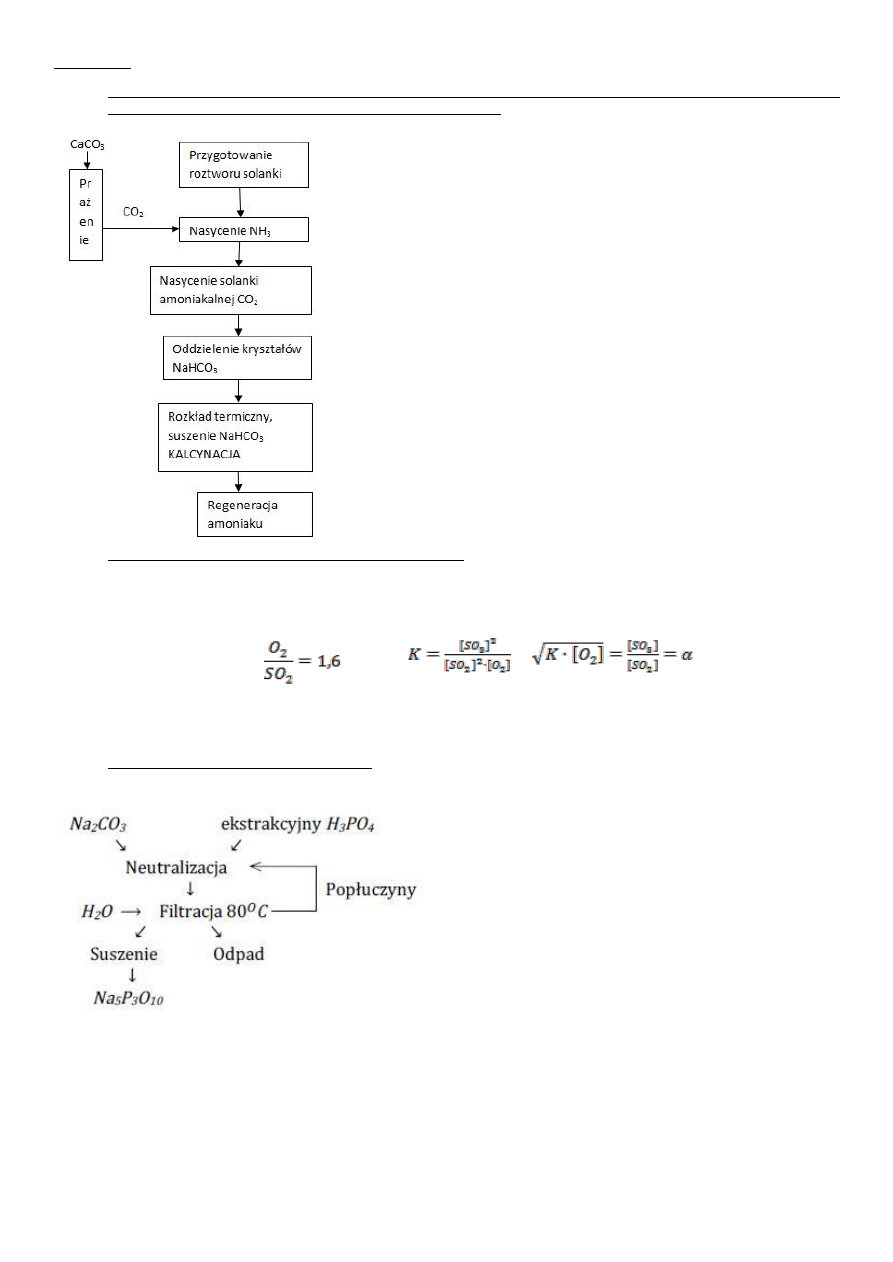
chemat ideowy otrzymywania sody metodą Solvaya. Podać reakcje, warunki procesu i omówić na tym przykładzie zasadę
maksymalnego wykorzystania surowca + chyba coś o karbojonowaniu.
CaCO
3
= CaO + CO
2
2NaCl +2NH
3
+2CO
2
+2H
2
O=2NaHCO
3
+2NH
4
Cl
2NaHCO
3
= Na
2
CO
3
+CO
2
+ H
2
O
M ieszanie z mlekiem wapiennym i ogrzewanie.
Amoniak zawracany do nasycenia
2NH
4
Cl + CaO = 2NH
3
+ H
2
O + CaCl
2
Reakcja ogólna CaCO
3
+ 2NaCl= Na
2
CO
3
+ CaCl
2
Amoniak nie zużywa się w reakcji.
Max wykorzystanie produktów w metodzie Solvaya: Jako produkt po karbonizacji
otrzymujemy związki amonowe. Amoniak możemy odzyskać z wodorotlenku i węglanów
przez ogrzewanie roztworu do 70
0
C. Chlorek rozkłada się pod działaniem wodorotlenku
wapnia. Zregenerowany amoniak jest zawracany i używany ponownie do nasycenia solanki.
2.
Warunki termodynamiczne i kinetyczne utleniania SO2 do SO3.
2SO
2
+O
2
=2SO
3
279 kJ/mol
Proces prowadzi się na katalizatorze V
2
O
5
w temperaturze 1780
0
C.
Najlepsza wydajność wraz ze wzrostem ciśnienia i obniżeniem temperatury. Aby przyspieszyć reakcję stosuje się katalizatory, które
ocenia się pod względem: aktywności, selektywności, powierzchni właściwej, wytrzymałości mechanicznej i termicznej, odporności
na starzenie, odporności na zatrucia.
3.
Schemat otrzymywania trój polifosforanu sodu.
3K
3
PO
4
+2,5 Na
2
CO
3
+ n H
2
O= 2Na
2
HPO
4
+(n+2,5)H
2
0+CO
2
Dehydratacja:
4Na
2
HPO
4
+2NaH
2
PO
4
=2Na
4
P
2
O
7
+Na
2
H
2
P
2
O
7
+3H
2
O T=100
0
C
2Na
4
P
2
O
7
+2NaH
2
P
2
O
7
=2Na
5
P
3
O
10
+H
2
O T=400
0
C
2N
2
O
4
+O
2
+H
2
O=4HNO
3
ZES TAW V
1.
Omówić syntezę HCl i kwasu solnego.
metoda: 2NaCl + H
2
SO
4
(T 500) Na
2
SO
4
+ 2HCl spiekanie
metoda: C
6
H
6
+ Cl
2
C
6
H
5
Cl chlorowanie zw. organicznych
H
2
+ Cl
2
2HCl synteza
Cl
2
+ hγ 2Cl
Cl + H
2
HCl + H
H + Cl
2
HCl + Cl
HCl tworzy azeotrop – 20% wag HCl w 107
o
C- proces adiabatyczny
Synteza chlorowodoru jest r. łańcuchową. Może być inicjowana sposobem technicznym lub fotochemicznym. Doprowadza się substraty do
strefy r. z odpowiednimi prędk., pierwotnie były używane aparaty kwarcowe, obecnie metalowe i mieszane. W aparacie metalowym ciepło
odprowadza się przez płaszcz wodny. Komora spalania ma stosunkowo duże wymiary tak aby płomień nie mógł zetknąć się ze ścianą komory
Gazy w odpowiednim stosunku zwykle z nadmiarem H
2
doprowadza się osobno i miesza w palniku. Otrzymany chlorowodór absorbuje w
wodzie tworząc HCl || dobrze rozpuszcza się w wodzie, absorpcja może być izotermiczna i adiabatyczna. Izotermiczna- ciepło odprowadza się
przez chłodzenie przeponowe. Ciepło jest oddawane przez dobrze przewodzące materiały węgla lub grafitu uszczelnionego. Aby otrzymać kw.
stęż. i całkowicie wymyć chlorowodór z gazów należy utrzymać niską T gazu i duże zużycie H
2
O do chłodzenia. Adiabatyczna- ciepło
odprowadza się jako ciepło parowania H
2
O. T wzrasta, kwas wrze i ciepło wydziela się w postaci pary. Nie musi być zbudowany z dobrze
przewodzących materiałów.
2.
Schemat ideowy produkcji kwasu siarkowego z blendy cynkowej. Wypisać reakcje i parametry, wymienić zastosowaną aparaturę.
Jest podstawowym surowcem do produkcji cynku, a otrzymywany przy tym kwas siarkowy stanowi produkcję uboczną
2ZnS + 3O
2
2ZnO + 2SO
2
Faza stała (ZnO) ma większą obj. od fazy zanikającej (ZnS) i powstając na pow. ziarn tworzy warstwę blokującą dostęp tlenu do ich wnętrza.
Wszystkie r. są egzotermiczne, więcej ciepła wydziela się przy prażeniu pirytu.
Ruda ZnS,PbS>rozdrabnianie i mielenie>flotacja>1)-konc.galenowy(79%Pb);2)konc.Zn(zaw.Zn61%)>utl.koncentratu(ZnS+1,5O2-
>ZnO+SO2)>1)7%SO2 do prod H2SO4;2)prażonka(technicznyZnO)>1)redukcja(ZnO+C->Zn+CO-prod.ZnO;2)ługowanie(ZnO+H2SO4-
>ZnSO4+H2O)>oczyszczanie r-ru>rozdział faz>1)szlamy;2)elektroliza>prod.ZnO
3.
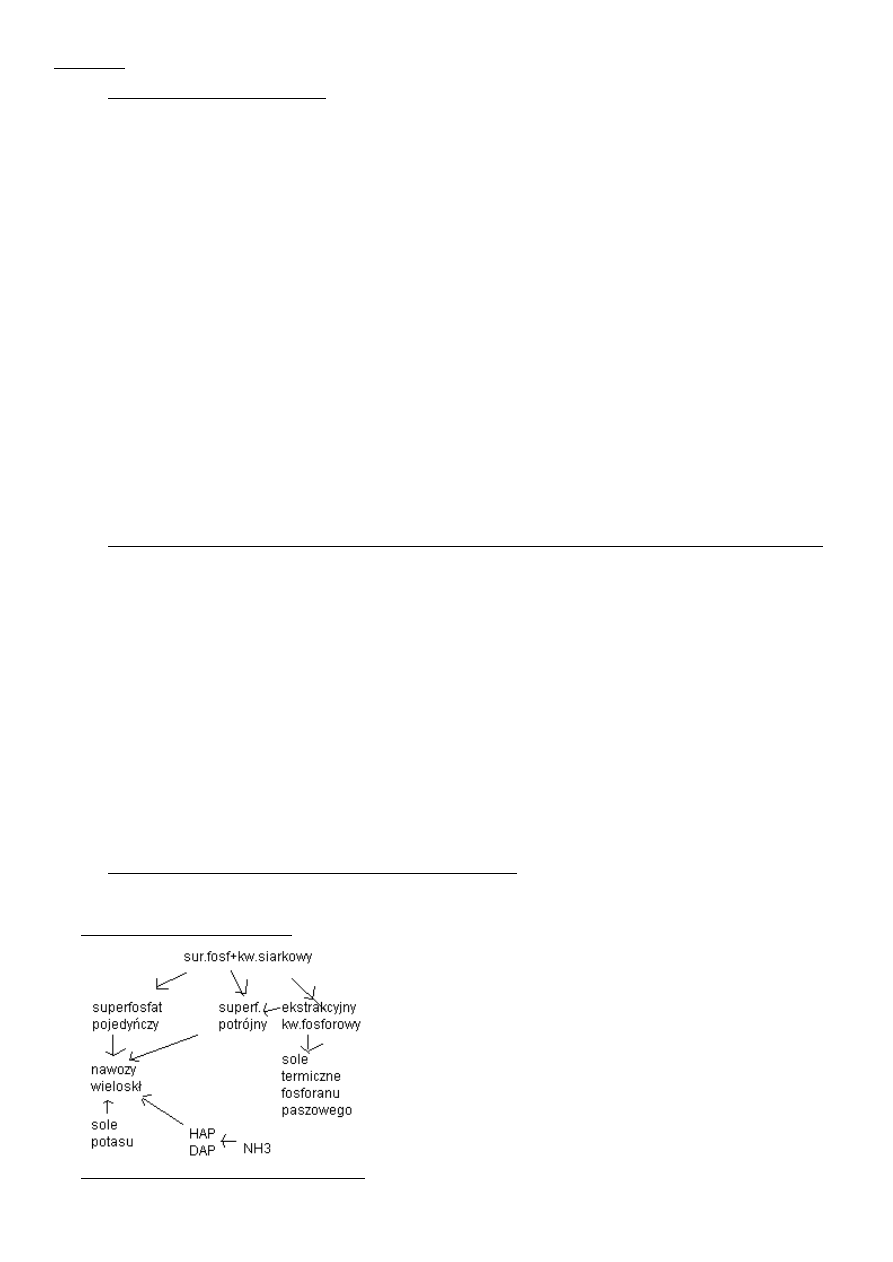
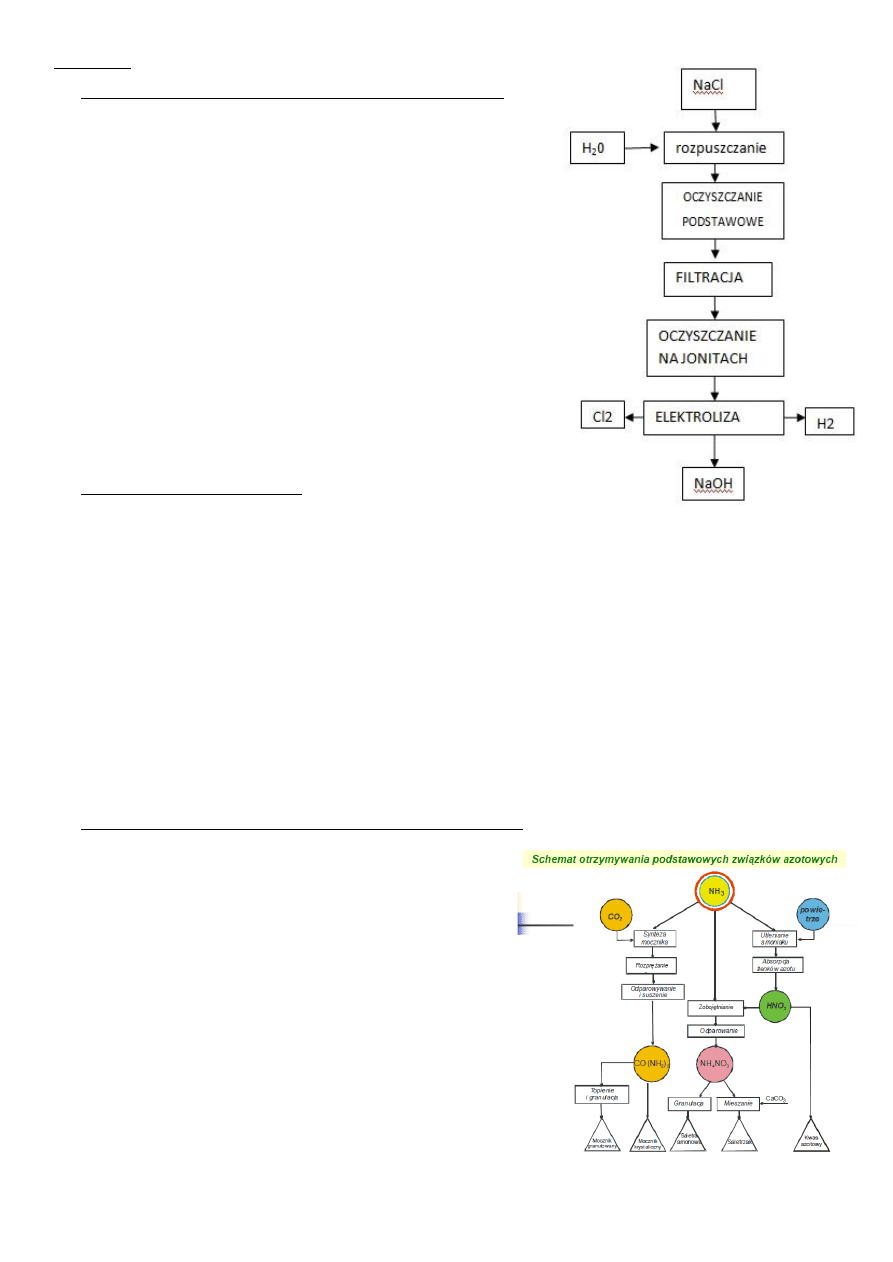
Schemat ideowy przeróbki surowców fosforonośnych kwasem siarkowym.
Kw siarkowy + surowiec fosforonośny
ZES TAW VI
1.
Schemat otrzymywania chloru metodą membranową – podaj reakcje i opisz.
2NaCl+H
2
0=2NaOH+H
2
+Cl
2
Podstawowe reakcje elektrolizy
H
2
O=H
+
+Cl
2
(K) 2H
+
+2e=H
2
(A)4OH
-
-4e=2H
2
0+O
2
Met membranowa: polimery jednowymienne (polielektrolity) na bazie kw
nadfluorosulfonowego; 1) duża selektywność (praktycznie nie przepuszczają
anionów), 2)mały opór elektryczny (małe napięcie w elektrolizerze i małe
zużycie en) 3)długie okresy pracy, 4)znaczna odporność mechaniczna
2.
Otrzymywania Al2O3 metodą Grzymka.
- otrzym. Al
2
O
3
z sur., które nie są boksytami. Sur. zaw. dużo krzemionki i tl. żelaza.
1 Spiekanie surowców glinonośnych z kamieniem wapiennym (dehydratacja i rozpad minerałów, rozpad CaCO3; reakcja CaO z
mieneralami)
Al
2
O
3
2SiO
2
2H
2
0=(T) Al
2
O
3
+SiO
2
+2H
2
O
CaCO
3
=Ca0+CO
2
XCaO+yAl
2
O
3
+5CaO3Al
2
O
3
+CaOAl
2
O
3
2CaO+SiO
2
=β2CaOSiO
2
(CaSiO
4
)
β CaSiO
4=
γCa
2
Si0
4
(675c)
2 ługowanie spieków
*5CaO3Al
2
O
3
+ Na
2
CO
3
+ H
2
O= 6NaAlO
2
+5CaCO
3
+ NaOH
3 usuniecie krzemionki 160C
2NaSiO3+ NaAlO
2
+Ca(OH)2=CaOAl2O3SiO2 6NaOH
karbonizacja glinianu
NaAlO
2
+NaOH+ CO2+H2O=Al.(OH)3 + Na2CO
3
+H2O
5 kalcynacja i regeneracja
2Al(OH)
3
=2AlO+3H
2
O (1200C)
3.
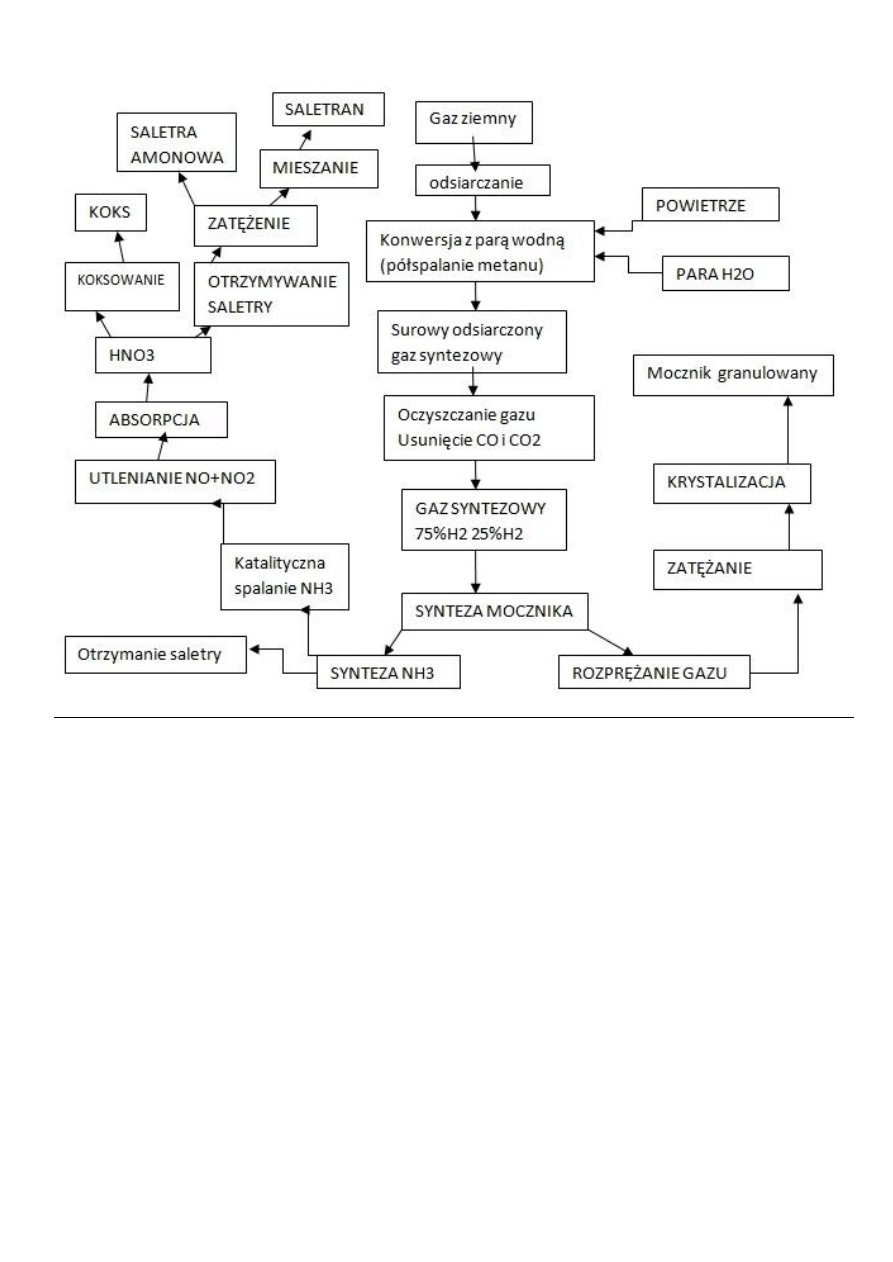
Otrzymywanie związków azotowych z gazu ziemnego, opisać konwersję metanu.
Temperatura500C
Szybkość reakcji jest tym większa im wyższa temperatura oraz stosunek H
2
O/ CH
4
CH
4
+H
2
O=CO+3H
2
CH
4
+2H
2
O=CO
2
+4H
2
CH
4
+0,5O
2
= CO+2H
2
CO+H
2
O=CO
2
+H
2
Reakcje uboczne: CH
4
+ CO
2
= 2CO+2H
2
CH
4
+ CO
2
=4CO+2H
2
O
CH
4
=C+2H
2
Proces konwersji metanu prowadzony jest w piecu opalanym metanem, w
komorze pieca znajdują się rury kontaktowe wypełnione kontaktem niklowym.
Powstały po procesie CO utlenia się w konwersji normalno temperaturowej
(kat:tl.żelaza, Tl.chromu), lub niskotemperaturowej (kat:tl.chromu i miedzi)
ZES TAW X
1.
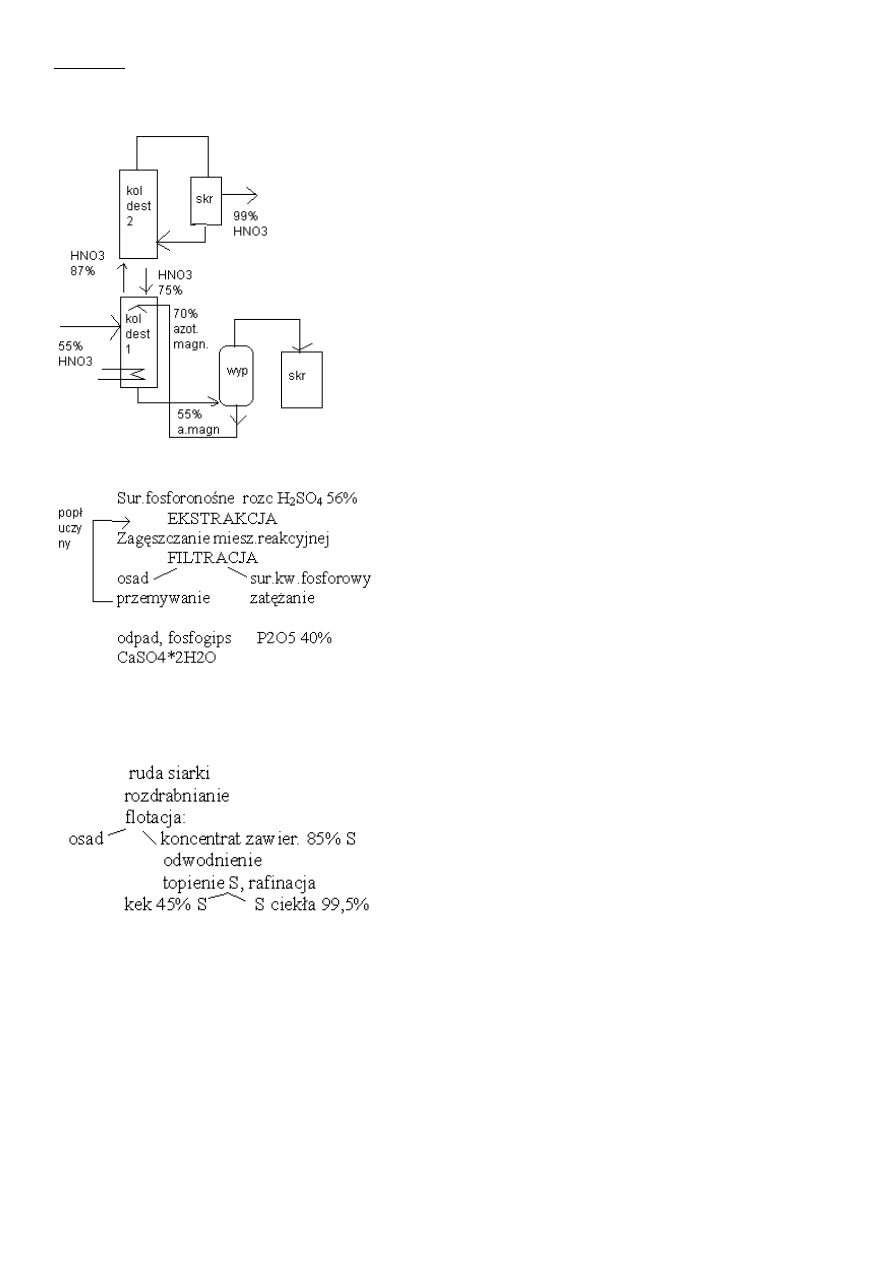
Podać i opisać aparaturę do produkcji kwasu azotowego za pomocą azotanu magnezu.
Rozcieńczony kwas HNO3( 55-65%) dopływa do kolumny destylacyjnej która równocześnie jest zraszana Mg(NO)3 (70%). Kolumnę ogrzewa
się parą wodną i odprowadza się opary HNO3(87%) do drugiej kolumny destylacyjnej,
gdzie dochodzi do rozdziału na kwas 99% HNO3 oraz 75% który zawracamy zpowrotem
do pierwszej kolumny. U dołu tej kolumny odprowadza się ok. 55-65% Mg(NO3)2 W
celu odparowania części wody i zawrócenia zpowrotem do procesu już jako 70% roztwór.
2.
Podać schemat ideowy otrzymywania kwasu fosforowego metodą ekstrakcyjną.
Główna reakcja to Ca
5
(PO
4
)
6
F + m H
2
O+ H
2
SO
4
+ n H
3
PO
4
CaSO
4
*mH
2
O + HF
+ (n+3) H
3
PO
4
3.
Metody otrzymywania siarki.
A. flotacyjno-rafineryjna:
B. Frasha: Umieszcza się 3 rury w otworze wiertniczym. Pomiędzy rurę zewnętrzną a środkową wprowadza się parę wodną o temp. 160st
C. Pod jej wpływem siarka się topi(112-temp top. S) i wypływa razem z powietrzem wtłaczanym rurą wewnętrzną pod ciśnieniem
C .Clausa- utlenianie stęż. H2S: H2S+ 3/2 O2SO2 + H2O SO2+2 H2S 3S+ 2H2O
D. ekstrakcyjna:
rozdrabnianie rudy
wymywanie S roztworem (NH4)2S
kolejne przemywanie wodą i stez (NH4)2S
powstają wielosiarczany HN4, które rozkładają się pod wpływem T, p
otrzymujemy ciekłą siarke, pare wodną, H2S, NH3
oddzielenie siarki
krystalizacja

ZES TAW XI
1.
Schemat ideowy otrzymywania NH3 z gazu ziemnego. Szczegółowo scharakteryzować metody odsiarczania.
Odsiarczanie:
M etoda mokra- absorcja 20-40 g/N*m3 H2S
M etoda sucha- adsorpcja węglowodorów 7,5g/N*m3
Metoda kombinowana pozwala na dogłębne usuniecie H2S
2.
Podać etapy przeróbki boksytów na Al2O3. Scharakteryzować metody równoległe i szeregowe.
Boksyty składają się głównie z Al2O3 ale również z SiO2 TiO2 Fe2O3 CaO stosunek Al2O3/SiO2= alfa( moduł krzemionkowy) Decyduje on o
tym czy należy użyć metody Bayera czy spiekania. Alfa<7 metoda spiekania(szeregowo) alfa> 7 metoda bayera (równolegle)
Ogólnie:
1.Rozdrobnienie boksytu, prazenie w celu usunięcia wody i rozkładu subst. Organicznych (450), mielenie
2. ługowanie r-rem NaOH w temp.200*C pod cisnieniem 0,4-2,5 MPa
3. rozdział r-ru glinianu sodowego od szlamu czerwonego
4. rozkład glinianu do wodorotlenku
5. kalcynacja wodorotl.glinu
M etoda Bayera:
Rozkład glinianów NaAl(OH)4= NaOH+ Al(OH)3
Kalcynacja: 2 Al.(OH)3alfa Al2O3 + 3H2O
M etoda spiekania: różni się tym od metody Bayera ze przed ługowanie spiekamy rozdrobniony boksyt z CaCO3 i Na2CO3:
Al2O3+ Na2CO3 2NaAlO2+ CO2
SiO2+ 2CaCO3 Ca2SiO4 +2CO2
Fe2O3+ Na2CO3Na2O*Fe2O3 + CO2
Spiek poddaje się ługowaniu wodą:
2NaAlO2+ CO2+3H2O 2Al(OH)3 + Na2CO3
3.
Omówić aspekty termodynamiczne i kinetyczne konwersji SO2 do SO3.
SO2+1/2 O2 SO3 H= -95,9kJ
Stała ciśnieniowa: Kp= p
SO3
/ p
SO2
*p
O2
^
1/2
Stopień przemiany x=
2
1
pO
Kp
Kp
Stopień przemiany w stanie równowagi zależy od składu gazów i zmniejsza się ze wzrostem SO2 w gazie, a wzrasta przy wzroście zawartości
tlenu i przy wzroście ciśnienia ogólnego. Z reguły La Chateliera wynika że najlepszą wydajność przemiany tlenków można osiągnąć w niskich
temp im pod zwiększonym ciśnieniem W niższych temp wpływ ciśnienia jest niewielki dlatego nie buduje się instalacji kontaktow ych
pracujących pod ciśnieniem.
ZES TAW XII
1.
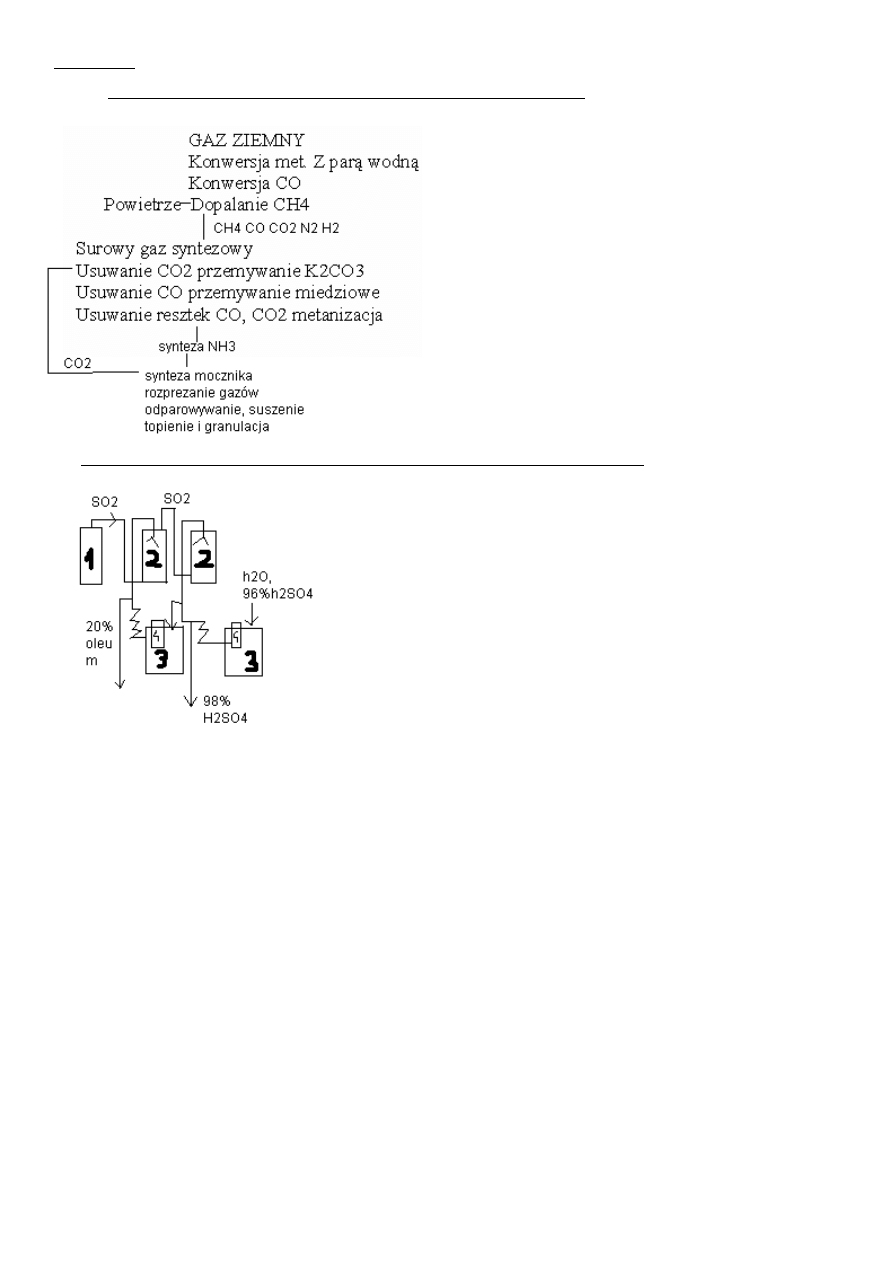
Schemat ideowy otrzymywania mocznika z gazu ziemnego, podać reakcje i parametry.
odsiarczony
Konwersja: 973-1073K p=3-3,5Mpa kat Ni/Al2O3
CH4 +H2O CO + 3H2
CH4+ 2H2OCO2 + 4H2
CO+H2) CO2+ H2
Synteza mocznika:p=14-25MPa t= 140-200stC
2NH3+CO2NH4COONH2
NH4COONH2 CO(NH)2 + H2O
3.Podaj i opisz schemat instalacji do absorpcji S O3 w celu otrzymania kwasu
siarkowego i oleum.
1-chłodnica
2- kol.absorpcyjna
3-zbiornik
4-pompa
Gaz z chłodnicy jest transportowany do wież absorp . Gdzie w pierwszej jest zraszany 20% oleum. Jest to reakcja egzo, zatem doprowadza
się taka ilość oleum żeby stez nie przekroczylo 1,5 raza początkowego. Aby utzrymac 20% stez dodaje się 98% kwasu siarkowego, a
nadmiar oleum się odprowadza. Drugą wieze zrasza się 98% H2SO4 i absorbuje się resztki SO2 z pierwszej kolumny. Aby utrzymac 98%
stez kwasu dodaje się 96%r-r H2SO4 oraz wodę.
Wyszukiwarka
Podobne podstrony:
Pytania na egz z Ekonomiki, OPRACOWANIE PYTAŃ NA EGZAMIN
PYT EGZ MASZYNY OPRACOWANIE, Polibuda, III semestr, Maszyny Elektryczne
egz end, opracowania na egzamin obrone, Wstęp do nauki o państwie , prawie i polityce
pytania egz ekonimak, OPRACOWANIE PYTAŃ NA EGZAMIN
ekonomika egz pyt, OPRACOWANIE PYTAŃ NA EGZAMIN
egz. OWI opracowanie, owi
semestr 1 opracowanie pyt egz, CHEMIA OPRACOWANA2003
egz wady opracowane pytania, AWF Kraków, Wady postawy
EKONOMIKA EGZ ZESTAWY, OPRACOWANIE PYTAŃ NA EGZAMIN
zagadnienie na egz dypl opracowanie
egz.+pytania+++opracowanie, socjologia, Socjologia Ludności, notatki UJ z tekstów, uj
PYT-EGZ-MASZYNY-OPRACOWANIE, Politechnika Poznańska, 2 rok, III, Maszyny el
egz end, opracowanie pytan z licencjata, GEOGRAFIA POLITYCZNA
mikro egz prakt opracowanie2
sem III GO egz pytania opracowanie
Pytania na egz z Ekonomiki, OPRACOWANIE PYTAŃ NA EGZAMIN
więcej podobnych podstron