4. Wiązania chemiczne
Tworzenie cząsteczek umożliwia pierwiastkom
uzyskanie na zewnętrznej powłoce
konfiguracji elektronowej zapewniającej im
minimum energetyczne i bierność chemiczną;
takie działanie prowadzi do powstania
wiązania chemicznego
Tylko nieliczne pierwiastki występują w przyrodzie w stanie atomowym; większość łączy się z innymi
atomami tworząc
cząsteczk
i.
cząsteczki pierwiastków -
zbudowane z tych samych
pierwiastków
cząsteczki związków
chemicznych – tworzone przez
atomy różnych pierwiastków
Wg
elektronowej
teorii
wiązań
chemicznych
(Kossel i
Lewis, 1916)
reagujące ze sobą atomy dążą do
uzupełnienia
lub
zredukowania
walencyjnej
(zewnętrznej)
powłoki
elektronowej do
powłoki najbliższego
helowca,
tzn.
do
8
elektronów
,
stanowiących tzw.
oktet elektronowy,
lub
do 2
elektronów
(tzw
.
dublet
elektronowy - jak w przypadku helu).
Sposób, w jaki następuje uzupełnianie lub
redukcja elektronów walencyjnych i rodzaj
tworzonego wiązania zależy od elektroujemności
pierwiastków je tworzących
przy znacznej różnicy w elektroujemności (o więcej niż 1,7 w skali Paulinga) następuje
przekazanie elektronów
jednego atomu drugiemu
–
powstaje
wiązanie heteropolarne (jonowe)
przy atomach tych samych pierwiastków
lub
atomach niemetali o małej różnicy elektroujemności
następuje
uwspólnienie (współużytkowanie) elektronów walencyjnych
–
powstaje
wiązanie kowalencyjne (atomowe)
lub
wiązanie
donorowo-akceptorowe (koordynacyjne
)
J.Szymońska KChiF UR, Kraków, 2013/2014

Liczba wiązań chemicznych, jakie
tworzy atom -
to
wartościowość
pierwiastka
w danym związku
chemicznym
W stanie wolnym wartościowość
pierwiastka wynosi 0;
zależnie od rodzaju związku
wartościowość tego samego
pierwiastka może być różna
Elektrony w cząsteczkach są opisywane za pomocą
orbitali molekularnych
czyli
cząsteczkowych
Orbitale molekularne powstają przez zbliżenie i „nałożenie”
się orbitali atomowych o podobnych energiach i tej samej
symetrii względem osi łączącej dwa jądra atomowe.
J.Szymońska KChiF UR, Kraków, 2013/2014
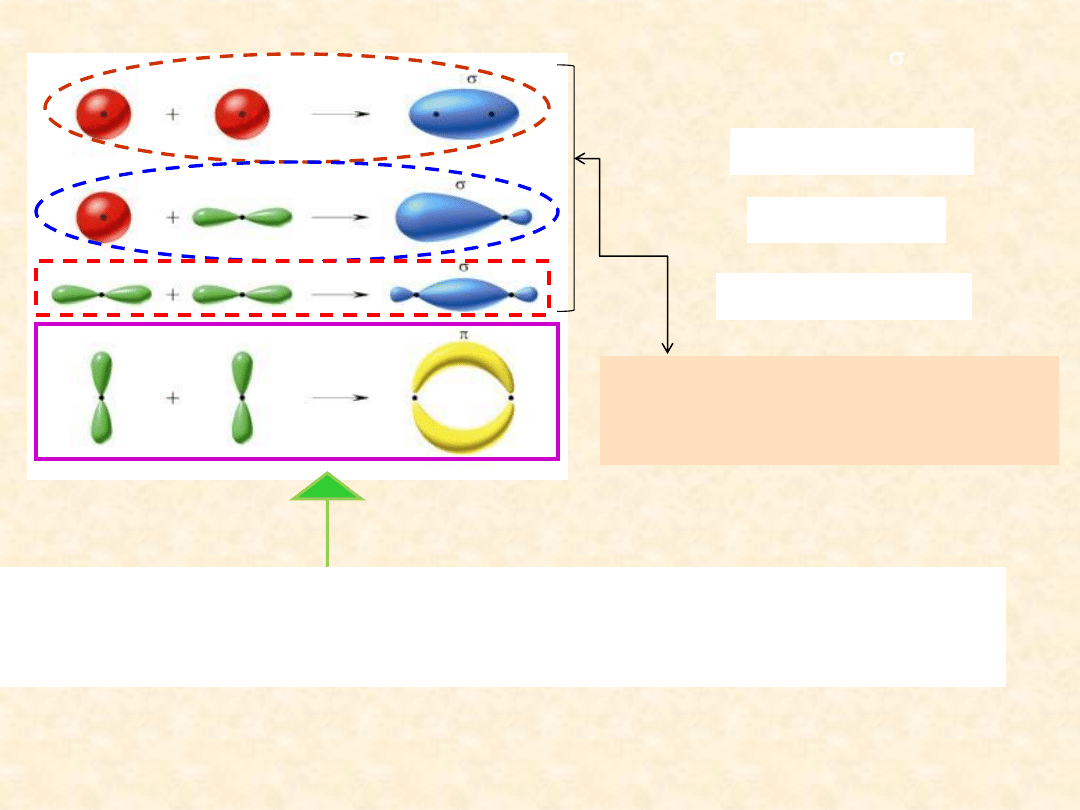
nakładających się
wzdłuż osi łączącej oba jądra
atomowe
Boczne nakładanie
się elektronów orbitali
p
x
lub
p
z
(oś y jest
kierunkiem zbliżania się atomów) prowadzi do utworzenia
wiążących i
antywiążących orbitali cząsteczkowych
i
*
Przestrzenny kształt
wiążących orbitali molekularnych (cząsteczkowych)
*
* Autorzy: J.Banaś, W. Solarski Opracowanie edycyjne M.Oczko
Orbital molekularny
i
wiązanie
sigma
powstaje z:
dwóch orbitali
s
orbitali
s
i
p
dwóch orbitali
p
x
J.Szymońska KChiF UR, Kraków, 2013/2014

Jeżeli cząsteczkę tworzą pierwiastki takie same
lub niewiele różniące się elektroujemnością to
wspólna para elektronowa
wiązania
kowalencyjnego
jest rozmieszczona symetrycznie w przestrzeni
między jądrami,
np. w cząsteczkach H
2
, O
2
, Cl
2
, N
2
.
Jeżeli tworzące cząsteczkę pierwiastki są niemetalami o różnej elektroujemności -
wspólna para elektronowa
wiązania kowalencyjnego
jest przesunięta w kierunku jądra pierwiastka bardziej elektroujemnego
z powodu nierównomiernego rozkładu ładunku wiązanie takie jest
wiązaniem kowalencyjnym spolaryzowanym
, np
.
w cząsteczkach HCl, H
2
O, HBr.
Takie cząsteczki mają budowę
biegunową - polarną
są
dipolami
o
cząstkowym
ładunku
(+)
w pobliżu atomu o mniejszej elektroujemności
i
(-)
– w pobliżu atomu
bardziej elektroujemnego.
+
-
l
Dipol jest układem dwóch różnoimiennych
ładunków
+ i
-
umieszczonych w odległości l
od siebie. Charakteryzuje się momentem
dipolowym
, który jest wektorem o wartości
bezwzględnej
=
l
J.Szymońska KChiF UR, Kraków, 2013/2014
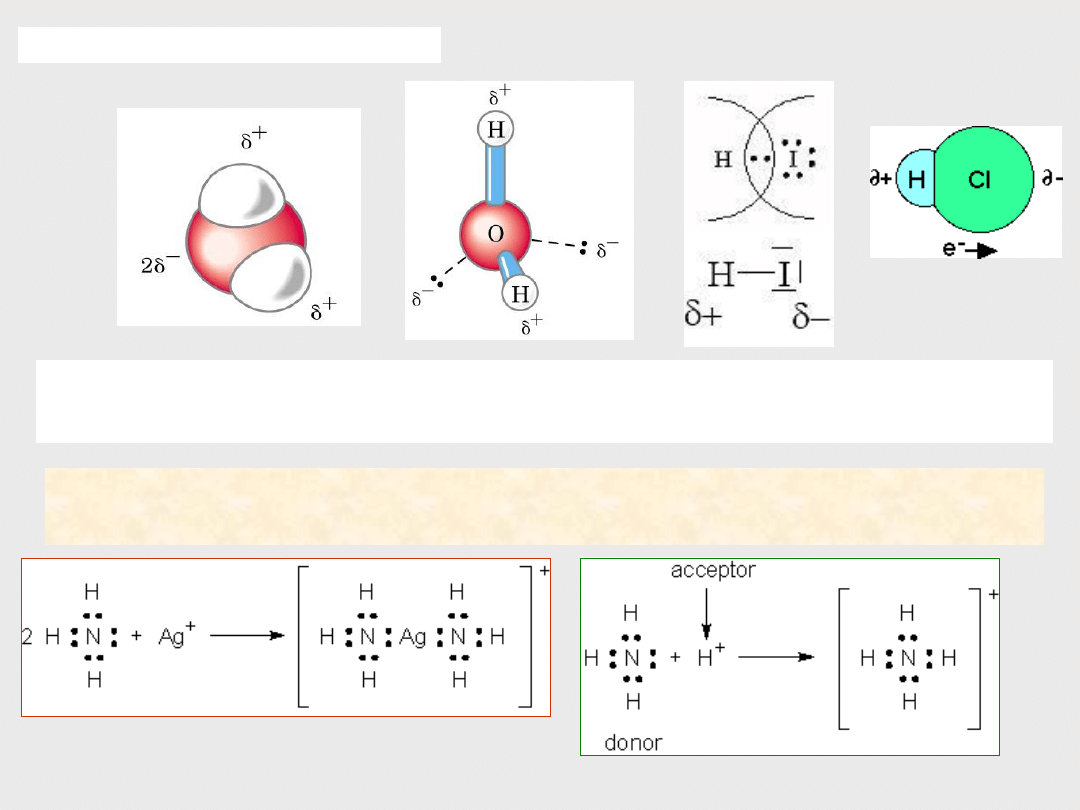
np. cząsteczka wody, HCl, HBr itp. :
Szczególnym przypadkiem wiązania kowalencyjnego jest
wiązanie donorowo-akceptorowe (koordynacyjne, semipolarne)
tworząca je para elektronowa pochodzi od jednego z atomów, zwanego
donorem
(dawcą) pary elektronowej; parę tę przyjmuje
akceptor
(biorca)
Wiązanie koordynacyjne występuje np. w
cząsteczkach
: SO
2
, CO, HNO
3
, H
2
SO
4
jonach
: NH
4
+
, SO
4
2-
,
jonach kompleksowych
: [Cu(NH
3
)
4
]
2+
,
K
3
[Fe(CN)
6
], [Fe(CNS)
6
]
3-
.
J.Szymońska KChiF UR, Kraków, 2013/2014
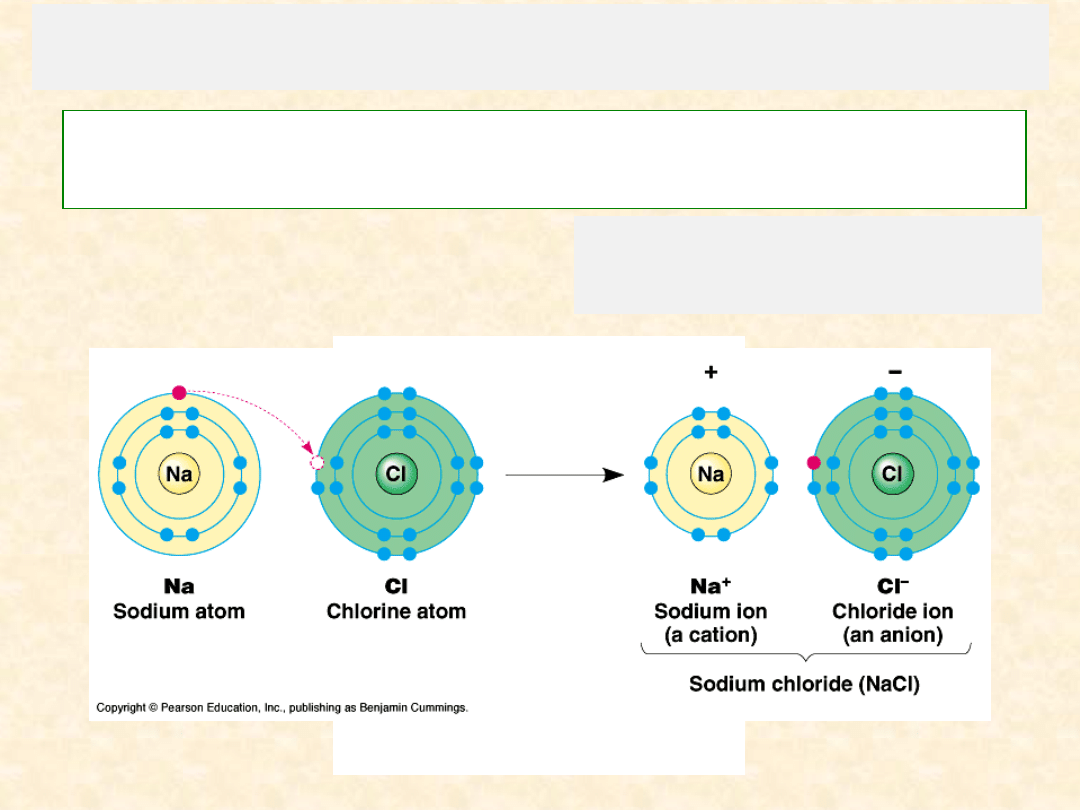
Przy znacznej r
óżnicy elektroujemności pierwiastków (przynajmniej o 1,7 w skali Paulinga),
elektrony walencyjne jednego z atom
ów mogą być tak silnie przyciągane przez drugi atom (bardziej
elektroujemny),
że zostaną „przechwycone” i obsadzają powłokę zewnętrzną tylko tego atomu.
Powstaje
wiązanie jonowe
polegające na
przyciąganiu elektrostatycznym
różnoimiennie naładowanych jonów
Takie
wiązania jonowe
występują np. w
cząsteczkach tworzonych przez atomy
metali i niemetali, np. NaCl, KJ itp.
Wówczas atom „przechwytujący” elektrony ma ich nadmiar i staje się
jonem ujemnym (anionem),
zaś ten, oddający elektrony staje się
jonem dodatnim (kationem).
J.Szymońska KChiF UR, Kraków, 2013/2014
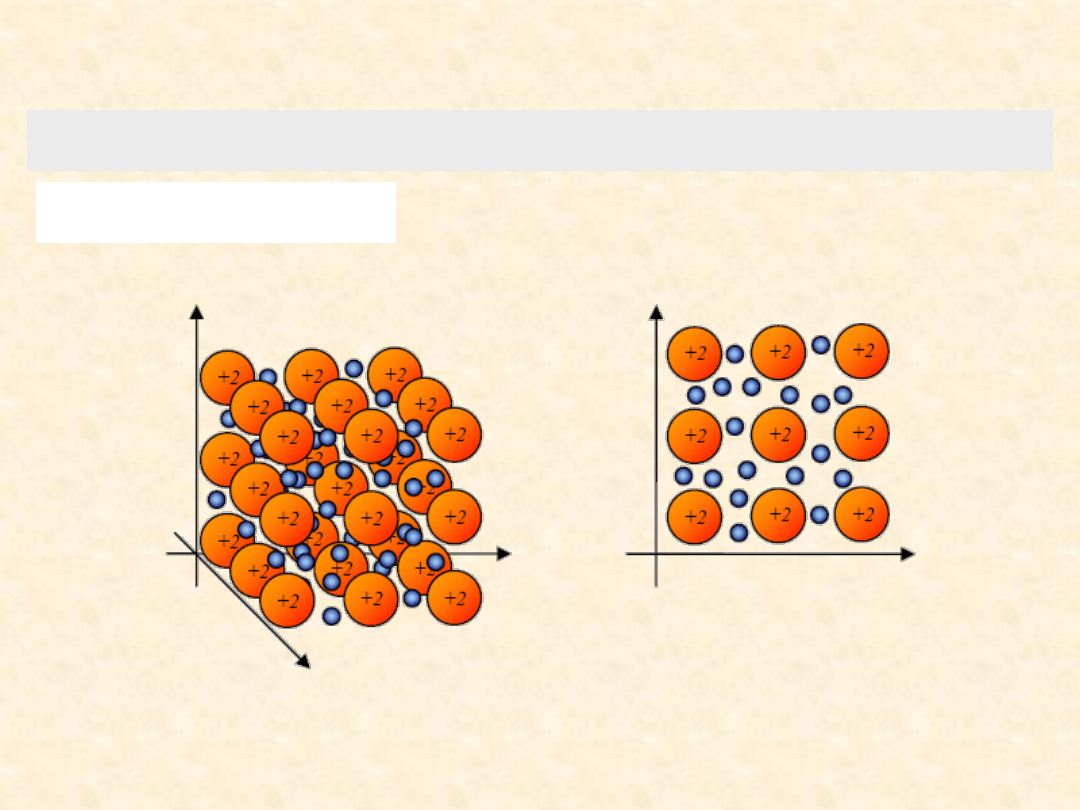
W metalach i ich stopach występuje szczególny rodzaj wiązania,
tzw.
wiązanie metaliczne
Jest to wiązanie pomiędzy tworzącymi sieć krystaliczną kationami metali i ich elektronami, które
zajmują orbitale powłok walencyjnych wszystkich tworzących sieć atomów
Takie elektrony nazywa się
elektronami zdelokalizowanymi
Elektrony te poruszają się swobodnie pomiędzy dodatnimi
elementami sieci, tworząc tzw. ”gaz elektronowy” i równoważą
sumaryczny ładunek dodatni kationów. Dlatego metal jako
całość jest elektrycznie obojętny
Wiązanie metaliczne nie jest ukierunkowane, tak jak wiązania kowalencyjne czy jonowe.
Obecność swobodnych elektronów w metalach powoduje ich wysokie przewodnictwo elektryczne i
cieplne oraz szereg innych charakterystycznych dla nich właściwości.
J.Szymońska KChiF UR, Kraków, 2013/2014
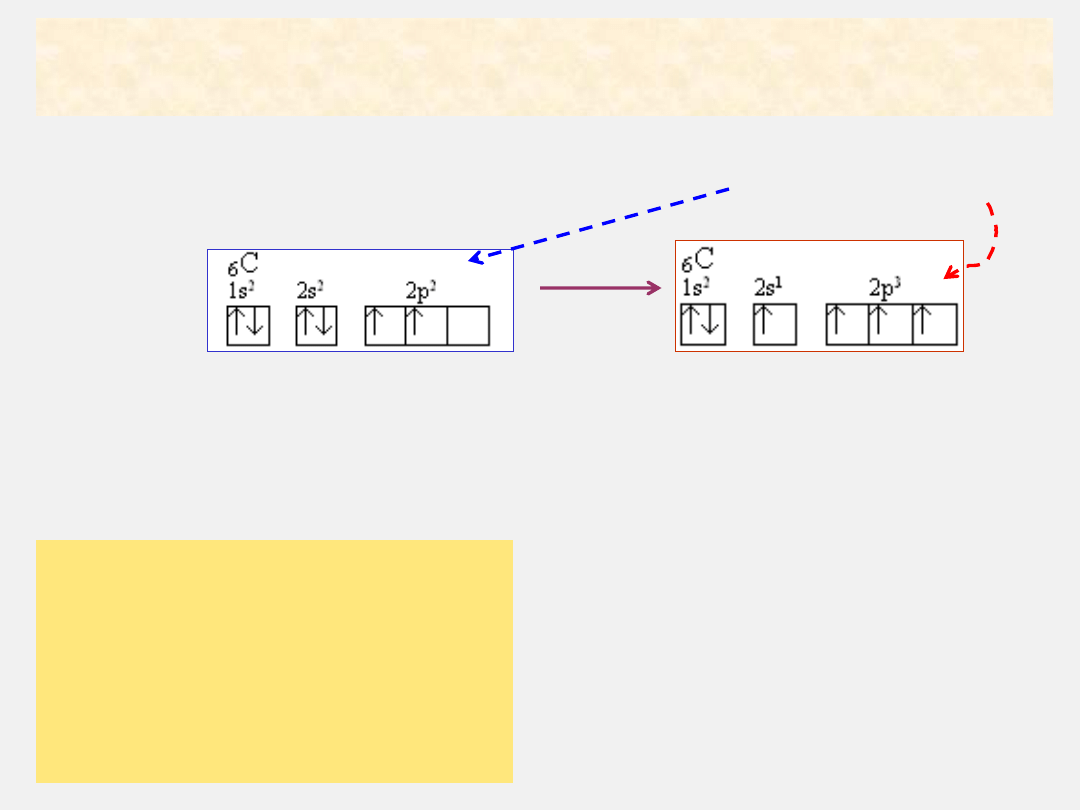
Wytwarzanie wiązań kowalencyjnych w liczbie przewyższającej liczbę
niesparowanych elektronów w atomie można wyjaśnić przyjmując, że powstanie
wiązania poprzedza zmiana konfiguracji elektronowej atomu reagującego pierwiastka
Na przykład w atomie węgla zmiana ta polega na „przejściu” (promocji) jednego elektronu z orbitalu
2s na niezapełniony orbital 2p, przy czym atom przechodzi ze
stanu podstawowego
w
stan
wzbudzony
uzyskując konfigurację elektronową:
Przejściu elektronów z orbitalu 2s na orbital 2p towarzyszy „wymieszanie”
i ujednolicenie orbitali, w wyniku czego powstają orbitale o
jednakowej energii
i kształcie
, czyli jednakowym przestrzennym rozłożeniu prawdopodobieństwa znalezienia
elektronów.
Te orbitale biorą udział w tworzeniu wiązań między atomami
„Wymieszanie” orbitali atomowych
w celu wytworzenia nowych
nazywa się
hybrydyzacją,
a
otrzymane w ten sposób orbitale
noszą nazwę
orbitali zhybrydyzowanych
(
od słowa hybryda = mieszaniec)
Hybrydyzacja
jest operacją matematyczną
(a nie zjawiskiem!)
polegającą na tym, że
funkcje falowe (orbitale atomowe
) opisujące
elektrony r
óżnych podpowłok tej samej powłoki
są przekształcane w funkcje falowe
opisujące elektrony
równocenne
energetycznie i zajmujące równoważne
geometrycznie obszary orbitalne
J.Szymońska KChiF UR, Kraków, 2013/2014
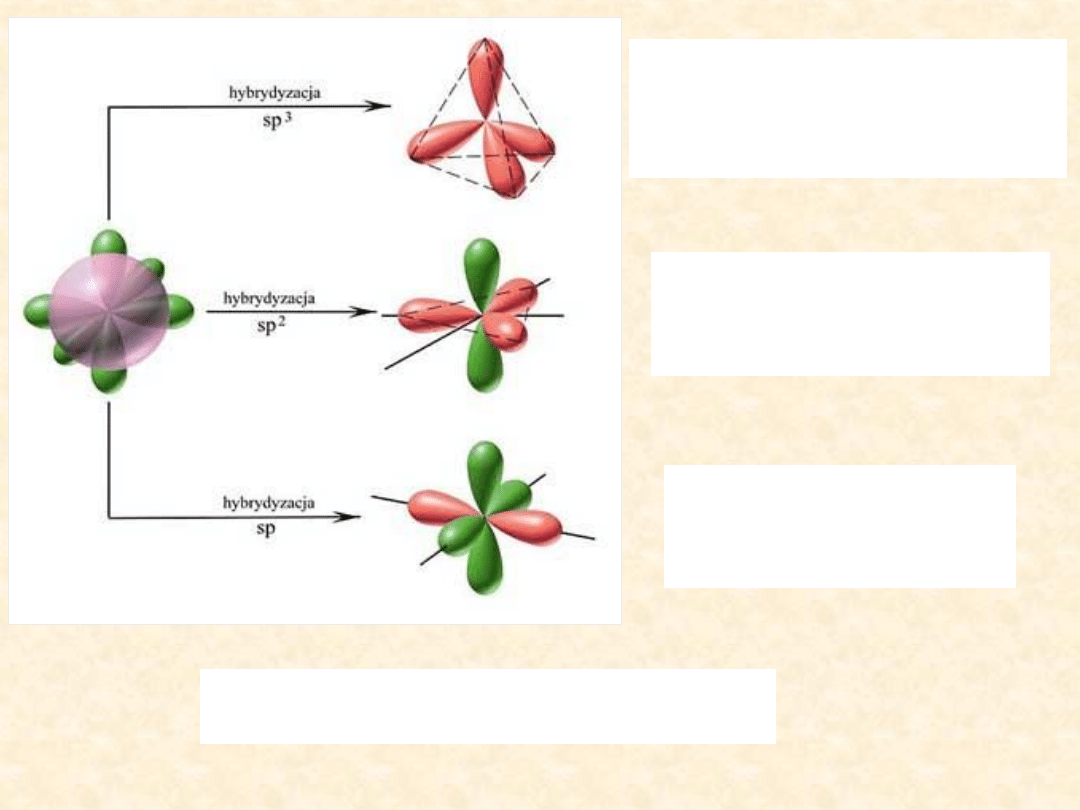
Wymieszanie
”
orbitalu s i trzech orbitali p
prowadzi do hybrydyzacji
sp
3
i powstania
czterech orbitali zhybrydyzowanych
sp
3
hybrydyzacja
sp
2
ma miejsce gdy
następuje „wymieszanie”
orbitalu s i
dwóch orbitali p,
powstają
trzy orbitale zhybrydyzowane
sp
2
hybrydyzacja
sp
- to
„wymieszanie”
orbitalu s i
orbitalu p,
powstają
dwa orbitale zhybrydyzowane
sp
Orbitale zhybrydyzowane biorą udział w
tworzeniu wiązań między atomami
J.Szymońska KChiF UR, Kraków, 2013/2014
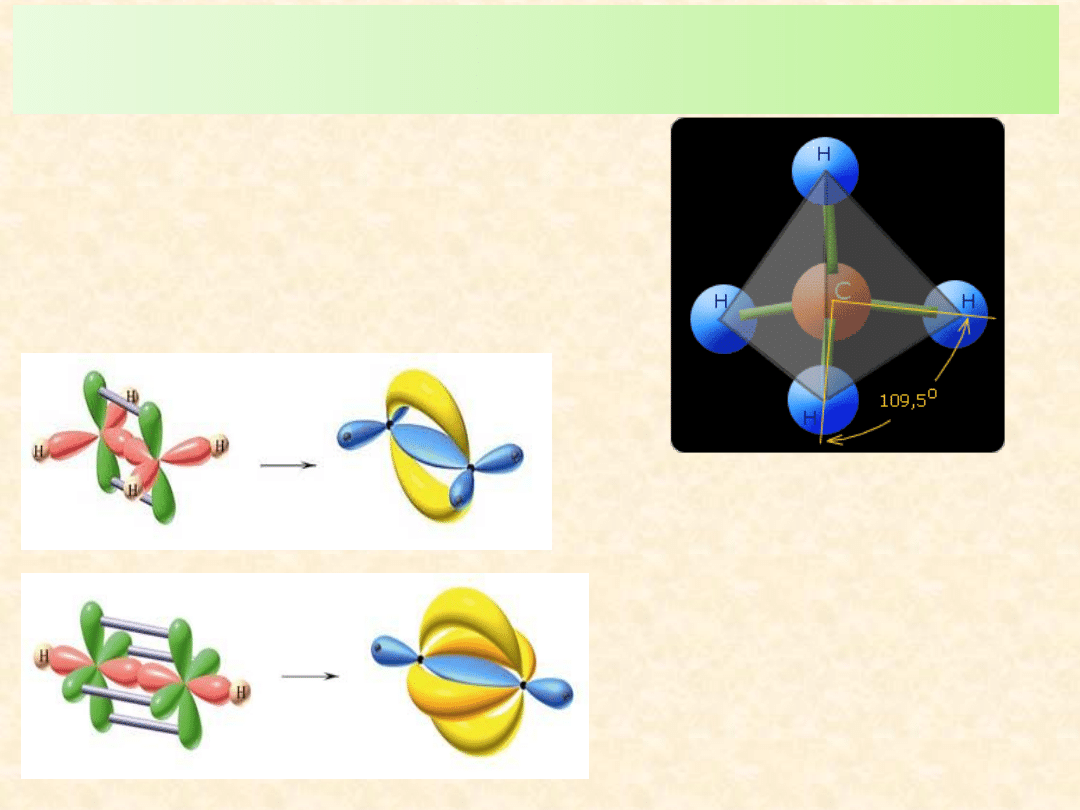
sp
2
wiązanie podwójne w etenie (
+
) –
cząsteczka płaska
sp
wiązanie potrójne w etynie (
+ 2
) –
cząsteczka liniowa
Rodzaj hybrydyzacji orbitali atomowych decyduje o kształcie cząsteczki i
odwrotnie – znajomość budowy przestrzennej cząsteczek pozwala wnioskować o
rodzaju hybrydyzacji orbitali atomu centralnego
wiązanie pojedyncze (
) w metanie - cząsteczka
nieliniowa- czworościan regularny
sp
3
J.Szymońska KChiF UR, Kraków, 2013/2014
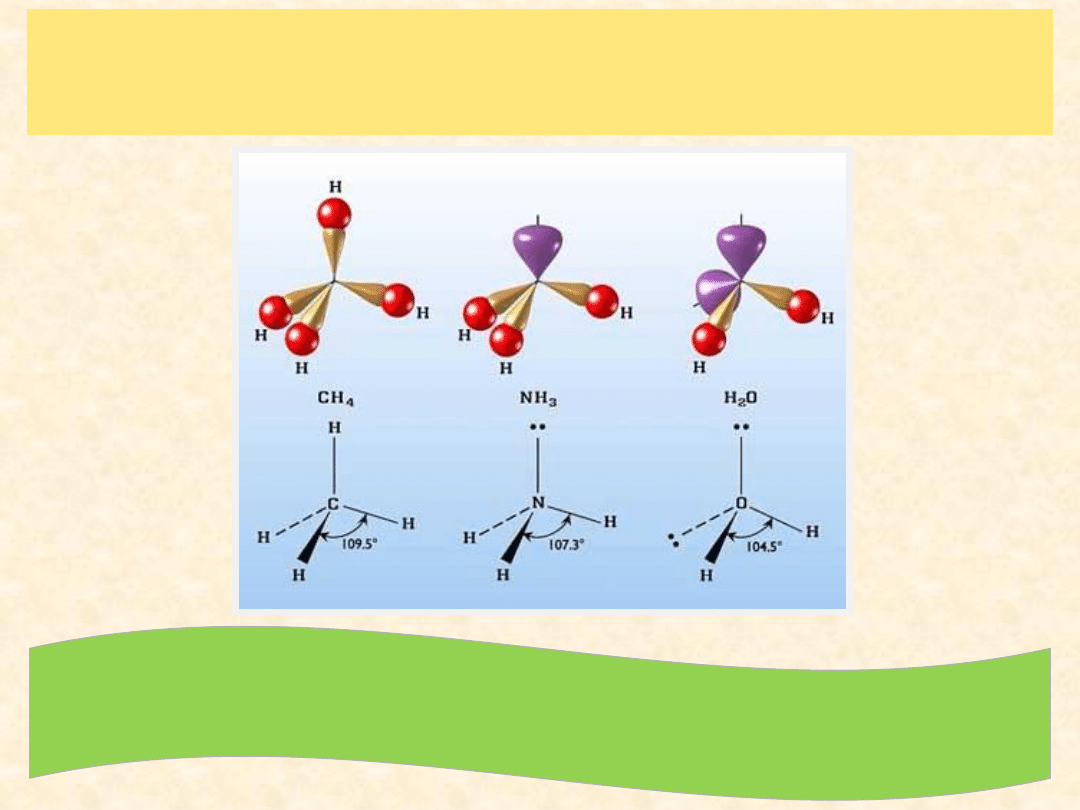
Obecne w atomie centralnym orbitale zajęte przez
wolne pary elektronowe
(
nie biorą udziału w tworzeniu wiązania
)
powodują
zaburzenie geometrii cząsteczki
(
zmianę kątów pomiędzy wiązaniami)
,
gdyż siła odpychania tych elektronów i elektronów wiązań
nie jest jednakowa
Kształt cząsteczki wieloatomowej, czyli rozkład przestrzenny jąder atomów
składowych, w zasadniczy sposób wpływa na właściwości chemiczne i fizyczne
związku
J.Szymońska KChiF UR, Kraków, 2013/2014
Wyszukiwarka
Podobne podstrony:
Kopia wyk sysop3
Kopia Wyk
Kopia wyk sysop3 ppt
Kopia PROCESY POZNAWCZE wyk^^ad
Kopia PROCESY POZNAWCZE I wyk^^ad
Kopia Bioetyka wyk& #8218 ad 1
EDI wyk
Wyk ad 5 6(1)
zaaw wyk ad5a 11 12
Kopia Kopia Rozwoj dziecka
Wyk 02 Pneumatyczne elementy
Kopia woda
więcej podobnych podstron