
Ćwiczenie 1
Oksydoreduktazy
i transferazy.
Ogólne właściwości enzymów
ENZYMOLOGIA
Wydział Nauk o Żywności i Rybactwa
Centrum Bioimmobilizacji
i Innowacyjnych Materiałów
Opakowaniowych
ul. Klemensa Janickiego 35
71-270 Szczecin

2
Ćwiczenie 1.
Oksydoreduktazy i transferazy. Ogólne właściwości enzymów
Reakcje chemiczne w organizmie są zawsze przyspieszane przez swoiste katalizatory
komórkowe, zwane biokatalizatorami lub enzymami. Enzymy nie zmieniają końcowego
składu mieszaniny reagującej ani stałej równowagi danej reakcji, przyspieszają jedynie
osiągnięcie stanu równowagi w reakcjach termodynamicznie możliwych. Są to reakcje
egzoergiczne, którym towarzyszy utrata energii swobodnej (∆G ma znak ujemny).
Enzymy są złożonymi, wielkocząsteczkowymi katalizatorami o charakterze białkowym
wytwarzanymi wyłącznie przez żywe komórki (ale mogą działać poza komórkami) i od-
znaczającymi się dużą swoistością w przyspieszaniu lub nadawaniu odpowiedniego kierunku
reakcjom chemicznym. Pod względem chemicznym wszystkie poznane dotąd enzymy należą
do białek prostych lub złożonych. Zasadniczą częścią składową enzymów jest tzw. grupa
czynna, warunkująca łączenie się enzymu z substratem.
Ze względu na budowę chemiczną wyróżnia się 3 kategorie enzymów:
l) Enzymy jako białka proste zbudowane tylko z aminokwasów. Rolę grupy czynnej spełniają
specyficzne zespoły aminokwasów, których nie można odszczepić bez zmiany struktury
białka, a więc bez zniszczenia enzymu jako substancji katalitycznej. Należą tu enzymy
proteolityczne oraz amylaza, ureaza, aldolaza, czy RNaza.
2)
E
n
zy
m
y ja
k
o
białka złożone
, zaw
i
era
j
ące
nieamino
k
wa
s
owe grup
y
chemiczne trwale
związane z cząst
e
c
z
k
ą
b
ia
ł
kową, t
z
w
.
grup
y
prostet
y
c
z
ne
.
Odd
zi
eleni
e
i
ch
i p
o
n
ow
n
e
z
ł
ą
cz
e
n
ie
n
ie zawsze
pro
wa
d
z
i do od
t
w
orzen
i
a ka
t
al
i
tycz
n
ie czy
n
nego e
n
zy
m
u
.
Należą t
u
t
a
k
ie e
n
zy
m
y
,
ja
k np.
o
k
sydaza cy
t
ochrom
o
w
a
, kata
l
aza
lub p
ero
k
sy
d
aza
,
w k
t
óryc
h
gr
up
ą
p
ros
t
e
t
ycz
n
ą
,
s
p
e
łni
ają
c
ą
rol
ę czyn
n
ej g
rup
y katali
ty
cz
n
e
j j
es
t
że
l
azo
p
o
rf
i
r
y
n
a.
3)
E
n
z
y
m
y
n
a
l
eżące
do b
ia
ł
ek złoż
on
yc
h
,
zawie
r
a
j
ące
nieaminokwa
s
owe grupy
z
wiązane
luźno
z cząs
tecz
ką
bi
a
łkow
ą, k
t
ó
rych ni
e
m
oż
n
a
tr
ak
towa
ć
j
ako
integr
al
nych c
zęś
ci
enzym
ó
w na p
o
dobień
s
tw
o g
rup pr
os
t
e
t
y
cznych
.
Obie c
zęści s
kład
owe
d
a
j
ą
si
ę
ł
a
tw
o
od
s
i
e
b
ie o
ddzieli
ć
z
a (m.in.
p
o
m
ocą zwyk
ł
e
j d
ia
li
zy)
i k
aż
d
a z
ni
c
h j
es
t
kata
l
i
tyc
z
ni
e
ni
eczy
nn
a
,
a z
ł
ą
c
z
on
e ze s
obą
(
np
. dializa
t
z
p
ozosta
ł
ośc
i
ą)
d
ają po
n
ownie
ak
tywny e
n
zy
m
.
T
ak
i
e gr
up
y
chemi
cz
n
e
n
azywa
n
e są
koenzymami
; część
b
ia
ł
kowa zw
i
e się wówczas a
p
oenzyme
m
,
a
ca
ł
ość, czyl
i
aktyw
n
y enzy
m
-
h
o
l
oenzy
m
e
m
.
Należą tu m.in. dehydrogenazy, których koenzymem może być dinukleotyd
nikotynamidoadeninowy (NAD
+
) lub jego fosforan (NADP
+
).
Grupy prostetyczne i koenzymy są odporne na ogrzewanie i mają różną budowę. Mogą to
być nukleotydy, witaminy, związki hemu, metale, pochodne cukrów czy kwasów
tłuszczowych. Ugrupowania te łączą się z białkiem różnymi wiązaniami: kowalencyjnymi,
koordynacyjnymi, wodorowymi, jonowymi czy przez siły van der Waalsa. Bardzo częste jest
wiązanie przez metal, przeważnie dwuwartościowy, jak Mg, Mn, czy Zn. Na przykład Zn,

3
mający liczbę koordynacyjną 6, w dehydrogenazie alkoholowej wiąże się Z NAD
+
dwiema
wartościowościami koordynacyjnymi, z apoenzymem - trzema dalszymi, a szóstą - z
substratem, tj. alkoholem (rys. 1). W wielu enzymach koordynacyjnie związany metal stanowi
jego grupę prostetyczną, niezbędną do pełnienia funkcji katalitycznej (metaloenzymy).
Rys. 1. Udział metalu w wiązaniu enzymu z substratem (
Kłyszejko-Stefanowicz, 2003)
Od części białkowej zależy specyficzność w stosunku do substratu (jaki rodzaj substratu
ulega przemianie), a ponadto białko decyduje również o kierunku reakcji. Istotnie, te same
grupy prostetyczne, czy koenzymy mogą brać udział w różnych reakcjach chemicznych,
zależnie od białka, z którym są związane, np. katalaza i peroksydaza. Specyficzność enzymu
zależy więc od komponentu białkowego. Grupa prostetyczna czy koenzym są tylko
narzędziem pozwalającym na przetwarzanie takiego czy innego materiału. Biorą one istotny
udział w działaniu enzymu, wyznaczając typ reakcji, decydując np. jakie atomy czy grupy
chemiczne mogą być przenoszone z donora na akceptor.
Zarówno grupy prostetyczne, jak i koenzymy biorą udział w katalizowanym procesie,
ulegając przy tym przekształceniu i tym samym nie odpowiadają definicji katalizatora,
ponieważ nie wychodzą z reakcji niezmienione. Wracają one do stanu pierwotnego dopiero na
skutek wtórnej reakcji, która zachodzi inaczej w przypadku grupy prostetycznej, a inaczej -
koenzymu.
Na ogół w reakcjach enzymatycznych biorą udział dwa substraty i enzym. Substratem
przyjęto nazywać związek, który jest przetwarzany przez enzym, natomiast drugi –
kosubstratem. Wiele kosubstratów biologicznych występuje w bardzo małych stężeniach,
często rzędu stężeń samych enzymów. Takie kosubstraty noszą nazwę koenzymów.
Odgrywają one rolę akceptorów czy donorów wodoru lub grup atomów. NAD
+
przyjmuje np.
wodór od substratu, a ATP dostarcza reszty fosforanowej w reakcji katalizowanej przez
glukokinazę:
Z tych reakcji widać, że oba koenzymy, zarówno NAD
+
, jak i ATP, funkcjonują jako drugi
substrat,· który ulega wymianie z substratem właściwym w stosunkach stechiometrycznych,
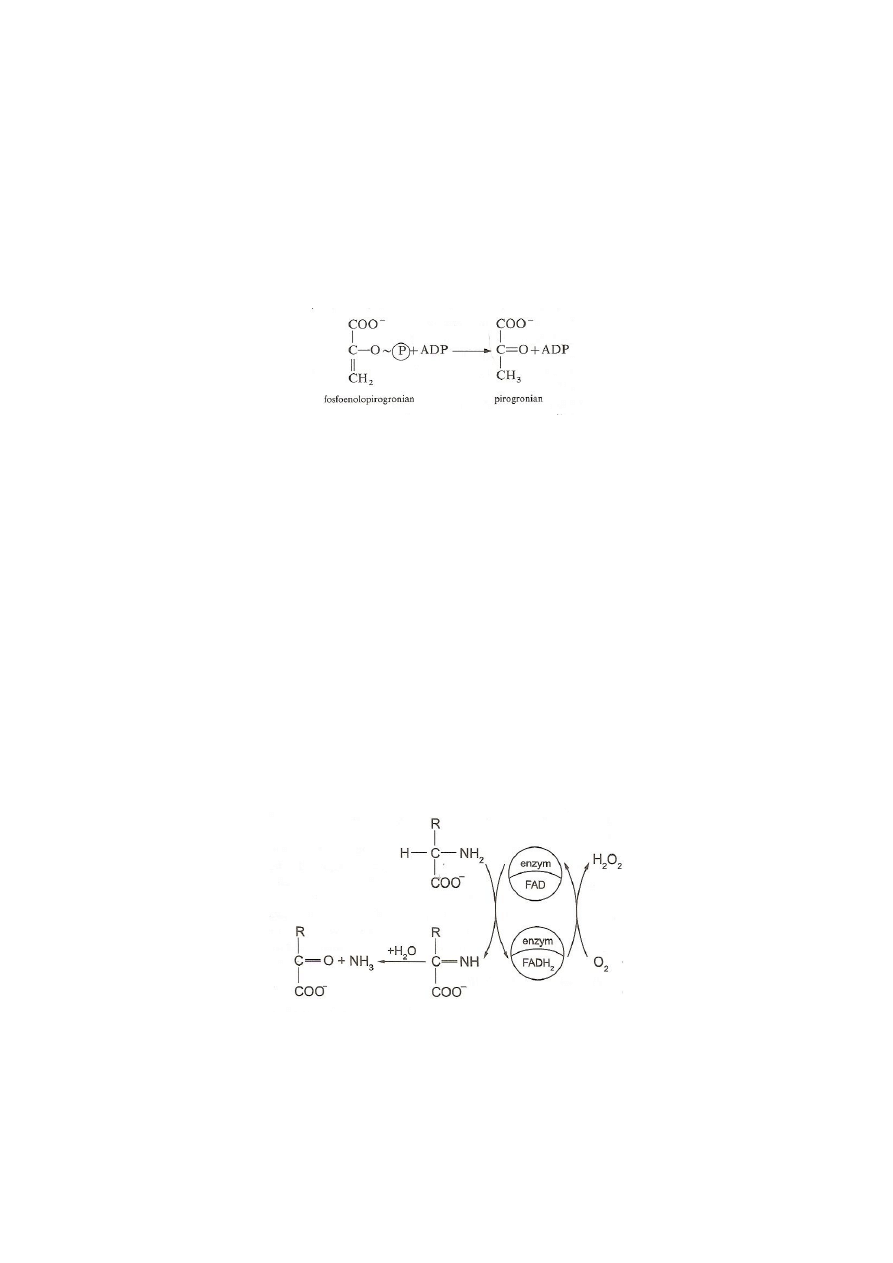
4
tzn. 1 mol/1 mol, a bynajmniej nie katalitycznie. W reakcji katalizowanej przez
dehydrogenazę zredukowany dinukleotyd nikotynamidoadeninowy (NADH) jest produktem
reakcji na równi z pirogronianem i jonem wodorowym. Regeneracja NAD
+
ze
zredukowanego NAD zachodzi w następnej reakcji katalizowanej przez inny enzym, w której
NADH będzie z kolei kosubstratem, ponieważ przekształca się w NAD
+
oddając swój wodór
stechiometrycznie. Podobnie ADP może znów przekształcić się stechiometrycznie w ATP
przyjmując fosforan od wysokoenergetycznego związku:
Katalityczne działanie koenzymu przejawia się dopiero w wyniku sprzężenia obydwu
enzymów w jeden układ enzymatyczny. Szczególne znaczenie koenzymów w przemianie
materii polega na pośredniczeniu między różnymi enzymami, bowiem w organizmie żywym
bardzo często ma się do czynienia z ciągami reakcji, w których koenzymy zmienione w jednej
reakcji są odtwarzane w następnej.
Enzym mający grupę prostetyczną reaguje równocześnie z dwoma różnymi substratami. Na
przykład aminokwas ulega pod wpływem enzymu odwodornieniu, wodory zostają przejęte
przez grupę prostetyczną przeniesione na cząsteczkę tlenu z wytworzeniem H
2
O
2
(rys. 2).
Wprawdzie i tutaj grupa prostetyczna, tj. dinukleotyd flawinoadeninowy (FAD) przekształca
się stechiometrycznie, ale w przeciwieństwie do koenzymu na tym samym białku
enzymatycznym odzyskuje pierwotną postać przez reakcję z drugim substratem. Jest to druga
różnica (oprócz trwałości wiązania z białkiem) między grupą prostetyczną a koenzymem.
Rys. 2. Odwracalna redukcja FAD w procesie deaminacji aminokwasów
(
Kłyszejko-
Stefanowicz, 2003)
Zasadniczą funkcją enzymu jest aktywowanie substratu (i ewentualnie koenzymu) przez
ustawienie go w przestrzeni w sposób najbardziej sprzyjający oddziaływaniu enzymu. Białko
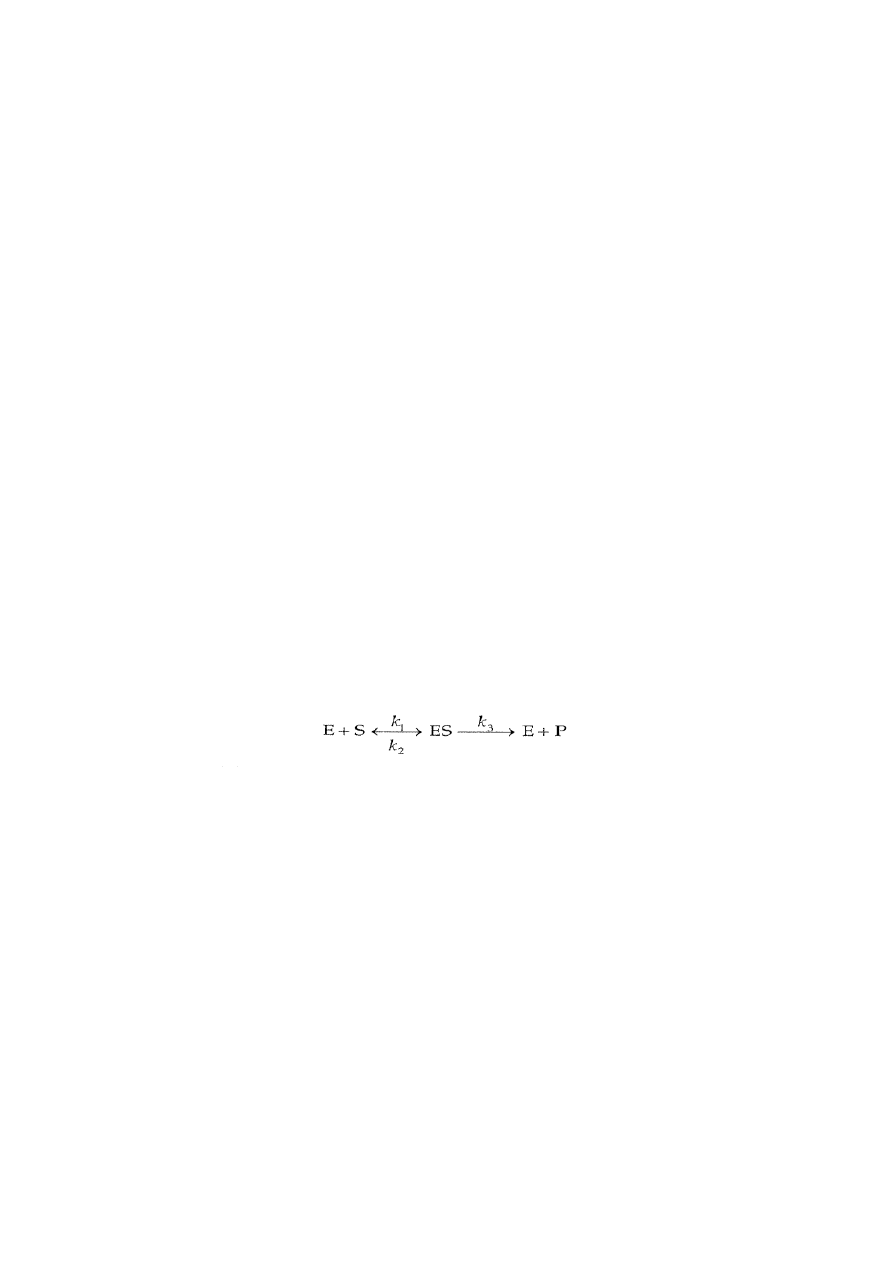
5
enzymatyczne jest pewnego rodzaju matrycą, na której układa się lub wiąże substrat i
kosubstrat. Dany enzym wchodzi w połączenie i aktywuje tylko określone substraty, a reakcja
zachodzi nie w dowolnych, lecz w ściśle określonych miejscach na powierzchni enzymu.
Swoistość działania enzymów jest miarą stopnia „dopasowania się” enzymu i substratu. Owo
„dopasowanie” może być niezupełnie doskonałe, wskutek czego cząsteczka substratu
uzyskuje pewne napięcie wewnętrzne, czego wynikiem jest wzrost reaktywności chemicznej,
określany jako aktywacja. Fakt, że enzymy reagują tylko z jedną odmianą stereoizomeryczną
danego związku, nasuwa przypuszczenie, że połączenie enzymu z substratem zachodzi co
najmniej w 3 miejscach.
W reakcjach enzymatycznych uzyskuje się zwiększenie szybkości reakcji 10
6
-10
11
razy.
Przyczyn tego jest kilka. W reakcji nieenzymatycznej znaczny odsetek zderzeń cząsteczek
substratu o energii większej od energii aktywacji nie prowadzi do powstania produktu, bo nie
następuje zetknięcie się czynnych grup substratów. Natomiast w reakcji enzymatycznej
występuje ścisła orientacja przestrzenna reagujących cząsteczek i eliminowana jest
przypadkowość sposobu ich zetknięcia.
Enzym (E) wiąże się ze swym substratem (S) tworząc kompleks enzym-substrat (ES).
Kompleks ES może dysocjować z powrotem do E + S lub przekształcić się w sam E i produkt
P. Stałe szybkości k
1
, k
2
, k
3
opisują szybkości przebiegu każdego etapu katalitycznego.
Przyjmuje się , iż reakcja odwrotna, w której enzym i produkt (E + P) byłyby przekształcane
w kompleks ES, przebiega z tak małą szybkością, że reakcję tę można pominąć.
Ponadto w reakcji enzymatycznej ważną rolę odgrywa aktywowanie substratów w wyniku
tworzenia kompleksu enzym-substrat. Występuje często zmiana rozmieszczenia elektronów w
reaktywnym wiązaniu tak, że w kompleksie jest ono mniej trwałe od wiązania w samym
substracie. Budowa wielkocząsteczkowa enzymu wpływa specyficznie na zmianę
rozmieszczenia elektronów w kompleksie ES. Pod wpływem przyłączenia substratu enzym
przybiera konformację (ukształtowanie) niezbędną do czynności katalitycznej; ułatwia to
zbliżenie i ustawienie w odpowiedniej pozycji substratu i grup czynnych enzymu, a także
powoduje wzrost naprężeń w substracie, co prowadzi do rozerwania określonych wiązań.
Tylko niewielka część łańcucha białkowego decyduje o katalitycznych właściwościach
enzymu. Najistotniejszym elementem budowy enzymów, któremu zawdzięczają aktywność
katalityczną, jest centrum aktywne. Jest to zgrupowanie właściwych reszt aminokwasowych
o odpowiednim ułożeniu przestrzennym i potencjalnej ruchomości. Z tymi właśnie grupami
połączy się substrat. Reszty aminokwasowe wchodzące w skład centrum aktywnego mogą

6
należeć do aminokwasów odległych w sekwencji łańcucha polipeptydowego, a zbliżonych do
siebie dzięki jego pofałdowaniom; dlatego czynniki oddziałujące na przestrzenną budowę
enzymu mają wpływ na jego funkcję. Większość zmian w konformacji cząsteczek enzymu
(struktura II-, III- i IV-rzędowa) prowadzi do utraty możliwości katalitycznych. Na przykład
czynniki redukujące czy utleniające powodują powstanie dodatkowych lub rozerwanie ist-
niejących wiązań -S-S-; zmiany wartości pH, zmieniając liczbę ładunków elektrycznych grup
dysocjujących, zwiększają lub zmniejszają liczbę wiązań jonowych wewnątrz- i
międzyłańcuchowych, co prowadzi do zmian układu łańcucha. Wpływ temperatury wynika ze
zwiększonej ruchliwości atomów zarówno środowiska, jak i enzymu. Wzrasta przez to
możliwość wytwarzania połączeń, które są mało prawdopodobne w normalnych warunkach, a
także przejścia aktywnej konformacji cząsteczki enzymu w konformację nieaktywną, czyli
denaturacji enzymu. Z tych rozważań wynika również wpływ aminokwasów nie
uczestniczących w budowie centrum, a tylko determinujących konformację cząsteczki, co ma
duże znaczenie dla optymalnej struktury centrum aktywnego. Główną rolę w centryum.
aktywnym przypisuje się najczęściej takim aminokwasom, jak seryna, cysteina czy histydyna,
chociaż mogą uczestniczyć w jego budowie jeszcze lizyna, tyrozyna, metionina, glicyna,
kwas asparaginowy i inne.
W cząsteczce enzymu należy wyróżnić jeszcze istnienie centrów allosterycznych, które
warunkują powinowactwo enzymu do czynników regulujących jego aktywność, a nie do
substratu.
Klasyfikacja i nazewnictwo enzymów. Swoistą cechą odróżniającą każdy enzym jest
katalizowana przez niego reakcja chemiczna i właśnie ona jest podstawą klasyfikacji i
nomenklatury enzymów (bierze się pod uwagę pełną, sumaryczną reakcję przedstawioną
odpowiednim równaniem). Reakcja ta łącznie z nazwą substratu (substratów) służy za
podstawę terminologii poszczególnych enzymów. Enzymy mają z reguły dwie nazwy:
systematyczną i potoczną. Nazwa systematyczna musi być tworzona według określonych
reguł, powinna identyfikować dany enzym i określać jego działanie.
Nazwy potoczne są zwykle krótkie i często tworzone od nazw substratu, m.in.
deoksyrybonukleaza, arginaza, amylaza, lipaza, ureaza. Niektóre nazwy potoczne, mimo
braku racjonalnego uzasadnienia, utrzymały się ze względu na tradycję, np. pepsyna,
trypsyna, chymotrypsyna.
Komisja Enzymowa Międzynarodowej Unii Biochemicznej opracowała w 1961 r. zasady
klasyfikacji i nazewnictwa enzymów. Według przyjętych zasad, enzymy i katalizowane
reakcje podzielono na sześć klas głównych:
1. Oksydoreduktazy — katalizują odwracalne reakcje utleniania i redukcji, a więc przemiany
związane z przeniesieniem protonów i elektronów,

7
2. Transferazy — katalizują odwracalne reakcje przeniesienia grup funkcyjnych z donora na
akceptor,
3. Hydrolazy — katalizują nieodwracalne reakcje hydrolizy, a więc rozpadu wiązań z
jednoczesnym przyłączeniem się jednej czasteczki wody na każde wiązanie ulegające
rozpadowi,
4. Liazy — katalizują niehydrolityczny rozpad wiązań (bez pobrania i wydzielania ubocznych
produktów), niektóre reakcje są odwracalne
5. Izomerazy — katalizują reakcje przekształceń strukturalnych w obrębie cząsteczki —
reakcje odwracalne
6. Ligazy czyli syntetazy — katalizują syntezę trwałych wiązań kowalencyjnych, (np. C-C,
C-N, C-S, C-O), z wykorzystaniem wiązań makroergicznych ATP
Zgodnie z zaleceniami Międzynarodowej Unii Biochemicznej nazwy systematyczne
enzymów składają się z dwóch części. Pierwszą tworzy się od nazwy katalizowanej reakcji,
dodając końcówkę -aza. np. hydrolaza, Drugą część tworzy się od nazwy substratu w
dopełniaczu - liczby pojedynczej, np. hydrolaza acetylocholiny, karboksyliaza L-tryptofanu
itp. Jeśli reagują dwa substraty, to druga część nazwy składa się z dwóch nazw substratów
podanych w mianowniku liczby pojedynczej i rozdzielonych dwukropkiem, np.
oksydoreduktaza alkohol: NAD.
Każdy enzym ma numer międzynarodowej klasyfikacji (EC), składający się z 4 członów
oddzielonych kropkami.
Człon I oznacza numer klasy, do której należy enzym. Enzymy podzielono na 6 klas: 1) ok-
sydoreduktazy, 2) transferazy, 3) hydrolazy, 4) liazy, 5) izomerazy i 6) ligazy (syntetazy).
Człon II - to podklasa. W klasie oksydoreduktaz wskazuje on na rodzaj grupy w donorach
ulegającej utlenieniu (-CHOH, aldehydowa, ketonowa itd.); w transferazach - na rodzaj grupy
przenoszonej (jednowęglowa, glikozylowa, azotowa itd.); w hydrolazach - na typ wiązania
ulegającego hydrolizie (peptydowe, estrowe, glikozyd owe itd); w liazach - typ
rozszczepianego wiązania (C-C, C-O, C-N, C-S); w izomerazach - na typ izomeryzacji (cis-
trans, racemizacja itp.); w ligazach - na typ utworzonego wiązania (C-O, C-S, C-N, C-C).
Człon III - to pod-podklasa. W klasie oksydoreduktaz wskazuje na rodzaj akceptora; w
transferazach bliżej określa rodzaj przenoszonej grupy (metylowa, aminowa, itp.), a w
hydrolazach - typ hydrolizowanego wiązania (estrów karboksylowych, fosforowych itp.); w
liazach - charakter chemiczny usuniętej grupy (CO
2
, H
2
O, NH
3
); w izomerazach - charakter
przekształcanego związku (aminokwasy, cukry itp.); w ligazach - wskazuje na rodzaj
powstałego związku.
Człon IV - to kolejny numer enzymu w jego pod-podklasie.
8
Oksydoreduktazy (klasa 1) katalizują wiele istotnych reakcji komórkowych, zwłaszcza
dotyczących utleniania biologicznego, które polega na łączeniu się wodoru z tlenem. W
komórkach utlenia się jednak nie wodór cząsteczkowy, ale związany przeważnie z
koenzymami nikotynamidoadeninowymi, które go pobierają wprost od substratów
biologicznych utleniań (glukozy, kwasów tłuszczowych, aminokwasów itp.). Biologiczne
utlenianie wodoru polega na przeniesieniu elektronów nie wprost z wodoru na tlen, ale przez
wiele biologicznych układów oksydoredukcyjnych. W ten sposób energia uwalnia się małymi
porcjami i może być wykorzystana dzięki sprzęgnięciu tych układów z reakcjami
magazynującymi energię w sposób chemiczny (ATP). Elektrony są przenoszone w kolejności
wyznaczonej przez potencjał oksydoredukcyjny od układów o bardziej ujemnym potencjale w
kierunku układów o bardziej dodatnim potencjale. Procesowi biologicznego odłączania
elektronów towarzyszy zwykle oddawanie protonów, które utleniany związek odrzuca.
Odbiorcą wodorów (elektronów i protonów) jest pośrednio i bezpośrednio tlen
atmosferyczny. Tlen przyjmując elektrony redukuje się do jonu tlenkowego, który łączy się z
protonami w cząsteczkę H
2
O.
Przyjmując za kryterium mechanizm działania, enzymy klasy oksydoreduktaz (14 podklas)
można ująć w 4 umowne grupy: oksydazy, oksygenazy, dehydrogenazy i hydroperoksydazy.
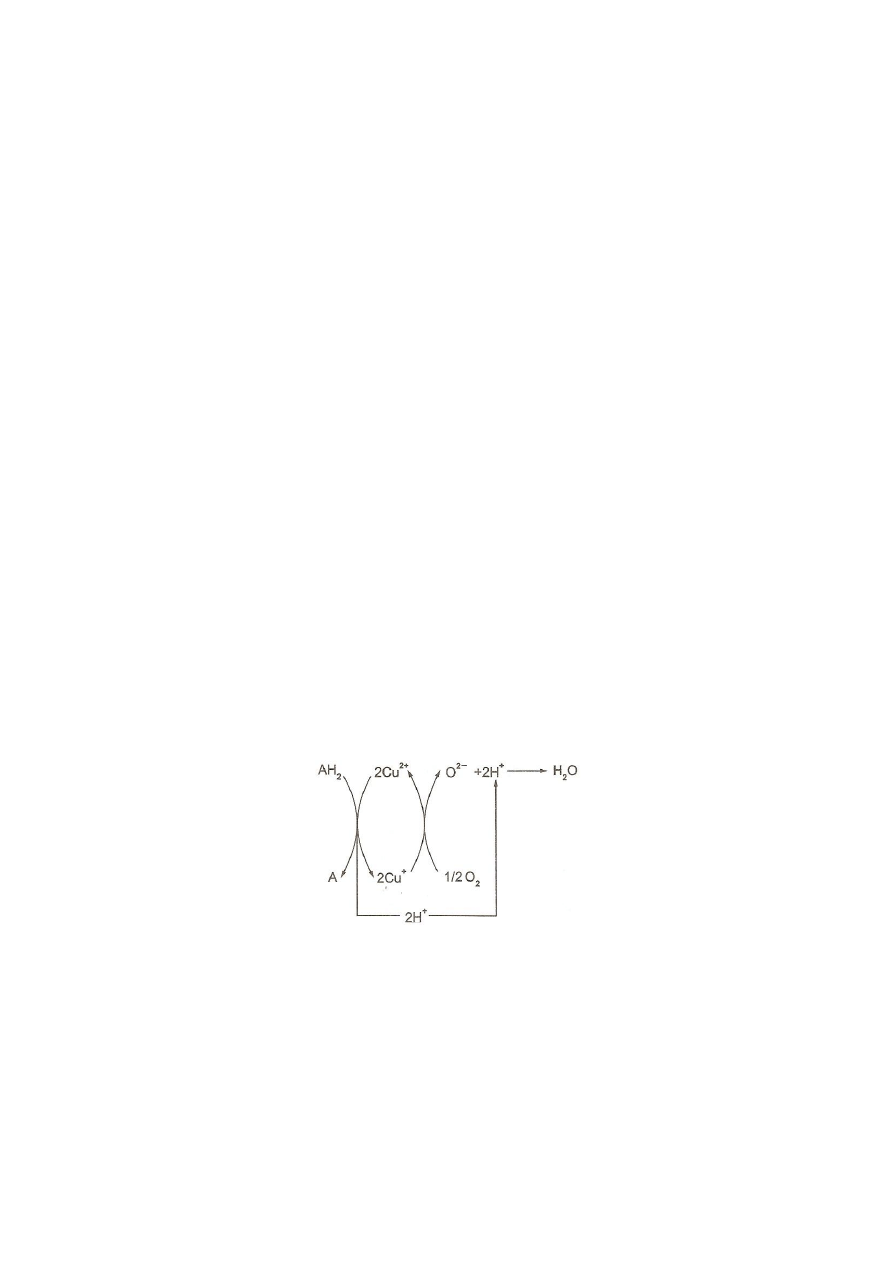
l. Oksydazy katalizują odrywanie się elektronów od utlenianego substratu i dwu lub
czteroelektronową redukcję cząsteczki tlenu. Po połączeniu się z protonami powstaje
cząsteczka H
2
O
2
lub H
2
O. Z uwagi na ten końcowy produkt katalizowanej reakcji wyróżnia
się 2 zespoły oksydaz. Mechanizm działania oksydaz I zespołu, w których grupą czynną jest
metal, np. miedź, przedstawia rys. 3. Do tego zespołu należą oksydazy mono- i polifenoli,
askorbinianu, oksydaza cytochromowa itp.
Rys. 3. Schemat działania oksydaz I
(
Kłyszejko-Stefanowicz, 2003)
Oksydazy ziemniaka. Enzymy te przenoszą elektrony bezpośrednio na tlen atmosf
e
r
yczny.
Substratem w reakcjach utleniania mogą być m
.
in. o- i p-difenole; utlenia się
także fenol
.
Powstają chinony
,
a w wyniku ich kondensacji tworzą się barwne pochodne. Oksydaza
fenolowa, zwana również oksydazą polifenolową, tyrozynazą lub katecholazą, jest
metaloproteiną i zawiera miedź, która przyjmuje elektrony od difenoli i przekazuje je na tlen
cząsteczkowy (rys. 4).
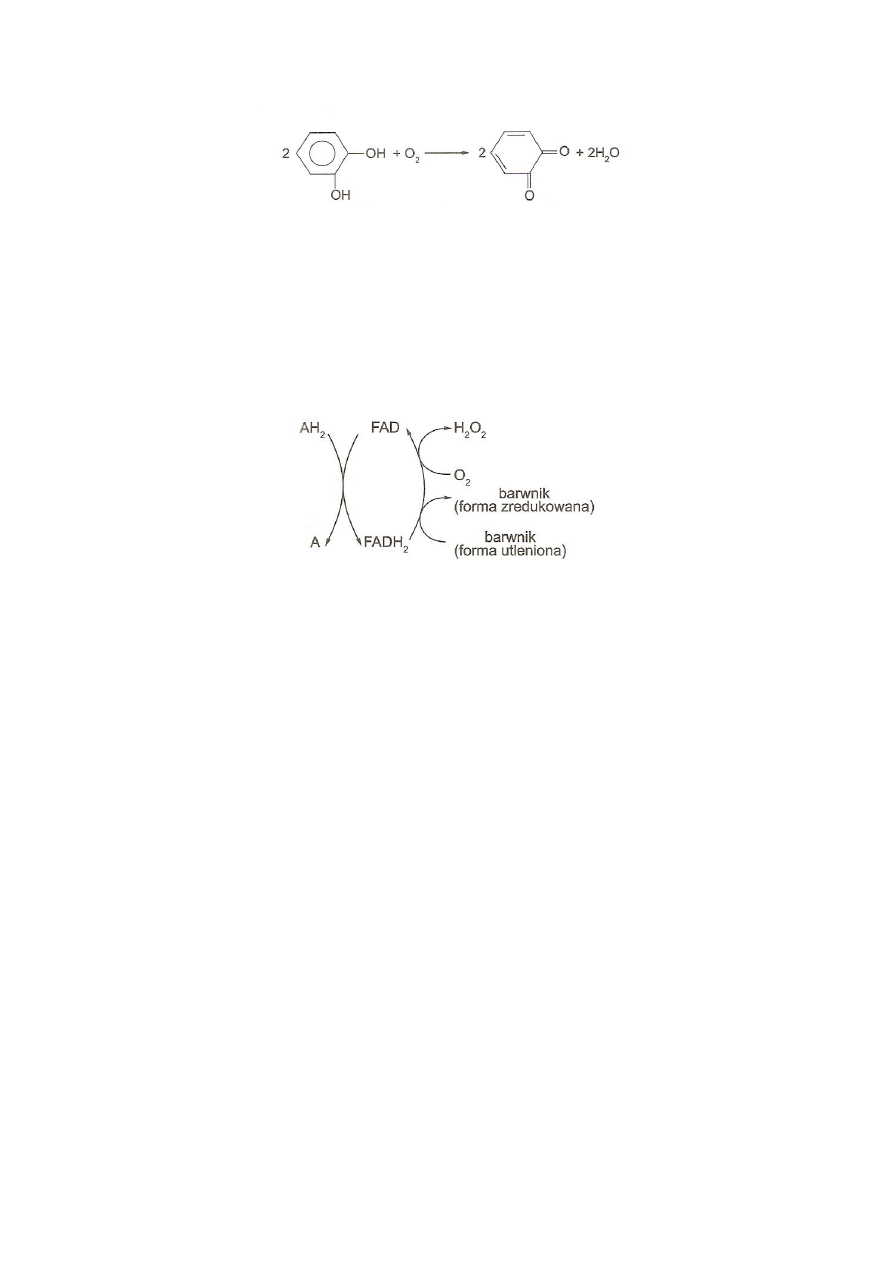
9
Rys. 4. Utlenianie pirokatechiny przez oksydazy
(
Kłyszejko-Stefanowicz, 2003)
Grupą prostetyczną oksydaz II zespołu jest dinukleotyd flawinoadeninowy występujący
bardzo często obok metali (Fe, Cu, Mo), które biorą udział w przenoszeniu elektronów z
FADH
2
na tlen z wytworzeniem H
2
O
2
(rys. 5). Tlen cząsteczkowy może tu być zastąpiony
innym akceptorem, np. błękitem metylenowym. Przykładem enzymów tego zespołu mogą być
oksydazy aldehydów, aminokwasów, oksydaza ksantynowa, moczanowa i in.
Rys. 5. Schemat działania oksydaz II
(
Kłyszejko-Stefanowicz, 2003)
2. Oksygenazy katalizują proces wbudowywania O
2
w cząsteczkę. Wyróżnia się oksygenazy
właściwe i hydroksylujące.
3. Dehydrogenazy katalizują odrywanie atomów wodoru od utlenianego substratu i
przenoszą je na inne enzymy czy związki pośrednie, a nie mają zdolności, przenoszenia
elektronów bezpośrednio na tlen. Różnią się rodzajem koenzymu, który jest właściwym
akceptorem atomów wodoru. Może być nim: NAD, NADP
+
, FMN, FAD lub liponian.
Dehydrogenazy te wykazują specyficzność zarówno w stosunku do substratów, jak i
koenzymów. Z NAD
+
współpracują m.in. dehydrogenazy: aldehydu 3-fosfoglicerynowego, 2-
glicerofosforanu (rozpuszczalna) mleczanu, jabłczanu, 3-hydroksymaślanu, glutaminianu, a
do współdziałających z NADP
+
- dehydrogenazy: glukozo-6-fosforanu, izocytrynianu itp.
Dehydrogenazy nie wymagające udziału NAD
+
ani NADP
+
to najczęściej: dehydrogenazy
flawinowe, np. dehydrogenaza 2-glicerofosforanu (nierozpuszczalna), bursztynianu, acylo-
CoA, bądź liponianowe (dehydrogenaza pirogronianu i 2-oksoglutaranu).
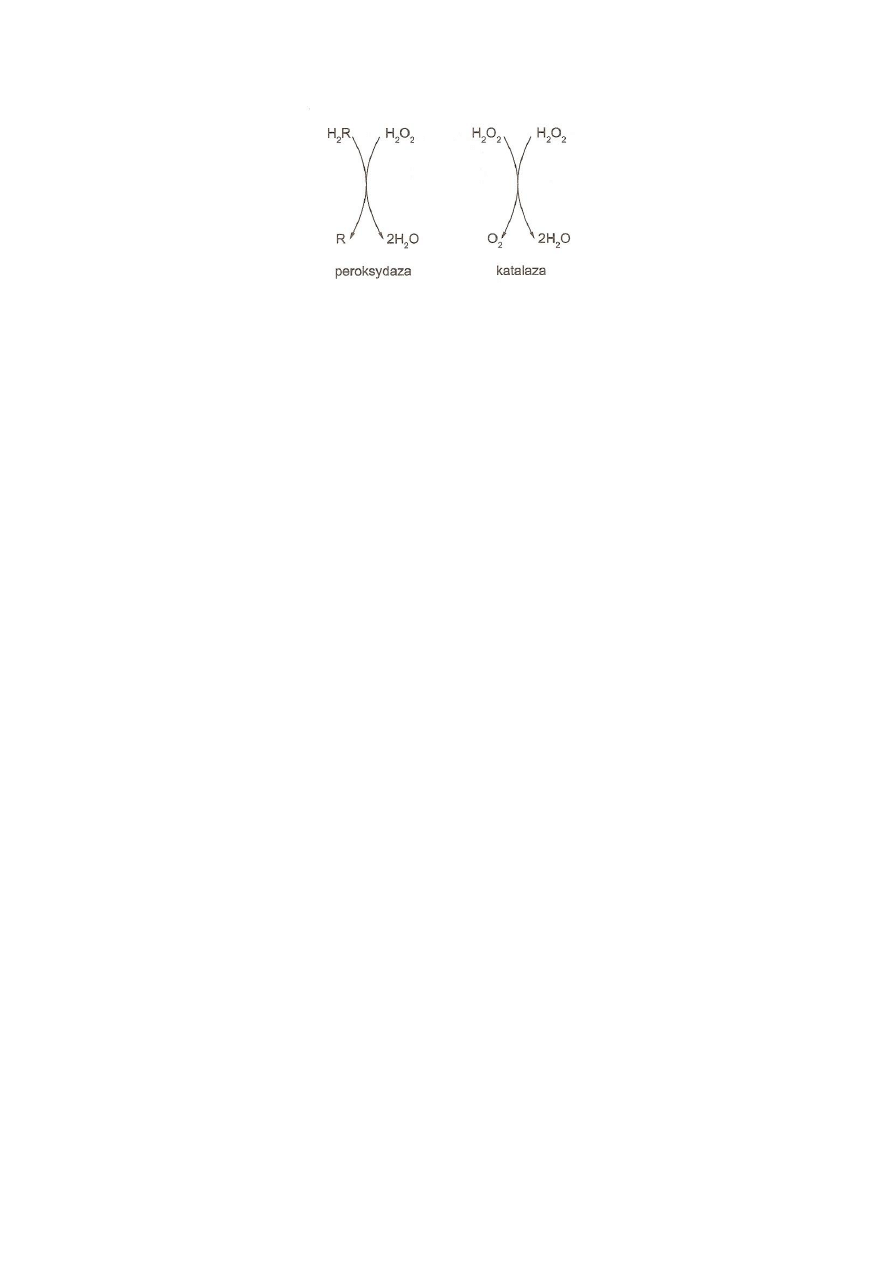
4. Hydroperoksydazy obejmują dwie podgrupy enzymów: peroksydazy (przeważają w
tkankach roślinnych) i katalazy (w tkankach zwierzęcych). Są to białka zawierające
żelazoporfirynę. Schemat reakcji katalizowanych przez hydroperoksydazy przedstawiono na
rys. 6.
10
Rys. 6. Schemat działania katalazy i peroksydazy
(
Kłyszejko-Stefanowicz, 2003)
Transferazy
(klasa 2). Enzymy tej klasy katalizują reakcje przeniesienia grup między
związkami i to zwykle z udziałem specyficznych koenzymów. Typowymi przedstawicielami
są: aminotransferazy, fosfotransferazy (kinazy), acylotransferazy i glikozylotransferazy,
katalizujące odpowiednio przeniesienie grupy aminowej, fosforanowej, acylowej lub
glikozylowej. Duże znaczenie mają enzymy przenoszące grupy jednowęglowe (C
1
), z których
najważniejsze to metylotransferazy, hydroksymetylotransferazy i formylotransferazy. Nazwa
enzymów tej klasy powinna zawierać określenie grupy przenoszonej, dawcy oraz akceptora.
Na przykład prawidłową nazwą heksokinazy jest 6-fosfotransferaza ATP : D-heksoza.
Zastosowanie w technologii żywności enzymów z klasy oksydoreduktaz
Preparaty (zwykle pochodzenia bakteryjnego) zawierające katalazę, tj. enzym z kategorii
hydroperoksydaz, znajdują zastosowanie przy rozkładzie np. wody utlenionej, która w krajach
tropikalnych bywa dodawana w stosunku ok. 0,03% (jako czysty H
2
O
2
) do surowego mleka w
celach konserwujących. Po spełnieniu swej funkcji nadtlenek wodoru jest rozkładany przez
katalazę dodaną do mleka bezpośrednio przed jego pasteryzacją
katalaza
2 H
2
O
2
———→ 2H
2
O + O
2
Ostatnio dość powszechne zastosowanie znajduje enzym oksydaza glukozowa (należący do
enzymów flawinowych - dehydrogenaz) w połączeniu z katalazą. Mianowicie β-D-
glukopiranoza zostaje utleniona pod wpływem oksydazy glukozowej do laktonu kwasu
glukonowego, który po przyłączeniu wody przechodzi w kwas glukonowy. Odłączone od
glukozy
atomy
wodoru są przekazywane za pośrednictwem dwunukleotydu
f1awinoadeninowego (w skrócie FAD) lub mononukleotydu flawinowego (FMN)
hezpośrednio na tlen z wytworzeniem nadtlenku wodoru. Ogólnie utlenianie glukozy można
przedstawić w postaci sumarycznej reakcji
oksydaza glukozowa
C
5
H
11
O
5
∙
CHO + H
2
O ———————→ C
5
H
11
O
5
∙
COOH + H
2
O
2
przy czym powstały nadtlenek wodoru jest rozkładany przez katalazę. W rezultacie ilość tlenu
biorącego udział w reakcji ulega zmniejszeniu do połowy, gdyż zostaje on zużyty do
11
utleniania glukozy. W dalszych reakcjach tego typu tlen z czasem zużywa się całkowicie do
utlenienia glukozy. Reakcje te wykorzystuje się w technologii żywności:
- do zużywania resztek glukozy (zlikwidowania w niej reaktywnej grupy aldehydowej) w celu
zapobieżenia niepożądanym reakcjom kondensacyjnym między aldozami i wolnymi grupami
aminowymi białek (związki Maillarda), powodującymi ciemnienie i niekorzystne zmiany
zapachowe; przykładem może tu być suszona masa jajowa;
- do usuwania resztek tlenu, np. z soków owocowych - w celu lepszego zachowania witaminy
C i zabezpieczenia przed brunatnieniem lub z majonezów w celu zahamowania autooksydacji
tłuszczu.
Oksydaza glukozowa łącznie z katalazą - w postaci tzw. pakietów antyoksydacyjnych - jest
wprowadzana także do niektórych produktów suchych łatwo utleniających się i pakowanych
hermetycznie
.
Część doświadczalna
Ćwiczenie 1.
Oksydoreduktazy i transferazy. Ogólne właściwości enzymów
Otrzymanie ekstraktu z ziemniaka:
Obrać jednego ziemniaka i zetrzeć na tarce. Miazgę zawiesić w 50 ml wody destylowanej, a
następnie wyciąg wodny wycisnąć przez gazę (do zlewki o poj. 400 cm
3
). Po opadnięciu
skrobi płyn zdekantować i użyć do przeprowadzenia doświadczeń.
1) BADANIE AKTYWNOŚCI OKSYDAZY FENOLOWEJ W EKSTRAKCIE Z
ZIEMNIAKA (oksydoreduktaza)
Do badania aktywności oksydazy fenolowej przygotować próby, jak podano w tabeli:
Nr probówki
1
2
3
wyciąg z ziemniaka (ml)
1
1*
wyciąg z ziemniaka należy
przegotować przed dodaniem
kolejnych roztworów
1
woda destylowana (ml)
5
4
4
fenol 1% (ml)
-
1
1
Próby inkubować w 37°C przez 40-50 minut mieszając od czasu do czasu. Obserwować
zmianę zabarwienia.
Wyjaśnienie:
Oksydaza fenolowa (oksydoreduktaza o-difenol: tlen EC.1.10.3.1) działa na o-difenole i
monofenole w myśl reakcji:

12
Reakcja katalizowana przez oksydazę fenolową
W próbówce nr 3 podczas inkubacji dochodzi do utleniania wprowadzonego do probówki
fenolu przy udziale oksydazy fenolowej. Barwa powstających produktów utleniania fenolu
zmienia się od różowej do ciemnobrunatnej – z fenolu powstaje pirokatechina, która
utleniana jest następnie do o-chinonu ulegającemu dalszym przemianom do ciemno
zabarwionej melaniny.
W probówce nr 2 nastąpiła denaturacja enzymu – reakcja nie zachodzi.
W wyciągu ziemniaczanym obecne są endogenne związki typu o-difenoli, które podczas
dość długiej inkubacji również ulegają utlenieniu, co może prowadzić do zmiany
zabarwienia w probówce nr 1. Podobną reakcję obserwuje się np. na obranym ziemniaku,
który po pewnym czasie sinieje, z tego samego powodu jabłko obrane ze skórki w krótkim
czasie brązowieje.
2) ENZYMY ROZKŁADAJĄCE NADTLENEK WODORU
Nadtlenek wodoru (H
2
O
2
) jest silnym inhibitorem układów enzymatycznych a jego
nagromadzenie może sprzyjać tworzeniu się wolnych rodników, które z kolei mogą
uszkadzać błony komórkowe i materiał genetyczny komórek oraz prowadzić do powstawania
nowotworów.
W związku z powyższym organizmy żywe posiadają aktywne mechanizmy zdolne do
rozkładu nadtlenku wodoru. Do enzymów biorących udział przy usuwaniu H
2
O
2
z komórki
należą peroksydazy i katalazy, które należą do hemoprotein.
Katalaza występuje powszechnie w organizmach tlenowych, głównie u zwierząt: w wątrobie,
nerkach, krwi, szpiku, błonach śluzowych. Peroksydazy są to enzymy głównie roślinne,
rzadziej zwierzęce.
2.1) WYKRYWANIE PEROKSYDAZY W ZIEMNIAKU (oksydoreduktaza)
Przygotować 2 probówki, wprowadzić do nich po 2 ml wyciągu z ziemniaka, zawartość
jednej z probówek zagotować. Do probówek dodać po 0,5 ml fenolu, a następnie 0,5 ml 3%
H
2
O
2.
Zawartość probówek wymieszać i obserwować zmianę zabarwienia (zmiana
zabarwienia następuje o wiele szybciej niż w zadaniu 1, gdyż jednocześnie działa oksydaza i
peroksydaza).

13
Wyjaśnienie:
Peroksydazy nie rozkładają nadtlenku wodoru a pośredniczą jedynie w utlenianiu substratów
(katalizują przeniesienie odłączonych atomów wodoru z substratów, zwykle aromatycznych
na H
2
O
2
), zgodnie z reakcją ogólną:
H
2
O
2
+AH
2
→ 2H
2
O + A
Substratami dla peroksydaz są najczęściej fenole:
H
2
O
2
+ fenole → 2H
2
O + chinony
2.2) BADANIE AKTYWNOŚCI KATALAZY W EKSTRAKCIE Z ZIEMNIAKA
(oksydoreduktaza)
Do dwóch probówek odmierzyć po 1 ml ekstraktu z ziemniaka. W jednej z probówek enzym
zinaktywować, wstawiając ją na 5 minut do wrzącej łaźni wodnej, po czym do obydwu
probówek dodać po 1 ml 3% roztworu nadtlenku wodoru. Obserwować wynik reakcji.
Wyjaśnienie:
Katalaza (oksydoreduktaza nadtlenek wodoru: nadtlenek wodoru) katalizuje rozkład H
2
O
2
na
wodę i tlen w myśl reakcji:
2 H
2
O
2
→ 2 H
2
O + O
2
W czasie reakcji pojawia się gazowy tlen w postaci pęcherzyków.
Katalaza wykazuje również aktywność peroksydazy, tzn. może katalizować oderwanie
atomów wodoru od substratów organicznych i tylko przy ich małym stężeniu działa jak
katalaza właściwa.
2.3) WYKRYWANIE AKTYWNOŚCI KATALAZY W WYBRANYCH OWOCACH
I WARZYWACH
Materiały i odczynniki:
- probówka typu Falcone o poj. 50 ml
- 3% roztwór nadtlenku wodoru
- ziemniak, burak, marchew, jabłko lub kapusta – „zestaw dnia” układa prowadzący
- płyn do mycia naczyń
1. Do zlewki należy nalać 30 ml roztworu nadtlenku wodoru, następnie dodać 5 ml
mieszaniny płynu do mycia naczyń (trzy krople płynu do mycia naczyń wymieszać z 30 ml
wody destylowanej). Całość delikatnie zamieszać, uważając by nie powstała piana.
2. Do każdej probówki należy nalać po 10 ml roztworu przygotowanego w punkcie 1.
3. W probówce nr 1 należy umieścić kawałek (ok. 1,5 g) ziemniaka, w probówce nr 2
kawałek (ok. 1,5 g) buraka/marchwi a w probówce nr 3 kawałek (ok. 1,5 g) jabłka i włączyć
stoper. Całość delikatnie zamieszać.
4. Zanotować, jaki jest poziom cieczy po umieszczeniu w probówkach kawałka
warzywa/owocu, a następnie sprawdzić i zanotować poziom cieczy (razem z powstającą
pianą) w poszczególnych probówkach po 5, 10, 20, 30 minutach.

14
Wyjaśnienie:
Katalaza występuje w komórkach organizmów tlenowych. Katalaza występuje np.
w komórkach krwi u ludzi – jej działanie możemy zaobserwować w momencie skaleczenia,
kiedy ranę polejemy wodą utlenioną (zauważymy pianę).
Katalaza występuje również w wielu owocach i warzywach, przy czym jej ilość i aktywność
w poszczególnych przypadkach jest zróżnicowana.
Awokado, kiwi, brzoskwinie, wiśnie, morele, banany, arbuzy i ananasy posiadają duże ilości
katalazy, natomiast mniej omawianego enzymu występuje w jabłkach i winogronach.
Wśród warzyw bogate w katalazę są: ziemniak, por, cebula, brokuł, cukinia, szpinak, kapusta,
rzodkiew, marchew, papryka czerwona, rzepa, ogórek, seler, natomiast pomidor zawiera
mniej katalazy.
3) BADANIE AKTYWNOŚCI FOSFORYLAZY (transferaza)
Do zlewki odmierzyć 20 ml wyciągu ziemniaczanego. Próbę wstawić do łaźni wodnej o
temperaturze 45 - 50
o
C!, mieszając ogrzewać 5 minut (w tych warunkach inaktywuje się β-
amylaza roślinna przeszkadzająca w doświadczeniu).
Przygotować 6 probówek (2 zestawy po 3 szt.).
Probówka I i I’ – odmierzyć 2 ml kleiku skrobiowego, 5 ml wody destylowanej i 3 ml buforu
fosforanowego, zawartość wymieszać.
Probówka II i II’ – odmierzyć 2 ml kleiku skrobiowego, 5 ml wyciągu ziemniaczanego i 3 ml
wody destylowanej, zawartość wymieszać.
Probówka III i III’ – odmierzyć 2 ml kleiku skrobiowego, 5 ml wyciągu z ziemniaka i 3 ml
buforu fosforanowego, zawartość wymieszać.
Schemat doświadczenia przedstawiono w tabeli:
Nr probówki
I i I’
II i II’
III i III’
3% kleik skrobiowy (ml)
2
2
2
woda destylowana (ml)
5
3
-
wyciąg z ziemniaka (ml)
-
5
5
bufor fosforanowy (ml)
3
-
3
Wszystkie probówki inkubować w temp. 37
o
C przez 25 min. Po inkubacji, do trzech
probówek: I’, II’ i III’ dodać po 1 ml roztworu I
2
w KI (reakcja z jodem na obecność skrobi).
Wyjaśnienie:
Fosforylaza katalizuje rozpad polisacharydów zapasowych (skrobi lub glikogenu). Enzym
należy do glikozylotransferaz. Katalizowana reakcja zachodzi na drodze fosforolizy, gdzie
wiązania α-1,4 glikozydowe ulegają rozbiciu a reszta α-glukozy przeniesiona zostaje na
ortofosforan.

15
Po inkubacji:
probówka I’ – obecność skrobi potwierdza dodatnia reakcja z jodem,
probówka II’ – reakcja katalizowana przez fosforylazę nie zajdzie z powodu braku reszty
fosforanowej. Obecność skrobi potwierdza dodatnia reakcja z jodem.
probówka III’ – pod działaniem fosforylazy odłącza się reszta glukozy z nieredukującego
końca skrobi i wiąże się z kwasem fosforowym, powstaje glukozo-1-fosforan. W próbie
obserwujemy brak reakcji z jodem.
Literatura:
1) Ćwiczenia z biochemii. Praca zbiorowa pod red. L. Kłyszejko-Stefanowicz. Wydawnictwo
Naukowe PWN, Warszawa, 2003.
2) Ogólna technologia żywności. Pijanowski E., Dłużewski M., Dłużewska A., Jarczyk A.
Wydawnictwa Naukowo-Techniczne, Warszawa, 2004.
3) Biochemia. Krótkie wykłady. Hames B.D. i Hooper N.M. Wydawnictwo Naukowe PWN,
Warszawa, 2002.
4) Podstawy biochemii. J. Kączkowski. Wydawnictwa Naukowo-Techniczne, Warszawa,
2005
5) http://www.ehow.com/info_8552996_vegetable-fruit-sources-catalase.html
Wyszukiwarka
Podobne podstrony:
cwiczenie 1 oksydoreduktazy i transferazy wykrywanie aktywnosci enzymow w materiale biologicznym 05
Ćwiczenie T1 Transformator trójfazowy, t1 f
Sprawozdanie z ćwiczenia nr 2(transformator), Studia, AAAASEMIII, 3. semestr, Elektrotechnika II, Pa
3 Cwiczenia zadania2 transformata Z id 606489 (2)
opisy transformacje, BUDOWNICTWO, geometria wykreslna, ćwiczenia do transformacji
3 Cwiczenia zadania4 transformata Laplacea id 606491 (2)
Ćwiczenie T1 Transformator trójfazowy, t1 f
Sprawozdanie z ćwiczenia nr 2(transformator), Studia, AAAASEMIII, 3. semestr, Elektrotechnika II, Pa
METALURGIA (polska sztuka pradziejowa), darmowy transfer, na ćwiczenia
Transformacja helmerta, Geodezja, Geodezja Inżynieryjna, gin cwiczenia
Fatima Nabili transf spr, ćwiczenie 1
stal damasceńska, darmowy transfer, na ćwiczenia
METALURGIA (polska sztuka pradziejowa), darmowy transfer, na ćwiczenia
T7 Transformacja układu odniesienia
3 ćwiczenia BADANIE asfaltów
Ćwiczenie7
11 BIOCHEMIA horyzontalny transfer genów
więcej podobnych podstron