
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Grażyna Sobierajska
Posługiwanie się podstawowymi pojęciami
fizykochemicznymi 714[03].L1.02
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Krzysztof Garczyński
mgr Romuald Mazur
Opracowanie redakcyjne:
mgr inż. Grażyna Sobierajska
Konsultacja:
mgr Zenon W. Pietkiewicz
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 714[03].L1.02.
Posługiwanie się podstawowymi pojęciami fizykochemicznymi zawartego w modułowym
programie nauczania dla zawodu lakiernik.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Przykładowe scenariusze zajęć
7
5. Ćwiczenia
11
5.1. Przepisy bezpieczeństwa pracy i ochrony przeciwpożarowej w pracowni
chemicznej
11
5.1.1. Ćwiczenia
11
5.2. Podstawowe pojęcia dotyczące budowy materii
12
5.2.1. Ćwiczenia
12
5.3. Roztwory i ich stężenia
14
5.3.1. Ćwiczenia
14
5.4. Układy fazowe i koloidy
16
5.4.1. Ćwiczenia
16
5.5. Właściwości gazów
17
5.5.1. Ćwiczenia
17
5.6. Właściwości cieczy
19
5.6.1. Ćwiczenia
19
5.7. Budowa kryształów i substancji bezpostaciowych
20
5.7.1. Ćwiczenia
20
5.8. Prawa chemiczne
21
5.8.1. Ćwiczenia
21
5.9. Układ okresowy pierwiastków
22
5.9.1. Ćwiczenia
22
5.10. Obliczenia stechiometryczne
23
5.10.1. Ćwiczenia
23
5.11. Związki nieorganiczne stosowane w lakiernictwie
24
5.11.1. Ćwiczenia
24
5.12. Związki organiczne stosowane w lakiernictwie
25
5.12.1. Ćwiczenia
25
5.13. Związki wielkocząsteczkowe
26
5.13.1. Ćwiczenia
26
5.14. Typy reakcji chemicznych
27
5.14.1. Ćwiczenia
27
5.15. Energetyka i szybkość reakcji
28
5.15.1. Ćwiczenia
28
5.16. Procesy elektrochemiczne: reakcje utleniania i redukcji, przewodnictwo
elektrolitów, elektroliza, szereg napięciowy metali, potencjał elektrody,
ogniwa i akumulatory, zjawisko elektroforezy
29
5.16.1. Ćwiczenia
29
6. Ewaluacja osiągnięć ucznia
32
7. Literatura
48

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik niniejszy będzie pomocny w prowadzeniu zajęć dydaktycznych obejmujących
zakres podstawowych pojęć fizykochemicznych.
W poradniku zamieszczono:
−
wymagania wstępne,
−
wykaz umiejętności i wiadomości, które uczeń opanuje podczas zajęć,
−
przykładowe scenariusze zajęć,
−
propozycje ćwiczeń, które pomogą wykształcić u uczniów umiejętności praktyczne,
−
wykaz literatury.
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami ze
szczególnym uwzględnieniem:
−
tekstu przewodniego,
−
ćwiczeń praktycznych,
−
pokazu z objaśnieniem.
Formy organizacyjne pracy uczniów mogą obejmować pracę indywidualną jak również
pracę zespołową.
W rozdziale 6 zamieszczono zestaw zadań testowych, który może być wykorzystany przez
nauczyciela w celu przeprowadzenia sprawdzianu wiadomości i umiejętności ucznia.
W rozdziale 6 podano również:
−
plan testu w formie tabelarycznej,
−
punktacje zadań,
−
propozycje norm wymagań,
−
instrukcję dla nauczyciela,
−
instrukcję dla ucznia,
−
kartę odpowiedzi,
−
zestaw zadań tekstowych.
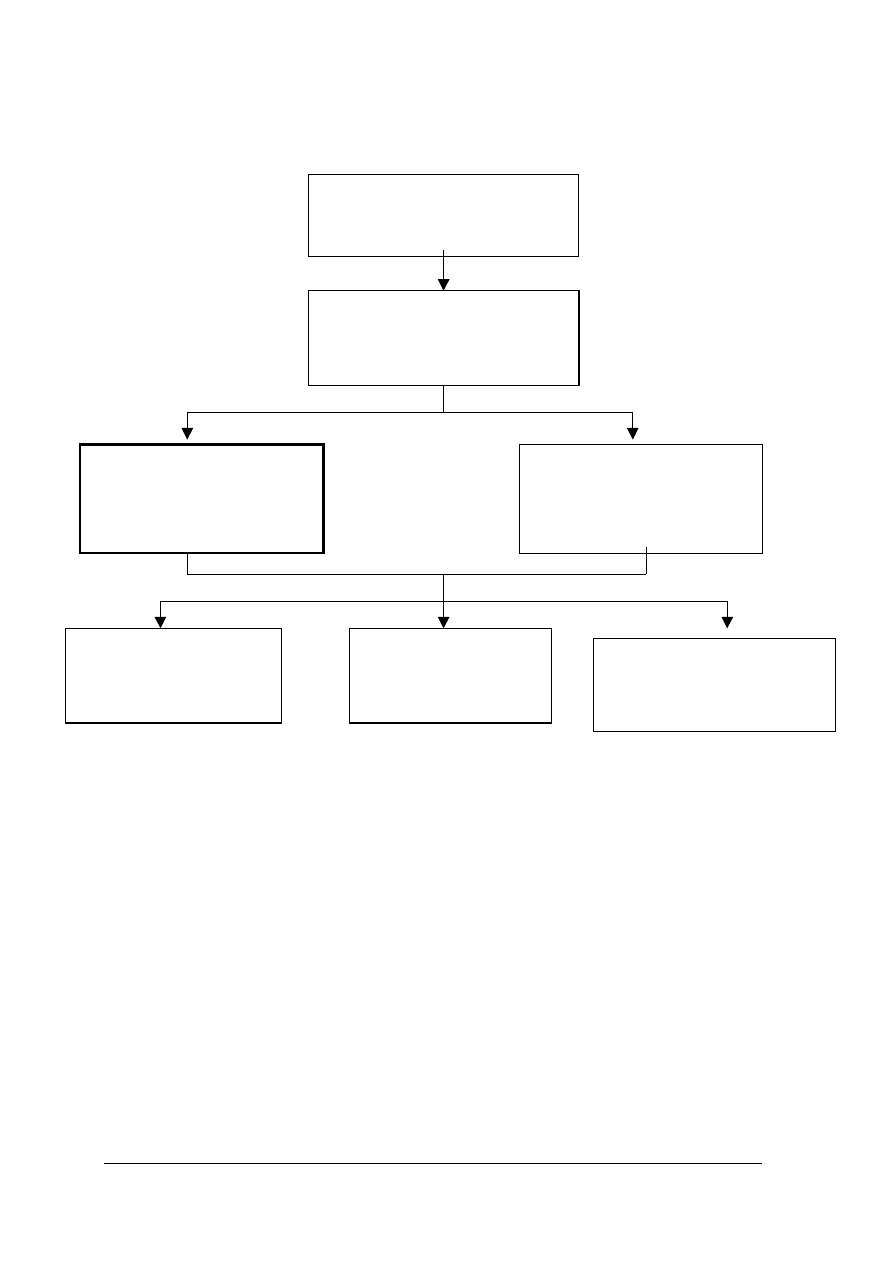
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat jednostek modułowych
714 [03].L1
Fizykochemicze podstawy
lakiernictwa
714 [03].L1.01
Przestrzeganie przepisów bhp
ochrony ppoż. i ochrony
środowiska
714 [03].L1.03
Wykonywanie pomiarów
laboratoryjnych
714 [03].L1.04
Rozróżnianie metali
i stopów
714 [03].L1.05
Zapobieganie korozji
metali
714 [03].L1.06
Rozpoznawanie materiałów
lakierniczych i pomocniczych
714 [03].L1.02
Posługiwanie się
podstawowymi pojęciami
fizykochemicznymi

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej uczeń powinien umieć:
−
organizować stanowisko pracy zgodnie z wymogami ergonomii,
−
znajdować właściwą dokumentację techniczną w bibliotece lub innej bazie danych,
−
rozróżniać pojęcia procesów fizycznych i chemicznych,
−
stosować poznane pojęcia i prawa w praktyce,
−
korzystać z różnych źródeł informacji.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji ćwiczeń podanych w poradniku uczeń powinien umieć:
−
wyjaśnić pojęcia z zakresu budowy materii, atomu, cząsteczki, pierwiastka, związku
chemicznego, wiązania chemicznego,
−
zastosować prawo stałości składu i prawo Avogadro,
−
posłużyć się układem okresowym pierwiastków chemicznych,
−
określić właściwości substancji chemicznych w zależności od ich budowy,
−
scharakteryzować związki nieorganiczne stosowane w lakiernictwie: kwasy, zasady, sole,
−
sporządzić roztwory i obliczyć ich stężenia,
−
scharakteryzować procesy elektrochemiczne,
−
wyjaśnić podstawowe pojęcia z elektrochemii: elektrody, polaryzacja, nadnapięcie,
napięcie rozkładowe, szereg napięciowy metali, ogniwa galwaniczne,
−
zapisać równania reakcji utleniania - redukcji,
−
scharakteryzować
właściwości
węglowodorów
alifatycznych
nasyconych
i nienasyconych,
−
scharakteryzować alkohole, aldehydy, ketony, kwasy organiczne, estry, etery, aminy,
aminokwasy pod względem ich budowy i właściwości,
−
scharakteryzować podstawowe związki aromatyczne: benzen i fenol,
−
rozróżnić reakcje polikondensacji, polimeryzacji i poliaddycji,
−
scharakteryzować związki wielkocząsteczkowe ze względu na budowę i ich właściwości,
−
wyjaśnić mechanizm procesu odtłuszczania,
−
wykonać zgodnie z zasadami bhp proste doświadczenia chemiczne,
−
scharakteryzować szybkość reakcji chemicznych i stan równowagi,
−
wyjaśnić działanie katalizatorów i inhibitorów,
−
scharakteryzować właściwości cieczy: lepkość, gęstość, napięcie powierzchniowe,
−
rozróżnić układy fazowe,
−
scharakteryzować właściwości układów koloidalnych,
−
rozróżnić substancje krystaliczne od bezpostaciowych,
−
zastosować przepisy bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej oraz
środowiska naturalnego,
−
skorzystać z literatury technicznej oraz bazy danych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca ……………………………………………….
Modułowy program nauczania: Lakiernik 714[03]
Moduł: Fizykochemiczne podstawy lakiernictwa 714[03].L1
Jednostka modułowa: Posługiwanie
się podstawowymi pojęciami fizykochemicznymi
714[03].L1.02
Temat: Podstawowe pojęcia dotyczące budowy materii.
Cel ogólny: Kształtowanie umiejętności posługiwania się podstawowymi pojęciami
dotyczącymi budowy materii.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
−
zorganizować stanowisko do wykonania ćwiczeń,
−
zdefiniować pojęcia: atom, cząsteczka, związek chemiczny,
−
obliczyć masę cząsteczkowa związku chemicznego,
−
podać wartość liczby Avogadro,
−
scharakteryzować stany skupienia materii,
−
scharakteryzować atom,
−
wykorzystać zdobyte wiadomości w praktycznym działaniu.
Metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
prezentacja multimedialna,
−
tekst przewodni.
Formy organizacyjne pracy uczniów:
−
indywidualna.
Czas: 90 minut.
Środki dydaktyczne:
−
kolekcja pierwiastków,
−
modele pierwiastków,
−
modele związków,
−
układ okresowy pierwiastków,
−
zeszyt przedmiotowy,
−
przybory kreślarskie, gumka, długopis.
Przebieg zajęć:
1. Sprawy organizacyjne.
2. Nawiązanie do tematu, omówienie celów zajęć.
3. Zorganizowanie stanowiska pracy do przeprowadzenia pokazu z objaśnieniem.
4. Realizacja tematu:
−
nauczyciel prowadzi pokaz z objaśnieniem z zakresu podstawowych pojęć
dotyczących budowy materii,
−
każdy uczeń wykonuje obliczenia masy cząsteczkowej następujących związków
chemicznych: NaOH, CO2, CO,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
−
pomocą do prawidłowego wykonania obliczeń jest układ okresowy pierwiastków,
informacje z tekstu przewodniego i podpowiedź nauczyciela,
−
uczeń dokonuje w zeszycie zapisu wykonanych obliczeń,
−
nauczyciel nadzoruje pracę uczniów i pomaga w prawidłowym obliczeniu masy
cząsteczkowej i sposobu zapisu obliczeń w zeszycie.
5. Po wykonaniu wszystkich obliczeń uczeń próbuje dokonać analizy wykonanego
ćwiczenia.
6. Uczeń wskazuje swoje mocne i słabe strony.
7. Nauczyciel analizuje prace ucznia i stwierdza poprawność i estetykę wykonanego
ćwiczenia.
8. Uczniowie prezentują swoje prace w kolejności wykonywania.
9. Klasa wspólnie z nauczycielem dokonuje oceny prac.
Zakończenie zajęć.
Praca domowa.
Obliczyć masę cząsteczkową związków: ZnO i HCl. Obliczenia zapisać w zeszycie
przedmiotowym.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
anonimowe ankiety ewaluacyjne dotyczące sposobu prowadzenia zajęć i zdobytych
umiejętności.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Scenariusz zajęć 2
Osoba prowadząca ……………………………………………….
Modułowy program nauczania: Lakiernik 714[03]
Moduł: Fizykochemiczne podstawy lakiernictwa 714[03].L1
Jednostka modułowa: Posługiwanie
się podstawowymi pojęciami fizykochemicznymi
714[03].L1.02
Temat: Typy reakcji chemicznych.
Cel ogólny: Kształtowanie umiejętności definiowania i rozpoznawania rodzajów reakcji
chemicznych.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
−
wymienić typy reakcji chemicznych,
−
scharakteryzować reakcje syntezy,
−
scharakteryzować reakcję analizy,
−
scharakteryzować reakcje wymiany,
−
wykorzystać zdobyte wiadomości w praktycznym działaniu.
Metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
dyskusja problemowa,
−
ćwiczenia praktyczne,
−
tekst przewodni.
Formy organizacyjne pracy uczniów:
−
indywidualna.
Czas: 45minut.
Środki dydaktyczne:
−
zeszyt przedmiotowy,
−
ołówek, długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela,
Przebieg zajęć:
1. Sprawy organizacyjne.
2. Nawiązanie do tematu, omówienie celów zajęć.
3. Zorganizowanie stanowiska pracy do przeprowadzenia pokazu z objaśnieniem.
4. Realizacja tematu:
−
nauczyciel prowadzi pokaz z objaśnieniem typowych reakcji chemicznych,
−
każdy uczeń zapisuje typowe równania reakcji chemicznych,
−
uczeń zapisuje w zeszycie typowe równania reakcji chemicznych,
−
nauczyciel nadzoruje pracę uczniów i pomaga w zapisywaniu równań reakcji
−
w zeszycie.
5. Po wykonaniu zadanych równań reakcji uczeń próbuje dokonać analizy wykonanego
ćwiczenia.
6. Uczeń wskazuje swoje mocne i słabe strony.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
7. Nauczyciel analizuje prace ucznia i stwierdza poprawność i estetykę wykonanego
ćwiczenia.
8. Uczniowie prezentują swoje prace w kolejności wykonywania.
9. Klasa wspólnie z nauczycielem dokonuje oceny prac.
Zakończenie zajęć.
Praca domowa.
Ułożyć po jednym przykładzie równań reakcji syntezy, analizy i wymiany.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
anonimowe ankiety ewaluacyjne dotyczące sposobu prowadzenia zajęć i zdobytych
umiejętności.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
5. ĆWICZENIA
5.1. Przepisy bezpieczeństwa pracy i ochrony
przeciwpożarowej w pracowni chemicznej
5.1.1. Ćwiczenia
Ćwiczenie 1
Przygotuj spis odzieży ochronnej niezbędnej w pracowni chemicznej.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) wypisać zalecane elementy odzieży ochronnej niezbędne do wykonywania doświadczeń
w pracowni chemicznej,
3) przedstawić wyniki wykonanego ćwiczenia,
4) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
5.2. Podstawowe pojęcia dotyczące budowy materii
5.2.1 Ćwiczenia
Ćwiczenie 1
Oblicz masę cząsteczkową następujących związków chemicznych: NaOH, CO
2
, CO.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) obliczyć masę cząsteczkową związków,
3) zapisać i zaprezentować wyniki swojej pracy,
4) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela,
−
układ okresowy pierwiastków.
Ćwiczenie 2
Na podstawie literatury z rozdziału wypisz charakterystyczne cechy pierwiastków zależne od
położenia w układzie okresowym. Szczególną uwagę zwróć na: właściwości metaliczne,
reaktywność, położenie metali i gazów szlachetnych. Szczególnie polecana pozycja [6, str.44-51]
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przygotować wskazaną literaturę,
3) odnaleźć informacje dotyczące właściwości pierwiastków zależnie od ich położenia
w układzie okresowym,
4) zapisać i zaprezentować wyniki swojej pracy,
5) dokonać oceny poprawności wykonanego ćwiczenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 6 poradnika dla ucznia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
5.3. Roztwory i ich stężenia
5.3.1. Ćwiczenia
Ćwiczenie 1
Wykonaj badanie rozpuszczalności soli kuchennej w wodzie i benzynie.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przygotować dwie probówki i dwa statywy do probówek,
3) przygotować 4 gramy soli kuchennej,
4) przygotować 10cm
3
wody i 10cm
3
benzyny,
5) wymieszać próbkę wody z 2 gramami soli kuchennej i próbkę benzyny z 2 gramami soli
kuchennej,
6) zaobserwować wyniki procesu mieszania,
7) zapisać wyniki swojej pracy,
8) zaprezentować efekty swojej pracy,
9) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
dwie probówki na statywach,
−
4g soli kuchennej,
−
10cm3 wody,
−
10cm3 benzyny,
−
literatura z rozdziału 7 poradnika dla nauczyciela.
Ćwiczenie 2
Oblicz ile gramów soli kuchennej i wody należy użyć aby przygotować 300 gramów 15
procentowego roztworu.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przeprowadzić obliczenia,
3) zaprezentować efekty swojej pracy,
4) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.
Ćwiczenie 3
Przygotuj 100 gramów 10 procentowego roztworu soli kuchennej w wodzie.
Przeprowadź proces odparowania wody z roztworu pozostawiając roztwór w płaskim
naczyniu w suchym i ciepłym pomieszczeniu. Zaobserwuj co stało się z wodą i co stało się
z solą wcześniej w wodzie rozpuszczoną
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przygotować naczynie do wykonania roztworu,
3) obliczyć niezbędną ilość soli kuchennej i wody,
4) przygotować roztwór,
5) pozostawić roztwór do odparowania,
6) zapisać wyniki swojej pracy,
7) zaprezentować efekty swojej pracy,
8) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
naczynie,
−
sól kuchenna,
−
woda,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
5.4. Układy fazowe i koloidy
5.4.1. Ćwiczenia
Ćwiczenie 1
Sporządź emulsję oleju w wodzie.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przygotować naczynie do przygotowania emulsji,
3) przygotować 10 cm
3
wody i 5 cm
3
oleju roślinnego,
4) zmieszać dwie ciecze ze sobą,
5) zaprezentować efekty swojej pracy,
6) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
cylinder pomiarowy o pojemności 50 cm
3
,
−
10 cm
3
wody i 5 cm
3
oleju roślinnego,
−
mieszadełko – np. łyżeczka,
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
5.5. Właściwości gazów
5.5.1. Ćwiczenia
Ćwiczenie 1
Wykonaj badanie ściśliwości powietrza.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przygotować strzykawkę,
3) przesuwając tłok strzykawki nabrać do niej powietrza,
4) zatkać wylot strzykawki palcem,
5) dociskać tłok strzykawki sprawdzając czy powietrze zmieści się w mniejszej objętości
strzykawki,
6) zapisać i zaprezentować wyniki swojej pracy,
7) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
strzykawka,
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.
Ćwiczenie 2
Wykonaj badanie rozprężliwości powietrza.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia:
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przygotować dwa balony,
3) przygotować rurkę z zaworem,
4) napełnić powietrzem jeden balon,
5) przy zamkniętym zaworze połączyć rurką balon napełniony z nie napełnionym,
6) odkręcić zawór,
7) zaobserwować co się stanie z nie napełnionym i z napełnionym balonem,
8) zapisać i zaprezentować wyniki swojej pracy,
9) dokonać oceny poprawności wykonanego ćwiczenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
dwa balony,
−
rurka z zaworem,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
5.6. Właściwości cieczy
5.6.1. Ćwiczenia
Ćwiczenie 1
Wykonaj badanie ściśliwości wody.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia:
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przygotować strzykawkę,
3) przesuwając tłok strzykawki nabrać do niej wody,
4) zatkać wylot strzykawki palcem,
5) dociskać tłok strzykawki sprawdzając czy woda zmieści się w mniejszej objętości
strzykawki,
6) zapisać i zaprezentować wyniki swojej pracy,
7) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
strzykawka,
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
5.7. Budowa kryształów i substancji bezpostaciowych
5.7.1. Ćwiczenia
Ćwiczenie 1
Przeprowadź proces krystalizacji soli kuchennej.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przygotować wysokie, wąskie naczynie, wykałaczkę, nitkę,
3) przygotować nasycony roztwór soli,
4) nitkę przywiązać do wykałaczki i zanurzyć w naczyniu opierając wykałaczkę o brzegi
naczynia tak aby nitka wisiała i nie była całkowicie zanurzona w wodzie,
5) po kilku dniach zaobserwuj wykrystalizowane na nitce kryształki soli,
6) zapisać i zaprezentować wyniki swojej pracy,
7) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
wąskie wysokie naczynie, nitka wykałaczka,
−
nasycony roztwór soli,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
5.8. Prawa chemiczne
5.8.1. Ćwiczenia
Ćwiczenie 1
Korzystając z prawa zachowania masy i prawa stałości składu uzupełnij poniższe równania
reakcji.
2Na + H
2
O = 2NaOH + H
2
MgO + H
2
O = Mg(OH)
Zn (OH)
2
+ HCl = ZnCl
2
+ 2H
2
O
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia:
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) zapoznać się z wiadomościami dotyczącymi prawa zachowania masy,
3) uzupełnić równania reakcji,
4) zapisać wyniki w zeszycie przedmiotowym,
5) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
5.9.
Układ okresowy pierwiastków
5.9.1.
Ćwiczenia
Ćwiczenie 1
Znajdź na układzie okresowym pierwiastków pierwiastki o liczbie atomowej równej: 7, 20,10.
Opisz te pierwiastki według schematu: nazwa pierwiastka, liczba atomowa, liczba protonów,
liczba neutronów, liczba elektronów.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przygotować układ okresowy pierwiastków,
3) odnaleźć pierwiastki o liczbie atomowej równej 7, 20, 10,
4) opisać pierwiastki według schematu z polecenia zadania,
5) zapisać wyniki swojej pracy,
6) zaprezentować wyniki swojej pracy,
7) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
układ okresowy pierwiastków,
−
zeszyt przedmiotowy,
−
długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
5.10. Obliczenia stechiometryczne
5.10.1. Ćwiczenia
Ćwiczenie 1
Oblicz ile gramów amoniaku można otrzymać z 15 gramów azotu w procesie opisanym
poniższym równaniem reakcji.
3H
2
+ N
2
= 2NH
3
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) zapisać równanie reakcji, wypisz dane i szukane,
3) ułożyć stosunek stechiometryczny,
4) obliczyć szukaną,
5) zapisać wyniki swojej pracy,
6) zaprezentować wyniki swojej pracy,
7) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
5.11. Związki nieorganiczne stosowane w lakiernictwie
5.11.1. Ćwiczenia
Ćwiczenie 1
Napisz równanie reakcji syntezy chlorku potasu z zastosowaniem zasady potasowej.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) zapisać równanie reakcji,
3) sprawdzić współczynniki stechiometryczne,
4) zaprezentować wyniki swojej pracy,
5) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
5.12. Związki organiczne stosowane w lakiernictwie
5.12.1. Ćwiczenia
Ćwiczenie 1
Wykonaj
zestawienie
stosowanych
w
lakiernictwie
pigmentów
organicznych
z uwzględnieniem barw.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) wykonać zestawienie pigmentów,
3) zapisać i zaprezentować wyniki swojej pracy,
4) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
5.13. Związki wielkocząsteczkowe
5.13.1. Ćwiczenia
Ćwiczenie 1
Wykonaj
tabelę
z
porównaniem
własności
polimerów
termoplastycznych
i termoutwardzalnych.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) zaplanować
pozycje
tabeli
analizując
cechy
polimerów
termoplastycznych
i termoutwardzalnych,
3) wykonać tabelę wg zaplanowanych analizowanych cech,
4) zapisać wyniki swojej pracy,
5) zaprezentować wyniki swojej pracy,
6) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
5.14. Typy reakcji chemicznych
5.14.1. Ćwiczenia
Ćwiczenie 1
Zapisz równanie reakcji syntezy wody.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia:
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) zapisać reakcję syntezy wody,
3) sprawdzić współczynniki stechiometryczne reakcji,
4) zapisać i zaprezentować wyniki swojej pracy,
5) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
5.15. Energetyka i szybkość reakcji
5.15.1. Ćwiczenia
Ćwiczenie 1
Znajdź w literaturze przykład reakcji egzoenergetycznej i endoenergetycznej. Zapisz
równania reakcji.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) odnaleźć w literaturze przykłady reakcji egzoenergetycznych i endoenergetycznych,
3) zapisać równania odnalezionych przykładowych reakcji,
4) zapisać i zaprezentować wyniki swojej pracy,
5) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
5.16.
Procesy elektrochemiczne: reakcje utleniania i redukcji,
przewodnictwo elektrolitów, elektroliza, szereg napięciowy
metali,
potencjał
elektrody,
ogniwa
i akumulatory,
zjawisko elektroforezy
5.16.1. Ćwiczenia
Ćwiczenie 1
Oblicz SEM ogniwa CuCu
2+
Au
3+
Au
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy do wykonania ćwiczenia,
2) przygotować szereg napięciowy metali,
3) zastosować wzór do obliczania SEM,
4) zapisać wyniki swojej pracy,
5) zaprezentować wyniki swojej pracy,
6) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.
Ćwiczenie 2
Oznacz biegun dodatni i ujemny nie oznakowanej baterii do ładowania latarki. Oznaczenie
wykonaj
badając
proces
elektrolizy
w
wodnym
roztworze
soli
kuchennej
z niewielką zawartością fenoloftaleiny.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy,
2) przygotować płaską baterię do latarki i usunąć z niej oznakowania biegunów,
3) przygotować wodny 15% roztwór soli kuchennej,
4) przygotować płaskie naczynie,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
5) przygotować fenoloftaleinę,
6) przelać roztwór do naczynia,
7) dodać do roztworu fenoloftaleinę,
8) zanurzyć odgięte blaszki baterii,
9) obserwować proces elektrolizy (przy biegunie ujemnym roztwór zabarwi się na
malinowo),
10) zapisać wyniki badania,
11) zaprezentować wyniki swojej pracy,
12) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.
Ćwiczenie 3
Sprawdź przewodnictwo cieczy na podstawie wody destylowanej, 0,2 molowego
roztworu kwasu solnego i 0,2 molowego kwasu octowego.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia:
Uczeń powinien:
1) zorganizować stanowisko pracy,
2) zbudować obwód elektryczny z płaskiej baterii, żarówki z oprawką do latarki oraz dwóch
elektrod węglowych,
3) przygotować 3 małe zlewki,
4) przygotować wodę destylowaną, 0,2 molowy roztwór kwasu solnego i 0,2 molowy
roztwór kwasu octowego,
5) zbadać przewodnictwo poszczególnych cieczy stosując obwód elektryczny,
6) zapisać i zaprezentować wyniki swojej pracy,
7) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
obwód elektryczny złożony z dwóch elektrod węglowych, baterii i żarówki,
−
trzy zlewki,
−
woda destylowana, 0,2 molowy roztwór kwasu solnego i 0,2 molowy roztwór kwasu
octowego,
−
literatura z rozdziału 6 poradnika dla ucznia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
Ćwiczenie 4
Wskaż utleniacz i reduktor a następnie dobierz współczynniki do poniższej reakcji redoks:
Ag + HNO
3
AgNO
3
+ NO
2
+ H
2
O
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy,
2) odnaleźć reduktor i utleniacz w równaniu reakcji,
3) zapisać równania połówkowe,
4) na ich podstawie dobrać współczynniki reakcji,
5) zapisać w zeszycie równania połówkowe i pełne równanie z dobranymi współczynnikami,
6) zaprezentować wyniki swojej pracy,
7) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ćwiczenie praktyczne.
Środki dydaktyczne:
−
zeszyt przedmiotowy i długopis,
−
literatura z rozdziału 7 poradnika dla nauczyciela.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
6. EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
Test
dwustopniowy
do
jednostki
modułowej
„Posługiwanie
się
podstawowymi pojęciami fizykochemicznymi”
Test składa się z 25 zadań, z których:
−
zadania 1 – 14 i 21 - 25 są z poziomu podstawowego,
−
zadania 15 - 20 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowienidź lub jej
brak uczeń otrzymuje 0 punktów
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 12 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 15 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 17 zadań, w tym co najmniej 2 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 21 zadań, w tym co najmniej 4 z poziomu
ponadpodstawowego.
Plan testu.
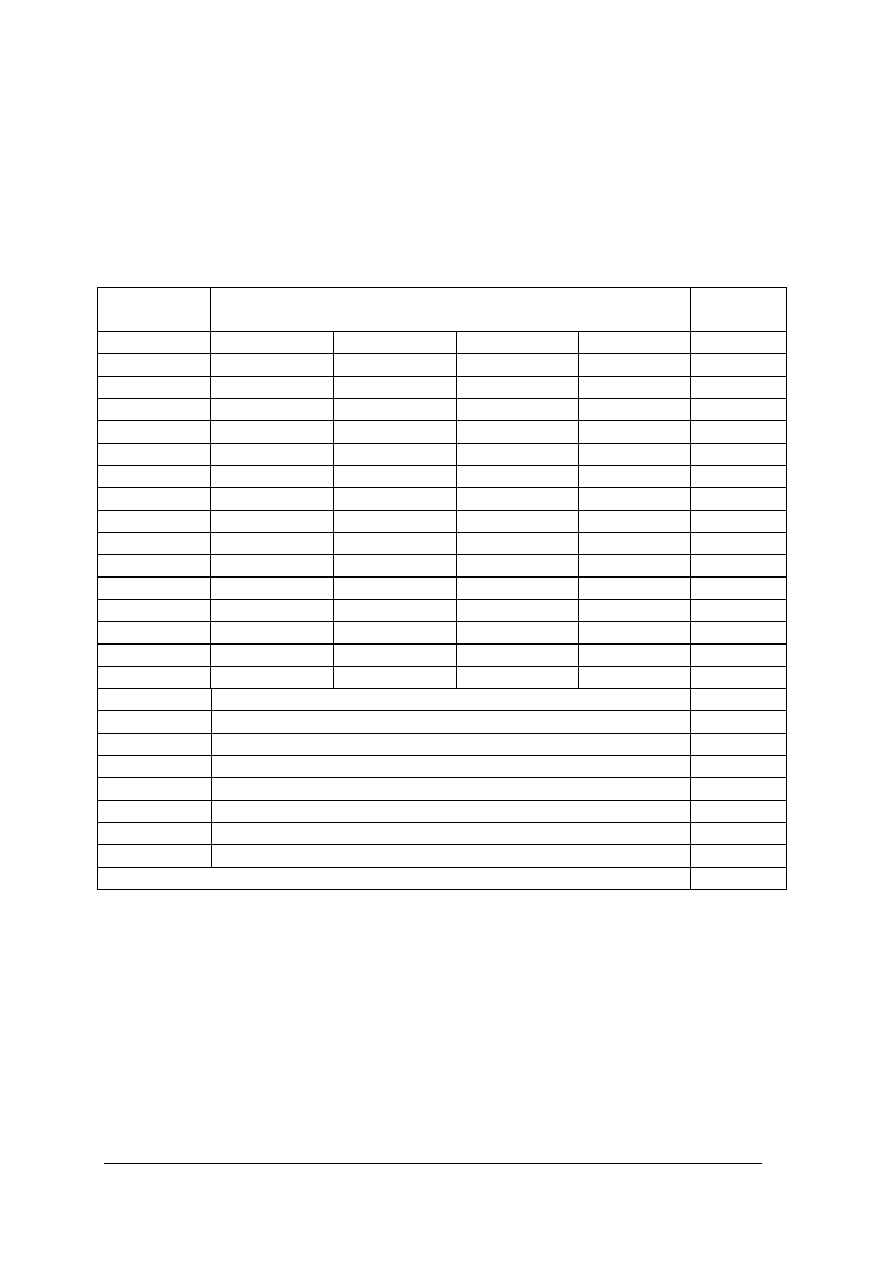
Klucz odpowiedzi
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1.
Omówić zasady bhp przy
wykonywaniu doświadczeń.
A
P
d
2.
Omówić zasady bhp przy regulacji
płomienia.
A
P
a
3.
Omówić zasady bhp przy
rozcieńczaniu kwasów.
A
P
b
4.
Wybrać właściwe określenie cząstek
wg mechaniki kwantowej.
A
P
d
5. Wyjaśnić pojęcie mola.
A
P
c
6. Zdefiniować roztwór nasycony.
A
P
c
7. Zdefiniować prawo zachowania masy.
A
P
a
8. Rozróżnić układy dyspersyjne.
B
P
d
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
9. Rozróżnić katodę i anodę w ogniwie.
B
P
a
10. Zdefiniować stałą Faraday’a.
A
P
a
11.
Określić obszary zastosowania
zjawiska elektroforezy.
A
P
c
12. Określić pojęcie akumulatora.
A
P
d
13.
Rozróżniać prawidłowe stwierdzenia
opisujące stany skupienia materii.
B
P
c
14. Podać definicję ciała bezpostaciowego.
A
P
b
15.
Uzupełniać współczynniki
stechiometryczne reakcji.
D
PP
AlCl
3
+ 3HNO
3
Al(NO
3
)
3
+
3HCl
16.
Obliczać stężenia procentowe
roztworów.
D
PP
30%
17.
Uzupełniać współczynniki reakcji
redoks.
D
PP
N ulega utlenieniu,
czyli jest
reduktorem.
O się redukuje czyli
jest utleniaczem.
Ostateczne
równanie:
4NH
3
+ 5O
2
4NO+ 6H
2
O
18.
Wymienić typy poznanych
akumulatorów.
A
PP
W zależności od
rodzaju
magazynowanej
energii rozróżnia
się akumulatory:
- elektryczne,
- cieplne,
- bezwładnościo
we,
- hydrauliczne,
- pneumatyczne.
19. Obliczać SEM ogniwa.
C
PP
SEM ogniwa
wynosi:
-0,44V – (-0,76V)
= 0,32V
20.
Zidentyfikować różne typy reakcji
chemicznych.
D
PP
- reakcje syntezy
Przykład:
2H
2
+ O
2
= 2H
2
O
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
- reakcje analizy
Przykład:
CaCO
3
= CaO +
CO
2
- reakcje wymiany
Przykład:
NaCl + AgNO
3
=
AgCl + NaNO
3
21. Zdefiniować katalizator.
A
P
katalizator
22. Zdefiniować inhibitor.
A
P
inhibitor
23. Rozróżniać katalizę.
A
P
kataliza
24. Omówić polaryzacje elektrod.
A
P
Polaryzacja
elektrod
25. Zidentyfikować kation.
A
P
kationy

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
Przebieg testowania
Instrukcja dla nauczyciela
1. Ustal z uczniami termin przeprowadzenia sprawdzianu z co najmniej jednotygodniowym
wyprzedzeniem.
2. Omów z uczniami cel stosowania pomiaru dydaktycznego.
3. Zapoznaj uczniów z rodzajem zadań podanych w zestawie oraz z zasadami punktowania.
4. Przeprowadź z uczniami próbę udzielania odpowiedzi na takie typy zadań testowych, jakie
będą w teście.
5. Omów z uczniami sposób udzielania odpowiedzi (karta odpowiedzi).
6. Zapewnij uczniom możliwość samodzielnej pracy.
7. Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi, podaj czas przeznaczony na
udzielanie odpowiedzi.
8. Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego (rozładuj niepokój, zachęć do sprawdzenia swoich możliwości).
9. Kilka minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia udzielania odpowiedzi.
10. Zbierz karty odpowiedzi oraz zestawy zadań testowych.
11. Sprawdź wyniki i wpisz do arkusza zbiorczego.
12. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
13. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
14. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem pytań testowych.
4. Test zawiera 20 pytań dotyczących posługiwania się podstawowymi pojęciami
fizykochemicznymi. Pytania: 1, 2, 3, 4, 5, 6 ,7, 8, 9, 10, 11, 12, 13, 14, są to pytania
wielokrotnego wyboru i tylko jedna odpowiedź jest prawidłowa; pytania: 15, 16, 17 i 19
to pytania obliczeniowe. Pytania 18, 20, 21, 22, 23, 24 i 25 to pytania, w których należy
udzielić krótkiej odpowiedzi.
5. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi:
−
w zadaniach wielokrotnego wyboru zaznacz prawidłową odpowiedź znakiem
X (w przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem, a następnie
ponownie zakreślić odpowiedź prawidłową),
−
w zadaniu z krótką odpowiedzią wpisz odpowiedź w wyznaczone pole,
−
w zadaniach do uzupełnienia wpisz brakujące wyrazy.
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas. Trudności mogą przysporzyć Ci
pytania: 18 - 20, gdyż są one na poziomie trudniejszym niż pozostałe.
8. Na rozwiązanie testu masz 90 min.
Powodzenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
ZESTAW ZADAŃ TESTOWYCH
1. Ćwiczenia doświadczalne należy wykonywać:
a) według własnego uznania,
b) pomijając zasady bhp,
c) pomijając zasady przeciwpożarowe,
d) zawsze zgodnie z instrukcją.
2. Płomień palnika regulujemy:
a) regulując knot przy wyłączonym palniku,
b) regulując knot przy włączonym palniku,
c) w dowolny sposób,
d) nie regulujemy.
3. Kwas rozcieńczamy:
a) dolewając do niego wody,
b) dolewając kwas do wody,
c) dowolnie, ale mieszając w jedną stronę,
d) dowolnie, mieszając wg uznania.
4. Wg mechaniki kwantowej cząstki mają naturę:
a) cząstkową,
b) ciekłą,
c) stałą,
d) korpuskularno – falową.
5. Definicja mola mówi, że:
a) mol jest to 12 gram substancji,
b) mol to 100 mg substancji,
c) mol to taka ilość substancji, która zawiera tyle atomów, jonów, cząstek materialnych ile
atomów zawartych jest w 12 gramach węgla,
d) mol jest to 120 gram substancji.
6. Roztwór nasycony występuje wtedy, gdy:
a) rozpuszczona jest ilość substancji równa jej rozpuszczalności,
b) rozpuszczona jest ilość substancji równa jej rozpuszczalności w danej temperaturze,
c) rozpuszczona jest ilość substancji równa jej rozpuszczalności w danej temperaturze
oraz danym rozpuszczalniku,
d) rozpuszczona jest ilość substancji nierówna jej rozpuszczalności.
7. Prawo zachowania masy mówi, że:
a) w każdej przemianie chemicznej masa substancji biorących udział w reakcji chemicznej
nie ulega zmianie, czyli jest równa masie produktów powstałych w wyniku reakcji,
b) w każdej przemianie chemicznej masa substancji biorących udział w reakcji chemicznej
ulega zmianie,
c) w każdej przemianie chemicznej masa substancji biorących udział w reakcji chemicznej
może nieznacznie ulec zmianie,
d) w każdej przemianie chemicznej masa substancji biorących udział w reakcji chemicznej
ulega zmniejszeniu.
8. Układ dyspersyjny, w którym faza rozproszona to ciecz i faza rozpraszająca ciecz to:
a) zawiesina ,
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
b) mikstura,
c) nie ma takiego układu,
d) emulsja.
9. Katoda w ogniwie to:
a) biegun dodatni ,
b) biegun ujemny,
c) anoda ogniwa,
d) nie występuje.
10.Stała Faradaya ma wartość:
a) 96485 C/mol,
b) 95600 C/mol,
c) 98500 C/mol,
d) 99900 C/mol.
11. Zaznacz błędną odpowiedź. Zjawisko elektroforezy może być wykorzystywane do:
a) oczyszczania i koagulacji lateksu,
b) pokrywania metali farbami, żywicą,
c) zmiany koloru roztworu,
d) pokrywania metali gumą.
12. Akumulator jest urządzeniem wykorzystywanym do:
a) wytwarzania energii,
b) przetwarzania energii,
c) przemiany energii,
d) magazynowania energii.
13. Które z poniższych twierdzeń jest nieprawdziwe:
a) w przyrodzie występują trzy stany skupienia materii,
b) stany skupienia to gaz, ciecz i ciało stałe,
c) stany skupienia nie są zależne od warunków otoczenia,
d) stany skupienia są zależne od warunków otoczenia.
14. Zaznacz prawidłową odpowiedź. Typowe przykłady ciał bezpostaciowych to:
a) kryształ cukru,
b) szkło,
c) diament,
d) grafit.
15. Uzupełnij współczynniki stechiometryczne poniższego równania:
AlCl
3
+ HNO
3
Al(NO
3
)
3
+ HCl
16. Oblicz stężenia procentowe roztworu uzyskanego poprzez rozpuszczenie 30 gramów soli
w 70 gramach wody:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
......................................................................................................................................
......................................................................................................................................
...........
17. Uzupełnij współczynniki reakcji redoks:
NH
3
+ O
2
NO+ H
2
O
18. Wymień znane ci typy akumulatorów zależnie od rodzaju energii gromadzonej:
..........................................................................................................................................
..........................................................................................................................................
............
19. Oblicz SEM ogniwa złożonego z:
Zn/ Zn
2+
E
o
[V]= -0,76 i Fe/ Fe
2+
E
o
[V]= -0,44
..........................................................................................................................................
..........................................................................................................................................
..........................................................................................................................................
20. Wymień znane ci typy reakcji chemicznych i podaj po jednym przykładzie:
reakcje ....................................
przykład ....................................
reakcje ....................................
przykład ....................................
reakcje ....................................
przykład ....................................
21. Jak nazywa się substancja przyspieszający reakcję?
..........................................................
22. Jak nazywa się substancja opóźniający reakcję?
..........................................................
23. Jak nazywa się proces przyspieszania reakcji?
..........................................................
24. Jak nazywa się procesy opisane poniżej?
To nieodwracalne procesy zachodzące na elektrodach, które hamują przepływ prądu
i powodują zmianę potencjału elektrody – różnica potencjałów maleje, maleje natężenie
prądu.
...........................................................
25. Jak nazywa się jony dodatnie?
...........................................................
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
KARTA ODPOWIEDZI
Imię i nazwisko ..........................................................................................
Posługiwanie się podstawowymi pojęciami fizykochemicznymi
Zakreśl poprawną odpowiedź, wpisz brakujące wyrazy
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
...........................................................................................
...........................................................................................
...........................................................................................
...........................................................................................
............
16.
...........................................................................................
...........................................................................................
...........................................................................................
...........................................................................................
............
17.
...........................................................................................
...........................................................................................
...........................................................................................
...........................................................................................
............
18.
...........................................................................................
...........................................................................................
...........................................................................................
...........................................................................................
............

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
19.
...........................................................................................
...........................................................................................
...........................................................................................
...........................................................................................
............
20.
...........................................................................................
...........................................................................................
...........................................................................................
...........................................................................................
...........................................................................................
...........................................................................................
...........................................................................................
.....................
21.
…………………………………….....................................
.
22.
…………………………………….....................................
.
23.
…………………………………….....................................
.
24.
…………………………………….....................................
.
25.
…………………………………….....................................
.
Razem:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
TEST 2
Test
dwustopniowy
do
jednostki
modułowej
„Posługiwanie
się
podstawowymi pojęciami fizykochemicznymi”
Test składa się z 24 zadań, z których:
−
zadania 1 - 16 i 20 - 24 są z poziomu podstawowego,
−
zadania 18 - 20 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowienidź lub jej brak
uczeń otrzymuje 0 punktów
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 12 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 15 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 17 zadań, w tym co najmniej 2 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 21 zadań, w tym co najmniej 4 z poziomu
ponadpodstawowego.
Plan testu.
Klucz odpowiedzi
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1. Zdefiniować roztwór.
A
P
b
2. Wskazać wynik efektu Tyndalla.
B
P
c
3.
Scharakteryzować pojęcie
hydrodynamika.
C
P
c
4. Rozróżnić typy kryształów.
B
P
d
5.
Rozróżnić kolor pigmentu- tlenek
chromu nieorganiczny nietoksyczny.
A
P
b
6. Wyjaśnić pojęcie roztwór nasycony.
B
P
c
7. Rozróżnić prawo zachowania masy.
B
P
a
8.
Zdefiniować sposób tworzenia
związku chemicznego.
A
P
b
9. Rozróżnić cechy atomu.
B
P
c
10. Zidentyfikować proces hydratacji.
A
P
a
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
11. Rozróżnić cechy roztworów.
B
P
b
12. Zdefiniować proces wrzenia.
A
P
c
13. Scharakteryzować emulsję.
A
P
d
14. Opisać pojęcie akumulatora.
A
P
d
15. Opisać liczby protonów.
B
P
c
16. Rozróżnić katodę i anodę w ogniwie.
B
P
a
17.
Scharakteryzować wartość liczby
Avogadra.
C
PP
6,02 * 10
23
18. Omówić cechy materii.
C
PP
materii
19.
Zidentyfikować tworzenie się
związków.
C
PP
chemiczne
20. Zidentyfikować mechanikę kwantową.
A
P
Mechanika
kwantowa
21. Opisać zjawisko elektroforezy.
A
P
Elektroforeza
22. Zdefiniować sole.
A
P
sole
23.
Rozróżniać obliczenia
stechiometryczne.
A
P
Obliczenia
stechiometryczne
24.
Wskazać twórcę prawa zachowania
masy.
A
P
Michaił
Łomonosow,
Lavoisier

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
Przebieg testowania
Instrukcja dla nauczyciela
1. Ustal z uczniami termin przeprowadzenia sprawdzianu z co najmniej jednotygodniowym
wyprzedzeniem.
2. Omów z uczniami cel stosowania pomiaru dydaktycznego.
3. Zapoznaj uczniów z rodzajem zadań podanych w zestawie oraz z zasadami punktowania.
4. Przeprowadź z uczniami próbę udzielania odpowiedzi na takie typy zadań testowych, jakie
będą w teście.
5. Omów z uczniami sposób udzielania odpowiedzi (karta odpowiedzi).
6. Zapewnij uczniom możliwość samodzielnej pracy.
7. Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi, podaj czas przeznaczony na
udzielanie odpowiedzi.
8. Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego (rozładuj niepokój, zachęć do sprawdzenia swoich możliwości).
9. Kilka minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia udzielania odpowiedzi.
10. Zbierz karty odpowiedzi oraz zestawy zadań testowych.
11. Sprawdź wyniki i wpisz do arkusza zbiorczego.
12. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
13. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
14. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem pytań testowych.
4. Test zawiera 20 pytań dotyczących posługiwania się podstawowymi pojęciami
fizykochemicznymi. Pytania: 1, 2, 3, 4, 5, 6 ,7, 8, 9, 10, 11, 12, 13, 14, 15, 16, są to
pytania wielokrotnego wyboru i tylko jedna odpowiedź jest prawidłowa; pytania: 17, 18
i 19 to pytania z luką do uzupełnienia. W pytaniach 20, 21, 22, 23 i 24 należy udzielić
krótkiej odpowiedzi.
5. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi:
−
w zadaniach wielokrotnego wyboru zaznacz prawidłową odpowiedź znakiem
X (w przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem, a następnie
ponownie zakreślić odpowiedź prawidłową),
−
w zadaniach do uzupełnienia wpisz brakujące wyrazy.
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas. Trudności mogą przysporzyć Ci
pytania: 17 - 19, gdyż są one na poziomie trudniejszym niż pozostałe.
8. Na rozwiązanie testu masz 90 min.
Powodzenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
ZESTAW ZADAŃ TESTOWYCH
1. Roztwór to:
a) mieszanina niejednorodna,
b) mieszania jednorodna,
c) mieszanina gazowa,
d) stop.
2. Efekt Tyndalla powoduje, że:
a) roztwór jest przezroczysty,
b) roztwór jest tęczowy,
c) roztwór jest nieprzezroczysty,
d) roztwór jest biały.
3. Hydrodynamika zajmuje się:
a) badaniami ciał stałych,
b) mechaniką kwantową,
c) badaniami cieczy,
d) mechaniką precyzyjną.
4. Diament jest przykładem kryształu:
a) molekularnego,
b) metalicznego,
c) jonowego,
d) kowalencyjnego.
5. Nieorganiczny nietoksyczny tlenek chromu to pigment:
a) biały,
b) zielony,
c) złoty,
d) szary.
6. Roztwór nasycony występuje wtedy, gdy:
a) rozpuszczona jest ilość substancji równa jej rozpuszczalności,
b) rozpuszczona jest ilość substancji równa jej rozpuszczalności w danej temperaturze,
c) rozpuszczona jest ilość substancji równa jej rozpuszczalności w danej temperaturze
i danym rozpuszczalniku,
d) rozpuszczona jest ilość substancji nierówna jej rozpuszczalności.
7. Prawo zachowania masy mówi, że:
a)
w każdej przemianie chemicznej masa substancji biorących udział w reakcji
chemicznej nie ulega zmianie, czyli jest równa masie produktów powstałych w wyniku
reakcji,
b)
w każdej przemianie chemicznej masa substancji biorących udział w reakcji
chemicznej ulega zmianie,
c)
w każdej przemianie chemicznej masa substancji biorących udział w reakcji
chemicznej może nieznacznie ulec zmianie,
d)
w każdej przemianie chemicznej masa substancji biorących udział w reakcji
chemicznej ulega zmniejszeniu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
8. Związek chemiczny powstaje poprzez:
a) zmieszanie pierwiastków,
b) reakcję chemiczną,
c) zmieszanie produktów,
d) zmieszanie substratów.
9. Które z poniższych zdań nie jest prawdziwe:
a) liczba elektronów = protonów w atomie,
b) atom jest elektrycznie obojętny,
c) atom nie jest elektrycznie obojętny,
d) prawie cała masa atomu skupiona jest w jądrze.
10. Hydratacją nazywamy proces solwatacji w:
a) wodzie,
b) oleju,
c) alkoholu,
d) benzynie.
11. Które z poniższych zdań jest prawdziwe
a) roztwór jest molekularnie jednorodny,
b) roztwór jest molekularnie niejednorodny,
c) układy dyspersyjne nie różnią się rozmiarem cząstek rozproszonych,
d) istnieją dwa rodzaje koloidów: koloidy cząsteczkowe i koloidy atomowe.
12. Proces parowania w całej objętości to:
a) resublimacja,
b) zamarzanie,
c) wrzenie,
d) sublimacja.
13. Układ dyspersyjny, w którym faza rozproszona to ciecz i faza rozpraszająca ciecz to:
a) zawiesina ,
b) mikstura,
c) nie ma takiego układu,
d) emulsja.
14. Akumulator jest urządzeniem wykorzystywanym do:
a) wytwarzania energii,
b) przetwarzania energii,
c) przemiany energii,
d) magazynowania energii.
15. Jeśli liczba atomowa wynosi 4 to liczba protonów wynosi:
a) 4-2,
b) 4-1,
c) 4,
d) 2.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
16. Katoda w ogniwie to:
a) biegun dodatni ,
b) biegun ujemny,
c) anoda ogniwa,
d) nie występuje.
17. Uzupełnij zdanie:
Współczynnik przeliczeniowy czyli liczba, której wartość wynosi ...............................,
została nazwana liczbą Avogadro.
18. Uzupełnij zdanie:
Podstawową cechą budowy ................................jest jej nieciągłość, czyli ziarnistość.
19. Uzupełnij zdanie:
Łączenie się pierwiastków w związki .............................. polega na łączeniu się różnych
atomów w większe zespoły zwane cząsteczkami.
20. Jak nazywa się dział nauki opisujący korpuskularno - falową naturę cząstek?
................................................
21. Jak nazywa się zjawisko elektrokinetyczne polegające na ruchu naładowanych cząstek fazy
rozproszonej w ośrodku rozpraszającym pod wpływem pola elektrycznego?
..................................................
22. Jak nazywa się związki o budowie jonowej zawierające w cząsteczce kation (kationy)
metalu Mey+ (lub grupę NH4+) i anion Ax- (aniony) reszty kwasowej?
................................
23. Jak nazywa się obliczenia ustalające ilości substratów niezbędnych do otrzymania
konkretnej ilości produktów?
..................................
24. Jak nazywa się twórca prawa zachowania masy?
.................................
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
47
KARTA ODPOWIEDZI
Imię i nazwisko ..........................................................................................
Posługiwanie się podstawowymi pojęciami fizykochemicznymi
Zakreśl poprawną odpowiedź, wpisz brakujące wyrazy
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
…………………………………………………………………
18.
………………………………………………………………….
19.
………………………………………………………………….
20.
……………………………
21.
……………………………
22.
……………………………
23.
……………………………
24.
……………………………
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
48
7. LITERATURA
1. Calus H.: Podstawy obliczeń chemicznych WNT, Warszawa 1978
2. Kabzińska K.: Chemia organiczna dla techników, WSiP, Warszawa 1990
3. Karpiński W.: Chemia fizyczna dla techników, WSiP, Warszawa 1998
4. Orzelowski S.(red), Praca zbiorowa. Powłoki malarsko lakiernicze. Poradnik. WNT,
Warszawa 1983
5. Pokrasen A. (red), Praca zbiorowa. Pokrycia ochronne i dekoracyjne. Poradnik. WNT,
Warszawa 1983
6. Wiłkomirski B., Chemia ogólna i nieorganiczna. Chemia organiczna, MAD Edukacja S.A.,
Kielce 2004
7. http://www.mlyniec.gda.pl/~chemia/tablice.htm
8. http://zdch.amu.edu.pl/pracownia/bhp.html
Wyszukiwarka
Podobne podstrony:
lakiernik 714[03] l1 02 u
lakiernik 714[03] l1 02 n
lakiernik 714[03] l1 04 n
lakiernik 714[03] l2 02 u
lakiernik 714[03] l1 04 u
lakiernik 714[03] l1 06 u
lakiernik 714[03] l1 01 u
lakiernik 714[03] z1 02 n
lakiernik 714[03] l2 02 n
lakiernik 714[03] l1 01 n
lakiernik 714[03] l1 03 u
lakiernik 714[03] l1 06 n
lakiernik 714[03] l1 03 n
lakiernik 714[03] l1 04 n
więcej podobnych podstron