
ZAŁO
ś
ENIE I CELE PRZEDMIOTU
• Umiej
ę
tno
ść
opisu wła
ś
ciwo
ś
ci stanów materii;
• Rozumienia podstawowych procesów chemicznych
maj
ą
cych znaczenie w budownictwie;
• Zaznajomienie si
ę
ze stosowanymi rozwi
ą
zaniami
in
ż
ynierii chemicznej w opracowaniu projektów
procesowych;
• Bezpiecznego stosowania materiałów budowlanych oraz
post
ę
powania z materiałami budowlanymi;
• Selekcji i utylizacji odpadów materiałowych w
budownictwie.

WYKŁADY -
Tre
ś
ci kształcenia:
1. Budowa i wła
ś
ciwo
ś
ci gazów, cieczy i ciał stałych. Struktury krystaliczne
i ich defekty. Siły spójno
ś
ci tworzyw jednorodnych i niejednorodnych.
2. Podstawy termodynamiki i kinetyki chemicznej. Stany równowagi
chemicznej.
3. Operacje jednostkowe z udziałem procesów fizykochemicznych.
•
Fizykochemia wody. Podstawy technologii chemicznej. Sposoby
uzdatniania wód naturalnych.
5. Układy koloidalne – otrzymywanie, wła
ś
ciwo
ś
ci, trwało
ść
. Podział
i zastosowania emulsji.
6. Zjawiska powierzchniowe – ich znaczenie w budownictwie.
7. Reakcje chemiczne ze szczególnym uwzgl
ę
dnieniem reakcji hydratacji
i hydrolizy. Chemia mineralnych materiałów budowlanych ze
szczególnym uwzgl
ę
dnieniem materiałów wi
ążą
cych.
8. Procesy korozji tworzyw cementowych.
9. Chemia tworzyw sztucznych i tworzyw bitumicznych.
10.Chemia metali. Chemiczne
ź
ródła energii elektrycznej. Procesy korozji.

LITERATURA PODSTAWOWA
1. Pauling L., Pauling P., Chemia, PWN, 1998.
2. Barycka I., Skudlarski K., Podstawy Chemii, Wydawnictwo Politechniki
Wrocławskiej, Wrocław, 1993.
3. Czarnecki L., Broniewski T., Henning O., Chemia w budownictwie,
Arkady, Warszawa 1996.
4. Dziadko D., i inni, Laboratorium Chemiczne – Materiały do
Ć
wicze
ń
,
Wydawnictwo Uczelniane Politechniki Lubelskiej, Lublin, 1998.
LITERATURA UZUPEŁNIAJ
Ą
CA
1. Czarnecki L., i inni,
Ć
wiczenia Laboratoryjne z Chemii Budowlanej,
Oficyna Wydawnicza Politechniki Warszawskiej, Warszawa, 2005.
2. Kowal A.,
Ś
widerska - Bró
ż
M.: Oczyszczanie wody, PWN, Warszawa-
Wrocław, 1997.

ZADANIA CHEMII BUDOWLANEJ
Zagadnienia chemiczne, na które napotyka in
ż
ynier
budowlany:
1. Budowa chemiczna jako wyznacznik wła
ś
ciwo
ś
ci
technicznych materiałów budowlanych.
2. Chemiczne metody oceny przydatno
ś
ci materiałów
budowlanych (np. badania chemiczne w normach
budowlanych).
3. Chemiczne uwarunkowania przydatno
ś
ci gruntów
budowlanych oraz chemiczne metody ich poprawy (np.
elektroosmoza, procesy sorpcyjne itp).

ZJAWISKA I PRZEMIANY NATURY CHEMICZNEJ
wyst
ę
puj
ą
podczas:
1. wytwarzania materiałów i elementów budowlanych oraz
utylizacji odpadów na cele budowlane.
2. stosowania materiałów budowlanych przy wznoszeniu
budowli i wykonywaniu robót wyko
ń
czeniowych (np.
procesy wi
ą
zania i twardnienia materiałów wi
ążą
cych),
3. u
ż
ytkowania obiektu (np. procesy korozji),
w sytuacjach awaryjnych (np. przebieg reakcji spalania
podczas po
ż
aru),
4. zagro
ż
enia i uci
ąż
liwo
ś
ci natury chemicznej w
odniesieniu do wykonawcy i u
ż
ytkownika materiałów
oraz obiektów budowlanych,
5. zagro
ż
enia
ś
rodowiska spowodowane przez przemysł
materiałów budowlanych.

Znamy ju
ż
:
• podstawowe reguły i zasady obowi
ą
zuj
ą
ce w
chemii
– s
ą
przydatne w procesie zdobywania
wiedzy o charakterze i wła
ś
ciwo
ś
ciach
pierwiastków poszczególnych grup.
• podstawowe zale
ż
no
ś
ci skutkowo-przyczynowe
- nale
ż
y zna
ć
i rozumie
ć
wła
ś
ciwo
ś
ci danego
pierwiastka, które wi
ążą
si
ę
:
- z budow
ą
jego atomów,
- formami cz
ą
steczkowymi.

Zapami
ę
taj,
ż
e:
zasady,
reguły,
podziały,
nawet niekiedy prawa,
to najcz
ęś
ciej uogólnienia typowych zachowa
ń
pierwiastków
i zwi
ą
zków w typowych sytuacjach, ( s
ą
wyj
ą
tki).
Podstawowe prawa chemii
dot. zwi
ą
zków chemicznych (Dalton):
1. Pierwiastek – te same atomy
2. Zwi
ą
zek chemiczny - ró
ż
ne atomy
Prawo stosunków stałych
Prawo stosunków wielokrotnych
Prawo zachowania masy (te
ż
energii).

Zapami
ę
taj te
ż
,
ż
e:
Istniej
ą
odst
ę
pstwa i wyj
ą
tki od wyuczonych prostych
regułek.
Wynikaj
ą
one z rzeczywistych i niezmiennych praw
przyrody.
Skala MIKRO
Wła
ś
ciwo
ś
ci substancji, zawieraj
ą
cej 1 – kilka elementów.
Skala MAKRO
Wła
ś
ciwo
ś
ci substancji, zawieraj
ą
cej wiele elementów
( np.10 ml wody)
Gdzie le
ż
y granica?

WYBRANE JEDNOSTKI SKALI ATOMOWEJ
(Skala mikro)
Masy atomów, j
ą
der atomowych i cz
ą
stek
elementarnych wyra
ż
a si
ę
powszechnie za pomoc
ą
:
Atomowej jednostki masy,
która jest równa
1/12 masy atomu nuklidu w
ę
gla
12
C.
Mi
ę
dzynarodowa Komisja Chemiczna IUPAC zaleca
symbol u.
atomowej jednostki masy u
wynosz
ą
cej około 1,661 • 10
-27
kg
Symbol „u" od unit (ang.) - jednostka.

Cz
ę
sto podaje si
ę
sam
ą
liczb
ę
, nazywaj
ą
c j
ą
WZGL
Ę
DN
Ą
MAS
Ą
ATOMOW
Ą
LUB CZ
Ą
STECZKOW
Ą
.
Na przykład:
(Na) = 23 oznacza,
ż
e masa atomu sodu jest 23 razy
wi
ę
ksza od atomowej jednostki masy u ( 1/12
masy atomowej
12
C).
Wzgl
ę
dna masa atomowa
12
C = 12

JEDNOSTKA ENERGII:
Elektronowolt (eV )
1 eV = 1,602 • 10
-19
J.
• Przemianom chemicznym jednego atomu
(cz
ą
steczki) towarzyszy wymiana z otoczeniem
energii około jednego elektronowolta.
• Przemianom j
ą
drowym towarzyszy pochłanianie lub
wydzielanie energii rz
ę
du megaelektronowoltów
(MeV).

JEDNOSTKA ŁADUNKU ELEKTRYCZNEGO
w skali atomowej jest ładunek elementarny, tzn.
ładunek jednego elektronu.
1 e =1,602.10
-19
C.
DŁUGO
ŚĆ
W SKALI ATOMOWEJ
wyra
ż
a si
ę
za pomoc
ą
podwielokrotnosci metra:
1 nm(nanometr) = 10
-9
m lub
1pm (pikometr)=10
-12
m.

Przypomnij sobie podstawowe definicje:
PIERWIASTEK CHEMICZNY
NUKLID
LICZBA MASOWA
LICZBA ATOMOWA
IZOTOP
MASA IZOTOPOWA
MASA ATOMOWA

MASA CZ
Ą
STECZKOWA
jest to masa cz
ą
steczki zwi
ą
zku lub
pierwiastka chemicznego wyra
ż
ona
w atomowych jednostkach masy.
•
Masa cz
ą
steczkowa = suma mas atomowych
wszystkich atomów wchodz
ą
cych w skład
cz
ą
steczki.
• Masa cz
ą
steczkowa, podobnie jak masa izotopowa i
masa atomowa, jest zwykle zapisywana jako wielko
ść
bezwymiarowa (wzgl
ę
dna).

LICZNO
ŚĆ
SUBSTANCJI
tzn. liczba okre
ś
lonych elementów w okre
ś
lonej
masie substancji, jednostk
ą
jest
mol.
"amount of
substance", jako "liczno
ść
materii" .
Jeden mol zawiera 6,02·10
23
elementów
( atomów, cz
ą
steczek, fotonów).
MOL
jest to liczba cz
ą
stek równa liczbie atomów zawartych w
12 g (dokładnie) nuklidu w
ę
gla
12
C.
Liczba cz
ą
stek zawartych w jednym molu jest nazywana
liczb
ą
Avogadra;
wynosi ona 6,0221367·10
23
± 3,6 ·10
17
.

MASA MOLOWA SUBSTANCJI
jest to stosunek masy substancji do jej
liczno
ś
ci; jest to masa jednego mola substancji.
Masa jednego mola ka
ż
dej substancji, jest liczbowo
równa masie atomowej (cz
ą
steczkowej) substancji.
Podobnie jak masa 1 mola w
ę
gla, wyra
ż
ona w
gramach (masa molowa) = 12g ( 12 g/mol ).

Przykład: 1
Oblicz mas
ę
cz
ą
steczkow
ą
i molow
ą
w
ę
glanu wapnia,
podstawowego składnika wapieni. Ile wynosi masa 10 moli
tego zwi
ą
zku?
Rozwi
ą
zanie:
1. Wzór w
ę
glanu wapnia - CaCO
3
2. Masa cz
ą
st. wzgl
ę
dna = 40 + 12 + 3 x 16 = 100
Masa cz
ą
st. w u = 100 u
Masa molowa = 100 g/ mol
Masa 10 moli = 10 x 100g/m = 1000g = 1, 000kg

Podobnie mo
ż
na przelicza
ć
wielko
ść
energii i ładunku
elektrycznego ze skali atomowej na molow
ą
:
1,602 •10
-19
C • 6,02 • 10
23
mol
-1
= 96 440 C • mol
-1
ładunek 1 elektronu
•
liczba Avogadra = stała Faradaya
Stała Faradaya to ładunek jednego mola elektronów.

BUDOWA MATERII
Cz
ą
stki elementarne
Cz
ą
stki elementarne s
ą
najprostszymi dotychczas
poznanymi do
ś
wiadczalnie cegiełkami budowy
materii.
Obecnie jest znanych ponad 200 takich cz
ą
stek,

Cz
ą
stki elementarne -
cztery grupy:
fotony, leptony, mezony i bariony
(składaj
ą
si
ę
z kwarków).
Obecnie
za
cz
ą
stk
ę
elementarn
ą
uwa
ż
a si
ę
cz
ą
stk
ę
, w której
nie mo
ż
na wyró
ż
ni
ć ż
adnej struktury, pomimo,
ż
e jest
ona w stanie rozpa
ść
si
ę
na inne – bardziej
elementarne.
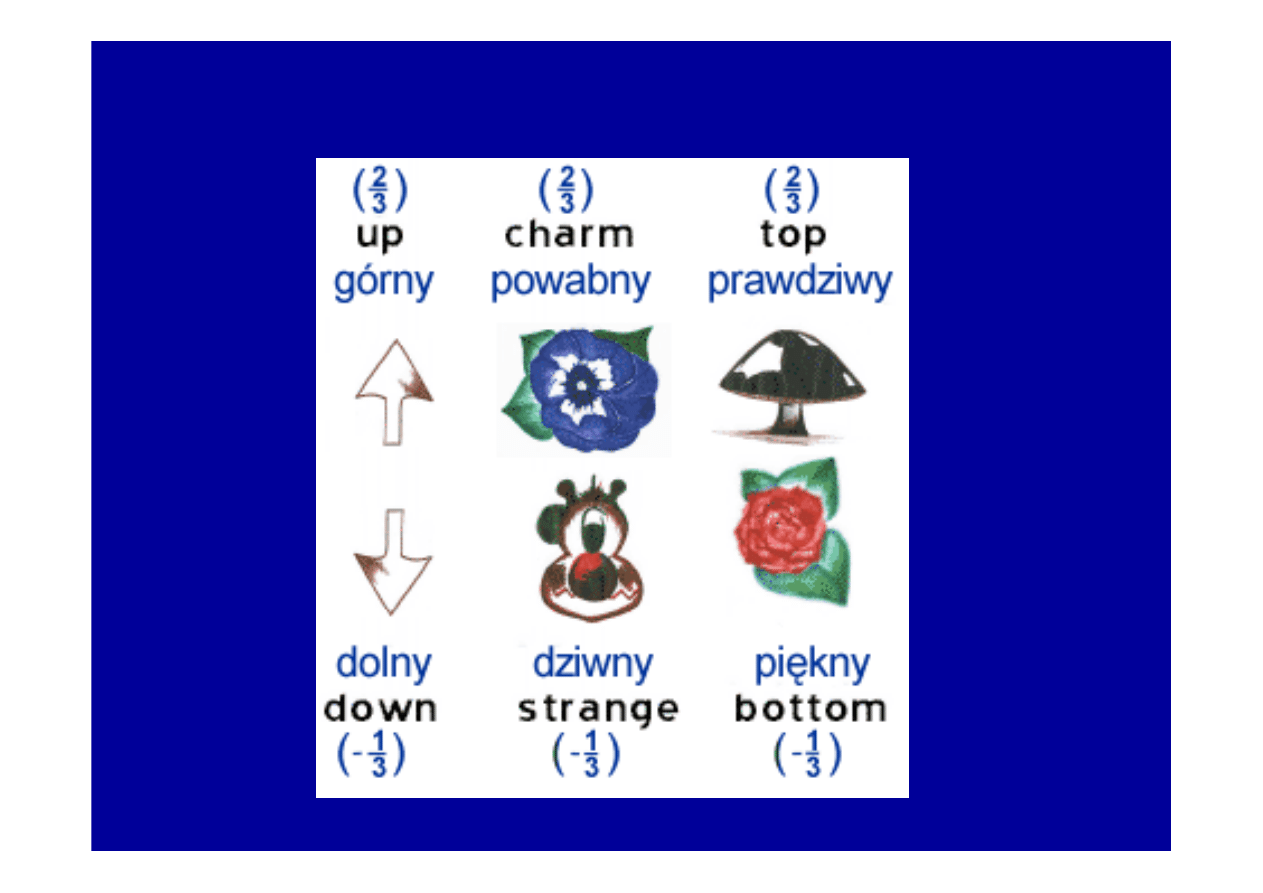
RODZAJE KWARKÓW

NAJNOWSZE TEORIE BUDOWY MATERII
1. Model standardowy , kwarkowy
2. Teoria strun
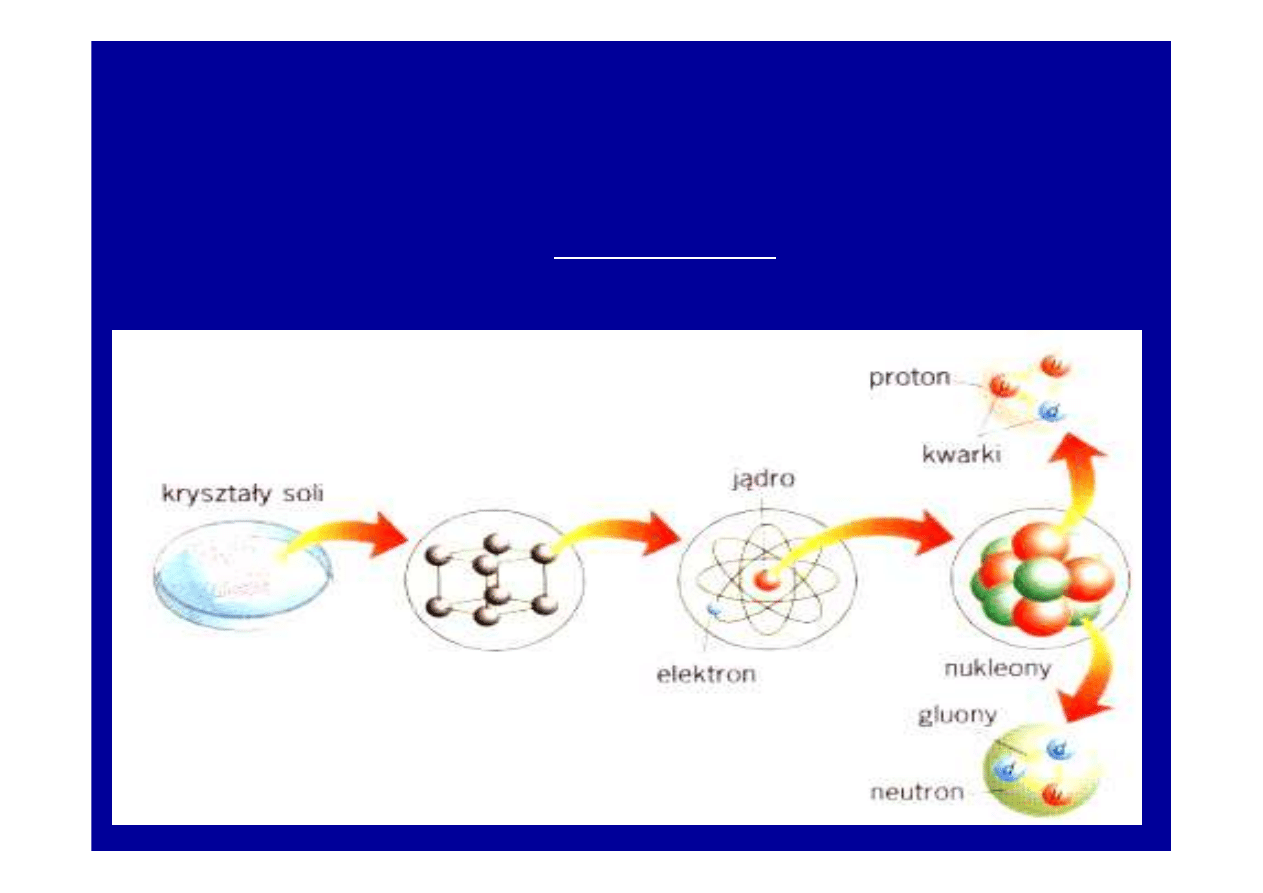
Model Standardowy
- kwarki ł
ą
cz
ą
si
ę
w taki sposób,
ż
e
wypadkowy ładunek powstałej cz
ą
stki jest całkowit
ą
krotno
ś
ci
ą
ładunku elementarnego.
Za koncepcj
ę
istnienia kwarków M.Gell i G.Zweig otrzymali w 1969 roku
nagrod
ę
Nobla.
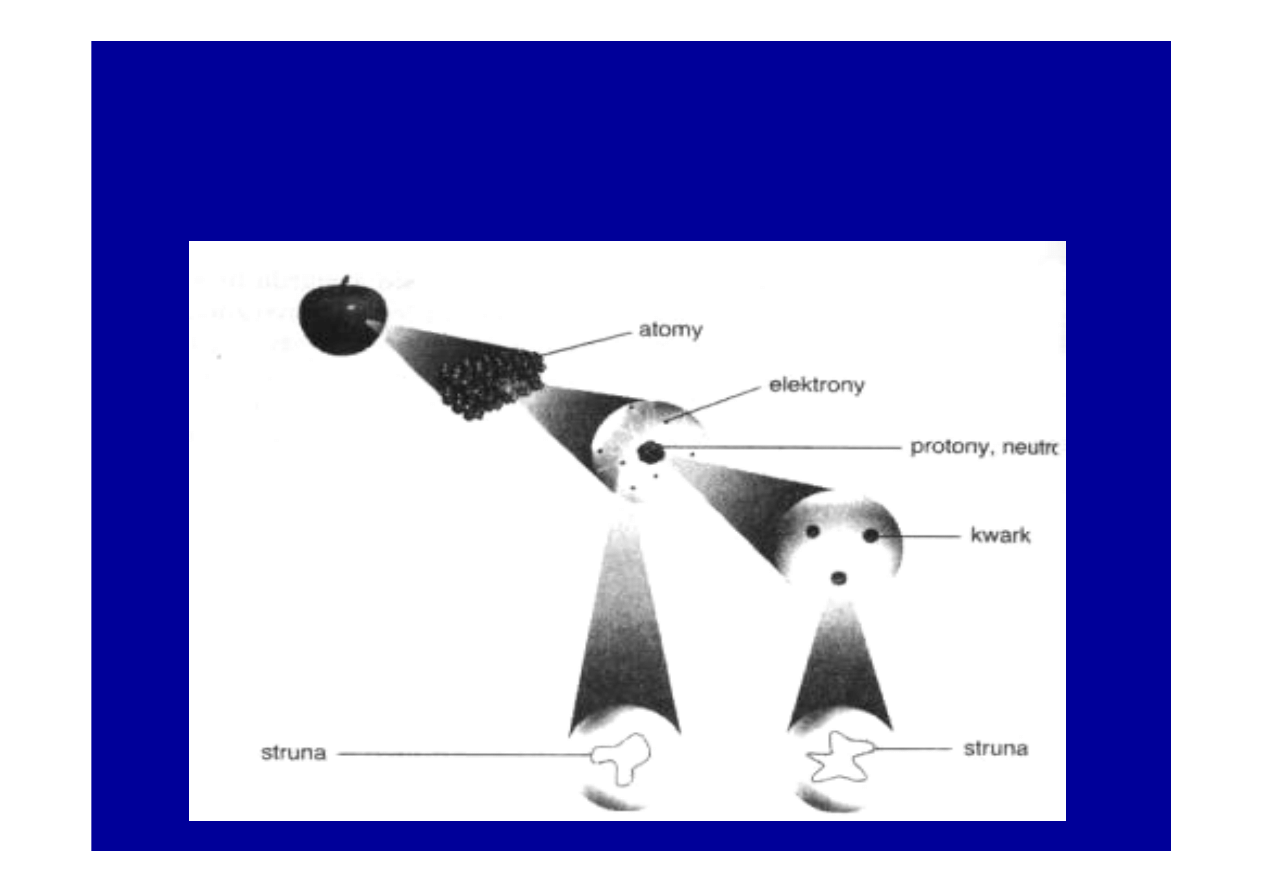
Według nowej
teorii superstrun
( 80-te lata), ka
ż
da cz
ą
stka
fundamentalna jest przejawem innego rodzaju drga
ń
superstruny.

Istotne znaczenie dla chemicznych wła
ś
ciwo
ś
ci materii
maj
ą
cz
ą
stki, które wchodz
ą
trwale w skład atomu:
tj.
nukleony (neutrony i protony)
oraz
elektrony
.
Proton,
oznaczony symbolem p, ma dodatni jednostkowy
ładunek elektryczny, mas
ę
około jedno
ś
ci (1,0073 u).
Neutron,
oznaczony symbolem n, ma mas
ę
około jedno
ś
ci
(1,0087 u).
Elektron,
oznaczony symbolem e, ma ujemny ładunek
jednostkowy, mas
ę
ok. 5.10
-4
u .

ELEKTRONOWA STRUKTURA
ATOMÓW
J
ą
dro atomowe
J
ą
dro atomowe skupia prawie cał
ą
mas
ę
atomu,
zajmuj
ą
c bardzo mał
ą
obj
ę
to
ść
.
Materia j
ą
dra składa si
ę
z
nukleonów
(protonów i
neutronów).
Rol
ę
wi
ążą
c
ą
w jadrze odgrywaj
ą
mezony
Π
,
wymieniane mi
ę
dzy protonami a neutronami,
tworz
ą
ce w przestrzeni j
ą
drowej pole mezonowe.

Energia wi
ą
zania j
ą
dra
- miara jego trwało
ś
ci.
W trakcie hipotetycznej syntezy j
ą
dra z protonów i
neutronów nast
ę
puje defekt (ubytek) masy, który jest
miar
ą
energii wi
ą
zania.

Elektronowa struktura atomów
Elektrony
• posiadaj
ą
wła
ś
ciwo
ś
ci korpuskularne, jak i falowe,
• energia wi
ą
zania z pozostał
ą
cz
ęś
ci
ą
atomu to parametr
opisuj
ą
cy elektron w atomie (energia elektronu),
• liczba elektronów w ka
ż
dym atomie jest równa liczbie
protonów w j
ą
drze tego atomu.
• struktura elektronowa atomu, to sposób rozmieszczenia
elektronów w atomie zgodnie z regułami, które rz
ą
dz
ą
tym
rozmieszczeniem.

• Ka
ż
dy stan elektronu w atomie to zasób pewnej energii.
• Dodatkowa energia powoduje
wzbudzenie atomu
i
przeniesienie elektronu na wy
ż
szy poziom energetyczny.
• Je
ż
eli dostarczona energia jest wystarczaj
ą
co du
ż
a, to
elektron zostanie odsuni
ę
ty poza sfer
ę
przyci
ą
gaj
ą
cego
działania jadra i nast
ą
pi
jonizacja atomu.
• Z wy
ż
szego poziomu elektron samorzutnie wraca do stanu
pierwotnego,
emituj
ą
c jednocze
ś
nie promieniowanie
elektromagnetyczne o odpowiedniej długo
ś
ci fali.

Zachowanie elektronów w atomach zostało
opisane równaniami ruchu falowego.
• Rozwi
ą
zania tych równa
ń
istniej
ą
tylko dla pewnych
okre
ś
lonych warto
ś
ci, tak zwanych
liczb kwantowych.
• Liczby te wyst
ę
puj
ą
w równaniach opisuj
ą
cych stan
elektronu w atomie.

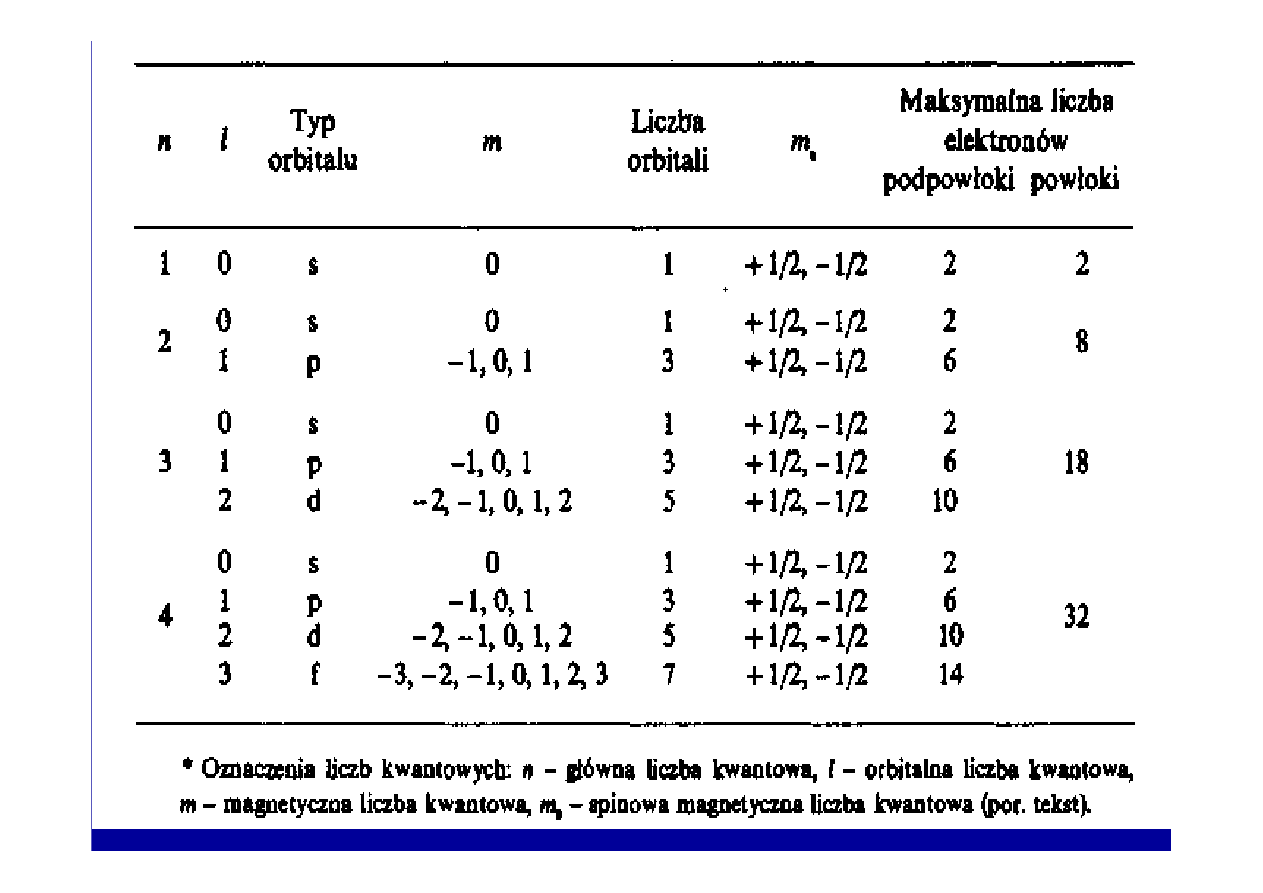
Liczby kwantowe
• Główna liczba kwantowa n kwantuje energi
ę
.
• Główn
ą
liczb
ę
kwantow
ą
okre
ś
la si
ę
symbolem cyfrowym
lub literowym:
warto
ść
liczby n
1 2 3 4 5 6 7
symbol literowy powłoki K L M N O P Q

Orbitalna (poboczna) liczba kwantowa l
•
kwantuje moment p
ę
du elektronu,
• przyjmuje warto
ś
ci od 0 do n-1.
Orbitalne liczby kwantowe o ró
ż
nych warto
ś
ciach l oznaczamy
symbolami literowymi:
warto
ść
liczby
0 1 2 3 4
symbol literowy podpowłoki s p d f g

Elektrony o tej samej głównej i orbitalnej liczbie kwantowej
nale
żą
do tej samej podpowłoki,
czyli do orbitali typu s czy typu p.
Orbitalem
nazywamy funkcj
ę
falow
ą
(
Ψ
) opisuj
ą
c
ą
stan elektronu w atomie.
Posługuj
ą
c si
ę
funkcj
ą Ψ
2
mo
ż
na sporz
ą
dzi
ć
rysunki
przedstawiaj
ą
ce rozmieszczenie elektronów w atomach.

Magnetyczna liczba kwantowa
m
• kwantuje warto
ść
rzutu momentu p
ę
du na kierunek pola
magnetycznego.
• dla danej orbitalnej liczby kwantowej l, magnetyczna liczba
kwantowa m mo
ż
e przyjmowa
ć
warto
ś
ci od –l poprzez 0 do +l,
czyli 2l+1 warto
ś
ci.

Spinowa magnetyczna liczba kwantowa m
s
• nieznaczne ró
ż
nice stanu tych elektronów wynikaj
ą
z ich
ruchu obrotowego wokół osi,
• ruch ten mo
ż
e mie
ć
dwa ró
ż
ne kierunki oznaczone jako
+1/2 i -1/2.
• ka
ż
demu orbitalowi mog
ą
odpowiada
ć
dwa elektrony o
trzech wspólnych liczbach kwantowych n, l, i m ró
ż
ni
ą
ce si
ę
spinem.

Zapis elektronowej struktury atomu
Opis struktury elektronowej atomu zawiera informacj
ę
:
•
o liczbie elektronów ( w elektrycznie oboj
ę
tnym atomie jest
jednoznaczne z rodzajem pierwiastka),
• o sposobie ich rozmieszczenia na powłokach i orbitalach,
•
zakaz Pauliego
pozwala przypisa
ć
ka
ż
demu elektronowi
w atomie zespół czterech liczb kwantowych, okre
ś
laj
ą
cych
jednoznacznie stan energetyczny tego atomu,
•
wszystkie elektrony w nie wzbudzonym atomie lokalizuj
ą
si
ę
na mo
ż
liwie najni
ż
szych poziomach energetycznych,
• zgodnie z
reguł
ą
Hunda,
w obr
ę
bie jednej powłoki s
ą
obsadzane kolejno podpowłoki s, p, d, f.
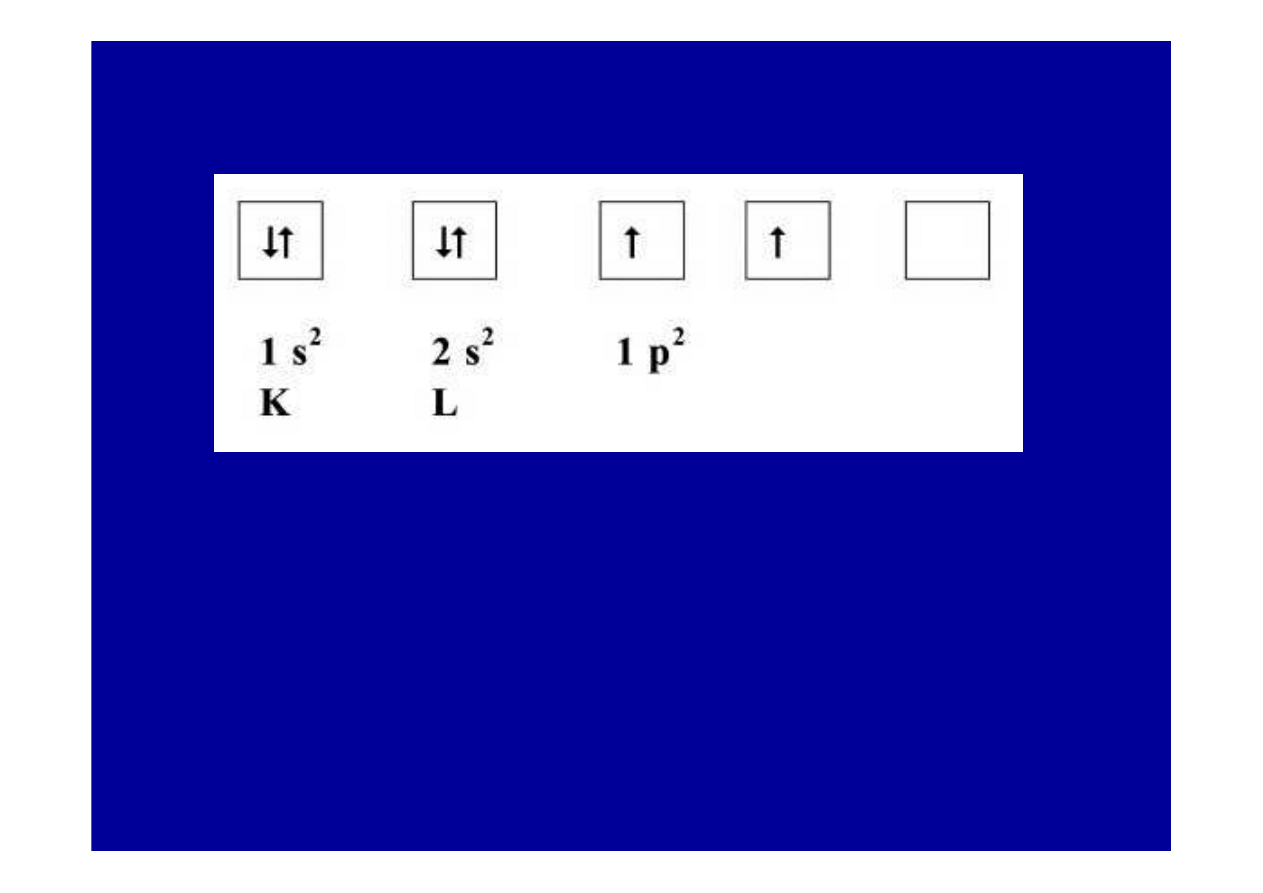
Zapis struktury elektronowej atomu w
ę
gla
6
C mo
ż
na te
ż
przedstawi
ć
graficznie:
• Ka
ż
da klatka przedstawia orbital dost
ę
pny dla dwóch
elektronów.
• Strzałki oznaczaj
ą
elektrony, przeciwne zwroty strzałek
oznaczaj
ą
przeciwne spiny elektronów orbitalu (Zakaz Pauliego).
• Zgodnie z reguł
ą
Hunda dwa elektrony typu p obsadzaj
ą
dwa
kolejne orbitale podpowłoki p.

UKŁAD OKRESOWY PIERWIASTKÓW
•
Uporz
ą
dkowanie pierwiastków według wzrastaj
ą
cej liczby
atomowej doprowadziło do utworzenia
układu okresowego
pierwiastków
(D.J. Mendelejew).
• Pierwiastki o podobnych wła
ś
ciwo
ś
ciach s
ą
umieszczone
jeden pod drugim w kolumnach (grupy główne i podgrupy),
• Pierwiastki o stopniowo zmieniaj
ą
cych si
ę
cechach od
metalicznych do niemetalicznych uporz
ą
dkowano w
poziomych szeregach (okresach).
• Numer okresu odpowiada liczbie powłok elektronowych w
atomach danych pierwiastków.
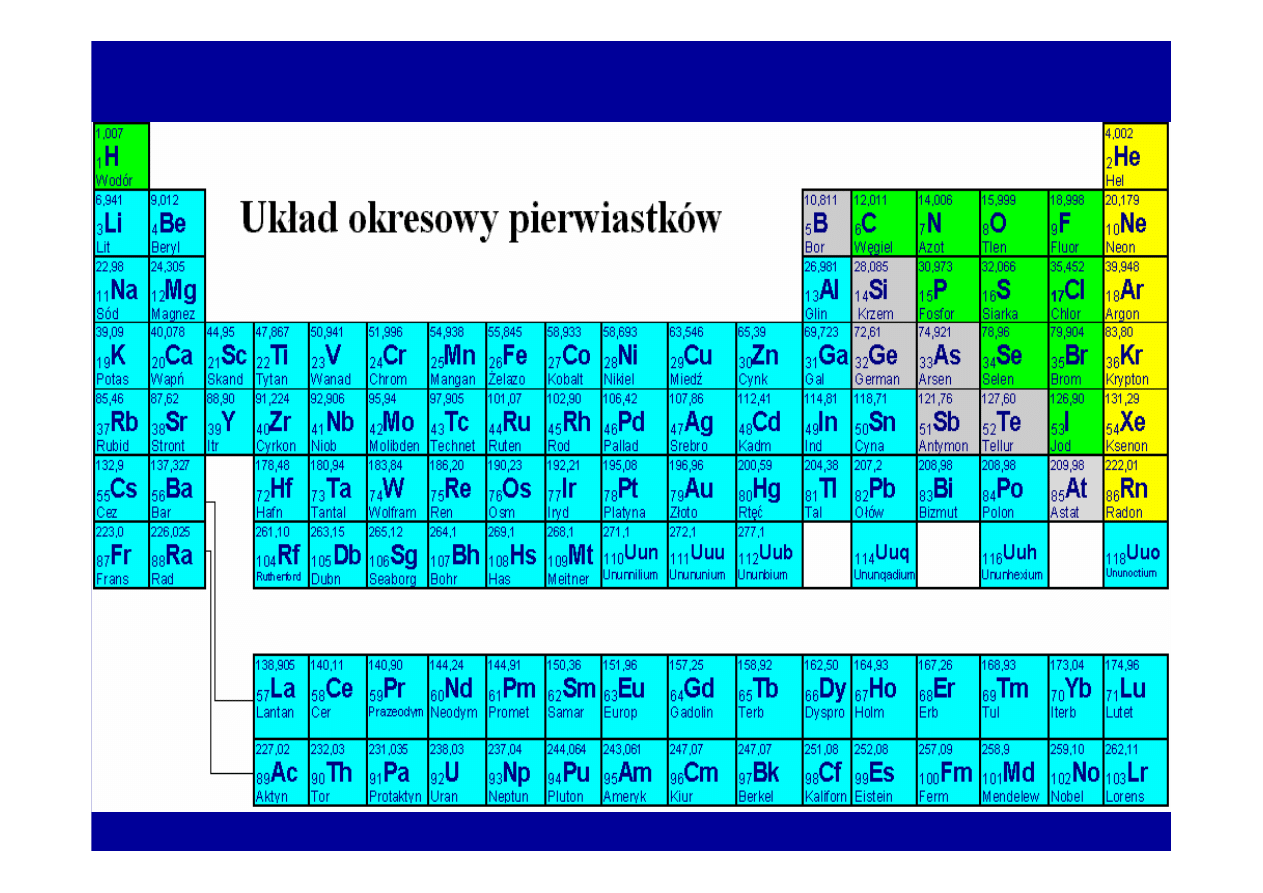

Zasada uporz
ą
dkowania pierwiastków w
układzie okresowym
• Wła
ś
ciwo
ś
ci chemiczne pierwiastka s
ą
jednoznacznie
zdefiniowane przez jego struktur
ę
elektronow
ą
.
• Pierwiastki o takiej samej budowie powłok walencyjnych
maj
ą
podobne wła
ś
ciwo
ś
ci.
• W układzie okresowym pierwiastki s
ą
uło
ż
one według
wzrastaj
ą
cej liczby protonów, któr
ą
nazywamy liczb
ą
atomow
ą
lub liczb
ą
porz
ą
dkow
ą
.

OKRESOWO
ŚĆ
WŁA
Ś
CIWO
Ś
CI PIERWIASTKÓW
Wła
ś
ciwo
ś
ci pierwiastków wynikaj
ą
ze struktury
elektronowej atomów i podlegaj
ą
prawidłom
okresowo
ś
ci.
Dotyczy:
Wła
ś
ciwo
ś
ci atomowych:
energia jonizacji, powinowactwo elektronowe,
elektroujemno
ść
, wymiary atomów i jonów.
Wła
ś
ciwo
ś
ci zespołowych:
stan skupienia, g
ę
sto
ść
, barwa, wła
ś
ciwa pojemno
ść
cieplna itp.
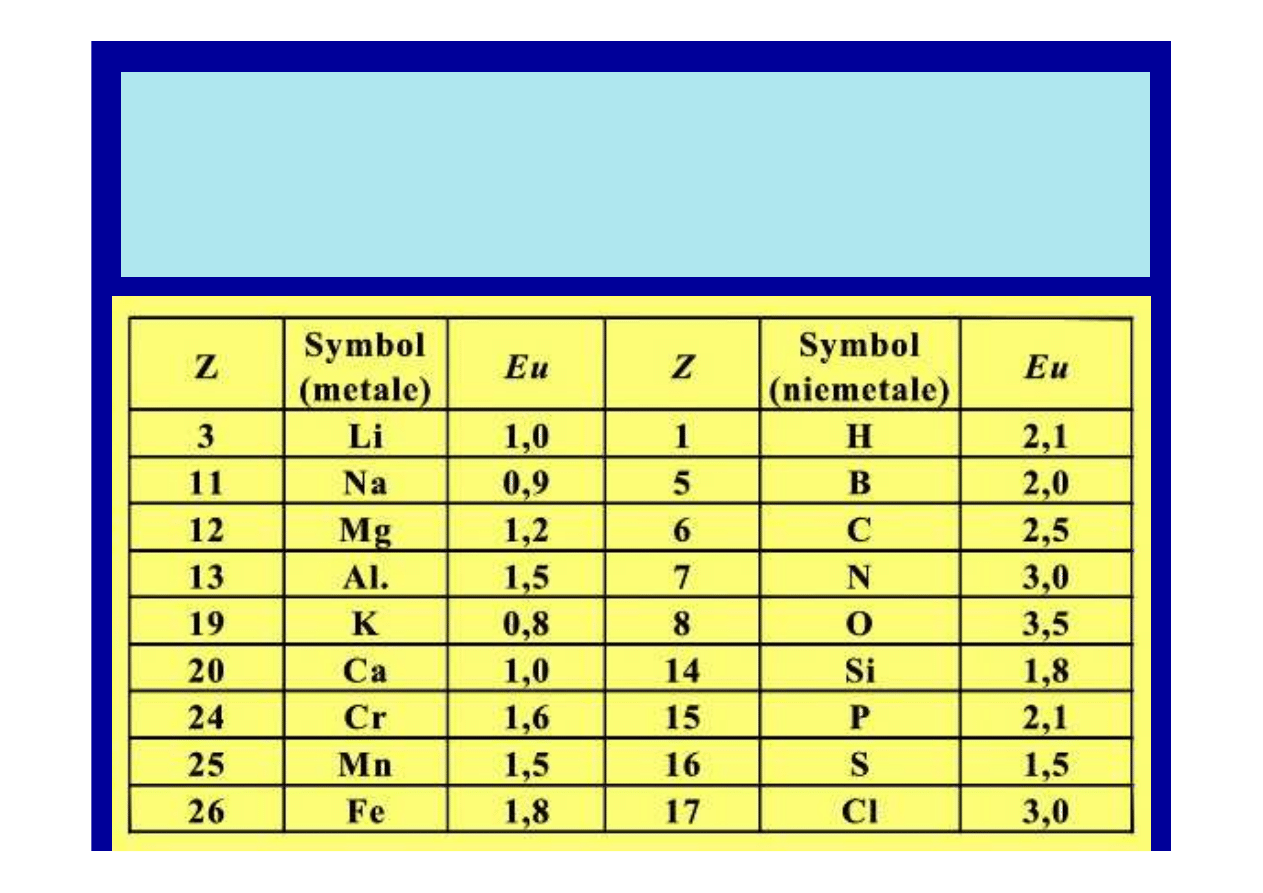
Elektroujemno
ść
Eu wybranych pierwiastków
wyst
ę
puj
ą
cych w materiałach budowlanych
(wg skali Paulinga)
Elektroujemno
ść
jest umown
ą
miar
ą
skłonno
ś
ci atomu do przyci
ą
gania
elektronów podczas tworzenia wi
ą
zania chemicznego.

Okresowo
ść
warto
ś
ciowo
ś
ci
Warto
ś
ciowo
ść
jest to liczba oddawanych lub
przyjmowanych elektronów w procesie tworzenia
wi
ą
zania chemicznego.
Oddawanie elektronów jest jednoznaczne z warto
ś
ciowo
ś
ci
ą
dodatni
ą
– atom staje si
ę
kationem
.
Przyjmowanie elektronów w celu uzupełnienia oktetu powoduje
nadmiarowy ładunek ujemny – powstaje ujemny jon
anion
.
Maksymalna dodatnia warto
ś
ciowo
ść
pierwiastka jest na ogół
równa ostatniej cyfrze numeru grupy

STOPIE
Ń
UTLENIENIA
- liczba elektronów, które dany atom przekazał lub
przyj
ą
ł od innego atomu w ramach tworzenia z nim
wi
ą
zania chemicznego.
- mo
ż
e tu oznacza
ć
zarówno pełne przekazanie
elektronu innemu atomowi (lub ich grupie), co prowadzi
do powstawania wi
ą
zania jonowego
-lub tylko cz
ęś
ciowe przekazanie elektronów w formie
wi
ą
zania kowalencyjnego.

Przykład :
Oblicz stopie
ń
utlenienia siarki w kwasie siarkowym
H
2
SO
4
, wiedz
ą
c ,
ż
e stopie
ń
utlenienia wodoru wynosi
+1,
a tlenu -2.
Rozwi
ą
zanie:
1. Wzór kwasu siarkowego H
2
SO
4
,
( cz
ą
steczka zwi
ą
zku chemicznego oboj
ę
tna).
1. Bilans ładunków: 0 = 2
·
(+1) + x + 4
·
( -2)
x = 8 - 2 = 6
Jest to kwas siarkowy (VI).

Zadanie 1
Napisz wzory tlenków pierwiastków a) I i II grupy oraz
b) VI i VII grupy.
Napisz reakcje tych tlenków z wod
ą
.
Napisz reakcje produktów a) z b).
Zadanie 2.
Oblicz masy molowe nast
ę
puj
ą
cych zwi
ą
zków: w
ę
glanu
magnezu, wodorow
ę
glanu wapnia, kwasu siarkowego i
zasady sodowej.
Wyszukiwarka
Podobne podstrony:
chemia, WYKL
Dlaczego chemia wykł wstepny 1
Chemia (10) doc
EMILIA Chemia analityczna doc
TRENDY W INFORMATYCE, WYKL DOC
CHEMIA IV DOC
WYDAJNOŚĆ DŹWIGNIC ostatni wykl doc
chemia pytania doc 0
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Doc 12, Studia, Chemia, chemia7
2015 pyt tren do wykł VII, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, ch
Wykład 5. Elektronowa struktura atomu, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
WYKLAD13.DOC, Chemia i technologia nitrowych pochodnych chlorobenzenu. 2,4-chlorodinitrobenzen, trin
kol wykl II zad, Chemia ogólna i nieorganiczna, giełdy
Chemia organiczna podstawy wykl Nieznany
2015 pytania tren do wykł VI, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna,
pyt tren wykł III 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chem
Chemia org wykl Tow stac 2013 2014, Studia, I o, rok II, semestr III, chemia organiczna [egz]
więcej podobnych podstron