
Katarzyna Bergmann
Collegium Medicum UMK w Bydgoszczy
Katedra i Zakład Diagnostyki Laboratoryjnej
Materiały biologiczne stosowane
w diagnostyce laboratoryjnej

Materiały biologiczny stosowane w badaniach
• Materiał biologiczny – każda próbka pochodząca
od żywego organizmu (człowieka), pozwalająca
określić aktualny stan zdrowia, obecność lub brak
choroby/zaburzeń, na podstawie jej właściwości
fizycznych i biochemicznych.
• Rodzaje materiałów:
- krew i pochodne
- bioptaty
- szpik kostny
-
komórki
- wydaliny
- fragmenty tkanek
- wydzieliny
- wymazy
-
płyn mózgowo-rdzeniowy
- zeskrobiny
-
płyny z jam ciała
-
popłuczyny
- dializaty
-
materiał genetyczny

Krew
• Krew – płyn ustrojowy, płynna tkanka łączna
krążąca w naczyniach krwionośnych. Składa
się w ok. 44% ze składników komórkowych
(krwinek) i w ok. 55% z osocza
• Rodzaje krwi:
-
krew tętnicza – krąży w tętnicach,
utlenowana, jasnoczerwona, płynie szybko
-
krew żylna – krąży w żyłach, odtlenowana,
ciemnoczerwona, płynie wolniej
-
krew włośniczkowa – pochodzi z drobnych
naczyń włosowatych (kapilarnych)

Krew żylna i materiały pochodne
•
Uzyskuje się z niej 3 rodzaje materiałów do
badań:
1.
krew żylną pełną = krwinki + osocze
2. osocze
– część płynna krwi, powstaje po
odwirowaniu elementów morfotycznych
3.
surowicę – osocze pozbawione
fibrynogenu i czynników krzepnięcia, w jej
skład wchodzą natomiast rozpuszczalnej
produkty konwersji fibrynogenu w fibrynę
oraz składniki uwalniane z płytek krwi,
powstaje po odwirowaniu wykrzepionej krwi

Osocze a surowica
OSOCZE
SUROWICA
- niewykrzepiona część
płynna krwi
- powstaje po wykrzepieniu
krwi
- zawiera fibrynogen i
czynniki krzepnięcia
- nie zawiera fibrynogenu i
czynników krzepnięcia
- wymaga zastosowania
antykoagulantów
- nie wymaga zastosowania
antykoagulantów
OSOCZE I SUROWICA RÓŻNIĄ SIĘ (CHOCIAŻ
CZASAMI NIEZNACZNIE) ZAWARTOŚCIĄ
POSZCZEGÓLNYCH SUBSTANCJI

Standardy pobierania krwi żylnej
• Krew pobierana jest zwykle na czczo, w godz. 7.00-9.00
• Probówki muszą być dobrane pod względem pojemności,
ilości badań oraz ich rodzaju (zwłaszcza odpowiedniego
antykoagulantu!)
• Przed pobraniem umyć i zdezynfekować ręce, założyć
jednorazowe rękawiczki
• Wyszukać odpowiednią żyłę – można użyć opaski uciskowej
(stazy), ale należy ją zwolnić po dokonaniu wyboru miejsca
wkłucia
• Oczyścić i zdezynfekować miejsce wkłucia
• Zacisnąć stazę 7-10 cm powyżej miejsca wkłucia, pacjent
powinien zacisnąć pięść w celu ułatwienia napływu krwi
• Wkłuć się pod kątem ostrym w żyłę i pobrać krew
• Zwolnić opaskę uciskową
• Usunąć igłę, a miejsce wkłucia ucisnąć jałowym gazikiem (ok.
4-5 min)
• Wyrzucić igłę oraz rękawiczki do specjalnego pojemnika na
odpady skażone, umyć i zdezynfekować ręce

Krew tętnicza
• pobierana jest przez lekarza!
• gł. z tętnicy promieniowej, udowej, grzbietowej stopy
• stosowana do badania gazometrycznego
• Standardy pobierania:
-
pacjent pozostaje w wygodnej pozycji (siedzącej lub leżącej)
-
miejsce pobierania podparte wałkiem/poduszką
-
wyczucie tętnicy palcami (pomiar tętna)
-
odkażenie miejsce wkłucia, czasem znieczulenie
-
podtrzymanie miejsca wkłucia 2 palcami, wkłucie pod kątem
45 lub 90
º
-
pobranie krwi do odpowiednich probówek/strzykawek - należy
zwrócić uwagę, by nie dostały się pęcherzyki powietrza!
-
zabezpieczenie korkiem przed dostępem powietrza
-
ucisnąć tętnicę do momentu ustania krwawienia (>10-15 min)
-
zabezpieczyć miejsce wkłucia opatrunkiem
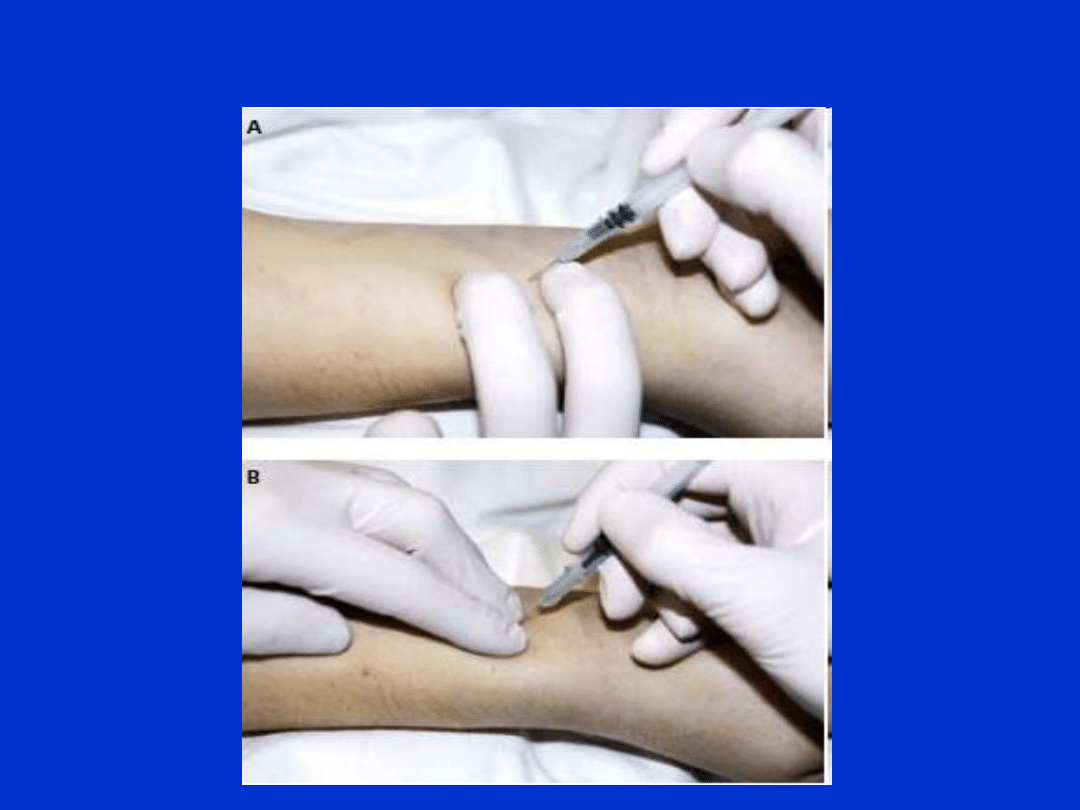
Krew tętnicza - pobieranie

Krew włośniczkowa
• pobierana z opuszki palca, płatka ucha
• u noworodków, niemowląt – z pięty
• stosowana do badań: gazometrii, glukozy, MetHb,
HbCO, wrodzonych zaburzeń metabolicznych
• Standardy pobierania:
-
ogrzać miejsce nakłucia (masaż, ciepła woda)
-
odkazić miejsce pobrania
-
nakłuć miejsce pobrania za pomocą igły lub
skalpela (2-5 mm)
-
usunąć 1-2 pierwsze krople krwi
-
pobrać swobodnie wypływającą (NIE
WYCISKAĆ!) krew do kapilar lub mikroprobówek
-
ucisnąć miejsce nakłucia jałowym gazikiem
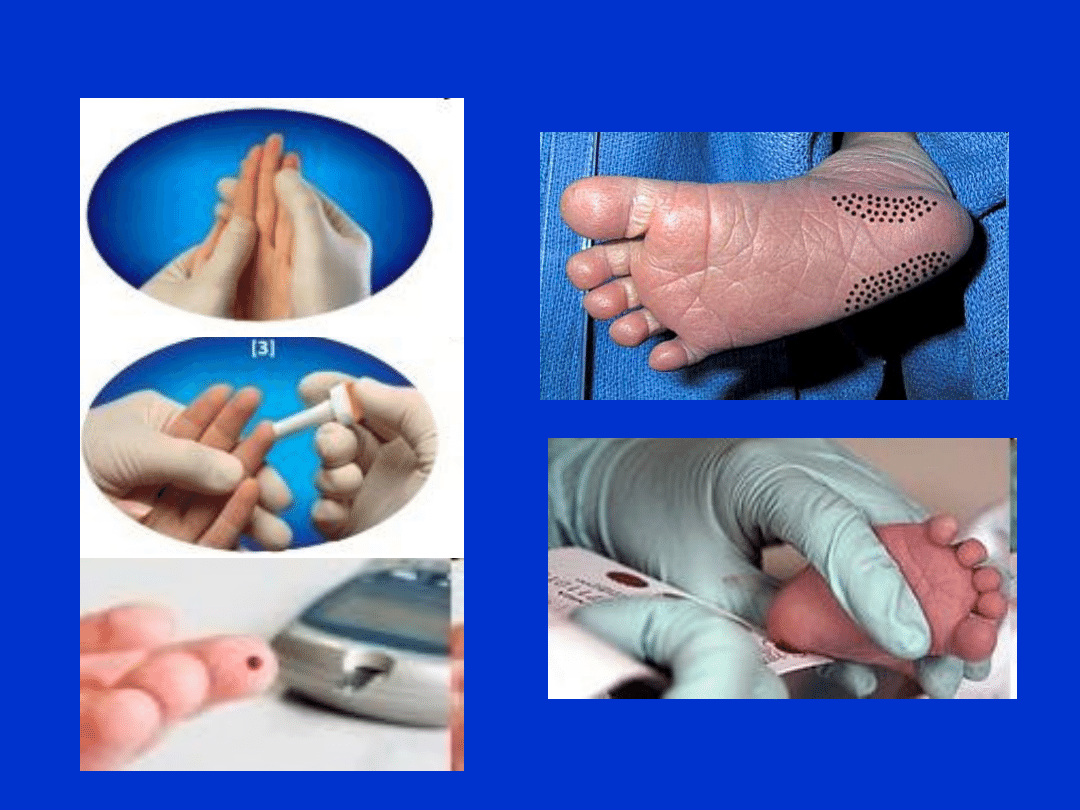
Krew włośniczkowa - pobranie

ANTYKOAGULANTY
• Substancje hamujące proces krzepnięcia krwi
• Pozwalają utrzymać krew w stanie płynnym oraz uzyskać
osocze
• Antykoagulant dobiera się w zależności od rodzaju badania i
specyfiki wykonywanych oznaczeń
AKTYWATORY KRZEPNIĘCIA
• substancje przyspieszające wykrzepianie krwi (np. trombina):
30 min → 5-10 min
• stosowane do pozyskiwania surowicy
• Antykoagulanty i aktywatory krzepnięcia mogą występować
w postaci:
- sproszkowanej
-
płynnej
-
rozpylonej na powierzchni wewnętrznej probówek

Rodzaje dodatków do probówek
-
system zamknięty Vacutainer firmy Becton Dickinson
Kolor korka
Substancja
Zastosowanie w badaniach
czerwony
brak dodatku lub aktywator
krzepnięcia (np. trombina)
surowica: biochemia,
immunochemia, białka
fioletowy
wersenian di- i tripotasowy
(EDTA-K
2
i EDTA-K
3
)
-
krew pełna: morfologia,
cyklosporyna, HbA1c
- osocze: ACTH, BNP
czarny
cytrynian sodu 3,8%
krew pełna: pomiar OB
niebieski
cytrynian sodu 3,2%
osocze: układ krzepnięcia
szary
fluorek sodu (inhibitor glikolizy)
+ EDTA lub szczawiany
osocze
– pomiar glukozy (na
czczo, DTTG, krzywe
cukrowe)
różowy
aprotynina (inhibitor proteaz
serynowych) + EDTA
-
krew pełna: cyklosporyna,
tacrolimus
- osocze: ACTH, BNP
zielony
heparyna litowa lub sodowa
osocze
– biochemia
*krew pełna – gazometria
(strzykawki, kapilary)

Rodzaje probówek
• Standardowe 1-2 ml – 9 ml
• Pediatryczne 200 µl – 1 ml
• Specjalne – np. mikropróbówki i
probówko-strzykawki do gazometrii
• Transportowe
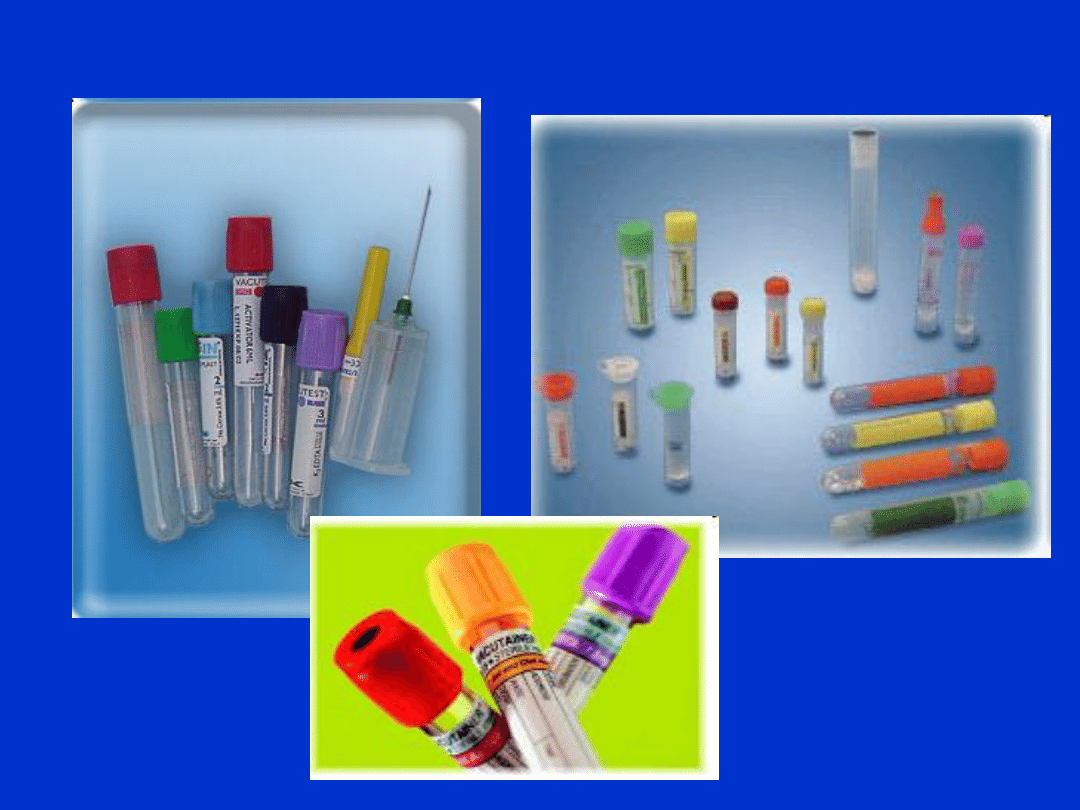
Probówki do badań

• Dodatkowo: probówki mogą posiadać granulat
lub żel separujący, ułatwiający odseparowanie
osocza/surowicy od krwinek
• WAŻNE!!!
Po pobraniu krwi należy ją
dokładnie wymieszać – delikatnie, ruchem
wahadłowym, zgodnie z zaleceniami
producenta
• NIE WOLNO WSTRZĄSAĆ PROBÓWEK!!!
• Probówki należy umieścić w pionowej pozycji
w statywach, korki zdejmujemy bezpośrednio
przed wykonaniem badania

Wybór właściwego materiału
• Rodzaj badania
• Specyfika oznaczenia
• Przyjęte standardy diagnostyczne
• Stabilność materiału oraz zawartych w
nim składników
• Cechy pacjenta
• Możliwości finansowe i techniczne
ośrodka zdrowia/laboratorium
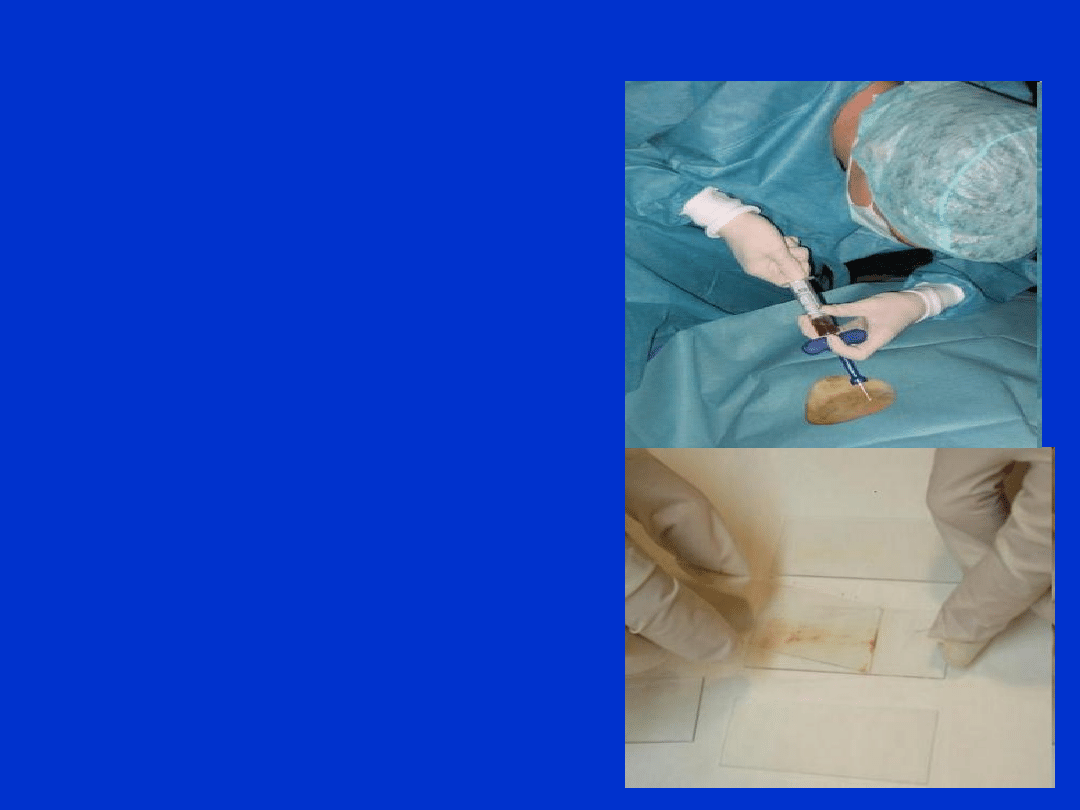
Szpik kostny
– badanie rozmazu
• Pobierany jest zwykle
bezpośrednio na oddziale
szpitalnym (hematologia,
onkologia)
• Szpik pobierany jest wyłącznie
przez lekarza, poprzez nakłucie
mostka lub talerza kości
biodrowej
• Diagnosta wykonuje
natychmiast po pobraniu
rozmaz szpiku na szkiełkach
mikroskopowych (2-3 szt.)
• Dodatkowo próbka szpiku
pobierana jest do probówki z
EDTA → możliwość
powtórzenia rozmazu

Mocz
• Wydalina układu moczowego, zawierająca w
swoim składzie wodę, elektrolity, zbędne
produkty azotowej przemiany materii (gł.
mocznik) oraz niewielkie ilości barwników
(urobilinogen)
• Dobowa ilość moczu wydalanego przez
zdrowego człowieka waha się od 600 do
2500 ml
. Zależy ona od wielu czynników,
m.in. ilości spożytych płynów i temperatury
otoczenia.

Cechy moczu osoby zdrowej
cecha
wartość
kolor
słomkowa
przejrzystość
przejrzysty
pH
4,5-7,5
glukoza, białko, ciała
ketonowe, bakterie,
bilirubina,
brak
nabłonki
pojedyncze, płaskie
erytrocyty, leukocyty
0-5 w polu widzenia

Rodzaje próbek moczu
• z mikcji pęcherza (mocz poranny)
• dobowa zbiórka moczu (DZM)
• z cewnikowania
• z nakłucia nadłonowego
Standardy pobierania moczu
• Mocz poranny:
-
Próbka musi być oddana bezpośrednio po nocnym
spoczynku (min. 4 h gromadzenia moczu w pęcherzu)
-
przed oddaniem moczu należy umyć dokładnie okolice
narząd płciowych ciepłą wodą z mydłem, bez wycierania
ręcznikiem!
-
mocz pobieramy ze środkowego strumienia, w ilości ok.
100 ml do jałowego, zamykanego pojemnika
-
Z moczu porannego można wykonać:
badanie ogólne moczu
badanie osadu moczu
Proteinogram
obecność białka Bence-Jonesa
α-amylazę
testy wykrywające leki, narkotyki

• Dobowa zbiórka moczu (DZM):
− DZM rozpoczynamy o godz. 6.00 w dniu poprzedzającym
badanie
− Pierwszą poranną porcję moczu należy odrzucić, wszystkie
następne (łącznie z pierwszą poranną porcja w dniu
badania) pacjent oddaje w całości do czystego naczynia o
poj. 2-3 l
− Naczynie należy przechowywać w chłodnym miejscu
(lodówce); w niektórych przypadkach używa się
konserwantów np. HCl
− Zebrany mocz należy wymieszać, zmierzyć jego objętość i
dostarczyć w ilości 100-200 ml do laboratorium
− Na zleceniu podać czas rozpoczęcia i zakończenia zbiórki
oraz objętość DZM
− Z DZM wykonujemy: albuminy, białko całkowite, kwas
moczowy, mocznik, klirens kreatyniny, elektrolity, hormony
(np. kortyzol)

Uwagi
• Nie należy pobierać
moczu w trakcie
miesiączki oraz po
znacznym wysiłku
fizycznym
• U niemowląt i małych
dzieci stosuje się
specjalne woreczki
pediatryczne, które
należy dostarczyć do
laboratorium w
jednorazowych
pojemnikach (bez
przelewania zawartości)

Kał
• Wydalina formowana w końcowych
odcinkach jelita grubego
• Składa się głównie z:
− niestrawionych resztek pokarmowych i
fragmentów złuszczonego nabłonka – 10%
− wody - 75%
− bakterii – 15%
• Prawidłowe wydalanie stolca ma ważne
znaczenie dla zdrowia. Odbywać się powinno
ono 1
–2 razy w ciągu doby.

Badanie laboratoryjne kału
• stopień strawienia (białko, tłuszcz)
• obecność krwi utajonej
• obecność drobnoustrojów chorobotwórcze (bakterie,
wirusy)
• pasożyty i ich jaja
Standardy pobierania kału
• kał do badania pobiera się z masy kałowej oddanej w
wyniku defekacji bez użycia środków
przeczyszczających lub lewatywy
• kał oddaje się do tzw. pojemnika kałowego, którym może
być dowolne naczynie uprzednio dokładnie umyte wodą
wraz z detergentem, dokładnie wypłukane i osuszone
(np. nocnik, basen); nie należy oddawać kału do muszli
klozetowej!
• następnie porcję kału (około 2 g) pobiera się szpatułką i
przenosi do jałowego, zamykanego pojemnika i
transportuje do laboratorium

Płyn mózgowo-rdzeniowy (PMR)
• Ciecz, która wypełnia przestrzeń
podpajęczynówkową, układ komorowy i
kanał rdzenia kręgowego.
• Pełni funkcje amortyzacyjne, chroniąc
tkankę nerwową mózgu i rdzenia przed
urazami mechanicznymi oraz wyrównuje
zmiany ciśnienia wewnątrzczaszkowego
• Ilość PMR w układzie komorowym i
przestrzeni podpajęczynówkowej wynosi
ok. 135 ml

PMR
• PMR u zdrowego człowieka
przejrzysty, wodnisty
pH 7,31-7,34
cytoza <5 komórek/mm3
białko < 40 mg/dl
glukoza 40-75 mg/dl
chlorki 115-130 mmol/l
• Badania płynu są bardzo istotne w diagnozowaniu
wielu
chorób układu nerwowego:
zapalenie opon mózgowych (wirusowe,
bakteryjne, grzybicze, pasożytnicze)
krwawienie podpajęczynówkowe
krwotoki mózgowe, krwiaki
guzy mózgu
stwardnienie rozsiane
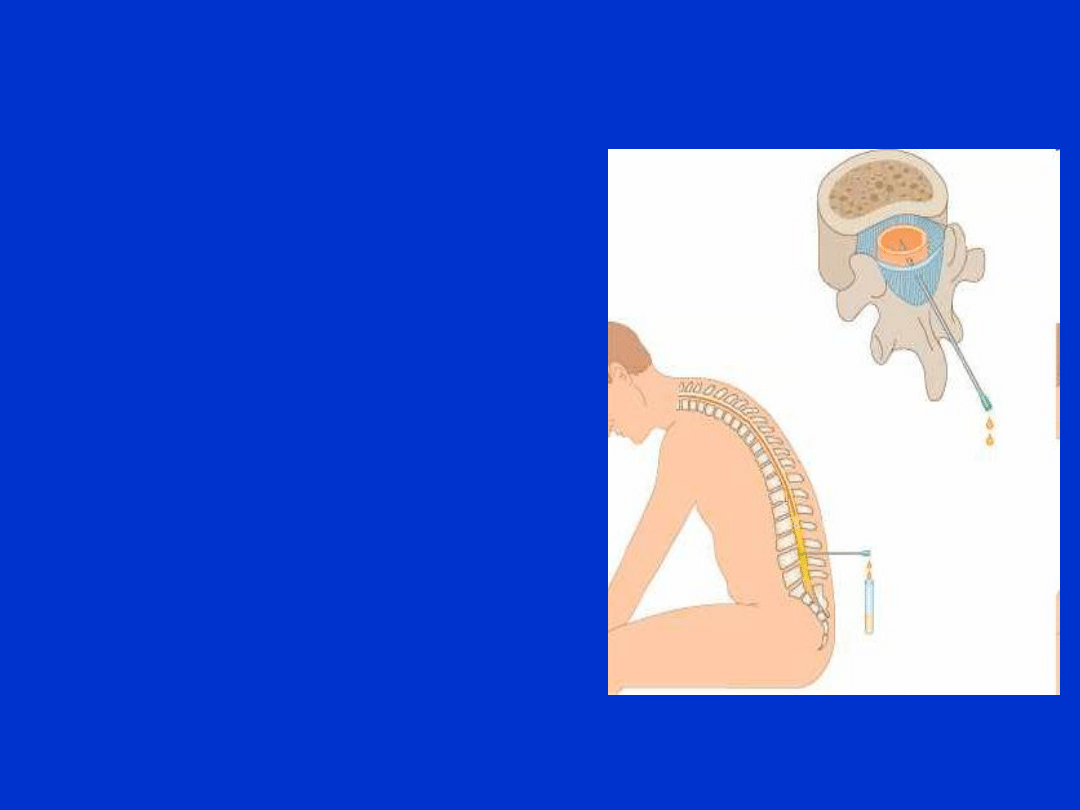
PMR - pobieranie
• PMR pobiera wyłącznie
lekarz poprzez:
nakłucie lędźwiowe (L4-L5)
punkcję podpotyliczną
punkcję komory bocznej
• Podczas pobierania nie
wolno dopuścić do
skrawienia płynu. Należy
odnotować wygląd płynu
podczas pobierania.
Wyszukiwarka
Podobne podstrony:
biologia-krew (2) , Osocze krwi, część płynna krwi stanowiąca 4,5% ciężaru ciała, lub 3-3,5 l, ok
1 Krew, osocze, erytrocyty
Krew i osocze(1)
Krew i choroby układu krwionośnego
KREW 6
krew i limfa
Święta krew Jezusa
3 Krew do wysłania
Krew 3
krew
Krew, Prywatne, Studia, Fizjologia
identyfikacja - krew, Kryminalistyka
Osocze a mocz. 5fantastic.pl , Ćwiczenia
KREW, Ratownicto Medyczne, FIZJOLOGIA
Krew, Pomoce naukowe na studia powiązane z medycyną
więcej podobnych podstron