
WIĄZANIA CHEMICZNE
Wiązania I rzędu
wewnątrzcząsteczkowe
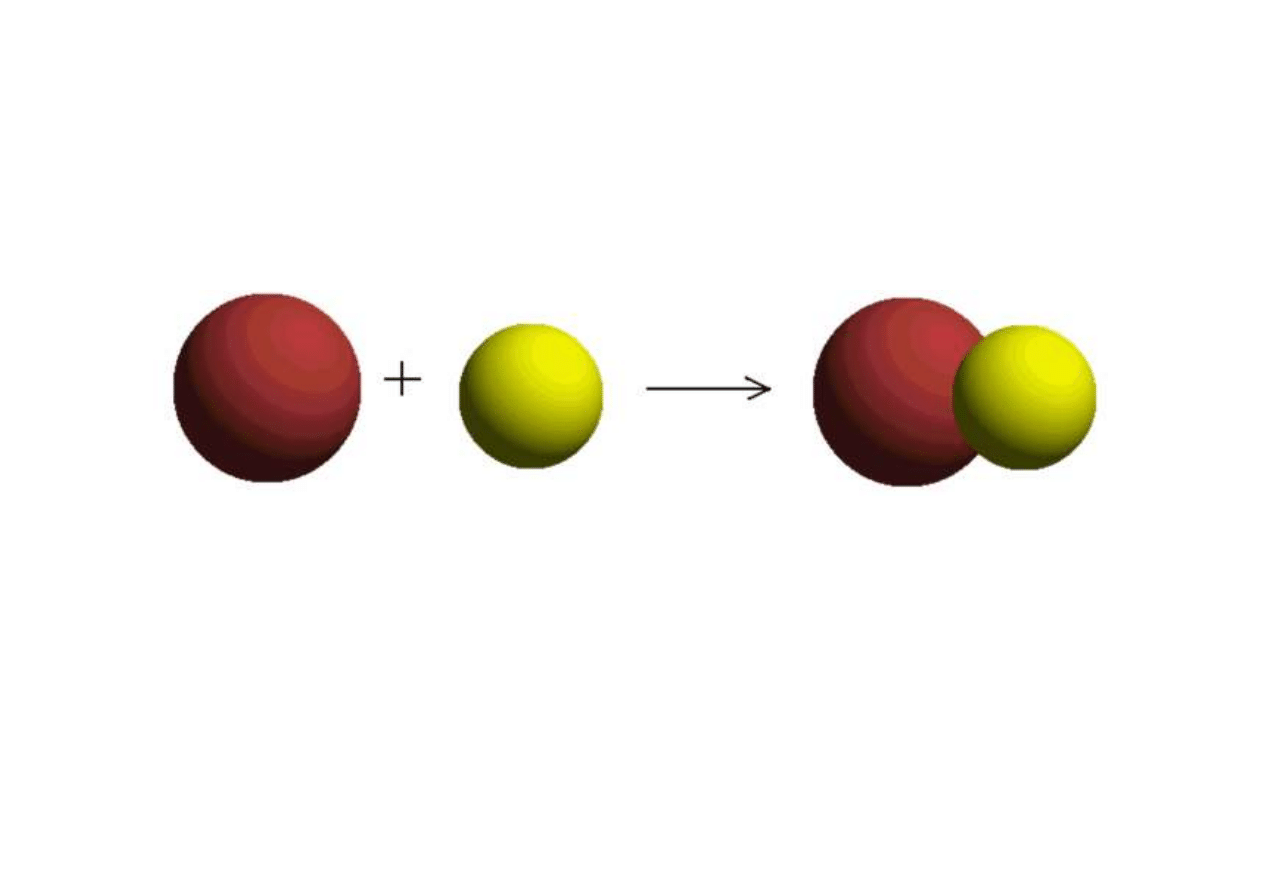
P.Łukowski, 2
Wiązanie chemiczne = siła wiążąca mniejsze
elementy materii w większe struktury
Wiązanie wewnątrzcząsteczkowe (I rzędu) = siła
wiążąca atomy w cząsteczki
P.Łukowski, 3
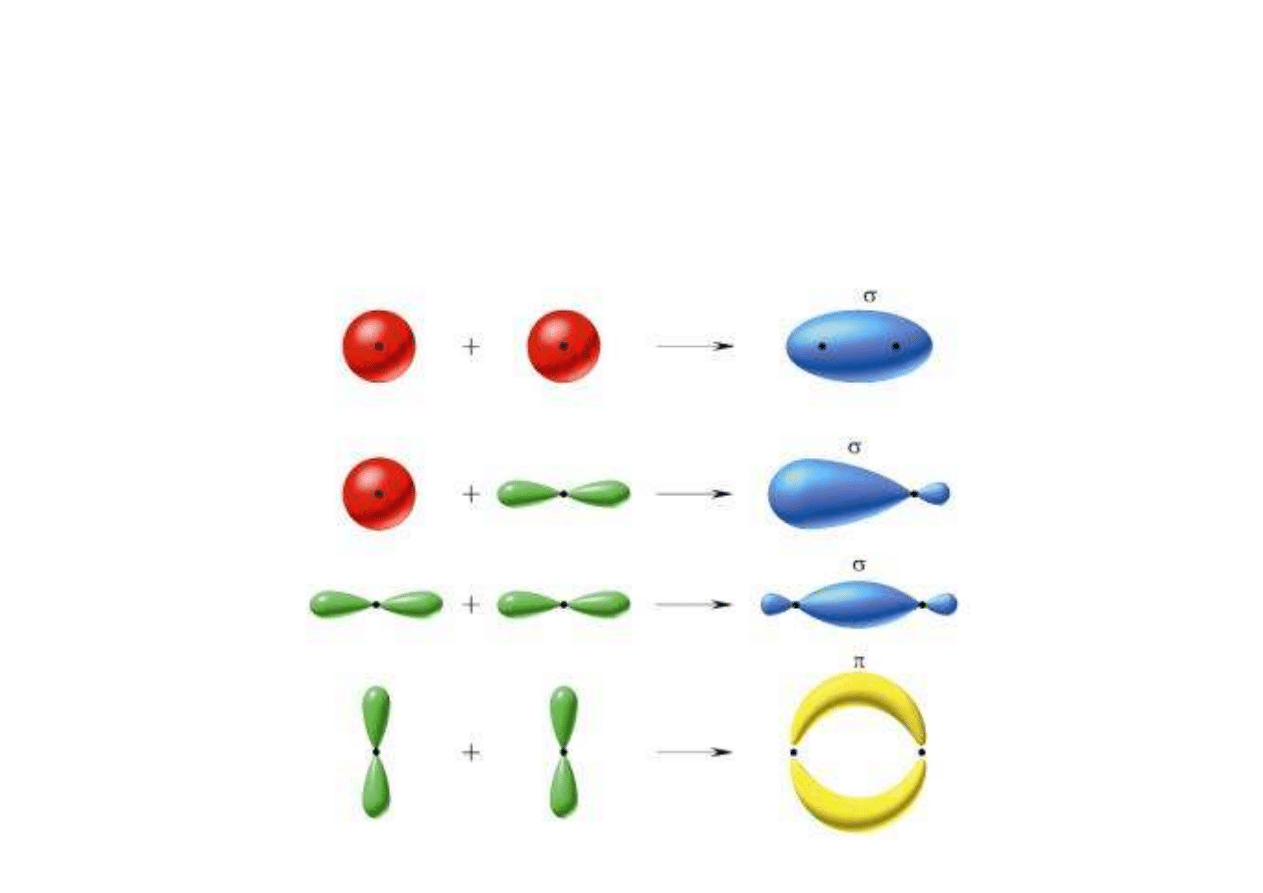
Z punktu widzenia chemii kwantowej wiązanie
wewnątrzcząsteczkowe polega na nałożeniu się orbitali
elektronowych różnych atomów z utworzeniem orbitalu
lub orbitali cząsteczkowych.

P.Łukowski, 4
Energia jonizacji, E
j
– miara łatwości, z jaką atom oddaje
elektrony i staje się kationem:
A + E
j
= K
+
+ e
–
Powinowactwo elektronowe, E
p
– miara łatwości, z jaką
atom przyłącza elektrony i staje się anionem:
A + e
–
= A
–
+ E
p
Elektroujemność, E
u
– miara zdolności atomu do
przyciągania elektronów (im większa elektroujemność, tym
silniej atom przyciąga elektrony):
E
u
= E
j
+ E
p
[keV]
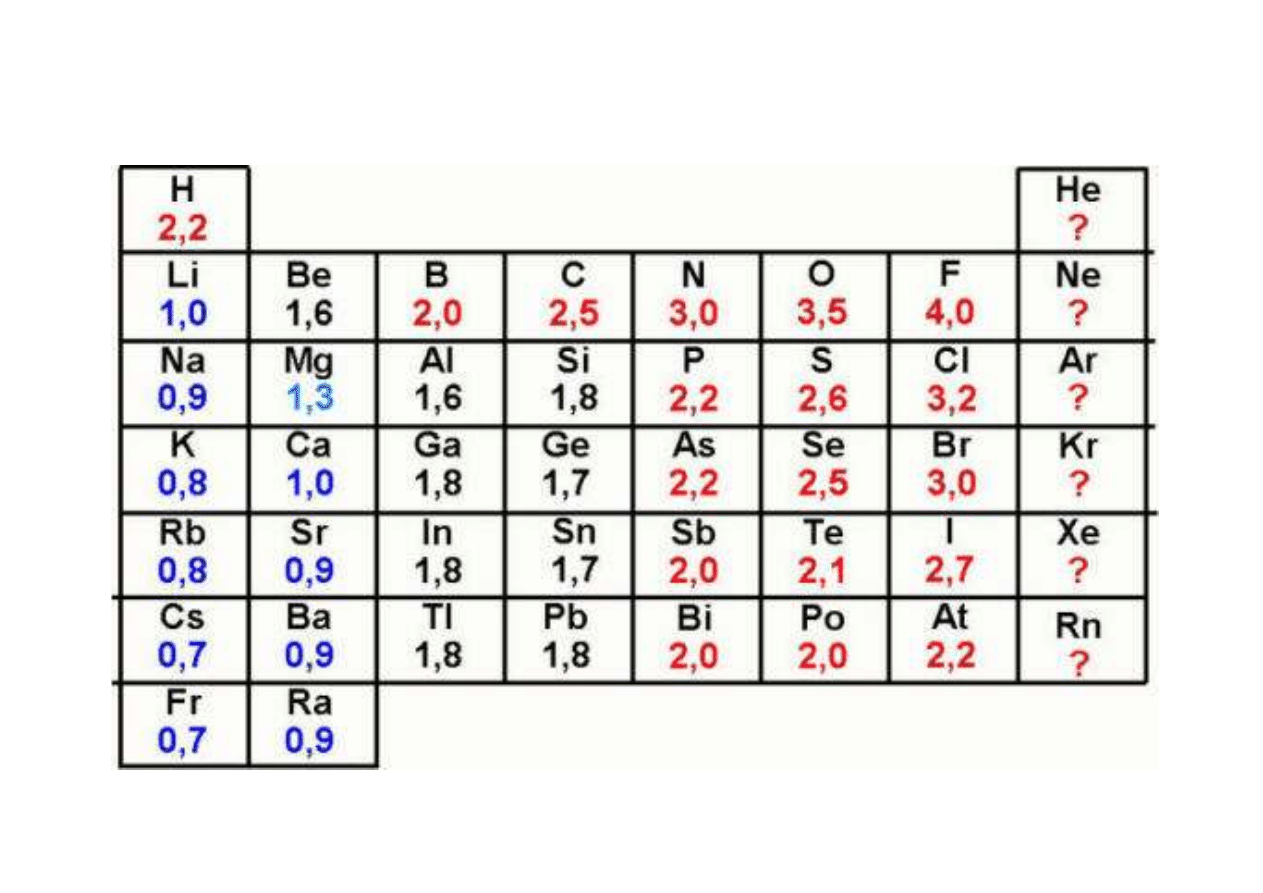
Elektroujemność w skali Paulinga (wielkość
bezwymiarowa) = Eu / 6,3
P.Łukowski, 5
Elektroujemność pierwiastków w skali Paulinga

Model tworzenia wiązania chemicznego
P.Łukowski, 6
Zgodnie z zakazem Pauliego w jednym orbitalu – także
orbitalu cząsteczkowym – mogą się znajdować dwa
elektrony.
Wiązanie może być utworzone przez parę elektronową.
Reguła oktetu: każdy atom dąży do posiadania na
powłoce walencyjnej 8 lub 0 elektronów (co umożliwia
osiągnięcie stanu o najniższej energii).
P.Łukowski, 7
Rodzaje wiązań wewnątrzcząsteczkowych
Na
Cl
Na
Cl
Na
Cl
Na
+
Cl
–
E
u
(Cl) = 3,2 >> E
u
(Na) = 0,9
Elektron z powłoki walencyjnej
sodu „przeskakuje” do powłoki
walencyjnej chloru.
Powstaje kation sodu i anion
chloru, które przyciągają się
elektrostatycznie.
Jest to
wiązanie jonowe.
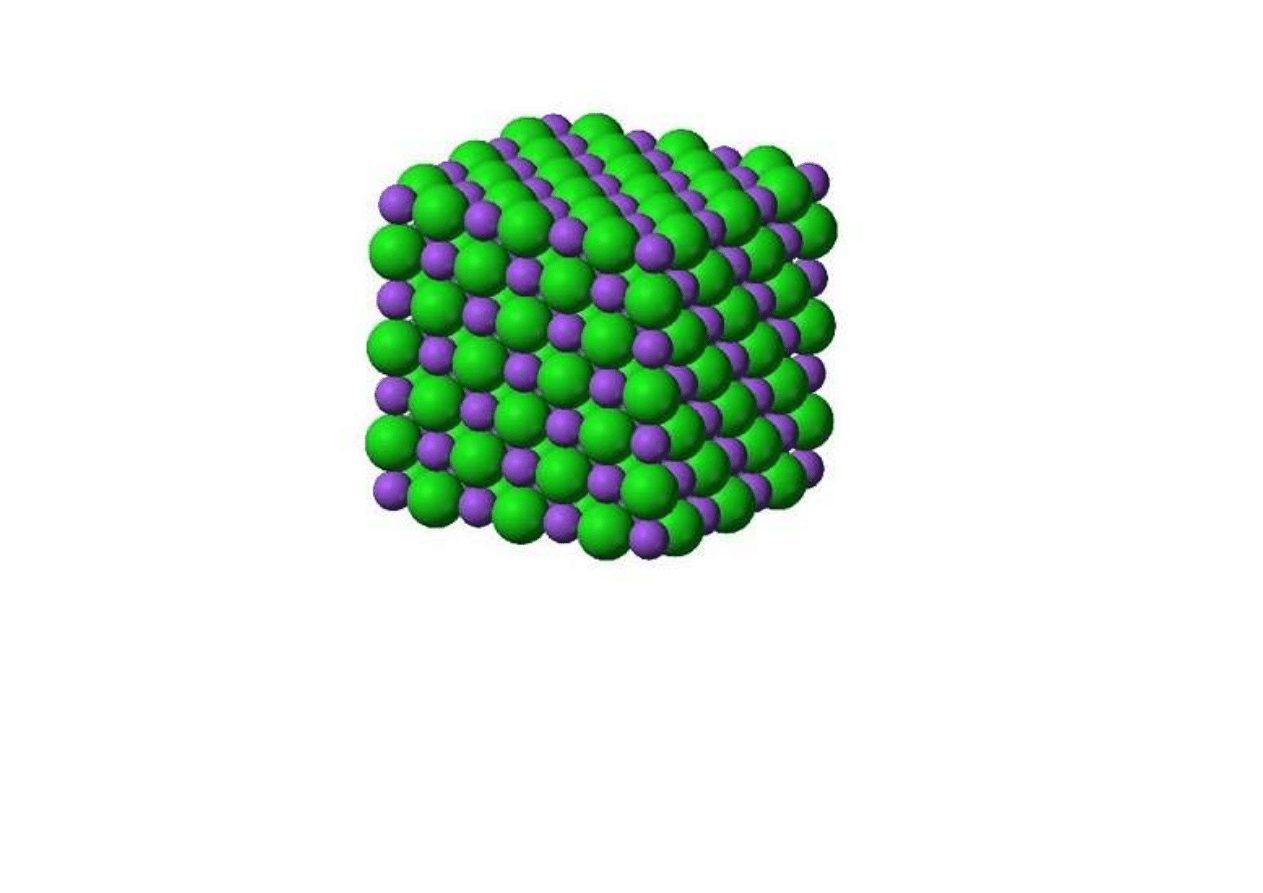
Jony Na
+
i Cl
–
tworzą kryształ – „megacząsteczkę”.
Nie istnieją pojedyncze cząsteczki NaCl – ten zapis
oznacza tylko proporcję jednych jonów do drugich
w związku chemicznym (1:1).
P.Łukowski, 8
P.Łukowski, 9
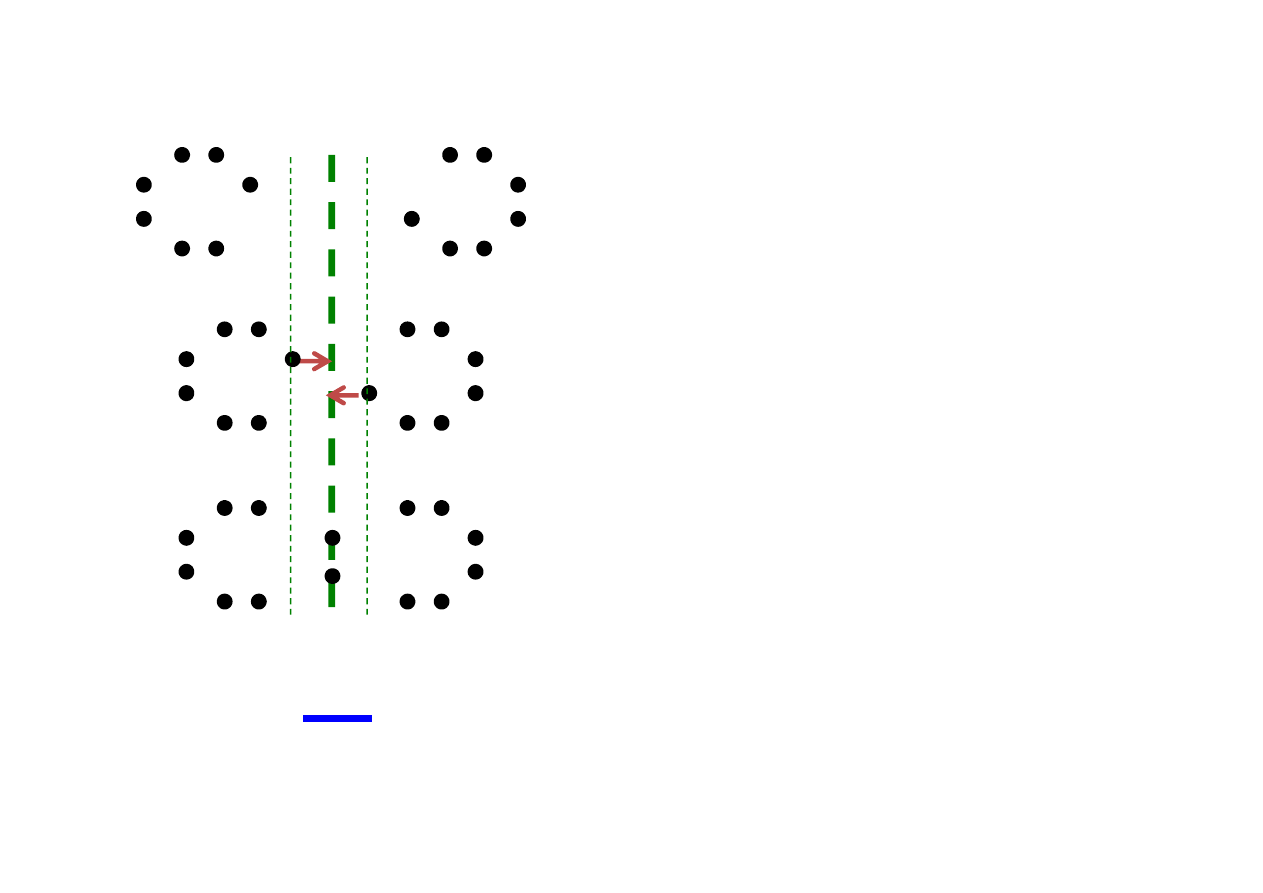
Rodzaje wiązań wewnątrzcząsteczkowych
Cl
Cl
Cl
Cl
Cl
E
u
obu atomów są identyczne.
Oba atomy przyciągają
elektrony z jednakową siłą.
Niesparowane elektrony zostają
uwspólnione – tworzą wiążącą parę
elektronową, znajdującą się dokładnie
„pomiędzy” atomami chloru.
Jest to
wiązanie atomowe
(kowalencyjne).
Cl
Cl
Cl
P.Łukowski, 10
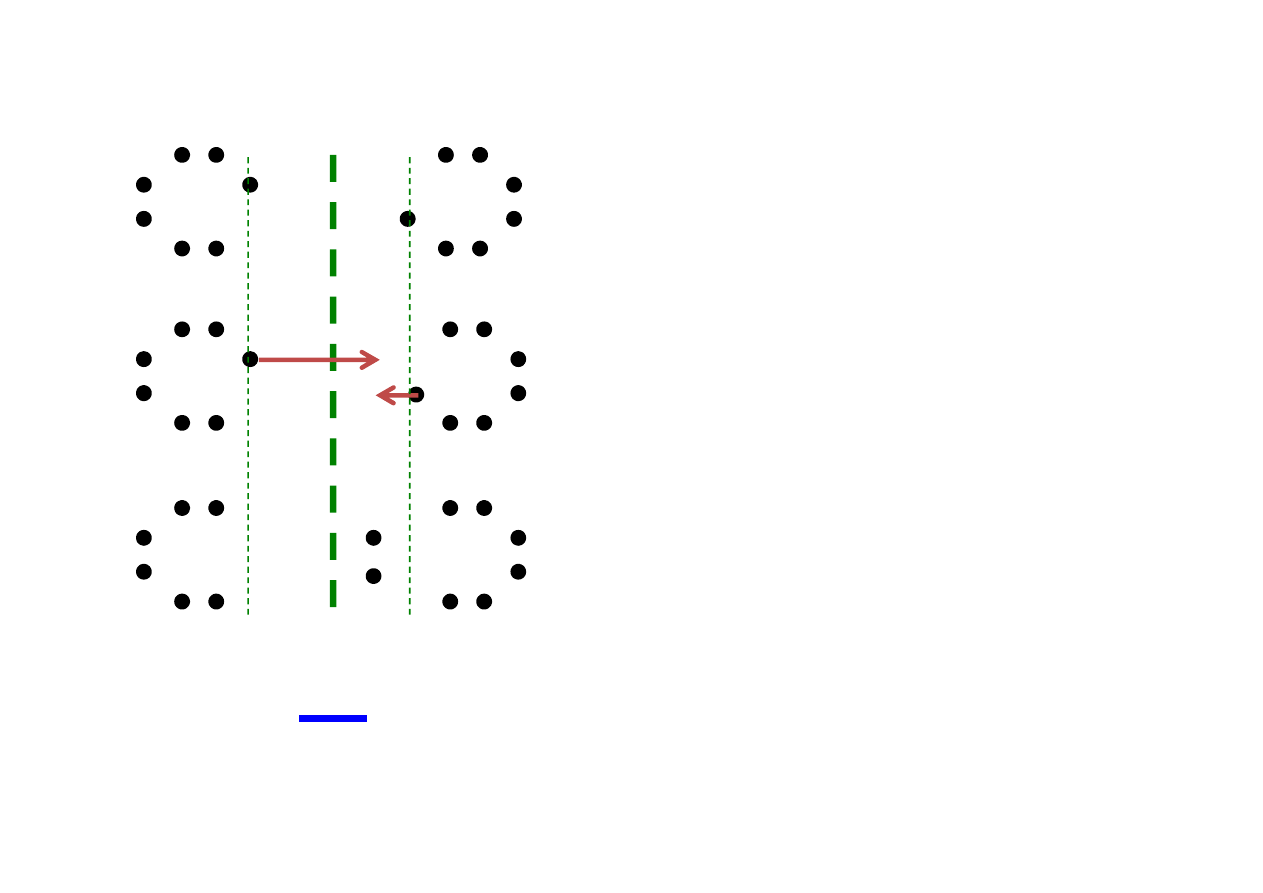
Rodzaje wiązań wewnątrzcząsteczkowych
B
B
B
A
B
E
u
obu atomów różnią się
nieznacznie.
Jeden z atomów przyciąga
elektrony nieco silniej.
Niesparowane elektrony zostają
uwspólnione – tworzą wiążącą parę
elektronową, znajdującą się bliżej
atomu o większej elektroujemności.
Jest to
wiązanie atomowe
spolaryzowane.
A
A
A

Rodzaje wiązań wewnątrzcząsteczkowych
Stopień polaryzacji wiązania zależy od różnicy
elektroujemności atomów biorących udział w wiązaniu.
∆
∆
∆
∆
E
u
> 1,7 ⇒
⇒
⇒
⇒
wiązanie jonowe
charakterystyczne dla połączeń pierwiastków I i VII grupy
NaCl, KI
∆
∆
∆
∆
E
u
< 0,4 ⇒
⇒
⇒
⇒
wiązanie atomowe
O
2
, Cl
2
, H
2
, N
2
, CO
2
∆
∆
∆
∆
E
u
= 0,4 – 1,7 ⇒
⇒
⇒
⇒
wiązanie atomowe spolaryzowane
(pośrednie między atomowym a jonowym).
H
2
O, HCl
P.Łukowski, 11

P.Łukowski, 12
Rodzaje wiązań wewnątrzcząsteczkowych
W metalach występują rdzenie atomowe (atomy pozbawione
wszystkich elektronów z powłok walencyjnych) i gaz
elektronowy (zdelokalizowane elektrony walencyjne).
Jest to
wiązanie metaliczne
.
N
H
H
H
H
+
N
H
H
H
H
+
Jest to
wiązanie koordynacyjne
(donorowo-akceptorowe)
np. jon amonowy NH
4
+
Rodzaje wiązań wewnątrzcząsteczkowych
Gdy oba elektrony w wiążącej
parze elektronowej pochodzą od
tego samego atomu.
P.Łukowski, 13
Wyszukiwarka
Podobne podstrony:
Czesc I wiazania chemiczne zada Nieznany
03 Wiazania chemiczne II rzedui Nieznany (2)
10) Wiazania chemiczne, wiazani Nieznany
Wyklad 4 Wiazania chemiczne w cialach stalych
Wiązania chemiczne (II)
6 wykad WiĄzania chemiczne[F]
Wykład 1, budowa atomu, wiązania chemiczne
2 1 V 1 02 ark 07id 20006 Nieznany
bns kalisz 02 06 id 90842 Nieznany (2)
2 Atom i cząstka Wiązania chemiczne klucz
2 Atom i cząstka Wiązania chemiczne
02 Identyfikacja zachowan konsu Nieznany (2)
02 2004 kurpiszid 3523 Nieznany
1 katastyrofy chemiczneid 9337 Nieznany (2)
Cw 02 M 04A Badanie wlasciwos Nieznany
17 02 2011 2id 17062 Nieznany (2)
02 Charakteryzowanie typow i ro Nieznany (2)
02 Krotko i dlugoterminowe dec Nieznany
więcej podobnych podstron