12
ĆWICZENIE 6
ALDEHYDY I KETONY
1.
Utlenianie etanolu za pomocą CrO
3
Celem ćwiczenia jest pokazanie, że alkohole I rzędowe utleniają się do aldehydów, a te z
kolei do kwasów karboksylowych
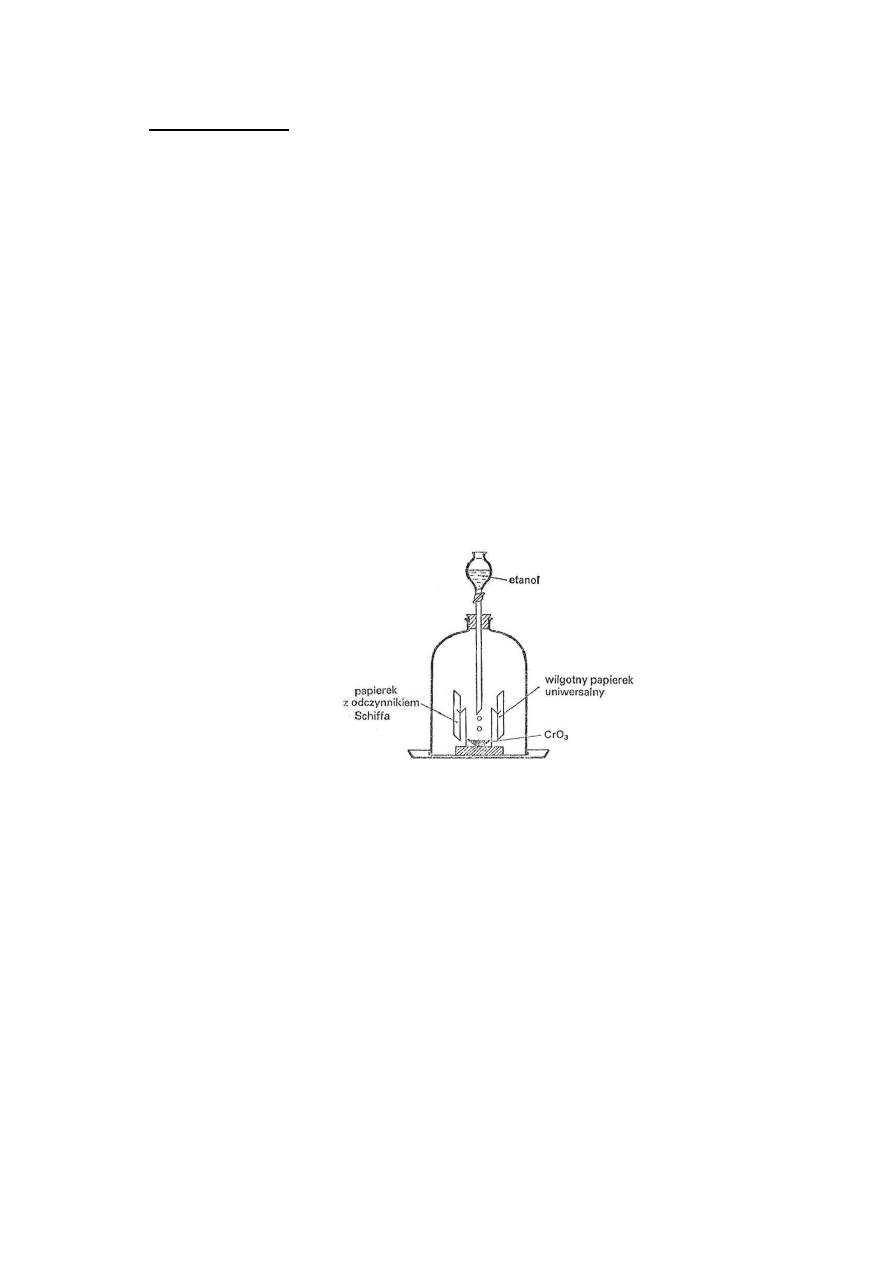
Szkło: klosz szklany, wkraplacz, szkiełko zegarkowe, korek.
Odczynniki: etanol, trójtlenek chromu, papierek Kongo, papierek nasycony odczynnikiem
Schiffa.
a. Ćwiczenie praktyczne
W naczynku wagowym, ustawionym na korku, umieścić płaską łyżeczkę (ok. 1 g)
krystalicznego CrO
3
. Na dwóch drucikach osadzonych w korku umieścić wilgotny papierek
Kongo oraz na drugim papierek nasycony odczynnikiem Schiffa. Całość zakryć kloszem
zawierającym w górnej części wkraplacz z etanolem (według schematu).
Po zmontowaniu układu wkropić kilka kropel etanolu na krystaliczny CrO
3
.Przebieg reakcji
jest energiczny. Papierek nasycony odczynnikiem Schiffa zabarwia się na czerwono, co
wskazuje obecność aldehydu. Papierek Kongo barwi się natomiast na granatowo, co z kolei
wskazuje obecność kwasu, który powstał w wyniku dalszego utleniania aldehydu. Trójtlenek
chromu redukuje się do tlenku chromu III.
2 CrO
3
+ 3 C
2
H
5
OH
→
Cr
2
O
3
+ 3 CH
3
CHO + 3 H
2
O
alkohol etylowy
aldehyd etylowy
CH
3
CHO + [O]
→
CH
3
COOH
aldehyd etylowy kwas etanowy (octowy)
2.
Wykrywanie aldehydu za pomocą reakcji z odczynnikiem Schiffa
13
Celem ćwiczenia jest wykrycie obecności aldehydu. Aldehydy w reakcji z odczynnikiem
Schiffa powodują zabarwienie roztworu na kolor purpurowo fioletowy.
Odczynnik Schiffa jest to nasycony tlenkiem siarki (IV), bezbarwny lub bladożółty roztwór
wodny fuksyny. Stosuje się go do wykrywania aldehydów oraz cukrów redukujących, w
reakcji z którymi przyjmuje barwę czerwonofioletową. W wyniku reakcji powstaje
trójfenylometanowa pochodna kwasu bis N-aminosulfinowego.
NHSO
2
H
C
HO
3
S
NHSO
2
H
NH
2
RCOH
C
NH
HN
NH SO
2
SO
2
CH
C
H
OH
R
OH
R
kwas bis N-aminosulfinowy (leukokwas)
a. Ćwiczenie praktyczne
Szkło: 3 probówki
Odczynniki: roztwór Schiffa, aldehyd octowy, aceton
Do 1 cm
3
badanego aldehydu dodać 2 cm
3
odczynnika Schiffa i po dokładnym wymieszaniu
obserwować powstające się zabarwienie. Próbę wykonać również z ketonem.
3. Własności redukujące aldehydów
Celem ćwiczenia jest wykazanie własności redukujących aldehydów w odróżnieniu od
ketonów. Aldehydy w reakcjach z utleniaczami wykazują własności redukujące, same
utleniając się do odpowiednich kwasów.
Szkło: 3 probówki
Odczynniki: 5% AgNO
3
, 2 m NaOH, 2% NH
4
OH, aldehyd octowy, aceton
a. Ćwiczenie praktyczne (próba Tollensa)
Do 2 cm
3
5% roztworu AgNO
3
dodać kroplę NaOH, a następnie kroplami 2% roztwór
NH
4
OH, tak by utworzony osad (Ag
2
O) uległ rozpuszczeniu. Do 3cm
3
tak przygotowanego
roztworu dodawać 5-10 kropel badanego aldehydu i pozostawić do wydzielenia się
metalicznego srebra. Jeżeli lustro srebrowe nie powstaje, probówkę ogrzać. Napisać reakcję.
Próbę Tollensa wykonać z acetonem. Analogiczną reakcję wykonać dla rozdrobnionych
owoców (jabłko, banan itp.).

14
4.
Utlenianie aldehydu mrówkowego do kwasu mrówkowego
Szkło: probówka, łapa do próbówki, palnik
Odczynniki: aldehyd mrówkowy (formalina) (3 cm
3
), roztwór NaOH (0,5 cm
3
),
rozcieńczony roztwór siarczanu miedzi (0,5 cm
3
).
a. Ćwiczenie praktyczne
Do probówki wlać aldehyd mrówkowy oraz 0,5 cm
3
roztworu wodorotlenku sodu. Do
mieszaniny dolać kilka kropel roztworu siarczanu miedzi. Próbkę ogrzewać w płomieniu
palnika, aż do pojawienia się czerwonego zabarwienia. W reakcji siarczan miedzi reaguje z
wodorotlenkiem sodu dając wodorotlenek miedzi Cu(OH)
2
:
CuSO
4
+ 2 NaOH
→
Cu(OH)
2
+ Na
2
SO
4
Aldehyd mrówkowy, w roztworze zasadowym oraz w podwyższonej temperaturze redukuje
miedź z +II na +I stopień utlenienia. W wyniku reakcji aldehydu z wodorotlenkiem miedzi II
powstaje zatem wodorotlenek miedzi I oraz kwas mrówkowy:
2 Cu(OH)
2
+ HCHO
→
2 CuOH + HCOOH + H
2
O
Wodorotlenek miedzi I przechodzi w tlenek miedzi I, który ma kolor czerwony.
2 CuOH
→
Cu
2
O + H
2
O
5.
Próba na ketony
Celem ćwiczenia jest stwierdzenie, że dane połączenie organiczne zaliczamy do ketonów.
Szkło: 1 probówka
Odczynniki: alkoholowy roztwór acetonu, stały nitroprusydek sodu, 2 m NaOH.
W probówce umieścić 2 kryształki nitroprusydku sodu, rozpuścić w kilku kroplach H
2
O,
wymieszać i dodać po 1-2 kropli acetonu w alkoholu. Następnie dodać 1-2 kropli roztworu
NaOH. Pojawienie się brunatno-czerwonego zabarwienia świadczy o obecności
metyloketonów. Po dodaniu 1-2 krople kwasu octowego zabarwienie zmienia się na czerwone
lub niebieskie.
Mechanizm tej reakcji nie jest znany.

15
ĆWICZENIE 7
KWASY, ESTRY, AMINY I AMIDY
1. Badanie właściwości kwasu octowego
Celem ćwiczenia jest zbadanie właściwości kwasowych kwasu octowego oraz jego mocy.
Kwasy karboksylowe w roztworach wodnych ulegają dysocjacji zgodnie z równaniem:
RCOOH
↔
RCOO
-
+ H
+
Kwasy reagują z metalami nieszlachetnymi dając odpowiednie sole i wodór.
Szkło: 2 probówki, 2 szkiełka zegarkowe
Odczynniki: kwas octowy, opiłki żelaza lub wstążki magnezu, stały węglan sodu, papierek
wskaźnikowy, papierek Kongo.
a. Ćwiczenie praktyczne
Na szkiełku zegarkowym umieścić parę kropel kwasu octowego. Za pomocą papierka
wskaźnikowego zbadać odczyn roztworu.
b. Ćwiczenie praktyczne
Umieścić na szkiełku zegarkowym papierek wskaźnikowy Kongo, który należy zwilżyć
paroma kroplami kwasu octowego. Pojawienie się niebieskiego zabarwienia wskazuje na
obecność mocnego kwasu organicznego.
c. Ćwiczenie praktyczne
Do probówki zawierającej 2 cm
3
kwasu octowego wrzucić parę opiłków żelaza lub kawałek
magnezu. Obserwować zachodzące zjawisko i wyjaśnić go za pomocą reakcji chemicznej.
d. Ćwiczenie praktyczne
Do probówki zawierającej 1g węglanu sodu wkraplamy 1cm
3
kwasu octowego. Obserwować
zachodzący proces i wyjaśnić go za pomocą reakcji chemicznej.
2. Reakcje charakterystyczne poszczególnych kwasów
Celem ćwiczenia jest identyfikacja poszczególnych kwasów karboksylowych za pomocą
reakcji charakterystycznych.
Szkło: 5 probówek
Odczynniki: kwas szczawiowy 1%, kwas benzoesowy, kwas salicylowy, 1% FeCl
3
,
rezorcyna, stęż. H
2
SO
4
, roztwór węglanu sodu, 2% kwas octowy, 0,5 molowy NaOH, alkohol
etylowy.

16
a. Ćwiczenie praktyczne- reakcja kwasu szczawiowego z rezorcyną.
Do probówki zawierającej 1 cm
3
wodnego roztworu kwasu szczawiowego wrzucić 2-3
kryształki rezorcyny i wymieszać do rozpuszczenia. Następnie ostrożnie po ściance probówki
wkraplać 1cm
3
stęż. H
2
SO
4
. Powstaje niebieski pierścień.
b. Ćwiczenie praktyczne- reakcja kwasu benzoesowego z chlorkiem żelaza (III).
Do probówki wlać 2 cm
3
roztworu kwasu benzoesowego i dodać 2 krople 0,5 molowego
roztworu NaOH do zobojętnienia wobec papierka wskaźnikowego. Następnie dodawać
kroplami 1 cm
3
FeCl
3
. Powstaje jasnopomarańczowy galaretowaty osad benzoesanu żelaza.
c. Ćwiczenie praktyczne- reakcja kwasu salicylowego z chlorkiem żelaza (III).
3-4 kryształki kwasu salicylowego umieścić w probówce i rozpuścić w wodzie. Dodać 3-5
kropli 1% roztworu FeCl
3
. Pojawia się fioletowe zabarwienie roztworu, nie znikające po
dodaniu kilku kropel alkoholu etylowego.
3.
Oznaczanie kwasów karboksylowych (mlekowego i octowego) w pieczywie
Celem ćwiczenia jest oznaczanie kwasowości pieczywa, dzięki której można określić rodzaj
pieczywa. Właściwość ta zależy od rodzaju i warunków fermentacji ciasta. Kwasowość
pieczywa wyrażana jest w stopniach kwasowości. Jest ona równa liczbowo ilości cm
3
NaOH
potrzebnej do neutralizacji kwasów (mlekowego i octowego) otrzymanych w procesie
ekstrakcji 100 g pieczywa.
Szkło i aparatura: waga techniczna, kolba stożkowa z korkiem o pojemności 300 cm
3
,
cylinder miarowy o pojemności 200- 250cm
3
, 2 zlewki o pojemności 100- 200 cm
3
, lejek
laboratoryjny, gaza opatrunkowa, pipeta Mohra
Odczynniki: wyciąg chlebowy, 0,1 molowy roztwór NaOH, roztwór fenoloftaleiny.
a. Ćwiczenie praktyczne
50 g miąższu chlebowego umieścić w kolbie stożkowej dodając 200 cm
3
wody destylowanej.
Całość wstrząsać ok.5 min, po czym dodać do kolby jeszcze 50 cm
3
wody destylowanej i
jeszcze wytrząsać ok. 5 min. Całość sączyć przez lejek laboratoryjny wyłożony gazą
opatrunkową.
Pipetą Mohra pobrać 50 cm
3
przesączu do dwóch zlewek, dodać kilka kropel fenoloftaleiny.
Roztwór miareczkować 0,1 m NaOH do pojawienia się słabo malinowego zabarwienia.
Pomiar wykonać dwukrotnie. Do obliczeń wziąć średnią ze zużytej do zobojętniania objętości
zasady.
Granice kwasowości pieczywa (PN-A-74108: 1996. Pieczywo. Metody badań):
Pieczywo pszenne zwykłe i wyborowe = 3-5
°
Pieczywo półcukiernicze = 3
°
Pieczywo mieszane (pszenno-żytnie) = od 5
°
(bułki) do 7-10
°
(chleb)
Pieczywo żytnie = 8-11
°

17
4.
Otrzymywanie i hydroliza estrów
Estry otrzymujemy w reakcjach estryfikacji tj. reakcji zachodzącej pomiędzy alkoholem a
kwasem karboksylowym lub kwasem nieorganicznym. Charakterystyczną reakcją dla estrów
jest reakcja hydrolizy. Obecność zasady lub kwasu przyspiesza przebieg tej reakcji.
Celem ćwiczenia jest otrzymanie octanu etylu oraz wykazanie, że estry ulegają reakcji
hydrolizy w środowisku zasadowym.
Szkło: 2 probówki
Odczynniki: alkohol etylowy, kwas octowy rozcieńczony z wodą w stosunku 1:1, stęż.
H
2
SO
4
, octan etylu, 0,1 molowy NaOH , 1% roztwór fenoloftaleiny.
a. Ćwiczenie praktyczne
Do probówki wlać 3 cm
3
alkoholu etylowego, 3 cm
3
kwasu octowego oraz 10 kropel
stęż.H
2
SO
4
. Mieszaninę ogrzewać do wrzenia na łaźni wodnej. Pojawienie się specyficznego
zapachu świadczy o otrzymaniu octanu etylu.
b. Ćwiczenie praktyczne
Do 1 cm
3
octanu etylu dodać 2-5 kropli roztworu NaOH i kroplę fenoloftaleiny. Roztwór
przybiera zabarwienie malinowe. Mieszaninę ogrzewać do wrzenia na łaźni wodnej. Po
upływie 2-5 minut następuje odbarwienie roztworu. Napisać zachodzącą reakcję.
5. Badanie właściwości amin i mocznika
Celem ćwiczenia jest wykazanie charakteru zasadowego amin. Wodne roztwory amin
alifatycznych wykazują odczyn zasadowy wobec papierka wskaźnikowego, natomiast aminy
aromatyczne wobec niego są obojętne.
Szkło: 4 probówki, 2 szkiełka zegarkowe
Odczynniki: etyloamina, anilina, papierek wskaźnikowy, stęż. HCl, mocznik, stęż. kwas
azotowy, woda wapienna.
a. Ćwiczenie praktyczne- badanie odczynu roztworów amin.
Zbadać odczyn aniliny i etyloaminy za pomocą papierka wskaźnikowego.
b. Ćwiczenie praktyczne- reakcje amin z kwasami.
Do 1cm
3
aniliny umieszczonej w probówce dodawać kroplami stęż. kwasu solnego. Pojawia
się biały dym, a po chwili wypada osad chlorowodorku aminy.
Reakcja mocznika z kwasem azotowym wskazuje na zasadowe właściwości mocznika.
Mocznik pod wpływem zasady ulega hydrolizie na amoniak i dwutlenek węgla.
Celem ćwiczenia jest wykazanie zasadowych właściwości mocznika i jednocześnie
stwierdzenie, że mocznik ulega hydrolizie.

18
c. Ćwiczenie praktycze- powstawanie azotanu mocznika.
Około 0,5g mocznika wsypać do probówki, dodać 5cm
3
wody i wytrząsać do rozpuszczenia
się mocznika. Do roztworu dodawać ostrożnie kroplami stęż. HNO
3
. Następnie oziębić
probówkę w zimnej wodzie. Wytrąca się biały osad azotanu mocznika. Napisać reakcję.
d. Ćwiczenie praktyczne- hydroliza mocznika pod wpływem zasady.
Około 0,5g mocznika wsypać do probówki, dodać 5 cm
3
wody i wytrząsać do rozpuszczenia
się mocznika. Do roztworu dodawać 10 cm
3
wody wapiennej i ogrzewać silnie w płomieniu
palnika. Wyczuwa się zapach amoniaku, a papierek wskaźnikowy zbliżony do wylotu
probówki zmienia barwę na niebieską. Napisać zachodzącą reakcję.
e. Ćwiczenie praktyczne- reakcja biuretowa.
Mocznik poddany prażeniu w temperaturze ok 150
o
C ulega rozkładowi, którego produktami
są biuret (dwumocznik), zawierający wiązanie peptydowe oraz amoniak. Biuret tworzy z
solami miedzi (II) np.CuSO
4
w roztworze alkalicznym związki kompleksowe o zabarwieniu
fioletowym.
Wykonanie:
biuret rozpuścić w 5 cm
3
wody, a następnie dodać 1 kroplę rozcieńczonego CuSO
4
oraz 2
krople 3 molowego NaOH.
Wyszukiwarka
Podobne podstrony:
ChO cw 5 destylacja
ćw 4 Profil podłużny cieku
biofiza cw 31
Kinezyterapia ćw synergistyczne
Cw 1 ! komorki
Pedagogika ćw Dydaktyka
Cw 3 patologie wybrane aspekty
Cw 7 IMMUNOLOGIA TRANSPLANTACYJNA
Cw Ancyl strong
Cw 1 Zdrowie i choroba 2009
Rehabilitacja medyczna prezentacja ćw I
ćw 2b
więcej podobnych podstron