
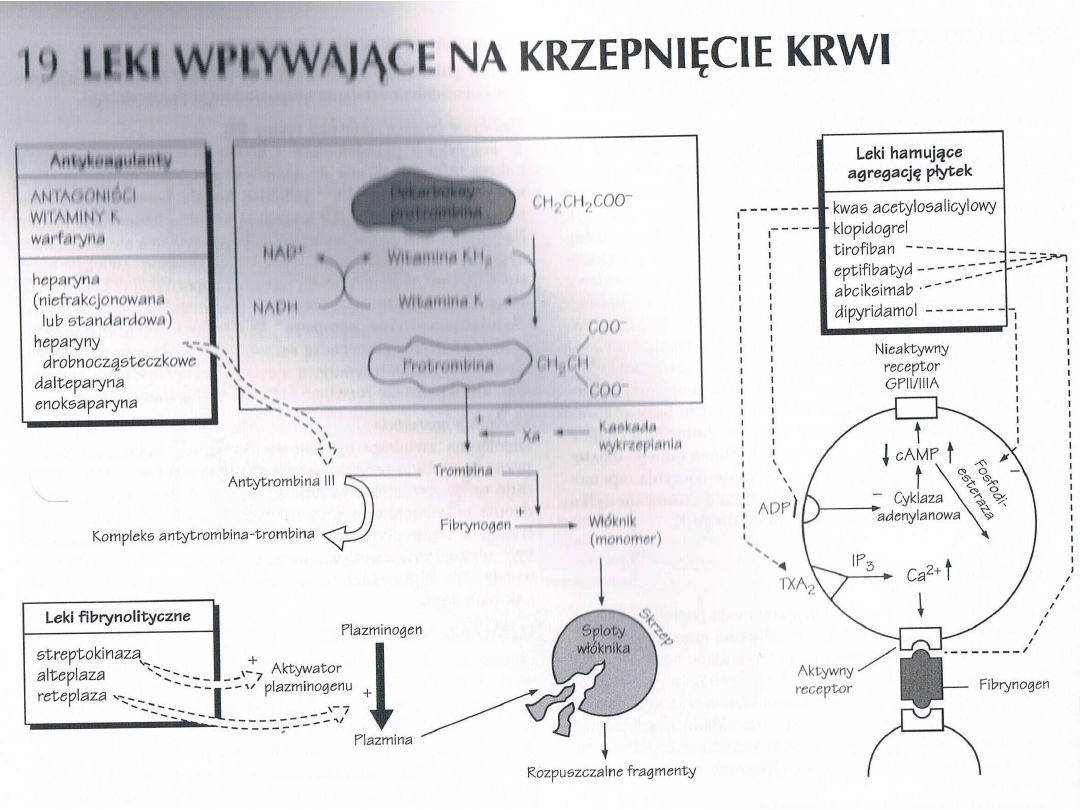
Leki wpływające na krzepliwośd
krwi

Hemostaza
Prawidłowo funkcjonujący układ hemostazy jest
niezbędny do życia, ponieważ w przypadku
zaburzeo hemostazy już niewielkie urazy mogą
prowadzid do ciężkich krwawieo, a z drugiej
strony przy nadmiernym krzepnięciu jest
skłonnośd do tworzenia zakrzepów i w związku
z tym wzrasta ryzyko zakrzepicy i powstawania
zatorów.

Hemostaza
Hemostaza polega na zatrzymaniu utraty krwi z
uszkodzonego naczynia. W pierwszym etapie
płytki ulegają adhezji do makrocząsteczek w
podśródbłonkowych okolicach uszkodzonego
naczynia krwionośnego; następnie agregują, aby
utworzyd pierwotny czop hemostatyczny. Płytki
stymulują lokalną aktywację osoczowych
czynników krzepnięcia, prowadząca do
wytworzenia skrzepu fibrynowego
wzmacniającego agregat płytkowy. W miarę
gojenia się rany agregat płytkowy oraz skrzep
fibryny są rozkładane.

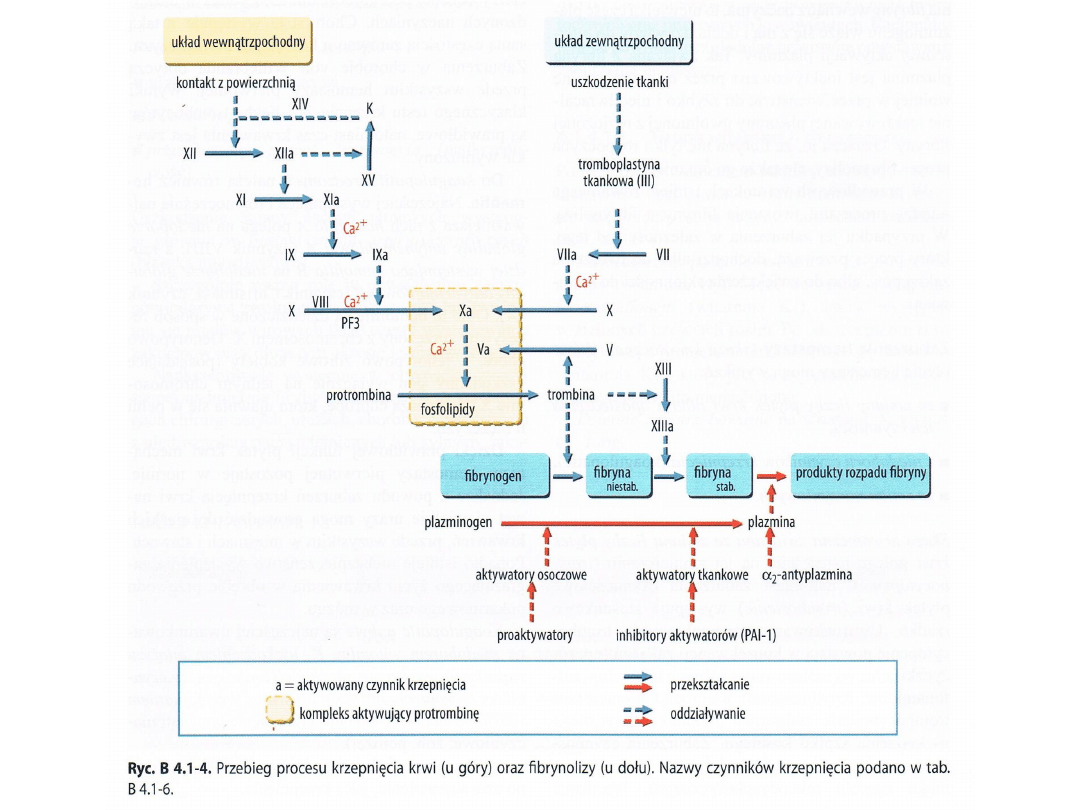

Na czym polega krzepnięcie krwi?
W prawidłowych, nieuszkodzonych naczyniach krwionośnych
(tętnicach i żyłach) krew pozostaje u zdrowego człowieka w stanie
płynnym i nie krzepnie. Jeżeli dojdzie do uszkodzenia ściany
naczynia zachodzi proces krzepnięcia krwi, oznacza to że składniki
krwi (czerwone i białe krwinki, płytki krwi, włóknik i odpowiednie
białka osocza) gromadzą się wokół siebie i zlepiają się ze sobą
tworząc skrzep- którego rola polega na zatykaniu, uszczelnieniu
uszkodzenia. Krzepniecie krwi jest niezbędne do prawidłowego
funkcjonowania organizmu, w przypadku upośledzenia procesu
krzepnięcia nie ma możliwości zahamowania krwawienia/
krwotoku. Ponadto powstanie skrzepu zapoczątkowuje proces
gojenia się.

Hemostaza
W procesie krzepnięcia uczestniczy ściana naczynia, osoczowe
czynniki krzepnięcia oraz płytki krwi. W wyniku aktywacji
układu krzepnięcia dochodzi do powstania skrzepu, który
hamuje wynaczynienie krwi z naczynia lub skrzepliny
(zakrzepu) wewnątrz naczynia, co prowadzi do
zablokowania przepływu krwi (np. pęknięta blaszka
miażdżycowa w naczyniach wieocowych prowadzi do
powstania w tym miejscu zakrzepu i zamknięcia naczynia,
co w konsekwencji prowadzi do zawału serca czyli martwicy
fragmentu mięśnia serca). We krwi istnieje także układ
fibrynolityczny, który rozpuszcza skrzep, gdy spełni on już
swoją funkcję (zahamowanie krwawienia).

Hemostaza
Śródbłonek naczyo fizjologicznie produkuje substancje (np. tlenek azotu,
prostacyklinę…) które zapobiegają krzepnięciu krwi. W wyniku uszkodzenia
ściany naczynia lub działania czynników uszkadzających (blaszka
miażdżycowa, toksyny bakterii, toksyny dymu papierosowego) może dojśd
do aktywacji przeciwnego procesu i wykrzepiania w naczyniu. Początkowo
dochodzi do agregacji i aktywacji płytek krwi, w wyniku czego naczynie
kurczy się w miejscu uszkodzenia i napływają kolejne płytki powiększając
skrzeplinę. Aktywacja układu osoczowego (pod wpływem uszkodzenia
naczynia) prowadzi ostatecznie do powstania fibryny z fibrynogenu (pod
wpływem trombiny powstającej z protrombiny). Zakrzepy mogą
powstawad wewnątrz naczyo żylnych i tętniczych oraz w sercu. Od
zakrzepów mogą odrywad się fragmenty prowadząc do zatorów
(najniebezpieczniejsze są zatory w mózgu i płucach).

Hemostaza
• W warunkach chorobowych może dochodzid do
niepożądanego krzepnięcia krwi w nieuszkodzonych
naczyniach krwionośnych- nie mówimy wówczas o skrzepie
a o zakrzepie, może to prowadzid do ograniczenia bądź
zatrzymania przepływu krwi przez te naczynia. Wynikiem
ograniczenia lub zatrzymania przepływu krwi przez naczynie
jest martwica tkanki, narządu które owo naczynie
zaopatruje, przykładem takiej martwicy może byd zawał
mięśnia sercowego bądź udar niedokrwienny mózgu.

Hemostaza
• Ponadto powstały zakrzep może się oderwad od ściany
naczynia, ściany serca bądź zastawki serca i popłynąd
wraz z prądem krwi do innej części ciała. Wraz ze
zmniejszającym się światłem naczynia taki oderwany,
wędrujący zakrzep może zablokowad przepływ krwi i
doprowadzid do niedokrwienia określonej części ciała a
co za tym idzie jej martwicy. Zakrzep który przemieścił
się do innej części ciała wraz z prądem krwi nazywamy
zatorem. We wszystkich częściach ciała może dojśd do
zatoru, najczęściej jednak mamy do czynienia z
zatorami w naczyniach nóg, w naczyniach płucnych lub
w naczyniach zaopatrujących mózg. .

Hemostaza
Protrombina powstaje w wątrobie przy udziale witaminy
K i należy do grupy α₁-globulin. Powstająca z niej
trombina, prowadzi do powstania fibryny.
Synteza fibryny rozpoczyna się od odszczepienia przez
trombinę fibrynopeptydów A i B z powstałego w
wątrobie fibrynogenu. Fibrynogen jest białkiem.
Monomery fibryny ulegają agregacji, tworząc długie
włókna. Następnie pod wpływem czynnika XIII
dochodzi do tworzenia się sieci kowalencyjnych wiązao
poprzecznych i podłużnych, co prowadzi do
wzmocnienia struktury.

Fizjologiczne inhibitory krzepnięcia
krwi
Oprócz czynników prowadzących do krzepnięcia
krwi organizm dysponuje różnymi
inhibitorami krzepnięcia.
• Antytrombina, wytwarzana w wątrobie,
hamuje kaskadę krzepnięcia krwi
• Siarczan heparanu, występuje na powierzchni
komórek śródbłonka
• Białko C i białko S

Hemostaza
W prawidłowych warunkach istnieje równowaga
pomiędzy procesami tworzenia fibryny a
fibrynolizą. W przypadku jej zaburzenia w
zależności od tego, który proces przeważa,
dochodzi albo do tworzenia zakrzepów, albo
do zwiększenia skłonności do krwawieo.

Zaburzenia hemostazy
Zaburzenia hemostazy (skaza krwotoczna) mogą
wynikad:
• Ze zmiany liczby płytek krwi
(trombocytopenia) albo z upośledzenia ich
czynności (zakażenia, stosowanie leków)
• Z niedoborów czynników krzepnięcia
(koagulopatie)- hemofilia
Układ krzepnięcia i fibrynolizy
aktywacja
wewnątrzpochodna
adhezja
i agregacja płytek
aktywacja
zewnątrzpochodna
aktywator protrombiny
protrombina
trombina
fibrynogen
monomery włóknika
plazminogen
plazmina
prod. degr. włóknika

Środki wspomagające hemostazę
Witamina K. Występuje w zielonych częściach
roślin. Konieczna jest do syntezy w wątrobie
czynników II, VII, IX oraz X, a także białek C i S.
Preparaty witaminy K są wskazane we
wszystkich postaciach niedoboru witaminy K.
Służą one również jako antidotum przy
przedawkowaniu leków przeciwzakrzepowych
(warfaryna).

Leki przeciwpłytkowe
Środki hamujące czynnośd trombocytów,
inhibitory agregacji płytek krwi.
Płytki formują pierwotny czop hemostatyczny w
miejscach uszkodzenia naczyo. Uczestniczą
także w formowaniu zakrzepów
patologicznych, które prowadzą do zawału
mięśnia sercowego, udaru i zakrzepicy naczyo
obwodowych.

Leki przeciwpłytkowe
Jako inhibitory agregacji trombocytów
zastosowanie znajdują:
• Inhibitory cyklooksygenazy ( kwas
acetylosalicylowy)
• Antagoniści receptorów ADP (tiklopidyna i
klopidogrel)
• Antagoniści receptora glikoproteinowego
IIb/IIIa (GB-IIb/IIIa)
• Dipirydamol

Odstawienie leków przeciwpłytkowych
przed zabiegami chirurgicznymi
W trakcie przyjmowania ASA wykonywane mogą
być:
•
operacje kardiochirurgiczne
•
biopsje narządowe
•
ekstrakcje zębów
Przyjmowanie ASA zwiększa częstość poważnych
krwawień jedynie u chorych poddawanych
operacjom wewnątrzczaszkowym i prostatektomii
przezcewkowej

Leki przeciwpłytkowe
Kwas acetylosalicylowy. Nieodwracalnie hamuje
cyklooksygenazę 1( COX-1). W płytkach głównym
produktem cyklooksygenazy jest tromboksan
(induktor agregacji płytek). Ponieważ płytki nie
syntetyzują nowych białek, działanie aspiryny na
płytkową cyklooksygenazę jest permanentne i
trwa przez cały czas życia płytek (7-10 dni). Zatem
powtarzane dawki aspiryny wywołują
skumulowany efekt działania na funkcję płytek.

Leki przeciwpłytkowe- antagoniści
receptorów ADP
Płytki zawierają dwa receptory purynergiczne , P2Y₁ oraz
P2Y₁₂.
Tiklopidyna jest prolekiem, który wymaga konwersji do
aktywnego metabolitu przez enzym wątrobowy ,
cytochrom P450. Lek jest szybko wchłaniany i ma
wysoką biodostepnośd. Cechuje się krótkim okresem
półtrwania i długim okresem działania. Maksymalne
zahamowanie agregacji płytek jest obserwowane po 8-
11 dniach. Zatem, aby uzyskad szybszy początek
działania, podawane są „dawki inicjujące” , wynoszące
500mg. Typowa dawka to 250 mg dwa razy dziennie.
Tienopirydyny
• tiklopidyna,
• klopidogrel
preferowany jest klopidogrel ze względu na lepszy profil bezpieczeostwa
9% leczonych tiklopidyną
: biegunka (także przewlekła po 3-8 tygodniach leczenia na
podłożu zmian zapalnych jelita grubego), nudności, wymioty;
często (2-3%) wysypka skórna lub świąd skóry;
2,1-2,4% - neutropenia (mechanizm toksycznego uszkodzenia), rozwijająca się
zazwyczaj w ciągu pierwszych 4 miesięcy, początkowo bezobjawowa (co 2 tygodnie
przez 4 miesiące badanie morfologii z rozmazem);
<1% agranulocytoza; opisywano także przypadki aplazji szpiku i zakrzepowej
plamicy małopłytkowej,
Nieodwracalnie modyfikują strukturę płytkowego receptora ADP o nazwie P2Y
12
,
bezpośrednio i swoiście hamując wiązanie ADP do receptora i hamując wywoływaną przez
ADP aktywację kompleksu glikoprotein GPIIb/IIIa.

Leki przeciwpłytkowe- antagoniści
receptorów ADP
Klopidogrel. Jest blisko powiązany z tiklopidyną, ale
posiada bardziej korzystny profil toksykologiczny,
z mniejszą częstością występowania
trombocytopenii i leukopenii. Klopidogrel jest
prolekiem o późnym początku działania. Typowa
dawka wynosi 75mg, a dawka wprowadzająca
300mg.
Wskazania: redukcja częstości udarów oraz śmierci
pacjentów ze świeżym zawałem mięśnia
sercowego lub udarem, stabilna choroba tętnic
obwodowych, ostry zespół wieocowy.
Tiklopidyna vs Klopidogrel
• Klopidogrel – zarejestrowany do stosowania w ostrych zespołach
wieocowych
• mniej działao niepożądanych (neutropenia, trombocytopenia,
nudności, biegunka, alergia, zmiany poziomu enzymów
wątrobowych)
• szybszy czas rozpoczęcia działania
• mniej interakcji lekowych (nie wpływa na farmakokinetykę
blokerów pompy protonowej, digoksyny)
• Niewskazane jest równoległe stosowanie klopidogrelu i gdyż
warfaryna może nasilad krwawienie.
• Inhibitory receptora glikoproteinowego IIb/IIIa mogą zwiększad
ryzyko krwawienia i nie powinny byd stosowane razem z
klopidogrelem.
• Klopidogrel nie zmienia wpływu heparyny na krzepnięcie krwi.

Inhibitory glikoproteiny IIb/IIIa
Glikoproteina IIb/IIIa stanowi receptor dla fibrynogenu,
odpowiedzialny za przyleganie płytek do obcych
powierzchni i do innych płytek (uczestniczy w
agregacji). Receptor ten jest aktywowany przez takich
agonistów płytek, jak trombina, kolagen czy tomboksan
A₂ w celu utworzenia miejsc wiążących dla jej ligandów,
które nie wiążą się z płytkami będącymi w spoczynku.
Hamowanie wiązania z tym receptorem blokuje
agregację płytek indukowaną przez jakichkolwiek
agonistów.
Obecnie zarejestrowano do stosowania trzy leki

Inhibitory glikoproteiny IIb/IIIa
Obecnie zarejestrowano do stosowania trzy leki:
Abciksimab, Eptifibatyd, Tirofiban.
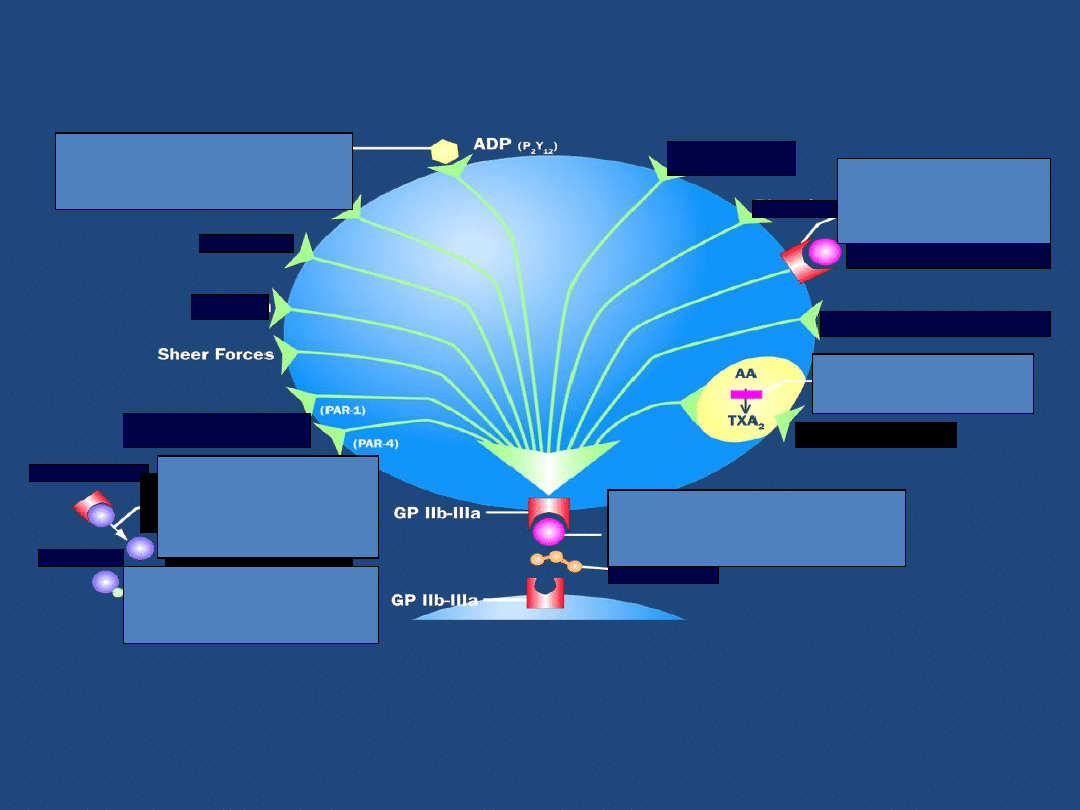
Jedynie inhibitor receptora
GP IIb-IIIa blokuje agregację płytek krwi
w odpowiedzi na działanie wszystkich agonistów
Zaadaptowano z Brogan. Ann Emerg Med. 2002;9:1029.
Fibrynogen
Serotoninan
Kolagen
Epinefryna
Plazmina
Fibrynogen
(GP IIb-IIa)
Czynnik aktywacji płytek
Receptor
trombiny
Protrombina
Trombina
Tienopirydyny blokują
aktywację
płytek
zachodzącą poprzez receptor dla ADP
Inhibitory
GP IIb-IIIa
zapobiegają aktywacji płytek
indukowanej przez fibrynogen
Aspiryna blokuje jedynie aktywację
płytek zachodzącą poprzez szlak
kwasu arachidynowego
Inhibitory receptora GP IIb-IIIa wypierają
cząsteczki fibrynogenu uniemożliwiając
powstanie/narastanie skrzepliny
Heparyna i enoksyparyna
zmniejszają syntezę trombiny
pośrednio i częściowo blokując
ten szlak aktywacji płytek
Bivalirudyna inaktywuje
cząsteczki trombiny
pośrednio i częściowo blokując ten
szlak aktywacji płytek
Tromboksan A2

INTEGRILIN
®
(eptifibatide) Injection
Syntetyczny peptyd uzyskany z
jadu węża Sistrurus m barbour
Brak właściwości immunizacyjnych

Inhibitory glikoproteiny IIb/IIIa
Eptifibatyd. Jest peptydem blokującym miejsce
fibrynogenu, ale przynoszący mniejsze korzyści
niż w przypadku przeciwciał.
Tirofiban (AGGRASTAT) jest niepeptydowym
małocząsteczkowym inhibitorem
glikoproteinowego receptora. Ma krótki czas
działania i wykazuje skutecznośd w przypadku
zawałów serca bez załamka Q i w niestabilnej
dusznicy bolesnej.
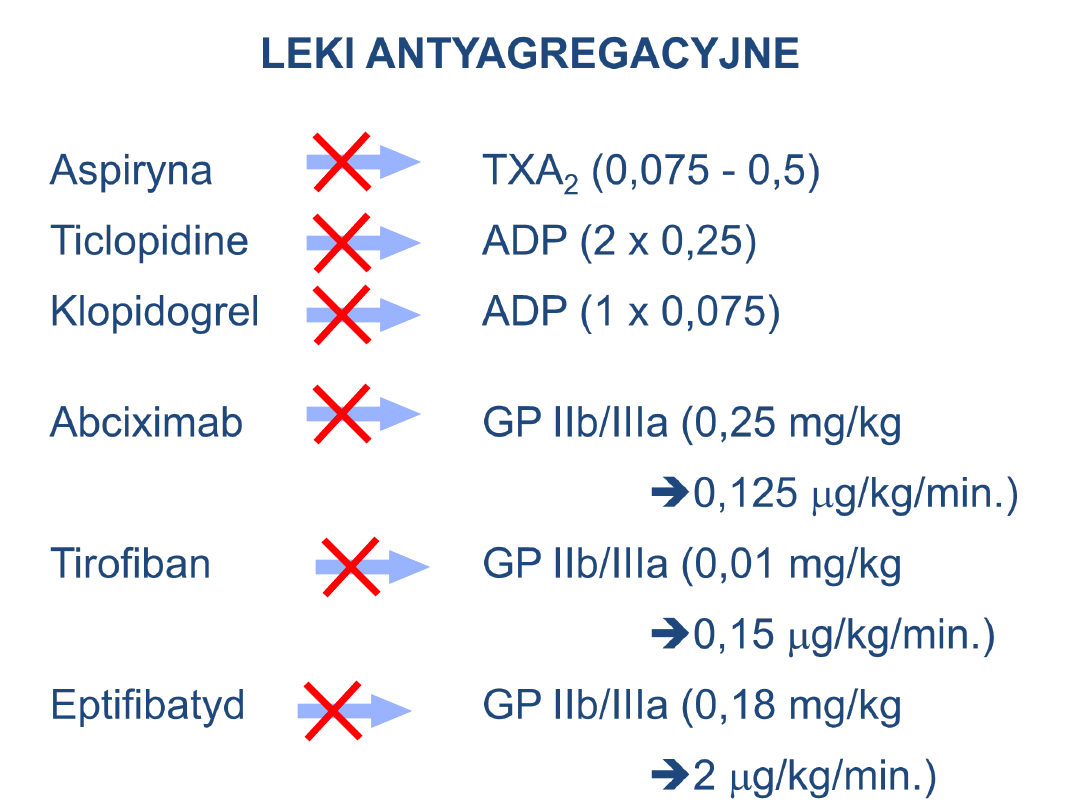
Aspiryna
TXA
2
(0,075 - 0,5)
Ticlopidine
ADP (2 x 0,25)
Klopidogrel
ADP (1 x 0,075)
Abciximab
GP IIb/IIIa (0,25 mg/kg
0,125
m
g/kg/min.)
Tirofiban
GP IIb/IIIa (0,01 mg/kg
0,15
m
g/kg/min.)
Eptifibatyd
GP IIb/IIIa (0,18 mg/kg
2
m
g/kg/min.)
LEKI ANTYAGREGACYJNE

Leki przeciwzakrzepowe
antykoagulanty
Antykoagulanty są stosowane, podobnie jak leki
hamujące agregację trombocytów, w
profilaktyce i leczeniu procesów zakrzepowo-
zatorowych. Są one ponadto niezbędne przy
produkcji preparatów krwi konserwowanej.
Leki przeciwzakrzepowe
antykoagulanty
Usunięcie jonów wapnia. Jony wapnia są
niezbędne do procesu krzepnięcia krwi. Dlatego
dzięki ich usunięciu można zapobiec krzepnięciu
krwi. Dokonuje się tego za pomocą wiązania w
kompleksach z cytrynianem sodu. Usuwanie
jonów wapnia może byd stosowane jedynie in
vitro, ponieważ obniżenie poziomu jonów wapnia
we krwi in vivo doprowadziłoby do tężyczki.
Można jednak użyd do transfuzji krwi
cytrynianowej, pod warunkiem że szybkośd
przetaczania nie jest zbyt duża.

Heparyny
Heparyna jest glikozaminoglikanem. Jest
wytwarzana i magazynowana wraz z histaminą
w ziarnistościach komórek tucznych, które
wystepują w szczególnie dużych ilościach w
wątrobie, płucach i błonie śluzowej jelit.
Biologiczne znaczenie endogennej heparyny
nie jest do kooca wyjaśnione.
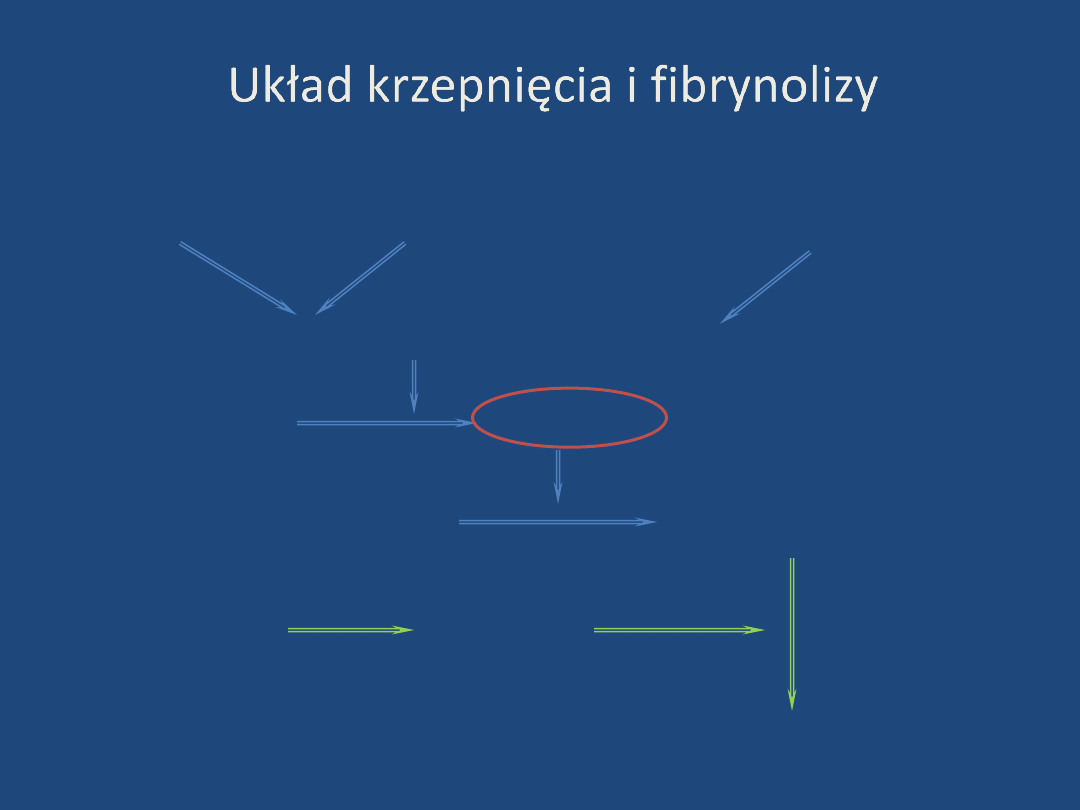
Układ krzepnięcia i fibrynolizy
aktywacja
wewnątrzpochodna
adhezja
i agregacja płytek
aktywacja
zewnątrzpochodna
aktywator protrombiny
protrombina
trombina
fibrynogen
monomery włóknika
plazminogen
plazmina
prod. degr. włóknika

Heparyny
Heparyna standardowa (heparyna
niefrakcjonowana , UFH) jest ekstrahowana z
błony śluzowej jelit świo lub z płuc krów,
aktywnośd biologiczna wynosi około 150 USP
jednostek/mg. Jednostka USP jest taką ilością
heparyny, która zapobiega skrzepnięciu 1 ml
cytrynianowego osocza owcy przez godzinę po
podaniu 0,2ml 1% CaCl₂.

Heparyny
Pozajelitowe podanie heparyny zapobiega
krzepnięciu krwi poprzez działanie na różne
miejsca układu krzepnięcia. Podstawowy
mechanizm działania polega na aktywacji
antytrombiny, która hamuje trombinę i inne
proteazy serynowe. Aktywacja antytrombiny
zachodzi dzięki pentasacharydowej strukturze
wewnątrz cząsteczki heparyny, która prowadzi
do zmian konformacji, a w rezultacie do
aktywacji antytrombiny.

Heparyny
Do zahamowania trombiny niezbędne jest
wytworzenie trójskładnikowego kompleksu
złożonego z heparyny, antytrombiny i
trombiny.
Antytrombina jest syntetyzowana w wątrobie i
krąży w osoczu. Hamuje ona zaktywowane
czynniki szlaku krzepnięcia, w tym trombinę,
czynniki Xa oraz Ixa.
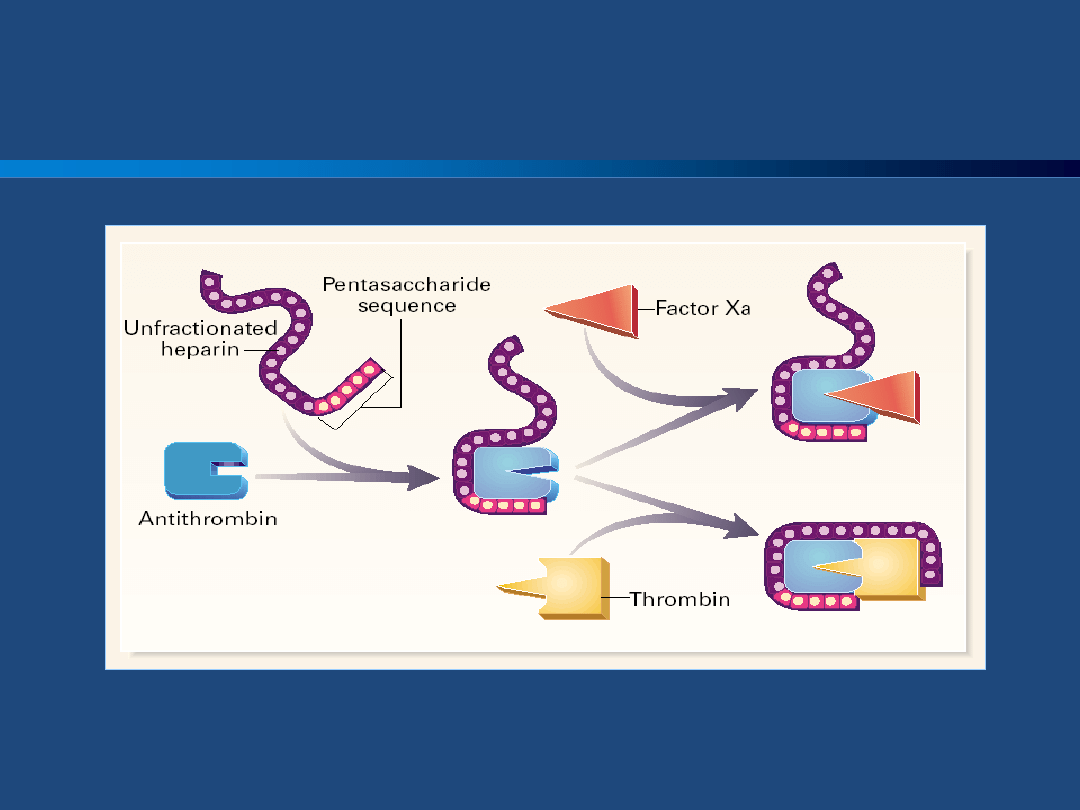
Weitz J, et al. N Engl J Med 1997
Heparyna niefrakcjonowana (UFH)

Heparyny
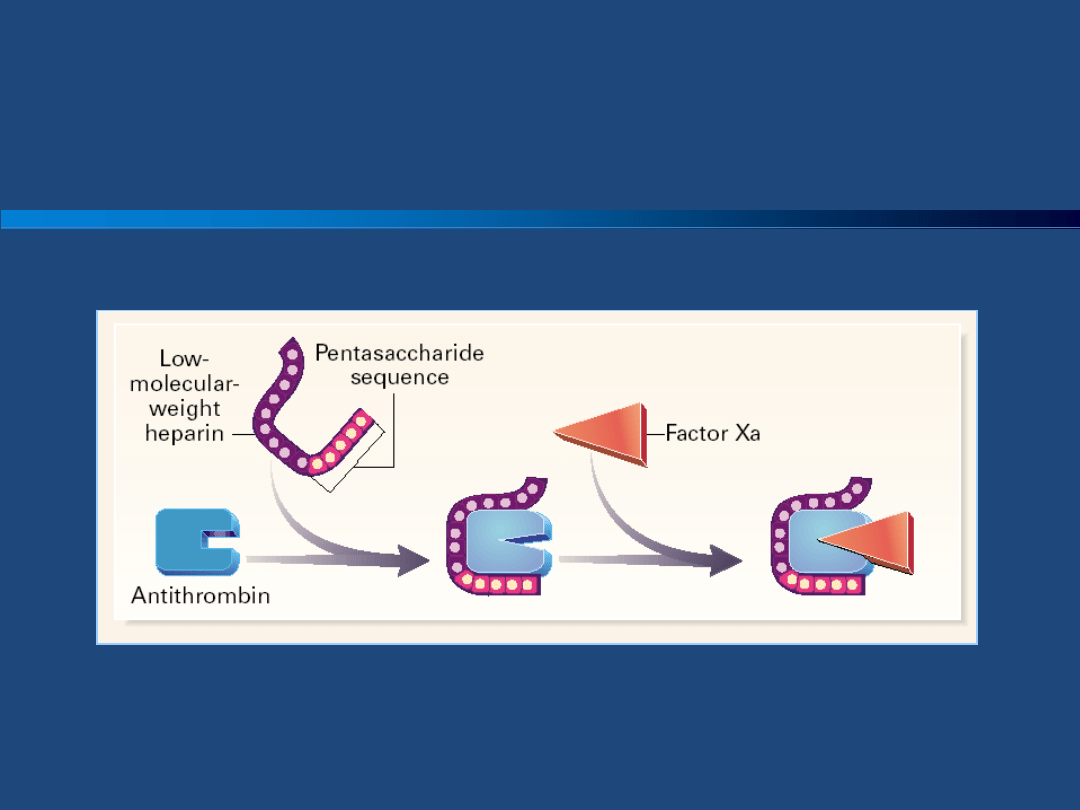
Heparyny drobnocząsteczkowe LMWH są
izolowane ze standardowych heparyn, różnią
się od heparyny standardowej i między sobą
właściwościami farmakokinetycznymi i
mechanizmem działania. LMWH różnią się od
heparyny standardowej przede wszystkim
tym, że ze względu na mniejsza długośd
łaocuchów hamują one głównie czynnik Xa.
Heparyny
Heparyna nie jest wchłaniana przez błonę śluzową
przewodu pokarmowego i dlatego jest podawana
drogą ciągłej infuzji dożylnej lub podskórnie.
Działanie heparyny może zostad szybko zniesione
przez siarczan protaminy. Jest to silnie zasadowe
białko, które inaktywuje heparynę, tworząc z nią
kompleksy. Siarczan protaminy stosuje się przy
powikłaniach wywołanych heparyną, pod koniec
zabiegów z wykorzystaniem krążenia
pozaustrojowego oraz po zakooczeniu transfuzji
wymiennej.
Heparyny drobnocząsteczkowe ( LMWH )
Weitz J, et al. N Engl J Med 1997
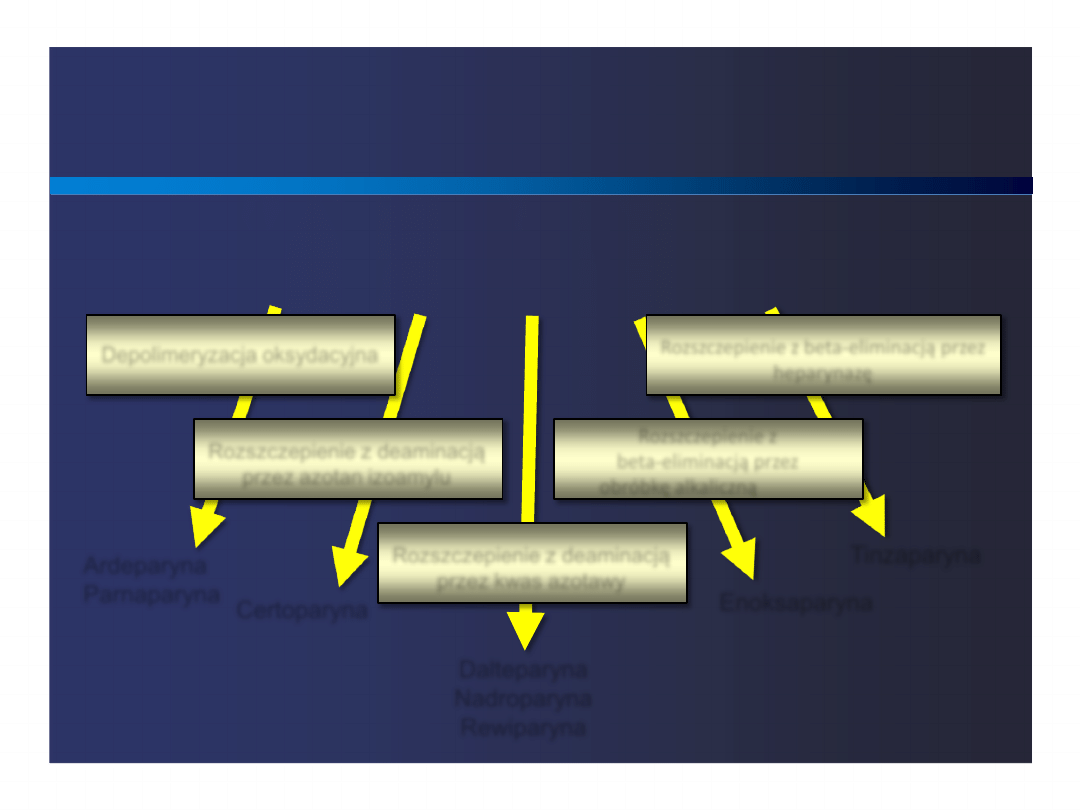
Ardeparyna
Parnaparyna
Heparyna niefrakcjonowana
Certoparyna
Dalteparyna
Nadroparyna
Rewiparyna
Enoksaparyna
Tinzaparyna
Lindhart & Gunay, SemThromb Hemost
1999; 25:5-16.
LMWH – metody wytwarzania
Depolimeryzacja oksydacyjna
Rozszczepienie z beta-eliminacją przez
heparynazę
Rozszczepienie z deaminacją
przez azotan izoamylu
Rozszczepienie z
beta-eliminacją przez
obróbkę alkaliczną
Rozszczepienie z deaminacją
przez kwas azotawy
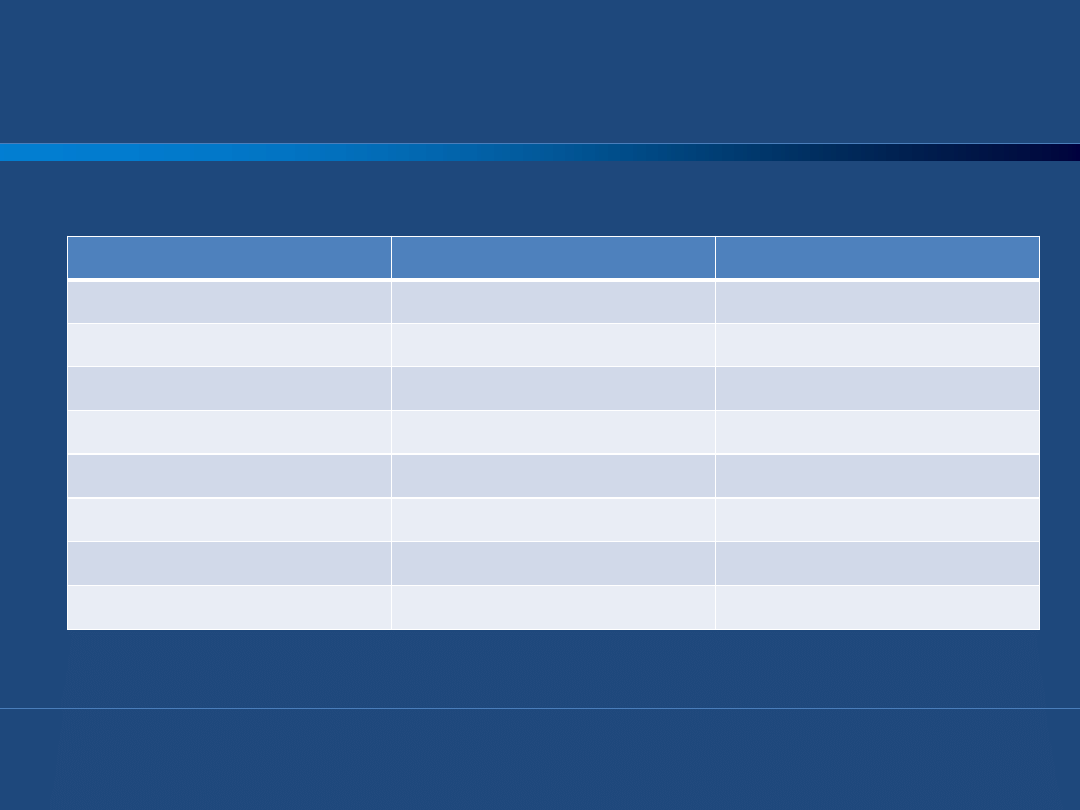
Farmakokinetyka UFH i LMWH
UFH
LMWH
masa cząsteczkowa
12000 – 15000 Da
8000 Da
okres półtrwania
1-2 godziny
4 -6 godzin
biodostępnośd
ok. 30%
90%
wpływ na APTT
( + )
( - )
monitorowanie
APTT
nie wymaga
anty-IIa/anty-Xa
1 : 1
1 : 2 - 4
droga eliminacji
nerki
nerki
droga podania
zwykle dożylnie
zwykle podskórnie

Zastosowania heparyn
drobnocząsteczkowych
Prewencja żylnej choroby zakrzepowo-zatorowej
Chirurgia ogólna
Ortopedia i chirurgia urazowa
Alternatywa doustnej antykoagulacji
Neurochirurgia – zabiegi na kręgosłupie
Leczenie zakrzepicy żył głębokich i zatorowości płucnej
Leczenie niestabilnej dusznicy bolesnej
i OZW bez uniesienia odcinka ST
Leczenie przeciwzakrzepowe podczas
angioplastyki tętnic wieocowych

Heparyny drobnocząsteczkowe
Główną przewagą heparyn drobnocząsteczkowych
nad standardowymi jest bardziej przewidywalny
profil farmakokinetyczny, który pozwala na
dostosowanie dawkowania podskórnego w
odniesieniu do masy ciała bez konieczności
monitorowania laboratoryjnego.
W odróżnieniu od warfaryny, heparyna nie przenika
przez łożysko i nie jest przyczyną deformacji
płodów; zatem jest to lek z wyboru w terapii
przeciwzakrzepowej u kobiet w ciąży.

Heparyny drobnocząsteczkowe
Preparaty:
Dalteparinum natricum Fragmin amp.
Enoxaparin sodium Lovenox
Enoxaparinum natricum Clexane, Clexane forte
Nadroparinum calcicum Fraxiparine
Parnaparinum natricum Fluxum
Reviparinum natricum Clivarin 1432

Heparyny
Działania niepożądane.
• krwawienie jest zasadniczym działaniem
niepożądanym heparyny.
• Trombocytopenia indukowana heparyną.
• Zaburzenia funkcji wątroby.
• Reakcje alergiczne (pokrzywka, nieżyt nosa)

Heparyny
Przeciwwskazania:
• Zwiększona skłonnośd do krwawieo
• Owrzodzenia przewodu pokarmowego
• Zagrażające poronienie
• Ciężkie schorzenia wątroby, nerek

Heparyny
Interakcje.
Równoczesne stosowanie środków hamujących
agregację trombocytów, a także niektórych
penicylin i cefalosporyn zwiększa ryzyko
wystąpienia krwawienia. Działanie heparyny
zmniejszają leki przeciwhistaminowe,
glikozydy nasercowe i tetracykliny.

Preparaty heparyny do stosowania
miejscowego
Na rynku dostępne są liczne preparaty zawierające heparynę do
stosowania miejscowego w przypadku zamkniętych urazów
sportowych i powypadkowych, zespołu żylakowatego, zakrzepicy
naczyo powierzchownych.
Esceven żel (heparinum +Hippocastani seminis exstractum siccum)
Haematoven żel (Escinum+Heparinum+Lecithinum)
Helason maśd(heparinum +Hyaluronidazum
Lioton żel
Aescin żel (Escinum+Diethylamini salicylas +Heparinum natricum)
Contractubex (Heparinum natricum+Allantoinum+Allii cepae
extractum)
Savarix żel (Benzocainum+Heparinum natricum+Hippocastani
intractum)
Tointex krem (Allantoinum+Heparinum)
Jakie kryteria decydują o wyborze LMWH ?
Właściwości
chemiczne
sprawiają,
że każda LMWH jest unikalna.
Przekłada się to na
farmakologiczne
różnice pomiędzy LMWH.
Ma to wpływ na bezpieczeostwo
kliniczne
i skutecznośd prowadzonego leczenia
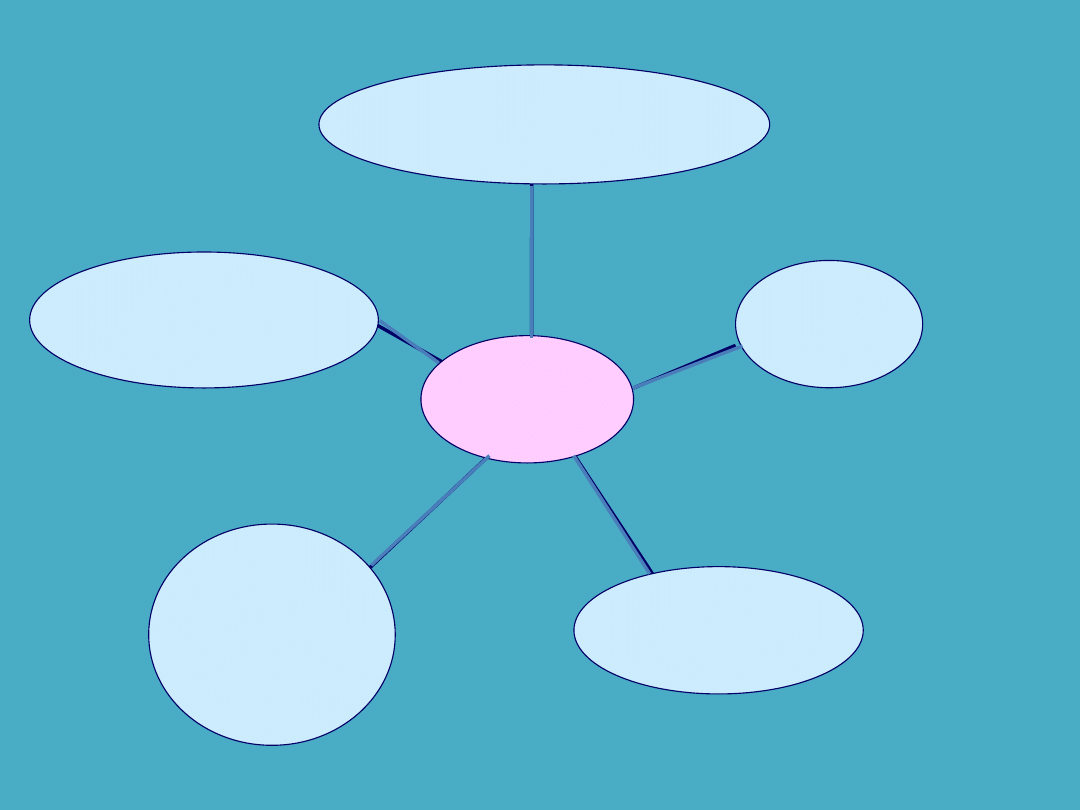
HEPARYNA
NIEFRAKCJONOWANA
BEZPOŚREDNIE
INHIBITORY
TROMBINY
PENTASACHARYDY
KUMARYNA
HEPARYNY
DROBNOCZĄSTECZKOWE
TROMBINA

Fondaparinuks
Fonfaparinuks ARIXTRA jest syntetycznym
pentasacharydem, który podobnie jak heparyna
drobnocząsteczkowa hamuje czynnik Xa, ale nie
wpływa hamująco na trombinę. Fondaparinuks
podawany w iniekcjach podskórnych osiąga
szczytowe stężenie w osoczu po 2 godzinach i jest
wydalany z moczem., a jego okres półtrwania
wynosi 17-21 godzin. Fondaparinuks wydaje się
w mniejszym stopniu niż heparyny wyzwalad
zespół indukowanej heparyną trombocytopenii.

Leki hamujące aktywnośd trombiny
Lekami hamującymi aktywnośd trombiny są:
Antytrombina III
Hirudyny i związki pokrewne
argatroban

Antytrombina III
Antytrombina III. Jest naturalnym inhibitorem
krzepnięcia krwi, syntetyzowanym w wątrobie.
Do celów leczniczych otrzymuje się ja z krwi
ludzkiej. Jej aktywnośd jest zwiększana przez
heparynę. W organizmie zapobiega powstawaniu
skrzepów krwi przez hamowanie aktywności
trombiny oraz czynnika Xa. Podawana jest we
wrodzonym lub nabytym jej niedoborze oraz
zapobiegawczo lub leczniczo w zespołach
zatorowo-zakrzepowych, w których heparyna jest
nieskuteczna.

Hirudyny
Naturalna hirudyna jest polipeptydem złożonym
z 65 aminokwasów, wydzielanym przez
gruczoły ślinowe pijawki lekarskiej. Wykazuje
działanie przeciwzakrzepowe, łącząc się
bezpośrednio z trombiną, i nie jest zależna w
działaniu farmakologicznym od antytrombiny
III. W odróżnieniu od heparyny nie wywołuje
trombocytopenii. Protamina nie znosi jej
działania przeciwzakrzepowego.

Hirudyny
Preparaty:
Lepirudyna
Desirudyna
Biwalirudyna- Angiomax
Ze względu na bezpośrednie i swoiste działanie na
trombinę są stosowane w zapobieganiu i leczeniu
zaburzeo zakrzepowo-zatorowych. Ich
wprowadzenie do lecznictwa stwarza szansę
uzupełnienia leczenia trombolitycznego w ostrym
zawale mięśnia sercowego i w czasie
angioplastyki naczyo wieocowych.
Wyszukiwarka
Podobne podstrony:
(41) Leki zwiększające krzepliwość
48 leki zwiększające krzepliwość
Leki zwiekszajace krzepliwosc k Nieznany
56 leki zwiększające krzepliwość
(41) Leki zwiększające krzepliwość
48 leki zwiększające krzepliwość
Leki zwiększające kurczliwość mięśnia sercowego
Leki hamujące krzepliwość krwi (antykoagulanty)
Kopia LEKI OBNIŻAJĄCE KRZEPLIWOŚĆ KRWI, farmakologia+++
W 37 Leki hamujące krzepliwość krwi i środki
7 Leki zwiększające siłę skurczu mięśnia sercowego1, 4farmacja, III koło
Kopia LEKI PODWYŻSZAJĄCE KRZEPLIWOŚĆ KRWI, farmakologia+++
LEKI ZWIĘKSZAJĄCE PRZEPŁYW WIEŃCOWY
Leki zwiększające kurczliwość mięśnia sercowego
więcej podobnych podstron