
KARDIOLOGIA PRAKTYCZNA
DLA LEKARZY RODZINNYCH
I STUDENTÓW MEDYCYNY
TOM IV
Część 1
ZABURZENIA RYTMU SERCA
Pod redakcją:
Mirosława Dłużniewskiego
Artura Mamcarza
Patryka Krzyżaka
AKADEMIA MEDYCZNA
WARSZAWA 2003

© Copyright by Mirosław Dłużniewski, Artur Mamcarz
& Patryk Krzyżak
ISBN 83-89517-13-2
Recenzent:
Prof. dr hab. n. med. Grzegorz Opolski
Druk i oprawa:
B-2 Sp. z o.o.
Projekt graficzny serii:
Urszula Janiszewska
Korekta:
Magdalena Zielonka
Katedra i Klinika Kardiologii
II Wydziału Lekarskiego Akademii Medycznej w Warszawie
ul. Kondratowicza 8, 03-242 Warszawa
tel.: (22) 326 58 24, fax: (22) 326 58 26
web site: www.amkard.waw.pl
e-mail: klinika@amkard.waw.pl

KARDIOLOGIA PRAKTYCZNA
DLA LEKARZY RODZINNYCH
I STUDENTÓW MEDYCYNY
TOM IV
Część 1
ZABURZENIA RYTMU SERCA

Autorzy:
Dr n. med. Wojciech Braksator
Lek. med. Ewa Burbicka
Lek. med. Marek Chmielewski
Lek. med. Agnieszka Cudnoch-Jędrzejewska
1
Lek. med. Katarzyna Cybulska
Prof. dr hab. n. med. Mirosław Dłużniewski
Lek. med. Włodzimierz Gierlak
Lek. med. Maciej Janiszewski
Lek. med. Małgorzata Kalinowska
Lek. med. Liliana Kostana
Lek. med. Edyta Kostarska-Srokosz
Dr n. med. Jarosław Król
Lek. med. Patryk Krzyżak
Prof. dr hab. n. med. Jerzy Kuch
Dr hab. n. med. Marek Kuch
Lek. med. Ewa Kucharczyk-Petryka
Lek. med. Andrzej Kurowski
2
Lek. med. Franciszek Majstrak
2
Dr hab. n. med. Artur Mamcarz
Dr n. med. Włodzimierz Mojkowski
Lek. med. Michał Moszczeński
Dr n. med. Witold Pikto-Pietkiewicz
Dr n. med. Jacek Sawicki
Lek med. Grzegorz Suwalski
2
Prof. dr hab. n. med. Kazimierz B. Suwalski
2
Lek. med. Piotr Suwalski
2
Dr n. med. Joanna Syska-Sumińska
Dr n. med. Edmund Szczepańczyk
Prof. dr hab. n. med. Ewa Szczepańska-Sadowska
1
Dr n. med. Andrzej Światowiec
Lek. med. Monika Tomaszewska-Kiecana
Lek. med. Karol Wrzosek

z Katedry i Kliniki Kardiologii II Wydziału Lekarskiego AM
1
z Katedry i Zakładu Fizjologii Doświadczalnej i Klinicznej AM
2
z Oddziału Klinicznego Kardiochirurgii I Katedry i Kliniki Kardiologii
AM w Warszawie


Szanowne Koleżanki, Szanowni Koledzy!
Nasi młodsi Koledzy Studenci!
Czwarty tom „Kardiologii Praktycznej” poświęcony jest „Zaburzeniom
rytmu serca”.
Arytmia serca, pomimo postępu medycyny, pozostaje wyzwaniem dla leka-
rzy praktyków. Jest ona najczęściej objawem choroby serca, ale zdarza się, że
jest związana z chorobą innego narządu i pozornie nie ma związku z sercem.
Dlatego też, aby skutecznie i co najważniejsze – bezpiecznie leczyć cho-
rych z zaburzeniami rytmu, trzeba dobrze poznać mechanizmy ich powsta-
wania, mieć wystarczające doświadczenie w diagnostyce i leczeniu chorób
dotyczących nie tylko układu krążenia. Postępująca specjalizacja spowodo-
wała, że także na tym polu coraz częściej koledzy koncentrują się na wybra-
nych problemach arytmii, na przykład na wszczepianiu stymulatorów, defi-
brylatorów serca, na ablacji ognisk arytmogennych lub wybranych badaniach
diagnostycznych. Tak jak choroby układu krążenia (kardiologia) stanowią
połowę interny, tak na pewno zaburzenia rytmu zajmują połowę lub więcej
kardiologii. Trudno tu wyliczyć choroby serca, które nie manifestowałyby się
arytmią.
Stąd znajomość mechanizmów, diagnostyki i leczenia arytmii jest nie-
odzowna w codziennym życiu nie tylko kardiologów, ale także kolegów inter-
nistów, lekarzy rodzinnych i innych podstawowych specjalności.
Przygotowując kolejne tomy „Kardiologii Praktycznej”, zapraszamy eks-
pertów do opracowania niektórych bardzo ważnych rozdziałów:
Komórkowe mechanizmy zaburzeń rytmu serca – bardzo ważny rozdział
napisany gościnnie przez panią profesor Ewę Szczepańską-Sadowską
i panią doktor Agnieszkę Cudnoch-Jędrzejewską, którym chciałbym po-
dziękować za kolejne już wsparcie następnego tomu „Kardiologii Prak-
tycznej” – bez wiedzy zespołu pani profesor wydania te byłyby znacznie
uboższe. Serdecznie dziękujemy!
Chciałbym zwrócić uwagę Czytelników na rozdziały poświęcone chirur-
gicznym metodom leczenia migotania przedsionków i tachyarytmii ko-
morowych – obydwa rozdziały opracował pan profesor Kazimierz Su-
walski z zespołem. To także kolejny już wkład pana profesora i jego
zespołu w realizację następnych tomów wydania, poparte jakże znako-
mitym udziałem w wykładach „Podyplomowej Szkoły Kardiologicznej”
– jeszcze raz we własnym imieniu oraz licznych „wielbicieli” kardiochi-
rurgii – dziękujemy.
1

Sprawiedliwie trzeba podkreślić, także i tym razem, duże zaangażowanie
całego zespołu naszej Katedry w opracowaniu wielu bardzo praktycznych
wskazówek dla lekarzy spotykających na swojej drodze pacjenta z zaburze-
niami rytmu.
Koleżanki i Koledzy Studenci!
Pamiętam z zajęć w klinice, iż zaburzenia rytmu serca są zagadnieniem,
które z jednej strony bardzo Was interesuje, z drugiej wielokrotnie podkre-
ślacie, iż trudno to zrozumieć i jeszcze trudniej opanować umiejętność wy-
ciągania klinicznych wniosków. Otóż kolejny tom „Kardiologii Praktycznej”
powinien Wam to znakomicie ułatwić. Co więcej, mało jest takich propozy-
cji, które w jednym opracowaniu przedstawiają znakomitą większość zagad-
nień „arytmologii”. Podkreślam to często na zajęciach, a także pisząc kilka
słów przed kolejnymi tomami, iż warto zainteresować się kardiologią. Po-
stęp jaki dokonał się w rozumieniu mechanizmów zaburzeń rytmu, a przede
wszystkim w ich diagnostyce i leczeniu powoduje, że jesteśmy coraz bardziej
skuteczni i zapewniamy naszym pacjentom normalne życie. NAPRAWDĘ
WARTO zająć się kardiologią – ten tom powinien Was do tego zachęcić.
Dobrej lektury i ciekawych przemyśleń
Prof. dr hab. n. med. Mirosław Dłużniewski
2

PS
Kolejny już tom „Kardiologii Praktycznej” ukazał się dzięki niezawodnej
pomocy i wsparciu firmy Schwarz Pharma – kolejny raz za to „długodystan-
sowe” wsparcie dziękujemy i do... kolejnego tomu.
Jeszcze raz dziękujemy naszym Gościom za kolejny już udział w uatrak-
cyjnianiu naszych opracowań:
Pani prof. dr hab. n. med. Ewie Szczepańskiej-Sadowskiej
Pani dr Agnieszce Cudnoch-Jędrzejewskiej
Panu prof. dr. hab. n. med. Kazimierzowi B. Suwalskiemu
Panu dr. Franciszkowi Majstrakowi
Panu dr. Grzegorzowi Suwalskiemu
Panu dr. Andrzejowi Kurowskiemu
Panu dr. Piotrowi Suwalskiemu
Chciałbym także bardzo serdecznie podziękować panu prof. dr. hab. n. med.
Grzegorzowi Opolskiemu za trud włożony w recenzję tego tomu.
Prof. dr hab. n. med. Mirosław Dłużniewski
3

4
SPIS TREŚCI
Część 1
1. Komórkowe mechanizmy zaburzeń rytmu serca
Ewa Szczepańska-Sadowska, Agnieszka Cudnoch-Jędrzejewska
7
2. Badania diagnostyczne w rozpoznawaniu, prognozowaniu
i ocenie skuteczności leczenia zaburzeń rytmu serca
– standard postępowania
Jarosław Król, Mirosław Dłużniewski
35
3. Elektrokardiogram spoczynkowy w diagnostyce
zaburzeń rytmu
Andrzej Światowiec, Artur Mamcarz
44
4. Bloki przedsionkowo-komorowe
Jacek Sawicki, Monika Tomaszewska-Kiecana,
Jarosław Król
65
5. Bloki śródkomorowe – zaburzenia przewodzenia
śródkomorowego
Monika Tomaszewska-Kiecana, Jarosław Król,
Jacek Sawicki
73
6. Badanie EKG metodą Holtera – ugruntowana pozycja
w diagnostyce arytmii
Jarosław Król, Monika Tomaszewska-Kiecana
84
7. Znaczenie testu wysiłkowego w diagnostyce zaburzeń
rytmu serca
Artur Mamcarz, Maciej Janiszewski, Andrzej Światowiec
93
8. Echokardiografia w diagnostyce zaburzeń rytmu serca
– na ile przydatna?
Wojciech Braksator, Marek Kuch
109
9. Badanie elektrofizjologiczne – czy najważniejsze
w diagnostyce arytmii?
Michał Moszczeński, Włodzimierz Mojkowski,
Mirosław Dłużniewski
118
10. Późne potencjały komorowe
Andrzej Światowiec, Mirosław Dłużniewski
127
11. Analiza zmienności rytmu serca – narzędzie badań
naukowych, czy rzeczywisty wskaźnik zagrożenia?
Ewa Kucharczyk-Petryka, Jarosław Król
133

12. Dyspersja QT – czy przydatna dla lekarza praktyka?
Marek Chmielewski, Artur Mamcarz
138
13. Zastosowanie testu pochyleniowego w diagnostyce
zaburzeń rytmu serca
Katarzyna Cybulska, Liliana Kostana, Mirosław Dłużniewski
147
14. Kardiosystem
Jarosław Król
154
15. Wskazania do wszczepienia stymulatora serca
Michał Moszczeński, Włodzimierz Mojkowski,
Mirosław Dłużniewski
161
16. Rodzaje stałej elektrostymulacji serca
Michał Moszczeński, Włodzimierz Mojkowski,
Mirosław Dłużniewski
167
17. Wybór właściwego rodzaju stymulacji
Michał Moszczeński, Włodzimierz Mojkowski,
Mirosław Dłużniewski
174
18. Wszczepienie stymulatora serca i opieka nad pacjentem
po implantacji rozrusznika
Michał Moszczeński, Włodzimierz Mojkowski,
Mirosław Dłużniewski
179
19. Typowe zapisy EKG u pacjentów ze wszczepionym
stymulatorem serca
Michał Moszczeński, Włodzimierz Mojkowski,
Mirosław Dłużniewski
189
5

6

I.
KOMÓRKOWE MECHANIZMY ZABURZEŃ
RYTMU SERCA
Ewa Szczepańska-Sadowska, Agnieszka Cudnoch-Jędrzejewska
Prawidłowa praca serca jest wynikiem skoordynowanego przepływu bodź-
ców elektrycznych przez układ bodźcoprzewodzący i mięsień sercowy. Czyn-
ność elektryczna serca rozpoczyna się w sposób spontaniczny i rytmiczny
w węźle zatokowo-przedsionkowym (S-A) znajdującym się w prawym przed-
sionku. Stąd pobudzenie szerzy się na cały mięsień przedsionka, dociera do
węzła przedsionkowo-komorowego (A-V), gdzie ulega opóźnieniu, a następ-
nie przechodzi przez układ His-Purkinjego, aby wreszcie dotrzeć do mięśnia
komór.
Podstawę informacji elektrycznej stanowi potencjał czynnościowy przewo-
dzony przez kolejne części układu bodźcoprzewodzącego i mięsień sercowy.
W mięśniu sercowym pobudzenie szerzy się z komórki zdepolaryzowanej na
sąsiadujące z nią komórki. Depolaryzacja komórek mięśnia sercowego za-
początkowuje sprzężenie elektromechaniczne wyzwalające skurcz pojedyn-
czych miocytów. Proces ten w warunkach prawidłowych przebiega w sposób
ściśle uporządkowany, zapewniający ekonomiczną pracę serca.
Zaburzenia przewodzenia w układzie bodźcoprzewodzącym serca lub po-
wstające poza tym układem pobudzenia dodatkowe powodują zaburzenia
rytmu serca (arytmie). Stanowią one jeden z częściej spotykanych proble-
mów w praktyce klinicznej. Mogą objawiać się w sposób łagodny, np. uczu-
ciem kołatania serca czy duszności, ale mogą także prowadzić do nagłego
zgonu sercowego. Zrozumienie patomechanizmów leżących u podłoża za-
burzeń rytmu serca stanowi podstawę zarówno dla ich diagnostyki, jak i le-
czenia. W niniejszym rozdziale zostanie omówiony mechanizm i kolejne eta-
py transmisji pobudzenia elektrycznego w układzie bodźcoprzewodzącym
i w mięśniu sercowym oraz ich zaburzenia w stanach patologicznych.
STRUKTURA I FUNKCJE BŁON KOMÓRKOWYCH
MIOCYTÓW SERCA
Błony komórkowe miocytów serca (kardiomiocytów) są zbudowane z po-
dwójnej warstwy fosfolipidów poprzecinanych białkami integralnymi i struk-
turalnymi. Błona komórkowa łatwo przepuszcza związki rozpuszczalne
w tłuszczach. Pozostałe związki są transportowane w sposób aktywny lub
bierny za pośrednictwem wyspecjalizowanych białek transportujących. Dla-
tego też tworzy ona barierę efektywnie ograniczającą przenikanie niepożą-
7
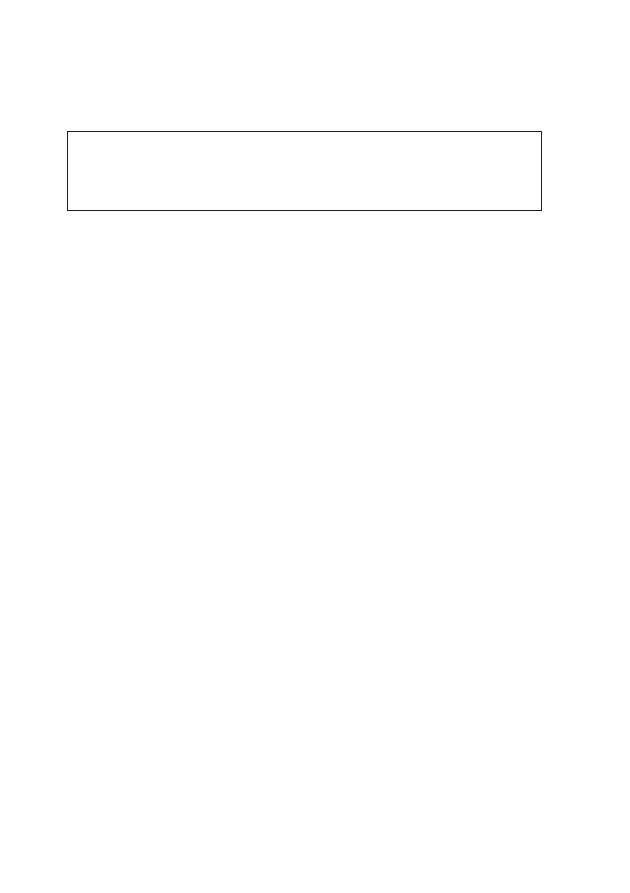
danych cząsteczek i jonów. U podstaw prawidłowego przebiegu pobudzenia
w mięśniu sercowym leży odpowiedni transport jonów. Do białek odpowie-
dzialnych za prawidłowość transportu jonów w mięśniu sercowym należą:
Głównymi elementami odpowiedzialnymi za generowanie potencjału elek-
trochemicznego w poprzek błony komórkowej są ATP-azy. Energia dla
transportu jonów pochodzi z rozkładu ATP. Najważniejszą ATP-azą sarkole-
my miocytów serca jest pompa sodowo-potasowa transportująca 3 jony Na
+
z komórki na zewnątrz oraz wprowadzająca podczas tego samego cyklu 2 jo-
ny K
+
do komórki. Aktywacja pompy umożliwia wykorzystanie energii po-
wstającej podczas hydrolizy wiązań fosforanowych ATP w potencjalną ener-
gię skierowanego dokomórkowo gradientu stężeń Na
+
. Energia ta jest
bezpośrednio wykorzystana przez wymienniki i kanały jonowe, przez które
przepływ jonów odbywa się zawsze zgodnie z różnicą potencjałów elektro-
chemicznych. Prawidłowa funkcja ATP-azy Na
+
/K
+
wytwarza odpowiedni
gradient elektrochemiczny i warunkuje właściwe funkcjonowanie kolejnych
grup białek odpowiedzialnych za transport bierny. Przykładem wymienni-
ków jonowych wykorzystujących wyżej opisany gradient sodowy jest układ
3Na
+
/Ca
2+
, umożliwiający odkomórkowy transport jonów wapnia wbrew je-
go gradientowi stężeń. Innym ważnym transporterem jest wymiennik
Na
+
/H
+
, który wykorzystuje wytworzony przez pompę sodowo-potasową
gradient dla jonów sodu do wprowadzenia do komórki jonu sodu i jedno-
czesnego usuwania jonu wodoru. Aktywność pompy sodowo-potasowej
wzrasta pod wpływem wzrostu stężenia jonów sodu wewnątrz komórki i jo-
nów potasu w przestrzeni zewnątrzkomórkowej. Na aktywność pompy ma
również wpływ wiele związków biologicznie czynnych. Trójjodotyronina i al-
dosteron zwiększają syntezę pomp sodowo-potasowych i ich aktywność, na-
tomiast noradrenalina, adrenalina, insulina, angiotensyna II i wazopresyna
aktywują pompę sodowo-potasową. Istnieją również naturalne inhibitory
ATP-azy Na
+
/K
+
. Należą do nich tzw. czynniki quabainopodobne, dawniej
określane nazwą hormonu natriuretycznego oraz dopamina.
Wszelkie zakłócenia w pracy pompy sodowo-potasowej prowadzące do
spadku gradientu sodowego mają ujemny wpływ na odkomórkowy transport
Ca
2+
. Jest to widoczne np. przy zatruciu preparatami glikozydów naparstni-
cy, które blokują działanie ATP-azy Na
+
/K
+
. Pompa wapniowa błony ko-
• ATP-azy odpowiedzialne za transport aktywny jonów;
• kanały i wymienniki jonowe odpowiedzialne za transport
bierny jonów.
8

mórkowej jest ATP-azą transportującą jeden jon wapnia z komórki do prze-
strzeni zewnątrzkomórkowej i wprowadzającą jednocześnie jeden jon wo-
doru do komórki. Pompa wapniowa umiejscowiona w błonie siateczki sar-
koplazmatycznej transportuje jedynie jony wapnia. Do najważniejszych
czynników aktywujących pompy wapniowe należą wzrost stężenia jonów
wapnia w cytoplazmie, kalmodulina i kinazy białkowe A i C. Kinaza A jest
aktywowana przez związki biologicznie czynne aktywujące cyklazę adenylo-
wą i zwiększające w komórce zawartość cAMP (np. noradrenalina, adrena-
lina, glukagon). Kinaza C jest natomiast aktywowana przez związki pobu-
dzające fosfolipazę C i zwiększające w komórce zawartość jonów wapnia.
Należą do nich m.in. katecholaminy, angiotensyna II, endotelina, wazopre-
syna. Związkiem silnie hamującym aktywność pompy wapniowej transpor-
tującej jony wapnia do siateczki sarkoplazmatycznej jest nieufosforylowany
fosfolamban. Kinazy białkowe A i C fosforylują fosfolamban i w ten sposób
usuwają jego hamujący wpływ na aktywność pompy wapniowej. Umożliwia
to aktywny wychwyt jonów wapnia przez siateczkę sarkoplazmatyczną.
Kanały jonowe są białkami umożliwiającymi przepływ jonów przez błonę
komórkową tylko na zasadzie dyfuzji prostej, a więc zgodnie z gradientem
elektrochemicznym dla danego jonu. Aktywacja kanałów sodowych i wap-
niowych powoduje dokomórkowy przepływ tych jonów przez sarkolemę i de-
polaryzację, a aktywacja kanałów potasowych przepływ odkomórkowy jonów
potasu i hiperpolaryzację. Kanały jonowe miocytów serca można podzielić
na różne klasy. W zależności od wybiórczej przewodności mówimy o kana-
łach sodowych, potasowych, wapniowych lub chlorowych, wśród których wy-
stępują liczne podgrupy. Natomiast opierając się na mechanizmie aktywacji,
możemy wyróżnić kanały potencjałozależne, sprzężone z receptorem czy też
mechaniczne, tzn. regulowane stopniem rozciągnięcia błony komórkowej.
Kanały sodowe, wapniowe i potasowe, które biorą udział w generacji po-
tencjału czynnościowego stanowią reprezentację kanałów regulowanych po-
tencjałem. Warto jednak zwrócić uwagę, że aktywność tych kanałów (zwłasz-
cza wapniowych i potasowych) może być również modulowana przez związki
biologicznie czynne. Aktywacja nieselektywnych kanałów wrażliwych na roz-
ciąganie błony komórkowej odgrywa prawdopodobnie istotną rolę w deter-
minowaniu podatności na powstawanie pobudzeń dodatkowych.
Dzięki aktywności pompy sodowo-potasowej i pomp wapniowych oraz
specyficznej przepuszczalności błony komórkowej dla poszczególnych jonów
jest możliwe utrzymywanie w komórce serca ujemnego potencjału błonowe-
go w okresach między pobudzeniami. Stężenie jonów sodu i wapnia jest jed-
nocześnie znacznie niższe, a stężenie jonów potasu znacznie wyższe w ko-
mórce niż poza komórką (ryc. 1).
9
ELEKTROFIZJOLOGIA SERCA
Wszelkie zjawiska elektrofizjologiczne zachodzące w sercu stanowią po-
chodną zmian czynnościowych zachodzących w błonach komórkowych mio-
cytów.
Na nich opiera się ważna życiowo funkcja, jaką stanowi przewodzenie
w układzie bodźcoprzewodzącym serca, narzucająca rytm całemu sercu oraz
sprzężenie elektromechaniczne, początkujące skurcz miocytów.
Zjawiska elektrofizjologiczne stanowią podstawę licznych testów diagno-
stycznych (elektrokardiografia, stymulacja przezprzełykowa), umożliwiają-
cych identyfikację miejsca i mechanizmu powstawania zaburzeń rytmu serca.
Miocyty serca
Ze względu na zdolność generowania i przewodzenia potencjałów czyn-
nościowych komórki serca można podzielić na trzy grupy:
U podłoża wszelkich elektrycznych procesów, niezależnie od rodzaju ko-
mórki leżą potencjał spoczynkowy i czynnościowy.
• komórki rozrusznikowe;
• komórki wyspecjalizowane w szybkim przewodzeniu, do których
należą komórki Purkinjego;
• komórki mięśnia sercowego, tzw. komórki robocze.
Rycina 1: Schemat najważniejszych dla funkcji miocytu serca białek transportujących jony
przez błonę komórkową
10

• Potencjał spoczynkowy
Potencjał spoczynkowy jest to przezbłonowy gradient ładunków elektrycz-
nych występujący w tzw. stanie spoczynku komórki. W czasie spoczynku po
stronie wewnętrznej (dokomórkowej) błony komórkowej znajduje się więk-
sza liczba ładunków ujemnych niż po stronie zewnętrznej. Nierównomierne
rozłożenie ładunków po obu stronach błony nazywane jest stanem polary-
zacji błony. Potencjał spoczynkowy wynosi odpowiednio dla komórek mię-
śnia komory -90 mV. Jest on bardziej ujemny niż w komórkach układu bodź-
coprzewodzącego serca, gdzie w węźle zatokowo-przedsionkowym wynosi
on -65 mV, a w komórkach Purkinjego -80 mV.
O obecności i amplitudzie potencjału spoczynkowego decydują następu-
jące procesy:
W warunkach fizjologicznych bodziec ponadprogowy działający na spola-
ryzowaną komórkę mięśnia sercowego wytwarzany jest przez komórki wę-
zła zatokowo-przedsionkowego układu bodźcoprzewodzącego serca. Bo-
dziec taki docierając do kardiomiocytów serca, zmienia przepuszczalność ich
błony komórkowej dla jonów Na
+
, co doprowadza do zmniejszenia wartości
ujemnego potencjału spoczynkowego do około -65 mV. Wartość ta nazywa-
na jest potencjałem progowym. Doprowadzenie błony komórkowej do po-
tencjału progowego powoduje otwarcie znacznej liczby kanałów sodowych,
gwałtowny napływ jonów Na
+
do wnętrza komórki i w następstwie szybką
oraz całkowitą depolaryzację błony komórkowej, a nawet odwrócenie po-
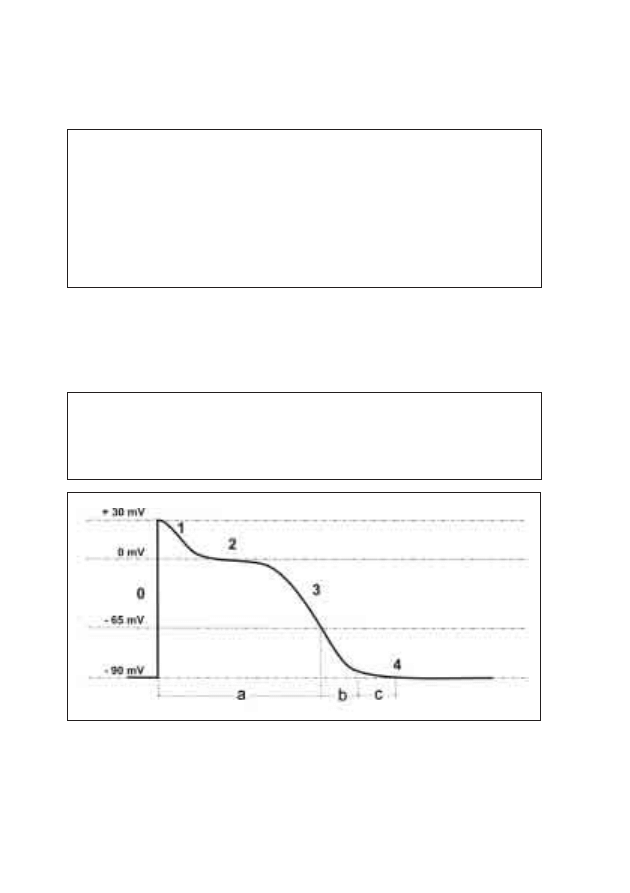
tencjału do wartości dodatnich. Okres ten nazywany jest fazą 0 potencjału
czynnościowego (ryc. 2). Po niej następuje faza 1, podczas której ma miejsce
szybka wstępna repolaryzacja spowodowana otwarciem kanałów potasowych
i
to
. Depolaryzacja komórki stwarza również korzystne warunki do napływu
jonów Cl
-
. W zewnętrznych i środkowych warstwach mięśnia sercowego
w fazie 1 występuje niewielkie wcięcie w dół na krzywej potencjału czynno-
ściowego. W fazie 2, tzw. fazie plateau, repolaryzacja ulega bardzo wyraźne-
• przewaga w komórce anionów (fosforany i ujemnie naładowane
cząsteczki białka) nad kationami, którymi są głównie jony potasu;·
• bardzo słaba przepuszczalność błony komórkowej dla jonów Na
+
na drodze dyfuzji prostej, przy znacznie większej
przepuszczalności dla jonów K
+
;
• działanie pompy sodowo-potasowej;
• brak bodźca zwiększającego przepuszczalność błony komórkowej
dla jonów.
11

mu zwolnieniu, a potencjał czynnościowy utrzymuje się na stałym poziomie.
Jest to możliwe dzięki dwóm jednocześnie zachodzącym procesom: zmniej-
szeniu przewodności kanałów potasowych dla prądu niesionego przez te jo-
ny oraz zwiększeniu przewodności kanałów wapniowych. Depolaryzacja bło-
ny komórkowej stwarza dogodne warunki dla ucieczki jonów potasu
z komórki. Zarówno gradient stężeń, jak i depolaryzacja błony komórkowej
powodują, że gradient elektrochemiczny staje się wyjątkowo korzystny dla
usuwania jonów K
+
z komórki. Jednocześnie jednak właściwości prostowni-
cze kanałów potasowych, zwłaszcza kanałów prądu I
K1
, powodują, że po
osiągnięciu przez potencjał błonowy wartości dodatnich ich przewodność
gwałtownie maleje i wzrasta ponownie dopiero po ponownym obniżeniu się
potencjału błonowego do wartości bardziej ujemnych niż -30 mV. Kanały,
przez które przepływają inne prądy potasowe (i
to
, I
K
) mają słabsze właści-
wości prostownicze, co umożliwia przepływ przez nie pewnej liczby jonów,
jednak kanały IK są aktywowane po długim czasie utajenia. Pełna aktywa-
cja tych kanałów ma miejsce dopiero w fazie 3. Istniejący w fazie 2 prąd po-
tasowy jest równoważony przez prąd wapniowy. Depolaryzacja błony komór-
kowej powoduje otwarcie kanałów wapniowych zależnych od potencjału.
Najważniejszą rolę dla prawidłowego przebiegu depolaryzacji w mięśniu ser-
cowym mają kanały wapniowe typu L. Są one otwierane przy potencjale bło-
nowym mniej ujemnym niż -30 mV, a ich aktywacja przebiega bardzo powoli.
Przewodność tych kanałów jest dodatkowo wzmacniana przez działanie
związków pobudzających receptory beta-adrenergiczne (noradrenalina, izopro-
terenol) i inne związki zwiększające poziom cAMP w komórce, a hamowana
podczas pobudzenia receptorów muskarynowych acetylocholiny. Przewod-
ność kanałów L jest hamowana przez antagonistów kanałów wapniowych
(diltiazem, werapamil). Czas trwania fazy plateau zależy zarówno od prze-
wodności dla jonów potasu, jak i dla jonów wapnia. Jony wapnia napływają-
ce do komórki mięśnia sercowego w fazie 2 biorą również udział w proce-
sach skurczu mięśnia sercowego. Wszystkie związki ułatwiające lub
utrudniające napływ jonów wapnia do kardimiocytów mają więc wpływ nie
tylko na czas trwania, ale również i na efektywność sprzężenia elektrome-
chanicznego i kurczliwość mięśnia sercowego.
W 3 fazie potencjału czynnościowego prądy repolaryzacyjne przeważają
nad depolaryzacyjnymi, co powoduje stosunkowo szybki powrót potencjału
czynnościowego do wartości spoczynkowych. Jest to związane z pełną akty-
wacją kanałów prądów I
K
i kanałów i
to
. Inaktywacja kanałów wapniowych
oraz wypływ jonów potasu powodują stopniowe obniżenie potencjału błono-
wego. Obniżenie potencjału do wartości -30 mV powoduje ponowne uaktyw-
nienie się kanałów I
K1
i przyspieszenie procesu repolaryzacji. W fazie 4 na-
12
stępuje przywrócenie spoczynkowych stężeń jonów sodu, potasu i wapnia po
obu stronach błony komórkowej. Sód usuwany jest przez pompę sodowo-
-potasową, która jednocześnie wprowadza do komórki jony potasu. Aktyw-
ność ATP-azy Na
+
-K
+
wzrasta na skutek zwiększenia stężenia jonów sodu
w komórce i potasu na zewnątrz komórki. Pełna aktywność pompy ujawnia
się w fazie 4 ze względu na długą stałą czasową aktywacji pompy. Wapń usu-
wany jest przez wymiennik Ca
2+
/3Na
+
oraz przez pompę sodowo-potasową.
Czas trwania tej fazy i wartość potencjału spoczynkowego zależy od często-
tliwości pobudzeń napływających z układu przewodzącego serca i efektyw-
ności mechanizmów transportujących jony. W stanach patologicznych im-
puls pobudzający może pojawić się przedwcześnie. Efektywność procesów
transportujących jony w fazie 3 i 4 ma wówczas decydujące znaczenie
w określaniu zdolności kardiomiocytów do wytworzenia dodatkowego po-
tencjału czynnościowego.
• Potencjał czynnościowy
FAZA 0 – szybka depolaryzacja
– zależna od szybkiego dośrodkowego prądu sodowego.
FAZA 1 – wstępna szybka repolaryzacja
– spowodowana przesunięciem jonów Cl
-
do wnętrza komórki,
a jonów K
+
do przestrzeni zewnątrzkomórkowej.
FAZA 2 – powolna repolaryzacja tzw. plateau potencjału czynnościowego
– stabilizacja potencjału czynnościowego jako efekt równowagi
pomiędzy wolnym dokomórkowym prądem wapniowo-so-
dowym i odśrodkowymi prądami potasowymi.
FAZA 3 – szybka repolaryzacja
– przewaga odkomórkowego prądu potasowego nad wygasającym
dokomórkowym prądem wapniowo-sodowym.
FAZA 4 – polaryzacja – potencjał spoczynkowy
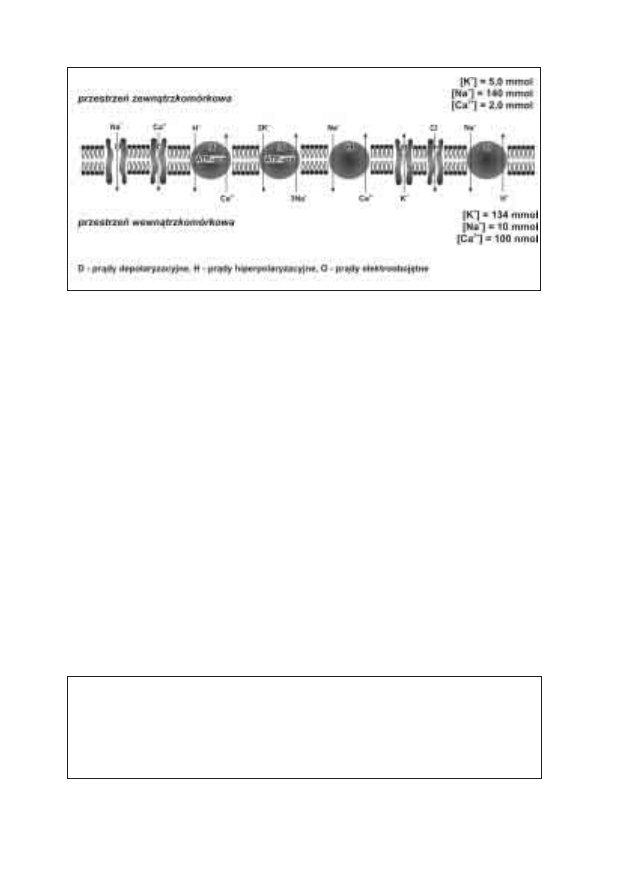
Rycina 2: Fazy potencjału czynnościowego: a) komórka mięśnia przedsionka
b) komórka rozrusznikowa węzła S-A c) komórka mięśnia komory
13
W trakcie trwania potencjału czynnościowego komórka mięśnia sercowe-
go ma ograniczoną zdolność do reagowania na kolejne bodźce. Okres ten
nazwano refrakcją. Wyróżniamy okres refrakcji bezwzględnej i względnej:
Długość trwania okresu refrakcji wynosi odpowiednio 150-200 ms dla mię-
śnia przedsionków, 200-300 ms dla komór, 300-400 ms dla włókien Purkinjego.
Istnieje także okres wzmożonej wrażliwości na bodźce nazywany okresem
nadwrażliwości:
Komórki mięśnia sercowego są połączone za pomocą synaps elektrycz-
nych tzw. wstawek, umożliwiających rozprzestrzenianie się potencjału czyn-
nościowego w całym sercu. Wstawki zawierają większą liczbę kanałów jono-
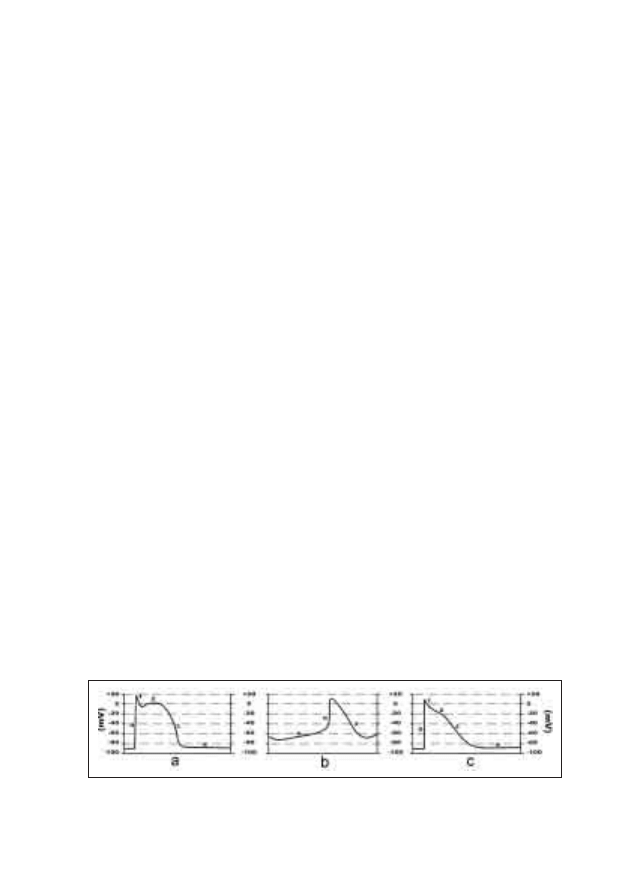
Rycina 3: Refrakcja a fazy potencjału czynnościowego a) refrakcja bezwzględna
b) refrakcja względna c) faza ranliwa
Okres nadwrażliwości (faza ranliwa) odpowiada:
• końcowemu okresowi fazy 3 i początkowi fazy 4;
• zapis EKG – ramię zstępujące załamka T.
Okres refrakcji bezwzględnej:
• obejmuje fazę 0, 1, 2 i część fazy 3;
• brak wrażliwości na jakikolwiek bodziec.
Okres refrakcji względnej:
• faza 3;
• wrażliwość jednie na bardzo silne bodźce.
14
wych. Zapewnia to elektryczną ciągłość komórek. W warunkach prawidło-
wych proces depolaryzacji rozprzestrzenia się w sposób ściśle uporządkowa-
ny. Po pobudzeniu węzła zatokowo-przedsionkowego zostaje ona przekaza-
na komórkom mięśnia przedsionka, a następnie do pozostałych części
układu bodźcoprzewodzącego. Mięsień komór zostaje pobudzony za pośred-
nictwem włókien Purkinjego. Najwcześniej zostaje pobudzona środkowa
i dolna część przegrody międzykomorowej, a najpóźniej koniuszek i warstwy
podnasierdziowe mięśnia komór serca.
Układ bodźcoprzewodzący serca
Wytwarzanie bodźców elektrycznych w sercu zależy od wewnętrznego au-
tomatyzmu wyspecjalizowanych komórek mięśnia sercowego, tzw. komórek
rozrusznikowych.
Automatyzm ten polega na zdolności komórki do spontanicznego osiąga-
nia potencjału progowego, co doprowadza do powstania potencjału czynno-
ściowego. Zjawisko to nazwano powolną spoczynkową depolaryzacją.
Powyższą właściwość posiadają w warunkach fizjologicznych jedynie te ko-
mórki serca, które tworzą układ bodźcoprzewodzący. W skład tego układu
wchodzą:
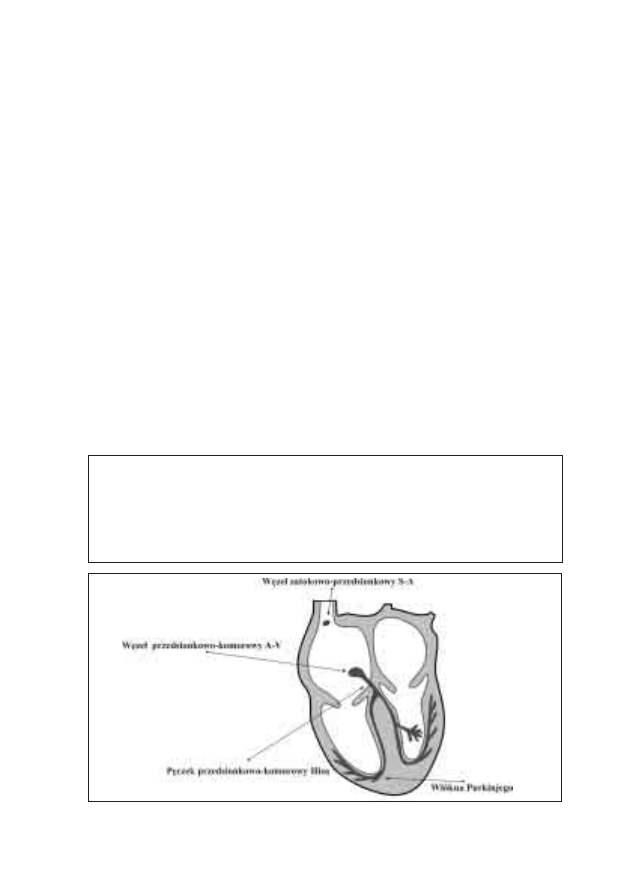
Rycina 4: Budowa układu bodźcoprzewodzącego serca
• węzeł zatokowo-przedsionkowy (S-A);
• węzeł przedsionkowo-komórkowy (A-V);
• pęczek przedsionkowo-komorowy, tzw. pęczek Hisa;
• włókna Purkinjego.
15
Nadrzędną częścią układu bodźcoprzewodzącego serca jest węzeł zatoko-
wo-przedsionkowy. Generowanie impulsów stanu czynnego w tym węźle na-
zywamy automatyzmem fizjologicznym serca. Pozostałe komórki układu
bodźcoprzewodzącego i komórki mięśnia sercowego, tzw. komórki robocze
serca, mogą wykazywać zdolność do automatyzmu jedynie w warunkach nie-
fizjologicznych. Jest to tzw. automatyzm patologiczny serca.
Istnieją także inne mechanizmy pobudzeń w sercu, takie jak aktywność
wymuszona czy sprzężenie mechaniczno-elektryczne, które dotyczą jednak
tylko chorobowo zmienionych komórek.
Komórki rozrusznikowe układu bodźcoprzewodzącego serca posiadają
wewnętrzny automatyzm dzięki obecności wyspecjalizowanych kationowych
kanałów jonowych, tzw. kanałów rozrusznikowych odpowiedzialnych za zja-
wisko powolnej spoczynkowej depolaryzacji. Mechanizm jonowy leżący
u podstaw powolnej spoczynkowej depolaryzacji zostanie omówiony na przy-
kładzie węzła zatokowo-przedsionkowego (S-A). Zasadnicze znaczenie
w tym zjawisku mają kanały kationowe I
f
, przez które przepływa prąd jono-
wy niosący głównie jony sodu. W odróżnieniu od innych kanałów sodowych
potencjałozależnych kanały prądu I
f
otwierają się nie podczas depolaryza-
cji, ale pod koniec repolaryzacji błony komórkowej, a dokładniej wówczas,
gdy potencjał błonowy obniży się po poprzedzającym pobudzeniu do warto-
ści (-50) mV – (-65) mV. Napływ do komórki jonów sodu powoduje przesu-
nięcie potencjału błonowego w kierunku wartości mniej ujemnych. Ta po-
wolna spoczynkowa depolaryzacja ma miejsce w okresie odpowiadającym
fazie 4 potencjału czynnościowego. Z chwilą, gdy potencjał błonowy osiąga
wartość ok. -55 mV, zaczynają się otwierać kanały wapniowe T i L. Napływ
jonów wapnia przyspiesza szybkość depolaryzacji. Po osiągnięciu potencjału
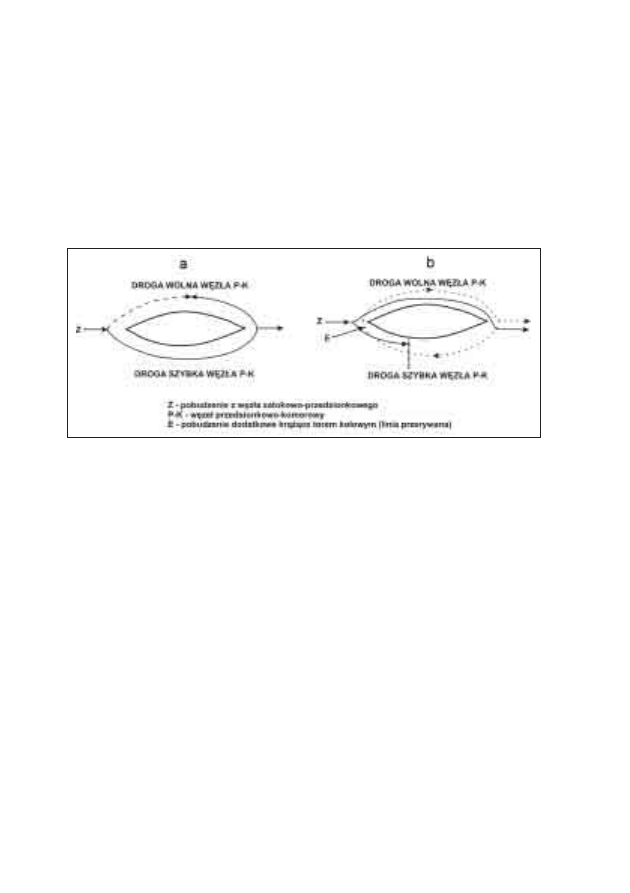
Rycina 5: Dysocjacja podłużna w węźle przedsionkowo-komorowym: a) fizjologiczne
przewodzenie impulsów zatokowych b) przedwczesne pobudzenie przedsionkowe
spowodowało zamknięcie toru kołowego przewodzenia pobudzenia (re-entry)
16

-40 mV dochodzi do pełnego otwarcia kanałów Ca
2+
typu L i tempo depola-
ryzacji zaczyna wzrastać bardzo szybko (faza 0), a potencjał błonowy osiąga
wartości dodatnie. Ponieważ napływ jonów Ca
2+
jest powolny, szybkość na-
rastania potencjału czynnościowego w komórkach rozrusznikowych jest
znacznie wolniejsza w porównaniu z szybkim narastaniem (zależnym od jo-
nów Na
+
) potencjału czynnościowego w komórkach roboczych mięśnia ser-
cowego. Po osiągnięciu potencjału 0 zaczynają się otwierać kanały potaso-
we prądu I
K
. Kanały te, podobnie jak kanały I
K
w mięśniu sercowym,
otwierają się z opóźnieniem. Ich otwarcie i wypływ jonów potasu z komórki
powoduje stopniową repolaryzację odpowiedzialną za fazę 3 potencjału
czynnościowego. W odróżnieniu od repolaryzacji w mięśniu sercowym, w re-
polaryzacji komórek węzła zatokowo-przedsionkowego główną rolę odgrywa
opóźniony prąd prostowniczy płynący przez kanały I
K
, natomiast kanały I
K1
nie odgrywają znaczącej roli. W związku z tym w węźle S-A nie występuje
faza 2 i okres plateau. Po osiągnięciu potencjału -50 mV ponownie zaczyna-
ją się otwierać kanały przewodzące prąd I
f
, co zapoczątkowuje ponowną
spoczynkową depolaryzację. Część kanałów I
K
jest jeszcze w tym czasie
otwarta. Współistnienie potasowego prądu repolaryzacyjnego z sodowym
i wapniowym depolaryzacyjnym przyczynia się do wolnego przebiegu powol-
nej spoczynkowej depolaryzacji. Jak więc widzimy, w odróżnieniu od komó-
rek mięśnia roboczego serca, w komórkach węzła zatokowo-przedsionko-
wego nie występuje typowy potencjał spoczynkowy o stałej amplitudzie.
Potencjał spoczynkowy jest tu najniższą wartością potencjału błonowego
osiąganą chwilowo.
Dynamika zmian potencjału błonowego w komórkach węzła S-A zależy
od liczby i właściwości kanałów przewodzących prądy I
f
, I
K
i I
Ca2+
. Głębo-
kość repolaryzacji oraz tempo powolnej spoczynkowej depolaryzacji zale-
żą od natężenia prądów płynących przez te kanały. Im bardziej intensywny
jest prąd I
f
, tym szybsze jest narastanie powolnej spoczynkowej depolary-
zacji.
Im większa jest liczba aktywowanych kanałów wapniowych, tym większą
amplitudę osiąga potencjał czynnościowy węzła S-A. Inaktywacja kanałów
wapniowych za pomocą antagonistów (np. nifedypiny) prowadzi do zmniej-
szenia amplitudy i częstości powstawania pobudzeń w węźle S-A. Różne ko-
mórki rozrusznikowe węzła zatokowo-przedsionkowego mają zróżnicowane
właściwości zależnie od liczby kanałów jonowych. Rytm pobudzeń nadawa-
ny jest przez rytm komórek wykazujących najszybszy przebieg powolnej spo-
czynkowej depolaryzacji. Komórki te znajdują się w głowie węzła S-A i sta-
nowią właściwy rozrusznik serca. Osiąganie potencjału progowego przez
indywidualną komórkę zależy więc od:
17

W czasie spoczynku i w stanie równowagi czynnościowej w obrębie układu
autonomicznego tempo powstawania pobudzeń w węźle zatokowo-przedsion-
kowym wynosi ok. 70/min (60-100) pobudzeń/min.
Właściwości wewnętrznego automatyzmu mają również inne części układu
bodźcoprzewodzącego serca: węzeł przedsionkowo-komorowy (P-K), który
jest drugorzędowym ośrodkiem automatyzmu serca i włókna Purkinjego sta-
nowiące trzeciorzędny ośrodek automatyzmu serca. Tempo samoistnego wy-
twarzania pobudzeń jest w nich jednak znacznie wolniejsze. W węźle przed-
sionkowo-komorowym wynosi ono ok. 45/min (40-60/min), a we włóknach
Purkinjego ok. 40/min (30-40/min). Różnice w częstości powstawania pobu-
dzeń w różnych ośrodkach automatyzmu wynikają z różnej liczby kanałów
sodowych, potasowych i wapniowych w ich błonie komórkowej.
W warunkach fizjologicznych najszybszy rytm własny posiadają komórki
węzła zatokowo-przedsionkowego, tzw. fizjologicznego rozrusznika serca
70-100/min. Pozostałe komórki układu bodźcoprzewodzącego z wewnętrz-
nym automatyzmem, nieaktywnym w warunkach fizjologicznych, pełnią
funkcję utajonych rozruszników. Rozruszniki te mogą stać się aktywne przy
uszkodzeniu tzw. fizjologicznego rozrusznika serca lub w przypadku zabu-
rzeń przewodzenia pobudzeń. Jak wspomniano wyżej, w warunkach prawi-
dłowych rytm pobudzeń całemu sercu nadawany jest przez rytm pobudzeń
powstających w komórkach węzła zatokowo-przedsionkowego serca. Jest to
związane z tym, że każde pobudzenie, które dociera do komórki wcześniej
niezdepolaryzowanej i będącej już w okresie refrakcji względnej powoduje
powstanie w niej potencjału czynnościowego i inaktywację kanałów jono-
wych. W związku z tym komórki takie nie mogą wytworzyć już potencjału
czynnościowego zgodnie z własnym rytmem automatyzmu, ponieważ ich we-
wnętrzna powolna spoczynkowa depolaryzacja przypadałaby na okres re-
frakcji bezwzględnej, spowodowany depolaryzacją wywołaną przekazaniem
pobudzenia przez węzeł S-A. Po drugie, pod wpływem pobudzenia narzuco-
nego przez węzeł zatokowy dochodzi w nich dodatkowo do zwolnienia po-
wolnej spoczynkowej depolaryzacji na skutek hiperpolaryzacji spowodowa-
nej częstymi pobudzeniami z węzła S-A. Przyczyną hiperpolaryzacji jest
wysoka aktywność pompy sodowo-potasowej, która musi usuwać sód napły-
• szybkości wolnych dokomórkowych prądów rozrusznikowych I
f
;
• wartości potencjału spoczynkowego (najbardziej ujemna wartość
potencjału błonowego w fazie 4);
• wartości potencjału progowego.
18

wający do komórek w czasie pobudzeń. Ponieważ liczba usuniętych jonów
sodu zawsze przeważa liczbę usuwanych jednocześnie jonów potasu, inten-
sywna praca pompy prowadzi do hiperpolaryzacji. Zjawisko tłumienia ak-
tywności niższych ośrodków automatyzmu przez pobudzenia dochodzące
z wyższych ośrodków nazywane jest tłumieniem szybszym rytmem (overdrive
supression). W komórkach rozrusznikowych, dzięki istnieniu intensywnego
prądu I
f
, hiperpolaryzujące działanie ATPazy Na
+
/K
+
może być zdomino-
wane przez powolną, spoczynkową depolaryzację.
Jak wspomniano wyżej, pobudzenia z węzła zatokowo-przedsionkowego
są przekazywane do mięśnia przedsionkowego. Natomiast włókna mięśnia
przedsionków pośredniczą w przekazywaniu pobudzenia z węzła S-A do węzła
A-V. Zdolność przewodzenia pobudzenia przez kardiomiocyty przedsionka
nie jest jednak jednakowa. Można w nim wyróżnić grupy komórek zdolnych
do szybszego przewodzenia, które tworzą kilka dróg ułatwionego przewo-
dzenia. Jedna z nich jest utworzona przez pęczek Bachmanna przekazujący
pobudzenie z węzła zatokowo-przedsionkowego do lewego przedsionka.
Trzy mniejsze pasma ułatwionego przewodzenia (przednie, pośrodkowe i tyl-
ne) przekazują pobudzenie z węzła S-A do węzła A-V. W warunkach niepra-
widłowych mogą występować również dodatkowe połączenia, które omówio-
ne są poniżej.
Węzeł przedsionkowo-komorowy składa się z trzech stref: przedsionkowo-
-węzłowej, węzłowej i węzłowo-pęczkowej, które wykazują odrębne właści-
wości. W strefie przedsionkowo-węzłowej i węzłowej dochodzi do zwolnienia
przewodzenia pobudzeń docierających z przedsionka (5 cm/s). Jest to zwią-
zane z tym, że znajdujące się tu włókna mają małą średnicę i mniej ujemną
wartość potencjału spoczynkowego. Ponieważ strefa przedsionkowo-węzło-
wa jest znacznie dłuższa niż węzłowa, zwolnienie przewodzenia powoduje
tu wyraźne opóźnienie w przekazywaniu pobudzenia (około 100 ms). Opóź-
nienie to umożliwia opróżnianie się przedsionków jeszcze przed skurczem
komór. Dodatkowo zapobiega ono nadmiernie częstemu pobudzeniu komór
w przypadku szybkiego rytmu przedsionków, np. podczas migotania czy trze-
potania przedsionków. Komórki strefy węzłowej mają właściwości automaty-
zmu. Potencjał spoczynkowy tych komórek wynosi -60 mV. Po pobudzeniu
wykazują one długi okres refrakcji (refrakcja postrepolaryzacyjna), który za-
pobiega przekazywaniu nieprawidłowych pobudzeń.
Warto zwrócić uwagę, że komórki węzła przedsionkowo-komorowego wy-
kazują zróżnicowanie nie tylko między strefami, ale również i w ułożeniu po-
dłużnym. Jedne z nich przewodzą szybciej, a inne mają dłuższą refrakcję
i przewodzą znacznie wolniej. W warunkach fizjologicznych nie przeszkadza
19

to w prawidłowym przekazywaniu pobudzenia przez układ przewodzący, jed-
nak w wypadku pojawienia się przedwczesnego pobudzenia przedsionków
może dojść do krążenia pobudzenia między przedsionkami i komorami.
Przyczyny tego zjawiska opisane są przy zaburzeniach przewodzenia.
Z węzła przedsionkowo-komorowego pobudzenie dociera do pęczka Hisa
i włókien Purkinjego, które przekazują je dalej do komórek roboczych mię-
śnia komór serca. Komórki Purkinjego różnią się od pozostałych komórek
układu bodźcoprzewodzącego. Wprawdzie posiadają one zdolność powol-
nej spoczynkowej depolaryzacji, jednak przebiega ona na tyle wolno, że im-
pulsy przewodzone włóknami pęczka Hisa docierają do komórek Purkinjego
w chwili, gdy ich potencjał spoczynkowy nie osiąga wartości progowej i jest
bardzo ujemny (około -80 mV). Wzbudzenie we włóknach Purkinjego po-
tencjału czynnościowego na tle bardzo ujemnego potencjału spoczynkowego
powoduje również, że powstający w nich potencjał czynnościowy osiąga war-
tości znacznie bardziej zbliżone do potencjału czynnościowego komórek ro-
boczych niż w pozostałych komórkach rozrusznikowych serca. Jednak
w przypadku pracy komórek Purkinjego we własnym rytmie 30-40/min, ich
potencjały czynnościowe mają amplitudę zbliżoną do potencjałów czynno-
ściowych węzła zatokowo-przedsionkowego, ponieważ rozpoczynają się one
od poziomu -40 mV, osiąganego w toku ich własnej spoczynkowej depolary-
zacji. Inną właściwością charakteryzującą włókna Purkinjego stanowi dłu-
gość fazy plateau. Bardzo długa faza plateau w tych włóknach chroni komo-
ry przed bardzo wczesnymi pobudzeniami pochodzenia nadkomorowego.
Takie pobudzenia mogą być łatwo przekazywane przez pęczek Hisa i duże
gałęzie, ponieważ ich potencjały czynnościowe, a więc i okresy refrakcji,
trwają stosunkowo krótko. Po dojściu do obwodowych włókien Purkinjego
trafiają jednak na długie okresy refrakcji bezwzględnej i ulegają wygaszeniu.
Jest to mechanizm korzystny, ponieważ bardzo wczesne pobudzenia dodat-
kowe mogą wyzwalać groźne dla życia arytmie komorowe.
WPŁYW UKŁADU AUTONOMICZNEGO NA POBUDLIWOŚĆ
MIĘŚNIA I UKŁADU BODŹCOPRZEWODZĄCEGO SERCA
Układ autonomiczny odgrywa bardzo ważną rolę w regulacji powstawania
i przewodzenia pobudzeń w mięśniu sercowym, a nieprawidłowa funkcja te-
go układu może spowodować zaburzenia rytmu serca.
Włókna przywspółczulne unerwiające mięsień sercowy wydzielają na swo-
ich zakończeniach acetylocholinę, która stymuluje receptory M
2
. W mięśniu
przedsionków stymulacja receptora M
2
powoduje otwarcie kanałów potaso-
wych zależnych od acetylocholiny i adenozyny, szybszy wypływ jonów potasu
20

i skrócenie okresu repolaryzacji. Oznacza to jednocześnie skrócenie czasu,
w którym jony wapnia mogą napływać do komórek i zmniejszenie siły skur-
czu przedsionka (ujemny efekt inotropowy). Działając na receptory M
2
, ace-
tylocholina hamuje również cyklazę adenylową, działając antagonistycznie
do noradrenaliny i adrenaliny. W mięśniu komór kanały potasowe zależne
od acetylocholiny nie istnieją. Jej działanie polega tu na antagonizowaniu
pobudzającego wpływu noradrenaliny i adrenaliny i ujawnia się wyraźnie je-
dynie na tle silnego pobudzenia układu współczulno-nadnerczowego.
Część współczulna układu autonomicznego unerwiająca mięsień sercowy
wywiera bardzo wyraźny wpływ na pobudliwość mięśnia sercowego za po-
średnictwem noradrenaliny uwalnianej na zakończeniach włókien współczul-
nych. Komórki mięśnia przedsionków i komór serca posiadają receptory ad-
renergiczne
β
1
,
β
2
i
α
α
1
. Pobudzenie receptorów
β
1
i
β
2
przez noradrenalinę
lub receptorów
β
2
przez adrenalinę prowadzi do wzrostu aktywności cyklazy
adenylowej, zwiększenia stężenia cAMP i otwarcia kanałów wapniowych ty-
pu L. Nasila to proces depolaryzacji kardiomiocytów, a w następstwie tego
wzrasta kurczliwość mięśnia sercowego. Znacznie słabsze działanie wywiera
pobudzenie receptorów
α
1
. Prowadzi ono do zwiększenia w komórce zawar-
tości trifosforanu inozytolu i diacyloglicerolu. Dzięki działaniu tych związ-
ków dochodzi do wzmocnienia efektu pobudzenia receptorów
β-adrener-
gicznych, zwiększenia napływu jonów wapnia przez kanały sarkolemy
i zwiększenia kurczliwości kardiomiocytów.
W układzie bodźcoprzewodzącym serca stymulacja receptorów M
2
w węź-
le zatokowo-przedsionkowym i przedsionkowo-komorowym powoduje ha-
mowanie aktywności cyklazy adenylowej i otwarcie kanałów potasowych re-
gulowanych przez acetylocholinę i adenozynę. Acetylocholina redukuje
również napływ jonów wapnia (hamując cyklazę adenylową) i przewodność
kanałów prądu I
f
. Powoduje to zmniejszenie tempa powolnej spoczynkowej
depolaryzacji (ujemny efekt chronotropowy), a przy bardzo silnym pobudze-
niu hiperpolaryzację i zablokowanie powstawania impulsów w komórkach
rozrusznikowych węzła zatokowego. W węźle przedsionkowo-komorowym
z tych samych przyczyn (zmniejszenie amplitudy lub generowania potencja-
łów czynnościowych) dochodzi do zwolnienia tempa przewodzenia (ujemny
efekt dromotropowy), a przy bardzo silnych pobudzeniach nerwu błędnego
do całkowitego bloku przewodzenia przez węzeł przedsionkowo-komorowy.
Przy bardzo silnym pobudzeniu nerwu błędnego może w związku z tym dojść
do zapaści wazowagalnej.
Układ współczulny wywiera przeciwstawne działanie. Podobnie jak w mię-
śniu sercowym nasila on w układzie bodźcoprzewodzącym przewodność dla
21

jonów wapnia i przyspiesza tempo depolaryzacji. Zwiększa również napływ
jonów sodu przez kanały prądu I
f
. W sytuacjach, którym towarzyszy aktywa-
cja układu współczulnego (stres, wysiłek fizyczny) dochodzi w związku z tym
do przyspieszenia tempa powstawania pobudzeń w węźle zatokowo-przed-
sionkowym (dodatni efekt chronotropowy) i zwiększenia szybkości ich prze-
wodzenia przez strefę przedsionkowo-węzłową węzła przedsionkowo-kom-
orowego (dodatni efekt dromotropowy). Ważną cechą unerwienia serca
przez układ współczulny jest to, że unerwienie to jest odcinkowe. Oznacza
to, że w przypadku czynnościowych zaburzeń układu autonomicznego pew-
ne obszary serca mogą otrzymywać silniejszą impulsację z zakończeń włó-
kien współczulnych. Może to spowodować większe przyśpieszenie powolnej,
spoczynkowej depolaryzacji w niektórych segmentach układu przewodzące-
go lub mięśnia komór, powstawanie dodatkowych pobudzeń nadkomoro-
wych oraz większą podatność na powstawanie przedwczesnych pobudzeń ko-
morowych. Fizjologiczny wpływ układu współczulnego na częstość rytmu
serca jest widoczny, np. podczas intensywnego wysiłku fizycznego oraz przy
napięciu emocjonalnym, gdy wraz ze wzrostem aktywności układu współ-
czulnego wzrasta częstość rytmu serca i również mogą pojawić się skurcze
dodatkowe.
U osób zdrowych podczas silnego pobudzenia układu autonomicznego
wpływ układu przywspółczulnego na czynność serca zawsze przeważa nad
wpływem układu współczulnego. Przewaga układu przywspółczulnego po-
woduje, że częstość generowania pobudzeń w węźle zatokowo-przedsionko-
wym jest w spoczynku znacznie niższa niż w odnerwionym sercu.
ZABURZENIA WYTWARZANIA BODŹCÓW
Zaburzenia wytwarzania bodźców występują w przypadku zmiany ośrodka
wytwarzającego bodźce lub wytworzenia w mięśniu sercowym warunków dla
powstania rozrusznika ekotopowego, tzn. w dwóch zasadniczych sytuacjach:
Gdy pobudzenia z węzła S-A pojawiają się zbyt rzadko lub zanikają całko-
wicie, a funkcja tego węzła może być przejęta przez komórki rozrusznikowe
podrzędnej części układu bodźcoprzewodzącego mamy do czynienia z po-
budzeniami zastępczymi. Natomiast, gdy pobudzenia wytwarzane są przez
• w wyniku zahamowania powstawania pobudzeń w węźle S-A;
• w wyniku powstania ośrodka o rytmie własnym szybszym niż rytm
S-A.
22
grupę komórek poza układem bodźcoprzewodzącym, pobudzenia takie na-
zywane są pobudzeniami ektopowymi. Pobudzenia zastępcze pojawiają się
po przerwie spowodowanej ustaniem lub zwolnieniem rytmu fizjologiczne-
go. Natomiast pobudzenie ektopowe występuje przedwcześnie w stosunku
do rytmu fizjologicznego. Zgrupowane pobudzenia zastępcze lub ektopowe
mogą tworzyć odpowiednio rytmy zastępcze i rytmy ektopowe.
Mechanizmy zaburzeń wytwarzania bodźców
Najczęstszą przyczyną zaburzenia wytwarzania bodźców przez układ bodź-
coprzewodzący jest powstawanie nieprawidłowych napięć w obrębie układu
autonomicznego. Mogą one wzmacniać tendencję do powstawania patolo-
gicznych pobudzeń w samym układzie bodźcoprzewodzącym i w mięśniu ser-
cowym. Często czynniki patologiczne (hipokaliemia, niedokrwienie, zatru-
cie glikozydami nasercowymi) mogą same nie wystarczać do wywołania
zaburzeń rytmu, jednak w skojarzeniu z nadmierną aktywacją układu współ-
czulnego mogą doprowadzić do groźnych dla życia arytmii. Świadczą o tym
liczne przypadki znacznego nasilenia liczby nagłych zgonów z przyczyn ser-
cowych w okresach związanych z dużymi napięciami emocjonalnymi (trzę-
sienia ziemi i inne stany zagrożenia).
Zaburzenia fizjologicznego automatyzmu powodują powstanie skurczów
dodatkowych zarówno pochodzenia nadkomorowego, jak i komorowego.
W przypadku pobudzeń zastępczych mechanizm tych zaburzeń polega na
szybszym pojawianiu się powolnej, spoczynkowej depolaryzacji w obwodo-
wych komórkach rozrusznikowych w stosunku do depolaryzacji węzła S-A.
Powstanie rytmu zastępczego może być m.in. wynikiem działania takich
czynników patologicznych, jak: hipokaliemia, przedawkowanie preparatów
glikozydów naparstnicy lub chinidyny czy też miejscowe niedokrwienie.
Tabela 1: Podział arytmii ze względu na zaburzenia wytwarzania impulsów
WZROST CZĘSTOŚCI
WYTWARZANIA BODŹCÓW
ZMNIEJSZENIE CZĘSTOŚCI
WYTWARZANIA BODŹCÓW
• węzeł S-A wykazuje zwiększony
automatyzm;
• węzeł S-A wykazuje zmniejszony
automatyzm;
• utajony rozrusznik wykazuje
zwiększony automatyzm
i wytwarza bodźce z większą
częstotliwością niż węzeł S-A.
• węzeł S-A wykazuje zmniejszony
automatyzm i ośrodki bardziej
obwodowe podejmują funkcje
rozrusznika.
23

W komórkach roboczych przedsionka i komór serca potencjał spoczynko-
wy nie wykazuje cech automatyzmu. Jak to wyjaśniono wyżej, komórki te
wymagają do swojego pobudzenia obecności bodźców zewnętrznych. W wa-
runkach fizjologicznych rolę taką spełnia pobudzenie przekazywane z ukła-
du bodźcoprzewodzącego. W pewnych warunkach komórki robocze mogą
jednak wykazywać zdolność do spontanicznej depolaryzacji. Dzieje się to
wówczas, gdy ich potencjał błonowy osiągnie wartość progową -60 mV pod
wpływem czynników patologicznych, którymi mogą być zaburzenia środowi-
skowe prowadzące do przebudowy komórek i przestrzeni zewnątrzkomór-
kowej serca, np. podczas niedokrwienia, zapalenia czy zwłóknienia mięśnia
sercowego. Przebudowa może prowadzić do zmiany liczby, budowy i funkcji
kanałów jonowych, połączeń międzykomórkowych o niskiej oporności i sa-
mych miocytów. Może mieć również wpływ na syntezę receptorów dla neuro-
transmiterów układu autonomicznego oraz zmieniać architekturę tkanek lub
aktywność układu autonomicznego. Jeżeli szybkość depolaryzacji w uszko-
dzonych komórkach przewyższy szybkość depolaryzacji właściwych komó-
rek rozrusznikowych, komórki uszkodzone staną się źródłem rytmu ektopo-
wego.
Powyższe zjawisko zostało określone jako tzw. automatyzm patologiczny
serca. Modulatorami arytmogennej przebudowy serca są katecholaminy,
wolne rodniki, enzym konwertujacy angiotensynę (ACE), angiotensyna II,
cytokiny oraz tlenek azotu. Obecność automatyzmu patologicznego jest
Tabela 2: Porównanie automatyzmu fizjologicznego i patologicznego mięśnia sercowego
AUTOMATYZM
FIZJOLOGICZNY
AUTOMATYZM
PATOLOGICZNY
występowanie
układ przewodzący
dowolna komórka
maks. częstotliwość
poniżej 200/min
200-600/min
reakcja na szybkie
drażnienie
zahamowanie
przyspieszenie
katecholaminy
przyspieszenie
przyspieszenie
leki antyarytmiczne
I grupa
zwolnienie
bez wpływu
antagoniści kanałów
wapniowych
bez wpływu
zahamowanie
24

w szczególności widoczna w przypadku zaburzeń przewodzenia między ko-
mórkami rozrusznikowymi i sąsiadującymi z nimi komórkami roboczymi ser-
ca. Patologiczny automatyzm może przyczynić się do powstania ogniska wie-
lokrotnych pobudzeń ektopowych, prowadzących do częstoskurczu, a nawet
migotania komór. Należy przy tym pamiętać, że patologiczna depolaryzacja
powstaje na tle mało ujemnego potencjału błonowego mięśnia komór, stąd
też powstałe potencjały czynnościowe mają małą amplitudę, a tym samym
małą szybkość przewodzenia. Stwarza to sprzyjające warunki dla krążenia
pobudzeń i wytworzenia opisanych niżej rytmów nawrotnych (re-entry).
Aktywność wyzwalana – depolaryzacje następcze
Aktywność wyzwalana polega na powstaniu w miocytach serca dodatko-
wych depolaryzacji poprzedzonych normalnym pobudzeniem zatokowym
zwanych depolaryzacjami następczymi.
W zależności od opóźnienia w stosunku do poprzedzającego potencjału
czynnościowego wyróżniamy:
Wystarczająco duże depolaryzacje następcze mogą doprowadzić do kolej-
nego pobudzenia komórki. Pojawiające się wówczas pobudzenia nazwano
aktywnością wyzwalaną (triggered activity).
Depolaryzacje następcze wczesne
Depolaryzacje następcze wczesne pojawiają się przy wolnej częstości ryt-
mu serca pod koniec fazy plateau lub w fazie 3 przed ukończeniem repolary-
zacji potencjału czynnościowego. U podstaw tego zjawiska leży ponowne,
spontaniczne pojawienie się prądu kationowego w obrębie tego samego po-
tencjału czynnościowego. Wczesne depolaryzacje następcze wyzwalają po-
budzenia dodatkowe przed zakończeniem repolaryzacji komórki, dlatego
też mają małą amplitudę i szybkość narastania i mogą się w związku z tym
przyczyniać do powstawania rytmów nawrotnych. Wśród mechanizmów, któ-
re mogą być przyczyną tych zaburzeń brana jest pod uwagę opóźniona inak-
tywacja kanałów sodowych, w komórkach częściowo lub całkowicie niedo-
• depolaryzacje następcze wczesne – pojawiające się w obrębie tego
samego potencjału czynnościowego pod koniec plateau lub
w fazie 3 potencjału czynnościowego;
• depolaryzacje następcze późne – pojawiające się po zakończeniu
okresu repolaryzacji.
25

krwionych, a następnie reperfundowanych. Może to być również wynikiem
nieprawidłowej aktywności kanałów sodowych spowodowanym defektem ge-
netycznym. Stwierdzono również, że komórki zdolne do wytwarzania wcze-
snych depolaryzacji następczych są przeładowane jonami wapnia i mogą wy-
dzielać je spontanicznie podczas repolaryzacji. Zwiększenie stężenia
wolnych jonów wapnia w cytoplazmie uaktywnia wymianę Na
+
/Ca
2+
, która
usuwa jony wapnia, wprowadzając jednocześnie jony sodu. Istnieją także
przypuszczenia, że może dochodzić do późnej reaktywacji wapniowej. Po-
nieważ wymiana Na
+
/Ca
2+
jest elektrogenna, w cytoplazmie dochodzi do
wzrostu stężenia kationów i depolaryzacji. Wiadomo, że powstawanie wcze-
snych depolaryzacji następczych prowokują także czynniki blokujące kanały
potasowe, a tym samym zwalniające proces repolaryzacji i wydłużające czas
trwania potencjału czynnościowego (w tym również fazy refrakcji względ-
nej). Dlatego też hipokaliemia, spowodowana najczęściej utratą potasu na
skutek uporczywych wymiotów czy biegunki lub podawania związków
zmniejszających przewodność kanałów potasowych (np. K
ATP
, który jest za-
mykany pod wpływem pochodnych sulfonylomocznika), mogą potęgować
występowanie tych zaburzeń. Także inne związki wydłużające okres repolary-
zacji, np. chinidyna ułatwiają wystąpienie wczesnych depolaryzacji następ-
czych.
Generowanie wczesnych depolaryzacji wydaje się leżeć u podłoża zabu-
rzeń rytmu serca w zespole wydłużonego QT. Elementami tego zespołu,
oprócz zmian w odstępie QT i bradykardii, są nawracające utraty przytom-
ności, charakterystyczny wielokształtny częstoskurcz komorowy typu tor-
sade de pointes, a także nagły zgon sercowy. Na podstawie badań labora-
toryjnych wykazano, że niektóre zespoły QT są związane z genetycznie
uwarunkowanymi zaburzeniami syntezy białek kanałów jonowych (patrz
niżej). Natomiast u podłoża nabytych zespołów QT leżą czynniki wydłuża-
jące czas trwania potencjału czynnościowego, np. hipokaliemia czy hipo-
magnezemia. Czynniki te mogą się również przyczyniać do ujawnienia wro-
dzonych zaburzeń funkcji kanałów. Skuteczne leczenie polega na
przyspieszeniu rytmu serca. Przyspieszenie rytmu serca odbywa się kosz-
tem skrócenia fazy repolaryzacji, a potencjał czynnościowy, redukując się
w ten sposób, skraca czas trwania okresu najbardziej podatnego na wystą-
pienie zaburzeń.
Depolaryzacje następcze późne
Depolaryzacje następcze późne występują po powrocie potencjału bło-
nowego do wartości spoczynkowych podczas szybkiego rytmu serca. Jak
26

wspomniano wyżej, przy szybkim rytmie serca, pomimo powrotu potencja-
łu błonowego do wartości wyjściowych, nie zostają jeszcze przywrócone
prawidłowe stężenia jonów po obu stronach błony komórkowej. Mecha-
nizm jonowy późnych depolaryzacji następczych polega na spontanicznym
uwalnianiu jonów wapnia z przeładowanej tymi jonami siateczki sarkopla-
zmatycznej. Podobnie jak w przypadku wyżej opisanych wczesnych depola-
ryzacji następczych, powoduje to wtórne uaktywnienie się wymiany
3Na
+
/Ca
2+
. Mechanizm powstawania późnych depolaryzacji jest więc
w tym zakresie podobny do mechanizmu powstawania wczesnych depola-
ryzacji. Podobne są również warunki kliniczne zagrażające wystąpieniem
późnych depolaryzacji następczych. Należą do nich wszystkie sytuacje,
w których może dojść do przeładowania komórek wapniem. Najczęstszymi
czynnikami wyzwalającymi są: przedawkowanie glikozydów naparstnicy
i nadmierna aktywacja układu współczulno-nadnerczowego, niedokrwie-
nie i reperfuzja. Ze względu na odcinkowe unerwienie serca przez układ
współczulny, pobudzenie włókien współczulnych może doprowadzić do
nierównomiernego przeładowania jonami wapnia różnych fragmentów
mięśnia sercowego, co może sprzyjać wystąpieniu późnych depolaryzacji
następczych jedynie w niektórych fragmentach miokardium. Stan taki
sprzyja tworzeniu się rytmów nawrotnych.
Patologiczne sprzężenie elektromechaniczne
We wszystkich komórkach pobudliwych serca może być wyzwolone pobu-
dzenie, jeżeli depolaryzacja osiągnie potencjał progowy. W stanach patolo-
gicznych potencjał czynnościowy może pojawić się spontanicznie w samym
układzie bodźcoprzewodzącym lub poza nim w wyniku działania bodźców,
które nie występują w warunkach prawidłowych. O ile stymulacja elektrycz-
na powoduje przytłumienie prawidłowego automatyzmu (poprzez mecha-
nizm overdrive suppression), to w przypadku automatyzmu patologicznego
jest ona bezskuteczna. Patologiczne sprzężenie elektromechaniczne może
być również spowodowane aktywacją kanałów jonowych wrażliwych na roz-
ciąganie błony komórkowej w przypadku przebudowy struktury przestrzeni
zewnątrzkomórkowej serca. Napływ jonów powoduje wówczas przejściową
depolaryzację, proporcjonalną do rozciągnięcia. W zwłókniałym sercu
sprzężenie elektromechaniczne rozprzestrzenia się z niejednakową szybko-
ścią. Obecność blizny pozawałowej lub zwłóknień, np. pozapalnych, unie-
możliwia uporządkowane przekazywanie pobudzeń z prawidłową szybko-
ścią. Może wówczas dojść do rozproszenia elektrofizjologicznego, co
sprzyja powstawaniu nawracających pobudzeń dodatkowych, a nawet czę-
stoskurczu.
27

ZABURZENIA PRZEWODZENIA BODŹCÓW
Zaburzenia przewodzenia pobudzeń stanowią również bardzo ważną przy-
czynę powstawania arytmii. Bloki przewodzenia mogą występować w każ-
dym punkcie układu przewodzącego i w każdym odcinku mięśnia roboczego
serca. Zależnie od rodzaju i umiejscowienia mogą one powodować różne
skutki uboczne, nie zawsze objawiające się klinicznie.
Stan czynny powstający w węźle zatokowo-przedsionkowym, przenoszony
jest na całe serce dzięki wstawkom tworzącym tzw. ścisłe złącze (nexus),
w obrębie których znajdują się kanały zwane koneksonami. Są to niskoopo-
rowe połączenia pomiędzy komórkami. Im mniejsza jest oporność połącze-
nia międzykomórkowego, tym większa jest szybkość międzykomórkowego
przewodnictwa, gdyż przy danej różnicy potencjałów natężenie prądu jest
większe. Oporność połączeń międzykomórkowych zależy od ilości ścisłych
złączy oraz od stanu czynnościowego koneksonów. Istnieją w sercu obszary,
gdzie ilość ścisłych złączy jest mała. Należy do nich przede wszystkim strefa
łącząca komórki węzła zatokowo-przedsionkowego z komórkami roboczy-
mi mięśnia prawego przedsionka. Dzięki temu w strefie tej stosunkowo ła-
two powstają bloki przewodzenia stanu czynnego (blok zatokowo-przedsion-
kowy). W stanach fizjologicznych stan czynnościowy koneksonów nie ulega
zmianie. Jednak w pewnych stanach patologicznych prowadzących do prze-
ładowania komórek wapniem (np. niedokrwienie czy zwłóknienie) oporność
koneksonów może ulec zmianie, co często doprowadza do powstania blo-
ków przewodzenia międzykomórkowego.
Najczęściej do zaburzeń przewodzenia dochodzi w wyniku uszkodzenia
lub niedokrwienia jednej z części układu bodźcoprzewodzącego. Obserwuje
się wówczas charakterystyczne zmiany w zapisie EKG. Podczas zaburzeń
przekazywania pobudzenia przez węzeł przedsionkowo-komorowy może,
w zależności od stopnia zaburzeń, dojść do wydłużenia czasu przewodzenia
lub do rozkojarzenia funkcji węzła zatokowo-przedsionkowego i przedsionko-
wo-komorowego. Przedsionki i komory pracują wówczas we własnym rytmie.
Przy bloku przedsionkowo-komorowym I stopnia wszystkie pobudzenia są
przewodzone, ale ze zwolnioną szybkością (wydłużenie odstępu P-Q na krzy-
wej EKG powyżej 0,2 s). Blok II stopnia występuje w dwóch postaciach: pe-
riodyki Wenckebacha (Mobitz I – stopniowe wydłużanie jednego z odstę-
pów P-Q, aż do całkowitego zablokowania jednego z pobudzeń) i wypadania
pobudzeń komorowych bez poprzedzającego wydłużania odstępu (Mobitz II).
Przy bloku III stopnia przekazywanie pobudzeń nie jest w ogóle możliwe.
Blok jednej z odnóg pęczka przedsionkowo-komorowego powoduje wy-
dłużenie czasu przewodzenia pobudzenia do komory przez ten pęczek. Po-
28

budzenie jest do niej wówczas przekazywane z opóźnieniem po dojściu do
przeciwległej komory. Powoduje to zawsze zniekształcenie zespołu QRS,
zmiany odcinka ST i załamka T, natomiast załamek P i odstępy PQ są prawi-
dłowe.
W przypadku powstania bloku przewodzenia przedsionkowo-komorowego
na skutek uszkodzenia węzła przedsionkowo-komorowego lub pęczka Hisa,
przerwa w czynności hemodynamicznej może spowodować spadek ciśnienia
tętniczego krwi i utratę przytomności na skutek niedokrwienia mózgu (ze-
spół Morgagniego-Adamsa-Stokesa – MAS).
Patologiczne przekazywanie pobudzeń z przedsionków i komór ma rów-
nież miejsce w zespole preekscytacji komorowej Wolffa-Parkinsona-White'a
(WPW). W zespole WPW między przedsionkami i komorami istnieje nie-
prawidłowe połączenie mięśniowe (pęczek Kenta). Pobudzenie przekazywa-
ne tą drogą dociera do mięśnia komór szybciej niż przez układ bodźcoprze-
wodzący, ponieważ nie napotyka na opóźnienie stwarzane przez węzeł
przedsionkowo-komorowy. Na ogół sumuje się ono z pobudzeniem docie-
rającym z układu przewodzącego, powodując zniekształcenie zespołu QRS
i pojawianie się w nim dodatkowej fali delta, ale nie dochodzi do dodatko-
wych pobudzeń. Może jednak wystąpić sytuacja, w której pobudzenie docie-
ra przez nieprawidłowe połączenie na tyle wcześnie, że może cofnąć się po-
przez drugie połączenie do przedsionków w okresie ich refrakcji względnej.
Występuje wówczas skrócenie odstępu PR i powstają warunki umożliwiają-
ce krążenie pobudzenia w zamkniętym obiegu i powstawanie rytmów na-
wrotnych. Klinicznym objawem tych zjawisk jest tachykardia pochodzenia
nadkomorowego, która może ustąpić na skutek zahamowania przewodze-
nia przez węzeł przedsionkowo-komorowy (np. przez podrażnienie nerwu
błędnego masażem zatoki szyjnej).
Inną przyczyną nieprawidłowego przekazywania pobudzenia między
przedsionkami i komorami może być nieprawidłowe wykorzystanie czynno-
ściowej dysocjacji podłużnej węzła przedsionkowo-komorowego. Pobudze-
nie w węźle A-V wchodzi na drogę wolną i szybką. Przy prawidłowym rytmie
pobudzeń węzła zatokowego przekazywane jest ono przez węzeł A-V jedynie
drogą szybką, ponieważ droga wolna ma zbyt długi okres refrakcji bez-
względnej (ryc. 5). Jeżeli jednak z przedsionka nadejdzie pobudzenie przed-
wczesne, to może ono trafić już na okres refrakcji względnej drogi wolnej
i po przejściu przez nią, cofnąć się do przedsionka drogą szybką, w której
okres refrakcji też już zdążył minąć. Dochodzi wówczas do dodatkowego po-
budzenia przedsionków. Sekwencja wydarzeń powodujących, że pobudzenie
krąży między przedsionkami i komorami może się powtarzać wielokrotnie.
29

Rytm nawrotny (re-entry) w komorach
Krążenie po obwodach zamkniętych stanowi również najczęstszy mecha-
nizm groźnych dla życia tachyarytmii pochodzenia komorowego, takich jak
częstoskurcz i trzepotanie komór, które mogą przekształcić się w migotanie
komór. Mechanizm tych zaburzeń polega również na wytworzeniu się ob-
wodów elektrycznych umożliwiających krążenie pobudzeń po zamkniętych
okręgach i nieregularnie powtarzającą się depolaryzację różnych obszarów
serca. Jak to wyjaśniano powyżej, długi okres refrakcji bezwzględnej unie-
możliwia w zdrowym sercu cofnięcie się fali depolaryzacyjnej. Jest to jednak
możliwe wówczas, gdy w jakimś obszarze przewodzenia znajduje się grupa
komórek wykazujących zbyt wolne przewodnictwo (np. w niedokrwieniu, za-
burzeniach składu jonowego) lub jeśli pojawia się w nim przeszkoda powo-
dująca całkowity blok przewodzenia (np. blizna pozawałowa). Fala depolary-
zacji szuka wówczas najkrótszej drogi dotarcia do miejsca, w którym błona
komórkowa jest jeszcze niepobudzona. Nie przechodzi ona wówczas jednoli-
tym frontem, ale dzieli się na odnogi otaczające miejsce zwolnionego przewod-
nictwa. Do ponownego połączenia się takich odnóg w obszarze zdrowego
miejsca dochodzi wówczas z opóźnieniem. Stwarza to warunki do nierów-
nomiernego czasu trwania repolaryzacji i wychodzenia kardiomiocytów
z okresu refrakcji bezwzględnej. Powstają w ten sposób korzystne warunki
dla krążenia pobudzenia w obwodach zamkniętych i powstawania pobudzeń
dodatkowych. Jednym z obszarów predysponowanych do powstawania tego
typu zaburzeń jest strefa połączenia obwodowego układu przewodzącego
komór z ich mięśniem roboczym. Czynnikiem ułatwiającym powstanie krą-
żenia pobudzeń w tym obszarze jest najczęściej ognisko niedokrwienne lub
zapalne we wsierdziu lub podwsierdziowych warstwach mięśnia sercowego.
Obwody kołowe mogą występować również w innych obszarach serca. Jest to
najczęściej spotykane w przypadku połączenia zaburzeń przewodzenia i jed-
nokierunkowego bloku w ognisku niedokrwienia lub w strefie granicznej po-
między takim ogniskiem a zdrowym mięśniem sercowym. Czynnikami wy-
zwalającymi rytmy nawrotne mogą być pobudzenia dodatkowe, a przede
wszystkim częstoskurcze, prowadzące do postępującej fragmentacji czynno-
ściowej mięśnia sercowego. Jednocześnie z pobudzeniami dodatkowymi mu-
szą jednak również wystąpić takie zaburzenia przewodzenia międzykomór-
kowego, które umożliwiają dodatkową depolaryzację miocytów poza
prawidłowym rytmem. Wszystkie czynniki zwalniające przewodnictwo uspo-
sabiają do rozwoju mechanizmu re-entry. Wszelkie wczesne pobudzenia dodat-
kowe mogą wówczas pojawić się w wydłużonym okresie refrakcji względnej
miejsca potencjalnego bloku. Potencjały czynnościowe wywołane pobudze-
niami przedwczesnymi powstają, gdy komórki nie są jeszcze w pełni zdepo-
30
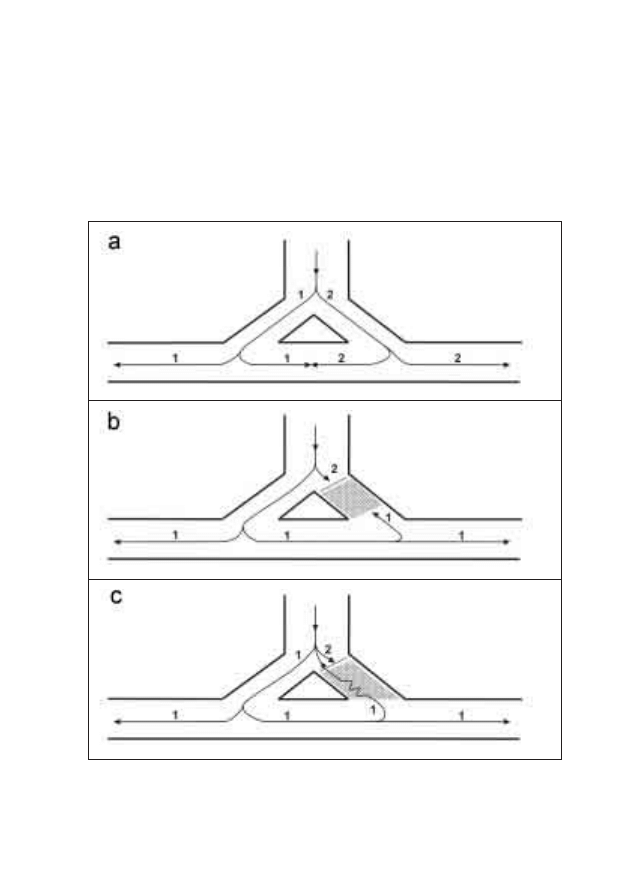
laryzowane i w związku z tym mają małą amplitudę i są przewodzone powoli.
Na skutek tego docierają one do drugiego końca strefy bloku już po prze-
minięciu jej okresu refrakcji i mogą być przewodzone antydromowo. Rytmy
nawrotne rozprzestrzeniające się na całe komory doprowadzają do ich
uogólnionego migotania. Przedział czasu, w którym występuje fizjologiczna
asynchroniczność repolaryzacji komórek, tj. w którym pojedynczy bodziec
dodatkowy może wywołać migotanie komór nazwano fazą nadwrażliwości
(fazą ranliwą).
Rycina 6: Mechanizm re-entry: a) przewodzenie prawidłowe b) blok układu
dwukierunkowego w jednej z odnóg (zjawisko re-entry nie jest możliwe)
c) blok jednokierunkowy w jednej z odnóg oraz zwolniona szybkość przewodzenia
wstecznego (zjawisko re-entry jest możliwe)
31
Szczególną postać opisywanych mechanizmów stanowią tzw. mikrorytmy
nawrotne (micro-re-entry), które polegają na powstawaniu obwodów za-
mkniętych na obszarze kilku lub kilkunastu miocytów. U podłoża tego pro-
cesu leży niejednorodność refrakcji i różnice szybkości repolaryzacji po-
szczególnych leżących koło siebie miocytów. Przy normalnym rytmie
zatokowym te różnice nie mają znaczenia klinicznego, gdyż wszystkie ko-
mórki są zdepolaryzowane, tj. wychodzą z okresu refrakcji przed nadej-
ściem kolejnego impulsu z węzła S-A. Jednak sytuacja ulega zmianie
w przypadku wystąpienia wczesnych pobudzeń dodatkowych. Dochodzi
wówczas do powstania grupy potencjałów przesuniętych w stosunku do sie-
bie w fazie. Na skutek tego komórki, które są aktualnie zdepolaryzowane,
mogą pobudzać sąsiednie, które zdążyły już wyjść z okresu refrakcji bez-
względnej. W ten sposób stan czynny krąży bezładnie pomiędzy poszcze-
gólnymi komórkami, stanowiąc nieregularnie ognisko pobudzeń dodatko-
wych o dużej częstotliwości.
Podsumowując, można powiedzieć, że określony obszar mięśnia sercowe-
go może stać się obwodem pobudzenia nawrotnego, jeśli występują w nim
następujące warunki:
Ze względu na złożony mechanizm powstawania arytmii postępowanie te-
rapeutyczne powinno być zawsze bardzo ostrożne i oparte na wnikliwej ana-
lizie przyczyn powodujących powstawanie zaburzeń rytmu oraz aktualnego
stanu zaburzeń rytmu. Należy zawsze pamiętać, że zastosowanie niewłaści-
wego leku antyarytmicznego może spowodować pogorszenie stanu pacjenta
i wystąpienie efektu proarytmicznego, zamiast oczekiwanej poprawy. Ogól-
nie postępowanie takie można podzielić na:
W pierwszym przypadku postępowanie powinno polegać na zapobieganiu
powstawania pobudzeń dodatkowych, a także, w przypadku ich istnienia, na
zmniejszaniu prawdopodobieństwa wywoływania pobudzenia krążącego po-
przez stosowanie odpowiednio dobranych leków antyarytmicznych. W dru-
gim przypadku istnieje konieczność eliminacji krążącego już pobudzenia po-
• antyarytmiczne (zapobiegające wystąpieniu arytmii);
• antyfibrylacyjne (usuwające istniejące już pobudzenia krążące).
• obecność jednokierunkowego bloku przewodzenia, najczęściej
spowodowanego niejednorodnym wydłużeniem okresu refrakcji;
• niejednorodne zwolnienie szybkości przewodzenia.
32

przez podanie leków antyarytmicznych, na drodze chirurgicznej lub za po-
mocą interwencji elektrycznej.
GENETYCZNE UWARUNKOWANIA ZABURZEŃ RYTMU SERCA
Wydłużenie okresu refrakcji względnej i związane z nim wydłużenie okre-
su QT w zapisie EKG (zespół LQT) może wystąpić w przypadku mutacji ge-
nów odpowiedzialnych za syntezę kanałów sodowych lub potasowych wystę-
pujących w sercu. Niektóre z tych mutacji ujawniają się we wczesnym okresie
życia, a inne w późniejszym, często po 30 roku życia, prawdopodobnie pod
wpływem współistniejących czynników środowiskowych.
Zespół wydłużonego QT1 spowodowany jest mutacją białka kanału pota-
sowego regulowanego przez zmiany potencjału błonowego, syntetyzowane-
go pod kontrolą genu KCNQ1. Mutacja tego białka występuje w zespole Je-
rvella i Langego i jest przekazywana jako cecha dominująca. Zespół
wydłużonego QT2 występuje u osób z mutacją genu KCNH2 (HERG), od-
powiedzialnego za syntezę białka kanału potasowego przewodzącego prąd
I
Kr
(opóźniony potasowy prąd prostowniczy). Zespół wydłużonego QT3 po-
jawia się w przypadku mutacji genu SCN5A, który jest odpowiedzialny za
syntezę białka kanału sodowego. W zależności od umiejscowienia mutacji,
zaburzenia mogą dotyczyć zarówno aktywacji, jak i inaktywacji kanału so-
dowego. Kanał może wykazywać w związku z tym niższy próg aktywacji lub
może ulegać zbyt późnej inaktywacji. W obu sytuacjach depolaryzacja ko-
mórki ulega przedłużeniu. W zespole wydłużonego QT4 stwierdzono muta-
cje w obrębie długiego ramienia czwartej pary chromosomów 4q25-27. Ze-
spół ten występuje rzadko i jest mało poznany. Zespół wydłużonego QT5 jest
spowodowany mutacją genu KCNE1 odpowiedzialnego za syntezę białka ka-
nału opóźnionego potasowego prądu prostowniczego I
Ks
(jest ono sprzężo-
ne z białkiem I
Kr
). Objawy kliniczne tego zespołu są podobne do objawów
zespołu QT1. Mutacja ta może prowadzić do rozwoju zespołu Jervella i Lan-
gego-Nielsena lub Romano-Warda. Zespół wydłużonego QT6 występuje
w przypadku mutacji genu KCNE2 odpowiedzialnego za syntezę białka
sprzężonego z białkiem I
Ks
.
Zapamiętaj!
1. Potencjał czynnościowy stanowi podstawę informacji elektrycznej w mię-
śniu sercowym.
2. Układ bodźcoprzewodzący serca narzuca rytm całemu sercu.
33

3. Fizjologicznym rozrusznikiem serca jest węzeł zatokowo-przedsionkowy,
w którym pobudzenia powstają z częstotliwością 60-100/min.
4. Zaburzenia w układzie bodźcoprzewodzącym serca i powstawanie dodat-
kowych pobudzeń poza tym układem nazwano zaburzeniami rytmu serca
(arytmiami).
5. Zaburzenia rytmu serca dzielimy na zaburzenia wytwarzania i przewodze-
nia bodźców.
6. Pobudzenie zastępcze pochodzi z utajonego rozrusznika układu bodźco-
przewodzącego w przypadku zwolnienia lub braku rytmu zatokowego, nato-
miast pobudzenie ektopowe pochodzi z utajonego rozrusznika znajdującego
się poza układem bodźcoprzewodzącym.
7. U podłoża zaburzeń przewodzenia prowadzących do powstania rytmów na-
wrotnych (re-entry) leży nieskoordynowana szybkość przewodzenia pobu-
dzeń w sercu.
Warto przeczytać:
W. Armstrong, N. Boulis: Patomechanizm zaburzeń rytmu serca. Patofizjo-
logia chorób serca. L. Lilly (red.), Wrocław 1996.
A. Beręsewicz: Komórkowe mechanizmy zaburzeń rytmu serca. Zaburzenia
rytmu serca. M. Dłużniewski (red.), Warszawa 1997.
R. Berne, M. N. Levy, B. M. Koeppen, B. A. Stanton: Physiology. Mosty
1998.
B. Lewartowski: Fizjologia Serca. Fizjologia człowieka z elementami fizjolo-
gii stosowanej i klinicznej. A. Traczyk, A. Trzebski (red.), Warszawa 2001.
A. A. Grace: Molekularne podłoże zespołu wydłużonego LQ. Genetyka
układu krążenia. A. Ciechanowicz, A. Januszewicz, W. Januszewicz, W. Ru-
żyłło (red.). Medycyna Praktyczna, Kraków 2002.
E.K. Włodarska: Podłoże genetyczne zaburzeń rytmu serca. Genetyka ukła-
du krążenia. A. Ciechanowicz, A. Januszewicz, W. Januszewicz, W. Rużył-
ło (red.). Medycyna Praktyczna, Kraków 2002.
34

II.
BADANIA DIAGNOSTYCZNE W ROZPOZNAWANIU,
PROGNOZOWANIU I OCENIE SKUTECZNOŚCI
LECZENIA ZABURZEŃ RYTMU SERCA
– STANDARD POSTĘPOWANIA
Jarosław Król, Mirosław Dłużniewski
Diagnostyka zaburzeń rytmu serca obejmuje badanie podmiotowe, przed-
miotowe i badania dodatkowe, które wykonuje się sekwencyjnie, zgodnie
z logicznymi wnioskami z badań wykonanych wcześniej. Zaburzenia rytmu
serca mogą być objawem schorzeń układu sercowo-naczyniowego, ale ich
powodem bywają także ostre i przewlekłe zaburzenia w przewodzie pokar-
mowym, zaburzenia wodno-elektrolitowe, stany gorączkowe, niedokrwistość,
zaburzenia hormonalne.
PRZYCZYNY SERCOWE ZABURZEŃ RYTMU
• choroba niedokrwienna serca, zwłaszcza stan po przebytym
zawale serca;
• niewydolność serca o różnej etiologii;
• przerost mięśnia lewej komory;
• nadciśnienie tętnicze;
• kardiomiopatie:
przerostowa,
rozstrzeniowa;
• „elektryczne” choroby serca:
wrodzony zespół wydłużonego QT,
arytmogenna kardiomiopatia prawej komory,
zespół Brugadów,
zespoły preekscytacji (WPW);
• zapalenie mięśnia sercowego;
• wady serca:
stenoza aortalna,
stenoza mitralna,
zespół wypadania płatka zastawki dwudzielnej.
35

Pierwszy etap diagnostyki – badanie podmiotowe, przedmiotowe, badania
biochemiczne oraz spoczynkowe badanie EKG mogą być wykonane z powo-
dzeniem przez lekarza rodzinnego. Gdy przyczyna zaburzeń rytmu jest oczy-
wista i łatwa do usunięcia, np. niedokrwistość czy zaburzenia jonowe dalsza
specjalistyczna diagnostyka nie jest konieczna. Celem wykonania badań jest
z jednej strony stwierdzenie, czy dolegliwości zgłaszane przez pacjenta mają
rzeczywisty związek z zaburzeniami rytmu serca, a z drugiej ustalenie cha-
rakteru tych zaburzeń, ich nasilenia, a w końcu określenie zagrożenia na-
głym zgonem sercowym, bo od tego zależy sposób postępowania terapeu-
tycznego.
Tabela 1: Arytmogenne choroby serca
PRZYCZYNY POZASERCOWE ZABURZEŃ RYTMU
• choroby układowe;
• zaburzenia hormonalne, metaboliczne i elektrolitowe;
• leki (jatrogenne):
sympatykomimetyki,
glikozydy naparstnicy,
moczopędne,
przeciwnowotworowe,
środki znieczulenia ogólnego;
• używki;
• choroby układu nerwowego;
• choroby jamy brzusznej;
• zabiegi diagnostyczno-terapeutyczne.
CHOROBA
NAJWAŻNIEJSZE BADANIA
POTWIERDZAJĄCE
ROZPOZNANIE
choroba niedokrwienna serca
test wysiłkowy, echokardiografia;
kardiomiopatia rozstrzeniowa
echokardiografia;
kardiomiopatia przerostowa
EKG, echokardiografia;
36

PIERWSZE KROKI DIAGNOSTYCZNE
Wywiady
Badanie podmiotowe ma na celu ustalenie prawdopodobieństwo związ-
ku zgłaszanych objawów z zaburzeniami rytmu. Najczęściej występujące
objawy to uczucie kołatania serca, opisywane jako silne lub szybkie bicie
serca, czasem wrażenie „zamierania” serca. Inne objawy to wynikające
z przejściowego upośledzenia przepływu mózgowego zaburzenia widze-
nia, zawroty głowy, omdlenia. Kolejne fakty wymagające ustalenia to ist-
niejące już choroby układu krążenia, takie jak nadciśnienie tętnicze, cho-
roba niedokrwienna serca, przebyty zawał serca. Ważny jest także wywiad
rodzinny ze względu na wprawdzie rzadkie, ale występujące rodzinnie
choroby przebiegające z zaburzeniami rytmu serca, czasem związane
z nagłymi zgonami w młodym wieku. Do bardzo istotnych informacji,
które powinniśmy uzyskać, należą leki, jakie przyjmuje chory. Dotyczy to
wszelkich leków, nie tylko tych stosowanych z powodu chorób serca (tab.
2). Podobnie, informacja o dolegliwościach ze strony przewodu pokar-
mowego, zwłaszcza przewlekła kamica żółciowa, przepuklina rozworu
przełykowego przepony – to stany mogące prowokować zaburzenia rytmu
serca.
Objaśnienia skrótów:
LP – późne potencjały komorowe wykryte w badaniu EKG wysokiego wzmocnienia;
MRI – magnetyczny rezonans jądrowy.
CHOROBA
NAJWAŻNIEJSZE BADANIA
POTWIERDZAJĄCE
ROZPOZNANIE
arytmogenna kardiomiopatia
prawej komory
EKG, LP, echokardiografia, MRI,
biopsja, wentrikulografia
prawostronna;
zespół wydłużonego QT
EKG, torsade de pointes;
zespół Brugadów
EKG, testy prowokacyjne
z ajmaliną, flekainidem.
37

Badanie przedmiotowe
Badanie przedmiotowe dostarcza bardzo istotnych informacji o ogólnym
stanie pacjenta. W stanach nagłych decyduje o wyborze terapii, np. kardio-
Tabela 2: Leki mogące wydłużać QT
probucol
+
terfenadyna
+
różne
cizapryd
+
hydroxyzyna
+
ebastyna
+
diphenhydramina
+
spiramycyna
+
antyhistaminowe
astemizol
+
droperidol
+
przeciwgrzybicze,
antybiotyki
ketokenazol
+
doxepin
+
citalopram
+
chlorpromazyna
+
clomipramina
+
papaveryna
+
psychotropowe
amitryptylina
+
d, l-sotalol
+
spazmolityczne
prenylamina
+
chinidyna
+
propafenon
+
prokainamid
+
dofetilid
+
bretylium
+
amiodaron
+
KLASA LEKÓW
LEK
TORSADE DE POINTES
antyarytmiczne
ajmalina
+
38

wersji elektrycznej zamiast prób leczenia farmakologicznego w leczeniu czę-
stoskurczu komorowego, gdy chory ma objawy małego rzutu lub niewydol-
ności serca. Chory z zaburzeniami rytmu może być w stanie dobrym, bez
uchwytnych zmian w badaniu przedmiotowym. Czasem zaburzenia rytmu
można stwierdzić podczas osłuchiwania serca. Istotne jest czy zaburzenia ryt-
mu powodują deficyt tętna na obwodzie, czy wysłuchiwana jest przerwa wy-
równawcza. Szmery serca nakazują diagnozowanie wady, kardiomiopatii lub
krążenia hiperkinetycznego. Najważniejsze jest ustalenie, czy chory ma obja-
wy niewydolności serca, która w powiązaniu z zaburzeniami rytmu istotnie
pogarsza rokowanie chorego.
Badania biochemiczne
Biochemiczne badania dodatkowe, które koniecznie należy wykonać to
morfologia krwi obwodowej oraz oznaczenie stężenia sodu, potasu i magne-
zu. Gdy istnieje podejrzenie, że tłem dolegliwości jest do tej pory nierozpo-
znana choroba niedokrwienna serca, ważne jest oznaczenie stężenia chole-
sterolu i jego frakcji. Gdy dane z wywiadu świadczą o możliwej nadczynności
tarczycy, należy oznaczyć stężenie TSH. Na podstawie wywiadu i wyników
badań biochemicznych można ustalić prawdopodobieństwo choroby niedo-
krwiennej serca i stopień jej zaawansowania. Prawidłowo postawione roz-
poznanie i kwalifikacja do leczenia poprawiającego krążenie wieńcowe mo-
że być podstawą skutecznego leczenia zaburzeń rytmu.
EKG spoczynkowe
Spoczynkowe, standardowe badanie EKG, choć czasem nie w pełni przy-
datne w diagnozowaniu zaburzeń rytmu jako takich (trwa zbyt krótko, trud-
no w nim uchwycić arytmię, zwłaszcza złożone komorowe zaburzenia ryt-
mu), stanowi ciągle ważne narzędzie diagnostyczne. Wynik badania
spoczynkowego, nawet gdy rejestruje bigeminię komorową, nie może być
jednak podstawą do rozpoczęcia leczenia. Wyjątkiem jest zarejestrowanie
utrwalonego częstoskurczu komorowego, kiedy konieczność leczenia doraź-
nego nie pozostawia czasu na szerszą diagnostykę. Zmiany stwierdzone
w spoczynkowym EKG mogą jednak pomóc w ustaleniu rozpoznania i mają
wpływ na rokowanie. Zmianami takimi są blok lewej odnogi pęczka Hisa,
cechy przebytego zawału, zmiany niedokrwienne, WPW i inne zespoły preek-
scytacji, wydłużone QT, cechy przerostu lewej komory, czasem zmiany ST-T
sugerujące zaburzenia jonowe lub wpływ stosowanych leków. Zmiany
w EKG są bardzo istotne w rozpoznaniu zespołu Brugadów, genetycznie
uwarunkowanego z wysokim zagrożeniem nagłym zgonem. U pacjenta z czę-
39

stoskurczami komorowymi spowodowanymi tą chorobą typowe zmiany
w EKG spoczynkowym to blok prawej odnogi pęczka Hisa oraz uniesienie
odcinka ST w V
1
-V
3
.
Badania specjalistyczne
Kolejne badania wymagają skierowania pacjenta do poradni specjalistycz-
nej. Dostępność tych badań rośnie i mogą być wykonane ambulatoryjnie,
a badanie echokardiograficzne, EKG metodą Holtera i test wysiłkowy mogą
i powinny być wykonane już na zlecenie lekarza rodzinnego, gdy istnieją ku
temu wskazania.
• EKG metodą Holtera
24-godzinne monitorowanie EKG jest badaniem o kluczowym znaczeniu
w diagnostyce zaburzeń rytmu. Badanie to wykonuje się w celu postawienia
rozpoznania, ustalenia wskazań do leczenia oraz po rozpoczęciu leczenia dla
oceny jego skuteczności. Bardzo istotne jest wykazanie związku zaburzeń
rytmu z rodzajem aktywności, porą dnia i dolegliwościami – kołataniem ser-
ca, bólami w klatce piersiowej, omdleniami. W zapisie EKG, poza zaburze-
niami rytmu, wykazać można również zmiany ST typowe dla niedokrwienia
serca. Gdy tego typu zmiany występują jednocześnie, można podejrzewać
niedokrwienne tło zaburzeń rytmu. Badanie holterowskie jest jednym z ba-
dań, na podstawie którego można określić zagrożenie nagłym zgonem.
Wśród parametrów świadczących o takim zagrożeniu są obniżona zmienność
rytmu zatokowego (heart rate variability, HRV), wzrost średniej częstości ryt-
mu zatokowego, epizody częstoskurczu komorowego.
Telemedycyna
Coraz ważniejsze miejsce w diagnostyce, a także w ocenie skuteczności
i bezpieczeństwa terapii, zajmuje monitorowanie EKG przez telefon. Zale-
tą tej metody jest wykonanie zapisu „na żądanie”, tj. wówczas, gdy pojawią
się dolegliwości.
Echokardiografia
Badanie echokardiograficzne powinno być wykonane u każdego chorego
z zaburzeniami rytmu. Pozwala ono określić przerost lewej komory, stopień
uszkodzenia lewej komory po przebytym zawale serca, zaburzenia kurczli-
wości wtórne do zaburzeń ukrwienia, rozpoznać wadę serca, czy w końcu
kardiomiopatię przerostową, która w skojarzeniu z zaburzeniami rytmu sta-
40

nowi bardzo poważne zagrożenie rokownicze. Badanie to, ze względu na
bezpieczeństwo pacjenta, powinno poprzedzać wysiłkowe badanie EKG. Pa-
rametrem stanowiącym o zagrożeniu nagłym zgonem uzyskiwanym z bada-
nia echokardiograficznego jest niska frakcja wyrzutowa EF <35%.
EKG wysiłkowe
Gdy w badaniu holterowskim wykazano związek zaburzeń rytmu z niedo-
krwieniem lub gdy pacjent ma dolegliwości typowe dla choroby niedo-
krwiennej serca, wykonuje się EKG wysiłkowe. W grupie chorych z zaburze-
niami rytmu serca badanie wysiłkowe może być związane z większym
ryzykiem. Badanie to zawsze musi być przeprowadzone w pracowni wypo-
sażonej w defibrylator, z zestawem leków koniecznych do udzielenia kwalifi-
kowanej pomocy w przypadku wystąpienia częstoskurczu komorowego lub
zatrzymania krążenia. Badanie ma na celu potwierdzenie związku zaburzeń
rytmu z wysiłkiem i niedokrwieniem serca. Gdy wynik testu wysiłkowego po-
twierdza te związki, dalszym krokiem jest wykonanie koronarografii i zabie-
gu przywracającego prawidłowy przepływ w tętnicy wieńcowej. Skuteczność
takiego postępowania można skontrolować ponownym badaniem wysiłko-
wym. Wynik testu wysiłkowego może także świadczyć o zagrożeniu nagłym
zgonem. Najsilniejszym dowodem takiego zagrożenia jest wybitnie dodatni
wynik badania typowy dla choroby trzech naczyń oraz wystąpienie podczas
wysiłku, a zwłaszcza jak wynika z ostatnio opublikowanych danych, bezpo-
średnio po zaprzestaniu wysiłku częstoskurczu komorowego.
Po wykonaniu tych badań większość pacjentów z zaburzeniami rytmu ser-
ca nie wymaga dalszej diagnostyki i może być poddana próbom leczenia. Jak
wynika z obecnego stanu wiedzy, leczenie farmakologiczne, objawowe leka-
mi antyarytmicznymi powinno być stosowane tylko wyjątkowo. Dane z prze-
prowadzonych badań pozwalają na podjęcie leczenia przyczynowego: opty-
malnego leczenia nadciśnienia tętniczego, kwalifikacji chorego do zabiegów
przywracających krążenie wieńcowe, kardiochirurgicznej korekty wady ser-
ca. Czasem dane z wywiadu i wyniki badania holterowskiego pozwalają na
zakwalifikowanie pacjenta do wszczepienia kardiowertera-defibrylatora.
Badania elektrofizjologiczne
Pacjent ze złośliwymi zaburzeniami rytmu wymaga poszerzenia diagnosty-
ki o badania elektrofizjologiczne: przezprzełykowe lub/i programowaną sty-
mulację komór. Badanie przezprzełykowe polega na wykonaniu zapisu EKG
z elektrody przełykowej, która pozwala na dokładniejsze zarejestrowanie za-
łamków P, co bywa istotne w różnicowaniu częstoskurczów komorowych
z częstoskurczami nadkomorowymi przewiedzionymi z aberracją. Inne da-
41
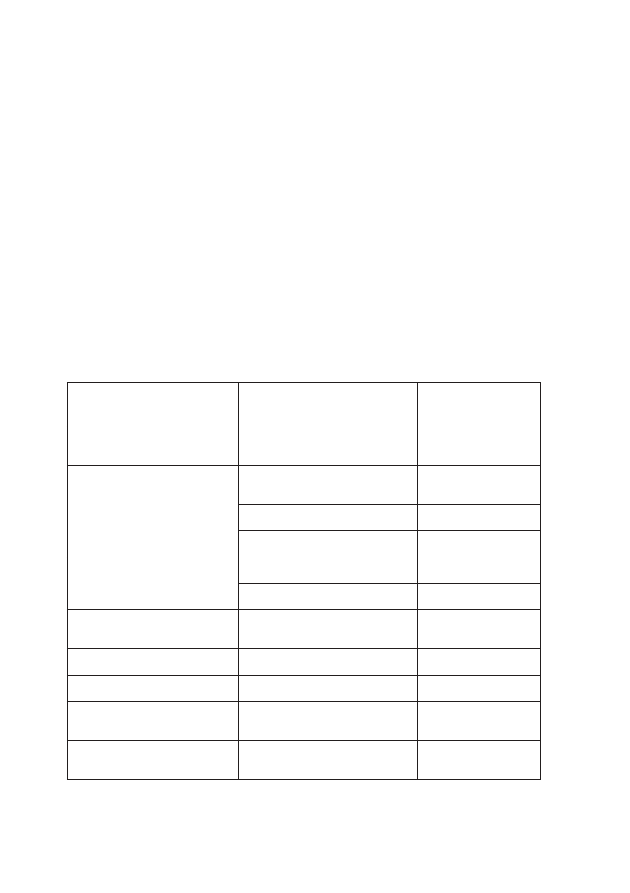
ne z badania przezprzełykowego to ocena przewodzenia przedsionkowo-
-komorowego, rozpoznanie zespołu preekscytacji, zespołu tachykardia-bra-
dykardia, kwalifikacja pacjenta do wszczepienia układu stymulującego. Jest
to badanie stojące na pograniczu badań inwazyjnych i nieinwazyjnych i mu-
si być wykonywane w warunkach szpitalnych.
Programowana stymulacja komór ma na celu wywołanie zaburzeń rytmu
występujących spontanicznie, potencjalnie zagrażających życiu i ustaleniu
empirycznie skutecznego leczenia farmakologicznego lub wskazań do wszcze-
pienia defibrylatora-kardiowertera. W praktyce klinicznej ten sposób dobo-
ru leczenia stosowany jest obecnie coraz rzadziej i nie jest bardziej precyzyj-
ny od powtarzanego badania holterowskiego. Mapowanie – poszukiwanie
w przedsionkach lub komorach obszaru odpowiedzialnego za zaburzenia
rytmu – jest wstępem do leczenia, polegającego na przezskórnej ablacji tzw.
substratu arytmii. Badania te wykonuje się w wyspecjalizowanych ośrodkach
dysponujących odpowiednią aparaturą i doświadczeniem.
Objaśnienia skrótów:
EF - frakcja wyrzutowa, HRV - zmienność rytmu zatokowego,
HR śr. - średnia dobowa częstość serca, LP - późne potencjały komorowe.
Tabela 3: Ocena zagrożenia nagłą śmiercią sercową
zaburzenia rytmu
prawdopodobne
EKG wysokiego
wzmocnienia
LP
ograniczona
odruch z baroreceptorów obniżona wrażliwość
udowodniona
zmienność załamka T
zmienność mikrowoltowa
ograniczona
koronarografia
• choroba trzech naczyń
• pień LTW
udowodniona
badanie
elektrofizjologiczne
indukowany utrwalony VT
ograniczona
wzrost HR śr.
prawdopodobna
test wysiłkowy
niedokrwienie
udowodniona
spadek HRV
udowodniona
BADANIE
POMOCNICZE
WSKAŹNIK
ZAGROŻENIA
PRZYDATNOŚĆ
KLINICZNA
badanie
echokardiograficzne
EF <35-40%
udowodniona
badanie holterowskie
liczne złożone komorowe
zaburzenia rytmu
prawdopodobna
42

Inne badania, takie jak EKG wysokiego wzmocnienia, pozwalające na re-
jestrację mikrowoltowych potencjałów w komorach, ocena załamka T czy
badanie odruchu z baroreceptorów mają mniejsze znaczenie kliniczne i pro-
gnostyczne, wykonywane są rzadziej i nie należą do standardu w diagnosty-
ce zaburzeń rytmu serca. Szersze omówienie przydatności badań dodatko-
wych znajdzie czytelnik w innych rozdziałach.
Zapamiętaj!
1. Najważniejszą przyczyną zaburzeń rytmu serca jest choroba niedokrwienna
serca, dlatego zawsze należy ustalić lub wykluczyć jej rozpoznanie oraz oce-
nić stopień zaawansowania.
2. Nie powinno się rozpoczynać leczenia lekami antyarytmicznymi wyłącznie
na podstawie wyniku spoczynkowego badania EKG.
3. Leczenie zaburzeń rytmu serca jest najskuteczniejsze, gdy usunie się ich
przyczynę, dlatego tak ważne jest dokładne zebranie wywiadu i wykonanie
przemyślanych badań diagnostycznych.
Warto przeczytać:
J.W. Mason for the ESVEMI Investigators: A comparison of electrophy-
siologic testing with Holter monitoring to predict antiarrhythmic drug efficacy
for ventricular tachyarrhythmias. N. Engl. J. Med. 1993; 329, 445.
Techniques for arrhythmia assessment and management. Cardiac Arrhythmia.
P. J. Podrid i P. R. Kowey (red.), Williams & Wilkins, Baltimore 1995.
Standardy Polskiego Towarzystwa Kardiologicznego:
http://www.ptkardio.pl
43
III. ELEKTROKARDIOGRAM SPOCZYNKOWY
W DIAGNOSTYCE ZABURZEŃ RYTMU
Andrzej Światowiec, Artur Mamcarz
Diagnostyka elektrokardiograficzna zaburzeń rytmu jest zagadnieniem
niezwykle złożonym. W ostatnich latach rozwinęły się różne inne metody dia-
gnozowania arytmii, jak chociażby powszechnie już niemal dostępna 24-godzin-
na rejestracja zapisu EKG (bad. holterowskie) czy też bardziej złożone ba-
dania elektrofizjologiczne – uśredniony zapis EKG (uEKG), stymulacja
przezprzełykowa przedsionków, programowana stymulacja komór (EPS) czy
też inwazyjne metody rejestracji potencjałów wewnątrzsercowych.
W codziennej praktyce elektrokardiogram spoczynkowy pozostaje jednak
najsilniejszym orężem w ręku lekarza. Analiza standardowego zapisu EKG
jest w większości przypadków całkowicie wystarczająca do postawienia wła-
ściwego rozpoznania. Z jednym zastrzeżeniem – trzeba umieć czytać EKG.
Bardzo celnie ujął to w swoim wielkim podręczniku elektrokardiografii
Schamroth: „Dostrzega się tylko to, czego się szuka, a szuka się tylko tego,
o czym się wie”.
Dla przypomnienia:
W niniejszym rozdziale prześledzimy wszystkie rodzaje zaburzeń rytmu,
ale nie wszystkie znane w kardiologii. Skupimy się na najczęściej występu-
jących, a co za tym idzie na najistotniejszych z punktu widzenia lekarza
praktyka.
Rytm zatokowy miarowy 70/min (zapis 25 mm/s)
44
• prawidłowa częstość rytmu zatokowego wynosi 60-100/min;
• załamek P jest zawsze dodatni w odprowadzeniu I i II, a ujemny
w odprowadzeniu aVR;
• po każdym załamku P występuje zespół QRS;
• cykl P-P jest niezmienny lub ulega zmianie nie większej niż 100 ms
(0,1 s).
Zgodnie z obowiązującym podziałem zaburzeń rytmu, wyróżniamy dwie
zasadnicze grupy arytmii:
Ponieważ zaburzenia przewodzenia omówione zostaną w innym rozdziale, tu-
taj przedstawione zostaną tylko zaburzenia należące w tym podziale do grupy A.
ZABURZENIA CZYNNOŚCI WĘZŁA ZATOKOWEGO
Przyspieszenie zatokowe (tachykardia)
Częstość rytmu w granicach 100-160/min. U młodych zdrowych osób mo-
że osiągać nawet 180-200/min. Pozostałe kryteria elektrokardiograficzne są
takie, jak w rytmie zatokowym.
Zwolnienie zatokowe (bradykardia)
Jest to rytm zatokowy o częstości poniżej 60/min. Za granicę fizjologicz-
nej bradykardii (podczas snu) przyjmuje się częstość rytmu 40/min, przy
czym odstęp P-Q pozostaje w normie (0,12-0,2 s).
Rycina 1: Tachykardia zatokowa 106/min (zapis 25 mm/s)
A. zaburzenia tworzenia impulsów;
B. zaburzenia przewodzenia impulsów.
45
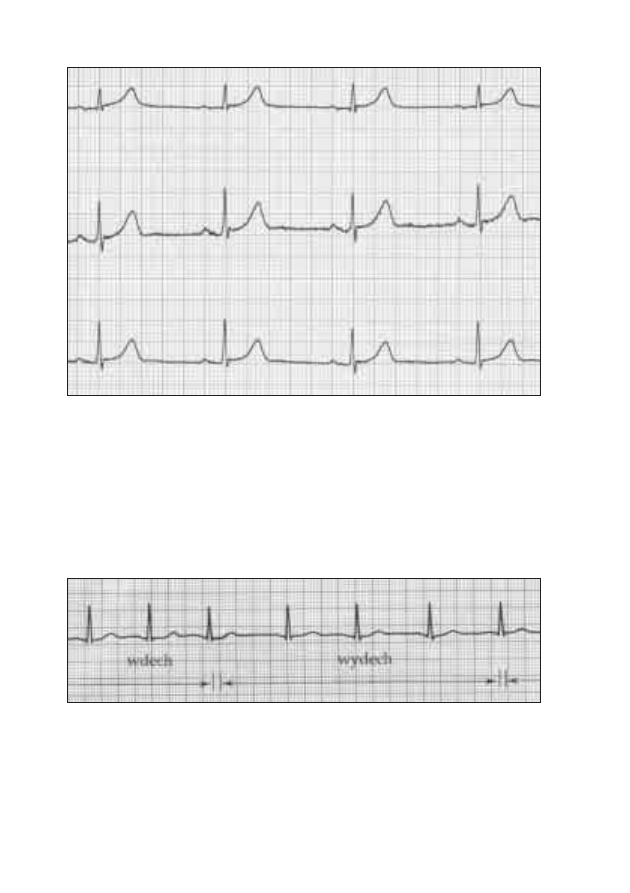
Niemiarowość zatokowa
Podobnie jak w miarowym rytmie zatokowym niezmienny pozostaje od-
stęp P-Q oraz kształt załamka P. Natomiast zdecydowanie większa może być
różnica cyklu P-P i wynosi zwykle >0,16 s. Najczęściej jest to niemiarowość
oddechowa i nie ma żadnego znaczenia klinicznego. Częstość rytmu wynosi
zwykle 45-100/min.
Innym nieco zjawiskiem jest niemiarowość zatokowa bezładna występują-
ca w przebiegu organicznych chorób serca. Różnice cyklu P-P są tutaj więk-
sze (>0,2 s), a zwolnienie rytmu zatokowego <50/min powoduje nierzadko
włączanie się rytmów zastępczych.
Rycina 3: Niemiarowość zatokowa (zapis 25 mm/s)
Rycina 2: Bradykardia zatokowa 50/min (zapis 25 mm/s)
46
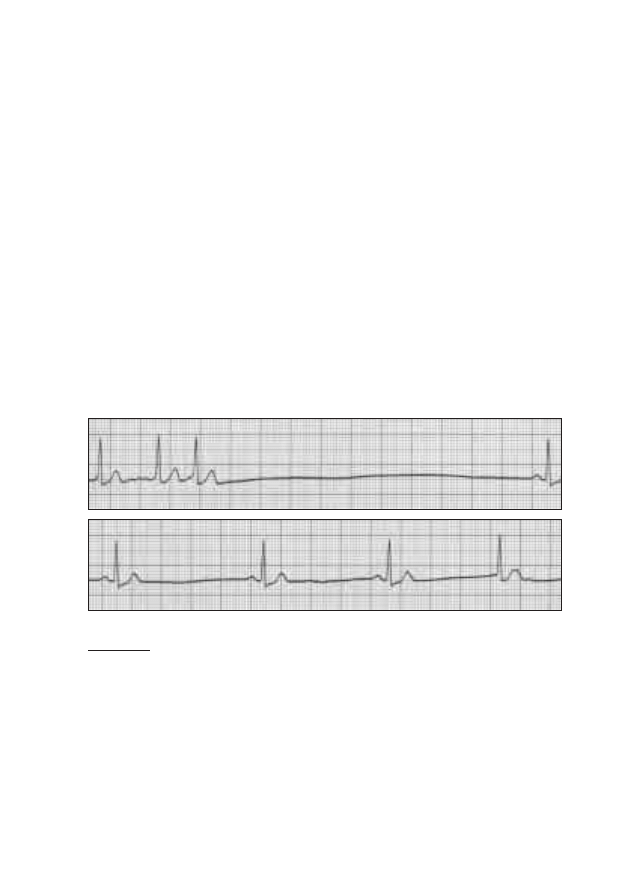
Wędrowanie rozrusznika
Zaburzenie to można uznać za formę niemiarowości zatokowej – częstość
rytmu oraz cyklu P-P jest podobna, odstęp P-Q bywa niestały, ale zawsze
w granicach normy. Jedynym odstępstwem jest zmienność kształtu załamka
P, z tym jednak, że zachowane są cechy jego zatokowego pochodzenia. Ta
zmienność kształtu wynika z przemieszczania się rozrusznika w obrębie wę-
zła zatokowego, niemniej rytm pozostaje rytmem zatokowym.
Zahamowanie zatokowe
Jest to ustanie czynności bodźcotwórczej węzła zatokowego. W zapisie
EKG stwierdza się nagłe zwolnienie rytmu oraz brak załamka P i zespołu
QRS przez okres nawet kilku tysięcy milisekund (kilku sekund). Po tej pau-
zie węzeł zatokowy podejmuje czynność bodźcotwórczą, ewentualnie w je-
go zastępstwie podejmuje ją inny ośrodek. W skrajnych przypadkach docho-
dzi do kilkunastosekundowej asystolii. Przyczyną tego rodzaju zaburzeń
może być wzmożone napięcie układu przywspółczulnego, ale najczęściej jest
to choroba węzła zatokowego (sick sinus syndrome, SSS).
Zahamowanie zatokowe wymaga często różnicowania z blokiem zatoko-
wo-przedsionkowym II stopnia (blok zatokowo-przedsionkowy I i III stopnia
jest w standardowym EKG niemożliwy do ustalenia), w którym nagłe zwol-
nienie rytmu jest rezultatem wypadnięcia (jednego bądź więcej) pobudze-
nia zatokowego, w wyniku czego długi odstęp P-P jest dwu- lub wielokrot-
nością prawidłowego cyklu.
Rycina 4: Zahamowanie zatokowe (zapis 25 mm/s)
Komentarz: w tym przypadku pauzę kończy pobudzenie zatokowe, po którym pojawia się
prawidłowy zespół QRS. Rytm zatokowy jest jednak bardzo wolny, ok. 30/min. Rolę rytmu
prowadzącego przejmuje więc węzeł przedsionkowo-komorowy (ostatni zespół QRS nie jest
poprzedzony załamkiem P - rytm węzłowy).
47
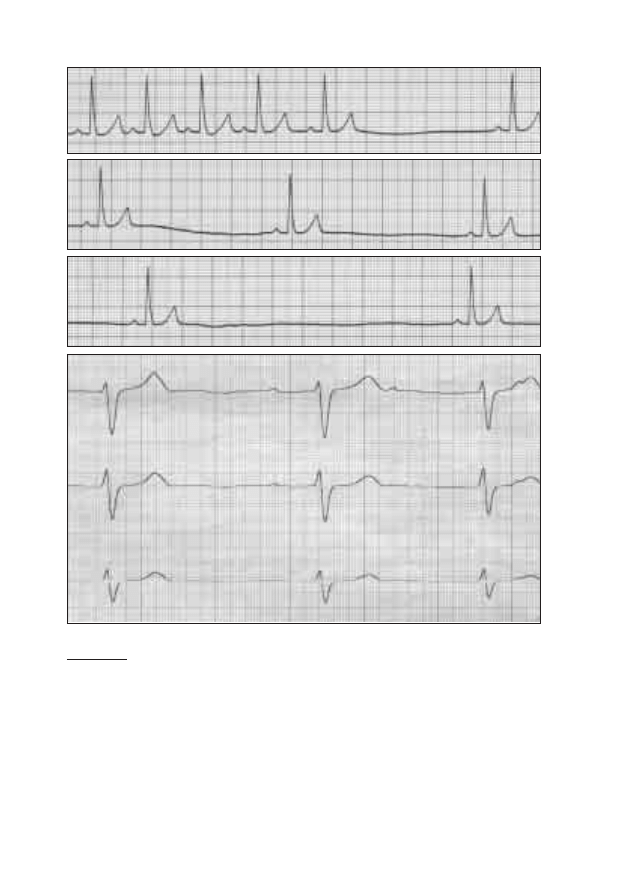
POBUDZENIA I RYTMY POZAZATOKOWE
Przedsionkowe pobudzenia przedwczesne (ekstrasystolia przedsionkowa)
Są to powstające przedwcześnie pobudzenia w przedsionkowym ognisku
ektopicznym zaburzające miarowość rytmu zatokowego. W elektrokardio-
grafii oznaczane są jako P'. Załamek P' ma zawsze w ekstrasystolii przed-
Rycina 5: Blok zatokowo-przedsionkowy (zapis 25 mm/s)
Komentarz: jest to blok ze zmiennym stopniem przewodzenia - od 2:1 do 5:1. Wielokrotności
cyklu P-P (880 ms) nie są idealne, mieszczą się jednak w różnicy <100 ms, a więc spełniają
kryteria rytmu zatokowego.
48
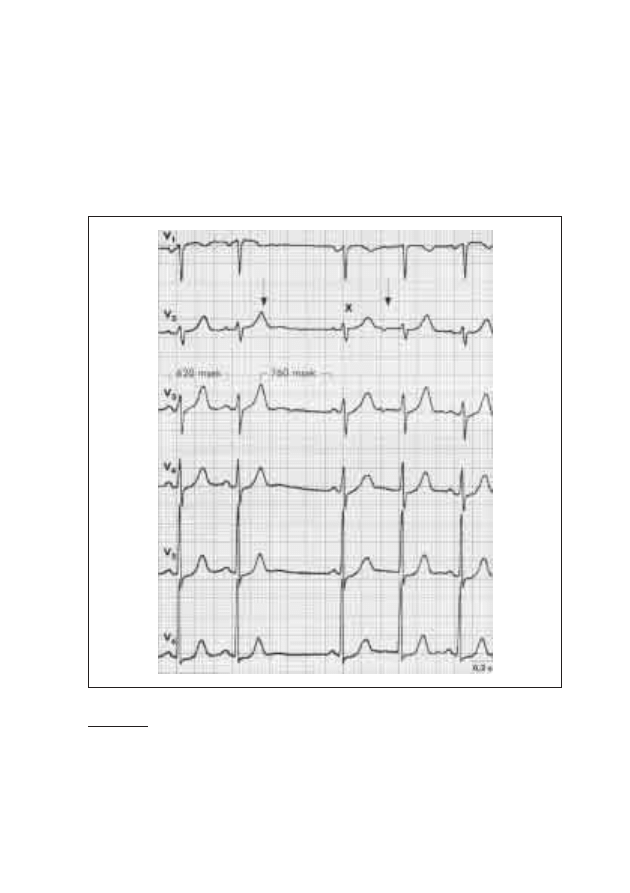
sionkowej kształt odmienny od załamka P pochodzenia zatokowego. Jeżeli
pobudzenie dodatkowe jest bardzo wczesne, tzn. trafia na refrakcję (okres
niepobudliwości) węzła przedsionkowo-komorowego, to zostaje zablokowa-
ne. Oznacza to w praktyce, że w zapisie EKG po załamku P' nie pojawia się
zespół QRS. Pobudzenie przedwczesne może być też przewiedzione z wy-
dłużeniem czasu P'-Q. Wtedy nierzadko zespół QRS ulega zniekształceniu
w wyniku zmienionego toru depolaryzacji komór (zjawisko aberracji).
Rycina 6: Przedsionkowe pobudzenia przedwczesne (zapis 25 mm/s)
Komentarz: załamki P' oznaczono strzałkami. Pierwszy z nich, bardzo wczesny, zniekształcający
załamek T to pobudzenie przedwczesne zablokowane (fala pobudzenia przedwczesnego
„ugrzęzła” w węźle A-V) - nie pojawia się po nim zespół QRS. Drugie pobudzenie przedwczesne
z wydłużonym czasem P'-Q zostało już przewiedzione do komór - świadczy o tym występujący
po załamku P' zespół QRS. Załamek P' jest wyraźnie różny od załamka P. Zespół QRS
zaznaczony krzyżykiem, to pobudzenie zastępcze z węzła A-V - świadczy o tym fakt, że pojawia
się on wcześniej (krótsze P-Q) od przewiedzionych prawidłowo (dwóch pierwszych oraz
ostatniego).
49

Napadowy częstoskurcz nadkomorowy
Może występować incydentalnie u osób zdrowych, bądź u osób uważanych
za zdrowe, to znaczy takich, u których dostępnymi metodami badawczymi
nie udało się zdiagnozować żadnej istotnej patologii.
Jest to zaburzenie rytmu spowodowane obecnością nawrotnej fali pobu-
dzenia (mechanizm re-entry). Bardzo rzadko jest rezultatem wzmożonego
automatyzmu ośrodków ekotopowych. Wyróżnia się 6 rodzajów częstoskur-
czu nadkomorowego, z których najczęściej występującym jest częstoskurcz
nawrotny w obrębie łącza przedsionkowo-komorowego. Kryteria rozpozna-
nia są następujące:
Różnicowanie częstoskurczów nadkomorowych z wąskimi zespołami QRS
jest zagadnieniem niezwykle złożonym i przekracza ramy tego rozdziału.
Innym problemem jest różnicowanie częstoskurczów z szerokimi zespoła-
mi QRS. Możemy mieć tutaj do czynienia z częstoskurczem nadkomorowym
z współistniejącym blokiem odnogi pęczka Hisa, z częstoskurczem w prze-
biegu zespołu WPW, wreszcie z częstoskurczem komorowym. Każdy z tych
częstoskurczów ma inny wpływ na rokowanie bliższe i dalsze u konkretne-
go pacjenta i podlega odmiennej farmakoterapii. Właściwe różnicowanie ma
więc tutaj zasadnicze znaczenie kliniczne. Wszystkie te częstoskurcze łączy
jedno – każdy z nich może być z powodzeniem leczony kardiowersją elek-
tryczną.
• załamek P inicjujący częstoskurcz ma inny kształt niż załamek P
pochodzenia zatokowego i jest przewiedziony do komór z
dłuższym czasem P-Q;
• załamki P' będące rezultatem wstecznego pobudzenia
przedsionków są albo ukryte w zespołach QRS, albo widoczne po
zespołach QRS z czasem R-P' < P'-R;
• częstość rytmu komór wynosi 140-250/min;
• zespoły QRS o prawidłowym kształcie (wąskie), z wyjątkiem
współistniejących bloków odnóg pęczka Hisa i zespołów
preekscytacji.
50
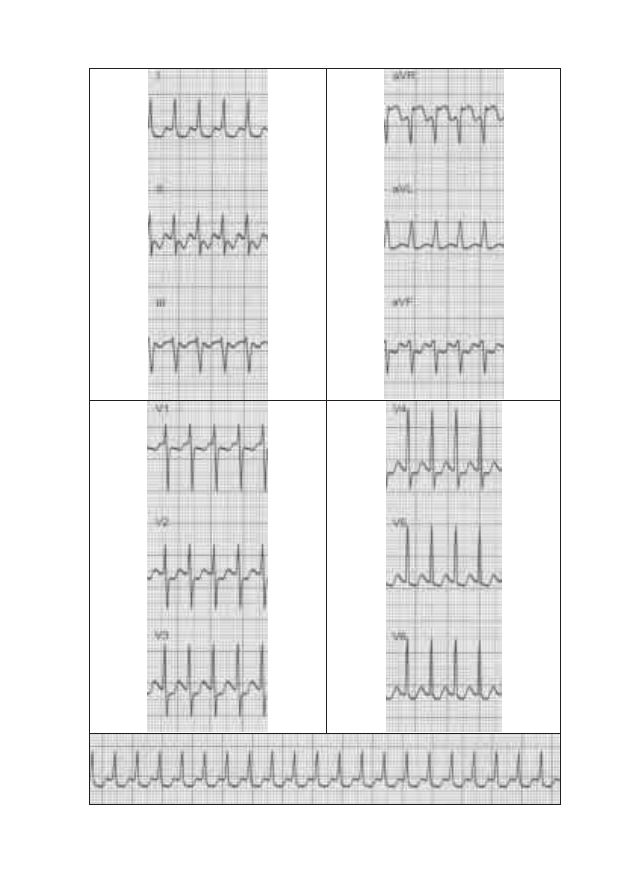
Rycina 7: Częstoskurcz nadkomorowy (zapis 25/s)
51

Różnicowanie częstoskurczów jest zagadnieniem bardzo złożonym, nie-
rzadko na podstawie standardowego zapisu EKG wręcz niemożliwym. War-
to może wspomnieć o kilku wskazówkach, pamiętając, że to tylko wierzcho-
łek góry lodowej:
Częstoskurcz przedsionkowy z blokiem (PAT z blokiem)
Zaburzenie rytmu określane w polskim piśmiennictwie jako skrót od an-
gielskiej nazwy paroxysmal atrial tachykardia with block (PAT z blokiem), na-
leży do najbardziej typowych ponaparstnicowych zaburzeń rytmu – w około
80% przypadków jest skutkiem toksycznego wpływu glikozydów naparstnicy.
Rozpoznanie elektrokardiograficzne:
• częstość załamków P zwykle 140-220/min (wartości graniczne:
110-280/min);
• pomiędzy załamkami P stwierdza się obecność linii izoelektrycznej
(zjawisko pomocne przy różnicowaniu z trzepotaniem
przedsionków);
• obecność bloku przedsionkowo-komorowego II° (zwykle jest to
blok typu Mobitz II 2:1, ale może być to 3:1 czy też 4:1, a czasem
blok typu Mobitz I – periodyka Wenckebacha).
• jeżeli częstoskurcz z wąskimi zespołami QRS nie jest poprzedzony
załamkiem P, należy myśleć o częstoskurczu węzłowym;
• jeżeli częstość rytmu komór w częstoskurczu nadkomorowym
przekracza 250/min, należy podejrzewać trzepotanie przedsionków;
• jeżeli w częstoskurczu z szerokimi zespołami QRS stwierdza się
wsteczne pobudzenie przedsionków o czasie R-P' <0,11 s,
przemawia to za częstoskurczem nadkomorowym.
Zapamiętaj!
Jeżeli skutkiem częstoskurczu jest:
• ostry zespół wieńcowy/zawał serca,
• obrzęk płuc,
• wstrząs kardiogenny,
• zaburzenia świadomości,
wykonaj pilnie kardiowersję elektryczną niezależnie od charakteru
częstoskurczu.
52
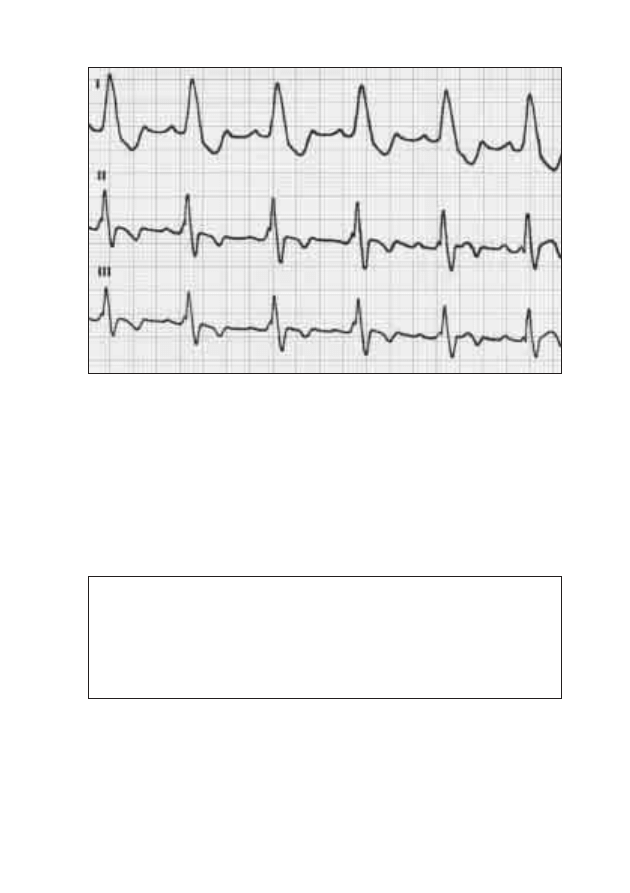
PAT z blokiem najczęściej wymaga różnicowania z trzepotaniem przed-
sionków i często jest to bardzo trudne. Warto jednak pamiętać, że fala trze-
potania jest niezwykle miarowa, a odstępy P-P w częstoskurczu nie są ideal-
nie równe.
Trzepotanie przedsionków
Rozpoznanie elektrokardiograficzne:
Warto zaznaczyć, że trzepotanie przedsionków najłatwiej ze wszystkich
znanych zaburzeń rytmu poddaje się kardiowersji elektrycznej – niemal
100% skuteczności.
• miarowa fala trzepotania (fala F) o częstości 250-350/min
(w postaci typowej fala F określana jest jako „zęby piły”);
• częstość i miarowość rytmu komór zależy od przewodzenia
w węźle A-V (przy stałym przewodzeniu rytm komór jest
miarowy).
Rycina 8: Częstoskurcz przedsionkowy (PAT) z blokiem (zapis 25 mm/s)
53
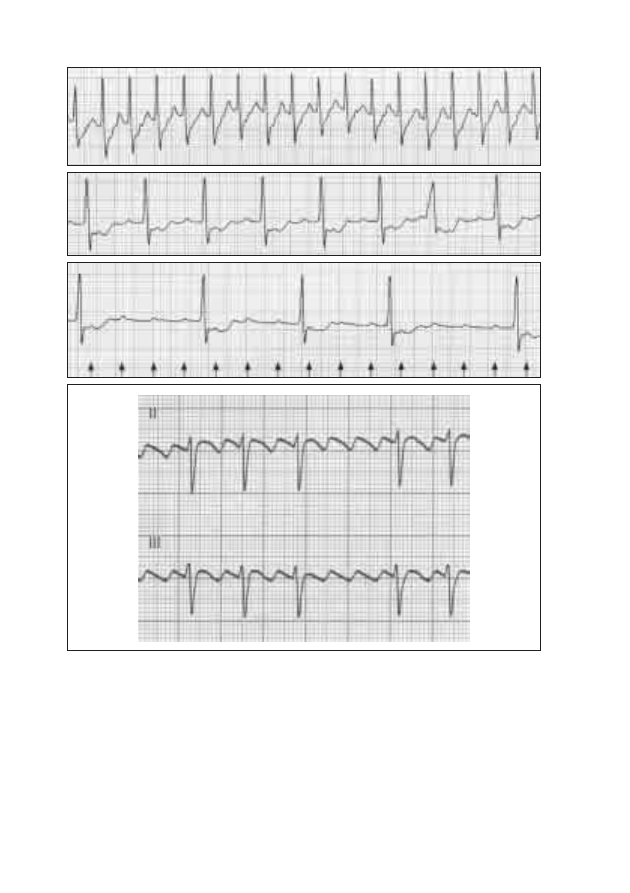
Migotanie przedsionków
Jest jednym z najczęściej stwierdzanych zaburzeń rytmu. Występuje w po-
staci napadowej, przetrwałej i utrwalonej, ale w zapisie EKG manifestuje się
zawsze podobnie:
Rycina 9: Trzepotanie przedsionków (zapisy 25 mm/s)
Komentarz:
a) przewodzenie w węźle A-V 1:1; b) przewodzenie w węźle A-V 2:1;
c) przewodzenie w węźle A-V 3:1 i 4:1, stąd czynność komór nie jest miarowa;
d) klasyczna fala F („zęby piły”).
54
a.
b.
c.
d.
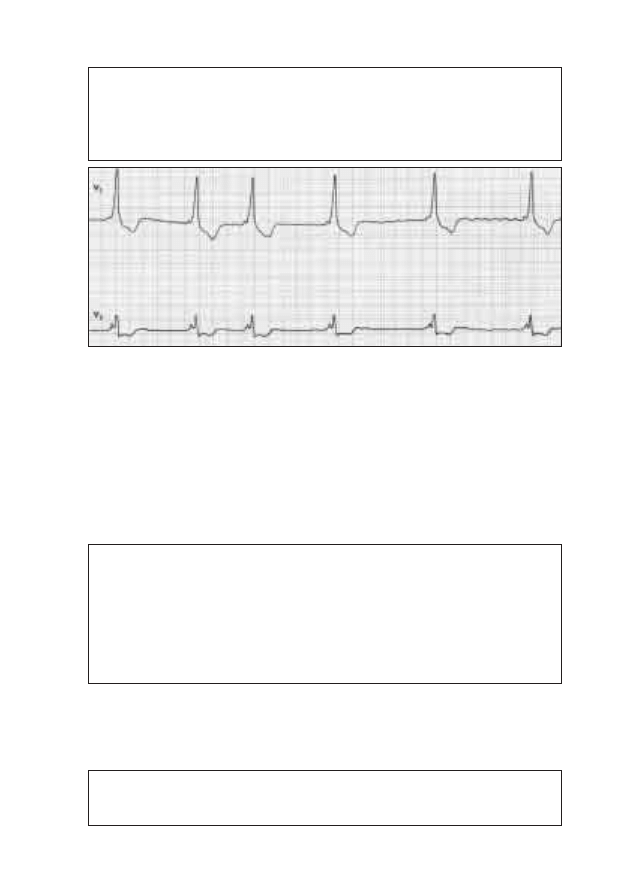
Częstość rytmu komór waha się zwykle od kilkudziesięciu do 200/min, gdyż
przewodzenie w węźle A-V zwykle nie przekracza 200 impulsów/min. Stwier-
dzenie w zapisie EKG migotania przedsionków z czynnością komór >200/min
nakazuje podejrzewać zespół preekscytacji, a jeżeli zespoły komorowe są do-
datkowo szerokie (>0,12 s), to rozpoznanie zespołu WPW jest niemal pewne.
Wyjątkowo w migotaniu przedsionków stwierdza się miarową czynność ko-
mór. Znane są dwie takie sytuacje:
WĘZŁOWE ZABURZENIA RYTMU
Możemy je podzielić na:
• pobudzenia i rytmy bierne (zastępcze);
• pobudzenia i rytmy czynne.
• jeżeli częstość rytmu wynosi >60/min – jest to współistniejący
z migotaniem przedsionków nienapadowy częstoskurcz węzłowy,
zwykle w przebiegu toksycznego działania glikozydów naparstnicy;
• jeżeli częstość rytmu wynosi <60/min – jest to współistniejący
z migotaniem przedsionków blok przedsionkowo-komorowy
III stopnia.
Rycina 10: Migotanie przedsionków z czynnością komór ok. 50/min z blokiem prawej odnogi
pęczka Hisa (zapis 25 mm/s)
• obecna fala migotania (fala f) o zmiennej amplitudzie, kształcie
i czasie trwania, co zawsze skutkuje brakiem załamków P;
• częstość fali f ocenia się na 400-700/min;
• całkowicie niemiarowa czynność komór.
55
Pobudzenia i rytmy zastępcze są zawsze zjawiskiem wtórnym i ujawniają
się zwykle podczas zwolnienia czynności węzła zatokowego poniżej fizjolo-
gicznej czynności rytmu węzłowego.
Bierny rytm węzłowy wynosi 40-60/min i jest miarowy (różnice cyklu
<0,04 s).
Cechy charakterystyczne:
Przykłady zastępczych rytmów węzłowych:
Nienapadowy częstoskurcz węzłowy
W przeciwieństwie do napadowego częstoskurczu węzłowego (sklasyfiko-
wanego wśród częstoskurczów nadkomorowych) nienapadowy częstoskurcz
węzłowy nie występuje u osób zdrowych – najczęstszą jego przyczyną jest
Rycina 12: Rytm węzłowy 45/min (zapis 25 mm/s)
Rycina 11: Ekstrasystolia węzłowa (zapis 25 mm/s)
• ekstrasystolia węzłowa pojawia się przedwcześnie w stosunku do
rytmu zatokowego;
• zespół QRS zwykle jest prawidłowy, tzn. taki, jak w cyklu rytmu
zatokowego;
• wsteczne pobudzenie przedsionków – załamek P' może pojawić
się przed lub po węzłowym zespole QRS (czas P'-Q i Q-P' <0,12 s),
może też być ukryty w zespole QRS;
• typowy dla rozrusznika węzłowego kształt załamka P': ujemny
w II, III, aVF, a dodatni w I, aVR i V
1
;
• wsteczne pobudzenie przedsionków (załamek P') nie zawsze jest
obecne – nie jest to kryterium niezbędne do rozpoznania rytmu
węzłowego.
56
toksyczne działanie glikozydów naparstnicy. Nienapadowy częstoskurcz wę-
złowy jest rytmem czynnym, a jego kryteria rozpoznawcze to:
Częstość rytmu 60-130/min jest wartością pośrednią pomiędzy fizjologicz-
nym, biernym rytmem węzłowym (40-60/min) a klasycznym napadowym czę-
stoskurczem węzłowym, nadkomorowym (140-250/min).
Różnicowanie jest bardzo trudne, ale należy rozważać przede wszystkim
konwersję migotania przedsionków do trzepotania przedsionków ze stałym
blokiem przewodzenia w węźle przedsionkowo-komorowym.
KOMOROWE ZABURZENIA RYTMU
Podobnie jak w przypadku rytmów węzłowych, komorowe zaburzenia ryt-
mu dzielą się na czynne i bierne (zastępcze).
Zastępczy rytm komorowy pojawia się zwykle w przypadku wystąpienia
zaawansowanego bloku przewodzenia w węźle przedsionkowo-komorowym.
Jest rytmem bardzo wolnym, co jest charakterystyczne dla ośrodków bodźco-
twórczych zlokalizowanych w obrębie komór. Jego częstość wynosi zazwy-
czaj 30-40/min, ale spotyka się rytmy znacznie wolniejsze, nawet <20/min.
Bardzo wolne rytmy komorowe wykazują tendencję do dalszych zwolnień,
aż do zatrzymania krążenia w mechanizmie asystolii.
Czynne rytmy komorowe to:
• ekstrasystolia komorowa;
• przyspieszony rytm komorowy;
• częstoskurcz komorowy;
• migotanie komór.
Rycina 13: Nienapadowy częstoskurcz węzłowy (zapis 25 mm/s)
• częstość rytmu 60-130/min;
• obecne lub nie wsteczne pobudzenia przedsionków (kryteria jw.).
57

Ekstrasystolia komorowa (pobudzenia komorowe przedwczesne)
Charakterystyczne cechy w elektrokardiogramie:
1. Przedwczesne w stosunku do rytmu prowadzącego, poszerzone (>0,12 s)
i zniekształcone zespoły QRS z wtórnymi zmianami zespołów ST-T. Eks-
trasystolie pochodzące z lewej komory, morfologicznie przypominają
kształtem blok prawej odnogi pęczka Hisa i odwrotnie – pochodzące
z prawej komory, dają obraz jak w bloku lewej odnogi p. Hisa. Pocho-
dzące z podstawy serca są dodatnie w większości odprowadzeń przed-
sercowych, a pochodzące z okolic koniuszka serca – ujemne.
2. Ekstrasystolię komorową cechuje stały czas sprzężenia, tzn. stała odle-
głość od poprzedzającego zespołu rytmu prowadzącego (dopuszczalna
różnica czasu sprzężenia nie może przekraczać 0,08 s). Ekstrasystolie
pochodzące z jednego ogniska bodźcotwórczego mają taki sam kształt.
Pochodzące z różnych ognisk różnią się zarówno kształtem, jak i cza-
sem sprzężenia (pobudzenia złożone, wielokształtne).
3. Czas sprzężenia w ekstrasystolii komorowej jest długi, co często pozwa-
la na różnicowanie z pobudzeniami przedwczesnymi nadkomorowymi
przewiedzionymi z aberracją (zwykle z krótkim czasem sprzężenia).
Ekstrasystolie komorowe z bardzo krótkim czasem sprzężenia, a więc
obejmujące nadwrażliwą fazę repolaryzacji (w EKG jest to strefa obej-
mująca 0,04 s po szczycie załamka T) poprzedzającego pobudzenia ryt-
mu prowadzącego, określane są jako ekstrasystolie typu R/T. Stanowią
one bezpośrednie zagrożenie wystąpieniem częstoskurczu bądź migo-
tania komór. Pobudzeniem typu R/T może okazać się każda ekstrasy-
stolia komorowa, nawet ta najbardziej klasyczna, a więc o długim czasie
sprzężenia. Dzieje się tak w przypadku wydłużonego odstępu Q-T. Pobu-
dzenie przedwczesne niejako naturalnie wpisuje się wtedy w poprzedza-
jący załamek T.
4. Wsteczne pobudzenie przedsionków (w zapisie EKG jest to obecność
załamka P bezpośrednio po zespole QRS) obecne lub nieobecne. Jeże-
li występuje, to czas wstecznego przewodzenia do przedsionków (R-P')
większy od 0,11 s przemawia za pobudzeniem przedwczesnym pocho-
dzenia komorowego.
5. Ekstrasystolia komorowa często powoduje wystąpienie tzw. pełnej
przerwy wyrównawczej. Oznacza to, że odstęp pomiędzy dwoma pobu-
dzeniami zatokowymi zawierającymi między sobą ekstrasystolię komo-
rową, stanowi dwukrotność cyklu zatokowego. Dzieje się tak wtedy, kiedy
istnieje wsteczny blok przewodzenia. Jeśli go nie ma, przerwa wyrów-
58
nawcza nie jest pełna, a wtedy może być krótsza lub dłuższa od dwu-
krotności cyklu zatokowego.
Powyższe pięć cech, bardziej lub mniej typowych dla ekstrasystolii ko-
morowej nie wyczerpuje całości zagadnienia. Jest ich więcej, co powoduje,
że nierzadko różnicowanie między ekstrasystolią komorową a nadkomo-
rową z blokiem odnogi czy też z aberracją przewodzenia bywa bardzo
trudne.
Ekstrasystolia komorowa może mieć charakter pojedynczych pobudzeń
przedwczesnych jednoośrodkowych lub wieloośrodkowych, może się poja-
wiać co drugie lub trzecie pobudzenie zatokowe (bigeminia, trigeminia). Je-
żeli dwie ekstrasystolie komorowe następują bezpośrednio po sobie, nazy-
wane są parą pobudzeń komorowych. Jeżeli jest ich więcej (od 3 do 5),
określa się je jako salwę pobudzeń komorowych.
Przyspieszony rytm komorowy
Nazywany też często czynnym rytmem komorowym. Jest to arytmia bar-
dzo typowa dla pierwszych godzin zawału serca. Uważa się ją za najbardziej
typowe zaburzenie rytmu dla reperfuzji w przebiegu skutecznej fibrynolizy.
Innymi słowy, przyspieszony rytm komorowy uznawany jest za najpewniejszy
nieinwazyjny wskaźnik reperfuzji w ostrej fazie zawału serca.
Częstość rytmu zawiera się w granicach 60-100/min, rzadko do 120/min.
Najniższa częstość rytmu w częstoskurczu komorowym to 140/min. Istnieje
więc w elektrokardiografii luka klasyfikacyjna – co z rytmem komorowym
o częstości pomiędzy 120-140/min?
Charakterystyczną cechą tej arytmii jest jej niemiarowość, zwykle na po-
czątku i końcu jej występowania oraz obecność w tym czasie tzw. pobudzeń
złożonych. Czas trwania zespołów komorowych jest oczywiście
≥0,12 s.
Przyspieszony rytm komorowy ustępuje samoistnie i często nawraca, a ze
względu na swoją częstość zwykle jest bezobjawowy klinicznie. Ponieważ
nie stanowi zapowiedzi innych groźnych arytmii, nie wymaga też zwykle le-
czenia.
Rycina 14: Ekstrasystolia komorowa (zapis 25 mm/s)
59
Częstoskurcz komorowy
W rozumieniu elektrokardiograficznym, częstoskurcz komorowy jest to
salwa, co najmniej 6 następujących bezpośrednio po sobie ekstrasystolii ko-
morowych.
Cechy typowe:
W typowym częstoskurczu komorowym kształt zespołów komorowych nie
ulega zmianie, a rytm jest miarowy (różnice odstępów R-R nie przekraczają
0,02-0,03 s). Czas przewodzenia wstecznego impulsów z komór do przedsion-
ków dłuższy niż 0,11 s (R-P' >0,11 s) przemawia za komorowym pochodze-
niem częstoskurczu, ale nie jest to kryterium pewne! Jak już wspominano przy
okazji omawiania częstoskurczów nadkomorowych, różnicowanie częstoskur-
czów z szerokimi zespołami QRS (bloki odnóg, aberracja, zespół WPW) bywa
bardzo trudne. Jednak, jeżeli rozpoznanie elektrokardiograficzne charakteru
częstoskurczu jest niepewne, należy przyjąć, że jest to częstoskurcz komorowy,
a postępowaniem z wyboru jest wtedy kardiowersja elektryczna.
Różnicowanie częstoskurczów:
1. Jeżeli we wcześniejszych zapisach EKG stwierdzano blok odnogi pęczka
Hisa, a morfologia zespołów komorowych w częstoskurczu jest podobna
– przemawia to za nadkomorowym pochodzeniem częstoskurczu.
• zespoły QRS poszerzone (
≥ 0,12 s) i zniekształcone,
z następującymi po nich wtórnymi zmianami zespołów ST-T;
• częstość rytmu w granicach 140-250/min;
• nagły początek i nagły koniec napadu (z wyjątkiem przypadków,
kiedy częstoskurcz przechodzi w trzepotanie lub/i migotanie
komór).
Rycina 15: Przyspieszony rytm komorowy (zapis 25 mm/s)
60
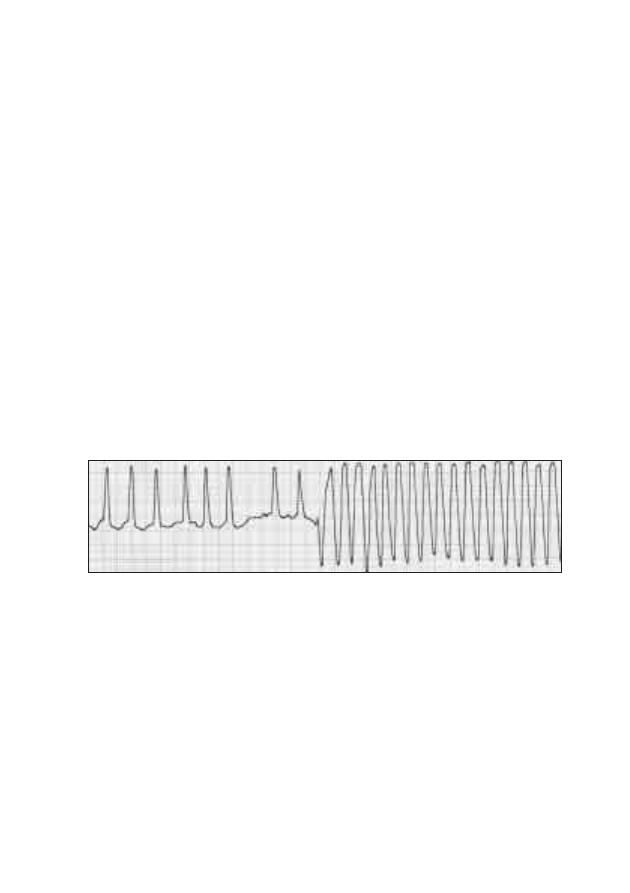
2. Jeżeli napad częstoskurczu poprzedzony jest jakąkolwiek ekstrasystolią
komorową, przemawia to za komorowym pochodzeniem częstoskurczu.
3. Jeżeli częstoskurcz poprzedzony jest przedwczesnym załamkiem P, prze-
mawia to za nadkomorowym pochodzeniem częstoskurczu.
4. Jeżeli częstoskurcz zapoczątkowany jest przedwczesnym pobudze-
niem komorowym, przemawia to za komorowym pochodzeniem czę-
stoskurczu.
5. Obecność lub brak wstecznego pobudzenia przedsionków (P') nie prze-
sądza o charakterze częstoskurczu.
6. Czas przewodzenia R-P' <0,11 s przemawia za nadkomorowym pocho-
dzeniem częstoskurczu.
7. Czas przewodzenia R-P' >0,11 s wskazuje na komorowe pochodzenie
częstoskurczu, ale nie jest cechą pewną – może występować w często-
skurczu węzłowym.
8. Sinistrogram patologiczny przemawia za częstoskurczem komorowym.
9. Obecność przewiedzionych impulsów nadkomorowych (zjawisko nieste-
ty bardzo rzadkie) zaburzających miarowość częstoskurczu, przemawia
zdecydowanie za komorowym pochodzeniem arytmii.
Nietypowe postaci częstoskurczu komorowego to częstoskurcz dwukie-
runkowy oraz częstoskurcz typu torsade de pointes. Częstoskurcz dwukie-
runkowy jest rzadkim zaburzeniem rytmu, występującym w przebiegu za-
trucia glikozydami naparstnicy. Wielokształtny częstoskurcz komorowy
(torsade de pointes) określany czasem jako „balet serca” jest bardzo cieka-
wym zjawiskiem elektrokardiograficznym. Jest to częstoskurcz występują-
cy w bardzo różnych sytuacjach klinicznych, ale charakteryzujących się jed-
ną wspólną cechą – wydłużonym odstępem Q-T. Zespoły QRS o częstości
200-250/min mają zmienny kierunek oraz różne kształty, co daje obraz cał-
kowitego bezładu, mało typowego dla klasycznego częstoskurczu komoro-
wego.
Rycina 16: Typowy częstoskurcz komorowy (zapis 25 mm/s)
61
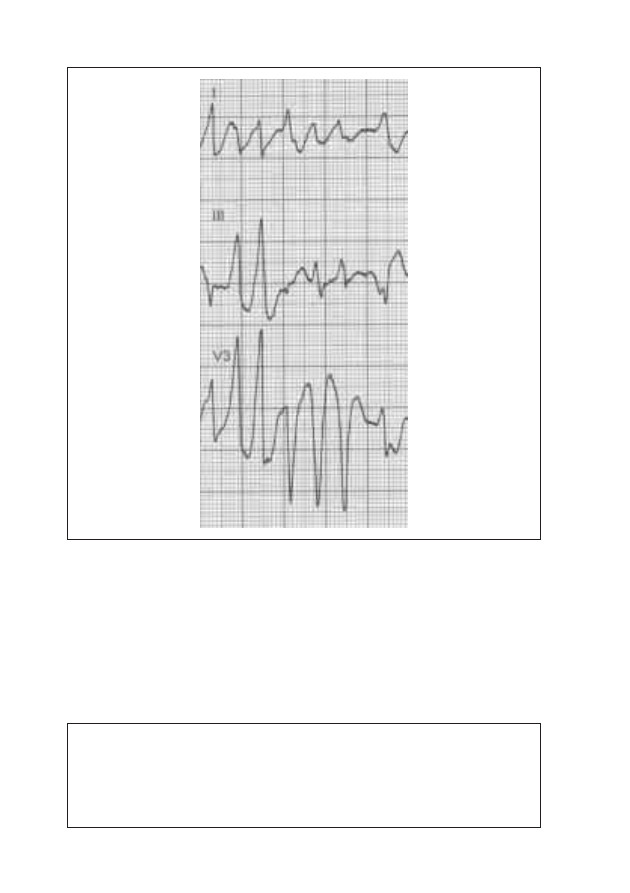
Migotanie i trzepotanie komór
Nierzadko formą przejściową między częstoskurczem komorowym a mi-
gotaniem komór jest trzepotanie komór. Zarówno trzepotanie, jak i migota-
nie komór jest równoznaczne z hemodynamicznym ustaniem czynności ser-
ca (zatrzymanie krążenia).
Różnice elektrokardiograficzne:
• w trzepotaniu komór charakterystyczna sinusoidalna fala
uniemożliwia oddzielenie zespołów QRS od zespołów ST-T;
• częstość wychyleń fali trzepotania to 180-250/min, ale może być
większa (ok. 300/min).
Rycina 17: Częstoskurcz komorowy typu torsade de pointes (zapis 25 mm/s)
62
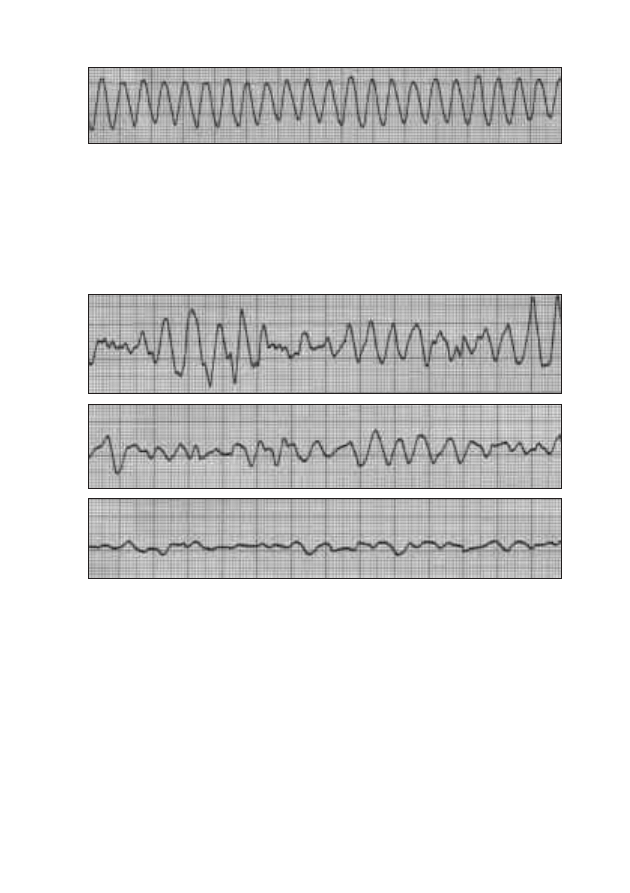
Trzepotanie komór zwykle trwa krótko i szybko przechodzi w migotanie
komór, dla którego charakterystyczne są chaotyczne wychylenia o zmiennej
amplitudzie i kierunku, o częstości 150-500/min. Rozróżnia się migotanie
wysoko- i niskonapięciowe. Ma to znaczenie rokownicze – defibrylacja elek-
tryczna jest o wiele skuteczniejsza w migotaniu wysokonapięciowym.
Migotanie komór nie zawsze jest konsekwencją częstoskurczu komorowe-
go. Może niestety wystąpić nagle, zapoczątkowane jedną bardzo wczesną
ekstrasystolią komorową typu R/T.
Migotanie komór w pierwszej dobie ostrego zawału serca, a według nie-
których autorów – w pierwszych 48 godzinach jest zjawiskiem częstym. Wy-
stępując w tym przedziale czasowym, nie pogarsza rokowania. Pojawienie
się migotania komór w późniejszych dobach zawału serca czy też w każdej
innej sytuacji klinicznej, świadczy o bardzo wysokim zagrożeniu nagłym zgo-
nem sercowym. Około 80% wszystkich zgonów spowodowanych jest migota-
niem komór.
Rycina 19: Migotanie komór – kolejne fazy: od wysokonapięciowego do niskonapięciowego
(zapis 25 mm/s)
Rycina 18: Trzepotanie komór (zapis 25 mm/s)
63
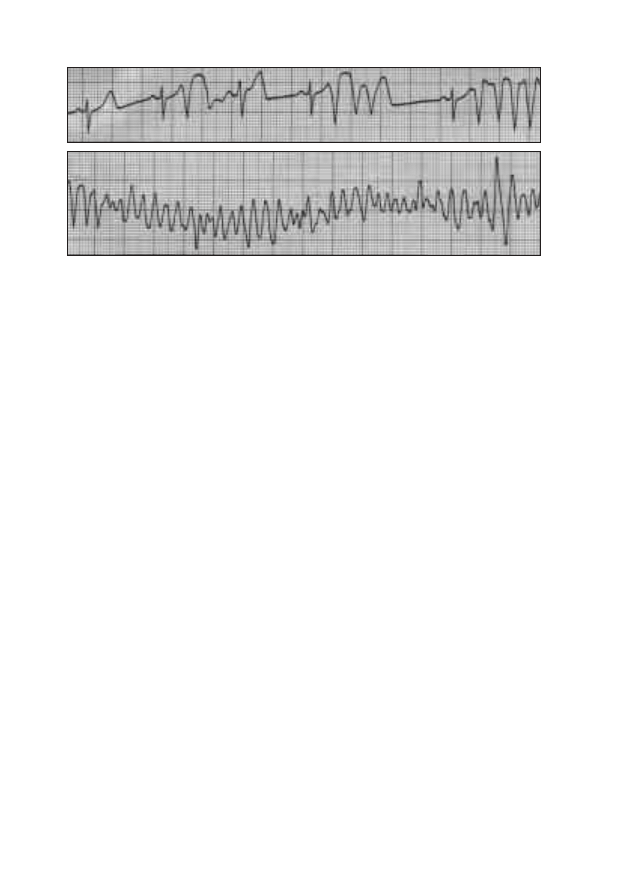
Zapamiętaj!
1. Standardowy zapis EKG nierzadko pozwala na precyzyjne rozpoznanie
arytmii.
2. Często jednak EKG jest tylko wstępem do diagnostyki zaburzeń rytmu. Ko-
lejnym krokiem powinno być wykonanie 24-godzinnego badania EKG me-
todą Holtera, a często badania ECHO serca.
3. Ważnym elementem diagnostyki zaburzeń rytmu jest test wysiłkowy EKG.
4. W uzasadnionych przypadkach konieczne jest wykonanie stymulacji przez-
przełykowej (przedsionków lub/i komór) oraz uśrednionego zapisu EKG
(uEKG) w celu stwierdzenia obecności późnych potencjałów komorowych.
Przedstawiona w niniejszym rozdziale problematyka zaburzeń rytmu jest
tylko „wierzchołkiem góry lodowej” – zainteresowanych czytelników zachęca-
my do zapoznania się z następującymi podręcznikami elektrokardiografii:
Warto przeczytać:
B. Dąbrowska, A. Dąbrowski: Podręcznik elektrokardiografii. PZWL 1986.
W. Rydlewska-Sadowska, Z. Sadowski: Zaburzenia rytmu serca. PZWL
1985.
B. Dąbrowska, A. Dąbrowski, W. Bodzoń: Ćwiczenia z elektrokardiografii.
Wydawnictwo Medycyna Praktyczna 1997.
A. Stanke: Elektrokardiogram bez tajemnic. Via Medica 1999.
Rycina 20: Migotanie komór w następstwie zjawiska R/T (zapis 25 mm/s)
64

IV.
BLOKI PRZEDSIONKOWO-KOMOROWE
Jacek Sawicki, Monika Tomaszewska-Kiecana, Jarosław Król
Bloki przedsionkowo-komorowe (P-K) powstają wskutek opóźnienia lub
przerwania przewodzenia impulsów z przedsionków do komór. Bloki P-K
dzielą się na bloki proksymalne, gdy zaburzenie przewodzenia impulsów po-
jawia się w węźle P-K lub pęczku Hisa oraz na bloki dystalne, wówczas prze-
wodzenie impulsów jest upośledzone w obrębie odnóg pęczka Hisa lub we
włóknach Purkinjego. Punktem podziału jest rozdwojenie (bifurkacja) pęcz-
ka Hisa. Ponadto bloki P-K dzieli się na bloki stałe oraz napadowe (przemi-
jające).
DIAGNOSTYKA ELEKTROKARDIOGRAFICZNA
W zależności od stopnia ciężkości upośledzenia przewodzenia impulsów
bloki P-K dzieli się na bloki I i II stopnia (bloki częściowe) oraz bloki III
stopnia (blok całkowity).
Blok przedsionkowo-komorowy I stopnia
Blok P-K I stopnia charakteryzuje się wydłużeniem odstępu P-Q powyżej
0,2 s, jednak po każdym załamku P pojawia się zespół QRS. Jest to zatem
rozpoznanie czysto elektrokardiograficzne, gdyż blok P-K I stopnia nie daje
żadnych objawów klinicznych. Wartość P-Q w granicach 0,21-0,25 s zdarza
się dość często nawet u osób zdrowych, szczególnie u osób wytrenowanych,
ale również u osób starszych. Wartość P-Q w granicach 0,26-0,30 s zwykle
wskazuje na obecność organicznej choroby serca. Niekiedy zdarzają się bar-
dzo długie odstępy P-Q (0,5-0,6 s), wówczas w razie przyśpieszonej czynno-
ści serca załamki P mogą kryć się w załamkach T poprzedzających ewolucji.
Rycina 1: Blok przedsionkowo-komorowy I stopnia (zapis 50 mm/s)
65
I
aVR
V
1
V
2
V
3
V
4
V
5
V
6
aVL
aVF
II
III
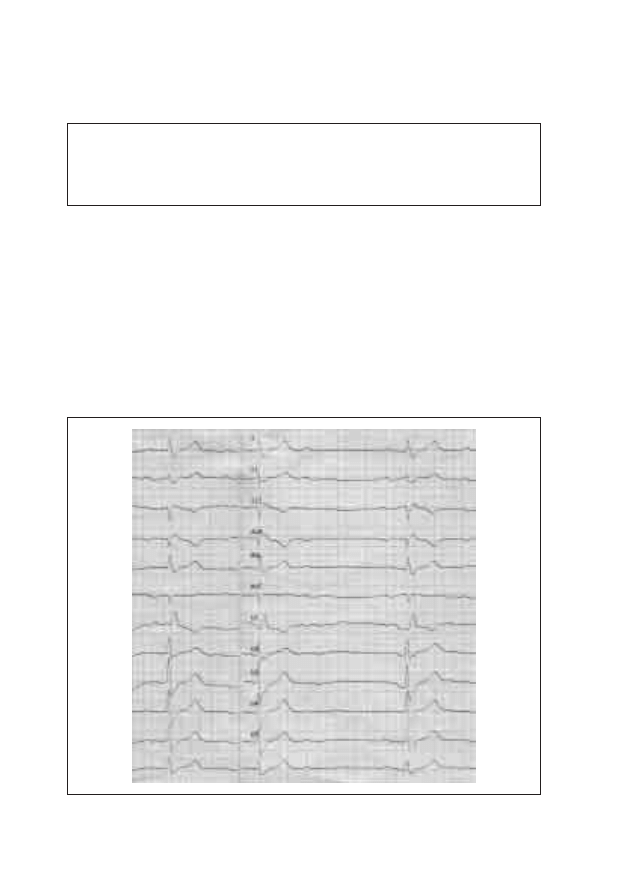
Blok przedsionkowo-komorowy II stopnia
Blok P-K II stopnia dzieli się na 3 typy:
Periodykę Wenckebacha rozpoznaje się na podstawie stopniowego wydłu-
żania się odstępu P-Q, aż do całkowitej utraty przewodzenia i braku zespołu
QRS po ostatnim załamku P. Zwykle obserwuje się sekwencje 3:2, 4:3, 5:4.
Oznacza to, że po trzecim kolejnym załamku P, po czwartym, lub po piątym
w ostatnim przykładzie „wypada” zespół komorowy. Następowa pauza po-
woduje „odpoczynek” węzła P-K i powrót jego czynności, tak iż po przerwie
odstęp P-Q ulega skróceniu do wartości wyjściowej, po czym cykl Wenckeba-
cha powtarza się. Wskutek stopniowego wydłużania się odstępu P-Q skró-
ceniu ulegają kolejne odstępy R-R, najkrótszy odstęp R-R obserwuje się bez-
pośrednio przed wypadnięciem zespołu komorowego.
Rycina 2: Blok przedsionkowo-komorowy II stopnia typu I - periodyka Wenckebacha (zapis
50 mm/s)
A. blok P-K II stopnia typu I, zwany periodyką Wenckebacha;
B. blok P-K II stopnia typu II, zwany także blokiem Mobitza;
C. blok P-K II stopnia, zaawansowany.
66
V6

Blok P-K II stopnia, II typu (blok Mobitza) charakteryzuje się nagłym
przerwaniem przewodzenia P-K i „wypadnięciem” jednego zespołu QRS,
ale bez poprzedzającego wydłużenia P-Q. Odstęp P-Q może być prawidło-
wy lub wydłużony, ale przez cały czas pozostaje wartością stałą.
Zaawansowany blok P-K II stopnia rozpoznajemy, gdy 2 lub więcej kolej-
nych zespołów komorowych ulega wypadnięciu. Przykładem będą następu-
jące sekwencje: 3: 1, 4: 1. Oznacza to, że zespół komorowy pojawia się po
trzecim załamku P (2 „wypadły”) lub zespół komorowy występuje dopiero
po czwartym załamku P (3 „wypadły”). Niektórzy autorzy do bloku zaawan-
sowanego zaliczają także blok II stopnia 2: 1; w tym przypadku co drugie
pobudzenie nie jest przewiedzione z przedsionków do komór. Wyróżnienie
zaawansowanego bloku P-K II stopnia ma duże znaczenie kliniczne, ponie-
waż zwykle towarzyszy mu „wolna” czynność serca (30-40/min), a tym sa-
mym pojawiają się typowe objawy „małego” rzutu. Wskutek wolnej czyn-
ności komór mogą występować pobudzenia i rytmy zastępcze węzłowe lub
komorowe.
Rycina 3: Blok przedsionkowo-komorowy II stopnia typu II - blok Mobitza (zapis 50 mm/s)
67
V6

Blok przedsionkowo-komorowy III stopnia
Ten rodzaj bloku P-K wskazuje na całkowite przerwanie przewodzenia
pomiędzy przedsionkami i komorami. W zapisie EKG mamy zatem nieza-
leżnie od siebie – rytm przedsionków (szybszy) oraz rytm komór (wolniej-
szy). W przypadku bloku proksymalnego, rozrusznikiem komorowym jest
zwykle zastępczy rytm węzłowy, ewentualnie rozrusznik umiejscowiony
jest w pęczku Hisa, natomiast w przypadku dystalnego bloku P-K rozrusz-
nik komorowy znajduje się w odnogach pęczka Hisa lub we włóknach Pur-
kinjego. Blok dystalny jest znacznie groźniejszy w skutkach dla chorego,
ponieważ rozrusznik umiejscowiony w komorowym układzie przewodzą-
cym często bywa niestabilny, może dojść do nagłego ustania jego czynno-
ści i do asystolii komór. Innym niebezpieczeństwem jest ektopia komoro-
wa oraz napadowe częstoskurcze komorowe wielokształtne (torsade de
pointes), które mogą spowodować nagły zgon chorego. W przypadku cał-
kowitego bloku P-K, rozrusznikiem sterującym przedsionkami jest zwykle
węzeł zatokowo-przedsionkowy, ale należy pamiętać, że blok P-K całkowi-
ty może wystąpić w przebiegu migotania przedsionków. Wówczas zamiast
całkowicie niemiarowej czynności serca (co jest typowym zjawiskiem
w migotaniu przedsionków) pojawia się wolny, miarowy rytm serca, za-
zwyczaj jest to zastępczy rytm węzłowy 50-60/min, no i oczywiście nie ma
w EKG załamków P, a mogą być widoczne fale migotania (f). Jest to jed-
na z dwóch sytuacji, kiedy w migotaniu przedsionków obserwuje się mia-
rową czynność serca. Drugą jest nienapadowy częstoskurcz węzłowy
(patrz rozdział II – Elektrokardiogram spoczynkowy w diagnostyce zabu-
rzeń rytmu).
Czy na podstawie standardowego EKG można ustalić, czy blok ma cha-
rakter proksymalny, czy dystalny? W dużej mierze jest to możliwe, a podsta-
wowym kryterium jest szerokość zespołu QRS. Wąski QRS poniżej 0,12 s
wskazuje, że pobudzenie przewodzone jest poprzez nieuszkodzony komo-
rowy układ przewodzący, tym samym, że blok jest typu proksymalnego. Sze-
roki QRS (
≥0,12 s) sugeruje uszkodzenie komorowego układu przewodzące-
Rycina 4: Zaawansowany blok przedsionkowo-komorowy II stopnia – 3:1
(zapis 25 mm/s)
68
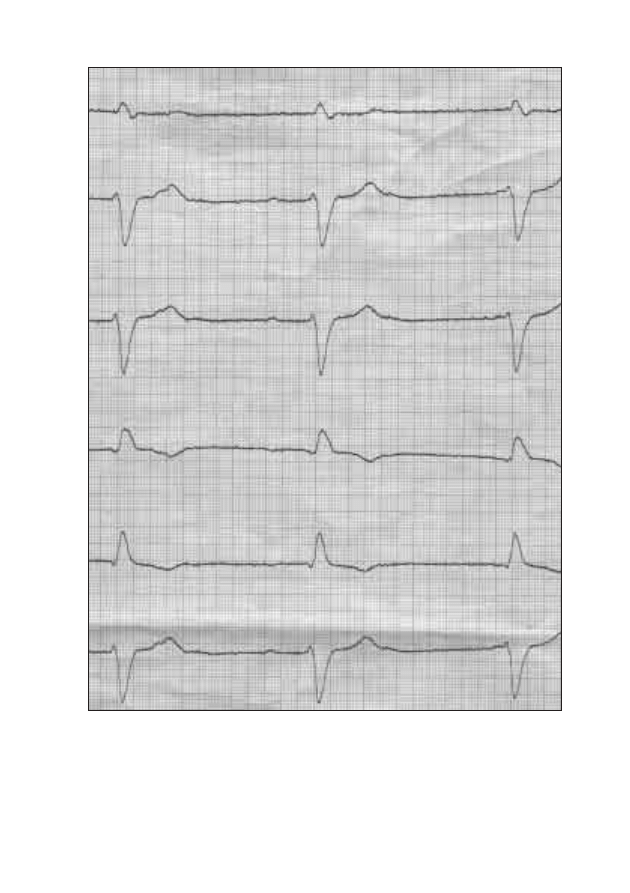
go, czyli blok dystalny. Ponadto doświadczenie kliniczne uczy, iż blok typu
periodyki Wenckebacha jest na ogół blokiem proksymalnym, a blok typu
Mobitza lub blok II stopnia zaawansowany są blokami dystalnymi. Biorąc
pod uwagę wszystkie wymienione kryteria można wyróżnić 3 grupy obrazów
EKG:
Rycina 5: Blok przedsionkowo-komorowy III stopnia (zapis 50 mm/s)
69
I
aVR
aVL
aVF
II
III

ETIOLOGIA
Ostry blok przedsionkowo-komorowy
• choroby serca:
zawał serca,
angina Prinzmetala,
infekcyjne zapalenie wsierdzia, szczególnie przy zajęciu
zastawki aortalnej i ropniach w przegrodzie
międzykomorowej,
zapalenie mięśnia sercowego (wirusowe, bakteryjne,
reumatyczne);
• przedawkowanie leków/zatrucie:
naparstnicą,
beta-adrenolitykami,
amiodaronem,
werapamilem,
innymi lekami antyarytmicznymi,
fenotiazynami,
trójcyklicznymi preparatami antydepresyjnymi;
• zaburzenia elektrolitowe: hiperkaliemia.
• te, które wskazują na proksymalny charakter bloku: blok P-K I°
bez bloku odnogi, blok P-K II° bez bloku odnogi, blok P-K III°
z zastępczym rytmem węzłowym;
• te, które wskazują na dystalny charakter bloku: blok P-K II°
typu Mobitza niekiedy z blokiem odnogi pęczka Hisa, blok
P-K III° z zastępczym rytmem komorowym, naprzemienne
występowanie bloku prawej i lewej odnogi pęczka Hisa oraz
naprzemienne występowanie bloku prawej odnogi z blokiem
przedniej wiązki odnogi lewej lub bloku prawej odnogi
z blokiem tylnej wiązki;
• blok P-K I° z blokiem odnogi pęczka Hisa może mieć charakter
zarówno proksymalny, jak i dystalny – w celu ostatecznego
ustalenia miejsca uszkodzenia przewodzenia, trzeba wykonać
elektrogram pęczka Hisa.
70

Przewlekły blok przedsionkowo-komorowy
Symptomatologia
Blok P-K I stopnia i blok II stopnia typu periodyki Wenckebacha na ogół
nie dają żadnych objawów klinicznych. Objawy, które występują u chorych
z blokiem II stopnia zaawansowanym lub z blokiem całkowitym, można po-
dzielić na objawy ostre i przewlekłe. Ostre objawy związane są z nagłym
zwolnieniem częstości serca, a nawet wręcz z ustaniem pracy serca albo z wy-
stąpieniem częstoskurczu komorowego. Są to napadowe utraty przytomno-
ści, określane napadami MAS. W lżejszych przypadkach występują zawroty
głowy, uczucie osłabienia, mroczki przed oczami, określane jako poronne
zespoły MAS albo presyncope. Zatrzymanie pracy serca na kilka sekund po-
woduje zwykle zawroty głowy, mroczki, uczucie nagłego osłabienia; zatrzy-
manie pracy serca na kilkanaście sekund powoduje utratę przytomności,
a trwające 30 sekund – dodatkowo drgawki, bezwiedne oddanie moczu. Ob-
jawy przewlekle utrzymującej się wolnej czynności serca to postępujące osła-
bienie, męczliwość, narastające objawy niewydolności serca i bóle wieńco-
we. Ze strony CUN obserwuje się z kolei stany splątania lub odwrotnie
– nadmierną drażliwość oraz postępujące otępienie.
• choroby serca:
choroba wieńcowa,
kardiomiopatie,
choroby zwyrodnieniowe układu przewodzącego
(choroba Lenegre, choroba Leva),
wrodzony blok przedsionkowo-komorowy,
uszkodzenie chirurgiczne lub w czasie ablacji,
wady serca, szczególnie zastawki aortalnej;
• choroby układowe:
sarkoidoza,
sklerodermia,
amyloidoza,
toczeń układowy,
hemochromatoza;
• choroby gruczołów wydzielania wewnętrznego
(niedoczynność tarczycy);
• blok czynnościowy (może być wywołany nadmiernym napięciem
nerwu błędnego, np. w czasie silnego kaszlu, wysiłku).
71

ROKOWANIE
Ryzyko zgonu chorego z blokiem P-K całkowitym bez wszczepionego roz-
rusznika serca przekracza 50% w ciągu roku. Z kolei w blokach II stopnia
typu dystalnego ryzyko progresji bloku do bloku całkowitego jest na tyle du-
że, że również zalecane jest wszczepienie rozrusznika serca.
Leczenie większości istotnych klinicznie bloków P-K polega na stałej elektro-
stymulacji, zagadnienie to jest szczegółowo omówione w innych rozdziałach.
Zapamiętaj!
1. Najczęstsze przyczyny ostrego bloku serca to: zawał serca, niestabilna choro-
ba wieńcowa, przedawkowanie leków kardiologicznych (beta-adrenolityki,
werapamil, naparstnica, leki antyarytmiczne) lub psychotropowych (trójcy-
kliczne antydepresanty) oraz zaburzenia metaboliczne (hiperkaliemia, kwa-
sica metaboliczna).
2. Ostre objawy bloku całkowitego lub bloku zaawansowanego to nagła utra-
ta przytomności – napad MAS (jej przyczyną może być także częstoskurcz
komorowy prowokowany wolną czynnością serca).
3. Blok całkowity musi mieć charakter napadowy.
4. Blok typu Mobitz, blok II stopnia zaawansowany i blok III stopnia to naj-
częściej tzw. bloki dystalne, w których rokowanie jest poważne.
5. Im niższa częstość rytmu zastępczego, tym większe zagrożenie dla chorego.
6. Bloki dystalne: QRS „szeroki” >0,12 s.
7. Bloki proksymalne: QRS „wąski” <0,12 s.
8. Periodyka Wenckebacha to najcześciej blok proksymalny, w którym roko-
wanie jest dobre.
9. Gdy w migotaniu przedsionków obserwujemy wolną, miarową czynność ser-
ca, to musi być to blok całkowity.
10. Roczne ryzyko zgonu z powodu bloku przedsionkowo-komorowego całkowi-
tego w przypadku braku implantacji stymulatora serca wynosi 50%.
Warto przeczytać:
W. Rydlewska-Sadowska, Z. Sadowski: Bloki przewodzenia. Zaburzenia ryt-
mu serca. PZWL 1989, 175-205.
E. Sandra, B. Sigural: Arrhythmia – a guide to clinical electrocardiology.
Verlags GmbH 1991, 245-275.
72

V.
BLOKI ŚRÓDKOMOROWE – ZABURZENIA
PRZEWODZENIA ŚRÓDKOMOROWEGO
Monika Tomaszewska-Kiecana, Jacek Sawicki, Jarosław Król
Zaburzenia przewodzenia śródkomorowego związane są ze zwolnieniem
lub przerwaniem przewodzenia impulsu elektrycznego w różnych częściach
układu przewodzącego. Bloki mogą pojawić się na różnym poziomie – na
odcinku od włókien tworzących prawą i lewą odnogę pęczka Hisa, aż do ob-
wodu (ściany komory). Najczęstszą lokalizacją bloku jest pień prawej lub le-
wej odnogi pęczka Hisa – dlatego jest zwykle nazywany blokiem odnogi.
W zależności od obrazu elektrokardiograficznego bloki śródkomorowe dzie-
limy na trzy zasadnicze grupy (podział obowiązujący według B. Dąbrowskiej
i A. Dąbrowskiego):
Bloki odnóg powstają na skutek przerwania lub zwolnienia przewodzenia,
co powoduje poszerzenie i zniekształcenie zespołów komorowych oraz opóź-
nienie czasu pobudzenia istotnego, czyli czasu od początku załamka Q do
szczytu załamka R nad odpowiednią komorą. Bloki śródkomorowe mogą
1. Bloki odnóg lub wiązek lewej odnogi pęczka Hisa:
a. blok prawej odnogi
– zupełny (całkowity),
– niezupełny;
b. blok lewej odnogi
– zupełny (całkowity),
– niezupełny,
– wiązki przedniej,
– wiązki tylnej,
– wiązki przegrodowej;
2. Bloki wielowiązkowe:
a. dwuwiązkowe
– prawej odnogi i przedniej wiązki lewej odnogi,
– prawej odnogi i tylnej wiązki lewej odnogi,
– prawej odnogi i wiązki przegrodowej lewej odnogi;
b. trójwiązkowe
– prawej odnogi oraz przedniej i przegrodowej
wiązki lewej odnogi,
– prawej odnogi oraz tylnej i przegrodowej wiązki
lewej odnogi;
c. czterowiązkowe.
73
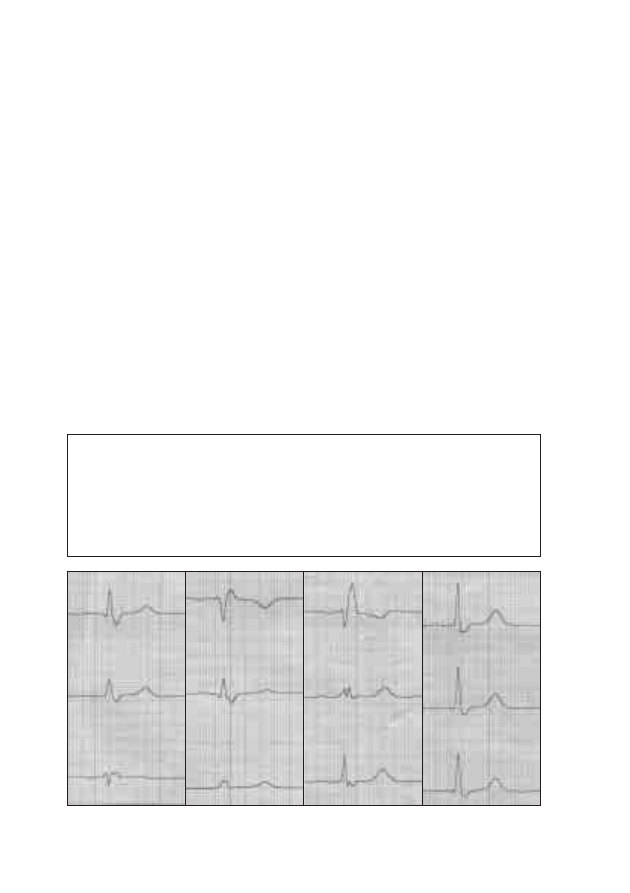
mieć charakter przemijający (ustąpienie bloku w kolejnej rejestracji zapisu
EKG), rzadziej przerywany, czyli intermitujący (zniknięcie bloku podczas
jednej rejestracji) lub naprzemienny (zespoły zablokowane występują na
przemian z prawidłowym zespołem komorowym). Zmienność występowa-
nia bloków dotyczy przede wszystkim całkowitych bloków odnóg rzadziej do-
tyczy niezupełnych bloków lub bloków wiązek.
ZUPEŁNY (CAŁKOWITY) BLOK PRAWEJ ODNOGI
Powstaje w wyniku przerwania przewodzenia impulsów w prawej odnodze
pęczka Hisa. W związku z tym pobudzenie dociera przez lewą odnogę do le-
wej komory, a następnie przez przegrodę międzykomorową do prawej ko-
mory. Jest to przyczyną opóźnienia depolaryzacji prawej komory. Blok mo-
że być zlokalizowany proksymalnie (w pniu lub rzadziej w prawej części
pęczka Hisa) lub obwodowo (tj. najczęściej w sieci włókien Purkinjego). Naj-
częściej jednak blok ten dotyczy proksymalnej części pnia prawej odnogi.
Morfologia zapisów EKG zależy od stopnia bloku, a nie od jego lokalizacji.
Kryteria elektrokardiograficzne:
Rycina 1: Blok prawej odnogi pęczka Hisa (right bundle branch block, RBBB), zapis 50 mm/s
• czas trwania zespołu QRS co najmniej 0,12 s;
• wydłużenie czasu pobudzenia istotnego w odprowadzeniach V
1
,
V
2
większe od 0,045 s;
• przeciwstawny kierunek odcinków ST i załamków T w stosunku
do głównego wychylenia zespołów QRS.
74
aVR
V
1
V
2
V
3
V
4
V
5
V
6
aVL
aVF
I
II
III
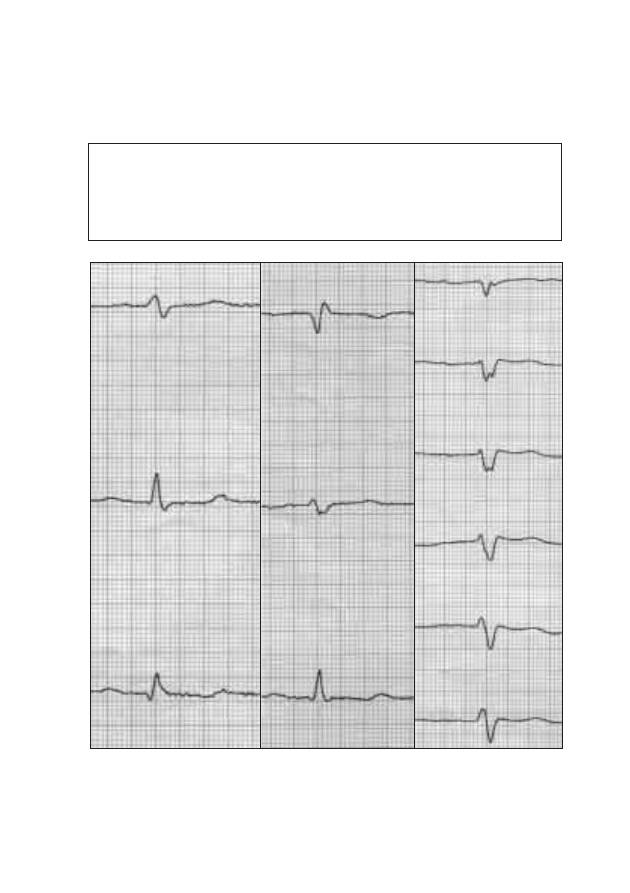
NIEZUPEŁNY BLOK PRAWEJ ODNOGI PĘCZKA HISA
Kryteria elektrokardiograficzne:
Przyczyną zupełnego lub niezupełnego bloku prawej odnogi są najczę-
ściej:
Rycina 2: Niezupełny blok prawej odnogi pęczka Hisa (zapis 50 mm/s)
• czas trwania zespołu QRS krótszy od 0,12 s;
• czas pobudzenia istotnego w V
1
większy od 0,045 s;
• obecność wtórnego załamka R w odprowadzeniu V
1
.
75
I
V
1
V
2
V
3
V
4
V
5
V
6
aVR
aVL
aVF
II
III

Niezupełny lub zupełny blok prawej odnogi pęczka Hisa może mieć także
charakter wrodzony i występować u ludzi zdrowych, bez organicznej choro-
by serca, bez żadnego znaczenia klinicznego.
ZUPEŁNY (CAŁKOWITY) BLOK LEWEJ ODNOGI PĘCZKA HISA
Powstaje w wyniku przerwania przewodzenia impulsów w lewej odnodze
pęczka Hisa. Pobudzenie dociera prawą odnogą do prawej komory, a na-
stępnie przez przegrodę międzykomorową do lewej komory. Jest to przyczy-
na opóźnienia depolaryzacji lewej komory. Blok może być proksymalny
(w pniu lub rzadziej w lewej części pęczka Hisa) lub obwodowy (w sieci włó-
kien Purkinjego). Najczęściej jednak blok dotyczy proksymalnej części pnia
lewej odnogi. Należy pamiętać, że morfologia zapisu EKG zależy od stop-
nia bloku, a nie od lokalizacji.
Kryteria elektrokardiograficzne:
• czas trwania zespołu QRS co najmniej 0,12 s;
• czas pobudzenia istotnego w odprowadzeniach V
5
i V
6
większy
od 0,06 s;
• przeciwstawny kierunek odcinków ST i załamków T w stosunku
do głównego wychylenia zespołów RS.
• pierwotna choroba układu bodźcoprzewodzącego (samoistne
włóknienie);
• niedokrwienie lub zawał mięśnia sercowego (ze względu na
unaczynienie z prawej tętnicy, blok pojawia się najczęściej
w zawale ściany dolnej);
• zapalenie mięśnia sercowego;
• przerost prawej komory;
• ostre serce płucne;
• zator tętnicy płucnej;
• wrodzone lub nabyte wady serca (ubytek przegrody
międzyprzedsionkowej, zwężenie lewego ujścia
przedsionkowo-komorowego).
76
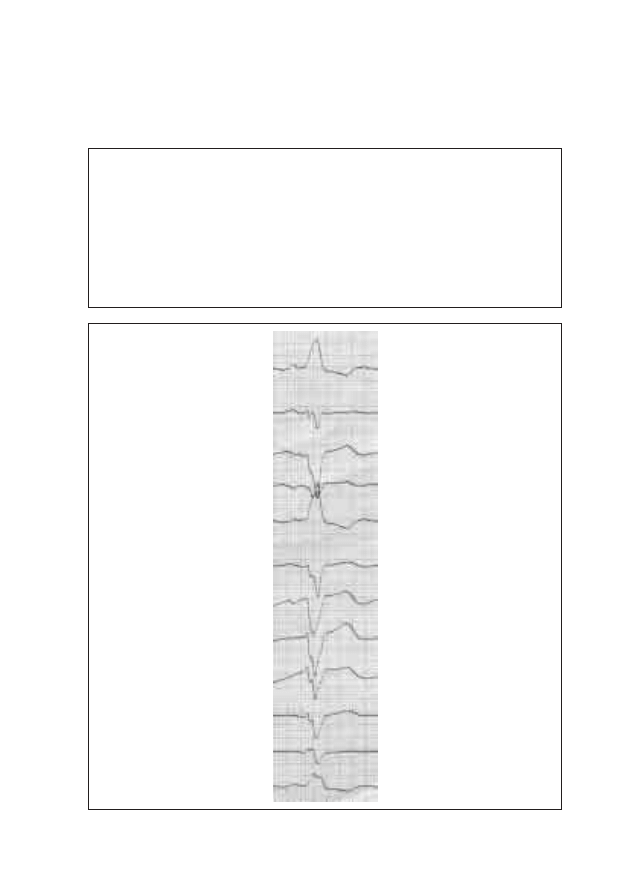
Obraz bloku lewej odnogi może odpowiadać upośledzeniu przewodzenia
w odnodze lub w jej wiązkach. Należy pamiętać, że blok lewej odnogi pęcz-
ka Hisa tylko wyjątkowo występuje u osób zdrowych. Najczęstszymi przyczy-
nami bloku lewej odnogi są:
Rycina 3: Blok lewej odnogi pęczka Hisa (left bundle branch block, LBBB) zapis 50 mm/s
• pierwotna choroba układu przewodzącego (samoistne włóknienie);
• zawał serca;
• niedokrwienie mięśnia sercowego;
• kardiomiopatie rozstrzeniowa i przerostowa;
• zapalenie mięśnia sercowego;
• przerost mięśnia lewej komory.
77
V
1
V
2
V
3
V
4
V
5
V
6
aVR
aVL
aVF
I
II
III
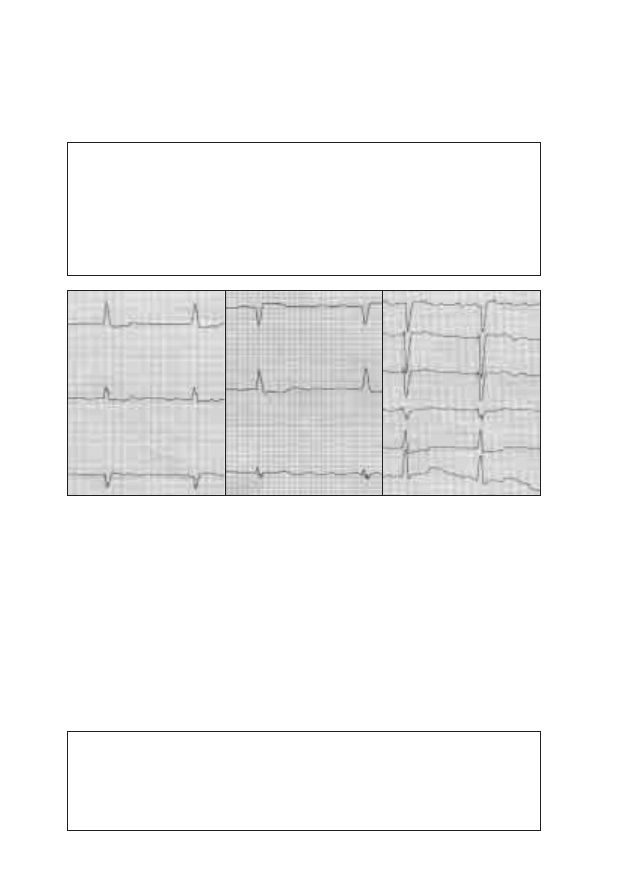
78
NIEZUPEŁNY BLOK LEWEJ ODNOGI PĘCZKA HISA
Kryteria elektrokardiograficzne:
Przyczyny niezupełnego bloku lewej odnogi pęczka Hisa są te same jak
przy bloku zupełnym.
BLOKI WIĄZEK LEWEJ ODNOGI PĘCZKA HISA
Układ anatomiczny rozgałęzień lewej odnogi obejmuje trzy podstawowe wiązki.
BLOK PRZEDNIEJ WIĄZKI LEWEJ ODNOGI PĘCZKA HISA
Kryteria elektrokardiograficzne:
• czas trwania zespołu QRS <0,12 s;
• odchylenie osi elektrycznej serca w lewo większe od -30 stopni;
• niska amplituda załamków R w odprowadzeniach II, III, aVF;
• obecne załamki Q w odprowadzeniach I i aVL.
Rycina 4: Niezupełny blok lewej odnogi pęczka Hisa i trzepotanie przedsionków
(zapis 50 mm/s)
• czas trwania zespołu QRS <0,12 s;
• czas pobudzenia istotnego w odprowadzeniach V
5
i V
6
większy od 0,06 s;
• zazębienie na ramieniu wstępującym załamków R
w odprowadzeniach I, aVL, V
5
i V
6
;
• brak załamków Q w odprowadzeniach I, aVL, V
5
i V
6
.
aVR
V
1
V
2
V
3
V
4
V
5
V
6
aVL
aVF
I
II
III
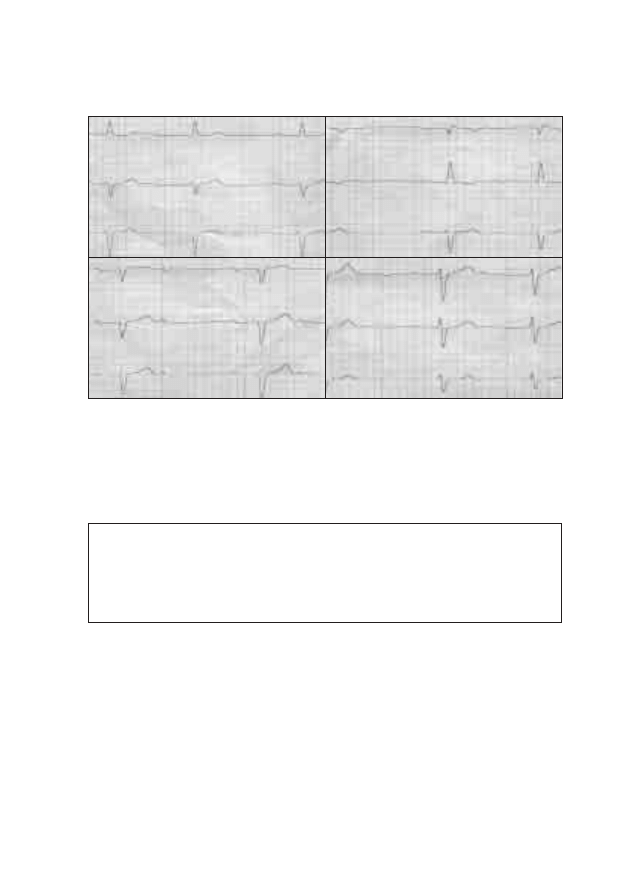
Najczęstszą przyczyną powyższych zmian jest choroba niedokrwienna ser-
ca oraz zmiany zapalne i zwyrodnieniowe.
BLOK TYLNEJ WIĄZKI LEWEJ ODNOGI PĘCZKA HISA
Kryteria elektrokardiograficzne:
Blok wiązki tylnej występuje rzadziej od bloku wiązki przedniej. Wynika
to z samej wielkości wiązek oraz z jej unaczynienia. Rozpoznanie bloku tylnej
wiązki można ustalić po wyłączeniu innych przyczyn patologicznego dekstro-
gramu. Należą do nich: przerost prawej komory, zawał bocznej ściany ser-
ca, rozedma płuc oraz pionowe położenie serca u osób młodych i szczupłych.
BLOK WIĄZKI PRZEGRODOWEJ
Blok wiązki przegrodowej można jedynie podejrzewać na podstawie elek-
trokardiogramu, ponieważ do zmian typu niezupełnego bloku lewej odnogi
• czas trwania zespołu QRS <0,12 s;
• odchylenie osi elektrycznej serca w prawo powyżej +90 stopni;
• niska amplituda załamków R w odprowadzeniach I i aVL;
• obecne załamki Q w odprowadzeniach III i aVF.
Rycina 5: Blok przedniej wiązki lewej odnogi pęczka Hisa (left anterior hemiblock, LAH)
i periodyka Wenckebacha (zapis 50 mm/s)
79
V
1
V
2
V
3
V
4
V
5
V
6
aVR
aVL
aVF
I
II
III
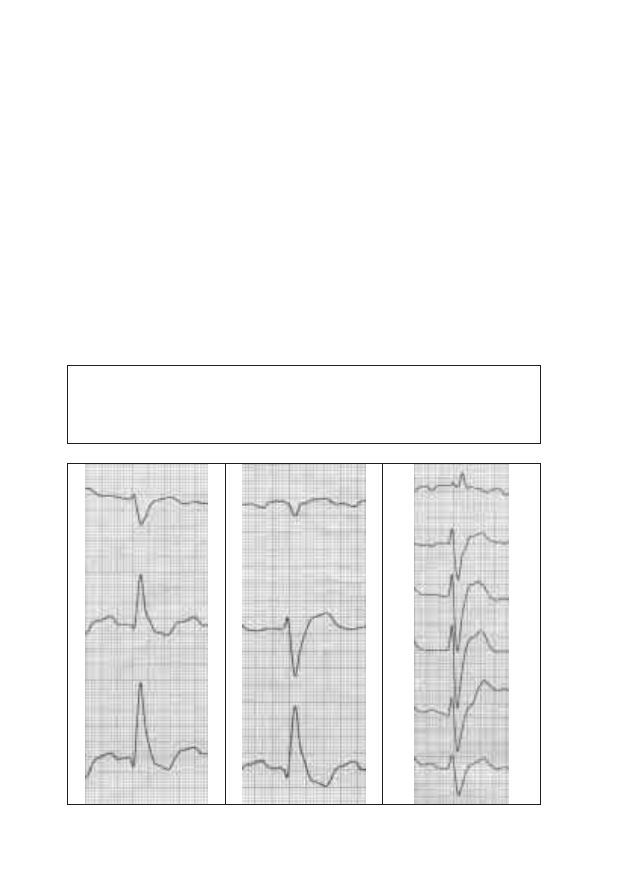
pęczka Hisa prowadzi także zwolnienie przewodzenia w głównym pniu tej
odnogi.
BLOKI WIELOWIĄZKOWE
Uwzględniając podział lewej odnogi na trzy, rzadziej na dwie wiązki, śród-
komorowy układ przewodzenia przybiera dwie formy: trójwiązkową lub
czterowiązkową. Forma trójwiązkowa to: prawa odnoga pęczka Hisa oraz
przednia i tylna wiązka lewej odnogi. Forma czterowiązkowa to: przednia,
tylna i przegrodowa wiązka oraz prawa odnoga traktowana jako czwarta
wiązka. Uwzględnienie czterowiązkowego układu przewodzenia śródkomoro-
wego pozwala na wyodrębnienie poniższych rodzajów bloku wielowiązkowego.
BLOKI DWUWIĄZKOWE
Do najczęściej występujących bloków dwuwiązkowych zaliczamy:
Rycina 6: Blok prawej odnogi i tylnej wiązki lewej odnogi pęczka Hisa (zapis 50 mm/s)
• blok prawej odnogi i przedniej wiązki lewej odnogi pęczka Hisa;
• blok prawej odnogi i tylnej wiązki lewej odnogi pęczka Hisa;
• blok prawej odnogi i wiązki przegrodowej lewej odnogi pęczka Hisa.
80
aVR
V
1
V
2
V
3
V
4
V
5
V
6
aVL
aVF
I
II
III
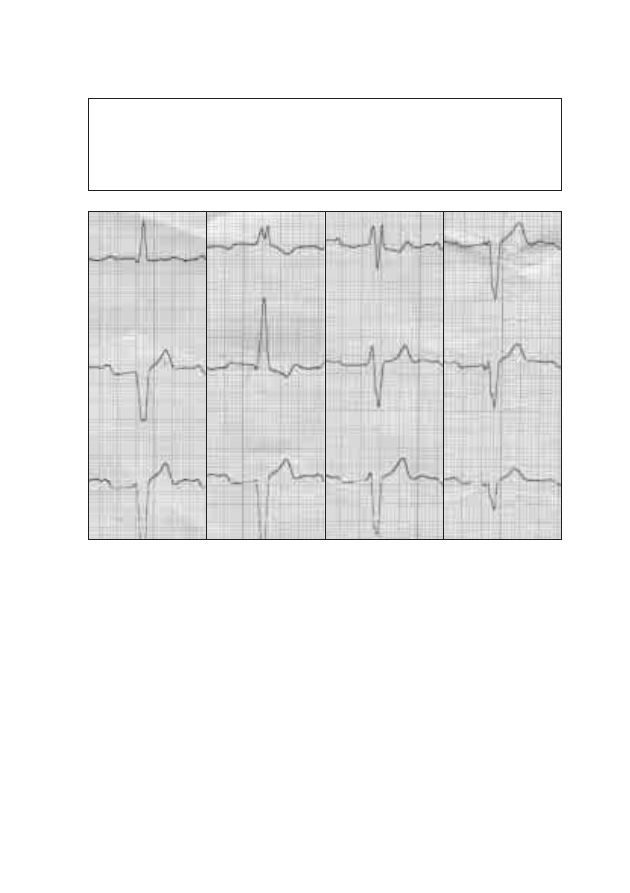
BLOKI TRÓJWIĄZKOWE
Rycina 7: Blok prawej odnogi i przedniej wiązki lewej odnogi pęczka Hisa oraz blok
przedsionkowo-komorowy I stopnia (zapis 25 mm/s)
• blok prawej odnogi oraz przedniej i przegrodowej wiązki lewej
odnogi;
• blok prawej odnogi oraz tylnej i przegrodowej wiązki lewej
odnogi.
81
aVR
V
1
V
2
V
3
V
4
V
5
V
6
aVL
aVF
I
II
III
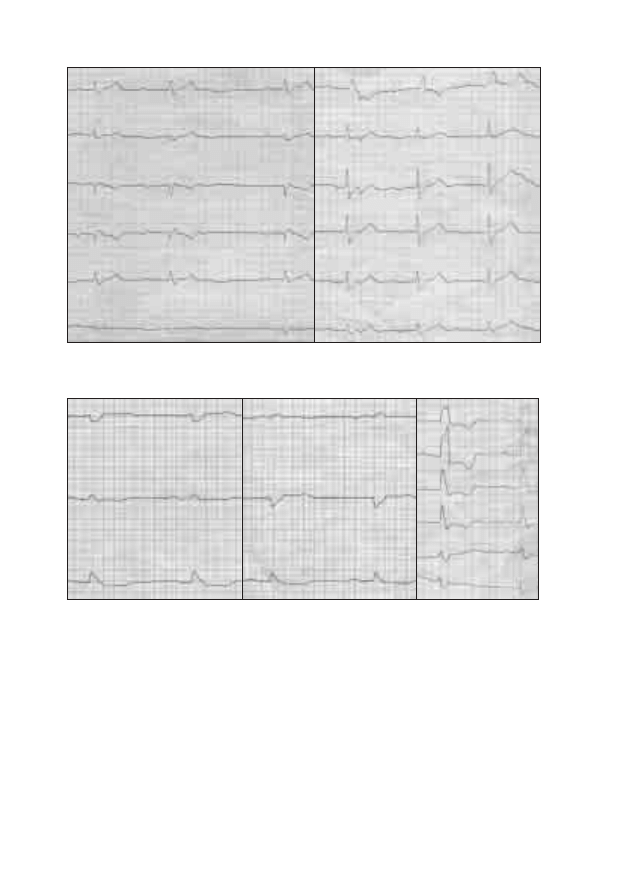
BLOKI CZTEROWIĄZKOWE
Bloki te można rozpoznać przy obecności bloku dwuwiązkowego i in-
termitujących zaburzeń przewodzenia w dwóch pozostałych wiązkach. Po-
dejrzenie tego bloku nasuwa także obraz bloku trójwiązkowego z wydłuże-
niem odstępu PQ. W pełni rozwinięty blok czterowiązkowy to nic innego
jak całkowity blok przedsionkowo-komorowy. Oznacza to, że pojawienie
się bloku trójwiązkowego należy traktować jako zapowiedź bloku całkowi-
tego.
Rycina 9: Blok prawej odnogi i tylnej wiązki lewej odnogi pęczka Hisa oraz blok
przedsionkowo-komorowy I stopnia (zapis 50 mm/s)
Rycina 8: Blok prawej odnogi i przedniej wiązki lewej odnogi pęczka Hisa oraz blok
przedsionkowo-komorowy II stopnia typu I - periodyka Wenckebacha (zapis 50 mm/s)
82
aVR
V
1
V
2
V
3
V
4
V
5
V
6
aVL
aVF
I
II
III
aVR
V
1
V
2
V
3
V
4
V
5
V
6
aVL
aVF
I
II
III

Zapamiętaj!
1. Blok trójwiązkowy może być zapowiedzią bloku całkowitego.
2. Najczęstszą przyczyną bloków są: niedokrwienie mięśnia sercowego, zawał
serca, samoistne włóknienie, zapalenie mięśnia sercowego, kardiomiopa-
tie, wady serca.
3. Blok lewej odnogi pęczka Hisa tylko w wyjątkowych sytuacjach występuje
u ludzi zdrowych!
4. Blok prawej odnogi pęczka Hisa może mieć charakter wrodzony, występo-
wać u ludzi zdrowych i nie mieć znaczenia klinicznego.
Warto przeczytać:
B. Dąbrowska, A. Dąbrowski: Podręcznik elektrokardiografii. PZWL 1999.
A. Bayes de Luna: Elektrokardiografia kliniczna. Via Medica 1999.
W. Sadowska, Z. Sadowski: Zaburzenia rytmu serca. PZWL 1985.
83

VI. BADANIE EKG METODĄ HOLTERA
– UGRUNTOWANA POZYCJA
W DIAGNOSTYCE ARYTMII
Jarosław Król, Monika Tomaszewska-Kiecana
Gdy w 1961 roku Norman Holter opublikował pierwsze doniesienie
o możliwości ambulatoryjnego monitorowania pracy serca, nie było jeszcze
kasety magnetofonowej ani przenośnych magnetofonów, komputerów osobi-
stych, nowością były tranzystorowe turystyczne odbiorniki radiowe, a era za-
łogowych lotów kosmicznych dopiero się zaczynała. Z biegiem lat postęp
techniczny, służący początkowo badaniom kosmosu, wkroczył do codzien-
nego życia i znalazł zastosowanie w medycynie. Badanie, znane dziś jako am-
bulatoryjne monitorowanie EKG (AMEKG), polegało na zarejestrowaniu
na taśmie magnetofonowej, a następnie odtworzeniu z magnetofonu i od-
czytaniu na monitorze zapisu EKG wykonanego u chorego podczas chodze-
nia lub jazdy na rowerze. Przez cały czas badania chory dźwigał magnetofon
i akumulator. Na szczęście badanie nie mogło trwać za długo, bo taśma ma-
gnetofonowa na małej szpuli pozwalała tylko na krótkie nagranie.
Wynalezienie rejestratora z kasetą magnetofonową, pozwalającego na za-
pis trwający całą dobę, wprowadzenie do powszechnego użytku kompute-
rów o coraz większej szybkości działania i stworzenie oprogramowania po-
zwalającego na półautomatyczne opracowanie wyników stanowiło znaczny
postęp. Pozwoliło na rozpowszechnienie tej metody badania w różnych sta-
nach chorobowych układu krążenia.
Nadal jednak zaburzenia rytmu serca i objawy mogące mieć z nimi związek
stanowią główne wskazanie do wykonania rejestracji. Wskazaniami tymi są:
Innymi wskazaniami są: ocena bólów w klatce piersiowej u chorych, któ-
rym nie można zrobić badania wysiłkowego, rokowanie u chorego po zawa-
le serca przed zakończeniem leczenia szpitalnego, kontrola skuteczności le-
czenia zaburzeń rytmu serca. Dawniejsze wskazania, takie jak kontrola pracy
stymulatora mają dziś mniejsze znaczenie, ponieważ współczesne stymulato-
ry dysponują funkcją zapamiętywania zdarzeń z minionych 24 godzin.
• kołatania serca;
• zawroty głowy;
• omdlenia;
• utraty świadomości.
84
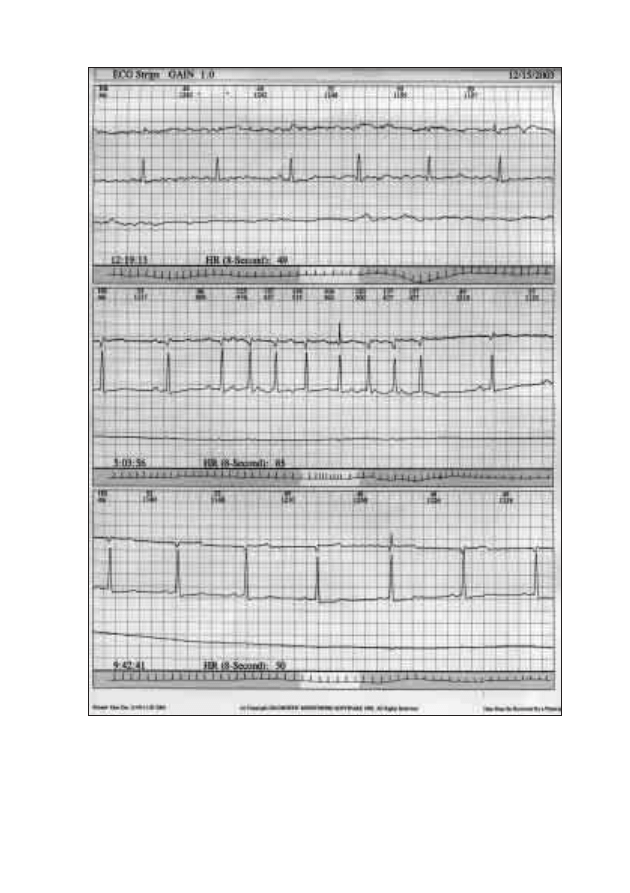
Wieloletnie obserwacje kliniczne z zastosowaniem klasycznej rejestracji
AMEKG są do dziś aktualne. Najważniejsza z nich to wiedza o naturalnej spon-
tanicznej zmienności zaburzeń rytmu, dzięki której można obiektywnie oce-
nić skuteczność leczenia zarejestrowanych przed leczeniem zaburzeń rytmu,
Rycina 1: Krótka wstawka migotania przedsionków
85
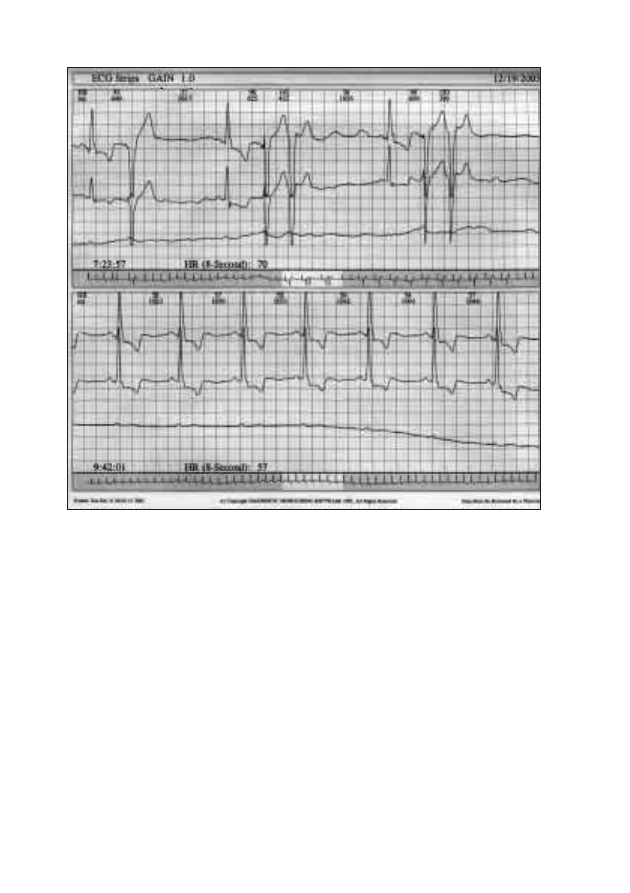
a co ważniejsze wykryć proarytmiczne działanie zastosowanych leków. Wy-
kazano, że zaburzenia rytmu charakteryzują się dużą zmiennością, gdy po-
równuje się rejestracje z kolejnych dni u tego samego chorego pozostające-
go bez leków. Dlatego nie każde zwiększenie i nie każde zmniejszenie liczby
komorowych zaburzeń rytmu świadczy o skuteczności lub szkodliwości dzia-
łania zastosowanego leku.
Kryteria skuteczności leczenia to eliminacja co najmniej 70-80% pobu-
dzeń dodatkowych komorowych, 80-90% par komorowych i 90-100% nie-
utrwalonych częstoskurczów komorowych. A dopiero istotne zmniejszenie
liczby zaburzeń rytmu jest dowodem na sukces w leczeniu. Podobnie nie każ-
de zwiększenie liczby zaburzeń rytmu świadczy o proarytmicznym działaniu
zastosowanego leku. Zależnie od liczby pobudzeń dodatkowych komoro-
wych w badaniu wstępnym, aby rozpoznać proarytmię, konieczne jest
Rycina 2: Pary pobudzeń komorowych
86
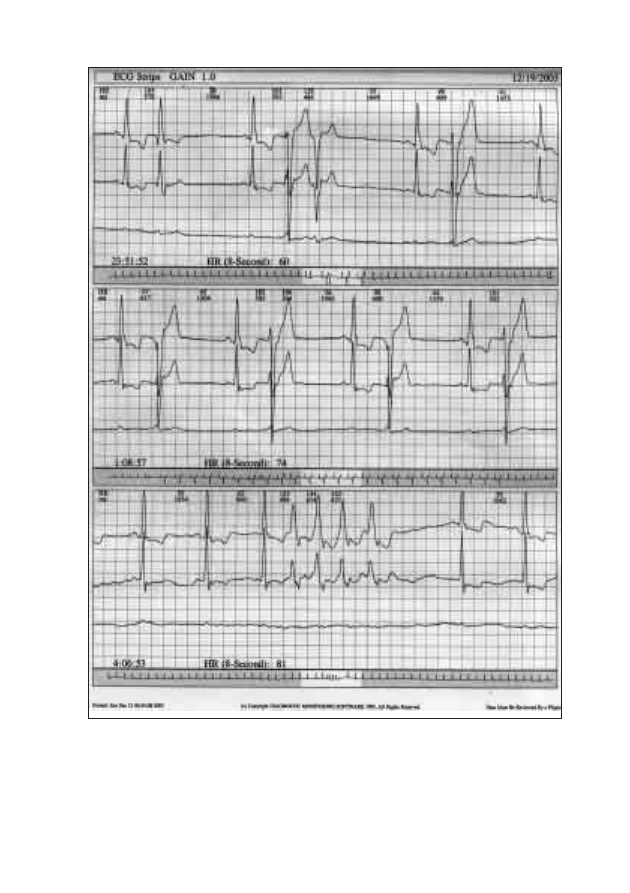
zwielokrotnienie zaburzeń rytmu 3-, 5- lub 10-krotne. Najważniejsze jest pojawie-
nie się częstoskurczów komorowych u chorego, który wcześniej ich nie miał
lub wystąpienie komorowych zaburzeń rytmu u chorego leczonego lekiem an-
Rycina 3: Bigeminia, pary i seria pobudzeń komorowych u pacjenta z kardiomiopatią
przerostową
87
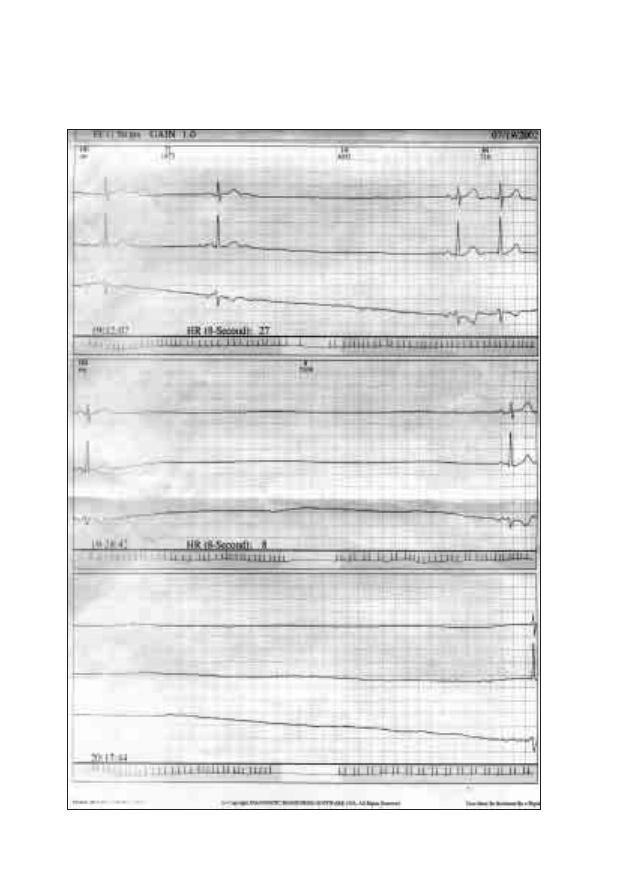
tyarytmicznym z powodu zaburzeń nadkomorowych, np. w zapobieganiu na-
padom migotania przedsionków. Ten problem przedstawiono dokładnie
w innym rozdziale podręcznika.
Rycina 4: Pauzy u pacjentki z omdleniami
88

Kolejne ważne wnioski z badania to możliwość oceny zmian odcinka ST,
pozwalająca na wykrycie niedokrwienia podczas codziennej aktywności cho-
rego, związek zaburzeń rytmu z niedokrwieniem mięśnia sercowego, a także
wykazanie niemego niedokrwienia. Nadal aktualne jest kryterium tzw.
trzech jedynek:
Gdy spełnione są te warunki, można rozpoznać incydent niedokrwienia.
Istotne jest określenie liczby tych epizodów, ich łączny czas trwania w ciągu
obserwacji i związek z dolegliwościami odczuwanymi przez pacjenta. Bar-
dzo istotne jest także wykazanie związków pomiędzy obniżeniami ST i za-
burzeniami rytmu serca.
U pacjenta z zaburzeniami świadomości, omdleniami czy zasłabnięciami,
rejestracja znaczącej bradykardii lub przerw w pracy serca oraz wykrycie czę-
stoskurczów komorowych może być najważniejszym wskazaniem do zasto-
sowania leczenia metodami elektrofizjologicznymi – wszczepieniem stymu-
latora, kardiowertera-defibrylatora lub kwalifikacji chorego do badań
elektrofizjologicznych, które pomogą w wybraniu najlepszej metody lecze-
nia, np. wykonania ablacji tkanki arytmogennej.
Dziś, gdy na naszych oczach dokonuje się szybki postęp techniki, zwłaszcza
wszelkich technik komputerowych, powoli z użycia wychodzą urządzenia
analogowe i zastępowane są cyfrowymi. I tak, coraz częściej rejestracja EKG
wykonywana jest aparatami z kartami pamięci zamiast kasety magnetofono-
wej. Daje to lepszą jakość zapisu, a dla pacjenta dużą wygodę, bo nowe reje-
stratory są małe i lekkie. Zapis wykonany techniką cyfrową może być przeka-
zywany drogą internetową do ośrodków, w których centralnie dokonuje się
analizy. Wynik badania przekazywany jest tą samą drogą. Metoda taka jest
chętnie stosowana w międzynarodowych badaniach naukowych, gdy ważny
jest jednolity sposób interpretacji wyników. Małe i lekkie rejestratory po-
zwalają także na długotrwałe badanie, czasem przez kilka tygodni, gdy po-
szukiwane zaburzenia rytmu serca są rzadkie, nawet gdy pacjent nie odczu-
wa przy nich dolegliwości. Rejestratory te, nazywane rejestratorami zdarzeń
event recorder, znajdują coraz większe zastosowanie. Stosujemy je wszędzie
tam, gdzie istotne jest wykrycie zaburzeń rytmu stanowiących potencjalne
zagrożenie dla chorego, gdy towarzyszą im konkretne dolegliwości, a zabu-
rzenia rytmu trwają na tyle długo, aby pacjent zdążył włączyć rejestrator.
• obniżenie ST o co najmniej 1 mm;
• obniżenie ST trwające co najmniej 1 minutę;
• przerwa pomiędzy kolejnymi epizodami trwająca co najmniej
1 minutę.
89
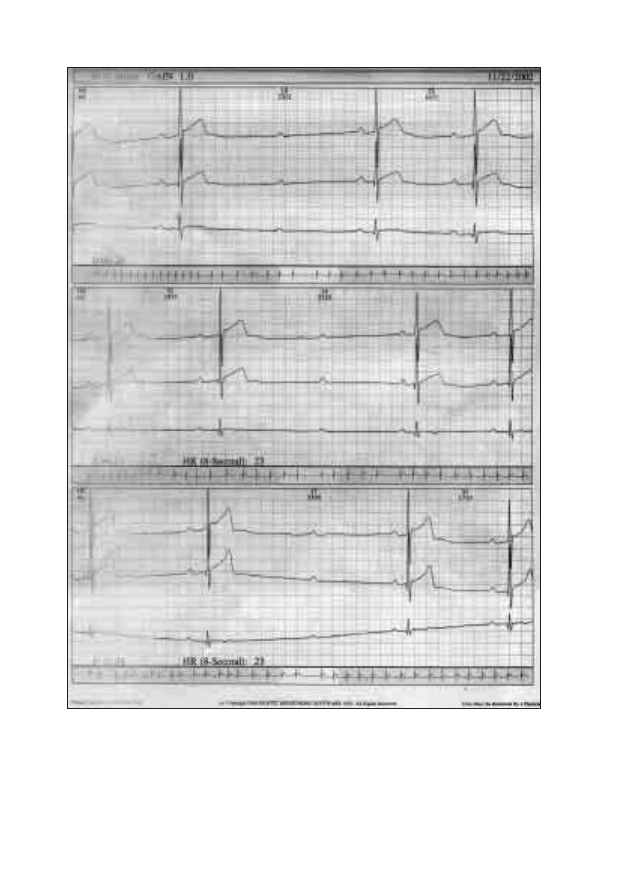
Gdy pacjent nie jest w stanie odpowiednio szybko zareagować na objawy,
konieczne jest użycie rejestratorów automatycznie wykrywających zaburze-
nia rytmu. W takich okolicznościach stosuje się długotrwałe prowadzenie
monitorowania z zastosowaniem tzw. pętli pamięci, rejestrator zapamiętuje
Rycina 5: Periodyka Wenckebacha
90
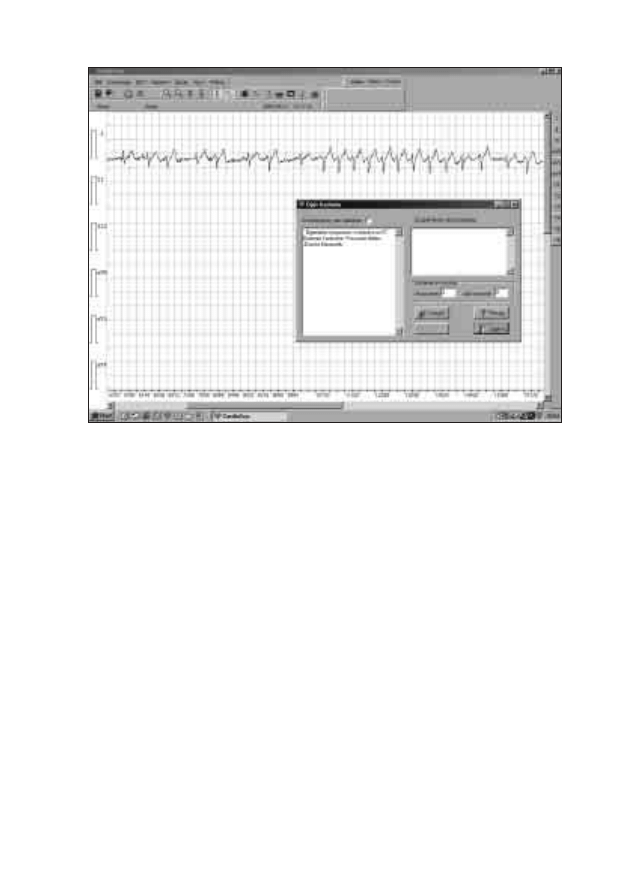
tylko rozpoznane automatycznie zaburzenia rytmu lub fragmenty zapisu
wskazane przez pacjenta. W rzadkich przypadkach stosuje się implantowane
rejestratory pracujące przez wiele tygodni, pozwalające wykryć bardzo rzad-
kie zaburzenia rytmu lub przewodzenia, potencjalnie groźne dla chorego.
Badania z zastosowaniem tej nowej metody wykazują, że bradyarytmie z za-
trzymaniem krążenia występują częściej niż do tej pory sądzono. Badania ta-
kie nie są jednak na razie powszechnie dostępne.
Zapamiętaj!
1. Diagnostyka zaburzeń rytmu wymaga czasem długotrwałego monitorowa-
nia, które umożliwiają nowoczesne rejestratory zdarzeń.
2. Badanie metodą Holtera precyzuje wskazania do leczenia zaburzeń rytmu
i przewodzenia – implantacji stymulatora lub kardiowertera-defibrylatora.
3. Badanie kontrolne pozwala na uniknięcie poważnych następstw działania
niepożądanego zastosowanego leku antyarytmicznego.
Rycina 6: Bigeminia komorowa i seria pobudzeń komorowych (nsVT) zarejestrowana
w czasie transmisji EKG przez telefon
91

Warto przeczytać:
A. Dąbrowski, B. Dąbrowska, R. Piotrowicz: Elektrokardiografia holterow-
ska. Wydawnictwo Medyczne, Warszawa 1994.
Techniques for arrhythmia assessment and management. Cardiac Arrhyth-
mia. Chapter VI. P.J. Podrid i P.R. Kowey (red.), Williams & Wilkins, Bal-
timore 1995.
Standardy postępowania w zakresie wybranych zagadnień elektrokardiografii
nieinwazyjnej; Badanie holterowskie: technika, schemat analizy, dokumen-
tacja. Folia Cardiologica 1999, (Supl. III), 5, 1.
92

VII. ZNACZENIE TESTU WYSIŁKOWEGO
W DIAGNOSTYCE ZABURZEŃ RYTMU SERCA
Artur Mamcarz, Maciej Janiszewski, Andrzej Światowiec
Test wysiłkowy jest w dalszym ciągu podstawową metodą diagnostyczną
w chorobie niedokrwiennej serca (ChNS). Dzieje się tak pomimo burzliwe-
go rozwoju nowoczesnych technik badawczych, takich jak echokardiografia
obciążeniowa, scyntygrafia perfuzyjna czy pozytronowa tomografia emisyjna
(PET). Szczegółowo omówiliśmy zalety i ograniczenia metody w pierwszym
tomie „Kardiologii Praktycznej”. W niniejszym opracowaniu chcemy odnieść
się krytycznie do znaczenia testu wysiłkowego w diagnostyce i prognozowa-
niu u pacjentów z zaburzeniami rytmu serca. Krytycyzm ten potrzebny jest
przede wszystkim dlatego, że w licznych opracowaniach dotyczących proble-
mu funkcjonuje wiele rozbieżności co do wartości metody. Eksperci Ameri-
can Heart Association (AHA) twierdzą wręcz, że u chorych z ChNS komo-
rowe zaburzenia rytmu wywołane wysiłkiem nie stanowią zwykle niezależnego
czynnika ryzyka odległego zgonu lub incydentu wieńcowego.
Istnieje jednak wiele doniesień, które pokazują istotne prognostyczne zna-
czenie arytmii komorowych prowokowanych wysiłkiem, a znakomity ekspert
w tym zakresie Victor Froelicher mówi z jednej strony, że „komorowe zabu-
rzenia rytmu nie mają tego samego znaczenia w pracowni badań wysiłko-
wych, co w Oddziale Intensywnej Opieki Kardiologicznej. W pracowni ba-
dań wysiłkowych są one zazwyczaj traktowane jako źle rokujące, gdy
wystąpią u pacjentów odratowanych z nagłego zgonu sercowego, z kardio-
miopatiami, wadami zastawkowymi serca i ciężkim niedokrwieniem w wy-
wiadzie”, z drugiej zaś, że „wywołane wysiłkiem zaburzenia rytmu wskazują
na niestabilność elektryczną spowodowaną najczęściej dysfunkcją lewej ko-
mory, rzadziej zaś niedokrwieniem i nie wydaje się, by miały one niezależną
wartość rokowniczą”.
Podobnie twierdzi Cohn, pisząc że „prowokowanie zaburzeń rytmu przez
nieme niedokrwienie lub w ogóle epizod niedokrwienny jest w dalszym cią-
gu kontrowersyjne”. W opozycji do tego stwierdzenia jest opinia Hoberga,
który uważa, że „związane z niemym niedokrwieniem komorowe zaburze-
nia rytmu mogą być brakującym ogniwem pomiędzy zwiększonym ryzykiem
zatrzymania krążenia i brakiem wcześniejszych objawów u chorych podda-
wanych rehabilitacji kardiologicznej”.
Wydaje się, że problem jest ciągle nierozstrzygnięty, a jego rozwiązanie,
wobec złożonych mechanizmów arytmogenezy będzie bardzo trudne. Posta-
ramy się więc przedstawić fakty.
93

FIZJOLOGIA I PATOFIZJOLOGIA
Wysiłek może wyzwalać zaburzenia rytmu w różnych sytuacjach, w tym
także podczas leczenia diuretykami lub glikozydami naparstnicy. Arytmia
może wystąpić u osób po spożyciu alkoholu, kofeiny czy wypaleniu papiero-
sa, stąd konieczne precyzyjne ustalenie wywiadu dotyczącego używek i przyj-
mowanych leków przed wykonaniem badania.
Powstawanie zaburzeń rytmu serca jest związane z istnieniem trzech podsta-
wowych mechanizmów, które w sposób oczywisty mogą wzajemnie na siebie
oddziaływać. Jednym z nich jest zjawisko wystąpienia fali nawrotnej (re-entry),
drugim – potencjałów następczych, trzecim zaś wystąpienie zwiększonego
automatyzmu ośrodków ektopowych. Ten ostatni mechanizm jest traktowa-
ny jako ważny w wyzwalaniu arytmii prowokowanej wysiłkiem fizycznym
i niedokrwieniem u osób z ChNS. Ważną rolę w generowaniu i utrwalaniu
zaburzeń rytmu ma autonomiczny układ nerwowy, szczególnie jego część
współczulna oraz krążące katecholaminy. Arytmie wywołane przez wysiłek
są przede wszystkim efektem zwiększonego napięcia układu współczulnego,
zwiększenia stężeń krążących katecholamin lub obu tych mechanizmów rów-
nocześnie. Wzrost napięcia układu współczulnego powoduje zmiany właści-
wości elektrofizjologicznych serca, szczególnie zaś skrócenie okresu refrak-
cji miokardium i komórek układu przewodzącego (His-Purkinje), wpływa
też na prędkość przewodzenia impulsów. Z drugiej strony zwiększone na-
pięcie współczulne może pobudzać aktywność ektopową poprzez przyspie-
szenie czwartej fazy potencjału czynnościowego, co wyzwala spontaniczne
wyładowania i prowadzi do zwiększonego automatyzmu. Hemodynamiczne
następstwa zwiększonej aktywności współczulnej to wzrost ciśnienia tętni-
czego, inotropowo dodatnie działanie na mięsień sercowy, przyspieszenie
częstości rytmu serca, a często wzrost obciążenia następczego. Prowadzi to
w konsekwencji do wzrostu zapotrzebowania na tlen, co u pacjentów z ChNS
może wywołać nie tylko niedokrwienie, lecz także prowokowane przez nie
zaburzenia rytmu. Towarzyszą temu często zmiany mechaniczne, takie jak
rozciągnięcie miokardium czy dysfunkcja lewej komory. Całości obrazu do-
pełniają prowokowane przez wysiłek i niedokrwienie zaburzenia metabolicz-
ne, takie jak niedobory jonu potasowego i/lub magnezowego czy regionalna
kwasica. Wysiłek wpływa również na właściwości układu przywspółczulnego
– jego aktywność wyraźnie maleje, co samo w sobie może być impulsem do
wyzwolenia zaburzeń rytmu.
Szczególnie ważny i niebezpieczny w generowaniu groźnych arytmii może
być okres po wysiłku, bowiem w tym czasie dużemu stężeniu katecholamin
(stężenie noradrenaliny może w tym okresie być najwyższe) towarzyszy
94

uogólnione rozszerzenie naczyń. Poszerzenie tętnic obwodowych jako me-
chanizm ochronny w czasie wysiłku (afterload) i spadek pojemności minuto-
wej serca spowodowany osłabieniem powrotu żylnego (preload), wtórne do
nagłego zakończenia obwodowej aktywności mięśniowej, mogą prowadzić
do zmniejszenia perfuzji wieńcowej we wczesnej fazie odpoczynku. Rytm
serca jest wówczas jeszcze szybki i brak możliwości zaspokojenia zwiększo-
nego zapotrzebowania na tlen może skutkować wystąpieniem lub nasileniem
arytmii. Z drugiej strony w późnej fazie powysiłkowej dochodzi do zwolnienia
częstości rytmu i do ustąpienia efektu tłumienia szybkim rytmem (overdrive
supression), dodatkowo zaś w pozycji leżącej dochodzi do zwiększenia po-
wrotu żylnego, zwiększenia naprężenia miokardium, wzrostu zapotrzebowa-
nia na tlen i nasilenia niedokrwienia i zaburzeń rytmu serca. Ważne jest wo-
bec tego, aby faza powysiłkowa (recovery phase) trwała odpowiednio długo
w sytuacji, gdy celem testu jest diagnostyka arytmii (często około 10 minut).
Wysiłek może również wygaszać zaburzenia rytmu występujące w spoczyn-
ku. Zjawisko to jest związane z tłumieniem ektopowej aktywności ośrodków
przez szybki rytm zatokowy, będący wynikiem spadku napięcia nerwu błęd-
nego i zwiększonej stymulacji współczulnej. Nie ma zgodności, co do zna-
czenia tego zjawiska. Przyjmuje się raczej, że jest to dobry parametr rokow-
niczy głównie dlatego, że przeczy niedokrwiennej etiologii arytmii.
NADKOMOROWE ZABURZENIA RYTMU W TEŚCIE WYSIŁKOWYM
Arytmie nadkomorowe występują w czasie badania wysiłkowego często.
Zdarza się, że są one nierozpoznane lub nawet niezauważone. W związku
z tym, że arytmie nadkomorowe często występują u osób ze zdrowym ser-
cem, większość badaczy uważa, że nie należy do nich przywiązywać istotnej
wagi, zwłaszcza w diagnostyce ChNS. Najczęściej obserwujemy przedwcze-
sne pobudzenia dodatkowe nadkomorowe (u około 10% osób ze zdrowym
sercem i do 40% pacjentów z chorobami układu krążenia), rzadziej wysiłek
prowokuje wystąpienie utrwalonego częstoskurczu nadkomorowego (1-2%
pacjentów, a u osób z wywiadem arytmii nadkomorowych tego rodzaju na-
wet do 15%). Wydaje się więc, że w tej grupie, przy braku dokumentacji
elektrokardiograficznej rodzaju arytmii, warto podjąć próbę prowokacji przy
maksymalnym teście wysiłkowym. Krótkotrwałe najczęściej napady migota-
nia lub trzepotania przedsionków wywołane wysiłkiem występują u poniżej
1% badanych. Uważa się powszechnie, że arytmie nadkomorowe nie są
związane z ChNS, a częściej z zaburzeniami funkcji tarczycy, podeszłym wie-
kiem, chorobą płuc, nadużyciem alkoholu czy wreszcie z zespołem wypada-
nia płatka zastawki mitralnej (MVP) lub zespołami preekscytacji. W diagno-
95

styce arytmii u pacjentów z MVP mamy własne bogate doświadczenie kli-
niczne, uważamy, że zaburzenia rytmu zarówno nadkomorowe, jak i komo-
rowe nie wpływają w sposób istotny na kwalifikację tych pacjentów do ak-
tywności fizycznej (rekreacyjnej i sportowej). Szerzej przedstawiono ten
problem w innym rozdziale. W zespole WPW test wysiłkowy nie jest pierw-
szoplanową metodą oceny arytmii, może jednak przynieść pewne ważne,
przydatne klinicznie informacje. Z jednej strony bowiem, brak gotowości
arytmicznej w czasie dużego obciążenia, a z drugiej ustąpienie cech preek-
scytacji w zapisie EKG w trakcie wysiłku są pośrednimi wykładnikami dłu-
giego okresu refrakcji drogi dodatkowej, co pozwala bezpiecznie kwalifiko-
wać tych pacjentów do aktywności fizycznej.
KOMOROWE ZABURZENIA RYTMU SERCA A WYSIŁEK FIZYCZNY
Komorowe zaburzenia rytmu są najczęściej występującą arytmią prowo-
kowaną wysiłkiem. Istotne znaczenie dla skutecznego wykrywania i obser-
wacji zaburzeń rytmu w czasie testu wysiłkowego miało ulepszenie technik
monitorowania EKG w czasie badania. Powszechne dziś ciągłe monitoro-
wanie zwiększyło skuteczność rozpoznawania arytmii prowokowanej wysił-
kiem, szczególnie zaś powtarzalnych jej form, takich jak pary i salwy pobu-
dzeń komorowych. Dowodzą tego pionierskie prace Bearda i Owena z lat
70., w których skuteczność rozpoznawania zaburzeń rytmu przy ciągłym mo-
nitorowaniu zwiększyła się z 8% do 34%. Częstość arytmii komorowych in-
dukowanych wysiłkiem zależy od płci i wieku badanych – u mężczyzn i osób
starszych wykrywa się je częściej. W sposób najbardziej znaczący częstość za-
burzeń rytmu zależy od obecności i nasilenia podstawowej choroby serca.
Znajdujemy tu istotną zależność zarówno w odniesieniu do wielkości frakcji
wyrzutowej, stopnia zwężenia naczynia, jak i do ilości zmienionych miażdży-
cowo tętnic. U osób z istotną organiczną chorobą serca szczególnie często
występują złożone formy pobudzeń komorowych, które u osób zdrowych
spotykamy niezwykle rzadko (0-6% badanych). Częstość arytmii komoro-
wych prowokowanych wysiłkiem była największa u chorych, którzy przebyli
epizod nagłego zatrzymania krążenia. U większości tych pacjentów podczas
testu występowały pojedyncze dodatkowe pobudzenia komorowe, a u 50-75%
z nich występowały formy złożone. Statystyka ta, aktualna przed laty, zmie-
nia się dziś wraz z coraz powszechniejszym stosowaniem w tej grupie sku-
tecznych leków antyarytmicznych, przede wszystkim beta-adrenolityków
i amiodaronu. Ostatnio opublikowane badania japońskie dotyczyły wystę-
powania groźnych arytmii komorowych (częstoskurcze komorowe i migota-
nie komór) w grupie 59 osób spośród blisko 8000 badanych w jednym
z ośrodków akademickich w ciągu 5 lat. U 52 wystąpił nieutrwalony często-
96

skurcz komorowy, u 5 utrwalony, u 2 zaś migotanie komór, u 14 z nich roz-
poznano ChNS, u 13 kardiomiopatię, u 9 zaś występowała choroba zastaw-
kowa. U 9 pacjentów arytmia wystąpiła w fazie recovery (w tym u czterech
chorych z utrwalonym częstoskurczem). Pokazuje to po raz kolejny koniecz-
ność wnikliwego monitorowania pacjenta także po wysiłku.
Występowanie komorowych zaburzeń rytmu serca w czasie testu wysiłko-
wego nie jest równoznaczne z rozpoznaniem ChNS, jeśli nie towarzyszą im
niedokrwienne zmiany odcinka ST, choć w raportach publikowanych przez
amerykańskie towarzystwa kardiologiczne jeszcze we wczesnych latach 90.
przywiązywano do nich pewną wagę, ostatni zaś opublikowany w 2001 roku
sceptycznie odnosi się do diagnostycznego znaczenia arytmii.
Należy podkreślić, że test wysiłkowy jest przecież tylko jednym z elemen-
tów kompleksowej diagnostyki pacjenta zmierzającej do jednoznacznego
rozstrzygnięcia przyczyn zaburzeń rytmu i nie można na podstawie jego wy-
niku przesądzać o obecności lub braku choroby organicznej. Z drugiej stro-
ny wygaszenie istniejącej w spoczynku arytmii nie wyklucza przecież jej nie-
dokrwiennej etiologii. Potrzebne są czasem precyzyjne sposoby oceny
(scyntygrafia perfuzyjna, echokardiografia obciążeniowa, koronarografia).
PROGNOSTYCZNE ZNACZENIE ARYTMII WYSIŁKOWYCH
Rokownicze znaczenie arytmii komorowych, występujących w czasie testu
wysiłkowego, jest od dawna przedmiotem licznych badań, opinii i podsumo-
wań. Już w końcu lat 70., a więc w okresie, kiedy testy wysiłkowe wchodziły
do szerokiego zastosowania klinicznego, także w grupach wysokiego ryzyka
Udall i Elestad przeprowadzili badania w grupie pacjentów bez wywiadu za-
wału serca. W czasie rocznej obserwacji ocenili oni śmiertelność na 2%
w grupie, gdzie nie obserwowano arytmii w czasie wysiłku, 15% w grupie pa-
cjentów z arytmią prostą i aż na 29% w grupie ze złożonymi formami zabu-
rzeń rytmu. U pacjentów tej grupy nie obserwowano niedokrwiennego obni-
żenia ST. W grupie, gdzie arytmia była prowokowana niedokrwieniem,
odpowiednie wskaźniki były istotnie statystycznie wyższe (odpowiednio 10,
33 i 42%). Podobne dane publikował nieco później Califf, Graboys zaś oce-
nia ryzyko zgonu u osób, które przebyły nagłe zatrzymanie krążenia (NZK),
pojawienie się arytmii złożonej w czasie testu zwiększało to ryzyko z 2 do
43%. Warto wspomnieć jeszcze o badaniach Welda i Krone'a, w których po-
jawienie się komorowych zaburzeń rytmu w czasie badania wysiłkowego
u chorych po zawale zwiększało ryzyko zgonu w ciągu roku od 2 do 4 razy
(śmiertelność roczna wynosiła 3% w grupie bez arytmii, 7% w grupie z aryt-
mią prostą i 13% z arytmią złożoną). W badaniach CASS nie obserwowano
97

podobnej zależności, być może dlatego, że chorzy najbardziej zagrożeni by-
li częściej leczeni chirurgicznie.
W badaniu japońskim, które opisano powyżej, w czasie 42 miesięcy obser-
wacji nie notowano zgonów sercowych w obserwowanej grupie. Pokazuje to
postęp medycyny, także w zakresie inwazyjnych sposobów leczenia, bowiem
w grupie z migotaniem komór metodą z wyboru było zastosowanie kardio-
werterów-defibrylatorów.
Badania Elhendy'ego publikowane w końcu 2002 roku pokazały istotne
prognostyczne znaczenia arytmii komorowej u pacjentów poddawanych te-
stowi wysiłkowemu i echokardiografii obciążeniowej. Uznano, że w analizie
wieloczynnikowej to właśnie arytmia komorowa w sposób najbardziej pre-
cyzyjny stratyfikowała ryzyko. Obserwowano też, że u osób z arytmią docho-
dziło do największych odwracalnych zaburzeń kurczliwości w czasie wysiłku.
Praca ta jest argumentem za kompleksową oceną ryzyka w grupach narażo-
nych na istotne powikłania.
Warto zacytować pracę Partingtona i wsp. ze stycznia 2003 roku, w której
pokazano istotną zależność miedzy arytmią komorową prowokowaną wysił-
kiem a ryzykiem zgonu w wieloletniej obserwacji na dużej ponad 6000-ty-
sięcznej grupie osób. Arytmia prowokowana wysiłkiem, niezależnie od obec-
ności zaburzeń ukrwienia, zwiększała istotnie ryzyko zgonu w ciągu 6 lat.
Badanie pokazało również, że obecność arytmii przed testem (okres wycze-
kiwania, zwiększone napięcie współczulne) również rokuje źle (zwiększone
ryzyko śmierci sercowej w obserwacji wieloletniej). U tych osób, u których
w spoczynku rejestrowano arytmię komorową rokowanie nie było gorsze,
wtedy gdy występowała ona również w czasie wysiłku. Autorzy konkludują,
że obserwacja ta wyjaśnia niektóre wcześniejsze kontrowersje i rzuca nowe
światło na znaczenie spoczynkowej (przed testem) arytmii komorowej
w oszacowaniu ryzyka zgonu.
W New England Journal of Medicine z 27 lutego 2003 roku przedstawiono
pracę, która na materiale blisko 30 000 pacjentów oszacowała prognostycz-
ne znaczenie arytmii komorowej w fazie powysiłkowej. Okazało się, że obec-
ność zaburzeń rytmu w okresie odpoczynku po teście w sposób znaczący
prognozuje ryzyko zgonu w obserwacji wieloletniej. Jest to pierwsza, ale nie-
zwykle znacząca obserwacja w tym zakresie, ważna o tyle, iż materiał jest
bardzo duży i niezwykle precyzyjnie opracowany. Autorzy dyskutują poten-
cjalne patofizjologiczne uwarunkowania tej obserwacji, podkreślając, że za
zwiększone ryzyko odpowiadać może nieadekwatność reakcji parasympa-
tycznej po wysiłku. Obserwacja ta powoduje, że u osób z wywiadem arytmii,
należy fazę powysiłkową maksymalnie wydłużyć.
98

Pod koniec lat 90. pojawiły się publikacje, które mówiły, że u chorych po
zawale wystąpienie złożonej i licznej arytmii komorowej może świadczyć
o obecności żywotnego mięśnia w obrębie blizny po zawale, zwłaszcza u cho-
rych z uszkodzeniem niepełnościennym. Wobec szerokiego rozpowszechnie-
nia interwencyjnych metod naprawczych obserwacja ta może mieć istotne
znaczenie, wydaje się jednak, że metodą z wyboru w diagnostyce żywotno-
ści mięśnia jest echokardiografia dobutaminowa. Test wysiłkowy może być
natomiast pierwszym krokiem diagnostycznym.
W podsumowaniu należy stwierdzić, że choć pojawienie się w czasie wy-
siłku arytmii komorowej jako jedynego elementu oceniającego prognozę jest
niewystarczające, to arytmia występująca przy małym obciążeniu, niskim tęt-
nie, z towarzyszącym spadkiem ciśnienia, a szczególnie arytmia złożona,
w sposób istotny pogarsza rokowanie u chorych z ChNS, niezależnie od
przebytego zawału. Wyczerpujące omówienie tego problemu przedstawił
Froelicher, który jednocześnie uznał, że wobec złożonych mechanizmów
arytmogenezy nie dziwi fakt, że w wielu opracowaniach rejestrowano jedynie
trendy na pograniczu istotności statystycznej (prognostyczne znaczenie aryt-
mii), a niektóre badania pokazują brak jakiegokolwiek wpływu. Stąd w rapor-
cie AHA, o którym mówiono wcześniej, dominuje sceptycyzm. W doświad-
czeniach naszego zespołu, test wysiłkowy jest ważną metodą w kompleksie
diagnostycznym, wykorzystujemy ją często nie tylko w diagnostyce arytmii
komorowych, lecz także jako metodę pomocniczą w arytmiach nadkomoro-
wych (zespół WPW, diagnostyka migotania przedsionków). Oddzielnym
wskazaniem jest ocena skuteczności leczenia antyarytmicznego.
OCENA SKUTECZNOŚCI LECZENIA ANTYARYTMICZNEGO
O ile w przypadku prognostycznego znaczenia arytmii komorowej wyzwa-
lanej wysiłkiem mogą istnieć pewne kontrowersje, to nie ma ich z pewnością
w wykorzystaniu badania dla oceny skuteczności leczenia antyarytmicznego.
Badanie to stwarza możliwości doboru leku najbardziej odpowiedniego dla
danego pacjenta i arytmii u niego występującej. Testy elektrofizjologiczne,
a zwłaszcza monitorowanie EKG metodą Holtera dostarczają ważnych in-
formacji o występowaniu arytmii w dłuższym okresie czasu, dają możliwość
oceny ich złożoności, natomiast nie pokazują, w jaki sposób aktywność fi-
zyczna wpływa na skuteczność leczenia. Jak wcześniej pokazano, w czasie
wysiłku powstają pewne zmiany dotyczące parametrów elektrofizjologicz-
nych, mechanicznych i metabolicznych, które mogą w istotny sposób wpły-
wać na skuteczność leczenia antyarytmicznego, zarówno wzmagając, jak
i osłabiając jego aktywność w organizmie, co w konsekwencji może wywołać
99

nawrót lub nasilenie arytmii. Dzieje się tak szczególnie poprzez wzrost ak-
tywności układu współczulnego, wzrost katecholaminemii, zmiany poziomu
potasu, pH i dowozu tlenu do mięśnia sercowego w czasie obciążenia wysił-
kiem. Katecholaminy poprzez skrócenie okresu refrakcji, zwiększenie pręd-
kości przewodzenia i wzrost automatyzmu – efekty odwrotne do wielu le-
ków antyarytmicznych – wchodzą z nimi w ujemne reakcje, odwracając
główne efekty działania. Ponieważ obciążenie wysiłkiem jest fizjologiczną
metoda aktywacji układu współczulnego, test wysiłkowy jest racjonalną me-
todą dla pełnej oceny aktywności terapeutycznej i stanowi cenne uzupełnie-
nie badań elektrofizjologicznych i monitorowania ambulatoryjnego.
I w istocie Graboys stwierdził, że prowokowana wysiłkiem arytmia, pomi-
mo jej nieobecności w badaniu holterowskim wiązała się z istotnie statysty-
cznie wyższą śmiertelnością (2,3 vs 43,6%). W innych badaniach u blisko
15% pacjentów uważanych za kontrolowanych antyarytmicznie występowa-
ły poważne arytmie komorowe w czasie obciążania wysiłkiem. W badaniach
Woelfela u chorych z udokumentowanym częstoskurczem komorowym test
wysiłkowy pokazał skuteczność leczenia tej groźnej arytmii, zarówno beta-
-adrenolitykiem, jak i werapamilem. Sukces leczenia polegał na zahamowa-
niu osiągania w czasie wysiłku tętna maksymalnego, przy którym przed roz-
poczęciem terapii występował częstoskurcz.
Testy wysiłkowe odgrywają znaczącą rolę w ocenie potencjalnie toksycz-
nych efektów działania leków antyarytmicznych. Wiele leków zwalnia bo-
wiem szybkość przewodzenia impulsów przez błonę komórkową i zmniejsza
częstość przewodzenia impulsów w układzie bodźco-przewodzącym. W cza-
sie testu wysiłkowego, gdy częstość rytmu wzrasta wraz ze wzrostem obciąże-
nia może to spowodować wystąpienie bloku przedsionkowo-komorowego
lub bloku odnogi pęczka Hisa. Może to w niektórych okolicznościach powo-
dować nasilenie arytmii lub ułatwienie wystąpienia mechanizmu re-entry.
Wysiłek skraca również czas repolaryzacji (skrócenie odstępu QT). Efekt
ten znacząco osłabiony przez leki antyarytmiczne klasy Ia może stanowić
podłoże dla wyzwolenia częstoskurczu typu torsade de pointes. Liczne bada-
nia udokumentowały skuteczność metody w ocenie proarytmicznego dzia-
łania leków.
ZABURZENIA PRZEWODZENIA A TEST WYSIŁKOWY
Zaburzenia przewodzenia śródkomorowego mogą istnieć przed wysiłkiem
lub wystąpić w trakcie jego trwania. Obecność bloku lewej odnogi (LBBB)
praktycznie uniemożliwia ocenę zaburzeń ukrwienia w EKG wysiłkowym.
Uważa się, że nasilenie zmian ST w bloku może wystąpić u osób zdrowych
100

i nie prognozuje co do istnienia ChNS ani ryzyka poważnych powikłań w ob-
serwacji odległej. Obecność bloku prawej odnogi (RBBB) utrudnia taką
ocenę, lecz jej nie uniemożliwia. Uważa się, że wystąpienie obniżenia ST
w RBBB w odprowadzeniach V
4
-V
6
lub odprowadzeniach dolnościennych
pozwala z dużym prawdopodobieństwem uznać, że zmiany te są niedo-
krwienne. Wystąpienie LBBB w czasie wysiłku może mieć istotne implikacje
diagnostyczne. Uważa się, że wystąpienie bloku przy częstości rytmu do
125/min może świadczyć o jego niedokrwiennym charakterze, natomiast
w sytuacji, gdy pojawia się on powyżej tętna 125/min, występuje często
u osób z prawidłowymi naczyniami. Wystąpienie bloku prawej odnogi, a tak-
że bloku wiązek lub bloków niezupełnych nie ma ugruntowanej pozycji dia-
gnostycznej i prognostycznej. Wystąpienie tych zjawisk zmusza najczęściej
do rozszerzenia diagnostyki nieinwazyjnej, a czasem do wykonania korona-
rografii.
Bloki przedsionkowo-komorowe stymulowane wysiłkiem nie były przed-
miotem intensywnych dociekań naukowych. Skrócenie odstępu PR, aż do
granicy uznawanej za prawidłową (0,10-0,11 s), które świadczy o przewodze-
niu AV, jest zjawiskiem prawidłowym, świadczy bowiem o wzmożeniu napię-
cia układu współczulnego i spadku napięcia nerwu błędnego. Czasem zdarza
się pod koniec wysiłku lub w fazie recovery wydłużenie odstępu PR (blok
I stopnia), co trudne jest do jednoznacznej interpretacji, zwłaszcza w okresie
rozpowszechnienia terapii wpływającej na przewodzenie (beta-adrenolityki,
antagoniści kanałów wapniowych, glikozydy naparstnicy, leki antyarytmicz-
ne). Bloki przedsionkowo-komorowe II stopnia – zarówno periodyka Wenc-
kebacha, jak i blok typu Mobitz II występują w czasie wysiłku rzadko, po-
dobnie jak blok całkowity. Ich znaczenie nie jest do końca określone,
a najczęściej świadczą one o istotnym upośledzeniu przewodzenia, będąc
z jednej strony wskazaniem do zakończenia badania, z drugiej zaś do wszcze-
pienia układu stymulującego na stałe (test wysiłkowy służy jako pomocnicza
metoda w ustaleniu koniecznego trybu stymulacji – czas i rodzaj wszczepio-
nego stymulatora).
BEZPIECZEŃSTWO BADANIA
Badania wysiłkowe uznawane są za badania bezpieczne. Zdarza się jed-
nak, zwłaszcza w grupach wysokiego ryzyka (ChNS, po zawale serca, niewy-
dolność serca), że podczas ich trwania wystąpią groźne powikłania w posta-
ci zawału serca lub nagłego zatrzymania krążenia (migotanie komór,
asystolia). Uważa się, że ryzyko wystąpienia zawału serca lub NZK wynosi
od 3 do 9 na 10 000 badań. Większość tych przypadków kończy się pomyślnie
101

(skuteczna reanimacja). W doświadczeniach naszego zespołu (ponad 22 ty-
siące badań) dwukrotnie wystąpiło migotanie komór, skutecznie defibrylo-
wane przed upływem 60 sekundy od wystąpienia NZK, a u jednej chorej wy-
stąpiła asystolia (kurczowa postać ChNS), również zakończona skuteczną
reanimacją. Kilkadziesiąt razy mieliśmy do czynienia z częstoskurczami ko-
morowymi, najczęściej nieutrwalonymi i samoograniczającymi się.
PODSUMOWANIE
Testy wysiłkowe są ważną metodą w diagnostyce kardiologicznej. Pozwala-
ją na ocenę niedokrwienia mięśnia sercowego, ocenę skuteczności leczenia
ChNS, odgrywają również istotną rolę w ocenie zagrożenia pacjentów z wy-
wiadem arytmii, zwłaszcza komorowej. W wielu przypadkach są jedyną me-
todą, która pozwala na udokumentowanie obecności zaburzeń rytmu lub po-
zwala wyjaśnić podłoże dolegliwości odczuwanych przez pacjentów.
W przypadku pacjentów z organiczną chorobą serca i wywiadem groźnych
arytmii komorowych testy są ważną metodą w określeniu zagrożenia nagłą
śmiercią sercową. Zajmują wobec tego ważną pozycję w ustalaniu wskazań
do leczenia antyarytmicznego, monitorowaniu skuteczności takiego lecze-
nia, a także w wykazaniu toksycznego działania leków antyarytmicznych i ich
proarytmicznych efektów. Często są jedyną metodą, która identyfikuje pa-
cjentów pozornie zabezpieczonych antyarytmicznie, u których arytmia ujaw-
nia się dopiero w czasie wysiłku.
Nie można jednak traktować badania wysiłkowego jako jedynej pełnej me-
tody diagnostycznej w identyfikacji i leczeniu pacjentów z arytmią komoro-
wą. Dopiero kompleksowa ocena kliniczna z wykorzystaniem różnych do-
stępnych metod pozwala trafnie postawić rozpoznanie i precyzyjnie dobrać
lub zmodyfikować leczenie.
FORUM ELEKTROKARDIOGRAFICZNE
Przypadek 1 – komorowe zaburzenia rytmu serca prowokowane niedokrwieniem
mięśnia sercowego
63-letni chory, palący od wielu lat papierosy, z nadciśnieniem tętniczym,
nieleczący się wcześniej z powodu chorób układu krążenia, został skierowa-
ny na test wysiłkowy z powodu występujących od kilku miesięcy niespecy-
ficznych dolegliwości bólowych w klatce piersiowej, z towarzyszącym uczu-
ciem nierównej pracy serca.
Badanie wykonano na bieżni ruchomej wg protokołu Bruce'a (ryc. 1).
102
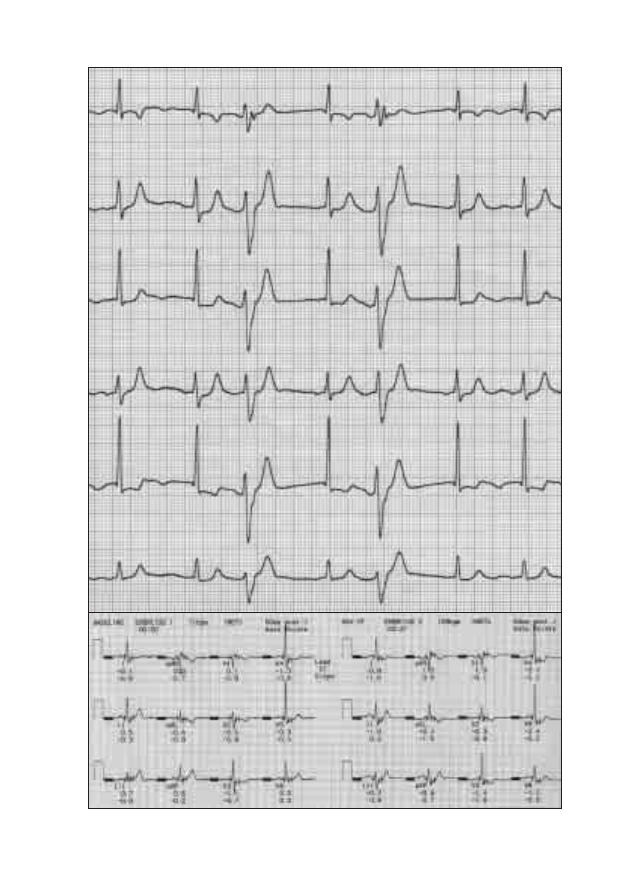
Rycina 1.
103
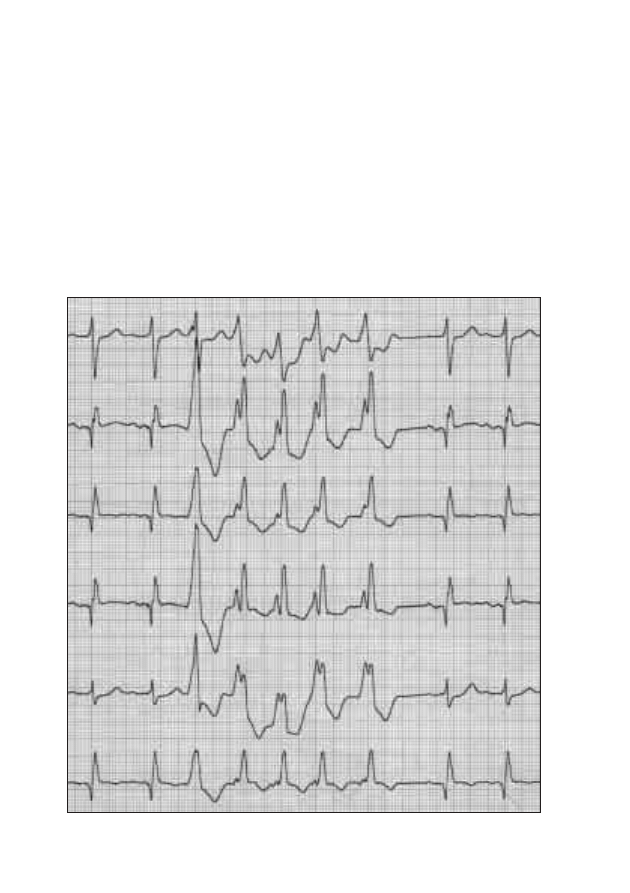
Wynik:
W spoczynku rytm zatokowy miarowy 66/min, bez zmian odcinka ST. Od
3 minuty wysiłku obniżanie odcinka ST w odprowadzeniach V
3
-V
6
z towa-
rzyszącą dość liczną arytmią komorową. Na szczycie wysiłku – ból w klatce
piersiowej o charakterze wieńcowym. Wynik wybitnie dodatni.
W wykonanym badaniu koronarograficznym stwierdzono 90% zwężenie
gałęzi okalającej lewej tętnicy wieńcowej (11 segment) i rozsiane 40-50%
zmiany na całym przebiegu prawej tętnicy wieńcowej.
Przypadek 2 – salwa pobudzeń z szerokimi zespołami QRS podczas wczesnego
pozawałowego testu wysiłkowego
Rycina 2.
104
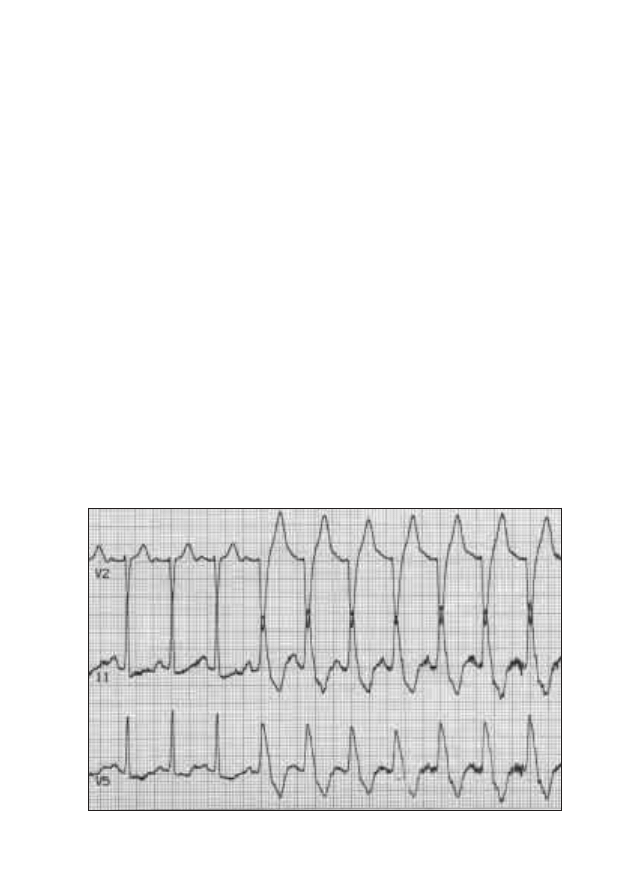
70-letni pacjent leczony z powodu ostrego zawału serca ściany dolno-
-tylno-bocznej (fibrynoliza). Przebieg wczesnej fazy zawału niepowikłany.
Test wysiłkowy wykonywany w 10 dobie hospitalizacji.
Badanie wykonano na bieżni ruchomej wg modyfikowanego protokołu
Bruce'a (ryc. 2).
Wynik:
W spoczynku rejestrowano pojedynczą heterotopię komorową. W 3 minucie
wysiłku – salwa pobudzeń z szerokimi zespołami QRS, bez towarzyszących
objawów klinicznych. Podczas testu nie rejestrowano zmian odcinka ST
typowych dla niedokrwienia.
W wykonanej koronarografii stwierdzono krytyczne zwężenie (95%) w pro-
ksymalnym odcinku prawej tętnicy wieńcowej. Podczas zabiegu angioplastyki
wieńcowej – 2 wstawki nieutrwalonego częstoskurczu o morfologii komo-
rowej. Po skutecznym zabiegu – ustąpienie zaburzeń rytmu serca.
Przypadek 3 – blok lewej odnogi pęczka Hisa podczas testu wysiłkowego
46-letni otyły pacjent, z nadciśnieniem tętniczym, z około 2-miesięcznym
wywiadem bólów w klatce piersiowej, występujących przy większych wysił-
kach fizycznych.
Badanie wykonano na bieżni ruchomej wg protokołu Bruce'a (ryc. 3).
Rycina 3a.
105

Wynik:
W spoczynku rytm zatokowy miarowy 73/min. Podczas badania bez dole-
gliwości bólowych. Przy obciążeniu 7 METs – blok lewej odnogi pęczka Hisa.
W fazie odpoczynku – ustąpienie zaburzeń przewodzenia.
W wykonanym badaniu koronarograficznym stwierdzono 90% zwężenie
w proksymalnym odcinku gałęzi przedniej zstępującej lewej tętnicy wieńco-
wej (6 segment).
Przypadek 4 – częstoskurcz komorowy u pacjenta z kardiomiopatią rozstrzeniową
32-letni pacjent z kardiomiopatią rozstrzeniowa (pozapalną), w III klasie
niewydolności serca wg NYHA, hospitalizowany po dwukrotnym epizodzie
krótkotrwałych utrat przytomności. W wykonanych wcześniej badaniach
EKG i 24-godzinnej rejestracji metodą Holtera stwierdzano pojedyncze
pobudzenia komorowe (klasa 2 wg Lowna).
Badanie wykonano na bieżni ruchomej wg modyfikowanego protokołu
Bruce'a (ryc. 4).
Wynik:
W 3 minucie wysiłku – zarejestrowano dwie wstawki nieutrwalonego czę-
stoskurczu komorowego, z towarzyszącymi zawrotami głowy.
Chory został zakwalifikowany do implantacji kardiowertera-defibryla-
tora.
Rycina 3b.
106
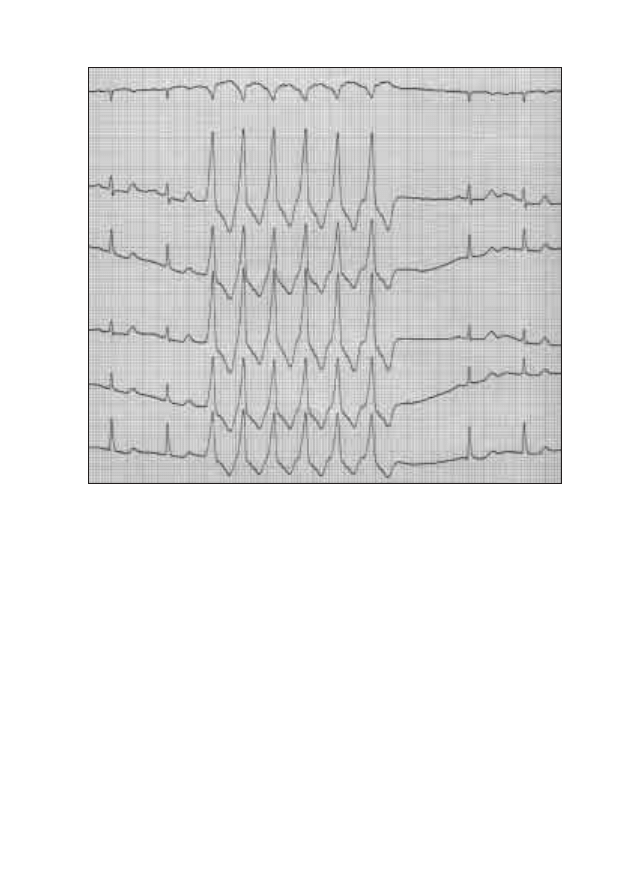
Zapamiętaj!
1. Test wysiłkowy jest jedną z najważniejszych metod w diagnostyce zaburzeń
rytmu serca. Dotyczy to zwłaszcza arytmii komorowych.
2. Wysiłek fizyczny powoduje wzrost napięcia układu współczulnego, zwięk-
szenie katecholaminemii oraz zmniejszenie napięcia nerwu błędnego, co
może skutkować wzmożeniem automatyzmu i pojawieniem się zaburzeń
refrakcji i przewodzenia.
3. Zmiany mechaniczne, takie jak rozciągnięcie miokardium i dysfunkcja lewej
komory, zaburzenia elektrolitowe (hipokaliemia), a także zmiany regional-
nego pH, to kolejne mechanizmy odpowiedzialne za wyzwalanie zaburzeń
rytmu w czasie wysiłku.
4. Arytmie nadkomorowe prowokowane wysiłkiem występują również u pa-
cjentów ze zdrowym sercem.
Rycina 4.
107

5. Arytmie komorowe, zwłaszcza złożone ich formy są najczęściej wynikiem
strukturalnego uszkodzenia serca (ChNS, wady, kardiomiopatie) i ich wy-
stąpienie może być związane ze zwiększeniem ryzyka nagłego zgonu.
6. Test wysiłkowy pozwala ocenić skuteczność leczenia antyarytmicznego,
zmodyfikować dawki i rodzaj leków, oszacować ryzyko działań proaryt-
micznych lub toksycznej terapii antyarytmicznej.
7. Badanie jest jedną z metod ważną w kompleksie diagnostycznym.
Warto przeczytać:
G.F. Fletcher i wsp.: Ujednolicone zasady wykonywania prób wysiłkowych
i prowadzenia treningu fizycznego. Stanowisko AHA dla pracowników służby
zdrowia. Circulation, wydanie polskie 2002, 1: 64-123.
E. Straburzyńska-Migaj: Zaburzenia rytmu serca. Wykrywanie, ocena i le-
czenie. Rola testów wysiłkowych. Kardiol. Pol. 1997, 46: 363-366.
V.F. Froelicher: Podręcznik testów wysiłkowych. Bel Corp., Warszawa 1999.
S. Partington, J. Myers, S. Cho, V.F. Froelicher, S. Chun: Prevalence and
prognostic value of exercise-induced ventricular arrhythmias. Am Heart J
2003, 145: 139-46.
A. Elhendy, K. Chandrasekaran, B.J. Gersh: Functional and prognostic sig-
nificance of exercise-induced ventricular arrhythmias in patients with suspec-
ted coronary artery disease. Am J Cardiol 2002, 90: 95-100.
108

VIII. ECHOKARDIOGRAFIA W DIAGNOSTYCE ZABURZEŃ
RYTMU SERCA – NA ILE PRZYDATNA?
Wojciech Braksator, Marek Kuch
Echokardiografia jest jedną z podstawowych metod diagnostycznych
w chorobach układu krążenia. Służy przede wszystkim do oceny mechanicz-
nej, hemodynamicznej serca, opisuje jego budowę i funkcję. Zaburzenia ryt-
mu i przewodzenia są nieprawidłowościami w pracy elektrycznej serca i dla-
tego podlegają przede wszystkim ocenie metodami badającymi czynność
elektryczną i ocenie elektrofizjologicznej, m.in. badania EKG: spoczynko-
we, metodą Holtera, przezprzełykowa stymulacja przedsionków, programo-
wana stymulacja komór, a także próba wysiłkowa (patrz inne rozdziały). Te
badania pozwalają ustalić rodzaj zaburzeń rytmu i wynikające z tego zagro-
żenie, jednak zwykle nie udaje się stwierdzić choroby, która jest ich przyczy-
ną. Potrzebne są inne metody badawcze. Echokardiografia jest podstawową
z nich. Daje możliwość zobrazowania serca w ruchu, ocenę jego czynności
i przepływów, pozwala na ustalenie rozpoznania wielu chorób powodują-
cych arytmię, a co najmniej na określenie tła, na które nakładają się zabu-
rzenia rytmu.
Za pomocą echokardiografii można określić:
Poniżej przedstawiono stany warunkujące wystąpienie zaburzeń rytmu
serca, tzn. te przyczyny arytmii, które można rozpoznać za pomocą echo-
kardiografii. Wiele z tych chorób charakteryzuje się różnorodnością obja-
wów, ale niejednokrotnie podstawowe zagrożenie stanowią zaburzenia ryt-
mu, główny mechanizm nagłej śmierci sercowej (sudden cardiac death,
SCD). Wymienione są też takie elementy badania serca, które mają duże
znaczenie jako podłoże arytmii, np. wielkość jam czy grubość mięśnia lewej
komory.
Najważniejszą podgrupę chorych zagrożonych zaburzeniami rytmu serca
stanowią pacjenci z chorobą niedokrwienną (ChNS), a przede wszystkim
z zawałem serca. Znaczenie echokardiografii w zawale jest znane. Podsta-
• stany warunkujące wystąpienie zaburzeń rytmu serca,
tzn. ich przyczyny;
• niektóre mechanizmy powodujące wystąpienie arytmii;
• grupy wysokiego ryzyka – chorych zagrożonych nagłą śmiercią
sercową.
109

wę badania stanowią: rozpoznawanie jakościowych i ilościowych zaburzeń
kurczliwości miejscowej (asynergii), ocena dysfunkcji skurczowej lewej ko-
mory wyrażająca się niską frakcją wyrzutową (ejection fraction, EF), pomiar
wielkości jam serca, zwłaszcza jamy lewej komory oraz ocena powikłań, ta-
kich jak np. obecność tętniaka pozawałowego czy dużej niedomykalności mi-
tralnej.
Im większe pozawałowe uszkodzenie mięśnia lewej komory, tym większe
zagrożenie groźnymi komorowymi zaburzeniami rytmu (częstoskurcz komo-
rowy, migotanie komór). Choroba wieńcowa i zawał serca stanowią ok. 80%
wszystkich przyczyn nagłej śmierci sercowej. Najistotniejsze zagrożenia aryt-
mią związane są z niską wartością frakcji wyrzutowej i powiększeniem jamy
lewej komory.
Tętniak pozawałowy skupia w sobie oba te elementy. Tętniakiem nazywa-
my zniekształcenie sylwetki lewej komory w skurczu i w rozkurczu ze scień-
czeniem ściany i odcinkowymi zaburzeniami kurczliwości (ryc. 1).
• zawał serca/choroba niedokrwienna:
wielkość jam (komory, przedsionki),
grubość ścian,
zaburzenia kurczliwości – miejscowe, uogólnione,
dysfunkcja skurczowa (EF < 40%),
dysfunkcja rozkurczowa (metoda Dopplera),
powikłania zawału serca: tętniak, skrzeplina,
niedomykalność mitralna, VSD;
• kardiomiopatie (przerostowa, zastoinowa, restrykcyjna);
• przerost (nadciśnienie tętnicze);
• wady zastawkowe;
• wypadanie płatka zastawki mitralnej
(mitral valve prolapse – MVP);
• zapalenia (mięśnia, wsierdzia, osierdzia);
• guzy (śluzak, skrzeplina);
• płyn w worku osierdziowym, tamponada;
• arytmogenna dysplazja prawej komory
(kardiomiopatia prawej komory);
• inne:
rozwarstwienie aorty,
zatorowość płucna.
110
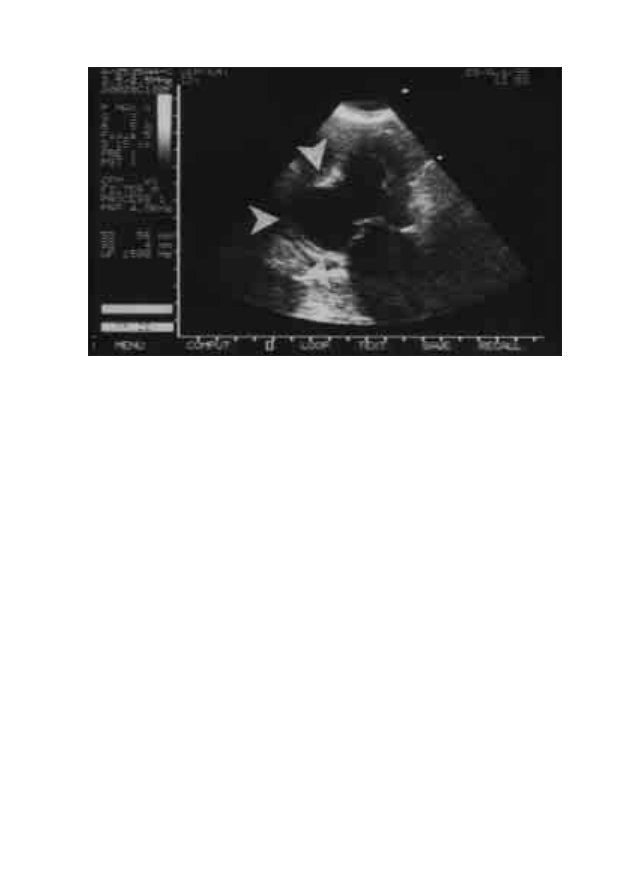
Tętniak charakteryzuje się zniekształceniem i zwykle powiększeniem ja-
my, morfologicznymi zmianami w budowie ściany z wytworzeniem tkanki
włóknistej, czyli blizny oraz niską frakcją wyrzutową i rozległymi zaburze-
niami kurczliwości. Należy stosować możliwie precyzyjne kryteria rozpozna-
nia tętniaka i nie nadużywać tego określenia. Wynik badania ECHO musi
być w pełni wiarygodny.
Za ważny, niezależny czynnik zagrożenia nagłą śmiercią sercową po zawa-
le serca i jeden z najistotniejszych czynników prognostycznych, uważa się ni-
ską wartość frakcji wyrzutowej. Echokardiografia jest podstawową metodą
oceny EF. Frakcję wyrzutową obliczamy z badania dwuwymiarowego za po-
mocą metody Simpsona (ryc. 2). Po obrysowaniu sylwetki skurczowej i roz-
kurczowej lewej komory, dzięki oprogramowaniu echokardiografów, w pro-
sty i wiarygodny sposób możliwe jest obliczenie wartości EF.
Niska wartość frakcji wyrzutowej koreluje z wysoką śmiertelnością. Zagro-
żenie jest największe, gdy wartość EF jest niższa niż 25%.
Klasyczne, ale ciągle aktualne dane Bigger'a pokazują, że prawdopodo-
bieństwo zgonu w ciągu 3 lat jest ponad czterokrotnie większe u chorych
z EF <30% niż u osób z EF >40%, a wartość frakcji wyrzutowej poniżej
40% dwukrotnie zwiększa ryzyko wystąpienia groźnych arytmii komorowych
po zawale w porównaniu z osobami z EF >40%. Prawdopodobieństwo wy-
wołania utrwalonego częstoskurczu komorowego za pomocą programowa-
Rycina 1: Tętniak pozawałowy dolnej ściany lewej komory (strzałki)
111
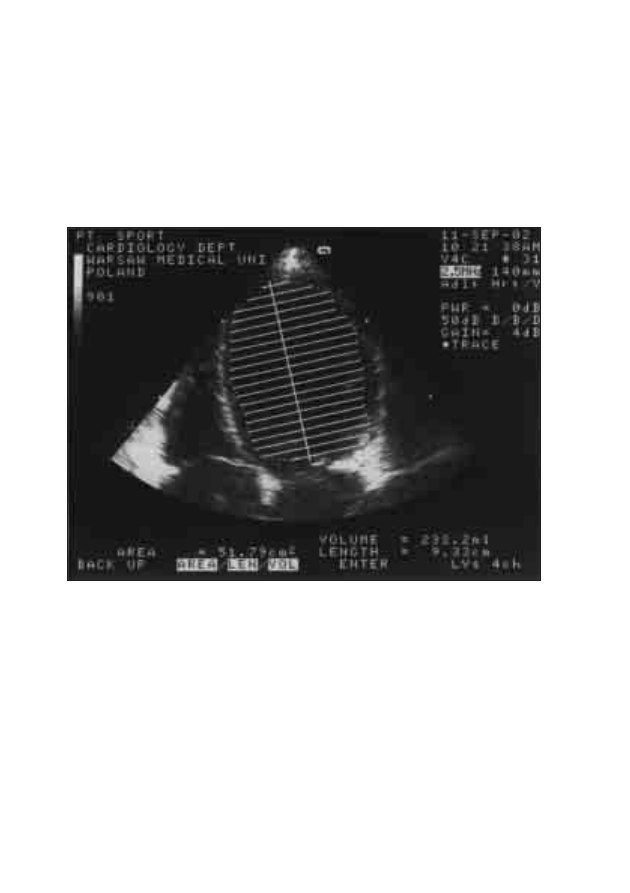
nej stymulacji komór zależy od wartości frakcji wyrzutowej. Ryzyko takie jest
10-krotnie większe u chorych z EF <40%, w porównaniu z osobami z frakcją
wyrzutową >40% (52% vs 5,0%). Znaczenie frakcji wyrzutowej w ocenie ry-
zyka SCD potwierdzają także współczesne badania naukowe. W badaniu
MADIT II frakcja wyrzutowa stanowiła podstawę do wszczepienia kardio-
wertera-defibrylatora u chorych po zawale serca z EF <30%. Śmiertelność
w tej grupie była znamiennie niższa niż w grupie leczonej farmakologicznie
(14% vs 19%).
Innym ważnym parametrem ocenianym echokardiograficznie po zawale
serca jest wielkość jam. U chorych z powiększoną jamą lewej komory znacz-
nie częściej występują komorowe zaburzenia rytmu, wzrasta również śmier-
telność. Poprzez powiększenie jamy lewej komory dochodzi do wzrostu ob-
jętości końcoworozkurczowej i końcowoskurczowej. Wzrost tych objętości
o 20-30% powoduje 6-krotny wzrost śmiertelności po zawale serca.
Echokardiografia jest podstawową metodą rozpoznania i oceny: kardio-
miopatii przerostowej, rozstrzeniowej, restrykcyjnej, wad zastawkowych, wy-
padania płatka zastawki mitralnej, nalotów bakteryjnych na wsierdziu, gu-
zów w jamach serca (śluzak, skrzeplina), płynu w worku osierdziowym,
rozwarstwienia aorty, przeciążenia serca prawego (zatorowość płucna).
Rycina 2: Echokardiograficzne obliczanie wartości frakcji wyrzutowej metodą Simpsona
112
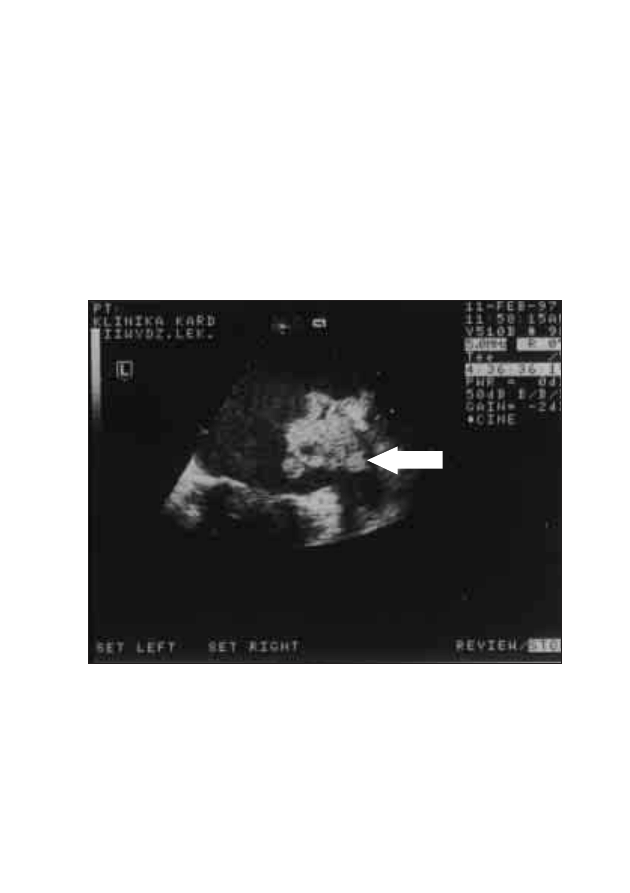
W przypadku wad zastawki mitralnej występują głównie nadkomorowe za-
burzenia rytmu, a zwłaszcza migotanie przedsionków (atrial fibrillation, AF).
Migotanie przedsionków stanowi przedmiot osobnego rozdziału tego pod-
ręcznika. Echokardiografia jest niezbędnym elementem diagnostyki AF. Na-
leży jednak pamiętać, że celem badania ECHO nie jest poszukiwanie skrze-
plin w sercu. Chodzi przede wszystkim o ocenę serca w aspekcie możliwości
przywrócenia i utrzymania rytmu zatokowego, a więc wielkości jamy lewe-
go przedsionka (<5 cm), lewej komory i jam serca prawego. Elementy te są
jednymi z wielu w takiej ocenie. Stwierdzenie obecności skrzepliny w jamie
lewego przedsionka, czy za pomocą techniki przezprzełykowej (transesophage-
al echocardiography, TEE) w jego uszku, wyklucza czasowo możliwość kar-
diowersji (ryc. 3).
Jednak wskazania do wykonania TEE są bardzo ograniczone. Korzyść
z wykonania badania przezprzełykowego odnoszą głównie ci pacjenci, którzy
są umiarawiani z wykorzystaniem tzw. przyspieszonej ścieżki, w przetrwałym
AF. Gdy czas trwania migotania przekracza 48 godzin, można po zastoso-
waniu heparyny i stwierdzeniu nieobecności skrzeplin w sercu w badaniu
TEE, wykonać bezpiecznie kardiowersję elektryczną bez potrzeby wielo-
Rycina 3: Lewy przedsionek i jego uszko w badaniu echokardiograficznym przezprzełykowym
(TEE); strzałka wskazuje dużą skrzeplinę w uszku
113

dniowego przygotowywania doustnymi lekami przeciwkrzepliwymi. Doust-
ne leki przeciwkrzepliwe stosujemy 4 tygodnie po kardiowersji. W pozosta-
łych przypadkach, zwłaszcza utrwalonego AF, chorzy nie odnoszą istotnych
korzyści z wykonania drogiego, półinwazyjnego, przezprzełykowego bada-
nia echokardiograficznego.
W diagnostyce wad zastawkowych obok wielkości powierzchni ujścia, gra-
dientu i fali niedomykalności (metoda Dopplera), oceniana jest przede
wszystkim wielkość jam serca lewego. W zespole wypadania płatka zastawki
mitralnej echokardiografia pozwala na ustalenie rozpoznania (wpuklanie się
płatka zastawki do jamy lewego przedsionka >2 mm w projekcji przymost-
kowej w osi długiej w badaniu dwuwymiarowym), a wynik badania jest sygna-
łem do dalszej diagnostyki.
W kardiomiopatii przerostowej oceniany jest przede wszystkim przerost
mięśnia lewej komory (wskaźnik przerostu: przegroda/ściana tylna >1,3), gra-
dient w drodze odpływu (znaczący: >50 mm Hg), ocena czynności rozkurczo-
wej na podstawie analizy napływu mitralnego (wskaźnik E/A). W kardiomio-
patii rozstrzeniowej badamy wielkość jam serca, głównie lewej komory,
grubość ścian, kurczliwość mięśnia lewej komory oraz frakcję wyrzutową.
W nadciśnieniu tętniczym metoda ultradźwiękowa pozwala na pomiar grubo-
ści mięśnia lewej komory i ocenę stopnia dysfunkcji rozkurczowej. ECHO 2D
jest metodą z wyboru w rozpoznawaniu i ocenie płynu w worku osierdziowym.
Echokardiografia jest metodą pomocniczą w ocenie zapalenia mięśnia ser-
cowego i zapalenia osierdzia. Infekcje wirusowe często dotyczą osierdzia,
zwłaszcza te nieleczone i przewlekające się. W tych przypadkach konieczne
jest wykonanie badania echokardiograficznego. Pogorszenie tolerancji wy-
siłku, tachykardia, zaburzenia rytmu serca, zwykle u osoby dotychczas zdro-
wej, często młodej, powinny zasugerować podejrzenie zapalenia mięśnia ser-
cowego. Echokardiografia jest niezbędną metodą diagnostyczną w tym
przypadku.
Groźne komorowe zaburzenia rytmu serca występują w arytmogennej
dysplazji prawej komory – kardiomiopatii prawej komory (ADPK). Echo-
kardiografia zawsze poprzedza wykonanie nuklearnego rezonansu magne-
tycznego, będącego podstawą rozpoznania tej choroby. Czasem w ECHO
stwierdzamy powiększenie prawej komory i zmiany w jej budowie, utwier-
dzając się w podejrzeniu ADPK.
Przedstawione choroby mogą być oceniane za pomocą echokardiografii.
Są one przyczyną występowania arytmii. Echokardiografia jest integralną
częścią diagnostyki kardiologicznej u chorych z zaburzeniami rytmu serca.
114
Zgodnie z obowiązującymi standardami badanie echokardiograficzne wyko-
nywane jest po to, aby ustalić „tło”, na którym występują zaburzenia rytmu.
Często można postawić rozpoznanie choroby (np. zawał, kardiomiopatia)
i ustalić przyczynę występowania arytmii (np. tętniak, przerost). Można też
ocenić stopień uszkodzenia serca oraz ewentualne następstwa leczenia anty-
arytmicznego.
Zostały ustalone wskazania do wykonania badania ECHO w zaburzeniach
rytmu serca. Amerykańskie Towarzystwa Kardiologiczne (American Heart
Association, American College of Cardiology, American Society of Echocar-
diography) przedstawiają 3 klasy wskazań: klasa I – wskazania pewne, klasa
II – wskazania względne, klasa III – wskazania wątpliwe (tab. 1).
Tabela 1: Wskazania do wykonania badania echokardiograficznego w diagnostyce zaburzeń
rytmu serca (wg AHA/ACC/ASE, 1997 rok)
• charakterystyka tła (przyczyna arytmii);
• ocena stopnia uszkodzenia (dysfunkcja skurczowa i rozkurczowa);
• rozpoznanie choroby;
• ocena skutków leczenia antyarytmicznego.
wg AHA/ACC/ASE, 1997
KLASA
WSKAZANIA
I
• zaburzenia rytmu w przebiegu choroby serca;
• dodatni wywiad rodzinny w kierunku chorób
uwarunkowanych genetycznie, przebiegających
z zaburzeniami rytmu serca;
• pacjenci przed zabiegiem ablacji;
II
• arytmia wymagająca leczenia;
• zaburzenia rytmu często występujące w przebiegu chorób
serca u chorego bez objawów choroby serca;
• badanie przezprzełykowe (TEE) przed zabiegiem
cewnikowania z przejściem przez otwór owalny i przed
zabiegiem ablacji;
III
• kołatania serca bez stwierdzonych zaburzeń rytmu;
• pojedyncze zaburzenia rytmu, bez objawów choroby serca.
115

Do wskazań pewnych zaliczono zaburzenia rytmu u chorych z rozpoznaną
chorobą serca, a także obciążający wywiad rodzinny. Według tej klasyfikacji
pewnym wskazaniem do wykonania badania echokardiograficznego jest
obecność lub podejrzenie choroby serca, a nie sam objaw, czyli fakt wystą-
pienia zaburzeń rytmu. Cały cykl diagnostyczny zmierza do rozpoznania i le-
czenia choroby, będącej podłożem arytmii, a nie jej objawów, do których
m.in. arytmia należy. W tej grupie wskazań znajdują się też szczególne pro-
cedury, jak np. przygotowanie do ablacji serca czy do wszczepienia układu
stymulującego serce. Echokardiografia znajduje zastosowanie w ocenie rzu-
tu metodą Dopplera u chorych ze wszczepionym rozrusznikiem serca.
Nie ma potrzeby wykonywania ECHO serca u osób z pojedynczą arytmią
i bez stwierdzanej choroby serca. Standardy te są potwierdzone przez Sekcję
Echokardiografii Polskiego Towarzystwa Kardiologicznego. W polskich wa-
runkach, wobec rozpowszechnienia choroby niedokrwiennej serca i nadci-
śnienia tętniczego, rośnie skala zagrożeń, łącznie z nagłą śmiercią sercową
w mechanizmie arytmicznym.
Każdy chory ze stwierdzonymi zaburzeniami rytmu serca powinien mieć
wykonane badanie echokardiograficzne.
Zapamiętaj!
1. Echokardiografia nie służy do oceny zaburzeń rytmu serca.
2. Każdy pacjent z zaburzeniami rytmu serca powinien mieć wykonane bada-
nie echokardiograficzne, gdyż:
często można rozpoznać chorobę,
można określić niektóre mechanizmy arytmii,
można wybrać grupy chorych zagrożonych nagłą śmiercią sercową
(z rozpoznaniem np. zawału serca czy kardiomiopatii).
Warto przeczytać:
M. Rubart, D. Zipes: Genesis of cardiac arrhythmias. Heart Disease;
E. Braunwald (red.), V edition, W.B. Saunders Comp., Philadelphia 1998.
W. Braksator: Rola echokardiografii w diagnostyce zaburzeń rytmu serca;
Nowa Klinika 1996, 3, 10, 166-192.
W. Rydlewska-Sadowska: Echokardiografia kliniczna; Wydawnictwo Insty-
tutu Kardiologii, Warszawa 1990.
116

H. Feigenbaum: Echocardiography, V edition, Lea& Febiger, Philadelphia
1995.
T.J. Bigger Jr.: Role of Ejection Fraction; Sudden Cardiac Death, Williams
Wilkins, Philadelphia 1994.
A. Moss et al.: Prophylactic Implantation of a Defibrillator In Patients with
Myocardial Infarction and Reduced Ejection Fraction; N Engl J Med 2002,
346, 12, 877-882.
P. Hoffman i wsp.: Standardy Echokardiografii Klinicznej Polskiego Towa-
rzystwa Kardiologicznego. Kardiol. Pol. 1999, 51, 173-187.
M. Cheitlin et al.: ACC/AHA Guidelines for the Clinical Application of
Echocardiography. A Report of the American College of Cardiology/Ameri-
can Heart Association Task Force on Assessment of Diagnostic and Thera-
peutic Cardiovascular Procedures (Subcommittee to Develop Guidelines for
the Clinical Application of Echocardiography); J Am Coll Cardiol. 1997, 29,
862-879.
117

IX.
BADANIE ELEKTROFIZJOLOGICZNE
– CZY NAJWAŻNIEJSZE W DIAGNOSTYCE ARYTMII?
Michał Moszczeński, Włodzimierz Mojkowski, Mirosław Dłużniewski
Elektrofizjologia kliniczna, gałąź kardiologii, która wyodrębniła się i roz-
winęła w latach 60. ubiegłego stulecia, wykorzystywała początkowo wprowa-
dzane poprzez nakłucie żyły (najczęściej udowej) elektrody endokawitarne,
za pomocą których możliwe było zarówno pobudzanie mięśniówki przed-
sionków bądź/i komór do skurczu, jak i rejestracja potencjałów wewnątrz-
sercowych. Pomagało to (i nadal pomaga) zrozumieć sekwencje wydarzeń
elektrycznych mięśnia sercowego w sytuacjach, kiedy standardowy 12-odpro-
wadzeniowy zapis EKG z powierzchni ciała okazywał się niewystarczający.
Kiedy taka sytuacja może mieć miejsce? Wyobraźmy sobie prosty układ ryt-
mu zatokowego z blokiem AV I°. Wraz ze wzrostem częstości pracy serca
wydłużeniu ulega odstęp PQ (jest to naturalne „męczenie” się układu bodźco-
-przewodzącego w mechanizmie opisanym przez Wenckebacha). W EKG
z powierzchni ciała nie jesteśmy w stanie określić, na jakim poziomie wystę-
puje uszkodzenie – czy między mięśniówką przedsionków a pęczkiem Hisa
(odstęp A-H), czy pęczkiem Hisa a mięśniówką komór (odstęp H-V). Jakie
to ma znaczenie? Okazuje się, że duże. Może czasami być czynnikiem decy-
dującym o zakwalifikowaniu danego pacjenta do wszczepienia rozrusznika
serca. Uszkodzenie na poziomie A-H określa się jako tzw. proksymalne
(zwykle dobrze reagujące na podanie atropiny) i uważa za mniej groźne od
uszkodzenia dystalnego H-V (ryc. 1). Pobudzenie pęczka Hisa jest po prostu
tak znikomym ilościowo zjawiskiem elektrycznym, że jego uwidocznienie
możliwe jest jedynie z bezpośredniej bliskości z zastosowaniem zapisu du-
żego wzmocnienia (co z kolei wymaga użycia odpowiednich układów elek-
tronicznych w tym różnych sekwencji filtrowania – ale komplikacja używa-
nej aparatury to osobna sprawa).
W trakcie inwazyjnego badania elektrofizjologicznego (Invasive Electro-
physiological Studies, EPS) wprowadza się zwykle 2-3 elektrody wielobiegu-
nowe, które rozmieszczone w prawym przedsionku, na granicy prawego
przedsionka i prawej komory w okolicach zastawki trójdzielnej (czasem
w zatoce wieńcowej) oraz w koniuszku prawej komory, pozwalają na obser-
wację sekwencji rozchodzenia się impulsu „z góry na dół” (bądź odwrotnie,
przy tzw. wstecznej depolaryzacji, np. po dodatkowym skurczu komorowym).
Oprócz prostej rejestracji samoistnie występujących zjawisk elektrycznych
możliwa i wykonywana jest tzw. programowana stymulacja przedsionków
i komór. W przypadku programowanej stymulacji przedsionków oznacza się
następujące parametry:
118
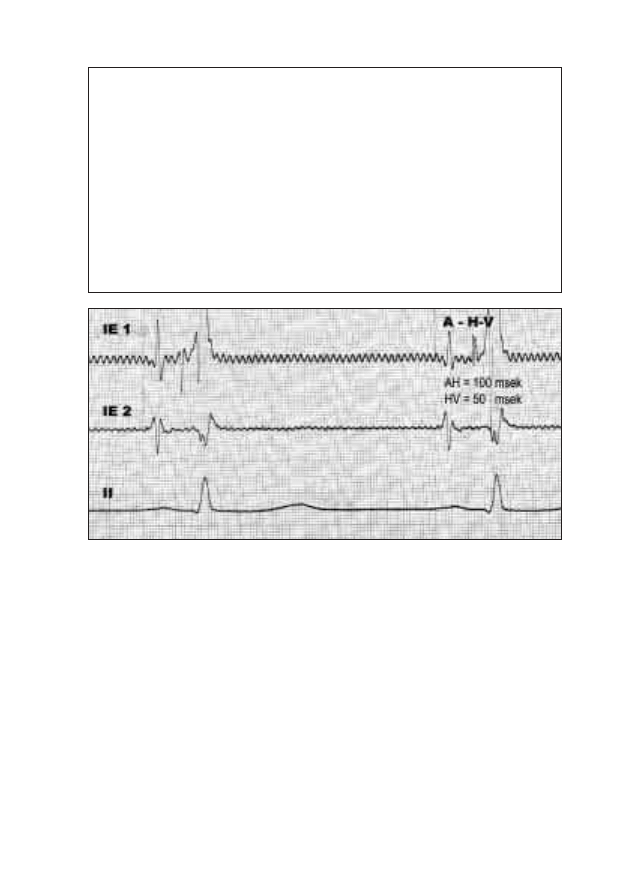
W latach 70. zaobserwowano (w czym duży udział miał zespół polskich ba-
daczy pod kierownictwem Mariusza Stopczyka), że większość powyżej opisa-
nych parametrów oznaczyć można podczas przezprzełykowej stymulacji
przedsionka. Stymuluje się wtedy lewy, a nie prawy przedsionek, co ma swo-
je wady, ale również zalety. Wadą jest niejako odwrotna sekwencja depolary-
zacji przedsionków przy stymulacji (najpierw lewy, potem prawy przedsio-
nek) – ale przy ocenianych zjawiskach – do zaakceptowania. Zaletą jest
możliwość oceny przewodzenia od prawego do lewego przedsionka (która
przy badaniu inwazyjnym wymagałaby wprowadzenia odrębnej elektrody do
zatoki wieńcowej, bądź przekłucia przegrody międzyprzedsionkowej i wpro-
wadzenia tejże elektrody bezpośrednio do lewego przedsionka). Przezprze-
łykowa stymulacja przedsionków została dokładnie opisana w pierwszym to-
mie podręcznika.
Rycina 1: Zapis wewnątrzsercowy (IE 1, IE2) oraz zapis z odprowadzenia II kończynowego
• maksymalne przewodzenie 1:1 (z przedsionków do komór),
tzw. punkt Wenckebacha;
• czas powrotu rytmu zatokowego (SNRT);
• skorygowany czas powrotu rytmu zatokowego (cSNRT);
• ewentualną obecność rozszczepienia łącza przedsionkowo-
komorowego i refrakcję włókien wolno i szybko przewodzących;
• ewentualną obecność, rodzaj, położenie i refrakcję drogi
dodatkowej (efektywna refrakcja drogi dodatkowej, ERP AP)
w przypadku podejrzenia zespołu preekscytacji;
• możliwość prowokacji nawrotnych tachyarytmii przedsionkowych
różnego rodzaju.
119
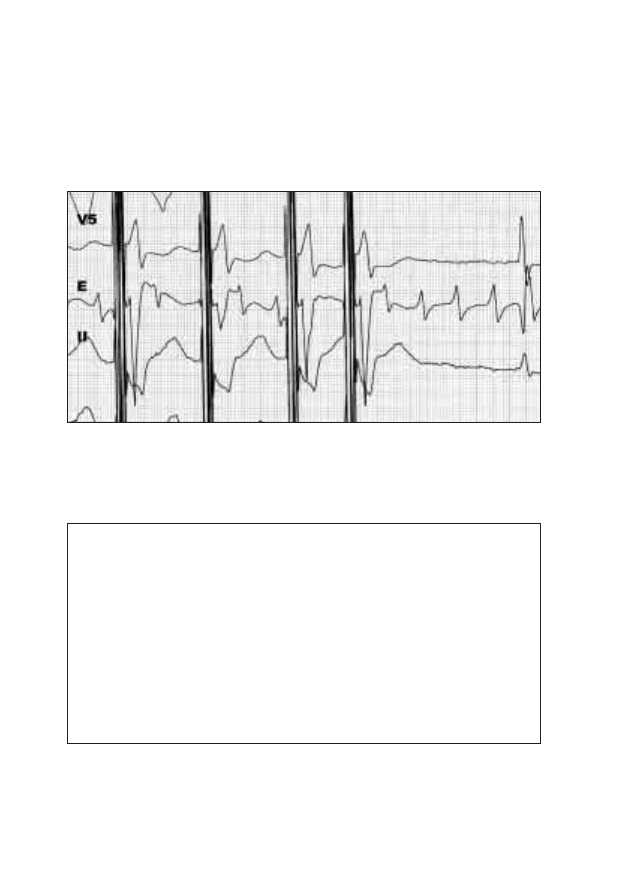
O ile w przypadku konieczności stymulacji przedsionków możemy posługi-
wać się metodą przezprzełykową, o tyle programowana stymulacja komór
pozostaje w praktyce domeną elektrofizjologii inwazyjnej. Bynajmniej nie
dlatego, że niemożliwa jest stymulacja komory z przełyku (ryc. 2), ale dlate-
go, że prąd potrzebny do wywołania odpowiedzi komory jest zwykle znacz-
nie powyżej progu bólu pacjenta.
Przy programowanej stymulacji komór oznaczamy następujące parametry:
Stymulację komór wykorzystać można również do przerwania częstoskur-
czu stymulacją programowaną bądź wewnątrzsercową defibrylacją. Siłą rze-
czy ogranicza się do przypadków częstoskurczów/migotania wywołanych
podczas EPS.
• refrakcję komór przy stymulacji jednym (ryc. 3), a następnie
dwoma impulsami (dopuszczalne jest stymulowanie trzema,
czterema czy wręcz serią impulsów, ale niektórzy badacze
podważają wartość prognostyczną wygenerowania podczas
takiego postępowania zaburzeń rytmu serca);
• możliwość sprowokowania pojedynczych ekstrasystolii
komorowych (repetitive response) (ryc. 4);
• możliwość sprowokowania częstoskurczu komorowego (ryc. 5);
• możliwość sprowokowania migotania komór (ryc. 6);
• zlokalizowanie miejsca powstawania komorowych pobudzeń
ektopowych.
Rycina 2: Przezprzełykowa programowana stymulacja komór - oznaczanie refrakcji komór
na rytmie narzuconym 110/'. W zapisie z elektrody przełykowej (E) wyraźnie
widoczny rytm przedsionków - trzepotanie
120
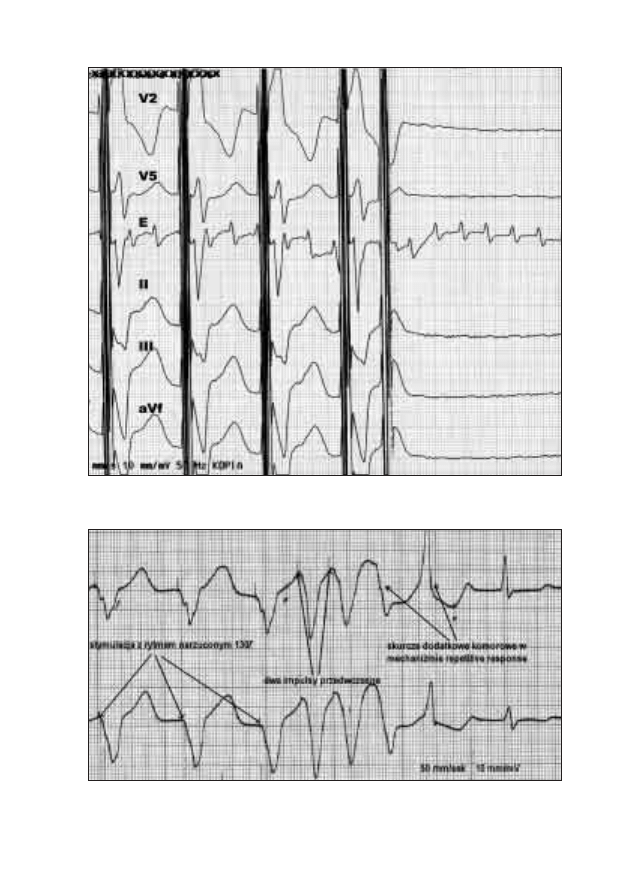
Rycina 4: Programowana stymulacja komór z dwoma impulsami przedwczesnymi
powodującymi dodatkowe skurcze komorowe w mechanizmie repetitive response
Rycina 3: Refrakcja komór oznaczona pojedynczym impulsem
121
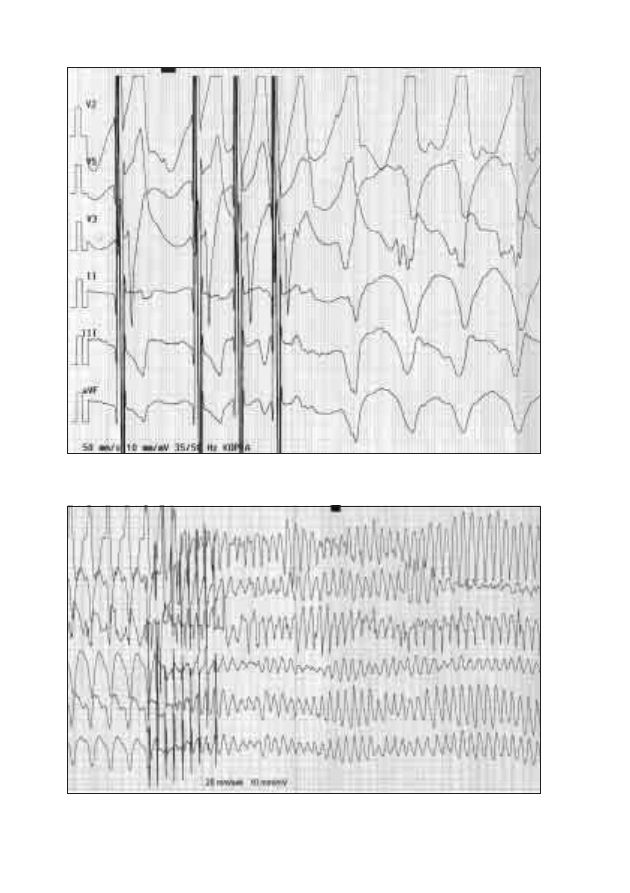
Rycina 6: Utrwalony częstoskurcz komorowy o częstości 150/min degenerujący do migotania
komór pod wpływem serii impulsów
Rycina 5: Częstoskurcz komorowy sprowokowany podczas programowanej stymulacji komór
122
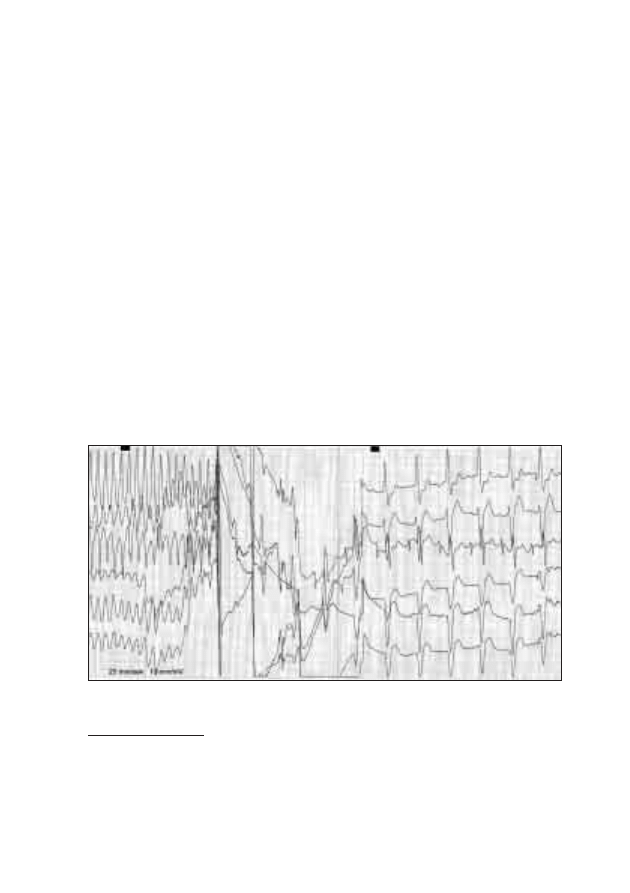
Do inwazyjnego badania elektrofizjologicznego powinni być kwalifikowani
pacjenci, u których częstoskurcze/migotania występują spontanicznie. Należy
pamiętać o ograniczeniu metody polegającej na występowaniu wyników za-
równo fałszywie dodatnich (generowanie arytmii u pacjentów, u których nigdy
wcześniej nie występowała), jak i fałszywie ujemnych (niemożność sprowoko-
wania arytmii u pacjentów z udokumentowanymi zaburzeniami). Ponadto pro-
blem stwarza nie zawsze pełna powtarzalność badania ze względu na wiele
zmiennych (aktywność nerwowego układu autonomicznego, wpływy hemody-
namiczne czy niedokrwienne, zmiany anatomiczne, np. „dorzut” zawału).
Badanie przeprowadzić można zarówno w warunkach podstawowych, jak
i po jednorazowym bądź dłuższym podawaniu leku antyarytmicznego dla
oceny bezpieczeństwa i/lub skuteczności leczenia. Ze względu zarówno na in-
wazyjny charakter badania, jak i możliwość prowokowania groźnych dla ży-
cia pacjenta zaburzeń rytmu, każdorazowa decyzja o wykonaniu programo-
wanej stymulacji komór wymaga rozważenia celowości i konieczności
wykonania tegoż badania. Ponadto musi ono być wykonywane przez do-
świadczonego elektrofizjologa przy pełnym zabezpieczeniu do podjęcia na-
tychmiastowej defibrylacji i ewentualnej dalszej akcji reanimacyjnej (ryc. 7).
Wymogiem etycznym i prawnym jest również uzyskanie świadomej, pisemnej
zgody pacjenta na powyższe badanie.
Rycina 7: Utrwalony częstoskurcz komorowy o częstości 150/min degenerujący do migotania
komór pod wpływem serii impulsów
Dla zainteresowanych: praktycznie każdy z nowoczesnych stymulatorów serca posiada możli-
wości wykonania badania elektrofizjologicznego z wykorzystaniem wszczepionej elektrody/
elektrod (w zależności od tego, czy stymulator jest jedno- czy dwujamowy). W praktyce możli-
we jest również (co z powodzeniem było stosowane w naszym ośrodku) wykorzystanie do
programowanej stymulacji komór stymulatora starszej generacji, który nie ma takiej funkcji w
swoim programie. W tym celu należy przestawić rodzaj odpowiedzi stymulatora na rozpoznany
impuls elektryczny w tryb „T” (VVT, SST) i narzucanie rytmu ze stymulatora zewnętrznego
poprzez naklejane na klatkę piersiową elektrody.
123

Na zakończenie spróbujmy rozważyć zadane w tytule pytanie: czy badanie
elektrofizjologiczne jest najważniejsze w diagnostyce arytmii?
Odpowiedź oczywiście nie jest jednoznaczna i zależy od tego, z jakimi ro-
dzajami zaburzeń wytwarzania/przewodzenia bodźca mamy do czynienia.
Pamiętajmy, że warunkiem niezbędnym do wykonania programowanej sty-
mulacji przedsionków (niezależnie czy metodą przezprzełykową, czy inwa-
zyjną) jest nieobecność migotania przedsionków – w przeciwnej sytuacji
wykonanie badania technicznie nie jest możliwe. W przypadku programo-
wanej stymulacji komór charakter rytmu przedsionków nie ma tak dużego
znaczenia. Ponieważ stymulacja przedsionków/komór jest badaniem trwają-
cym 15-30 min, pozwala ocenić zaburzenia rytmu serca jakościowo, a nie ilo-
ściowo. Ale właśnie dla oceny jakościowej (np. sprowokowanie częstoskur-
czu nad- czy komorowego) badanie to jest niezwykle przydatne. Zarówno
w przypadku utrwalonego migotania przedsionków, jak i oceny ilościowej
zaburzeń rytmu serca, metodą z wyboru pozostaje badanie EKG metodą
Holtera. Z kolei przewaga stymulacji polega na możliwości sprowokowania
arytmii w trakcie badania (a w związku z tym rozstrzygnięcia jej charakte-
ru), na co przy badaniu holterowskim (przy „braku szczęścia”) oczekiwać
można kilka lub kilkanaście dni. Z kolei zaburzenia przewodzenia przed-
sionkowo-komorowego pod postacią napadowych bloków wysokiego rzędu
(II stopnia t. Mobitz 2, III stopnia) przerastają możliwości zarówno stymula-
cji, jak i klasycznego zapisu EKG metodą Holtera ze względu na właśnie na-
padowy charakter arytmii. W takim przypadku przy ustaleniu właściwego
rozpoznania pomaga tzw. event-holter czy wręcz przypominający z wyglądu
stymulator serca rejestrator wszczepiany pod skórę pacjenta, z pamięcią
w postaci „pętli”. Pacjent chodzi z nim do momentu zasłabnięcia/utraty przy-
tomności. Event-holter z kolei jest urządzeniem, które pamięta na bieżąco
kilkanaście-kilkadziesiąt sekund poprzedzających incydent (o jego wystąpie-
niu pacjent informuje, naciskając odpowiedni guzik) najczęściej post factum,
chociaż niektórzy chorzy odczuwają objawy przepowiadające i wtedy uru-
chamiają urządzenie. Metodą, o której należy wspomnieć, jest również EKG
przez telefon (wg standardów PTK traktowany jako odmiana event-holtera).
W trakcie odczuwania dolegliwości pacjent przesyła telefonicznie obraz
elektrokardiograficzny do centrum monitorującego, gdzie jest on oceniany
przez dyżurującego lekarza. Umożliwia to ocenę zarówno ilościową, jak i ja-
kościową dłużej trwających arytmii. Ograniczeniem metody w tym wypadku
jest sprawne nawiązanie łączności przez pacjenta (czas – ważne dla oceny
ilościowej) oraz prawidłowe rozmieszczenie przez chorego elektrod EKG
(istotne dla oceny jakościowej). Obecnie postęp techniczny w konstrukcji
event-holterów (oraz nadajników do wysyłania zapisu EKG przez telefon)
124
umożliwia również automatyczną rejestrację asymptomatycznych zaburzeń
rytmu, co znacznie podnosi możliwość ilościowej oceny zaburzeń rytmu
serca.
W przypadku nieadekwatności chronotropowej niezastąpioną metodą po-
zostaje test wysiłkowy. EKG metodą Holtera zarejestruje co prawda zmien-
ność rytmu w ciągu doby, ale nie ma możliwości obiektywnego (poza słow-
nym opisem pacjenta) pomiaru wykonywanego wówczas wysiłku fizycznego.
Natomiast przy stymulacji, częstość rytmu narzucana jest „z zewnątrz” – moż-
na więc dokładnie określić możliwości przewodzenia przez węzeł przedsion-
kowo-komorowy, ale nie „własną” zdolność do przyspieszania rytmu serca.
Przy ocenie ekstrasystolii nad- i komorowych ponownie musimy rozróżnić
metody lepsze w ocenie ilościowej (rejestratory holterowskie) i jakościowej
– tu ponownie olbrzymia rola stymulacji przezprzełykowej i EPS oraz duża
testu wysiłkowego dla różnicowania niedokrwiennego tła zaburzeń rytmu.
Porównanie poszczególnych metod w diagnostyce zaburzeń rytmu serca
przedstawia tabela 1.
(A) - ocena ilościowa, (B) - ocena jakościowa
SPP - stymulacja przezprzełykowa przedsionków; EPS - inwazyjne badanie
elektrofizjologiczne; TW - test wysiłkowy; WRH - wszczepialny rejestrator holterowski.
Tabela 1: Przydatność różnych metod diagnostycznych dla wykrywania i różnicowania
zaburzeń wytwarzania i przewodzenia bodźca
EKG
spocz.
SPP
EPS
TW
EKG
met.
Holtera
Event-
-holter
EKG
przez
telefon
WRH
Blok p-k
utrwalony
(+++)
(+++)
(+++)
(+++)
(+++)
(+++)
(+++)
(+++)
Blok p-k
napadowy
(-)
(-)
(-)
(-)
(+/-)
(++)
(++)
(+++)
Nieadekwatność
chronotropowa
(-)
(-)
(-)
(+++)
(+/-)
(-)
(-)
(-)
Częstoskurcz
nadkomorowy
A (-)
B (+)
A (-)
B (+++)
A (-)
B (+++)
A (-)
B (++)
A (+++)
B (+)
A (+++)
B (+)
A (+++)
B (+)
A (+++)
B (+)
Częstoskurcz
komorowy
A (-)
B (+)
A (-)
B (++)
A (-)
B (+++)
A (-)
B (++)
A (+++)
B (+)
A (+++)
B (+)
A (++)
B (+)
A (+++)
B (+)
Ekstrasystolia
nad- i komorowa
pojedyncza
A (-)
B (+)
A (+/-)
B (++)
A (+/-)
B (+++)
A (++)
B (++)
A (+++)
B (+)
A (++)
B (+)
A (++)
B (+)
A (+++)
B (+)
125

Zapamiętaj:
1. Badanie elektrofizjologiczne jest badaniem inwazyjnym (bądź „półinwazyj-
nym” w przypadku stymulacji przezprzełykowej), w związku z czym należy
precyzyjnie rozważyć wskazania do wykonania go (ostateczną decyzję po-
dejmuje lekarz bezpośrednio wykonujący badanie).
2. Badanie elektrofizjologiczne może dostarczyć istotnych informacji jako-
ściowych, co do rozpatrywanych arytmii – zarówno nadkomorowych, jak
i komorowych – nie nadaje się jednak do oceny ilościowej tych zjawisk.
3. Inwazyjne badanie elektrofizjologiczne wykonuje się głównie w celu dia-
gnostyki komorowych zaburzeń rytmu.
4. Stymulację przezprzełykową wykonuje się w celu oceny zaburzeń wytwarza-
nia i przewodzenia bodźca.
Warto przeczytać:
D.P. Zipes, W. M. Miles: Assesment of the patient with a cardiac arrhythmias;
Cardiac Electrophysiology: from cell to bedside. D. P. Zipes, J. Jalife
(red.) 3rd edition, WB Saunders, Philadelphia 2000.
P. Brugada, S. Gursoy, J. Brugada et al.: Investigation of palpitations; Lan-
cet 341: 1254, 1993.
H.L. Kennedy: Use of long term (Holter) electrocardiography recordings;
Cardiac Electrophysiology: from cell to bedside. D. P. Zipes, J. Jalife
(red.) 3rd edition, WB Saunders, Philadelphia 2000.
R.L. Page, W. E. Wilkinson, W. K. Clair, et al.: Asymptomatic arrhythmias
in patients with symptomatic paroxysmal atrial fibrillation and paroxysmal
supraventricular tachycardia. Circulation 89: 224, 1994.
G. Fontaine, P. Aouate, F. Fontaliran: Repolarization and the genesis of car-
diac arrhythmias. Circulation 95: 2600, 1997.
D.P. Zipes, J.P. DiMarco, P.C. Gillette et al.: Guidelines for clinical intracar-
diac electrophysiological and catheter ablation procedures: a report of Ameri-
can College of Cardiology/American Heart Assotiation Task Force on Practice
Guidelines develloped in collaboration with the North American Society of Pa-
cing and Electrophysiology. J. Am. Coll. Cardiol. 26: 555, 1995.
J.M. Miller, D.P. Zipes: Management of the Patient with Cardiac Arrhythmias.
Heart Disease, 6th edition, WB Saunders 2001.
126
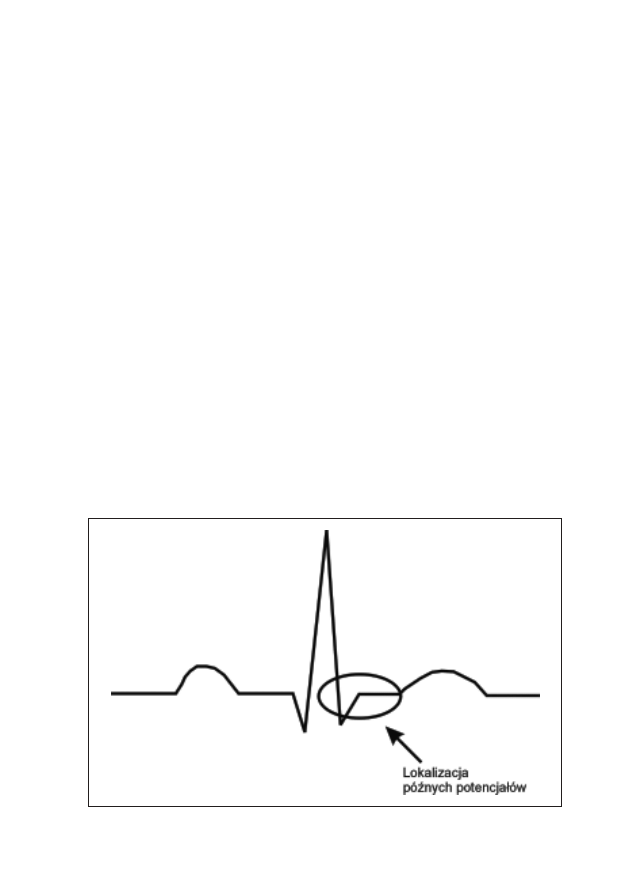
X.
PÓŹNE POTENCJAŁY KOMOROWE
Andrzej Światowiec, Mirosław Dłużniewski
Nagły zgon sercowy jest główną przyczyną wysokiej śmiertelności wśród
pacjentów z chorobą niedokrwienną serca, ale dotyka też często osób, które
nie mają żadnych dolegliwości wieńcowych, nie leczą się też z żadnego in-
nego powodu i uznawane są powszechnie za zdrowe. Spośród chorych, któ-
rzy przeżyli szpitalną fazę zawału serca, w ciągu pierwszego roku umiera
około 15%. Ponad 50% tych zgonów jest konsekwencją komorowych zabu-
rzeń rytmu, czego dowodem są rejestracje EKG metodą Holtera dokonane
podczas śmiertelnych incydentów sercowych.
Do nagłej śmierci sercowej dochodzi najczęściej w mechanizmie migotania
komór powstającego w wyniku wzbudzenia fali pobudzenia nawrotnego (re-
-entry). Do powstania fali re-entry konieczne jest istnienie bloku jednokie-
runkowego oraz zwolnienie przewodzenia, umożliwiające powrót pobudli-
wości komórek znajdujących się przed nadchodzącą falą kolejnego
pobudzenia i dalszą propagację impulsu.
Jak wykazano w badaniach inwazyjnych rejestrujących potencjał mięśnia
sercowego bezpośrednio z wsierdzia w rejonie blizn pozawałowych, w ob-
szarach tych w terminalnej części zespołu QRS spotyka się niskonapięciowe
sygnały będące wykładnikiem zwolnionego przewodzenia. Sygnały te nazwa-
no późnymi potencjałami komorowymi (ventricular late potentials, LP).
Rycina 1: Obszar rejestracji późnych potencjałów komorowych
127

Późne potencjały komorowe związane są z fragmentaryzacją aktywacji ko-
mór i zazwyczaj umiejscowione są w brzeżnej strefie zawału. W tym miejscu
włókna, które uległy martwicy, są wysepkowato poprzetykane włóknami nie-
dokrwionymi oraz ukrwionymi prawidłowo i tworzą strefy niejednorodnej
i opóźnionej aktywacji. LP mogą więc być markerem zagrożenia powstania
fali re-entry, a co za tym idzie groźnych arytmii komorowych.
Późne potencjały komorowe są oscylacjami o amplitudzie od kilku do kil-
kudziesięciu mikrowoltów, a więc niewidocznymi w standardowym elektro-
kardiogramie. Ich identyfikację umożliwia wprowadzona przed ponad dwu-
dziestu laty nieinwazyjna metoda dużego wzmocnienia i wielokrotnego
cyfrowego uśredniania klasycznego zapisu EKG z powierzchni ciała, tak
zwana metoda uśrednionego EKG (uEKG).
Twórcami metody są Berbari, który jako pierwszy opisał ją w roku 1973
oraz Stopczyk i Flowers, którzy w tym samym roku, niezależnie od siebie, za-
stosowali ją do nieinwazyjnej rejestracji potencjału pęczka Hisa. W roku 1981
Simson określił kryteria dla rozpoznawania późnych potencjałów komoro-
wych, a w roku 1991 ustalono obowiązujące aktualnie standardy – warunki
do zapisu i pomiaru sygnału uEKG, dopuszczalne poziomy szumów, rodza-
je filtrów, częstotliwość wzmacniaczy itp.
Od tego czasu w licznych pracach wykazano, że obecność patologicznie
zmienionego uEKG wiąże się z występowaniem groźnych dla życia zaburzeń
rytmu serca, a zwłaszcza napadów utrwalonego częstoskurczu komorowego
oraz migotania komór. Znakomitym potwierdzeniem tego zjawiska może
być fakt stwierdzanej przez niektórych badaczy 100% obecności LP u cho-
rych z rozpoznaną arytmogenną dysplazją prawej komory i towarzyszącymi
nawracającymi częstoskurczami komorowymi, choć ze zrozumiałych wzglę-
dów są to prace analizujące niewiele przypadków.
Aktualnie LP uznawane są za istotny wskaźnik prognostyczny komoro-
wych zaburzeń rytmu, a analiza uEKG jest ważną metodą oceny niestabil-
ności elektrycznej serca, aczkolwiek jej znaczenie budzi nadal kontrowersje.
Powodem rozbieżnych ocen jest, jak się wydaje, brak odpowiednio szerokich
i wiarygodnych badań na dobrze wyselekcjonowanych grupach pacjentów.
Według różnych autorów LP występują u 24-63% chorych po zawale serca,
a wśród pacjentów z pozawałowym tętniakiem lewej komory nawet do 89%.
Z kolei u tych chorych, u których podczas inwazyjnego badania elektrofizjo-
logicznego udaje się wystymulować utrwalony częstoskurcz komorowy, obec-
ność LP stwierdza się w 73-94% przypadków.
Wykazano, że obecność LP nie jest stała podczas ewolucji zawału i może
ulegać zmianie szczególnie w pierwszych 6-8 tygodniach, co wydaje się mieć
128

związek ze zwiększaniem się liczby włókien tkanki łącznej w okresie gojenia
zawału. Tłumaczyłoby to znaczące nieraz różnice w procentowej obecności
LP w pracach wielu autorów. W okresie późniejszym, po ustąpieniu zjawisk
towarzyszących niedokrwieniu, takich jak „zamrożenie” czy też „ogłuszenie”
mięśnia sercowego, LP nabierają charakteru utrwalonego.
O ile badania nad późnymi potencjałami komorowymi u pacjentów z róż-
nymi postaciami choroby niedokrwiennej serca są dość powszechne, to
wśród osób uznawanych za zdrowe nie ma tych badań zbyt wiele. Ze zgro-
madzonego piśmiennictwa wynika, że w populacji osób bez stwierdzanej pa-
tologii w zakresie układu krążenia, późne potencjały komorowe stwierdza
się średnio u 1% (0-7%) badanych.
Wartość LP jako wskaźnika zagrożenia nagłym zgonem wzrasta w powią-
zaniu z innymi uznanymi czynnikami ryzyka nagłej śmierci sercowej, takimi
jak wiek, rozległość zawału, stopień dysfunkcji mięśnia lewej komory, obec-
ność ponad 10 pobudzeń komorowych (VEB) na 1 h w 24-godzinnym bada-
niu EKG metodą Holtera. Oszacowano, iż obecność trzech z wyżej wymie-
nionych czynników ryzyka, tj. LP + LVEF <40% + VEB >10/1h, zwiększa
o ok. 50% prawdopodobieństwo wystąpienia NZS w ciągu 1 roku od wystą-
pienia zawału serca. Stwierdzenie zaś dwóch z wyżej wymienionych czynni-
ków ryzyka (w tym obecność LP) zwiększa takie prawdopodobieństwo
o około 35-37%.
Zgodnie z wynikami badań własnych (co znajduje potwierdzenie w wielu
innych pracach) skuteczna fibrynoliza istotnie redukuje częstość występo-
wania LP po zawale serca.
W zgodzie z ogólnie przyjętymi standardami międzynarodowymi, rejestra-
cję uśrednionego zapisu EKG (uEKG) przeprowadza się stosując układ
elektrod (odprowadzeń) ortogonalnych X, Y, Z wg zmodyfikowanego ukła-
du Franka. Układ ten pozwala na przestrzenną analizę depolaryzacji mię-
śnia sercowego. Analizie podlega wiele, przeważnie kilkaset powtarzalnych
(identycznych) zespołów QRS, z wyłączeniem pobudzeń przedwczesnych,
przewiedzionych z blokiem odnóg pęczka Hisa czy też aberracją. Zastoso-
wanie odpowiednich filtrów pozwala na eliminację artefaktów.
Odprowadzenia poziome „X” umieszcza się w czwartym międzyżebrzu
w linii pachowej po stronie lewej (+X) i po stronie prawej (-X), a odprowa-
dzenia pionowe „Y” w okolicy grzebienia biodrowego lewego (+Y) oraz
w górnej 1/3 części mostka (-Y). Odprowadzenia strzałkowe „Z” znajdują
się w czwartym międzyżebrzu przymostkowo po stronie lewej (+Z) – ana-
logicznie do odprowadzenia V
3
standardowego EKG – oraz prostopadle do
niego z tyłu, w czwartym międzyżebrzu przykręgosłupowo po stronie lewej.
129
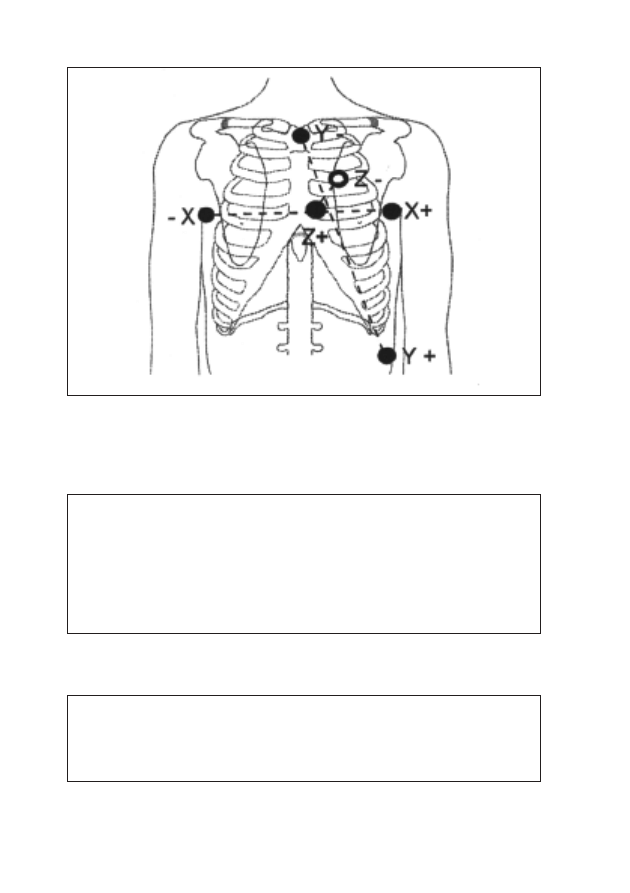
Dla identyfikacji późnych potencjałów komorowych dokonuje się nastę-
pujących pomiarów:
Zgodnie z przyjętymi międzynarodowymi zaleceniami, aby rozpoznać
obecność LP, muszą zostać spełnione następujące kryteria:
Podstawą do rozpoznania obecności LP jest stwierdzenie co najmniej
dwóch z trzech podanych wyżej kryteriów.
• tQRS > 114 ms;
• LAS > 38 ms;
• RMS < 20 µV.
• czas trwania uśrednionego zespołu QRS (total QRS, tQRS [ms]);
• czas trwania końcowej części uśrednionego zespołu QRS
o amplitudzie <40 µV (low-amplitude signal; LAS [ms]);
• pierwiastek kwadratowy woltażu z końcowych 40 ms
uśrednionego zespołu QRS, tzw. wartość skutecznej amplitudy
końcowych 40 ms uEKG (root mean square, RMS [µV]).
Rycina 2: Układ odprowadzeń ortogonalnych wg Franka
130
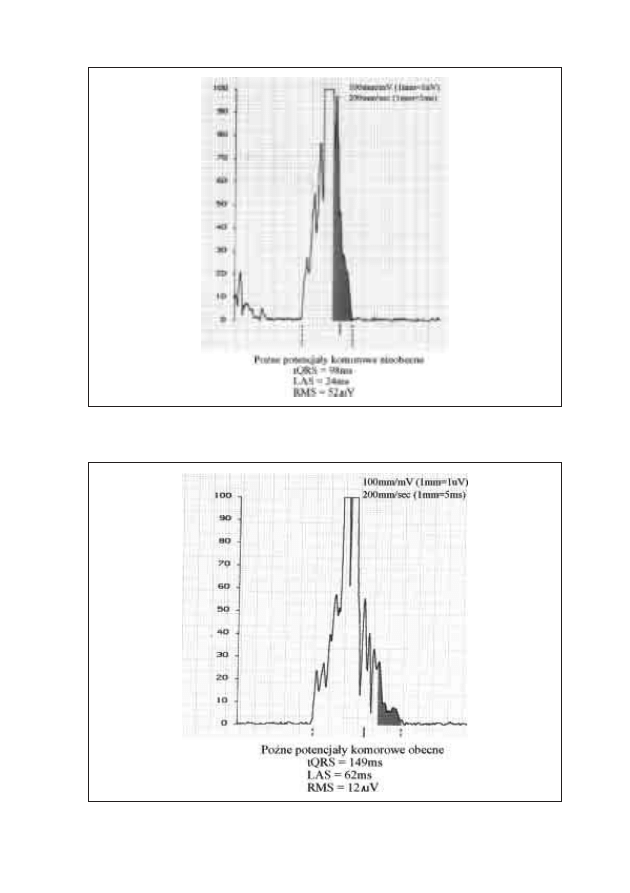
Rycina 4: Późne potencjały komorowe obecne
Rycina 3: Późne potencjały komorowe nieobecne
131

Zapamiętaj:
1. Późne potencjały komorowe są wykładnikiem zwolnionego przewodzenia
w określonych obszarach mięśnia sercowego.
2. Późne potencjały komorowe uznawane są za istotny wskaźnik prognostycz-
ny komorowych zaburzeń rytmu, szczególnie w połączeniu z innymi czynni-
kami ryzyka nagłej śmierci sercowej.
3. Obecność późnych potencjałów komorowych stwierdza się najczęściej u pa-
cjentów z organiczną chorobą serca (przebyty zawał serca, tętniak pozawa-
łowy, kardiomiopatia), ale również u osób uznawanych za kardiologicznie
zdrowe.
4. Identyfikację późnych potencjałów komorowych umożliwia nieinwazyjna
metoda dużego wzmocnienia i cyfrowego uśredniania klasycznego zapisu
EKG – tzw. metoda uśrednionego EKG (uEKG).
Warto przeczytać:
E. Rapaport: Sudden cardiac death. Am J Cardiol 1988.
E. G. Vester: Ventricular late potentials: state of the art and future perspective.
Eur Heart J 1994.
A. Beręsewicz: Komórkowe mechanizmy zaburzeń rytmu serca. Zaburzenia
rytmu serca. M. Dłużniewski (red.), Warszawa 1997.
132

XI.
ANALIZA ZMIENNOŚCI RYTMU SERCA
– NARZĘDZIE BADAŃ NAUKOWYCH,
CZY RZECZYWISTY WSKAŹNIK ZAGROŻENIA?
Ewa Kucharczyk-Petryka, Jarosław Król
Aktywność elektryczna węzła zatokowego podlega wpływom różnych
czynników wewnętrznych i zewnętrznych, wśród których istotną rolę od-
grywa autonomiczny układ nerwowy. Fizjologiczny „rytm zatokowy miaro-
wy” wykazuje zmienność odstępów RR łatwą do zaobserwowania w dłuż-
szych odcinkach zapisu EKG, rzadko stosowanych w rutynowym badaniu
spoczynkowym. Z obserwacji klinicznych wynika, że brak zmienności od-
stępów RR może świadczyć o zagrożeniu nagłym zgonem. Analiza zmien-
ności rytmu serca (heart rate variability, HRV) służy ocenie przewagi współ-
czulnego lub przywspółczulnego układu nerwowego, pomiędzy którymi
trwa stała rywalizacja na poziomie struktur ośrodkowego układu nerwo-
wego, neuronów pozazwojowych, a także w strukturach serca, takich jak
układ przewodzący, mięsień sercowy i naczynia wieńcowe. Dobrze znana
fizjologiczna niemiarowość oddechowa spowodowana jest hamowaniem
neuronów dosercowych nerwu błędnego przez neurony sieci oddechowej
i mechanoreceptory płuc w czasie wdechu z jednoczesną aktywacją neuro-
nów współczulnych. Wpływ autonomicznego układu nerwowego na serce
obserwowany jest także podczas snu, wysiłku, stresu, zmian pozycji ciała,
palenia tytoniu. Wykazano zależność zmienności rytmu od płci, wieku,
a także takich czynników środowiskowych, jak szerokość geograficzna czy
aktywność układu słonecznego.
PATOFIZJOLOGICZNE PODSTAWY ZMIENNOŚCI RYTMU
ZATOKOWEGO
U podłoża oceny HRV leży znajomość anatomii i fizjologii mięśnia ser-
cowego. W skrócie można przyjąć, że unerwienie współczulne (w którym
rolę mediatora pełni noradrenalina) rozmieszczone głównie nasierdzio-
wo, dociera do wszystkich części serca, wzmaga pobudliwość komórek ser-
ca, co oznacza obniżenie progu migotania komór. Ponadto stymulacja be-
ta-receptorów niejednakowo wpływając na potencjał czynnościowy
włókien zdrowych i niedokrwionych, zwiększa dyspersję okresów refrakcji,
co także sprzyja powstaniu zaburzeń rytmu. Stymulacja beta-receptorów
w chorobie niedokrwiennej serca nasila niedokrwienie, zwężając naczynia
wieńcowe podczas wysiłku, a także zwiększa agregację płytek podczas
133

stresu. Działanie przeciwne wykazuje unerwienie przywspółczulne, roz-
mieszczone głównie w warstwie podwsierdziowej, w którym mediatorem
jest acetylocholina. Nerw błędny działa na przedsionki, węzeł zatokowo-
-przedsionkowy, węzeł przedsionkowo-komorowy, bliższą część układu
przewodzącego komór i powoduje zwolnienie czynności serca, hamuje
przewodzenie przedsionkowo-komorowe oraz zmniejsza kurczliwość włó-
kien sercowych. Działanie układu przywspółczulnego jest tym silniejsze,
im większe jest pobudzenie układu współczulnego (na zasadzie „wzmoc-
nionego antagonizmu”).
METODYKA OCENY ZMIENNOŚCI RYTMU SERCA
Klasyczne metody oceny HRV to: analiza czasowa i analiza częstotliwo-
ściowa, a także oparta na teorii chaosu nieliniowa prezentacja rozkładu od-
stępów RR w układzie współrzędnych.
Analiza czasowa polega na ocenie wszystkich odstępów RR pomiędzy pra-
widłowymi zespołami QRS i obliczeniu następujących parametrów:
Analiza częstotliwościowa opiera się na ocenie widma zmienności odstę-
pów RR, utworzonego po dokonaniu pomiarów RR rytmu zatokowego
w milisekundach, utworzeniu tachogramu, jego formatowaniu i przetworze-
niu. Niskie częstotliwości (0,04-0,15 Hz) są charakterystyczne dla układu
współczulnego, a wysokie częstotliwości (0,15-0,4 Hz) dla układu przywspół-
czulnego. Uporządkowanie zapisu pod względem jakościowym i ilościowym
następuje metodą szybkiej transformacji Fouriera lub metodą autoregresji,
w której uwzględnia się fizjologiczne niemiarowości, takie jak oddechowa
(cykliczne zwolnienie i przyspieszenie rytmu serca wynikające z oddychania,
ok. 12-15/min – 0,2-0,25 Hz; cykliczna (odruch z baroreceptorów) zmien-
ność ciśnienia tętniczego, ok. 6/min – 0,1 Hz; cykliczna zmienność oporu na-
czyniowego związanego z termoregulacją i układem renina-angiotensyna-al-
dosteron, ok. 3/min – 0,05 Hz.
• mRR – średnia ze wszystkich odstępów RR;
• SDNN – odchylenie standardowe od średniej RR;
• SDANN – średnia różnica pomiędzy kolejnymi odstępami RR;
• r-MSSD – pierwiastek kwadratowy ze średniej sumy kwadratów
różnic między kolejnymi odstępami RR;
• pNN50 – odsetek kolejnych odstępów różniących się o ponad 50 ms.
134
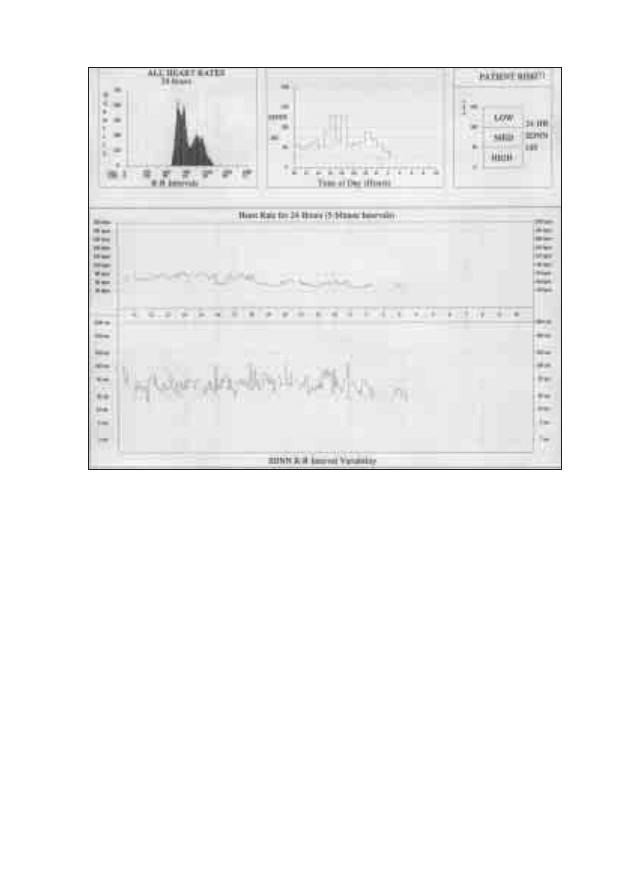
Analiza widmowa pozwala na obliczenie wskaźnika czynności układu auto-
nomicznego mówiącego o stosunku układu współczulnego do przywspółczul-
nego (niskich do wysokich częstotliwości). Gdy wskaźnik ten ma wartość po-
wyżej 1,0, dominuje układ współczulny, co ma świadczyć o zagrożeniu
nagłym zgonem w wybranych grupach chorych.
Nieliniowa dynamika zmian – teoria chaosu: analiza ta pozwala na pre-
zentację graficzną, gdzie odpowiednie punkty odpowiadają kolejnym odstę-
pom RR – na osi X wartość aktualnego czasu RR, a na osi Y wartość po-
przedniego odstępu RR. Gdy rozkład kolejnych punktów jest rozproszony
– zmienność rytmu zatokowego jest duża, gdy skupiony – zmienność HRV
jest niska.
KLINICZNE ZNACZENIE OCENY HRV
Badania wpływu układu nerwowego na układ krążenia mają już ponad 60-le-
tnią historię. Badania wykonywano głównie u chorych z chorobami układu
Rycina 1: Przykładowy wykres analizy częstotliwościowej
135

krążenia – chorobą niedokrwienną i zawałem serca, nadciśnieniem tętni-
czym, migotaniem przedsionków, cukrzycą, ale także u chorych z depresją.
Obniżenie HRV wykazano u chorych z niestabilną dusznicą bolesną, z nie-
wydolnością serca po zawale, którzy nie wykonywali ćwiczeń fizycznych,
u chorych z niewydolnością serca zarówno lewo-, jak i prawokomorową,
w nadciśnieniu tętniczym z przerostem lewej komory i u chorych z depresją.
Naturalną konsekwencją neuropatii cukrzycowej jest także zmniejszenie
HRV. Wzrost HRV obserwowano u chorych skutecznie leczonych fibrynoli-
tycznie w ostrej fazie zawału serca. U chorych z napadowym migotaniem
przedsionków obserwowano początkowy wzrost aktywności adrenergicznej
z następczą dominacją przywspółczulną. Na podstawie wielu wyników ba-
dań można przyjąć, że układ przywspółczulny pełni kardioprotekcyjną rolę,
co wydaje się logiczne, jeśli pamiętamy, że równoważy on wzrost napięcia
układu współczulnego towarzyszącego wielu ostrym i przewlekłym stanom
patologicznym w układzie krążenia. Od lat trwają poszukiwania wskaźnika
zagrożenia nagłym zgonem. Dotychczas związek z występowaniem nagłych
zgonów u chorych po przebytym zawale serca wykazano oceniając m.in. na-
stępujące parametry:
W literaturze obniżona zmienność rytmu zatokowego jest uznana za nieza-
leżny wskaźnik zagrożenia nagłym zgonem u chorych po zawale serca. War-
tość rokownicza tego badania zmienia się jednak w zależności od czasu, któ-
ry upłynął od ostrej fazy zawału, od aktywności fizycznej chorego w czasie
badania, od stosowanych leków, a w końcu od techniki badania. Ten ostatni
czynnik w sposób najistotniejszy wpływa nie tylko na wynik badania, ale
w ogóle na sens jego wykonywania. W ocenie HRV najważniejsze są obli-
czenia, których bez techniki komputerowej wykonać nie można. Obliczenia
wykonywane przez komputer mają wartość tylko wtedy, gdy dane poddawa-
ne opracowaniu są wiarygodne. Ocena HRV powinna opierać się tylko na
odstępach pomiędzy prawidłowymi zespołami QRS. Ocenie poddane mogą
• niska frakcja wyrzutowa (EF <40%) w badaniu
echokardiograficznym;
• nieutrwalone częstoskurcze komorowe w badaniu EKG metodą
Holtera;
• późne potencjały komorowe rejestrowane w badaniu
elektrofizjologicznym;
• upośledzona reakcja z baroreceptorów;
• złożone arytmie komorowe po zakończeniu testu wysiłkowego.
136

być tylko fragmenty zapisu EKG z rytmem zatokowym, bez pobudzeń do-
datkowych, bez obecności bloku odnogi pęczka Hisa czy przedsionkowo-ko-
morowego, bez migotania przedsionków, w końcu bez artefaktów. Źródłem
artefaktów może być sam sposób rejestracji na taśmie magnetycznej, która
nie zapewnia wierności rejestracji wystarczającej do prawidłowej oceny
HRV. Pozostaje zatem rejestracja metodą cyfrową, analiza wybranych frag-
mentów EKG pozbawionych artefaktów, ocena wartości HRV w wybranych
porach dnia i nocy. Aby wyniki uzyskane w różnych pracowniach były po-
równywalne, konieczne jest przyjęcie standardu prezentacji wyników prze-
strzeganego przez producentów sprzętu i oprogramowania. Wartość wyni-
ków oceny HRV drukowanych automatycznie bez możliwości ingerencji
w wynik badania przez opracowującego lekarza pozostaje znikoma.
Stale trwa doskonalenie metod oceny HRV, a wprowadzanie ciągle no-
wych sposobów obliczeń i prezentacji wyników oraz brak standardu powodu-
je, że wciąż aktualne jest stanowisko ekspertów sprzed 10 lat mówiące o tym,
że jest to bardzo interesująca metoda oceny wpływu układu autonomiczne-
go na czynność serca. Istnienie wielu niewyjaśnionych problemów sprawia
jednak, że nie może to być standardowy test kliniczny.
Zapamiętaj!
1. Zaburzenia autonomicznego układu nerwowego mogą powodować groź-
ne dla życia zaburzenia rytmu serca.
2. Obniżone wartości HRV są czynnikiem ryzyka nagłego zgonu u chorych po
zawale serca.
Warto przeczytać:
A. Dąbrowski, B. Dąbrowska, R. Piotrowicz: Elektrokardiografia holterow-
ska. Wydawnictwo Medyczne, Warszawa 1994.
M.G. Kienzle: Parasympathetic Influence in Cardiac Electrophysiology. Car-
diac Arrhythmia. P. J. Podrid, P. R. Kowey (red.) Wiliams & Wilkins, Bal-
timore 1995.
E.M. Antman, E. Braunwald: Acute Myocardial Infarction – Risk Stratifica-
tions; Chapter in Heart disease. 6th edition, E. Braunwald (red.) WB Saun-
ders 2001.
137

XII. DYSPERSJA QT – CZY PRZYDATNA DLA LEKARZA
PRAKTYKA?
Marek Chmielewski, Artur Mamcarz
WSTĘP
Wciąż trwają poszukiwania nowych wyznaczników zagrożenia wystąpie-
niem powikłań wśród pacjentów ze schorzeniami kardiologicznymi. To
stwierdzenie otwiera większość prac poświęconych tematyce dyspersji od-
stępu QT i jednocześnie stanowi próbę określenia miejsca tej metody w dia-
gnostyce kardiologicznej. U podłoża zainteresowania zaburzeniami odstę-
pu QT leżą poszukiwania prostych, tanich i łatwych w ocenie parametrów,
które mogą mieć znaczenie diagnostyczno-prognostyczne w chorobach ukła-
du krążenia. Wiele wskazuje na to, że jednym z takich parametrów może być
ocena czasu trwania i dyspersji odstępu QT w oparciu na standardowym, 12-od-
prowadzeniowym zapisie elektrokardiograficznym.
ZJAWISKO ROZPROSZENIA W ELEKTROFIZJOLOGII SERCA
Terminu „dyspersja” używamy dla opisania różnic czasowych między od-
powiadającymi sobie zjawiskami przebiegającymi w różnych częściach mię-
śnia sercowego. Właściwym określeniem dla „dyspersji” w języku polskim
jest słowo rozproszenie, jednakże termin anglojęzyczny jest powszechnie ak-
ceptowany w zdecydowanej większości prac krajowych. Z tego względu w ni-
niejszej pracy przyjęto używać terminu „dyspersja”. Z definicji możemy mó-
wić o dyspersji okresu depolaryzacji (nierównoczesna aktywacja miocytów)
i dyspersji okresu repolaryzacji. Zjawisko dyspersji może dotyczyć pojedyn-
czych miocytów oraz dużych obszarów mięśnia sercowego – przedsionków
lub komór.
Dyspersja zjawisk elektrycznych zachodzących w wolnym mięśniu komór
jest zjawiskiem fizjologicznym. Wynika to z nierównoczesnej aktywacji, a na-
stępnie repolaryzacji poszczególnych miocytów. Dobrym tego przykładem
jest dyspersja okresu depolaryzacji, która w ujęciu elektrokardiograficznym
odpowiada czasowi trwania zespołu QRS. Czas trwania zespołu QRS, czyli
inaczej dyspersja okresu depolaryzacji nie przekracza w warunkach fizjolo-
gicznych 100 ms. Nawet obecność układu włókien His-Purkinje oraz skróce-
nie czasu trwania potencjału czynnościowego w obszarach miokardium, które
są aktywowane później ograniczają jedynie dyspersję okresu depolaryzacji.
Jest więc rzeczą oczywistą, że dyspersja repolaryzacji miocytów będzie zjawi-
skiem stałym, zależnym od dyspersji depolaryzacji i w pewnym zakresie nor-
138

my wyrazem fizjologii. Z punktu widzenia patogenezy arytmii komorowej
równoczasowość repolaryzacji ma zdecydowanie większe znaczenie niż rów-
noczasowość depolaryzacji. Z tego powodu w warunkach fizjologicznych
funkcjonują mechanizmy synchronizujące repolaryzację miocytów.
Związek pomiędzy dyspersją czasów repolaryzacji i arytmią został wykaza-
ny już w latach 60. W latach 70. obserwowano zjawisko indukcji fali re-entry
pojedynczym, zewnętrznym impulsem elektrycznym w izolowanych włók-
nach mięśni przedsionków, korelujące z rosnącą dyspersją repolaryzacji po-
szczególnych włókien. Kilkanaście lat później, używając w trakcie badań na
bijącym sercu psa techniki jednofazowego potencjału czynnościowego, wyka-
zano, że dramatyczny wzrost dyspersji repolaryzacji (z 13 ms do 111 ms) pod
wpływem miejscowego oziębienia, toruje arytmię komorową wywołaną poje-
dynczym, zewnętrznym, przedwczesnym impulsem komorowym. Badania te
w sposób czytelny udokumentowały związek nierównoczesnej repolaryzacji
poszczególnych miocytów z powstawaniem arytmii komorowej i stały się im-
pulsem do poszukiwania klinicznych sposobów oceny tego zjawiska.
ODSTĘP QT
Klinicznej oceny zjawiska repolaryzacji można dokonywać na podstawie
zapisu elektrokardiograficznego (EKG). W standardowym powierzchnio-
wym zapisie EKG okresowi repolaryzacji mięśni komór odpowiada odstęp
QT. Odstęp QT obejmuje okres od początku depolaryzacji mięśnia serco-
wego (zespół QRS) do końca repolaryzacji włókien mięśniowych (koniec za-
łamka T). Czas trwania odstępu QT zmienia się w zależności od częstości
rytmu serca. Wraz z przyśpieszeniem częstości rytmu serca czas trwania od-
stępu QT ulega skróceniu. Istnieje wiele sposobów korekcji częstotliwościo-
wej odstępu QT, z których najpowszechniej stosowanym jest wzór podany
w 1920 roku przez Bazetta. Wzór ten znajduje zastosowanie w zakresie czę-
stości rytmu serca od 50 do 120/min.
Wzór korekcji częstotliwościowej QT wg Bazetta
QTc = QT / RR
1/2
= QT / (1/HR)
1/2
QTc – skorygowany odstęp QT [ms]
QT – zmierzony odstęp QT [ms]
RR – odstęp RR [s]
HR – częstość rytmu serca [1/s]
139

Skorygowany odstęp QT (QTc) umożliwia obiektywne porównywanie wyni-
ków różnych pacjentów, niezależnie od częstości rytmu serca. Czas trwania od-
stępu QT podawany jest w milisekundach (ms). Prawidłowy czas trwania sko-
rygowanego odstępu QT wg Dąbrowskich mieści się w granicach 350-440 ms
(średnio 380 ms).
Na czas trwania odstępu QT oprócz częstości rytmu serca wpływają inne
czynniki. Z punktu widzenia patologii znaczenie mają czynniki wydłużające
QTc ponad przyjętą granicę normy, czyli 440 ms, choć wg Braunwalda do-
puszczalne jest występowanie QTc do 460 ms u mężczyzn i 470 ms u kobiet.
Wydłużenie odstępu QTc ma jednoznaczną wartość diagnostyczną w roz-
poznawaniu zespołu wydłużonego QT. Zespół wydłużonego QT może mieć
charakter wrodzony lub nabyty. Nabyte przyczyny zespołu wydłużonego QT
to przede wszystkim zaburzenia jonowe. Typowym przykładem jest hipokal-
cemia, która wydłuża fazę drugą potencjału czynnościowego i w tym mecha-
nizmie wydłuża czas trwania odstępu QTc. Także w hipokaliemii dochodzi
do wydłużenia QTc, co podobnie jak w hipomagnezemii wynika z pojawienia
się fali U w końcowej części załamka T.
Wydłużenie odstępu QTc, zarówno wrodzone, jak i nabyte, ma istotne zna-
czenie kliniczne. Wiadomo, że w zespole wydłużonego QT prawdopodobień-
stwo wystąpienia zagrażającej życiu arytmii komorowej (częstoskurcze komo-
rowe typu torsade de pointes) rośnie wraz z wydłużeniem czasu trwania QTc.
Wydłużenie QTc jest zjawiskiem występującym także w strukturalnym
uszkodzeniu mięśnia, czego typowym przykładem jest pozawałowe uszko-
dzenie mięśnia sercowego. Także w zaburzeniach czynnościowych, takich jak
niedokrwienie miokardium odstęp QTc ulega wydłużeniu.
DYSPERSJA QT
Pojęcie rozproszenia, czyli dyspersji QT, oznacza różnicę pomiędzy naj-
dłuższym i najkrótszym odstępem QT spośród poddających się analizie od-
prowadzeń 12-odprowadzeniowego zapisu EKG (QTd = QTmaks. – QT-
min). W przypadku dyspersji QT dokładność analizy zależy od precyzji,
z jaką dokonywane są pomiary poszczególnych odstępów QT. Niestety, wia-
rygodność pomiaru QT, zwłaszcza we wszystkich odprowadzeniach standar-
dowego zapisu EKG jest niewystarczająca. Wynika to głównie z trudności
precyzyjnego wyznaczenia końca załamka T. Niezależnie czy pomiary są do-
konywane przez doświadczonego obserwatora, czy też system komputerowy,
morfologia końcowej części załamka T silnie wypływa na wartość zmierzone-
go odstępu QT. Z tego powodu w części odprowadzeń obiektywny pomiar
140

QT może być obciążony dużym błędem. Przyjmuje się, że najlepszym spo-
sobem określenia dyspersji QT jest analiza wszystkich 12 odprowadzeń spo-
czynkowego zapisu EKG. Jeśli w części odprowadzeń nie można precyzyj-
nie wyznaczyć końca załamka T, to powinny być one wykluczone z analizy,
a minimalna ilość odprowadzeń potrzebnych do określenia dyspersji QT nie
powinna być mniejsza niż 8. Ustalono również, że warunkiem właściwej oce-
ny dyspersji QT jest jednoczasowa rejestracja wszystkich 12 odprowadzeń
zapisu EKG. Dzięki temu możliwa jest ocena odstępu QT w tej samej ewo-
lucji rytmu zatokowego. Warunek ten może być spełniony w 3-6-kanałowej
rejestracji trybu „auto” w cyfrowych aparatach elektrokardiograficznych.
Korekcja częstotliwościowa odnosi się także do dyspersji QT (QTcd).
Oznacza różnicę pomiędzy najdłuższym i najkrótszym skorygowanym odstę-
pem QT (QTcd = QTcmaks. – QTcmin), choć związek pomiędzy dyspersją
a częstością rytmu serca nie jest do końca poznany. Wydaje się, że dyspersja
QT mierzona w oparciu na 12-odprowadzeniowym EKG nie podlega zmie-
niającej się częstości rytmu serca w tym samym stopniu, co odstęp QT. War-
to jednak zauważyć, że największe prace dotyczące dyspersji QT, oceniające
wartość rokowniczą tego parametru wykorzystują skorygowaną częstotliwo-
ściowo wartość QTd (QTcd). Jak wspominano wcześniej, dyspresja okresu
repolaryzacji jest w pewnym zakresie wartości zjawiskiem fizjologicznym.
Jednym z tego powodów jest sama metodyka rejestracji 12-odprowadzenio-
wego EKG. Czas trwania odstępu QT w standardowym zapisie EKG zmie-
nia się w zależności od odprowadzenia. Jest najdłuższy w 2 i 3 odprowadze-
niu przedsercowym (V
2
i V
3
). Z tego względu uważa się, że u osób zdrowych
dyspersja QT może sięgać 50 ms. Wg standardów Sekcji Kardiologii Niein-
wazyjnej Polskiego Towarzystwa Kardiologicznego dyspersja QT u osób
zdrowych wynosi zwykle 20-50 ms. Wartości, które mogą świadczyć o patolo-
gii przekraczają 100 ms. Z przeglądu literatury klinicznej wynika, że dysper-
sja QT u osób zdrowych mieści się w przedziale od 30 do 60 ms. W większości
prac stwierdzano duże różnice wartości dyspersji QT oraz innych wskaźni-
ków dyspersji okresu repolaryzacji pomiędzy osobami zdrowymi i pacjenta-
mi z różnymi schorzeniami kardiologicznymi.
Pomiar odstępu QT napotyka wiele trudności, których głównym źródłem
są zmienna morfologia załamka T, jego niska amplituda, zlewanie się załam-
ka T z falą U i szybkie rytmy utrudniające precyzyjny rozdział załamka T i P.
W świetle obecnych badań uważa się, że fala U powinna być wykluczana
z analizy dyspersji QT. Istnieją dwie metody pomiaru dyspersji QT – ręczna
i automatyczna. Uznaje się, że najwłaściwsze dla analizy ręcznej dyspersji
QT są elektrokardiogramy rejestrowane przy przesuwie taśmy 50 mm/s
z jednoczasową rejestracją wszystkich 12 odprowadzeń. W badaniach po-
141
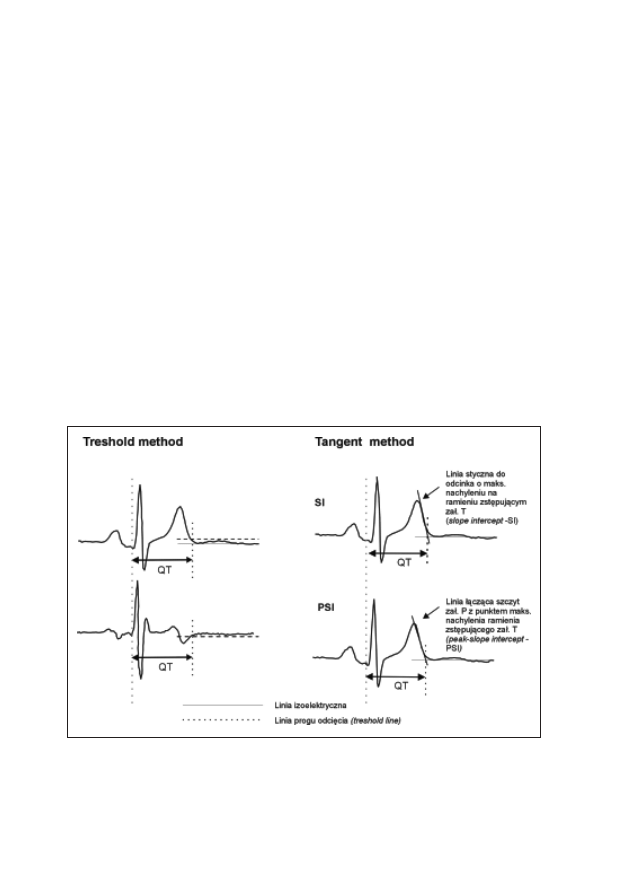
równujących pomiary QTd dokonywane ręcznie przez niezależnych obser-
watorów uzyskiwano rozbieżności w zakresie do 30%. W przypadku powta-
rzania pomiarów przez tego samego obserwatora różnica pomiaru QTd jest
niższa i wynosi od 13% do 21%.
Alternatywnym dla ręcznego pomiaru odstępu i dyspersji QT jest pomiar
automatyczny. Opiera się on na komputerowej analizie zapisu EKG wg
przyjętych kryteriów. Powtarzalność automatycznego oznaczania końca za-
łamka T jest znacznie mniejsza niż rozpoznawania początku zespołu QRS.
W praktyce wykorzystuje się dwie podstawowe metody określania końca za-
łamka T. Pierwsza z nich (tangent method) określa koniec załamka T jako
punkt przecięcia osi stycznej do ramienia zstępującego załamka T z linią izo-
elektryczną, druga (treshold method) wyznacza koniec załamka T jako punkt
na ramieniu zstępującym załamka T, który jest poniżej założonego progu od-
cięcia (ryc. 1). Odmiany tych metod dotyczą sposobu określania stycznej do
ramienia zstępującego załamka T, wyznaczania linii izoelektrycznej, ustala-
nia progu odcięcia lub sposobu przetwarzania sygnału. Porównania różnych
algorytmów automatycznych z ręcznymi pomiarami QT wypadają na nieko-
rzyść pomiarów automatycznych.
W badaniach porównawczych pomiar ręczny odstępu QT obarczony jest
mniejszym błędem (średnio 20±12 ms) niż pomiar automatyczny (średnio
30±15 ms). Wyniki uzyskiwanych wartości dyspersji QT różnią się jeszcze
Rycina 1: Przykładowy wykres analizy częstotliwościowej
142

bardziej niż w przypadku poszczególnych pomiarów QT. Należy pamiętać,
że płeć pacjenta wpływa na wartość dyspersji QT. Wykazano, że u kobiet jest
ona niższa o około 5 ms. Dane dotyczące wpływu wieku na wartości dyspersji
QT są sprzeczne, choć przeważa pogląd, że w grupie osób zdrowych parametr
ten nie wpływa w sposób istotny na średnie wartości uzyskiwanych wyników.
Problematyka klinicznej oceny dyspersji odstępu QT została upowszechniona
na początku lat 90. przez grupę badaczy kierowaną przez Campbella. Zwrócili
oni uwagę na związek pomiędzy zwiększoną dyspersją QT a występowaniem ko-
morowych zaburzeń rytmu serca u pacjentów z zespołem długiego QT i wysunę-
li przypuszczenie, że zwiększona dyspersja QT jest wyrazem odcinkowej nieho-
mogenności w repolaryzacji mięśnia sercowego, co może stanowić substrat dla
powstawania arytmii komorowej. Obserwacje te zapoczątkowały erę badań oce-
niających przydatność dyspersji QT w diagnostyce i przewidywaniu wystąpienia
arytmii komorowej w różnych stanach klinicznych. Obszary zainteresowania
związane z dyspersją QT (lub też ogólnie z dyspersją okresu repolaryzacji) w ba-
daniach klinicznych można podzielić na zagadnienia:
Dyspersja QT w zespole wydłużonego QT
W przeglądzie badań klinicznych dokonanym przez Malika mediana śred-
niej dyspersji QT ze wszystkich analizowanych badań wyniosła 103 ms. W ol-
• metodologiczne:
określenie metod pomiaru,
określenie zakresu norm w różnych stanach klinicznych;
• poszukiwania przyczyn zwiększonej dyspersji QT:
dysfunkcja elektrofizjologiczna (zespół wydłużonego QT),
dysfunkcja anatomiczna (uszkodzenie struktury mięśnia
sercowego: blizna pozawałowa, przerost mięśnia
sercowego),
dysfunkcja czynnościowa (niedokrwienie, reperfuzja,
zaburzenia metaboliczne),
dysfunkcja autoregulacyjna (zaburzenia funkcji
autonomicznego układu nerwowego);
• poszukiwania wartości klinicznej dyspersji QT:
wartość diagnostyczna (arytmia komorowa, ocena
skuteczności leczenia antyarytmicznego),
wartość prognostyczna (groźna arytmia komorowa, nagły
zgon sercowy, zgony ogółem).
143

brzymiej większości badań dyspersja QT była znacząco wyższa w grupach
pacjentów z zespołem wydłużonego QT niż w grupach kontrolnych. W chwi-
li obecnej nie ma wątpliwości, co do wartości diagnostycznej dyspersji QT
w zespole wydłużonego QT, a parametr ten wykorzystywany jest praktycz-
nie do monitorowania skuteczności leczenia antyarytmicznego. Wykazano,
że skuteczne leczenie lekami beta-adrenolitycznymi zmniejsza w sposób
istotny dyspersję QT w grupie pacjentów z zespołem wydłużonego QT (75 ms
vs 137 ms w grupie pacjentów bez efektu leczenia beta-adrenolitykiem).
Dyspersja QT w chorobie niedokrwiennej serca
Istnieją dowody na to, że zaburzenia QT (wydłużenie QTc i zwiększenie
QTcd) mogą zwiększać ryzyko wystąpienia groźnej arytmii komorowej u pa-
cjentów po przebytym zawale mięśnia sercowego. Zwiększona międzyodpro-
wadzeniowa różnica QT u pacjentów z chorobą wieńcową była obserwowana
jeszcze przed „erą” dyspersji QT. Potencjalny związek zwiększonej dysper-
sji QT z arytmią komorową postulowany w pierwszych publikacjach doty-
czących QTd stał się powodem badań w grupie pacjentów z chorobą wieńco-
wą. Zwiększenie dyspersji QT obserwowano w wielu badaniach pacjentów
z ostrym zawałem mięśnia sercowego, chociaż prezentowane wartości róż-
nią się znacznie w zakresie od 40 ms do 160 ms. Średnie wartości dyspersji
QT w niewyselekcjonowanej grupie pacjentów z ostrym zawałem serca wy-
noszą około 70 ms. W większości badań stwierdzano wyższe wartości QTd,
w ostrym zawale ściany przedniej w porównaniu z ostrym zawałem o innej
lokalizacji, choć dane na ten temat nie są jednoznaczne. Obserwowano też
korelację zwiększonej dyspersji QT z wielkością zawału mierzoną za pomo-
cą wielkości frakcji wyrzutowej lewej komory.
W wielu badaniach wykazano, że rewaskularyzacja w wyniku trombolizy
lub angioplastyki wieńcowej znacząco wpływa na zmniejszenie dyspersji QT.
Przekonujące dowody na wpływ skutecznej reperfuzji w OZS na dyspersję
QT przedstawiono w badaniach TEAM-2 i TEAM-3. Uzyskanie przepływu
TIMI
≥ 2 w wyniku skutecznej reperfuzji wiązało się z istotnym zmniejsze-
niem dyspersji QT. Obserwacje dotyczące zwiększonej dyspersji QT dotyczą
również pacjentów w odległym okresie zawału mięśnia sercowego, jak rów-
nież osób z chorobą wieńcową bez zawału serca. Zarówno pozawałowe
uszkodzenie (blizna), jak i odwracalne za pomocą rewaskularyzacji niedo-
krwienie wpływają na zwiększenie dyspersji QT, ale wydaje się, że w odmien-
nym mechanizmie. Zainteresowanie dyspersją QT w różnych postaciach
choroby wieńcowej związane jest z próbą praktycznego zastosowania tego
parametru w diagnostyce groźnej dla życia arytmii komorowej. W większości
badań dotyczących arytmii komorowej związanej z chorobą wieńcową
144

stwierdzano istotnie wyższe wartości dyspersji QT w podgrupach pacjentów
z groźnymi komorowymi zaburzeniami rytmu. Wprawdzie uzyskiwane w po-
szczególnych badaniach różnice w stosunku do osób bez arytmii są istotne
statystycznie, ale jedynie w nielicznych przypadkach wartość dyspersji QT
w grupie osób z arytmią przekracza 100 ms. Istotną wydaje się obserwacja,
że najwyższe wartości dyspersji QT występują u osób szczególnie zagrożo-
nych, ze stwierdzanymi nieutrwalonymi monomorficznymi częstoskurczami
komorowymi i częstoskurczami wielokształtnymi typu torsade de pointes
(TdP). W badaniach klinicznych analizujących związek występowania groź-
nej arytmii komorowej ze zwiększoną wartością dyspersji QT, fakt występo-
wania złożonej arytmii komorowej w większym stopniu determinuje wartość
dyspersji QT niż podłoże morfologiczno-czynnościowe, które prowadzi do
jej wzrostu. Szczególnie dobrze jest to widoczne w badaniach porównują-
cych różne grupy pacjentów – osoby po zawale serca, z kardiomiopatią prze-
rostową i osoby z grupy kontrolnej, gdzie najwyższe wartości dyspersji QT
występowały wśród osób z groźną arytmią komorową, niezależnie od przy-
czyny wywołującej komorowe zaburzenia rytmu. Wstępne obserwacje klinicz-
ne z badań małych wyselekcjonowanych grup pacjentów, dotyczące warto-
ści prognostycznej dyspersji QT w przewidywaniu incydentów arytmicznych
nie znajdują pełnego potwierdzenia w prospektywnych, randomizowanych
badaniach klinicznych zaprojektowanych w tym celu. Wartość rokownicza
dyspersji QT istotnie rośnie, jeśli jej wartości są wybitnie zwiększone i prze-
kraczają 100 ms. Wydaję się, że sam fakt istotnego statystycznie zwiększenia
średniej wartości dyspersji QT ma mniejsze znaczenie kliniczne niż stwier-
dzane wybitnie podwyższone (przekraczające 100 ms) wartości QTd.
Dyspersja QT w grupie pacjentów z cukrzycą
Cukrzyca typu 2 jest niezależnym czynnikiem wystąpienia i progresji cho-
roby niedokrwiennej serca. Zaburzenia okresu repolaryzacji wśród pacjen-
tów z cukrzycą stanowią przedmiot wielu prac klinicznych. Koncentrują się
one na związku występowania zaburzeń skorygowanego odstępu QT i dys-
persji QT z potencjalnymi czynnikami patogenetycznymi obecnymi w cu-
krzycy oraz ich wartością prognostyczną w cukrzycy. Cukrzyca zwiększa czas
trwania skorygowanego odstępu QT i w sposób istotny wpływa na dyspersję
QT. Warto jednak zauważyć, że choć wartości średnie pomiarów dyspersji
QT w cukrzycy są większe w porównaniu z grupami kontrolnymi, to pozo-
stają w zakresie wartości prawidłowych (35 ms vs 25 ms w grupie kontrolnej
bez cukrzycy). Wzrost wartości średnich dyspersji QT powoduje jednak, że
powiększa się liczba osób ze znacznie zwiększoną dyspersją QT. Badania osób
z cukrzycą wskazują na istotny związek zaburzeń metabolicznych i autore-
gulacyjnych ze zwiększoną dyspersją QT i QTc. Obserwacje dotyczące związ-
145

ku dyspersji QT z neuropatią autonomicznego układu nerwowego w prze-
biegu cukrzycy są rozbieżne. Wydaje się, że neuropatia autonomiczna w cu-
krzycy silniej koreluje z wydłużeniem odstępu QT (QTc) niż ze wzrostem
dyspersji QT. Badano również wpływ stopnia wyrównania glikemii, w tym
kontrolowanej hipoglikemii na parametry QT. Hipoglikemia zwiększa ryzy-
ko wystąpienia arytmii i w sposób jednoznaczny wpływa na wydłużenie od-
stępu QT i zwiększenie dyspersji QT. W niektórych badaniach wykazano, że
cukrzyca jest niezależnym od wieku, czasu trwania choroby i obecności ma-
kroangiopatii czynnikiem zwiększającym dyspersję QT. Dowody na związek
zwiększonej dyspersji QT z chorobą niedokrwienną serca w przebiegu cu-
krzycy są klarowne, choć wartość prognostyczna tego parametru jest mniej-
sza niż wydłużonego QTc. Wydłużenie odstępu QTc jest niezależnym czynni-
kiem ryzyka zgonu u pacjentów z cukrzycą typu 2.
Dyspersja QT – podsumowanie
Uwzględniając wątpliwości płynące z opublikowanych badań klinicznych,
grupa ekspertów Polskiego Towarzystwa Kardiologicznego sformułowała
stanowisko dotyczące klinicznej użyteczności dyspersji QT.
Zapamiętaj!
Według standardów Sekcji Elektrokardiologii Nieinwazyjnej PTK dyspersję
QT większą niż 100 ms można uważać za wskaźnik:
1. Zwiększonego zagrożenia wystąpieniem groźnej dla życia arytmii komoro-
wej i nagłego zgonu u chorych po zawale serca oraz u osób z wrodzonym
zespołem długiego QT.
2. Nieskuteczności leczenia trombolitycznego w ostrej fazie zawału serca.
3. Nieskuteczności profilaktycznego leczenia beta-adrenolitykami wrodzonego
zespołu długiego QT.
4. Zagrożenia częstoskurczem torsade de pointes u chorych leczonych prepa-
ratami antyarytmicznymi z grupy IA i III.
Warto przeczytać:
R. Piotrowicz i wsp.: Standardy postępowania dotyczące wybranych zagad-
nień elektrokardiologii nieinwazyjnej. ESS 1998, 5, (supl. II): 43-47.
M. Malik, V. Batchvarov: QT Dispersion. Futura Publishing Company 2000.
146

XIII. ZASTOSOWANIE TESTU POCHYLENIOWEGO
W DIAGNOSTYCE ZABURZEŃ RYTMU SERCA
Katarzyna Cybulska, Liliana Kostana, Mirosław Dłużniewski
Test pochyleniowy, o którym napisano szerzej w części dotyczącej diagno-
styki kardiologicznej, nie jest klasycznym badaniem służącym rozpoznawaniu
zaburzeń rytmu serca. Nie mniej jednak, jego wykonanie może być przydat-
ne dla wykrycia zaburzeń rymu i przewodzenia zależnych od wzmożonego
napięcia układu przywspółczulnego, takich jak napadowy blok przedsionko-
wo-komorowy lub zaburzenia czynności węzła zatokowego.
Wykonanie testu pochyleniowego jest szczególnie wskazane u chorych
z nawracającymi zasłabnięciami lub utratami przytomności występującymi
przy zmianie pozycji na stojącą albo podczas dłuższej pionizacji. W takich
przypadkach zaburzeń rytmu często nie można wykryć z pomocą badania
holterowskiego i dopiero wykonanie swoistego badania prowokacyjnego, od-
twarzającego warunki zbliżone do sytuacji, w której wystąpiło omdlenie, mo-
że ujawnić jego mechanizm.
WSKAZANIA DO TESTU POCHYLENIOWEGO
Przydatność testu pochyleniowego w diagnostyce zaburzeń rytmu i prze-
wodzenia ilustrują przedstawione przypadki kliniczne.
Przypadek 1: Pacjentka Ł.G. lat 72
Wywiad:
Nadciśnienie tętnicze rozpoznawane w przeszłości, od kilku lat prawidło-
we wartości ciśnienia bez leków hipotensyjnych. Bez typowych bólów wień-
cowych. Bez objawów niewydolności serca.
• wykonywanie go jako jednego z pierwszych badań diagnostycznych
w przypadkach nawracających omdleń u osób bez organicznej
choroby serca;
• wykonywanie go po wykluczeniu innych sercowych przyczyn
zasłabnięć w przypadkach nawracających omdleń u osób
z rozpoznaną chorobą serca;
• wykonanie go w przypadku jednorazowego, niewyjaśnionego
omdlenia u osób z grupy dużego ryzyka (szczególne zawody,
przebyty ciężki uraz związany z omdleniem).
147

Zasłabnięcia:
Od wielu lat, zazwyczaj 1-2 razy w roku, zwykle w pozycji stojącej, prze-
biegające z utratami przytomności, dwukrotnie uraz głowy.
Badania dodatkowe:
ECHO serca:
Przerost mięśnia 1,2 cm. Mała niedomykalność zastawki mitralnej. Bez in-
nych odchyleń od normy.
Badanie EKG met. Holtera:
Rytm zatokowy 45-160/min, średnio 90/min. Bez komorowych zaburzeń
rytmu. Nadkomorowe zaburzenia rytmu 26/dobę. Jedna wstawka częstoskur-
czu nadkomorowego o częstości 160/min (bezobjawowa). Bez migotania
przedsionków. Bez pauz.
Stymulacja przezprzełykowa przedsionków:
Wynik prawidłowy.
Test wysiłkowy:
6 METs (95% HR maks.). Badanie przerwane z powodu zmęczenia. Bez bó-
lu w klatce piersiowej. Pojedyncze pobudzenia dodatkowe komorowe w czasie
wysiłku. Bez zmian ST typowych dla niedokrwienia. Wynik testu ujemny.
Badanie neurologiczne:
Bez odchyleń od normy.
Badanie EEG:
Wynik prawidłowy.
Tomografia komputerowa głowy:
Wynik prawidłowy.
Badanie przepływów szyjnych i kręgowych metodą Dopplera:
Wynik prawidłowy.
Badanie rtg kręgosłupa szyjnego:
Miernie nasilone zmiany zwyrodnieniowe.
Test pochyleniowy:
Faza bierna: test ujemny.
Test prowokacyjny z nitrogliceryną: w 3 minucie po podaniu nitrogliceryny
– utrata przytomności z drgawkami. W EKG – zahamowanie zatokowe trwa-
jące 16 sekund (ryc. 1). Powrót rytmu zatokowego i ustąpienie objawów kli-
nicznych po przywróceniu pozycji leżącej.
148
Rozpoznanie:
Omdlenie wazowagalne. Typ kardiodepresyjny – 2B.
Leczenie:
Beta-adrenolityk (Metoprolol 2 x 25 mg) – dobry efekt kliniczny.
Komentarz:
Jest to przypadek starszej pacjentki z wieloletnim wywiadem zasłabnięć
o ciężkim przebiegu. Ze względu na wiek pacjentki i wywiad nadciśnienia
tętniczego prawdopodobne wydawało się istnienie u niej organicznej choro-
by serca, czego jednak nie potwierdziła przeprowadzona szczegółowa dia-
gnostyka kardiologiczna. Wykluczono także neurologiczne przyczyny zasłab-
nięć, które u starszej chorej także były bardzo prawdopodobne. Dopiero
wykonany test pochyleniowy pozwolił na ustalenie mechanizmu omdleń. Za-
stosowano klasyczne leczenie farmakologiczne proponowane w przypadkach
zespołu wazowagalnego z dobrym efektem.
Przypadek 2: Pacjent P.T. lat 14
Wywiad:
Pacjent dotychczas zdrowy.
Zasłabnięcia:
Od roku, zwykle w pozycji stojącej, poprzedzone bólem i zawrotami głowy.
Dotychczas dwa epizody zasłabnięć, za każdym razem przebiegających z utra-
tą przytomności. Wywiad rodzinny występowania zasłabnięć wazowagalnych
u starszego brata.
Badania dodatkowe:
ECHO serca:
Wynik prawidłowy.
Rycina 1: Chora Ł.G. - rejestracja zapisu EKG podczas omdlenia. Zwolnienie rytmu
zatokowego, następnie zahamowanie zatokowe trwające 16 sekund. Powrót rymu
zatokowego w pozycji leżącej
149
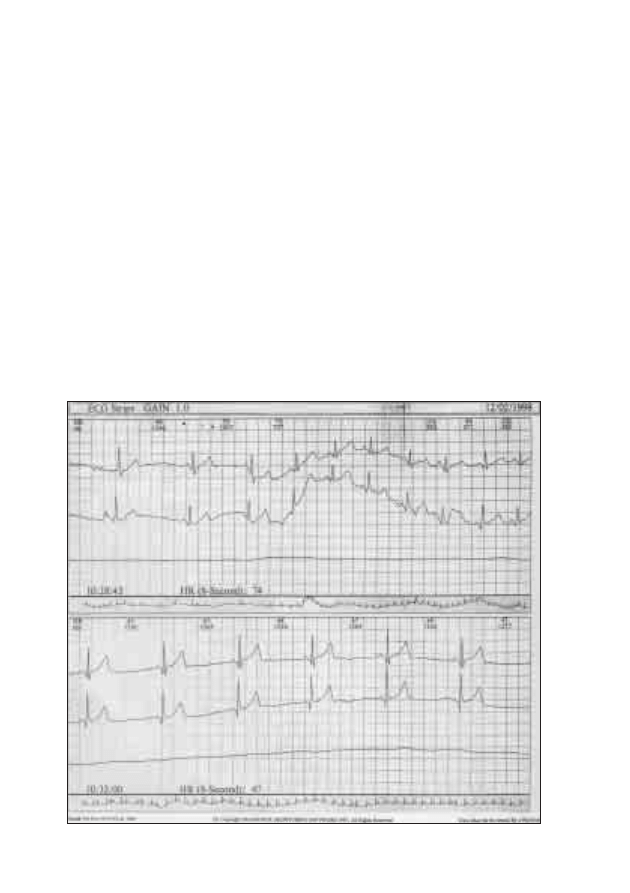
150
Badanie EKG met. Holtera:
Rytm zatokowy 46-164/min, średnio 60/min. Bez komorowych zaburzeń
rytmu. Nadkomorowe zaburzenia rytmu 782/dobę. Bez wstawek częstoskur-
czu komorowego, migotania przedsionków. Bez pauz.
Badanie neurologiczne:
Bez odchyleń od normy.
Badanie EEG:
Wynik prawidłowy.
Test pochyleniowy:
W 16 minucie badania w warunkach podstawowych utrata przytomności,
drgawki, spadek ciśnienia do wartości nieoznaczalnych. W zapisie EKG (ryc.
2) stopniowe zwalnianie się rytmu zatokowego, zastępczy rytm węzłowy 25/min
(2 pobudzenia) i zahamowanie zatokowe trwające ok. 6 sekund, ponownie po-
jedyncze pobudzenia zastępcze węzłowe. Szybki powrót rytmu zatokowego,
normalizacja ciśnienia tętniczego i odzyskanie świadomości w pozycji leżącej.
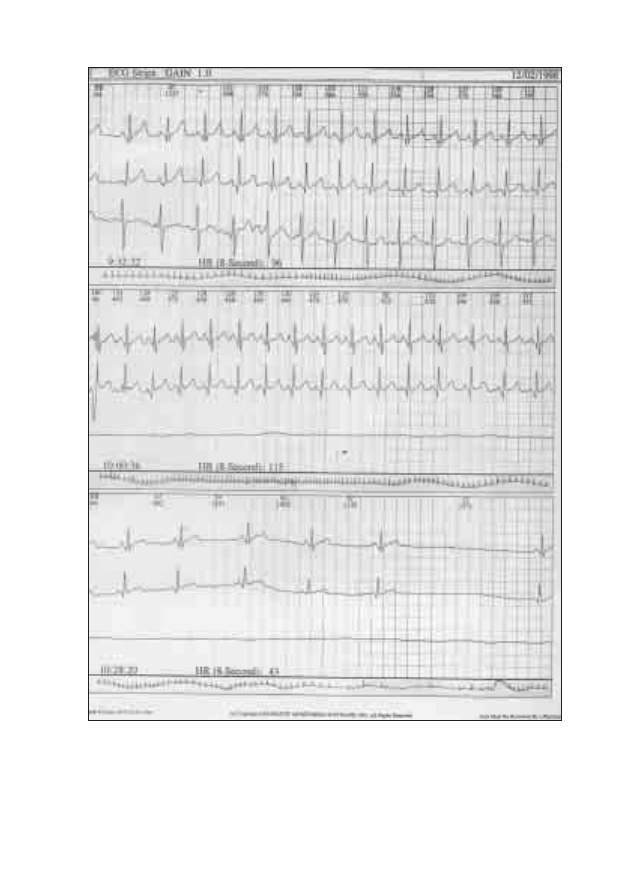
151
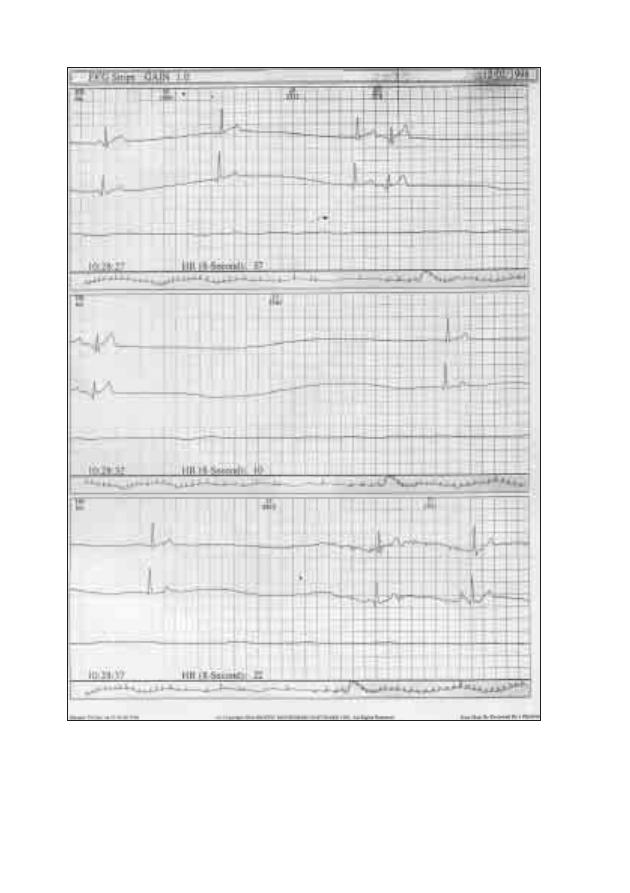
Rycina 2: Chory P.T. - rejestracja zapisu holterowskiego EKG podczas omdlenia. Stopniowe
zwolnienie rytmu zatokowego, zastępczy rytm węzłowy 25/min (2 pobudzenia)
i zahamowanie zatokowe trwające ok. 6 sekund, ponownie pojedyncze pobudzenia
zastępcze węzłowe. Powrót rymu zatokowego w pozycji leżącej (brak rejestracji
EKG w kanale 3)
152

Rozpoznanie:
Omdlenie wazowagalne. Typ kardiodepresyjny – 2B.
Leczenie:
Effortil 3 x 1 tabl. – dobry efekt kliniczny.
Komentarz:
Jest to przypadek młodego pacjenta bez choroby organicznej serca z krót-
kim wywiadem zasłabnięć występujących rzadko, jednak o ciężkim przebie-
gu (utraty przytomności). Zwraca uwagę fakt występowania omdleń wazo-
wagalnych także u brata pacjenta.
Ze względu na młody wiek chorego, typowy wywiad i brak choroby serca,
zespół wazowagalny wydawał się bardzo prawdopodobną przyczyną zasłab-
nięć, dlatego test pochyleniowy był jednym z pierwszych badań diagnostycz-
nych. Badanie pozwoliło na ustalenie mechanizmu zasłabnięć. Podjęto pró-
bę leczenia farmakologcznego lekiem z grupy alfa-agonistów z dobrym
efektem. W opisanym przypadku, ze względu na obserwowaną tendencję do
bradykardii i hipotonii nie rozpoczęto leczenia od leku beta-adrenolitycz-
nego, lecz zdecydowano się na zastosowanie leku z grupy alfa-agonistów, co
jak wskazuje dotychczasowa obserwacja pacjenta, było decyzją właściwą.
Zapamiętaj!
1. Test pochyleniowy jest badaniem umożliwiającym rozpoznanie zaburzeń
rytmu i przewodzenia zależnych od wzmożonego napięcia układu przy-
współczulnego, takich jak napadowy blok przedsionkowo-komorowy lub
zaburzenia czynności węzła zatokowego.
2. Wykonanie tego badania jest szczególnie wskazane u chorych z nawracają-
cymi zasłabnięciami lub utratami przytomności występującymi przy zmia-
nie pozycji na stojącą albo podczas dłuższej pionizacji.
Warto przeczytać:
Task Force on Syncope European Society of Cardiology. Guidelines on ma-
nagement (diagnosis and treatment) of syncope. Eur Heart J. 2001, 22:
1256-1306.
153

XIV. KARDIOSYSTEM
Jarosław Król
Próby zastosowania telefonu do badania układu krążenia nie są nowością.
Już w latach dwudziestych ubiegłego wieku Wenckebach posługiwał się tele-
fonem w sali wykładowej, prowadząc zajęcia ze studentami medycyny, ucząc
osłuchiwania serca i płuc. Nauczyciel i uczniowie osłuchiwali jednocześnie
tego samego pacjenta (ryc. 1).
Nieco później, bo w latach pięćdziesiątych, przeprowadzono pierwsze pró-
by przekazu przez telefon zapisu EKG. Metoda okazała się bardzo użyteczna
w kolejnej dekadzie, gdyż w pierwszych stymulatorach serca baterie były nie-
trwałe i bardzo ważne było wczesne wykrycie objawów ich wyczerpywania się.
Przy transmisji zapisu EKG przez telefon wykorzystuje się możliwość za-
miany sygnału elektrycznego pochodzącego z serca pacjenta na sygnał
dźwiękowy, a następnie zamianie sygnału dźwiękowego na wykres EKG
oglądany na monitorze lub drukowany na papierze. Przystawki do EKG
przez telefon produkowano w Polsce już w latach 70. Miały służyć do konsul-
Rycina 1: Rok 1926 - Karel Frederik Wenckebach i studenci - nauka osłuchiwania serca i płuc
154

towania opisów EKG w małych ośrodkach. Metoda jest prosta, pozwala na
przekazywanie jednokanałowego zapisu EKG, a zatem szczególnie polecana
przy ocenie zaburzeń rytmu serca. Uzyskiwany w ten sposób zapis EKG
przypomina ten oglądany na monitorze przy łóżku chorego.
Wykonanie badania EKG przez telefon jest bardzo łatwe. Pacjent przy-
kleja dwie elektrody do nadgarstków lub w wyznaczonych punktach na klat-
ce piersiowej, następnie łączy się z centrum monitorującym i po usłyszeniu
komunikatu od operatora włącza rejestrator, który „wygwizduje” modulo-
wany sygnał dźwiękowy do aparatu telefonicznego. Sygnał ten poprzez mo-
dem trafia na ekran komputera. Gdy operatorem systemu jest lekarz, moż-
liwe jest udzielenie porady przez telefon. Porada ta polegać może np. na
zaleceniu przyjęcia dodatkowej dawki stale stosowanego leku, uspokojeniu
chorego, gdy dolegliwości, które zgłasza nie są groźne lub odwrotnie, gdy
dolegliwości świadczą o zagrożeniu, wtedy lekarz wzywa karetkę, co znacznie
przyspiesza czas fachowej interwencji w warunkach szpitalnych. U chorych
z chorobami układu krążenia czas interwencji jest bardzo ważnym czynni-
kiem wpływającym na rokowanie.
Rycina 2: Rok 1960 - EKG przez telefon - kontrola stymulatora
155

W centrach dysponujących odpowiednim sprzętem, EKG wykonane przez
pacjenta trafia automatycznie do bazy danych i jest analizowane dopiero
w godzinach pracy personelu. Pacjent nie ma kontaktu z lekarzem, a zareje-
strowane zapisy EKG służą opracowaniom naukowym, mogą być wysłane
do lekarza prowadzącego jako kolejne badanie dodatkowe, ale nie dają do-
raźnych korzyści pacjentowi. Nadajnik do przekazu EKG przez telefon mo-
że być różnie skonstruowany. Najprostszy służy do wykonania badania w czasie
rzeczywistym, podczas rozmowy pacjenta z lekarzem. Obraz na monitorze
jest analizowany na bieżąco, czas monitorowania jest dowolnie długi, a wy-
brany fragment zapisu pozostaje w bazie danych pacjenta. Inny prosty na-
dajnik to jednocześnie rejestrator zdarzeń event recorder. Aparat taki w za-
leżności od budowy może zarejestrować od jednego do kilkunastu, zwykle
jednominutowych fragmentów zapisu EKG, które następnie można przeka-
zać przez telefon do centrum monitorującego. Pacjent może w ten sposób
zapisać EKG w każdej chwili, nawet wtedy, gdy nie ma możliwości połącze-
nia telefonicznego. Omówione typy rejestratorów mają jedną wadę, pozwa-
lają jedynie na wykonanie zapisu EKG w jednym kanale. Przekaz dźwiękowy
nie pozwala na jednoczesne transmitowanie zapisu z dwóch odprowadzeń.
Jednokanałowe badanie jest wystarczające do analizy zaburzeń rytmu ser-
Rycina 3: Rok 2003 - zapis EKG jednokanałowy w bazie danych
156
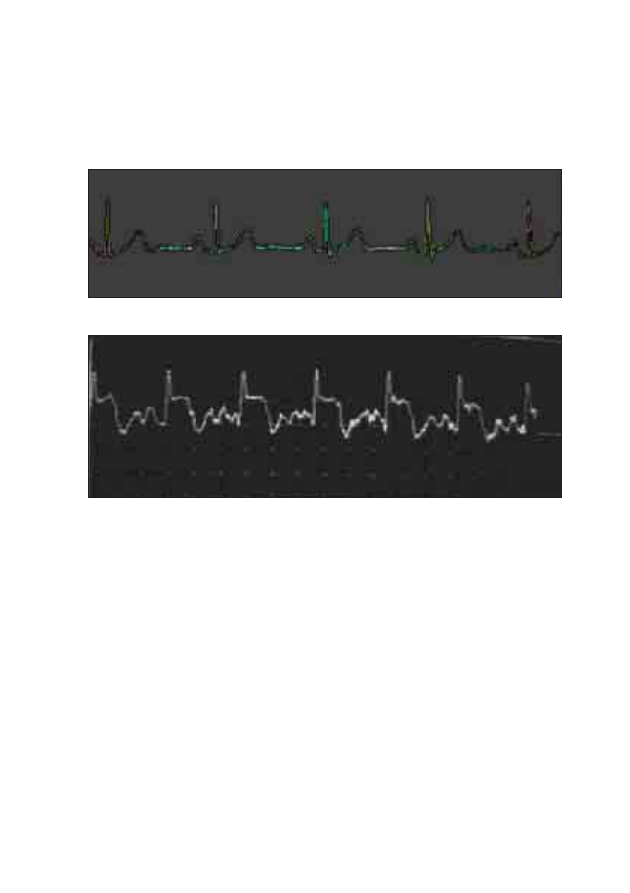
ca, ale dzięki niemu wykazać też można zmiany odcinka ST. Jak pokazują
historyczne już obrazy z pierwszego w Polsce systemu telefonicznego nad-
zoru kardiologicznego, utworzonego przez nasz zespół w połowie lat 90., gdy
zebrany jest wywiad, dysponujemy danymi pacjenta i w bazie danych dostęp-
ne jest poprzednie badanie EKG, rozpoznanie zawału serca możliwe.
Wielokanałowe EKG można wykonać innym rodzajem aparatu. Nadal na-
dajnik wysyła sygnał dźwiękowy, a zamiast dwóch elektrod pacjent przykle-
ja na klatce piersiowej trzy, z których (jak z trójkąta Einthovena) można uzy-
skać sześć odprowadzeń kończynowych. W nadajniku automatycznie
przełączane są kolejne pary elektrod, z których powstaje zapis sześciu od-
prowadzeń: I, II, III, aVR, aVL, aVF. Sposób wykonania badania, podob-
nie jak w klasycznym jednokanałowym aparacie EKG, kolejne odprowadze-
nia rejestrowane są jedno po drugim.
Od kilkunastu lat notujemy szybkie rozpowszechnienie telefonii komór-
kowej. Początkowo telefony przenośne przypominały małe radiostacje, były
duże, ciężkie, miały ograniczony zasięg i baterie wymagające częstego łado-
wania. Ale już wtedy okazało się, że można za ich pośrednictwem przekazy-
wać zapis EKG, tak jak z aparatu stacjonarnego. Wykorzystano te możliwo-
ści podczas masowych uroczystości religijnych, uzupełniając wyposażenie
karetek i punktów medycznych w aparaty do EKG przez telefon.
Rycina 5: Zdjęcie z monitora (29.09.1997 r.). EKG - zawał serca, pacjent W.B. lat 54
Rycina 4: Zdjęcie z monitora (30.05.1997 r.). EKG - prawidłowe, pacjent W.B. lat 54
157
Kwestią czasu było stworzenie aparatu, który będąc skomplikowanym tech-
nicznie i jednocześnie prostym w obsłudze urządzeniem, pozwoli na cyfrowy
przekaz EKG. Dziś, gdy telefon cyfrowy, czasem z radioodbiornikiem, apara-
tem fotograficznym, notatnikiem i stacją gier w jednym, noszą nawet małe dzie-
ci, oczywiste jest zastosowanie go także w medycynie. Najnowsze aparaty do
transmisji EKG to małe komputery z zakodowanymi danymi pacjenta, nume-
rem telefonu centrum diagnostycznego i możliwością programowania trybu
pracy jako rejestrator zdarzeń lub jako monitor pracujący w czasie rzeczywi-
stym. W aparatach cyfrowych wada polegająca na możliwości tylko jednokana-
łowego zapisu EKG została wyeliminowana. Aparaty te mogą przekazywać za-
pis w 6 lub 12 kanałach synchronicznie, bez uszczerbku dla jakości obrazu.
Na rysunku przedstawiono pełny zapis EKG przekazany przez telefon ko-
mórkowy. Kliniczne zastosowanie takiego aparatu jest jednak ograniczone,
bo badanie wymaga użycia 10 elektrod, standardowo rozmieszczonych na
klatce piersiowej i kończynach. Trudno wymagać od chorego, często będą-
cego w stresie, aby bezbłędnie wszystko połączył. Badanie można uprościć,
stosując tylko 3 elektrody przedsercowe i wtedy kształt zespołów QRS w nie-
których odprowadzeniach jest sztucznie generowany jako wypadkowa zespo-
łów z sąsiednich odprowadzeń. Obecnie najbardziej użyteczne wydaje się za-
Rycina 6: Rok 2003 - zapis 6 odprowadzeń kończynowych (przekaz akustyczny)
158
stosowanie aparatu dającego z trzech elektrod zapis sześciu odprowadzeń
kończynowych. Pozwala to na ocenę rytmu oraz zmian ST ze ściany przed-
niej (I), bocznej (aVL) i dolnej (II, III, aVF).
Jak widać na rycinie 8, zapis taki wyraźnie pokazuje rytm ze stymulatora.
Jakość nie budzi zastrzeżeń, a badania wykonała samodzielnie w domu 75-let-
nia chora.
W marcu 2003, po długim okresie prób aparatury najnowszej generacji,
uruchomiono w Klinice stały dyżur lekarski, pozwalający pacjentom z choro-
bami układu sercowo-naczyniowego, czynnikami ryzyka tych chorób, choro-
bami prowadzącymi do powstawania zaburzeń rytmu serca na konsultacje
telefoniczne połączone z wykonaniem badania EKG. Pacjenci wpisani do
KARDIOSYSTEMU mają do dyspozycji aparaty umożliwiające wykonanie
badania EKG przez telefon. W zależności od potrzeb są to aparaty jedno-
lub sześciokanałowe, z dźwiękowym lub cyfrowym trybem przekazu sygnału.
Pacjentom z napadowym migotaniem przedsionków najlepiej służą aparaty
jednokanałowe, pozwalające na długi czas transmisji i wnikliwą analizę zabu-
rzeń rytmu. Gdy pacjent leczony jest lekiem antyarytmicznym, można drogą
telefoniczną monitorować proces nasycania, wykonując codzienne pomiary
Rycina 7: Rok 2003 - EKG przez telefon (12 odprowadzeń)
159

QT. Chorzy po przebytym zawale serca otrzymują aparaty sześciokanałowe,
co pozwala na ocenę zmian odcinka ST w wielu odprowadzeniach. Wybrani
pacjenci korzystają z aparatów do przekazu zapisu przez telefon komórko-
wy. Rejestratory stosowane w tej opcji to rejestratory zdarzeń pozwalające
na długotrwałe monitorowanie pracy serca i wychwycenie zmian występują-
cych rzadko, ale dających objawy. Ten typ rejestracji może zastąpić wielo-
dniowe monitorowanie tradycyjną metodą Holtera.
Zapamiętaj!
1. EKG przez telefon to jeszcze jedna możliwość poprawy opieki nad pacjen-
tem i źródło dodatkowych możliwości diagnostycznych.
2. W przyszłości, wraz z rozwojem technik telekomunikacyjnych, znaczenie
telemedycyny wzrośnie.
Warto przeczytać:
M. Bujak, C. Zorkun, K. Żmudka: Telemedycyna: wczoraj, dziś, jutro. TMM
Kardiologia 1/2003; 27-31.
Rycina 8: Rok 2003 - EKG przez telefon (rytm ze stymulatora)
160

XV. WSKAZANIA DO WSZCZEPIENIA STYMULATORA
SERCA
Michał Moszczeński, Włodzimierz Mojkowski, Mirosław Dłużniewski
Wyrafinowanie techniczne i dostępność stymulatorów systematycznie
wzrasta. Pacjentów ze wszczepionym rozrusznikiem serca przybywa w Pol-
sce w tempie 14 000 rocznie. W związku z tym prawdopodobieństwo spotka-
nia pacjenta leczonego tą metodą nie ogranicza się jedynie do wyspecjalizo-
wanych klinik kardiologii – stają się oni codziennym „problemem” lekarzy
wszelkich specjalności. Warto wiedzieć, przy jakich chorobach można po-
móc stosując stałą elektrostymulację serca. Poniżej przedstawiono zespoły
chorobowe, w jakich rozważamy wszczepienie stymulatora serca:
Jak wszędzie w medycynie, tak i tu występują wskazania pierwszo-, drugo-
i trzeciorzędowe, czyli wskazania bezwzględne – co do których nie ma wąt-
Tabela 1: Objawy kliniczne I i II kategorii
• bloki przedsionkowo-komorowe;
• utrwalone migotanie przedsionków;
• choroba węzła zatokowego;
• zespół wazowagalny;
• nadwrażliwość zatoki szyjnej;
• kardiomiopatia rozstrzeniowa;
• kardiomiopatia przerostowa;
• zaburzenia wytwarzania i przewodzenia bodźca
po przeszczepie serca;
• zespół wydłużonego QT.
I KATEGORII
II KATEGORII
• utraty przytomności;
• stany przedomdleniowe;
• zawroty głowy (pełnoobjawowe
i poronne zespoły MAS).
• upośledzenie tolerancji wysiłku;
• niewydolność serca;
• zaburzenia krążenia mózgowego
(związane z przedłużającą się
bradykardią).
OBJAWY KLINICZNE
161

pliwości, wskazania względne oraz brak wskazań (czy wręcz przeciwwskaza-
nia). Proszę zwrócić uwagę na to, że często to samo schorzenie znajduje się
w grupie wskazań bezwzględnych i względnych lub względnych i braku wska-
zań, a różnią je objawy kliniczne (tab. 1) lub ich brak.
WSKAZANIA DO STAŁEJ STYMULACJI W BLOKACH
PRZEDSIONKOWO-KOMOROWYCH
WSKAZANIA BEZWZGLĘDNE
• blok przedsionkowo-komorowy III stopnia (blok całkowity):
utrwalony lub napadowy, o różnej etiologii (w tym
wrodzony) z towarzyszącymi zespołami MAS (zespół
Morganiego-Adamsa-Stokesa – utraty przytomności)
również z objawami II kategorii,
blok III stopnia bezobjawowy z istotną bradykardią
(<40/min) lub/i przerwami w pracy serca >3 s, lub/i
niewydolnością serca;
• blok przedsionkowo-komorowy typu Mobitza, z objawami I
i II kategorii;
• blok przedsionkowo-komorowy II i III stopnia, występujący
w czasie wysiłku fizycznego;
• blok przedsionkowo-komorowy II i III stopnia objawowy,
u chorych po przeszczepie serca;
• blok przedsionkowo-komorowy II i III stopnia objawowy oraz
bezobjawowy (przy współistniejących blokach odnóg pęczka Hisa),
który nie ustąpił 2 do 3 tygodni po zawale mięśnia sercowego.
BEZ WSKAZAŃ
• blok przedsionkowo-komorowy I stopnia bezobjawowy, także
z blokami odnóg;
• blok przedsionkowo-komorowy II stopnia typu Wenckebacha
bezobjawowy (szczególnie u osób młodych);
• blok przedsionkowo-komorowy II i III stopnia wrodzony,
bezobjawowy, z czynnością komór >50/min;
• blok przedsionkowo-komorowy III stopnia występujący przy świeżym
zawale mięśnia sercowego, ustępujący 2 do 3 tygodni po zawale;
• blok przedsionkowo-komorowy II i III stopnia po przeszczepie
serca, przemijający w okresie pooperacyjnym.
162

WSKAZANIA DO STAŁEJ ELEKTROSTYMULACJI
W UTRWALONYM MIGOTANIU PRZEDSIONKÓW
WSKAZANIA BEZWZGLĘDNE
• migotanie przedsionków z częstością rytmu komór <50/min lub/i
przerwami w pracy serca do 4-5 s, z objawami klinicznymi I lub
II kategorii;
• blok przedsionkowo-komorowy po ablacji prądem wysokiej
częstotliwości.
BEZ WSKAZAŃ
• bradyarytmia bezobjawowa, okresowo w nocy nawet <40 min,
• przerwy w pracy serca <3 s w dzień i <4 s w nocy.
WSKAZANIA WZGLĘDNE
• blok przedsionkowo-komorowy III stopnia (zwłaszcza wrodzony)
bezobjawowy z czynnością serca regularną (>40/min);
• blok przedsionkowo-komorowy II i III stopnia bezobjawowy po
zawale mięśnia sercowego z czynnością komór >50/min;
• blok przedsionkowo-komorowy II stopnia typu Mobitza
bezobjawowy (nie ma zgodności – w zależności od ośrodka chorzy
z tym typem bloku mają implantowany stymulator bądź są pod
okresową obserwacją pod kątem ew. wystąpienia objawów
klinicznych, bądź degeneracji do bloku wyższego rzędu);
• blok przedsionkowo-komorowy II stopnia t. Wenckebacha
z objawami II kategorii (nie ma zgodności – zależy dodatkowo
od wydolności układu krążenia);
• blok przedsionkowo-komorowy I i II stopnia z objawami
II kategorii po przeszczepie serca;
• blok przedsionkowo-komorowy I stopnia ze znacznym
wydłużeniem PQ u chorych z kardiomiopatią rozstrzeniową
– oczekiwany efekt hemodynamiczny przy skróceniu PQ.
163

WSKAZANIA DO STAŁEJ ELEKTROSTYMULACJI W CHOROBIE
WĘZŁA ZATOKOWEGO
DLA ZAINTERESOWANYCH: Pacjenci z wyżej wymienionymi wskazaniami do leczenia sta-
łą elektrostymulacją stanowią niewątpliwie większość wśród chorych leczonych tą metodą. Po-
zostałe wskazania z wymienionych w tabeli 1 są rzadsze, warto jednak wiedzieć, kiedy spodzie-
wamy się korzyści po wszczepieniu rozrusznika serca.
Zespół nadwrażliwej zatoki tętnicy szyjnej
Postać kardiodepresyjna zespołu nadwrażliwej zatoki tętnicy szyjnej – zahamowanie zatoko-
we (najczęściej) lub blok przedsionkowo-komorowy (rzadziej) – przy powtarzających się omdle-
niach. Postać mieszana – kardio-wazodepresyjna – stanowi względne wskazanie do wszczepie-
nia stymulatora. Z doświadczenia wiemy, że rozrusznik potrafi nie zabezpieczyć takiego chorego
przed zasłabnięciem.
WSKAZANIA WZGLĘDNE
• bezobjawowa bradykardia <40 min trwająca 30-60 s;
• pauzy do 3 s (bezobjawowe).
WSKAZANIA BEZWZGLĘDNE
• choroba węzła zatokowego objawowa (bradykardia zatokowa,
zahamowania zatokowe z objawami klinicznymi);
• objawowe, naprzemienne napady tachykardii nadkomorowych
i bradykardii zatokowej (tzw. zespół tachykardia-bradykardia);
• objawowa bradykardia będąca wynikiem stosowanych leków
(preparaty naparstnicy, beta-adrenolityki, antagoniści kanałów
wapniowych) – przy konieczności ich dalszego stosowania.
BEZ WSKAZAŃ
• bezobjawowa bradykardia zatokowa <60/min, również u osób
starszych.
WSKAZANIA WZGLĘDNE
• trudne do ustalenia.
164

Zespół wazowagalny
Są to spontanicznie występujące omdlenia związane z pionizacją, w mechanizmie kardiode-
presyjnym (zahamowanie bądź znaczne zwolnienie czynności serca), wazodepresyjnym (nagły
spadek ciśnienia tętniczego) bądź mieszanym kardio-wazodepresyjnym. Od kilku lat podejmo-
wane są próby zabezpieczenia pacjentów z postacią kardiodepresyjną bądź mieszaną, stałą elek-
trostymulacją, jednak wyniki odległe są wciąż dyskusyjne. Zespół ten klasyfikowany jest jako
wskazanie względne. „Czysta” postać wazodepresyjna jest przeciwwskazaniem do wszczepie-
nia stymulatora.
Kardiomiopatia przerostowa zawężająca
Wszczepienie stymulatora serca proponuje się zamiast leczenia chirurgicznego (bądź jako
„pomost” do czasu zabiegu chirurgicznego), gdy zawodzi leczenie farmakologiczne. Korzyści
możemy spodziewać się tylko pod warunkiem nieprzerwanej stymulacji prawej komory (stymu-
lacja t. DDD). „Niefizjologiczny” kierunek rozchodzenia się fali pobudzenia od koniuszka ko-
mory (przy elektrodzie komorowej w koniuszku prawej komory) powoduje w tym wypadku re-
dukcję gradientu ciśnień w drodze odpływu lewej komory oraz poprawę funkcji rozkurczowej
lewej komory. W długiej obserwacji występuje również zmniejszenie przerostu przegrody mię-
dzykomorowej oraz mięśnia lewej komory, a w efekcie zmniejszenie częstości omdleń i bólów
stenokardialnych.
Kardiomiopatia rozstrzeniowa
Decyzję o wszczepieniu stymulatora serca w kardiomiopatii rozstrzeniowej możemy rozważać
u chorych w III i IV klasie wg NYHA – oczekujących na przeszczep serca lub nie kwalifikują-
cych się do przeszczepu. Warunkiem uzyskania korzyści hemodynamicznych jest stymulacja
t. DDD lub VDD (nie może być migotania przedsionków) z krótkim opóźnieniem przedsionko-
wo-komorowym u chorych z blokiem AV I stopnia. Ulega wtedy poprawie napełnianie lewej
komory (przywrócenie dopełniającej funkcji przedsionka). W długiej obserwacji zmniejszeniu
ulega rozstrzeń komory. Obecnie od kilku lat trwają również próby kliniczne ze stymulacją resyn-
chronizującą trójjamową (elektrody stymulujące prawy i lewy przedsionek oraz prawą komorę)
oraz czterojamową (elektrody stymulujące oba przedsionki i obie komory serca). Te rodzaje
stymulacji przynoszą korzyści chorym z istotnymi zaburzeniami przewodnictwa śródprzedsion-
kowego i śródkomorowego, poprawiają synchronię skurczu i rozkurczu komór, zmniejszają sto-
pień niedomykalności zastawki dwudzielnej, przyczyniają się do wzrostu napełnienia lewej ko-
mory. Należy zdawać sobie sprawę, że te wyszukane tryby stymulacji dotyczą bardzo wąskiego
grona chorych, skrajnie niewydolnych krążeniowo i stanowią dodatek (choć często niezwykle
istotny) do intensywnej farmakoterapii.
Przeszczep serca
Serce przeszczepione jest sercem odnerwionym – pozbawionym wpływu układu autonomicz-
nego, reagującym jedynie na wzrost wydzielania katecholamin przez organizm biorcy. W związ-
ku z tym, przyspieszenie czynności serca jest niepełne i występuje z opóźnieniem. W grupie
chorych po przeszczepie serca mogą oczywiście oprócz niewydolności węzła zatokowego wy-
stępować bloki przedsionkowo-komorowe, ale dotyczą one ok. 10% chorych i często mają cha-
rakter przemijający, w okresie nawet do kilku miesięcy od przeszczepu. Podobnie zresztą by-
wa z niewydolnością węzła zatokowego, o czym należy pamiętać przed podjęciem decyzji
o wszczepieniu stymulatora serca. Bardzo istotną rzeczą jest dobór optymalnej stymulacji. Mo-
żemy w tym wypadku wybrać między „klasyczną” stymulacją t. AAIR bądź DDDR z elektroda-
mi przedsionkowymi w przedsionkach serca przeszczepionego (elektroda komorowa w przy-
padku stymulacji t. DDDR klasycznie w koniuszku prawej komory), bądź zsynchronizować
naturalną częstość węzła zatokowego biorcy (z „kikuta” własnego przedsionka) z przedsionka-
mi dawcy. Wymaga to umieszczenia dwóch elektrod w przedsionkach – dawcy i biorcy, połą-
165

czonych ze stymulatorem w ten sposób, że jedna elektroda przedsionkowa (w przedsionku bior-
cy) odbiera czynność węzła zatokowego i przekazuje ją do drugiej elektrody przedsionkowej
(w przedsionku dawcy). Idealnym rozwiązaniem jest dodatkowa elektroda w koniuszku prawej
komory.
Zespół wydłużonego QT
Zarówno wrodzony, jak i nabyty zespół wydłużonego QT związany jest z nawracającymi utra-
tami przytomności oraz zagrożeniem nagłą śmiercią sercową (z powodu częstoskurczu komoro-
wego, najczęściej typu torsade de pointes, który degeneruje do migotania komór). Korzyści z le-
czenia stałą elektrostymulacją mogą odnieść chorzy, u których:
• przyspieszenie czynności serca np.: do 80-90/min skraca odstęp QT;
• częstoskurcze komorowe prowokowane są bradykardią lub przerwami w pracy serca (należy
też pamiętać, że chorzy ci często przyjmują, zalecane w zespole wydłużonego QT beta-adre-
nolityki, dodatkowo zwalniające czynność serca).
Zapamiętaj!
1. O pilności wskazań do wszczepienia stymulatora serca decyduje obecność
(lub brak) objawów klinicznych.
Warto przeczytać:
G. Świątecka, K. Bieganowska, W. Kargul i wsp.: Standardy postępowania
w elektroterapii serca. Folia Card. 1999, 1 (supl. 1) 1-13.
166

XVI. RODZAJE STAŁEJ ELEKTROSTYMULACJI SERCA
Michał Moszczeński, Włodzimierz Mojkowski, Mirosław Dłużniewski
Pierwszy stymulator serca wszczepiono w Sztokholmie w 1958 roku pacjento-
wi z całkowitym blokiem przedsionkowo-komorowym. Przez okres ponad
czterdziestu lat, jaki upłynął od tamtego czasu, stymulatory uległy (i wciąż ule-
gają) kolejnym modernizacjom, powodującym z jednej strony ich postępującą
miniaturyzację, z drugiej zaś coraz większe techniczne wyrafinowanie. Doda-
wane są kolejne funkcje związane już nie tylko z samym pobudzeniem mięśnia
sercowego do skurczu, ale również rozliczne możliwości diagnostyczne pozwa-
lające (szczególnie przy stymulatorach dwujamowych) na optymalne dopaso-
wanie parametrów pracy stymulatora do choroby konkretnego pacjenta.
Rycina 2: Wielkość stymulatorów z różnych lat. Po prawej - najmniejszy stymulator na świecie
Rycina 1: Od lewej: prof. Ake Senning, inż. Rene Elmqvist – twórcy pierwszego
wszczepialnego stymulatora serca i ich dzieło
167

Ze względu na różne miejsca stymulacji (przedsionek, komora, przedsio-
nek i komora), jak i rodzaje stymulacji („sztywna”, „na żądanie”, z adaptacją
częstości itd.) wprowadzono powszechnie przyjęty literowy kod trybu pracy
stymulatora (tab. 1).
Pierwsza litera oznacza jamę serca, w której umieszczona jest elektroda
stymulująca (wysyłająca impulsy elektryczne pobudzające mięsień serca do
skurczu) – może to być prawy przedsionek (A), prawa komora (V) bądź
przedsionek i komora (D). Druga litera określa jamę serca, która steruje
pracą stymulatora (odbiera impulsy własnej czynności elektrycznej serca).
I tak elektroda odczytująca w przedsionku (A), w komorze (V), w obu ja-
mach (D), brak sterowania (0). Litera trzecia oznacza, w jakim trybie sty-
mulator pracuje. 0 – to stała praca z zadaną częstością, niezależnie od wła-
snej aktywności elektrycznej – obecnie spotykane sporadycznie, raczej przy
specyficznych ustawieniach diagnostycznych bądź na czas zabiegów opera-
cyjnych z użyciem elektrokoagulacji, która mogłaby zablokować pracę sty-
mulatora. Stymulator ustawiony w trybie A00, V00 pracuje „sztywno” z za-
programowaną częstością, bez względu na własną aktywność elektryczną
mięśnia sercowego. Kolejną możliwość określa litera I – oznacza ona stymu-
lator blokujący się wykrytą własną aktywnością serca (najczęściej spotykany
rodzaj stymulacji, tzw. na żądanie – stymulator włącza się przy braku rytmu;
jeżeli rytm serca jest szybszy od zaprogramowanego – czuwa, nie stymulu-
je). Litera T oznacza, że impuls stymulatora jest wyzwalany wykrytym wła-
snym pobudzeniem serca (w tej samej jamie serca w przypadku stymulato-
Tabela 1. Literowy kod pracy stymulatora.
Rycina 3: Porównanie grubości powyższych stymulatorów
D
D
V
T
A
I
MIEJSCE
STYMULACJI
MIEJSCE
ODBIORU
SYGNAŁU
SPOSÓB
ODPOWIEDZI
ADAPTACJA
CZĘSTOŚCI
AVD
0
0
R
168

rów jednojamowych – AAT, VVT lub przy stymulacji dwujamowej typu VAT
po każdym wykrytym własnym pobudzeniu przedsionkowym wysyłany jest
– z zaprogramowanym opóźnieniem – impuls stymulujący mięśniówkę ko-
mory) i wreszcie przy stymulatorach z literą D na końcu wiadomo, że sty-
mulator w zależności od sytuacji może pracować w obu poprzednio wymie-
nionych trybach I oraz T (nie znaczy to, że stymulator sam decyduje
o rodzaju odpowiedzi w danym momencie, ale że daje możliwości różnego
ustawienia trybu stymulacji). Można spotkać również czwartą literę – R. Jej
obecność oznacza, że stymulator wyposażony jest w funkcję adaptacji (przy-
spieszania, a następnie zwalniania) czynności serca do aktywności fizycznej.
W przeszłości spotkać można było więcej liter na czwartej pozycji (P – mało
programowalny, M – multiprogramowalny, C – komunikujący się z progra-
merem – czyli mający możliwość zewnętrznej zmiany nastawów). Jednak
w chwili obecnej po prostu nie ma stymulatorów „mało programowalnych”
bądź bez możliwości zewnętrznego programowania, wobec czego oznaczenia
powyższe straciły rację bytu i przestały być używane.
Chociaż możliwości zaprogramowania trybów pracy stymulatora jest wiele,
w praktyce najczęściej spotykamy się z następującymi rodzajami pracy sty-
mulatora: AAI (R), VVI (R), VDD, DDD (R), DDI (R). Litery w nawia-
sie oznaczają, że przy wszystkich tych trybach stymulacji można spotkać do-
datkowo funkcję adaptacji częstości serca (przyspieszanie/zwalnianie) do
wysiłku fizycznego.
TRYB AAI (AAIR)
Elektroda stymulująca (pierwsza litera) i sterująca (druga litera) jest to
jedna elektroda umieszczona w prawym przedsionku serca (klasycznym
miejscem fiksacji jest uszko prawego przedsionka). W tym przypadku sty-
mulacja hamowana jest wykrytą własną aktywnością elektryczną serca (trze-
cia litera). W przypadku konieczności przyspieszenia czynności serca przy
wysiłku fizycznym można uruchomić funkcję adaptacji częstości (czwarta li-
tera R). Kiedy zastosujemy stymulację AAI? Przy zaburzeniach w wytwarza-
niu bodźca w węźle zatokowo-przedsionkowym, przy zachowanym prawidło-
wym przewodzeniu impulsu z przedsionków do komór.
TRYB VVI (VVIR)
Podobnie jak poprzednim razem, jest jedna elektroda stymulująca i steru-
jąca zarazem. Umieszczona jest ona w prawej komorze serca (koniuszek
prawej komory). Stymulacja hamowana jest własną aktywnością elektrycz-
ną mięśnia komór. Ten rodzaj stymulacji zastosujemy u pacjenta z wolną
169

czynnością komór (patrz rozdział „Wskazania do wszczepienia stymulatora
serca”) i utrwalonym migotaniem przedsionków. Obecnie uważa się, że
obecność rytmu zatokowego jest przeciwwskazaniem do zastosowania sty-
mulacji VVI, ponieważ ten tryb stymulacji w żaden sposób nie uwzględnia
rytmu przedsionków.
TRYB VDD
Elektroda stymulująca jest umieszczona w komorze, natomiast sterująca
w przedsionku i komorze (układ dwóch elektrod – jednej w przedsionku,
drugiej w komorze lub jednej specjalizowanej elektrody tylko do tego rodza-
ju stymulacji, stymulującej komorę, a odbierającej również sygnały z przed-
sionka). Jest to stymulacja z możliwością zarówno hamowania, jak i wyzwa-
lania własnym rytmem. Stosuje się ją wtedy, gdy zachowana jest prawidłowa
czynność węzła zatokowego, a występuje blok przedsionkowo-komorowy II°
(t. Mobitz) lub III°.
TRYB DDD (DDDR)
Jest to najbardziej „zaawansowany” rodzaj stymulacji: elektrody w przed-
sionku i komorze, zarówno stymulujące, jak i sterujące, oczywiście z możli-
wością zarówno wyzwalania, jak i hamowania własnymi potencjałami. Ten
tryb stymulacji ma zastosowanie w przypadku dysfunkcji dwóch węzłów, to
znaczy w momencie, kiedy są problemy zarówno z wytwarzaniem bodźca
przez węzeł zatokowo-przedsionkowy, jak i z przewodzeniem przez węzeł
przedsionkowo-komorowy. W przypadku nieadekwatności chronotropowej
należy dodatkowo zastosować stymulację z adaptacją częstości rytmu
(DDDR).
TRYB DDI
Wreszcie ostatni z często spotykanych trybów stymulacji. Niby wszystko
jest tak samo jak w trybie DDD – elektrody w obu jamach serca, niepokój
budzi jedynie litera I na końcu. Jest to specyficzny rodzaj stymulacji stosowa-
ny u pacjentów z napadowymi migotaniami/trzepotaniami przedsionków,
a uniemożliwiający przekazanie szybkiego rytmu z przedsionka do komór
– stymulator ma oczywiście możliwość stymulowania przedsionka przy zbyt
wolnej jego czynności, ale tylko w przypadku stymulacji przedsionka zacho-
wana jest synchronizacja z komorą. Jeżeli rytm przedsionka jest szybszy, to
sterowanie częstością stymulatora przejmuje wyłącznie elektroda komoro-
wa. Skomplikowane? Niestety. Dla ułatwienia warto zapamiętać, że tryb
170

DDI to tak, jakby dwa oddzielne stymulatory AAI i VVI synchronizowane je-
dynie po wystymulowanym pobudzeniu przedsionkowym.
Często spotyka się określenie „stymulator fizjologiczny” bądź „stymulacja
fizjologiczna”. Jest to taki rodzaj stymulacji, w której zachowana jest natural-
na sekwencja pobudzania przedsionków i komór, czyli najpierw przedsio-
nek, następnie komora. „Stymulatory fizjologiczne” to te, które pracują
w trybie AAI (AAIR), VDD, DDD (DDDR). Stymulacja A00, V00, VVI nie
jest fizjologiczna, ponieważ albo w ogóle nie uwzględnia własnej czynności
elektrycznej serca (A00, V00), albo uwzględnia jedynie czynność komór
(VVI).
W tym miejscu warto również wyjaśnić terminy: stymulatory jednojamo-
we i stymulatory dwujamowe. Jednojamowe połączone są z elektrodą tylko
w jednej jamie serca, przedsionku (AAI) bądź komorze (VVI). Dwujamowe
– z elektrodami i w przedsionku i w komorze (VDD, DDD, DDI). Z tego
względu stymulatory dwujamowe można, w razie potrzeby, zaprogramować
w tryb jednojamowy (AAI, VVI) – druga część układu wtedy nie pracuje.
Przykład: pacjent z zaburzeniami wytwarzania i przewodzenia bodźca miał
wszczepiony stymulator typu DDD. Po pewnym czasie wystąpiły napadowe
migotania przedsionków – stymulator przeprogramowano w tryb DDI. Pomimo
modyfikacji leczenia farmakologicznego, napadowe migotanie przedsion-
ków przeszło w migotanie utrwalone. Ponieważ w tym momencie funkcja
części przedsionkowej stymulatora jest żadna, stymulator można przepro-
gramować w tryb VVI.
Na zakończenie tego rozdziału trzeba wspomnieć, że z pewnością w dość
bliskim czasie dotychczas stosowany tryb literowy ulegnie modyfikacji spo-
wodowanej nowymi rodzajami stymulacji (dwuprzedsionkowa, trójjamowa,
czterojamowa). W chwili obecnej stymulację trójjamową (dwa przedsionki
i jedna komora bądź jeden przedsionek i dwie komory) określa się termi-
nem DDDbiA oraz DDDbiV i jest to jeszcze terminologia, co do której auto-
rzy różnych artykułów są dość zgodni, a samo oznaczenie czytelne. W przy-
padku stymulacji dwuprzedsionkowej spotyka się przynajmniej dwa skróty:
AAD oraz A2A2T, natomiast na stymulację czterojamową nie ma właściwego
określenia (przez analogię można by ją określać jako DDDbiAbiV bądź
D2D2D – ale to czysta spekulacja).
DLA ZAINTERESOWANYCH: Stymulacja dwuprzedsionkowa stosowana jest jako jedna
z niefarmakologicznych metod zapobiegania napadom migotania przedsionków. Ponieważ na-
pady takie najczęściej mają miejsce w przypadku powiększonych przedsionków, w których wy-
dłużeniu ulega czas rozchodzenia się impulsu na drodze węzeł zatokowy – prawy przedsionek
– lewy przedsionek, jednoczasowe wysłanie impulsu stymulującego do prawego i lewego przed-
sionka skraca tenże czas, co zapobiega powstawaniu fali nawrotnej (re-entry). Elektroda w pra-
171

wym przedsionku umieszczona jest „typowo” w uszku przedsionka, elektroda stymulująca
przedsionek lewy wprowadzana jest bądź do zatoki wieńcowej, bądź wkręcana w przegrodę mię-
dzyprzedsionkową.
Stymulacja trójjamowa może polegać na stymulacji obu przedsionków (jak wyżej) oraz dodat-
kowo stymulacji prawej komory (napadowe migotanie/trzepotanie przedsionków + zaburze-
nia przewodzenia przedsionkowo-komorowego) albo na stymulacji prawego przedsionka oraz
prawej i lewej komory (specyficzne wskazania hemodynamiczne – choroba węzła zatokowego
+ blok AV I° – lub wyższy
+
blok lewej odnogi pęczka Hisa + zaburzenia przewodzenia śródko-
morowego + istotna niedomykalność mitralna). Lewą komorę serca stymuluje się, zakładając
elektrodę poprzez zatokę wieńcową do jednej z żył lewej komory.
Stymulacja czterojamowa – jak sama nazwa wskazuje elektrody umieszczone są w prawym
i lewym przedsionku oraz prawej i lewej komorze. Wskazania jak wyżej + napadowe migota-
nie/trzepotanie przedsionków.
Zapamiętaj!
1. Najczęściej spotykane tryby stymulacji to: AAI (stymulacja samego przed-
sionka), VVI (stymulacja samej komory), DDD (stymulacja zarówno
przedsionka, jak i komory).
2. Stymulacja fizjologiczna to taka, w której zachowana jest sekwencja pobu-
dzeń przedsionek-komora.
Warto przeczytać:
G. Gregoratos, M. Cheitlin, A. Conill et al.: ACC/AHA guidelines for
implantation of cardiac pacemakers and antiarrhythmia devices. A report of
the American College of Cardiology/American Heart Association Task Force
on Practice Guidelines (Committee on Pacemaker Implantation). J. Am.
Coll. Cardiol. 1998, 31: 1175-1209.
D. Hayes, D. Zipes: Cardiac Pacemakers and Cardioverter-Defibrillators.
Heart Disease. E. Braunwald (red.), 6th edition, W.B. Saunders Company,
Philadelphia 2001.
H.L. Kennedy: Use of long term (Holter) elektrocardiography recordings.
Cardiac electrophysiology: from cell to bedside. D.P. Zipes, J. Jalife (red.),
3rd edition, W.B. Saunders Company, Philadelphia 2000.
T. Lee: Guidelines: Use of Cardiac Pacemakers and Antiarrhythmia Devices.
Heart Disease. E. Braunwald (red.), 6th edition, W.B. Saunders Company,
Philadelphia 2001.
172

W. Mojkowski: Kliniczne wskazania do leczenia stałą stymulacją serca.
Groźne dla życia zaburzenia rytmu i przewodzenia; Medipress Kardiologia
tom 2, nr 5, 1995: 2-7.
G. Świątecka, K. Bieganowska, W. Kargul, Z. Kornacewicz-Jach, A. Kutarski,
E. Lewicka-Nowak, A. Lubiński, W. Musiał, W. Piwowarska, F. Prochaczek,
Z. Sadowski, M. Trusz-Gluza, F. Walczak, D. Wojciechowski: Standardy
postępowania w elektroterapii serca. Folia Card. 1999, 1 (supl. 1) 1-13.
M. Trusz-Gluza, A. Dąbrowski, Z. Kornacewicz-Jach, P. Kułakowski,
M. Markiewicz, W. Musiał, G. Świątecka, G. Opolski, A. Torbicki, F. Walczak,
A. Wnuk-Wojnar: Komorowe zaburzenia rytmu serca. Kardiol. Pol. 1997;
46, (supl. 1): 34-50.
G. Świątecka, K. Bieganowska, W. Kargul, Z. Kornacewicz-Jach, A. Kutarski,
E. Lewicka-Nowak, A. Lubiński, W. Musiał, W. Piwowarska, F. Prochaczek,
Z. Sadowski, M. Trusz-Gluza, F. Walczak, D. Wojciechowski: Standardy
postępowania w elektroterapii serca. Folia Card. 1999, 1 (supl. 1) 52-58.
F. Walczak, R. Kępski: Stymulator – przyjaciel twojego serca. PZWL, Warszawa
1995.
D.P. Zipes, W.M. Miles: Assesment of the patient with a cardiac arrhythmias.
Cardiac Electrophysiology: from cell to bedside, D.P. Zipes, J. Jalife (red.),
3rd edition, W.B. Saunders Company, Philadelphia 2000.
173
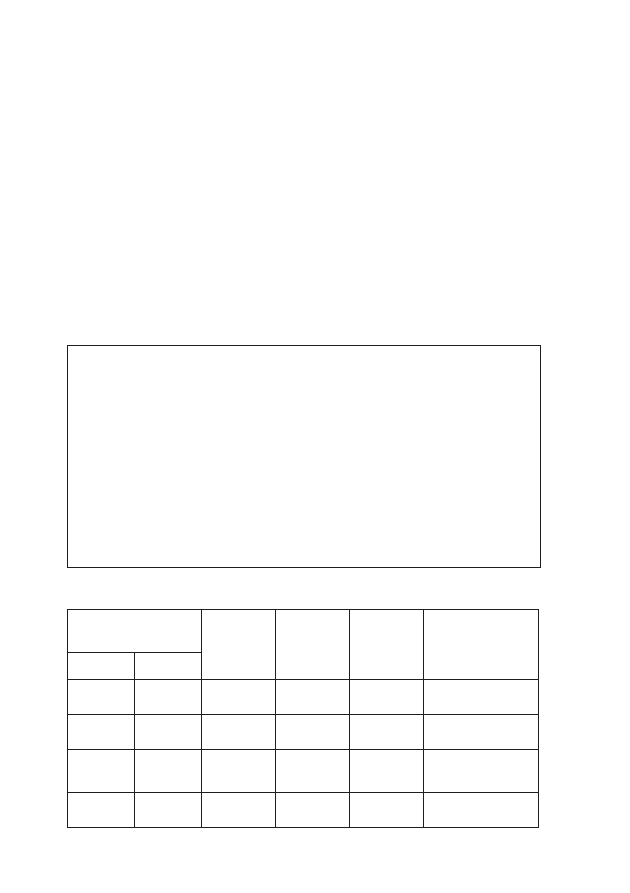
XVII. WYBÓR WŁAŚCIWEGO RODZAJU STYMULACJI
Michał Moszczeński, Włodzimierz Mojkowski, Mirosław Dłużniewski
Teraz, kiedy z poprzednich rozdziałów wiemy już jakie tryby stymulacji
mamy do wyboru i przy jakich zaburzeniach wytwarzania i przewodzenia
bodźca można pomóc wszczepieniem stymulatora serca, należy zastanowić
się nad dopasowaniem rodzaju stymulacji do określonej choroby. Pamiętaj-
my przy tym, że tzw. stymulacja fizjologiczna (AAI, VDD, DDD) jest ko-
rzystniejsza hemodynamicznie i zapewni choremu lepszą jakość życia.
WYBÓR TRYBU STYMULACJI W BLOKACH
PRZEDSIONKOWO-KOMOROWYCH
Wybierając tryb stymulacji, należy uwzględnić:
Tabela 1: Wybór trybu stymulacji w blokach przedsionkowo-komorowych
• jaki jest rodzaj bloku;
• czy blok jest stały, czy napadowy;
• czy współistnieje niewydolność węzła zatokowego;
• czy występuje zjawisko przewodzenia wstecznego
komorowo-przedsionkowego (często niemożliwe do określenia
przed implantacją stymulatora, jeśli nie wykonywano
programowanej stymulacji komór);
• niewydolność serca;
• stan ogólny chorego.
+
-
prawidłowy
-
-
VDD, DDD,
VVI - dopuszczalny
+
-
prawidłowy
+
+
DDD, VDD
-
+
prawidłowy
-
-
VDD, DDD,
VVI - dopuszczalny
(z histerezą)
+
-
upośledzony
+
+/-
DDDR, VDDR
CHRONO-
TROPIZM
WSTECZNE
PRZEWO-
DZENIE
NIEWYDOL-
NOŚĆ
KRĄŻENIA
TRYB STYMULACJI
STAŁY
NAPADOWY
BLOK
PRZEDSIONKOWO-
-KOMOROWY
174
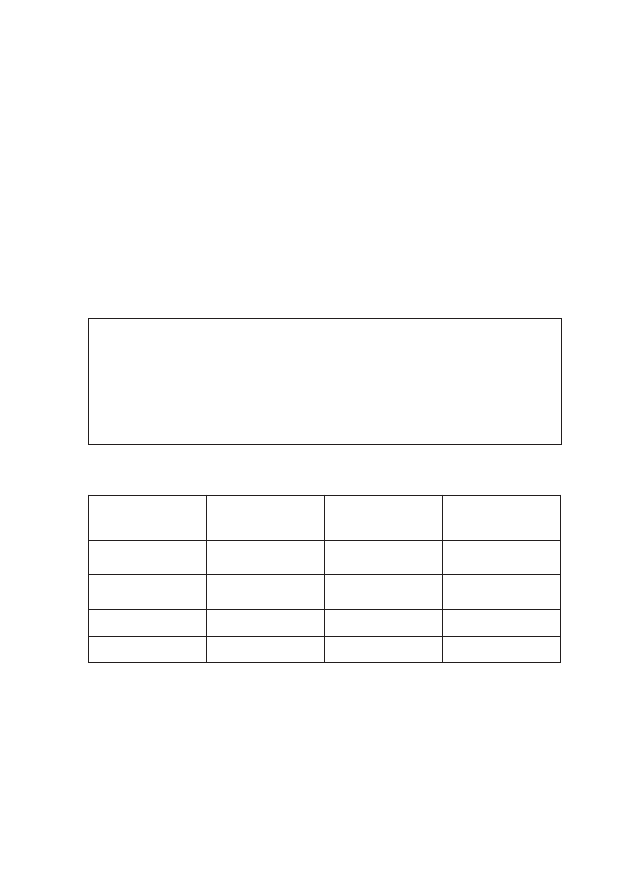
WYBÓR TRYBU STYMULACJI W UTRWALONYM MIGOTANIU
PRZEDSIONKÓW
Utrwalone migotanie przedsionków jest tym szczególnym schorzeniem,
przy którym z wyboru stosujemy stymulację typu VVI. Należy jedynie spraw-
dzić (wykonując test wysiłkowy bądź badanie holterowskie), czy pacjent ma
prawidłowy, czy upośledzony chronotropizm. W tym drugim wypadku po-
winno się implantować stymulator z adaptowaną częstością – VVIR.
WYBÓR TRYBU STYMULACJI W CHOROBIE
WĘZŁA ZATOKOWEGO
Wybierając tryb stymulacji, należy uwzględnić:
Kilku słów wyjaśnienia wymaga ostatnia rubryka „rodzaj stymulacji”. Dla-
czego tryb AAI i AAIR jest zalecany, a „lepszy” przecież DDD i DDDR jedy-
nie dopuszczalny? Rzeczywiście, np. w Stanach Zjednoczonych nie wszczepia
się praktycznie stymulatorów tylko do przedsionka – uważa się (poniekąd słusz-
nie), że u pacjentów z chorobą węzła zatokowego mogą również pojawiać
się nie wykryte wcześniej zaburzenia przewodzenia przedsionkowo-komo-
rowego. W takiej sytuacji stymulacja przedsionkowa faktycznie nie zabezpie-
czy pacjenta. W naszych warunkach ocenia się przewodzenie przedsionko-
Tabela 2: Wybór trybu stymulacji w chorobie węzła zatokowego
• czy współistnieją zaburzenia przewodzenia
przedsionkowo-komorowego;
• jaka jest wydolność chronotropowa węzła zatokowego;
• czy choroba węzła (bradykardia) ma charakter stały, czy pojawia
się okresowo i jeżeli tak, to jak często.
OBJAWY KLINICZNE
CHOROBY WĘZŁA
ZABURZENIA
PRZEWODZENIA
P-K
CHRONOTROPIZM
RODZAJ
STYMULACJI
+
-
prawidłowy
AAI
DDD - dopuszczalny
+
-
upośledzony
AAIR
DDDR - dopuszczalny
+
+
prawidłowy
DDD
+
+
upośledzony
DDDR
175
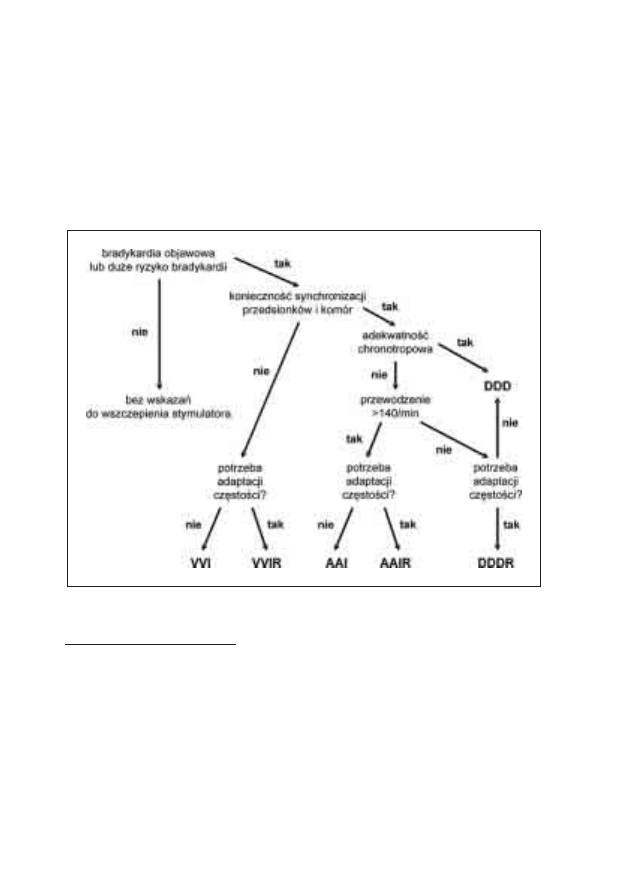
wo-komorowe. Jeżeli jest ono zupełnie prawidłowe, to nie ma przeciwwska-
zań do zastosowania stymulatora typu AAI. Natomiast osobom, u których
(często po wieloletniej obserwacji) pojawią się zaburzenia przewodzenia
– wymienia się układ stymulujący na dwujamowy. Również u pacjentów,
u których manifestacja kliniczna choroby węzła jest sporadyczna decydujemy
o wszczepieniu układu typu VVI – pomimo wszelkich ograniczeń tego ro-
dzaju stymulacji. Ogólny algorytm wyboru trybu stymulacji przedstawiono
na rycinie 1.
DLA ZAINTERESOWANYCH:
Wybór trybu stymulacji w nadwrażliwości zatoki tętnicy szyjnej
W przypadku nadwrażliwości zatoki tętnicy szyjnej sprawa wydaje się prosta – mamy do czy-
nienia z zahamowaniem zatokowym, czyli trzeba wszczepić stymulator typu AAI. Pozornie. Na-
leży pamiętać, że w tym zespole chorobowym może współistnieć napadowy blok AV II° i III°,
w związku z czym optymalnym rozwiązaniem byłby stymulator typu DDD (bez funkcji „dolegli-
wość”, gdyż dolegliwość ma charakter napadowy i krótkotrwały). U pacjentów, którzy objawy
kliniczne miewają bardzo rzadko można również rozważać wszczepienie stymulatora typu VVI.
Wybór trybu stymulacji w zespole wazowagalnym
W postaci kardiodepresyjnej zespołu wazowagalnego również, jak w przypadku nadwrażli-
wości zatoki tętnicy szyjnej, poronne bądź pełnoobjawowe zespoły MAS nie występują często,
Rycina 1: Algorytm wyboru trybu stymulacji
176

przeważa tu prawidłowy rytm zatokowy. Optymalnym zabezpieczeniem dla pacjenta dotknięte-
go tą przypadłością jest wszczepienie stymulatora typu DDD wyposażonego w funkcję tzw.: rate
drop response (RDR), która to uwzględnia nie tylko fakt – do jakiej najniższej wartości zwolni-
ła się czynność serca – ale również jak szybko się to stało (powoli = zwalnianie fizjologiczne).
Ma to spowodować rzadkie włączanie się stymulatora, czy wręcz nie włączanie się go przy fi-
zjologicznych zwolnieniach częstości rytmu serca (np. podczas snu), a jednocześnie zapobiegać
omdleniom pacjenta. U pacjentów leczonych stałą elektrostymulacją typu DDD bez funkcji
RDR, programowano zwykle wysoką podstawową częstość stymulacji (np.: 80-100/”) przy histe-
rezie rzędu 40/' i nierzadko zdarzało się, że pacjenta budziło w nocy nagłe przyspieszenie czyn-
ności serca (stymulator!).
Wybór trybu stymulacji w zespole wydłużonego QT
Przed podjęciem decyzji o wszczepieniu stymulatora u chorego z zespołem wydłużonego QT,
należy zawsze sprawdzić, czy ta forma leczenia przyniesie spodziewane korzyści, to znaczy czy
rzeczywiście wpłynie na skrócenie QT. Ten element sprawdza się podczas badania elektrofizjo-
logicznego, narzucając rytm szybszy od własnego rytmu pacjenta i obserwując zachowanie od-
cinka QT. W przypadku podjęcia decyzji o wszczepieniu stymulatora serca w zespole wydłużo-
nego QT, implantować można stymulator typu AAI (przy zupełnie prawidłowym przewodzeniu
przedsionkowo-komorowym) lub DDD (optymalnie – nawet przy prawidłowym przewodzeniu
p-k należy pamiętać o beta-adrenolitykach, którymi są leczeni ci pacjenci). Warunkiem powo-
dzenia jest zaprogramowanie wyższej od własnego rytmu częstości stymulacji.
Wybór trybu stymulacji w kardiomiopatiach i w przeszczepionym sercu opisany jest w roz-
dziale poświęconym wskazaniom do wszczepienia stymulatora serca.
Zapamiętaj!
1. Sposób pracy stymulatora opisany jest międzynarodowym kodem literowym.
2. Stymulację samego przedsionka bądź przedsionka i komory określamy mia-
nem stymulacji fizjologicznej. Taką stymulacją nie jest stymulacja typu VVI.
3. Stymulacja wyłącznie komorowa (VVI) powinna być stosowana jedynie
u pacjentów z utrwalonym migotaniem przedsionków.
Warto przeczytać:
G. Gregoratos, M. Cheitlin, A. Conill et al.: ACC/AHA guidelines for
implantation of cardiac pacemakers and antiarrhythmia devices. A report of
the American College of Cardiology/American Heart Association Task Force
on Practice Guidelines (Committee on Pacemaker Implantation). J. Am.
Coll. Cardiol. 1998, 31: 1175-1209.
D. Hayes, D. Zipes: Cardiac Pacemakers and Cardioverter-Defibrillators.
Heart Disease. E. Braunwald (red.), 6th edition, W.B. Saunders Company,
Philadelphia 2001.
177

H.L. Kennedy: Use of long term (Holter) elektrocardiography recordings.
Cardiac electrophysiology: from cell to bedside, D.P. Zipes, J. Jalife (red.),
3rd edition, W.B. Saunders Company, Philadelphia 2000.
T. Lee: Guidelines: Use of Cardiac Pacemakers and Antiarrhythmia Devices.
Heart Disease; E. Braunwald (red.), 6th edition, W.B. Saunders Company,
Philadelphia 2001.
W. Mojkowski: Kliniczne wskazania do leczenia stałą stymulacją serca.
Groźne dla życia zaburzenia rytmu i przewodzenia; Medipress Kardiologia
tom 2, nr 5, 1995: 2-7.
G. Świątecka, K. Bieganowska, W. Kargul, Z. Kornacewicz-Jach, A. Kutarski,
E. Lewicka-Nowak, A. Lubiński, W. Musiał, W. Piwowarska, F. Prochaczek,
Z. Sadowski, M. Trusz-Gluza, F. Walczak, D. Wojciechowski: Standardy
postępowania w elektroterapii serca. Folia Card. 1999, 1 (supl. 1) 1-13.
M. Trusz-Gluza, A. Dąbrowski, Z. Kornacewicz-Jach, P. Kułakowski,
M. Markiewicz, W. Musiał, G. Świątecka, G. Opolski, A. Torbicki, F. Walczak,
A. Wnuk-Wojnar: Komorowe zaburzenia rytmu serca. Kardiol. Pol. 1997;
46, (supl. 1): 34-50.
G. Świątecka, K. Bieganowska, W. Kargul, Z. Kornacewicz-Jach, A. Kutarski,
E. Lewicka-Nowak, A. Lubiński, W. Musiał, W. Piwowarska, F. Prochaczek,
Z. Sadowski, M. Trusz-Gluza, F. Walczak, D. Wojciechowski: Standardy
postępowania w elektroterapii serca. Folia Card. 1999, 1 (supl. 1) 52-58.
F. Walczak, R. Kępski: Stymulator – przyjaciel twojego serca. PZWL, Warszawa
1995.
D.P. Zipes, W.M. Miles: Assesment of the patient with a cardiac arrhythmias.
Cardiac Electrophysiology: from cell to bedside, D.P. Zipes, J. Jalife (red.),
3rd edition, W.B. Saunders Company, Philadelphia 2000.
178

XVIII. WSZCZEPIENIE STYMULATORA SERCA
I OPIEKA NAD PACJENTEM PO IMPLANTACJI
ROZRUSZNIKA
Michał Moszczeński, Włodzimierz Mojkowski, Mirosław Dłużniewski
WSZCZEPIENIE STYMULATORA
Wszczepienie stymulatora serca jest zabiegiem chirurgicznym, w związ-
ku z czym powinno się ono odbywać zgodnie z ogólnie przyjętymi reguła-
mi aseptyki na sali operacyjnej bądź w przystosowanej do tego sali hemo-
dynamicznej lub elektrofizjologii inwazyjnej. Należy pamiętać, że poprzez
elektrodę układ stymulujący ma bezpośrednie połączenie z wsierdziem,
w związku z czym zainfekowanie miejsca operacji bądź samego stymulato-
ra może prowadzić do infekcyjnego zapalenia wsierdzia (IZW). Zabiegu
dokonuje najczęściej kardiolog przeszkolony w tej technice operacyjnej,
rzadziej kardiochirurg bądź chirurg w towarzystwie kardiologa. Pacjent
do operacji wszczepienia stymulatora musi być na czczo, konieczne jest
odstawienie preparatów kwasu acetylosalicylowego na minimum 4 dni przed
planowanym terminem operacji. U pacjentów przyjmujących na stałe ace-
nokumarol, zalecany wskaźnik protrombiny powinien być nie mniejszy niż
80% (odstawienie leku w okresie przedoperacyjnym i zastosowanie hepa-
ryn niskocząsteczkowych). Okolica pola operacyjnego powinna być wygo-
lona. Przed samym zabiegiem można zastosować środki sedatywne. Znie-
czulenie jest miejscowe – nasiękowe. W tym celu najczęściej używa się 1%
roztworu lidokainy, rzadziej prokainy lub bupiwakainy. W razie koniecz-
ności rozwarstwienia mięśnia piersiowego stosuje się dodatkowe wstrzyk-
nięcia analgetyku. Wszczepienia stymulatora dokonuje się najczęściej
z dojścia z prawej bądź lewej okolicy podobojczykowej. Jeżeli nie ma in-
nych uwarunkowań medycznych, np. przebytych urazów obojczyka, zabie-
gów operacyjnych w tej okolicy, zaleca się stronę przeciwną do dominują-
cej (u praworęcznych – po lewej stronie). Rzadziej do wprowadzenia
elektrody do stałej stymulacji wykorzystuje się żyły szyjne zewnętrzne z ich
dopływem lub żyły szyjne wewnętrzne (wymaga operatora doświadczone-
go w chirurgii szyi). W razie niemożności dojścia z ww. regionów alterna-
tywnie można wykorzystać żyłę udową, ewentualnie w przypadku anomalii
anatomicznych układu żylnego, jego niedrożności, może zajść konieczność
wszczepienia stymulatora podczas zabiegu kardiochirurgicznego. Elektro-
dę naszywa się wówczas bezpośrednio na mięsień serca (elektrody nasier-
dziowe).
179

Rycina 2: Moment wprowadzania elektrody do żyły
Rycina 1: Znieczulenie nasiękowe pola operacyjnego
180
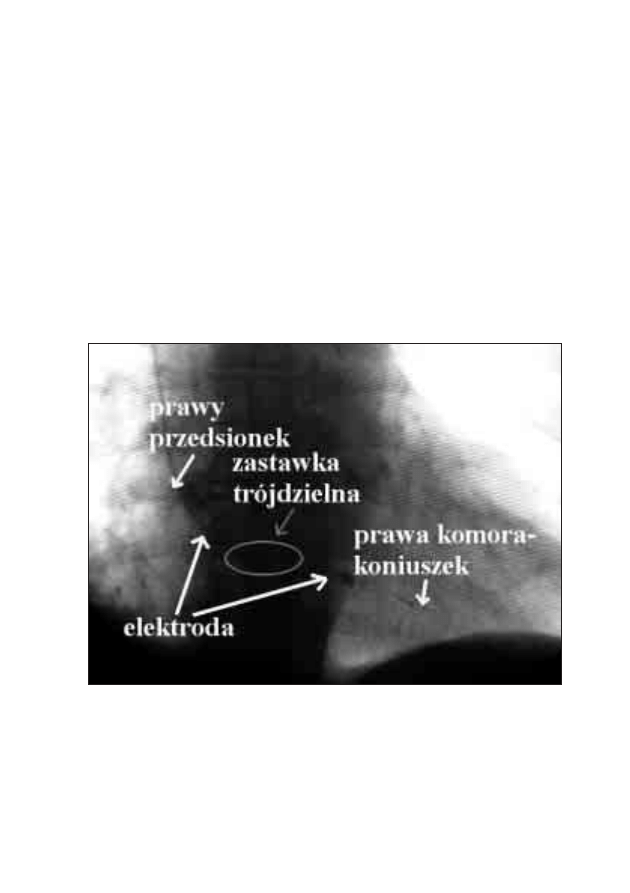
Typowa technika operacyjna polega na wypreparowaniu żyły odpromie-
niowej w bruździe naramienno-piersiowej i wprowadzeniu poprzez wenesek-
cję elektrody do światła żyły. Równoważną metodą jest nakłucie żyły pod-
obojczykowej (choć obarczone możliwością wystąpienia dodatkowych
powikłań, takich jak: nakłucie tętnicy podobojczykowej, spowodowanie od-
my opłucnowej, przerwanie przewodu piersiowego). W razie nieskuteczno-
ści powyższego postępowania można wypreparować żyłę szyjną zewnętrzną
bądź któryś z jej dopływów. Wiąże się to z koniecznością przeprowadzenia
przyłącza elektrody nad bądź pod obojczykiem do loży stymulatora. Elek-
trodę do układu żylnego (niezależnie od miejsca dojścia) wprowadza się na
stalowym mandrynie, który umożliwia manewrowanie elektrodą wewnątrz
serca w celu ustalenia optymalnego miejsca stymulacji. Dla stymulacji ko-
morowej jest to koniuszek prawej komory ewentualnie (rzadziej stosowane)
droga odpływu z prawej komory.
W przypadku stymulacji przedsionkowej końcówkę elektrody umieszcza
się w uszku prawego przedsionka. Długość elektrody pozostawiona w ja-
mach serca powinna być tak dobrana, aby uwzględnić ruch klatki piersiowej
przy głębokim oddychaniu, a jednocześnie by nie powodować drażnienia za-
stawki trójdzielnej (komorowe zaburzenia rytmu serca) czy mięśnia przed-
Rycina 3: Elektroda w koniuszku prawej komory - zdjęcie ze skopii RTG
181
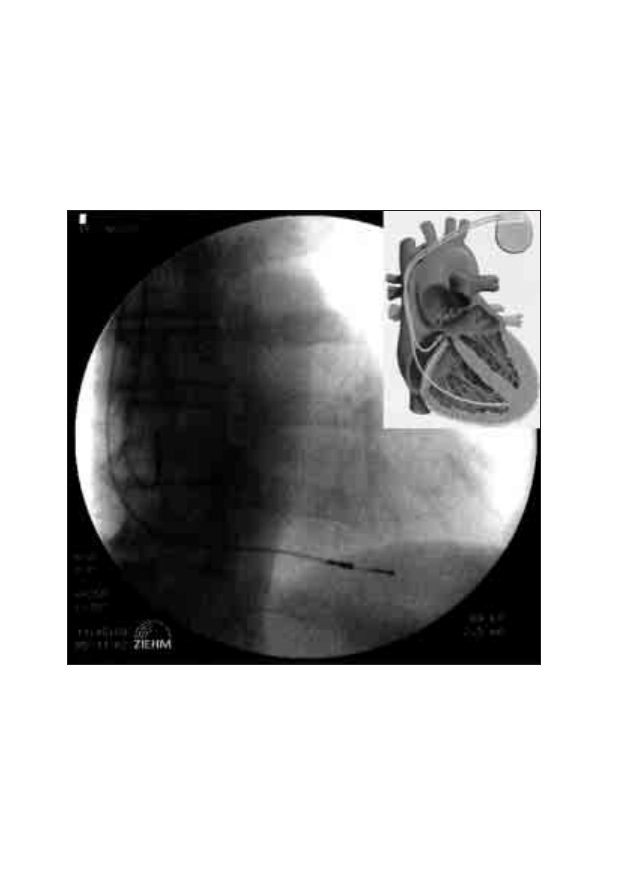
sionka (tachyarytmie nadkomorowe). Po implantacji elektrody (elektrod)
sprawdza się parametry elektryczne miejsca, w którym znajduje się końcówka
elektrody. Ważna jest zarówno amplituda sygnału przedsionkowego/komoro-
wego (odpowiada za późniejsze sterowanie stymulatora), jak i tak zwany próg
stymulacji (treshold), to jest najmniejsza amplituda prądu wywołująca skurcz
mięśnia sercowego. Z reguły używa się elektrod o biernej fiksacji (elektroda
ma na końcu „wąsy”, które zahaczają się między mięśniami beleczkowatymi).
W razie trudności z utrzymaniem się elektrody w mięśniu sercowym moż-
na zastosować elektrody o aktywnej fiksacji (elektrody zakończone różnego
rodzaju spiralami), pozwalające wkręcić końcówkę elektrody w mięsień. Zasad-
nicza różnica w kształcie elektrody przedsionkowej i komorowej polega na
tym, że elektroda komorowa jest prosta, a elektroda przedsionkowa po wyję-
ciu mandrynu przyjmuje kształt litery J (lepsza fiksacja w uszku przedsionka).
Rycina 4: Zdjęcie ze skopii RTG - stymulacja dwujamowa; elektroda przedsionkowa w uszku
prawego przedsionka, elektroda komorowa w koniuszku prawej komory
182
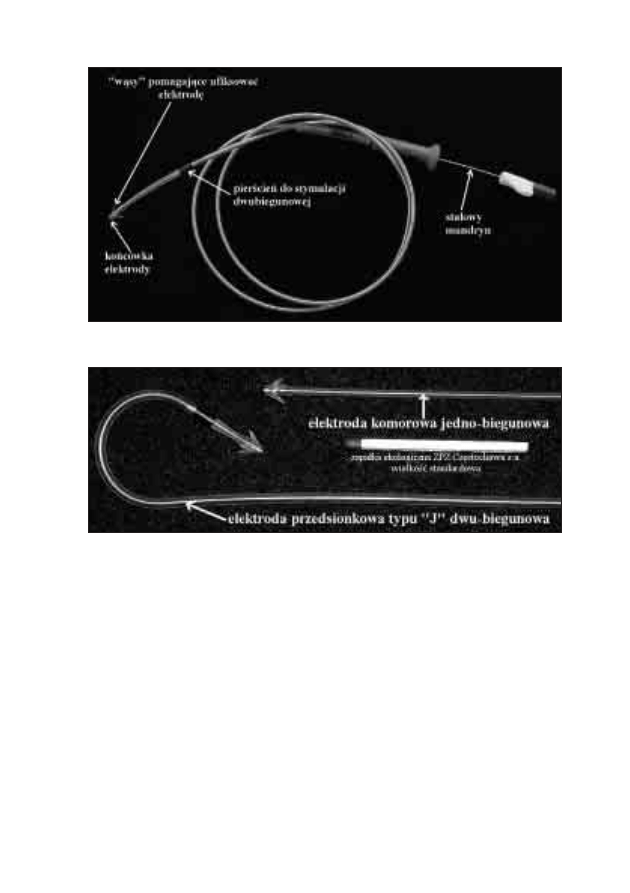
Po założeniu elektrody (elektrod) do pożądanego miejsca w sercu, przy-
łącze elektrody (elektrod) przykręca się do stymulatora, który następnie
umieszczany jest w loży stymulatora w tkance podskórnej (najczęściej) bądź
w loży pod mięśniem piersiowym większym (np. u osób bardzo szczupłych
bądź prowadzących aktywny fizycznie tryb życia).
Nadmiar elektrody (typowa elektroda komorowa ma ok. 60 cm długości,
przedsionkowa 53 cm) umieszcza się najczęściej pod stymulatorem. Po za-
szyciu rany zalecany jest okres unieruchomienia pacjenta w łóżku (różnie
– od kilku godzin do doby – w zależności od doświadczeń ośrodka). Również
różnie stosowana jest profilaktyczna antybiotykoterapia – od pojedynczej
dawki dożylnej przed zabiegiem operacyjnym, do trzech dni stosowania an-
tybiotyku. Chociaż dyslokacje elektrod zdarzają się stosunkowo rzadko, tym
Rycina 6: Przykładowe elektrody przedsionkowa i komorowa – porównanie wielkości i kształtu
Rycina 5: Elektroda dwubiegunowa do stymulacji komorowej
183
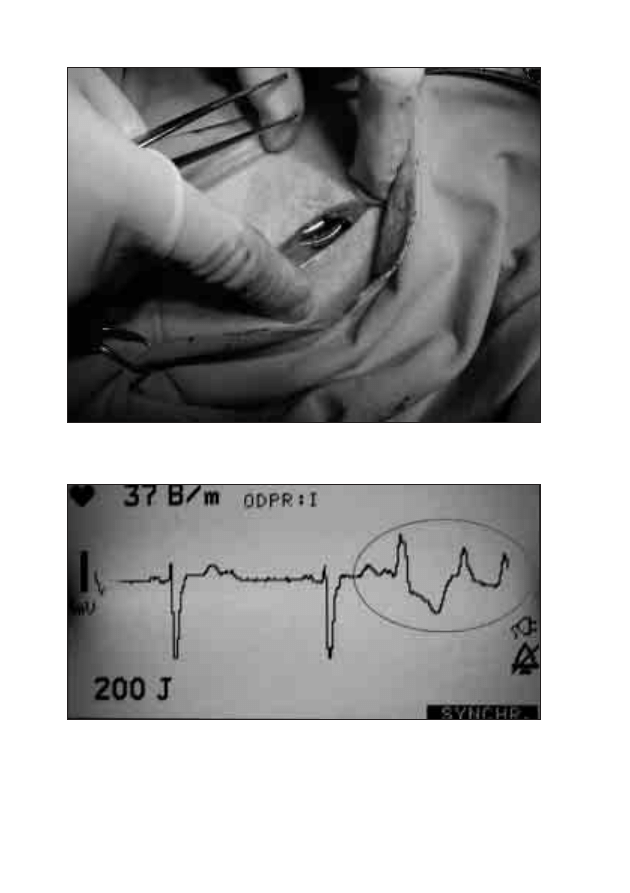
Rycina 8: Typowe arytmie komorowe wywołane przejściem elektrody przez pierścień zastawki
Rycina 7: Stymulator umieszczony w loży stymulatora pod skórą
184

niemniej wskazana jest obserwacja pacjenta po wszczepieniu stymulatora
w Oddziale Intensywnej Opieki Kardiologicznej przez okres co najmniej kil-
ku godzin, szczególnie w przypadku pacjentów, których rytm serca jest cał-
kowicie zależny od stymulatora. Ponadto pacjenci po wszczepieniu stymula-
tora muszą być obserwowani w szpitalu przez okres kilku dni ze względu na
możliwe powikłania typowo chirurgiczne, takie jak krwiak okolicy stymulato-
ra bądź zakażenie i ropienie loży stymulatora. O ile to pierwsze z reguły po-
woduje głównie pewien defekt kosmetyczny (zasinienie tkanki podskórnej)
znikający w ciągu 4-6 tygodni i bardzo rzadko wymagający ewakuacji, o tyle
jakiekolwiek przesłanki co do możliwości zakażenia bakteryjnego są wskaza-
niem do usunięcia układu stymulującego i ponownej implantacji nowego
układu stymulator-elektroda po drugiej stronie (bardzo duże ryzyko IZW).
Współczesne elektrody endokawitarne są na tyle cienkie i miękkie, że z re-
guły nie powodują drażnienia komórek mięśnia sercowego, do których doty-
kają na swoim przebiegu w jamach serca. Miejscami szczególnie wrażliwy-
mi na trącanie przez elektrodę są płatki zastawki trójdzielnej (złożone
komorowe zaburzenia rytmu są wręcz wskazówką w trakcie zakładania elek-
trody informującą o jej przejściu przez pierścień zastawki). Podczas operacji
należy tak dobrać długość elektrody pozostającą w jamach serca, aby wyklu-
czyć bądź zminimalizować powyższe zjawisko. Podobnie łuk elektrody przed-
sionkowej, dotykając ścian przedsionka, prowokować może arytmie przed-
sionkowe. Jeżeli po wszczepieniu stymulatora utrzymują się zaburzenia
rytmu, których przed wszczepieniem nie było, stanowi to wskazanie do re-
operacji i rewizji przebiegu elektrod. Poniżej wymieniono najczęstsze (cho-
ciaż w praktyce klinicznej na szczęście występujące bardzo rzadko) tak zwa-
ne powikłania wczesne. Również do tej grupy powikłań zaliczany jest „blok
wyjścia” (exit block) – znaczny wzrost progu stymulacji, w najgorszym wy-
padku prowadzący do jej nieskuteczności. Co do powikłań późnych – zda-
rzyć się może (szczególnie u pacjentów, którzy znacznie schudli) przemiesz-
czenie stymulatora w tkance podskórnej, późna dyslokacja elektrody,
zakrzep żyły podobojczykowej bądź (ekstremalnie rzadko) przebicie stymu-
latora przez skórę.
185

DALSZA OPIEKA NAD PACJENTEM ZE WSZCZEPIONYM
STYMULATOREM SERCA
Dla pacjenta najważniejszym momentem, związanym z największym stre-
sem, jest sam zabieg wszczepienia stymulatora. Dla lekarza, który zajmuje
się wszczepianiem i kontrolą stymulatorów przeciwnie – trudna część pracy
dopiero przed nim – prawidłowe ustawienie parametrów pracy urządzenia.
Należy zdawać sobie sprawę z tego, że stymulatory doby obecnej są urządze-
niami multiprogramowalnymi. W stymulatorze jednojamowym (AAI, VVI)
ustawić można: podstawową częstość stymulacji (w niektórych urządzeniach
z dokładnością do 1 uderzenia/min), histerezę, zwolnienie czynności rozrusz-
nika w godzinach nocnych, napięcie impulsu, szerokość impulsu, okres re-
frakcji, czułość. Jeżeli stymulator wyposażony jest w funkcję adaptacji czę-
stości do wysiłku fizycznego (AAIR, VVIR), dochodzi do tego szereg
parametrów regulujących, jak i przy jakim poziomie wysiłku stymulator bę-
dzie przyspieszał (a następnie zwalniał) czynność serca. Poziom komplikacji
znacznie wzrasta przy stymulatorach dwujamowych (VDD, DDD, DDI) – do-
chodzą wzajemne współzależności między częścią przedsionkową i komoro-
wą. Ponadto w zależności od stopnia zaawansowania stymulatora jest on
obecnie wyposażony w szereg funkcji diagnostycznych, których interpreta-
cja wymaga doświadczenia; dodatkowym utrudnieniem jest inny dobór za-
równo zestawu tych funkcji, jak i dostępu do nich stosowana przez różne fir-
my produkujące stymulatory serca.
Według zaleceń amerykańskich lekarz samodzielnie wszczepiający
stymulator serca powinien:
• posiadać odpowiednią wiedzę teoretyczną dotyczącą opieki nad
pacjentem ze wszczepionym stymulatorem/programowania
stymulatorów;
• asystować co najmniej przy 100 kontrolach stymulatorów;
• wszczepić jako pierwszy operator co najmniej 50 stymulatorów
(z czego połowa dwujamowych);
• uczestniczyć w 20 operacjach wymiany stymulatora/rewizji układu
stymulującego;
• posiadać odpowiednią wiedzę dotyczącą rozpoznawania i leczenia
powikłań stałej elektrostymulacji;
• zalecana znajomość techniki usuwania elektrod.
186

Z reguły pierwszą kontrolę stymulatora, (jeżeli we wczesnym okresie oko-
łooperacyjnym nie wystąpiły zjawiska zmuszające do szczególnej czujności)
przeprowadza się w szóstej-siódmej dobie po wszczepieniu (w praktyce naj-
częściej w dniu wypisu pacjenta ze szpitala). Następna kontrola wyznacza-
na jest po upływie sześciu tygodni, kolejna po pół roku, a nastepnie jeden
raz na rok aż do momentu, kiedy stymulator zacznie wykazywać zużycie ba-
terii – wtedy kontrole przeprowadzane są częściej, aż do czasu wymiany sty-
mulatora na nowy. Okres pracy stymulatora zależy oczywiście od wielu
zmiennych (pobór prądu, procent „włączania się” stymulatora), średnio jest
to ok. ośmiu lat. W trakcie kontroli stymulatora ustawia się szereg parame-
trów – ważne jest dostosowanie tychże do zapotrzebowania konkretnego pa-
cjenta (tu niezwykle istotny jest problem właściwej współpracy i wymiany in-
formacji między lekarzem kontrolującym stymulator a lekarzem opiekującym
się stale pacjentem). Chociaż współczesne stymulatory zwalniają podstawo-
wą czynność stymulacji w miarę zużywania baterii (co może być zaobserwo-
wane poprzez pomiar tętna), bardzo ważne jest pilnowanie przez pacjenta
lub opiekującego się nim lekarza terminów kontroli stymulatora. Równie
ważne jest zdawanie sobie sprawy z tego, że niezależnie od wyrafinowania
technicznego, stymulator jest tylko generatorem impulsów elektrycznych po-
budzających mięsień sercowy do skurczu z zadaną częstością i nie zabezpie-
cza chorego, np. przed chorobą wieńcową czy nadciśnieniem tętniczym.
Przypominam o tym, aby uzmysłowić konieczność farmakoterapii chorób
współistniejących u pacjenta ze wszczepionym stymulatorem serca według
ogólnie przyjętych zasad. Z drugiej strony wątpliwości, co do poprawnego
funkcjonowania rozrusznika powinny spowodować skierowanie chorego do
kontroli w Ośrodku Kontroli Stymulatorów.
Zapamiętaj!
1. Wszczepienie stymulatora serca jest zabiegiem chirurgicznym, wymagają-
cym pełnego zaplecza właściwego dla działań operacyjnych.
2. Po wszczepieniu stymulatora serca pacjent pozostaje pod kontrolą Ośrodka
Kontroli Stymulatorów, ale odnośnie schorzeń towarzyszących, musi być
leczony wg ogólnie przyjętych zasad.
Warto przeczytać:
G. Gregoratos, M. Cheitlin, A. Conill et al.: ACC/AHA guidelines for
implantation of cardiac pacemakers and antiarrhythmia devices. A report of
187

the American College of Cardiology/American Heart Association Task Force
on Practice Guidelines (Committee on Pacemaker Implantation). J. Am.
Coll. Cardiol. 1998, 31: 1175-1209.
D. Hayes, D. Zipes: Cardiac Pacemakers and Cardioverter-Defibrillators.
Heart Disease. E. Braunwald (red.), 6th edition, W.B. Saunders Company,
Philadelphia, 2001.
H.L. Kennedy: Use of long term (Holter) elektrocardiography recordings.
Cardiac electrophysiology: from cell to bedside. D.P. Zipes, J. Jalife (red.),
3rd edition, W.B. Saunders Company, Philadelphia 2000.
T. Lee: Guidelines: Use of Cardiac Pacemakers and Antiarrhythmia Devices.
Heart Disease. E. Braunwald (red.), 6th edition, W.B. Saunders Company,
Philadelphia 2001.
W. Mojkowski: Kliniczne wskazania do leczenia stałą stymulacją serca.
Groźne dla życia zaburzenia rytmu i przewodzenia; Medipress Kardiologia
tom 2, nr 5, 1995: 2-7.
G. Świątecka, K. Bieganowska, W. Kargul, Z. Kornacewicz-Jach, A. Kutarski,
E. Lewicka-Nowak, A. Lubiński, W. Musiał, W. Piwowarska, F. Prochaczek,
Z. Sadowski, M. Trusz-Gluza, F. Walczak, D. Wojciechowski: Standardy
postępowania w elektroterapii serca. Folia Card. 1999, 1 (supl. 1) 1-13.
M. Trusz-Gluza, A. Dąbrowski, Z. Kornacewicz-Jach, P. Kułakowski,
M. Markiewicz, W. Musiał, G. Świątecka, G. Opolski, A. Torbicki, F. Walczak,
A. Wnuk-Wojnar: Komorowe zaburzenia rytmu serca. Kardiol. Pol. 1997;
46, (supl. 1): 34-50.
G. Świątecka, K. Bieganowska, W. Kargul, Z. Kornacewicz-Jach, A. Kutarski,
E. Lewicka-Nowak, A. Lubiński, W. Musiał, W. Piwowarska, F. Prochaczek,
Z. Sadowski, M. Trusz-Gluza, F. Walczak, D. Wojciechowski: Standardy
postępowania w elektroterapii serca. Folia Card. 1999, 1 (supl. 1) 52-58.
F. Walczak, R. Kępski: Stymulator – przyjaciel twojego serca. PZWL, Warszawa
1995.
D.P. Zipes, W.M. Miles: Assesment of the patient with a cardiac arrhythmias.
Cardiac Electrophysiology: from cell to bedside. D.P. Zipes, J. Jalife (red.),
3rd edition, W.B. Saunders Company, Philadelphia 2000.
188

XIX. TYPOWE ZAPISY EKG U PACJENTÓW
ZE WSZCZEPIONYM STYMULATOREM SERCA
Michał Moszczeński, Włodzimierz Mojkowski, Mirosław Dłużniewski
Metodą powszechnie dostępną, która pozwala wstępnie zorientować się,
czy stymulator pracuje poprawnie, jest badanie EKG. Aby dobrze zinter-
pretować zapis, należy sprawdzić, jak ustawione jest urządzenie według
wpisu w legitymacji stymulatora, którą pacjent (zgodnie z zaleceniami)
powinien mieć przy sobie. W legitymacji sprawdzić można, w jakim trybie
pracuje stymulator (AAI, VVI itd.), jaka jest minimalna częstość stymula-
cji (również maksymalna częstość synchronizowana w przypadku stymula-
torów VDD, DDR), czy jest włączona tzw. histereza, czy jest włączony
czujnik adaptacji częstości (R) oraz czy stymulacja jest jedno-, czy dwu-
biegunowa. Dla dalszego zrozumienia tekstu objaśnimy, co to jest histere-
za oraz jakie znaczenie może mieć jedno-dwubiegunowa stymulacja. Hi-
stereza jest zaprogramowaną częstością, po osiągnięciu której włącza się
stymulator. Jeżeli np. stymulator pracuje z podstawową częstością 60/min,
z histerezą ustawioną na 50/min, oznacza to, że (przy własnej czynności
serca) aż do rytmu 50/min stymulator nie włączy się, jeżeli natomiast czę-
stość rytmu spadnie poniżej 50/min, to rozrusznik zacznie stymulować
z podstawową częstością 60/min i będzie pracował do momentu, kiedy
własna czynność serca przekroczy 60/min. Wtedy ponownie przestanie wy-
syłać impulsy i będzie „czekać” na zwolnienie rytmu poniżej 50/min. Ina-
czej mówiąc, przy nastawach stymulatora jak wyżej, zupełnie prawidłowy
jest zarówno zapis EKG z własnym rytmem pacjenta >50/min, jak i wy-
stymulowanym 60/min. Histerezę uruchamia się najczęściej u pacjentów
z przewagą własnego rytmu, u których stymulator włącza się sporadycz-
nie, ewentualnie w przypadku chorych z postacią kardiodepresyjną zespo-
łu wazowagalnego (wysoka podstawowa częstość stymulacji 80-110/min
i duża wartość histerezy, np.: 40/min – obecnie wypierane przez stymula-
tory ze specjalizowaną dla tego zespołu funkcją rate drop response). Na
czym polega odrębność stymulacji jedno- i dwubiegunowej? Przy stymula-
cji jednobiegunowej prąd przepływa między końcówką elektrody a obu-
dową stymulatora, w związku z czym impuls jest wyraźnie widoczny w za-
pisie EKG z powierzchni ciała. W układzie dwubiegunowym prąd
przepływa pomiędzy końcówką elektrody a pierścieniami na tejże elek-
trodzie i może być (szczególnie przy niskiej amplitudzie impulsu) mało
charakterystyczny w EKG.
189
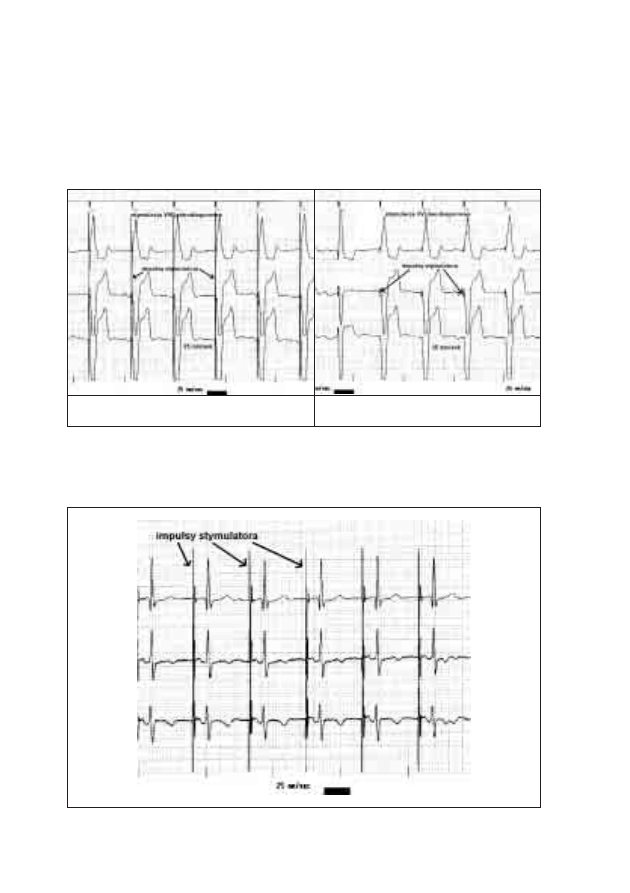
TYPOWE ZAPISY STYMULACJI
Na rycinie 1 przedstawiono stymulację komorową typu VVI jednobiegu-
nową i dwubiegunową. Zapisy krzywych EKG należą do tego samego pa-
cjenta.
Stymulację przedsionkową typu AAI przedstawia rycina 2.
Rycina 2: Stymulacja jednobiegunowa typu AAI
Rycina 1: Stymulacja typu VVI jednobiegunowa (a) i dwubiegunowa (b)
a)
b)
190
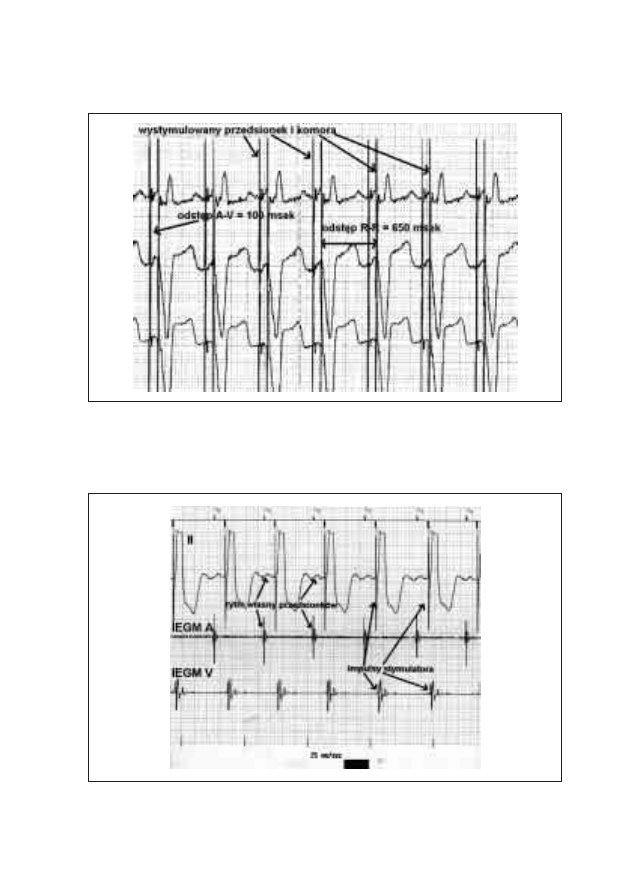
Stymulację dwujamową (przedsionek i komora) typu DDD przedstawiono
na rycinie 3.
Stymulację komorową sterowaną rytmem przedsionka typu VDD przed-
stawia rycina 4.
Rycina 4: Stymulacja typu VDD:
IEGM A - zapis z elektrody przedsionkowej stymulatora,
IEGM V - zapis z elektrody komorowej
Rycina 3: Stymulacja typu DDD
191
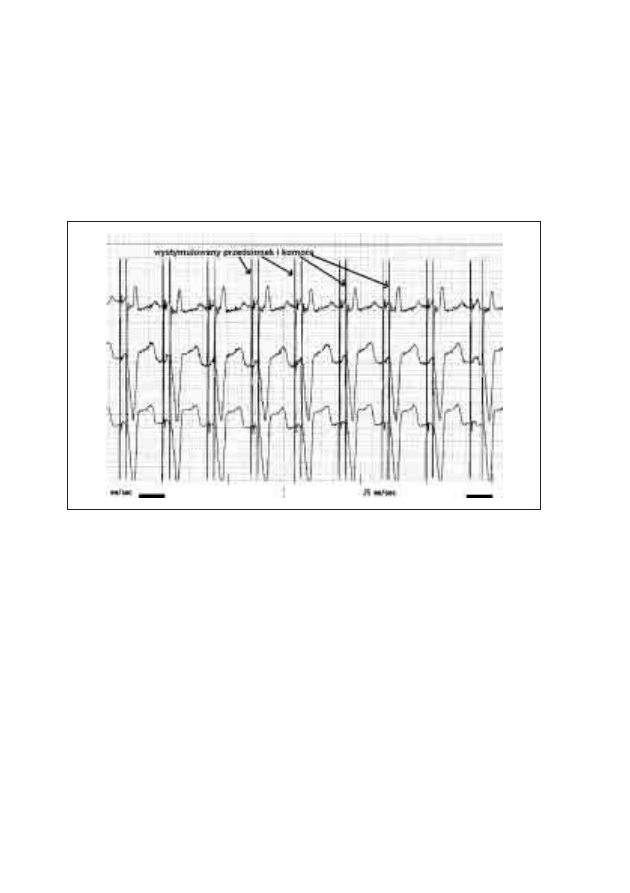
Czasem problem może powodować wątpliwość, czy stymulator w ogóle
pracuje, jeżeli własna czynność serca jest szybsza od zaprogramowanej
i w zapisie EKG w ogóle nie widać pobudzeń wystymulowanych. Możemy
wtedy wykorzystać specyficzną funkcję diagnostyczną stymulatora, jaką jest
tzw. częstość magnetyczna. Po przyłożeniu nad stymulator magnesu prze-
chodzi on na częstość testową ok. 90/min (85-100/min w zależności od pro-
ducenta) – niezależnie od własnej czynności serca (stymulacja A00, V00,
D00). Przykładowy rytm magnetyczny obrazuje rycina 5.
PRZYKŁADY NIEPRAWIDŁOWEJ STYMULACJI
Nieskuteczną stymulację komorową typu VVI przedstawiono na rycinie 6.
Pobudzenia ze stymulatora nie powodują odpowiedzi komór.
Identyczny zapis może świadczyć również o nieskutecznej stymulacji typu
AAI. A czy może być przykładem stymulacji typu A00 lub V00? Nie! Można
to wnioskować po tym, że przerwy między impulsami stymulatora nie są równe, co
świadczy o zachowaniu przynajmniej częściowego „sensingu” (wykrywania wła-
snej czynności elektrycznej serca), co przemawia przeciw „sztywnej” stymulacji.
Częstoskurcz stymulatorowy – jest to powikłanie mogące występować je-
dynie w stymulatorze dwujamowym. Może mieć dwie postaci:
• przy migotaniu przedsionków „przerzucanie” rytmu do komór (poprzez
układ stymulatora) do maksymalnej synchronizowanej 1: 1 częstości co
zobrazowano na rycinie 7.
Rycina 5: Rytm magnetyczny stymulatora typu DDD
192
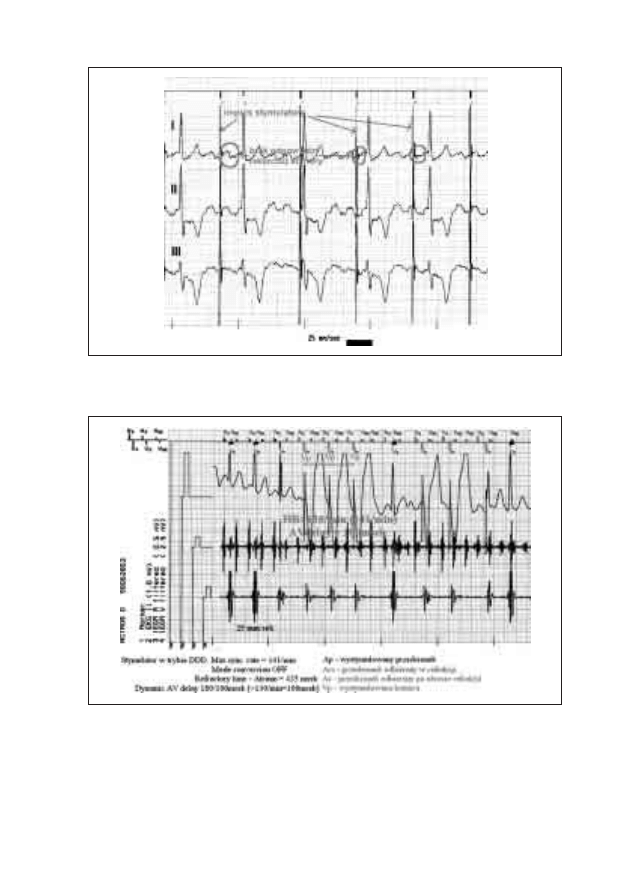
• w przypadku nieskutecznej stymulacji przedsionka, po impulsie z elek-
trody komorowej, następuje wsteczna depolaryzacja przedsionka, którą
wykrywa elektroda przedsionkowa. Stymulator wówczas wysyła sygnał
do pobudzenia komory, ponownie odbiera wsteczny przedsionek, po-
Rycina 7: Częstoskurcz stymulatorowy przy migotaniu przedsionków
Rycina 6: Nieskuteczna stymulacja typu VVI
193
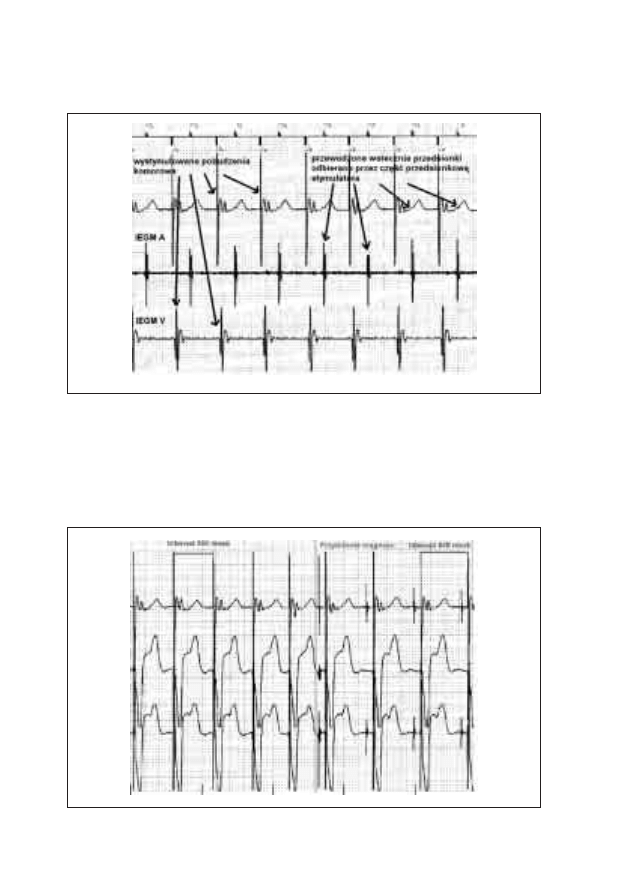
nownie stymulowana jest komora i w ten sposób podtrzymuje się czę-
stoskurcz – jak to zobrazowano na rycinie 8.
Prostym sposobem doraźnym przerwania drugiej z wymienionych postaci
częstoskurczu stymulatorowego jest przyłożenie nad magnes stymulatora.
Przedstawia to rycina 9. Definitywnie (w obu przypadkach) problem rozwią-
że przeprogramowanie stymulatora.
Rycina 9: Przerwanie częstoskurczu stymulatorowego przyłożeniem magnesu nad stymulator
Rycina 8: Częstoskurcz stymulatorowy spowodowany nieskuteczną depolaryzacją
przedsionka i obecnością wstecznego przewodzenia
194
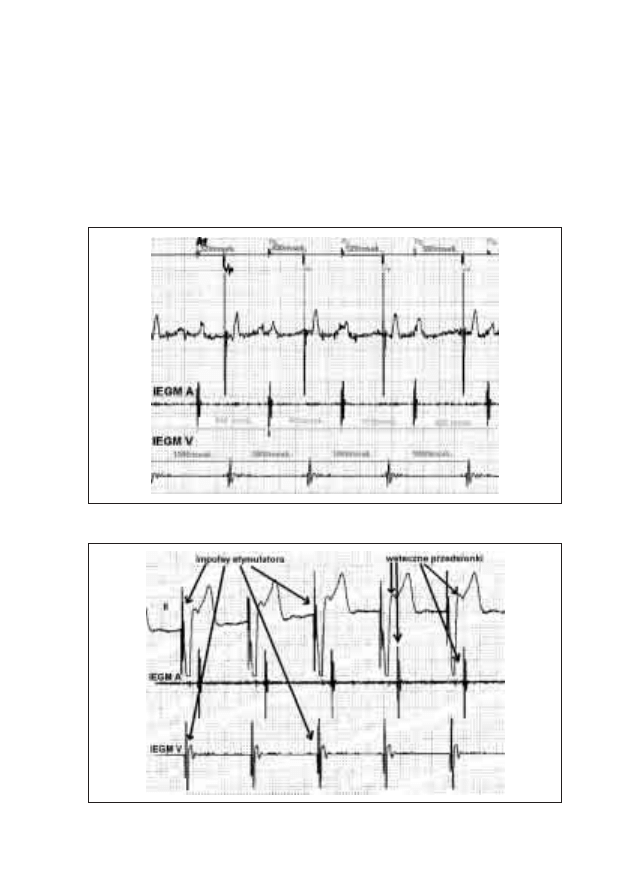
Ostatnim z groźniejszych powikłań jest tzw. zespół stymulatorowy. Jest to
pogorszenie stanu klinicznego pacjenta będący następstwem spadku rzutu
serca po wszczepieniu stymulatora. Może on występować w przypadku sty-
mulacji komorowej typu VVI u pacjenta z zachowanym rytmem zatokowym
(dlatego przy rytmie zatokowym nie powinno się wszczepiać stymulatorów
typu VVI). W „łagodniejszej” postaci rytm zatokowy nie jest zsynchronizo-
wany z rytmem komór, w związku z czym okresowo brakuje dopełniającej
funkcji przedsionka. Taką sytuację przedstawia rycina 10.
Rycina 11: Obecność wstecznego przewodzenia komorowo-przedsionkowego
Rycina 10: Brak synchronizacji skurczów przedsionków i komór
195

W skrajnie niekorzystnej postaci zespołu stymulatorowego stymulacja ko-
mory powoduje wsteczną depolaryzację przedsionka, w związku z czym każ-
dy skurcz przedsionków trafia w zamknięte zastawki przedsionkowo-komo-
rowe i powoduje cofanie się krwi do układu żylnego. Obrazuje to rycina 11.
W efekcie bardzo spada hemodynamiczna sprawność serca. Stwierdzenie
zespołu stymulatorowego jest wskazaniem do wymiany układu stymulujące-
go z jedno- na dwujamowy.
Zapamiętaj!
1. Do prawidłowej interpretacji zapisu EKG u pacjenta ze wszczepionym sty-
mulatorem serca pomocne jest zapoznanie się z legitymacją stymulatora.
2. W przypadku rytmu własnego, o częstości wyższej od zaprogramowanej,
w stymulatorze pracę urządzenia można „wymusić” przyłożeniem nad sty-
mulator magnesu.
3. Przy podejrzeniu nieprawidłowego działania urządzenia, pacjenta należy
skierować do Ośrodka Kontroli Stymulatorów.
Warto przeczytać:
G. Gregoratos, M. Cheitlin, A. Conill et al.: ACC/AHA guidelines for
implantation of cardiac pacemakers and antiarrhythmia devices. A report of
the American College of Cardiology/American Heart Association Task Force
on Practice Guidelines (Committee on Pacemaker Implantation). J. Am.
Coll. Cardiol. 1998, 31: 1175-1209.
D. Hayes, D. Zipes: Cardiac Pacemakers and Cardioverter-Defibrillators.
Heart Disease. E. Braunwald (red.), 6th edition, W.B. Saunders Company,
Philadelphia 2001.
H.L. Kennedy: Use of long term (Holter) elektrocardiography recordings.
Cardiac electrophysiology: from cell to bedside. D.P. Zipes, J. Jalife (red.),
3rd edition, W.B. Saunders Company, Philadelphia 2000.
T. Lee: Guidelines: Use of Cardiac Pacemakers and Antiarrhytmia Devices.
Heart Disease. E. Braunwald (red.), 6th edition, W.B. Saunders Company,
Philadelphia 2001.
W. Mojkowski: Kliniczne wskazania do leczenia stałą stymulacją serca.
Groźne dla życia zaburzenia rytmu i przewodzenia. Medipress Kardiologia.
tom 2, nr 5, 1995: 2-7.
196

G. Świątecka, K. Bieganowska, W. Kargul, Z. Kornacewicz-Jach, A. Kutarski,
E. Lewicka-Nowak, A. Lubiński, W. Musiał, W. Piwowarska, F. Prochaczek,
Z. Sadowski, M. Trusz-Gluza, F. Walczak, D. Wojciechowski: Standardy
postępowania w elektroterapii serca. Folia Card. 1999, 1 (supl. 1) 1-13.
M. Trusz-Gluza, A. Dąbrowski, Z. Kornacewicz-Jach, P. Kułakowski,
M. Markiewicz, W. Musiał, G. Świątecka, G. Opolski, A. Torbicki, F. Walczak,
A. Wnuk-Wojnar: Komorowe zaburzenia rytmu serca. Kardiol. Pol. 1997; 46,
(supl. 1): 34-50.
G. Świątecka, K. Bieganowska, W. Kargul, Z. Kornacewicz-Jach, A. Kutarski,
E. Lewicka-Nowak, A. Lubiński, W. Musiał, W. Piwowarska, F. Prochaczek,
Z. Sadowski, M. Trusz-Gluza, F. Walczak, D. Wojciechowski: Standardy
postępowania w elektroterapii serca. Folia Card. 1999, 1 (supl. 1) 52-58.
F. Walczak, R. Kępski: Stymulator – przyjaciel twojego serca. PZWL, Warszawa
1995.
D.P. Zipes, W.M. Miles: Assesment of the patient with a cardiac arrhythmias.
Cardiac Electrophysiology: from cell to bedside. D.P. Zipes, J. Jalife (red.),
3rd edition, W.B. Saunders Company, Philadelphia 2000.
197

Wyszukiwarka
Podobne podstrony:
Kardiologia praktyczna 4 Zaburzenia rytmu serca (2)
Seminarium 10. - Zaburzenia rytmu serca i przewodnictwa, Medycyna, Pediatria, kardiologia
Komorowe zaburzenia rytmu serca- standardy, Kardiologia
Nadkomorowe zaburzenia rytmu serca- standardy, Kardiologia
ZABURZENIA RYTMU SERCA, fizjoterapia, fizjoterapia w kardiologii i chirurgii naczyniowej
Zaburzenia rytmu serca
Leki antyarytmiczne i leczenie zaburzeń rytmu serca
Komorowe i nadkomorowe zaburzenia rytmu serca
ZABURZENIA RYTMU SERCA I ZABURZENIA PRZEWODNICTWA MR
Zaburzenia rytmu serca[1], badania fizykalne
Zaburzenia rytmu serca wykład
Zaburzenia rytmu serca (2)
KOMOROWE ZABURZENIA RYTMU SERCA
Leczenie Zaburzeń rytmu serca
więcej podobnych podstron