
Kurs podstawowy
Kurs podstawowy
Wykład 8
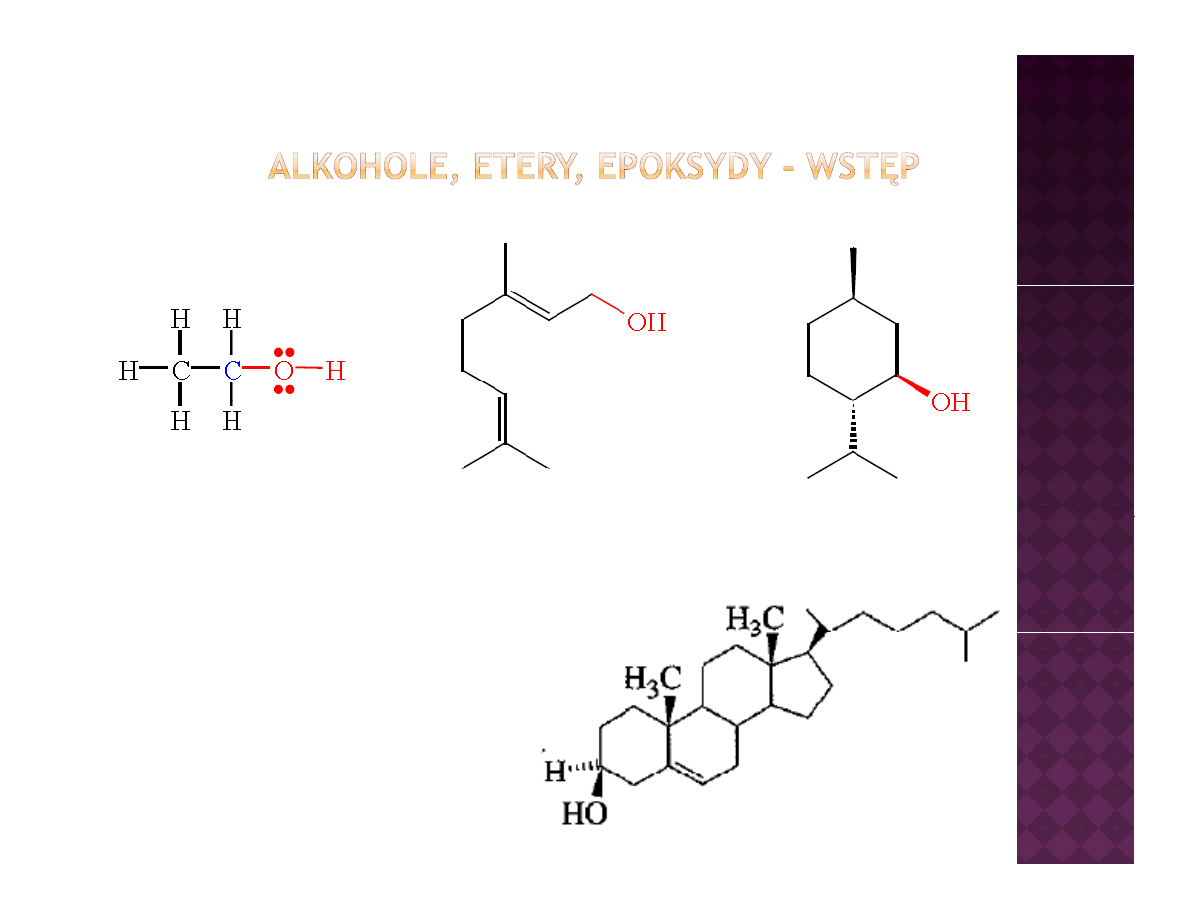
Etanol – siła
napędowa
ludzkości
Geraniol – zapach róż
Mentol – zapach mięty
Cholesterol –
zdemaskowany złoczyńca
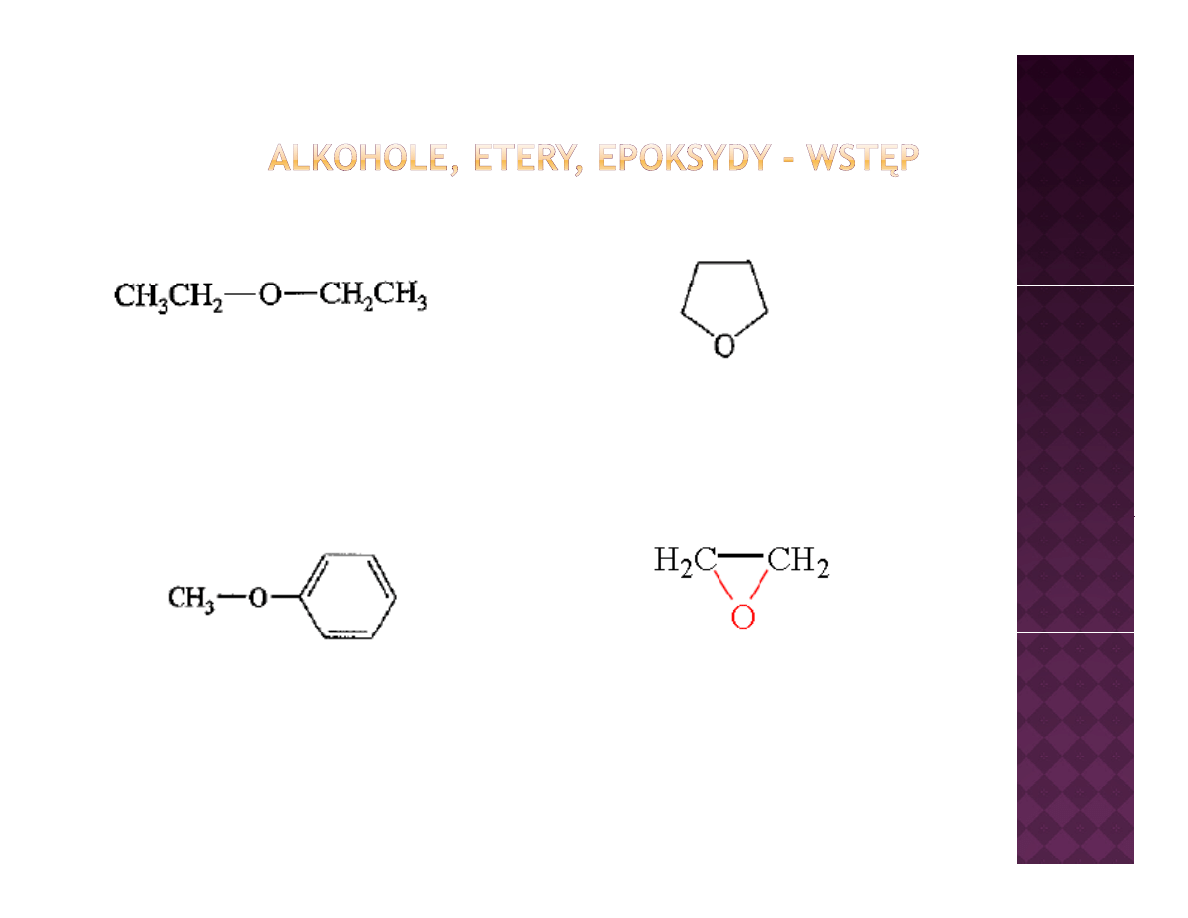
Eter dietylowy –
l ik d
i j
Tetrahydrofuran - rozpuszczalnik
rozpuszczalnik, dawniej
anestetyk
Tetrahydrofuran rozpuszczalnik
Anizol- składnik
olejku anyżowego
Tlenek etylenu – ważny
przemysłowy odczynnik chemiczny
olejku anyżowego
przemysłowy odczynnik chemiczny
O
O
O
O
O
O
O
O
O
O
Li
O
O
O
O
Na
O
O
O
O
K
O
O
O
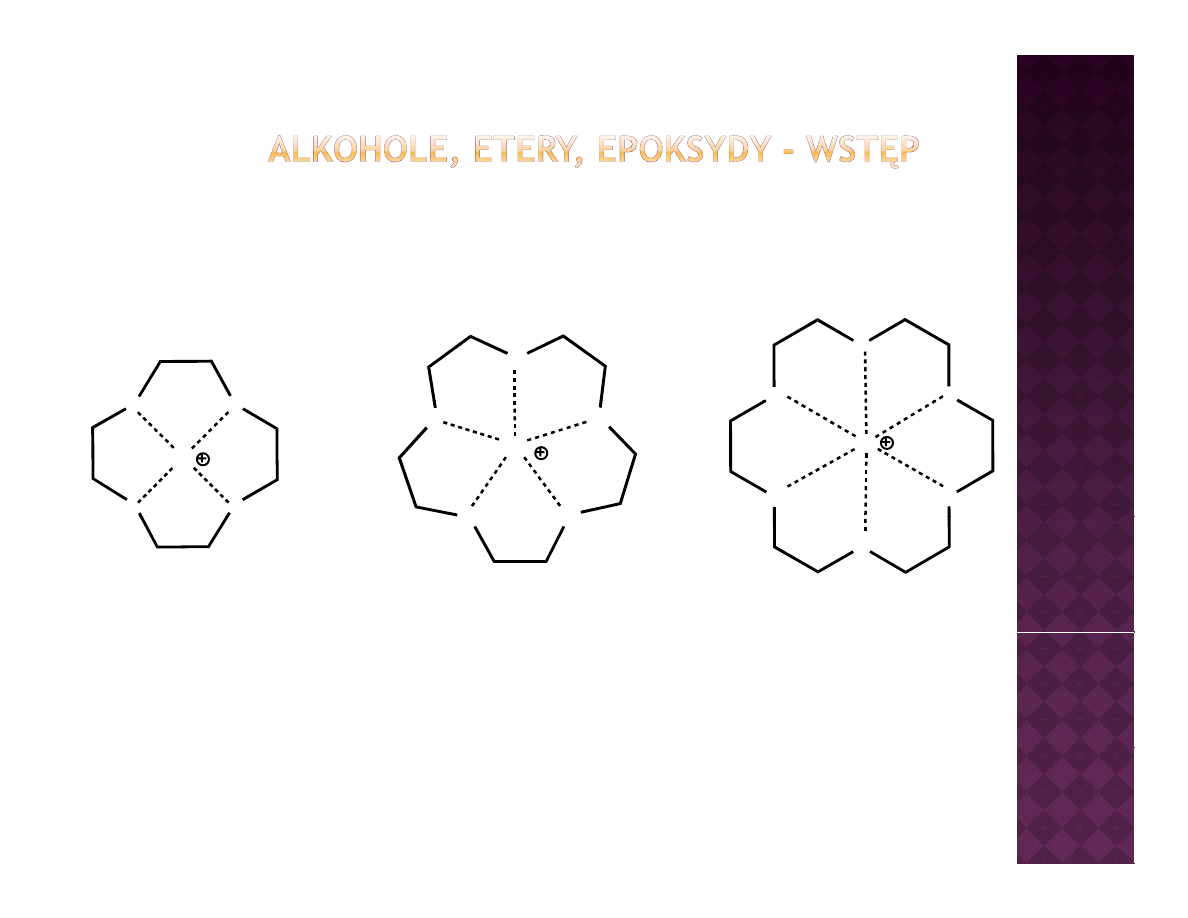
12 k
4
12-korona-4
15-korona-5
18-korona-6
Ze względu na swoją budowę, etery koronowe mogą selektywnie wiązać
jeden z kationów metali alkalicznych
jeden z kationów metali alkalicznych
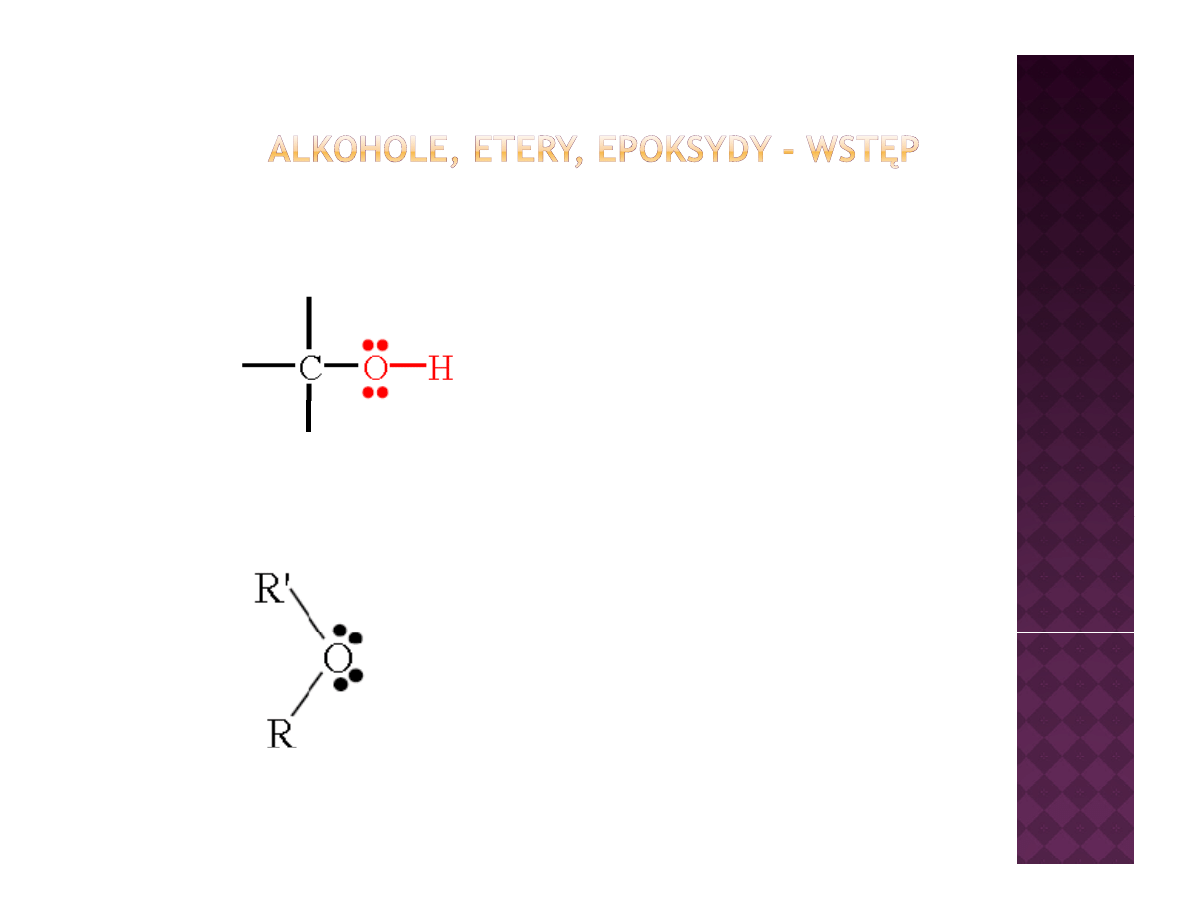
Cechą charakterystyczną dla wszystkich
alkoholi jest obecność grupy hydroksylowej
(OH) związanej z atomem węgla szkieletu
(
)
ą
j
ęg
węglowego
W eterach oraz epoksydach jest obecny
atom tlenu związany z dwoma resztami
węglowymi
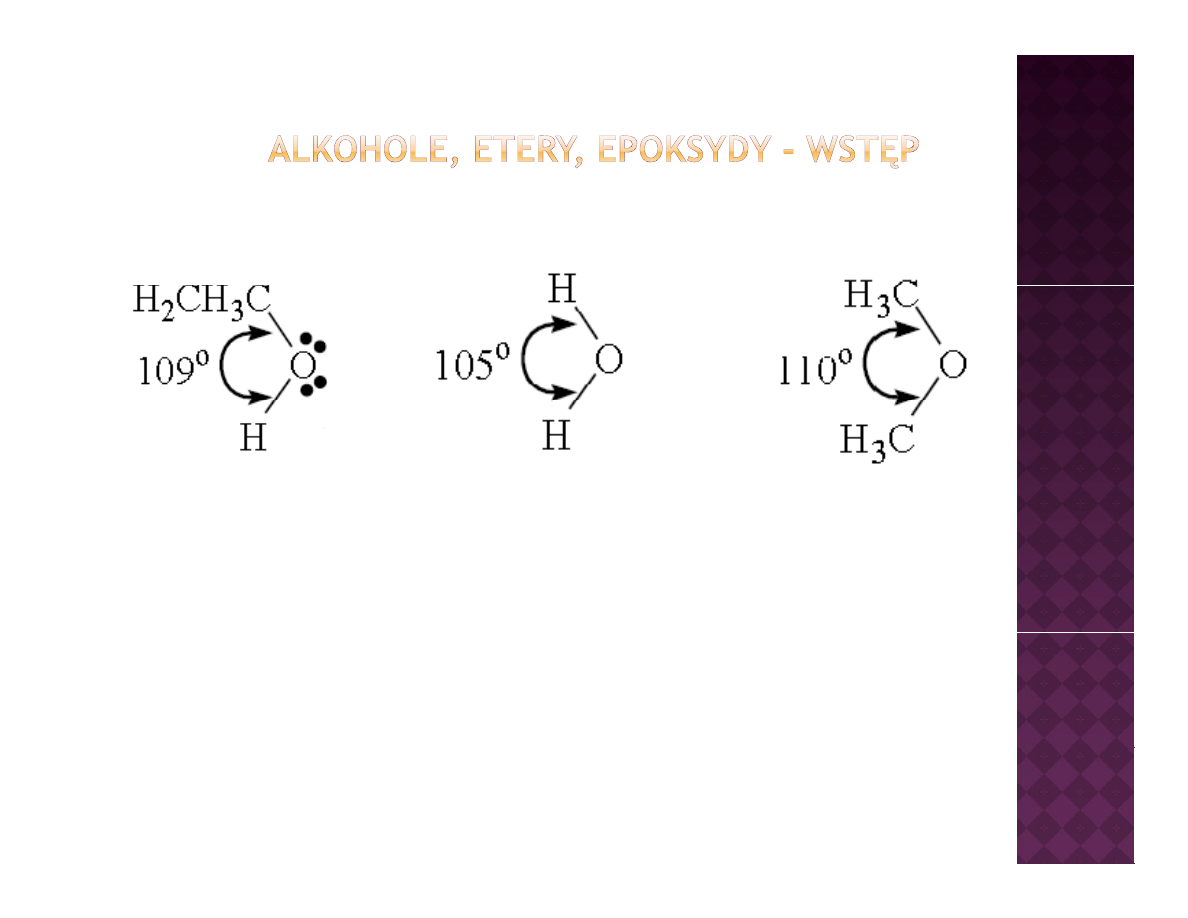
woda
etanol
eter dimetylowy
woda
etanol
eter dimetylowy
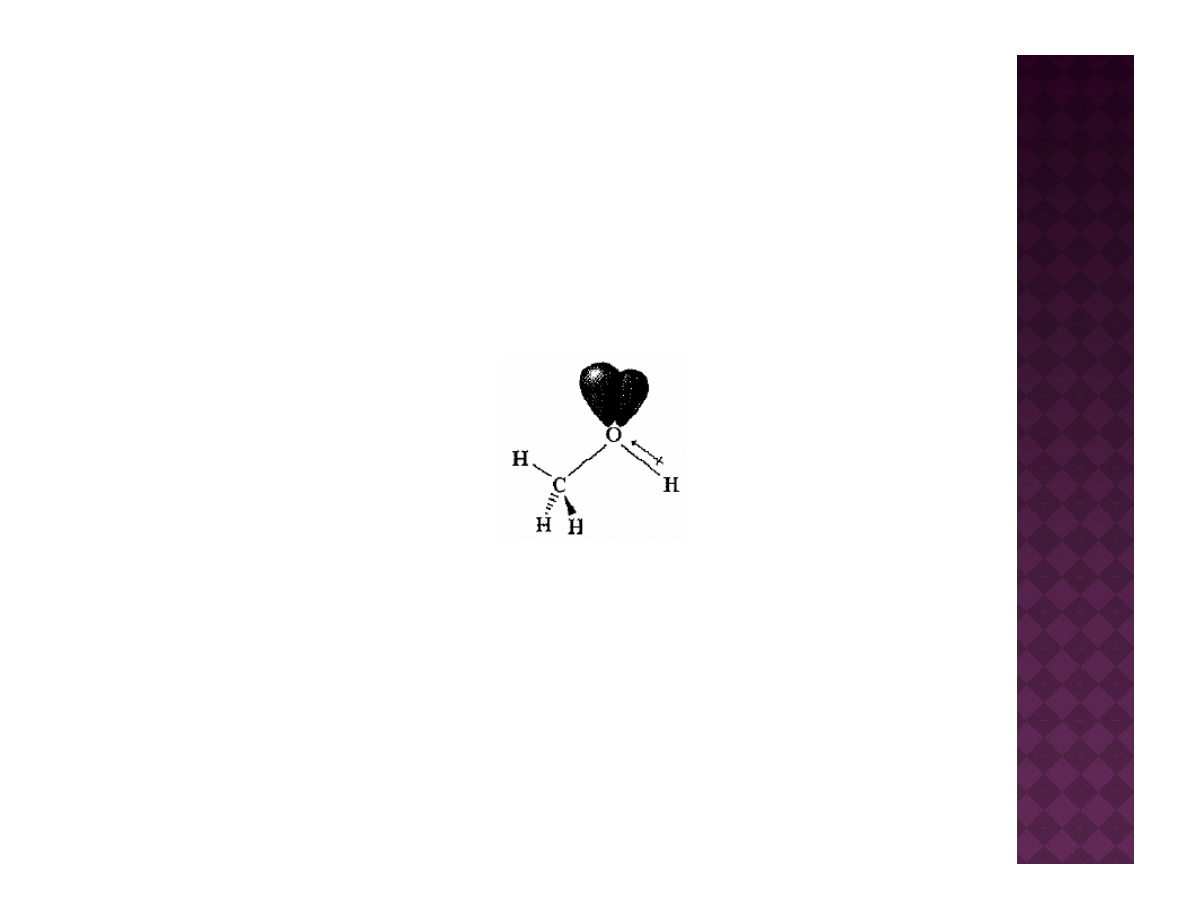
Zarówno w etanolu jak i w eterze dietylowym atom tlenu posiada
hybrydyzację sp
3
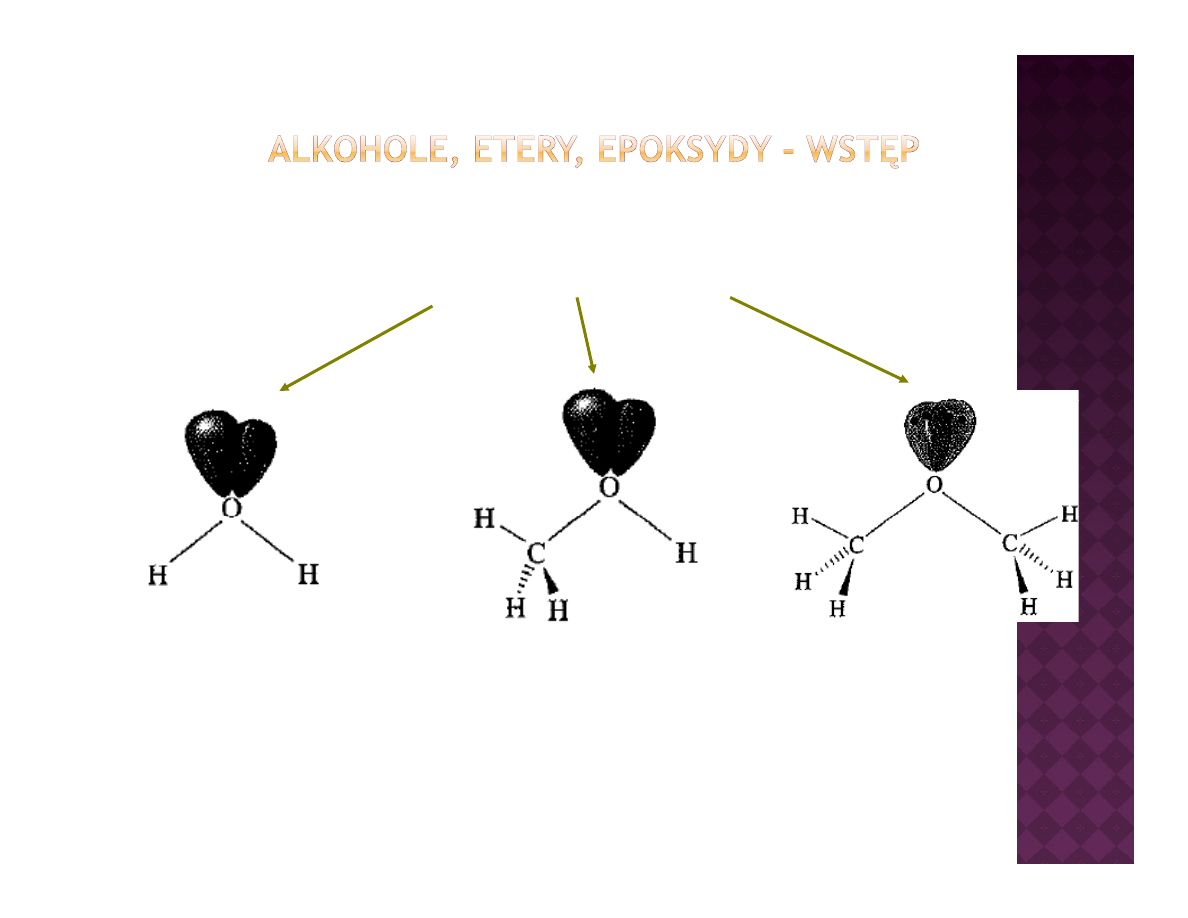
Wolne pary elektronowe
Elektroujemność: O > C > H
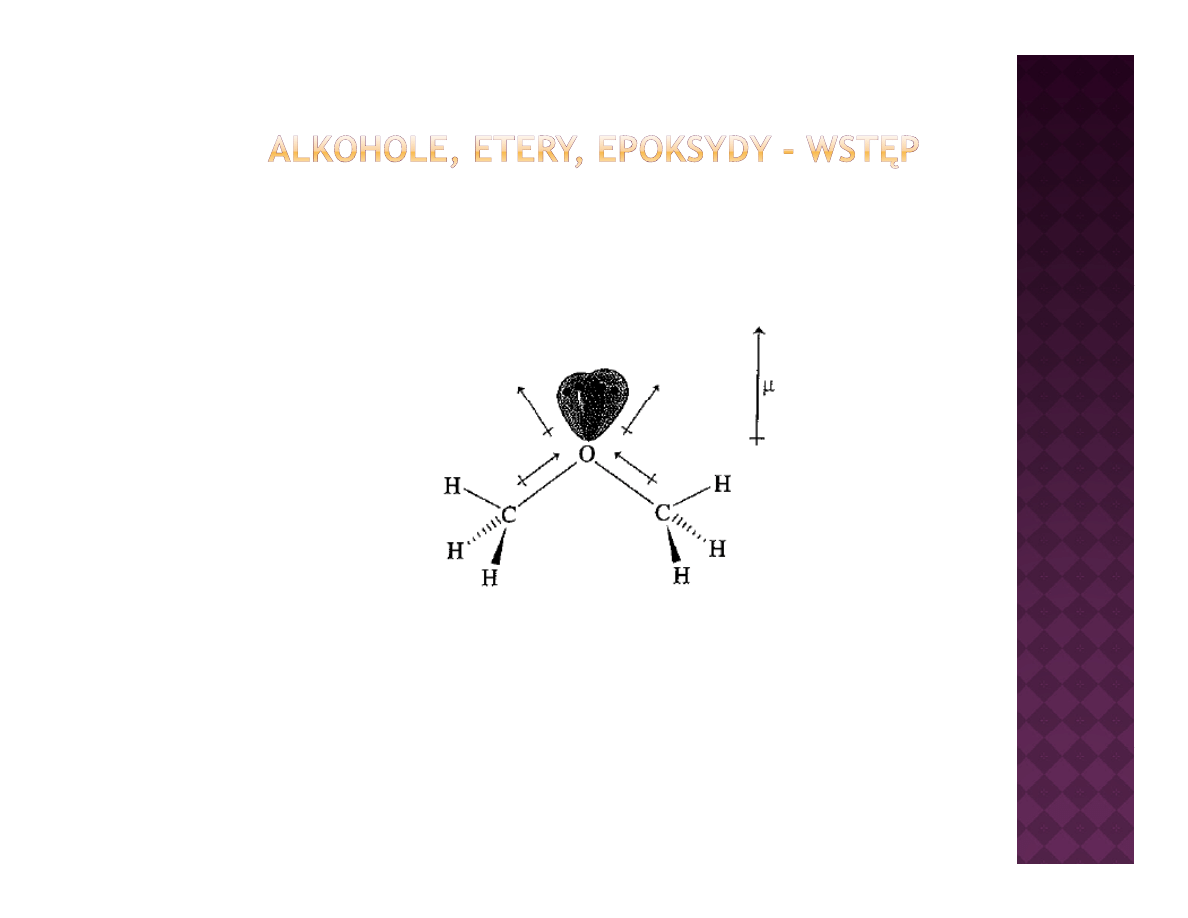
W alkoholach ma miejsce analogiczne przesunięcie ładunków, co w
konsekwencji prowadzi do tworzenia dipoli i powstawania momentu
dipolowego w cząsteczce
p
g
ą
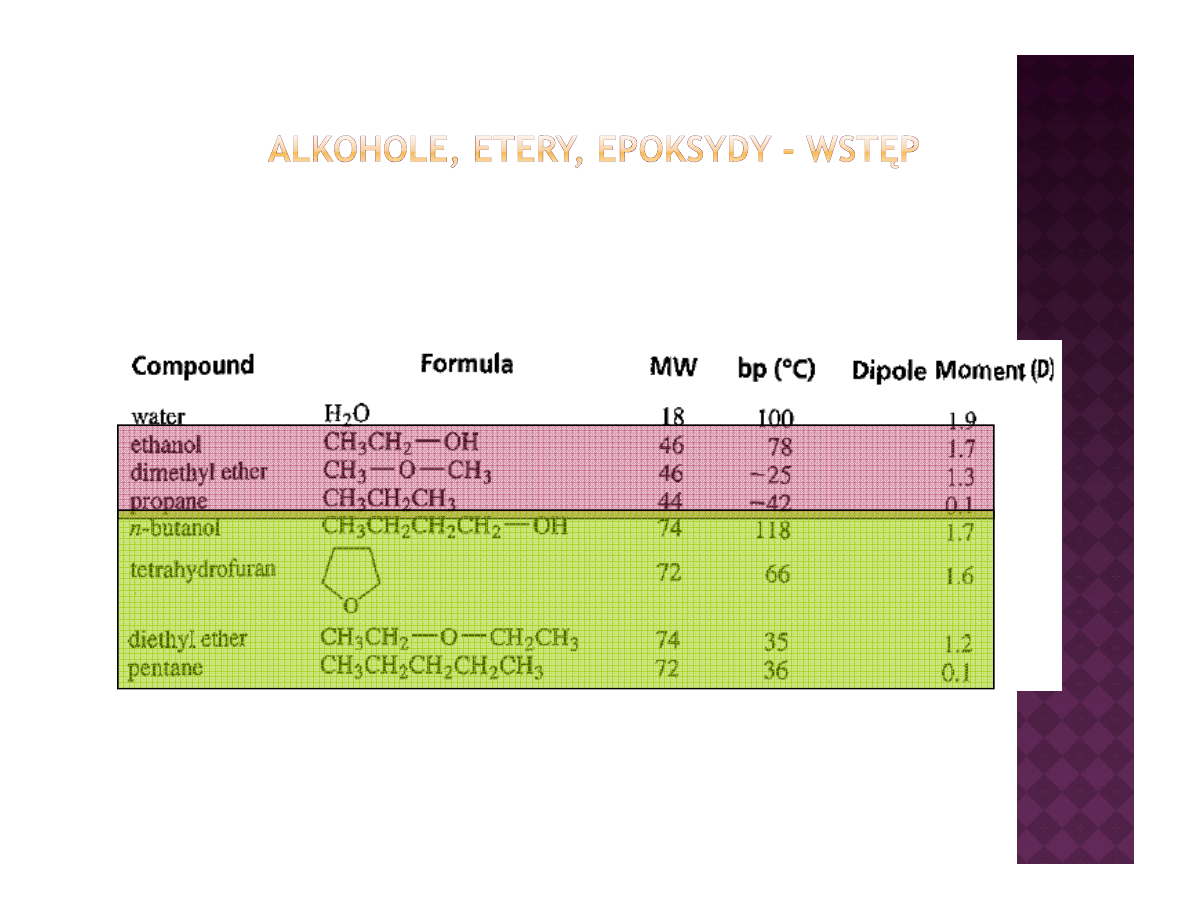
Porównanie właściwości fizykochemicznych alkoholi, eterów i
węglowodorów
ęg o odo ó
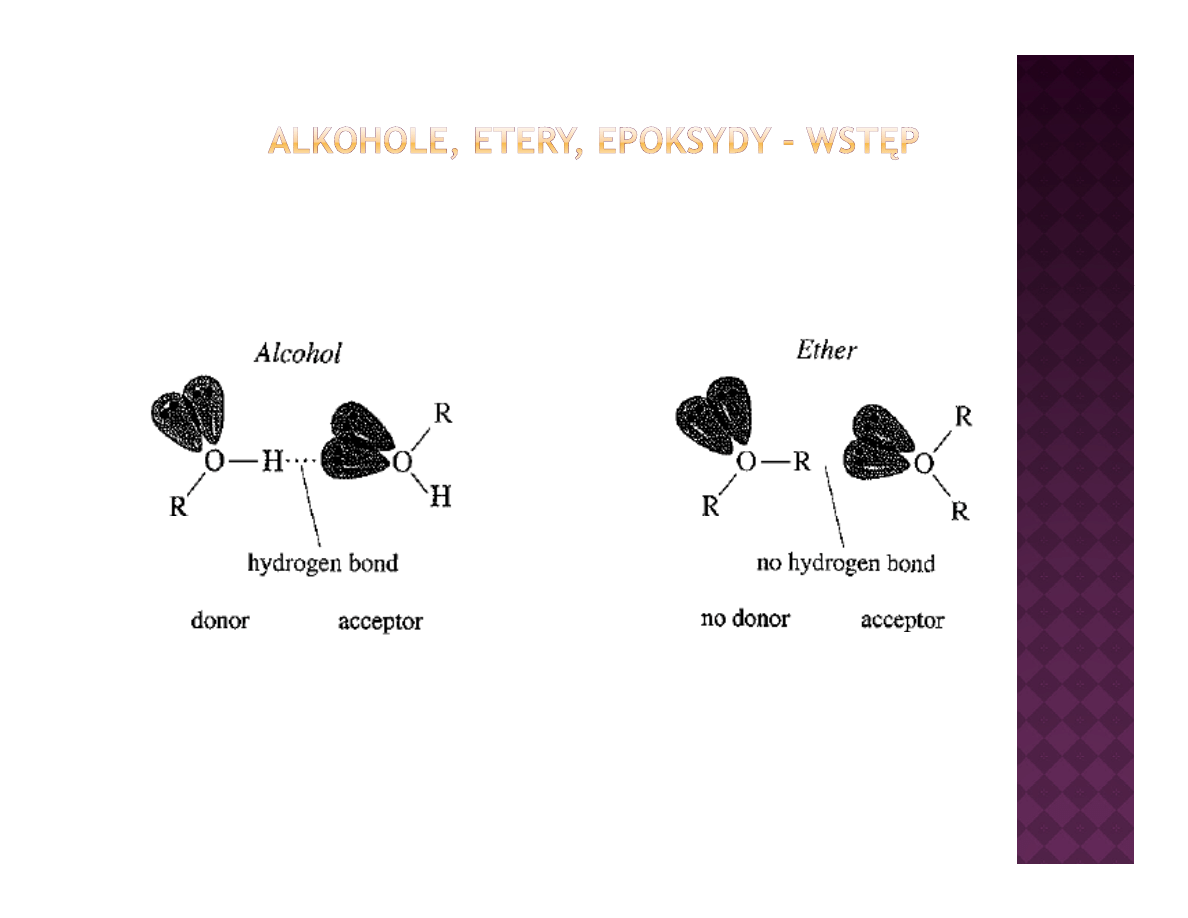
Obecność wiązań wodorowych, tworzących się pomiędzy protonem jednej
cząsteczki alkoholu a tlenem drugiej powoduje drastyczną zmianę
ą
g j p
j
y
ą
ę
właściwości fizykochemicznych w porównaniu do eterów
Alkohole, etery, epoksydy
Kwasowość alkoholi i fenoli
δ
+
δ
-
Większa elektroujemność atomu tlenu w porównaniu do atomu wodoru
Większa elektroujemność atomu tlenu w porównaniu do atomu wodoru
powoduje przesunięcie gęstości elektronowej od atomu wodoru w stronę
atomu tlenu. Powoduje to powstawanie cząstkowego dodatniego ładunku na
atomie wodoru oraz ogólne obniżenie pKa alkoholi.
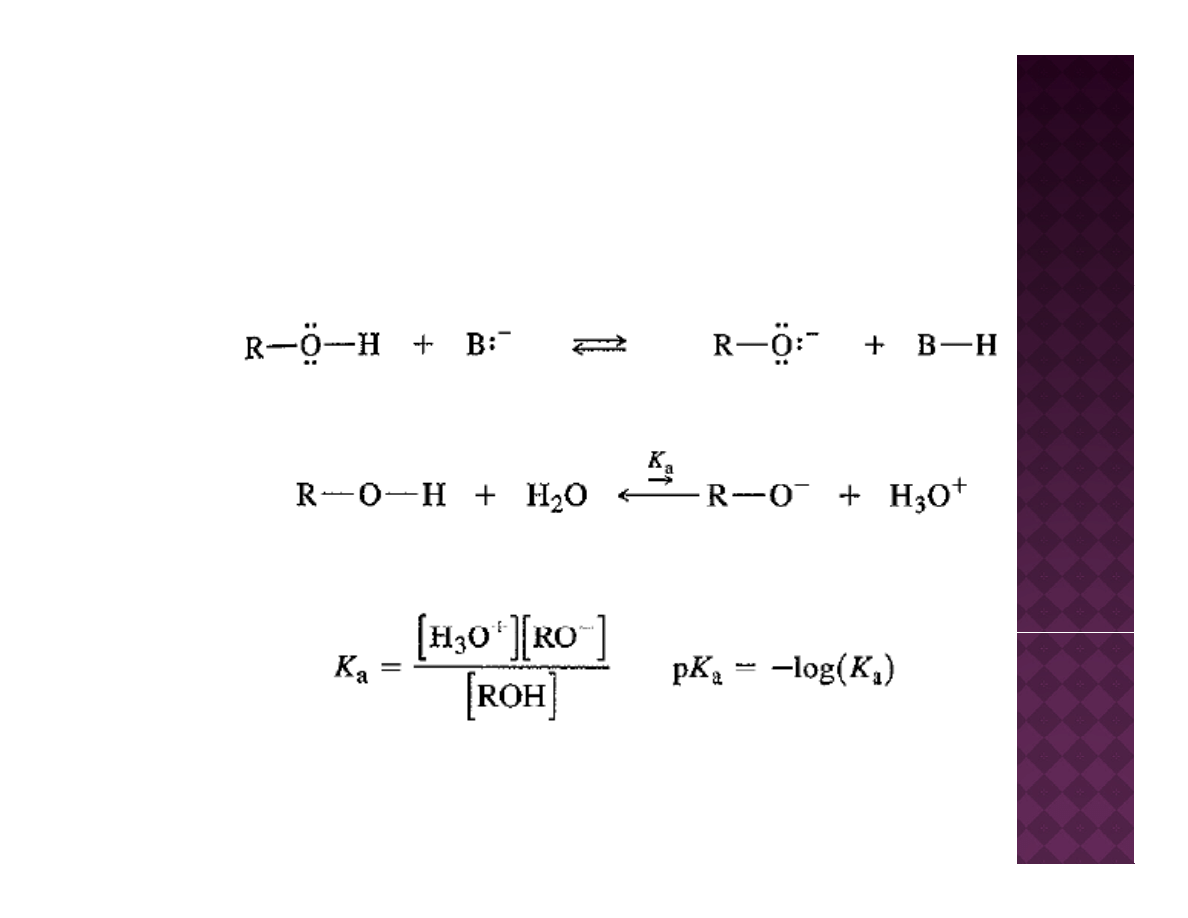
Alkohole, etery, epoksydy
Kwasowość alkoholi i fenoli
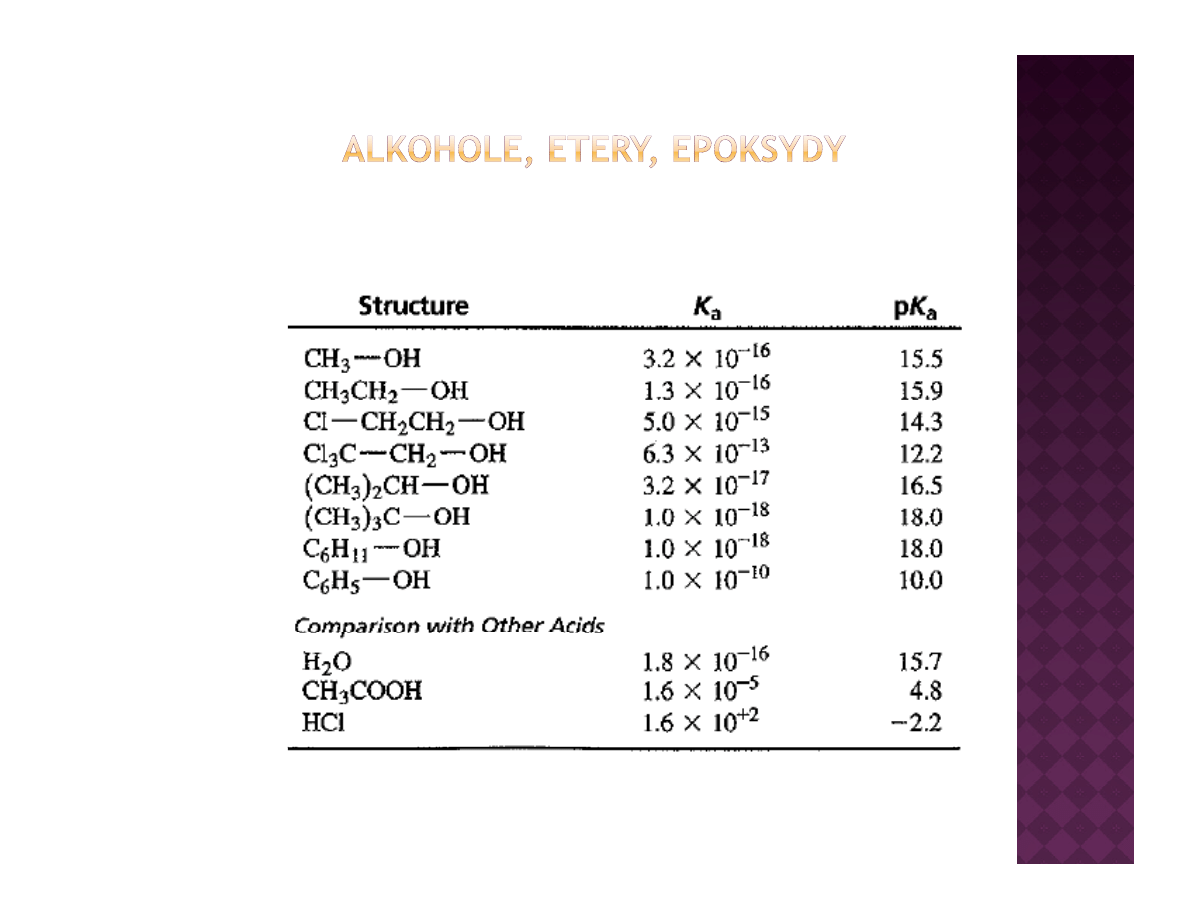
Kwasowość alkoholi i fenoli
Jaka korzyść płynie z kwasowości alkoholi?
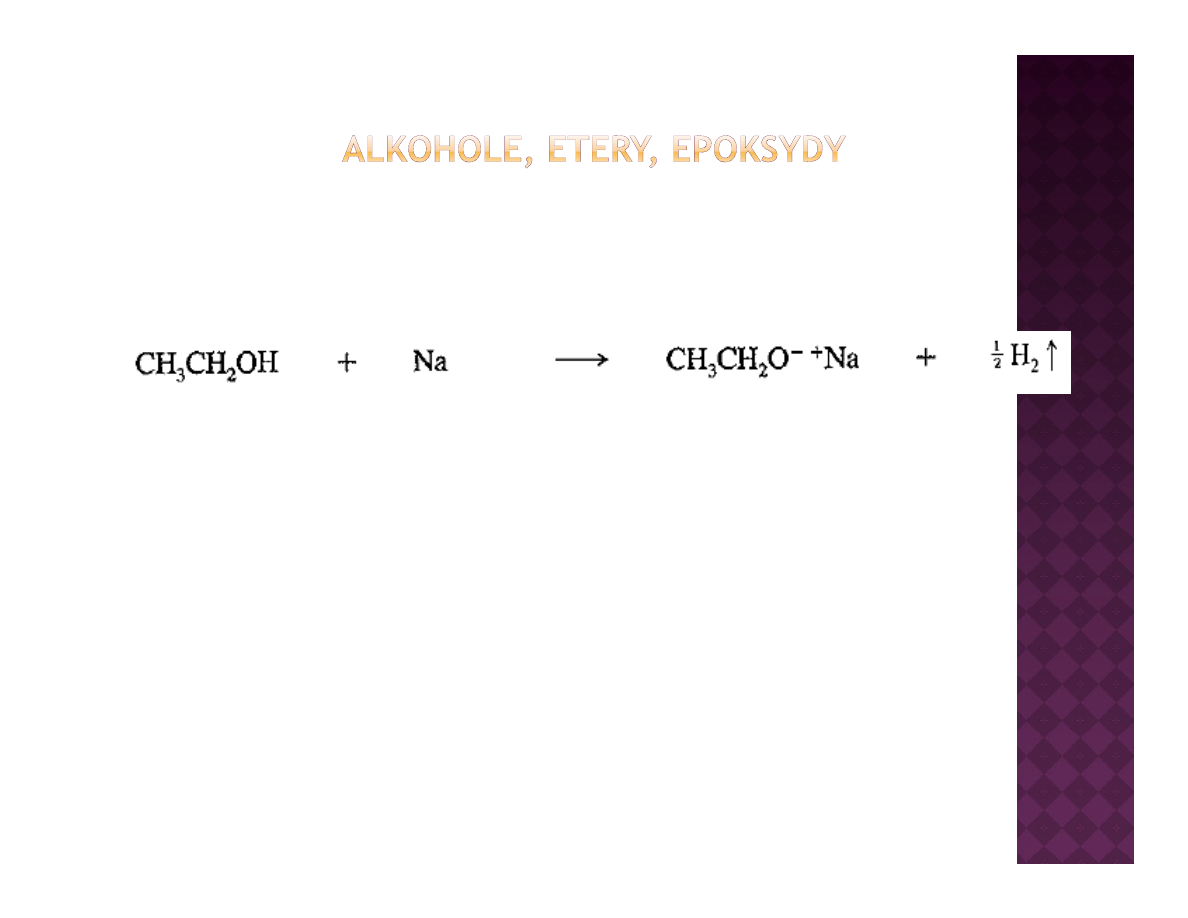
Kwasowość alkoholi i fenoli
Obecność kwaśnego protonu w alkoholu daje możliwość jego trwałego
usunięcia z utworzeniem alkoholanu. Alkoholan może być użyty jako
nukleofil bądź zasada w zależności od potrzeb
nukleofil bądź zasada, w zależności od potrzeb
Im niższe pKa alkoholu, tym łatwiej się tworzą alkoholany w reakcji
Im niższe pKa alkoholu, tym łatwiej się tworzą alkoholany w reakcji
alkoholu z metalem alkalicznym
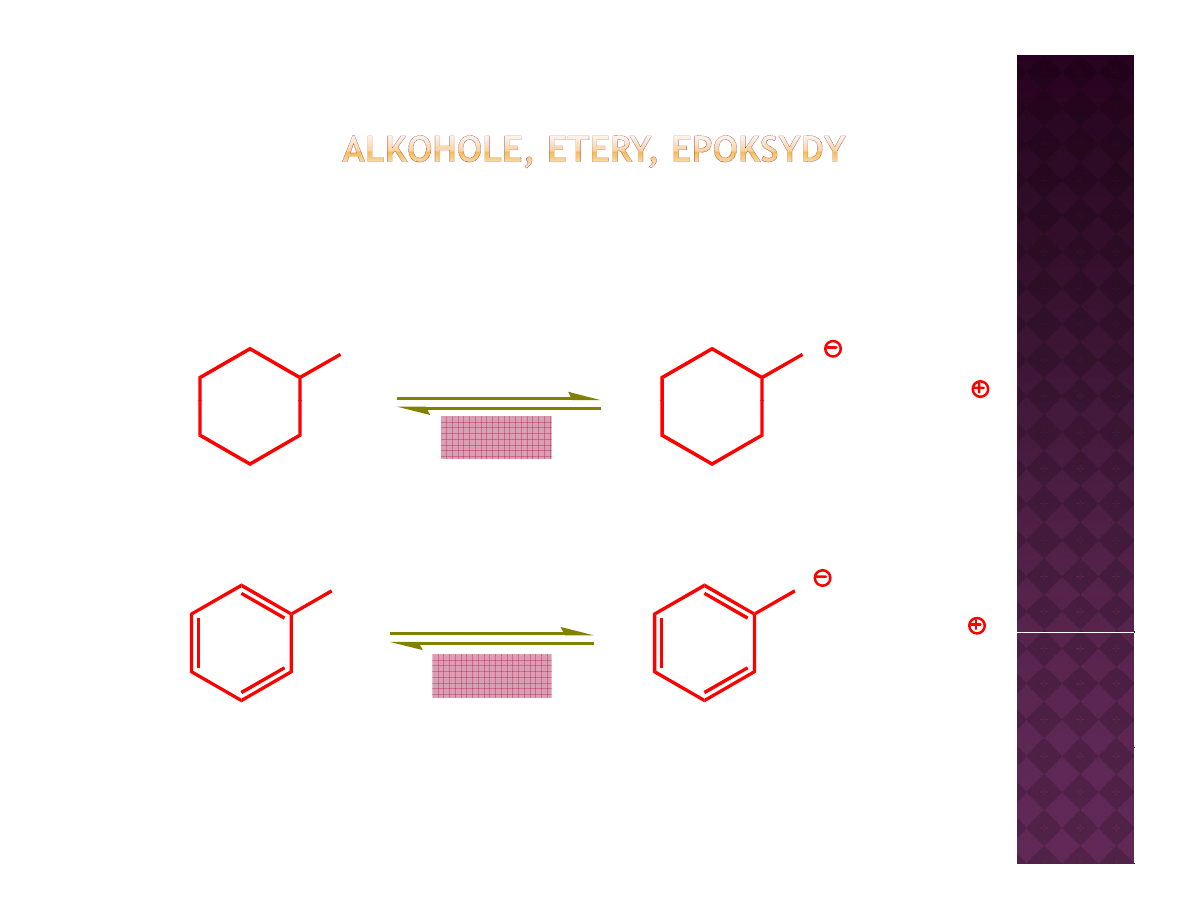
Kwasowość fenoli
OH
H
2
O
O
+
H O
+
H
3
O
pKa = 18
H
2
O
OH
O
pKa = 10
+
H
3
O
Skąd taka różnica w kwasowości?
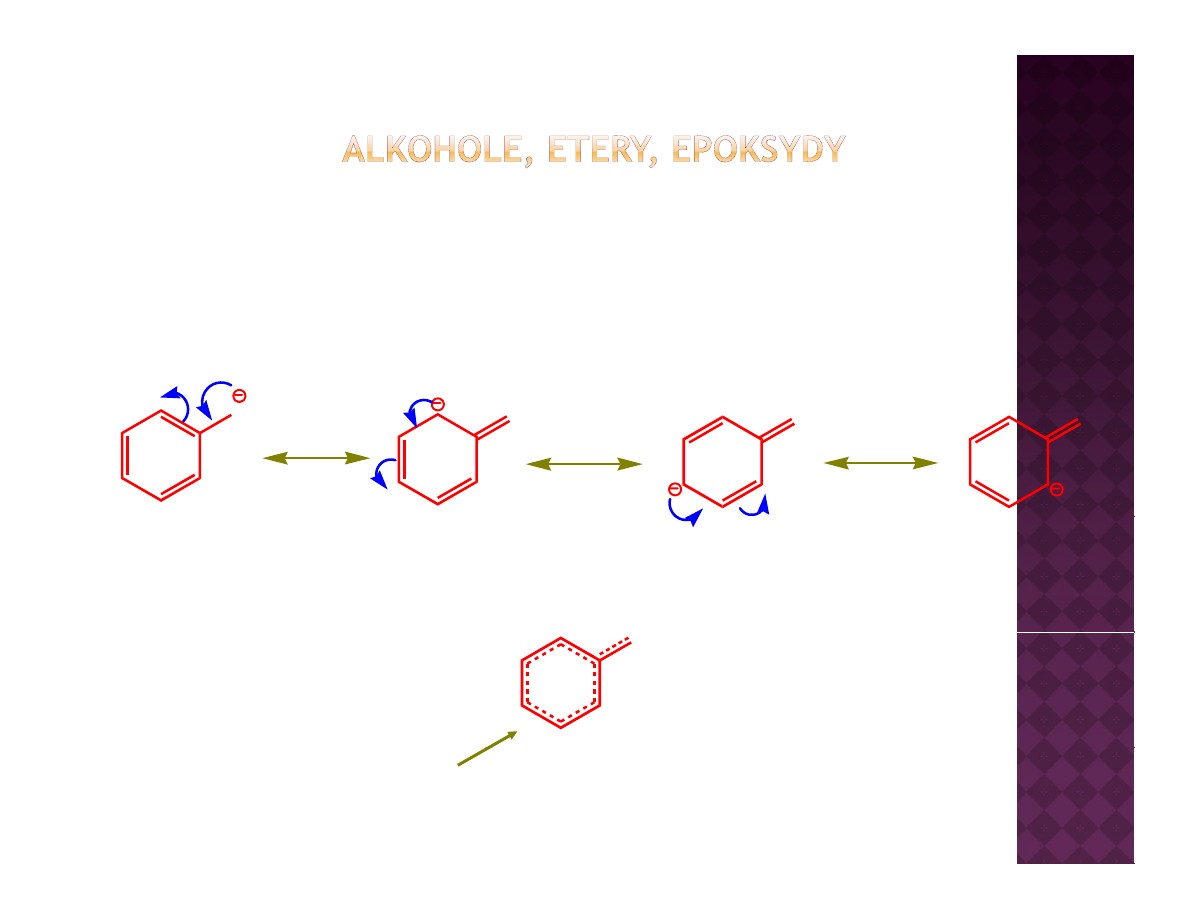
Kwasowość fenoli
O
O
O
O
O
Ładunek ujemny zdelokalizowany na całą cząsteczkę
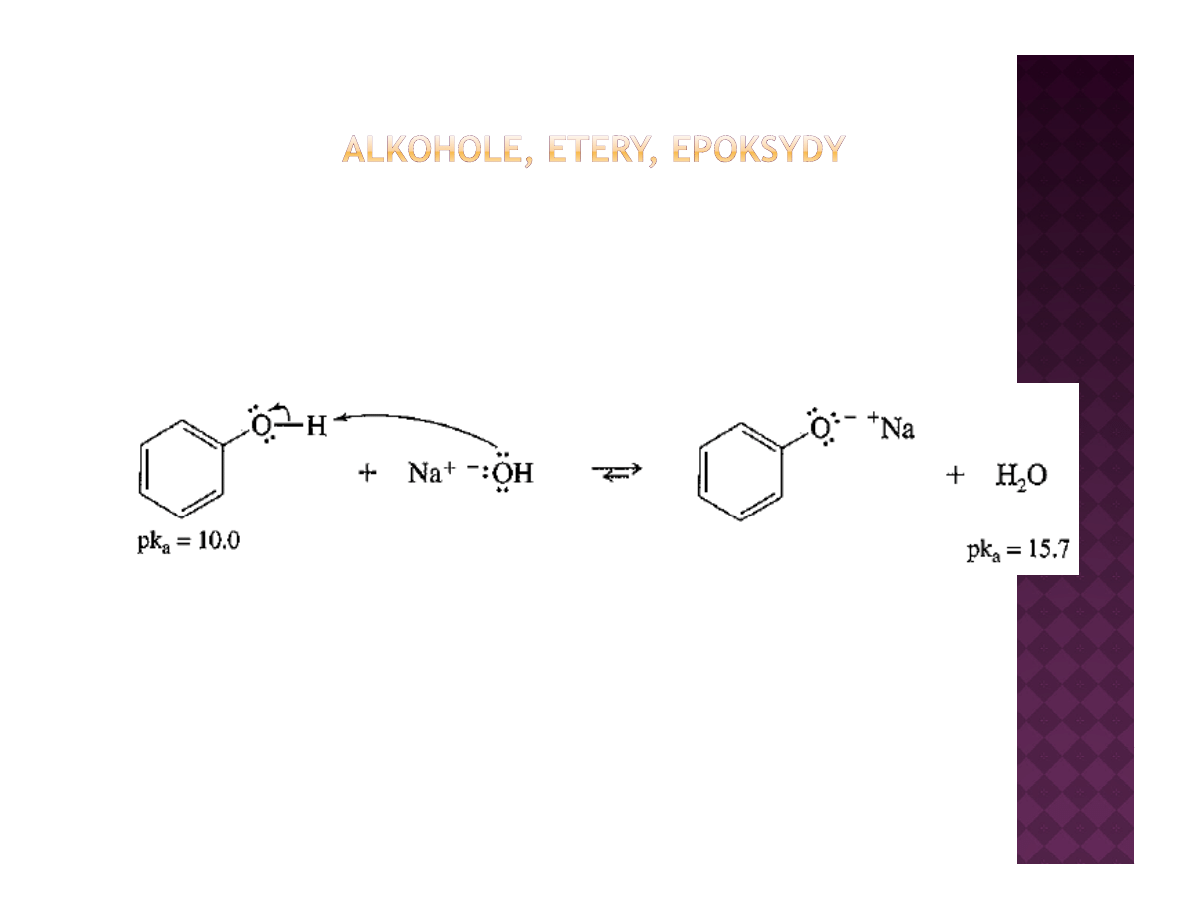
Kwasowość fenoli

Dla prostych alkoholi
Tradycyjna: alkohol etylowy
IUPAC: etanol
OH
IUPAC: etanol
OH
Tradycyjna: alkohol amylowy
IUPAC: 1-pentanol
Tradycyjna: alkohol izoamylowy
OH
IUPAC: 3-metylo-1-butanol
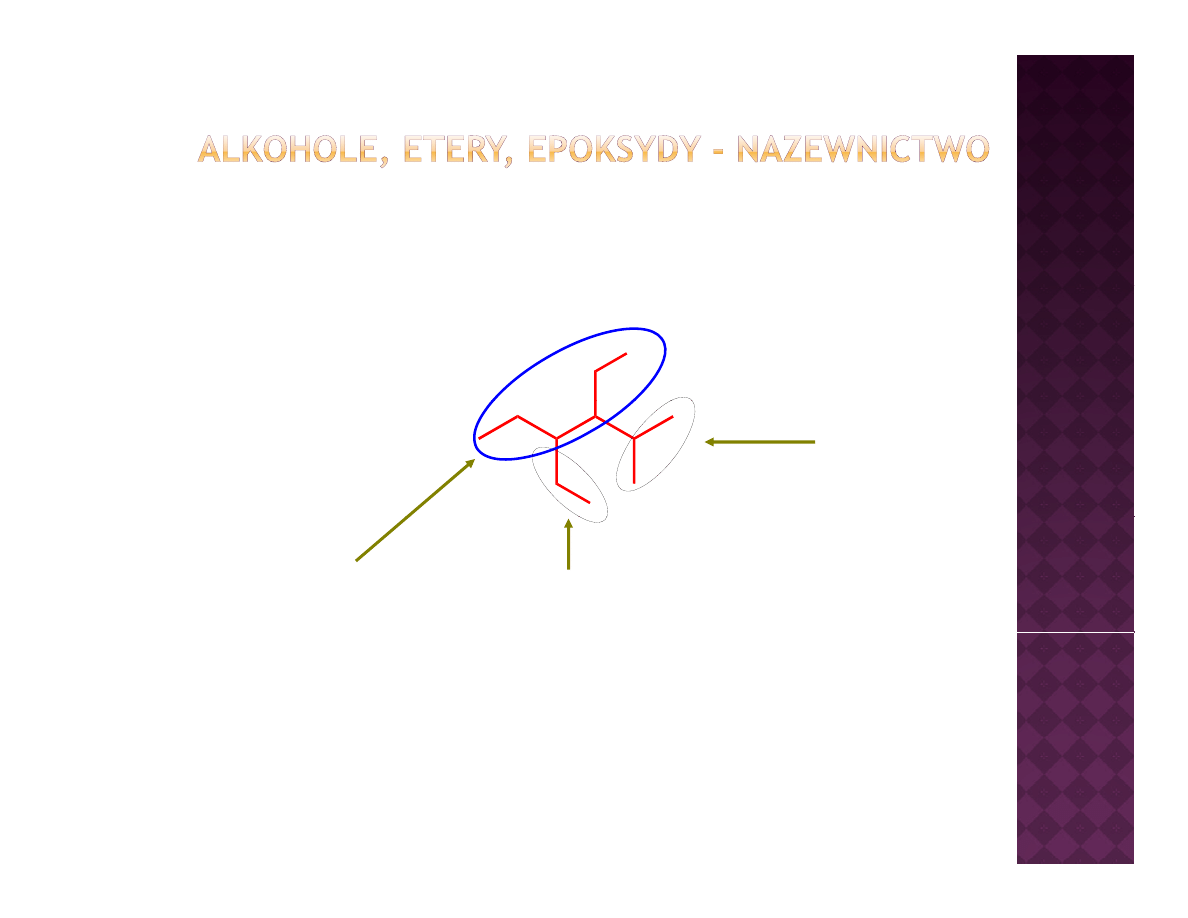
Dla złożonych alkoholi
Dla złożonych alkoholi
OH
I
Podstawnik
(izopropyl)
Najdłuższy łańcuch
Podstawnik
(jodometylo)
3 (j d
t l ) 2 i
l
t
1 l
3-(jodometylo)-2-i-propylopentan-1-ol
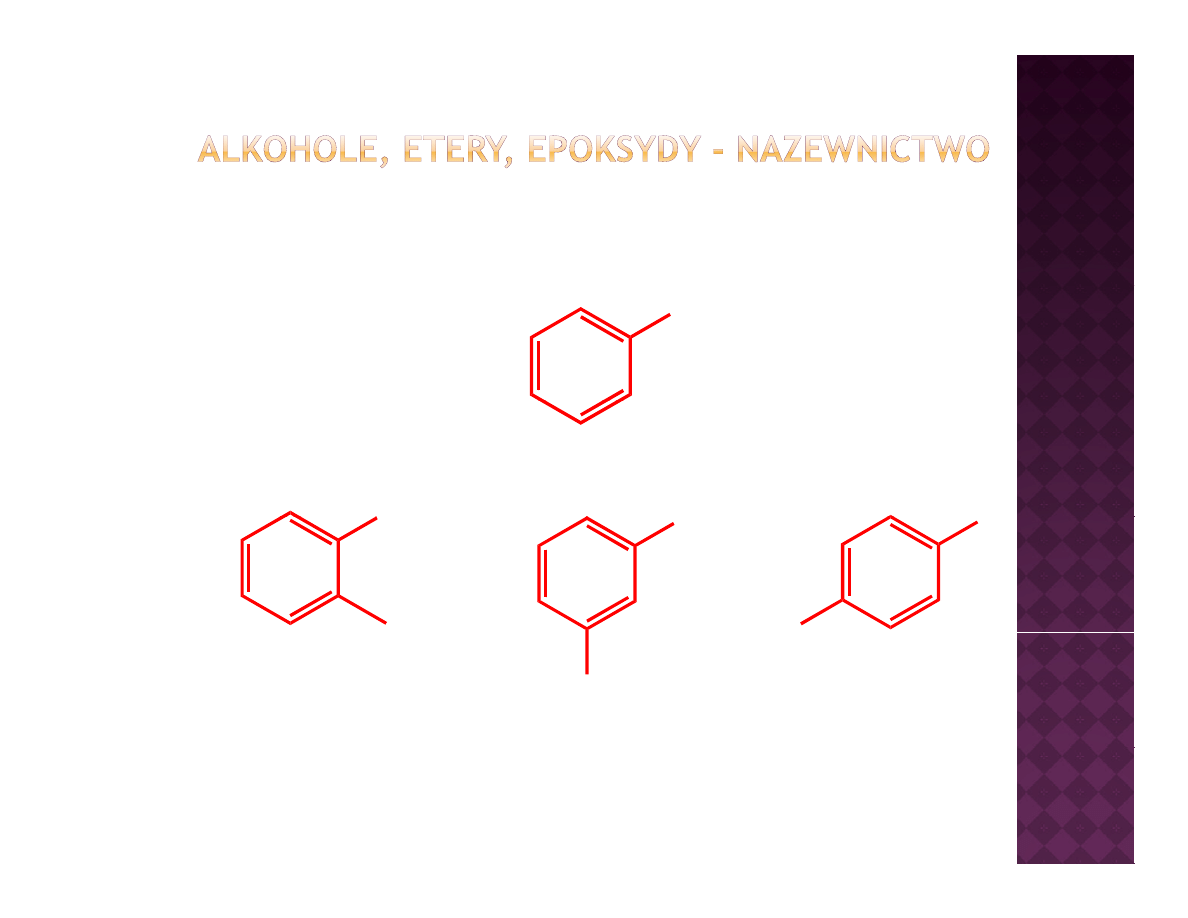
Fenole
-
nazewnictwo
OH
fenol
OH
OH
OH
OH
OH
OH
I
NO
2
I
IUPAC
2-metylofenol
3-nitrofenol
4-jodofenol
tradycyjnie
orto
-krezol
y
meta
-nitrofenol
j
para
-jodofenol
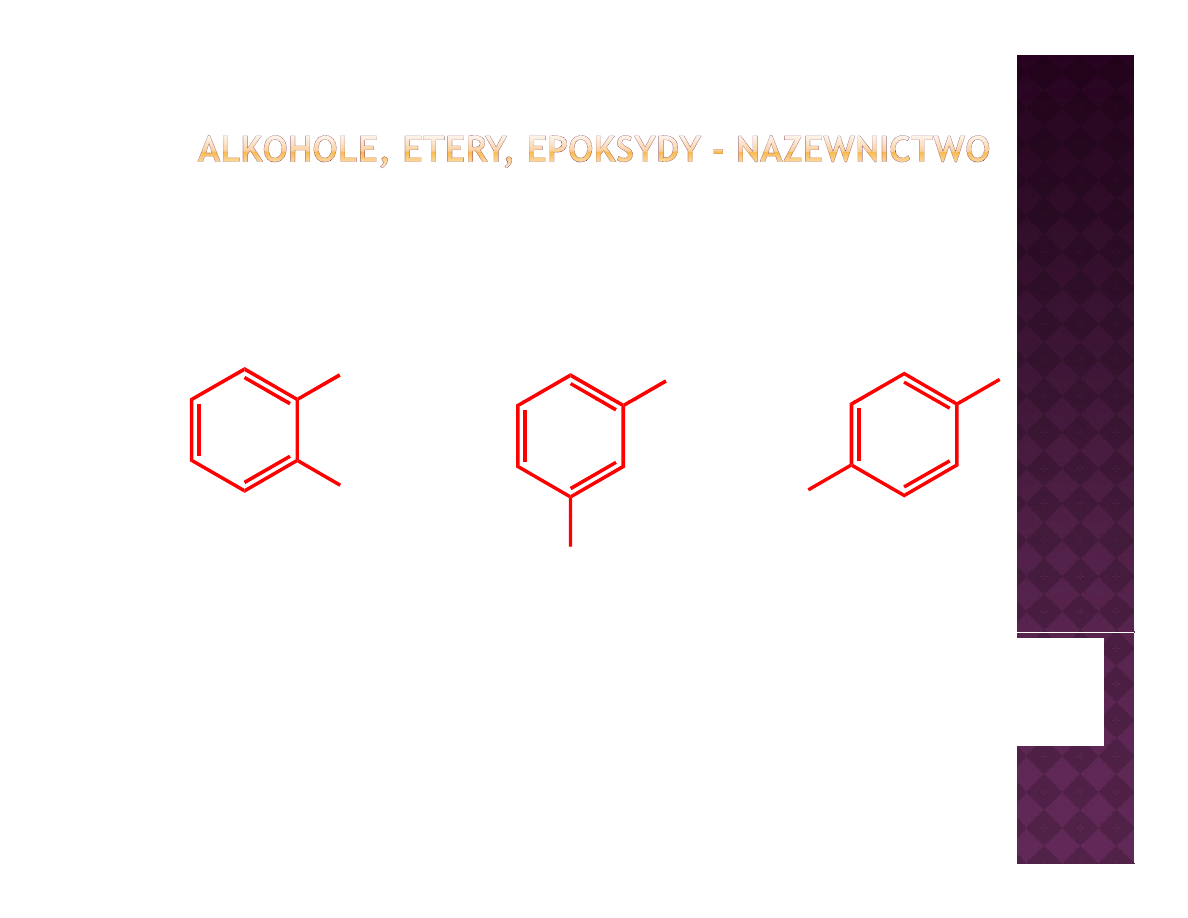
Fenole
OH
OH
OH
OH
HO
OH
Katechol – wartościowy
odczynnik chemiczny
Rezorcynol – składnik
wielu związków
biologicznie aktywnych
Hydrochinon – utleniacz,
wykorzystywany w
fotografii
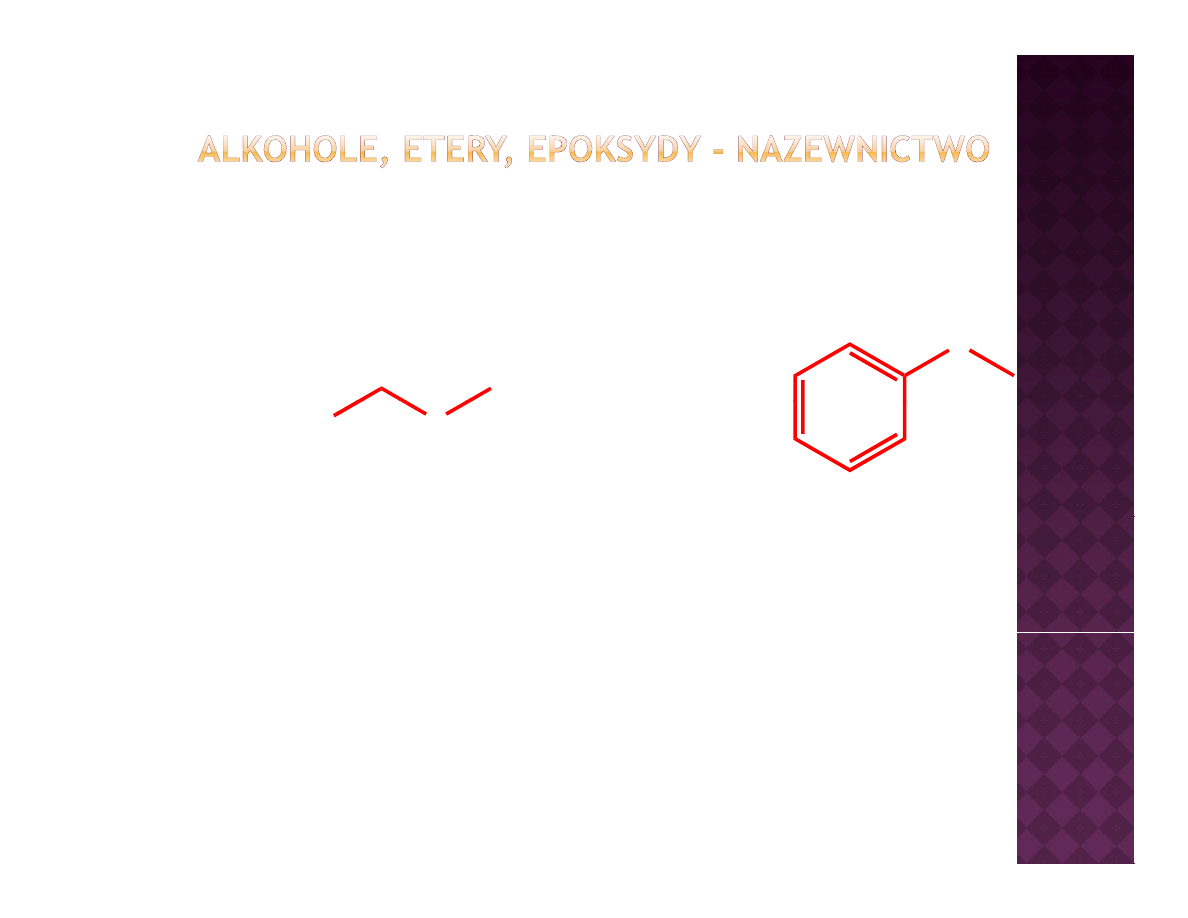
Etery - nazewnictwo
O
Cl
O
IUPAC
chlorometoksymetan
metoksybenzen
tradycyjnie
eter metylowo-chlorometylowy
eter metylowo-fenylowy
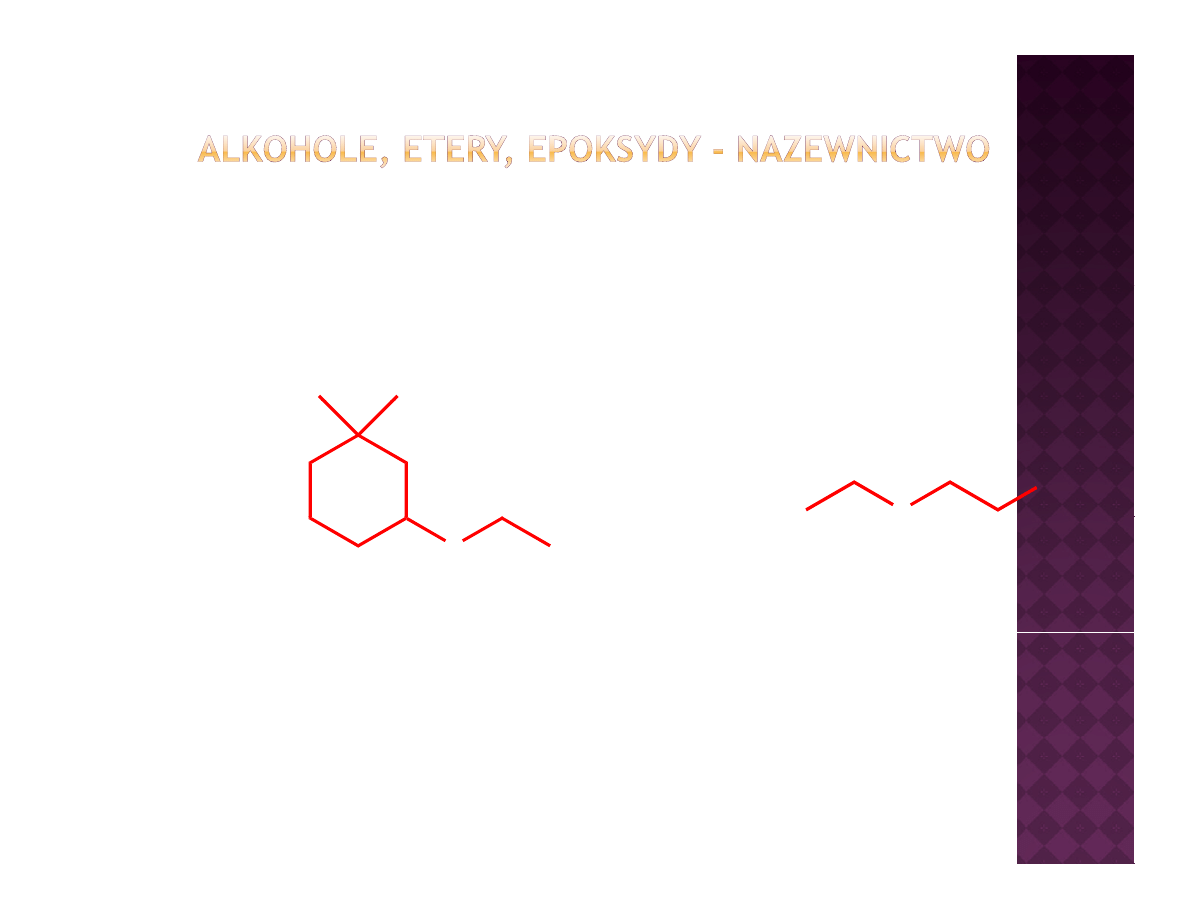
Etery - nazewnictwo
O
OH
O
O
IUPAC
1,1-dimetylo-3-etoksycykloheksan
2-etoksyetanol
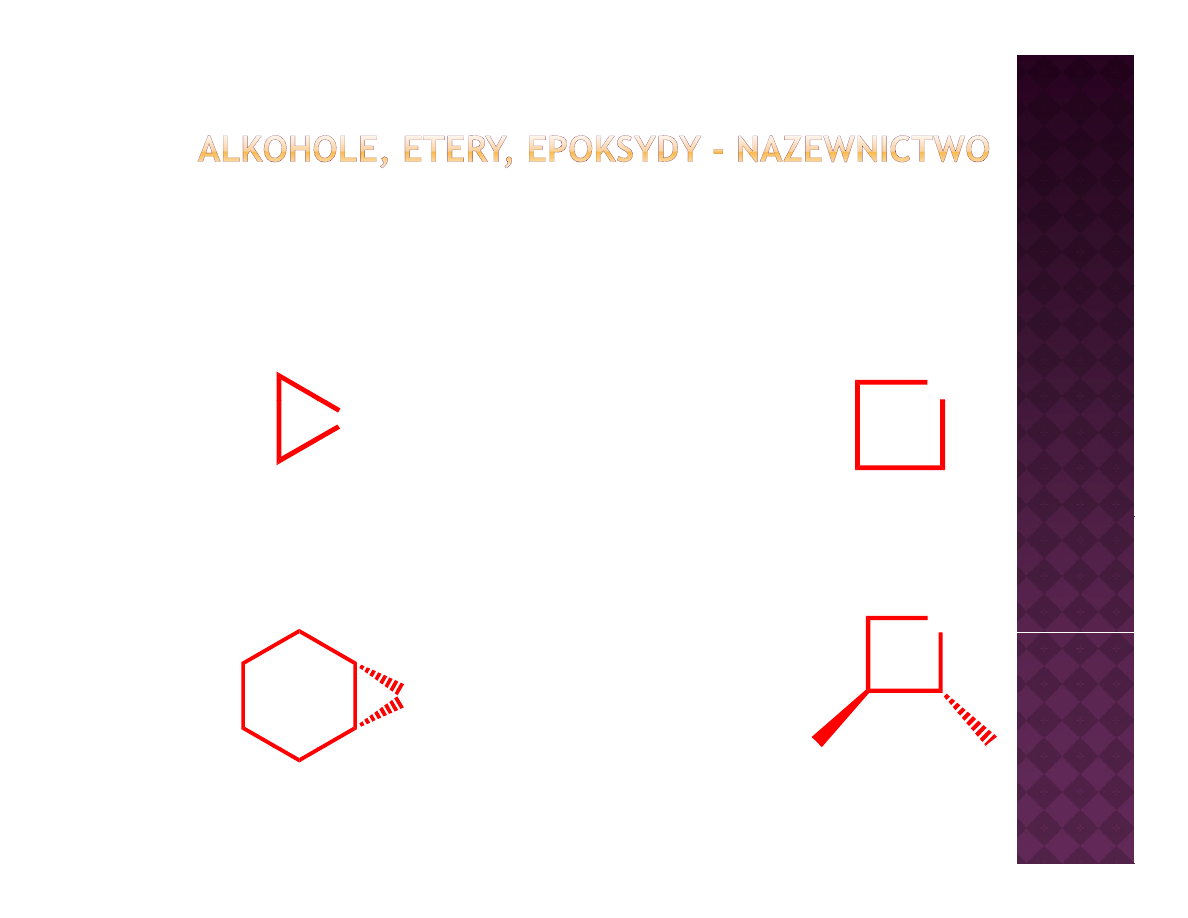
Etery cykliczne - nazewnictwo
O
O
epoksyd
oksiran
IUPAC
oksetan
IUPAC
O
O
tlenek cykloheksylu
trans
-2,3-dimetylooksetan
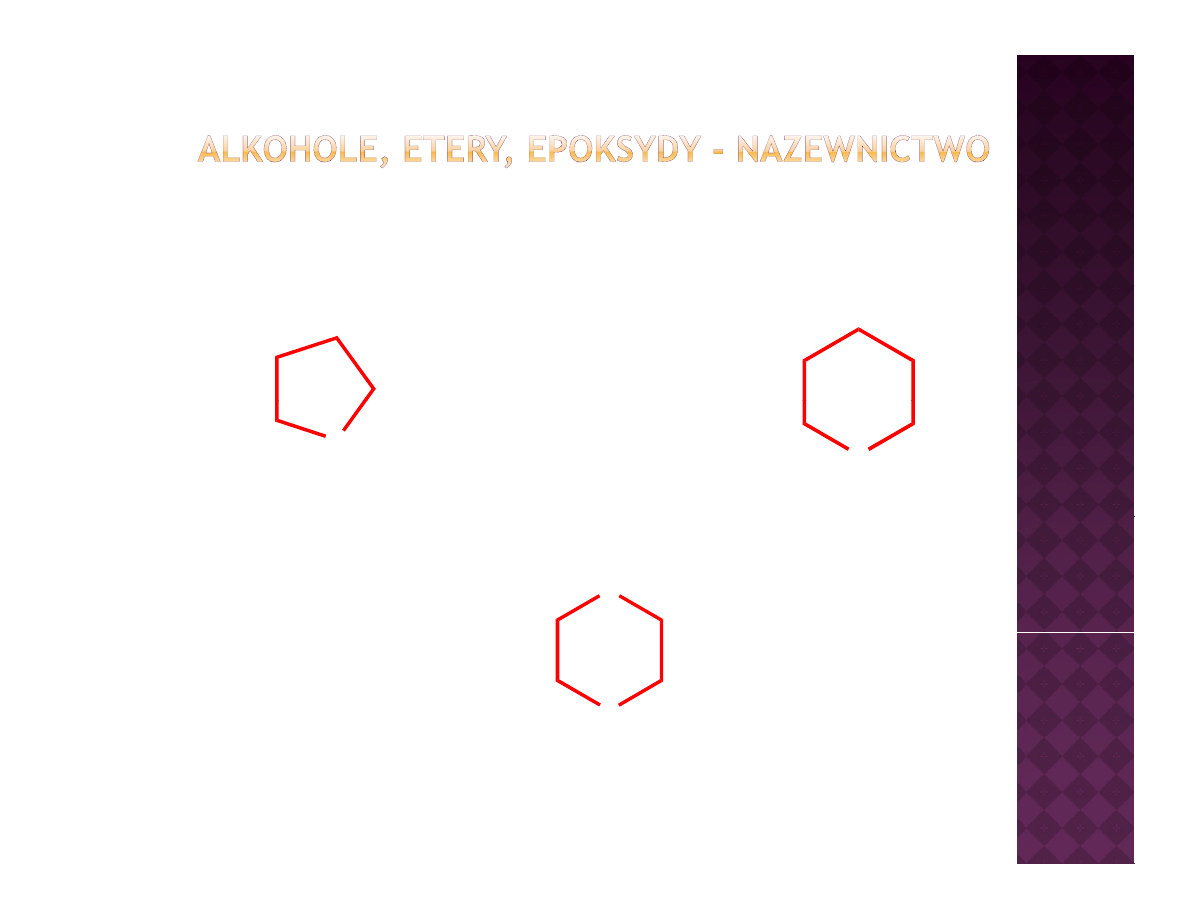
Etery cykliczne - nazewnictwo
O
O
oksolan
IUPAC
oksan
IUPAC
tetrahydrofuran
IUPAC
oksan
IUPAC
tetrahydropiran
O
O
1,4-dioksan
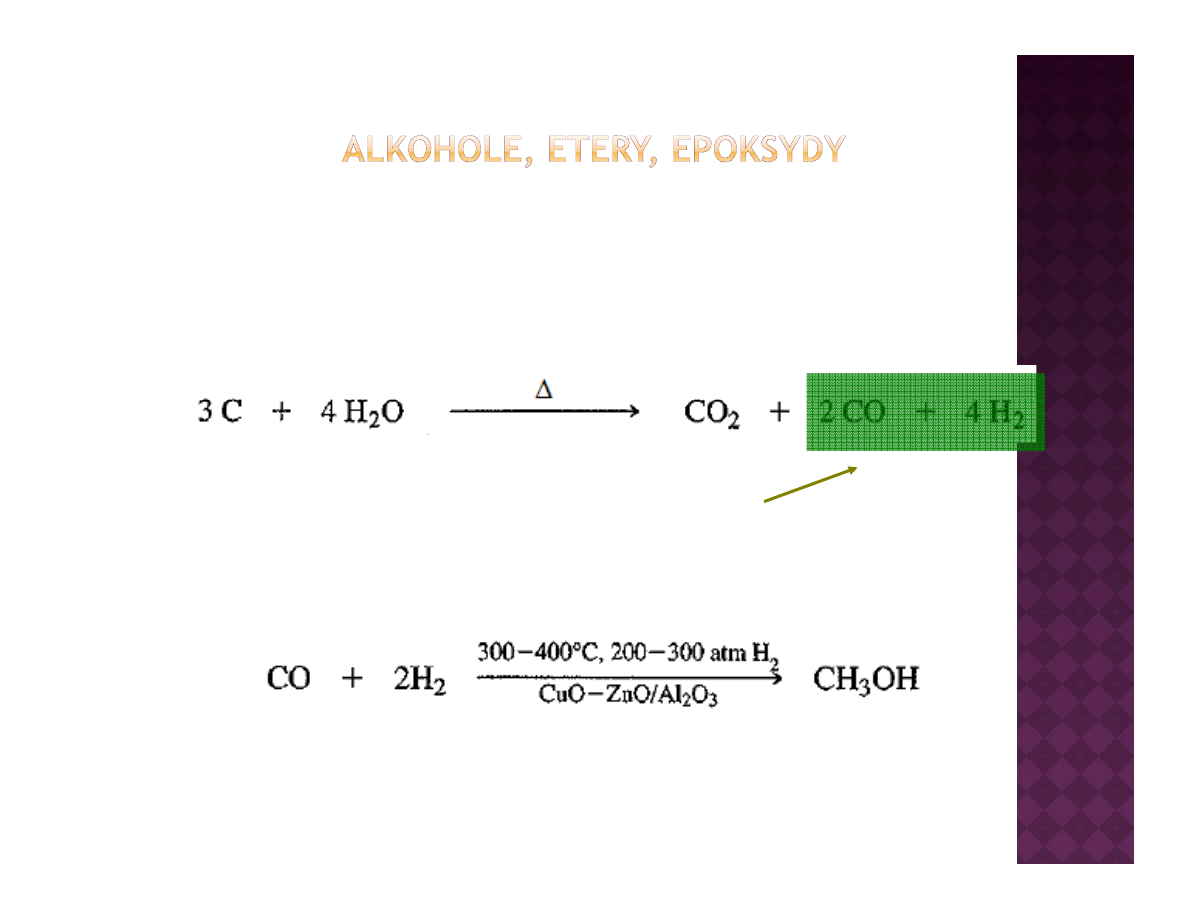
Przemysłowe otrzymywanie alkoholi
metanol
t
gaz syntezowy
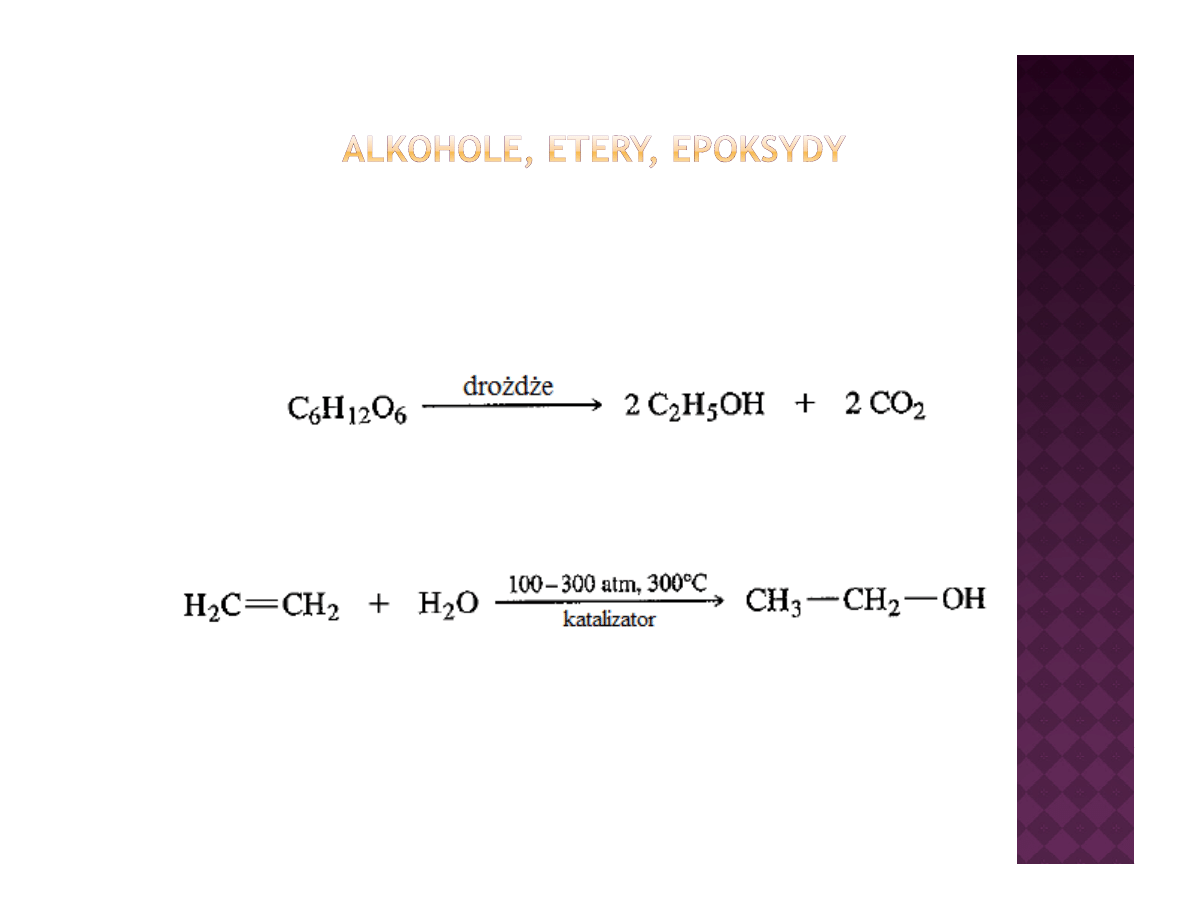
Przemysłowe otrzymywanie alkoholi
etanol
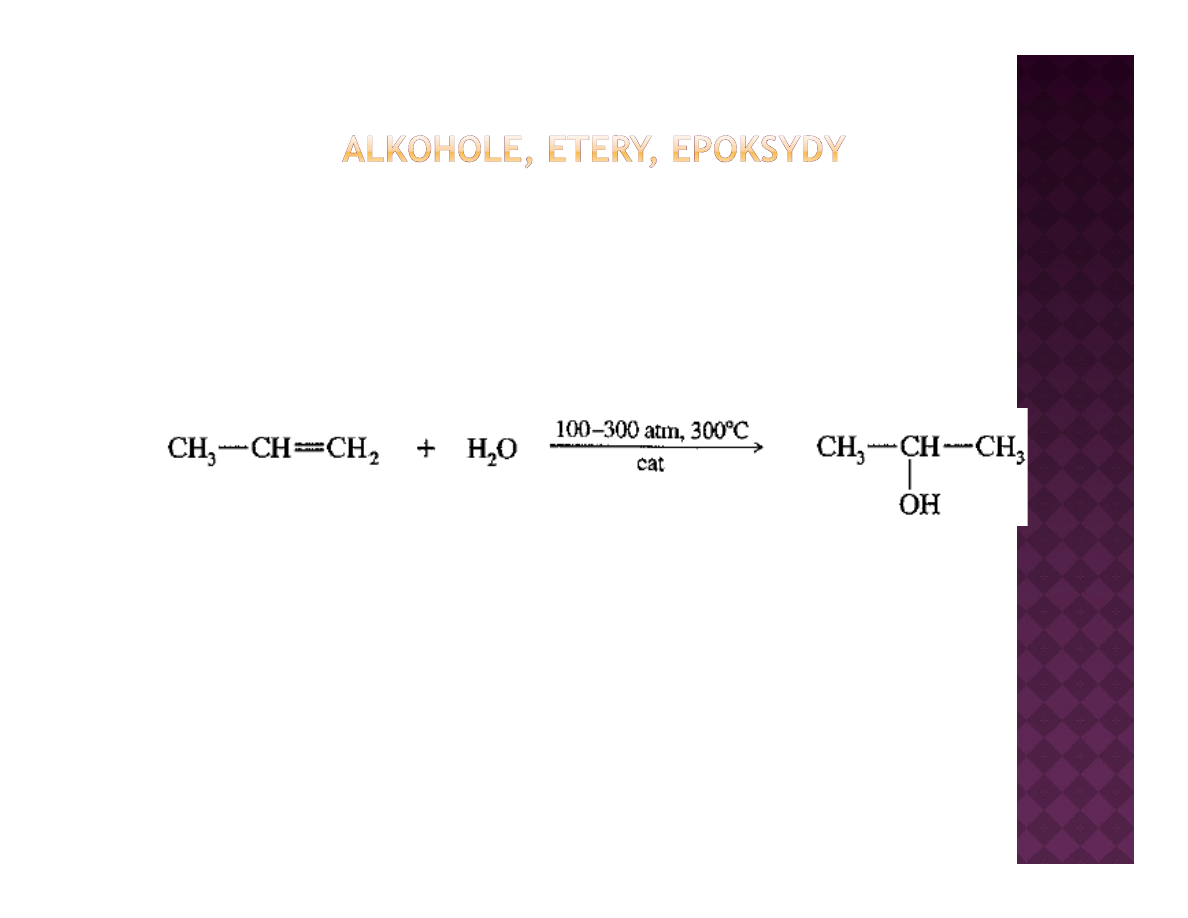
Przemysłowe otrzymywanie alkoholi
2-propanol
Laboratoryjne otrzymywanie alkoholi
Hydroliza haloalkanów
Hydroliza haloalkanów
Br
NaOH
rozc
OH
Br
rozc.
H
2
O
OH
Uwodnienie alkenów
H
2
O
OH
H
2
SO
4 kat.
2
4 kat.
Laboratoryjne otrzymywanie alkoholi
Hydroborowanie utlenianie
Hydroborowanie-utlenianie
1. BH
3
2. H
2
O
2
OH
Utlenianie alkenów – cis-dihydroksylacja
KMnO
4
, NaOH
OH
HO
OH
Laboratoryjne otrzymywanie alkoholi
Utlenianie alkenów – trans-hydroksylacja
Utlenianie alkenów trans hydroksylacja
O
O
Cl
HO
OH
CH
3
C(O)OOH
H
2
O, HCl
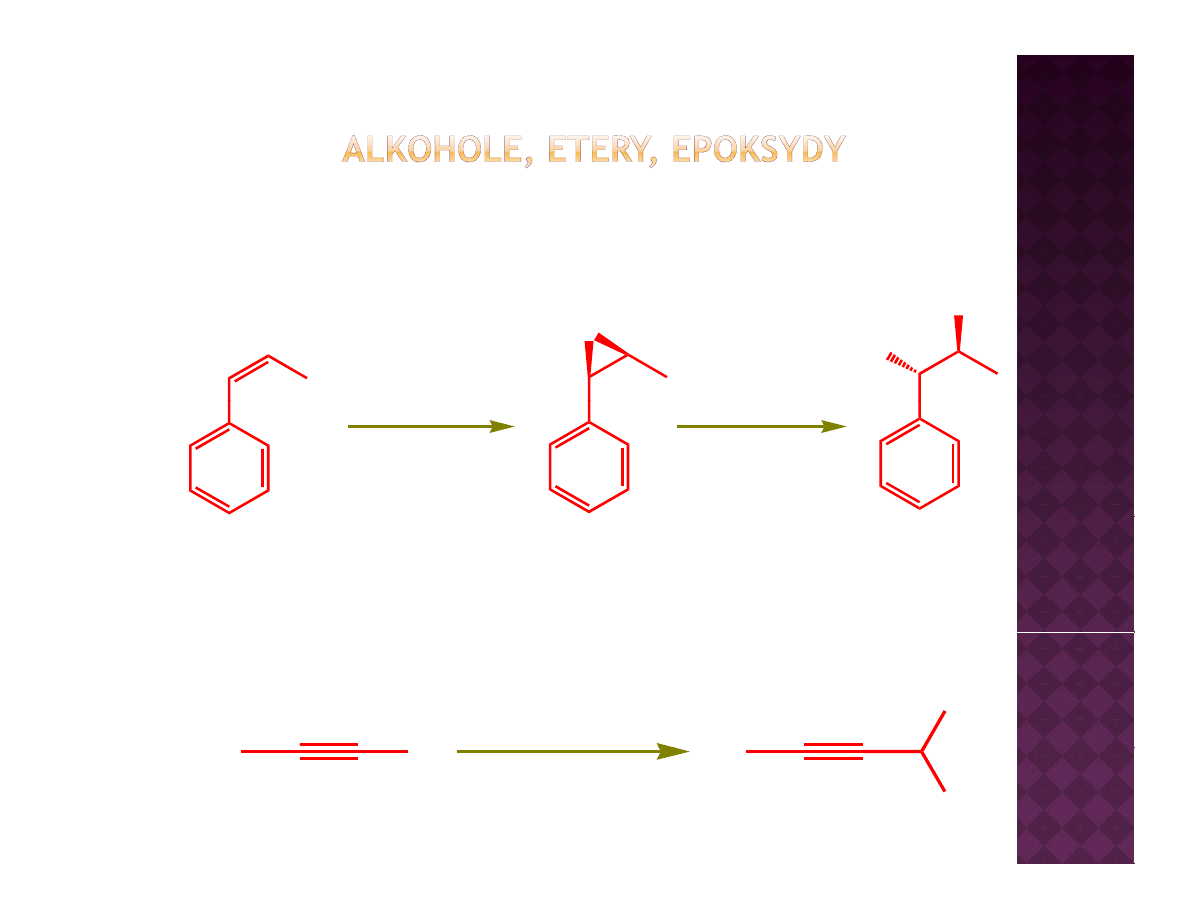
Addycje acetylidów do zwiazków karbonylowych
H
1. NaNH
2
2. PhC(O)H
3.H
3
O
+
OH
H
Ph
Laboratoryjne otrzymywanie alkoholi
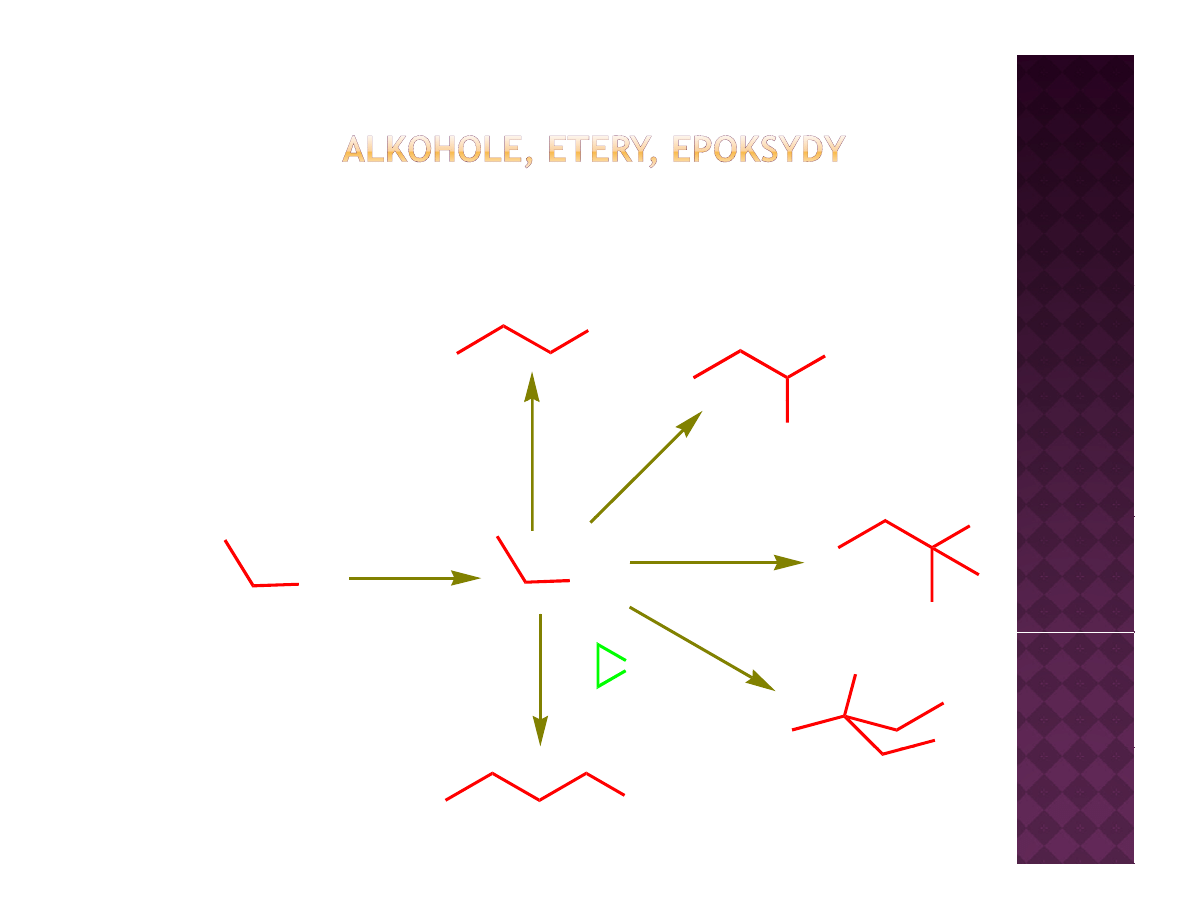
Wykorzystanie związków Grignarda
OH
OH
1. H
2
C=O
2. H
3
O
+
1. PhHC=O
2. H
3
O
+
Ph
1 (CH
3
)
2
C=O
OH
Br
Mg
MgBr
1. (CH
3
)
2
C=O
2. H
3
O
+
OH
1. CH
3
C(O)OEt
2 H
3
O
+
2. H
3
O
OH
1.
2. H
3
O
+
O
OH
Laboratoryjne otrzymywanie alkoholi
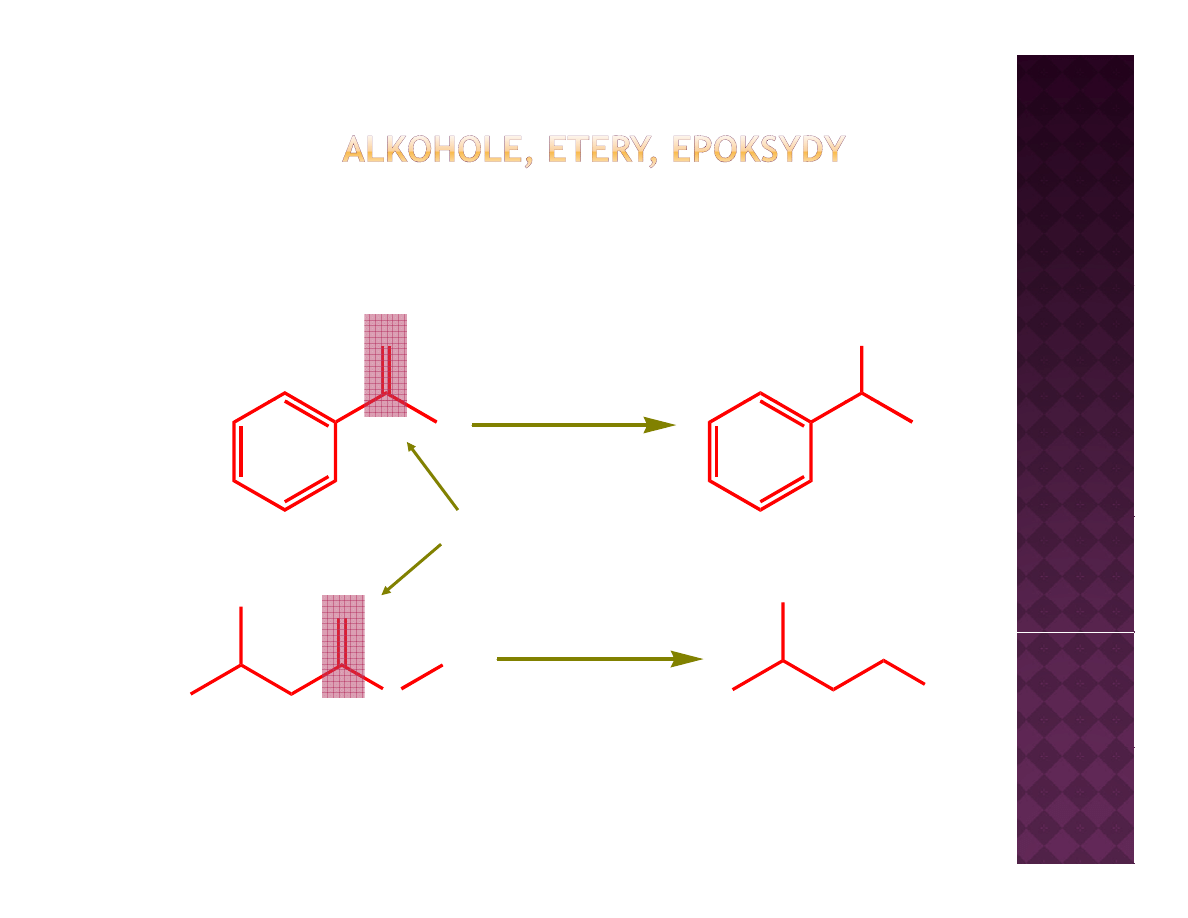
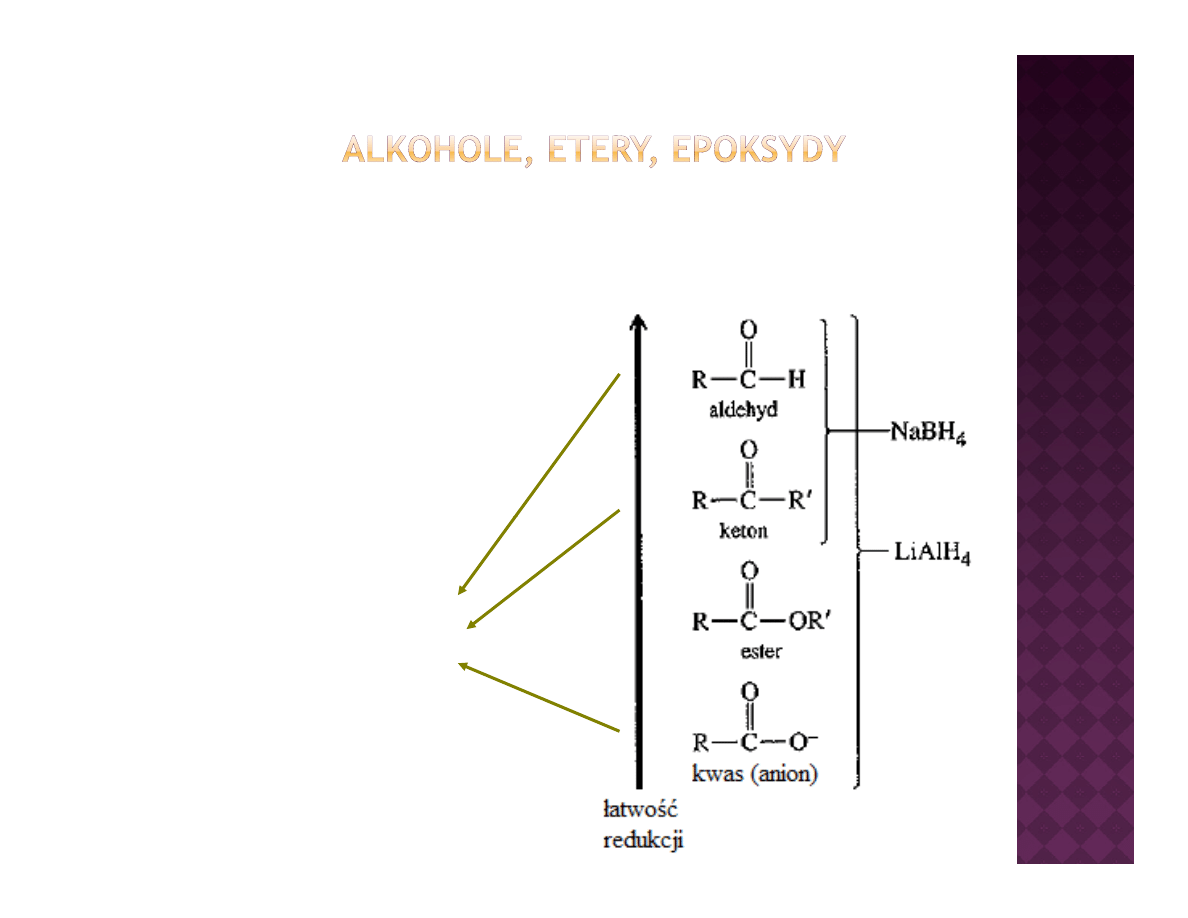
Redukcja związków karbonylowych
O
NaBH
OH
NaBH
4
MeOH
k b
l
O
LiAlH
karbonyl
O
LiAlH
4
Et
2
O
OH
Laboratoryjne otrzymywanie alkoholi
Redukcja związków karbonylowych
BH
BH
3
Efektywny odczynnik
redukujący
ją y
Laboratoryjne otrzymywanie alkoholi
Redukcja związków karbonylowych
O
O
NaBH
4
OH
O
LiAlH
OH
OH
O
NaBH
4
O
LiAlH
4
OH
Laboratoryjne otrzymywanie alkoholi
Redukcja związków karbonylowych
H
H
H
H
Al
H
H
H
H
B
H
H
H
δ
-
δ
-
δ
+
δ
+
H
B
H
H
H
B
H
H
H
H
luka elektronowa
Zasada Lewisa
Kwas Lewisa
Laboratoryjne otrzymywanie alkoholi
Redukcja związków karbonylowych
H
B
H
H
O
O
-
BH
3
+
H
f
H
Przeniesienie anionu H
-
-
atak nukleofilowy na węgiel karbonylowy
Laboratoryjne otrzymywanie alkoholi
Redukcja związków karbonylowych
H
O
O
B
H
H
H
O
BH
2
H
H
B
H
H
Elektrofilowa addycja boru do tlenu
Nukleofilowe wewnątrzczasteczkowe
przeniesienie H
-
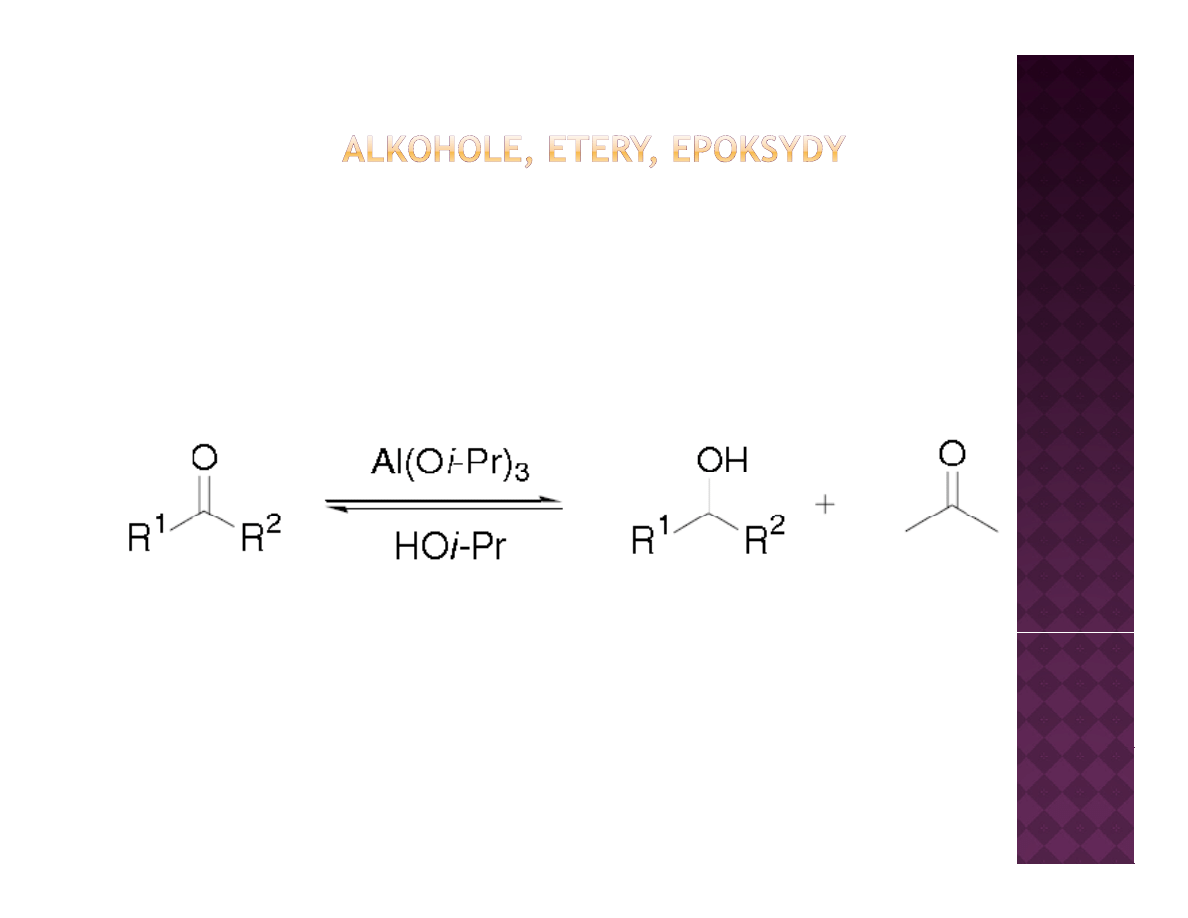
Laboratoryjne otrzymywanie alkoholi
Redukcja związków karbonylowych
Redukcja Meerveina-Ponndorfa-Verleya
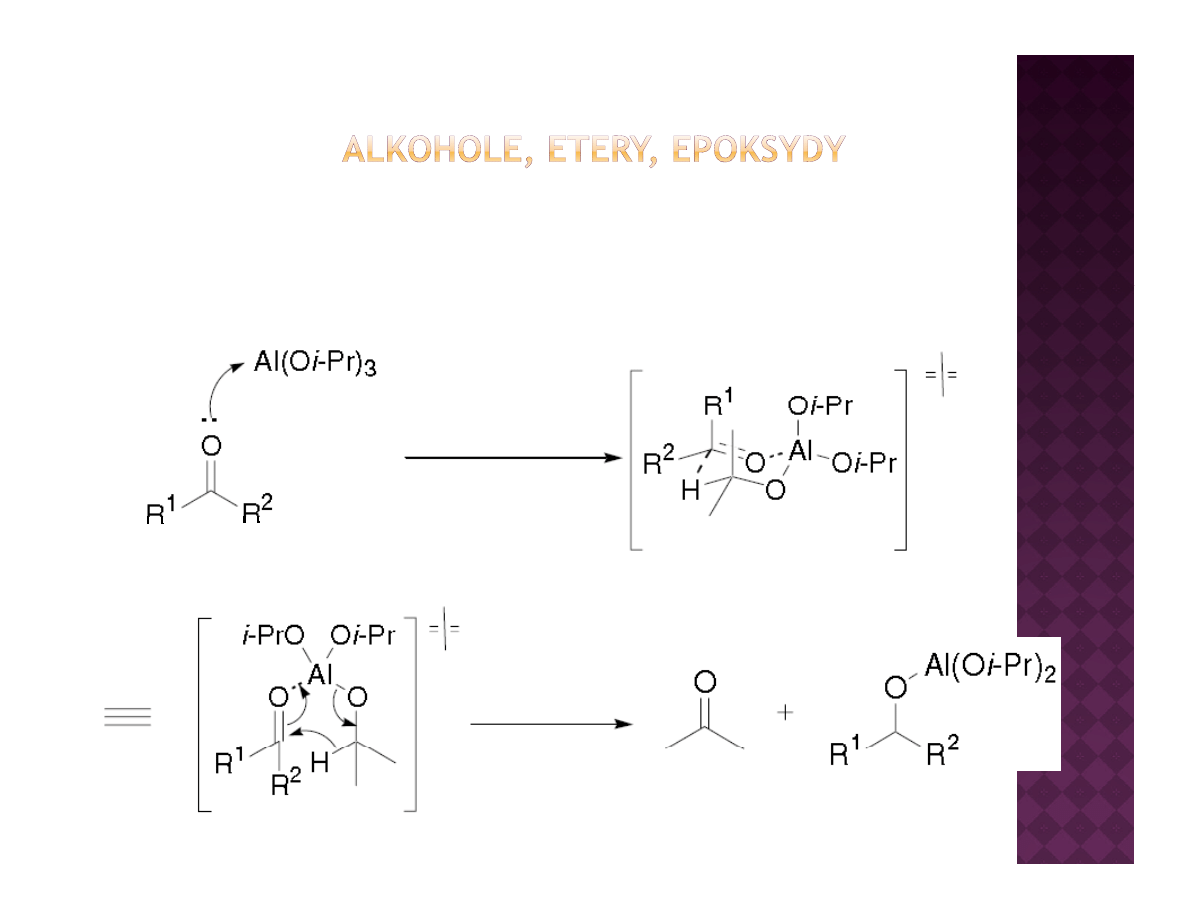
Laboratoryjne otrzymywanie alkoholi
Redukcja związków karbonylowych
koordynacja
przeniesienie
wodoru
Laboratoryjne otrzymywanie alkoholi
Redukcja związków karbonylowych
Laboratoryjne otrzymywanie alkoholi
Redukcja związków karbonylowych
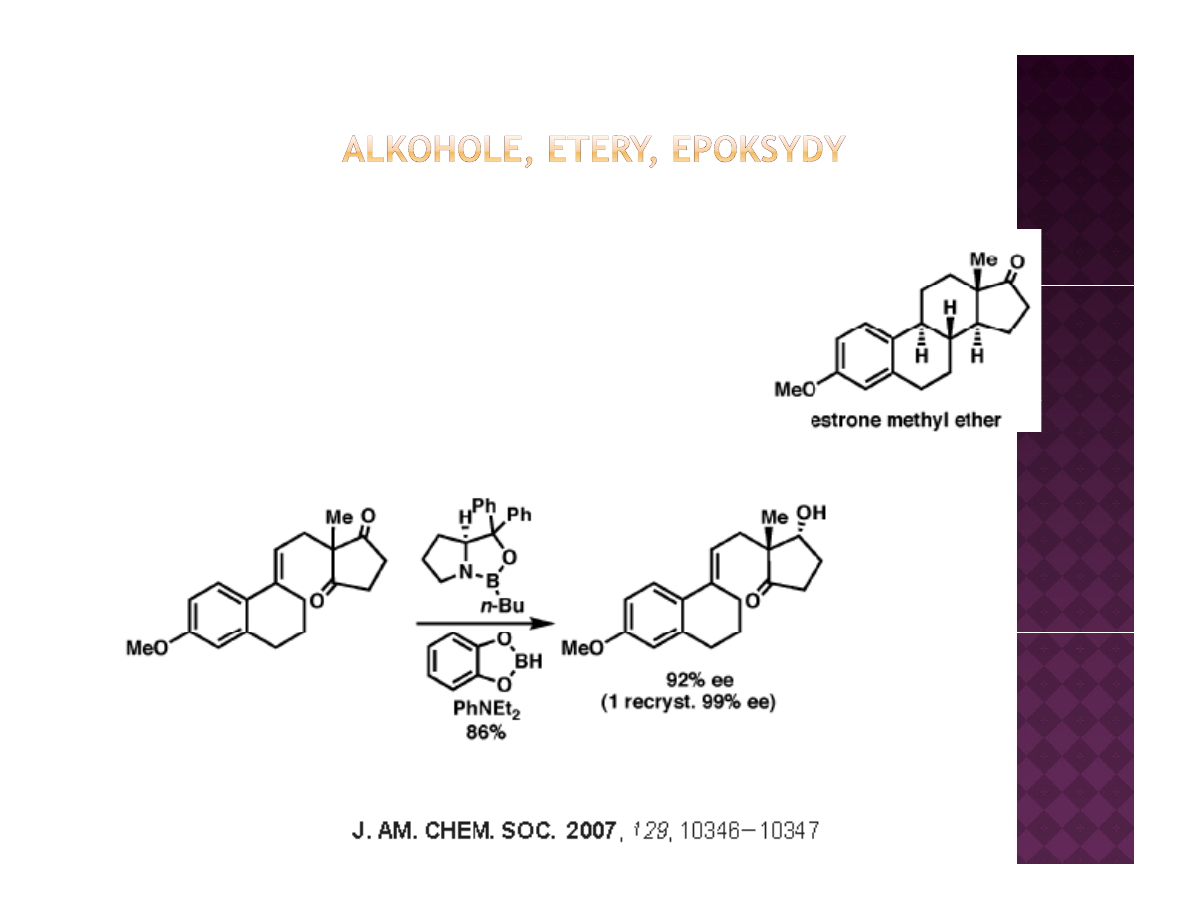
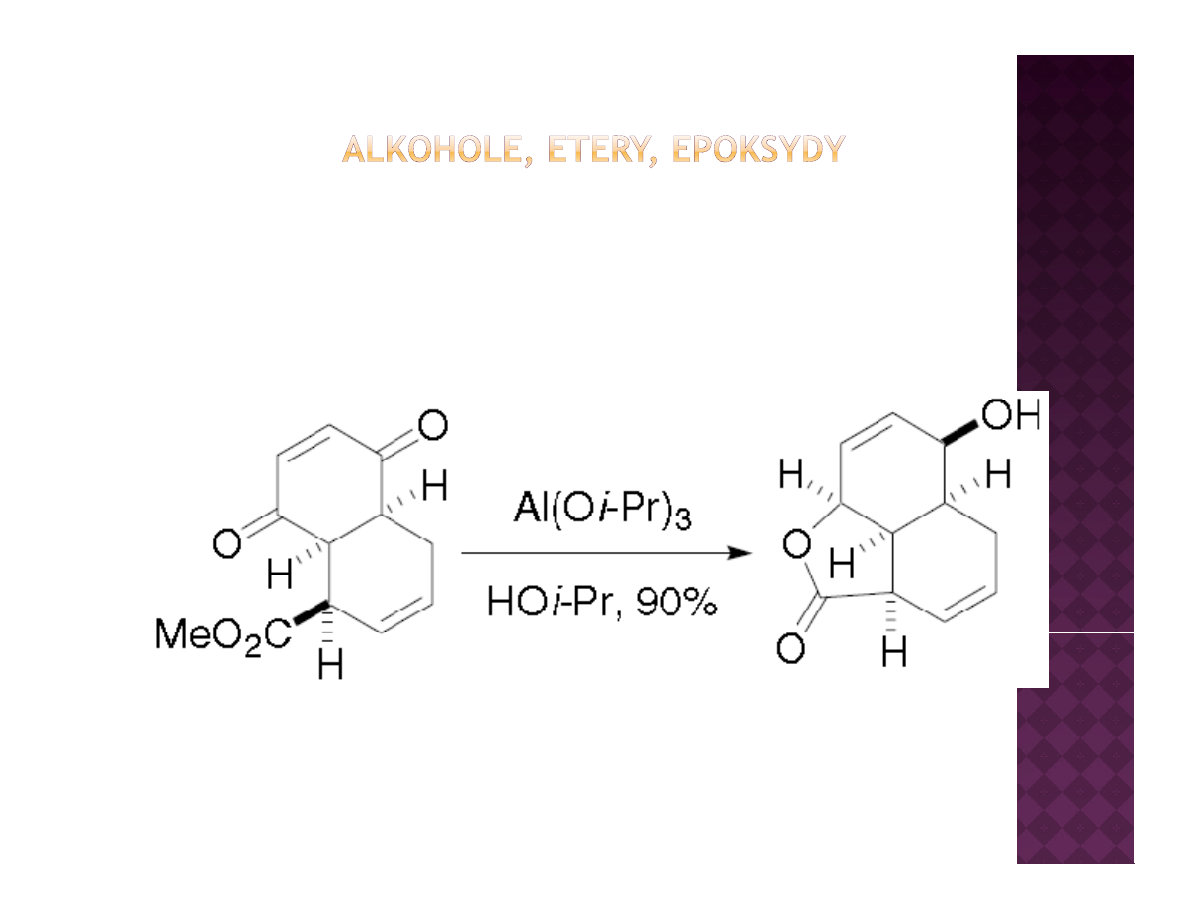
Laboratoryjne otrzymywanie alkoholi
Redukcja związków karbonylowych
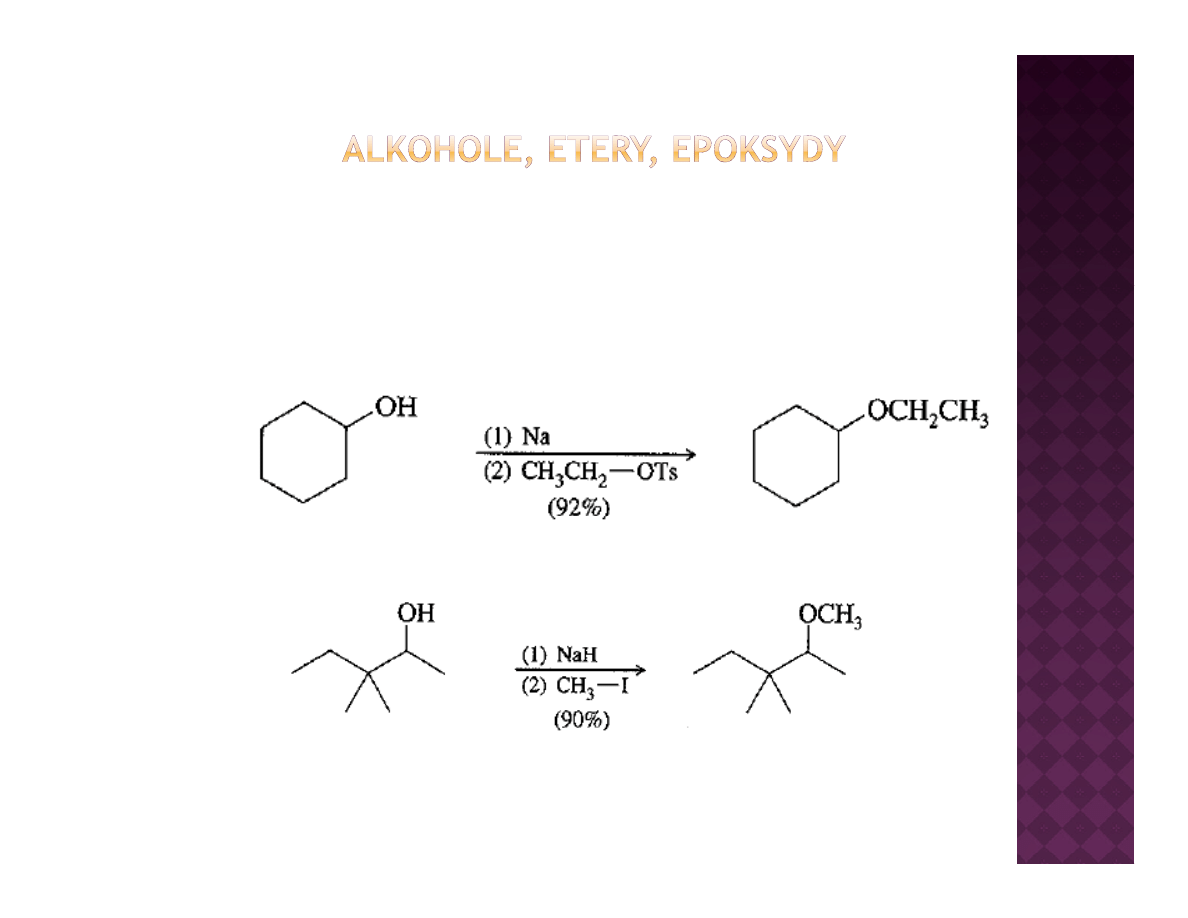
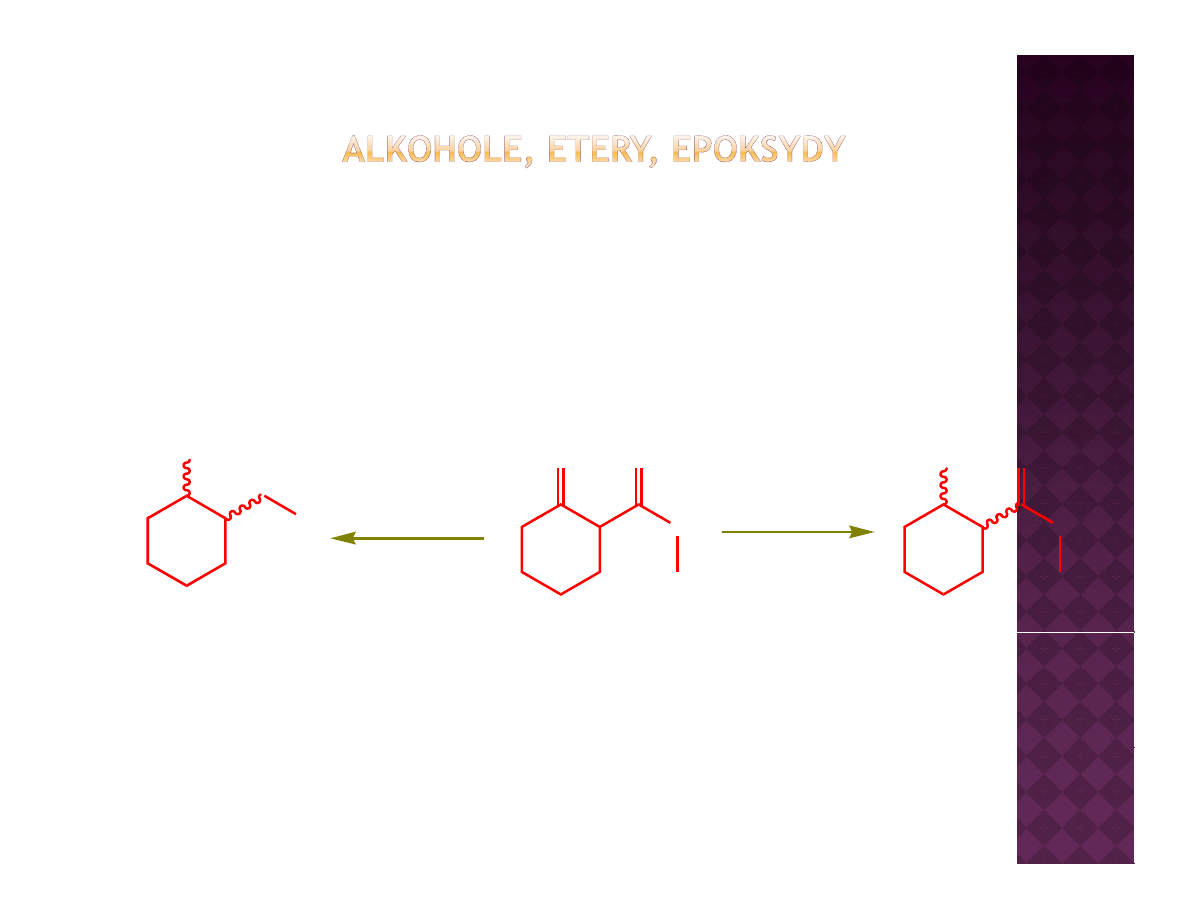
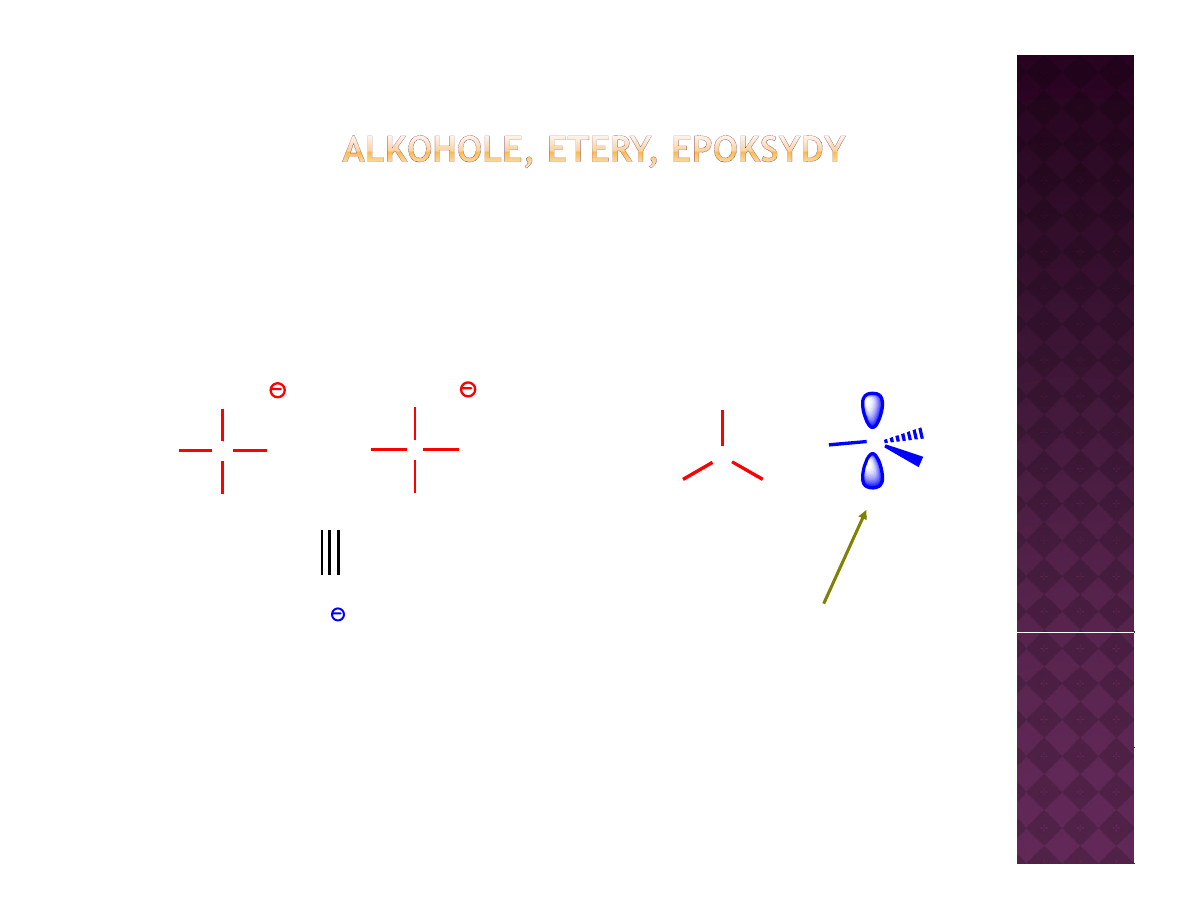
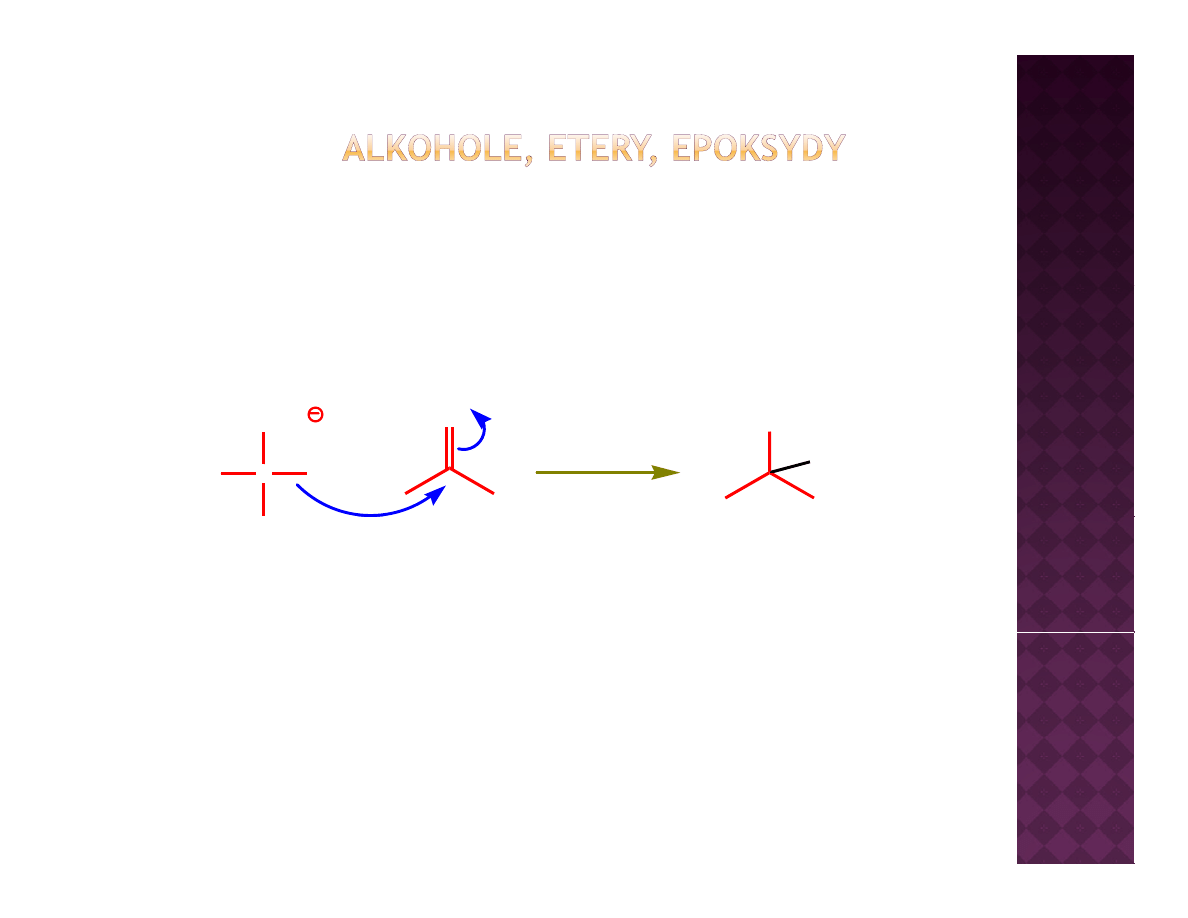
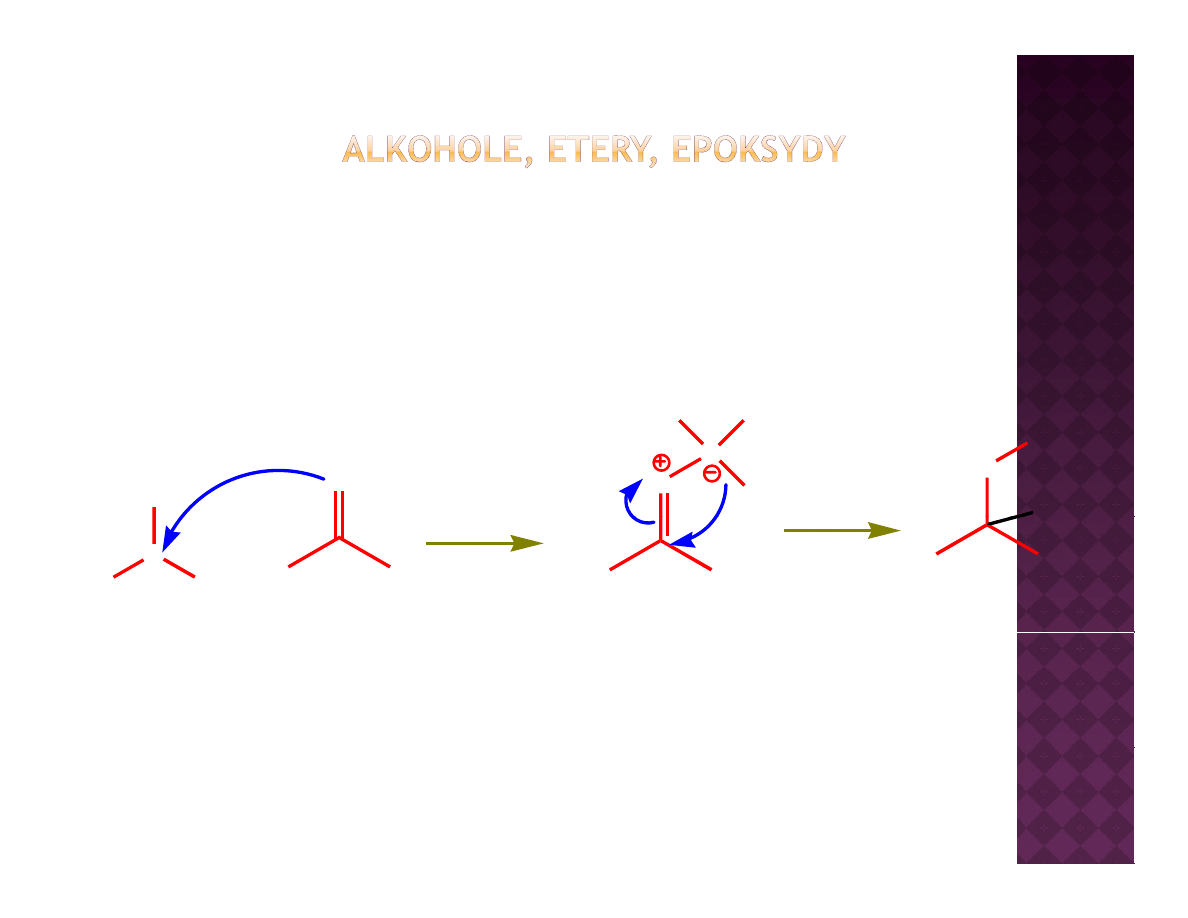
Otrzymywanie eterów
Synteza Williamsona
Synteza Williamsona
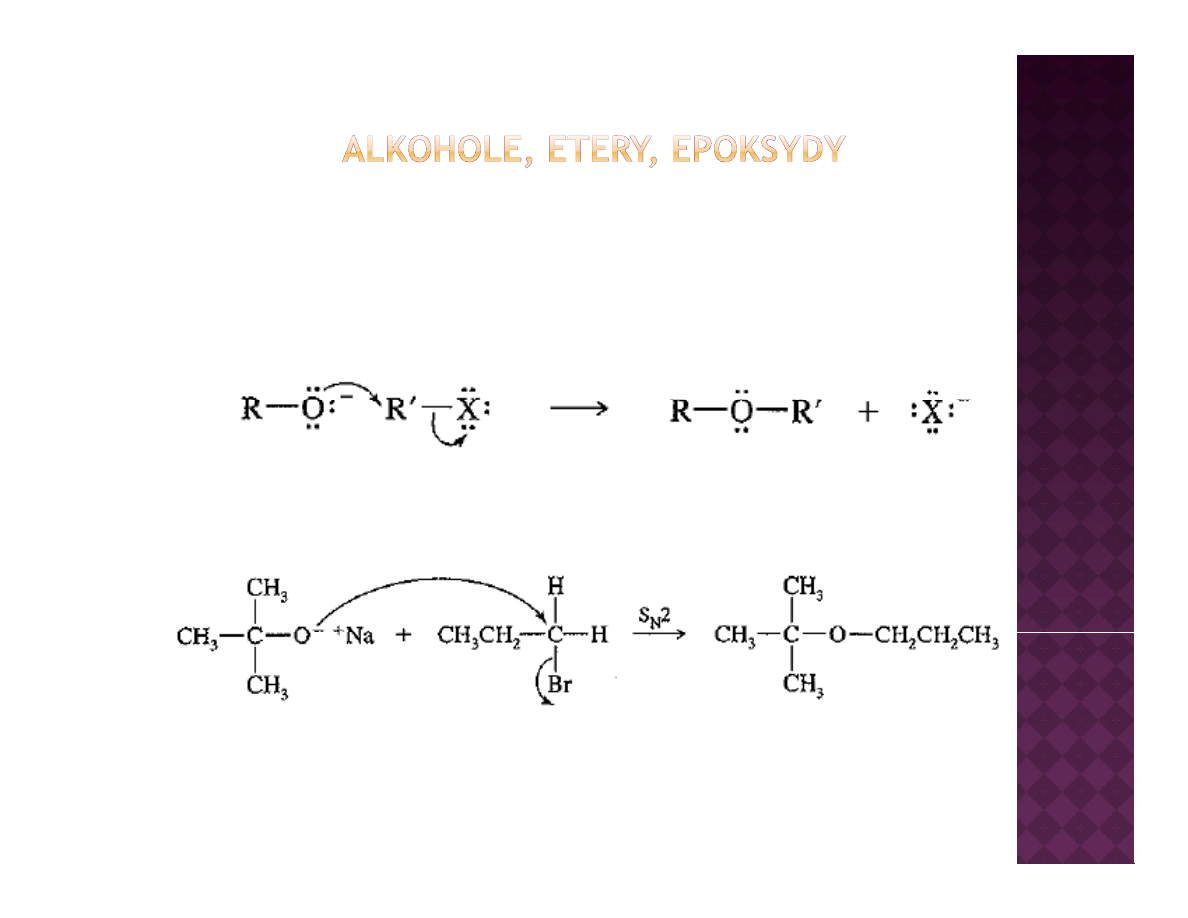
Otrzymywanie eterów
Synteza Williamsona
Synteza Williamsona
Reakcja S
N
2
Dla przypomnienia
Dla przypomnienia
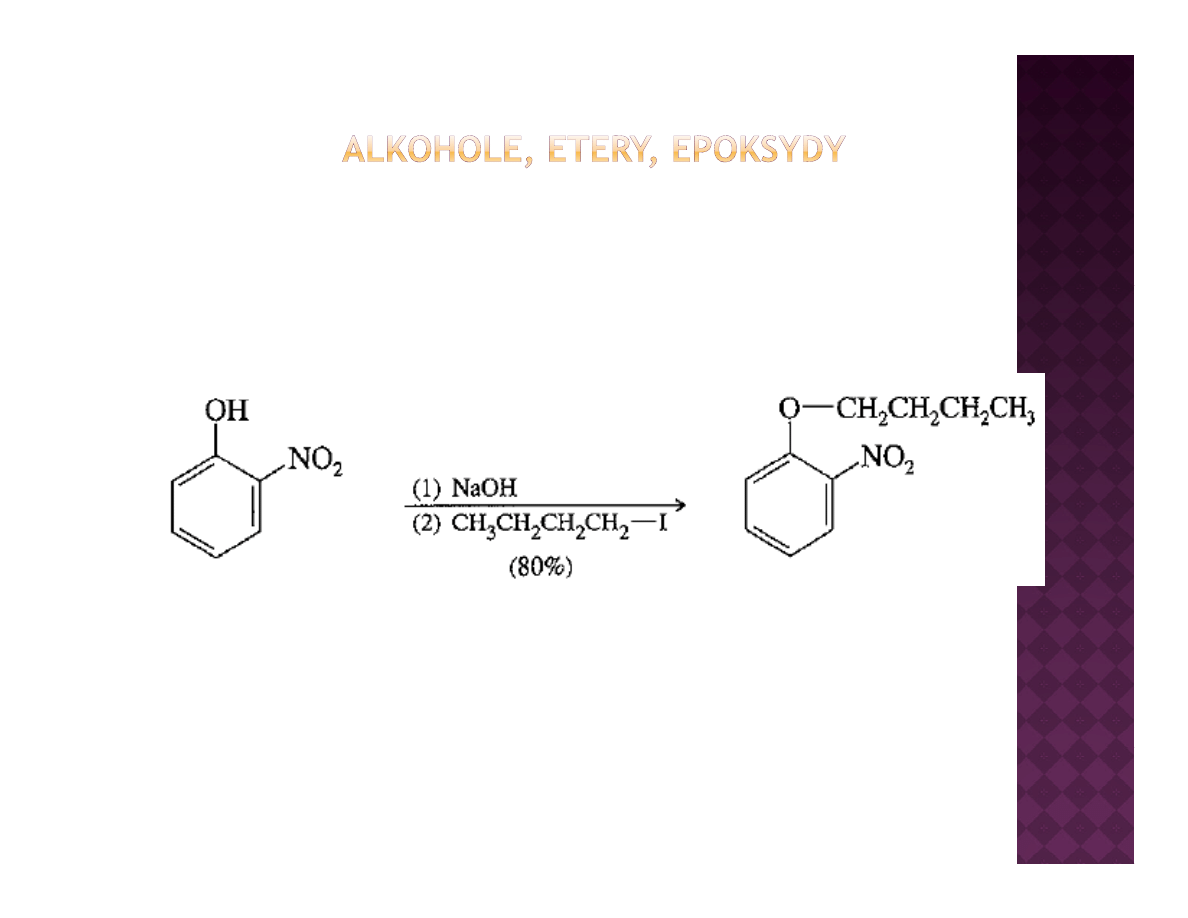
Otrzymywanie eterów
Synteza Williamsona
Synteza Williamsona
Synteza Williamsona ma również zastosowanie do fenoli, które łatwiej
ulegają tej reakcji ze względu na wyższą kwasowość
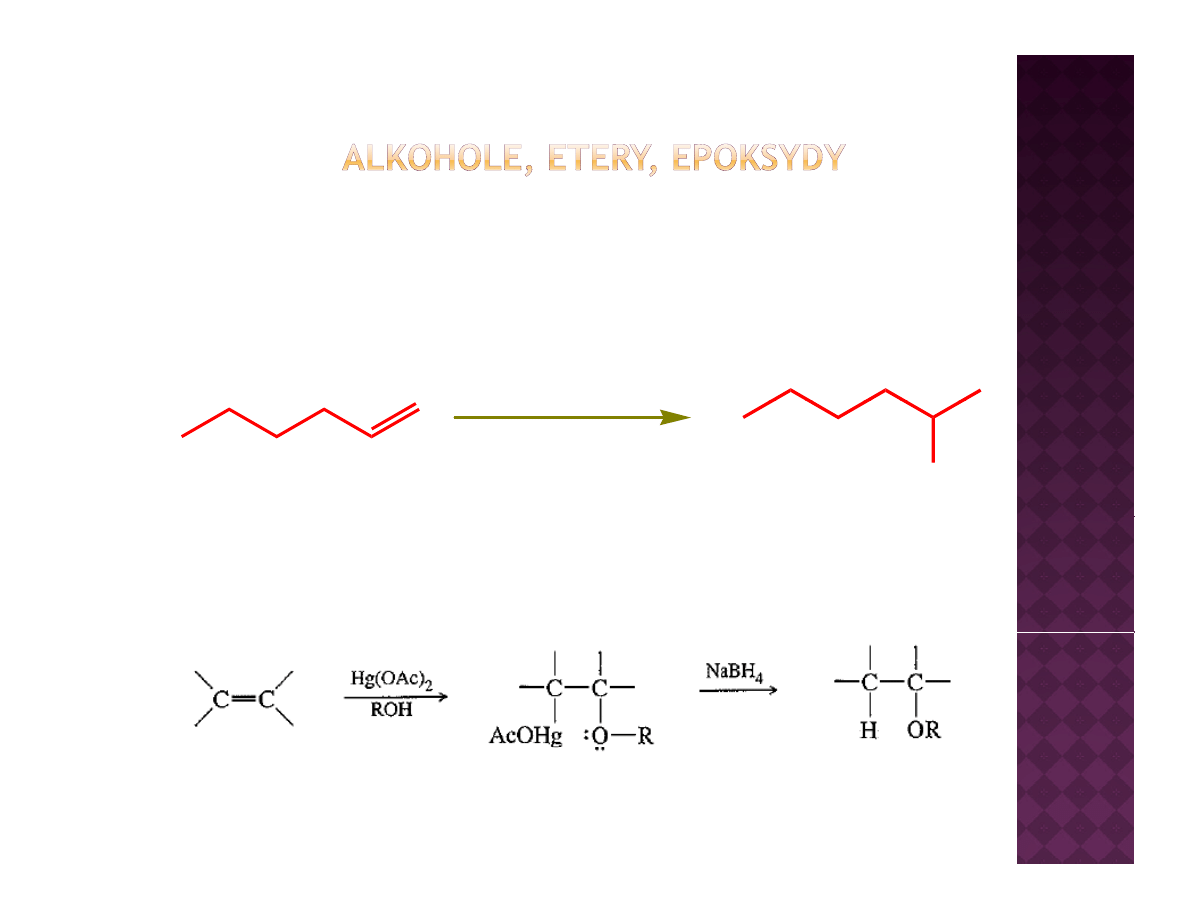
Otrzymywanie eterów
Alkoksyrtęciowanie - odrtęciowanie
1. Hg(OAc)
2
, MeOH
2 NaBH
4
2. NaBH
4
OMe
80%
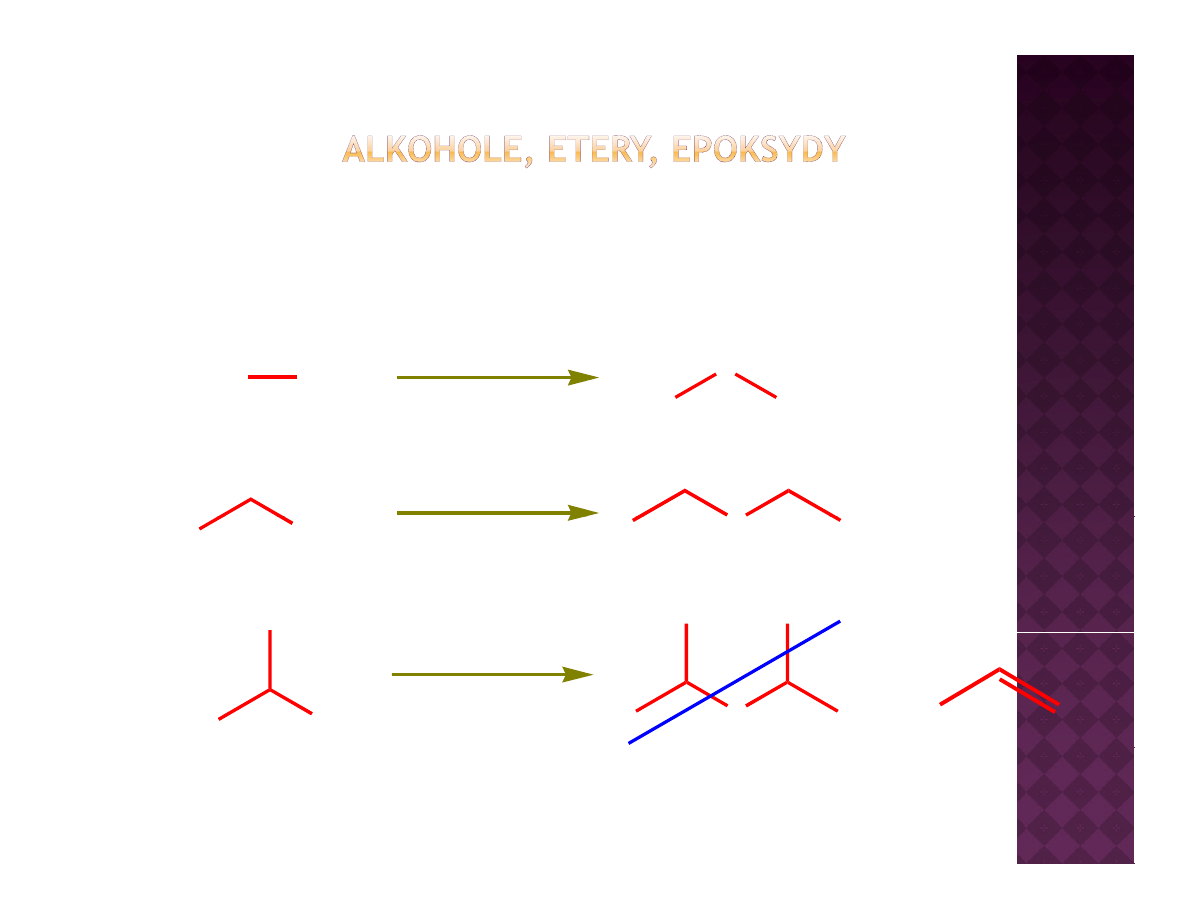
Otrzymywanie eterów
Odwadnianie alkoholi
OH
H
2
SO
4
140
o
C
O
140 C
100%
H
2
SO
4
O
OH
140
o
C
88%
O
OH
H
2
SO
4
140
o
C
O
Tylko I-rzędowe alkohole nadają się do użycia w reakcji odwadniania

Otrzymywanie eterów
Odwadnianie alkoholi
O
R
OH
2
R
O
R
+
H
2
O
Odwadnianie alkoholi jest procesem odwracalnym, dlatego też w celu
maksymalizacji wydajności eteru konieczne jest ciągłe usuwanie wody ze
środowiska
ś odo s a
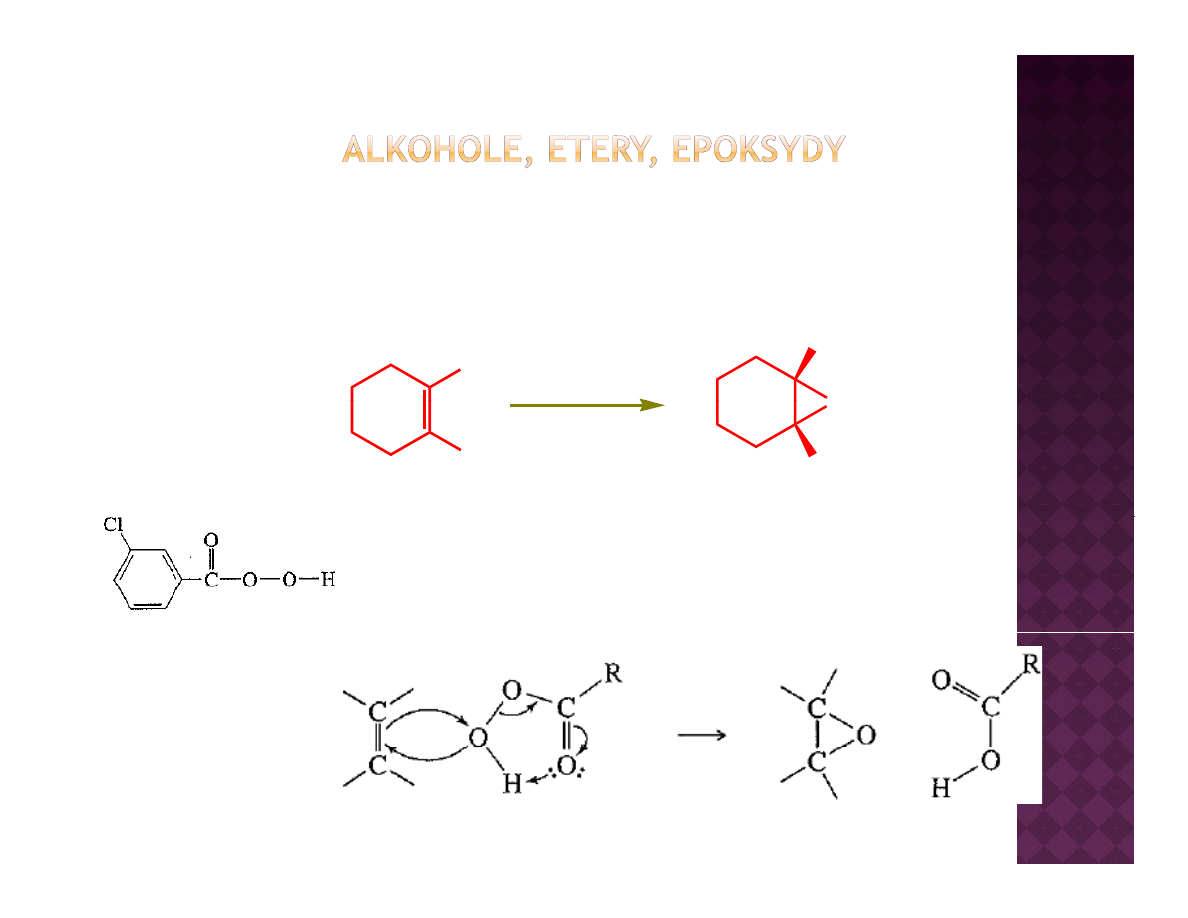
Otrzymywanie epoksydów
Epoksydacja olefin
H
MCPBA
O
H
H
DCM
100%
O
H
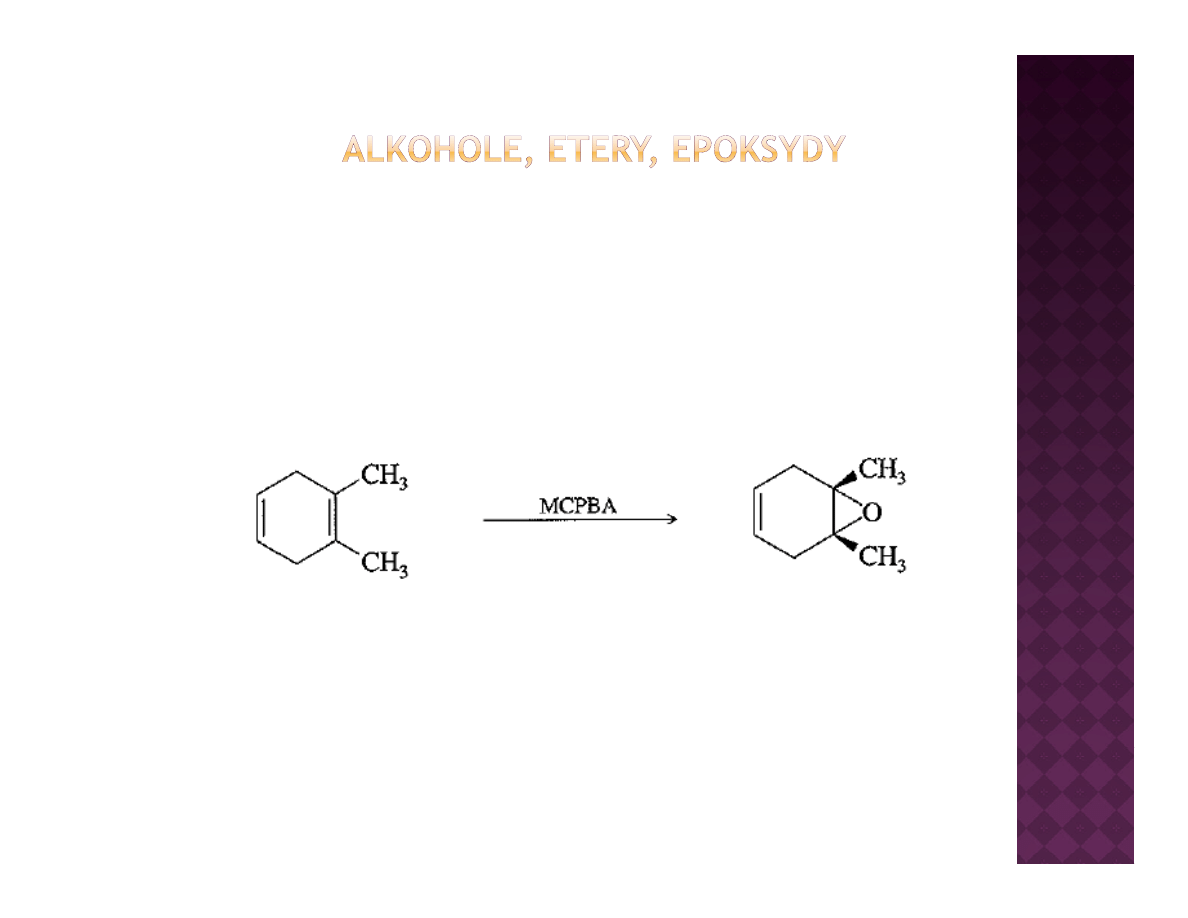
Otrzymywanie epoksydów
Epoksydacja olefin
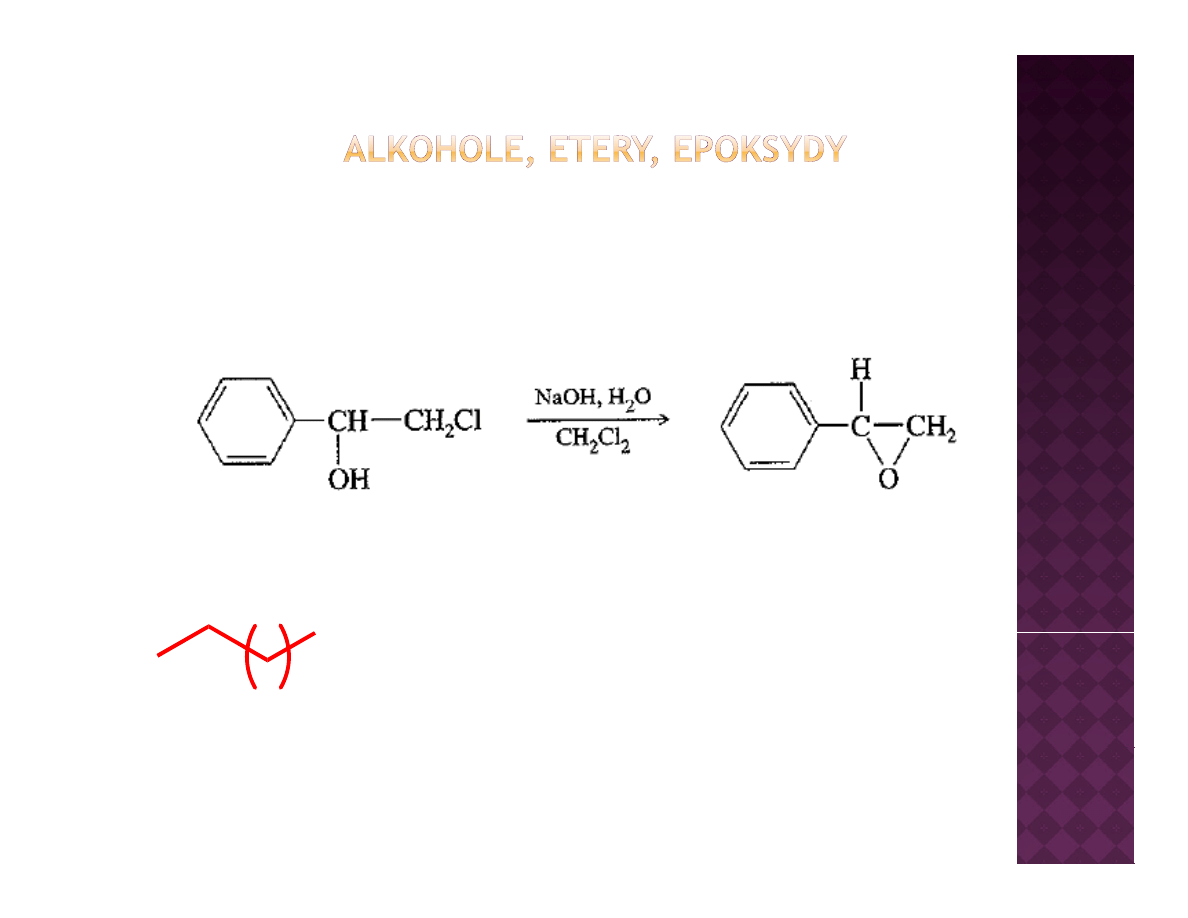
Otrzymywanie epoksydów
Cyklizacja halohydryn
OH
Cl
OH
n
Halohydryna – związek posiadający w strukturze
zarówno atom halogenu jak i podstawnik hydroksylowy
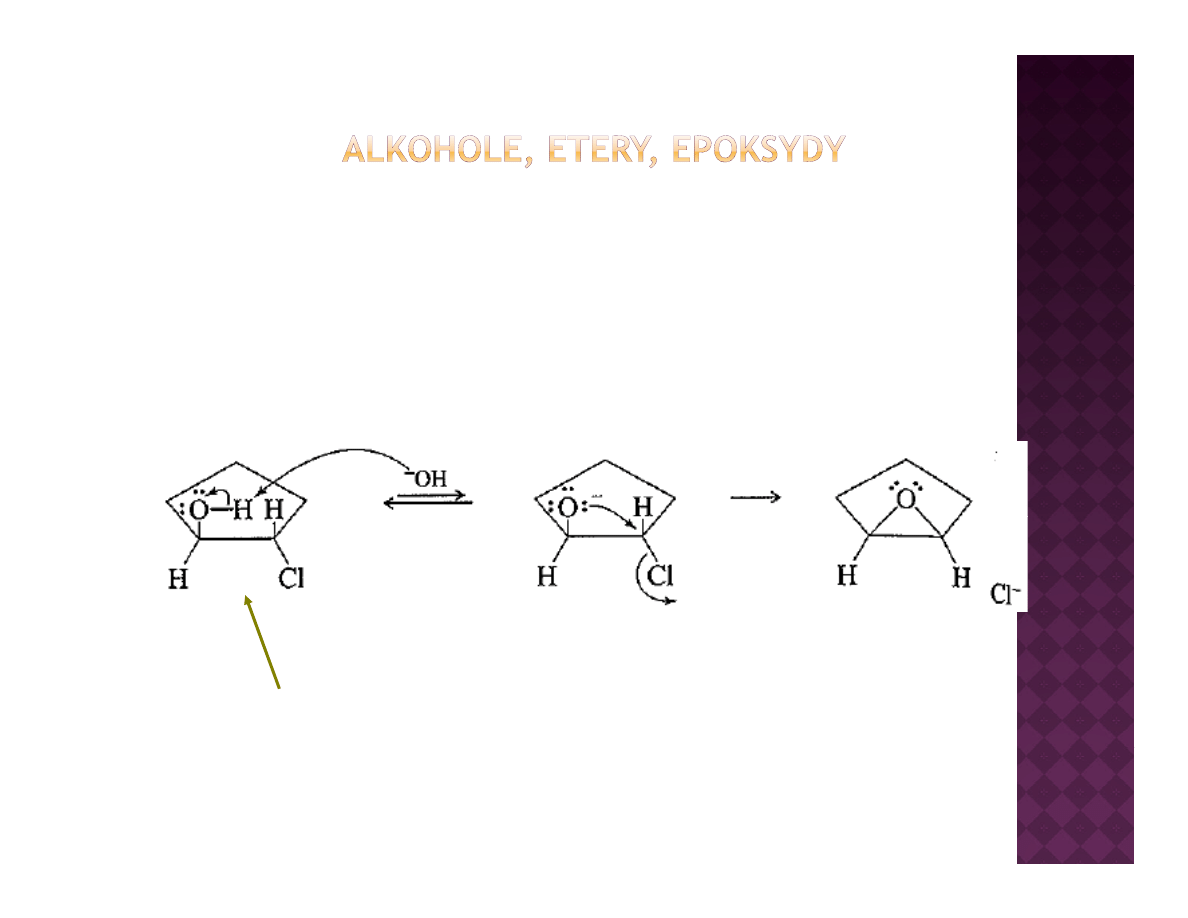
Otrzymywanie epoksydów
Cyklizacja halohydryn
1
2
3
4
Uł ż i
b f k j
h
i b ć t
j śli
k j t
i
Ułożenie grup obu funkcyjnych musi być trans, jeśli reakcja tworzenia
epoksydu ma mieć miejsce
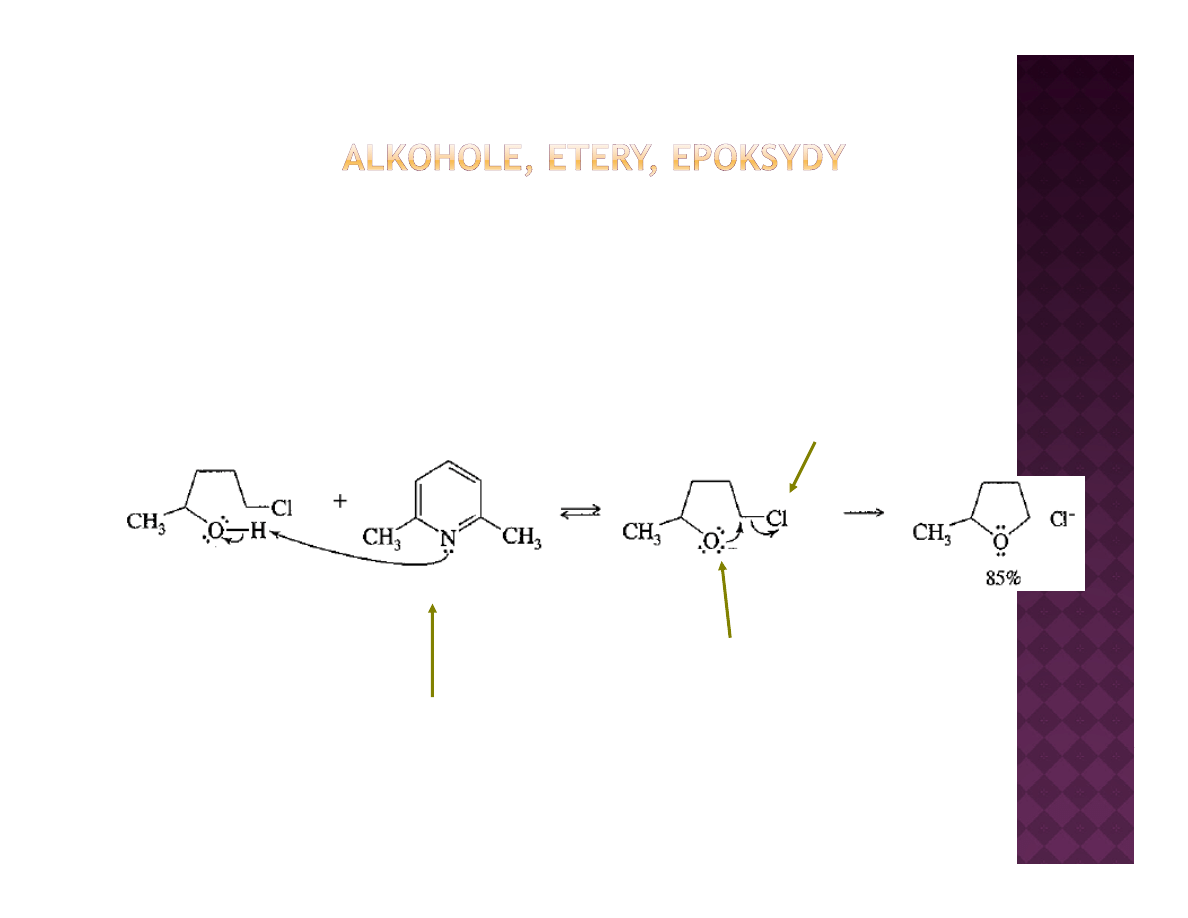
Otrzymywanie cyklicznych eterów
Cyklizacja halohydryn
Dobra grupa opuszczająca
Dobra grupa opuszczająca
Działa jak zasada
Alkoksylan
j
Nazewnictwo
Do zapamiętania:
Budowa wiązania O-H i C-O-C
Polarność alkoholi i eterów
Kwasowość alkoholi i fenoli
Otrzymywanie alkoholi, eterów i epoksydów
Wyszukiwarka
Podobne podstrony:
chemia organiczna wykład 6
Chemia organiczna wykłady całość(1)
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
Instrukcja do prób barwnych I (alkohole, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady
Chemia organiczna wykłady
dyd e2b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
Ćwiczenia – węglowodory alifatyczne, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
dyd k2a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Instrukcja do zmydlania tłuszczów, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
dyd kzb, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd kza r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd e1c, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
Chemia organiczna wykład 14
Chemia organiczna wykład 9
Instrukcja do prób barwnych II (kwasy, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
Instrukcja do chromatografii, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
więcej podobnych podstron