
CHEMIA
ORGANICZNA
Kurs podstawowy
Kurs podstawowy
Wykład 9
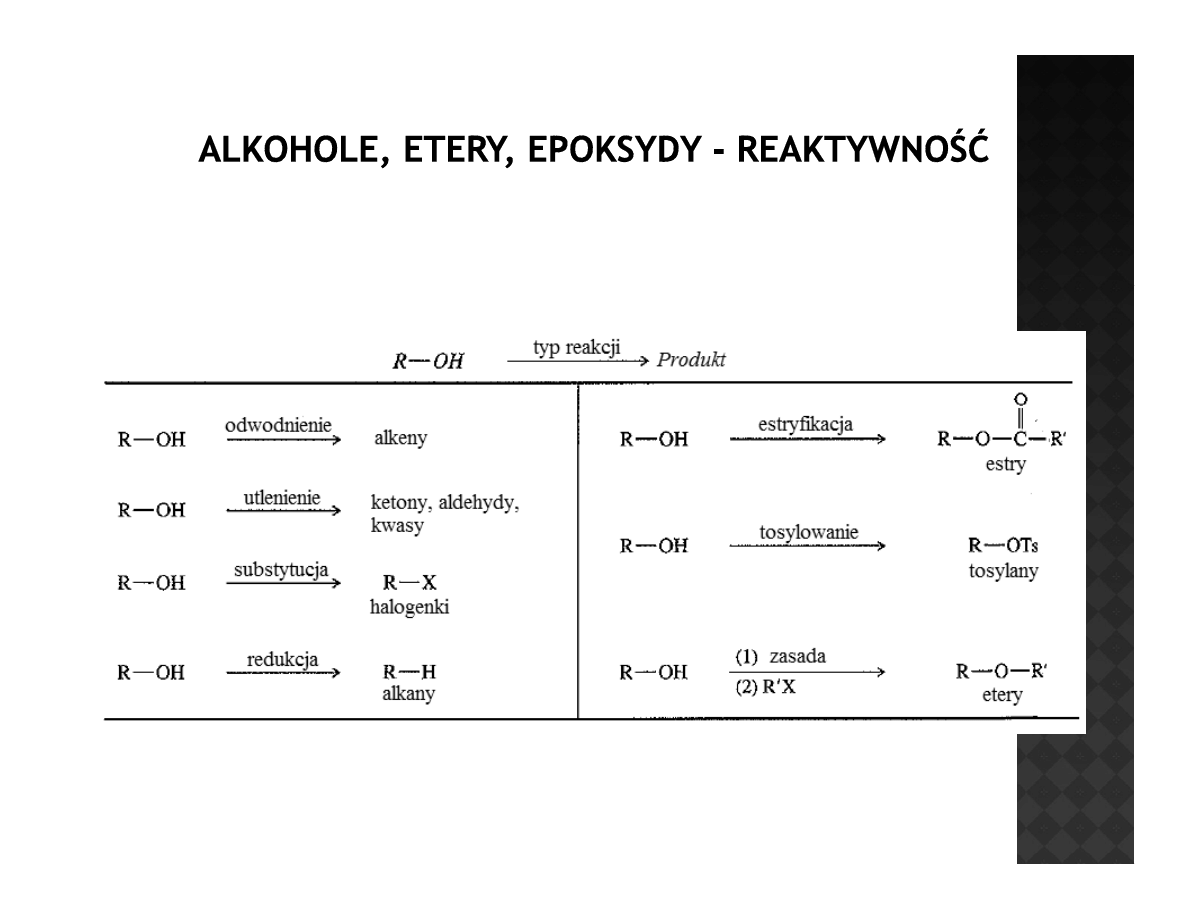
Reaktywność alkoholi
Reaktywność alkoholi
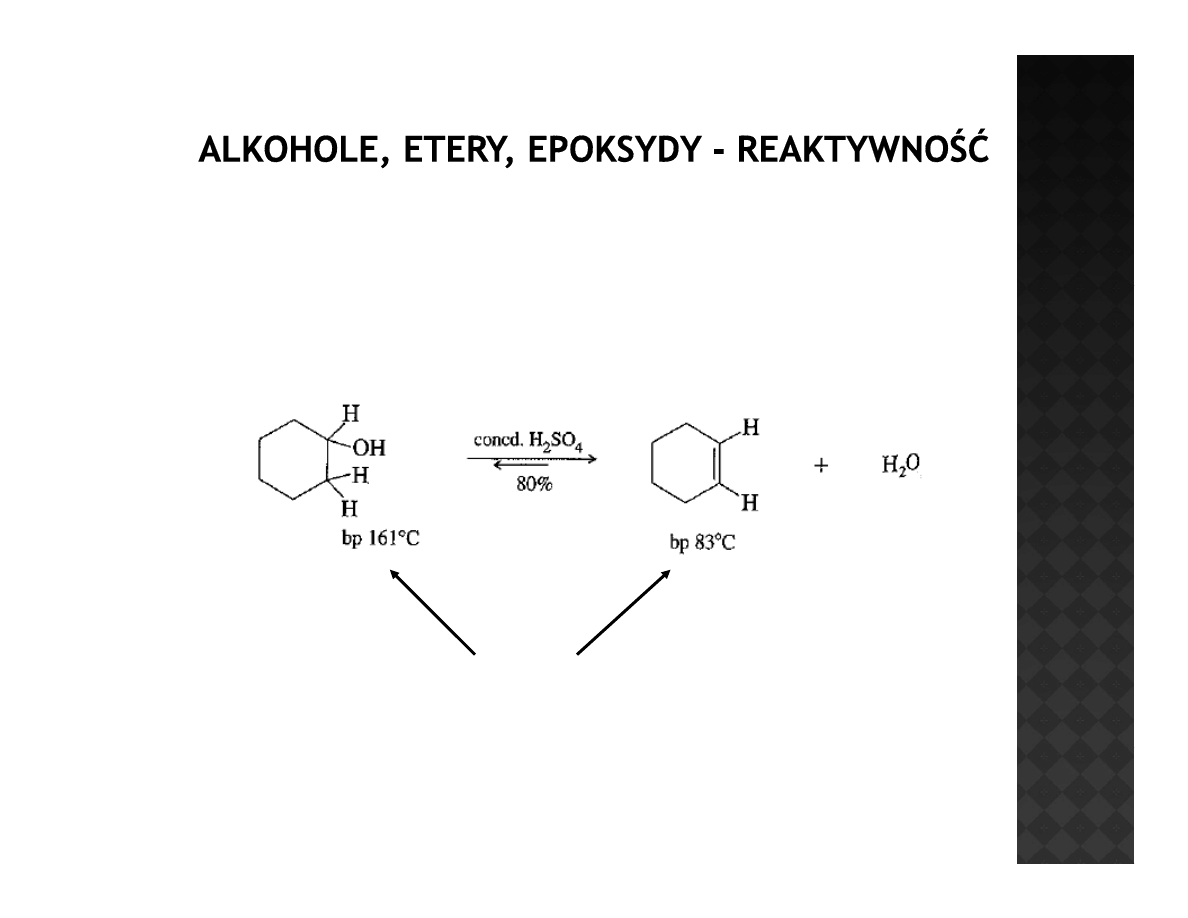
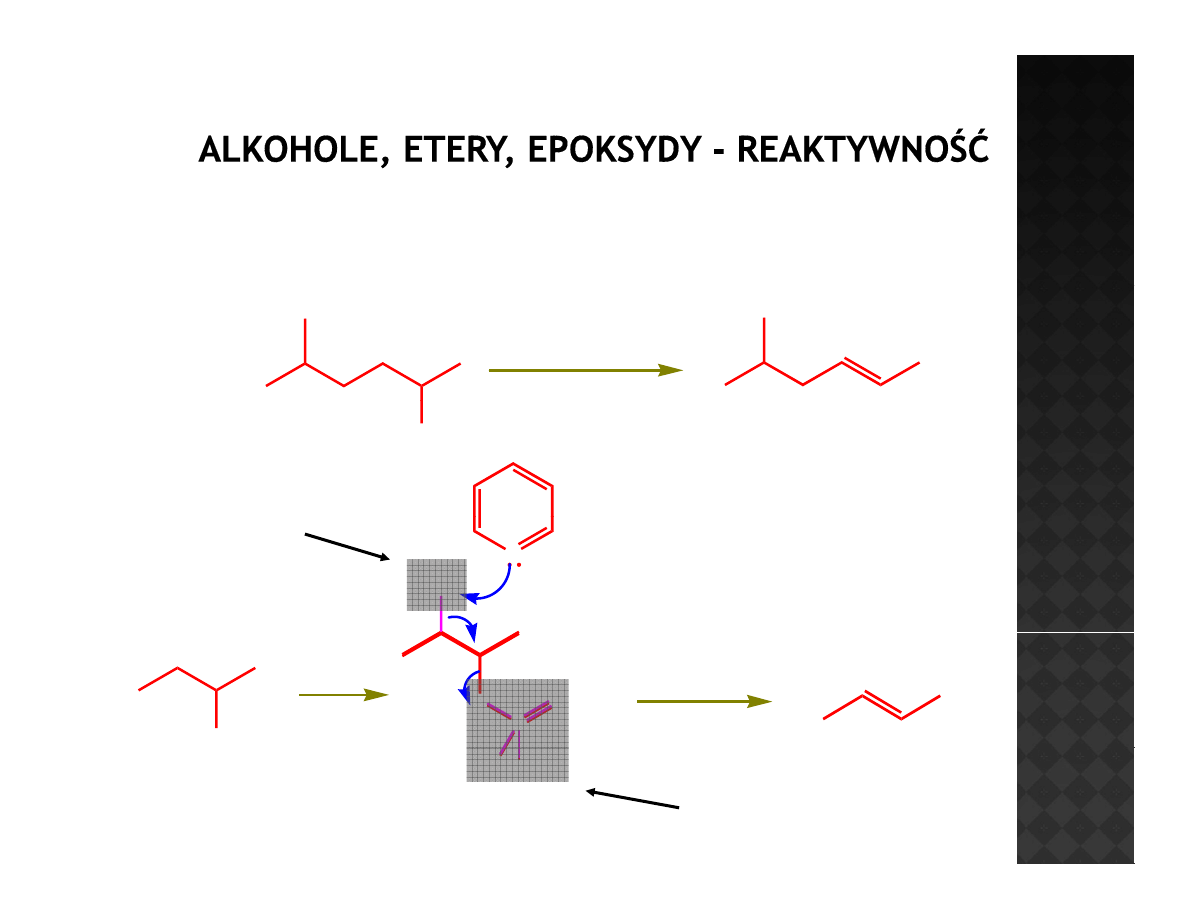
Odwadnianie alkoholi
Różnica w temperaturach wrzenia pozwala na wydzielenie produktu
Reaktywność alkoholi
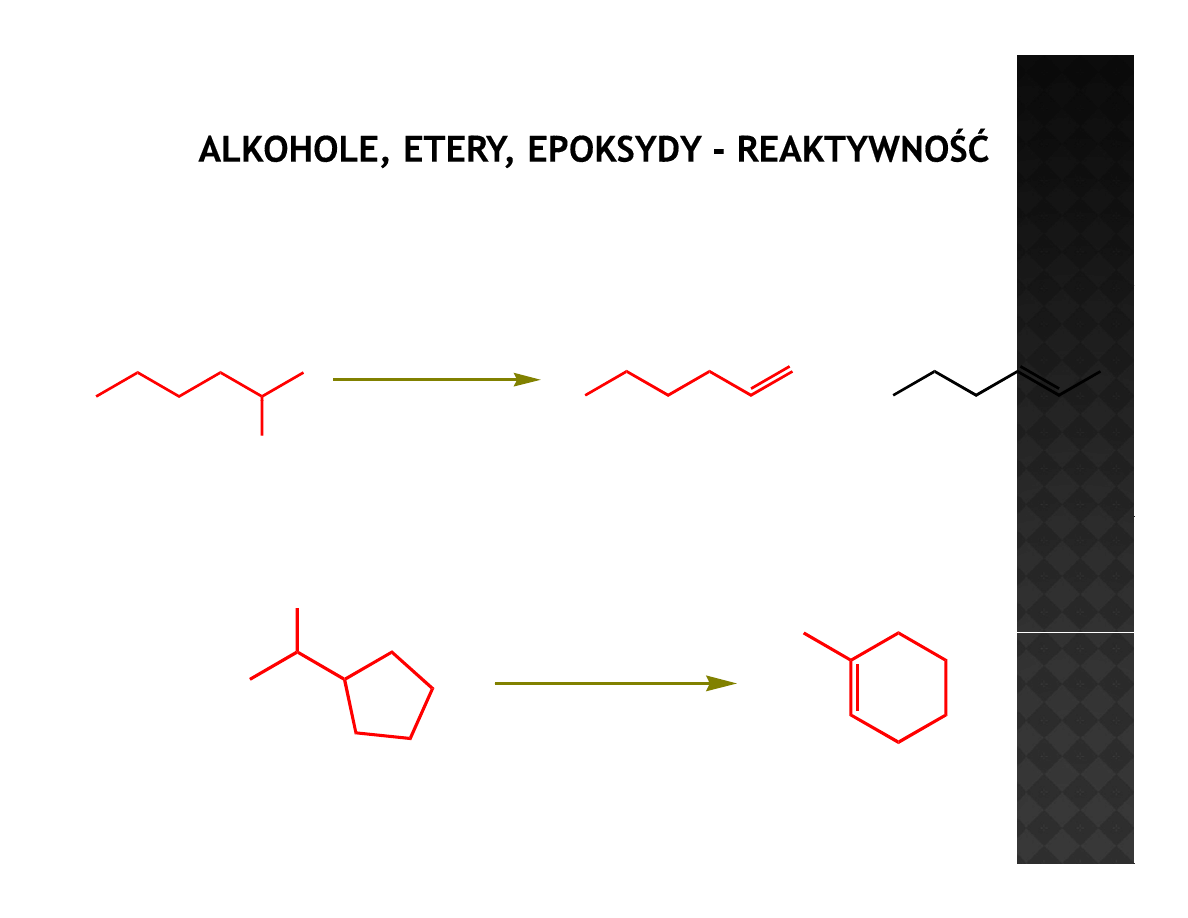
Odwadnianie alkoholi
H
2
SO
4
+
grzanie
OH
g³ówny
grzanie
Tworzy się trwalszy alken
OH
H
2
SO
4
grzanie
Kation się przegrupowuje ze względu na wyższą rzędowość
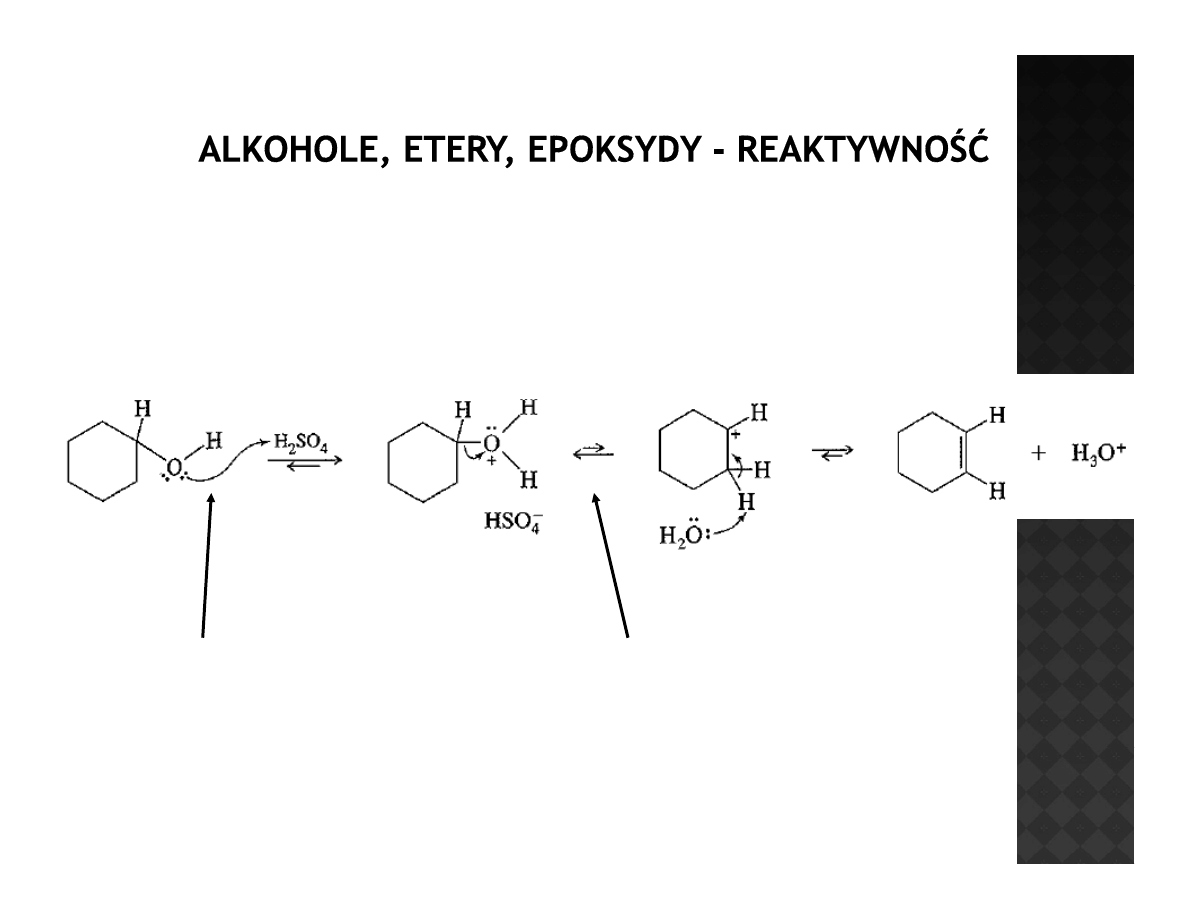
Reaktywność alkoholi
Odwadnianie alkoholi
Przyłączenie protonu
do tlenu
Odejście wody i
utworzenie karbokationu
Reaktywność alkoholi
Odwadnianie alkoholi
POCl
3
Pirydyna
OH
β
t
H
N
β-proton
OH
POCl
3
Pirydyna
Py*HCl
O
P
O
O
P
O
- Py*HCl
Cl
Cl
Cl
Cl
Doskonała grupa opuszczająca
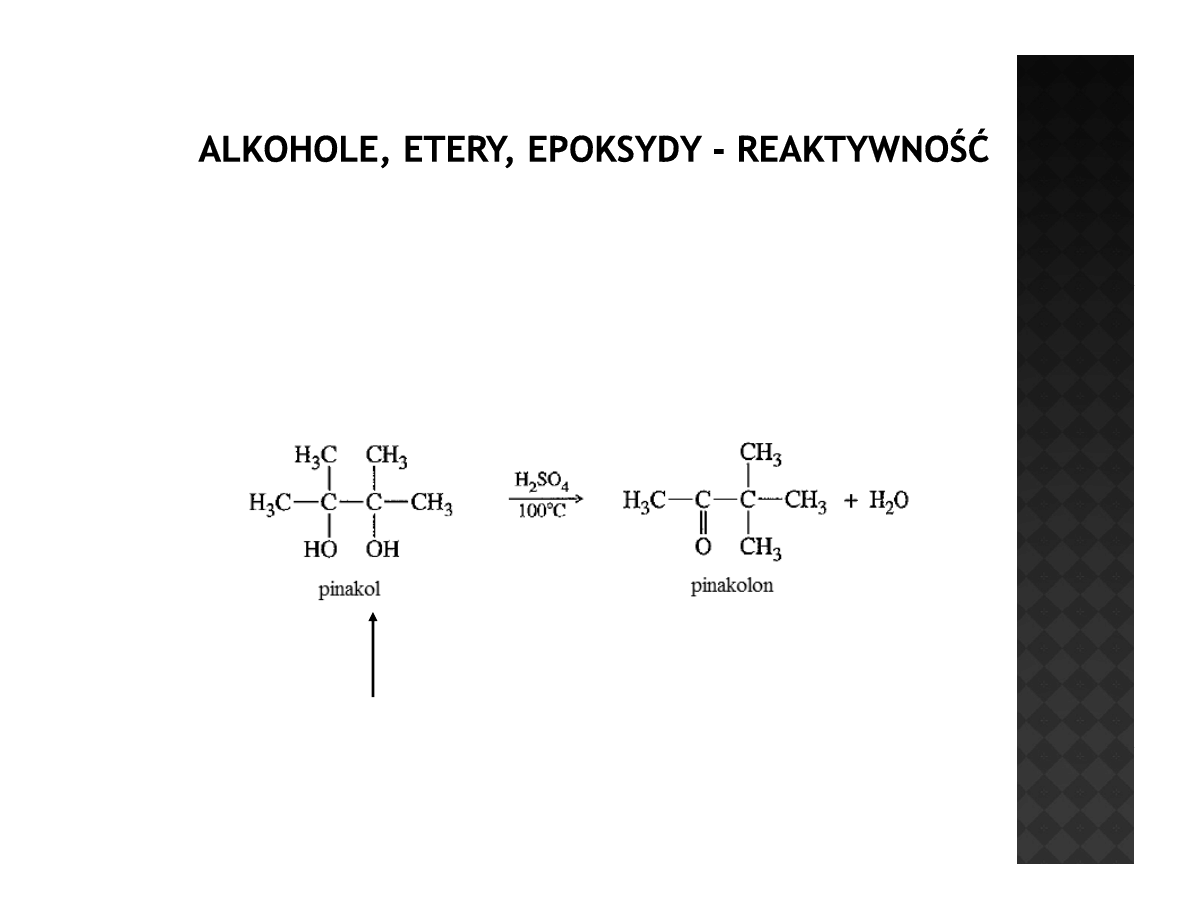
Reaktywność alkoholi
Przegrupowanie pinakolinowe dioli
Brak protonu
β więc reakcja nie powinna zajść
Brak protonu
β więc reakcja nie powinna zajść
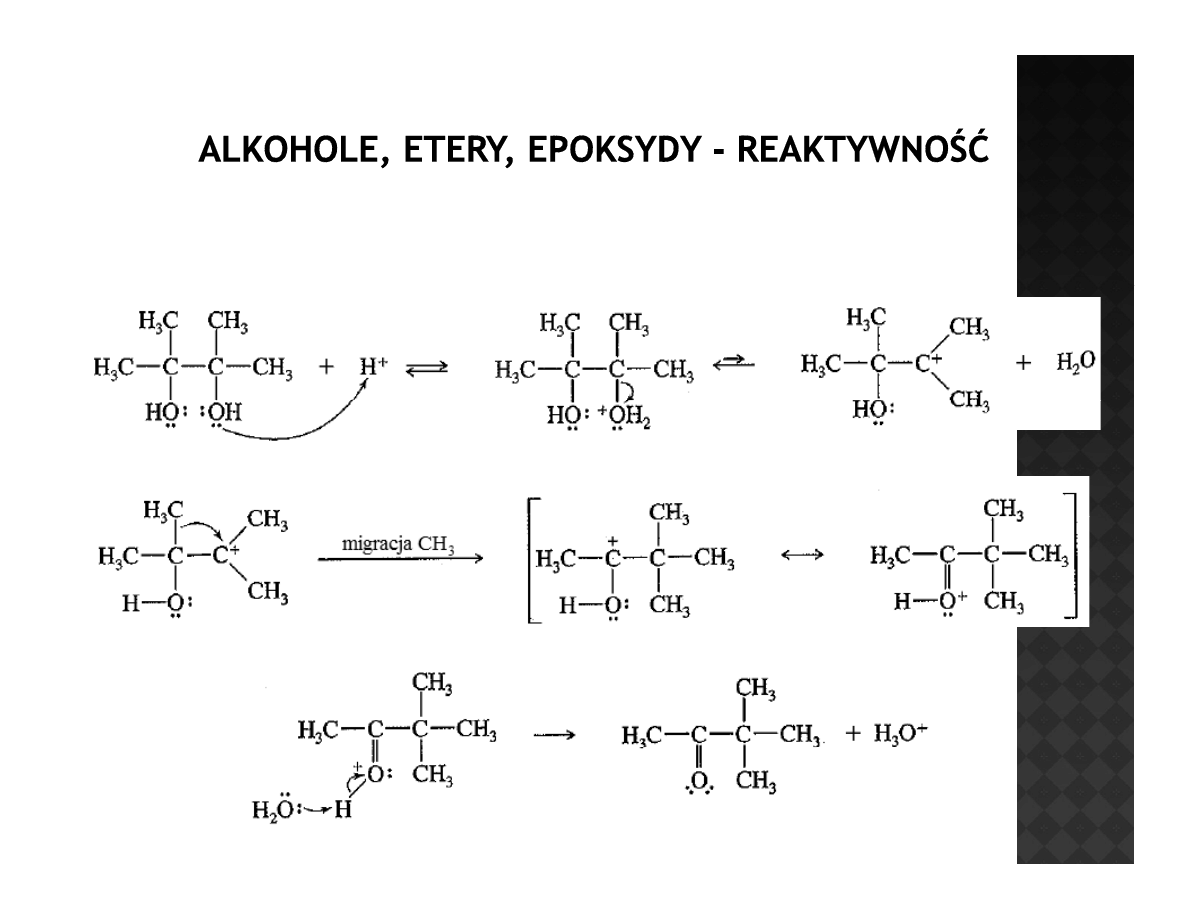
Reaktywność alkoholi
Przegrupowanie pinakolinowe dioli
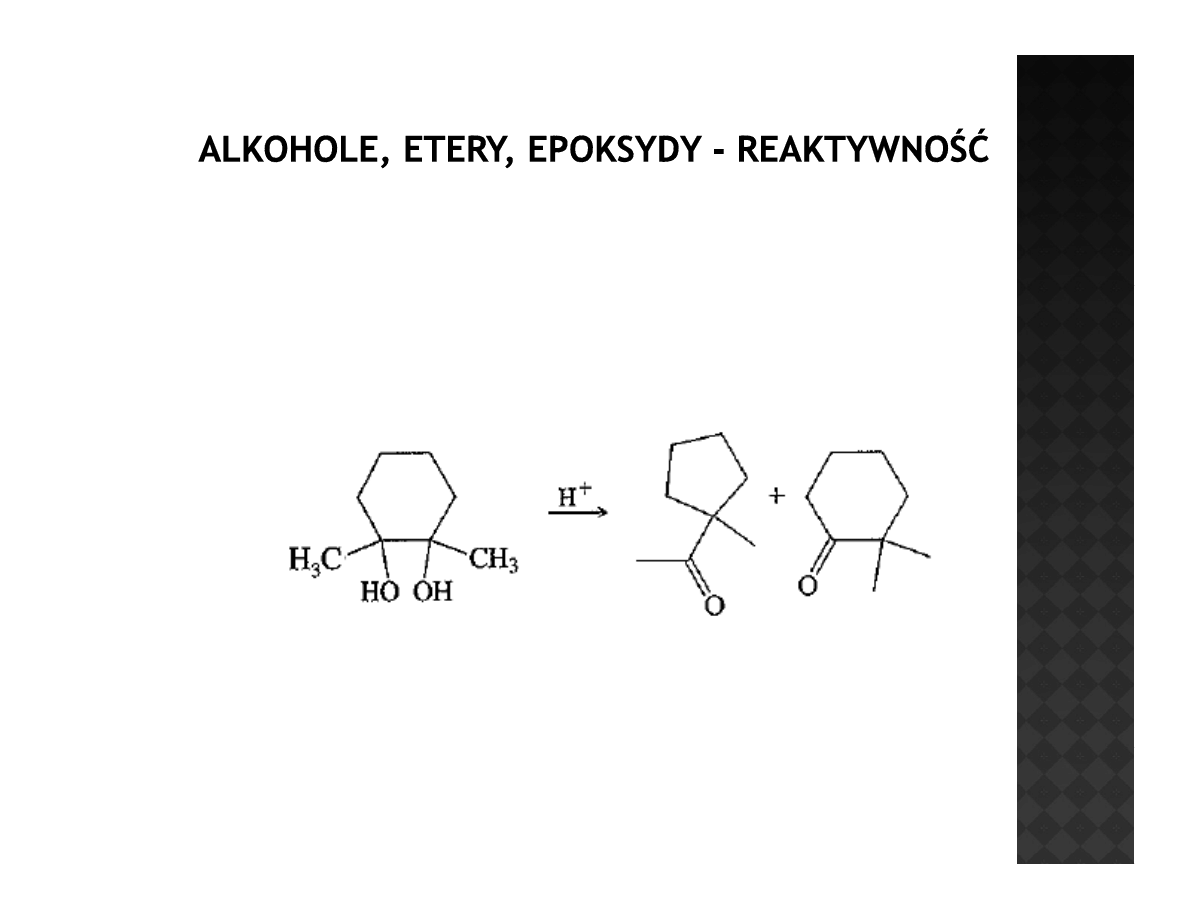
Reaktywność alkoholi
Przegrupowanie pinakolinowe dioli
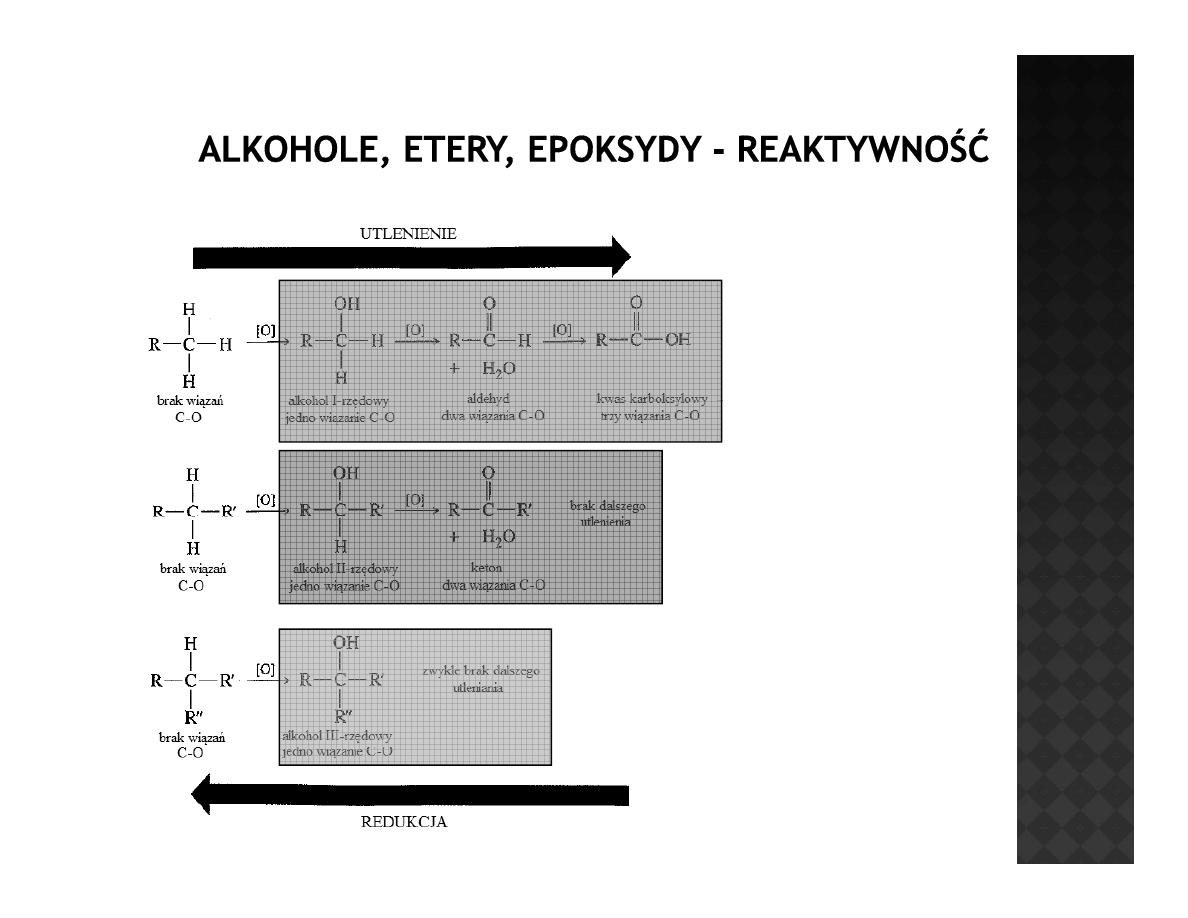
Reaktywność alkoholi
Utlenianie alkoholi
Utlenianie alkanów
prowadzi do
prowadzi do
powstawania całej gamy
związków w zależności
od budowy wyjściowego
alkanu
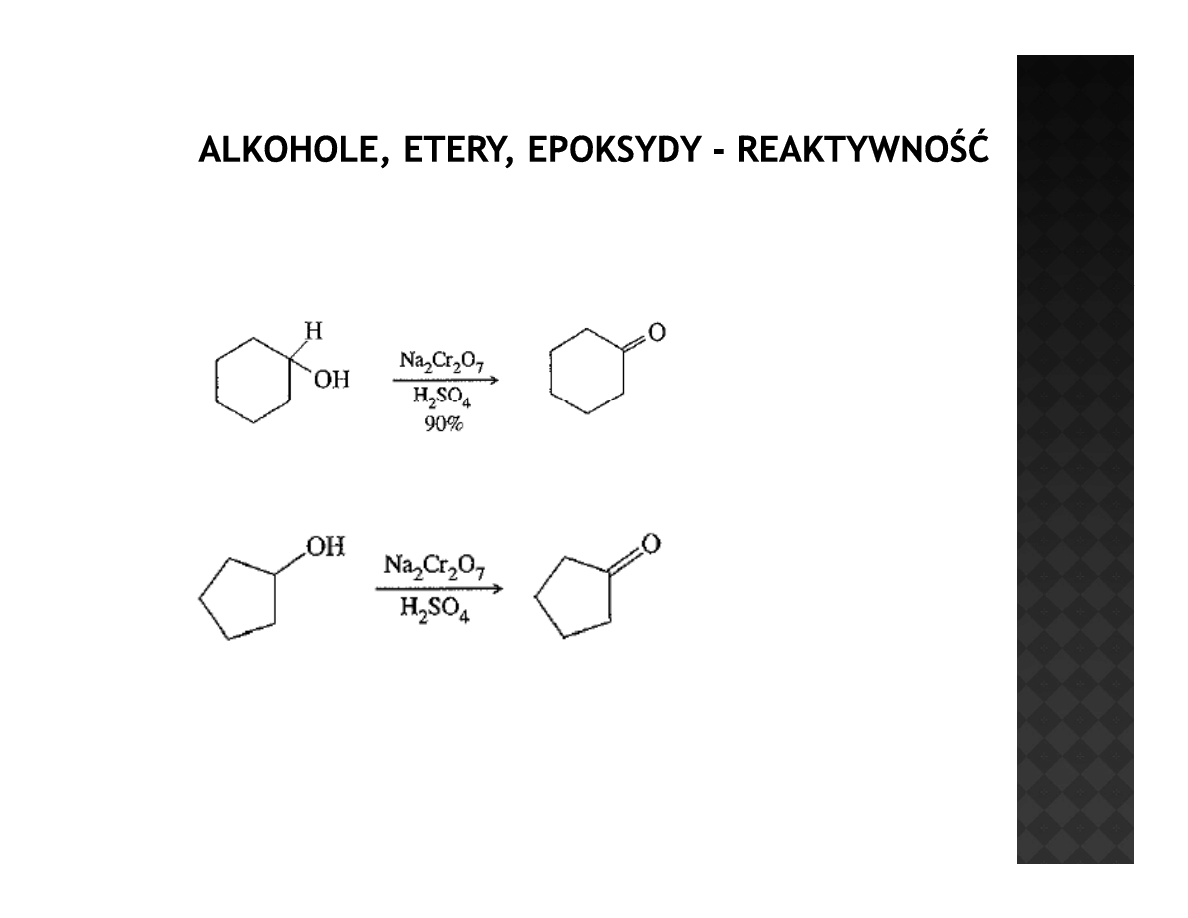
Reaktywność alkoholi
Utlenianie alkoholi II-rzędowych
Środowisko kwaśne
jest potrzebne do
otrzymania
otrzymania
właściwego utleniacza
Chromian bądź dwuchromian sodu – podstawowy utleniacz dla
niewymagających alkoholi
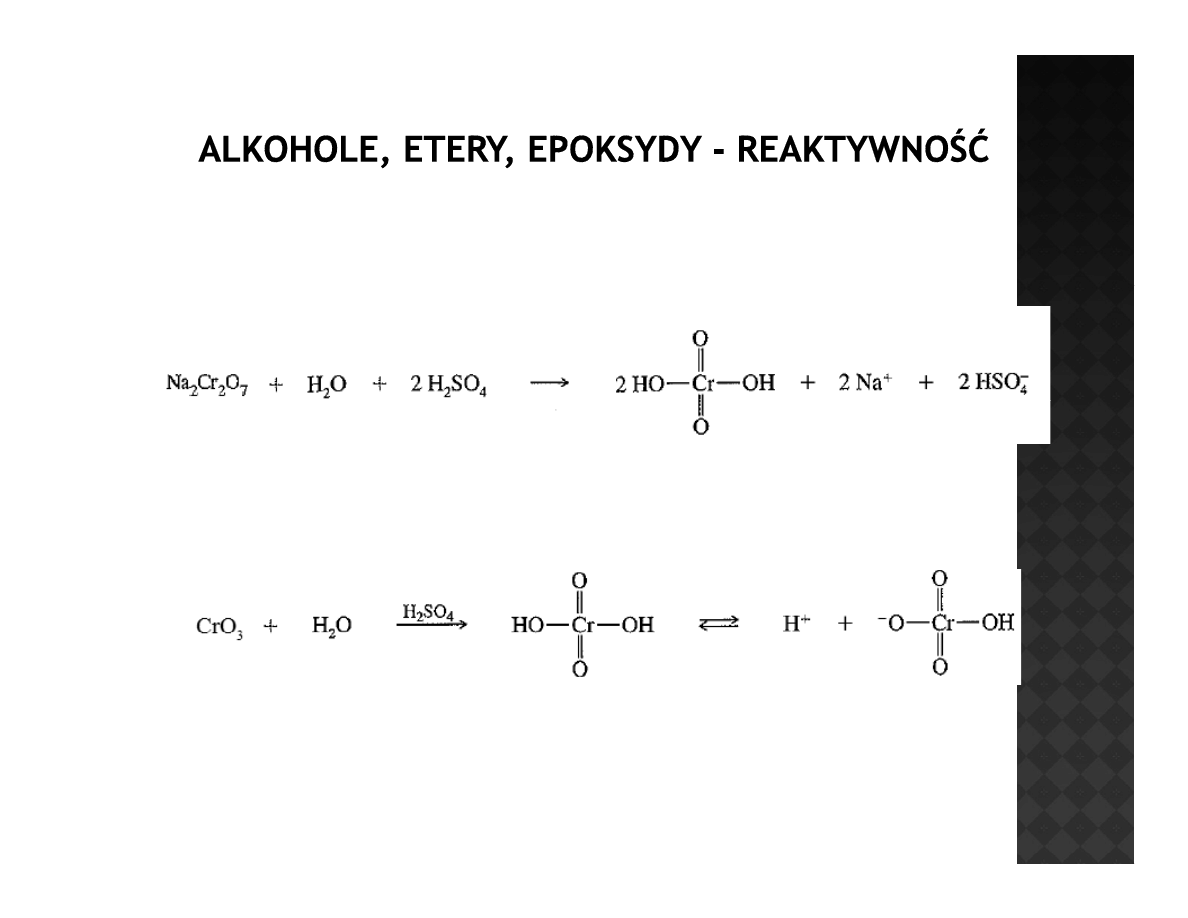
Reaktywność alkoholi
Utlenianie alkoholi II-rzędowych
kwas chromowy
kwaśny chromian
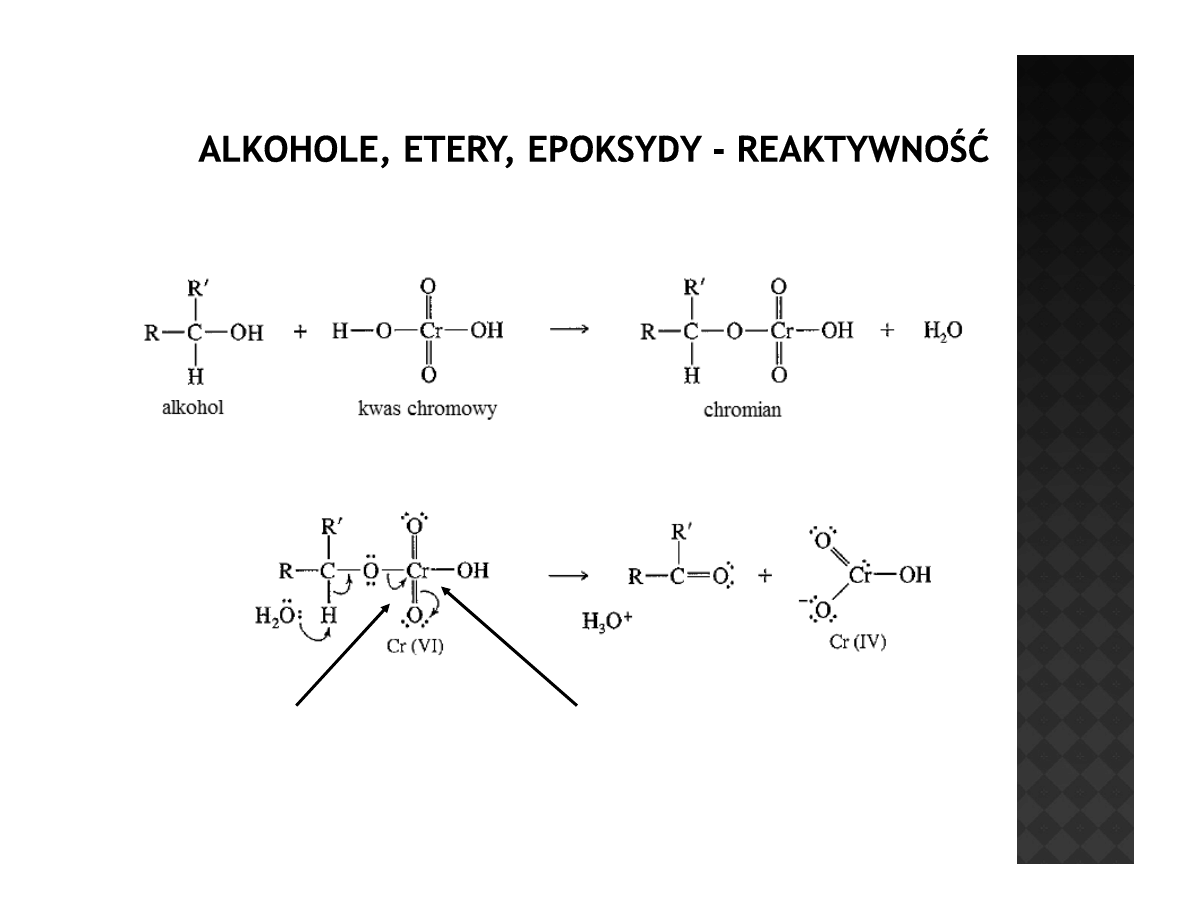
Reaktywność alkoholi
Utlenianie alkoholi II-rzędowych
Tlen oddaje dwa elektrony
na atom chromu
Chrom może przyjąć aż
6 elektronów
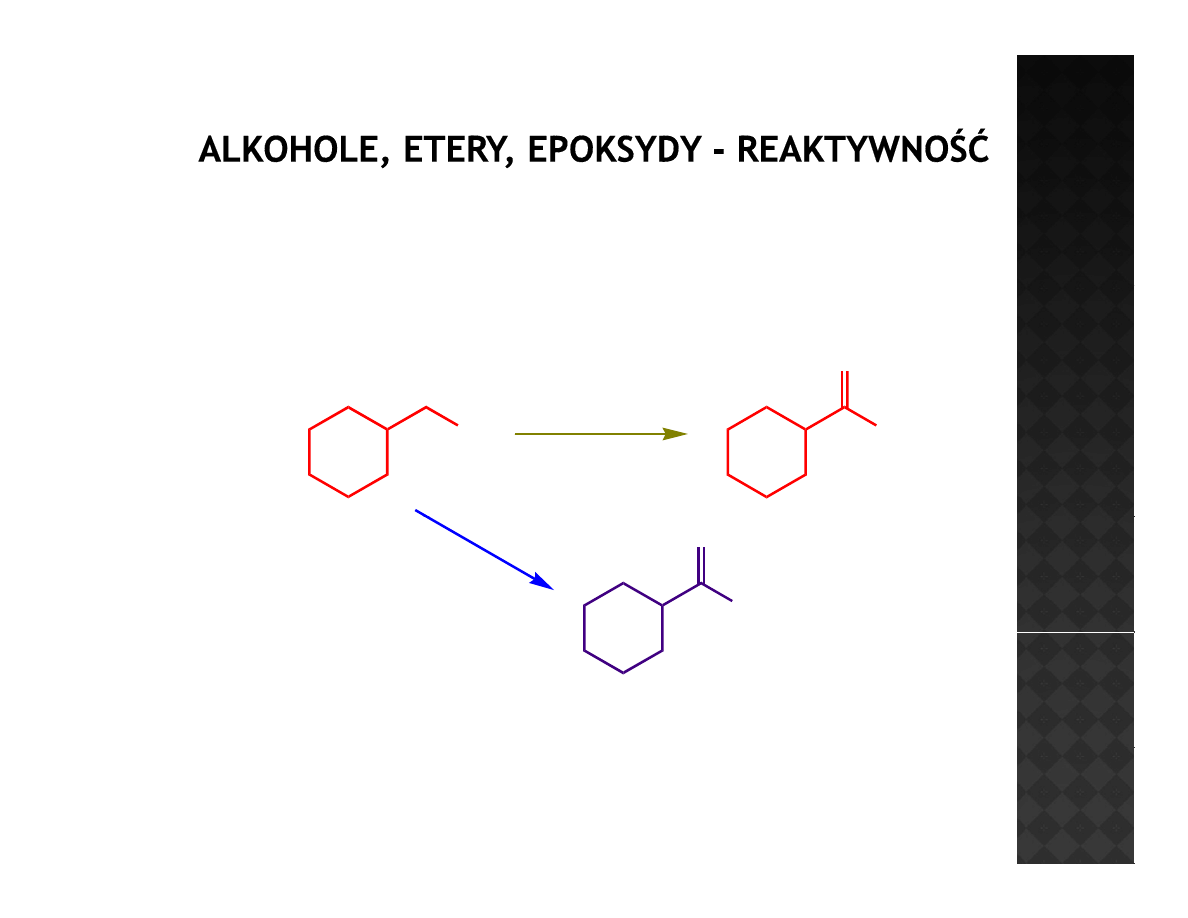
Reaktywność alkoholi
Utlenianie alkoholi I-rzędowych
O
OH
Na
2
CrO
4
H
2
SO
4
OH
92%
?
H
O
Czy jest możliwość zatrzymać proces utlenienia na etapie aldehydu?
Czy jest możliwość zatrzymać proces utlenienia na etapie aldehydu?
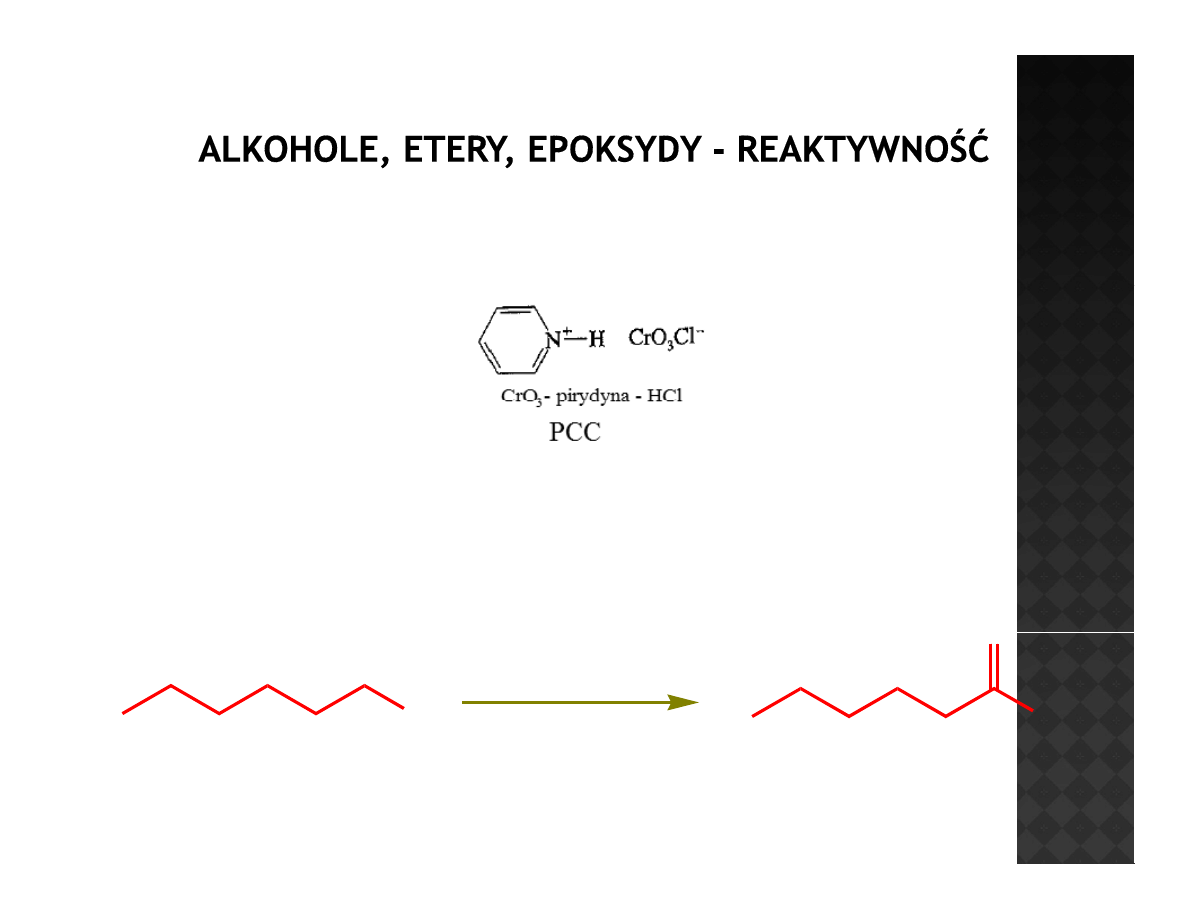
Reaktywność alkoholi
Utlenianie alkoholi I-rzędowych
Jest to tak naprawdę zdezaktywowany bezwodnik kwasu chromowego, który
swoją mniejszą aktywność zawdzięcza pirydynie która kompleksuje chrom
swoją mniejszą aktywność zawdzięcza pirydynie, która kompleksuje chrom
oslabiając jego zdolności do przyjmowania elektronów
O
OH
PCC
DCM
H
O
78%
78%
Inny odczynnik utleniający tylko do aldehydów – MnO
2
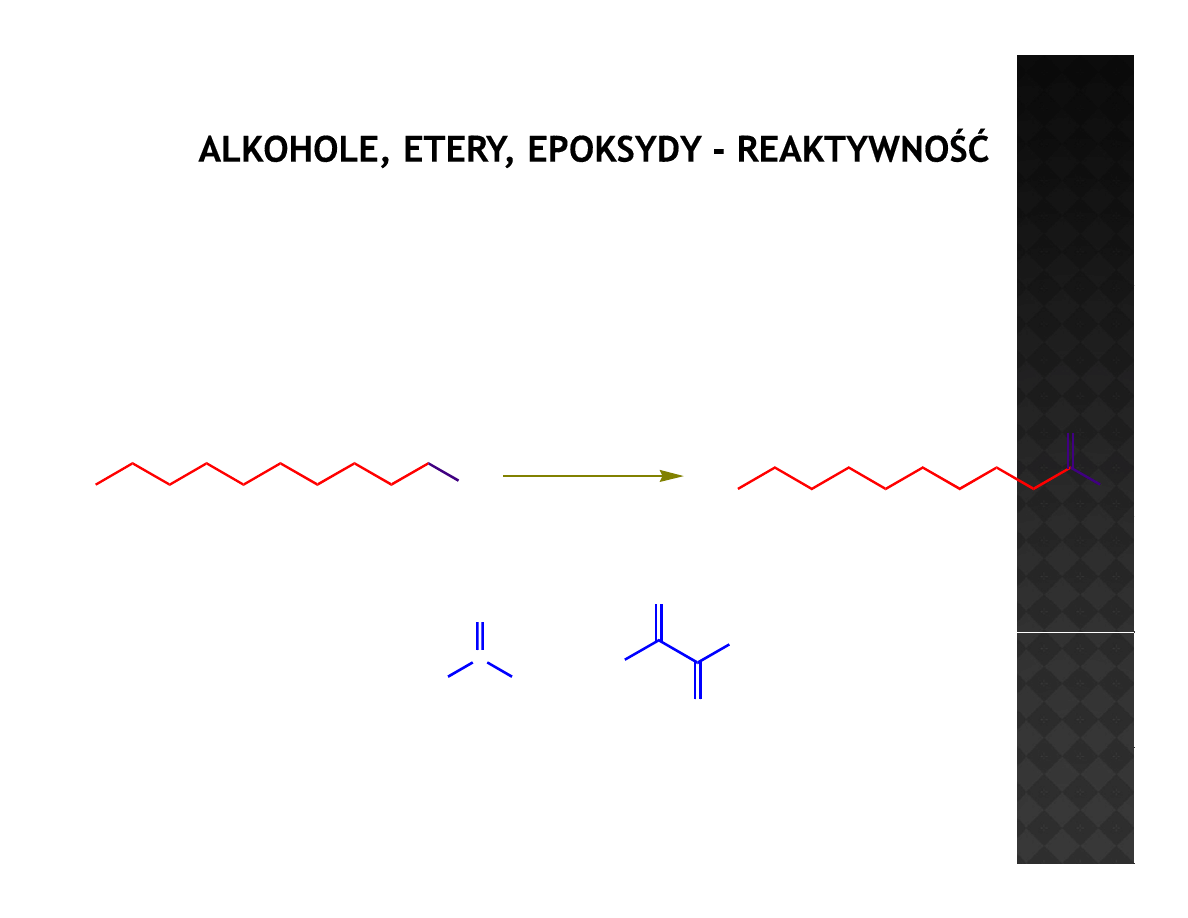
Reaktywność alkoholi
Utlenianie Swerna
OH
DMSO, (COCl)
2
H
O
85%
Et
3
N, DCM, -60
o
C
85%
O
O
H
3
C
S
CH
3
Cl
Cl
O
Gdzie tu jest utleniacz?
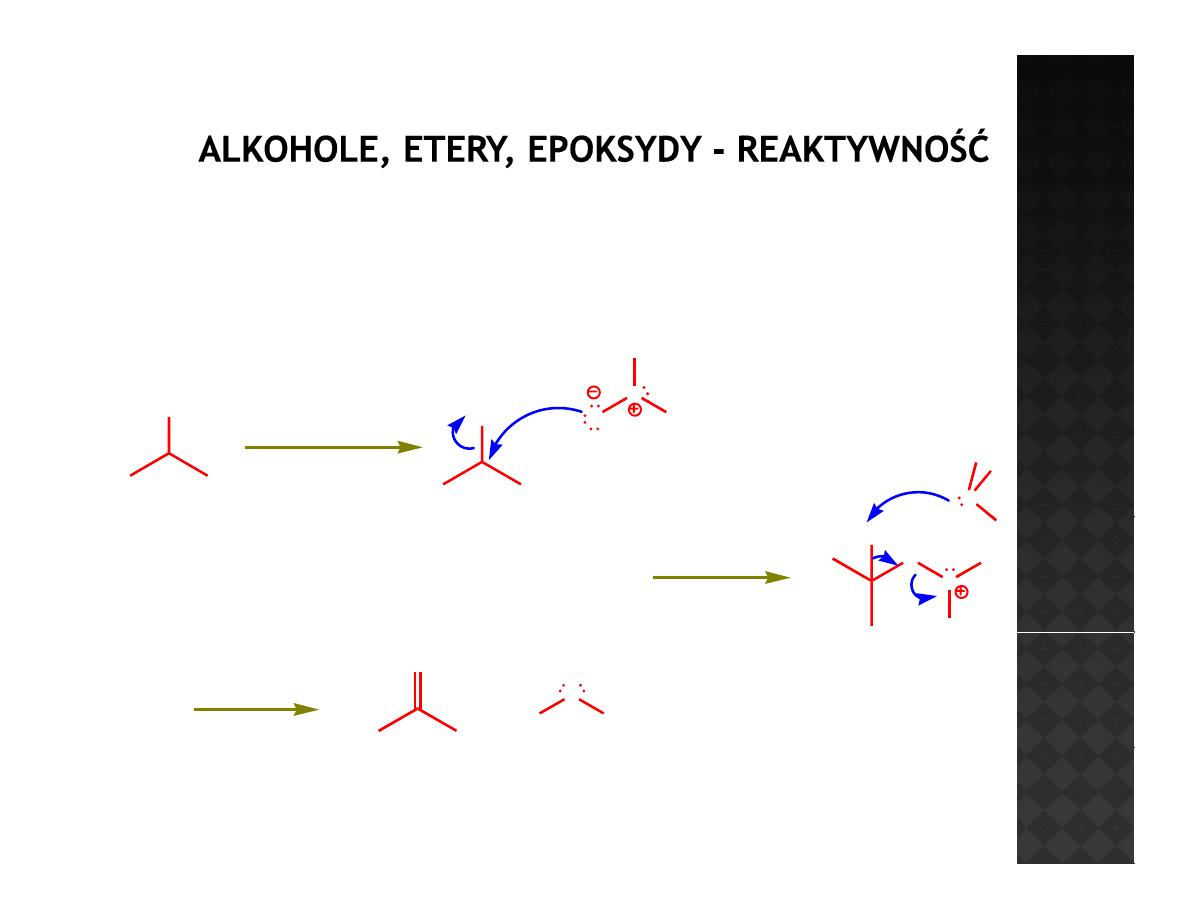
Reaktywność alkoholi
Utlenianie Swerna
S
CH
3
OH
(COCl)
2
- CO
2
, -CO, -HCl
Cl
O
CH
3
N
Et
Et
O
S
CH
3
CH
3
H
Et
3
O
+
H
3
C
S
CH
3
+ NEt
3
-HCl

Reaktywność alkoholi
Utlenianie alkoholi - podsumowanie
Alkohol I-rzędowy:
-do aldehydu – PCC, MnO
2
, utlenianie Swerna
d k
k b k l
k żd
tl i
N C O
-do kwasu karboksylowego – każdy mocny utleniacz – Na
2
CrO
4
,
KMnO
4
, HNO
3
itd.
Alkohol II-rzędowy:
-do ketonu: każdy odczynnik utleniający
do ketonu: każdy odczynnik utleniający
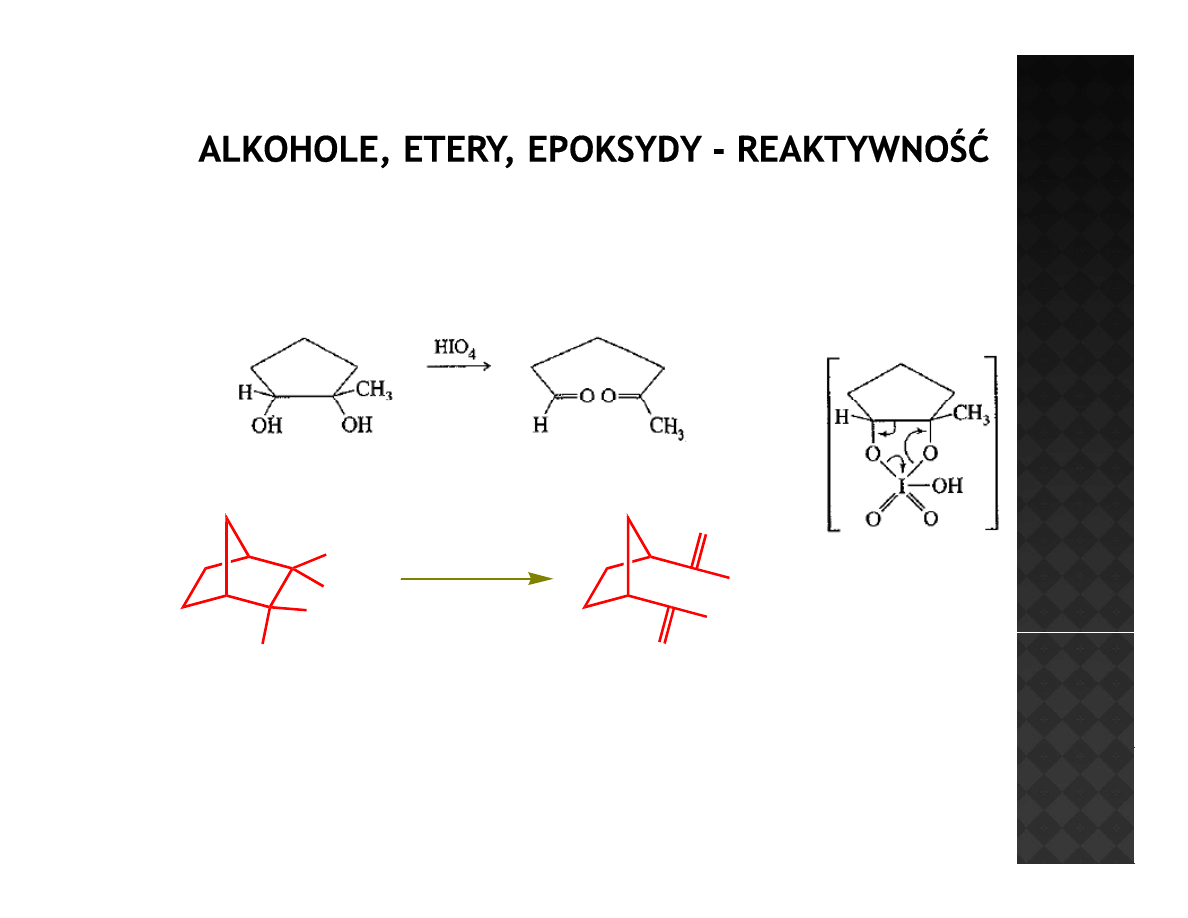
Reaktywność alkoholi
Utlenianie dioli
OH
OH
HIO
4
H
O
H
H
H
O
W przypadku potraktowania dowolnego diolu kwasem nadjodowym w
p yp
p
g
j
y
pierwszej kolejności tworzy się diester kwasu nadjodowego, który
rozkłada się elektrocyklicznie do dialdehydu i kwasu jodowego

Reaktywność alkoholi
Alkohole jako nukleofile i elektrofile
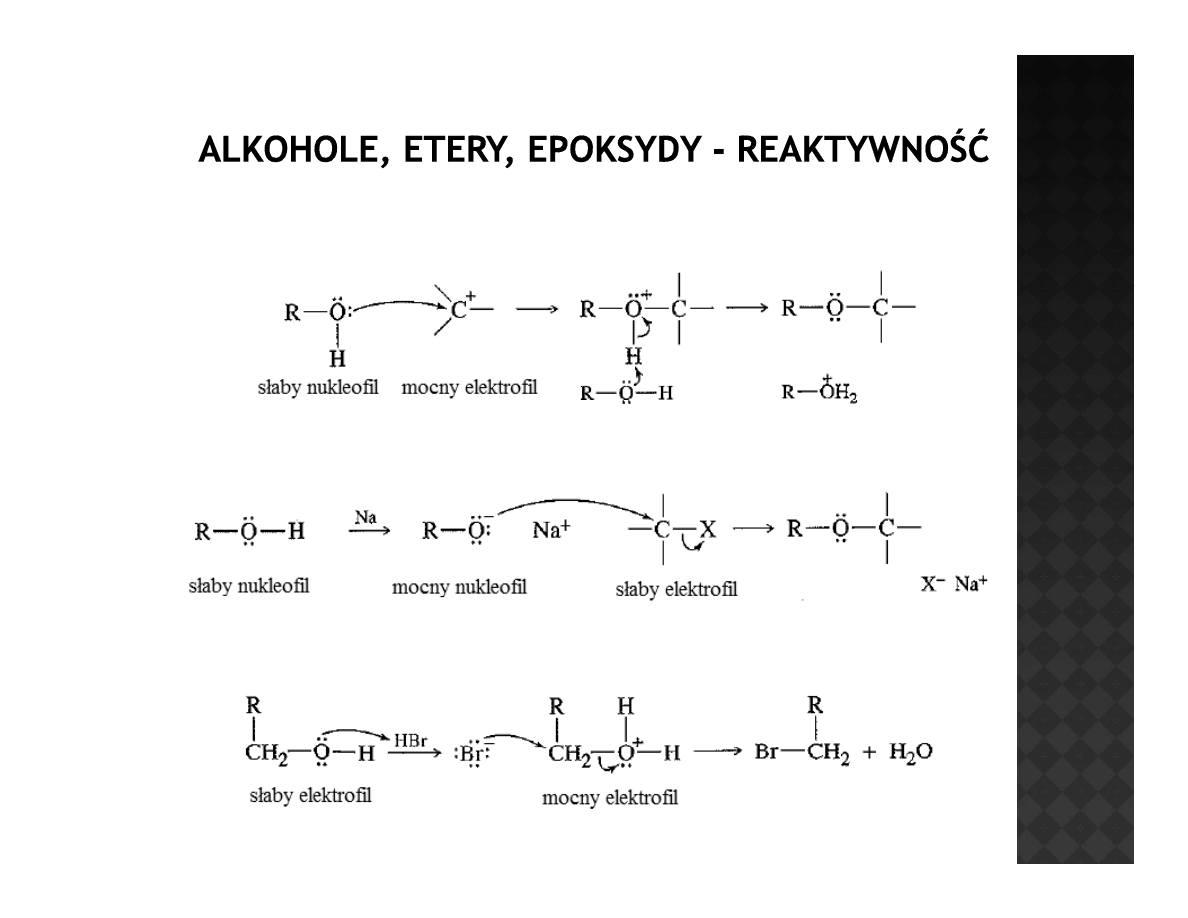
Reaktywność alkoholi
Alkohole jako nukleofile i elektrofile

Reaktywność alkoholi
Alkohole jako nukleofile i elektrofile
W dużej części reakcji z udziałem alkoholi jako substratów obserwuje się
sytuację, że alkohol ulega w tej samej reakcji zarówno jako elektrofil jak i
nukleofil
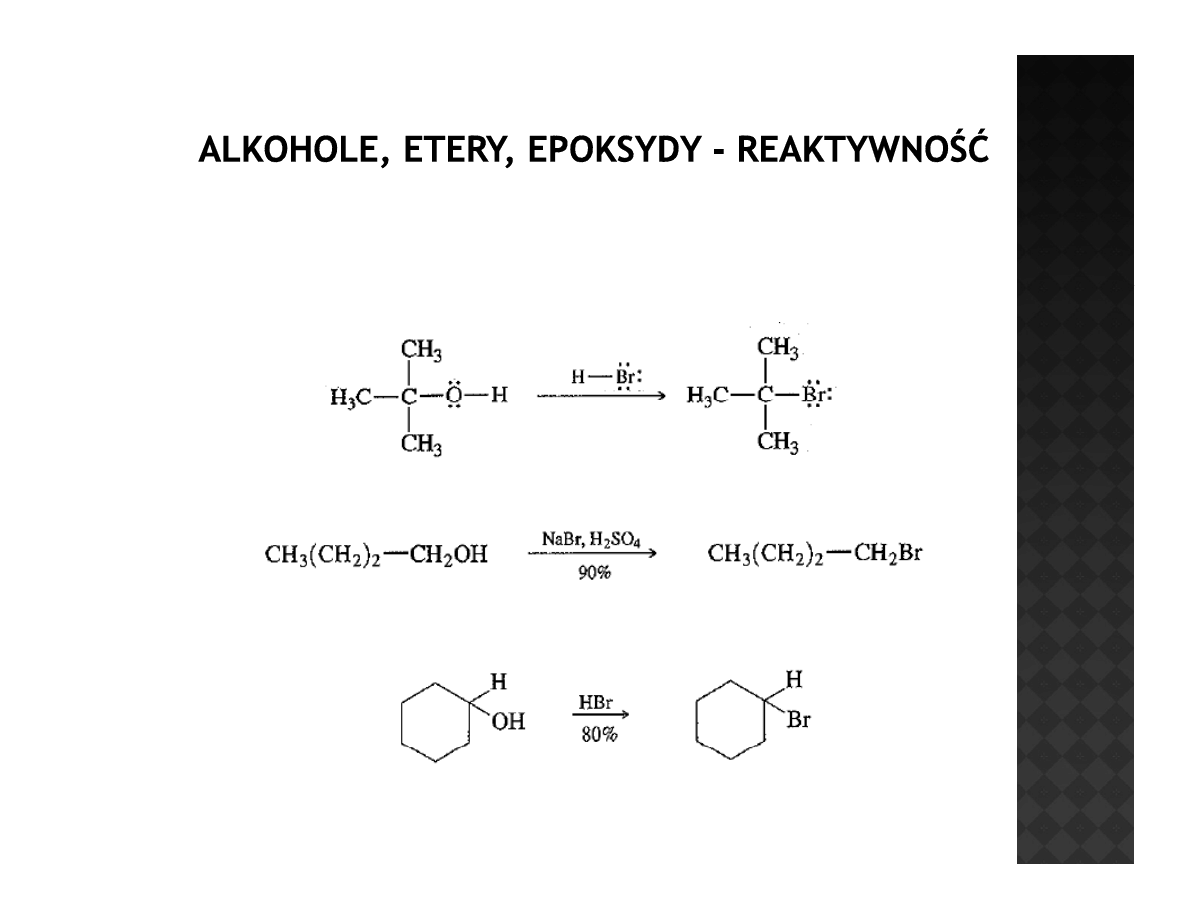
Reaktywność alkoholi
Reakcja z halogenowodorami
Reaktywność alkoholi
Reakcja z halogenowodorami
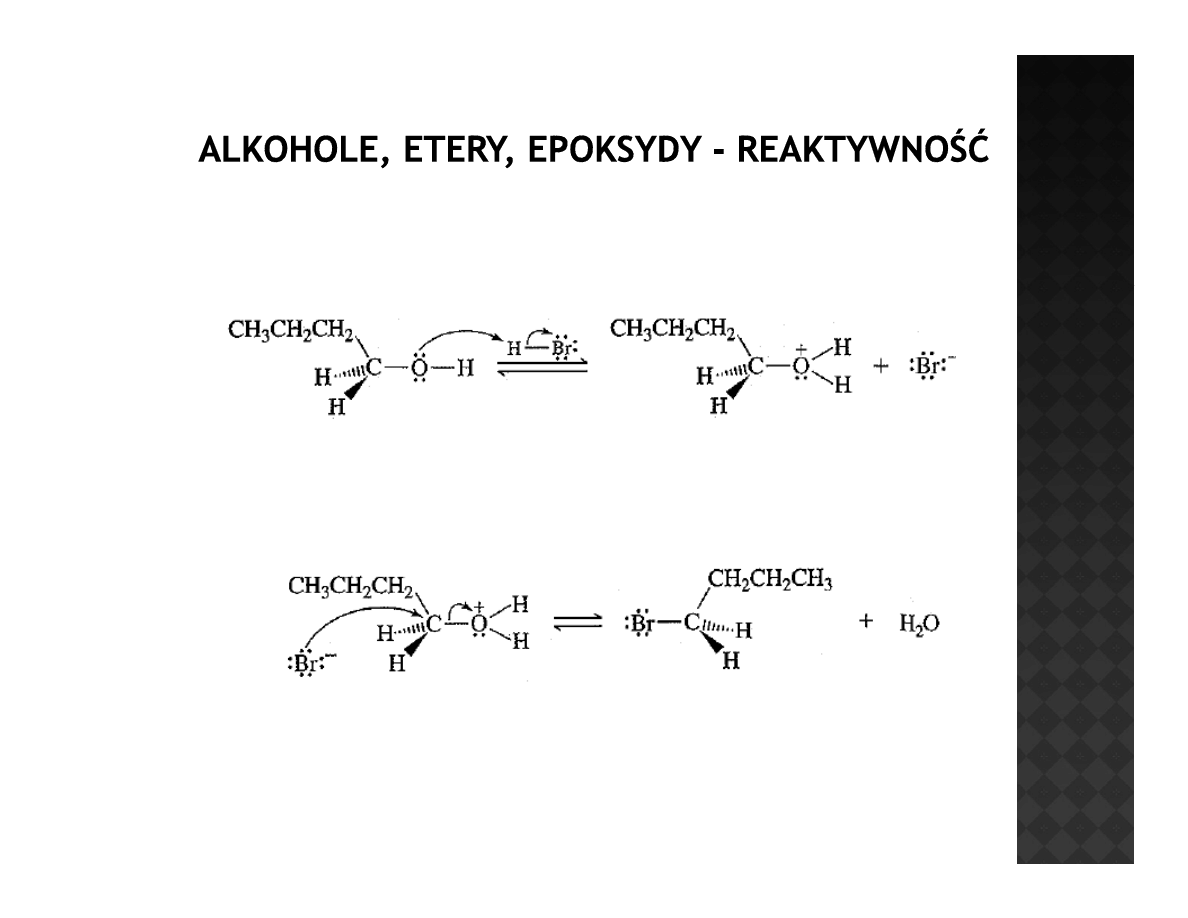
Reaktywność alkoholi
Reakcja z halogenowodorami
S
N
2
S
N
2
S
N
2
Reakcja składa się właściwie z dwóch reakcji S 2 początkowo na HBr a
Reakcja składa się właściwie z dwóch reakcji S
N
2, początkowo na HBr a
potem na kationie hydroksoniowym
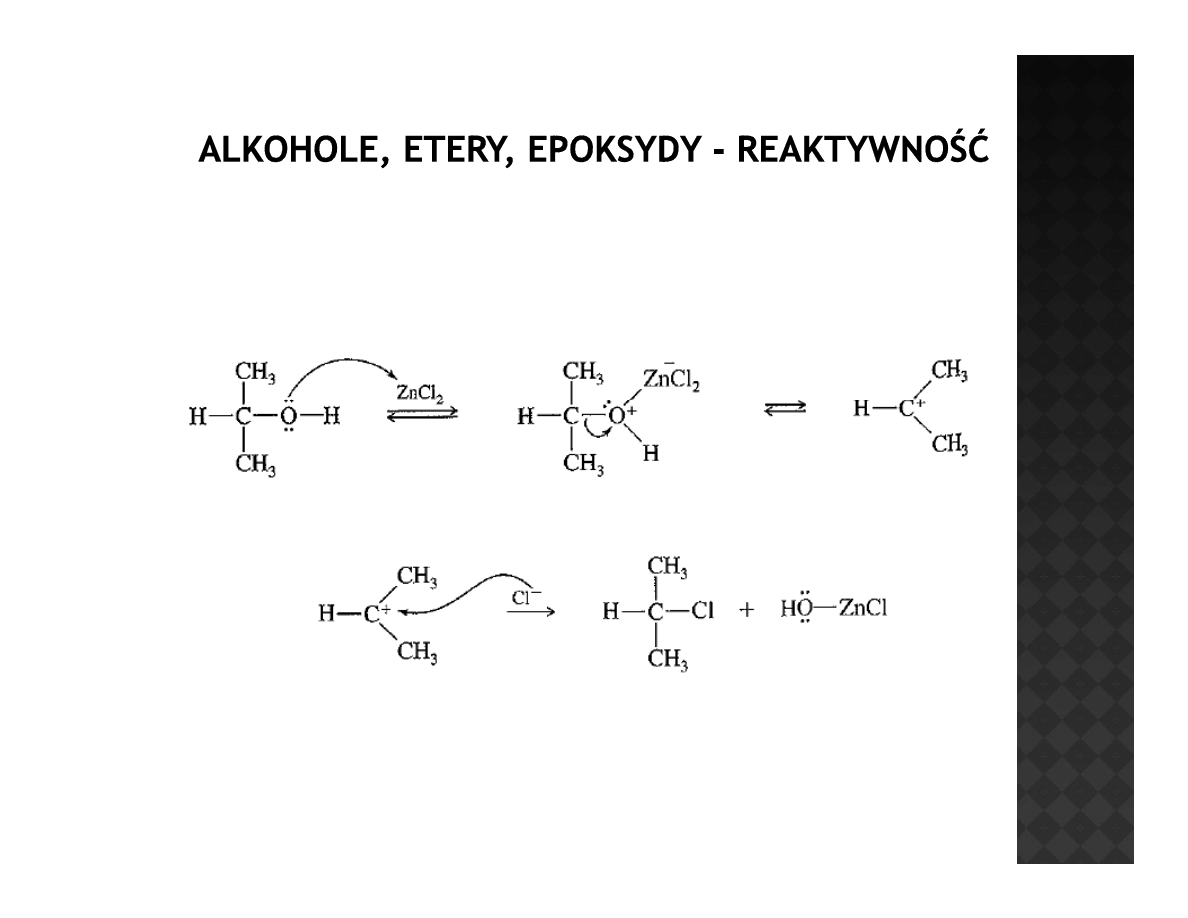
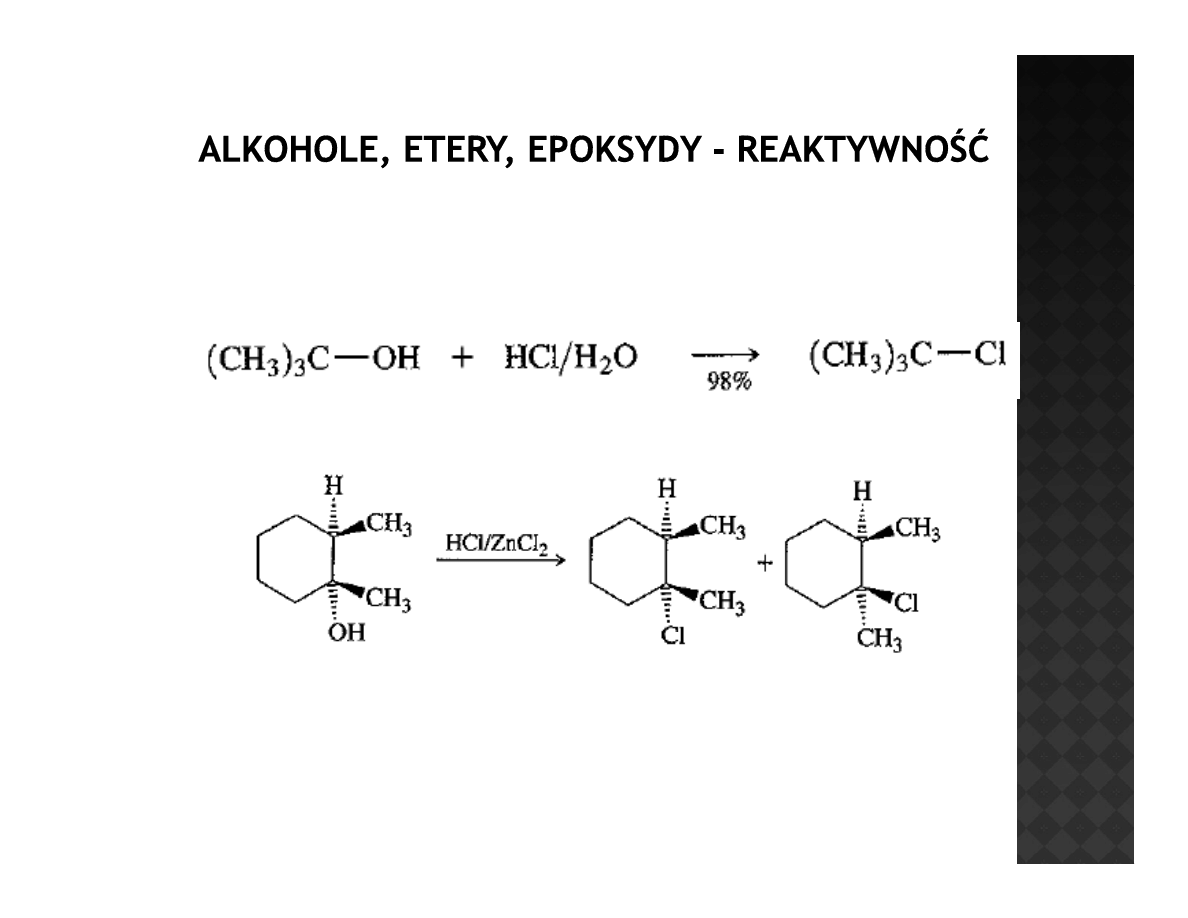
Reaktywność alkoholi
Reakcja z halogenowodorami
Chlorek cynku pełni w tej reakcji rolę kwasu Lewisa, który ma za zadanie
wspomagać tworzenie się karbokationu W przypadku alkoholi I rzędowych
wspomagać tworzenie się karbokationu. W przypadku alkoholi I-rzędowych
ZnCl
2
zwiększa polaryzację wiązania C-O i umożliwia atak anionu
chlorkowego
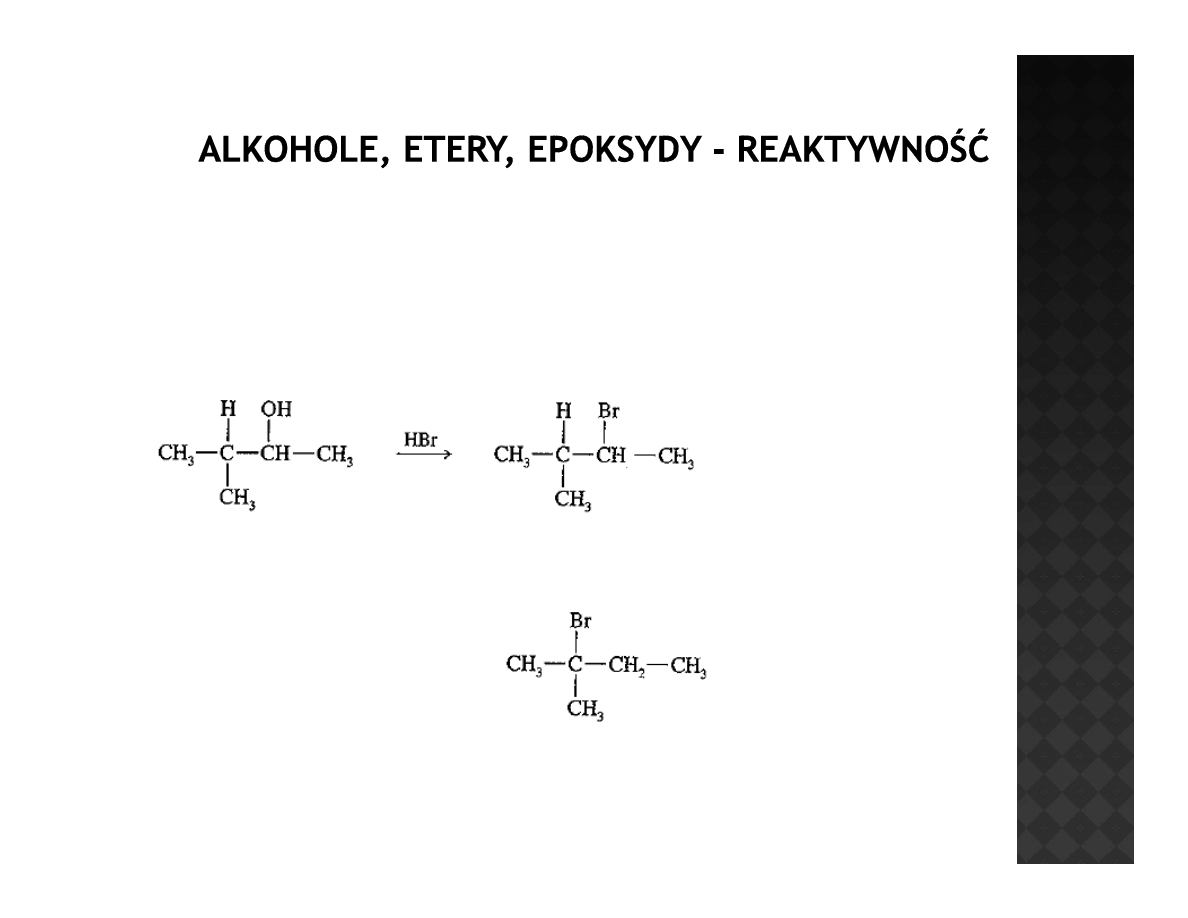
Reaktywność alkoholi
Problemy reakcji alkoholi z HX
Produkt oczekiwany
Produkt rzeczywisty
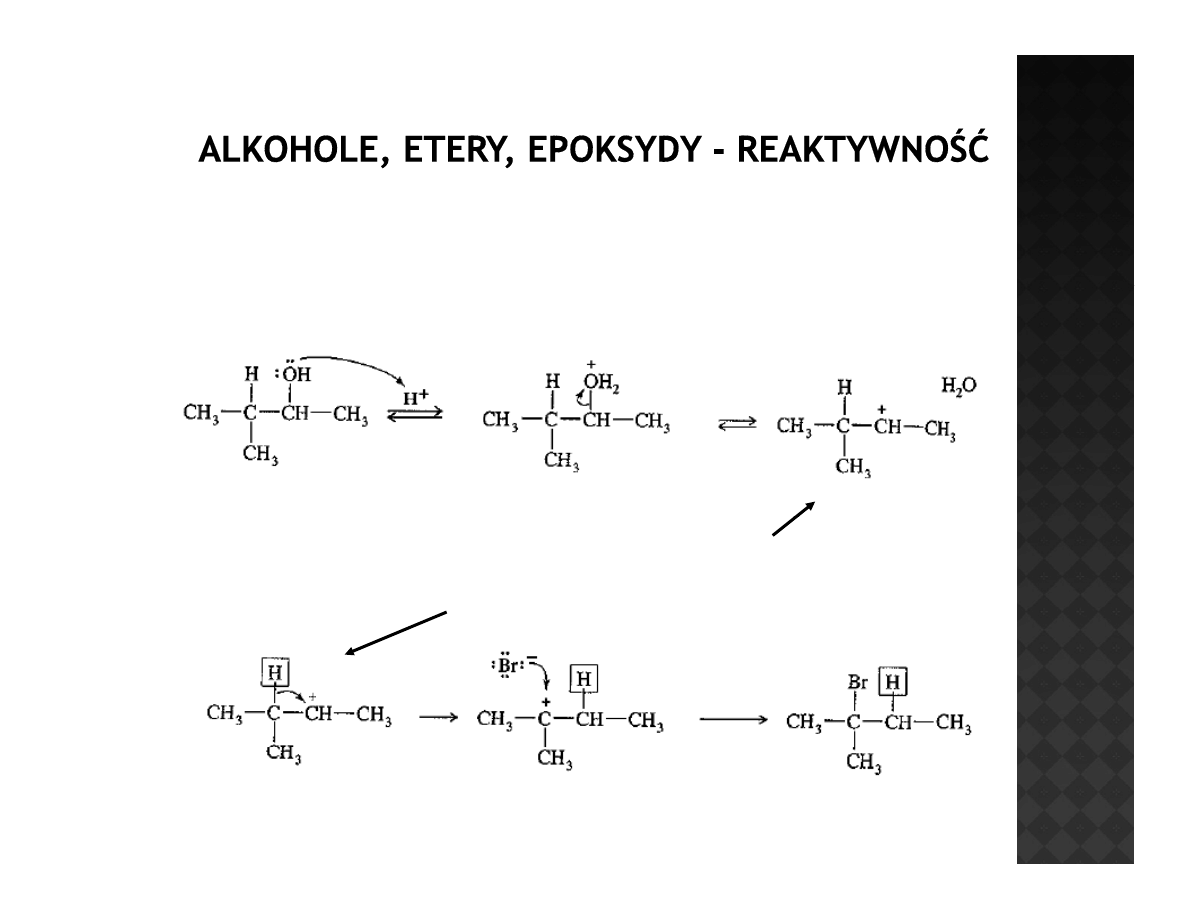
Reaktywność alkoholi
Problemy reakcji alkoholi z HX
Tworzący się karbokation jest drugorzędowy i ma
możliwość przekształcenia się w trzeciorzędowy
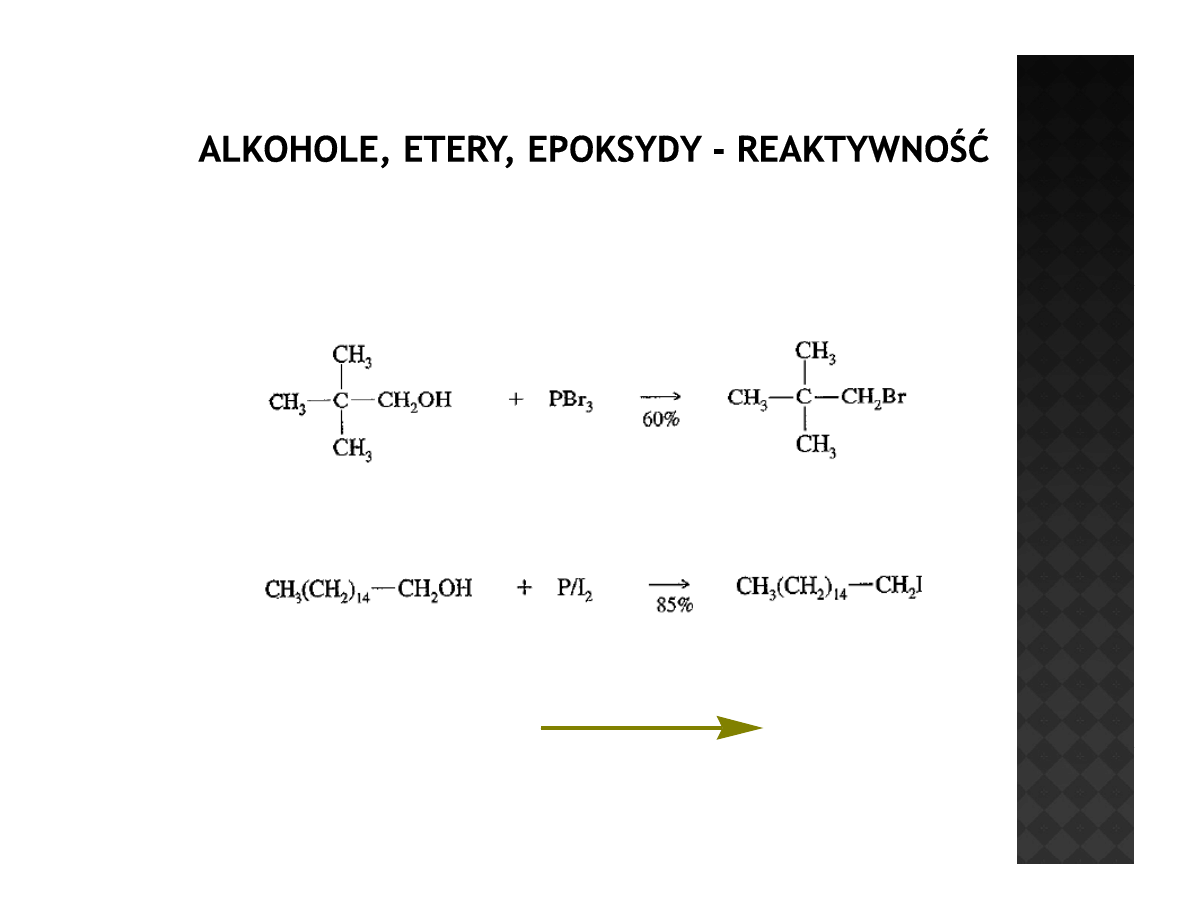
Reaktywność alkoholi
Przekształcenia w haloalkany
2P
+
3I
2
2PI
3
3
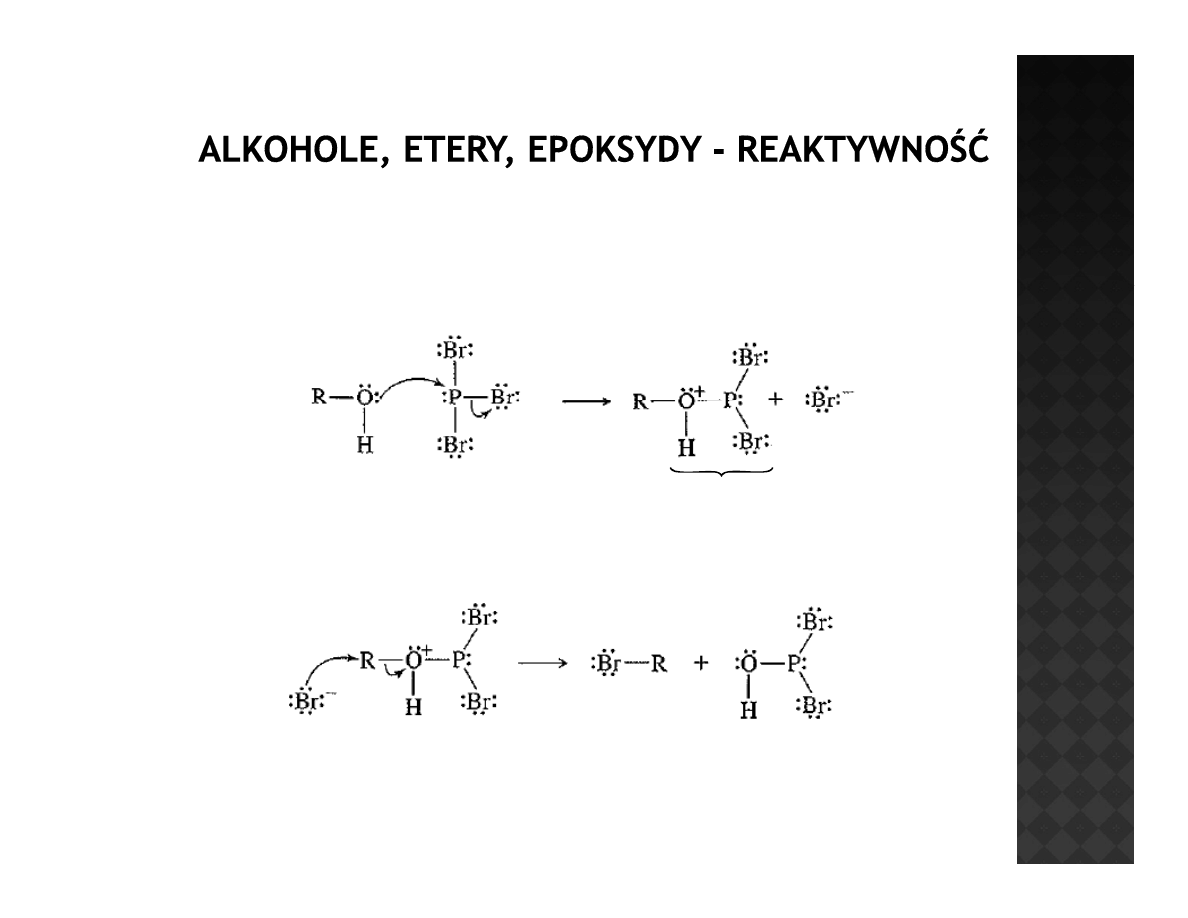
Reaktywność alkoholi
Przekształcenia w haloalkany
bardzo dobra grupa
j
opuszczająca
Przekształcenie alkoholi w halogenki za pomocą trójhalogenków fosforu
zachodzi z inwersją konfiguracji
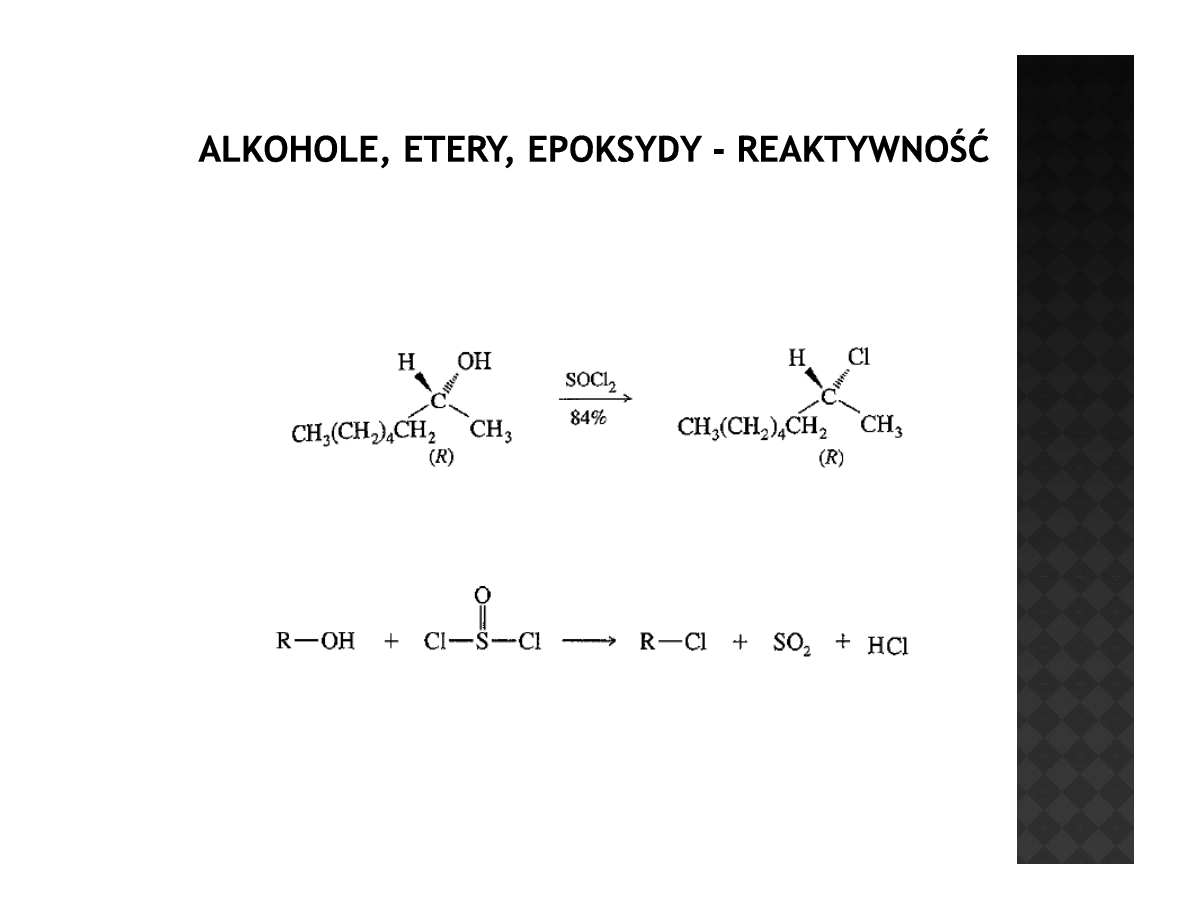
Reaktywność alkoholi
Przekształcenia w haloalkany
Uż i
hl k ti
l
k ji
lk h l
d j
t
i
Użycie chlorku tionylu w reakcji z alkoholem powoduje utworzenie
chloroalkanu jako produktu głównego oraz dwutlenku siarki oraz
chlorowodoru jako produktów ubocznych
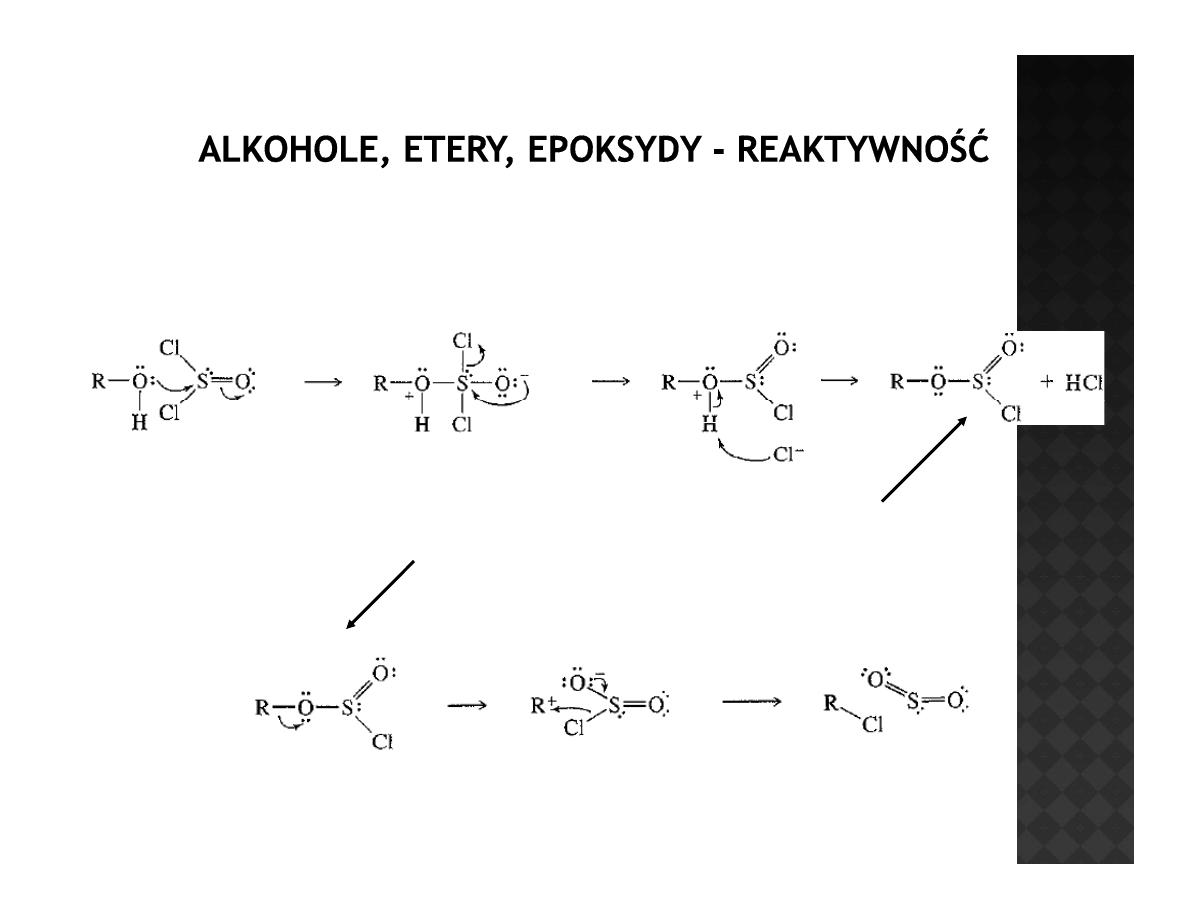
Reaktywność alkoholi
Przekształcenia w haloalkany
W t k i
k ji t
i
hl
lfi i
d kt
jś i
W trakcie reakcji tworzy się chlorosulfinian – produkt przejściowy
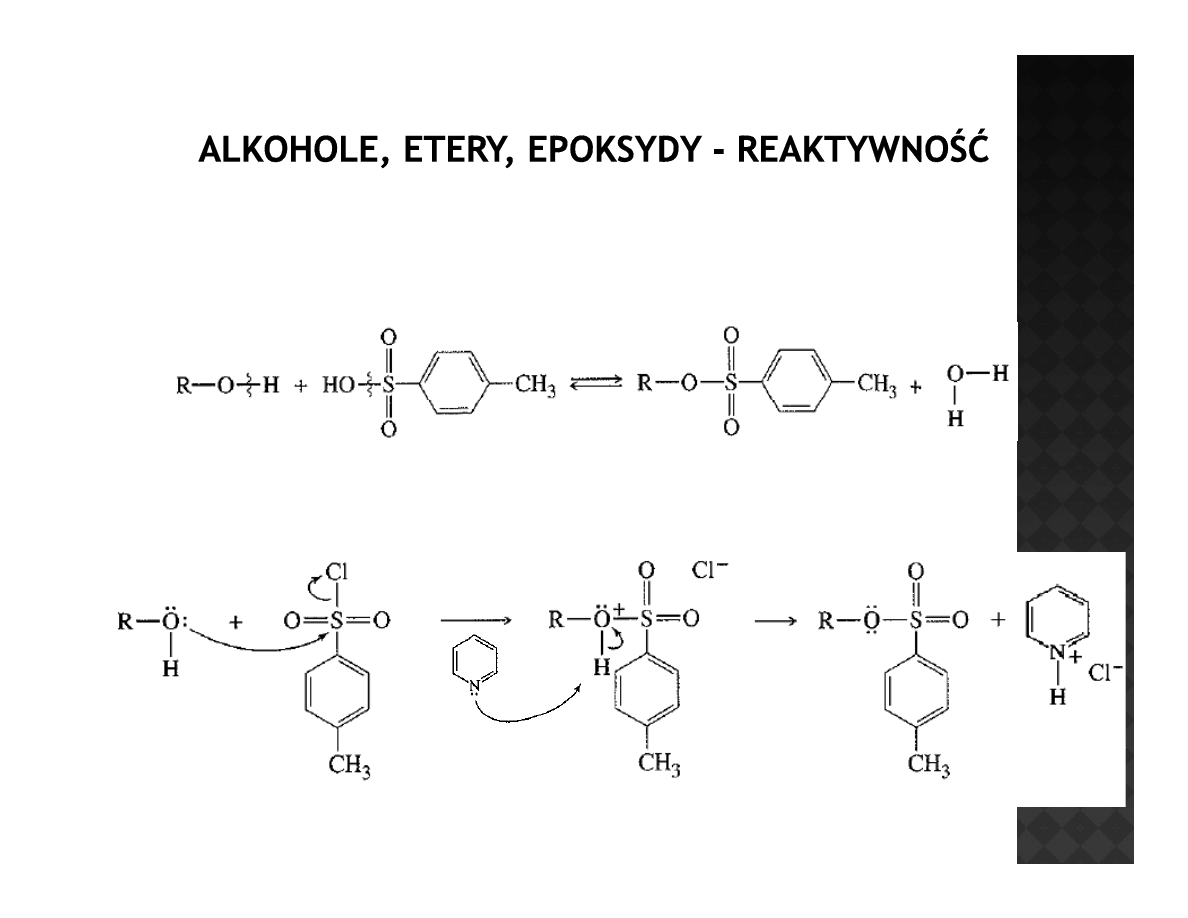
Reaktywność alkoholi
Tosylany
Dlaczego tosylany?
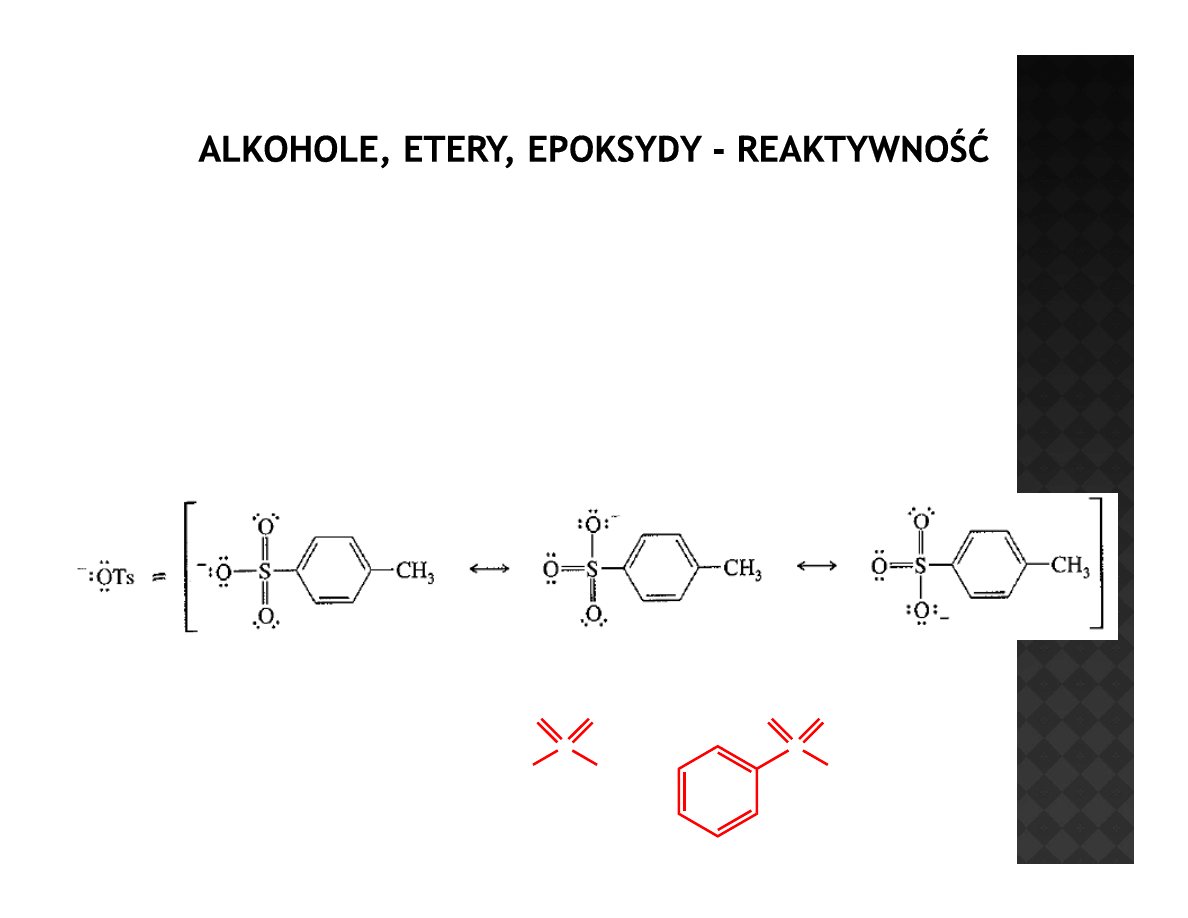
Reaktywność alkoholi
Tosylany
Grupa p toluenosulfonowa jest anionem mocnego kwasu więc jest bardzo dobrą
Grupa p-toluenosulfonowa jest anionem mocnego kwasu, więc jest bardzo dobrą
grupą opuszczającą. Modyfikacja alkoholu poprzez utworzenie tosylanu a
następnie podstawienie tosylanu nukleofilem jest bardzo popularną reakcją w
chemii organicznej
S
O
O
S
O
O
Inne chlorki kwasowe to:
H
3
C
S
Cl
S
Cl
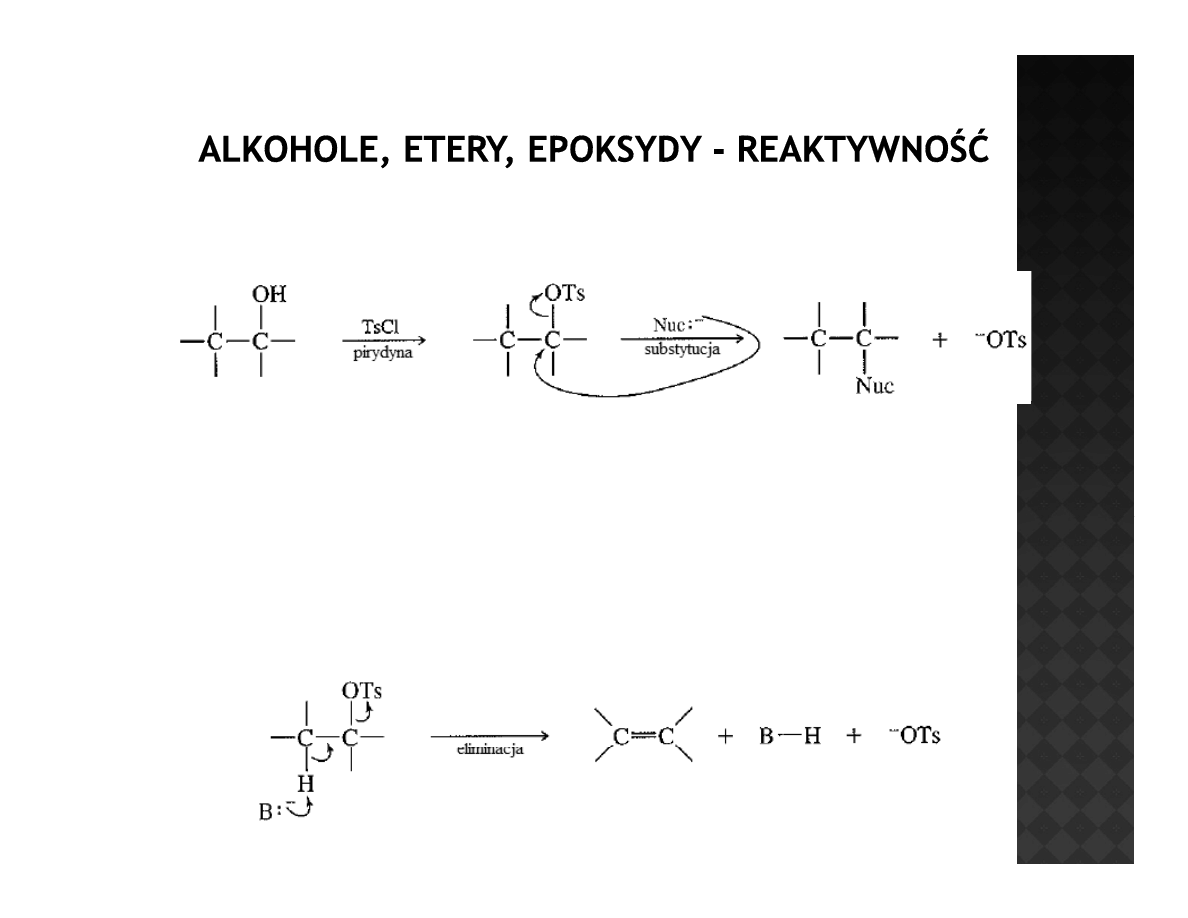
Reaktywność alkoholi
Tosylany
SUBSTYTUCJA
Przebieg reakcji tosylanów z nukleofilami zależy od mocy nukleofila i
warunków prowadzenia reakcji
ELIMINACJA
ELIMINACJA
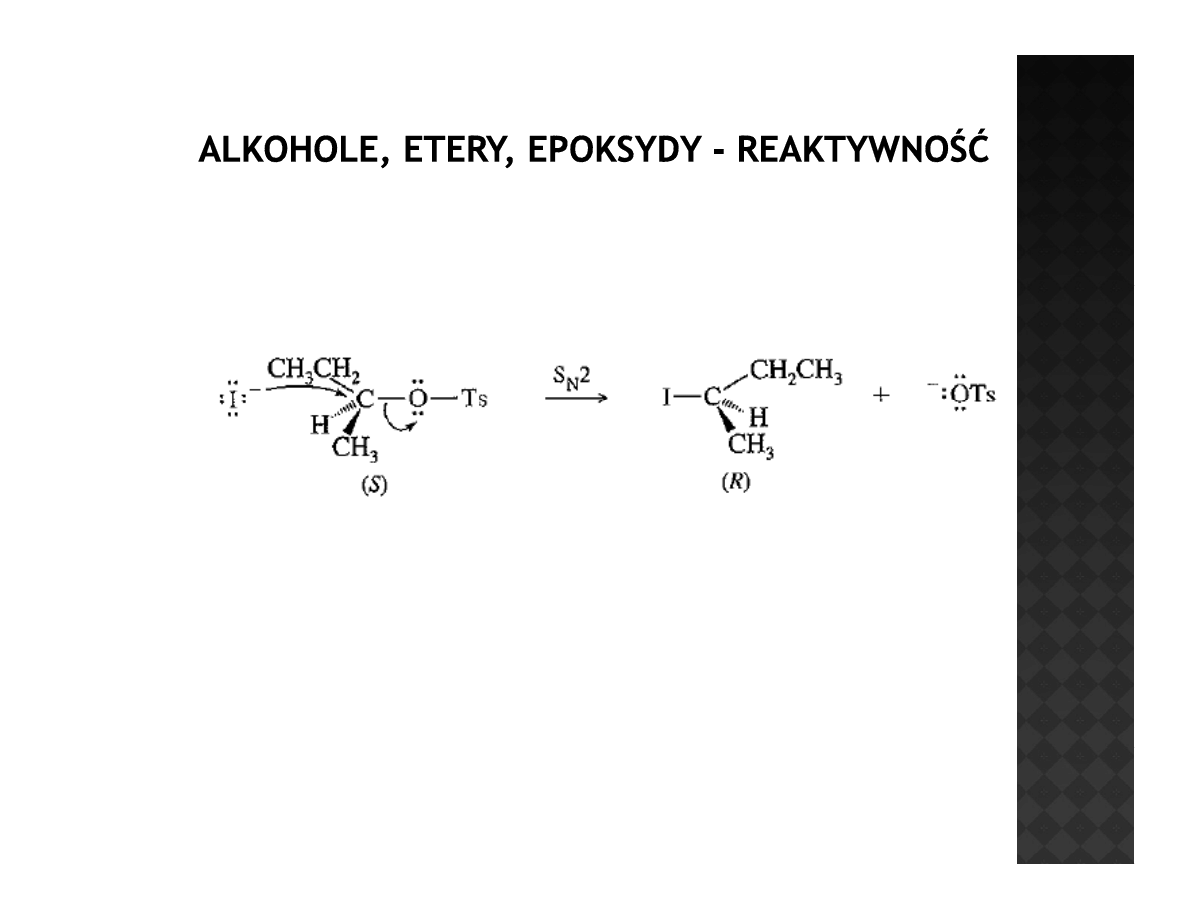
Reaktywność alkoholi
Tosylany
Substytucja nukleofilowa z udziałem tosylanów zachodzi według
h i
S 2
mechanizmu S
N
2
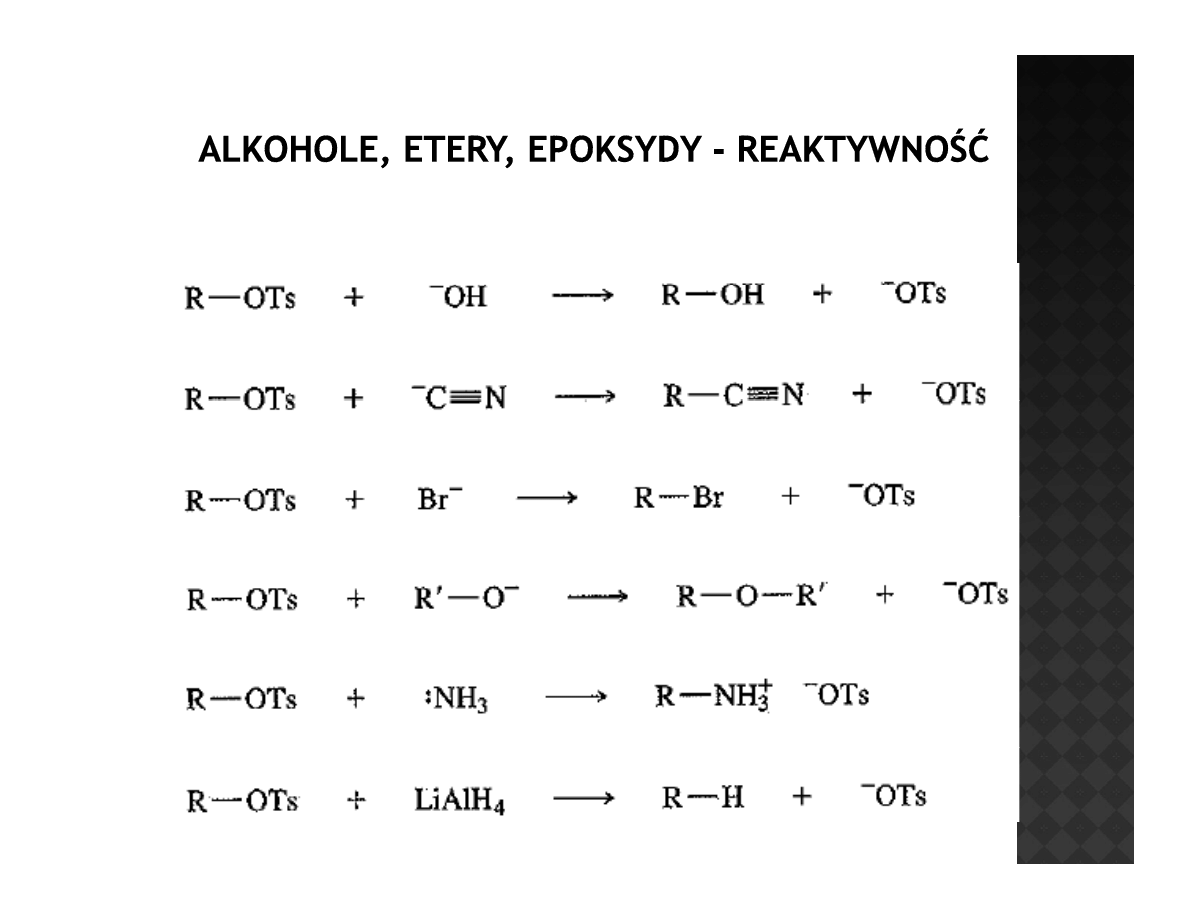
Reaktywność alkoholi
Tosylany
alkohole
nitryle
haloalkany
etery
sole amoniowe
sole amoniowe
alkany
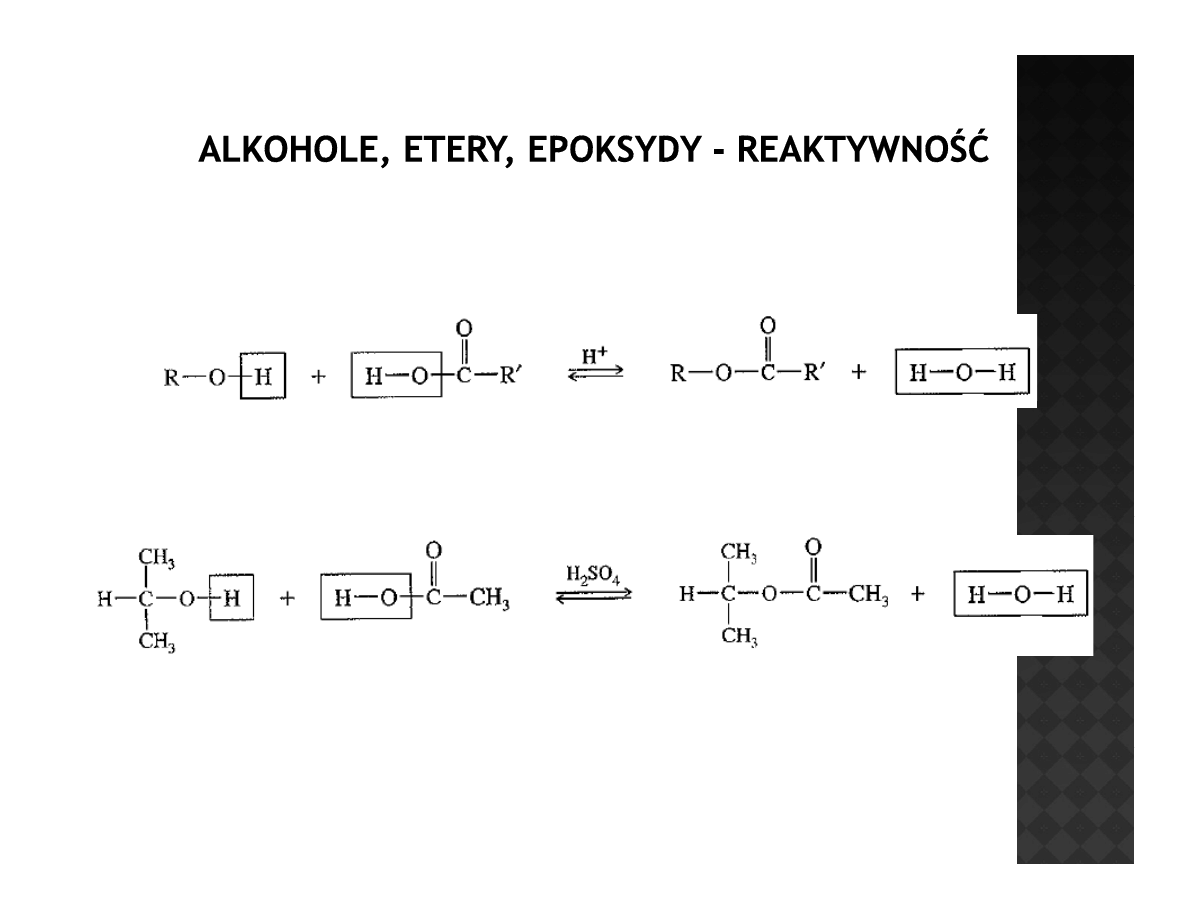
Reaktywność alkoholi
Estryfikacja alkoholi
kwas karboksylowy
ester kwasu
karboksylowego
Ni t lk k
k b k l
l
j
k ji
t fik ji l
ó
i ż k
Nie tylko kwasy karboksylowe ulegają reakcji estryfikacji, ale również kwasy
nieorganiczne
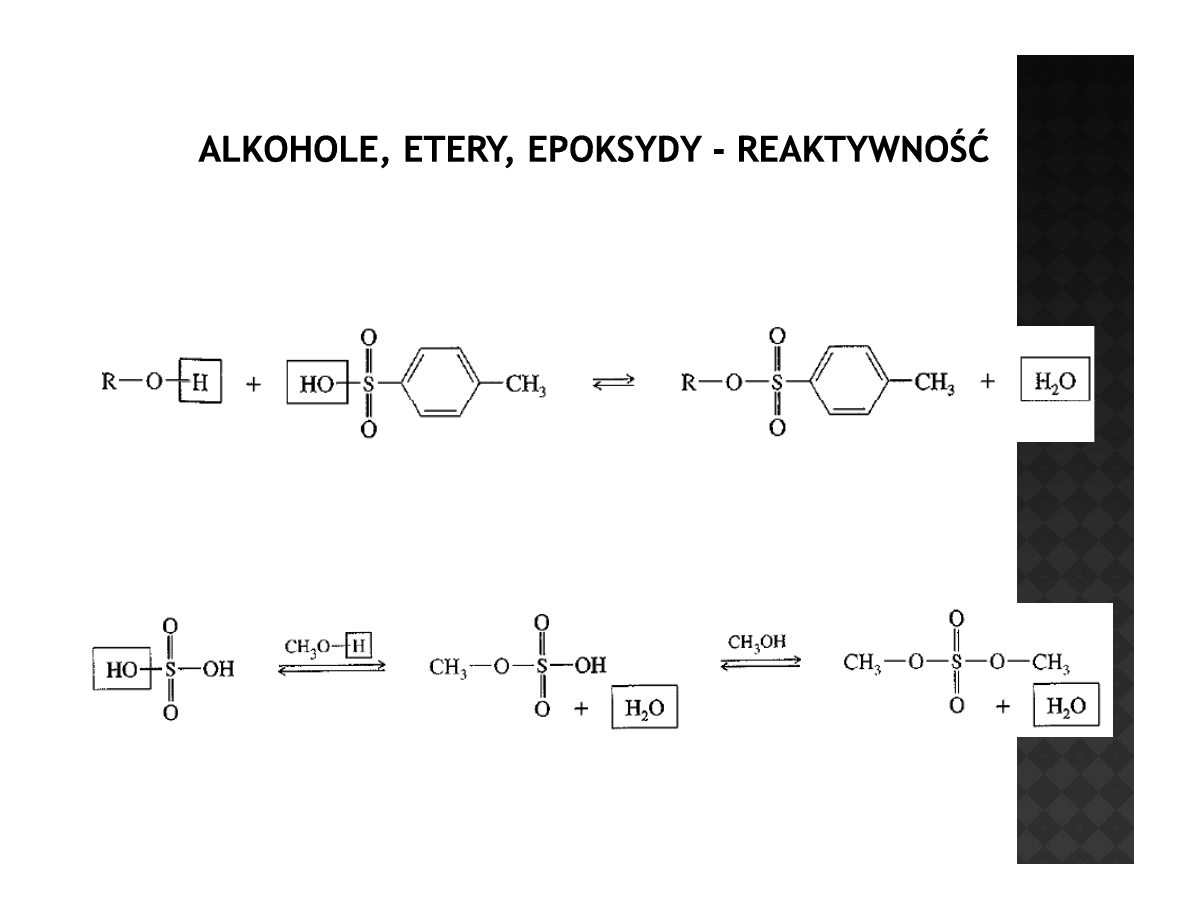
Reaktywność alkoholi
Estryfikacja alkoholi
K
lf
Kwasy sulfonowe
Kwas siarkowy
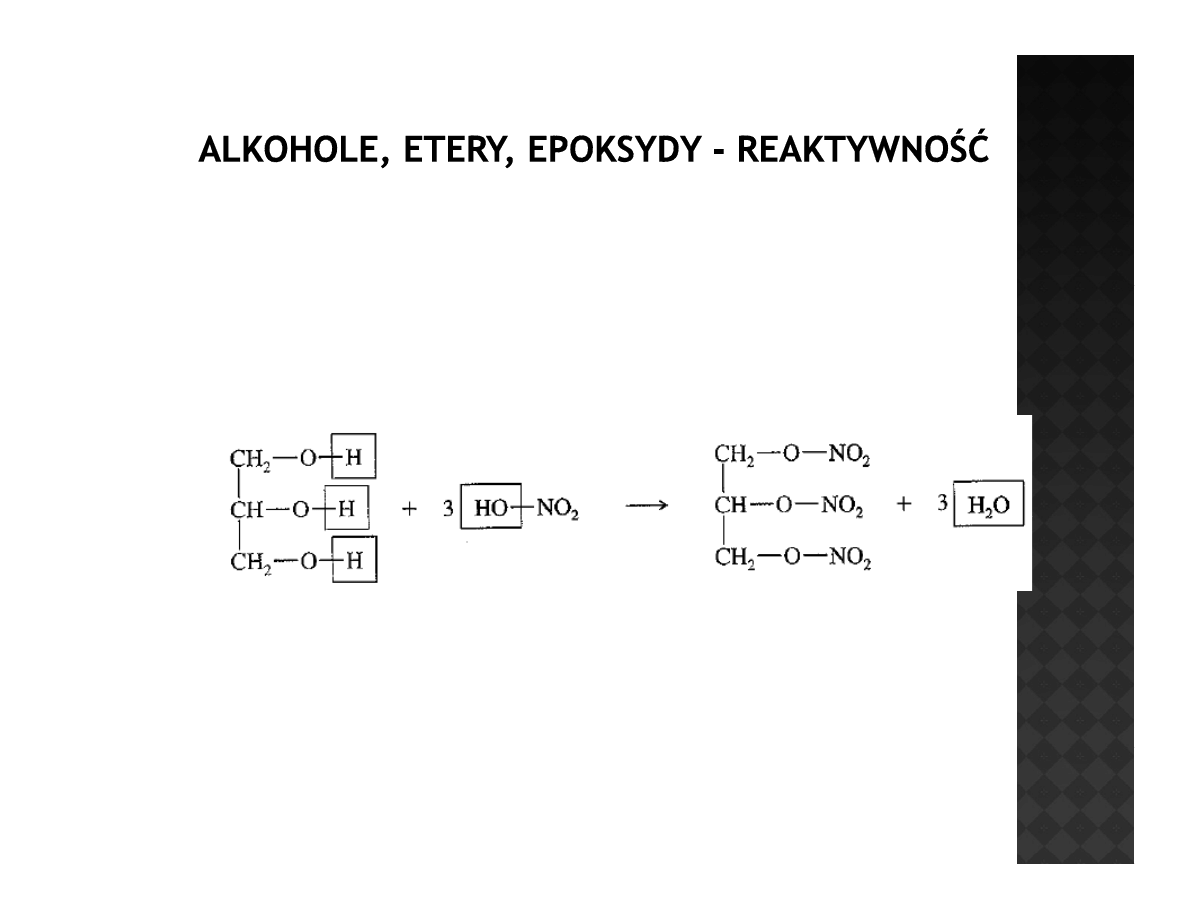
Reaktywność alkoholi
Estryfikacja alkoholi
Kwas azotowy
trinitrogliceryna
Reaktywność alkoholi
Estryfikacja alkoholi
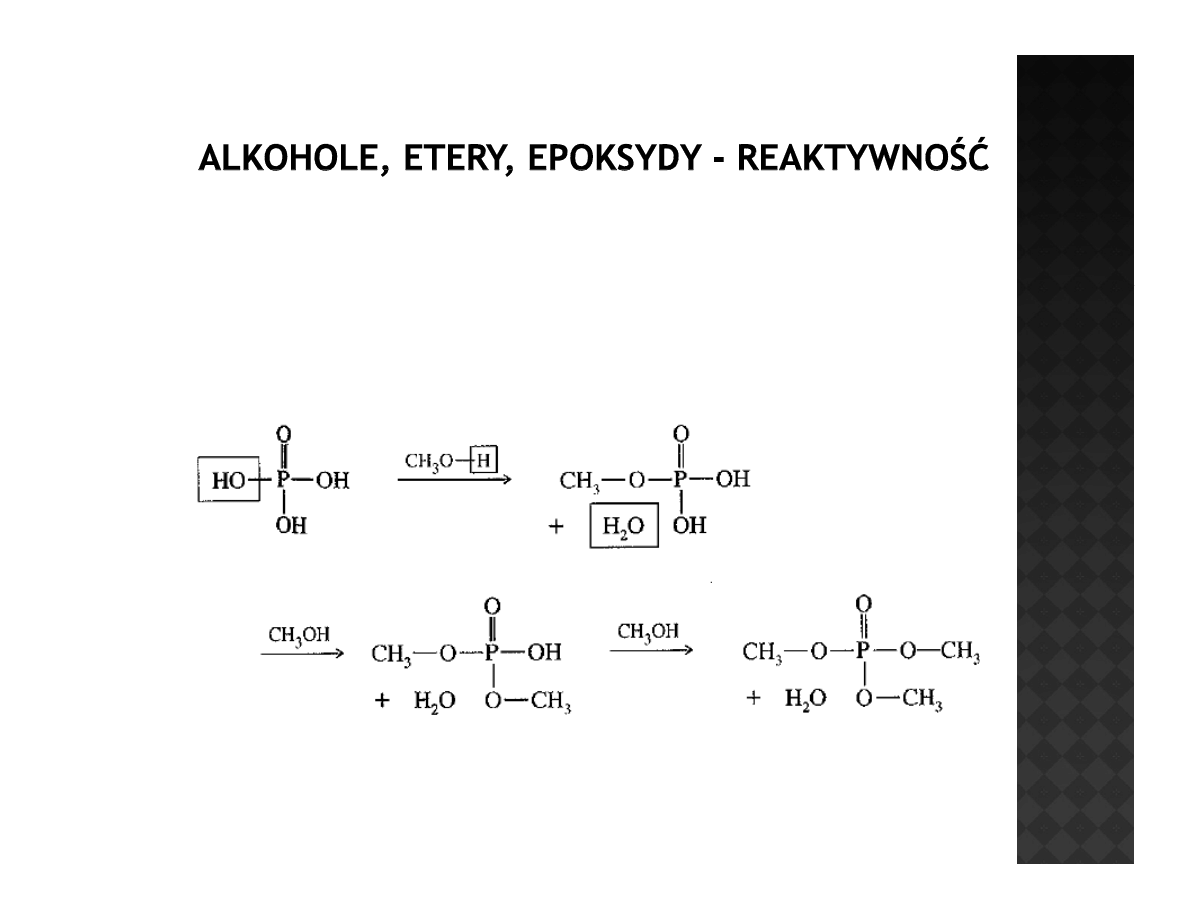
Kwas fosforowy
W kwasie fosforowym możliwe jest podstawienie aż trzech grup -OH
Reaktywność alkoholi
Alkoholany
R
O
H
Na
R
O
+
1/2 H
2
Na
R
O
H
K
R
O
+
1/2 H
2
K
Synteza eterów Williamsona to najważniejsze zastosowanie alkoksylanów
Synteza eterów Williamsona to najważniejsze zastosowanie alkoksylanów.
Niektóre z alkoholanów są używane jako zasady (np. t-BuOK).
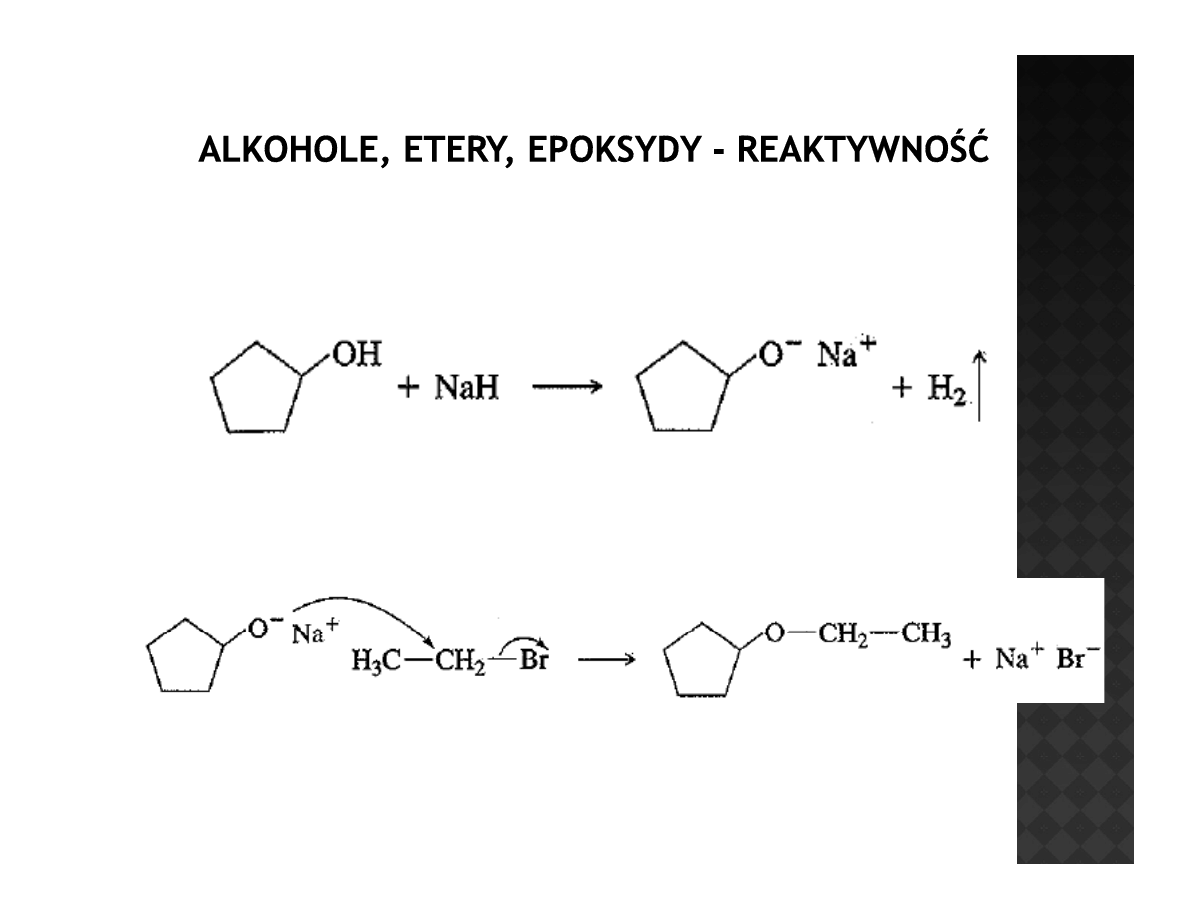
Reaktywność alkoholi
Synteza Williamsona
W pierwszym etapie następuje generowanie alkoksylanu
W drugim etapie alkoholan reaguje z haloalkanem tworząc eter
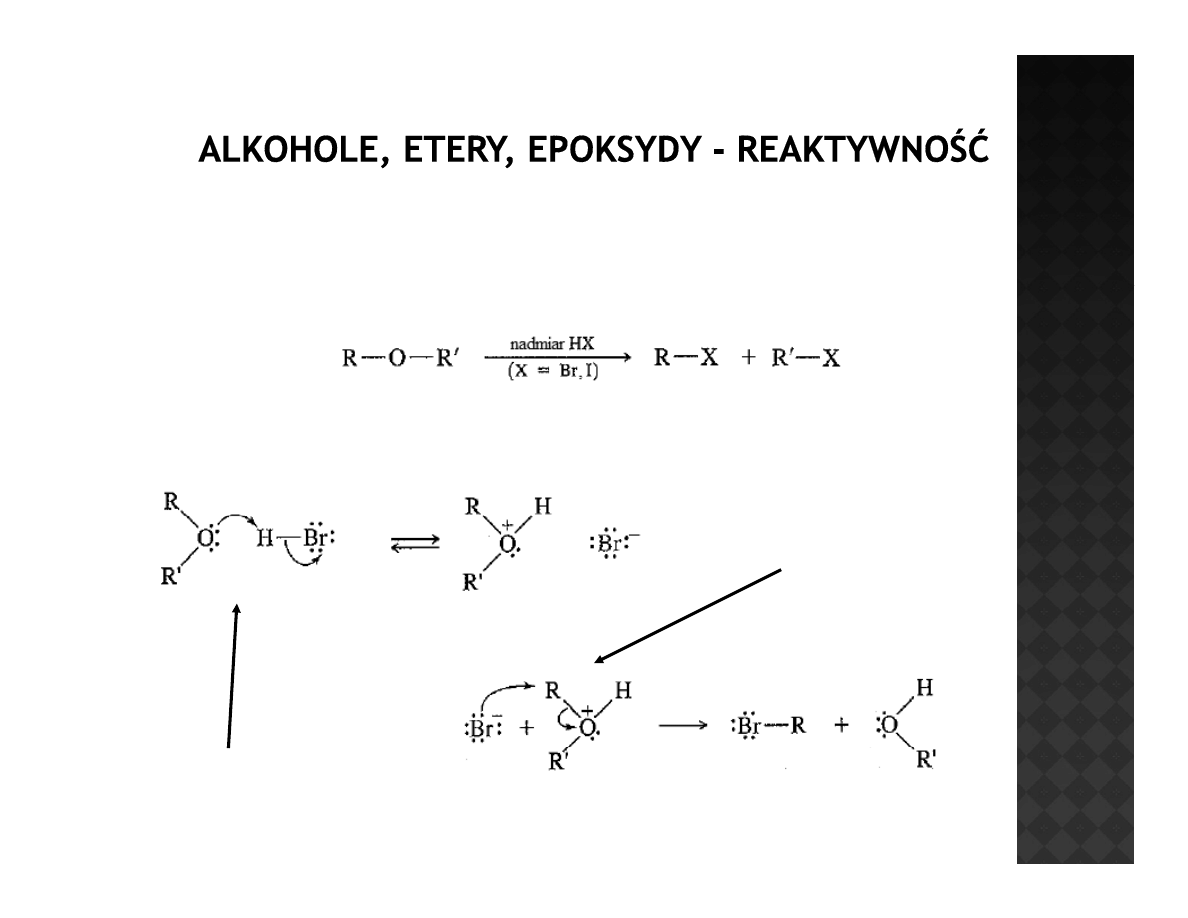
Reaktywność eterów
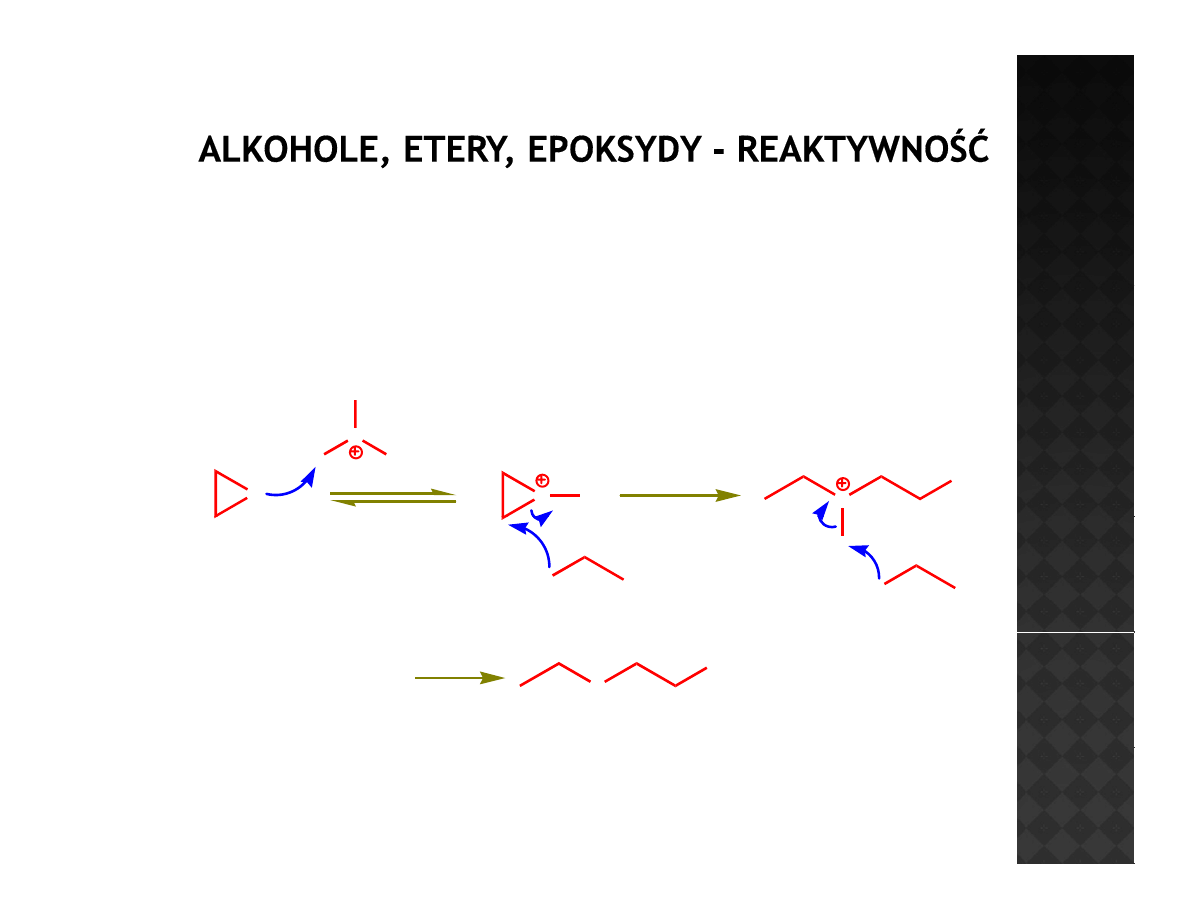
Reakcja z HX (X = Cl, Br, I)
At k B
j d
Atak Br
-
na jeden z
rodników alkoliwych
Atak tlenu na proton w HBr
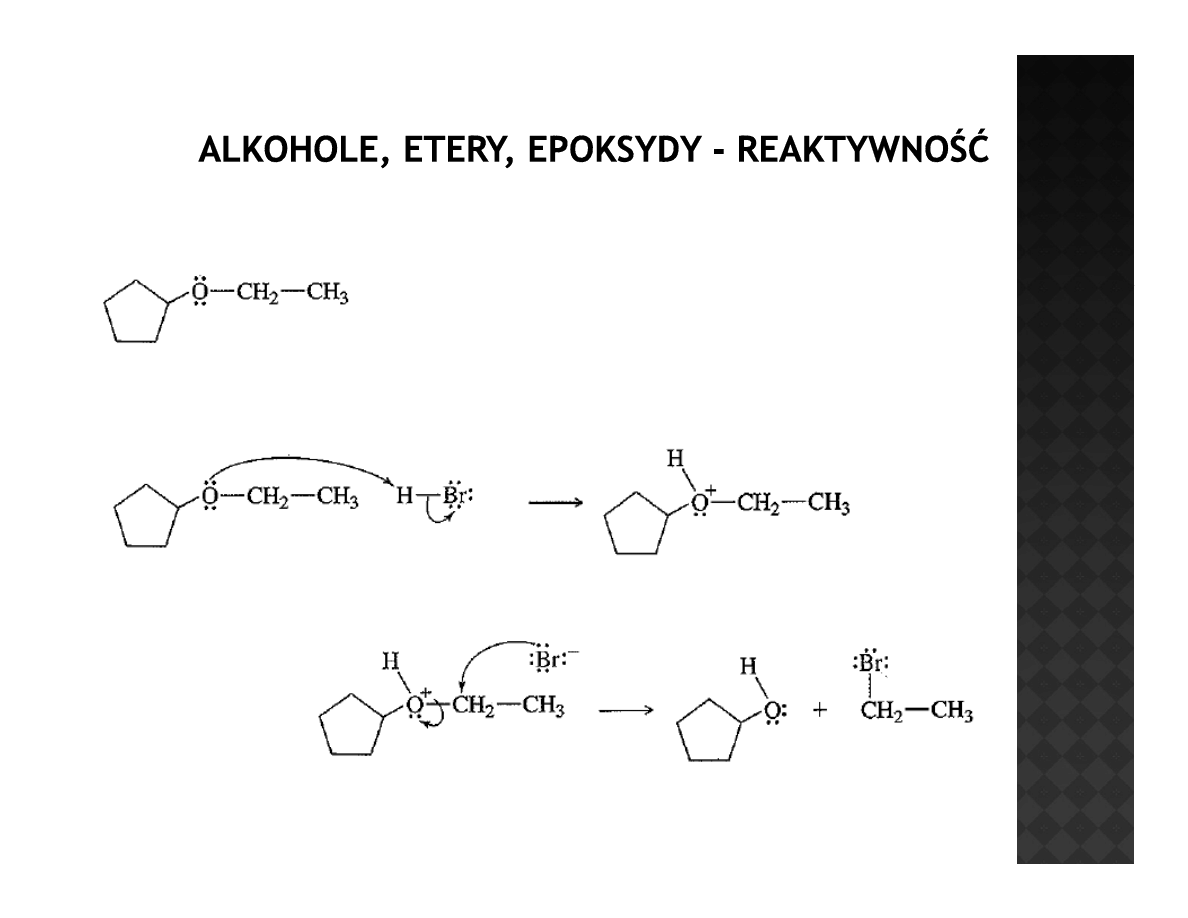
Reaktywność eterów
Rozszczepianie eteru
cyklopentylowo-etylowego
Rozszczepianie może zajść według dwóch mechanizmów
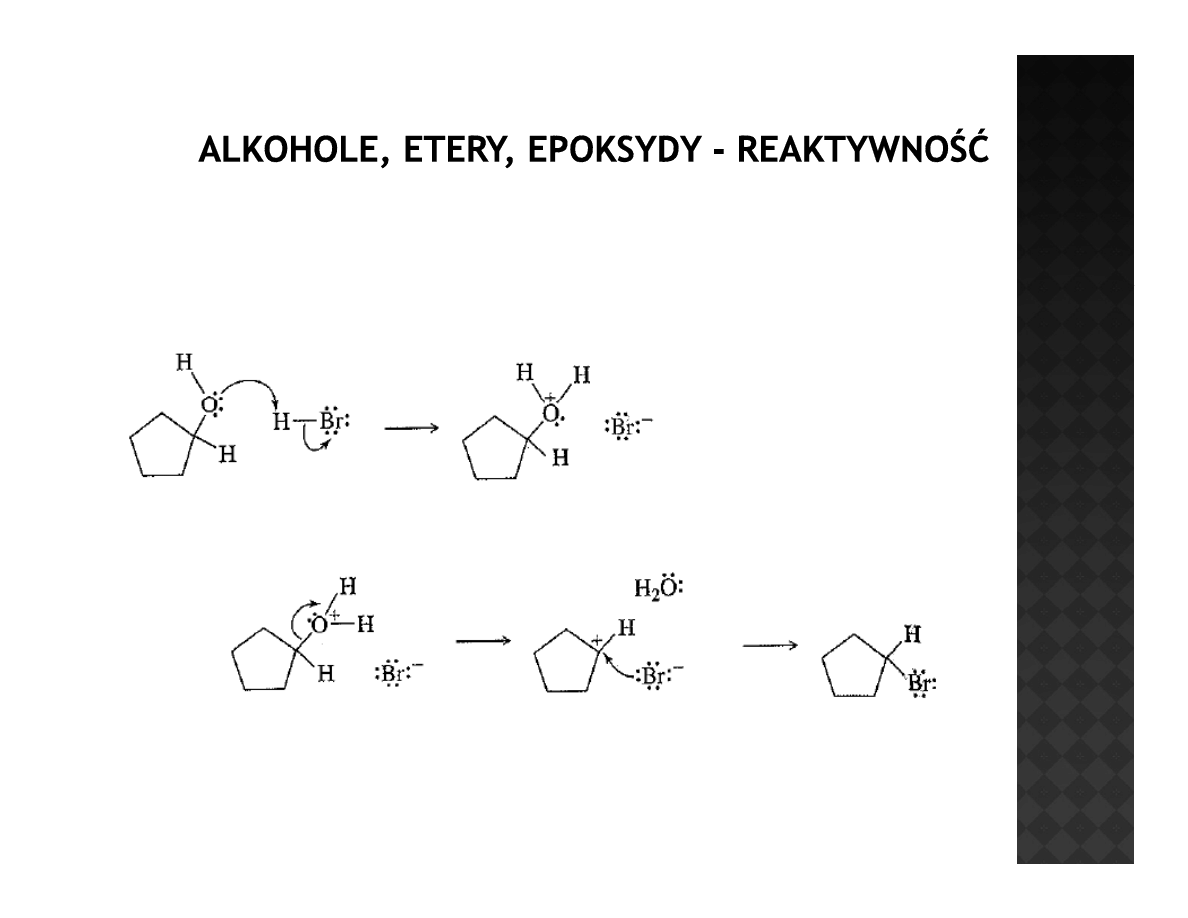
Reaktywność eterów
Rozszczepianie eteru
cyklopentylowo-etylowego
Rozszczepianie eterów
di lkil
h
b
d i
dialkilowych wobec nadmiaru
HX prowadzi do powstania
haloalkanów
Wymiana –OH na –Br może zachodzić według mechanizmu S
N
1 lub S
N
2 w
zależności od użytych warunków
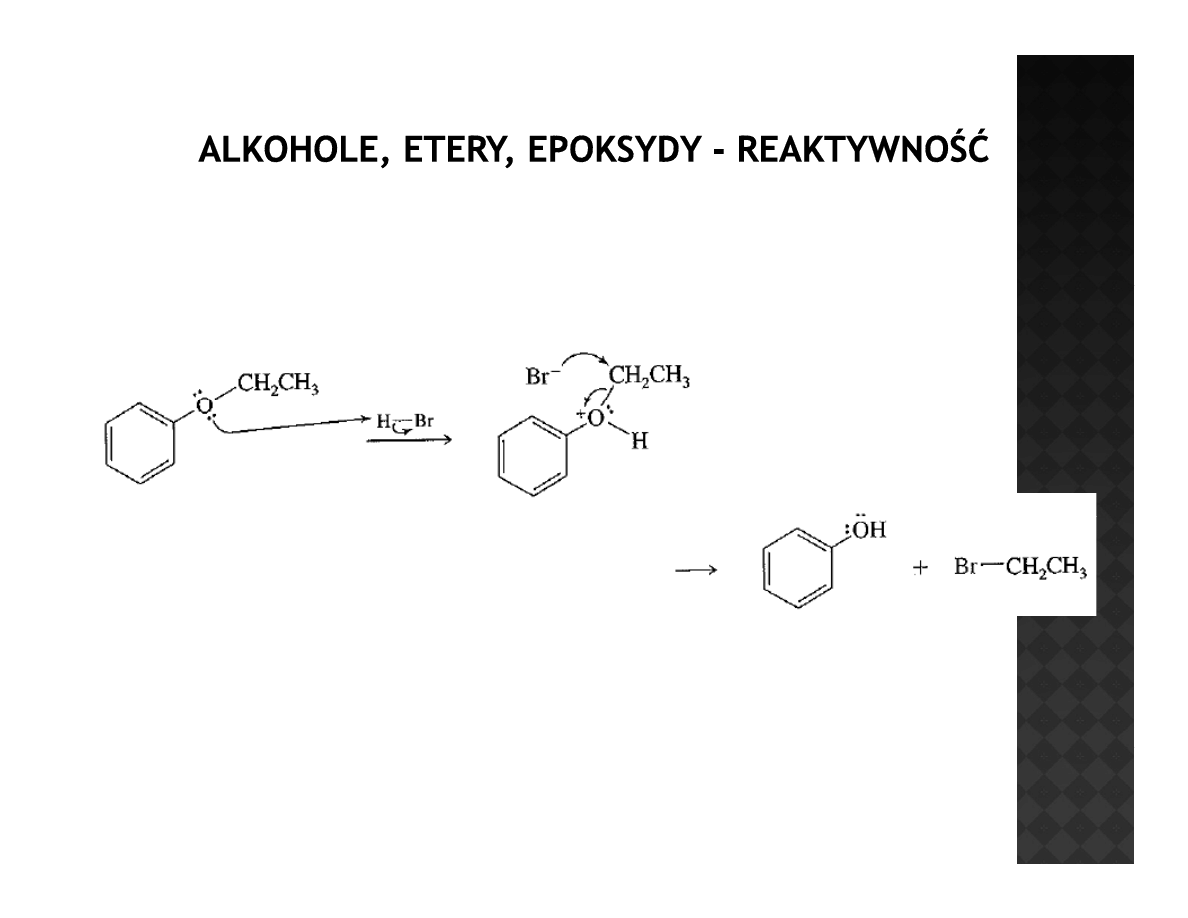
Reaktywność eterów
Rozszczepianie eteru fenylowo-etylowego
Dla eterów arylowo-alkilowych reakcja rozszepiania biegnie wyłącznie w podany
y
y
j
p
g
y ą
p
y
powyżej sposób, a reakcja zatrzymuje się na etapie fenolu
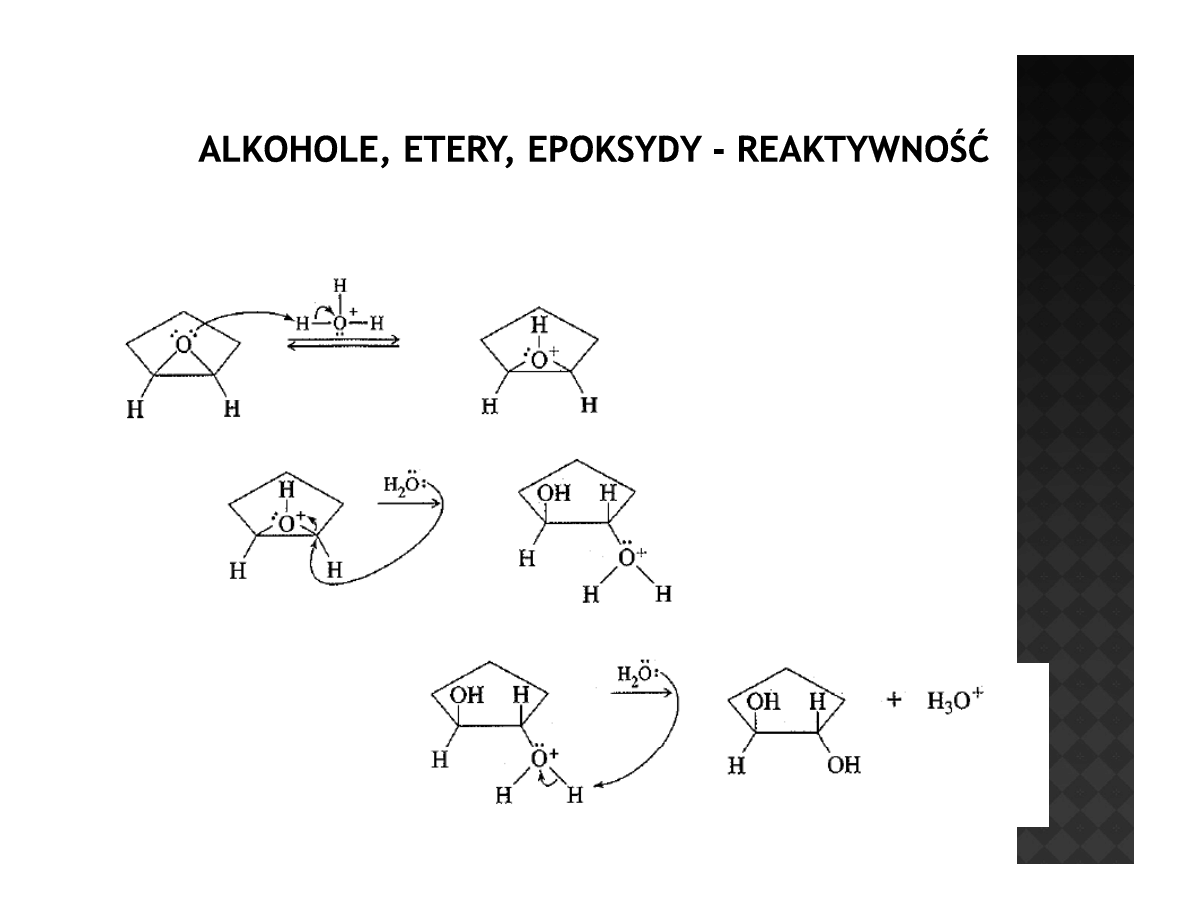
Reaktywność epoksydów
Otwieranie epoksydów w środowisku kwaśnym
Otrzymany diol posiada
kondigurację trans
Reaktywność epoksydów
Otwieranie epoksydów w środowisku kwaśnym
w obecności alkoholu
w obecności alkoholu
H
O
H
O
H
O
H
O
OH
HO
H
HO
O
OH
Reaktywność epoksydów
Otwieranie epoksydów w środowisku
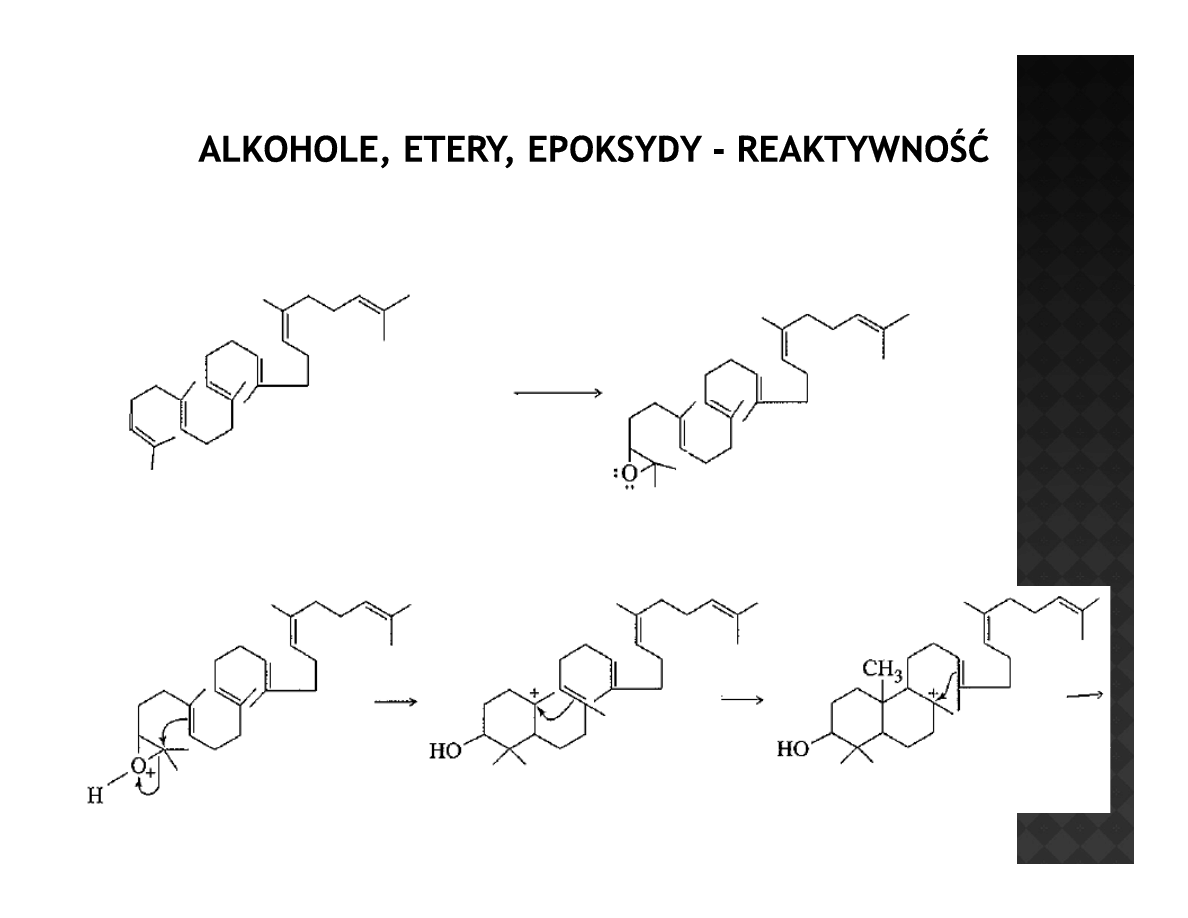
przyrodzie
Skwalen prekursor steroidów
Skwalen – prekursor steroidów
Cyklizacja prowadzi do lanosterolu – pierwszego ze steroli
Reaktywność epoksydów
Reakcja epoksydów z HX
O
HBr
gaz
HBr
wodny
Br
Br
Br
OH
Oddziaływanie związków typu HX podlega mechanizmowi opisanemu
wcześniej. Różnice w produktach wynikają z prowadzenia reakcji w
rożnych środowiskach
rożnych środowiskach
Reaktywność epoksydów
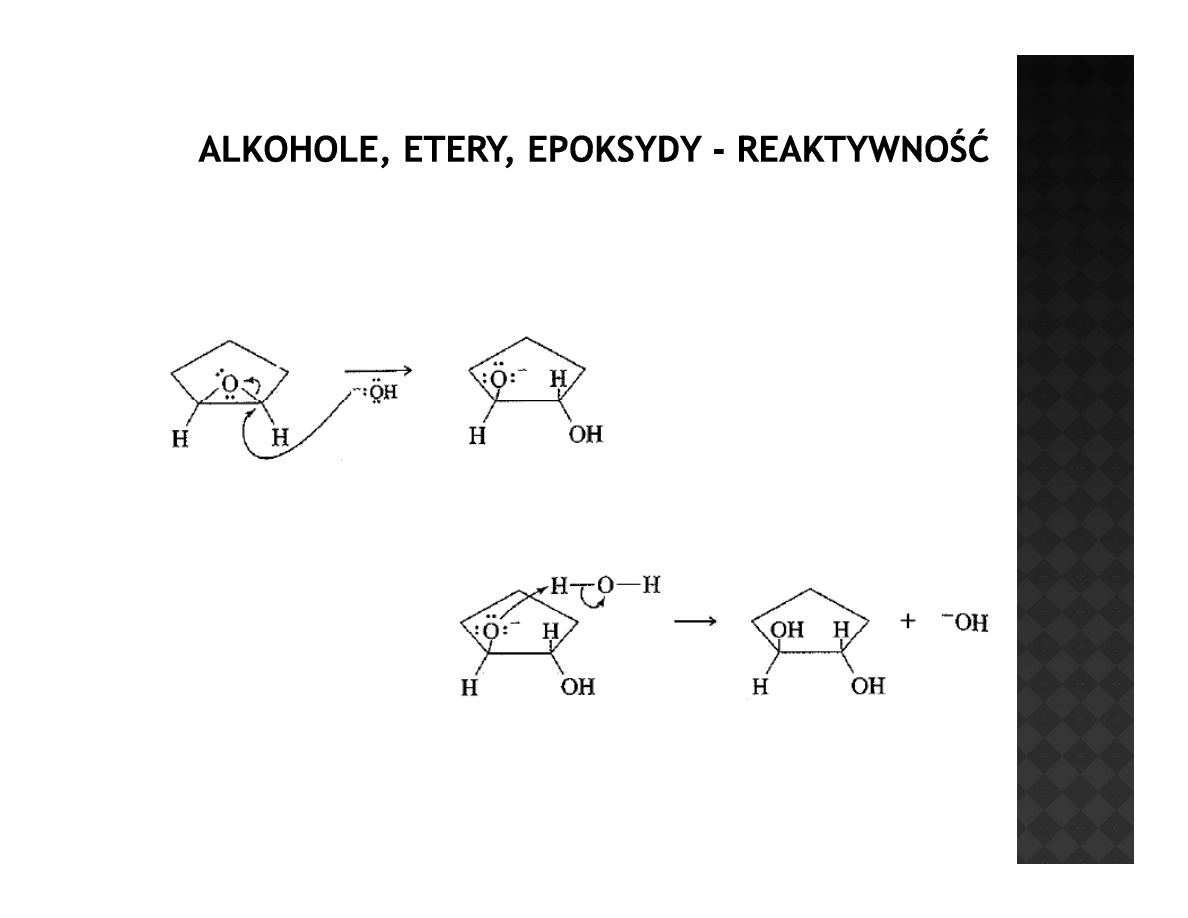
Otwieranie epoksydów w warunkach zasadowych
Atak OH
-
następuje od strony
przeciwnej do tlenu
epoksydowego
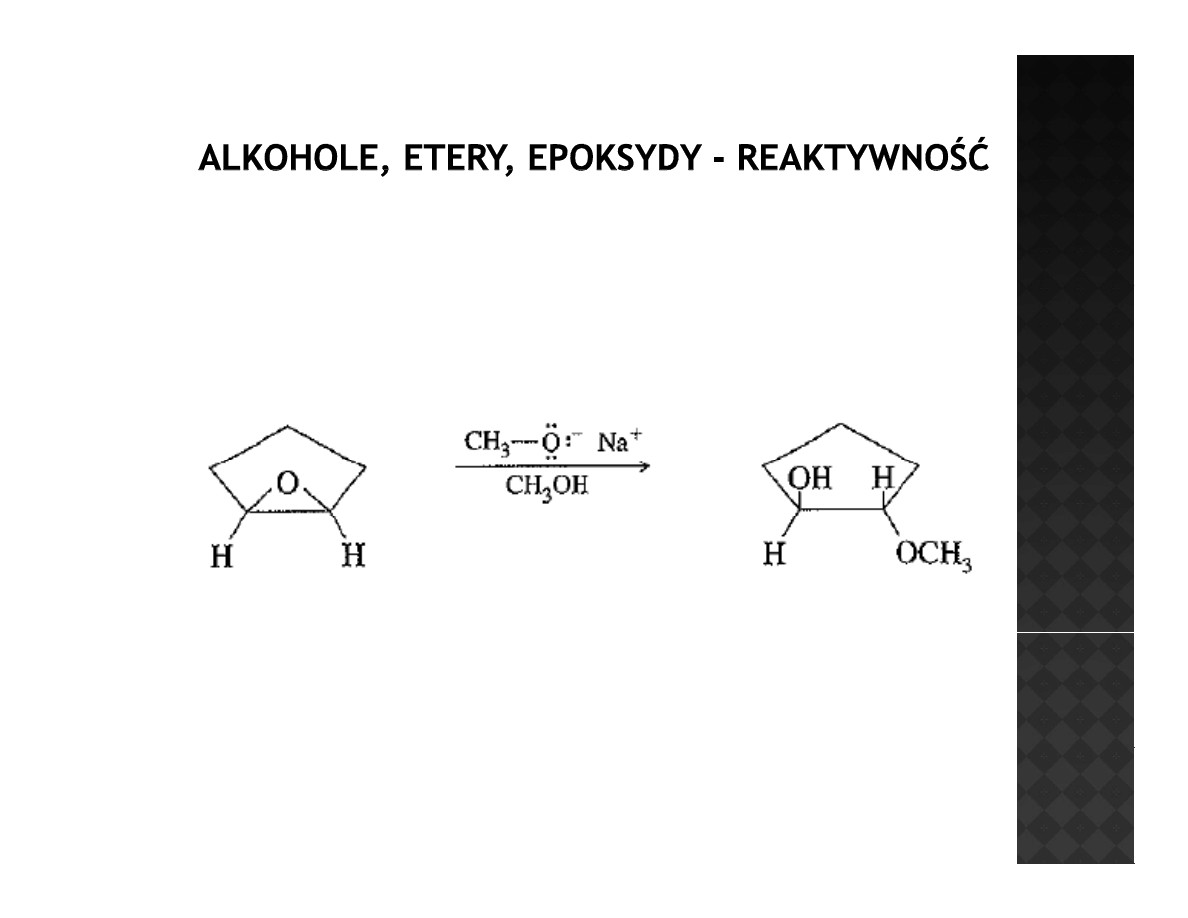
Reaktywność epoksydów
Otwieranie epoksydów w warunkach zasadowych
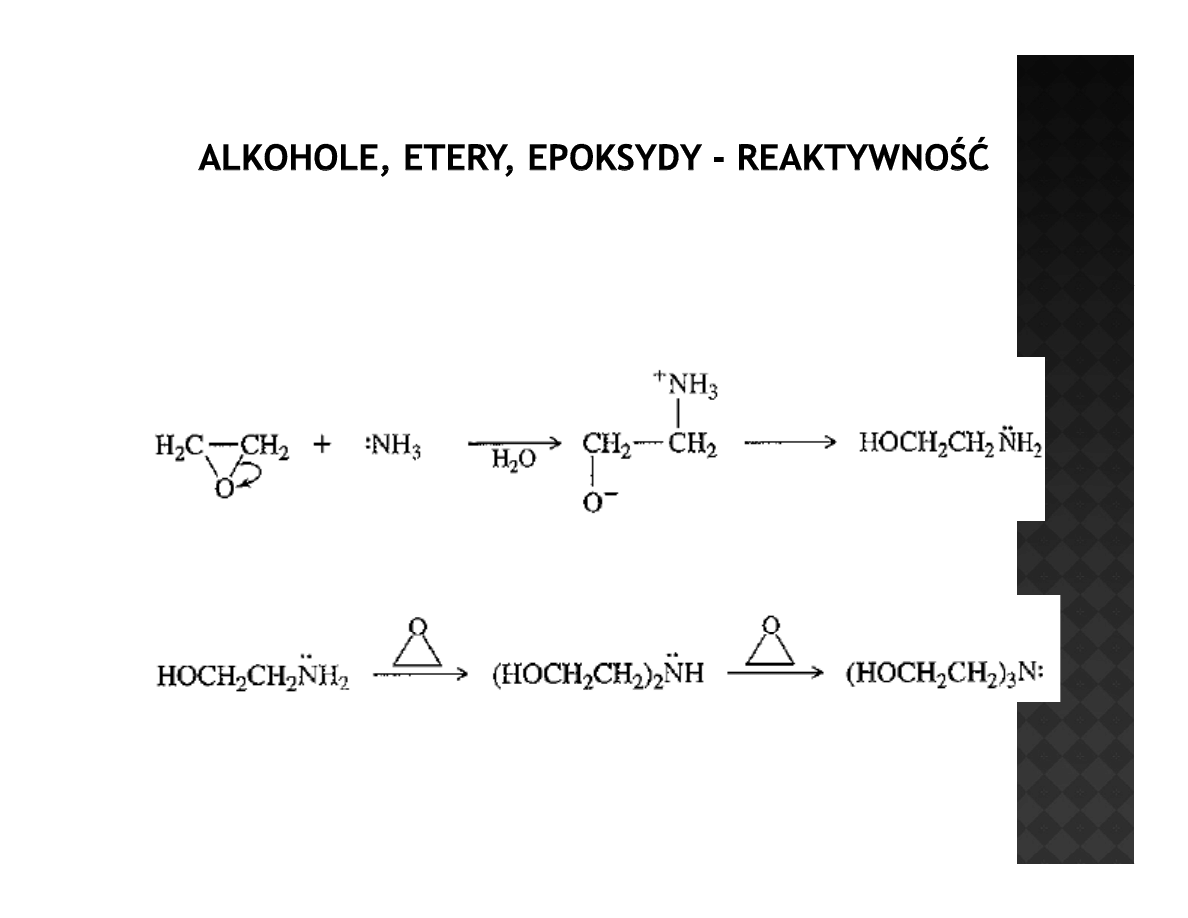
Reaktywność epoksydów
Otwieranie epoksydów w warunkach zasadowych
Amina jako zasada
Reaktywność epoksydów
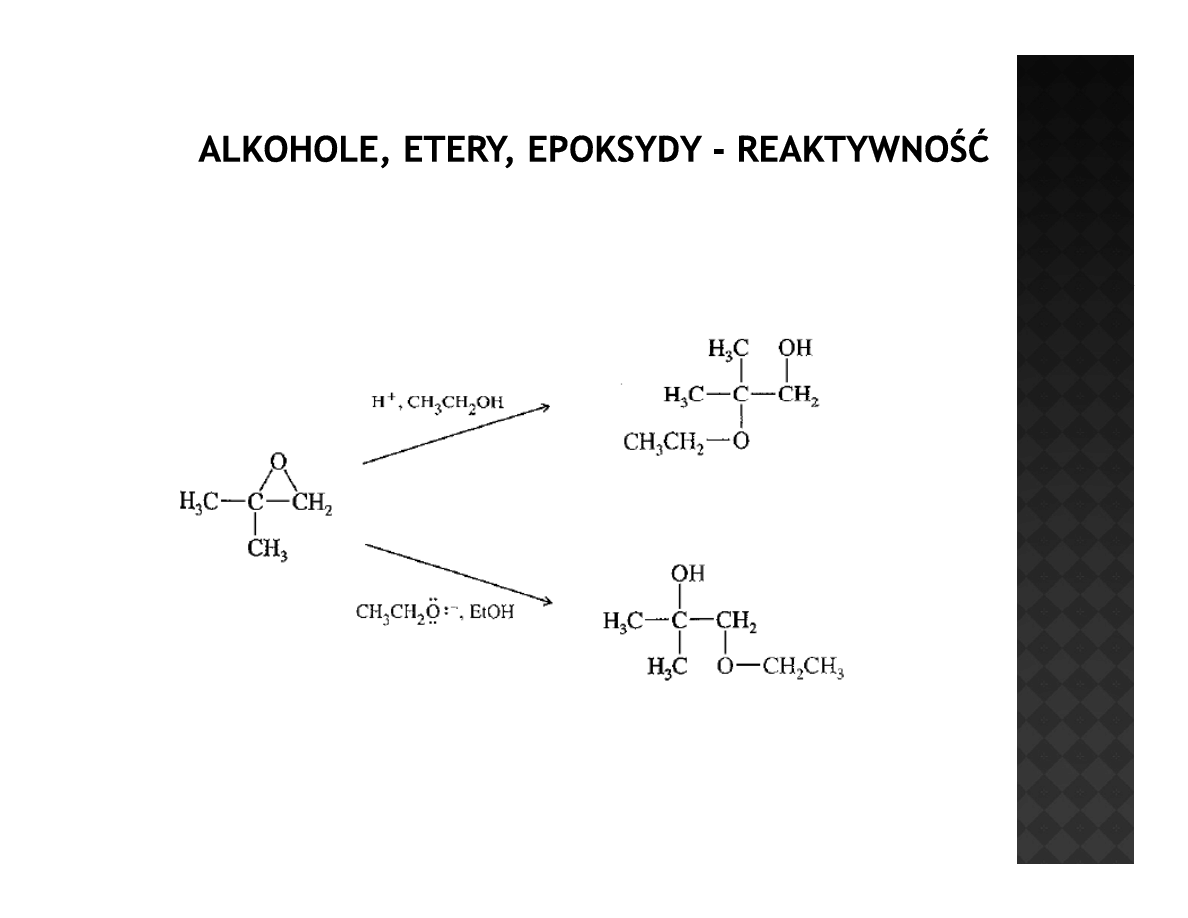
Orientacja addycji nukleofili do epoksydów
Addycja w warunkach kwaśnych
Addycja w warunkach zasadowych
y j
y
Reaktywność epoksydów
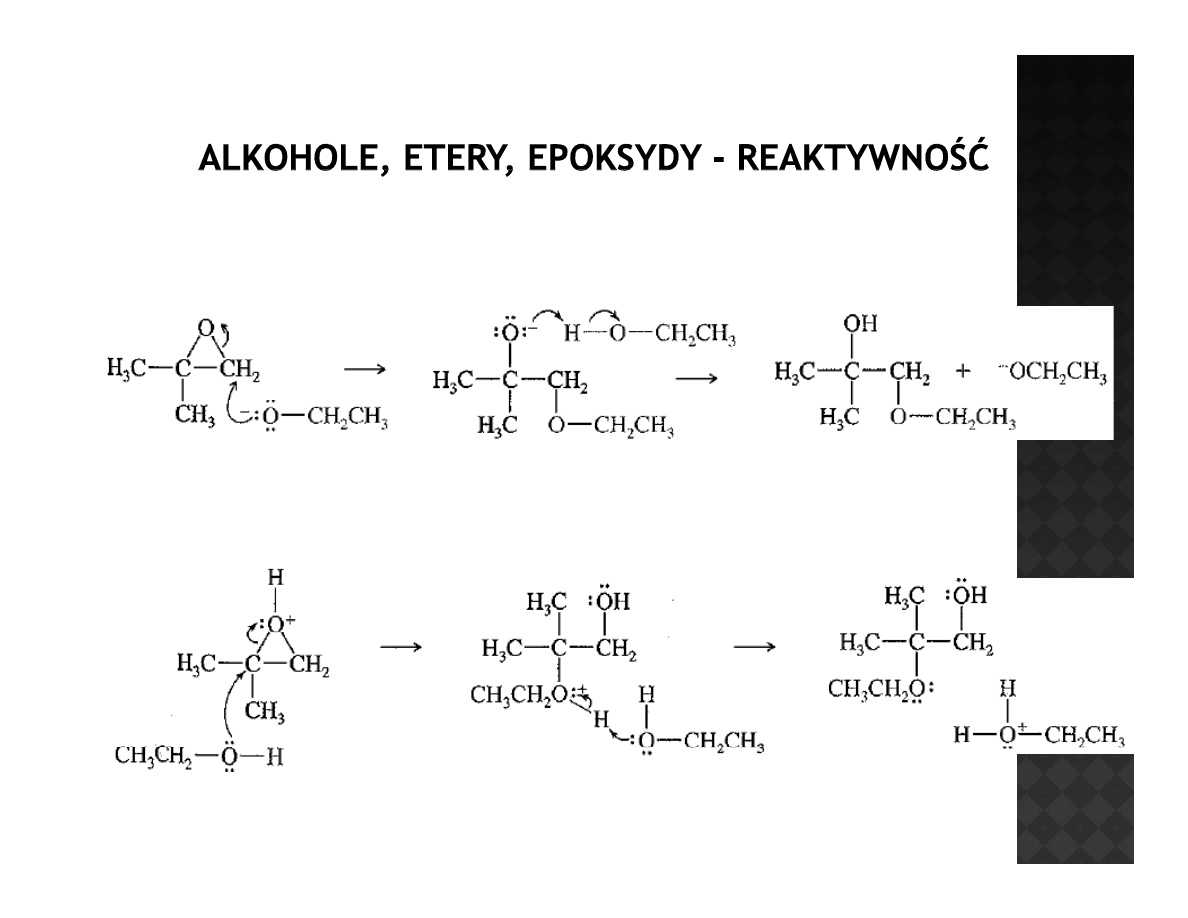
Orientacja addycji nukleofili do epoksydów
Anion alkoksylowy reaguje wg S
N
2 i atakuje najmniej zatłoczoną pozycję w
epoksydzie
epoksydzie
W katalizie kwaśnej nukleofil atakuje najbardziej pozytywny węgiel
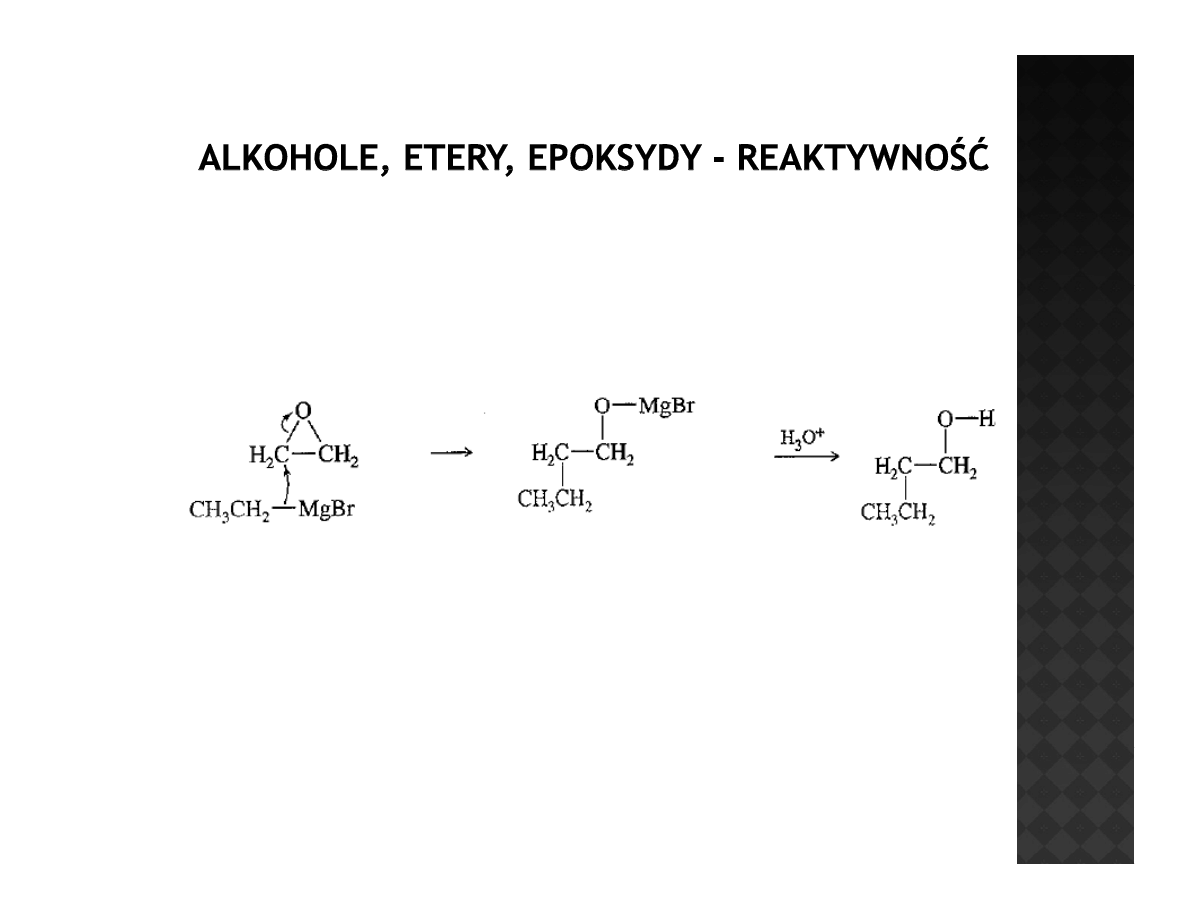
Reaktywność epoksydów
Addycja związków organometalicznych
Związki organomagnezowe (Grignarda) i organolitowe również
przyłączają się do epoksydów
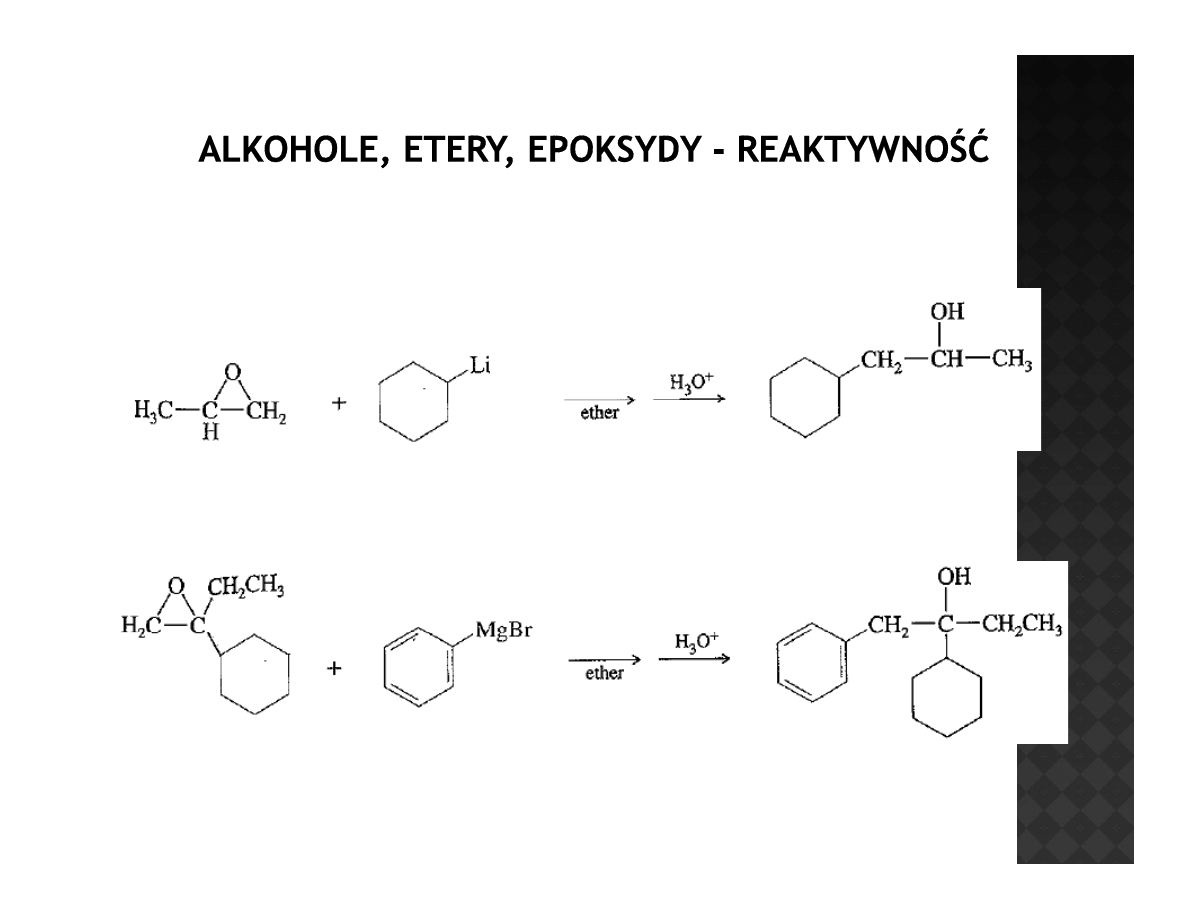
Reaktywność epoksydów
Selektywność addycji
Przylączenie organolitu zachodzi od mniej zatłoczonej strony
Selektywność addycji odczynnika Grignarda jest dużo niższa

Do zapamiętania
Reaktywność alkoholi
Reaktywność eterów
Reaktywność epoksydów
Reaktywność epoksydów
Wyszukiwarka
Podobne podstrony:
chemia organiczna wykład 6
Chemia organiczna wykłady całość(1)
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
Instrukcja do prób barwnych I (alkohole, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady
Chemia organiczna wykłady
dyd e2b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
Ćwiczenia – węglowodory alifatyczne, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
Chemia organiczna wykład 8
dyd k2a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Instrukcja do zmydlania tłuszczów, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
dyd kzb, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd kza r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd e1c, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
Chemia organiczna wykład 14
Instrukcja do prób barwnych II (kwasy, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
Instrukcja do chromatografii, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
więcej podobnych podstron