Białka i peptydy
Białka i peptydy są to związki organiczne zbudowane z reszt aminokwasów i
występujące w każdym żywym organizmie. Granica pomiędzy peptydem a białkiem nie
jest dokładnie sprecyzowana. Peptydy zawierające do 10 reszt aminokwasów nazywamy
oligopeptydami, a od 11 do 100 nazywamy polipeptydami. Uznaje się, że białka są
peptydami zbudowanymi z więcej niż 100 reszt aminokwasów.
P e p t y d y
1. Budowa peptydów
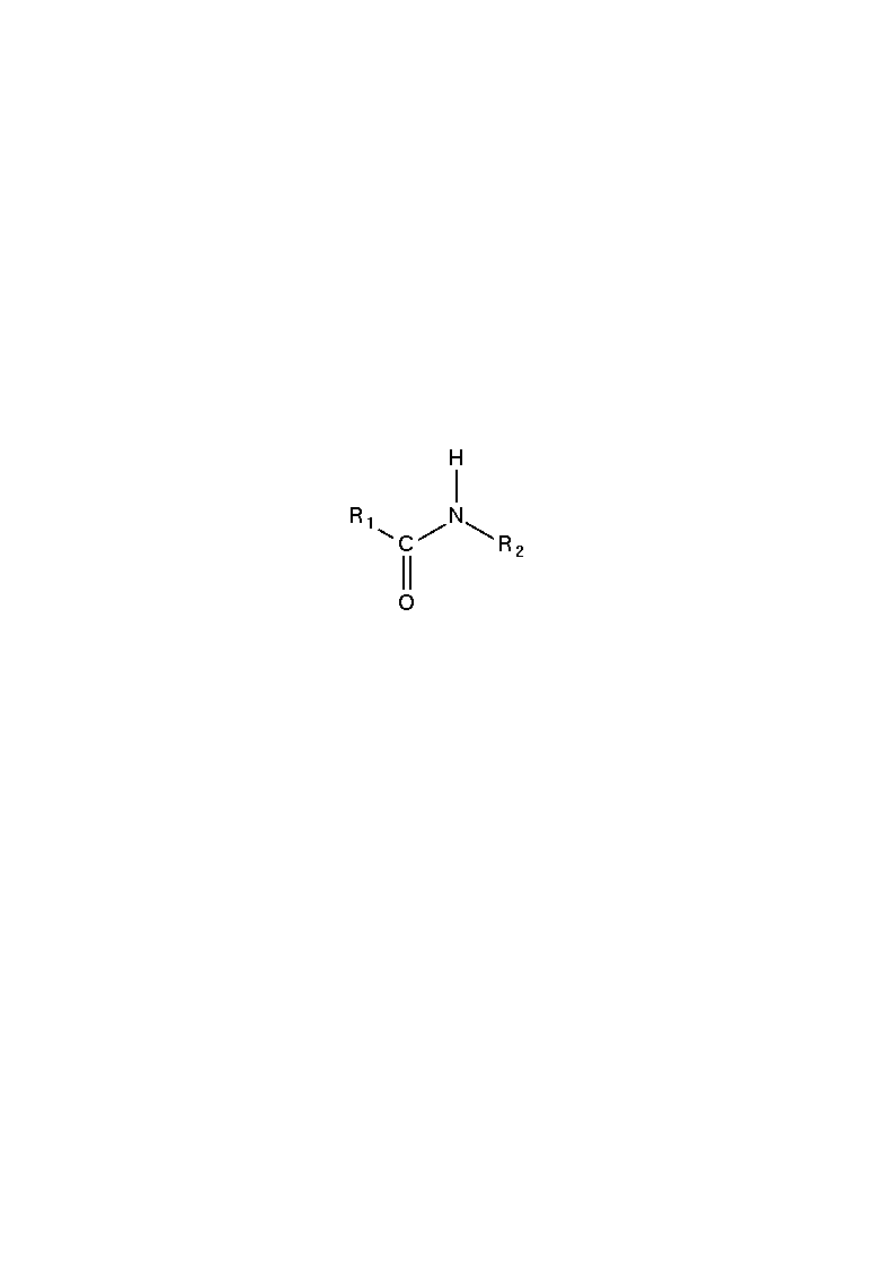
Peptydy są zbudowane z reszt aminokwasów połączonych wiązaniami amidowymi,
zwanymi też wiązaniami peptydowymi. Wiązania te tworzą się między grupą aminową
jednej reszty, a grupą karboksylową drugiej reszty.
2. Nazewnictwo
Nazwy peptydów tworzymy poprzez łączenie nazw reszt aminokwasów, z których
powstał dany peptyd. Najpierw podajemy nazwę aminokwasu N-końcowego (czyli tego,
który ma wolną grupę –NH
2
), później kolejno nazwy reszt tworzących łańcuch peptydowy,
a na końcu nazwę aminokwasu C-końcowego (czyli tego, który ma wolną grupę –COOH).
Zwykle nazwę peptydu zapisuje się używając trzy- lub jednoliterowych skrótów nazw
aminokwasów (np. alanina – Ala). Peptydy powstałe z dwóch aminokwasów noszą nazwę
dipeptydów, z trzech aminokwasów – tripeptydów, z czterech - tetrapeptydów itd.
3. Określanie struktury peptydów
Aby określić strukturę peptydów musimy wiedzieć jakie aminokwasy wchodzą
w skład danego peptydu, w jakiej ilości oraz w jakiej kolejności one występują.
Dwie pierwsze kwestie można rozwiązać dzięki aparatowi zwanemu analizatorem
aminokwasów. Jest to automatyczny instrument pracujący na podstawie technik
analitycznych opracowanych w latach piećdziesiątych w Uniwersytecie Rockefellera
w Nowym Yorku przez Williama Steina i Stanforda Moore'a. Najpierw peptyd zostaje
rozłożony na składowe aminokwasy. Później otrzymaną mieszaninę analizuje się
nanosząc ją na szczyt szklanej kolumny wypełnionej specjalnym absorbentem
i przepuszczając przez kolumnę różne bufory. Różne aminokwasy przemieszczają się w
dół kolumny z różną prędkością, zależnie od ich struktury. Każdy z aminokwasów po
wyjściu z kolumny miesza się z roztworem ninhydryny (odczynnika, który reaguje
z α-aminokwasami, dając intensywnie fioletowe zabarwienie). Na podstawie intensywności
barwy roztworu wyznacza się ilość danego aminokwasu w próbce.
Aby rozwiązać trzecią kwestię musimy zastosować sekwencjonowanie peptydu.
Wiązanie amidowe (peptydowe)

Polega ono na kolejnym odrywaniu po jednym aminokwasie z końca łańcucha
peptydowego (z C-końca lub z N-końca). Oderwany aminokwas jest następnie wydzielany
i identyfikowany, a potem powtarza całość operacji dla krótszego łańcucha. Obecnie
najpopularniejszą metodą sekwencjonowania peptydów jest degradacja Edmana, która
jest wydajną metodą analizy N-terminalnej.
4. Synteza peptydów
Synteza peptydów wymaga zachowania ich sekwencji w łańcuchu peptydowym. W
tym celu konieczne jest blokowanie. Należy zablokować wszystkie grupy aminowe i
karboksylowe, które nie mają ze sobą reagować. Najczęściej grupę karboksylową blokuje
się poprzez przekształcenie jej w ester(np. metylowy lub benzylowy). Grupy aminowe
łatwo blokuje się na drodze reakcji z diwęglanem di-tert-butylu otrzymując pochodne tert-
butoksykarbonyloamidowe (BOC). Wiązanie peptydowe zwykle tworzy siędziałając na
mieszaninę blokowanego kwasu i aminy dicykloheksylokarbodiimidem (DCC)
B i a ł k a
1. Struktura białek
Ze względu na złożoną budowę białek ich strukturę określamy na czterech
poziomach:
a)Struktura pierwszorzędowa – kolejność aminokwasów w liniowym łańcuchu
polipeptydowym
b)Struktura drugorzędowa – sposób przestrzennego ułożenia łańcucha
polipeptydowego wynikający z geometrycznej budowy wiązania peptydowego i wiązań
wodorowych, które tworzą się między grupami CO i NH tego samego lub różnych
łańcuchów.
Grupa peptydowa ma sztywną budowę, dlatego łańcuchy polipeptydowe białek
skręcają się prawostronnie w cylindryczne spirale – tzw. linie śrubowe ( α-helisy). Możliwe
też są struktury β – tzw. pofałdowanej kartki papieru. Dwa równoległe łańcuchy
polipeptydowe są w nich połączone wiązaniami wodorowymi.
c)Struktura trzeciorzędowa – ułożenie w przestrzeni skręconych w cylindryczne
spirale łańcuchów polipeptydowych.
Teoretycznie liczba struktur trzeciorzędowych jest nieskończona, ale każde
naturalne białko ma tylko jedną taką strukturę. Jej zmiana prowadzi do zmiany właściwości
białka.
d)Struktura czwartorzędowa – sposób organizacji w przestrzeni kilku
makrocząsteczek polipeptydów
Tworzy się, gdy w skład białka wchodzi więcej niż jeden łańcuch polipeptydowy.
2. Klasyfikacja białek
Ze względu na skład białka dzielimy na proteiny i proteidy. Proteiny to białka proste,
zbudowane tylko z aminokwasów, zaś proteidy to białka złożone, które dodatkowo
zawierają elementy substancji niebiałkowych (tzw. grupy prostetyczne) takie jak
węglowodany, tłuszcze czy kwasy nukleinowe.
Ze względu na budowę białka dzielimy na białka fibrylarne (włóknowe) i globularne
(kłębkowe). Białka fibrylarne, takie jak kolagen lub kreatyna, mają cząsteczki wydłużone,

nitkowate i są albo słabo rozpuszczalne albo wcale nie rozpuszczalne w wodzie. Białka
globularne zwykle są zwinięte w zwarty, w przybliżeniu kulisty kształt. Są raczej
rozpuszczalne w wodzie i są składnikami płynów ustrojowych.
Nazwa
Występowanie i zastosowanie
Białka fibrylarne
•
Kolageny
•
Elastyny
•
Fibrynogen
•
Keratyny
•
Miozyny
•
skóry zwierzęce, ścięgna, tkanki łączne
•
naczynia krwionośne, wiązadła
•
niezbędny do krzepnięcia krwi
•
skóra, wełna, pióra, kopyta, jedwab, paznokcie
•
tkanka mięśniowa
Białka globularne
•
Hemoglobina
•
Immunoglobiny
•
Insulina
•
Rybonukleaza
•
bierze udział w transporcie tlenu
•
biorą udział w reakcjach odpornościowych
•
hormon regulujący metabolizm glukozy
•
enzym regulujący syntezę RNA
Białka dzielimy również ze względu na właściwości odżywcze - wyróżnia się białka
doborowe i niedoborowe. Białka doborowe (pełnowartościowe) to takie, które w swoim
składzie zawierają wszystkie aminokwasy egzogenne. Do takich białek zaliczamy np.
albuminę, białko jaja kurzego, białko mleka i mięsa. Białka niedoborowe
(niepełnowartościowe) to takie, w których brakuje choćby jednego aminokwasu
egzogennego. Przykładem takiego białka jest kolagen, żelatyna.
3. Właściwości chemiczne białek
Reakcją ksantoproteinowa - charakterystyczn dla białek reakcja ze stężonym HNO
3
,
w której białko zmienia swoje zabarwienie na żółte.
Denaturacja – rozpad wiązań wodorowych w drugo i trzeciorzędowej strukturze
białek na skutek zmiany temperatury lub pH.
Koagulacja – tworzenie osadów rozpuszczalnych w wodzie w reakcjach z solami
lekkich metali i solami amonu (np. NaCl, Ca(NO
3
)
2
, (NH
4
)
2
SO
4
itp.)
4. Trawienie białek
Białka pokarmowe w organizmie dostają się pod wpływ enzymów występujących
w żołądku i przewodzie pokarmowym, a szczególnie pepsyny. Pod działaniem enzymów
ulegają procesowi hydrolizy, co prowadzi do uzyskania poszczególnych aminokwasów lub
polipeptydów. Częściowo zhydrolizowane białka hyrolizują do aminokwasów
w dwunastnicy i jelicie cienkim.
5. Białka w żywieniu
Białko jest konieczne w diecie każdego człowieka. Nasze ciała mogą syntezować
tylko 10 spośród 20 pospolitych aminokwasów. Pozostałe 10 aminokwasów musi
pochodzić z trawienia białek, które dostały się do organizmu wraz z pokarmem. Nie każdy
rodzaj żywności dostarcza odpowiedniej ilości 10 podstawowych aminokwasów, aby
zaspokoić minimalne zapotrzebowanie. Dobrymi źródłami białek są: mięso, jaja, orzechy,
zboża, rośliny strączkowe oraz nabiał, jak mleko czy ser (np. parmezan zawiera aż ok.
40% białka)

6. Rola białek w ustroju człowieka
Funkcja
Przykład
Wzrost
rozwój młodych organizmów
Uzupełnianie naturalnych ubytków
wzrost włosów, paznokci, regeneracja
złuszczonych nabłonków skory i przewodu
pokarmowego
Naprawa tkanek
gojenie ran, wytwarzanie blizn
Sterowanie procesami przemiany materii
przez układy enzymatyczne
udział enzymów w syntezie i degradacji
różnych związkow, regulacja enzymatyczna
procesów życiowych, np. krzepnięcia krwi,
udział enzymów w degradacji substancji
obcych, np. leków, toksyn, udział w
procesach obronnych ustroju, np. odporność
komórkowa
Regulacja ważnych czynności życiowych
przez hormony
regulacja gospodarki energetycznej przez
insulinę
Udział w procesach obronnych ustroju
produkcja przeciwciał jako wyraz odporności
humoralnej ustroju
Regulacja równowagi wodnej
własności fizykochemiczne białek
umożliwiają wiązanie cząsteczek wody i
utrzymywanie jej w środowisku wewnątrz i
zewnątrz komórkowym, np. obniżenie
zawartości albumin we krwi powoduje
przechodzenie wody z krwiobiegu do tkanek
i powstawanie obrzęków
Regulacja równowagi kwasowo-zasadowej wykorzystanie własności buforowych białek
Funkcje transportowe białek
np. transferyna przenosi żelazo, a białko
wiążące retinol - witaminę A
Udział w procesach widzenia
białko światłoczułe (opsyna) przenosi
bodźce świetlne do zakończeń układu
nerwowego
Bibliografia:
1. John McMurry „Chemia organiczna tom 5”, Wydawnictwo Naukowe PWN
2. Hassa Romuald, Mrzigod Aleksandra i Janusz, Sułkowski Wiesław „Chemia - podręcznik dla liceum
ogólnokształcącego, profilowanego i technikum, część III” wydawnictwo M. Rożak
3.
http://pl.wikipedia.org/wiki/Białka
http://portalwiedzy.onet.pl/77063,,,,peptydy,haslo.html
Wyszukiwarka
Podobne podstrony:
Chemia 3 - ściąga (aminokwasy białka peptydy), Inne
Peptydy i białka
białka i wiaz peptyd 2011
Peptydy i białka
01 Aminokwasy, peptydy, białka, enzymyid 3054 ppt
68 Aminokwasy peptydy i bialka(1)
59 Zmiany strukturalne w dwuwarstwie po zwiazaniu z bialkami lub peptydami
68 Aminokwasy peptydy i bialka
Biochemia, Peptydy, Peptydy, Białka
biologia, bialka, 1 I rzedna struktora bialek- peptydy w budowie jednej plaszczyzny
Aminokwasy,peptydy,białka i inne
peptydy i bialka, Biologia-liceum
Aminokwasy, peptydy, białka
Peptydy i białka, STOMATOLOGIA, II ROK, Biochemia, zbiorcze
Peptydy i Białka, Kosmetologia, Notatki i wyłady, Biochemia
peptydy i bialka
Chemia 6 Aminokwasy Peptydy i Białka
więcej podobnych podstron