
Imię i Nazwisko:
Wydział: Grupa: Numer
ewidencyjny:
Temat ćwiczenia:
Data wykonania:
Data zaliczenia:
1. Cel
ćwiczenia:
Zapoznanie się z metodami pomiaru szybkości reakcji I rzędu. Wyznaczenie
stałej szybkości reakcji inwersji sacharozy katalizowanej kwasem w dwóch
różnych temperaturach, wyznaczenie energii aktywacji oraz obliczenie entalpii
i entropii aktywacji.
2. Sposób wykonania:
1.Włączyć i nastawić oba termostaty tak, aby różnica temperatur między nimi
wynosiła około 10°, najlepiej w zakresie między 20 a 40°C. W każdym z
termostatów umieścić (zawiesić):
- zamkniętą butelkę zawierającą 60 cm3 20-procentowego roztworu
sacharozy,
- zamkniętą butelkę zawierającą 25 cm
3
HCl o stężeniu 2 mol/dm
3
,
- zamkniętą butelkę zawierającą 25 cm
3
wody.
Po upływie około 10 - 15 min wszystkie butelki osiągają temperaturę równą
temperaturze wody w termostacie.
2.Z butelki zawierającej cukier pobieramy 25 cm
3
roztworu i wprowadzamy do
butelki z wodą. Butelek nie wyjmować z termostatu. Roztwór ten mieszamy i
napełniamy nim rurkę polarymetru, po czym mierzymy kąt skręcenia
płaszczyzny polaryzacji światła. Jest to kąt
α
0
.
3. Do butelki zawierającej 25 cm
3
HCl o stężeniu 2 mol/dm
3
dodać 25 cm
3
termostatowego roztworu cukru i zanotować dokładnie czas - od tej chwili
rozpoczynamy liczenie czasu. Zawartość butelki dokładnie mieszamy i
wypełniamy nią rurkę polarymetru. Dla reakcji prowadzonej w temperaturze
niższej (ok. 20°C) odczytujemy kąty skręcenia co 5 min przez 30 min, a dalej
co 15 min. Reakcję prowadzimy 90 min. W czasie pomiędzy poszczególnymi
pomiarami wypełniona rurka polarymetru powinna znajdować się w
termostacie. Rurkę tę należy wyjmować wyłącznie w celu dokonania pomiaru,
który trzeba wykonywać możliwie szybko. Przed pomiarem rurkę należy z
zewnątrz wytrzeć, a szczególnie starannie szkiełko zamykające rurkę.
Otrzymane wartości
α
t
wpisujemy do tabeli.
Uwaga. Z roztworami umieszczonymi w drugim termostacie (o temperaturze
wyższej) postępujemy analogicznie, z tym, że w tym przypadku
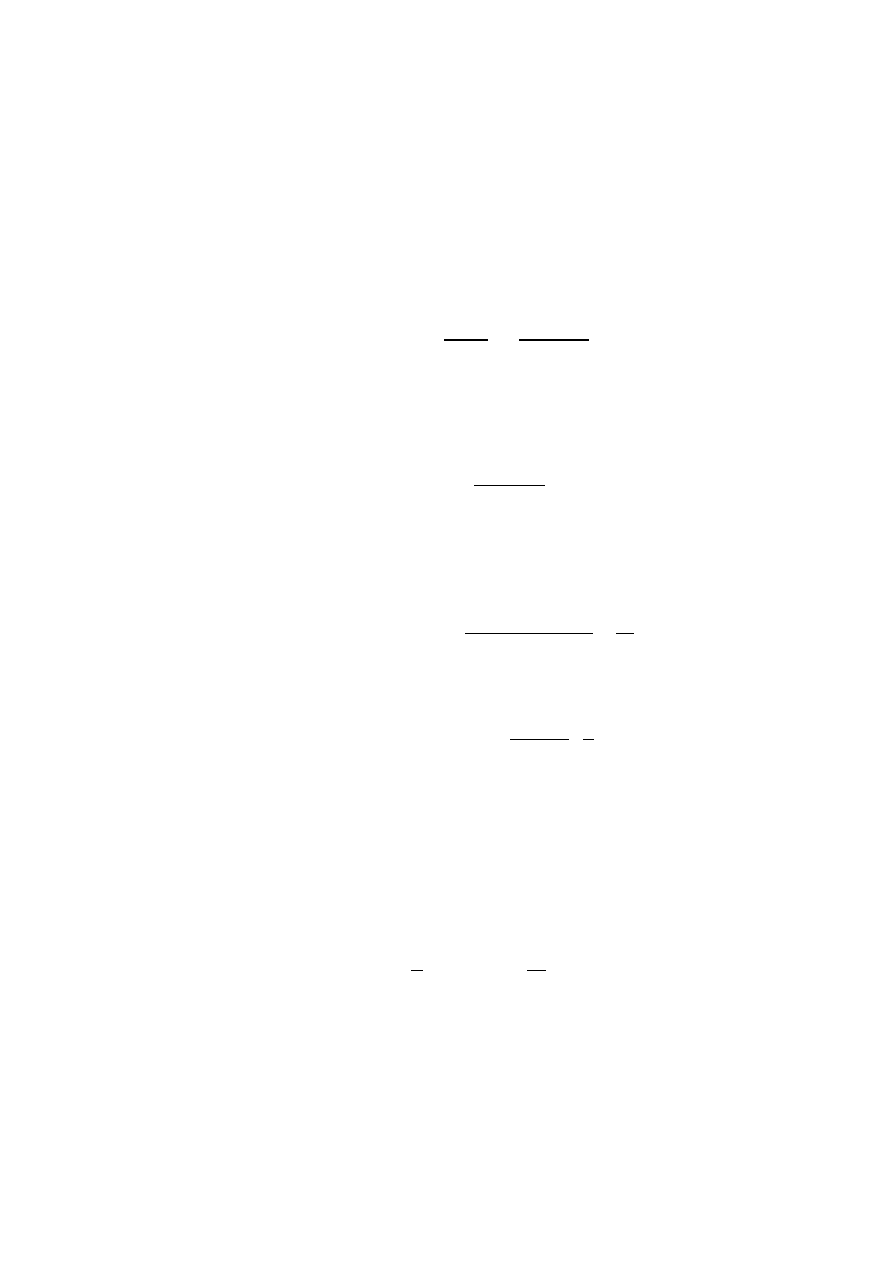
próby pobieramy co 2 min przez 10 min, a następnie co 5 min. Obie serie
należy prowadzić równolegle.
3. Sposób opracowania wyników:
1. Ze wzoru
α
∞
= -
α
o
(0,44 - 0,005 t) obliczyć kąt a
∞
dla badanych temperatur
inwersji
2. Obliczyć stałe szybkości reakcji (k) za pom
:
ocą równania
2,303
a z nich wartości średnie
i w temperaturze T
1
i T
2
3. Sporządzić wykres zależności:
od czasu. Z nachylenia prostych wyznaczyć dodatkowo (metodą graficzną)
stałe szybkości.
4. Korzystając z równania:
2,303 · ·
·
obliczyć metodą algebraiczną wartość energii aktywacji (E
A
) i z równania:
lg
lg
2,303
·
1
wartość czynnika przedwykładniczego A (do obliczeń użyć stałych szybkości z
punktu 2.).
5. Z równania:
∆
·
obliczyć entalpię aktywacji
∆
, a z równania:
∆
9,15 lg
1
205,92
·
·
entropię aktywacji
∆
6.Wyniki pomiarów i obliczeń zestawić w tabeli:
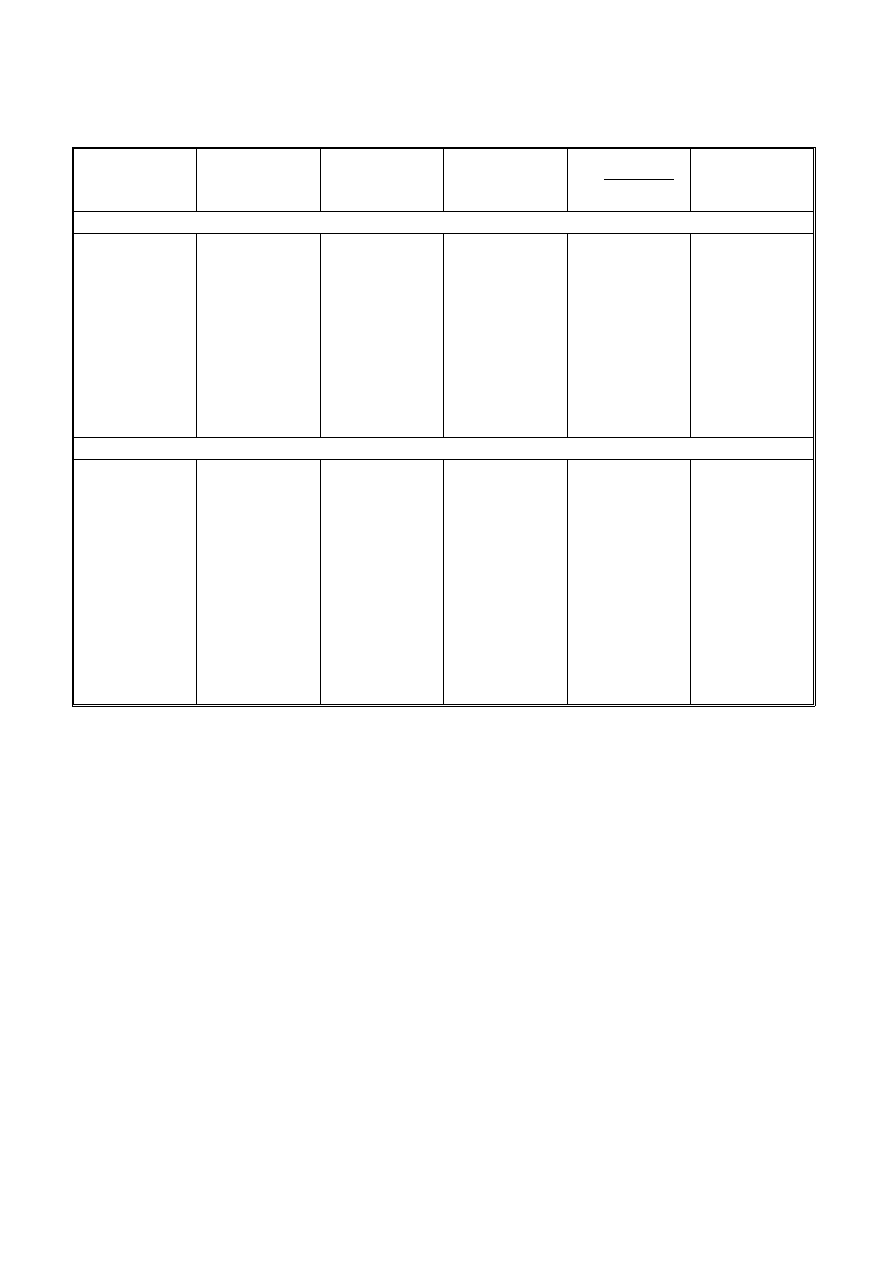
Kinetyka hydrolizy sacharozy
Czas trwania
inwersji
(s)
α
∞
Stała
szybkości
k
Termostat 1 – temperatura T
1
= K
Termostat 1 – temperatura T
1
= K
·
∆
·
∆
·
·

4. Obliczenia:

5. Wykresy (w załączniku)
6. Wnioski:
Wyszukiwarka
Podobne podstrony:
Sld 16 Predykcja
Ubytki,niepr,poch poł(16 01 2008)
16 Metody fotodetekcji Detektory światła systematyka
wyklad badania mediow 15 i 16
RM 16
16 Ogolne zasady leczenia ostrych zatrucid 16903 ppt
Wykład 16 1
(16)NASDAQid 865 ppt
16 2id 16615 ppt
Temat6+modyf 16 05 2013
bn 16
16 Tydzień zwykły, 16 wtorek
16 Dziedziczenie przeciwtestamentowe i obliczanie zachowkuid 16754 ppt
16 WITAMINY 2id 16845 ppt
P 16
prezentacja z cwiczen 16 12 08
więcej podobnych podstron