
09. Elementy geochemii izotopów
1
09. ELEMENTY GEOCHEMII IZOTOPÓW
9.1. Izotopy radioaktywne
Izotopami nazywamy odmiany tego samego pierwiastka różniące się masą atomową. Określenie „tego
samego pierwiastka” oznacza, że wszystkie atomy mają tyle samo protonów w jądrze. Natomiast określe-
nie „różniące się masą atomową” oznacza, że atomy poszczególnych izotopów mają różną ilość nukle-
onów w jądrze, co przy stałej ilości protonów oznacza różną ilość neutronów. A więc można powiedzieć,
że izotopami są odmiany tego samego pierwiastka różniące się liczbą protonów w jądrze. Przykładem są
izotopy pierwiastka węgla (patrz rys. 1.2 w rozdziale drugim), które mają tą samą liczbę atomową 6
(równą liczbie protonów w jądrze i decydującą o tym, jakiego pierwiastka jest to atom) natomiast różną
liczbę masową: 12, 13 lub 14, w zależności od liczby neutronów w jądrze (odpowiednio 6, 7 lub 8 neu-
tronów). Suma protonów i neutronów w jądrze składa się na liczbę masową, zapisywaną jako indeks gór-
ny przed symbolem pierwiastka:
12
C,
13
C,
14
C. Atomy poszczególnych izotopów noszą nazwę nuklidów.
Obecnie znanych jest około 1700 nuklidów z ponad 110 pierwiastków. Tylko około 280 z nich to stałe
izotopu, pozostałe ulegają rozpadowi promieniotwórczemu.
Promieniotwórczość została odkryta w 1896 r przez Henry Becquerela. Nauka o promieniotwórczości
zaczęła się rozwijać błyskawicznie z prędkością reakcji łańcuchowych. Samo słowo „radioaktywność”
zostało wymyślone przez Marię Skłodowską-Curie. W 1903 r Maria Curie, jej mąż Piotr i odkrywca zja-
wiska H.Becquerel otrzymali wspólnie nagrodę Nobla z fizyki. W kilka lat później, już po śmierci męża,
M.Curie otrzymała drugi raz nagrodę Nobla, tym razem z chemii. W 1935 r jej córka Irena również
otrzymała nagrodę Nobla z chemii za badanie promieniotwórczości.
Promieniotwórczość jest zaledwie ubocznym przejawem rozpadu niestabilnych jąder izotopów radioak-
tywnych. Niestabilność jąder jest spowodowana nadmiarem bądź niedoborem neutronów w stosunku do
optymalnej ilości względem liczby protonów. W przypadku naturalnych izotopów może wystąpić jedynie
nadmiar neutronów: niedobór neutronów jest obserwowany w sztucznych izotopach promieniotwórczych.
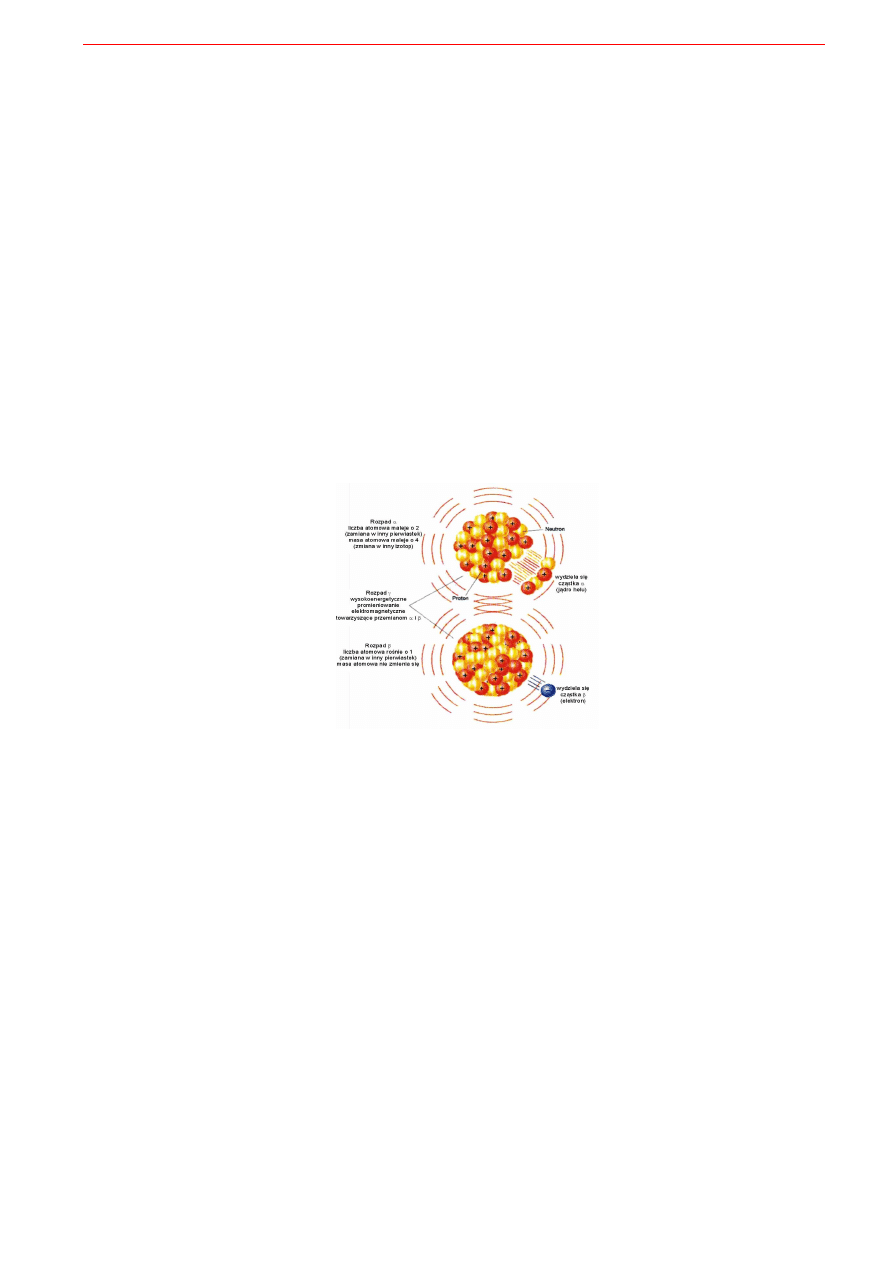
Przykładami przemian promieniotwórczych są przemiana beta, przemiana alfa i spontaniczny rozpad
jądra z wytworzeniem dwóch mniejszych jąder atomów innych pierwiastków (Rys. 9.1.). W przemianie
β
-
zmniejszenie nadmiaru neutronów dokonuje się najłatwiej przez emisję promieniowania β
-
czyli emisję
elektronu.Powstaje on podczas przemiany neutronu w proton:
n => p + e
-
+ ν
Ubocznym efektem jest też wydzielenie cząstki antymaterii antyneutrina ν. W przemianie β
+
zmniejsze-
nie niedoboru neutronów (nadmiaru protonów) dokonuje się najczęściej przez emisję promieniowania β
+
czyli emisje pozytonu (dodatniego elektronu e
+
) podczas przemiany protonu w neutron:
p => n + e
+
+ ν
09. Elementy geochemii izotopów
2
z wydzieleniem neutrina ν. Ta przemiana zachodzi wyłącznie w przypadku sztucznych izotopów promie-
niotwórczych.
Jądra atomowe o dużej masie (>58) ulegają często rozpadowi z wydzieleniem cząstek α, złożonych z 2
protonów i 2 neutronów (cząstki α są identyczne z jądrami atomów helu He). Przemianie tej często towa-
rzyszy też emisja groźnego promieniowania γ. Podczas kolizji emitowanych cząstek α z otoczeniem wy-
dziela się ciepło. Takie kolizje mogą wywołać zniszczenia w strukturze krystalicznej minerałów zawiera-
jących pierwiastki emitujące cząstki α. Jednym z najpowszechniej obserwowanym przejawem takich
zniszczeń są obwódki pleochroiczne wokół wrostków cyrkonów w biotytach widoczne w świetle spolary-
zowanym w mikroskopowych szlifach petrograficznych. Jest to efekt optyczny związany właśnie
z uszkodzeniami w strukturze krystalicznej biotytu spowodowanym promieniowaniem α emitowanym
z cyrkonów. Źródłem tego promieniowania są domieszki pierwiastków promieniotwórczych (U, Th, ...)
szczególnie obficie występujące w cyrkonach. Rozmiary tych obwódek dają też pojęcie o niewielkim
zasięgu przenikalności promieniowania α w skałach nieprzekraczających ułamków milimetra.
Rys. 9.1. Schemat promieniotwórczych przemian
α
,
β
i γ
Jądra atomowe o dużych masach (np.
238
U) są nietrwałe i ulegają często spontanicznemu rozpadowi na
dwa nierównej wielkości fragmenty z wydzieleniem dużej ilości energii. Tym przemianom towarzyszy
najczęściej emisja cząstek i promieniowania, na przykład groźnych i przenikliwych promieni γ czy pro-
mieni X. Taki rozpad może też zostać wymuszony na przykład bombardowaniem neutronami wywołując
reakcję łańcuchową. Szkodliwość promieniowania dla organizmów żywych zależy od jego energii. Naj-
bardziej szkodliwe a jednocześnie najbardziej przenikliwe jest promieniowanie o wysokiej energii: pro-
mieniowanie kosmiczne, promieniowanie gamma γ i promieniowanie rentgenowskie X. Czym wyższa
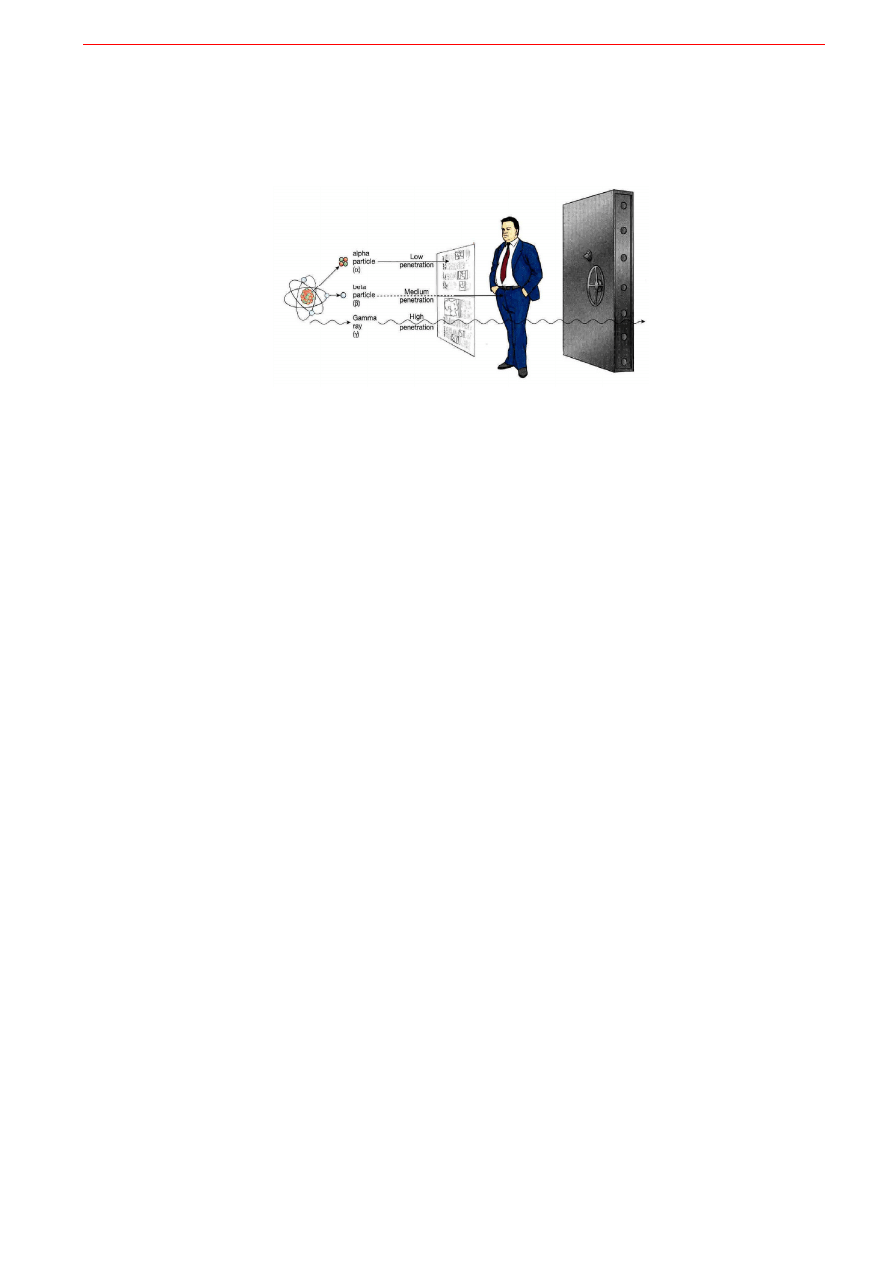
energia promieniowania tym krótsza długość fali. Cząstki α mają dużą masę a więc promieniowanie α ma
dużą długość fali i małą przenikliwość. Nieco większą przenikliwość mają cząstki β, a największą przeni-
kliwość i szkodliwość ma promieniowanie γ (Rys. 9.2.). Ze względu na wszechobecność śladowych ilości
naturalnych i antropogenicznych pierwiastków radioaktywnych oraz ze względu na przenikliwość pro-
mieniowania kosmicznego jesteśmy stale pod działaniem śladowego promieniowania. Większość (ok.
70%) pochodzi z jedzenia, powietrza i z powierzchni ziemi. Kilkanaście procent to promieniowanie ko-
09. Elementy geochemii izotopów
3
smiczne a kolejne kilkanaście procent to efekt okresowych prześwietleń promieniami X wykonywanych
dla naszego zdrowia. Jak dotąd wpływ promieniowania pochodzącego z wypadków i prób związanych
z reaktorami i bombami atomowymi jest globalnie oceniany na poniżej jednego procenta.
Rys. 9.2. Czym wyższa energia promieniowania tym krótsza długość fali i większa przenikliwość promieniowania.
Istnieje kilka sposobów pomiaru intensywności promieniowania. Jest to o tyle istotne, że intensywność
promieniowania jest proporcjonalna do ilości atomów ulegających rozpadowi radioaktywnemu. Pomiar
intensywności promieniowania pozwala więc na oznaczenie zawartości (stężenia) izotopu promienio-
twórczego. Jeden z najprostszych i od dawna stosowanych liczników opiera się na zliczaniu wyładowań
elektrycznych powstających w gazie ulegającym jonizacji pod wpływem promieniowania. W liczniku
tym, we wnętrzu katody w kształcie walca umieszczona jest anoda z cienkiego drutu a wolna przestrzeń
wypełniona jest gazem. Taka konstrukcja pozwala na powstanie silnego niejednorodnego pola elektrycz-
nego pod wpływem promieniowania jonizującego a licznik rejestruje wyładowania tego pola.
Wyzwanie analityczne dla wykonywanych pomiarów stanowi fakt, że izotopy promieniotwórcze sta-
nowią zazwyczaj śladową domieszkę pośród składników głównych minerałów i skał. Ponadto stosowana
metoda analityczna musi pozwalać na odróżnianie od siebie poszczególnych izotopów tego samego pier-
wiastka.
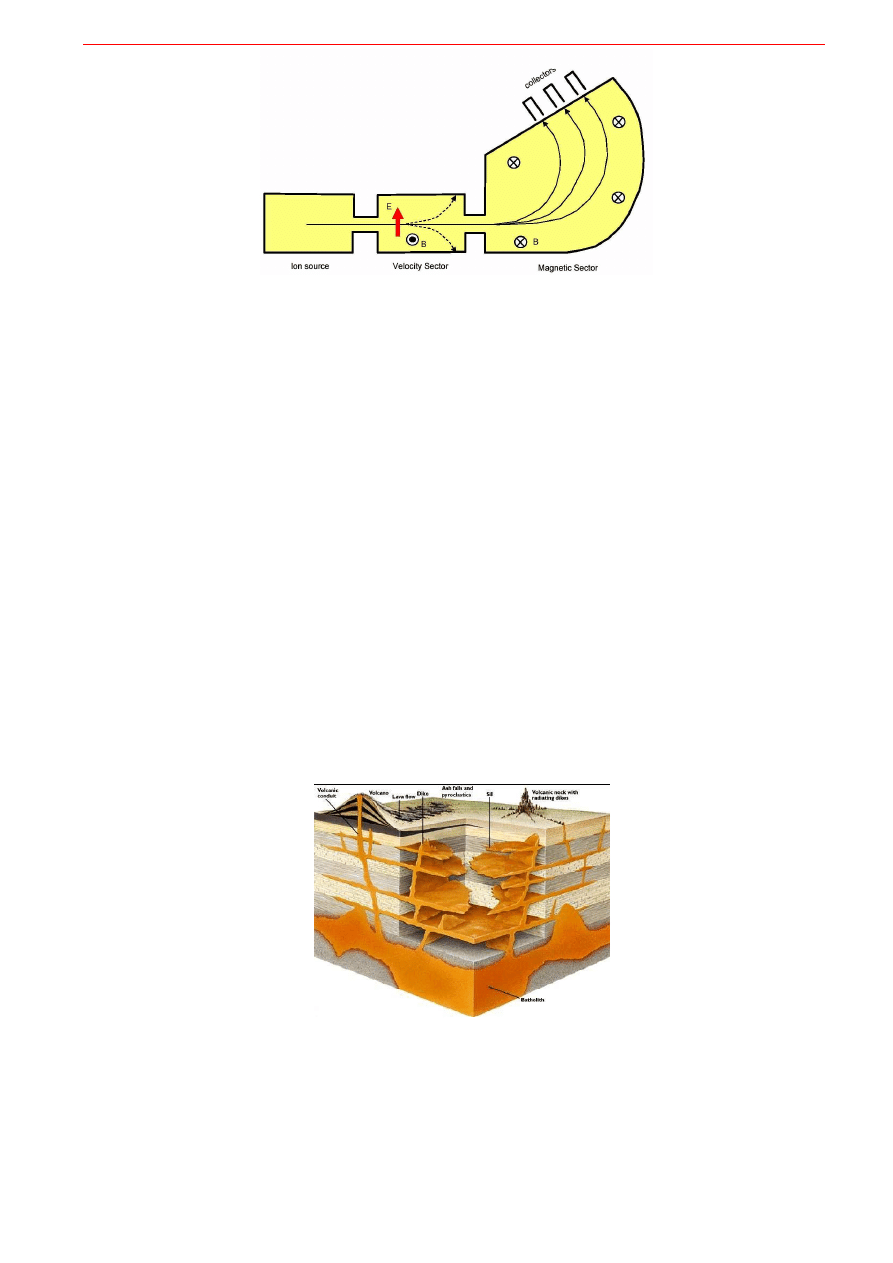
Oznaczenia izotopowe wykonuje się z użyciem spektrometru mas
. Jest to urządzenie pozwa-
lające odróżniać od siebie i zliczać atomy według ich masy (Rys. 9.3.). Badaną substancję trzeba prze-
prowadzić do stanu gazowego. Gaz ten wprowadza się do komory próżniowej i jonizuje strumieniem
elektronów. Powstały strumień jonów dodatnich jest przyspieszany w polu elektrycznym. Tor ruchu pę-
dzących naładowanych cząstek można zakrzywić przy użyciu pola magnetycznego. Krzywizna toru, przy
stałym ładunku cząstki, zależy od jej masy. Mierząc pole magnetyczne niezbędne do takiego zakrzywie-
nia toru, aby cząstki trafiły do detektora można wyznaczyć masę izotopu a detektor mierzy jego koncen-
trację. Z przyczyn technicznych w spektrometrach masowych uzyskuje się znacznie dokładniejsze wyniki
pomiaru, gdy oznacza się wzajemne proporcje ilości izotopów niż gdy mierzy się zawartości. Dlatego
wiele wzorów i wykresów stosowanych w geochronologii jest przedstawianych w konwencji stosunków
izotopowych np.
87
Rb/
86
Sr czy
40
Ar/
39
Ar.
09. Elementy geochemii izotopów
4
Rys. 9.3. Schemat działania spektrometru mas. Badaną substancję w postaci gazu wprowadza się do komory próżniowej
i jonizuje strumieniem elektronów. Strumień jonów dodatnich jest przyspieszany w polu elektrycznym. Ich bieg odchyla się
pod wpływem pola magnetycznego w różnym stopniu w zależności od ich masy.
Podstawy geochronologii
Geochronologia jest dziedziną geologii poświęconą datowaniu, czyli określaniu wieku obiektów
i procesów geologicznych. Używa się pojęć: wiek względny i wiek bezwzględny. Wiek względny to ja-
kościowe określenie zdarzeń według logiki następstw. Na przykład dajka przecinająca utwory skalne jest
od nich młodsza (Rys. 9.4.).
Wiek bezwzględny to oznaczony metodami geochronologicznymi czas
w latach, jaki upłynął od zajścia zdarzenia geologicznego do dzisiaj
. Podstawą teoretyczną zastoso-
wania radioizotopów do oznaczania wieku jest stwierdzenie, że
szybkość każdej przemiany promienio-
twórczej jest charakterystyczna dla tej przemiany i stała bez względu zmiany ciśnienia, temperatu-
ry i na reakcje chemiczne, w które wchodzą pierwiastki promieniotwórcze
. Radiometryczne datowa-
nie minerałów i skał pozwala więc na ustalenie bezwzględnego wieku utworów i na rekonstrukcję następ-
stwa zdarzeń i historii geologicznej badanego obszaru a w konsekwencji całych płyt tektonicznych.
Rys. 9.4. Wiek względny: dajka przecinająca sekwencję warstw jest od nich młodsza. Geochronologia pozwala na oznaczenie
bezwzględnego wieku intruzji a tym samym na umiejscowienie sekwencji związanych z nią zdarzeń geologicznych w skali
czasu w przeszłości Ziemi.
Zasada datowania izotopowego jest dość prosta. Niektóre minerały zawierają domieszki izotopów pro-
mieniotwórczych, które stale ulegają rozpadowi. Prędkości rozpadu dla poszczególnych izotopów uży-
09. Elementy geochemii izotopów
5
tecznych w geochronologii są obecnie dokładnie znane. Oznacza to, że wiemy z jaką prędkością ubywa
atomów izotopu macierzystego i jednocześnie przybywa produktów rozpadu. Od momentu krystalizacji
minerału w procesie magmowym czy metamorficznym lub rekrystalizacji w procesie metamorficznym
czy w czasie diagenezy możemy traktować minerał jako układ zamknięty na wymianę składników z oto-
czeniem. W takim zamkniętym systemie z upływem czasu geologicznego ubywa w minerale izotopów
macierzystych a jednocześnie w wyniku rozpadu przybywa innych izotopów (izotopów pochodnych, pro-
duktów samorzutnego rozpadu), których przedtem w minerale nie było lub było mniej. Czyli od momentu
„zamknięcia” zaczynają się w minerale akumulować produkty przemiany promieniotwórczej. Znając stałą
prędkości rozpadu i mierząc dzisiejsze wzajemne proporcje izotopów można wyznaczyć czas, jaki upły-
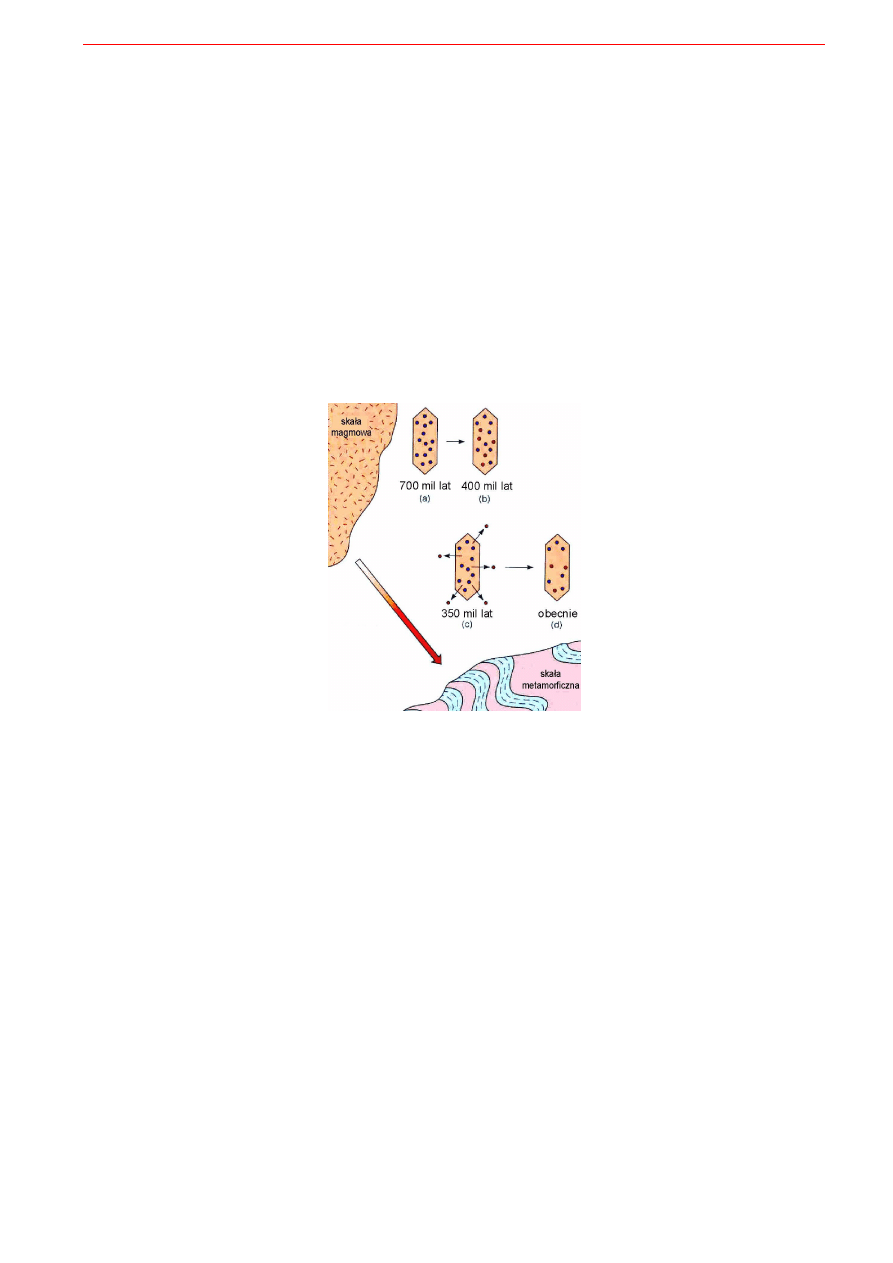
nął od krystalizacji (czy rekrystalizacji) datowanych minerałów i skał. Przedstawia to rys. 9.5.
Rys. 9.5. Przykładowy scenariusz możliwości interpretacji historii skały metamorficznej odtworzonej metodami geochronolo-
gicznymi. a) Minerał wykrystalizował w skale magmowej 700 milionów lat temu. b) Po upływie 300 Ma (czyli 400 milionów
lat temu) zakumulowało się w nim nieco produktów przemiany promieniotwórczej odpowiadające upływowi tego czasu. c)
Metamorfizm 350 mil. lat temu spowodował jednak utratę tych produktów przemiany i zresetowanie zegara radiogenicznego.
d) Dzisiejsze datowanie minerału wyseparowanego ze skały może pozwolić na ustalenie wieku metamorfizmu (350 Ma) pod-
czas gdy datowanie całej skały może pozwolić ustalić wiek krystalizacji protolitu magmowego (700Ma).
Datowanie metodą K-Ar.
Pośród różnych izotopów potasu izotop
40
K jest nietrwały ulegając przemianie na izotop argonu
40
Ar
albo na izotop wapnia
40
Ca. Łączna stała rozpadu promieniotwórczego dla obu tych reakcji wynosi λ =
5,543
.
10
-10
lat
-1
. Powstający
40
Ar jest gazem. Mierząc zawartość uwięzionego w próbce
40
Ar
i wyznaczając stężenie pozostałego jeszcze macierzystego
40
K można obliczyć, przez jaki okres czasu
argon akumulował się w próbce od momentu zamknięcia na wymianę składników z otoczeniem. W zasa-
dzie do oznaczenia wieku, a więc do określenia ile czasu minęło od „zamknięcia“ minerału wystarczy
albo zmierzyć ile powstało atomów izotopu wapnia
40
Ca albo ile powstało atomów izotopu argonu
40
Ar.
Jednakże pomiar stężenia izotopu wapnia jest zazwyczaj niewygodny. Pierwiastek ten jest tak powszech-
ny, występując często jako główny składnik o dużych stężeniach, że analitycznie trudno jest zmierzyć

09. Elementy geochemii izotopów
6
niewielki wzrost jego zawartości w wyniku przemiany promieniotwórczej potasu. To tak jakby mierzyć o
ile podniósł się poziom wody w wiadrze po dodaniu jednej kropli. Natomiast pomiar zawartości argonu
jest znacznie wygodniejszy. Argon jest gazem, w dodatku gazem szlachetnym, a więc nie wchodzi
w skład związków chemicznych budujących skałę. Możemy być niemal całkowicie pewni, że w momen-
cie „zamknięcia” nie było w badanym minerale ani śladu argonu, a cały argon wykryty obecnie powstał w
wyniku rozpadu promieniotwórczego i zakumulował się, ponieważ nie miał jak uciec z ciasnej struktury
minerału. Stosując tą samą analogię co poprzednio można stwierdzić, że łatwo zauważyć kilka kropel
wody na dnie pustego wiaderka.
Mierząc zawartość więzionego w minerale izotopu argonu
40
Ar
dzisiaj
i wyznaczając stężenie pozostałego
jeszcze macierzystego izotopu radioaktywnego potasu
40
K można z prostego równania obliczyć ile czasu
upłynęło od „zamknięcia” minerału:
40
Ar
dzisiaj
=
40
Ar
o
+ 0,105
.
40
K(e
λ t
– 1)
gdzie
40
Ar
o
oznacza początkową ilość argonu w próbce w momencie „zamknięcia”. Ponieważ możemy
z czystym sumieniem założyć, że
40
Ar
o
= 0 równanie upraszcza się do
40
Ar
dzisiaj
= 0,105
.
40
K(e
λ t
– 1)
gdzie λ to stała rozpadu izotopu
40
K natomiast t jest szukanym przez nas wiekiem próbki. Pomiar można
wykonać następująco: dokładnie zważoną porcję wyseparowanego czysto minerału podgrzewa się mocno
(do kilkuset stopni) w próżni. Uwolniony gaz przepompowywany jest do spektrometru masowego
i oznaczana jest w nim zawartość izotopu
40
Ar. Z osobnej naważki oznacza się dokładnie zawartość pota-
su przez bezpośrednią analizę ciała stałego używając fluorescencji rentgenowskiej lub przez rozpuszcze-
nie w kwasach i oznaczenie potasu na mokro metodami opisanymi w ostatnich wykładach. Izotop
40
K
zawsze stanowi 0,01167 część tak oznaczonego potasu całkowitego.
Metoda potas-argon jest szeroko stosowaną techniką datowania i jedną z najstarszych metod geochro-
nologicznych rozwijanych od ponad pięćdziesięciu lat. Ponieważ potas jest bardzo powszechnym pier-
wiastkiem można wykonywać oznaczenia różnych minerałów skałotwórczych, z których najczęściej ana-
lizowanymi są hornblenda, muskowit, biotyt i skalenie, a w skałach osadowych również glaukonit i illit.
Oprócz czystych separatów mineralnych okazyjnie datuje się również próbki skał. Czas połowicznego
rozpadu izotopu
40
K wynosi 1,25 miliarda lat, co pozwala na zastosowanie tej metody nawet do bardzo
starych skał. W szczególnych przypadkach technikę można stosować też do bardzo młodych utworów,
których wiek jest mierzony w dziesiątkach tysięcy lat.
Pomimo tych wielu cudownych zalet i zastosowań metoda ta ma pewne ograniczenia, które w efekcie
spowodowały, że w miarę rozwoju innych technik datowania utworów geologicznych coraz rzadziej
używa się metody K-Ar do skał metamorficznych czy magmowych. Należy pamiętać, że jednym
z podstawowych założeń obliczeń jest w tym wypadku przypuszczenie, że od momentu „zamknięcia”
analizowanego minerału argon nie „uciekał” tylko cały czas ulegał akumulacji. Niestety, już niewielkie
podgrzanie skały do temperatury 100-200
o
C lub intensywne ruchy tektoniczne czy inne przyczyny po-

09. Elementy geochemii izotopów
7
wodujące mechaniczne spękanie ziaren mogą spowodować częściową ucieczkę Ar. Taka ucieczka powo-
duje, że oznaczony minerał wydaje się być młodszy niż jest w rzeczywistości a otrzymana data nie wiąże
się z żadnym epizodem geologicznym w historii skały i po prostu nie ma sensu. Niestety, nie ma możli-
wości zweryfikowania takiego wyniku i często nie wiemy, czy otrzymany rezultat ma sens geologiczny
czy nie. Jedynym sposobem weryfikacji jest określenie wieku tej samej próbki inną metodą pozbawioną
takiej wady. Ale w takim wypadku, po co w ogóle robić oznaczenie K-Ar inwestując czas i pieniądze,
jeśli można to oznaczenie zrobić od razu inną, lepszą metodą? Tak więc, choć metoda K-Ar nie wyszła
z użycia, zmieniły się jej zastosowania, Dla starszych skał magmowych i metamorficznych
o skomplikowanej wieloetapowej historii geologicznej zastąpiły ją metody nowocześniejsze,
w szczególności metoda Ar-Ar i metody U-Th-Pb.
Datowanie metodą izochrony.
Kolejną metodą geochronologiczną jest cała rodzina technik datowania z użyciem tzw. izochrony,
z których klasycznym przykładem jest datowanie Rb-Sr. Z dwóch izotopów rubidu,
85
Rb i
87
Rb, ten
ostatni jest promieniotwórczy i stanowi około 28% całego rubidu występującego w próbce. Jego prze-
miana prowadzi do powstania izotopu strontu
87
Sr. Ich wzajemne zawartości w analizowanej próbce
można przedstawić w formie równania linii prostej o postaci y=ax+b:
(
87
Sr/
86
Sr)
dzisiaj
= (e
λ t
– 1)
.
(
87
Rb/
86
Sr)
dzisiaj
+ (
87
Sr/
86
Sr)
początkowo
To pozornie skomplikowane równanie w istocie nie jest takie straszne. Po pierwsze fakt, że zamiast bez-
pośrednich zawartości rubidu czy strontu używa się stosunku izotopów wynika z ograniczeń analitycz-
nych. Do oznaczeń używa się spektrometru mas opisanego powyżej a specyfiką tego urządzenia jest to,
że znacznie dokładniejsze wyniki otrzymujemy mierząc stosunki izotopowe niż ich absolutne zawartości.
W tym wypadku wykorzystuje się jak odnośnik izotop
86
Sr. W powyższym równaniu λ jest stałą rozpadu
promieniotwórczego izotopu
87
Rb, zaś (
87
Sr/
86
Sr)
dzisiaj
i (
87
Rb/
86
Sr)
dzisiaj
są naszymi wynikami oznaczeń
wykonanych na próbce z użyciem spektrometru masowego. Pozostają nam dwie niewiadome: czas t
(wiek próbki) i (
87
Sr/
86
Sr)
początkowo
. Ta ostatnia niewiadoma mówi nam o tym ile było już w próbce izoto-
pu
87
Sr w momencie „zamknięcia”. O ile w technice K-Ar nie mieliśmy tego problemu, bo zakładaliśmy,
że gazowego argonu nie było w próbce w ogóle, o tyle tutaj nie możemy zrobić takiego założenia i war-
tość początkową trzeba jakoś poznać. Oznaczyć się tego nie da, więc trzeba ją wyliczyć. Dla obliczenia
dwóch niewiadomych najlepiej jest ułożyć układ dwóch równań. Wystarczy więc wykonać co najmniej
dwa oznaczenia dla dwóch różnych minerałów z tej samej skały i z układu równań (lub z przecięcia pro-
stej z osią Y) wyznaczyć początkową zawartość
87
Sr/
86
Sr. Bo przecież obydwa badane minerały wzięte
z tej samej skały muszą mieć jednakowy wiek. Tak powstała prosta nazywa się izochroną, czyli prostą
jednakowego wieku.
Jak powstaje izochrona? Otóż każdy z oznaczanych minerałów ma inną zawartość potasu a więc i inną
zawartość rubidu. W efekcie, na skutek przemiany promieniotwórczej radioaktywnego
87
Rb powstaje
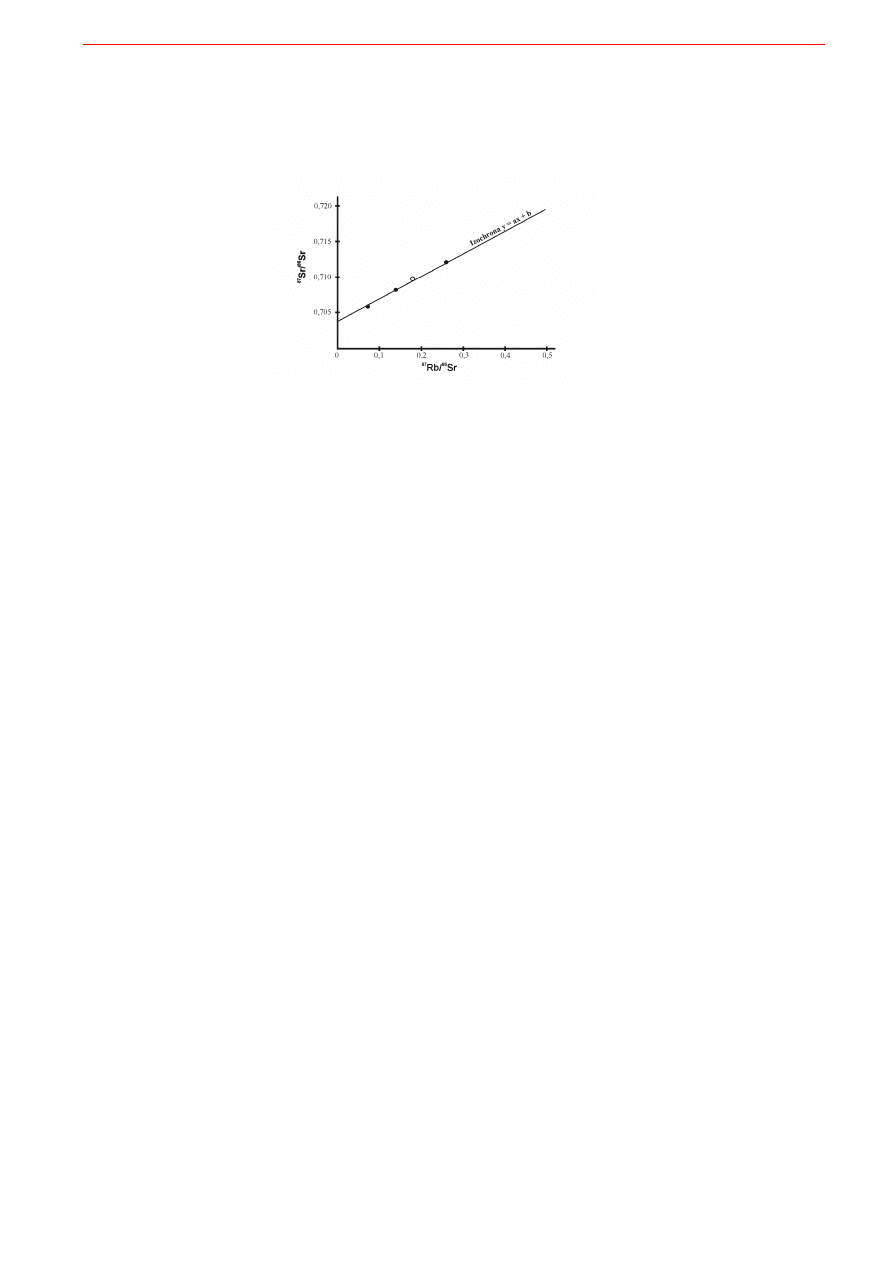
09. Elementy geochemii izotopów
8
w nich inna ilość pochodnego izotopu strontu
87
Sr. A więc na wykresie (Rys. 9.6) punkty odpowiadające
poszczególnym minerałom czy całej skale wypadną w różnych miejscach. Ponieważ jednak wszystkie te
próbki mają ten sam wiek wszystkie punkty ułożą się na prostej, nachylenie której pozwoli wyznaczyć
wiek.
Rys. 9.6. Idea konstrukcji izochrony dla oznaczenia wieku skały magmowej, jako prostej regresji wyznaczonej na podstawie
analizy wyseparowanego plagioklazu, piroksenu i ilmenitu (czarne kółka) oraz analizy całej skały (białe kółko). Wiek oznacza-
jący czas, jaki upłynął od krystalizacji skały wyliczany jest z nachylenia izochrony a = e
λ
t
- 1.
Koncepcja izochrony ma olbrzymi sens interpretacyjny w geologii, bo rozwiązuje opisany wcześniej
problem związany z metodą K-Ar identyfikacji błędnych oznaczeń. Jeśli na przykład skała magmowa
przeszła w swej historii jakiś epizod termiczny, który zachwiał zawartością izotopów w minerałach to
znajdzie to odbicie na izochronie. Jeśli taki epizod termiczny był słaby i spowodował jedynie zachwianie
składu izotopowego minerałów przez częściową dyfuzję (w każdym z nich w innym stopniu) nasze wyni-
ki oznaczeń nie ułożą się na linii prostej a więc nie utworzą izochrony. I chociaż nie uda się w ten sposób
określić ani wieku skały ani wieku epizodu termicznego i nasz czas i pieniądze włożone w analizy pójdą
do kosza, to jednak unikniemy opublikowania bezsensownego wyniku, który nie ma żadnego związku z
wiekiem jakiegokolwiek zdarzenia geologicznego z historii tej skały. Jeśli jednak ten epizod termiczny
był na tyle silny, że umożliwił swobodna dyfuzję Sr i Rb w całej skale (homogenizację izotopową), po-
wstanie izochrona, której nachylenie będzie wskazywało na czas jaki upłynął nie od krystalizacji tej skały
z magmy lecz od tego właśnie, ostatniego epizodu metamorficznego, który spowodował homogenizację
składu izotopowego.
Rubid jest pierwiastkiem śladowym często obecnym w minerałach zawierających potas, za który Rb
podstawia się izomorficznie zgodnie z regułami Goldschmidta. Dlatego metodę Rb-Sr można zastosować
do całej skały (w publikacjach anglojęzycznych oznaczanych często WR = whole rock) oraz do datowa-
nia separatów mineralnych z tej skały: muskowitu, biotytu, skaleni potasowych, hornblendy, i in. Metodę
stosuje się najczęściej do skał magmowych i metamorficznych, choć udaje się też datować autigeniczny
glaukonit ze skał osadowych.
Datowanie metodą U-Th-Pb
Prawdopodobnie najbardziej skomplikowaną, ale też jedną z najbardziej użytecznych i wciąż w różnych
odmianach rozwijaną jest rodzina metod datowania z wykorzystaniem uranu, toru i ołowiu. W swej pod-

09. Elementy geochemii izotopów
9
stawowej, klasycznej już wersji wykorzystuje jednocześnie serie promieniotwórcze, które na drodze wie-
lu przemian prowadzą do powstania różnych izotopów ołowiu:
238
U->
206
Pb
235
U->
207
Pb i
232
Th->
208
Pb.
Tak jak w poprzednio omawianych metodach do analizy wykorzystuje się spektrometr masowy oznacza-
jąc wybrane stosunki izotopowe, np.
207
Pb/
235
U i
206
Pb/
238
U. Ze względu na długi czas połowicznego roz-
padu wymienione reakcje mogą być stosowane do bardzo starych skał. Metoda jest stosowana głównie do
skał metamorficznych i magmowych oraz do detrytycznych ziaren w klastycznych skałach osadowych.
Służy do określania wieku krystalizacji z magmy i wieku metamorfizmu. Najczęściej oznaczenia wyko-
nuje się na ziarnach cyrkonu, analizuje się też apatyt, monacyt, czy tytanit i inne. Minerały te mają
w swej strukturze pozycje zdolne pomieścić niewielkie domieszki dużych czterowartościowych jonów
U
4+
i Th
4+
. Natomiast ze względu na różnice w rozmiarach i ładunku jonów ograniczenia opisane reguła-
mi Goldschmidta minerały te (za wyjątkiem apatytu) praktycznie nie dopuszczają w swej strukturze oło-
wiu. Mamy więc sytuację korzystną podobnie jak w metodzie K-Ar: możemy założyć, że ilość atomów
izotopów ołowiu jako produktów przemian promieniotwórczych wynika jedynie z długości okresu czasu
w jakim ołów się akumulował (tak jak akumulacja argonu w minerałach zawierających K).
Analiza polega na odparowaniu całego lub fragmentu ziarna cyrkonu i oznaczeniu odpowiednich sto-
sunków izotopowych ołowiu i uranu przy użyciu spektrometru mas. Wyniki oznaczeń izotopowych inter-
pretuje się w szczególny sposób na specjalnie do tego skonstruowanym wykresie. Na osi poziomej wy-
kresu odkłada się zmierzony stosunek izotopów
207
Pb/
235
U a na osi pionowej zmierzony stosunek
206
Pb/
238
U.
Przez środek wykresu biegnie łukowata krzywa zwana konkordią, wyskalowana w skali
czasu
(Rys. 9.7). Wynik analizy izotopowej np. pojedynczego ziarna cyrkonu wyseparowanego z ryolitu
powinien uplasować się na konkordii i z jego położenia bezpośrednio odczytuje się wiek. Tak odczytany
wynik podaje nam czas, jaki upłynął od momentu „zamknięcia” się cyrkonu na dyfuzję ołowiu (przez co
izotopy ołowiu zaczęły się akumulować w cyrkonie) co praktycznie oznacza wiek od momentu wykrysta-
lizowania skały magmowej. Jest to więc niejako określenie „daty urodzenia” cyrkonu. Wykonanie kilku
oznaczeń różnych separatów cyrkonu z tej samej skały powinno dać identyczny wynik: punkty pokryją
się na konkordii a otrzymane daty będą ze sobą zgodne. Jak zwykle jednak przy tego typu metodach da-
towania istnieją obawy, że w historii długiego życia ziarenka cyrkonu mogły nastąpić różne zdarzenia,
które zachwiały proporcjami izotopowymi w jego składzie. Ma to najczęściej miejsce w wyniku meta-
morfizmu lub zdarzeń tektonicznych. I chociaż do wielu zalet minerału cyrkonu należy i to, że jest on
bardzo odporny zarówno mechanicznie jak i chemicznie, to jednak w wysokich temperaturach nie jest on
doskonale szczelny i przy odpowiednio silnym i długim działaniu metamorfizmu nieco ołowiu ze swej
struktury zgubi. Każdy okruch cyrkonu w skale ma nieco inne rozmiary i kształt i straci nieco odmienną
ilość izotopów ołowiu. W rezultacie oznaczenie izotopowe kilku kryształków cyrkonu wyseparowanych z
tej samej skały metamorficznej da nam kilka różnych punktów na wykresie poniżej konkordii. Poniżej –
bo takie cyrkony utraciły nieco Pb, więc wartości stosunków Pb/U spadły. W przypadku każdej innej me-
tody taka sytuacja jest beznadziejna i wyniki idą do kosza. Ale nie w metodzie U-Th-Pb. Cyrkonolodzy
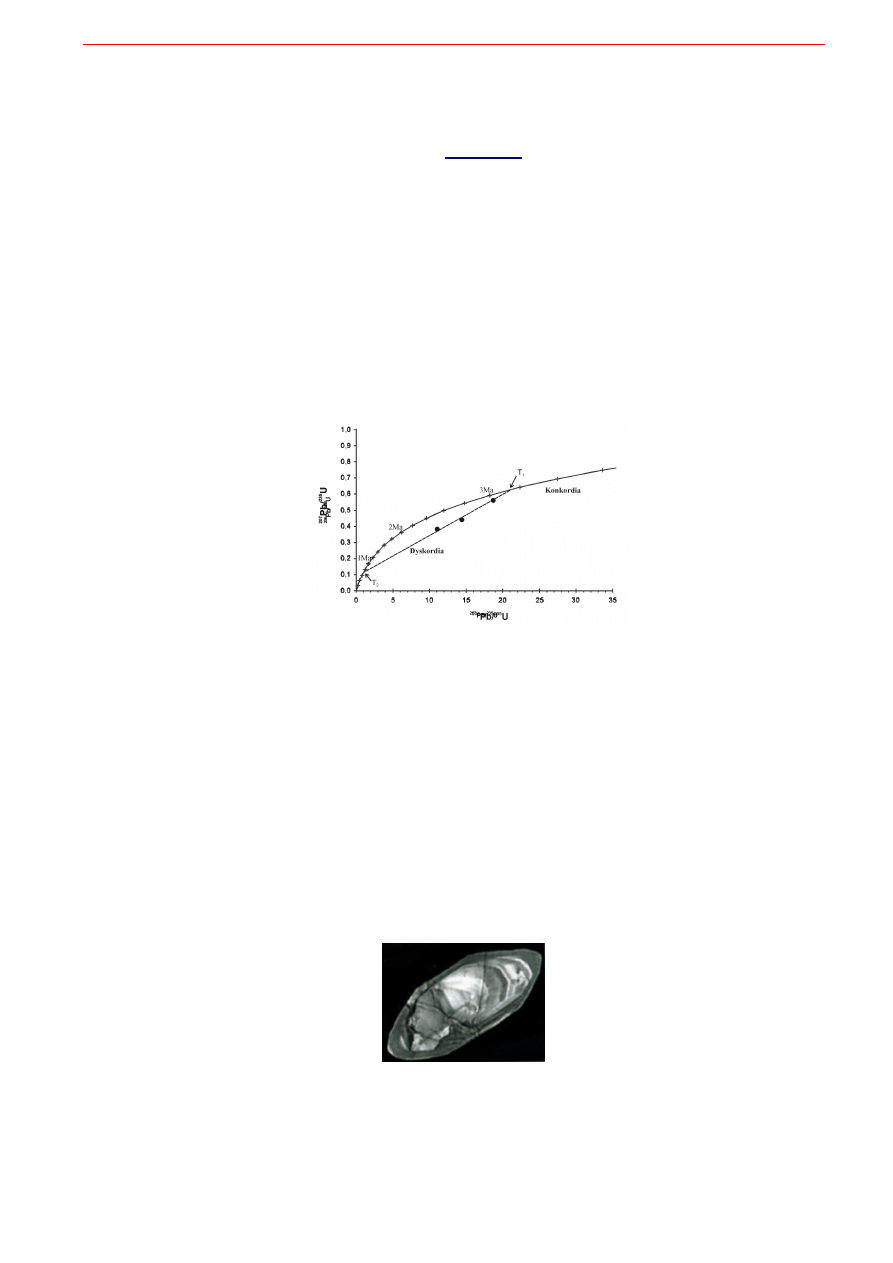
09. Elementy geochemii izotopów
10
modlą się o takie przypadki bo są one najciekawsze. Otóż
wszystkie wyniki oznaczeń cyrkonów pocho-
dzących z tej samej skały magmowej, która uległa metamorfizmowi, ułożą się na linii prostej będą-
cej cięciwą łuku konkordii. Ta prosta, zwana dyskordią, będzie przecinać łuk konkordii w dwóch
miejscach, pozwalając na odczytanie dwóch dat z życia cyrkonów: górny punkt przecięcia podaje
datę krystalizacji magmy natomiast dolny punkt przecięcia podaje czas, jaki upłynął od epizodu
metamorficznego, który spowodował częściową utratę ołowiu.
A że wszystkie cyrkony z tej samej
skały narodziły się jednocześnie i jednocześnie przeżyły metamorfizm, więc wszystkie zarejestrowały ten
sam wiek. Tak więc metoda U-Th-Pb jest jedyną metodą datowania izotopowego pozwalającą w sposób
ilościowy oznaczyć zarówno początkowy wiek magmowej krystalizacji skały jak i wiek późniejszego
epizodu geologicznego prowadzącego do częściowego zaburzenia stosunków izotopowych. I to wszystko
za jednym i tym samym oznaczeniem.
Rys. 9.7. Wykres
207
Pb/
235
U = f(
206
Pb/
238
U) z naniesioną konkordią oraz przykładową pozycją cyrkonów (czarne kółka) wyse-
parowanych z metaryolitu i wyznaczających przebieg dyskordii. Górne przecięcie linii T
1
oznacza wiek krystalizacji ryolitu a
dolne przecięcie T
2
oznacza wiek metamorfizmu.
Obecnie mikrotechniki wykonywania oznaczeń izotopów z cyrkonów posunęły się tak daleko, że nie
tylko oznacza się wiek pojedynczych wyseparowanych ze skał kryształków wielkości ułamków milime-
tra, lecz można zanalizować mikroobszary warstw cyrkonów, które powstawały w osobnych zdarzeniach
związanych z epizodami wzrostu kryształków (Rys. 9.8). Zastosowanie SIMS pozwoliło oznaczyć wiek
cyrkonów z kwarcytów w Zachodniej Australii na ok. 4,2 miliardy lat, czy cyrkonów z jednych z najstar-
szych skał na Ziemi, gnejsów Acasta w Kanadzie datowanych na 3962 ±3 Ma. Proszę przy tym zwrócić
uwagę na szokująco mały błąd oznaczenia rzędu ułamka procenta, co jest kolejną zaletą tej metody.
Rys. 9.8. Obraz wypolerowanej powierzchni zonalnego ziarna cyrkonu w mikroskopie elektronowym przy użyciu elektronów
wstecznie rozproszonych BSE (szerokość zdjęcia 0,5 mm). Obecnie możliwe jest oznaczanie kolejnych dat epizodów wzrostu
poszczególnych stref zonalnych ziaren cyrkonów

09. Elementy geochemii izotopów
11
Datowanie metodą Ar/Ar.
Jedną ze wspomnianych uprzednio wad datowania metodą K-Ar szczególnie dotkliwą w przypadku skał
magmowych i metamorficznych jest brak informacji czy otrzymany wynik określa wiek rzeczywistego
zdarzenia geologicznego (czy jest „dobrą datą”) czy też jest przypadkową liczbą wynikającą z częściowej
utraty Ar i nie nadaje się do interpretacji. W miarę rozwoju technik geochronologicznych powstała mody-
fikacja tej techniki pozbawiona tej wady. Dzięki wielu zaletom z czasem rozwinęła się ona
w samodzielną metodę bardzo szeroko stosowaną i o wielu aplikacjach. Została nazwana metodą
40
Ar/
39
Ar gdyż ten stosunek izotopowy jest jedynym oznaczeniem wykonywanym dla określenia wieku
próbki.
W metodzie Ar/Ar wykorzystuje się m.in. przemianę promieniotwórczą wzbudzoną. Bombardowanie
jąder atomowych neutronami, protonami, czy promieniami kosmicznymi powoduje często przemiany
jądrowe i powstawanie nowych nuklidów. Takie zjawiska zachodzą w naturze (np. powstawanie izotopu
14
C w górnych warstwach atmosfery) i są też wywoływane sztucznie do celów analitycznych np.
w neutronowej analizie aktywacyjnej INAA opisanej na końcu książki.
Datowanie metodą Ar/Ar opiera się na tej samej reakcji promieniotwórczej przemiany
40
K =>
40
Ar co
metoda K-Ar. Przypomnę, że w metodzie K-Ar oznacza się zawartości Ar i K w próbce co pozwala wyli-
czyć wiek ze wzoru. W przypadku metody Ar-Ar, zamiast oznaczać zawartość potasu, próbkę poddaje się
napromieniowaniu w reaktorze jądrowym czy akceleratorze, co powoduję przemianę obecnego w próbce
izotopu
39
K w izotop
39
Ar. Izotop
39
K jest trwałym izotopem w naturze, stanowiącym główny izotop pota-
su, a tej przemianie ulega wyłącznie pod działaniem promieniowania. Następnie przy pomocy spektrome-
tru masowego oznacza się stosunek izotopów
40
Ar/
39
Ar. Ponieważ zawartości obydwu izotopów potasu
40
K i
39
K oraz izotopów
40
Ar i
39
Ar są ze sobą powiązane, stosunek izotopowy
40
Ar/
39
Ar jest proporcjo-
nalny do wieku. Oznaczenie wykonuje się w sposób szczególny: próbkę ogrzewa się stopniowo, krokami
co 50
o
C, za każdym razem oznaczając stosunek wydzielonych izotopów argonu a więc i wiek. Każde
podgrzanie uwalnia tylko część argonu z próbki. Trwa to aż do całkowitego uwolnienia argonu w tempe-
raturze kilkuset stopni. Wynikiem pomiaru jest wykres (spektrum wiekowe) w którym na osi poziomej
odkłada się ułamek (lub procent) ilości
39
Ar uwolnionego w każdym kroku podgrzania (kumulatywnie) a
na osi pionowej wiek przypisany każdemu krokowi podgrzania (Rys.9.9). Wykres ten pozwala wyzna-
czyć wiek próbki i zidentyfikować ewentualne ubytki Ar czy inne zaburzenia w składzie izotopowym
próbki.
Datowanie metodą Ar/Ar ma wiele zalet, pośród których najistotniejszymi są: niewielka ilość próbki,
wysoka precyzja oznaczeń, możliwość wyeliminowania błędnych wyników oraz możliwość powiązania
wieku z temperaturą, w jakiej nastąpiło „zamknięcie” wobec dyfuzji argonu. Obecnie rozwój technik mi-
kroanalitycznych pozwala nawet na punktowe oznaczanie wieku różnych obszarów pojedynczej blaszki
muskowitu czy biotytu umożliwiające odtworzenie wielofazowych historii kompleksów metamorficz-
nych.

09. Elementy geochemii izotopów
12
Rys. 9.9. Przykładowe wyniki uzyskane metodą Ar-Ar dwóch separatów mineralnych muskowitu i hornblendy z tej samej
skały magmowej. Grubość prostokątów tworzących wykres oznacza błąd oznaczenia wieku dla kolejnych kroków ogrzewania
prowadzonego aż do ustania wydzielania się argonu. Wiek 186±4 Ma wyznaczony jest przez sekwencję kolejnych kroków
tworzących wypłaszczenie na wykresie („plato”). Otrzymany wynik podaje w tym wypadku kiedy skała ostygła poniżej tem-
peratury, w jakiej nastąpiło „zamknięcie” wobec dyfuzji argonu. Pominięcie początkowych kroków świadczących o częścio-
wej utracie Ar pozwala uzyskać prawidłowy wynik nawet z próbek o skomplikowanej historii geologicznej.
Gdyby na tych próbkach wykonać analizę metodą K-Ar wynik byłby średnią ze wszystkich kroków dając błędnie młodą datę.
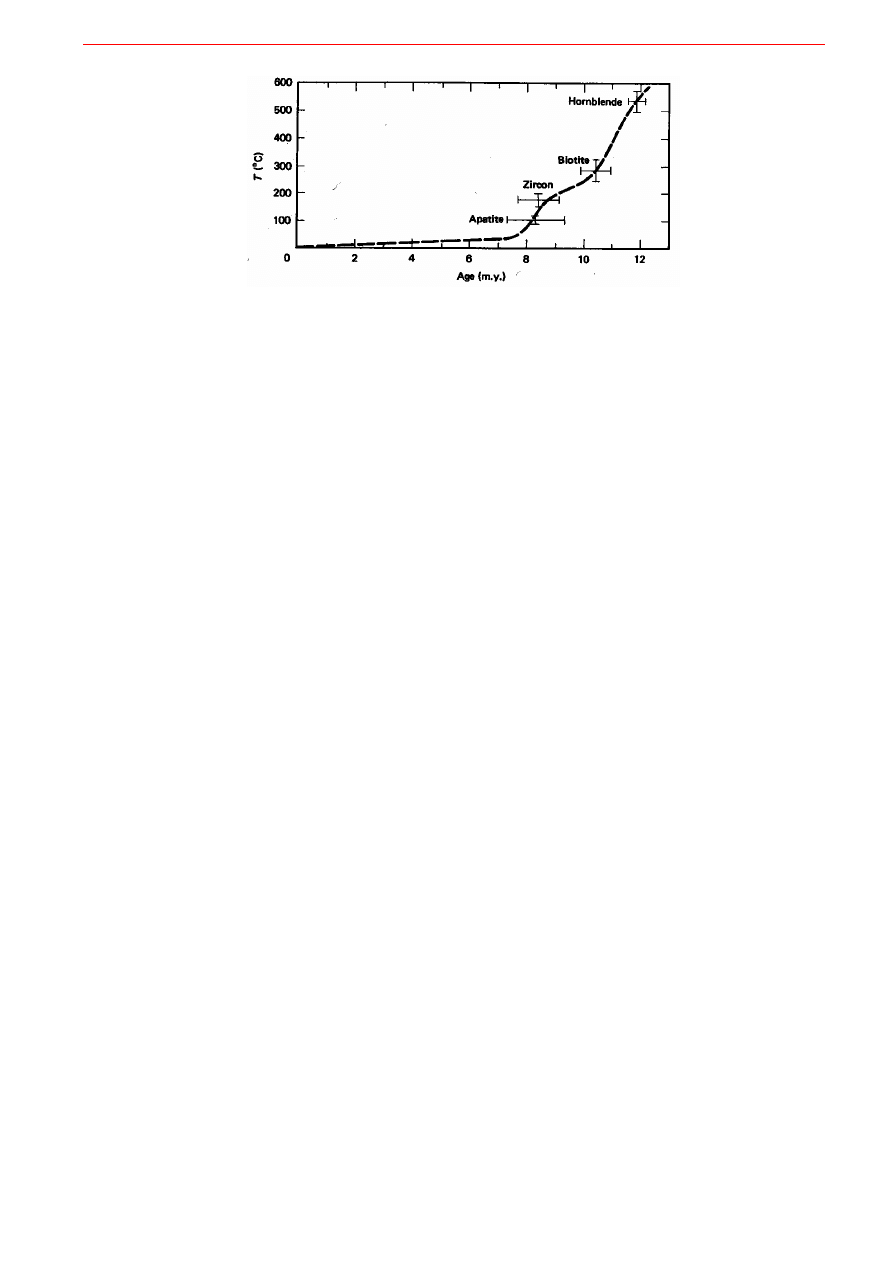
Elementy termochronologii.
Najbardziej zaskakującym okazało się stwierdzenie, że różne minerały wyseparowane z tej samej skały
dają często różne wyniki przy oznaczaniu wieku metodą Ar/Ar. I te wyniki są dobre! Pozwoliło to na
rozwinięcie się termochronologii - działu geochronologii zajmującego się określaniem wieku
i chronologicznego następstwa zdarzeń termicznych w historii skały. Ma to zastosowanie głównie
w petrologii skał magmowych i metamorficznych. Opiera się na spostrzeżeniu, że moment włączenia się
zegara radiologicznego, a więc moment „zamknięcia” się minerału (ustania dyfuzji) pozwalającego na
akumulację produktów przemian promieniotwórczych następuje zazwyczaj na skutek ochłodzenia mine-
rału poniżej określonej temperatury. Okazało się, że różne minerały mają różną temperaturę zamknięcia.
Wynikają z tego trzy wnioski. Po pierwsze w wielu wypadkach „datowanie” oznacza określenie „kiedy
minerał ostatni raz ostygł poniżej swojej temperatury zamknięcia”. Po drugie, datowane minerały pocho-
dzące z tej samej skały mogą dać wyraźnie różne wyniki (wiek) nawet jeśli stygły jednocześnie: podczas
stygnięcia będą kolejno przechodzić przez swoje temperatury zamknięcia i minerały o wysokiej tempera-
turze zamknięcia włączą zegar najwcześniej a więc przy datowaniu będą najstarsze, a minerały o niskiej
temperaturze zamknięcia będą najmłodsze. Po trzecie, oznaczając „wiek zamknięcia” i znając temperatu-
rę zamknięcia charakterystyczną dla każdego minerału można obliczyć np. szybkość stygnięcia komplek-
su skalnego (Rys. 9.10).
186 ±4 Ma
09. Elementy geochemii izotopów
13
Rys. 9.10. Termochronologiczne określenie tempa studzenia z oznaczeń wieku (kiedy ostatni raz minerał ostygł
poniżej temperatury zamknięcia) i znajomości temperatur zamknięcia różnych minerałów:
~100
o
C/mln lat oznacza bardzo szybkie tempo studzenia.
Datowanie metodą węgla radioaktywnego
14
C.
W przeciwieństwie do oznaczania „daty urodzenia” skał metodami izotopowymi, metoda
14
C służy do
określania „daty śmierci” żywych organizmów. Promieniowanie kosmiczne, składające się m.in.
z szybkich protonów, neutronów i innych cząstek, stanowi naturalne źródło promieniowania oddziaływu-
jące z atomami składników wyższych warstw atmosfery. Rezultatem jest m.in. powstawanie promienio-
twórczego izotopu węgla
14
C z napromieniowanych atomów azotu. Ten kosmogeniczny izotop węgla
ulega samorzutnemu rozpadowi w przemianie beta z powrotem do azotu
14
N z czasem połowicznego roz-
padu t
1/2
= 5730 lat. Szybkość powstawania i rozpadu izotopu jest na tyle zbliżona, że proces jest w rów-
nowadze i ilość przez co zawartość kosmogenicznego izotopu węgla w atmosferze jest stała. Tym samym
stała i jednakowa jest zawartość
14
C we wszystkich organizmach, gdyż wchodzi on do obiegu w biosfe-
rze. Organizmy zielone wymieniają CO
2
z atmosferą przyswajając proporcjonalnie również
14
C, a pozo-
stałe organizmy (w tym ludzie) otrzymują wszystkie izotopy węgla w tej samej proporcji w łańcuchu po-
karmowym. Po śmierci jednak, organizmy przestają wymieniać węgiel z otoczeniem i ilość
14
C w ob-
umarłej tkance systematycznie maleje przez rozpad promieniotwórczy. Czas, jaki upłynął od tego mo-
mentu wyznacza się mierząc np. radioaktywność próbki, która zanika wraz z zanikiem radioaktywnego
węgla (Rys. 9.11).
Dzięki krótkiemu czasowi połowicznego rozpadu datowanie metodą
14
C ma ogromne zastosowanie do
badań najmłodszych obiektów: utworów geologicznych młodszych od 100000 lat zawierających szczątki
organiczne oraz obiektów archeologicznych i antropogenicznych. Głównym ograniczeniem metody jest
to, że można ją zastosować tylko do szczątków organicznych i produktów z nich wytworzonych: drewna,
skóry, torfu, papieru, szczątków roślinnych, nasion, kości, materii organicznej młodych osadów itp.

09. Elementy geochemii izotopów
14
Rys. 9.11. Izotop
14
C jest stale tworzony z atomów azotu pod wpływem promieni kosmicznych. Zawartość kosmogenicznego
14
C w atmosferze i w żywych organizmach jest stała. Ilość
14
C w tkankach maleje od chwili śmierci organizmu. Można wyzna-
czyć tą chwilę, mierząc promieniotwórczość próbki, która maleje systematycznie z zanikiem promieniotwórczego węgla.
9.2 Izotopy stałe
Podstawy teoretyczne
Spośród około 1700 znanych nuklidów (czyli pierwiastków z ich wszystkimi odmianami izotopowymi)
tylko około 260 to izotopy stałe. Pozostałe mają jądra atomowe, które ulegają spontanicznemu rozpado-
wi. Wśród stałych izotopów tylko te najlżejsze są rzeczywiście użyteczne w geochemii. Bada się głównie
izotopy stałe wodoru H, węgla C, azotu N, tlenu O i siarki S, sporadycznie krzemu Si, boru B i in. Pro-
porcje odmian izotopowych każdego pierwiastka są zazwyczaj takie, że jeden z izotopów dominuje i jest
najliczniejszy a pozostałych jest niewiele. Zauważono, że w różnych materiałach geologicznych i w róż-
nych środowiskach na Ziemi te proporcje pomiędzy izotopami wodoru, węgla, tlenu, itp., nie są jednako-
we.
Zastosowanie izotopów promieniotwórczych do datowania materiałów geologicznych wiąże się
z założeniem, że wszystkie izotopy JEDNAKOWO uczestniczą w procesach geologicznych. Natomiast
zastosowanie izotopów stałych jako wskaźników geochemicznych opiera się na obserwacji, że izotopy
NIEJEDNAKOWO uczestniczą w procesach przyrodniczych, w tym geologicznych: że ulegają tzw.
FRAKCJONACJI. Aby wyjaśnić tą sprzeczność przyjrzyjmy się bliżej przyczynom tej obserwowanej
frakcjonacji.
Jedyną różnicą pomiędzy izotopami tego samego pierwiastka jest liczba neutronów w jądrze atomo-
wym. Izotopy o większej ilości neutronów mają większą masę atomową i nazywamy je „izotopami cięż-
kimi” a odmiany izotopowe o mniejszej ilości neutronów w jądrze mają mniejszą masę atomowa
i nazywamy je „izotopami lekkimi”. Każdy pierwiastek występujący w przyrodzie jest mieszaniną jego
izotopów. Częstość występowania izotopów (tzw. abundancje) i proporcje odmian izotopowych pier-

09. Elementy geochemii izotopów
15
wiastków są znane i zazwyczaj dość stałe.
Frakcjonacja izotopów jest to nieznaczna zmiana proporcji
pomiędzy ciężkimi a lekkimi izotopami danego pierwiastka w wyniku procesu, którego przebieg lub
prędkość są w pewnym stopniu uzależnione od masy reagującego atomu
. Izotopy tego samego pier-
wiastka mają identyczną strukturę elektronową, wchodzą więc w identyczne reakcje chemiczne i tworzą
identyczne związki chemiczne. Ciężkie izotopy tworzą jednak nieco silniejsze wiązania, co zaznacza się
najwyraźniej w przypadku wiązań atomowych. Również prędkość niektórych procesów fizycznych czy
reakcji chemicznych może zależeć od masy atomowej. Prędkość dyfuzji czy prędkość parowania są więk-
sze dla cząstek zbudowanych z lżejszych izotopów. Prędkość wielu reakcji z udziałem żywych organi-
zmów również jest zależna od masy atomowej izotopów. A więc niektóre procesy zachodzące
w przyrodzie powodują nieznaczne rozdzielanie izotopów na frakcje: frakcję cięższą i frakcję lżejszą.
Podobne techniki używa się w przemyśle jądrowym przy wzbogacaniu izotopów uranu na potrzeby elek-
trowni. Są więc dwie podstawowe przyczyny frakcjonacji izotopów spowodowanej różnicą mas atomo-
wych: różnica w sile wiązań chemicznych oraz różnica w prędkości zachodzenia reakcji chemicznych
i procesów fizycznych. Czym większa różnica mas pomiędzy izotopami biorącymi udział w reakcji tym
wyraźniej zaznaczająca się frakcjonacja izotopów. Choć frakcjonacja związana z różnicą mas zachodzi
teoretycznie dla wszystkich izotopów, tak naprawdę widoczna jest jedynie dla pierwiastków lekkich, dla
których procentowa różnica mas jest rzeczywiście znacząca. Na przykład dwa izotopy wodoru,
1
H (prot)
o masie ok. 1 g/mol i deuter
2
H o masie ok. 2 g/mol mają różnicę masy wynoszącą:
(2-1)/2
.
100% = 50%
Podobnie dla izotopów tlenu, najpowszechniejszego
16
O i jego cięższego brata
18
O:
(18-16)/18
.
100% = 11,11%
Takie różnice masy pomiędzy izotopami mogą na tyle istotnie wpłynąć na szybkość procesów, że spowo-
dują rozdzielenie na dwie frakcje: jedną wzbogaconą nieco w cięższe izotopy a drugą proporcjonalnie
wzbogaconą w lżejsze izotopy. Jedna frakcja będzie wzbogacona o tyle o ile druga frakcja jest zubożona.
Natomiast dla stosowanych w datowaniu radiometrycznym pierwiastków cięższych ta różnica jest mała
i ma pomijalnie mały wpływ na przebieg procesów frakcjonacji. Na przykład dla
87
Sr i
86
Sr procentowa
różnica mas wynosi:
(87-86)/87
.
100% = 1,15%
Frakcjonacja izotopów strontu, choć pewnie w jakimś stopniu zachodzi, jest praktycznie niemierzalna
i nie wpływa w żaden sposób na wyniki datowania. To wyjaśnia pozorny paradoks przeciwnych założeń
leżących u podstaw obydwu dziedzin badań izotopowych.
Istnieje kilka przyczyn, dla których badania izotopów stałych w dużej mierze skupiają się na wodorze,
węglu, azocie, tlenu i siarce. Wszystkie wymienione pierwiastki mają izotopy, których zawartości, choć
często niewielkie, są wciąż na tyle wysokie, że są łatwo mierzalne z wystarczająco wysoką precyzją. Po-
nadto dzięki temu, że są to pierwiastki lekkie, różnice mas pomiędzy izotopami są dość duże (od 50% dla
H do 6,25% dla S) powodując wyraźną frakcjonację w procesach geologicznych i w środowisku. Pier-

09. Elementy geochemii izotopów
16
wiastki te są też bardzo powszechne w naturze wchodząc w skład wielu składników skorupy ziemskiej,
atmosfery, hydrosfery i biosfery. Pozwala to na szeroką gamę zastosowań. Węgiel, azot i siarka występu-
ją również na kilku stopniach utlenienia, co jeszcze bardziej poszerza spektrum reakcji, które mogą zostać
wykorzystane. Wreszcie każdy z tych pierwiastków tworzy wiązania kowalencyjne w wielu różnych
związkach, co sprzyja efektywności frakcjonacji izotopowej.
Proporcje zawartości izotopów w naturalnych materiałach wyrażają się ułamkami. Na przykład dla tle-
nu stosunek izotopów z powietrzu wynosi R =
18
O/
16
O = 1/489 a dla skał R =
18
O/
16
O = od 1/475 do
1/525. Dla wygody, aby uniknąć posługiwania się ułamkami, przyjęto poręczniejsze sposoby prezento-
wania składu izotopowego na przykład obliczając z wyznaczonych stosunków wartość delta δ w promi-
lach:
Delta δ wskazuje na promil odchylenia stosunku izotopowego próbki od wzorca: dodatnia δ ozna-
cza wzbogacenie w izotop ciężki a ujemna δ oznacza zubożenie w izotop ciężki
. Przyjęcie notacji po-
dającej na ile stosunki izotopowe odbiegają od umownego wzorca ma też uzasadnienie analityczne: wy-
konując na przemian pomiar stosunków izotopowych próbki i wzorca i odnosząc je do siebie uniezależ-
niamy wynik od błędów analitycznych (które są w obu pomiarach jednakowe i się wzajemnie znoszą)
zwiększając bardzo precyzję oznaczenia. Umownymi wzorcami są pewne wybrane próbki naturalne: wo-
da morska SMOW (Standard Mean Ocean Water), kalcyt z belemnita z formacji Peedee w Karolinie Po-
łudniowej w USA (PDB = Peedee Belemnite), azot z atmosfery, próbka minerału troilitu FeS pochodząca
z meteorytu żelaznego Canyon Diablo w Arizonie w USA (CDM = Canyon Diablo Meteorite) itp.
Współczesne wzorce ustanowione są i przechowywane przez Międzynarodową Agencję Energii Atomo-
wej w Wiedniu.
Przykłady frakcjonacji izotopów w przyrodzie
Teoretycznie możliwych jest co najmniej 9 odmian izotopowych wody: H
2
16
O, H
2
17
O, H
2
18
O, D
2
16
O,
D
2
17
O, D
2
18
O, HD
16
O, HD
17
O, HD
18
O (D oznacza deuter, odmianę izotopową ciężkiego wodoru
2
H).
Proporcje tych odmian są w wodzie oceanicznej stałe. Cząsteczki jednych odmian mają niższą masę niż
innych, na przykład H
2
16
O, H
2
17
O mają masę cząsteczkową wyraźnie niższą od D
2
17
O, D
2
18
O czy HD
18
O.
Jednym z procesów powodujących frakcjonację izotopów jest parowanie i skraplanie. Atomy (cząsteczki)
lekkich odmian izotopowych częściej biorą udział w parowaniu i statystycznie ulegają wzbogaceniu w
‰
1000
1
R
‰
1000
R
R
wzorcu
we
wzorcu
we
wzorcu
we
18
⋅
−
=
⋅
−
=
wpróbce
wpróbce
R
R
O
δ
1000
1
wzorcu
we
próbce
w
[‰]
16
18
16
18
18
⋅
−
=
O
O
O
O
O
δ

09. Elementy geochemii izotopów
17
parach w stosunku do cieczy. Izotopy ciężkie częściej biorą udział w skraplaniu i ulegają wzbogaceniu
w kondensującej się cieczy. Parowanie wody oceanicznej powoduje powstanie mas powietrza zawierają-
cego parę wodną zubożoną w izotopy ciężkie
18
O i
2
H w stosunku do wody morskiej i wzorca SMOW.
Objętość oceanów jest tak wielka, że nie ma to w mierzalny sposób wpływu na stosunek izotopowy wody
oceanicznej, który jest stały, jednak skład izotopowy pary wodnej nad oceanami jest mierzalnie odmien-
ny. Z kolei kondensacja i skraplanie pary wodnej zachodzi nieco łatwiej i częściej dla cząsteczek zbudo-
wanych z cięższych izotopów, przez co woda deszczowa jest izotopowo „cięższa” niż para wodna
w chmurach, z których powstała. Określenie „woda izotopowo lżejsza” lub „woda izotopowo cięższa”
dotyczą względnych zależności izotopowych pomiędzy dwoma próbkami. Na przykład określenie „para
wodna jest izotopowo lżejsza od wody, z której powstała” oznacza, że proporcja lekkich izotopów wodo-
ru i tlenu w tej parze wodnej jest większa niż w tej wodzie. Podobnie określenie „skroplona woda jest
izotopowo cięższa niż para wodna, z której powstała” oznacza, że proces skraplania zmienił stosunki izo-
topowe, w wyniku czego zawartość procentowa cząsteczek wody zbudowanych z cięższych izotopów
wodoru i tlenu jest w tej wodzie większa niż była pierwotnie w parze wodnej.
A teraz uwaga, zapiąć pasy bo zaczyna się ostra jazda bez trzymanki. Kto zrozumie względne zależno-
ści izotopowe spowodowane frakcjonacją na izotopowo lżejszą wodę przy parowaniu a izotopowo cięż-
szą wodę przy skraplaniu w globalnym cyklu hydrologicznym ten może przerwać czytanie i sprawić so-
bie nagrodę. Parowanie oceanów i globalna cyrkulacja powietrza i chmur na Ziemi powodują, że skład
izotopowy opadów na różnych szerokościach geograficznych jest odmienny. Parowanie oceanów jest
najintensywniejsze w okolicach równika, w tropikach.
Powstające tam chmury są parą wodną izoto-
powo „lżejszą” od wody oceanicznej, z której powstały.
Jest to efekt frakcjonacji podczas parowania.
W miarę przesuwania się powstałych tam wilgotnych mas powietrza ku biegunom okresowe deszcze po-
wodują również frakcjonację pary wodnej w atmosferze:
skraplająca się woda deszczowa zawiera wię-
cej cięższych izotopów niż pozostała w chmurach para wodna
. Należy pamiętać, że jedna frakcja bę-
dzie wzbogacona o tyle o ile druga frakcja jest zubożona. Za każdym więc razem po deszczu pozostała
para wodna w chmurach jest jeszcze bardziej wzbogacona w izotopy lekkie, bo cięższe zostały preferen-
cyjnie skroplone w postaci deszczu. Jak się to ma do wzorcowej wody oceanicznej? Chmury powstały
z oceanów na drodze parowania, więc są izotopowo „lżejsze” (mają ujemną deltę δ), a z każdym skroplo-
nym deszczem staja się jeszcze „lżejsze”. Natomiast deszcz powstaje z chmur na drodze skraplania, wiec
jest izotopowo „cięższy” od chmur (Rys. 9.12). Ponieważ jednak ten deszcz powstał z „lekkich” chmur,
więc woda deszczowa jest i tak „lżejsza” od wody oceanicznej: ma deltę ujemną, ale mniej ujemną niż
para wodna chmur. W miarę przesuwania się ku wyższym szerokościom geograficznym każdy kolejny
deszcz powoduje, że delta chmur jest coraz bardziej ujemna, ale i delta wody deszczowej jest coraz bar-
dziej ujemna. Cały proces, choć pozornie dość skomplikowany, za każdym razem opiera się na jednym
i tym samym zjawisku względnego wzbogacania wody deszczowej w izotopy ciężkie w stosunku do pary
wodnej w chmurach, a co za tym idzie względnego zubożania pozostałej pary wodnej w te izotopy. Klu-
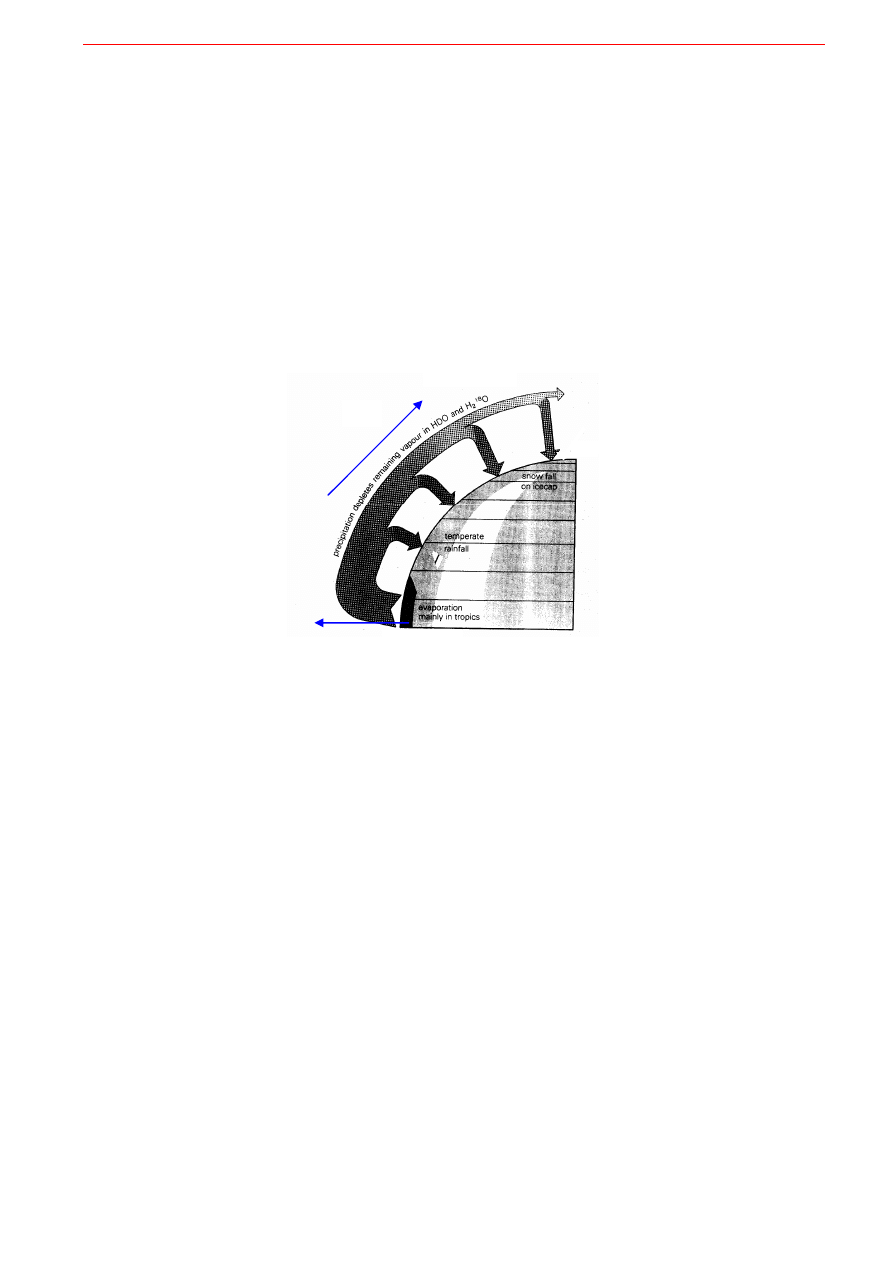
09. Elementy geochemii izotopów
18
czowym słowem jest tutaj słowo „względnego”.
W efekcie obserwuje się systematyczny spadek warto-
ś
ci δ dla izotopów tlenu i wodoru w miarę wzrostu szerokości geograficznej i izotopowo „najlżejsze”
opady są w rejonach polarnych
. To zjawisko obserwowane jest również w przypadku przesuwania się
mas powietrza od wybrzeża oceanów w głąb lądu. Kolejne opady atmosferyczne są zubożałe w izotopy
ciężkie a wzbogacane w lekkie (coraz bardziej ujemna δ).
Rys. 9.12. Frakcjonacja izotopów stałych w hydrosferze: ciemniejsze wypełnienie strzałki wskazuje na frakcję izotopowo
cięższą. a) Parowanie oceanów zachodzi głównie w tropikach. Chmury są izotopowo „lżejsze” od wody oceanicznej. b) Coraz
„lżejszy” izotopowo deszcz (i śnieg) pada na coraz wyższych szerokościach geograficznych, przy tym deszcz jest zawsze izo-
topowo „cięższy” od chmury, z której bezpośrednio powstaje.
Frakcjonacja izotopów węgla
12
C i
13
C powoduje, że węgiel będący składnikiem substancji organicz-
nych jest zazwyczaj „lżejszy” od węgla będącego składnikiem minerałów węglanowych pochodzenia
morskiego. Może to na przykład posłużyć do odtworzenia genezy wtórnej mineralizacji węglanowej w o-
sadach. Czapy węglanowe na wysadach solnych mają silnie negatywne δ
13
C w stosunku do węglanów
pochodzenia morskiego, co świadczy o ich powstaniu z udziałem węgla pochodzącego z utleniania pobli-
skich węglowodorów raczej, niż z rekrystalizacji wapieni. Izotopy węgla mogą być też wykorzystane do
odróżniania złóż ropy i gazu czy do korelacji warstw w lokalnej stratygrafii. Jest to szczególnie użytecz-
ne, gdy nie ma skamieniałości przewodnich, np. w skałach prekambryjskich. Ulegają one też wyraźnej
frakcjonacji w procesach fotosyntezy i wzrostu roślin i zwierząt. Pozwala to na użycie izotopów węgla do
odtwarzania warunków paleoklimatycznych. Kalcyt i aragonit wytrącające się z wody morskiej (również
z udziałem organizmów) są wzbogacone w cięższy izotop tlenu
18
O. Wzbogacenie to jest zależne od tem-
peratury wody morskiej i może być wykorzystane do odtworzenia klimatu w przeszłości.
a
b
równik
biegun
Wyszukiwarka
Podobne podstrony:
09 geochemia izotopów
70 NW 09 Elementy radioelektroniki
GEOCHEMIA IZOTOPOW id 187948 Nieznany
Geochemia izotopów wykłady
Izotop, Geologia, UNIWERSYTET WARSZAWSKI, SEMESTR I, GEOCHEMIA IZOTOPÓW, WYKŁAD
geochemia izotopów
11 elementy geochemii poszukiwawczej
Ćwiczenia geochemia izotopw
Geochemia izotopów materiały
70 NW 09 Elementy radioelektroniki
FINITE ELEMENT METHOD II 09 intro
Elementy prawa, 09-prawo
elementy ekonomii - wykład 6 (09.12.2007 r.), WSB, elementy ekonomi
elementy prawa pytania 09 10
12 ELEMENTY ANALITYKI GEOCHEMICZNEJ d same metody instrumentalneid 13444
więcej podobnych podstron