
Mikrobiologia prezentacje 2009
Sporządzone na podstawie folii dr Ireneusza Ciebiady w roku 2009 przez grupy 9 i 10
Spis treści
Rodzaj: Corynebacterium.....................................................................................................................2
Rodzaj Listeria. Listeria monocytogenes.............................................................................................3
Rodzaj Haemophilus............................................................................................................................5
Rodzaj Bordetella.................................................................................................................................6
Rodzaj Legionella.................................................................................................................................8
Rodzaj Brucella....................................................................................................................................9
Rodzaj Yersynia..................................................................................................................................10
Rodzina Mycoplasmataceae...............................................................................................................12
Rodzaj Chlamydiae............................................................................................................................14
Rodzaj Ricketssia...............................................................................................................................16
Rodzaj Coxiella..................................................................................................................................16
Rodzaj Erlichia...................................................................................................................................16
Rodzaj Treponema
............................................................................................................................................................17
Rodzaj Borelia....................................................................................................................................19
Rodzaj Leptospira...............................................................................................................................20
Rodzaj Staphylococcus.......................................................................................................................21
Gronkowce koagulozo ujemne / coagulase negative staphylococci – CSN/......................................24
Rodzaj Streptocoocus.........................................................................................................................26
Rodzaj Enterococcus..........................................................................................................................30
Rodzaj Neisseria ................................................................................................................................32
Rodzaj Bacillus...................................................................................................................................36
Rodzaj Clostridium.............................................................................................................................38
Bakterie beztlenowe nieprzetrwalnikujące.........................................................................................42
Rodzaj Campylobacter.......................................................................................................................44
Rodzaj Helicobacter...........................................................................................................................45
Rodzaj Escherichia.............................................................................................................................47
Rodzaj Klebsiella................................................................................................................................51
Rodzaj Enterobacter...........................................................................................................................52
Rodzaj Salmonella..............................................................................................................................53
Rodzaj Shigella...................................................................................................................................56
Rodzaj Proteus....................................................................................................................................58
Rodzaje: Vibrio, Pseudomonas, Actinetobacter.................................................................................59
Prątki, promieniowce ( rodzaj Actinomyces, Nocardia)....................................................................61

Rodzaj: Corynebacterium.
Charakterystyka ogólna.
Należą tutaj gatunki ludzkie, zwierzęce i roślinne, chorobotwórcze i niechorobotwórcze oraz
gatunki niesklasyfikowane tzw dyfteroidy ( C.jejkejum, C.urealytioum, C.lipophilicus,
C.lipophylium i inne). Większość z dyfteroidów wchodzi w skład flory skóry, jamy nosowo-
gardłowej, dróg moczowo-płciowych i przewodu pokarmowego (np. C.pseudodipthericum
hofmani, C.xerosis). Chorobotwórczy dla człowieka jest maczugowiec błonicy
(C.diptheriae) i błonniczopodobny (C.ulcerans).
Dla zwierząt chorobotwórcze są: C.pseudotuberculosis, C.equi, C.pyogenes, C.renale,
C.suis.
Corynebacterium sp. to pałeczki Gram +, nieruchliwe, nie wytwarzające zarodników,
otoczek , często o maczugowatych zgrubiałych biegunach zawierających niekiedy
ziarnistości matachromatyczne (wolutyna). Niekiedy barwią się nierównomiernie,
met.Neissera barwią się na żółto brązowo a ziarna wolutyny na fioletowo (jeśli są obecne).
Są to pałeczki długie, proste lub zagięte od1,2-6,5μm długości 0,3-1,5μm szerokości.
Układają się różnie, maczugowce błonnicy w kształcie litery V lub L, przypominając pismo
klinowe. Giną w temp. 58ºC w ciągu 10 min.
Corynebacterium diphteriae.
Ogólna charakterystyka:
są to bakterie pleomorficzne najczęściej przypominające maczugę. Różny kształt i
wielkość zależą od wieku komórki, pH i składu podłoża oraz
stężenia tlenu. Rośnie
dobrze na agarze z krwią, lepiej na podłożu Löflera lub agarze Tindala, Gundel-Tietza. Na
podłożu Clauberga tworzy trzy niehemolizujące typy wzrostu:
●
mitte; małe kolonie, gładkie, wypukłe, sporadyczne łagodne zachorowania
●
intermedius- pośredni, początkowo małe, gładkie z jasną obwódką, kolonie które po kilku
dniach upodabniają się do typu gravis.
●
Gravis; duże szare lub szaro-czarne, szorstkie podobne do stokrotki kolonie, wywołujące
ciężkie zachorowania.
Czynniki chorobotwórczości:
- toksyna zaliczana do egzotoksyn. Jej obecność uwarunkowana jest pojawieniem się w
komórce lizogennego faga beta zawierającego geny kodujące toksynę (toks.+). Szczury i
myszy nie mając receptorów nie są na nią wrażliwe. DLM wynosi 0,1μg/kg masy ciała.
Frakcja b wiąże toksynę z komórką, frakcja A odpowiada za właściwości
biologiczne,uszkodzenie nabłonka powstawanie błon rzekomych.
Patogeneza i epidemiologia
●
zakażenie drogą kropelkową, rzadziej jako zakażenia przyranne lub poprzez żywność,
●
najczęściej zakażają się dzieci
●
rezerwuarem zarazków są zwierzęta
●
namnażanie na błonach śluzowych, okres inkubacji 2-6 dni
●
uszkodzenie nabłonka, tworzenie błon rzekomych, włóknik, granulocyty,nabłonek,
limfocyty i bakterie na migdałkach i pozostałych częściach jamy ustnej i gardła,
●
drogą krwionośną toksyna powoduje zapalenie mięśnia sercowego i obwodową neuropatię
Rozpoznawanie:
●
objawy kliniczne: błonica nozdrzy, migdałków, gardła, zapalenie m.sercowego, neuropatie,
trudności w mówieniu, połykaniu, widzeniu, poruszaniu się, zaburzenia rytmu serca

●
Badanie mikrobiologiczne:
- materiał do badań- wymazy,
- badanie nakterioskopowe, m Grama, Neissera,
- hodowla:
- podłoże Löflera (C.d. Szybki obfity wzrost, żółty nalot, inne wolny wzrost, mocno
związanie z pożywką,
- podłoże Claudberga (C.d. szare, szaro-czarne),
- agar z krwią (C.d, hemoliza, inne brak hemolizy krwinek baranich)
- bulion / mitis-cała objętość, intermedius-ziarnisty osad/
●
różnicowanie biochemiczne API Coryne,
●
określanie toksynotwórczości szczepu:
- in vivo: podskórnie ( 1 oczko ezy 24 godziny hodowli / Löfler/ w 2ml wody w okolice uda
świnki morskiej w ilości 0,5ml – odczyn miejscowy, podanie świnki po 4 – kilku dniach.
Śródskórnie 0,2ml w wygoloną skórę brzucha 2 świnkom ale 1 z nich podaje się 500 JA
antytoksyny dootrzewnowo lub podskórnie na 12-24 godziny przed, drugiej śwince 50-125
JA w 4-5 godzin po injekcji szczepu. Duże dawki JA- brak reakcji w miejscu wkłucia, małe
dawki – odczyn zapalny po 24 godzinach z martwicą miejscową włącznie po 48-72h.
- in vitro:
- metoda Eleka lub Ouchterlonego,
- test Difeo Bacto KL, anatoksyn stripes (wg/ Eleka)
- metody immunoenzymatyczne:
-ELISA
-Difeo Bacto TA C.diptheriae
-diagnostyka molekularna:
-PCR
-MEE /muholocus enzyme electrophoresis/
- rybotypowanie /hybrydyzacja sond/ molekularnych komplementarnych do
odpowiednich genów/
Zapobieganie i leczenie:
●
leczenie ma na celu hamowanie rozwoju lub zniszczenie bakterii, neutralizacja toksyn +
terapia podtrzymująca
●
profilaktyka nieswoista;
●
profilaktyka swoista
- szczepienia anatoksyną błoniczą /DPT/
- podawanie anatoksyny błoniczej w okresie zakażenia od 20 do 100 tys jednostek
- antybiotyki – penicylina
- tracheostomia, leki krążeniowe i inne,
- odczyn skórny Schicka /ustalenie stanu odporności/
Rodzaj Listeria.
Listeria monocytogenes
Ogólna charakterystyka.
Do rodzaju Listeria zalicza się 5 gatunków: L.ivanovi, L.monocytogenes, L.innicua,
L.seeligeri, L.welshimeri, L.grayi, z których dwa pierwsze są chorobotwórcze.
L.monocytogenes to mała /1-2μm długości/ pleomorficzna Gram dotatnia pałeczka,
wykazująca ruch / do 4 rzęsek/, nie mająca otoczek, przetrwalników, wytwarzająca katalazę,
rosnąca na różnych podłożach w temperaturze 5-40˚C. Niektóre szczepy wytwarzają
hemolizynę na podłożu z krwią. Wywołuje zakażenia u zwierząt jak i u ludzi, zwłaszcza z

obniżoną odpornością.
Czynniki chorobotwórczości:
●
Fosfolipazy-rozpuszczają błony komórkowe ułatwiając rozprzestrzenianie się zakażenia na
nie zakażone komórki /maskowanie bakterii/
●
Listeriofizyna O- białko hemolityczne przerywające błony fagolizosomów, jest to główny
czynnik zjadliwości.
●
Internalina- białko b łonowe ułatwiające wchłanianie bakterii przez makrofagi lub komórki
śródbłonka. Dzięki temu L.momocytogenes unika fagosomu i może rozmnażać się w
cytoplaźmie.
●
Mniejsze znaczenie ma katalaza, dysmutaza nadtlenkowa i układy transportujące żelazo.
Patogeneza i epidemiologia:
●
Sporadyczne, samoistne zakażenia u ludzi i zwierząt.
●
U małych zwierząt zakażenie ma postać posocznicy.
●
U ludzi L.monocytogenes zachowuje się jak oportunista, zakażając osoby bardzo młode
oraz dorosłe z obniżoną odpornością.
●
Wrotami zakażenia jest przewód pokarmowy.
●
W odpowiedzi na zakażenie występuje wielojądrzasta leukocytoza z tworzeniem mikroropni
oraz mobilizacja monocytów do krwiobiegu i ognisk zakażenia - stąd nazwa
monocytogenes.
●
Zakażenie noworodków następuje w czasie porodu lub przez łożysko. U dorosłych drogą
pokarmową /niepasteryzowane mleko, jarzyny.
●
Śmiertelność od 30 do 60% /nowotwory/
Rozpoznanie:
●
Objawy kliniczne:
- listerioza noworodków zapalenie opon mózgowo-rdzeniowych w 1-3 tygodniu życia
- listerioza dorosłych
~od postaci lekkiej podobnej do grypy do gwałtownych, ciężkim przebiegu
~najczęstszą postacią jest zapalenie opon mózgowo-rdzeniowych
- listerioza ciężarnych
- bakteriemia, zapalenie żołądka i jelit, ropień wątroby,
- zapalenie wsierdzia, otrzewnej, skóry, kości i szpiku
Badanie mikrobiologiczne:
●
materiał do badania: płyn m-rdzeniowy, krew, rzadziej wymazy, bioptaty, inny,
●
preparat mikroskopowy – pałeczki Gram dodatnie ale i inne formy np kokoidalne,
ziarniakowate,
●
hodowla – różne podłoża, agar z krwią /hemolizyna/ ruchy+,
●
biochemia /katalaza, dysmutaza/,
●
serologia- aglutynacja /z surowicą chorego 1:160-320 lub OWD 1:10-20,
●
próby biologiczne – wrażliwe świnki morskie, białe myszy, zapalenia spojówek i rogówki
i/lub monocytoza u królika.
Zapobieganie i leczenie:
●
Profilaktyka nieswoista, swoistej brak.
●
Po przebytej chorobie pozostaje długotrwała odporność.
●
Lekami z wyboru są antybiotyki β-laktamowe.
●
Stosuje się również aminoglikozydy i makrolidy.

Pałeczki małe. Gram – ujemne. Rodzaje Bordetella, Haemophilus, Legionella, Brucll,
Yersinia.
Rodzaj Haemophilus
Charakterystyka ogólna
Rodzaj obejmuje kilka bakterii chorobotwórczych lub nie, z których najważniejszym jest H.
influenza. Są to małe pałeczki Gram ujemne, o wymiarach 0,4x2,0µm, układające się w
preparacie w skupiska, w łańcuszki lub czasami parami, nie posiadają przetrwalników,
posiadające otoczkę w organizmie zakażonym. Czasami mogą mieć kształty koliste lub
wydłużone. Rosną na pożywkach wzbogaconych, specjalnych w atmosferze tlenu
wzbogaconej dwutlenkiem węgla. Szybko giną w temp. 55 °C, są wrażliwe na środki
dezynfekcyjne.
Haemophiluz influenzae- cechy ogólne jak wyżej. Bakterie występują w formie otoczkowej
lub bezo toczkowej. W oparciu o metabolizm bakteryjny wyodrębniono 8 biotypów, a
analiza białek podzieliła je na dwie grupy. Szczepy najbardziej inwazyjne należą do grupy I.
Szczepy patogenne posiadają dodatkowe geny odpowiedzialne za wirulencję. H. influenzae
rośnie najlepiej na agarze czekoladowym w obecności czynnika V /NAD/ oraz X
/hematyny/. Bakterie mogą rosnąć na agarze z krwią, ale tylko w obecności S. ureus, który
dostarcza mu NAD. Kolonie są gładkie lub szorstkie.
Czynniki chorobotwórczości
●
otoczka polisacharydowa /6 serotypów/, posiada właściwości antyfagocytarne, główny
czynnik zjadliwości H. inf. tyb b, (pozostałe niepatogenne serotypy mają inne cukry w
otoczce),
●
lipooligosacharyd – podobny do LPS, białek Gram - , odpowiada za przyleganie bakterii,
inwazyjność i uszkodzenie nabłonka rzęskowego ukł. oddechowego
●
fimbrie ułatwiają przyleganie do komórek nabłonka oddechowego
●
białka Hia i Hsf mają zdolność adhezji do różnych linii komórek nabłonkowych ludzkich,
●
adhezyjna Hap / proteaza serynowa/ umożliwia przyleganie i wnikanie bakterii do komórek
nabłonkowych, agreguje bakterie i tworzy mikrokolonie,
●
białka wysokocząsteczkowe /HMW/ posiadają cechy adhezyn, umożliwiają kolonizację
komórek nabłonkowych,
●
białka błony zewnętrznej (OmpP2 i P5) pośredniczą w wiązaniu się bakterii do mucyny
komórek nabłonkowych i inicjują kolonizację bakterii,
●
białka wiążące hem i żelazo, wchodzą w mechanizm pozyskiwania tych substancji do
wzrostu bakterii,
●
tryptofanaza, wytwarzanie indolu wiąże się u 70-100% izolatów z patogennością bakterii,
●
proteinaza IgA, enzym niszczący IgA, umożliwia zasiedlanie bakterii oraz ich przenikanie
przez błony śluzowe,
Patogeneza i epidemiologia.
●
Wrotami zakażenia są drogi oddechowe, a zwłaszcza jama nosowo-gardłowa, zakażenia
drogą kropelkową.
●
Bakteria wnika do nabłonka i rozprzestrzenia się przez ciągłość /opony m-rdz./ oraz drogą
krwi.
●
Rezerwuarem zakażenia jest człowiek. Kolonizację szczepami bezo toczkowymi spostrzega
się u 60-90%zdrowych dzieci oraz do 35% u dorosłych, a 2% dzieci jest bezobjawowymi
nosicielami otoczkowego szczepu typu b,
●
Zapadalność jest odwrotnie proporcjonalna do wieku a do rozwoju choroby przyczyniają
się choroby pierwotne lub wtórne niedobory immunologiczne.

Rozpoznanie.
●
Objawy kliniczne
- zapalenie opon m-rdzeniowych /dzieci/
- zapalenie ucha środkowego i zapalenie
- ostre zapalenie nagłośni /2-5 r.ż./
- choroby układu oddechowego -najczęściej szczepy
- zapalenie oskrzeli- rzadko, - bezotoczkowe
- zapalenie płuc u osób wyniszczonych
- zapalenie tkanki podskórnej /twarz, szyja/,
-bakterie /zawsze szczepy otoczkowe/,
- zapalenie osierdzia i wsierdzia,
●
Badanie mikrobiologiczne
- materiał do badań to wymazy, płyn m-rdzeniowy, krew, BAL, plwocina
- preparat mikroskopowy barwiony metodą grama- krótki Gram- pałeczki,
- hodowla- agar czekoladowy, agar Haemophilus influenzae + 5% dwutlenek węgla, klonie
otoczkowe S są gładkie, okrągłe, wypukłe. Bezotoczkowe w fazie S mają odcień
niebieskawy, w fazie R szare i płaskie.
- testy aglutynacji lateksu- test aglutynacji szkiełkowej z lateksem opłaszczonym
przeciwciałami przeciwko H. inf. Typ b.
Zapobieganie i leczenie.
●
leczenie empiryczne podejrzanych / cefalosporyny III generacji, augmentin lub
chloramfenikol/. Lekami z wyboru są B-laktamy /ampicylina lub amoksycylina/
●
w likwidacji nosicieli oraz w chemioprofilaktyce u osób z kontaktu z zapaleniem opon m-
rdzeniowych zalecana jest rifampicyna,
●
profilaktyka nieswoista i swoista,
●
ochronny podział przeciwciał od matki do 4 miesiąca życia,
●
szczepienia ochronne /szczepionki monowalentne zawierające polisacharyd otoczki
bakteryjnej kowalencyjnie związany z nośnikiem białkowym tzw. szczepionki celularne
/ACT-HIB, Pedvax HIB/
Inne bakterie z rodzaju Haemophilus
- H. parainfluenzae – mniejsza zjadliwość, podobne zachorowania, nie wymaga do wzrostu
czynnika X
- H. aegyptius – ostre zapalenie spojówek,
- H. ducrei wywołuje wrzód miękki zaliczany do chorób wenerycznych / bolesne owrzodzenie
okolic płciowych z obrzękiem i odczynem węzłowym/.
Rodzaj Bordetella
Charakterystyka ogólna
W skład rodzaju wchodzą trzy gatunki: B. pertussis wywołująca krztusiec oraz B.
parapertussis i B. bronchoseptica wywołujące choroby o przebiegu podobnym do krztuśca.
Są to pałeczki o wymiarach 0,3 x 1,0 µm, Gram ujemne w preparatach układają się parami
lub w krótkie łańcuszki, tworzące w organizmie otoczkę. Bakterie posiadają katalazę i
hemolizyny, rosną w warunkach tlenowych na pożywkach zwykłych lub z krwią,
różnicowanie gatunków na podstawie cech biochemicznych. Wrażliwe na wysychanie giną
po kilku godzinach.
Bordotella pertussis – cechy ogólne jak wyżej. Temperatura i warunki wewnątrzkomórkowe
mogą wyłączać geny zjadliwości i umożliwiać przeżycie form mało zjadliwych u nosicieli

Czynniki chorobotwórczości
●
Toksyna krztuścowa- aktywna A i region wiążący B, wykazują działanie anafilaktyczne i
podwyższające poziom insuliny, zmieniająca limfocyty,
●
Toksyna podobna do cyklazy adenylowej hamująca wybuch tlenowy i powodująca
przeżycie bakterii we wnętrzu fagocyta.
●
Cytotoksyna tchawicza uszkadzająca nabłonek tchawicy i powodująca kaszel,
●
Adhezyny w postaci fimbrii otoczkowych, aglutynogenów i włókienkowej hem aglutyniny
odpowiadają za przyleganie bakterii do komórek rzęskowych nabłonka.
Patogeneza i epidemiologia
●
Objawy chorobowe zakażenia B. pertussis związane są ze zniszczeniem śluzówki górnych
dróg oddechowych oraz rozprzestrzenianiem toksyny drogą krwi i krzyżowymi reakcjami
immunologicznymi.
●
Objawy kliniczne rozwijają się fazowo,
●
Źródłem zakażenia jest tylko człowiek, zakażenie drogą kropelkową, pacjentów zakażonych
należy izolować,
●
Najczęściej chorują dzieci, ciężki przebieg do 6 m. życia.
Rozpoznanie
●
Objawy kliniczne
- okresowe napady kaszlu – krztuszenie się,
- faza nieżytowa 7-14 dni,
- faza napadowa do 6 tygodni,
- faza zdrowienia 1-3 tygodnie,
- powikłania : zapalenie oskrzeli, płuc, encefalopatia.
●
Badanie mikrobiologiczne
- materiał do badań: wymazy na specjalnym waciku
- wydzielina, plwocina,
- preparat mikroskopowy barwiony metoda Grama – mniejsze znaczenie
- preparat immunofluoroscencji bezpośredniej – szybki rozpoznanie,
- hodowla na podłożu Bordeta-Gengou /30% krwi baraniej, wyciąg z ziemniaka,
glicerol i agar/ - w fazie S kolonie błyszczące, gładkie wypukłe, mętne wielkości ok
1 mm z niewielką hemolizą
- zróżnicowanie pałeczek biochemicznie /wzrost na pożywkach, hemoliza, rozkład
mocznika, glukoza. Wytwarzanie indolu, redukcja azotanów/
Zapobieganie i leczenie:
●
Lekiem z wyboru są makrolidy.
●
Po zakażeniu utrzymuje się długotrwała odporność.
●
Profilaktyka nieswoista /higiena, izolacja chorych/.
●
Profilaktyka swoista;
- szczepionka Di-Per-Te /zabite ottoczkowe szczepy B.pertussis + anatoksyna błonicy i
tężca/
- szczepionki bezkomórkowe zawierające toksynę krztuścową i inne składniki
wymieniane w czynnikach chorobotwórczości w trakcie badań

Rodzaj Legionella
Charakterystyka ogólna.
Mała pleomorficzna pałeczka o wymiarach 0,3-0,9x2,40μm, Garm ujemna, najlepiej
barwiona wysrebrzaniem, ruchliwa, urzęsiona, wytwarzająca katalazę i beta-laktamazę,
rosnąca na wzbogaconych podłożach /drożdżami, węglem, cysteiną/.Po za L.pneumophila są
i inne gatunki np L.micdadei izolowana w zapaleniu płuc oraz L.bozemani, L.gromani,
L.dumofii i inne izolowane najczęściej ze środowiska.
Legionella pneumophila
Cechy ogólne jak wyżej. Poza wzbogaconym podłożem niezbędne do wzrostu jest wysokie
stężenie CO
2
do 5% oraz wysoka wilgotność. Wzrost trwa do 6 dni
Znanych jest 9
serotypów tej bakterii i jest ona zaliczana do patogenów wewnątrzkomórkowych.
Czynniki chorobotwórczości:
●
adhezyny w postaci białek błony zewnętrznej uczestniczą w adhezji i penetracji do
makrofagów,
●
toksyna białkowa oraz katalaza zapewniają umiejętność przeżycia wewnątrzkomórkowego
ponieważ toksyna hamuje wybuch tlenowy, a katalaza rozkłada resztki nadtlenku wodoru,
●
toksyny np hemolizyny, endotoksyny, cytolizyny,
●
hamowanie odpowiedzi komórkowej poprzez np zahamowanie ekspresji układu zgodności
tkankowej.
Patogeneza i epidemiologia:
●
Bakterie są szeroko rozpowszechnione w świecie.
●
Zakażenia drogą kropelkową lub wodną.
●
Rezerwuarem mogą być systemy klimatyzacyjne, skażona woda w wieżach chłodniczych,
rozpylacze prysznicowe i krany. Nie udowodniono przenoszenia z człowieka na człowieka.
●
Sprzyja zakażeniu spadek odporności, choroby układu oddechowego, palenie tytoniu.
●
U około 20% osób w podeszłym wieku stwierdza się obecność przeciwciał.
Rozpoznanie:
●
Objawy kliniczne:
- choroba legionistów czyli zapalenie płuc o ciężkim przebiegu,
- okres inkubacji 2-10 dni,
- zapalenie płuc z gorączką, biegunką, zaburzeniami świadomości, powiększeniem
wątroby i śledziony,
- gorączka Pontiac pod postacią zespołu grypopodobnego bez zajęcia płuc.
●
Badanie mikrobiologiczne:
- materiał do badania: plwocina, BAL, bioptaty, treść ropni, mocz, kał, krew, aspiraty
płucne,
- badanie mikroskopowe- wysrebrzanie lub immunofluorescencja bezpośrednia/DIF/
- hodowla jest bardzo trudna, najlepsze wyniki z bioptatów z tkanki płucnej, podłoże to
wyciąg z drożdży z węglem, cysteiną, zbuforowane do pH 6,0
- serologia – ograniczona wartość w okresie ostrym Miano 1:256, w ostrej fazie
wskazuje na prawdopodobne zakażenie.
Zapobieganie i leczenie:
●
profilaktyka nieswoista, swoistej brak,
●
lekiem z wyboru są makrolidy i doksycyklina,
●
dodatkowe leczenie wspomagające układ oddechowy, krążeniowy i przewód pokarmowy.

Rodzaj Brucella
Charakterystyka ogólna:
są to tlenowe małe, wielkości 0,5x0,2μm pałeczki Gram ujemne, wykazujące
powinowactwo do gruczołów mlecznych i dróg rodnych zwierząt, powodując poronienia u
zwierząt i chorobę zwaną brucelozą u ludzi. Nie posiadają rzęsek ani otoczek, są patogenami
wewnątrzkomórkowymi, nie wytwarzają przetrwalników. Rodzaj obejmuje 6 gatunków oraz
kilkanaście typów niewiele różniących się od siebie /na podstawie właściwości
biochemicznych/. Cztery z nich są chorobotwórcze dla ludzi: B.abortus, B.sius,
B.melitinensis, B.canis. Bakterie zaliczane do niebezpiecznych- szczególne środki
ostrożności.
Brucella sp.
/B.abortus, B.sius,B.melitinensis, B.canis./ ze względu na duże podobieństwo będą
omówione łącznie. Cechy morfologiczne jak wyżej. Dość oporne na środowisko
zewnętrzne, w wodzie i glebie żyją do kilki miesięcy, w mleku do 9 dni. Rosną na podłożach
wzbogaconych.
Cechy chorobotwórczości:
●
obecność substancji na powierzchni hamujących fuzję ziarnistości lizosomalnych z
fagosomami,
●
zdolność do przeżycia wewnątrzkomórkowego,
●
obecność endotoksyny działającej cytotoksycznie na komórki zwierząt uczulonych.
Patogeneza i epidemiologia:
●
Rezerwuarem zarazków są zwierzęta a bakterie mogą być wydalane z mlekiem przez wiele
lat.
●
Brucelloza u ludzi jest typową chorobą odzwierzęcą a u weterynarzy jest chorobą
zawodową.
●
Wrotami zakażenia może być przewód pokarmowy – spożycie skażonego mleka czy innego
pokarmu lub uszkodzona skóra w bezpośrednim kontakcie ze skażonymi produktami.
●
W nieleczonym zakażeniu śmiertelność wynosi do 10% zakażonych
Rozpoznanie:
●
Objawy kliniczne:
- okres inkubacji 3-16 dni
- ostre objawy pod postacią zespołu grypopodobnego z gorączką do kilku tygodni
- czasami gorączka falująca /maltańska/ do kilku miesięcy
- w następstwie niedokrwistości, łatwa męczliwość, zapalenie stawów, uszkodzenie
kręgosłupa, zapalenie naczyniówki oka, opon mózgowo-rdzeniowych i jąder,
●
Badanie mikrobiologiczne:
- materiał do badań; krew, mocz, punktaty, płyn m-rdzeniowy, ropa, szpik kostny, tkanka
obumarłych płodów, mleko i jego przetwory,
- badanie bezpośrednie mikroskopowe metodą Grama / mała przydatność/ oraz
immunofluoroscencyjne – w ciężkich zakażeniach i poronieniach,
-w pierwszych 3 tygodniach gorączkowych posiew krwi
- hodowla na podłożach stałych i płynnych z wyciągiem z wątroby z dodatkiem tryptozy,
glicerolu i surowicy w atmosferze 10% CO
2
- wykorzystuje się też metodę Castendy na pożywce skośnej w butli Legroux lub gotowe
podłoża np. Brucella agar lub Brucellgroth,
- po 10 dniach w bulionie tworzy się śluzowy osad. Co kilka dni wysiewa się na podłoża

stałe. Po 24-48 h wyrastają małe, wypukłe, gładkie, szare kolonie, które żółkną i
brązowieja. Posiane od początku na podłoża stałe, wyrastają w postaci gładkich,
śluzowatych kolonii.
- biochemia: wyhodowane bakterie identyfikuje się przy pomocy odczynów
biochemicznych / dodatnie – katalaza, oksydaza, ureaza, redukcja azotanów, ujemne-
indol, acetonina, metyl-red, oraz zróżnicowana wrażliwość na barwniki/
- odczyny serologiczne:
- aglutynacja szkiełkowa ze swoistą surowicą
- test aglutynacji Wrighta z surowicą chorego (miano równe lub wyższe 1:80-
160)
- test Brucellosis Cf lub Bruceloslide – Test, oparte na odczynie wiązania
dopełniacza miano 1;3
- testy immunofluorescencji pośredniej, opono- fagocytarny Huddlesona (indeks
powyżej 20% - dodatni), zahamowani migracji leukocytów, odczyn Combsa
(dodatni 1:25),
- metoda immunoenzymatyczna (EIA) – IgM w ostrym zakażeniu
- próba skórno-alergiczna z bruceliną Burneta ( naciek i strefa zaczerwienienia 20mm),
- próba biologiczna – zakaża się 2 świnki morskie. Po 3 tygodniach usypia się jedną,
pobiera próbki narządów i posiewa na podłoża. Drugą usypia się po 6 tyg. pobiera próbki
narządów do posiewów oraz określa miano przeciwciał (dodatnie 1:10)
Zapobieganie i leczenie
●
lekiem z wyboru jest tetracyklina. W skojarzeniu ze streptomycyną ma zmniejszyć częstość
nawrotów,
●
profilaktyka swoista i nieswoista u zwierząt ( szczepionki z zabitych i atenuowanych
bakterii)
●
u ludzi tylko profilaktyka nieswoista ( eliminacja chorych zwierząt, izolacja chorych, środki
ochrony osobistej, )
Rodzaj Yersynia
Charakterystyka ogólna
Są to mała, pleomorficzne, opisywane czasami jaki ziarniako-pałeczki o wymiarach 0,5-0,8 x
1,5-1,8 mikrometra, Gram – ujemne (najczęściej barwiące się dwubiegunowo (bakterie, nie
posiadające rzęsek, przetrwalników, katalazo-dodatnie, rosnące względnie beztlenowo. W
preparatach z materiału chorobowego obserwuje się otoczkę, która ginie po kilku pasażach.
Rosną na podłożach zwykłych, najlepiej w temp. 28-30
o
C, i pH 6,5-7,0. Są wrażliwe na
działanie temperatury i środków dezynfekujących. Rosnąca podłożach zwykłych. Rodzaj
zawiera 11 gatunków z których trzy gatunki chorobotwórcze dla ludzi: Y.pestis, Y.enterocolitica,
Y.pseudotuberculosis.
Yersinia pestis – cechy ogólne jak dla rodzaju.
Jest to bakteria odpowiedzialna za co najmniej 2 wielki pandemie dżumy, w 500 r.p.n.e.
(100 ml zgonów). Mniejsze pandemie występują do obecnych czasów.
Są to fakultatywne, wewnątrzkomórkowe patogeny, zdolne do wzrostu zarówno w
zakażonych zwierzętach jak i środowisku zewnętrznym.
Czynniki chorobotwórczości
●
fimbrie pośredniczące w wiązaniu bakterii z komórką żywiciela,
●
glikoproteina F-1 tworząca antyfagocytarną otoczkę,
●
proteza Pla aktywująca plazminogen i inaktywująca C3b i C5a

●
tzw. Antygen W/V mający właściwości antyfagocytarne i wspomagające wzrost
wewnątrzkomórkowy,
●
wytwarzają pestycydy, kongulazy i fib
●
uwalnianie temperaturostabilnej enterotoksyny Yst,
Patogeneza i epidemiologia
●
Głównym rezerwuarem zarazków są gryzonie, zwłaszcza szczury, susły, świstaki, świnki
morskie i wiewiórki,
●
Bakteria wywołuje chorobę szczurów i innych gryzoni. Gdy gospodarz zginie pchły
poszukując nowego przenoszą chorobę na ludzi.
●
Człowiek jest gospodarzem przejściowym.
●
Do zakażenia dochodzi poprzez:
-kontakt bezpośredni ze źródłem zakażenia
-poprzez przenosicieli ( pchły szczurze opite krwią chorego zwierzęcia są zakażone
przez kilka miesięcy)
●
Wrotami zakażenia jest uszkodzona skóra lub błona śluzowa dróg oddechowych przy
zakażeniach kropelkowych.
●
Wyróżnia się dwa typy dżumy:
- miejską jako epidemią przenoszoną przez pchły.
- leśną nabywaną od zwierząt
●
W latach 1958-79 zanotowano 47 tys. zachorowań na świecie.
Rozpoznanie
●
Objawy kliniczne:
- okres inkubacji 2-7 dni,
- dżuma dymieniczna – rozległa limfadenopatia zwykle z wysoką gorączką i wtórną
bakteriemią (60% zgonów)
- dżuma płucna – rozszerzenie zakażenia lub zakażenie drogą kropelkową, ciężkie
zapalenie płuc (90% zgonów)
- posocznica – (100% zgonów)
●
Badanie mikrobiologiczne:
- materiał do badań; punktak z węzłów, krew, plwociny, ropa z przetok, materiał
sekcyjny,
- preparat mikroskopowy met. Grama lub Giem…? , bezpośrednie badanie
immunofluorescencyjne.
- hodowla; na agarze zwykłym po 48 godz. małe, 1-2 mm. okrągłe kolonie,
przeźroczyste, szarawe, lekko wzniesione. W bulionie rosną w postaci kosmków,
bulion pozostaje klarowny. Można posiać na podłoże Mc Conkeya.
- identyfikacja i różnicowanie na podstawie cech biochemicznych ( przydatne testy
AP1)
-badanie serologiczne – aglutynizacja szkiełkowa surowicą przeciwdżumową,
odczyn flokulacji ( są to badania uzupełniające).
-próby biologiczne; podanie bakterii białym myszom, szczurom lub świnką
morskim. Zwierzęta giną po 3-6 dniach z powodu posocznicy.
Zapobieganie i leczenie.
●
Zaleca się stosowanie streptomycyny, chloramfenikolu, tetracykliny, sulfonamidów.
●
Y.pestis jest wrażliwa na wiele antybiotyków.
●
Stosuje się również leczniczo surowicę p-dżumową końską.
●
Profilaktyka tylko nieswoista:

- bezwzględna izolacja chorych i hospitalizacja,
- kwarantanna osób z kontaktu,
- dezynfekcja i dezynsekcja zagrożonego obszaru,
- profilaktyka antybiotykowa personelu zwalczającego zakażenie
Yersina pseudotuberculosis
- Powoduje epizoocje u odległych gatunków ssaków i ptaków. Rezerwuarem zarazków są
dzikie gryzonie, zwierzęta, ptaki. Człowiek choruje b. rzadko. Zakażenia drogą kropelkową.
- U człowieka wywołują chorobę objawiającą się Bulami brzucha, wymiotami, nudnościami i
podwyższoną temperaturą ciała a w narządach wewnętrznych zmianami …? ogniska
gruźlicze.
Yersinia enterocolica
- Posiada adhezyjny i inwazyjny, białka antyfagocytarne, enterotoksynę podobną do oksyny
ST E. Coli – jako czynniki chorobotwórczości,
- wywołuje zapalenie żołądka i jelit, reaktywne zapalenie stawów, jest odpowiedzialna za
ZZSK,
–
rezerwuarem zarazków są różne zwierzęta domowe i gryzonie a do zakażenia ludzi
dochodzi poprzez spożycie skażonej wody i żywności oraz drogą fekalno-oralną.
Bakterie atypowe i rodzina Rickettsiaceae
Rodzina Mycoplasmataceae
Charakterystyka ogólna
Gram ujemne, pleomorficzne bakterie wielkości 150-250nm, pozbawione ściany komórkowej,
posiadające trójwarstwową błonę komórkową. Rosną w warunkach tlenowych lub względnie
beztlenowych na pożywkach specjalnych wzbogaconych w sterole, kolonie wielkości do 0,5 mm
mają wygląd sadzonego jaja, poszczególne gatunki różnią się właściwościami biochemicznymi. Do
rodziny należą dwa rodzaje: Mycoplasma i Ureaplasma. Bakterie te najczęściej kolonizują
powierzchnie błon śluzowych układu oddechowego i moczowego.
Mycoplasma pneumoniae
Charakterystyka ogólna – taka jak dla rodziny. Komórki mają kształt butelkowaty lub
gruszkowaty za ze zwężeniem na jednym biegunie
Czynnik chorobotwórczości
●
białko P1 będące częścią błony zewnętrznej o właściwościach adhezyjny. Przyczepia ono
bakterię do komórek nabłonkowych dróg oddechowych hamując działanie rzęsek
oddechowych i powoduje śmierć komórek błony śluzowej.
Patogeneza i epidemiologia
●
rezerwuarem zakażenia jest chory człowiek lub ozdrowieniec,
●
zakażenia przenosi się drogą kropelkową, rzadziej przez kontakty bezpośrednie.
●
bakterie wydalane są przez wiele tygodni od wystąpienia początkowych objawów
chorobowych,
●
jako następstwo powstawania kompleksów immunologicznych może wystąpić zapalenie
stawów i odczyny skórne, a w skutek powstawania zimnych aglutynin dochodzi do
niedokrwistości hemolitycznej,
●
duże skupiska ludności i ciepły klimat sprzyjają rozprzestrzenianiu się zakażenia

Rozpoznanie
1. Objawy kliniczne:
●
objawy rozwijają się powoli, podstępnie po 2-3 tyg., okresie inkubacji,
●
zapalenie płuc, tchawicy, oskrzeli, ucha środkowego,
●
powikłania w postaci: zapalenia OUN, zapalenia m. sercowego, niedokrwistości
hemolitycznej, zapalenia stawów, kłębkowego zapalenia nerek,
●
zmian skórnych: wysypka, rumień, zespół Stevensa-Lobinsona
2. Badanie mikrobiologiczne:
●
materiał do badania – plwocina, wymaz, popłuczyny drzewa oskrzelowego,
●
hodowla – mało przydatna w okresie ostrym. Na pożywce Hayflicka/ agar wzbogacony
surowicą końską i wyciągiem drożdżowym /po 2-28 dniach wyrastają bardzo małe
pomarańczowe kolonie, zagłębione w agarze. Można też hodować na gotowych
podłożach np.: Mycotrim GV, Mycotrim RS, agar A7 i inne,
●
M. pneumoniae można hodować w zarodku kurzym oraz liniach komórkowych
embrionu ludzkiego i innych ludzkich, nerek małp
●
testy biochemiczne: bakterie rozkładają większość cukrów poza laktozą, wytwarzają
hemolizynę typu beta,
●
badanie serologiczne:
- OVD /miano dodatnie wyższe niż 1:20, 1:40/,
- ELISA / klasa IgA – miano dodatnie wyższe niż 1:100, 1:30/.
klasa IgG – miano dodatnie wyższe niż 1:1600, 1:120/,
klada IgM – miano dodatnie wyższe niż 1:1200, 1:85/,
klasa Iga,G,M, łącznie wyższe niż 1:3200
- odczyn immunoelektroprecypitacji/OIEP/ większy niż 2,
- odczyn lateksowy większy niż 1:8,
- odczyn lateksowy
- poszukiwanie antygenów:
-westem immunobioting, - PCR
Zapobieganie i leczenie
●
Profilaktyka nieswoista, swoistej brak.
●
Powstała odporność po przebyciu jest niekompletna i nie zabezpiecza przed następną
infekcją
●
Lekami z wyboru są makrolity i tetracykliny. Brak skuteczności antybiotyków działających
na ścianę komórkową
Mycoplasma homonis i Ureaplasma urealyticum
Bakterie kolonizują drogi moczowo-płciowe. Wywołują one gorączkę połogową,nierzerzączkowe
zapalenie cewki moczowej, niekiedy zapalenie nerek i narządów miednicy małej. U.urealyticum
odróżnia od innych mykoplazm odmienna budowa antygenowa, zdolność wytwarzania ureazy, oraz
brak rozkładania niektórych cukrów. Diagnostyka podobna do diagnostyki M.pneumoniae z
możliwością wykorzystania gotowych zestawów do identyfikacji biochemicznej /Sanofi
Diagnostics, International mycoplasma/.
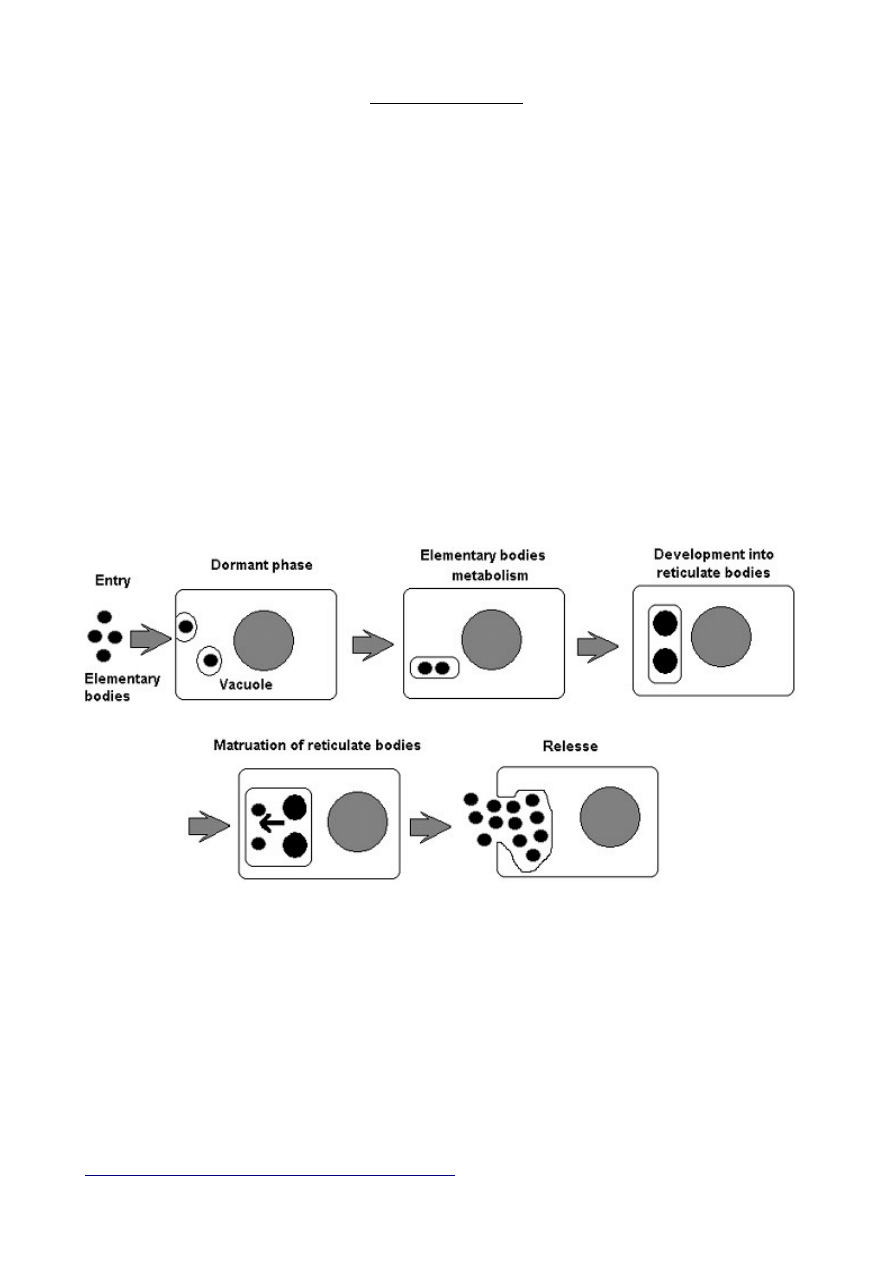
Rodzaj Chlamydiae
Charakterystyka ogólna
Rodzaj składa się z trzech gatunków patogennych dla człowieka: Chlamydia psittaci , Chlamydia
pneumoniae, Chlamydia trachomatis.
Mają one kształt ziemniakopodobny lub pałeczkowaty, są Gram ujemne. Ściana komórkowa ma
1.PS, który jest wspólnym antygenem dla wszystkich gatunków ale nie zawiera peptydoglikanu.
Bakterie nie rosną na podłożach sztucznych, rosną w zarodkach kurzych oraz różnych tkankach
zwierzęcych. Nie są wrażliwe na beta-laktamy. Są to:
●
bakterie bezwzględnie wewnątrzkomórkowe
●
brak wielu szlaków metabolicznych i biochemicznych – całkowita zależność od komórki
gospodarza
●
dwa stadia:
- formy infekcyjne nazywane ciałkami podstawowymi
- formy rozrodcze, wewnątrzcytoplazmatyczne
Ciałka elementarne są dojrzałymi komórkami bakteryjnym, barwią się na purpurowo a
ciałka pierwotne/retikulocytarne, wtrętowe/ barwią się na niebiesko m. Giemzy.
CYKL ROZWOJOWY
Czynnik chorobotwórczości:
●
zakaźnych wszystkich chlamydii,
●
główną role odgrywa zdolność do wewnątrzkomórkowego namnażania i wytwarzania Endo-
i egzotoksyn,
●
ciałko siatkowate może hamować fuzję lizosomów z pęcherzykami fagocytarnymi w którym
ono przybywa,
●
zniszczenie komórki, /śmierć/ w czasie uwalniania ciałek elementarnych,

Postacie kliniczne:
Chlamydia psittaci
●
choroba odzwierzęca, zawodowa, rezerwuarem są ptaki-papugi, gołębie,
●
wywołują papuzich /ornitozę, chorobę ptasią/ chorobę podobną nieco do grypy z
jadłowstrętem i wysypką skórną i obrazem klinicznym zapalenia płuc.
Chlamydia pneumoniae
●
choroba przenoszona z człowieka na człowieka,
●
przebiega dwufazowo, początkowo jako zapalenie górnych dróg oddechowych a
następnie odoskrzelowe zapalenie płuc
Chlamydia trachomatis
●
bakteria zajmuje głównie komórki błony śluzowe,
●
rezerwuarem bakterii są ludzie, 5% kobiet i 10% mężczyzny uważa sięga nosicieli
●
zakażenie szerzy Si z człowieka na człowieka drogą płciową, podczas porodu lub
kontaktu bezpośredniego z zakażoną osobą,
zakażenie przebiega jako:
- jaglica – przewlekłe zapalenie pęcherzykowe rogówki,
- ziarniak weneryczny,
- niegonokokowe zapalenie cewki moczowej
- śluzowe zapalenie szyjki macicy
- zakażenie noworodków /zapalenie spojówek, płuc/,
●
powikłania po w/w zapaleniach:
- blizna – łuszczka
- zapalenie najądrzy, zespół Reitera, zapalenie przydatków u kobiet
Rozpoznanie:
Chociaż istnieją pewne odrębności w rozpoznaniu każdego z zakażeń, podstawy rozpoznania są
takie same:
●
materiał do badania – wymazy, preparaty biopsyjne
●
preparat bezpośredni m. Giemzy – ciałka elementarne lub wtrętowe,
●
test immunofluoroscencji bezpośredniej w preparacie z ciałkami elementarnymi
●
hodowla - /zarodek, tkanki/ sporadycznie, wysokie koszta, wysoka zakaźność, długi czas
oczekiwania,
●
badanie serologiczne – testy immunoenzymatyczne, OWD,
●
poszukiwanie DNA – hybrydyzacja, PCR
Zapobieganie i leczenie
●
Profilaktyka nieswoista – unikanie przypadkowych kontaktów seksualnych, eliminowanie
zakażenia, szybkie wykrywanie osób zakażonych, prawidłowe leczenie,
●
Lekiem z wyboru są tetracykliny, makrolity, niekiedy podawane do trzech tygodni w
przypadku powikłań

Rodzina Ricketsiae
Charakterystyka ogólna
Należą tutaj małe polimorficzne ziarniakowate lub pałeczkowate 0.5-2.0 mikrometra długości 0.2-
0.5 mikrometra szerokość, bakterie żyjące wewnątrzkomórkowo. U przenosicieli (owady) mogą
występować międzykomórkowo. Błona komórkowa jest podobna do błony bakterii Gram
ujemnych, zawiera LPS i peptydoglikan. Do rodziny należą trzy rodzaje: Riketsja Coxiella i
Ehrlichia.
Patogeneza i epidemiologia
●
z wyjątkiem gorączki Q w patogenezie chorób wywołanych tymi bakteriami jest wiele
podobieństw.
●
bakterie z wyjątkiem C. Burneti przenoszone są przez wszy, pchły, kleszcze i inne wektory,
mogą być przenoszone z kleszcza na jego potomstwo.
●
C. Burneti odporna na wysuszenie przenosi się drogą powietrzną
●
bakterie występują na całym świecie z przewagą terytorialną niektórych gatunków
●
po zakażeniu riketsje rozmnażają się w komórkach śródbłonka naczyń wrót zakażenia ( 7
dniowy okres wylęgania), następnie rozsiewają się drogą naczyń chłonnych. Riketsje
nieopsonizowane pochłonięte przez niezaktywowane makrofagi przeżywają i rozmnażają się
wewnątrzkomórkowo, powiększają się węzły chłonne
●
po dalszych 7-10 dniach drogą krwi bakterie rozsiewają się po ustroju. Dochodzi do
replikacji bakterii w jądrze lub cytoplazmie komórek śródbłonka, co prowadzi do zapalenia
naczyń a objawy kliniczne przybierają postać ogólnych z wysypką skórną, martwicą tkanek
okolonaczyniowych, zakrzepicą i niedokrwieniem.
●
rozsiane uszkodzenia śródbłonka zwiększają przepuszczalność naczyń, powodują obrzęk,
krwotok, wstrząs lub zespól DIC i zgon wskutek zaburzeń krążenia lub uszkodzenia serca.
Rodzaj Ricketssia
Poszczególne bakterie z tego rodzaju wywołują choroby wysypkowe lub wysypkowe i gorączkowe
dość podobne do siebie. Są to:
●
dur plamisty epidemiczny - Ricketssia prowazeki
●
dur plamisty endemiczny- Ricketssia typhi
●
dur zaroślowy - Ricketssia tsutsugamushi
●
gorączka plamista Gór Skalistych – Ricketsia ricketssi
●
gorączki plamiste - Ricketssia conori
Rodzaj Coxiella
Bakteria ta wywołuje tzw. Gorączkę Q charakteryzującą się gorączką, objawami grypopodobnymi.
Niekiedy rozwija się odoskrzelowe zapalenie płuc.
Rodzaj Erlichia
Bakterie wywołują tzw. Erlichiozę (E chaffeensis) charakteryzującą się klinicznie leukopenią,
trombocytopenią i podwyższonymi aminotransferazami. Choroba przebiega łagodnie, może dojść
do samowyleczenia ale i do zgonów w zakażeniu powtórnym.

Rozpoznanie
1. Objawy kliniczne w/w chorób, bobrze zebrany wywiad w przypadku gorączek i/lub
wysypek niewiadomego pochodzenia
2. Badanie mikrobiologiczne:
●
materiał do badania: krew, surowica, mocz
●
preparat mikroskopowy – mazane preparaty narządowy barwione m.Romanowskiego-
Giemsy, Riteksje barwią się na czerwono a elementy komórek gospodarza na niebiesko
●
odczyn immunofluorescencji pośredniej,
●
hodowla ( worek żółtkowy jaja kurzego, płuca myszy i innych gryzoni, hodowle
tkankowe, jelita wszy, organizm kleszczy (niebezpieczna i kosztowna)
●
testy serologiczne:
- immunofluorescencji pośredniej, OWD,
- Wwigla, Weila-Felixa, hemaglutynacji biernej
●
odczyn Neilla i Moosera – wyhodowane riketsje podaje się świnkom morskim R.typhi
(moosen) powoduje obrzęk moszny
●
poszukiwanie genomu bakteryjnego metodą PCR
Zapobieganie i leczenie
●
profilaktyka nieswoista i zwalczanie stawonogów jako wektorów
●
Profilaktyka swoista – szczepionki:
- Weigla (jelita wszy i R.prowazeki)
- Coxa (woreczek żółciowy zarodka kurzego)
- inne (płuca zakażonych myszy, królików i psów)
- lek musi penetrować przez błony komórkowe ssaków. Lekami z wyboru są doksycylina i
chloramfenikol podawane do 6 dni po ustąpieniu gorączki (zapobieganie nawrotom)
Bakterie spiralne – krętki
Charakterystyka ogólna
Zalicza się do nich dwie rodziny. Rodzinę Spirochetaceae z rodzajami Treponema i Borelia oraz
rodzinę Leptospiraceae Do której należy chorobotwórczy rodzaj Leptospira. Są to długie (do 50
mikrometrów, cienkie 0.1-0.3 pikometrów, ruchliwe spiralnie zwinięte bakterie, żyjące w
warunkach domowych względnie beztlenowych lub beztlenowych, dające się hodować lub nie. Są
Gram ujemne, ale niektóre gatunki są trudne do uwidocznienia w metodzie Grama.
Rodzaj Treponema
Charakterystyka ogólna
Do rodzaju należą bakterie spiralne o długości 5-20 mikrometrów, o ścisłych lub nieregularnych
skrętach, bezwzględnie beztlenowe, wykazują ruch. Chorobotwórcze dla człowieka:
T.pallidum(kiłe), T. pertenue (malinica) i T.carateum (pinta) nie dają się hodować na podłożach
sztucznych... Inne krętki niechorobotwórcze a występujące u człowieka dają się hodować: T.orale,
T.dentcola, T.vincenti, T.phagedenis, T.refringens i inne.
Treponema pallidum
Bakteria spiralna o długości 6-20mikrimetrów i 0.1-0.2 mikrometrów grubości wykazuje ruch,
posiada 6-13 regularnych skrętów. Barwi się słabo m.Grama, daje się impregnować solami srebra.

Nie udalo się dotychczas bakterii wyhodować na podłożach sztucznych a tylko w hodowlach
tkankowych. Krętki są bardzo wrażliwe na warunki środowiskowe.
Czynniki chorobotwórczości
●
słabo poznane,
●
występowanie adhezyn umożliwiających wiązanie krętków do komórek sródbłonkowych
gospodarza
●
fibronektyna zwiększa adhezję bakterii
Patogeneza i epidemiologia
●
z miejsca inwazji krętki przenikają do drenujących okolicę węzłów chłonnych następnie do
krwiobiegu i łączą się z komórkami śródbłonka powodując stan zapalny błony wewnętrznej
naczyń, co jest głównym mechanizmem uszkadzającym,
●
antygeny powierzchniowe krętków są mało immunogenne
●
zakażenie przenosi się poprzez kontakt bezpośredni, łożysko oraz przypadkowo np. w
laboratorium, biorcy krwi.
●
pewien problem terapeutyczny i diagnostyczny może być u osób z nietypowym przebiegiem
klinicznym i późnym rozpoznaniem
Rozpoznanie
1. Objawy chorobowe
●
kiła wrodzona
●
kiła nabyta
●
kiła I rzędowa ( zmiana pierwotna)
●
kiła II rzędowa ( wysypka)
●
kiła III rzędowa ( zmiany degeneracyjne i martwicze)
2. Badanie mikrobiologiczne
●
materiał do badań: wymaz ze zmiany pierwotnej, krew
●
preparat mikroskopowy oglądany w ciemnym polu widzenia – na ciemnym tle jasne
ruchliwe ‘sprężynki’ (kiła I rzędowa)
●
testy serologiczne – testy te są dodatnie prawie u 100% zakażonych jeśli wykonuje się je
po wystąpieniu zmiany pierwotnej. W kile trzeciorzędowej odczyny swoiste są dodatnie,
odczyny nieswoiste-ujemne. U każdego chorego należy obok odczynów nieswoistych
wykonać swoiste ponieważ te pierwsze mogą dawać wyniki fałszywie ujemne.
●
nieswoiste – antygenem jest uzyskana z serca wołu kardiolipina bogata w fosfolipidy
- odczyn Wassermanna oparty na odczynie OWD
- testy kłaczkujące (flokulacyjne): VDRI, RPR, USR
●
swoiste - wykorzystujące antygeny T. Pallidum
●
OWD-test mikrihemaglutynacji (MHA-TP)
●
FTA, FTA-ABS immobilizacji krętków TPI

Zapobieganie i leczenie
●
Profilaktyka nieswoista to likwidowanie źródeł zakażenia źródeł zakażenie i wczesne
leczenie osób zakażonych.
●
Po zakażeniu powstaje pewien rodzaj odporności ale jest ona niezbyt pewna.
●
Lekiem z wyboru jest penicylina od dawki pojedynczej do kilku dawek zależności od czasu
chorowania. Względna skuteczność leczenia. U większości klinicznie wyleczonych można z
węzłów chłonnych wyizolować żywe krętki przez długi czas, niekiedy przez całe życie.
Rodzaj Borelia.
Charakterystyka ogólna;
są to bakterie Gram ujemne, spiralne o 4- 50 nieregularnych skrętach. Są bezwzględnymi
beztlenowcami, rosną na podłożach wzbogaconych lub błonie kosmówkowo-omoczniowej zarodka
kurzego. U bakterii występuje duża zmienność antygenowa. Liczne gatunki występujące w tym
rodzaju wywołują gorączkowe zespoły chorobowe podobne do duru i przenoszone są przez
kleszcze. Najbardziej znanym kosmopolitycznym gatunkiem jest B.burgdorferi oraz B.recurrentis.
Borellia burgdorferi
Charakterystyka ogólna
jak dla całego rodzaju. Bakterie poruszają się ruchem rotacyjnym za pomocą pęczka 7-11 rzęsek,
ułatwiających penetracje. Komórki wykazują duży polimorfizm, wyodrębniono trzy genogatunki
bakterii izolowane w Europie, USA i Japonii.
Czynniki chorobotwórczości
●
toksyczny liposacharyd o działaniu prozapalnym, działanie białek powierzchniowych,
●
ruchliwość, adherencja i inwazja do komórek ludzkich,
●
umiejscowienie międzykomórkowe, cytotoksyczność,
●
zmienność antygenowa, stymulacja limfocytów B, limfokin,
●
oporność na bakteriobójcze działanie dopełniacza pod nieobecność przeciwciał
Patogeneza i epidemiologia
●
krętki są wydzielane ze śliną kleszczy Ixodes dammini i pokrewnych,
●
okres zapadalności przypada pomiędzy 1 maja a 30 listopada, najczęściej w czerwcu i lipcu,
●
z miejsca zakażenia bakterie są roznoszone drogą krwionośną do różnych tkanek
gospodarza, przylegają do śródbłonka naczyń i substancji międzykomórkowej. Bakterie
posiadają właściwości inwazji wewnątrzkomórkowej do różnych komórek hodowlanych i
ludzkich,
●
krętki wykazują tropizm do tkanki łącznej serca, błony maziowej stawów, śródbłonka
naczyń, więzadeł i przyczepów ścięgien, śledziony, nerek, skóry. W narządach krętki
występują w skupiskach wokół naczyń.
Rozpoznanie
1. Objawy kliniczne: krętki wywołują chorobę – boreliozę z Lyme. Po okresie (do 32 dni)
inkubacji w miejscu zakażenia pojawia się rumień wędrujący, dalej następuje bakteriemia,
dotarcie bakterii do serca, układu nerwowego. W późniejszym okresie rozwija się zapalenie
stawów..
2. Badanie mikrobiologiczne:
●
materiał do badania; krew, płyn m-rdzeniowy, płyn stawowy, wycinki tkanek,
●
preparat mikroskopowy metoda Giemsy – krętki

●
hodowla; podłoże BSK II z dodatkiem agarozy i krwi końskiej (warunki
mikroaeorofilne, temp. 30-35 °C ) wzrost po 5 dniach, hemoliza typu beta, rzadka
izolacja w 5 %, duże koszty, długi czas trwania
●
testy serologiczne:
- test hemaglutynacji biernej OWD,
- test immunofluorescencji pośredniej – IFA
- test immunoenzymatyczny ELISA, Western-blotting,
●
poszukiwanie antygenów metodą PCR,
Zapobieganie i leczenie
●
Szeroko pojęta profilaktyka nieswoista, zabezpieczenie ciała w czasie pobytu w lesie w
letnie miesiące. Ważną sprawą jest zauważenie zmian skórnych w pierwszym okresie
zakażenia.
●
Swoista szczepionka jest w trakcie badań klinicznych.
●
Lekiem z wyboru jest doksycyklina, następnie amoksycyklina, erytromycyna. Leczenie
powinno być prowadzone przez okres 2-3 tygodni.
Borellia recurrentis
Bakteria wywołuje dur powrotny /bakteriemia z gorączką/ - chorobę związaną z wystąpieniem do
10 nawrotów. Zmiany dotyczą takich narządów jak śledziona wątroba nerki. Po 3-10 dniowym
okresie inkubacji występują nagle dreszcze, gorączka, która trwa 3-5 dni i po 5-10 dniach przerwy –
ponowny podobny atak. Rezerwuarem są gryzonie, a przenosicielami kleszcze i wszy. Diagnostyka
podobna do poprzedniej, preparat mikroskopowy i ciemne pole widzenia, technika
immunofluorescencji bezpośredniej, bakterie dają się hodować na podłożach wzbogaconych. W
leczeniu stosuje się makrolidy, tetracykliny lub penicyliny.
Rodzaj Leptospira
Charakterystyka ogólna
Bakterie spiralne, silnie zwinięte, z haczykowatym zakończeniem, ruchliwe, długości od 6-20μm i
średnicy około 0,1μm. Są względnie beztlenowe, rosną w temp. 30°C, mogą rosnąć na
wzbogaconych podłożach sztucznych, najlepiej płynnych. Rosną wolno 6-8 dni pod powierzchnia
agaru, kolonie są słabo widoczne, lepiej po specjalnym zabarwieniu. Barwią się trudno zwykłymi
metodami, najlepiej metodą Giemsy. Wrażliwe na czynniki zewnętrzne, w wodzie i wilgoci
przeżywają dłuższy czas.
Patogeneza i epidemiologia
●
Zakażenie przenosi się poprzez kontakt z zakażonym zwierzęciem, zakażoną glebą,
przedmiotami, wodą, wydalinami zwierząt.
●
Krętki wnikają przez nie naruszone błony śluzowe, otarcia skóry. Nie naruszona skóra jest
dobrą barierą ochronną.
●
Następnie krętki dostają się do krwi i tą drogą do różnych narządów (wątroba, naczynia
krwionośne, nerki).
●
Rezerwuarem bakterii są drobne gryzonie najczęściej szczury, oraz psy, koty i zwierzęta
domowe. Najbardziej podatni na zakażenie są pracownicy weterynarii i pracownicy
żywnościowi.

Rozpoznanie:
1. Objawy kliniczne:
●
postać bezobjawowa, (obecność przeciwciał wykrytych przypadkowo),
●
leptospiroza bez żółtaczki, objawy grypopodobne, następnie bóle głowy, mięśni,
nudności, wymioty, powiększenie śledziony, wątroby, objawy oponowe.
●
Zespół Weila – leptospiroza z żółtaczką (L.icterohaemorrhagiae, interrogans) z
uszkodzeniem śródbłonka naczyń i powiększeniem wątroby.
●
Gorączka błotna (L.grippotyphosa, sejroe) z wysoką temperaturą, dreszczami, bólami
mięśni i głowy, nudnościami i wymiotami.
2. Badanie mikrobiologiczne:
●
materiał do badania: krew, mocz, płyn m-rdzeniowy,
●
hodowla na podłożu Korthofa (zbuforowana sól z surowicą) inkubacja przez 2 miesiące
w termostacie i przegląd w ultramikroskopie (ciemne pole),
●
testy serologiczne; aglutynacji szkiełkowej surowicy chorego z 15 szczepami leptosir
hodowanych jak wyżej. Szczyt przeciwciał w 4 tygodniu choroby.
Profilaktyka i leczenie:
Profilaktyka swoista – szczepienia zabitymi leptospirami. W nieswoistej- likwidacja ognisk
leptospirozy, odzież ochronna, zwalczanie gryzoni. W leczeniu: penicyliny, streptomycyny,
tetracyklina, erytromycyna.
Ziarniaki Gram dodatnie
Rodzaje: Staphyloccocus, Streptoccocus
Charakterystyka ogólna ziarniaków:
Powyższe rodzaje należą do rodziny Micrococcaccae (rodzaj Microccocus, Staphyloccocus/,
Streptococcacae/ rodzaj Streptococcus/, Peptococcacae/ rodzaj Peptostreptococcus, Peptococcus/,
Neisseriaceae/ rodzaj Neisseria, Branhamella/ oraz Veillonaceae/ rodzaj Veillonaceae/ . Są to
drobnoustroje kształtu kulistego wielkości 0,3-2,0 mikrom, Gram dodatnie lub Gram ujemne,
rosnące na podłożach zwykłych, wzbogaconych lub specjalnych warunkach tlenowych, względnych
beztlenowych lub bezwzględnych beztlenowych. Występują tutaj bakterie chorobotwórcze,
potencjalnie chorobotwórcze, komensale lub saprofityczne. Niektóre z nich należą do bakterii
najbardziej rozpowszechnionych na świecie. Obecnie wyróżnia się 25 rodzajów ziarniaków Gram
dodatnich.
Rodzaj Staphylococcus
Ogólna charakterystyka – S. ureus zostały wykryte przez Pasteura w 1880r opisane przez
Rosenbacha w 1884r. Gronkowce – bakterie układające się z hodowli stałej w gronka, mają kształt
kulisty o średnicy 0,8-1,0 Mikrom . W podłożach płynnych i środowisku naturalnym wstępują
pojedynczo lub układają się parami, krótkie łańcuszki, dwoinki, czworaczki. Nie wytwarzają
przetrwalników i nie wykazują ruchu, pojedyncze szczepy wtwarzają otoczki. Główną cechą
różnicującą gatunki jest zdolność do wytwarzania koagulaty. Do rodzaju należy ponad 40
gatunków. Głównym gatunkiem chorobotwórczym odpowiedzialnym za wiele ciężkich zakażeń jest
koagulozo dodatni S. ureus. Gronkowce koagulozo – ujemne stanowią flore fizjologiczną człowieka
lub w sprzyjających okolicznościach mogą być czynnikiem etiologicznym niektórych schorzeń.
Takie gatunki jak S. auricularis, capitis, hominis i saccharoliticus wykrywa się tylko u ludzie,
pozostałe występują zarówno u ludzi jaki i u zwierząt

Staphylococcus aureus – ogólna charakterystyka jak wyżej. Ściana komórkowa tych gronkowców
zawiera rybitolowy kwas tejchojowy oraz peptydoglikan zawierający mostki pentaglicynowe
związane z auraminą. Mostki te są wrażliwe na lizostafinę, enzym niszczący ścianę komórkową.
Bakterie rosną na podłożach zwyczajnych w temp. 30-37C, pH 7,0-7,5 (możliwości to 4,2-9,3). Są
względnymi beztlenowcami ale lepiej rosną w warunkach tlenowych. Rosną w obecności 7,5%
NaCl. W bulionie tworzą jednolite zmętnienie i osad. W zależności od składu podłoża i warunków
hodowli (dostęp światła) wytwarzają barwnik /złotawy/. Na agarze z krwią wywołują hemolizę
beta. Bakterie te cechują dużą aktywność biochemiczną, wytwarzają liczne enzymy i toksyny. Są
dość oporne na środki dezynfekcyjne, a w obecności białka mogą przeżyć poza ustrojem wiele
tygodni. W hodowlach w chłodni niektóre szczepy żyją ponad rok. Jest to bakteria odpowiedzialna
za liczne zakażenia u ludzi i zwierząt. Wykorzystują różne patomechanizmy, począwszy od inwazji,
tworzenia ropni po działanie egzotoksyn
Czynniki chorobotwórczości
●
egzotoksyny /toksyny pirogenne/ - wywołują gorączkę, zwiększają przepuszczalność naczyń
i prowadzą do zapaści i wstrząsu
●
enterotoksyny A-F – odpowiedzialne za zatrucie pokarmowe i biegunki, toksyna-1 zespołu
wstrząsu toksycznego (TSST), podobna do enterotoksyny
●
F-powoduję gorączkę niewydolność wielonarządową i wstrząs
●
toksyny epidermolityczne ( eksfoliatywne – rozpuszczają warstwę skóry powoduję utratę
naskórka)
●
hemolizyny alfa, beta, gama, delta - niszczą erytrocyty /liza/ oraz tkanki /hemolizyna alfa/
●
białko A – wiąże region Fc IgG uniemożliwiają wiązanie przeciwciał do komórki bakterii
hamując opsonizację i fagocytozę, a po dostaniu się do krwi kompleks ten jak i odsłonięty
peptydoglikan mogą aktywować komplement
-enzymy :
●
Koagulaza – ścina osocze ludzkie i królicze
●
Clumping factor/czynnik zlepiania/ - ścina fibrynogen
●
Katalaza
●
Inne: beta laktamaza, fibrynolizyna, DNAaza, fosfolipaza, hialuronidaza, proteinazy, lipazy
i inne
Patogeneza i epidemiologia:
●
S. ureus najczęściej kolonizuje skórę i błony śluzowe / u 30-40% zdrowych /, a nozdrza są
najczęstszym miejscem lokalizacji. Regularnie znajdują się w otoczeniu człowieka, na
ubraniu, bieliźnie i innych przedmiotach

●
jest to bakteria o względnej odporności na chemioterapeutyki
●
połączenie czynników inwazyjności sprzyja zakażeniu i rozprzestrzenianiu się bakterii i jest
uzależniony od proporcjonalnego udziału.
●
zakażenie przenosi się najczęściej z człowieka na człowieka. Głównym źródłem zakażenia
jest chory człowiek lub bezobjawowy nosiciel
●
źródłem zatruć pokarmowych jest zakażona żywność najczęściej przez personel
przygotowujący posiłki
Diagnostyka:
1. Objawy chorobowe:
●
zakażenia skóry:
-liszajec, zapalenie mieszków włosowych, czyrak, jęczmień, ropnie i czyraki mnogie
●
zakażenia głębokie
-zapalenia kości i szpiku, zapalenia stawów
-zapalenia płuc, opłucnej, oskrzeli
-zapalenia wsierdzia
-zapalenia górnych dróg oddechowych i innych narządów / nos, zatoki, gardło,
migdałki, krtań, ucho, oko/
●
zapalenie i ropnie narządów wewnętrznych / wątroba, mózg, nerki, układ moczowo-
płciowy, zapalenie jelit/
●
bakteriemie i posocznice
●
choroby wywołane przez toksyny bakteryjne:
-gronkowcowe złuszczające zapalenie skóry (Staphyloccocus skaled skin syndrom –
SSSS).
-liszajec pęcherzykowy
-płonica gronkowcowa
-gronkowcowe zatrucie pokarmowe
-zespół wstrząsu toksycznego (toxic Srock syndrom –TSS)
2. Badanie mikrobiologiczne
●
materiał do badań: wymazy, ropa, krew, mocz, płyn MR, bioptaty, tkanka sekcyjna,
nasienie, kał i inne
●
preparaty barwione metoda Grama – Gram + dodatnie ziarniaki, układające się różnie,
niekiedy w grona
●
hodowla: gronkowce rosną na podłożach zwykłych i wzbogaconych. Na agarze
wyrastają kolonie wypukłe, gładkie i okrągłe o kolorze żółtym lub złocistym. Materiał
najczęściej wysiewa się na agarze z krwią, podłoża wybiórczo-różnicujące Chapmana,
Zebovitza, Bairda-Parkera. Na agarze z krwią tworzą hemolizynę typu beta, na p.
Chapmana rozkładają Manitol zakwaszają podłoże, które zmienia kolor na żółty. Na
podłożu Zebovitza kolonie zabarwiają się na czarno. Ostatnio wykorzystuję się podłoża
chromogenie, na których S. ureus barwi się na niebiesko

●
testy biochemiczne:
-Szereg biochemiczny API
-Próba na obecność koagulaty – próba na obecność clumping factor
-Wykrywanie DNA-azy
-Wykrywanie innych enzymów /hemolizyny, leukocydyny, hialuronidazy, fosfatazy,
żelatynazy, fibrynolizyny, lipazy/
●
próby biologiczne / wykrywanie enterotoksyn i ich właściwości letalnych i
dermonekrotycznych/
Zapobieganie i leczenie
●
Profilaktyka nieswoista
-szczepionki nieswoiste: Broncho-Vaxom, Luiviae, Polyvaccinum
-likwidacja nosicielstwa /mupirocyna/
-rozsądne i ograniczone stosowanie antybiotyków
-zarządzanie organizacyjne /szpitale i inne placówki służby zdrowia/ zapobiegające
zakażeniom szpitalnym
-higiena osobista, rodzinna „ w domu i zagrodzie”, zdrowy rozsądek w życiu
codziennym
●
Leczenie
-problem leczenia antybiotykami betalaktamowymi z powodu wytwarzania betalaktamaz
/90% szczepów/
-problem metycylinooporności / brak skuteczności penicylin, penicylin z inhibitorami,
cefalosporyn i karbapenemów, a niekiedy w ślad za tym wielooporności – takie szczepy
zaliczane są do tzw. Patogenów alarmowych
-pojawiające się w świecie problemy wankomycynooporności lub np. u nas na tolerancje na
wankomycynę
Gronkowce koagulozo ujemne / coagulase negative staphylococci – CSN/
Charakterystyka ogólna
Zalicza się do nich gronkowce tzw. Koagulozo ujemne, oporne na nowobiacynę /grupa S.
saprophyticus i S. sciuri/ lub wrażliwe na novobiacynę / grupa S. epidermidis i pozostałe grupy/.
Niektóre z nich występują tylko u ludzi /S. auricularis, capitis, hominis, saccharolyticus/, u ludzi i
zwierząt /S. epidermidis, haemolyticus, simulans, werneri, cohni, saprophyticus, xylosus, pulveri/.
Takie gatunki jak : S. capre, xylosus, arlette, equorum, galiranum, lentu, sciuri występowały
początkowo tylko u zwierząt, ale później były izolowane u ludzi z bakteriemią, zapaleniem
wsierdzia, zakażeniem ran, dróg oddechowych i moczowych lub zatruciach pokarmowych. Bakterie
te kolonizują najczęściej skórę i jej przydatki /broda, włosy/ 10-12 gatunków, niekiedy jednocześnie
obok siebie. Kolonizacja czasowa lub stała poprzedza rozwój zakażenia u grup ryzyka. Źródłem
endogennych zakażeń gronkowcowych u ludzi jest skóra, jama ustna, nos, drogi moczowo-płciowe
i przewód pokarmowy. Rzadziej występują zakażenia egzogenne krzyżowe / pomiędzy pacjentami
lub personelem/ lub drogą kropelkową, pośrednią przez przedmioty itp.

S. saprophyticus
Oporny na novobiocyne, wykazuje tropizm do błony śluzowej dróg moczowo-płciowych u ludzi.
Za zjadliwość tej bakterii odpowiadają fimbrie i struktury podobne do fimbrii odpowiadające za
adhezję, struktury ściany kom. Tj. kwas lipotejchojowy i białko wiążące fibronektynę o
właściwościach hemaglutyniny aglutynującej krwinki czerwone tylko barana, inne miejsca wiążące
fibronektynę co sprzyja adhezji do śródbłonka. Ponadto bakterie te wytwarzają ureazę, która
uszkadza nabłonek dróg moczowych oraz posiadają hemaglutyninę – lektynę, wykazującą adhezję
do receptorów erytrocytów grupy krwi A i AB – stąd u pacjentów z tymi grupami krwi 80%
zakażeń wywołuje S. saprophyticus
S. epidermis i inne bakterie tej grupy wrażliwej na novobiocynę / S. haemolyticus, hominis,
simulans, capitis/ są izolowane z różnych próbek od pacjentów hospitalizowanych. Obserwuje się
wzrost tych bakterii w zakażeniach szpitalnych. Często są izolowane od pacjentów z bakteriemia
lub posocznicą, zapaleniem wsierdzia, mogą wywoływać zakażenia ran, dróg oddechowych,
moczowych, kości i szpiku. Opon MR, i inne. Bakterie te dysponują następującymi czynnikami
zjadliwości:
●
adhezyny, hemaglutyniny, otoczki
●
struktury wiążące białka, białka wiążące transferynę
●
peptydoglikan i kwas tejchojowy /indukcja TNF alfa, IL 1B, IL6/
●
ureazy, protezę, hemolizynę i DNAaza
Zakażenie występuje u pacjentów z czynnikami predysponującymi:
●
narkomani dożylni zażywający głównie heroinę
●
wrodzone lub nabyte niedobory immunologiczne /wcześniaki, neutropenia po cytostatykach
lub immunosupresji, białaczki i nowotwory/
●
szczególna wrażliwość po wszczepieniu ciał obcych /polimery cewnikowe, endoprotezy,
zastawki naczyniowe i serca, protezy itp. Polimer – associated staphylooccal infections –
PASI)
Rozpoznanie:
1. Obajwy kliniczne zakażenia podejrzanego o etiologiczny czynnik gronkowcowy, głównie
zakażenia u pacjentów z grup ryzyka
2. Badanie mikrobiologiczne:
●
materiał do badań: wymazy, zeskrobiny, krew, mocz, inne wydzieliny ustrojowe, płyn
MR, ropa, plwocina
●
preparat bezpośrednim. Grama – ziarniaki GRAM DODATNIE
●
hodowla: Podłoża zwykłe i wzbogacone /np. agar z krwią/, kolonie gładkie, wypukłe,
nieprzejrzyste, o równym brzegu, białawe, na agarze z krwią nie wytwarzają
hemolizyny; Podłoże Chapmana – nie rozkładają mannitolu / podłoże różowe/
●
odczyny biochemiczne:
-Próba na katalazę-dodatnia
-Próby na kogulazę i CF – ujemne
-Testy API lub ATB takie jak dla S.aureus

-Sporadycznie w rutynowej diagnostyce inne testy wykrywające w/w. enzymy
Zapobieganie i leczenie
●
zasady profilaktyki nieswoistej identyczne jak dla S.aureus
●
szczepionka nieswoista Polyvaccinum zawiera . In. S. Saprophyticus
●
bakterie są wrażliwe lub oporne na leki zalecane dla ziarniaków
●
podobnie jak u S. ureus tak i w tej grupie bakterii istnieje problem betalaktamaz, oporności
na glukopeptydy /niektóre gatunki już nabyły tę cechę/ oraz oporności na metycylinę i
wielooporności
Rodzaj Streptocoocus
Ogólna charakterystyka:
Są to bakterie G+, ziarniaki katalazo dodatnie, układające się w preparacie pojedynczo, podwójnie,
w łańcuszki /paciorki/, względnie beztlenowe, a niektóre ściśle beztlenowe. Wg.Lancefield można
podzielić na podstawie obecności cukru C w ścianie komórkowej. Na tej podstawie można zaliczyć
je do którejś z grup od A do R. Dla ludzi chorobotwórcze są paciorkowce należące do grup A, B, C,
D i G. Bakterie z poszczególnych grup można typować dalej na podstawie różnic antygenowych
ściany komórkowej (białko M, R i T). Poszczególne typy można różnicować na podstawie
hemolizy /alfa, beta i gamma/, zdolności do wzrostu w 6,5% NaCl, wrażliwości na bacytracynę,
optochine oraz żółć. Rosną dobrze na agarze z krwią, niektóre na zwykłym agarze, w bulionie w
postaci osadu. W grupie tej występują bakterie saprofityczne, względnie chorobotwórcze i
wywołujące ciężkie zakażenia. Praktycznie rodzaj ten podzielono na:
●
paciorkowce ropotwórcze ( gr.A, B, C i S.pneumoniae)
●
paciorkowce jamy ustnej (gr. Viridans)
●
paciorkowce o zwiększonych wymaganiach odżywczych
Sterptococcus pyogenes (paciokowiec zaliczany do grupy A)
Bakteria okrągła o średnicy 0,8 mikrometrów, zaliczana do paciorkowców ropotwórczych, na
agarze z krwią wywołuje hemolizę beta. Nie rośnie na podłożach zwykłych. Wyróżnia się 80 typów
serologicznych /białko M/. bakterie są wrażliwe na bacytracynę ale nie rosną na 6,5% NaCl, w żółci
i nie są wrażliwe na optochinę. Wywołują ropne zakażenia różnych narządów i tkanek. Są mało
wrażliwe na wysuszenie i wrażliwe na środki dezynfekcyjne.
I. Czynniki chorobotwórczości
a) białka
●
białko M- ma właściwości anyfagocytarne i antykomplementarne działa cytotoksycznie na
neutrofile, silnie immunogennie
●
białko F- wiąże fibronektynę, jest czynnikiem adhezyjnym, który łącznie z białkiem M
wiąże paciorkowce z komórkami nabłonkowymi gardła
b) egzotoksyny
●
toksyny erytrogenne wywołujące wysypkę płonniczą
●
egzotoksyna A podobna do TSST-1 odpowiada za objawy ogólne zakażenia, gorączkę

wymioty
●
egzotoksyna B czyli proteaza cysteinowa niszczy tkanki u pacjentów z martwiczym
zapaleniem powięzi
●
toksyna sercowo-wątrobowa
c) hemolizyny
●
streptolizyna O- wywołuje hemolizę typu beta oraz działa toksycznie na leukocyty
●
streptolizyna S- działa hemolitycznie i cytotoksycznie
d) czynniki rozprzestrzeniania /ułatwiają inwazje i rozprzestrzenianie/
●
hialuronidaza, prateinazy streptokinaza, nukleazy- większość ma zdolności immunogenne
Patogeneza i epidemiologia
●
Rezerwuarem paciorkowców ropnych są ludzie /zdrowi, nosiciele zarazków w j.ustnej i
gardle, ozdrowieńcy, chorzy/
●
Zakażenie szerzy się drogą kropelkową i pyłową, rzadziej przez przedmioty i żywność / a
tutaj głównie mleko/
●
Częstość zakażeń uwarunkowana jest różnorodnością typów serologicznych i możliwością
wielokrotnych zakażeń
●
Najczęściej zakażenia występują u dzieci w wieku szkolnym wskutek łatwego kontaktu i
rozprzestrzeniania się zarazka. Wspomaga zakażenie również i to, że większość
paciorkowców przeżywa w gardle nawet po 3-4 dniach leczenia.
Diagnostyka
1. Objawy kliniczne chorób takich jak:
●
ropne zapalenie tkanek i narządów /pierwotne i wtórne/
●
zapalenie gardła i angina paciorkowcowa
●
zapalenie ucha środkowego, zatok, wyrostka sutkowego
●
ropne zapalenie skóry i liszajec
●
róża, cellulitis, niesztowica
●
gorączka połogowa i posocznica
●
martwicze zapalenie powięzi, zapalenie płuc
●
następstwa nieropne:
-gorączka reumatyczna
-rumień guzowaty
-ostre paciorkowcowe zapalenie kłębków nerkowych
2. Badanie mikrobiologiczne:
●
materiał do badania: wymazy, ropa, krew, zeskrobiny, bioptaty i inne
●
preparat bezpośredni met. Grama: krótkie lub długie łańcuszki ziarniaków G+
●
hodowla na agarze z krwią - kolonie okrągłe o średnicy 0,5-0,2 mm, przezroczyste
otoczone pasem hemolizy beta, mogą być matowe błyszczące lub śluzowe.

●
testy biochemiczne- API 20 STREPT, Rapid ID 32 Strept
●
test przydatności grupowej:
●
precypitacji z wielocukrem C izolowanym w pracowni + surowice A,B,C,D,F,Glub
gotowy zestaw Slidex Strepto- Kit
●
immunofluorescencji bezpośredniej z bakteriami w preparatach wykonanych z materiału
od chorego lub hodowli
●
test wrażliwości na bacytracynę /100% S.pyogenes jest wrażliwych/krążek z
bacytracyną o stężeniu 0,2-0,4 mikrograma/ ml i strefa zahamowania powyżej 15 mm.
●
testy serologiczne:
-określenie miana ASO
-odczyny skórne: Dicków, Schulca-Charltona
Zapobieganie i leczenie
●
profilaktyka nieswoista; wykrywanie źródeł zakażeń, hospitalizacja i/lub izolacja chorych na
płonnice, wykrywanie nosicielstwa, odsuwanie zakażonych od pracy w warunkach
szczególnych, ochrona żywności głównie mleka
●
istnieją poliwalentne szczepionki zawierające m.in S.pyogenes np: Luivac, Ribomucyl,
Bronch-Vaxom i IRS 19 /te zawierają Streptococcus sp./ które znalazły zastosowanie w
profilaktyce zakażeń układu oddechowego.
●
profilaktyka zakażeń zapobiega występowaniu powikłań /np. zapalenia ucha, nerek i nnych/
powstawaniu chorób autoalergicznych /ch. reumatyczna, zap. kłębków nerkowych/ oraz
występowaniu posocznic
●
Lekiem z wyboru jest penicylina / brak oporności jeszcze/ lub makrolidy, linkomycyna
ewentualnie cefalosopryny w przypadku uczulenia na PNC
●
prawidłowe i dość długie leczenie zakażeń PNC np. angin, zapaleń
Streptococcus agalacticae
paciorkowce zaliczane do grupy B. komórki nieco większe /0,4-1,2 mikrometrów/ od poprzednich,
układają się w długie łańcuszki. najczęściej na agarze z krwią wywołują hemolizę beta ale mogą
również alfa i gamma. Wyróżniono 5 typów serologicznych. Rezerwuarem jest bydło /zap. wymion
u krów/ inne zwierzęta domowe i chory człowiek. U ludzi wywołują zakażenia błon płodowych i
poronienia, zapalenia opon mózgowo-rdzeniowych u niemowląt i dzieci, zakażenia układu
moczowego, zapalenie wsierdzia, płuc i otrzewnej, zakażenia szpitalne. Najciężej przebiegają
wczesne zakażenia u noworodków /do 5 dnia po urodzeniu/ bardzo często z posocznicą i zgonem
dziecka.
Streptococcus equi
zaliczany do grupy C. Bakterie mogą występować w mikroflorze skóry, gardła, pochwy. Wywołują
zakażenia ran, tkanki łącznej, zapalenie wsierdzia, posocznice połogowe i inne zakażenia.
Najczęściej chorują ludzie z obniżoną odpornością, z nowotworami, niedożywieni i po zabiegach
operacyjnych.
Streptococcus pneumoniae
bakterie mają kształt dwoinek podobnych do płomyków świecy, czasami układają się w krótkie
łańcuszki. Średnica komórek 0,5-1,2 mikrometrów, wytwarzają otoczki, barwią się G+, rosną na

podłożach wzbogaconych /agar z krwią, bulion pneumokokowy/. Na agarze z krwią wywołują
hemolizę alfa, są wrażliwe na żółć i optochinę/ cechy różnicujące/
Czynniki chorobotwórczości
●
otoczka polisacharydowa- posiada właściwości antyfagocytarne. Tylko typy otoczkowe są
patogenne- 84 typy serologiczne.
●
proteaza IgA inaktywuje przeciwciała wydzielnicze IgA
●
enzymy- hemolizyna, hialuronidaza, leukocydyna, fibrynolizyna
Patogeneza
●
bakteria jest patogenem tylko u ludzi brak rezerwuarów zwierzęcych
●
zakażenie przenosi się drogą kropelkową z człowieka na człowieka
●
ludzie zdrowi są przenosicielami bakterii na błonach śluzowych jamy nosowo-gardłowej
●
zapalenie płuc występuje najczęściej w zachwianiu równowagi biologicznej np. w
przeziębieniu, spadek odporności, ogólne osłabienie po przebytych chorobach, zabiegach,
chorobach wirusowych / grypa,odra/ utrata czynności śledziony.
Diagnostyka
1. Objawy kliniczne
●
zapalenie płuc, oskrzeli, opłucnej
●
zapalenie ucha środkowego, zapalenie zatok
●
zapalenie opon mózgowo-rdzeniowych
●
zapalenie rogówki, stawów, otrzewnej i inne zakażenia
2. Badanie mikrobiologiczne
●
materiał do badania: plowcina , popłuczyny drzewa oskrzelowego, wymazy, płyn m-
rdzeniowy, krew, bioptaty, płyn opłucnowy, otrzewnowy i inne.
●
preparat mikroskopowy met. Gramma: dwoinki G+, m. pozytywno-negatywną lub
specjalna na otoczki-otoczki
●
hodowla- agar z krwią, bulion pneumokokowy Picka
●
testy biochemiczne:
-rozpuszczalność w żółci-pneumokoki się rozpuszczają
-wrażliwość na optochinę- zahamowanie wzrostu
●
testy serologiczne:
- test pęcznienia otoczek
-test lateksowy w diagnostyce zapalenia opon m-rdzeniowych
- wykrywanie sekwencji DNA
Zapobieganie
●
profilaktyka nieswoista- eliminacja nosicieli
●
u pacjentów z grup ryzyka można zastosować szczepinkę poliwalentną zawierającą 23 typy
serologiczne otoczek polisacharydowych / Pneumovax/ ale mała jej immunogenność lub
nieswoistą poliwalentną IRS 19 gdzie S. pneumoniae jest jednym ze składników

●
dotychczasowa wrażliwość na penicylinę zmienia się na oporność, izoluje się szczepy
wysoce oporne
●
wykorzystuje się 3 generację cefalosporyn a w wysokiej oporności na PNC z wyboru
stosuje się wankomycynę, niekiedy z rimfampicynąw zapaleniu opon m-rdzeniowych
●
pojawia się również oporność na inne antybiotyki makrolidy, biseptol, fluorochinolony,
tetracykline, chloramfenikol
Rodzaj Enterococcus
Charakterystyka ogólna
w latach 80 ubiegłego wieku z rodziny paciorkowców /była to grupa serologiczna D wg.
Lancefield/ wyodrębniono rodzaj Enterococcus. Jeszcze do niedawna bakterie te uważano za
względnie chorobotwórcze, a najczęstszą postacią zakażenia było podostre zapalenie wsierdzia.
Aktualnie wśród zidentyfikowanych 20 gatunków, tylko 2 są odpowiedzialne za zakażenia u ludzi.
Dominuje E.faecalis /80-90% izolatów klinicznych/ oraz E.faecium /10-15% izolatów/. około 5%
zakażeń uludzi wywołują takie gatunki jak: E.gallnarum, E.casseliflavus, E.durans, E.avium,
E.raffinosus. Są to ziarniaki G+, mają ok 1,2 mikrometrów średnicy, rosną na podłożach zwykłych
w obecności 6,5% NaCl, rozkładają eskulinę w obecności żółci, dają dodatni test
PYR(aryloamidaza pyrolidynowa).
Czynniki chorobotwórczości
●
cytolizyna o właściwościach hemolizyny, hemolizuje krwinki zwierząt, działa toksycznie na
komórki, nasila objawy zapalenia jako bakteriocyna wskazuje aktywność przeciwko
bakteriom G+
●
substancja agergującą będąca białkiem powierzchniowym ułatwia łączenie się bakterii w
pary podczas koniugacji, pośredniczy w adhezji bakterii do różnych komórek, zapewnia
przeżycie w ludzkich leukocytach wielojądrzastych. z cytolizyną znacznie zwiększa
śmiertelność w eksperymentalnym endocarditis. może prowadzić do destrukcji mięśnia
sercowego i płuc
●
żelatynaza hydrolizuje kolagen, hemoglobinę, kazeinę, żelatynę występuje w dużych
ilościach u szczepów wywołujących endocarditis
●
hialuronidaza degraduje mukoplisacharydy tkanki łącznej i chrzęstnej, może wpływać na
rozprzestrzenianie się bakterii
●
pozakomórkowe nadtlenki wytwarzane podczas bakteriemii przez szczepy inwazyjne
/najczęściej przez E.faecalis E.faecium/
●
zewnątrzkomórkowe białka powierzchniowe, zwiększają przyleganie bakterii do komórek
mięśnia sercowego oraz pozwalają bakterii uniknąć odpowiedzi immunologicznej
Patogeneza i epidemiologia
●
naturalnym rezerwuarem podstawowych gatunków enterokoków jest przewód pokarmowy
●
zakażenia występuja najczęściej u osób z upośledzoną odpornością lub u osób z ciężkimi
schorzeniami
●
zakażenia endogenne u ludzi dotyczą najczęściej dróg moczowych osób hospitalizowanych

●
bakterie te dość często zanieczyszczają środowisko szpitalne stając się czynnikiem
etiologicznym zakażeń szpitalnych? najczęściej szczepy wielooporne/
●
zakażenia endogenne w szpitalu przenoszą się poprzez ręce od pacjenta do pacjenta lub
poprzez personel szpitalny
●
enterokoki charakteryzuje wrodzona oporność na liczne antybiotyki: cefalosporyny,
linkoamidy, aminoglikozydy, polimyksyny.Narasta oporność na glikopeptydy.
Rozpoznanie
1. Objawy kliniczne schorzeń takich jak:
●
bakteryjne zapalenie wsierdzia
●
zakażenie układu moczowego
●
zakażenie skóry i tkanek miękkich, ran
●
zakażenia jamy brzusznej /zap.otrzewnej, ropnie/
●
zakażenia ginekologiczne
●
zapalenie opon m-rdzeniowych u noworodków
●
zakażenia wszczepów i protez
●
bakteriemia
2. Badanie mikrobiologiczne:
●
materiał do badań: wymazy, ropa, płyn m-rdzeniowy i inne
●
preparat mikroskopowy barwiony met. Grama- ziarniaki układające się niekiedy w pary,
krótkie paciorki/łańcuszki/
●
hodowla:
-na agarze z krwią wytwarzają kolonie szarobiałe drobne ale większe od
paciorkowców ropnych z hemolizą alfa, beta lub gamma
-agar cocco-drobne gładkie kolonie na czarnym tle /zmiana zabarwienia podłoża/
-inne cechy hodowli: wytrzymują temp. 60 st.C przez 60 min rosną przy pH 9,6; w
podłożach zawierających 6,5% NaCl; 0,1% błękitu met; 40% żółci; 0,1% telluryn
potasu; oraz temp. 10 st.C i 45 st.C
●
testy Api 20 Strep, Api Rapid Strep
Zapobieganie i leczenie
●
profilaktyka nieswoista, swoistej brak. Reżim sanitarny i kontrola zakażeń szpitalnych
●
odpowiednia polityka lekowa w leczeniu różnych zakażeń w oddziałach szpitalnych
●
szczególna troska o chorych z obniżoną odpornością
●
bakterie mają zróżnicowaną oporność na wiele antybiotyków- od niskiej po wysoką
●
niepokój budzi oporność na glikopeptydy/wankomycyna, telkoplanina/

Ziarniaki Gram-ujemne.
Rodzaj Neisseria
Charakterystyka ogólna
Do rodziny należą dwa gatunki chorobotwórcze: N. meningitidis i gonorrhoea oraz kilka gatunków
niepatogennych(N.sicca, subflava, mucosa i in.) Bakterie G- o średnicy 0,6-1,0 mikrometra, maja
kształt podobnych do ziarenek kawy, często występują jako dwoinki. Rosną w warunkach
tlenowych lub względnie beztlenowych, maja duże wymagania odżywcze. Mało aktywne
biochemicznie, wytwarzają katalazę i oksydazę cytochromowa. Są pasożytami błon śluzowych
ludzi i zwierząt.
Neisseria gonorrhea
Charakterystyka ogólna
Owalne komórki o średnicy 0,6-0,8 mikrometra, podobne do ziarenek kawy, układają się parami,
nie wytwarzają otoczek, nie posiadają rzęsek ani przetrwalników. Barwią się Gram-, są bardzo
wybredne pod względem zapotrzebowania na substancje odżywcze. Lepiej rosną w obecności 5-
10% CO2. Na podstawie białek zew. Błony cytoplazmatycznej zdefiniowano 16 serotypów, a na
podstawie wymagań wzrostowych 30 auksotypów.
Czynniki chorobotwórczości
●
fimbrie - przyleganie do komórek gospodarza,
●
zewnętrzne białka błonowe:
- odpowiadają za odporność na surowice, inwazyjność i rozprzestrzenianie się zakażenia
-zwane z białkami Opa umożliwiają przyleganie do komórek błon śluzowych oraz chronią je
przed fagocytoza,
●
otoczka - umożliwia wewnątrzkomórkowe przeżycie bakterii,
●
endotoksyna - wpływa na rozprzestrzenianie zakażenia,
●
peptydoglikan - działa prozapalnie,
●
enzymy:
-proteaza IgA- chroni bakterie przed wydzielnicza Iga na powierzchni błon
śluzowych,
-beta-laktamaza- unieczynnia penicyliny,
●
Unikanie bakteriobójczego wpływu przeciwciał w obecności dopełniacza oraz
przeciwdziała niepełnej aktywacji dopełniacza
●
Zmienność antygenowa poprzez różnorodność struktur fimbrii oraz białek Opa, wiele
serotypow i słaba immunogenność,
●
Unikanie działania fagocytów i przeciwciał poprzez wnikanie do komórek śródbłonka.
Patogeneza i epidemiologia
●
Bakterie są przekazywane z człowieka na człowieka(stosunek płciowy, podczas porodu)
rzadziej przez przedmioty.
●
N.gonorrhea wnika i przylega do Komorek nabłonkowych cewki moczowej, dróg
płciowych, odbytu i gardła.

●
Bakterie po wniknięciu do komórek nabłonka penetrują do przestrzeni podnabłonkowej
powodując ropne zakażenia
●
Z miejsca inwazji np. cewki bakterie droga bezpośredniego kontaktu mogą zakażać cały
układ moczowo-płciowy zarówno u kobiet jak i mężczyzn
●
Sporadycznie dochodzi do bakteriemii i zakażeń odległych
●
w 40% przypadków u mężczyźni w 90% u kobiet zakażenia są bezobjawowe, często
nierozpoznawalne co sprzyja rozprzestrzenianiu się schorzenia
●
Grupami ryzyka są nastolatki, mężczyźni homoseksualni oraz dorośli mężczyźni do 25 roku
życia.
Rozpoznanie
1. Objawy kliniczne takich chorób jak:
●
zapalenie cewki moczowej
●
zapalenie szyjki macicy
●
zapalenie w obrębie miednicy z powikłaniami : u kobiet pod postacią zap.
przydatków, otrzewnej, ciąży pozamacicznej, bezpłodności, a u mężczyzn pod
postacią zap. prostaty, jader,
●
zapalenia odbytu i odbytnicy,
●
zakażenie rozsiane(zap. stawów, pochewek ścięgien, wsierdzia, skory, opon m-r,
szpiku kostnego,
●
zapalenie gałki ocznej noworodków,
●
zapalenie gardła,
●
zespol Fitza-Hough i Curtisa-zap. torebki wątroby,
2. Badanie mikrobiologiczne
●
materiał do badania: wydzielina cewki moczowej, wymazy z cewki, szyjki, pochwy,
odbytu, punktaty ze stawów i inne,
●
preparat bezpośredni m. Gram z wydzieliny z cewki moczowej- we wnętrzu
leukocytu Gram- dwoinki,
●
metody tzw. szybkie:
-test immunofluorescencji bezpośredniej, test koaglutynacji
-Gonoenzym- test oparty na odczynie EIA-bezp. Wykrycie gonokoków w
próbkach materiału.
●
hodowla w warunkach 10% CO2; podłoże transportowe”Gonomedium”, agar
czekoladowy, podłoża selekcyjne z antybiotykami(Roiron, Thayera-Martina).Na
podłożach tych można obserwować kolonie 5 typów, najczęściej są to kolonie o
średnicy 1-3 mm, półprzezroczyste, gładkie, okrągłe i lśniące o równych brzegach.
●
próba na oksydazę indofenolowa- po dodaniu do kolonii roztworu dwumetylo-p-
fenylenodwuaminy powstaje początkowo czerwone a następnie brunatne zabarwienie
●
test biochemiczny z cukrami- gonokoki rozkładają tylko glukozę i fermentują
azotany(testy chromogenie, API NH, Rapid ID),
●
serologiczne typowanie szczepów,
●
odczyn wiązania dopełniacza z surowica chorego w przewlekłej
rzeżączce(gonoreakcja) od 3 tyg. Po zakończeniu do 2-3 mies po wyzdrowieniu
●
techniki genetyczne.

Zapobieganie i leczenie
●
wykrywanie źródeł zakażenia
●
unikanie przypadkowych kontaktów seksualnych
●
prowadzenie oświaty zdrowotnej
●
zwalczanie prostytucji i alkoholizmu,okresowe kontrole i leczenie osób uprawiających
prostytucje
●
leczenie osób zakażonych i profilaktyka antybiotykowa osób z kontaktu
●
w leczeniu rzeżączki niepowikłanej stosuje się np. ceftriakson, cefiksym lub
fluorochinolony w pojedynczej dawce
●
chorzy z powikłaniami muszą być leczenia do ustąpienia objawów a przy rozpoznaniu
zakażenia rozsianego powinni być leczeni w warunkach szpitalnych.
Neisseria meningitidis
Charakterystyka ogólna
Bakterie o nerkowatym kształcie, średnicy 0,6-1,0 mikrometra, układające się parami, wytwarzają
otoczki, posiadają rzęski, tlenowce, oksydazo-dodatnie, rosną na podłożach wzbogaconych(agar
czekoladowy wzbogacony skrobia) w atmosferze CO2. Na podstawie różnic antygenowych w
polisacharydach otoczki bakterie są podzielone na 9 grup serologicznych -A,B,C,X,Y,Z,29c I W-
135. Grupy serologiczne A i B dzielą się na serotypy. Szeroko rozpowszechnione są grupy A,B,C i
Y i one są najczęściej czynnikami patogennymi u człowieka. Najczęściej izolowanym jest serotyp
2 grupy serologicznej B i C. Bakterie bardzo wrażliwe na warunki środowiskowe.
Czynniki chorobotwórczości
●
fimbrie- umożliwiają przyleganie do śluzówki jamy ustnej i gardła oraz do tkanek opon m-r,
●
otoczka chroni bakterie przed fagocytoza,
●
proteazy IgA rozcinają IgA w regionie zawiasowym,
●
lipopolisacharyd (LPS) o cechach endotoksyny- jest zdecydowanie bardziej aktywna
biologicznie od endotoksyn innych bakterii.
Patogeneza i epidemiologia
●
zakażenie przenosi się droga kropelkowa, po ekspozycji bakterie przylegają do komórek
nabłonka nosa i gardła,
●
wydzielina dróg oddechowych osób zakażonych jest wysoce zakaźna, a izolacja bakterii od
osób z otoczenia chorych jest kilka razy częstsza niż w populacji ogólnej,
●
po ekspozycji bakterie wnikają do komórek nabłonka górnych dróg oddechowych,
rozprzestrzeniają się droga krwi, docierają do opon m-r jako miejsca docelowego,
rozmnażają powodując zapalenie
●
nosicielstwo w jamie nosowo-gardłowej bywa bezobjawowe i wynosi na obszarach

epidemicznych do 95%, podczas gdy w normalnej populacji nieepidemicznej wynosi 20%
populacji.
Rozpoznanie
1. Objawy kliniczne następujących stanów chorobowych:
●
choroba gorączkowa ustępująca najczęściej samoistnie,
●
zapalenie opon m-r;
●
posocznica meningokokowi i wstrząs septyczny
●
zespół Waterhouse’a-Ffriderichsena- piorunująca posocznica z zapaleniem m.
sercowego i krwotocznym zap. nadnerczy
●
przewlekła posocznica meningokokowi z niewielka gorączką, bolami stawów i
zmianami skórnymi
●
hipotensja, uszkodzenie wielonarządowe,
●
zap. gardła, płuc, cewki moczowej.
2. Badania mikrobiologiczne:
●
materiał do badania; plyn m-r, krew, wymazy z nosa, gardła, wydzielina z jamy nosowo-
gardłowej
●
preparat bezpośredni metoda Grama- dwoinki Gram- wewnątrz leukocytów
●
test immunofluorescencji z osadem płynu m-r
●
testy szybkiej diagnostyki
-lateksowy wykrywający bakterie w płynie m-r
-serologiczne(DIF,LA,CIE,koagulacja) wykrywające antygeny otoczek
polisacharydowych w płynie m-r, moczu lub krwi
●
hodowla;
-Meningomedium”-gotowe podłoże do posiewu płynu m-r lub
-podłoże płynne(wyciąg mózgowo-sercowy, bulion z surowica)
-agar czekoladowy, p. Lófflera, agar z krwią- kolonie okrągłe, gładkie, wilgotne,
błyszczące o średnicy 1-3 mm, bez strefy hemolizy na agarze z krwią
●
testy biochemiczne(API NH)- mała aktywność, bezgazowy rozkład maltozy i glukozy
●
test aglutynacji z surowica chorego- mała wartość diagnostyczna
●
określenie typu serologicznego wyhodowanego drobnoustroju z typowo swoistymi
surowicami
●
wykrywanie nosicieli(wymazy lub wydzielina z jamy nosowo-gardłowej)
Zapobieganie i leczenie
●
profilaktyka nieswoista, szczególnie w okresach epidemicznych oraz swoista, dostępna

szczepionka uzyskana z otoczek polisacharydowych szczepów A i C , W-135
●
w zapobieganiu zakażeniom szczególne znaczenie ma zwalczanie nosicielstwa
●
u osób z bezpośredniego kontaktu wskazane jest podawanie profilaktycznie
cyprofloksacyny i ryfampicyny
●
w leczeniu stosuje się dożylnie duże dawki penicyliny, ceftriakson i inne cefalosporyny III
generacji. Przy wyborze leku należy uwzględnić wrażliwość dwoinek na antybiotyki i
stopień penetracji do antybiotyku do płynu m-r.
Laseczki
Rodzaj Bacillus
Charakterystyka ogólna: Gram dodatnie przetrwalnikujące i tworzące owalne spory w środku
komórki, tlenowe laseczki, (klinicznie czarno zabarwiony strup) o wymiarach 1-1,5 μm grubości 5-
10 μm długości. Rodzaj zaiwiera 48 poznanych gatunków. Najbardziej chorobotwórczy dla
człowieka jest B.anthracis, inne jak B.cereus, są zdecydowanie mniej wirulentne w porównaniu do
poprzedniej. Saprofity to B.myeoides, B.mesentericum, B.megaterium. Większość tych bakterii
występuje w wodzie, glebie np B.stearothermophilus, B.subtilis i przejściowo w organizmach
zwierząt np B.coagulans, B.cireulans, B.pumilus i inne. Poza człowiekiem niektóre laseczki są
patogenne dla owadów, sporadycznie dla zwierząt. Rosną dobrze na podłożach prostych stałych i
płynnych B.anthracis w logarytmicznej fazie wzrostu produkuje proteazy wykrywane na agarze z
kazeiną. Wszystkie wytwarzają katalazę, większość posiada rzęski, niektóre wytwarzają otoczki.
Bacillus anthracis
Cechy charakterystyczne jak wyżej. Jest to największa laseczka tego rodzaju. W preparatach
mikroskopowych układa się pojedynczo, w krótkie łańcuszki lub „kije bambusowe”. W hodowlach
sztucznych wytwarzają przetrwalniki dające się barwić metodą Muellera lub Ziehla-Neelsena.
Formy wegetatywne są mało odporne na warunki zewnętrzne, wysokie temperatury i czynniki
dezynekcyjne, formy przetrwalnikowe natomiast wytrzymują tem 150˚C do kilkudziesięciu minut,
a wysuszone żyją kilkadziesiąt lat.
Czynniki chorobotwórczości
- toksyny:
●
czynnik PA (protective antigen), który wiąże się z receptorami komórek a następnie zostaje
rozłożony do dwóch białek będących egzotoksynami i antygenami:
- czynnik LF (lethal factor) niszczący makrofagi,
- czynnik EF (edema factor) czynnik obrzęku,
- otoczka zbudowana z kwasu D-glutaminianowego chroniącego bakterię przed fagocytozą
Epidemiologia
B.anthracis jest zaliczany do tzw patogenów obligatoryjnych. Jego obecność w ekosystemie – gleba
– rośliny – zwierzęta ma związek z patogennością dla zwierząt. Zarazek rozmnaża się w organizmie
zwierz at (najczęściej kozy, owce), a jego spory skażają środowisko. Źródłem zakażenia zwierząt
jest pasza, woda, czasami występują strefy wąglikowe gdzie gleba posiada ogromne ilości tych
bakterii. Zwierzęta mięsożerne oraz owady krwiopijcy też mogą przenosić bakterie. Człowiek
zakaża się przez przewód pokarmowy, drogą oddechową lub kontakt bezpośredni z chorymi
zwierzętami. Do zakażenia od człowieka dochodzi sporadycznie.
Przy zakażeniu inhalacyjnym dawka śmiertelna dla człowieka wynosi 1000 endospor.

Diagnostyka
1. Objawy kliniczne:
●
postać skórna /najczęstrza 95% wszystkich przypadków,
- 2-5 dni po zakażeniu występuje krosta by po dalszych 4-5 dniach wytworzyć czarno
zabarwiony strup otoczony drobnymi pęcherzykami. Obrzęk okolicznych tkanek i
powiększenie węzłów chłonnych. Zmiany znikają po 2-6 tyg.
●
postać jelitowa – nudności wymioty biegunka, wyczerpanie, odwodnienie, niekiedy
wstrząs,
●
postać płucna – zapalenie śródpiersia i zajęcie węzłów chłonnych śródpiersia wysięk do
opłucnej, bóle w klatce piersiowej, kaszel, gorączka dreszcze, wstrząs, śmierć w skutek
toksemii, jako powikłanie krwotoczne zapalenie opon mógowo-rdzeniowych,
bakteriemia, posocznica.
2. Badanie mikrobiologiczne:
●
materiał do badania: ropa, plwocina, kał, krew,
●
preparat mikroskopowy barwiony metodą Grama lub Ziehla Neelsena (długie laseczki
charakterystycznie ułożone, przetrwalniki w centrum bakterii nie zmieniają jej kształtu)
●
hodowla na agarze zwykłym, krwawym- szare kolonie o nieregularnych brzegach z
białawym nalotem i licznymi wypustkami /głowa meduzy/. Na płytce krwawej brak
hemolizy.
●
Cechy biochemiczne API 50 CHB /bio Merieux/
●
próby biologiczne- podanie wyciągu badanego materiału lub hodowli bulionowej
pozajelitowo myszce lub śwince morskiej, padnięcie zwierzęcia po 2-3 dniach, sekcja
zwierząt.
●
Inne metody chromatografia gazowa, użycie przeciwciał monoklonalnych p-ko
antygenowi PA oraz wykorzystanie technik PCR
Profilaktyka i leczenie:
●
profilaktyka nieswoista w regionach zagrożonych; odzież ochronna, maseczki, itp,
niszczenie (palenie) padłych i zakażonych zwierząt,
●
dekontaminacja terenów skażonych przetrwalnikami;
●
profilaktyka swoista podanie szczepionki przeciwwąglikowej – AVA (Anthrax Vacuine
Adsorbed) zawierającej filtrat nieotoczkowego, atenuowanego szczepu B.anthracis gdzie
głównym antygenem ochronnym odpowiadającym za powstanie odporności jest antygen PA
3 dawki w odstępach 2 tygodniowych a następnie po 6,12 i 18 miesiącach.
●
Leczenie- po zakażeniu natychmiastowe podanie antybiotyków /tetracykliny, penicyliny ale
i klindamycyna, rifampicyna, aminoglikozydy, chloramfenikol, cefazolina.
●
U pacjentów z objawami zakażenia zalecana jest kuracja 2-3 podobnie działającymi
antybiotykami ze względu na możliwość oporności na jeden.
Bakterie beztlenowe
Bakterie mogą rozwijać się wyłącznie w warunkach beztlenowych. Nie posiadają cytochromów ani
oksyadazy cytochromowej, nie mogą więc wykorzystywać tleni jako akceptora wodoru. Nie
wytwarzają również katalazy / z wyjątkiem mikroaerofili/ i peroksydazy.
Rodzaj Clostridium
Charakterystyka ogólna
Bakterie Gram dodatnie, dość długie 2-5μm laseczki wytwarzające przetrwalniki, enzymy i toksyny
odpowiedzialne za ich patogenność. Większość z nich posiada rzęski a przetrwalniki układają się w
różny sposób zmieniając kształt komórki, pozwalają niekiedy na identyfikację mikroskopową.
Niektóre ze 100 gatunków (około 40) są izolowane od ludzi wchodząc w skład flory błon
śluzowych różnych narządów, najczęściej przewodu pokarmowego. Inne wywołują ciężkie
zakażenia u ludzi wywołując tężec, zgorzel gazową czy zatrucie jadem kiełbasianym.
Clostridium perifingens
/C.septicum, C.novyi, C.bifermentas, C.histolyticum./
Czynniki chorobotwórczości:
●
egzotoksyny w sumie 12 mające letalne dla zwierząt laboratoryjnych. Najważniejsze to
lecytynaza (toksyna alfa, hydrolizuje lecytynę i sfingomielinę, uszkadza fosfolipidy błony
komórkowej i mitochondrialnej.
●
Enterotoksyna hamuje transport glukozy, powoduje utratę białek i uszkodzenie nabłonka
jelitowego.
Objawy chorobowe:
1. Zakażenia skóry i tkanki podskórnej
●
zakażenia ropne narządów jamy brzusznej,
●
martwicze zapalenia jelit
●
zgorzel gazową

2. Zatrucia pokarmowe (typ A 1 mln bakterii / 1g kału)
Clostridium tetani
Czynniki chorobotwórczości:
●
egzotoksyna:
- tetanospazmina odpowiedzialna za porażenie spastyczne poprzez zwiększone
gromadzenie acetylocholiny na zakończeniach nerwów motorycznych,
- tetanolizyna odpowiedzialna za hemolizę krwinek czerwonych
Objawy chorobowe:
●
tężec
- miejscowy, przyranny
- obejmujący mięśnie głowy, najczęściej w zakresie nerwu VII,
- uogólniony
Clostridium botulinum
Czynniki chorobotwórczości
●
botulina – egzotoksyna, 6 typów serologicznych toksyn /A,B,C,D,E,F/, podobnych do siebie
ale dany szczep wydziela tylko jeden rodzaj toksyny. Blokuje ona funkcje nerwów
motorycznych wskutek zaburzeń syntezy lub uwalniania acetylkocholiny na zakończeniach
nerwowych co prowadzi do porażenia wiotkiego.
Objawy chorobowe:
●
zatrucia pokarmowe
●
botulizm przyranny
●
botulizm niemowląt
Clostridium difficile
Czynniki chorobotwórczości:
●
cytotoksyna A i B powodują śmierć komórek nabłonkowych jelit i odsłonięcie śluzówki,
●
niekontrolowany wzrost w przewodzi pokarmowym opornych na antybiotyki szczepów
C.difficile po leczeniu antybiotykami o szerokim spektrum (np klindamycyna, ampicylina,
cefalosporyny).
Objawy chorobowe:
●
biegunka związana z podawaniem antybiotyków
●
rzekomobłoniaste zapalenie jelit
Epidemiologia
●
Do zakażenia może dojść na drodze endo lub egzogennej. Bakterie C.septicum występują w
macicy kobiet (5%) i po zabiegach oraz poronieniach mogą wywołać objawy chorobowe.
●
Najczęściej do zakażeń dochodzi na drodze egzogennej – zakażone rany, spożycie
skażonego toksynami pokarmu.
●
Niektóre laseczki mogą przebywać jako komensale w dolnym odcinku przewodu
pokarmowego ludzi i zwierząt bez wywoływania objawów chorobowych.
●
C.difficile kolonizuje około 3-5% zdrowych osób, ale bakterie te można wykryć u około
30% chorych w szpitalu.
●
Najbardziej rozpowszechnionym wydaje się być C.botulinum a bakterie tego rodzaju można
znaleźć w wodzie, glebie i kale.

Badanie mikrobiologiczne:
●
materiał do badania: wymazy, bioptaty, tkanka, krew, kał, treść pokarmowa, wymiociny,
produkty żywnościowe,
●
preparat mikroskopowy metodą Grama. Gram dodatnie, czasami ujemne, laseczki
układające się pojedynczo w pary lub łańcuszki. Bakterie wytwarzają przetrwalniki większe
od wymiarów bakterii umieszczone centralnie, terminalnie lub subterminalnie,
●
hodowla- warunki ściśle beztlenowe /metody fizyczne lub chemiczne/. Materiał posiewa się
na agar z krwią, podłoże tioglikolanowo-sojowe, podłoże z polimyksyną, agrar Zeisslera,
Wilson-Blaira. Przed posianiem ogrzewa się materiał do temperatury 80ºC 30-60 min.
Hodowlę prowadzi się przez 2-3 doby. Kolonie poszczególnych gatunków różnią się od
siebie, wszystkie wydzielają przykry zapach.
●
Testy biochemiczne: bakterie można podzielić na sacharolityczne i proteolityczne. W
identyfikacji stosuje się szereg cukrowy, wytwarzanie indolu, wykrywanie żelatynazy,
trawienie mleka, fermentację niektórych cukrów. Są gotowe testy firmowe np API 20 A,
Rapid ID 32,
●
próby serologiczne- pozwalają na wykrywanie toksyn, np botulinowej, tężcowej, toksyny
A,B,C C. difficile.
●
Metoda immunoenzymatyczna ELISA
●
metoda hemaglutynacji pośredniej, aglutynacji lateksowej,
●
elektroforezy w żelu i immunobltingu
●
próby cytotoksyczne na hodowlach komórkowych pozwalające na wykrycie toksyn
C.difficile,
●
próby biologiczne:
- wykrywanie toksyny botulinowej we krwi chorego, w żywności w hodowli bakteryjnej
w wodzie
- wykrywanie toksyny tężcowej
- podawanie C.perifringens, C.novyi, C.histolyticum w udo śwince morskiej i
obserwacja zmian tkankowych,
●
wykrywanie genomu bakteryjnego – PCR, sondy genetyczne
Profilaktyka i leczenie:
●
Profilaktyka nieswoista: odpowiednia oświata sanitarna, zaopatrzenie ran, sterylizacja i
kontrola konserw, odpowiednie przechowywanie żywności, racjonalna antybiotykoterapia.
●
Profilaktyka swoista: podawanie surowicy p-tężcowej, p-botulinowej, p-zgorzeli gazowej,.
Stosowanie szczepień ochronnych przeciwko tężcowi.
●
Lekiem z wyboru jet penicylina a w zakażeniach C.difficile – metronidazol, wankomycyna,
rifampicyna,. Poza podaniem antybiotyków odpowiednie leczenie chirurgiczne ran i urazów
otwartych, leczenie objawowe chorych z objawami zakażenia.
Clostridium tetani barwienie tuszem.
Clostridium difficile barwienie tuszem
Clostridium bifermentas – barwienie metodą Grama

Bakterie beztlenowe nieprzetrwalnikujące.
Znalazły się tutaj bakterie zaliczane do różnych rodzajów bakterii Gram dodatnich lub ujemnych
mających kształt ziarniakowaty, pałeczkowaty lub spiralny. Należą one do flory jamy ustnej, dróg
oddechowych, przewodu pokarmowego i dróg moczowo - płciowych i skóry. W kieszonkach
dziąseł lub jelicie grubym stosunek bakterii beztlenowych do tlenowych wynosi jak 1:1000.
W sprzyjających okolicznościach (upośledzenie mechanizmów obronnych ustroju, zmiany
postępowania diagnostycznego i terapeutycznego, przerwanie ciągłości tkanek, zabiegi
chirurgiczne) dochodzi do zakażeń tymi bakteriami.
Bakterie te biorą udział w zakażeniach stomatologicznych, laryngologicznych, okulistycznych,
zapaleniach żył, ropniach mózgu, zapaleniach otrzewnej i wyrostka robaczkowego, zapaleniach
ginekologicznych, układu moczowo – płciowego i skóry. Zwiększa się systematycznie udział w
zakażeniach pacjentów szpitalnych, zwłaszcza chirurgicznych. Bakteriemie i posocznice najczęściej
występują po zabiegach chirurgicznych w obrębie jamy brzusznej (j.grube) i po zabiegach
ginekologicznych. Bardzo często izoluje się B.fragilis i ziarniaki Gram dodatnie beztlenowe w
infekcyjnym zapaleniu wsierdzia oraz po zabiegach wszczepienia zastawek i protez naczyniowych.
Ziarniaki Gram dodatnie
Bakterie zaliczane do dwóch rodzajów Peptococcus ( P.niger, P.aerogenes, P.asacholyticus,
P.anaeronius) i Peptostreptococcus (P.anaerobius, P.magnus, P.mieros, P.prevotti). Są to bakterie
okrągłe lub owalne o średnicy około 1μm, układające si e pojedynczo, w dwoinki lub małe
łańcuszki. Są izolowane od ludzi zdrowych jak i również z różnych przy chorobowych wyżej
wymienionych.
Ziarniaki Gram ujemne
Występują tutaj gatunki V.parvula, V.dispar, V,atypica. Są to małe gram ujemne do około 0,5μm
ziarniaki rosnące na podłożach wzbogaconych. Występują na błonach śluzowych człowieka i
zwierząt, izolowane s a również w różnych jednostkach chorobowych z innymi bakteriami. Wydaje
się że są one raczej florą towarzyszącą.
Pałeczki Gram dodatnie
Bytują najczęściej na powierzchni ciała lub w przewodzie pokarmowym, drogach m – płciowych u
kobiet. Należą tu rodzaje:
●
Lactobacillus (L.acidophilus, L.fermentum, L.casei) kolonizują przewód pokarmowy i
szczególnie pochwę u kobiet. Bakterie L.acidophilus nazywane są pałeczkami kwasu
mlekowego zakwaszają środowisko pochwy utrzymując jej fizjologiczną mikroflorę, ale
mogą być również izolowane w zapaleniach występujących w obrębie jamy ustnej i innych
zakażeniach u chorych z obniżoną odpornością.
●
Eubacterium (E.brachy, E.timidum, E.nodatum, E.lentum i inne) bakterie izolowane z płytek
nazębnych i/lub poddziąsłowych u ludzi. Bakterie te uczestniczą również w zakażeniach w
obrębie głowy i szyi oraz w ropniach płuc.
●
Propionibacterium (np P.acnes, P.avidum, P.granulosum) bakterir o zdolnościach do
wytwarzania kwasu octowego i propionowego w obecności metylo-malonylo-koenzymu A.
Z aminokwasów bakterie mogą wytwarzać histaminę i trypaminę, które z kwasami
karboksylowymi (octowym i propionowym) mogą nasilać odpowiedź zapalną i
cytotoksyczną w miejscu zapalenia. Ponadto P.acnes wykazuje odporności na
wewnątrzkomórkowe mechanizmy bakteriobójcze. W preparatach bakterie barwią się Gram
dodatnio, przypominają maczugowce. Kolonizują powierzchnię ciała, są izolowane w
zakażeniach skóry pod postacią trądzika młodzieńczego oraz zakażenia sztucznych
zastawek serca i protez, zapalenia stawów, oka oraz posocznice u chorych z obniżoną
odpornością.

Pałeczki Gram ujemne.
Dawna rodzina Bacteroides została podzielona na szereg mniejszych rodzajów i gatunków.
Wydzielono więc rodzaj Bacteroides oraz bakterie z czarnym barwnikiem nazwane Prevotelia
( P.melaminogenica, P.intermedia) i Porphyromonas (P.asacholityca, P.gingivalis, P.endodontalis).
Do pałeczek tych zaliczono także inne rodzaje jak Fusobacterium, Mobiluncus, Megamonas czy
Selenomonas i Leptotrichia.
Rodzaj Bacteroides
Do rodzaju tego zaliczono gatunek Bacteroides:
●
grupa fragilis (B.fragilis, B.distansonis, B.vulgatus, B.uniformis i inne)
●
grupa ureolyticus (B.stercordis, B.merdae, B.egerthi, B.gracialis i inne)
Czynniki chorobotwórczości:
●
otoczka chroniąca bakterie przed fagocytozą oraz bakteriofagami,
●
liposacharyd – endotoksyna wykazująca działanie letalne dla zwierząt, jest toksyczna dla
ludzkich fibroblastów, może wywołać gorączkę, leukopenię z następową leukocytozą oraz
lokalną i uogólnioną reakcję Shwartzmana.
●
Enzymy bakteryjne: kolagenaza, hemolizyna, fibrynolizyna, lecytynaza, neuroamidaza,
hialuronidaza, fosfataza, proteaza, lipaza i inne zdolne do rozpuszczenia i trawienia tkanek
oraz materiału komórkowego, odpowiedzialne za rozprzestrzenianie bakterii,
●
enterotoksyna odpowiedzialna za wystąpienie biegunek w zakażeniach B.fragilis,
●
inne czynniki zjadliwości: adhezyny, fimbrie, pęcherzyki (blebs, vesicles - ułatwiające
przyleganie do siebie bakterii tego samego rodzaju oraz posiadające aktywność
proteolityczną).Krótkołańcuchowe kwasy tłuszczowe wydzielane do środowiska
uszkadzające granulocyty obojętnochłonne, obniżające chemotaksję neutrofilów i
wewnątrzkomórkowe zabijanie bakterii.
Bakterie zasiedlają jelito cienkie i grube stanowią składnik flory skóry i błon śluzowych jamy
ustnej, górnych dróg oddechowych i moczowo-płciowych. Wywołują stany zapalne o charakterze
ropnym i zgorzelinowym różnych narządów i tkanek, najczęściej izoluje się je z zakażeń ropnych i
bakteriemii po zabiegach operacyjnych w obrębie jamy brzusznej.
Rodzaj Fuscobacterium
(F.nucleatum, F.gonidiaformans, F.varium, F.glutinosum). Bakterie wytwarzają kwas bursztynowy
hamujący fagocytozę oraz dyzmutazę nadtlenkową i enzymy odpowiedzialne za destrukcję tkanek.
Przebywają zwykle w naturalnych jamach ciała ludzi i zwierząt. Niektóre z nich wywołują u ludzi
zmiany martwicze, owrzodzenia, ropnie tkanek, zapalenia zatok, płuc i opłucnej, otrzewnej,
zakażenia płodów.
Rodzaj Gardnerella (G.vaginalis)
Są to pałeczki, ziarniako-pałeczki Gram ujemne czasami Gram zmienne, hydrolizujące skrobię i
hipuran produkują kwas z glukozy, maltozy o sacharozy, wytwarzają hemolizę typu beta na agarze z
krwią króliczą i baranią. Wywołują „waginozę” zaliczaną do chorób wenerycznych – zapalenie
pochwy z charakterystycznym zapachem pochodzącym z uszkodzonych produktów nabłonka w
skutek wewnątrzkomórkowej lokalizacji bakterii. Bakterie mogą wywołać zapalnie układu
moczowego, czasami gorączkę połogową z bakteriemią i zapalenie opon mózgowo-rdzeniowych u
noworodków.
Profilaktyka i leczenie:
●
profilaktyka nieswoista. Uwzględnienie możliwości zakażenia tymi bakteriami w czasie
zabiegów chirurgicznych zwłaszcza rozległych, długotrwałych i zabiegów na jelitach.

●
Leczenie zakażeń bakteriami Gram dodatnimi podobne do leczenia ziarniaków tlenowych.
●
Pałeczki Gram ujemne są naturalnie oporne na aminoglikozydy a B.fragilis jest naturalnie
oporny na penicylinę, cefalosporyny I generacji aztreonam.
●
Chinolony nie są aktywne wobec tych bakterii ponieważ nie hamują aktywności gyrazy
DNA.
●
Najwiekszą aktywność wobec bakterii beztlenowych nieprzetrwalnikujących wykazują
cefamycyny, karbapenemy, metronidazol i klindamycyna.
●
Oporność na antybiotyki beta-laktamowe wiąże się z wytwarzaniem beta-laktamaz. Niektóre
szczepy B.fagilis zmieniają białka wiążące penicyliny (PBP) lub zmieniają
przepuszczalność ściany komórkowej.
Mikroaerofile.
Rodzaj Campylobacter
Charakterystyka ogólna
Bakterie o długości 0,5-5μm i szerokości 0,2-0,5μm, tworzące „układy” mikroskopowe lini falistej,
litery S lub skrzydeł mewy. Komórki o kształtach zagiętej pałeczki, posiadają 2 rzęski umieszczone
na jej biegunach. Rosną w warunkach mikroaerofilnych, najlepiej z dodatkiem 10 % dwutlenku
węgla, normalne stężenie tlenu działa na nie bójczo.
Bakterie posiadają cytochromy i
dehydrogenazy typowe dla bakterii tlenowych oraz hydrogenazy, ferredoksyny właściwe bakteriom
beztlenowym. Można bakterie adaptować do hodowli w warunkach tlenowych. Rosną na podłożach
wzbogaconych np agar czekoladowy, agar Bruucelia z 5% krwią końską lub baranią lub na
podłożach wybiórczych Campylobacter w temperaturze 42°C, niektóre w temperaturze 35-37°C.
Kolonie są bezbarwne i szare, wodniste i rozlewające się lub okrągłe i wypukłe. Chorobotwórcze
dla człowieka wytwarzają katalazę i oksydazę, nie utleniają i nie fermentują glukozy. Poza tym
bakterie z tego rodzaju redukują azotany, hydrolizują hipuran, wytwarzają siarkowodór i wykazują
zróżnicowaną wrażliwość na kwas nalidyksowy i cefalotyne. Do tego rodzaju zaliczono obecnie 24
gatunki C.fetus, C.coli, C.jejuni, C.sputorum, C.concisus, i wiele innych C.pylori, Clari, C.curvus,
C.fenelliae itd.
Czynniki chorobotwórczości:
●
rzęski- przechodzenie bakterii poza warstwę śluzu, adherencja do komórek nabłonka,
●
toksyny:
- enterotoksyna podobna do toksyny cholery,
- cytotoksyny podobne do toksyn typu Shigella, C.difficile
Epidemiologia:
●
rezerwuarem bakterii są ptaki i zwierzęta. Patogenem człowieka jest: C.jejuni, C.coli,
C.fecalis, C.upsaliensis, C.hyointestinalis u homoseksualistów w odbycie, C.sputorum
kolonizują jamę ustną, inne u zwierząt i ptaków oraz w zakażeniach oportunistycznych u
ludzi.
●
Zakażenie : - drogą pokarmową (fekalno-oralną)
- kontakt bezpośredni,
- stosunki oralno-analne,
- w czasie porodu
●
Do zakażenia konieczne jest spożycie około 1000 bakterii (dane od 5-500).
●
Bakterie namnażają się w jelicie cienkim, wywołując zapalenie nabłonka i ściany jelita w
efekcie powodując biegunkę.
●
Choroba występuje sezonowo, najczęściej zimą (zimowa czerwonka np u kotów).
●
Najczęściej chorują dzieci i dorośli w wieku 25-45 lat.

●
W ostatnich latach liczba zakażeń i zachorowań wzrasta. Mogą być zakażenia rodzinne lub
ma małe ogniska epidemiczne. W grupach ryzyka przypadki śmiertelne.
Diagnostyka:
1. Objawy klinicznie:
●
okres wylęgania 1-7 dni w zależności od ilości spożytych bakterii,
●
kampylobakterioza – biegunka wodnisto-śluzowa z domieszką krwi, bóle brzucha,
wzrost ciepłoty ciała,
●
dość łagodny przebieg, wydalanie bakterii z kałem przez okres 7-21 dni
●
w grupach ryzyka mogą być powikłania w postaci bakteriemii, zapalenia opon
mózgowo-rdzeniowych, zespołu Guillaina-Barrégo, zapalnia stawów.
2. Badanie mikrobiologiczne:
●
materiał do badania: kał, wymazy z odbytu, wymiociny, materiał z sondy, bioptaty.
●
Badanie mikroskopowe- polimorfizm, kształt pałeczkowaty, czasem ziarniakowaty lub
długie spiralne, Gram ujemne,
●
hodowla prowadzona w warunkach (na podłożach) z dodatkiem antybiotyków podanych
wyżej,
●
identyfikacja bakterii uwzględniająca morfologię, ruch, właściwości biochemiczne
●
wykorzystanie chromatografii cieczowo-gazowej
●
identyfikacja immunologiczna z przeciwciałami monoklonalnymi (EIA,EA,DIF)
●
badania genetyczne PCR, sonda,
●
sporadycznie badania serologiczne,
●
niekiedy badanie endoskopowe przewodu pokarmowego połączone z biopsją błony
śluzowej.
Profilaktyka i leczenie:
●
profilaktyka nieswoista, swoistej brak, dobra znajomość etiopatogenezy zakażeń,
●
lekiem z wyboru są makrolidy,
●
oporność bakterii na fluorochinolony (spowodowane leczeniem zwierząt tym
antybiotykiem).
Rodzaj Helicobacter
Charakterystyka ogólna:
Bakterie zakrzywione lub spiralne o wymiarach 0,5-1μm x 2,5-4μm, względnie beztlenowe, Gram
ujemne pałeczki. Czasami występują formy kokoidalne. Na jednym biegunie znajduje się od 4 do 6
rzęsek a komórka bywa otoczona warstwą glikokaliksu. Rosną na podłożach z krwią, surowicą lub
np. Hemoglobiną z dodatkiem wybranych antybiotyków w ciągu 5 dni w temperaturze 37° C w
warunkach mikroaerofilnych (zestaw Gas Box Campylobacter lub Gas Pak Pouch). Bakterie
wytwarzają katalazę, oksydazę, fosfatazę alkaliczną, ureazę. Nie wytwarzają indolu, siarkowodoru,
nie hydrolizują hipuranu, są oporne na wankomycynę, sulfonamidy oraz wykazują zmienną
oporność w stosunku do cefalotyny, metronidazolu i kwasu nalidykdowego. Chorobotwórczy dla
człowieka Helicobacter pylori, inne np: H.mustele izolowanego od zwierząt. Ogółem wyróżniono
16 gatunków.
Czynniki chorobotwórczości:
●
adhezyny pozwalające na adherencję do ściśle określonych komórek,
●
niezwykła ruchliwość w gęstym śluzie żołądkowym (kształt komórki + rzęski),
●
wytwarzanie form kokoidalnych, zdolnych do przeżycia w trudnych warunkach,
●
wytwarzanie cytotoksyny Vac A wakuolizującej komórki i powodującej ich obumieranie,

●
wytwarzanie białka Cag A towarzyszącego toksynie, odpowiedzialnego prawdopodobnie za
powstawanie wrzodów żołądka,
●
wytwarzanie ureazy rozkładającej mocznik. Produkt rozkładu – amoniak, neutralizuje
kwaśne środowisko żołądka w otoczeniu bakterii,
●
wytwarzanie dyzmutazy nadtlenkowej i katalazy, chroniących bakterie przed toksycznym
działaniem nadtlenków po sfagocytowaniu.
Epidemiologia:
●
Bakterie kolonizują błonę śluzową żołądka, sporadycznie dwunastnicy i przełyku.
●
Na powierzchni komórek jest obecny glicerolipid, który jest receptorem dla bakterii.
Inwazyjności sprzyja duża ruchliwość bakterii i wytwarzanie ureazy.
●
Do zakażenia dochodzi drogą kontaktu bezpośredniego, prawdopodobnie we wczesnym
okresie życia (w krajach rozwijających się około 10 r.ż). Ekspozycja zwiększa się z każdą
dekadą.
●
Częstość kolonizacji zwiększa się wraz z wiekiem, u chorych dorosłych wynosi około 50%.
Występuje zróżnicowanie sezonowe, środowiskowe i geograficzne.
Diagnostyka
1. Objawy kliniczne:
●
objawy przewlekłego zapalenia błony śluzowej żołądka,
●
w dalszej kolejności:
- wrzody żołądka i dwunastnicy,
- zanikowe zapalenie błony śluzowej żołądka,
- gruczolakorak żołądka lub chłoniak B-komórkowy powstały z tkanki limfatycznej
żołądka.
2. Diagnostyka mikrobiologiczna:
●
materiał do badania:wycinki błony śluzowej żołądka i/lub dwunastnicy, krew,
●
badanie bezpośrednie, inwazyjne pobranie wycinka,
●
preparat barwiony metodą Grama lub inną metodą,
●
test ureazowy (podłoże z mocznikiem i indykatorem zmian pH – dodanie do podłoża
wycinka błony śluzowej)
●
hodowla na w/w podłożach w warunkach mikroaerofilnych. W ciągu 5 dni pojawiają się
niewielkie przezroczyste kolonie średnicy 0,3-1,5 mm. Identyfikacja na podstawie cech
morfologicznych (ruch, barwienie metodą Grama), biochemicznych (wytwarzanie
ureazy, katalazy, oksydazy) lub immunologicznych z przeciwciałami monoklonalnymi
(odczyn DIF,EIA,LA)
●
badanie histopatologiczne,
●
badania pośrednie
- test oddechowy (podanie choremu znakowanego radioaktywnym węglem

mocznika i w 30 min po podaniu badanie zawartości dwutlenku węgla w
wydychanym powietrzu),
- test osoczowy ze znakowanym węglem (oznaczanie znakowanego dwutlenku
węgla w surowicy),
- test ze znakowanym azotem w moczu (poszukiwanie jonów amonowych
znakowanych radioaktywnym azotem w moczu),
- badanie serologiczne – poszukiwanie w teście Elisa lub aglutynacji lateksowej
przeciwciał IgG i IgA przeciwko H.pylori,
- poszukiwanie bakteryjnego DNA metodą PCR lub sondy genetycznej.
Profilaktyka i leczenie:
●
Profilaktyka nieswoista jest trudna ze względu na morfologię bakterii jak i cechy
epidemiczne zakażeń.
●
W trakcie badań laboratoryjnych i klinicznych jest szczepionka przeciwko H.pylori.
●
Leczenie:
- leki hamujące wydzielanie jonów wodorowych i sole bizmutu (Omeprazol i pokrewne,
inhibitory receptora H2 np ranitydyna, sole bizmutu),
- antybiotyki (beta-laktamy, makrolidy, nitroimidazole-metronidazol),
- zaleca się równoczesne stosowanie 1 leku z grupy pierwszej i dwóch z grupy drugiej
przez okres 14 dni. Najczęsciej zaleca się sole bizmutu z ampicyliną i metronidazolem.
- występują szczepy oporne na metronidazol do 40% oraz makrolidy.
Rodzaj Escherichia
Ogólne informacje
Gram ujemne pałeczki najczęściej urzęsione, niektóre szczepy mogą posiadać otoczkę,Wzrastają na
podłożach zwykłych w warunkach tlenowych w temp.30-37°C. kolonie na agarze zwykłym są duże
(śr.5mm) o nierównych brzegach i powierzchni. Fermentują laktozę podczas fermentacji glukozy
wytwarzają gaz, wytwarzają indol rozkładając tryptofan, nie produkują H2S, niektóre szczepy(gł.te
izolowane z moczu) dają hemolizę na agarze z krwią .giną w temp.60°C w ciągu 30 min.
Czynniki chorobotwórczości
●
LPS(gorączka, leukopenia i hipoglikemia, hipotensja i wstrząs, zaburzenia perfuzji
podstawowych narządów, uczynnienie C3 i kaskady dopełniacza , krzepniecie
wewnątrznaczyniowe(DIC i zgon);
●
czynniki adhezyjne(czynniki inwazyjności tj.swoisty antygen O, unikatowe antygeny
fimbrialne P(kolonizacja nabłonka przewodu pokarmowego i dróg moczowych;
●
enterotoksyny będące przyczyną wielu zaburzeń żołądkowo-jelitowych
-toksyny ciepłochwiejne(LT-1 i LT-II) ulegające denaturacji, wydzielane przez szczepy
entrotoksygenne(ETEC), kodowane przez plazmidy, pobudzają jelitową cyklozę
guanylanową( nadmierne wydzielanie wody i chlorków oraz hamowanie wchłaniania
zwrotnego jonów łowych),podobne do toksyny cholery
-toksyna ciepłostała(ST)odporna na denaturację, także wydzielana przez szczepy ETEC i
kodowana przez plazmidy, wiąże się ona z komórkową cyklozą guanylanową, co
zwiększa wewnątrzkomórkowe stężenie cGMP i prowadzi do zaburzeń transportu
jonów(nadmierne wydzielanie wody i elektrolitów);
-werotoksyna(lizogenia)/podobna do toksyny wytwarzanej przez Shigella, stąd inna
nazwa Shiga –like toin/wytwarzana przez szczepy enterokrwotoczne E.coli(EHEC,
VTEC)-hamuje syntezę białek
- hemolizyny o właściwościach ogólnie cytotoksycznych wytwarzane przez szczepy
zakażające ukł. Moczowy
●
otoczka o właściwościach antyfagocytarnych (np.szczepy K1 E.coli wywołujących 80%
przypadków zapalenia opon mózgowo-rdzeniowych u noworodków)
Patogeneza i epidemiologia
●
pałeczki E.coli są normalnymi mieszkańcami j. grubego człowieka i zwierząt wyższych
●
transmisja najczęściej na drodze feralno oralnej lub pokarmowej
●
źródła endogenne( szczególnie w zakażeniach szpitalnych)
Postacie kliniczne zakażeń E.coli
●
schorzenia żołądka i jelit
szczepy ETEC- biegunki podróżnych i innych osób w różnym wieku, obfita
biegunka
pojawia się nagle i samoistnie następuje, groźne powikłania u dzieci;
szczepy EHEC(najgroźniejszy szczep ma serotyp O157:H7)-obfite biegunki
krwotoczne, krwotoczne zapalenie jelit i zespół hemolityczno-mocznicowy /ostra
niewydolność nerek, trombocytopenia, mikroangiopatyczna niedokrwistość
hemolityczna/
szczepy EPEC /enteropatogenne/ -biegunki u dzieci
szczepy EIEC /enteroinwazyjne/ -biegunki u dzieci
●
zakażenia układu moczowego(najczęstszy czynnik etiologiczny!)objawowe lub
bezobjawowe(częste i utrudnione/ból/oddawanie moczu, krwiomocz, bóle w boku)-objawy
nie są swoiste dla E.coli,
●
zapalenia opon mózgowo-rdzeniowych ( głównie u noworodków)
●
wtórne zapalenie płuc
●
zapalenie wsierdzia
●
bakteriemia i posocznica
●
zakażenia szpitalne
Zapobieganie i leczenie:

●
Profilaktyka nieswoista
-kontrola jakości spożywanych pokarmów
-bakteriologiczna kontrola jakości wody, aby zapobiegać szerzeniu się zakażeń
żołądkowo jelitowych; E.coli są dobrym wskaźnikiem zanieczyszczeń wód odchodami
ludzkimi(miano coli -objętość badanej wody, w której wykryć można jeszcze pałeczki
okrężnicy)
- kotrimoksazol profilaktycznie dla podróżujących w regiony , gdzie zakażenia układu
pokarmowego pałeczkami jelitowymi są bardzo prawdopodobne oraz zwracanie uwagi
na pochodzenie tego, co spożywamy
-higiena osobista i rodzinna
●
Profilaktyka swoista – Uro Vaxon(liofilizowany wyciąg E.coli) w zakażeniach dróg
moczowych
Rodzina Enterobacteriaceae
Charakterystyka ogólna
Jest to duża heterogenna grupa krótkich, cylindrycznych pałeczek Gram – ujemnych O szerokości
0,3-0,8mikro metra i dł.1,0-5,0 mikrometra , wykazujących podobieństwo strukturalne, antygenowe
i genetyczne. Naturalnie występują ona przewodzie pokarmowym zwierząt i ludzi , na skórze i
błonach śluzowych jamy ustnej, układu oddechowego , pochwy i cewki
moczowej(symbionty).Powodują jednakże choroby przewodu pokarmowego, są drobnoustrojami
oportunistycznymi, zakażającymi chorych lub osoby osłabione(mogą być przyczyną zakażeń
przyrannych, zakażeń układu moczowego, wtórnych zapaleń płuc, bakteriemii i posocznicy oraz
zakażeń szpitalnych), niektóre są drobnoustrojami pierwotnie patogennymi(np.Salmonella i
Shigella)
Określono 27 rodzajów (m.in.Eschericha,Shigella, Salmonella, Enterobaceter, Klebsiella, Proteus,
Yersinia, Serratia, Citrobacter, Morganella, Providencia, Hafnia,Edwardsiella)i ok.100 gatunków.
Nie wytwarzają przetrwalników, mogą posiadać rzęski (wkołorzęse) i otoczki. Są to względne
beztlenowce lub tlenowce, fermentują liczne cukry (m.in. glukozę z wytworzeniem kwasu lub
kwasu i gazu, laktozę), redukują azotany do azotynów, mogą wytwarzać siarkowodór i ureazę, są
katalazo dodatnie i oksydazo ujemne. Rosną na zwykłych podłożach w warunkach tlenowych.
Mają złożoną strukturę antygenową i wytwarzają różnorodne toksyny (endotoksyny i
egzotoksyny)oraz inne czynniki zjadliwości( czynniki kolonizacyjne- fimbrie/pile i inne białka
błonowe , rzęski , otoczki)
Liczne pałeczki jelitowe wytwarzają kolicyny (bakteriocyny)-substancje kodowane na plazmidach,
działające przeciwko blisko spokrewnionym szczepom, np.E.coli wytwarza kolicyny, Serratia sp.-
marcescyny. Szczepy wytwarzające bakteriocyny są oporne na działanie swojej własnej
bakteriocyny.
Charakterystycznym składnikiem ściany komórkowej pałeczek jelitowych , podstawowym
czynnikiem ich zjadliwości są złożone liopopolisacharydy (endotoksyny) o następującej strukturze;
●
policukrowy O-swoisty antygen somatyczny indukujący swoista odporność
●
polisacharyd rdzenia, identyczny u wszystkich bakterii Gram ujemnych indukujący pewną ,
nieswoistą odporność na posocznicę wywołaną przez bakterie Gram ujemne
●
lipid A odpowiedzialny za toksyczność endotoksyny.
Endotoksyny odpowiadają za liczne procesy patologiczne(gorączka, leukopenia i hipoglikemia,
hipotensja i wstrząs, zaburzenia perfuzji podstawowych narządów, uczynnienie C3i kaskady
dopełniacza, krzepniecie wewnątrznaczyniowe /DIC/ i zgon.
Pałeczki z rodziny Enterobacteriaceae mogą z łatwością wymieniać między sobą informację
genetyczną(najczęściej na drodze koniugacji i wymiany plazmidów oraz przez transdukcję)co
przyczynia się do przekazywania genowej oporności na wiele leków oraz nabywania genów
kodujących syntezę różnych czynników zjadliwości(toksyn i czynników kolonizacji).
Struktura antygenowa
Rodzina Enterobacteriaceae ma bardzo złożoną strukturę antygenową, klasyfikacja oparta jest na
ponad 150 różnych ciepłostałych antygenach somatycznych O (lipopolisacharyd), ponad
100ciepłochwiejnych antygenach otoczkowych K i ponad 50 antygenach rzęskowych H;
●
antygeny O
są powtarzającymi się jednostkami lipopolisacharydowymi,
niejednorodnymi(istnieje wiele ich odmian)odpornymi na działanie ciepła i alkoholu,
zwykle są wykrywane w reakcji aglutynacji bakteryjnej; przeciwciałami przeciwko
antygenom O są głównie IgM.
●
antygeny K znajdują się na zewnątrz antygenów u niektórych paleczek jelitowych, mogą
być polisacharydami(np.u E.coli, Klebsiella), inne białkami.
●
antygeny H są umiejscowione na rzęskach , ulegają denaturacji pod wpływem alkoholu i
ogrzewania, aglutynują głównie z przeciwciałami IgG;u salmonella typki antygeny
otoczkowe są zwane antygenami Vi i są bardzo istotne w serotypowaniu.
Rodzina Enterobakteriaceae
Laktoza+
Laktoza -
Rzęski +
Rzęski –
Rzęski +
Rzęski –
Escherichia
Enterobacter
Citrobacter
Serratia
Klebsiella
Salmonella
Proteus
Providencia
Hafnia
Edwardsiella
Shigella

Rodzaj Klebsiella
Informacje ogólne:
●
gram ujemne pałeczki
●
fermentują laktozę
●
wytwarzają, duże wyraźne otoczki
●
nie wykazują ruchu
●
na podłożu stałym dają bardzo śluzowe kolonie
●
wchodzą w skład fizjologicznej flory bakteryjnej (u 10% zdrowej populacji naturalnie
bytują w jamie nosowo-gardlowej, a także w jelicie grubym)
●
w pewnych warunkach mogą wywoływać groźnie, uogólnione zakażenia (w stanach
obniżonej odporności lub osłabienia)
●
za większość zakażeń odpowiada K. Pneumoniae, zaliczają się także takie chorobotwórcze
gatunki jak K.oxytoca, K.ozaenae, K. rhinoscleromatis
Czynniki chorobotwórczości
●
LPS (gorączka, leukopenia, hipoglikemia, hipotensja i wstrząs, zaburzenia perfuzji
podstawowych narządów, uczynnienie C3 i kaskady dopełniacza, krzepnięcie
wewnątrznaczyniowe /DIC/ i zgon
●
Śluzowa otoczka chroniąca przed fagocytoza
●
Zmienna oporność na antybiotyki uzależniona od koniugacyjnej wymiany plazmidów
(problem ESBL, szczególnie u bakterii z rodzaju Klebsiella)
●
Produkcja ciepłostałych i ciepłochwiejnych toksyn (koniugacyjna wymiana plazmidów)
Patogeneza i epidemiologia
●
Pałeczki Klebsiella są normalnymi mieszkańcami jelita grubego i jamy nosowo- gardłowej
●
Transmisja na drodze fekalno- oralnej i pokarmowej
●
Źródła endogenne (szczególnie w zakażeniach szpitalnych)
4. Postacie kliniczne zakażeń pałeczkami z rodzaju Klebsiella
K.pneumoniae
●
Pierwotne lub wtórne zapalenie płuc i ropnie płuc, głównie u osób z obniżoną odpornością,
cukrzyków i alkoholików, zakażenia maja charakter destrukcyjny (zmiany martwicze,
krwotoki, wykrztuszanie gęstej, lepkiej, podbarwioną krwią plwociny, bóle w klatce
piersiowej), rokowanie jest niepomyślne, zwłaszcza jeśli dojdzie do bakteriemii i sepsy
●
Zakażenia pozapłucne np. enteritis, meningitis u niemowląt
●
Zakażenia dróg moczowych u dzieci i dorosłych
●
Bakteriemie i posocznice
K. ozaenae
●
wywołuje zanikowy, cuchnący nieżyt nosa /ozena/ lub ropne zapalenia błony śluzowej nosa
K. rhinoscleromatis
●
czynnik etiologiczny twardzieli /scleroma/, ziarniniakowatej choroby przebiegającej z
zapaleniem błony śluzowej gardła, jamy nosa i zatok bocznych nosa
K. oxytoca
●
zakażenia układu moczowego, bakteriemie, posocznice, zakażenia szpitalne
Profilaktyka i leczenie
●
Profilaktyka nieswoista – przestrzeganie zasad higieny osobistej, szczepionki poliwalentne:
Broncho – Vaxom, Luivae, Polyvaccinum, Ribomunyl
●
Leczenie: antybiotyki takie jak w leczeniu bakterii Gram ujemnych, duża oporność na
antybiotyki, największa w całej rodzinie możliwość występowania oporności typu ESBL
●
leczenie wspomagające w zakażeniach układu oddechowego, moczowego i innych

Rodzaj Enterobacter
Informacje ogólne:
●
Gram ujemne pałeczki jelitowe
●
Fermentujące laktozę
●
Naturalnie bytują w jelitach, powszechne w środowisku otaczającym,
●
Ruchliwe, wytwarzają otoczki
●
Z materiałów klinicznych najczęściej izoluje się E.aerogenes i E.cloacae, E.sakazakii
●
Mogą wywoływać biegunki, zakażenia ran, zapalenia opon mózgowych, zakażenia
szpitalne, głównie w postaci zakażeń dróg oddechowych i moczowych, także bakteriemie i
posocznice
Diagnostyka zakażeń pałeczkami Escherichia, Klebsiella, Enterobacter
1. Objawy kliniczne w/w postaci klinicznych zakażeń + wiek pacjenta, jego podróże w
przypadku zakażeń jelitowych
2. Badanie mikrobiologiczne
●
Materiał do badania (kał, mocz, zakażona tkanka, krew, płyn mózgowo- rdzeniowy,
ropa, wymazy)
●
Preparat mikroskopowy:
-barwiony metodą Grama – krótkie, cienkie pałeczki Gram ujemne (wszystkie
bakterie z rodziny Enterobacteriaceae są do siebie podobne)
-barwiony metodą pozytywno – negatywną lub na otoczki – widoczne otoczki w
przypadku Klebsiella
●
Hodowla
●
Na podłożach zwykłych (agarowe i krwawe) – duże (5 mm średnicy), okrągłe, śluzowate
kolonie o nierównym brzegu, kremowej barwie i charakterystycznym zapachu, na agarze
z krwią hemolizy raczej nie obserwuje się (za wyjątkiem niektórych szczepów E. Coli)
●
Na podłożach wybiórczych i wybiórczo- różnicujących:
-Podłoże MacConkey’a – rosną na nim jedynie bakterie z rodziny
Enterobacteriaceae, zawiera laktozę i wskaźnik pH, jeśli laktoza jest fermentowana
(Escherichia, Klebsiella, Enterobacter), wytworzony zostaje kwas i kolonie są
różowo- fioletowe, jeśli laktoza nie jest fermentowana (rodzaje bakterii inne niż
w/w) kolonie pozostają bezbarwne
-Podłoże Kliglera z żelazem: fermentacja samej dekstrozy- żółty słupek (reakcje
czerwieni fenolu w kwaśnym środowisku), barwa skosu bez zmian, produkcja gazu –
pęcherzyki, rozerwane podłoże, fermentacja samej laktozy- żółty skos, wytwarzanie
siarkowodoru- zaczernienie podłoża
-Podłoże Levine’a (Eosin Methylene Blue agar) – pozwala odróżnić pałeczki
jelitowe, które fermentują laktozę od niefermentujących (E. Coli, Citrobacter-
kolonie z metalicznym połyskiem, Enterobacter – śluzowate, brązowe kolonie,
Salmonella, Shigella kolonie przejrzyste bursztynowe)
-Podłoże Endo – do izolowania pałeczek okrężnicy (czerwone kolonie)
-Hektoen agar z solami żółci
-Coli ID
-Drygalskiego agar
-Bulion laktozowy
-CPS, CLED agar – podłoża do badań moczu
●
Testy biochemiczne (szereg biochemiczny API 20 E, system ATB – ID 32E), inne testy
(np. fermentacja sorbitolu, wydzielanie indolu i H2S, reakcja oksydacji)
●
Testy serologiczne, (jeśli konieczne) podział grupy Escherichia na podgrupy oparty na
obecności antygenów somatycznych (reakcja z surowicami poliwalentnymi), podział na
serotypy – na podstawie antygenów rzęskowych
●
Test pęcznienia otoczek (Klebsiella)
●
Badanie zdolności szczepu do wytwarzania toksyn (metody immunoenzymatyczne)
●
Test na inwazyjność szczepu (test Sereny’ego)

●
Test aglutynacji na obecność czynników inwazyjności (test aglutynacji z przeciwciałami
anty-CFA)
●
Oznaczanie miana coli
●
Testy genetyczne PCR
Rodzaj Salmonella
Ogóle informacje
Są to Gram ujemne pałeczki należące do rodziny Enterobacteriaceae, nie wytwarzają otoczek i
przetrwalników, wykazujące zdolność ruchu dzięki urzęsieniu peritrichalnemu (wkołorzęse). Rosną
dobrze na zwykłych podłożach w warunkach tlenowych w temp 37 stopni C, nie fermentują laktozy
i sacharozy, fermentują kwaśno i gazowo glukozę, wytwarzają H2S.
Są wrażliwe na temperaturę (56C przez 60 min) i środki dezynfekcyjne (lizol, fenol, środki
utleniające i formaldehyd), w wodzie mogą natomiast utrzymać się przy życiu nawet przez 200 dni.
Nie są wrażliwe na zieleń brylantową, eozynę, deoksycholan sodu, co umożliwiło opracowanie dla
nich podłóż o wysokiej selektywności.
Rodzaj Salmonella obejmuje ponad 2 tys. Odmian chorobotwórczych dla zwierząt i ludzi. Gdy
bakterie te przedostaną się do przewodu pokarmowego (przez wodę lub produkty spożywcze
pochodzenia zwierzęcego), mogą wywołać zapalenie przewodu pokarmowego, zakażenia układowe
i gorączkę durową. Główne gatunki to S.typhi, S.paratyphiA, B, S choleraesuis, S. entiritidis
(podzielony na setki serotypów).
Budowa antygenowa
Bakterie z rodzaju Salmonella posiadają:
●
antygen somatyczny O (ciepłostały) dający w wyniku reakcji ze swoistymi
przeciwciałami aglutynację grudkową
●
antygen rzęskowy H (ciepłochwiejny), który może występować w obrębie jednego
gatunku z rodzaju Salmonella pod postacią fazy I swoistej dla gatunku, oraz fazy II,
która może być jednakowa dla wielu gatunków
●
antygen otoczkowy Vi (u niektórych szczepów), względnie ciepłochwiejny,
odpowiadający za zjadliwość bakterii
W oparciu o strukturę antygenów somatycznych i rzęskowych, podzielono pałeczki z rodzaju
salmonella na grupy serologiczne i zawarto je w tablicy Kauffmanna-White’a (schemat ten
obejmuje około 2200 odmian Salmonella podzielonego na grupy A do Z i dalej oznaczone cyframi
arabskimi).
Poszczególne gatunki lub serotypy należące do tej samej grupy określa się za pomocą antygenu
rzęskowego I fazy oznaczonego małymi literami alfabetu oraz fazy drugiej oznaczonego cyframi
arabskimi.
Czynniki chorobotwórczości
●
Endotoksyna (gorączka, leukopenia i hipoglikemia, hipotensja i wstrząs, zaburzenia
perfuzji podstawowych narządów, uczynnienie C3 i kaskady dopełniacza, krzepnięcie
wewnątrznaczyniowe (DIC) i zgon)
●
Inwazyny- białka warunkujące przyleganie i penetrację do komórek nabłonkowych
jelita.
●
Czynniki odporności na fagocytozę (np. katalaza, dysmutaza nadtlenkowa – neutralizują
wolne rodniki tlenowe
●
Czynniki neutralizujące defenzyny, co uniemożliwia zabicie bakterii przez fagolizosomy)
●
Czynniki odporności na kwaśne pH (dzięki temu bakterie mogą przeżyć w żołądku i

fagolizosomach)
●
Antygen Vi – otoczkowy polisacharyd S. typhi o właściwościach antyfagocyytarnych
Patogeneza i epidemiologia
●
Rezerwuarem Salmonella sp. Są zwierzęta (trzoda chlewna, bydło, drób, zwierzęta
domowe)
●
Ludzie zakażają się drogą pokarmową (skażone mięso drobiowe i jaja – salmonellozy;
drogą fekalno-oralną (skażona woda lub posiłki skażone podczas przygotowywania
przez bezobjawowych nosicieli)-dur brzuszny , dury rzekome; wrotami zakażenie jest
nabłonek jelita cienkiego.
●
Penetracja błony śluzowej zależy od inwazyn Salmonella sp, a jej następstwem jest ostre
zapalenie i owrzodzenie jelita
●
Zapalenie błony śluzowej indukuje syntezę prostaglandyn, co aktywuje cyklazę
adenylanową prowadząc do utraty płynów i elektrolitów.
Postacie kliniczne zakażeń pałeczkami Salmonella sp.
A. Dur brzuszny (Typhus abdominaliis) (schemat), wywoływany gł. Przez S. typhi oraz
paradury i dury rzekome (czynnik etiologiczny – S. paratyphi A, B, C) drobnoustroje po
wniknięciu do organizmu drogą pokarmową umiejscawiają się w węzłach chłonnych jelita
cienkiego i w pierwszym tyg. Choroby występuje senność, złe samopoczucie, stany
podgorączkowe, bóle i zaparcia) i po namnożeniu (okres wylegania ok. 10-14 dni), za
pośrednictwem chłonki przenikają do krwi (bakteriemia) i są przenoszone do śledziony,
wątroby, płuc, opon mózgowych i nerek oraz do jelita cienkiego, gdzie ulegają namnożeniu
w grudkach chłonnych (kępki Peyera), wywołują martwicę (czasem też perforację) ściany
jelita i zostają uwolnione do jego światła ( 2-3 tydzień choroby, po 10-14 dniach pojawia się
wysoka temperatura (gorączka durowa), tkliwość uciskowa brzucha, obserwuje się
powiększenie wątroby i śledziony a czasami także krótkotrwałą różowawą wysypkę skórną,
biegunka rozpoczyna się w końcu 2 tyg. Lub na początku 3 tyg. Możliwe są powikłania
zakażenia (groźne krwawienia z przewodu pokarmowego będące następstwem perforacji
ściany jelita, zakrzepowe zapalenie żył, zmiany ogniskowe w wątrobie, zapalenie
przewodów żółciowych (nosicielstwo przez wiele lat), zapalenie płuc, okostnej, szpiku i in.
narządów, ropnie.
B. Zapalenie jelita cienkiego i okrężnicy (salmonelloza) – najczęściej spotykana postać
zakażeń przewodu pokarmowego wywoływanych przez pałeczki Salmonella (S. enteritidis,
S. typhimurium, S. paratyphi), po spożyciu zakażonych bakteriami produktów
żywnościowych w czasie 8 – 48 godz. Występuje ostry nieżyt przewodu pokarmowego
(nudności, wymioty, biegunka, ból brzucha, nieznacznie podwyższona temperatura),
choroba ustępuje po 2-5 dniach, bakteriemia występuje rzadko, powstają zmiany zapalane w
jelicie cienkim i grubym oraz wzmożone wydalanie bakterii z kałem przez kilka tygodni.
C. Bakteriemia ze zmianami ogniskowymi – czynnikiem etiologicznym jest najczęściej S.
choleraesuis; bakterie po wniknięciu do przewodu pokarmowego we wczesnej fazie
zakażenia atakują układ krążenia i osiedlają się w narządach wewnętrznych (płuca, kości,
opony M-R) nie dając objawów ze strony układu pokarmowego.
Diagnostyka zakażeń pałeczkami Salmonella sp.
1. Objawy chorobowe w/w postaci klinicznych zakażeń
2. Badanie mikrobiologiczne:
●
Hodowla i izolacja są niezbędne do potwierdzenia rozpoznania!
●
Materiał do badania:

●
w przypadku salmoonellozy najlepszym materiałem do badania jest kał
●
w przypadku duru brzusznego:
a) dodatnie izolacje z krwi występują pod koniec I tyg. Posiew z krwi należy
wykonywać wielokrotnie, posiewając przy łóżku chorego na bulion z żółcią lub
gotowe zestawy w proporcji 10ml krwi do 90 ml podłoża; posiewy obserwuje się
przez 14 dni, izolując z nich co kilka dni namnażające się bakterie na podłożach
selektywnych
b) w 2/3 tyg. Choroby pojawiają się dodatnie posiewy z kału
c) w 3 tyg. Zakażenie występują tez dodatnie posiewy z moczu
d) można też hodować aspiraty szpiku kostnego oraz wymazy z owrzodzeń jelita
(sigmoidiskopia), żółć, wymiociny, treść pokarmową
●
Zawiesinę kału i osad po odwirowaniu moczu posiewa się na płynne podłoża selektywne
SF (z kwaśnym selenianem sodu i laktozą wybiórczo namnażające pałeczki Salmonella
i Shigella)
●
Po 24 godz. Inkubacji w temp 37C dokonuje się przesiewu na stałe podłoża wybiórczo-
diagnostyczne (agar SSz laktozą solami żółci, cytrynianem żelazowym?, zielenią
brylantową i czerwienią obojętną; czarne zabarwienie środka koloni dowodzi produkcji
H2S), agar MacConkeya z fioletem krystalicznnym, czerwienia obojętną, laktozą, solami
zółci; podłoże Levina EMB agar; agar Wilsona-Blaira z (dekstrozą, siarczannem
bizmutu i żelaza, zielenią brylantową)
●
Preparat barwiony metodą Grama – z hodowli, niekiedy z materiału diagnostycznego
(G- pałeczki)
●
Podejrzane kolonie laktozo-ujemne, okrągłe, gładkie, lśniące i przejrzyste 3mm średnicy
(forma S) lub matowe, płaskie i suche (forma R) identyfikuje się za pomocą szeregu
biochemicznego (API 20E lub w systemie ATB)
●
Testy serologiczne – wykonuje się aglutynacje identyfikowanych zawiesin bakterii ze
swoistymi surowicami odpornościowymi; w I etapie z surowicą poliwalentną HM
swoista dla rodzaju Salmonella, a w II z surowicami przeciwko antygenom
somatycznym a następnie z antygenami rzęskowymi fazy pierwszej, czasami i fazy
drugiej.
●
Od 6 dnia choroby w probówkach surowicy pobranych od chorych pojawiają się p. ciała
zlepiające w odczynie Widala; miano tych p-ciał szybko wzrasta w 2 i 3 tyg. Gorączki
durowej; w celu wykazania dynamiki przyrostu p-ciał należy pobierać podwójne próbki
surowic w odstępach 7-10 dni
a) wysokie lub rosnące miano p-ciał przeciwko antygenowi somatycznemu 0 1:160
(1:200) i więcej świadczyo czynnej chorobie
b) miano p-ciał przeciwko antygenowi H wyższe niż 1:50 wskazuje na toczący się
proces chorobowy
c) miano przeciwciał anty H wyższe niż 1:200 i niskie miano anty0 sugeruje
przebytą infekcje lub przebyte szczepienie
●
Odczyn wiązania dopełniacza
●
Metody genetyczne PCR
●
Dla wykazania nosicielstwa wykonuje się odczyn aglutynacyjny z antygenem Vi
(wysoki poziom u nosicieli pałeczek Salmonella)
Zapobieganie i leczenie
Profilaktyka nieswoista:
●
Stosowanie odpowiednich środków sanitarnych i higieny osób.

●
Kontrola sanitarna wody i żywności
●
Wyeliminowanie nosicieli mających kontakt z żywnością
●
Okresowe badanie kału na nosicielstwo wśród personelu zatrudnionego w dystrybucji i
przygotowywaniu środków spożywczych
●
Systematyczna walka z gryzoniami (okresowa deratyzacja)
Profilaktyka swoista
●
szczepionka zawierająca zabite S. typhi (skuteczność dyskusyjna)
●
szczepionka przeciwko durowi brzusznemu zawierająca atenuowany szczep (Ty21a)
stopień ochrony po szczepieniu jest zróżnicowany;
●
szczepionka z oczyszczonym polisacharydem Vi (S. typhi Ty2) oraz w badaniach z
rekombinowanym wariantem Ty 21a
●
szczepionka durowo-tężcowa (Ty-T) zawiera zabite pałeczki duru i toksoid tężcowy
Leczenie:
●
w przypadku chorych na dur brzuszny – ampicylina lub kotrimoksazol, chinolony ,
noflokacyna, cigrafloksacyna (dawniej chloramfenikol) oraz leczenie podtrzymujące;
dużym utrudnieniem jest szybkie narastanie oporności pałeczek Salmonella na antybiotyki
(plazmidy), dlatego niezbędne jest wykonanie antybiogramu. Poza tym leczenie
wspomagajace, płyny, elektrolity itp..
●
w stanachprzewlekłego nosicielstwa – chinolony (dawniej ampicilina) oraz chirurgiczne
usunięcie pęcherzyka żółciowego u nosicieli z chorobami tego narządu
●
w przypadku salmonelloz - tylko leczenie wspomagające, za wyjątkiem pacjentów
poniżej 6 mż oraz powyżej 50 rż ze współistniejącymi chorobami przewlekłymi.
Rodzaj Shigella
Ogólne informacje
Są to Gram-ujemne pałeczki należące do rodziny Enterobacteriaceae, dla których naturalnym
środowiskiem bytowania jest układ pokarmowy człowieka, są czynnikiem etiologicznym czerwonki
bakteryjnej – choroby zakaźnej rozprzestrzeniającej się epidemicznie w środowisku ludzi. Ze
względu na właściwości biochemiczne i różnice w budowie antygenu 0 wyróżnia się cztery grupy
tych pałeczek:
●
grupa A Sh. Dysenteriae typ od 1 do 10
●
grupa B Sh. Flexneri typ od 1 do 6 oraz warianty X i Y
●
grupa C Sh. Boydi typ od 1 do 15
●
grupa D Sh. Sonnei
Pałeczki z rodzaju Shigella nie posiadają rzęsek ani otoczek nie wytwarzają
przetrwalników, S.flexneri posiada fimbrie. Shigella sp. są bardzo wrażliwe na czynniki zewnętrzne
( 70 ° C/ 15 min, oraz środki antyseptyczne). Dobrze rosną na podłożach zwykłych tworząc kolonie
lśniące i wypukłe o średnicy 3 mm (forma S) i duże, matowe, szorstkie kolonie (forma R),
zmienność formy S na R wiąże się z utratą inwazyjności. Obficie rosną na podłożach z dodatkiem
soli żółci (agar SS i McConceya), wszystkie typy Shigella fermentują glukozę i inne cukry bez
wytworzenia gazu, za wyjątkiem laktozy, która nie jest fermentowana. Nie wytwarzają
siarkowodoru i ureazy.
Czynniki chorobotwórczości:
●
LPS o działaniu drażniącym błonę śluzową,
●
inwazyjne antygeny kodowane przez plazmidy, które pośredniczą w przyleganiu i penetracji
do komórek nabłonkowych błony śluzowej, warunkujące ucieczkę z pęcherzyków

fagocytarnych,
●
białka związane z szerzeniem się wewnątrzkomórkowym – pośredniczą one w przyleganiu
do białek cytoszkieletu, ułatwiając przechodzenie bakterii do sąsiadujących komórek przez
wypustki błon,
●
toksyna czerwonkowa Shigella ciepłochwiejna, cytotoksyczna, egzotoksyna wytwarzana
przez S.dysenteriae typ I (gatunek wywołujący większość groźnych zakażeń), która
inaktywuje podjednostkę 60S rybosomów komórkowych ssaków, hamując w ten sposób
syntezę białek, uważa się, że toksyna czerwonkowa, która jest wydzielana tylko w chwili
śmierci bakterii, powoduje zespół hematolityczno-mocznicowy, wywołując uszkodzenie
naczyń potęgowane przez endotoksynę.
Patogeneza i epidemiologia:
●
Shigella sp. są wyłącznie bakteriami patogennymi, które nie mają rezerwuarów
zwierzęcych. Z człowieka na człowieka szerzą się drogą fekalno-oralną przez skażony
pokarm i wodę lub przez kontakt bezpośredni.
●
W różnych częściach świata występują różne gatunki ( np S.sysenteriae w krajach
rozwijających się).
●
Patogeneza – pałeczki Shigella po przedostaniu się do przewodu pokarmowego lokalizują
się w jelicie grubym, powodując mikroropnie w ścianie jelita, czego następstwem może być
martwica błon śluzowych oraz powierzchniowe owrzodzenia pokryte pseudobłoną
(włóknik, leukocyty, bakterie i martwicza błona śluzowa), w trakcie gojenia owrzodzenia
wypełniają się ziarniną tworząc blizny.
Diagnostyka zakażeń pałeczkami Shigella sp.
1. Objawy kliniczne:
●
Bakterie z rodzaju Shigella są czynnikami etiologicznymi czerwonki bakteryjne
(shigellosis), mogą też powodować wodniste biegunki, zakażenie jest ograniczone do
błony śluzowej i tkanki podśluzowej okrężnicy, okres inkubacji jest krótki (1-4 dni)
czerwonka objawia się silnymi, kurczowymi bólami brzucha i częstym bolesnym
oddawaniem małej ilości stolca z krwią, śluzem, ropą oraz wysoką temperaturą, po 2-5
dniach choroba może ustąpić samoistnie, u dzieci i ludzi starszych na skutek silnego
odwodnienia może jednak zakończyć się zgonem. Po wyzdrowieniu może ustalić się
stan nosicielstwa i wznowienia choroby. Zespół hemolityczno-mocznicowy może się
rozwinąć w przypadku zakażenia S.dysenteriae typ 1 i jest przypisywany aktywności
egzotoksyny Shigella, która powoduje rozsiane uszkodzenia śródbłonka doprowadzająca
do wewnątrznaczyniowego wykrzepiania, hemolizy i niewydolności nerek.
2. Badanie mikrobiologiczne:
●
Materiał do badania: do postawienia rozpoznania Shigella sp. muszą zostać
wyizolowane z odpowiednich próbek materiału klinicznego – świeżego kału, lub
ewentualnie wymazów odbytniczych z owrzodzeń śluzówki, bakterie szybko ulegają
autolizie, materiał posiewać trzeba przy łóżku chorego na bulion z żółcią lub podłoże
SF, a w przypadku konieczności transportu materiał należy zabezpieczyć płynem
konserwującym z NaCl, fosforanami i glicerolem.
●
W badaniu mikroskopowym świeżego kału, wymazów z odbytnicy i kłaczków śluzu
stwierdza się obecność Gram ujemnych pałeczek, obecność dużej ilości krwinek białych.
●
Po 24 h inkubacj (37°C warunki tlenowe) materiał przesiewa się na podłoża wybiórcze
typu McConkey, SS.
●
Wyrosłe laktozo-ujemne kolonie przesiewa się na szereg biochemiczny API 20E, system
ATB.
●
W dalszym etapie wykonuje się aglutynację szkiełkową z surowicami diagnostycznymi
przeciwko poszczególnym szczepom.

●
Określenie poziomu przeciwciał jest niezbędne w przypadku konieczności wykazania
dynamiki wzrostu lub poziomu w seryjnych próbkach surowicy.
●
Inne badanie:
- barwienie błękitem metylenowym leukocytów w kale wskazuje na inwazję błony
śluzowej, ale nie jest dowodem na zakażenie Shigella sp.
- test Sereny'go dla potwierdzenia inwazyjności szczepu, nie wykonuje się go
rutynowo (kroplę inwazyjnego szczepu nakłada się na rogówkę świnki morskiej lub
królika, co powoduje ciężkie zapalenie rogówki i spojówki i ich martwice)
Zapobieganie i leczenie:
●
Profilaktyka nieswoista:
- poprawa warunków sanitarnych i higiena osobista, które przerywają łańcuch
epidemiologiczny zakażeń (kał, muchy, palce)
- kontrola sanitarna wody, mleka, żywności,
- izolacja chorych,
- dezynfekcja wydalin i ścieków
- wykrywanie nosicieli
●
Leczenie:
- objawowe ( nawadnianie zwłaszcza u pacjentów z biegunką),
- antybiotykoterapia głównie u młodych pacjentów, skraca czas choroby i stan
nosicielstwa, leki z wyboru to ampicilina i amoksycylina, chinolony ( ale
narastający problem oporności), kotrimoksazol , (niski poziom oporności wsród
szczepów Shigella sp.)
Rodzaj Proteus
Charakterystyka ogólna
należą tu Gram ujemne pałeczki, szeroko rozpowszechnione w przyrodzie (gleba, ścieki, woda,
przewód pokarmowy ludzi i zwierząt), biorące udział w procesach gnilnych. Gdy z przewodu
pokarmowego przedostaną się do innych układów, mogą wywołać zakażenie. Do rodzaju Proteus
zalicza się pięć gatunków P.vulgaris (pałeczka odmieńca), P.mirabilis, P.morgani, P.inconstans, P.
retigeri. Posiadają one zdolność ruchu (peritrychialny układ rzęsek). Dobrze rosną na zwykłych
podłożach tworząc wzrost mgławicowy (typ II). Wytwarzają fimbrie, nie wytwarzają
przetrwalników. Niektóre szczepy dają hemolizę na agarze z krwią. Wydzielają ureazę, H
2
S,
deaminazę fenyloalaninową, fermentują indol. Posiadają antygeny O, H, K. Istnieją trzy podtypy
pałeczek P.vulgaris posiadających wspólne antygeny z gatunkami Ricketsia powodującymi dur
plamisty (Proteus OX
19
, OX
2
, OX
K
). Przedstawiciele rodzaju P.vulgaris , P.mirabilis, oraz
spokrewnione z nimi i Providentia alcalifaciens,Providentia rettgeri , Providentia stuarti
Morganella morganii.
Chorobotwórczość
●
czynnikiem chorobotwórczości jest endotoksyna. Ponadto bakterie wytwarzają ureazę,
siarkowodór, fermentują indol i wydzielają deaminazę fenyloalaninową.
●
Zakażenia dróg moczowych (także szpitalne),
●
zatrucia pokarmowe i biegunki niemowląt, zakażenia ran (ropne),
●
zapalenia ucha środkowego,
●
zapalenia opon mózgowo-rdzeniowych,
●
bakteriemie i posocznice,
●
zapalenia płuc.
Diagnostyka zakażeń pałeczkami Proteus sp.
●
Materiał: mocz, kał, żółć, ropa, płyn m-rdzeniowy w zależności od objawów.

●
Preparat barwiony metoda Grama (niespecyficzne Gram ujemne pałeczki).
●
Pobrany materiał przesiewa się na podłoża zwykłe (wzrost mgławicowy), agar z krwią,
podłoże McConceya (ogranicza wzrost mgławicowy).
●
Podejrzane laktozo-ujemne kolonie poddaje się testom biochemicznym API 20E, ATB w
celu określenia gatunku.
Profilaktyka i leczenie:
●
Profilaktyka nieswoista (przestrzeganie zasad higieny), swoistej brak
●
Antybiotykoterapia po wykonaniu antybiotykogramu (pałeczki z
rodzaju Proteus są najczęściej oporne na większość antybiotyków),
ampicylina, augumentin, cefalosporyny III generacji, aminoglikozydy,
imipenem, kotrimoksazol, aztreonam.
Rodzaje: Vibrio, Pseudomonas, Actinetobacter
Rodzina Vibrionaceae: pałeczki Gram ujemne, proste lub zakrzywione, ruchliwe,
niezarodnikujące, o małych wymaganiach odżywczych. Z pięciu rodzajów tylko Vibrio jest
chorobotwórczy dla człowieka.
Vibrio cholerae – przecinkowiec cholery, pałeczka w formie przecinka, 0,5 mikrometra szerokość,
1,5 – 3,0 długości, posiadają jedną rzęskę, pleomorficzna rosnąca w warunkach alkalicznych pH-8
Klasyfikacja:
●
Biotypy toksynogenne, reagujące z surowicami anty 01 (grupa 01)
o E1 Toru występuje najczęściej,
o Klasyczny – 01
●
Nowy biotyp toksynogenny, nie reagujący z anty 01- V. cholerae 0139 – Bengal,
posiadającą trzecią toksynę w porównaniu do pozostałych,
●
Biotypy nietoksynogenne, 137 grup, nie reagujące z surowicami anty 01 /grupa nie 01/,
pojedyncze przypadki zachorowań
Czynniki chorobotwórczości
a) Enterotoksyna, główna toksyna bakteryjna;
-
region A – aktywność biologiczna
-
region B – ułatwia wiązanie toksyn do kom. Jelitowej
d) toksyna ZOT uszkadzająca połączenia międzykomórkowe i zwiększająca przepuszczalność
jelit,
e) toksyna pomocnicza ACE /tylko u szczepów 0139/ - powodująca akumulację płynów w
jelicie
f) czynniki adhezyjne ułatwiające przyleganie – prawdopodobnie mucynaza u typów 01
rozkładająca osłonę komórek jelitowych,
Patogeneza: przyleganie bakterii do kom. Kosmków jelitowych, namnażanie bakterii, wydzielanie
toksyny, aktywacja podjednostki A-1, penetracja jej do wnętrza komórki, zwiększenie aktywności
cAMP co powoduje wzros t wydzielania chlorków oraz spadek wchłaniania sodu i potasu – w
efekcie masowa utrata płynów,
Klinika: postać poronna, klasyczna, tzw. „sucha”, nagła biegunka bez bólów brzucha, wymioty,
wodniste, ryżowe stolce, silne odwodnienie. W postaci suche brak biegunki i wymiotów, porażenie
jelit i zgon.
Diagnostyka:
●
materiałem jest kał, wymaz z odbytu, wymiociny

•
posiew na podłoże alkaliczne (woda peptonowa)
•
posiew na agar alkaliczny lub TCB (thiosulfat-citrate-bile-sucrose)
•
izolacja podejrzanych (duże, półprzepuszczalne, okrągłe, płaskie lub żółte na TCBS /kolonie
na szereg biochemiczny/)
•
test na oksydazę (różnicowanie z atypowymi coli)
•
oksydazododatnie – aglutynacja z surowicą poliwalentną
Vibrio parahacmolyticus – zapalenie jelit po spożyciu ryb i/lub skorupiaków morskich, objawy
biegunkowe, ustępujące samoistnie.
Vibrio valnificus – halofit morski, wywołujący zakażenia ran, zakażenia biegunkowe(ostrygi),
czasami posocznicę.
Rodzina Pseudomonadaceae – pałeczki tlenowe, bytujące w wodzie lub glebie, niezarodnikujące,
ruchome (jedna rzęska lub kilka), nie fermentujące glukozy, rosnące na zwykłych podłożach,
niektóre wytwarzają barwniki. Należą tutaj rodzaje: Pseudomonas (P. aeruginosa, stutzeri,
fluorescens, alkaligenes, putida), Burkholderia (B. pseudomallei. Maleli, cepacia),
Stenotrophomonas (S. maltophila)
Pseudomonas aeruginosa – pałka wytwarzająca otoczkę, ruchliwa, wytwarzająca barwniki, mało
wymagająca do wzrostu, nie fermentuje glukozy.
Barwniki:
•
Piocjanina – katalizująca przejście tlenu w rodniki ponadtlenkowe i nadtlenek wodoru
•
Piowerdyna – zielone zabarwienie podłoża
•
Fluoresceina – powoduje zieloną fluorescencję pod wpływem UV
Czynniki chorobotwórczości:
•
Otoczka alginianowa – śluzowaty wygląd, przeżywalność w wodzie, wyższa patogenność
np. zap. płuc, czynnik adhezyjny i antyfagocytarny
•
Proteazy niszczące białka
•
Pilina i adhezyjny wzmagające kolonizację
•
Hemolizyny (fosfolipaza A) niszczące surfaktant płucny
•
Toksyny (hamują aktywność fagocytów)
egzotoksyna A – najważniejsza toksyna P. aeruginosa, hamuje syntezę białek
egzotoksyna S – rybozyluje białka D komórek gospodarza,
1. fimbrie – zwykle zwiększona adhezja
2. oporność na antybiotyki – względna nieprzenikalność ściany komórkowej, częste mutacje
puryn i zmiany LPS
Patogeneza i chorobotwórczość:
•
zakażenia oportunistyczne u osób predysponowanych (rozległe urazy i oparzenia, zabiegi
operacyjne, mukowiscydoza). Kolonizacji w mukowiscydozie sprzyja
wysokie stężenie kwasu sialowego mucynie ślinowej,
zwiększona ekspresja asialogangliozydu – 1 jako receptora dla Pseudomonas w
nabłonku oddechowym,
uszkodzenie nabłonka dr. Oddechowych przez proteazy bakteryjne w tym i P.
aeruginosa z odsłonięciem cytoszkieletu komórkowego silnie wiążącego P. aerug.
Mukowiscydoza sprzyja większemu wydzielaniu egzotoksyny A przez P.aeruginosa
oraz tworzeniu dobrze rozwiniętej otoczki alginianowej.
•
Zakażenia ucha u zdrowych dzieci
•
Bakteriemie i posocznice
•
Zakażenie szpitalne

Diagnostyka:
•
Różne materiały kliniczne
•
Posiew na agar zwykły, podłoże MacConkeya, SS, lub wybiórcze cetrymidowe. Typowe
zapachowe kolonie świecące w promieniach UV
•
Cechy biochemiczne – testy API, ATB, ewentualnie podłoże Hugha-Leifsona (utlenianie
glukozy przy braku jej fermentacji)
Antybiotykowrażliwość – duża oporność, wytwarzanie tzw. Metyloenzymów.
Rodzaj Burkholderia
•
Cepacia – zakażenia oportunistyczne, zakażenia szpitalne, zapalenie płuc z mukowiscydozą
•
Maleli – nieruchome, wywołujące nosaciznę i zwierząt i pośrednio u ludzi
•
Pseudomallei – ruchliwe, wywołują u zwierząt meloidozę, podobną do nosacizny, u ludzi
zakażenie pośrednie drogą wodną lub pokarmową.
Rodzaj Stenotrophomenas:
•
Maltophila – występuje w żywności ale i w wodzie, glebie, ściekach, na roślinach i u
zwierząt. Wywołuje zakażenia szpitalne, szczególnie u osób z obniżoną odpornością (od
zakażenia lokalnego po posocznicę)
Rodzaj Acinetobacter – ziarniako-pałeczki, układają się po dwie lub w krótkie łańcuszki, nie
ruchome. Gram-ujemne, dobrze rosnące na agarze z krwią, MacConkeyu, nie wytwarzają oksydazy
cytochromowej, oporne na wiele antybiotyków, 12 gatunków.
Występowanie – środowisko naturalne: woda, gleba (A. calcoaceticus, johnsoni), produkty
spożywcze w tym mięso ( A. johnsoni, lwoffi), środowisko szpitalne w pobliżu źródeł wody.
Stanowią składnik mikroflory skóry ludzi zdrowych (A. lwoffi, jonhsoni, radioresiscantes), mogą
kolonizować przewód pokarmowy, jamę nosowo-gardłową i pochwę.
Chorobotwórczość – wywołują zakażenia oportunistyczne (wszystkie spotykane) u ludzi z obniżoną
odpornością, a uczestniczą w tym w/w bytujące u ludzi oraz najczęściej izolowanych A. baumani
oraz A. jejuni.
Diagnostyka – podobna jak w przypadku Pseudomonas. Nie wytwarzają barwnika. A. baumani jest
najbardziej oporną na antybiotyki bakterią w tej grupie.
Prątki, promieniowce ( rodzaj Actinomyces, Nocardia)
Rodzina Mycobacteriaceae
Bakterie wolno rosnące, tlenowe, wydłużone, nieznacznie wykrzywione pałeczki o średnicy 0,2-
0,4μm i długości 2-10 μm, zaliczane raczej do Gram + niż do Gram -, kwasoodporne. Występują
jako saprofity w wodzie i glebie oraz jako bakterie chorobotwórcze dla ludzi i zwierząt. Problemy z
klasyfikacją.
Dzieli się je na:
I Pod względem szybkości wzrostu:
●
wolno rosnące (kolonie po siedmiu dniach)-prątki chorobotwórcze,
●
szybko rosnące(kolonie po 48 h) najczęściej saprofity
●
wymagające specjalnych warunków lub dotąd niewyhodowane (M. leprae,
lepraemurium)
II Pod względem chorobotwórczości:
A.Gruźlicze
●
Mycobacterium tuberculosis complex: M. tuberculosis, bovis, bovic BCG, africanum,
microti,
●
Mycobacterium avium complex(MAC) lub Mycobacterium avium intracellulare (MAI): M.
avium, intracellulare, cansasi, fortuitum, marinum, sclofuraceum, cholerae’
(zakażenia u ludzi z obniżoną odpornością, AIDS, zap. węzłów chłonnych, zak. skóry, tk.
łącznej, p. pokarmowego, otrzewnej)
●
M. ulcerans
●
M. leprae
B. Saprofityczne (M. smegmatis)
C. Niegruźlicze
●
Fotochromogeny(2-10 tyg. wzrostu, M. kansasi, marinum),
●
Skotochromogeny (powolny wzrost, M. flavesens, sclofuraceum),
●
Niefotochromogeny (powolny wzrost, M. avium, intracellulare),
●
Prątki szybko rosnące (w ciągu 7 dni, M. fortuitum, smegmatis),
III Pod względem praktycznym:
●
typowe
●
atypowe
●
szybko rosnące
Mycobacterium tuberculosis
Czynniki determinujące chorobotwórczość:
●
czynnik wiązkowy (glikolipid kwasu nikolowego w strukturach zewnętrznych komórki)
●
hamuje migrację leukocytów i wywołuje ziarniaki, uszkadza błony mitochondrialne,
●
w hodowli odpowiada za wężowy wzrost prątków,
●
pobudza mechanizmy odporności u zwierząt (jest immunogenny)
●
sulfatydy – glikolipidy powierzchniowe hamują tworzenie fagolizosomów,
●
Mutacyjne zmiany miejsc docelowych leków p-prątkowych
Patogeneza
1. Gruźlica płuc
●
zakażenie pierwotne (zespół pierwotny)
●
czynna gruźlica
●
reaktywne zakażenie fenomen Kocha
●
gruźlica prosówkowa

2. Gruźlica pozapłucna
●
p. pokarmowy
●
skóra
●
kości i stawy
●
układ moczowy
●
OUN
3. Diagnostyka
●
materiał do badan i jego opracowanie (flokulacja, flotacja, homogenizacja)
●
preparat mikroskopowy barwiony met. Zehla-Neelsena
●
hodowle
-wytwarzanie barwnika, typ wzrostu
- charakterystyka biochemiczna
- próba na katalazę,
- próba niacynowa wg Konno prątki ludzkie – niacyna (+)
- próba z czerwienią obojętna (zjadliwe czerwone, inne-żółte)
- chromatografia cieczowo-gazowa (ośrodki wyspecjalizowane np.CDC)
●
hodowla serologiczna – poszukiwanie przeciwciał metodą ELISA z użyciem antygenów:
- nieoczyszczonych ( kom. bakteryjne poddane działaniu ultradźwięków,
przesącze hodowlane),
-tuberkuliny (PPD),
- oczyszczonych (5,6,p-32, lipoarabinomannan, glikolipidy, czynnik
wiązkowy, antygen błony cytoplazmatycznej, A-60 M. bovis)
●
badania genetyczne,
- hybrydyzacja kwasów nukleinowych
- PCR
●
metody nowoczesne (przyspieszone) radiometryczne, fluoroscencyjne,
- Bactec460 Tb (kwas palmitynowy znakowany c14, wzrost po 6 dniach, typowanie i
antybiogramy po 5 dniach),
- Septi-chec AFB (pożywki stałe i płynne),
- MGIT (hodowle z fluoresceiną rejestrującą ubytek tlenu),
●
próba biologiczna (świnka morska),
4. Lekooporność (badanie bezpośrednie lub pośrednie)
●
metoda proporcji
●
metoda wskaźnika
●
metoda absolutnych stężeń
5. Leczenie i profilaktyka

●
Profilaktyka
- nieswoista
- swoista
●
zapobieganie gruźlicy bydła,
●
szczepionka BCG,
Leczenie
●
leki I rzutu, Sm, INH, RMP,EMB,
●
leki II rzutu, PZA, ETA, C5,KM,CM,VM, hinolony,
●
3 okresy leczenia (18 miesięcy)
-1 okres- 1-3 mies, 3 leki, codziennie w dawkach przeciętnych
-2 okres- 4-12 mies, 2 leki, codziennie w dawkach przeciętnych lib 2x w tygodniu w
dawkach podwyższonych,
-3 okres- 13-18 mies, 1 lek codziennie w dawkach normalnych
Oporność na leczenie:
●
wewnątrzkomórkowe umiejscowienie prątków,
●
serowatość zmian gruźliczych (trudny dostęp leków)
●
nieczynność metabolizmu prątków w przewlekłej chorobie,
●
lekooporność wtórna, niekiedy pierwotna
Prątki inne niż gruźlicze (MOTT)
1. M. cansasi: zapalenie płuc, skóry, węzłów chłonnych
2. M. avium-intracellulare: zakażenia oportunistyczne u osób z obniżoną odpornością,
- M. sclofaceum: ziarniniakowate powierzchnie węzłów chłonnych szyi u dzieci, zespół
gruźliczo podobny,
3. M. fortuitum: ropnie narkomanów, zakażenia implantów,
4. M. marinum: guzkowe owrzodzenie skóry, wtórne wątroby,
Prątki saprofityczne
5. M. phlei, gordone : gleba, woda, rośliny
6. M. smegmatis: wydzielina łojowa u człowieka,
Prątki trądu (Mycobacterium leprae)
●
trąd choroba Hansena
●
postać tuberkuloidowa (plamki na rozległe odbarwienia ciała),
●
postać leproniatyczna (zajęcie skóry i kolagenu, narządów wewnętrznych, bakteriemia
prątkowa),
●
postać graniczna
- diagnostyka
●
histopatologia

●
test z leprominą
●
odowle komórkowe, podtrzymujące wzrost
Rodzina: Actinomycetaceae
Rodzaje: Actinomyces, Nocardia, Streptomyces
Bakterie podobne do prątków, przybierają kształt delikatnych nitkowatych, rozgałęzionych form, o
średnicy 0,3-0,8μm, długości do 50μm, Gram +, rosną w temp. 35-37 C, całkowite lub względne
beztlenowce(Actinomyces), lub tlenowce (Nocardia, Streptomyces),
Actinomyces israeli
Drobnoustroje oportunistyczne lub chorobotwórcze. Wywołuję promienicę, ropnie w okolicach
żuchwy, jamie ustnej, klatce piersiowej i jamie brzusznej drogi rodne kobiet.
Rozpoznanie:
●
badanie histopatologiczne
●
preparat bezpośredni z ropnia- żółte ziarna (ziarna siarkowe) wielkości ziaren prosa. W
środku jest grzybnia, a na powierzchni wypustki ułożone promieniście, zgrubiałe na końcu
tworzące kolbki. Czasami tworzą grzybnię powietrzną.
●
hodowla: podłoża wzbogacone, warunki beztlenowe, wzrost po 24-48h, ale i po 7-14
dniach, kolonie podobne do prątków, wytwarzają barwnik dyfundujący do podłoża, w
podłożach puszystych rośnie w postaci kuleczek na dnie probówki.
Nocardia asteroides
Bakterie, najczęściej saprofity glebowe, nitkowate, tlenowe, tworzą grzybnie wegetatywną,
rozpadającą się na pałeczkowate fragmenty, niektóre są słabo kwasoodporne. Wywołują ropne
zakażenia w płucach, zakażenia skóry, tkanek miękkich kończyn (N. tenis) , uszkadzają włosy i
wywołują łupież rumieniowy skóry.
Rozpoznanie:
●
preparat mikroskopowy- grudka z ropy (ziarenka siarki) roztarte szkiełkiem i zabarwione
metodą Ziehl-Neelsena lub Grama- Rozgałęzione nitki kwasoodporne lub Gram dodatnie.
●
Hodowla
– roztarte grudki posiewa się na agarze na krwią, 2 płytki inkubuje
się
tlenowo w temp. 25-37 C a dwie następne beztlenowo. Nocardia to wzrost po 5 dniach
w warunkach tlenowych, kolonie pofałdowane, nieregularne, woskowe z puszystą
grzybnią, żółte, pomarańczowe lub czerwone.
Document Outline
- Rodzaj: Corynebacterium.
- Rodzaj Listeria.
- Rodzaj Haemophilus
- Rodzaj Bordetella
- Rodzaj Legionella
- Rodzaj Brucella
- Rodzaj Yersynia
- Rodzina Mycoplasmataceae
- Rodzaj Chlamydiae
- Rodzaj Ricketssia
- Rodzaj Coxiella
- Rodzaj Erlichia
- Rodzaj Treponema
- Rodzaj Borelia.
- Rodzaj Leptospira
- Rodzaj Staphylococcus
- Gronkowce koagulozo ujemne / coagulase negative staphylococci – CSN/
- Rodzaj Streptocoocus
- Rodzaj Enterococcus
- Rodzaj Neisseria
- Rodzaj Bacillus
- Rodzaj Clostridium
- Bakterie beztlenowe nieprzetrwalnikujące.
- Rodzaj Campylobacter
- Rodzaj Helicobacter
- Rodzaj Escherichia
- Rodzaj Klebsiella
- Rodzaj Enterobacter
- Rodzaj Salmonella
- Rodzaj Shigella
- Rodzaj Proteus
- Rodzaje: Vibrio, Pseudomonas, Actinetobacter
- Prątki, promieniowce ( rodzaj Actinomyces, Nocardia)
Wyszukiwarka
Podobne podstrony:
Kształtowanie świadomości fonologicznej prezentacja 2009
Mikrobiologia-prezentacja
MSG I STDZIEN Bilans płatn , kurs i rynek walut PREZENTACJA I 2009
prezentacja 2009 drabiny
Mikrobiologia prezentacja
MSG I STDZ OECD i POLSKA PREZENTACJA 8 I 2009
MIKROBIOLOGIA Egzamin 2009-01-23 STOMATOLOGIA, 3 rok stoma, mikroby i immuny, MIKROBY
Mikrobiologia prezent I, Mikrobiologia
TIiK prezentacja 2009 04 24 VII pol
Mikrobiologia prezent II, Mikrobiologia
Pytania z egzaminu teoretycznego z Mikrobiologii Lekarskiej 2009, Medycyna, Mikrobiologia
TGI prezentacja 2009
Kolejność prezentacji 2009, Studia, Politechnika
więcej podobnych podstron