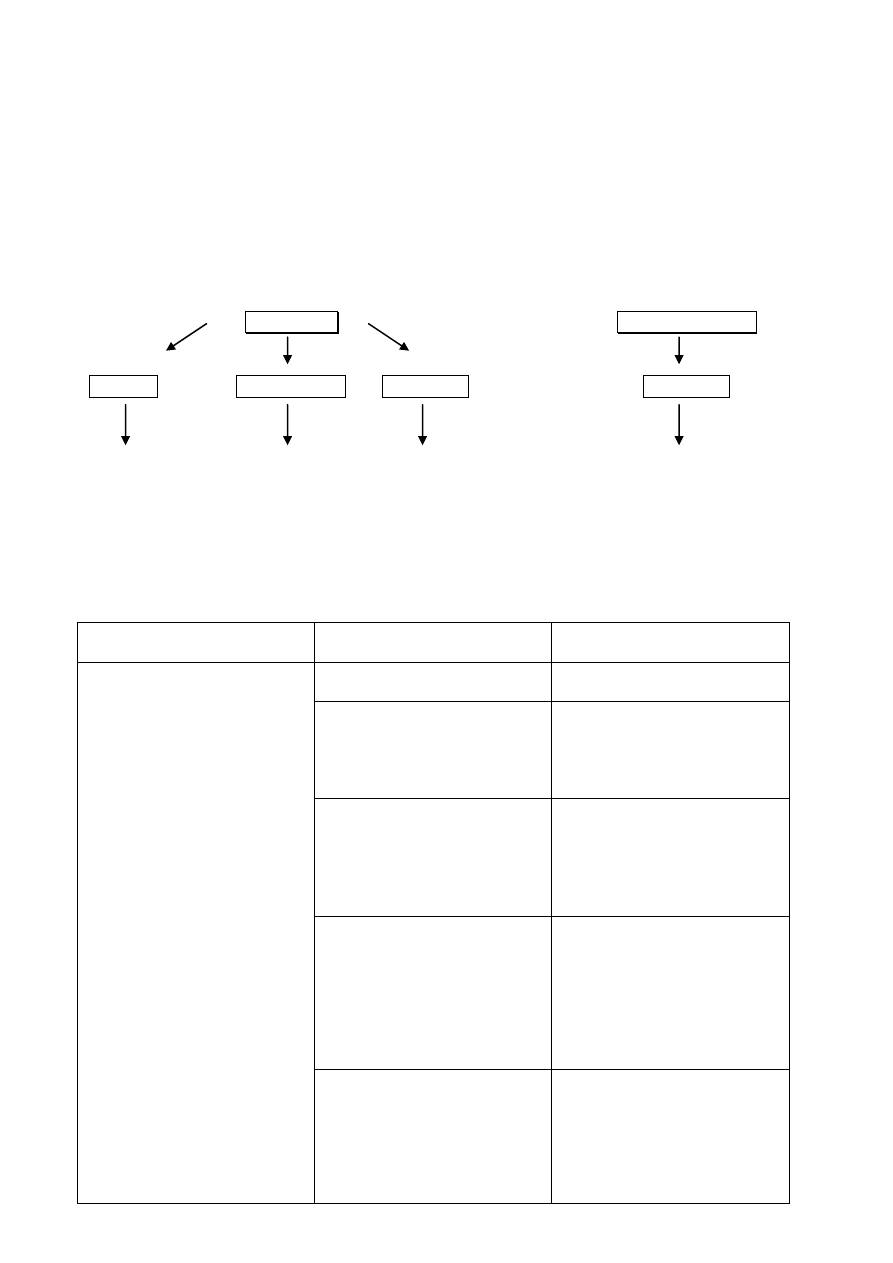
1
Antybiotyki i chemioterapeutyki
1. Podział ogólny preparatów o działaniu przeciwdrobnoustrojowym
Antybiotyk to substancja o aktywności przeciwdrobnoustrojowej, wytwarzana przez mikroorganizmy
(bakterie, grzyby) lub uzyskana na drodze półsyntetycznej lub syntetycznej, mająca swój naturalny wzorzec.
Chemioterapeutyk to substancja o aktywności przeciwdrobnoustrojowej, uzyskana na drodze syntezy
chemicznej, nie posiadająca naturalnego wzorca.
Antybiotyki
Chemioterapeutyki
naturalne
półsyntetyczne syntetyczne
syntetyczne
metabolity naturalny produkt syntetyczne odtworzenie preparaty nie posiadające
drobnoustrojów wyjściowy - struktury naturalnej naturalnego wzorca
pochodne w przyrodzie
uzyskane drogą
chemicznej modyfikacji
2. Grupy chemiczne antybiotyków i chemioterapeutyków
Grupa chemiczna
Podgrupa
Przedstawiciel
β - laktamy
Penicyliny naturalne
penicylina benzylowa,
penicylina fenoksymetylowa
Penicyliny aktywne wobec
penicylinazo (+) szczepów
gronkowców,
w tym penicyliny izoksazolilowe
nafcylina, metycylina (nie
stosowana),
oksacylina, kloksacylina,
dikloksacylina, flukloksacylina
Penicyliny półsyntetyczne
(szerokowachlarzowe):
- aminopochodne:
- karboksypochodne:
– ureidopochodne:
- piperazynowo pochodne:
ampicylina, amoksycylina
karbenicylina, tikarcylina
azlocylina, mezlocylina
piperacylina
Połączenie penicylin z
inhibitorami β - laktamaz
ampicylina + sulbaktam =
Unasyn
amoksycylina + kwas
klawulanowy = Augmentin
tikarcylina + kwas
klawulanowy = Timentin
piperacylina + tazobaktam =
Tazocin
Cefalosporyny (I, II, III, IV
generacja)
I - cefazolina, cefradyna,
cefalotyna, cefaleksyna,
cefadroksyl
II - cefuroksym, cefamandol,
cefaklor, cefprozil, cefoksytyna
III - ceftazydym, cefoperazon,
ceftriakson, cefotaksym,

2
cefiksym, cefetamet, ceftibuten,
moksalaktam
IV - cefepim
Monobaktamy
aztreonam
Karbapenemy
imipenem, meropenem,
doripenem, ertapenem
Makrolidy
Stara generacja
erytromycyna C
14
Makrolidy
Nowa generacja
roksytromycyna C
14
,
klarytromycyna C
14
,
oleandomycyna C
14
,
azytromycyna C
15
, josamycyna
C
16
,
spiramycyna C
16
Ketolidy
trolitromycyna
Linkozamidy
-
linkomycyna, klindamycyna
Tetracykliny
-
tetracyklina, doksycyklina,
minocyklina
Aminoglikozydy
Naturalne
streptomycyna, neomycyna,
kanamycyna, gentamycyna,
tobramycyna, sisomycyna
Półsyntetyczne
netylmycyna, amikacyna
Streptograminy
Grupa A
pristinamycyna IIA i IIB –
półsyntetyczne pochodne
chinupristina, dalfopristina
Grupa B
Pristinamycyna IA i
wirginamycyna S1
Oksazolidynony
-
linezolid
Glikopeptydy
-
wankomycyna, teikoplanina
Lipopeptydy
-
daptomycyna
Chloramfenikol
-
chloramfenikol
Polimiksyny
-
kolistyna
Ryfamycyny
-
ryfampicyna
Chinolony
Stare
kwas nalidyksowy, kwas
pipemidynowy
Nowe - fluorochinolony
ciprofloksacyna, ofloksacyna,
norfloksacyna, pefloksacyna,
lewofloksacyna, enoksacyna
Nitrofurany
-
Nitrofurantoina, furagin,
nifuroksazyd
Nitroimidazole
-
Metronidazol, ornidazol
Sulfonamidy
-
sulfametoksazol
Leki przeciwgrzybicze
Polieny
nystatyna, natamycyna,
amfoterycyna B
Azole
flukonazol, ketokonazol,
ekonazol, mikonazol, tiokonazol,
itrakonazol, klotrimazol,
terkonazol, worikonazol
Antymetabolity
5-fluorocytozyna
Echinokandyny
kapsifungina
Leki przeciwwirusowe
-
acyklowir, zydowudyna,
gancyklowir, lamiwudyna,
rybawiryna, widarabina,
amantadyna, didanozyna,
foskarnet, interferon,
delawirdyna, zanamiwir,
sakwinawir, ritonawir, indinawir,
nelfinawir

3
3. Mechanizm, sposób i spektrum działania antybiotyków i chemioterapeutyków
Mechanizm działania
- blokowanie biosyntezy ściany komórkowej
antybiotyki β-laktamowe: penicyliny, połączenie penicylin z inhibitorami β-laktamaz,
cefalosporyny, monobaktamy, karbapenemy;
glikopeptydy
fosfomycyna
bacytracyna
- uszkodzenie błony protoplazmatycznej
polimiksyny
leki przeciwgrzybicze
- blokowanie biosyntezy białka
makrolidy
ketolidy
linkozamidy
streptograminy
aminoglikozydy
tetracykliny
oksazolidynony
chloramfenikol
kwas fusydowy
- blokowanie syntezy DNA
chinolony
nitroimidazole
nitrofurany
ryfamycyny
kotrimoksazol
leki przeciwwirusowe
- konkurencyjne wnikanie w łańcuch metaboliczny
sulfonamidy
Penicyliny i cefalosporyny
– wiążą i unieczynniają tzw. białka wiążące penicyliny PBP (penicillin binding proteins): transpeptydazę,
karboksypeptydazę i inne enzymy związane z syntezą ściany komórkowej. Unieczynnienie transpeptydazy
hamuje wiązanie krzyżowe peptydoglikanu, a przez to ściany komórkowej.
Wankomycyna, cykloseryna, bacytracyna
– hamują polimeryzację peptydoglikanu (syntezę ściany komórkowej) poprzez wiązanie się z peptydami
zawierającymi D-alanylo-D-alaninę.
Ryfampicyna
– inhibitor transkrypcji RNA – unieczynnia polimerazę RNA zależną od DNA
Chinolony
– hamują bakteryjną gyrazę DNA (topoizomerazę II lub topoizomerazę IV) prowadząc do zahamowania
replikacji DNA
Chloramfenikol, makrolidy, linkozamidy, streptograminy
– wiążą się z podjednostką 50S rybosomu, hamują peptydylotransferazę, prowadząc do przedwczesnego
zakończenia tworzenia łańcuchów peptydowych.
Aminoglikozydy
– wiążą się z jednostką 30S rybosomu bakteryjnego tworząc kompleks 30S-50S, blokują miejsca inicjujące
syntezę kwasów nukleinowych lub zaburzają tripletowe kodowanie mRNA. W konsekwencji bakterie stają się
niezdolne do syntezy łańcucha peptydowego.
Tetracykliny
- wiążą się z jednostką 30S rybosomu bakteryjnego, blokują wiązanie tRNA z kompleksem rybosom-mRNA,
hamują wydłużanie peptydów.
Sulfonamidy, trimetoprim
– blokują aktywność syntetazy dihydropterynianu i reduktazy dihydrofolianu, hamując syntezę nukleotydów.
Oksazolidynony
– miejscem ich działania są obie podjednostki rybosomalnego DNA. Hamują syntezę białka komórkowego
poprzez blokowanie translokacji tRNA. Tworzący się łańcuch peptydowy ulega znacznemu skróceniu.
4
Sposób działania
Antybiotyki mogą wykazywać działanie bakteriobójcze lub bakteriostatyczne. Miarą aktywności
bakteriobójczej antybiotyku jest najmniejsze stężenie bakteriobójcze MBC (Minimal Bactericidal
Concentration). MBC określa minimalne stężenie leku (mg/l lub μg/ml), oznaczone w warunkach in vitro, przy
którym ginie 99,9% komórek bakteryjnych przy określonej gęstości inokulum, w określonym czasie.
Najmniejsze stężenie hamujące MIC (Minimal Inhibitory Concentration) określa aktywność bakteriostatyczną
antybiotyku. MIC to najmniejsze stężenie leku (mg/l lub μg/ml), oznaczone w warunkach in vitro, hamujące
wzrost bakterii przy określonej gęstości inokulum, w określonym czasie.
Za bakteriobójcze uważa się te preparaty, dla których stosunek wartości MBC/MIC jest mniejszy lub równy 4.
Antybiotyki o wysokiej aktywności bakteriobójczej charakteryzują się zbliżoną wartością MBC do wartości
MIC.
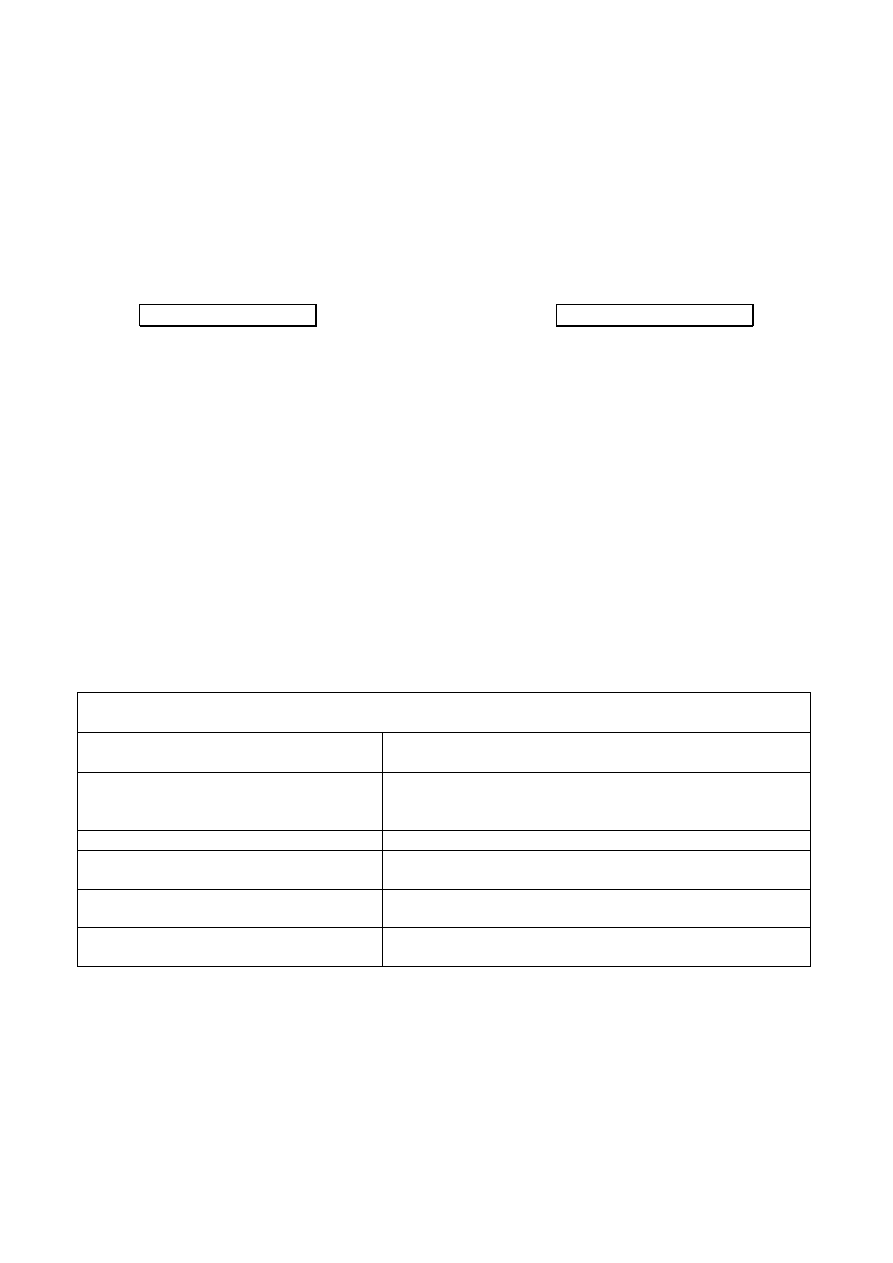
działanie bakteriobójcze
działanie bakteriostatyczne
↓
↓
↓
efekt zależny
efekt zależny
zahamowanie wzrostu
od maksymalnego od czasu, w którym stężenie
↓
stężenia
przekracza wartości MIC
↓
↓
- aminoglikozydy
- β-laktamy
- chloramfenikol
- chinolony
- makrolidy/ketolidy
- linkozamidy
- tetracykliny
- trimetoprim
- sulfonamidy
Zakres działania
Leki przeciwbakteryjne mogą wykazywać wąskie spektrum działania ograniczone do jednej grupy lub
jednego typu drobnoustrojów (np. Gram-ujemne lub Gram-dodatnie) lub szerokie spektrum działania
obejmujące swoją aktywnością bakterie Gram-ujemne i Gram-dodatnie, a czasem również beztlenowce.
Podział antybiotyków w zależności od spektrum działania
Typ drobnoustrojów
Aktywne antybiotyki
Bakterie Gram-dodatnie
Penicylina G, penicylina fenoksymetylowa, glikopeptydy,
makrolidy, linkozamidy, kwas fusydowy, linezolid
(oksazolidynony)
Bakterie Gram-ujemne
Aztreonam (monobaktamy)
Bakterie Gram-dodatnie i Gram-ujemne
Penicyliny półsyntetyczne, cefalosporyny, aminoglikozydy,
chinolony, tetracykliny, kotrimoksazol
Bakterie beztlenowe (+/- tlenowe)
Linkozamidy,
metronidazol,
chloramfenikol,
penicyliny/inhibitor, cefoksytyna/cefotetan
Bakterie atypowe
Makrolidy/ketolidy, streptograminy, tetracykliny, chinolony,
ryfampicyna, kotrimoksazol
4. Metody oznaczania wrażliwości na antybiotyki i chemioterapeutyki w oparciu o zalecenia
EUCAST (European Committee on Antimicrobial Susceptibility).
Określenie wrażliwości drobnoustroju na antybiotyki i chemioterapeutyki związane jest z poznaniem i
zdefiniowaniem podstawowych pojęć. Zalecenia EUCAST wprowadzają dwie kategorie wartości granicznych:
- kliniczne wartości graniczne służące do przewidywania możliwości osiągnięcia sukcesu terapeutycznego -
informacja dla lekarzy
- epidemiologiczne wartości graniczne (określane w skrócie ECOFF) stosowane do monitorowania zmian w
oporności populacji danego gatunku drobnoustrojów izolowanych z materiałów klinicznych - ważne narzędzie
dla mikrobiologów i zespołów zakażeń szpitalnych.

5
Kliniczne wartości graniczne są zdefiniowane następująco:
- wrażliwość kliniczna – oznacza wrażliwość drobnoustroju na standardowe dawki leku i wysokie
prawdopodobieństwo sukcesu terapeutycznego. Na skuteczność kliniczną, oprócz wrażliwości drobnoustroju na
dany antybiotyk in vitro, ma wpływ szereg czynników: właściwości farmakokinetyczne i farmakodynamiczne
stosowanego leku przeciwdrobnoustrojowego oraz aktywność układu immunologicznego pacjenta.
- kliniczna średnia wrażliwość – oznacza, że szczep mieści się w zakresie wartości MIC pomiędzy wrażliwym
a opornym; efekt terapeutyczny jest niepewny, ale może zostać osiągnięty, jeśli zakażenie przebiega z taką
lokalizacją, gdzie lek jest fizycznie zagęszczany (np. układ moczowy) lub jest możliwość podania wysokich
dawek leku.
- oporność kliniczna – oznacza wysokie prawdopodobieństwo niepowodzenia terapeutycznego, nawet w
przypadku zastosowania wysokich dawek leku.
Epidemiologiczne wartości graniczne (ECOFF) wynikają z zebrania wyników oznaczeń lekowrażliwości
pochodzących z różnych lat i z różnych ośrodków zajmujących się monitorowaniem lekowrażliwości
drobnoustrojów i analizy rozkładu wartości MIC dla poszczególnych antybiotyków i poszczególnych gatunków
drobnoustrojów. Oddzielają one populacje „szczepów dzikich”, czyli szczepów bez nabytych mechanizmów
oporności, wykazujących „oporność mikrobiologiczną” na dany antybiotyk.
Szczep dziki (ang. wild type WT) – szczep należący do najbardziej wrażliwej populacji, nie posiadający
nabytego drogą transferu horyzontalnego lub mutacji mechanizmu oporności na dany lek; klinicznie może nie
odpowiadać na leczenie danym lekiem ze względu na naturalną oporność; jest charakteryzowany przez
zastosowanie odpowiedniego, fenotypowego punktu odcięcia wartości MIC dla danego gatunku.
Oporność mikrobiologiczna (ang. Non-Wild Type NWT)) – szczep „nie-dziki” to szczep posiadający
nabyte drogą transferu lub mutacji mechanizmy oporności na dany lek; jest charakteryzowany poprzez
zastosowanie odpowiedniego, fenotypowego punktu odcięcia wartości MIC dla danego gatunku; szczep taki w
niektórych przypadkach może odpowiadać na leczenie danym lekiem jeśli wykazuje wartości MIC w zakresie
klinicznej wrażliwości.
Oporność krzyżowa – oznacza niewrażliwość na wszystkie lub niektóre antybiotyki należące do tej samej
grupy chemicznej (np. antybiotyki β-laktamowe, aminoglikozydy, makrolidy) lub czasem nie spokrewnionej
grupy chemicznej, gdy miejsca uchwytu dla antybiotyków znajdują się blisko siebie (np. oporność na makrolidy
i linkozamidy). Mechanizmy oporności wynikające z braku przepuszczalności błony komórkowej lub
aktywnego wypompowywania leku z komórki mogą powodować oporność na więcej niż jedną grupę
chemiczną, zjawisko to jest niekiedy określane jako oporność skojarzona.
A. Metody jakościowe oznaczania lekowrażliwości bakterii
a) metoda dyfuzyjno-krążkowa
Oznaczenie wykonywane jest:
dla pałeczek Enteobacteriaceae, pałeczek niefermentujących (Pseudomonas
spp., Acinetobacter spp., Stenotrophomonas maltophilia), Staphylococcus spp.,
Enterococcus spp. na podłożu Mueller-Hinton (MH)
dla drobnoustrojów o szczególnych wymaganiach (Streptococcus spp.,
Haemophillus spp., Moraxella catarrhalis) na podłożu Mueller-Hinton z 5%
krwią końską i 20mg/L NAD (MH-F).
Skład podłoża jest ściśle ustalony, a grubość podłoża nie powinna przekraczać 4 mm (na bardzo cienkich
podłożach może wytwarzać się większa strefa zahamowania wzrostu, odwrotnie przy zbyt grubym podłożu).
Podłoże wpływa na wielkość strefy, decydując o stopniu wzrostu, współczynniku dyfuzji i aktywności leku.
Przygotowuje się zawiesinę bakterii o zmętnieniu odpowiadającym bezwzględnie 0,5 jednostki w skali
McFarlanda. W przypadku zbyt małej gęstości zawiesiny strefa zahamowania wzrostu, niezależnie od
wrażliwości mikroorganizmu, będzie większa i oporne szczepy mogą zostać zakwalifikowane jako wrażliwe.
Przy zbyt dużej gęstości zawiesiny, wielkość uzyskanej strefy zahamowania wzrostu będzie mniejsza, a szczepy
wrażliwe mogą zostać zakwalifikowane jako oporne.
Zawiesinę nanosi się na powierzchnię podłoża za pomocą jałowej wymazówki odciśniętej uprzednio o
ścianki probówki w celu usunięcia nadmiaru płynu. Całą powierzchnię agaru pokrywa się zawiesiną, obracając
płytkę trzykrotnie o kąt 60
o
.

6
Na powierzchnię posianego podłoża w ciągu 15 minut nakłada się krążki z antybiotykami (na
posianych płytkach pozostawionych w temperaturze pokojowej dłużej niż podano, przed nałożeniem krążków
dochodzi do namnożenia szczepów i w efekcie strefy zahamowania wzrostu mogą być mniejsze i szczepy mogą
zostać zakwalifikowane jako oporne) w odległości 24 mm jeden od drugiego (najlepiej za pomocą dyspensera,
który ułatwia właściwe rozmieszczenie krążków na podłożu). Na płytce o średnicy 10 cm układa się nie więcej
niż 5 krążków, natomiast na płytce o średnicy 15 cm – 12 krążków. Właściwe rozmieszczenie krążków
zapobiega nakładaniu się stref zahamowania wzrostu lub powstawaniu zniekształceń przy brzegach płytki.
Średnica strefy zahamowania wzrostu zależy od zawartości antybiotyku w krążku. Krążki wymagają
odpowiedniego przechowywania, zgodnie z instrukcją.
Po posiewie przed ułożeniem krążków należy odczekać około 15 minut w celu wysuszenia płytek. Po
15 – minutowej preinkubacji w temperaturze pokojowej, należy rozpocząć inkubację w temperaturze 35
o
C przez
16-18 godzin. WYJĄTEK! Dla cefoksytyny i wankomycyny inkubację prowadzi się pełne 24 godziny.
Miarą wrażliwości badanego szczepu na antybiotyk jest wielkość średnicy strefy zahamowania wzrostu
mierzona z dokładnością do 1 mm przy pomocy cyrkla, linijki lub aparatu do pomiaru stref zahamowania
wzrostu. Strefę zahamowania wzrostu odczytuje się w dziennym świetle przechodzącym (dla cefoksytyny w
świetle odbitym).
Dla prawidłowo wykonanych posiewów uzyskuje się koliste strefy zahamowania wzrostu, a wzrost
bakterii jest równomierny. Korzystając z tablic EUCAST, zawierających wytyczne co do wielkości stref
zahamowania wzrostu dla poszczególnych antybiotyków i drobnoustrojów, należy zakwalifikować badany
szczep jako: wrażliwy (S - susceptible) lub oporny (R – resistant), a dla niektórych antybiotyków i
drobnoustrojów średnio wrażliwy (I - intermediate).
Precyzja i dokładność metody powinny być monitorowane za pomocą programu kontroli jakości.
Okresowo (raz w miesiącu, przy nowej serii krążków) przeprowadza się kontrole wrażliwości dla szczepów
wzorcowych o znanej lekowrażliwości. Uzyskiwanie wyników, które nie mieszczą się w określonym zakresie,
może być efektem błędu technicznego lub użycia niewłaściwych odczynników. Należy sprawdzić każdy
odczynnik i etap badania, odnaleźć i wyeliminować błąd.
Fot.1. Dyspenser (H. Kukuła)
Fot.2. Antybiogram (bioMerieux)
Metoda stężeń granicznych (breakpoint) polega na
zakwalifikowaniu drobnoustroju do jednej z trzech kategorii: wrażliwy, średnio wrażliwy, oporny, na
podstawie zachowania się szczepu wobec dwóch granicznych stężeń antybiotyku. Stężenia graniczne
opisywane są jako c i C, co oznacza niskie i wysokie stężenie antybiotyku. Wzrost szczepu w obecności
niskiego i wysokiego stężenia antybiotyku oznacza, że szczep jest oporny; wzrost tylko w obecności
niskiego stężenia antybiotyku oznacza, że szczep jest średnio wrażliwy; brak wzrostu w obecności
7
niskiego i wysokiego stężenia antybiotyku oznacza, że szczep jest wrażliwy. Badanie można
przeprowadzić w podłożu płynnym lub na podłożu stałym.
b)
Metody ilościowe oznaczania lekowrażliwości bakterii
- metoda seryjnych rozcieńczeń w podłożu płynnym (makro- i mikrorozcieńczeń)
Metoda ta pozwala na określenie wartości MIC czyli najmniejszego stężenia antybiotyku koniecznego do
zahamowania wzrostu szczepu odpowiedzialnego za zakażenie oraz na oznaczenie najmniejszego stężenia
bakteriobójczego – MBC.
a) klasyczna metoda makrorozcieńczeń
Przygotowuje się serię probówek zawierających taką samą objętość bulionu (minimalna objętość bulionu 2 ml) i
seryjne rozcieńczenie danego antybiotyku. Do każdej probówki z bulionem i odpowiednim rozcieńczeniem
antybiotyku dodaje się jednakową objętość standaryzowanej zawiesiny badanego drobnoustroju. Probówka
kontrolna nie zawiera antybiotyku. Roztwory inkubuje się przez 18-24 godziny. Odczyt polega na obserwacji
zmętnienia w probówkach po zakończonej inkubacji.
W probówkach, w których stężenie antybiotyku jest niższe niż stężenie hamujące, bakterie rosną i
obserwowalne jest zmętnienie. W probówkach, w których stężenie antybiotyku jest równe lub większe od
stężenia hamującego, bulion pozostaje klarowny. Najniższe stężenie, w którym nie obserwuje się wzrostu
określa się jako MIC.
1 dzień
1 ml zawiesiny zawierającej 1 x 10
6
CFU/ml
wprowadzić do każdej probówki z szeregu rozcieńczeń antybiotyku w bulionie
1 ml 1 ml 1 ml 1 ml 1 ml
↓ ↓ ↓ ↓ ↓ ↓
→
kontrola
1ml
bulionu
64 μg/ml 32 16 8 4 0
↑ ↑ ↑ ↑ ↑ ↑
→
kontrola
Teraz probówki zawierają po 2 ml bulionu z antybiotykiem w μg/ml
i bakteriami w liczbie N = 5,0 x 10
5
CFU/ml
2ml
→ 0,5 ml →
32 μg/ml 16 8 4 2 0
0,5 ml z probówki kontrolnej przenieść do 0,5 ml bulionu
Całonocna inkubacja
a następnie 0,001 ml wysiać na
2 dzień
podłoże agarowe
↓ ↓ ↓ ↓ ↓ ↓
↓
32
MIC = 8 μg/ml
32 μg/ml 16 8 4 2 0
Z probówek nie wykazujących
wzrostu wysiać po 0,1 ml
na podłoże agarowe
0,1ml
250 CFU
Całonocna inkubacja
250 CFU odpowiada 5,0 x 10
5
CFU/ml
3 dzień
N
A
= 7,0 x 10 CFU/ml
MBC = 8 μg/ml
Wartość MBC w podanym przykładzie wynosi 8 μg/ml i jest równa wartości MIC.
Stosunek MBC/MIC = 8μg/ml / 8
μg/ml
= 1
-
taki antybiotyk wykazuje aktywność bakteriobójczą.

8
Metoda makrorozcieńczeń stosowana jest głównie tam, gdzie pojawia się potrzeba wykonania oznaczenia
wrażliwości na pojedynczy antybiotyk dla jednego szczepu.
b) metoda mikrorozcieńczeń – pozwala również na wyznaczenie wartości MIC, ale wykonywana jest na
płytkach titracyjnych, zawierających w studzienkach odpowiednie rozcieńczenia antybiotyku w formie
zliofilizowanej. Objętość bulionu z zawiesiną bakteryjną dodawaną do każdego rozcieńczenia
antybiotyku wynosi 100 μl.
- metoda seryjnych rozcieńczeń w agarze – pozwala na określenie wartości MIC. W metodzie
tej antybiotyk jest obecny w podłożu agarowym w malejących stężeniach (jedno podłoże - jedno
stężenie antybiotyku), na które posiewa się zawiesinę bakterii o określonym inokulum. Wartość
MIC wyznacza stężenie antybiotyku w podłożu, przy którym brak wzrostu drobnoustrojów.
- gradient stężeń (E-testy, M.I.C EVALUATOR) - metoda dyfuzyjna pozwalająca na
wyznaczenie wartości MIC antybiotyku. Jest to pasek plastikowy wysycony antybiotykiem w
gradiencie stężeń, który nakłada się na powierzchnię podłoża z wysianym szczepem. Po
inkubacji odczytuje się wartość MIC, którą wyznacza wyraźny punkt przecięcia eliptycznej
strefy zahamowania wzrostu drobnoustrojów z określoną wartością stężenia antybiotyku na
pasku (poza określonymi wyjątkami). Jest to metoda prosta, wygodna, mniej czuła na
niepoprawnie przygotowane inokulum.
Fot.3. E-test (H. Kukuła)
Fot. 4. M.I.C. Evaluator (Oxoid)
Oznaczanie w warunkach in vitro wartości MIC i MBC
pozwala przeprowadzić spekulację – czy stężenie jakie stosowany antybiotyk osiąga w ognisku zakażenia
odpowiada wartości MIC lub MBC w stosunku do drobnoustroju odpowiedzialnego za zakażenie. Stężenie
antybiotyku w surowicy odpowiadające wielokrotności wartości MIC zwiększa prawdopodobieństwo
osiągnięcia pożądanego efektu terapeutycznego. Wartość prognostyczną mają także badania, oceniające efekt
bakteriobójczy surowicy chorego, leczonego określonym antybiotykiem lub antybiotykami w skojarzeniu.
Badanie takie ocenia sumę działania bakteriobójczego surowicy i zastosowanego antybiotyku i czasem jest
konieczne do oznaczenia, głównie u chorych z zakażeniami trudnymi do leczenia, np. endocarditis (zapalenie
wsierdzia), osteomyelitis (zapalenie kości i szpiku) lub w przypadku stosowania antybiotyków
charakteryzujących się dużą toksycznością i niewielką różnicą między dawką terapeutyczną a toksyczną
(aminoglikozydy, wankomycyna).
Oznaczenie aktywności bakteriobójczej surowicy chorego
przeprowadza się metodą seryjnych rozcieńczeń. W metodzie tej w dwóch szeregach probówek sporządza się
wzrastające rozcieńczenia antybiotyku wzorcowego i badanego. Jako rozcieńczalnika używa się specjalnego
podłoża bulionowego, umożliwiającego wzrost używanego w badaniach szczepu wzorcowego. Do wszystkich
probówek, z wyjątkiem kontroli, dodaje się zawiesiny wrażliwego szczepu wzorcowego i próbki inkubuje się
przez 16-18 godzin. W probówkach, w których stężenie antybiotyku jest odpowiednio małe, występuje wzrost
drobnoustrojów, natomiast tam, gdzie stężenie antybiotyku jest odpowiednio duże, następuje zahamowanie
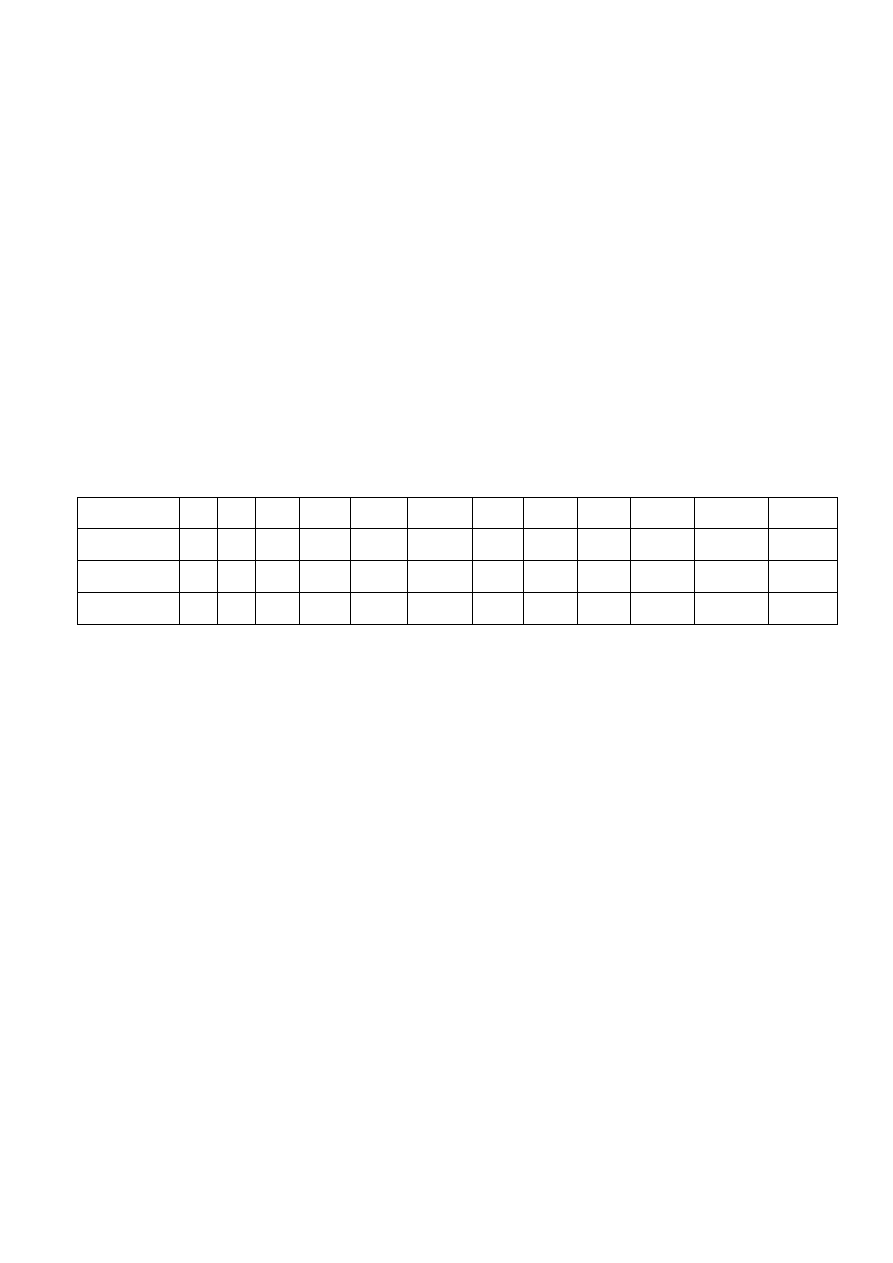
9
wzrostu. Znając najmniejsze stężenie hamujące wzrost szczepu wzorcowego przez antybiotyk wzorcowy,
można określić ile antybiotyku znajduje się w 1ml badanej surowicy.
Wykonanie (na przykładzie miareczkowania penicyliny):
- rozlać aseptycznie do 12 probówek po 2 ml jałowego podłoża bulionowego (11 probówka stanowi kontrolę
jałowości bulionu, 12 – kontrolę wzrostu szczepu)
- z probówki zawierającej roztwór penicyliny o stężeniu 2j/ml przenieść pipetą 2 ml do pierwszej probówki;
zmienić pipetę; wymieszać płyn w probówce i przenieść 2 ml roztworu z pierwszej probówki do drugiej;
zmienić pipetę i po wymieszaniu przenieść 2 ml roztworu do trzeciej probówki, itd. aż do ostatniej probówki w
szeregu; z ostatniej probówki po wymieszaniu usunąć 2 ml płynu.
W ten sposób uzyskuje się szereg rozcieńczeń penicyliny. W pierwszej probówce stężenie penicyliny wynosi
1j/ml, w drugiej 0,5j/ml, w trzeciej 0,25j/ml, itd.
- przygotować rozcieńczenie hodowli bulionowej szczepu wzorcowego w bulionie w stosunku 1:1000
- dodać do wszystkich probówek, z wyjątkiem 11, po 2 krople przygotowanej zawiesiny szczepu
- umieścić statyw z probówkami w cieplarce na 16-18 w temperaturze 35
o
C
- w ten sam sposób przygotować rozcieńczenia roztworu o nieznanej zawartości antybiotyku (surowicy) i po
dodaniu szczepu wzorcowego również umieścić w cieplarce
- po zakończeniu inkubacji odczytać wyniki
- obliczyć ile penicyliny (w jednostkach) znajduje się w 1 ml badanego roztworu (surowicy).
Stężenie antybiotyku w badanym roztworze oblicza się przez pomnożenie największego rozcieńczenia
wykazującego brak wzrostu przez stężenie antybiotyku w analogicznym szeregu wzorcowym.
Stężenie
antybiotyku
1
0,5
0,25
0,125
0,0625
0,03125
0,016
0,0078
0,0039
0,00195
j/ml
Kontrola
jałowości
Kontrola
wzrostu
Roztwór
wzorcowy
-
-
-
-
-
-
-
-
-
+
-
+
Rozcieńczenie
antybiotyku
1:2
1:4
1:8
1:16
1:32
1:64
1:128
1:256
1:512
1:1024
Kontrola
jałowości
Kontrola
wzrostu
Roztwór
badany
-
-
-
-
-
-
-
-
+
+
-
+
„+” – wzrost „-„ – brak wzrostu
Największe rozcieńczenie nie wykazujące wzrostu w szeregu badanym = 1:256
Najmniejsze stężenie w szeregu z roztworem wzorcowym nie wykazujące wzrostu odpowiada stężeniu
0,0039 j/ml
Stąd: 256 j/ml x 0,0039 j/ml = 0,998 j/ml
10
Część praktyczna
1. Wykonaj badanie wrażliwości na antybiotyki szczepu Escherichia coli metodą dyfuzyjno-
krążkową zgodnie z wytycznymi EUCAST.
Przygotuj zawiesinę bakterii o gęstości 0,5 jMcF w 0,9%
jałowym roztworze NaCl (porównaj zmętnienie z wzorcem). Jałową wymazówkę zanurz w
zawiesinie, odciśnij nadmiar płynu o ściankę probówki, a następnie wykonaj posiew
drobnoustrojów na podłożu Mueller-Hinton (trzy razy obracając płytkę o 60
o
). Odczekaj 15 minut i
nanieś przy pomocy pęsety krążki z antybiotykami, zachowując odległość 24mm między
krążkami. Po 15 minutowej preinkubacji w temperaturze pokojowej, płytki włóż do cieplarki
nastawionej na temperaturę 35
o
C. Takie samo oznaczenie wykonaj ze szczepem wzorcowym
Escherichia coli ATCC 25922. Odczytaj średnice stref zahamowania wzrostu bakterii po 16-18
godzinnej inkubacji.
Wpisz uzyskane średnice do tabeli i zinterpretuj wynik w oparciu o zamieszczone poniżej kryteria
EUCAST.
Antybiotyk/stężenie/skrót
Średnica strefy zahamowania
wzrostu w mm
Interpretacja*
Escherichia coli
ATCC 25922
I
szczep
II
szczep
Escherichia coli
ATCC 25922
I
szczep
II
szczep
Ampicylina 10 μg (AM, AMP)
Amoksycylina/kwas
klawulanowy 20/10 μg (AMC)
Cefuroksym 30 μg (CXM)
Gentamycyna 10 μg (GM)
* O – oporny (resistant) św – średnio wrażliwy (intermediate) W – wrażliwy (susceptible)
Dla szczepu wzorcowego „Z” – wynik zgodny „NZ” – wynik niezgodny z kryteriami
Kryteria interpretacji EUCAST dla szczepu badanego Escherichia coli
Antybiotyk/stężenie/skrót
Średnica strefy zahamowania wzrostu w mm
Wrażliwy
S
średnio
wrażliwy
I
Oporny
R
Ampicylina 10 μg (AM, AMP)
≥14
-
<14
Amoksycylina/kwas klawulanowy 20/10 μg
(AMC)
≥17
-
<17
Cefuroksym 30 μg (CXM)
≥ 18
-
<18
Gentamycyna 10 μg (GM)
≥ 17
14-16
<14
Kontrola jakości oznaczenia lekowrażliwości z zastosowaniem szczepu wzorcowego Escherichia coli
ATCC 25922
Antybiotyk/stężenie/skrót
Escherichia coli ATCC 25922
Średnica strefy zahamowania wzrostu w mm
Ampicylina 10 μg (AM, AMP)
16-22
Amoksycylina/kwas klawulanowy 20/10 μg (AMC)
18-24
Cefuroksym 30 μg (CXM)
20-26
Gentamycyna 10 μg (GM)
19-26
11
2. Odczytaj wartości MIC piperacyliny (antybiotyk β-laktamowy z grupy penicylin
półsyntetycznych) szczepów Escherichia coli pochodzących z różnych materiałów
klinicznych. Badanie zostało wykonane klasyczną metodą makrorozcieńczeń w bulionie
Mueller-Hinton. Wpisz odczytane wartości do tabeli i zinterpretuj wynik.
Materiał
Stężenie piperacyliny (PIP) μg/ml
MIC
szczepu
badanego
Interpretacja
*
MIC
Escherichia
coli
ATCC
25922
Interpretacja**
4
8
16
32
0
(kontrola
)
1. Krew
2. Wymaz z rany oparzeniowej
3. Wydzielina z dolnych dróg
oddechowych
4. Żółć
Wpisz: „+” – wzrost „-„ – brak wzrostu
* O – oporny (resistant) św – średnio wrażliwy (intermediate) W – wrażliwy (susceptible)
** Dla szczepu wzorcowego „Z” – wynik zgodny „NZ” – wynik niezgodny z kryteriami
Kryteria interpretacji EUCAST dla piperacyliny
Wartość MIC piperacyliny w μg/ml
Wrażliwy
S
średnio wrażliwy
I
Oporny
R
Szczep badany
Escherichia coli
≤ 8
16
>16
Escherichia coli ATCC
25922
1- 4
-
-
3. Odczytaj wartości stężeń granicznych piperacyliny dla szczepów Escherichia coli
pochodzących z różnych materiałów klinicznych. Badanie zostało wykonane metodą
makrorozcieńczeń w podłożu agarowym Mueller-Hinton. Wpisz odczytane wartości do
tabeli i zinterpretuj wynik.
Materiał
Stężenie piperacyliny w μg/ml
8
16
0 (kontrola)
Interpretacja*
1. Krew
2. Wymaz z rany
oparzeniowej
3. Wydzielina z dolnych
dróg oddechowych
4. Żółć
Wpisz: „+” – wzrost „-„ – brak wzrostu
* O – oporny (resistant) św – średnio wrażliwy (intermediate) W – wrażliwy (susceptible)

12
4.
Podaj stężenie penicyliny w surowicy ludzkiej. Oznaczenie zostało wykonane metodą
seryjnych rozcieńczeń.
Stężenie antybiotyku w badanym roztworze oblicza się przez pomnożenie największego rozcieńczenia
wykazującego brak wzrostu przez stężenie antybiotyku w analogicznym szeregu wzorcowym.
Stężenie
antybiotyku
1
0,5
0,25
0,125
0,0625
0,03125
0,016
0,0078
0,0039
0,00195
j/ml
Kontrola
jałowości
Kontrola
wzrostu
Roztwór
wzorcowy
Rozcieńczenie
antybiotyku
1:2
1:4
1:8
1:16
1:32
1:64
1:128
1:256
1:512
1:1024
Kontrola
jałowości
Kontrola
wzrostu
Roztwór
badany
„+” – wzrost „-„ – brak wzrostu
Największe rozcieńczenie nie wykazujące wzrostu w szeregu badanym = ?
Najmniejsze stężenie w szeregu wzorcowym nie wykazujące wzrostu odpowiada stężeniu = ?
Stężenie penicyliny wynosi………………………………

13
Wyszukiwarka
Podobne podstrony:
Ćw 9 ANTYBIOTYKI BAKTERIOSTATYCZNE
FARMAKOLOGIA ćwiczenie 6 Antybiotyki bakteriosatyczne, 3 rok stoma, farma, II kolo F, cw
ćw 4 Profil podłużny cieku
biofiza cw 31
Kinezyterapia ćw synergistyczne
Cw 1 ! komorki
Pedagogika ćw Dydaktyka
Cw 3 patologie wybrane aspekty
Praktyczne zasady antybiotykoterapii
Cw 7 IMMUNOLOGIA TRANSPLANTACYJNA
Cw Ancyl strong
Cw 1 Zdrowie i choroba 2009
Rehabilitacja medyczna prezentacja ćw I
więcej podobnych podstron