Temat: ELEKTROLIZA WODNYCH ROZTWORÓW ELEKTROLITÓW
Przebiegająca w ogniwie galwanicznym reakcja chemiczna (suma dwu reakcji elektrodowych zachodzących
w obu półogniwach) powoduje przepływ prądu elektrycznego przez obwód zewnętrzny l<tcz4cy elektrody
ogniwa. Podczas pracy ogniwa elektrony płyną od elektrody o potencjale niższym do elektrody o potencjale
wyższym. Co się stanie, jeżeli do elektrod metalicznych, np. platynowych, zanurzonych w roztworze
elektrolitu lub innego przewodnika jonowego (stopionej soli), podleczy się zewnętrzne źródło prądu stałego o
odpowiednim napięciu? Na elektrodach zajdą wtedy procesy odwrotne do reakcji elektrodowych
przebiegających w ogniwie galwanicznym. Określane są one mianem elektrolizy. Elektroliza jest to zespół
przemian chemicznych zachodzących na elektrodach pod wpływem prądu stałego przepływającego przez
elektrolit.
DOŚWIADCZENIE
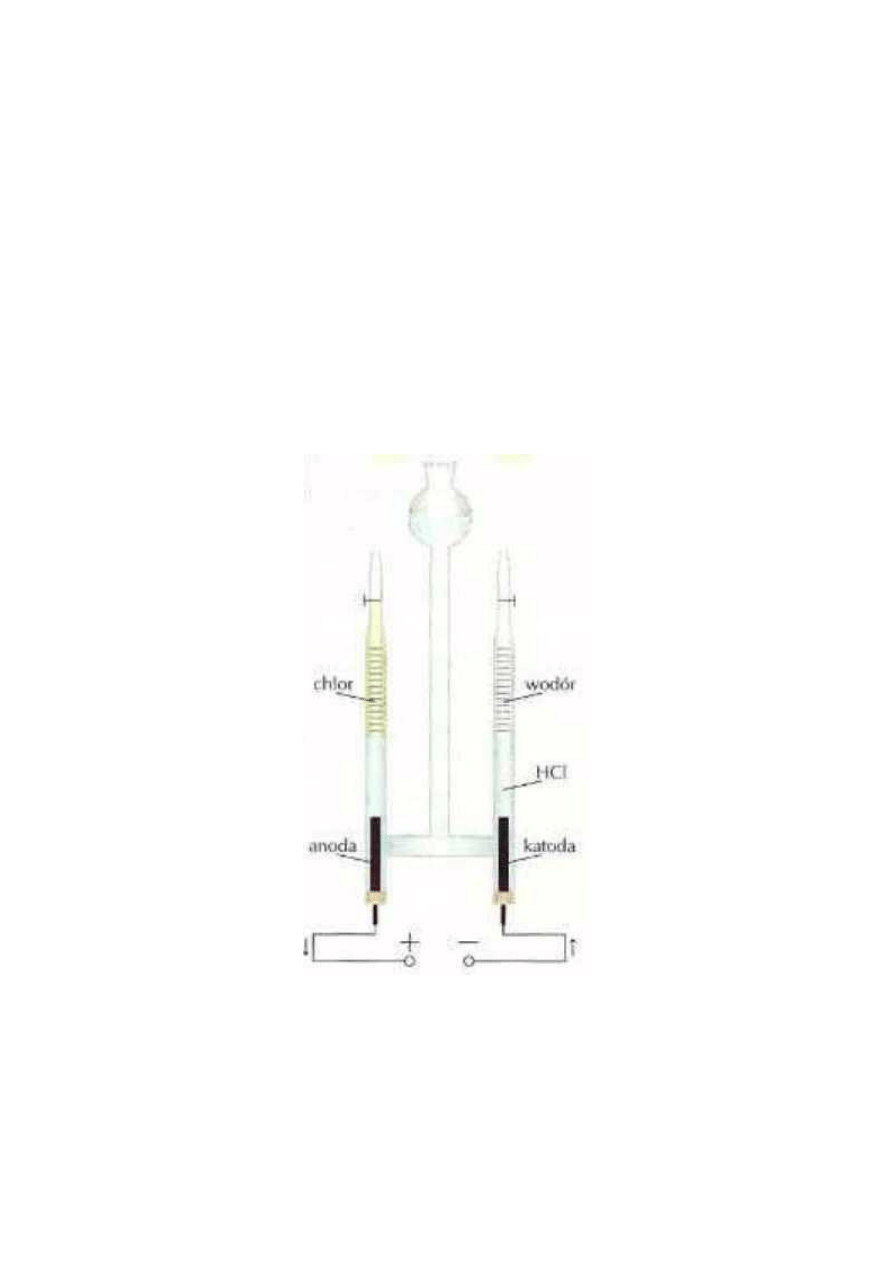
Elektroliza wodnego roztworu kwasu solnego Uwaga! Doświadczenie wykonaj ostrożnie ze względu na
produkty reakcji. Aparat Hofmanna zaopatrzony w elektrody węglowe napełnij roztworem kwasu solnego o
stężeniu 1 mol/dm
3
. Do zacisków podłącz źródło prądu stałego (akumulator lub prostownik) o napięciu 8 - 12
V. Obserwuj zjawiska zachodzące na elektrodach. Zbierz po około 10 cm
3
gazów w obu ramionach aparatu.
Gazem, znajdującym się w rurce nad elektrodą połączoną z ujemnym biegunem źródła prądu, napełnij
odwróconą do góry dnem probówkę. Następnie wylot probówki skieruj do góry, równocześnie zbliżajcie do
niego zapalona zapałkę. Co obserwujesz? Zbadaj ostrożnie zapach gazu zebranego w drugim ramieniu
aparatu. Czy ma on jakąś barwę? Jakie produkty powstały na elektrodach?
W doświadczeniu, wskutek przepływu prądu przez wodny roztwór kwasu solnego, nastąpiła elektroliza
kwasu powodująca powstanie produktów gazowych na elektrodach.
W elektrolizie, odwrotnie niż w ogniwach galwanicznych, elektroda połączona z dodatnim biegunem
źródła prądu to anoda, a elektroda ujemna to katoda. Anoda jest zawsze tą elektrodą, na której
zachodzi proces utleniania, a katoda tą, na której zachodzi proces redukcji.
Pod wpływem przyłożonego z zewnątrz napięcia na anodzie wydzielił się chlor, a na katodzie wodór. Proces
polega na wędrówce obecnych w roztworze jonów H
+
do katody, gdzie następuje ich redukcja do atomów
wodoru, a te łącząc się, tworze cząsteczki:
K(-): 2H
+
+ 2e
-
→ H
2
0
- redukcja

Aniony Cl
-
wędruje do anody, gdzie po oddaniu elektronów, czyli po utlenieniu, tworzą atomy chloru, które
łącząc się, dają cząsteczki. Na anodzie wydziela się gazowy chlor o charakterystycznym zapachu i
żółtozielonej barwie:
A(+): 2Cl
-
+ 2e
-
→ Cl
2
0
utlenianie
Sumaryczna reakcję przebiega j ;ic<i w procesie elektrolizy HCl przedstawia równanie:
2H
+
+ Cl
-
→ H
2
+ Cl
2
Jak z tego równania wynika, procesy zachodzące podczas elektrolizy roztworu HCl są dokładnym
odwróceniem procesów przebiegających w ogniwie wodorowo - chlorowym:
H
2
+ Cl
2
→ 2H
+
+ Cl
-
Różnica polega na tym, że w ogniwie reakcje przebiegają samorzutnie, a powstające w nich elektrony
wędrują w obwodzie zewnętrznym, podczas gdy w elektrolizerze dostarczane z zewnątrz
elektrony wymuszają przebieg reakcji w kierunku przeciwnym. Warunkiem zachodzenia elektrolizy jest
przyłożenie zewnętrznego napięcia o wartości przewyższającej SEM ogniwa, jakie tworzą elektrody
elektrolizera. Najmniejsza wartość napięcia konieczna do rozpoczęcia elektrolizy nazywa się napięciem
rozkładowym U . Różnica pomiędzy SEM odpowiedniego ogniwa i napięciem rozkładowym nosi nazwę
nadnapięcia elektrolizy η (czytaj: eta):
U
r
= SEM + η
Wartość nadnapięcia dla danej reakcji elektrodowej zależy do materiału elektrod, rodzaju ich powierzchni
(porowate czy gładkie), rodzaju elektrolitu i temperatury. Te same czynniki, a także pH elektrolitu i gęstość
prądu wpływa na kolejność wydzielania się na elektrodach produktów elektrolizy. Uproszczone reguły
pozwalają przewidzieć kolejność rozładowywania jonów w roztworach wodnych elektrolitów o
stężeniach jonów zbliżonych do 1 mola/dm
3
.
KATODA(-):
Kolejność redukcji jonów w procesie elektrolizy jest na ogól zgodna z szeregiem potencjałów standardowych
półogniw.
1. Najpierw redukują się kationy metali mniej aktywnych od glinu, na katodzie wydziela się metal:
M
z+
+ ze
-
→ M
0
Uwaga! Na katodzie rtęciowej mogą redukować się kationy metali lekkich. W środowisku kwasowym może
równocześnie wydzielać się gazowy wodór.
2. Po metalach mniej aktywnych redukują się jony H
+
lub cząsteczki H
2
O, w zależności od środowiska:
• w roztworach kwasów:
2H
+
(aq)
+ 2e
-
→ H
2(g)
• w wodnych roztworach soli litowców, berylowców lub glinu:
2H
2
O
(c)
+ 2e
-
→ 2H
2(g)
+ 2OH
-
na katodzie wydziela się wodór.
ANODA(+).
W procesie utleniania anionów na anodzie wydzielają się przeważnie produkty gazowe.
1. Najpierw utleniają się aniony kwasów beztlenowych i ich soli:
2X
-
(aq)
- 2e
-
→ X
2
0
Wówczas no anodzie wydziela się gazowy niemetal, np. chlor.
2. W następnej kolejności utleniają się jony OH
-
lub cząsteczki H
2
O w zależności od środowiska:
• w roztworach wodorotlenków metali:
2OH
-
(aq)
- 2e
-
→ H
2
O + 0,5O
2(g)
w roztworach kwasów tlenowych i ich soli:
H
2
O
(c)
- 2e
-
→ 0,5O
2(g)
+ 2H
+
Na anodzie wydziela się wówczas gazowy tlen.
Uwaga! Równocześnie z reakcja utleniania anionu może przebiegać proces roztwarzania anody. Nie dotyczy
to jedynie elektrod platynowych i grafitowych.
DOŚWIADCZENIE
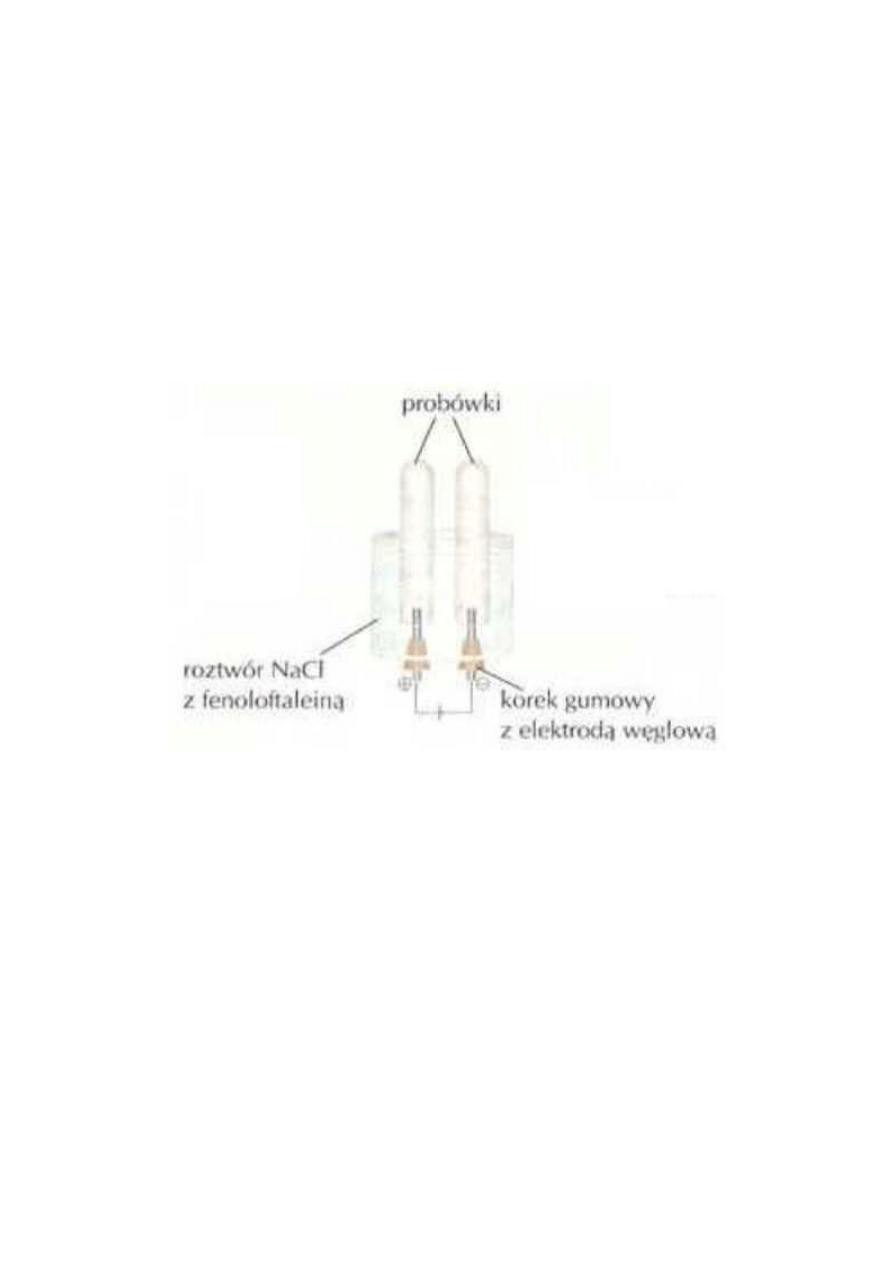
Elektroliza wodnych roztworów chlorku i wodorotlenku sodu.
Elektrolizer napełnij wodnym roztworem chlorku sodu z kilkoma kroplami fenoloftaleiny. Połącz elektrody ze
źródłem prądu stałego, np. płaska bateria 4,5 V, i prowadź elektrolizę aż do zebrania w probówkach po około
10 cm
3
gazów. Zbadaj, jakie to gazy. Jak barwi się roztwór w pobliżu katody Wyjaśnij swoje obserwacje.
Napisz równania zachodzących reakcji elektrodowych i sumaryczne równanie elektrolizy, Podaj wyjaśnienie
wyników doświadczenia. Analogicznie przeprowadź elektrolizę wodnego roztworu wodorotlenku sodu (bez
używania fenoloftaleiny).
Podczas elektrolizy wodnego roztworu NaCl na katodzie wydziela się wodór, a na anodzie chlor. W pobliżu
katody roztwór przyjmuje zabarwienie malinowe, co świadczy o jego zasadowym odczynie. Przebieg
elektrolizy wodnego roztworu NaCl można wyjaśnić następująco: W roztworze wodnym
soli znajdują się jony Na
+
i Cl
-
oraz H
+
(jako H
3
O
+
) i OH
-
. Kationy Na+ i H+ podążają do katody, a aniony Cl-
i OH- do anody (rysunek).

Elektroliza wodnego roztworu NaCl
Dla uproszczenia przyjmujemy, że na elektrodach może ulegać rozładowaniu tylko jeden rodzaj jonów.
Zgodnie więc z podanymi regułami, na katodzie - będzie to H
+
, a na anodzie - jon Cl
-
:
K(-): 2H
2
O
(c)
+ 2e
-
→ H
2(g)
+ 2OH
-
A(+): 2Cl
-
- 2e
-
→ Cl
2
0
Sumarycznie:
2Cl
-
+ 2H
2
O
(c)
→ H
2
+ C
2
+ 2OH
-
W roztworze wodnym NaOH znajdują się jony: Na+, H+ (jako H3O+) i OH-. Jony Na
+
i H
+
podążają do
katody, a jony OH
-
do anody. Podczas elektrolizy wodnego roztworu NaOH na katodzie tworzy się gazowy
wodór, na analogicznie jak w wypadku NaCl, a na anodzie gazowy tlen. W pobliżu katody gromadzą się jony
2OH
-
, powodując odczyn zasadowy roztworu. Zachodzą, procesy elektrodowe:
K(-): 2H
2
O
(c)
+ 2e
-
→ H
2(g)
+ 2OH
-
A(+): 2OH
-
- 2e
-
→ 0,5O
2(g)
+H
2
O
Po dodaniu stronami:
2H
2
O
(c)
+ 2OH
-
→ H
2(g)
+ 2OH
-
+ 0,5O
2(g)
+ H
2
O
Sumarycznie:
2H
2
O
(c)
→ 2H
2(g)
+ O
2(g)
DOŚWIADCZENIE
Elektroliza wodnego roztworu siarczanu(VI) miedzi(II).
W wodnym roztworze siarczanu(VI) miedzi(II) znajdującym się w elektrolizerze zanurz dwie czyste elektrody
węglowe, po czym przepuść prąd elektryczny o natężeniu 1A Obserwuj procesy zachodzące na elektrodach.
Po upływie 5 min wyjmij elektrody. Co obserwujesz na katodzie? Zapisz równania reakcji elektrodowych i
sumaryczne równanie reakcji zachodzącej w elektrolizerze.
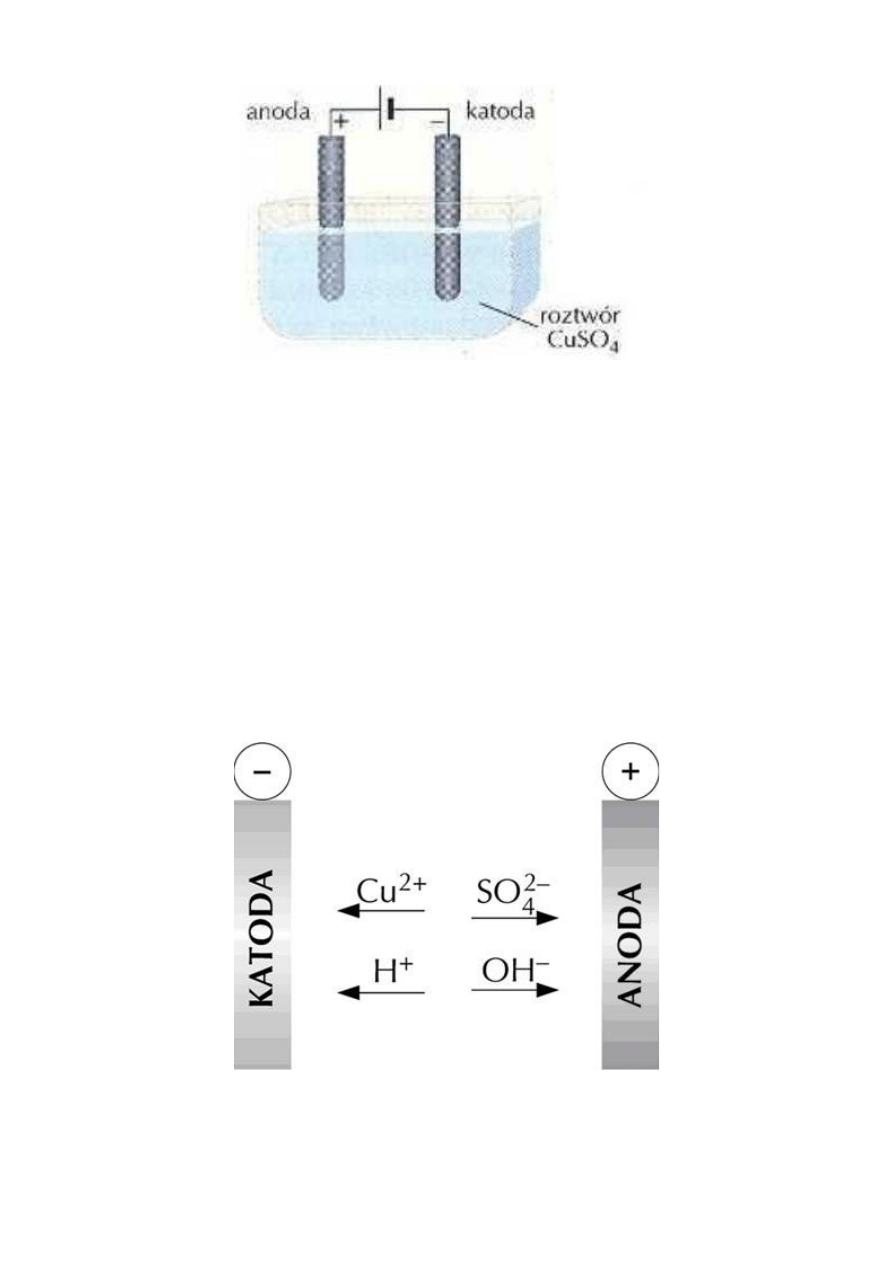
Elektroliza wodnych roztworów kwasów tlenowych, wodorotlenków metali alkalicznych oraz soli tych metali z
kwasami tlenowymi prowadzi do wydzielenia się wodoru na katodzie i tlenu na anodzie, czyli do rozkładu
wody na pierwiastki. Z tego względu taki proces nazywa się często elektrolizą wody. Podczas elektrolizy
wodnego roztworu CuSO
4
, na katodzie wydzieliła się metaliczna miedź, a na anodzie powstał gazowy tlen.
Na elektrodach zachodzą procesy:
K(-): Cu
2+
+ 2e
-
→ Cu
0
A(+): H
2
O - 2e
-
→ 0,5O
2
+ 2H
+
Po dodaniu stronami:
Cu
2+
+ H
2
O → Cu + 0,5O
2
+ 2H
+
Sumarycznie:
2Cu
2+
+ 2H
2
O → 2Cu + O
2
+ 4H
+
Jak wynika z równania reakcji anodowej, roztwór wokół tej elektrody staje się kwasowy, bo zwiększa się w
nim liczba jonów H
+
. Należy zaznaczyć, że wszystkie opisane procesy elektrolizy przeprowadzono przy
zastosowaniu elektrod obojętnych, które nie brały udziału w procesach elektrodowych.
Elektroliza wodnego roztworu CuSO
4
.
Wyszukiwarka
Podobne podstrony:
elektroliza roztworów ELEK .metali DOBRE
elektroliza roztworów ELEK metali DOBRE
12.ROZTWORY ELEKTROLITÓW, ROZTWORY ELEKTROLITÓW
elektrotechnika - prad staly - poprawa, Uczelnia PWR Technologia Chemiczna, Semestr 2, Elektronika,
Do Ćw 3 IŚ Elektrotermia grzejnictwo elek
elektrochemia, ĆWNR1, Zakres potencjałów w których mogą być prowadzone procesy elektrochemiczne w ro
Elektrochemia osadzanie stopów metali na metalach szlachetnych
01 3 Zachowanie metali w roztworach elektrolitów zadania do lekcji nr 2
01 3 FOLIA Zachowanie metali w roztworach wodnych elektrolitów zadania do lekcji nr 1
Wyklad 7 Wlasnosci elektryczne metali
Elektrolityczne osadzanie metali
10 ROZTWORY ELEKTROLITW 09
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
korozja elektrochemiczna metali tom
13 Równowagi w roztworach elektrolitów słabych
więcej podobnych podstron