Wykład z Chemii Fizycznej str. 2.1 / 1
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Opisuje i bada efekty procesów chemicznych i fizycznych.
Zawiera zbiór reguł znanych jako zasady lub prawa termodynamiki.
Jest podstawowym aparatem naukowym chemika służącym do
przewidywania kierunku procesów zachodzących w sposób samorzutny.
TERMODYNAMIKA
2.1.1. Pojęcia podstawowe
2.1.2. Zerowa zasada termodynamiki
2.1.3. Pierwsza zasada termodynamiki
2.1.4. Energia, praca, ciepło
2.1.5. Prawo Hessa
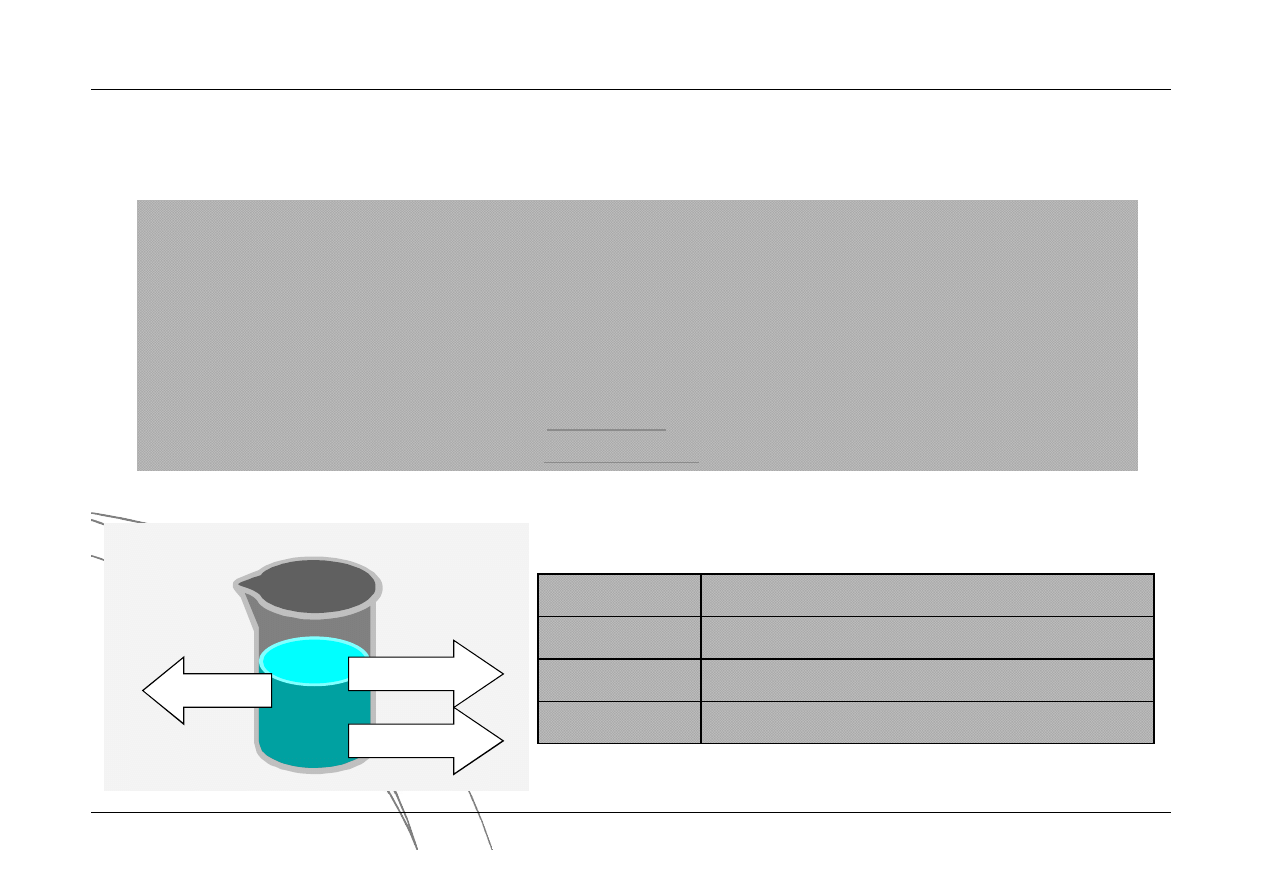
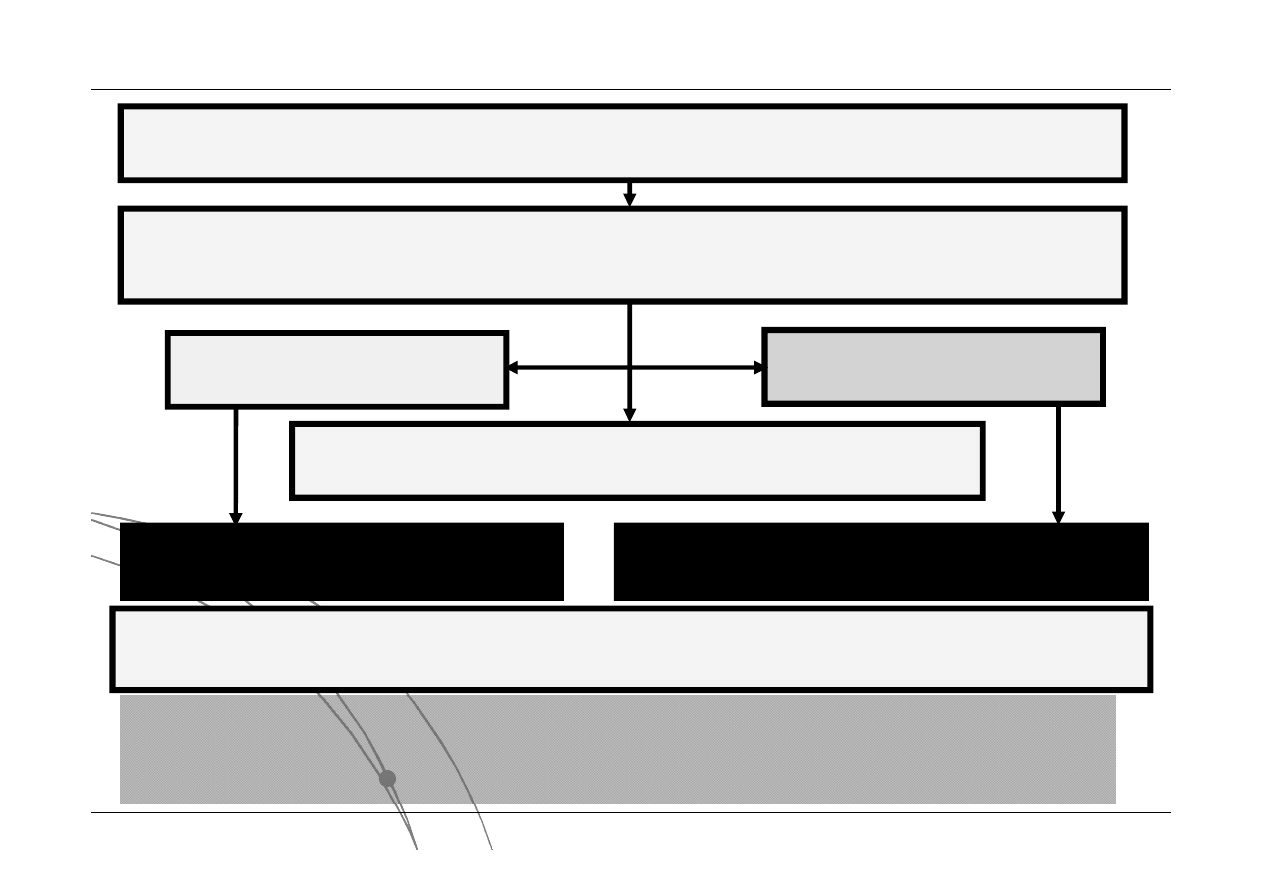
Układ termodynamiczny
Jest to część przestrzeni wyodrębniona za pomocą abstrakcyjnej osłony bilansowej.
Otoczenie
- Otoczeniem jest ta część przestrzeni, która nie należy do układu. W
otoczeniu mogą znajdować się źródła ciepła oraz zbiorniki substancji.
Osłona bilansowa
- Stanowi granicę pomiędzy układem a otoczeniem.
Umożliwia kontrolę ilości energii i substancji przepływających pomiędzy układem
a otoczeniem. typy osłon bilansowych:
osłonę diatermiczna
- umożliwia przepływ ciepła
osłonę adiabatyczna
- uniemożliwia przepływ energii w postaci ciepła
CIEPŁO
PRACA
MASA
otwarty
otwarty
wymiana masy i energii
wymiana masy i energii
zamknięty
zamknięty
brak wymiany masy, możliwa wymiana energii
brak wymiany masy, możliwa wymiana energii
adiabatyczny
adiabatyczny
brak wymiany ciepła, możliwa wymiana masy
brak wymiany ciepła, możliwa wymiana masy
izolowany
izolowany
brak wymiany masy i energii
brak wymiany masy i energii
Wykład z Chemii Fizycznej str. 2.1 / 2
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Jaki to rodzaj układu: otwarty, zamknięty czy izolowany?
Wykład z Chemii Fizycznej str. 2.1 / 3
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
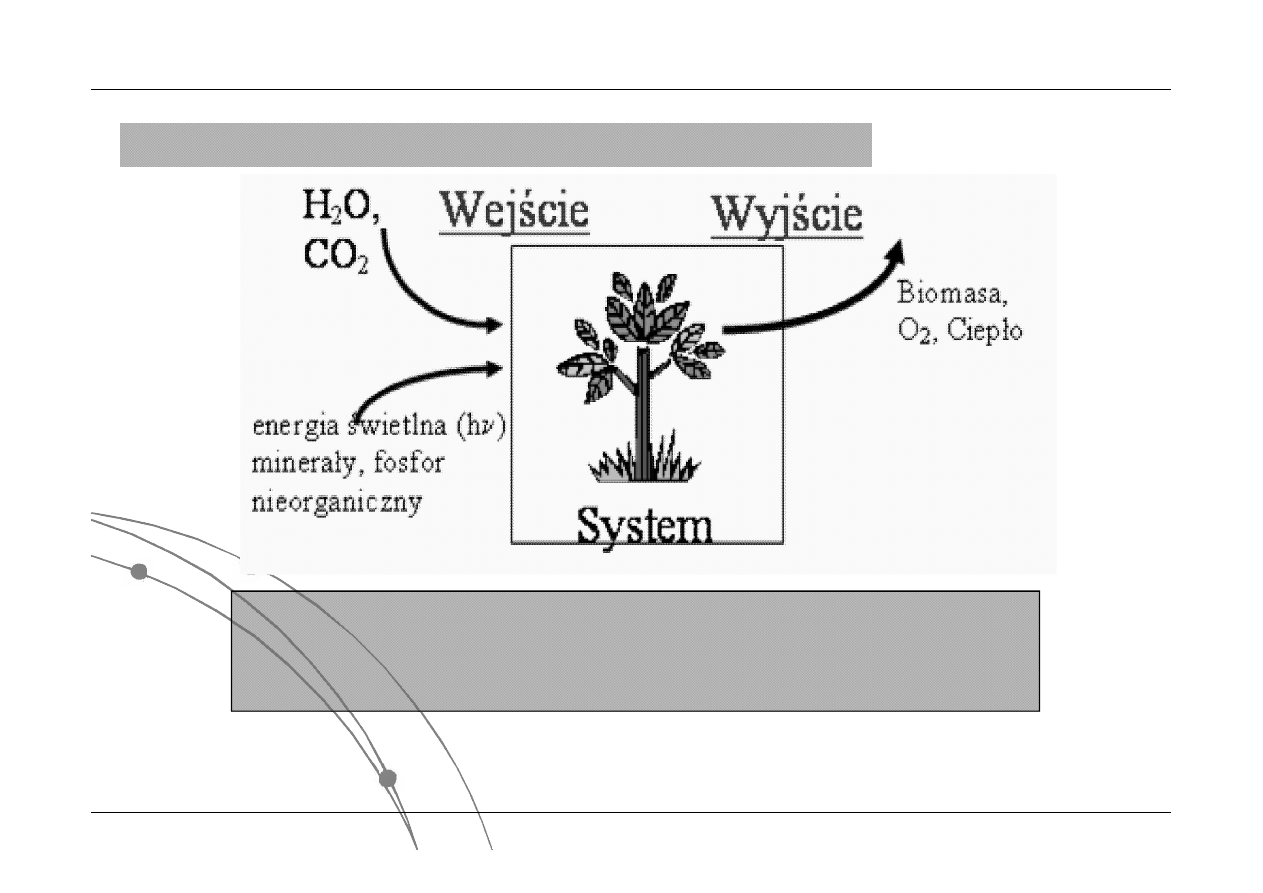
zasadniczy proces zachodzący w chloroplastach niesie efekt
energetyczny równy ok. DH°= 485 J/mol
H
2
O + CO
2
→ O
2
+ (CH
2
O)

Wykład z Chemii Fizycznej str. 2.1 / 4
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Elektrownia
Elektrownia
wiatrowa
Jaki to rodzaj układów: otwarte, zamknięte czy izolowane?
Metropolia
Wirus
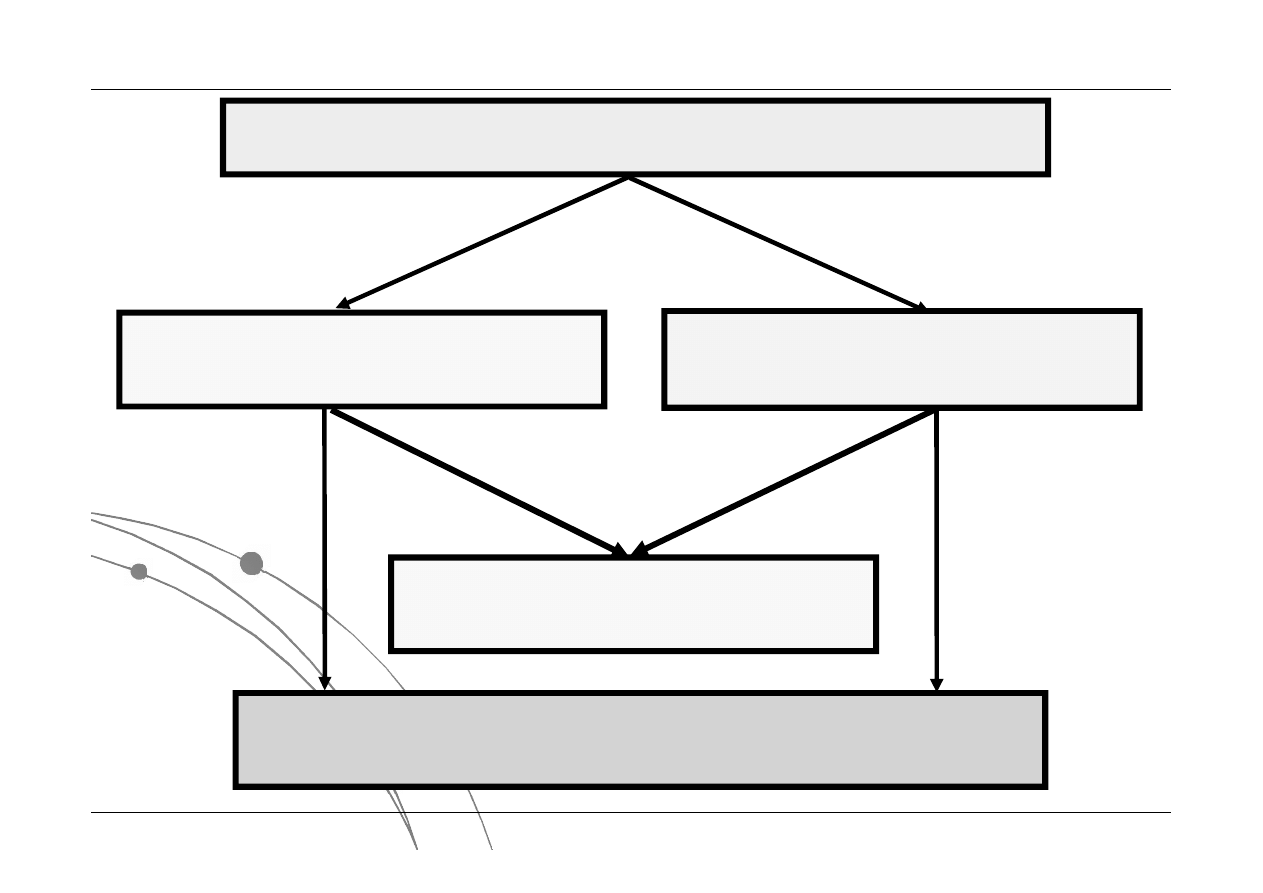
Układ termodynamiczny
Układ termodynamiczny
jednoskładnikowy
jednoskładnikowy
wieloskładnikowy
wieloskładnikowy
jednofazowy
jednofazowy
wielofazowy
wielofazowy
Wykład z Chemii Fizycznej str. 2.1 / 5
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Stan układu termodynamicznego
Stan układu termodynamicznego
Parametry stanu układu
Parametry stanu układu
(p, V, T, lepkość, gęstość, współczynnik załamania, przewodnictwo…)
(p, V, T, lepkość, gęstość, współczynnik załamania, przewodnictwo…)
Ekstensywne
Ekstensywne
Intensywne
Intensywne
Liczba stopni swobody (wariancja)
Liczba stopni swobody (wariancja)
Wykład z Chemii Fizycznej str. 2.1 / 6
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Reguła Duhema:
Stan termodynamiczny układu jest jednoznacznie określony jeżeli
znane są ilości każdego składnika oraz dodatkowo dwa parametry.
Niezależne od ilości materii w układzie:
temperatura, ciśnienie, ułamek molowy
Proporcjonalne do ilości materii
w układzie: masa, objętość
Procesy termodynamiczne (przemianą termodynamiczną)
Zjawisko, podczas którego ulega zmianie wartość przynajmniej jednego
parametru nazywa się my przemianą czynnika termodynamicznego lub krótko.
Wykład z Chemii Fizycznej str. 2.1 / 7
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Zdefiniować układ
Zdefiniować układ
Określić więzy narzucone układowi
Określić więzy narzucone układowi
Określić liczbę stopni swobody układu
Określić liczbę stopni swobody układu
Wybrać parametry stanu układu (zmienne niezależne)
Wybrać parametry stanu układu (zmienne niezależne)
Na zbiorze parametrów stanu zdefiniować funkcje termodynamiczne
Na zbiorze parametrów stanu zdefiniować funkcje termodynamiczne
(syn. funkcje stanu)
(syn. funkcje stanu)
Obliczyć zmianę
Obliczyć zmianę D
DY funkcji stanu w wyniku opisywanej przemiany
Y funkcji stanu w wyniku opisywanej przemiany
Zinterpretować obliczoną wartość
Zinterpretować obliczoną wartość D
DY
Y
Metoda opisu termodynamicznego
DY
Y
x
dx
j
x
const
j
x
x
j
k
i
j
j
i
j
ii
.
1
Stan początkowy
Y(x’
1
, x’
2
, ....x’
k
)
Stan końcowy
Y(x”
1
, x”
2
, ....x”
k
)
Założenie:
Założenie:
Ciągłość parametrów i funkcji stanu
Ciągłość parametrów i funkcji stanu
ciągłość materii
ciągłość materii
ignorowanie
ignorowanie
molekularnej budowy materii
molekularnej budowy materii
Ograniczenie:
Ograniczenie:
możliwość opisu wyłącznie układów
możliwość opisu wyłącznie układów
makroskopowych (N > 10
makroskopowych (N > 10
10
10
drobin) w których
drobin) w których
nieciągłość materii jest pomijalna
nieciągłość materii jest pomijalna
Metoda opisu termodynamicznego
Wykład z Chemii Fizycznej str. 2.1 / 8
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Sukcesy opisu termodynamicznego
Sukcesy opisu termodynamicznego
właściwości PVT substancji czystych i efektów energetycznych ich
właściwości PVT substancji czystych i efektów energetycznych ich
przemian fizycznych
przemian fizycznych
przemiany fazowe substancji czystych (topnienie, parowanie,
przemiany fazowe substancji czystych (topnienie, parowanie,
sublimacja, polimorfizm)
sublimacja, polimorfizm)
efekty objętościowe i energetyczne tworzenia roztworów z
efekty objętościowe i energetyczne tworzenia roztworów z
substancji czystych
substancji czystych
równowagi fazowe w układach wieloskładnikowych (ciecz
równowagi fazowe w układach wieloskładnikowych (ciecz -- ciecz,
ciecz,
ciecz
ciecz -- para, ciecz
para, ciecz -- kryształ)
kryształ)
efekty cieplne reakcji chemicznych
efekty cieplne reakcji chemicznych
położenie stanu równowagi w układach, w których przebiegają
położenie stanu równowagi w układach, w których przebiegają
reakcje chemiczne
reakcje chemiczne
ograniczeń procesu konwersji energii cieplnej na energię
ograniczeń procesu konwersji energii cieplnej na energię
mechaniczną (teoria maszyn cieplnych)
mechaniczną (teoria maszyn cieplnych)
procesu konwersji energii chemicznej w energię elektryczną
procesu konwersji energii chemicznej w energię elektryczną
Wykład z Chemii Fizycznej str. 2.1 / 9
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Zalety opisu termodynamicznego
Zalety opisu termodynamicznego
Prostota wnioskowania metodami analizy
Prostota wnioskowania metodami analizy
matematycznej
matematycznej
Brak teoretycznych ograniczeń stopnia złożoności
Brak teoretycznych ograniczeń stopnia złożoności
układów (od „1 mola gazu” do „organizmu żywego”)
układów (od „1 mola gazu” do „organizmu żywego”)
Możliwość obliczenia wartości wielkości trudno
Możliwość obliczenia wartości wielkości trudno
mierzalnych na podstawie wartości wielkości łatwo
mierzalnych na podstawie wartości wielkości łatwo
mierzalnych
mierzalnych
Brak konieczności kontrolowania „drogi przemiany”
Brak konieczności kontrolowania „drogi przemiany” --
zmiana funkcji stanu zależy wyłącznie od wartości
zmiana funkcji stanu zależy wyłącznie od wartości
parametrów stanu początkowego i końcowego układu
parametrów stanu początkowego i końcowego układu
Wykład z Chemii Fizycznej str. 2.1 / 10
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Braki opisu termodynamicznego
Braki opisu termodynamicznego
Brak możliwości określenia szybkości przemiany (czas
Brak możliwości określenia szybkości przemiany (czas
nie jest parametrem stanu układu)
nie jest parametrem stanu układu)
Brak możliwości teoretycznego obliczenia wartości
Brak możliwości teoretycznego obliczenia wartości
funkcji termodynamicznych
funkcji termodynamicznych
mogą być one
mogą być one
obliczane wyłącznie na podstawie wartości
obliczane wyłącznie na podstawie wartości
doświadczalnych
doświadczalnych
konieczność pomiarów wielkości
konieczność pomiarów wielkości
określających charakterystykę termodynamiczną
określających charakterystykę termodynamiczną
układów i ich przemian
układów i ich przemian
TERMODYNAMIKA
TERMODYNAMIKA
DOŚWIADCZALNA.
DOŚWIADCZALNA.
Wykład z Chemii Fizycznej str. 2.1 / 11
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
TERMODYNAMIKA DOŚWIADCZALNA
TERMODYNAMIKA DOŚWIADCZALNA
--najważniejsze typy pomiarów ....
najważniejsze typy pomiarów ....
Relacje PVT substancji czystych
Relacje PVT substancji czystych
Efekty cieplne przemian fizycznych substancji czystych
Efekty cieplne przemian fizycznych substancji czystych
(ogrzewanie/oziębianie, przemiany fazowe)
(ogrzewanie/oziębianie, przemiany fazowe)
Efekty objętościowe i cieplne tworzenia roztworów
Efekty objętościowe i cieplne tworzenia roztworów
(rozpuszczania)
(rozpuszczania)
Równowagi fazowe w układach jedno
Równowagi fazowe w układach jedno-- i wieloskładnikowych
i wieloskładnikowych
(związek między ciśnieniem, temperaturą i naturą (ewentualnie
(związek między ciśnieniem, temperaturą i naturą (ewentualnie --
składem) faz współistniejących w stanie równowagi
składem) faz współistniejących w stanie równowagi
Efekty energetyczne reakcji chemicznych (efekty cieplne i SEM
Efekty energetyczne reakcji chemicznych (efekty cieplne i SEM
ogniw chemicznych)
ogniw chemicznych)
Położenie stanu równowagi (skład równowagowy) układów w
Położenie stanu równowagi (skład równowagowy) układów w
których przebiegają reakcje chemiczne.
których przebiegają reakcje chemiczne.
Wykład z Chemii Fizycznej str. 2.1 / 12
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
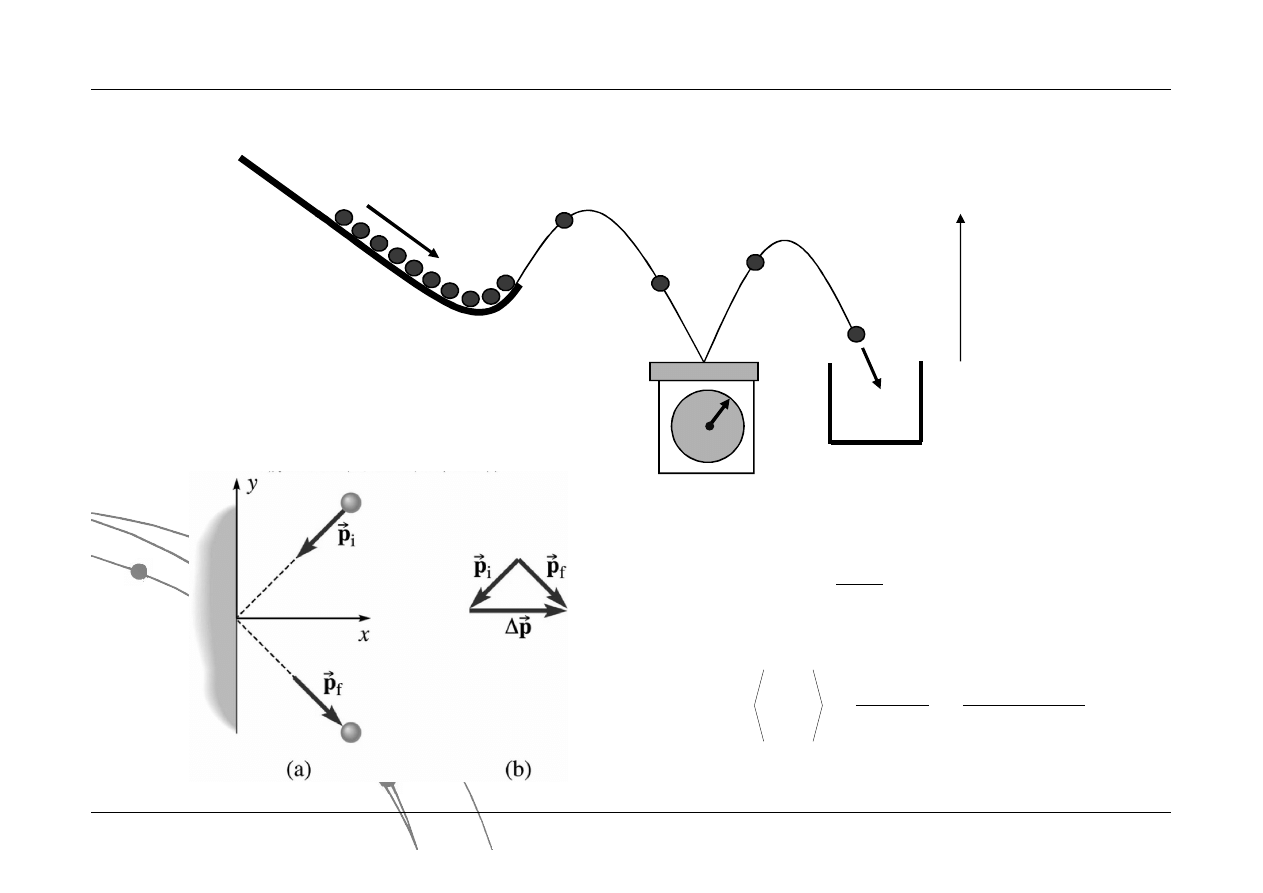
y
t
y
mv
t
y
p
y
f
D
D
D
D
CIŚNIENIE
Parametry termodynamiczne
Ilościowa demonstracja
ciśnienia
Średnia składowej siły
prostopadłej do powierzchni:
Wykład z Chemii Fizycznej str. 2.1 / 13
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
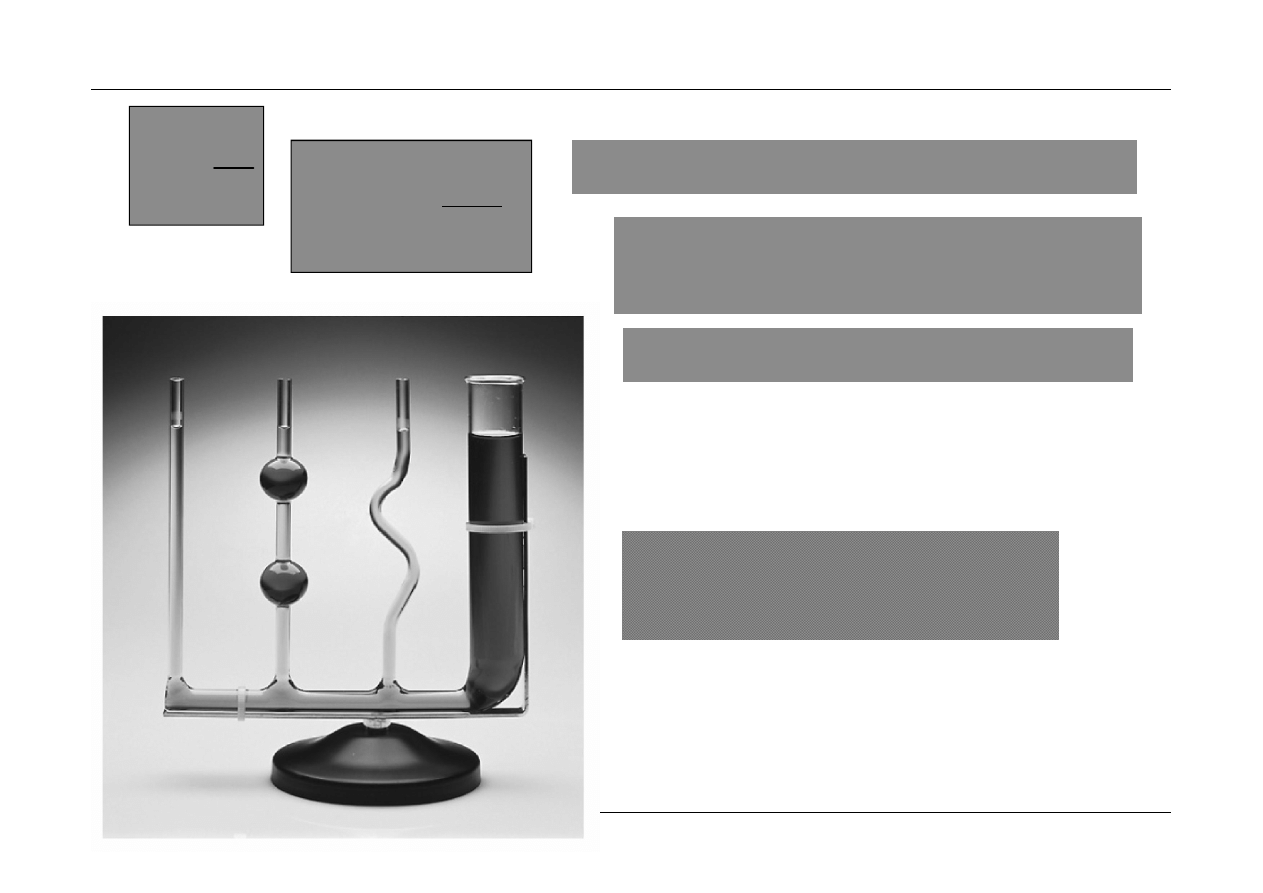
Jednostka ciśnienia
Wykład z Chemii Fizycznej str. 2.1 / 14
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
A
F
P
2
m
N
Pa
Jeden paskal - to niewielkie ciśnienie
1 atm = 960 mmHg 10 mH
2
O
1 atm = 101.325 kPa = 1013.25 hPa
= 1.01325 bar
Dlaczego wysokości słupów
cieczy w naczyniach
połączonych są jednakowe?

Jak wielkie jest ciśnienie atmosferyczne ?
Ciężar atmosfery przytłaczającej
Ciężar atmosfery przytłaczającej
jednostkę powierzchni
jednostkę powierzchni
P = 1x10
P = 1x10
5
5
N/m
N/m
2
2
Przykładowo dla sfery:
Przykładowo dla sfery: r = 0.1 m
r = 0.1 m
A = 4
A = 4 p
p rr
2
2
=
= 0
0.125 m
.125 m
2
2
F = P A
F = P A
= (1x10
= (1x10
5
5
N/m
N/m
2
2
)(
)( 0
0.125 m
.125 m
2
2
))
= 12500 N
= 12500 N
Wykład z Chemii Fizycznej str. 2.1 / 15
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Czy powietrze jest ciężkie?
przemiana zamknięta;
m
=
const
przemiana otwarta;
m
=
var
ekspansja:
dV
> 0
kompresja:
dV
< 0
rozprężanie:
dp
< 0
sprężanie:
dp
> 0
Typy przemian termodynamicznych
samorzutne ↔ niesamorzutne
odwracalne (quasistatyczne) ↔ nieodwracalne
izotermiczne, izobaryczne, izochoryczne, izokratyczne
adiabatyczne
Droga reakcji sposób zmiany
parametrów stanu w czasie
Odwracalne i nieodwracalne
przemiany termodynamiczne
Odwracalne (quasistatyczne) –
stan
układu zmieniany jest w sposób ciągły o
nieskończenie małe wartości na drodze
procesu. W dowolnym momencie
nieskończeni mała praca może
odwrócić kierunek biegu procesu.
Wykład z Chemii Fizycznej str. 2.1 / 16
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Przemiana = zmiana
przynajmniej jednego
parametru termodynamicznego
Równanie stanu = (x1,...,x2)
Funkcje stanu
np. U, H, S, G, F, , A
Jakie funkcje parametrów stanu
mogą być funkcjami stanu?
Stan A:
= (x
1
,...,x
n
)
Stan B:
= (x’
1
,...,x’
n
)
Funkcjami stanu są tylko takie wielkości
fizyczne, których zmiany w takcie przebiegu
procesów termodynamicznych nie zależą od
drogi przemiany, a wyłącznie od stanu
początkowego i końcowego.
dy
y
F
dx
x
F
y
x
dF
x
y
)
,
(
niezależność funkcji stanu od drogi oznacza, że jest ona różniczką zupełną
Matematyczna interpretacja funkcji stanu
Wykład z Chemii Fizycznej str. 2.1 / 17
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
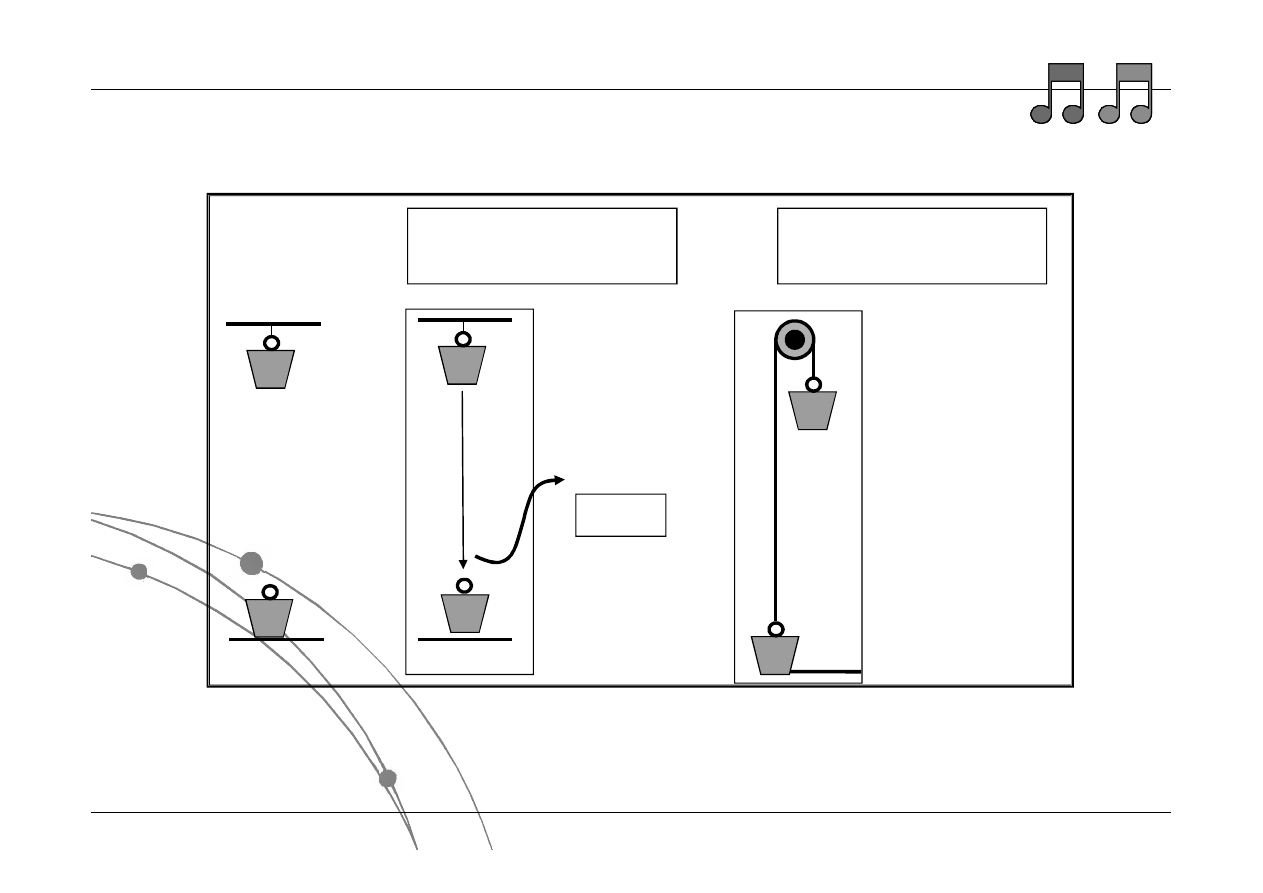
Przykłady przemian termodynamicznych
Stan A
Stan B
Ciepło
DE
term
= +
DE
mech.
= 0
DE
thermal
= 0
DE
mech.
= +
Proces natychmiastowy =
nieodwracalny
Proces powolny =
odwracalny
Wykład z Chemii Fizycznej str. 2.1 / 18
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
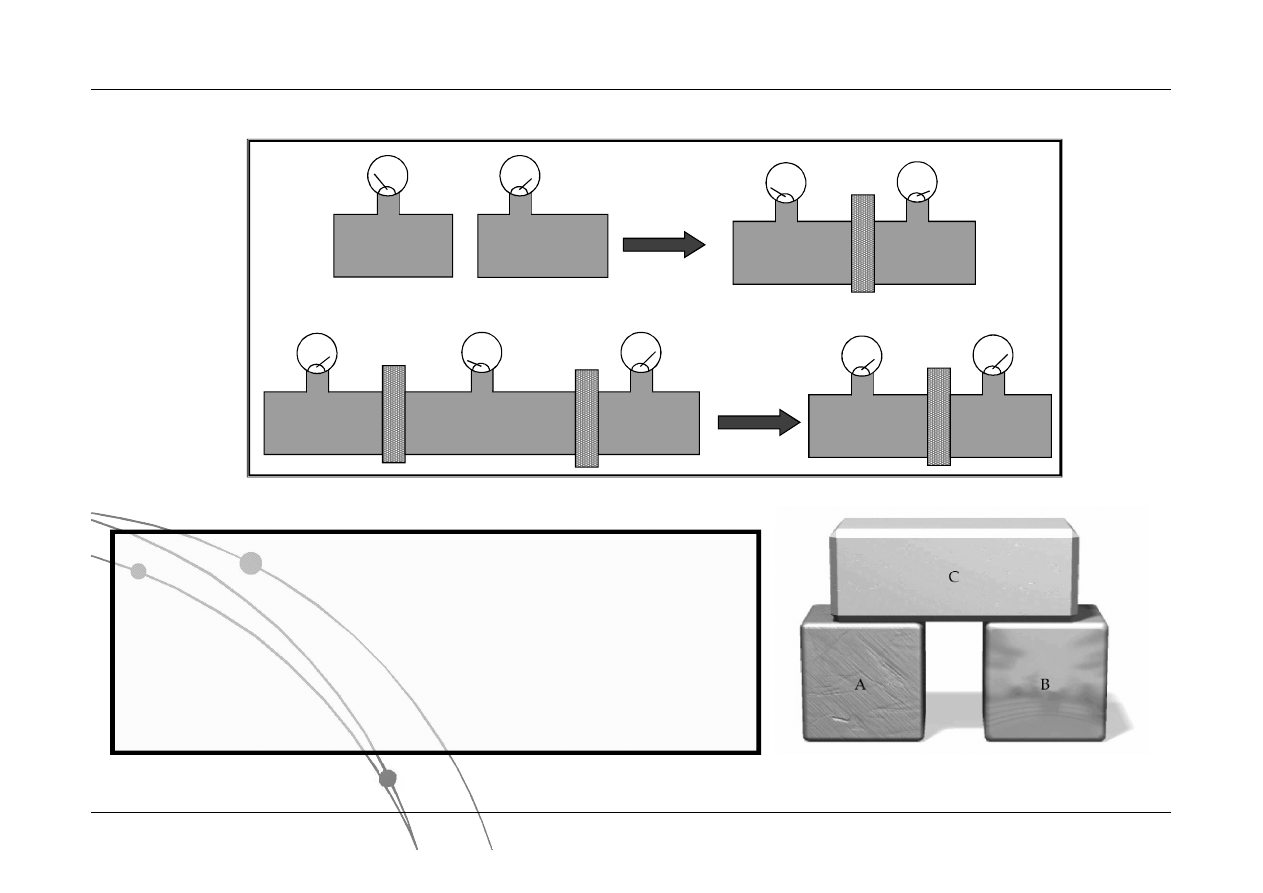
V
1
, T
1
P1
V
2
, T
2
>T
1
P2
V
1
, T
P1
’
V
2
, T
P2
’
Układy izolowane
w równowadze
termodynamicznej
V
1
, T
1
P1
V
3
, T
3
P3
V
2
, T
2
P2
V
1
, T
1
P1
V
3
, T
P3
Zerowa zasada termodynamiki
Wykład z Chemii Fizycznej str. 2.1 / 19
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
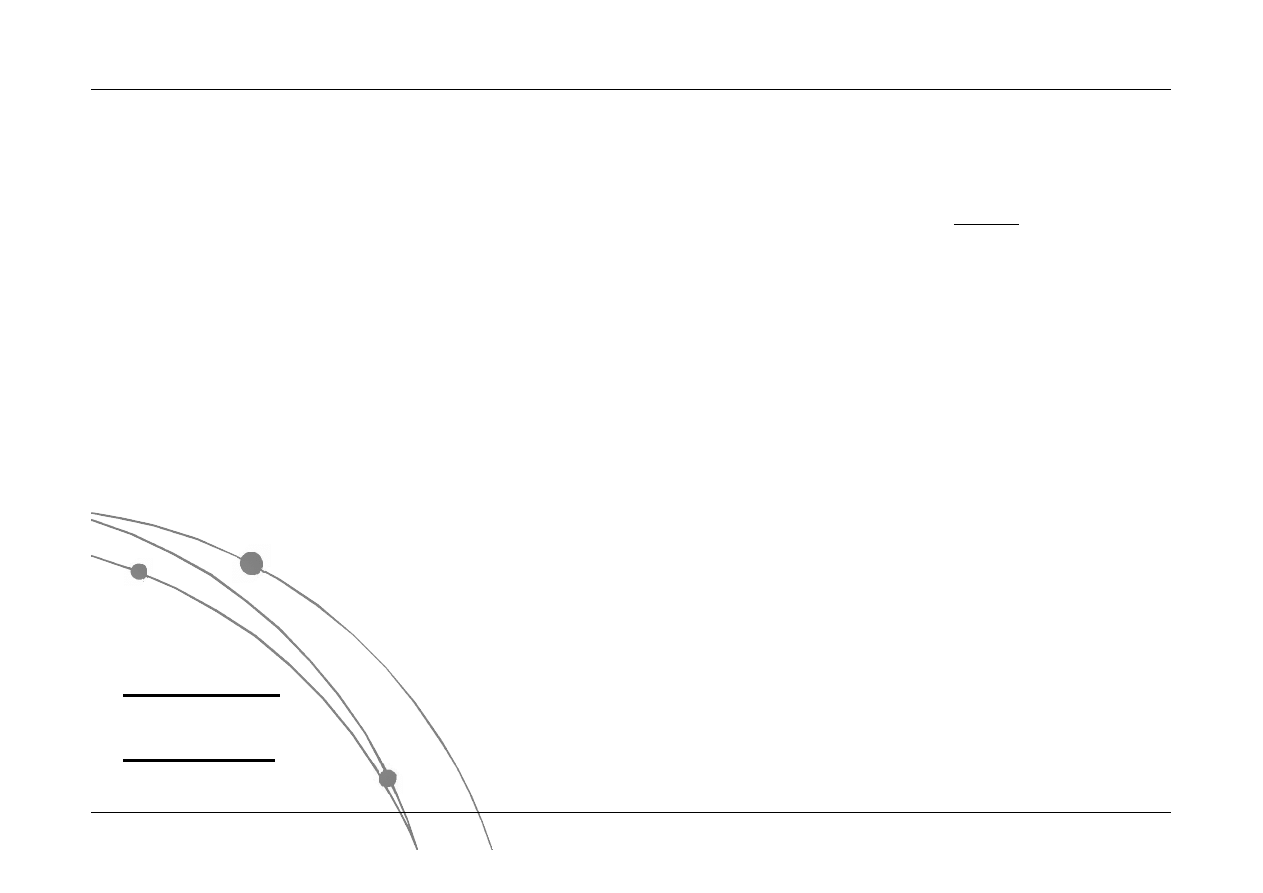
Jeżeli układy A i B są w stanie równowagi
Jeżeli układy A i B są w stanie równowagi
termicznej z układem C, to są one również
termicznej z układem C, to są one również
w stanie równowagi termicznej względem
w stanie równowagi termicznej względem
siebie.
siebie.
E.A. Guggenheim, R. Fowler (1939)
E.A. Guggenheim, R. Fowler (1939)
Mikroskopowa interpretacja temperatury
W interpretacji kinetycznej teorii gazów
temperatura jest miarą średniej energii
kinetycznej ruchu środków mas cząstek.
kT
f
E
2
Pomiar temperatury
Skale
Zdefiniowanie skali temperatur wymaga deklaracji:
• przynajmniej jednego stanu (temperatury) jako punktu podstawowego skali i
przyporządkowanie tej temperaturze określonej wartości.
• określenia jednostki temperatur
Jako punkty podstawowe przyjmuje się najczęściej punkty (temperatury) równowagi
międzyfazowej substancji jednoskładnikowych występujących często w przyrodzie
(np. temperatura wrzenia topnienia lub punktu potrójnego wody).
Skale temperatur można podzielić na dwie klasy:
Teoretyczne - oparte na zależnościach teoretycznych (idealnych). Przykładem
może być termodynamiczna skala temperatur lub skala gazu doskonałego.
Empiryczne - oparte na danych doświadczalnych np.
Międzynarodowa Praktyczna Skala Temperatur (1968r.)
Wykład z Chemii Fizycznej str. 2.1 / 20
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Przykłady skal temperatur:
Termodynamiczna skala temperatury wg koncepcji Kelvin'a.
teoretyczna skala oparta na sprawności cyklu Carnota. Jednostką tej skali jest Kelvin
(K) - jednostka podstawowa Międzynarodowego Układu Jednostek Miar SI.
Skala temperatury Celsjusza.
empiryczna skala określona po raz pierwszy w 1743 roku, oparta na dwóch punktach
stałych: t
1
=0
o
C (temperatura topnienia lodu), t
2
=100
o
C (temperatura wrzenia wody).
Oba te punkty określone są pod ciśnieniem 101325 N/m2 [Pa] = 1 atmosfera.
Jednostką jest stopień Celsjusza (ozn. oC).
Skala temperatury Fahrenheita.
empiryczna skala temperatury oparta na dwóch punktach stałych: t
1
=0
o
F
(temperatura mieszania śniegu z salmiakiem) i t2=100oF (temperatura normalna
ciała ludzkiego). Skala ta jest stosowana głównie w krajach posługujących się
angielskim i amerykańskim systemem miar.
Wykład z Chemii Fizycznej str. 2.1 / 21
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Wykład z Chemii Fizycznej str. 2.1 / 22
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
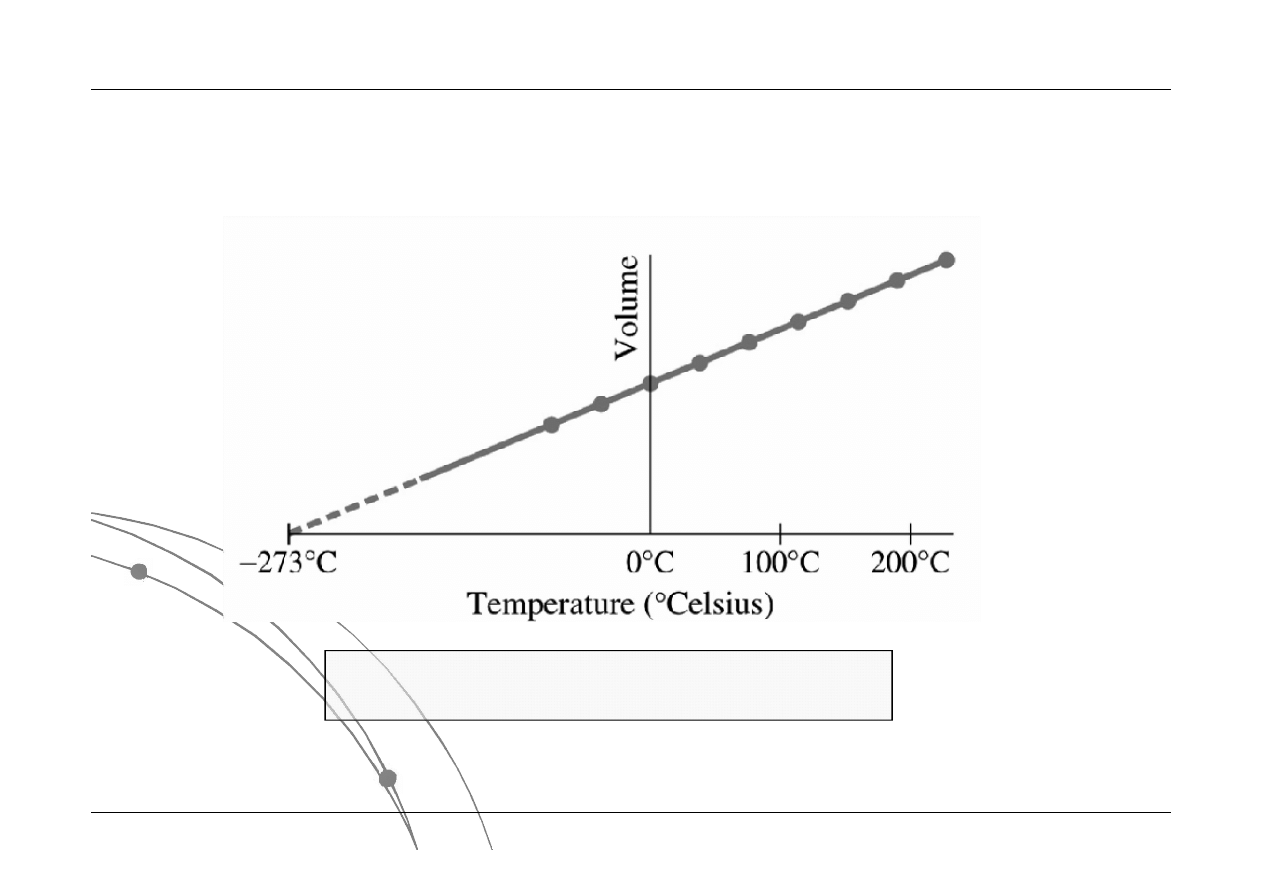
T(K) = T(ºC) + 273.15
Absolutna
Absolutna (( w
w Kelvin
Kelvinach
ach)
) skala temperatury
skala temperatury
Czy różnice temperatur w różnych skalach są różne?
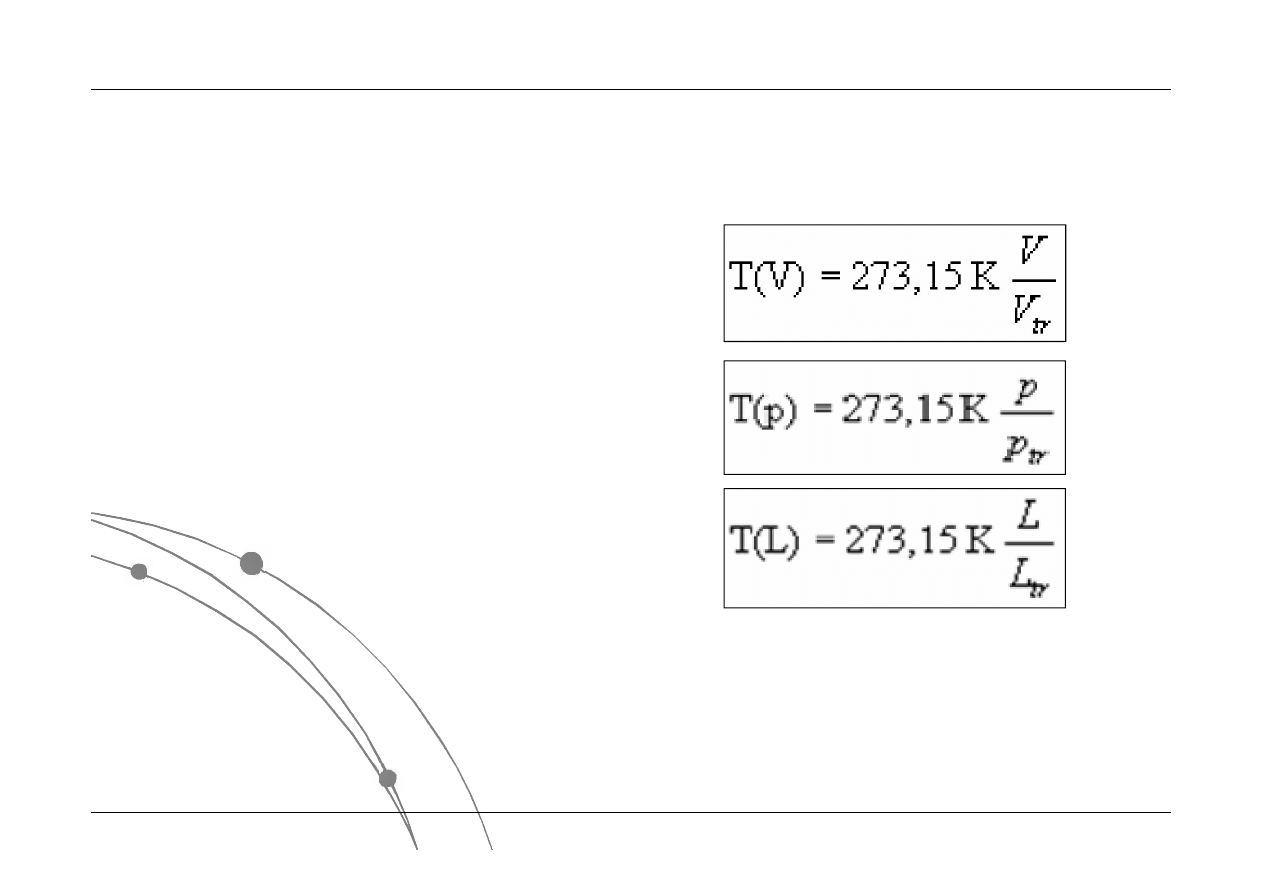
Termometry
Do pomiaru temperatury można wykorzystać każdą własność
fizyczną, która ulega monotonicznej i ciągłej zmianie ze zmianą
temperatury. Urządzenie takie nosi nazwę termometru.
1. Rtęciowy, alkoholowy
pomiar zmian objętość płynów dla gazu pod
stałym ciśnieniem
2. Bolometr
pomiar zmian ciśnienia gazu zamkniętego w
stałej objętości
3. Termometry kontaktronowe
pomiar zmian długość pręta
4. Termopara - pomiar zmian napięcia
Termopara to złącze dwóch różnych metali, na którym powstaje napięcie o
niewielkiej wartości - najczęściej w zakresie miliwoltów - i współczynniku
temperaturowym rzędu 50 mikroV/
o
C. Za pomocą termopar można mierzyć
temperaturę od -270
o
C do +2700
o
C z błędem w zakresie 0,5 - 2
o
C.
Wykład z Chemii Fizycznej str. 2.1 / 23
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
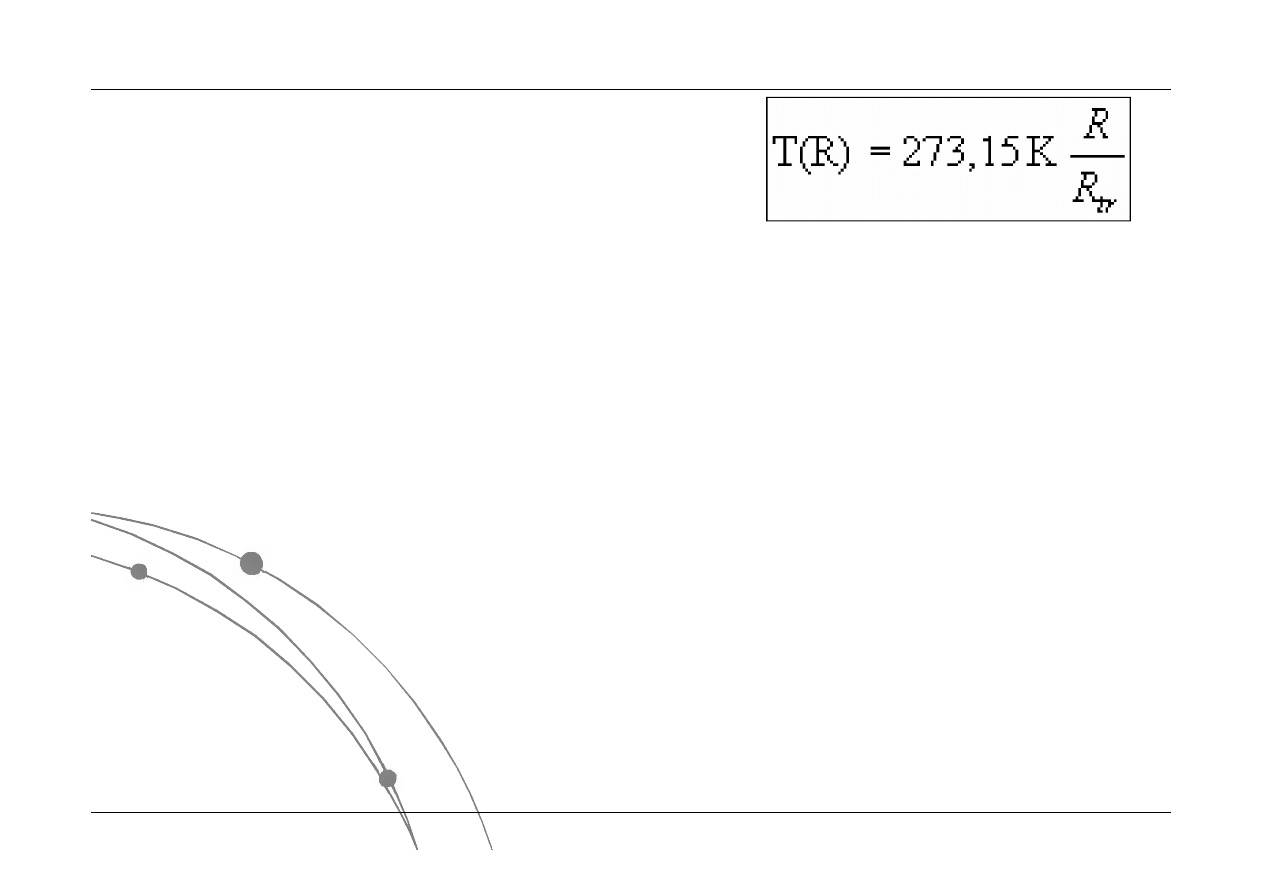
Termometry
5. Termistory
opór elektryczny drutu
są to półprzewodnikowe elementy rezystancyjne o ujemnym współczynniku
temperaturowym rezystancji, którego wartość jest równa mniej więcej -4%/
o
C. Na
ogół stosowane są termistory o rezystancji, w temperaturze pokojowej, rzędu kilku
k. Termistory nadają się bardzo dobrze do pomiaru temperatury oraz do
sterowania jej zmianami w zakresie od -50
o
C do +300
o
C z błędem nie
przekraczającym 0,1 do 0,2
o
C
6. Pirometry
pomiar zmian emisji promieniowana elektromagnetycznego
realizuje się poprzez obserwację żarzącego się obiektu przez lunetę i porównanie
jego koloru z kolorem świecenia umieszczonego wewnątrz pirometru drucika
żarowego. Pirometrami optycznymi mierzy się temperatury w zakresie od 750
o
C do
+3000
o
C. Błąd szacuje się na około 4
o
C w pobliżu dolnej granicy zakresu
pomiarowego i około 20
o
C w pobliżu górnej granicy. Pirometry pracujące w
podczerwieni są bardziej dokładne.
Wykład z Chemii Fizycznej str. 2.1 / 24
2.1. Pojęcia podstawowe
TERMODYNAMIKA – pojęcia podstawowe
Wyszukiwarka
Podobne podstrony:
Wprowadzenie do termodynamiki W 2 3
2 WPROWADZENIE DO TERMODYNAMIKI
Wykład 1 inżynierskie Wprowadzenie do zarządzania operacyjnego
Wprowadzenie do medycyny rozwojowej 1
PD W1 Wprowadzenie do PD(2010 10 02) 1 1
Wprowadzenie do psychologii
Wprowadzenie do filozofii
(1) Wprowadzenie do nauki o finansach 1id 778 ppt
wprowadzenie do systemu win i podst sieci
wprowadzenie do psychologii społecznej
Wprowadzenie do cw1A
1 Wprowadzenie do psychologii pracy (14)id 10045 ppt
MWB 1 Wprowadzenie do modelowania wymagań w bezpieczeństwie
Wprowadzenie do Kryptografii
Wprowadzenie do pomocy społecznej
ZZL USWyklad 1 Wprowadzenie do tematyki
więcej podobnych podstron