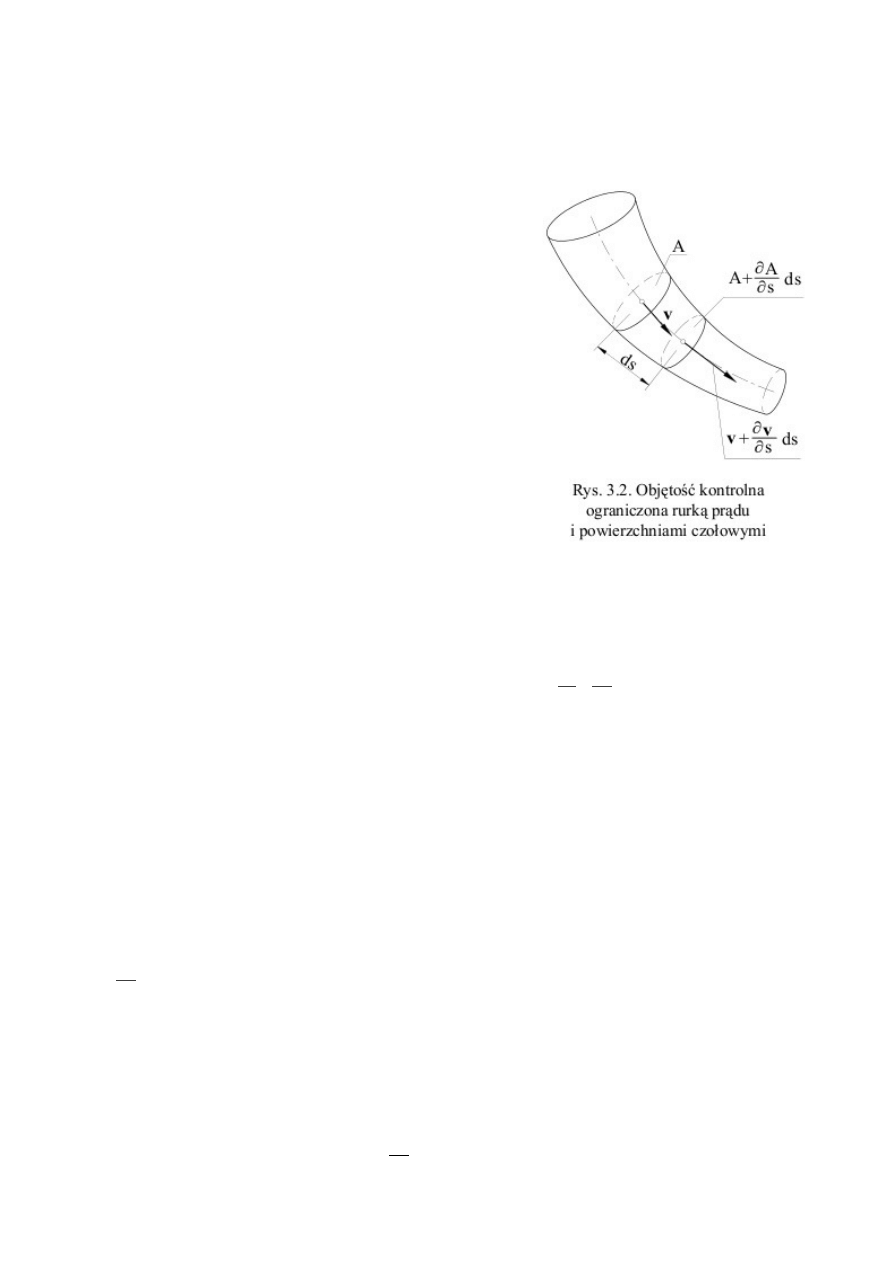
1.1 Podstawowe równania mechaniki płynów – zasada zachowania masy, pędu i
energii.
1. Równanie ciągłości przepływu (zasada zachowania masy)
Zgodnie z zasadą zachowania masy, w żadnym punkcie pola masa
nie może się tworzyć ani znikać. W płynie nieściśliwym (ρ = const)
tylko takie pole prędkości będzie spełniało tę zasadę, w którym w
każdej chwili do obszaru ograniczonego powierzchnią kontrolną
będzie wpływało tyle płynu, ile w tej samej chwili wypływa.
Warunek ten jest zatem identyczny dla przepływów ustalonych i
nieustalonych.
W przypadku ruchu ustalonego (żadna wielkość nie zależy od czasu)
zasadę przedstawiają równania:
•
dla płynu ściśliwego -
⋅
A⋅v =const
•
dla płynu nieściśliwego -
A⋅v=const ,
które można również napisać w postaci:
•
dla płynu ściśliwego -
ρ
1
⋅
A
1
⋅
v
1
=
ρ
2
⋅
A
2
⋅
v
2,
•
dla płynu nieściśliwego -
A
1
⋅
v
1
=
A
2
⋅
v
2,
gdzie:
v
1
– prędkość wpływu przez powierzchnię o polu
A
1
,
v
2
– prędkość wypływu przez powierzchnię o polu
A
2
.
Wielkość
A⋅v
oznacza strumień objętości przepływu:
q
V
=
∫
v⋅dA=A⋅v
śr
A po pomnożeniu przez gęstość dostajemy strumień masy:
q
m
=
∫
v⋅⋅dA= A⋅⋅v
śr
Stąd możemy wyliczyć wartość prędkości średniej:
v
śr
=
q
v
A
=
q
m
A
W obliczeniach inżynierskich najczęściej operuje się właśnie prędkością średnią, sprowadzając ruch w
rurach i kanałach do przepływu jednowymiarowego.
2. Zasada zachowania pędu
Opisana ogólnie:
∑
m
i
a
i
=
∑
P
io
∑
P
ij
, gdzie:
P
io
– siła zewnętrzna działająca na i-tą cząstkę o masie m
i
i przyśpieszenie a
i
,
P
ij
– siła wewnętrzna, z jaką j-ta cząstka działa na i-tą
W ośrodku ciągłym sumy zastępujemy całkami i otrzymujemy:
∫
dv
dt
⋅⋅
dV =
∫
f dV
∫
dA
, gdzie:
dv /dt – przyśpieszenie elementu o masie ρ dV ,
f i σ – jednostkowe siły :masowa i powierzchniowa
Równanie powyższe przedstawia zasadę zachowania pędu w niutonowskiej mechanice ośrodków ciągłych,
które orzeka, że zmiana pędu w czasie jest spowodowana przez siły masowe i powierzchniowe.
Ciecz doskonała jest nieściśliwa i nielepka, a zatem nie występują w niej naprężenia styczne , więc równanie
zachowania pędu można zapisać w postaci równania Eulera (równanie cieczy doskonałej):
⋅
dv
dt
=⋅
f −grad p
3. Zasada zachowania energii dla cieczy nielepkiej i nieprzewodzącej (nn) ciepła oraz gazu
doskonałego
Gaz doskonały oraz ciecz nn spełniają zależność na energię wewnętrzną:
e=c
V
⋅
T
,
c
V
=
const
.
Równanie energii dla powyższych:
⋅
d
dt
v
2
2
c
V
⋅
T
p
=⋅
f⋅v−
p
t
, gdzie
c
V
⋅
T
p
=
i
1.2. Równanie Bernoulliego dla płynu doskonałego i jego zastosowanie
v
2
2g
p
g
z =H =const
, gdzie H jest wysokością rozporządzalną oraz [H] = m
v
2
2
pz⋅⋅g = p
rozp
=
const
, gdzie p
rozp
jest to ciśnienie rozporządzalne podawane w Pa
Równanie Bernoulliego określa przemiany energetyczne wzdłuż strugi elementarnej o przekroju
poprzecznym nieskończenie małym i jest szczególnym przypadkiem zasady zachowania energii w
przepływie płynu nielepkiego. W przepływach płynów rzeczywistych ograniczonych ścianami stałymi
(przepływy przez przewody pod ciśnieniem, kanały otwarte itd.) twierdzenie Bernoulliego prowadzi
natomiast do wyników niezgodnych z doświadczeniem. Ale i w tych przypadkach posługujemy się tym
równaniem, powiększonym o składnik, którego wartość liczbowa odpowiada wysokości strat
energetycznych. Uogólnione w ten sposób równanie Bernoulliego stanowi jedno z podstawowych równań
hydrauliki .
Zastosowania równania Bernoulliego
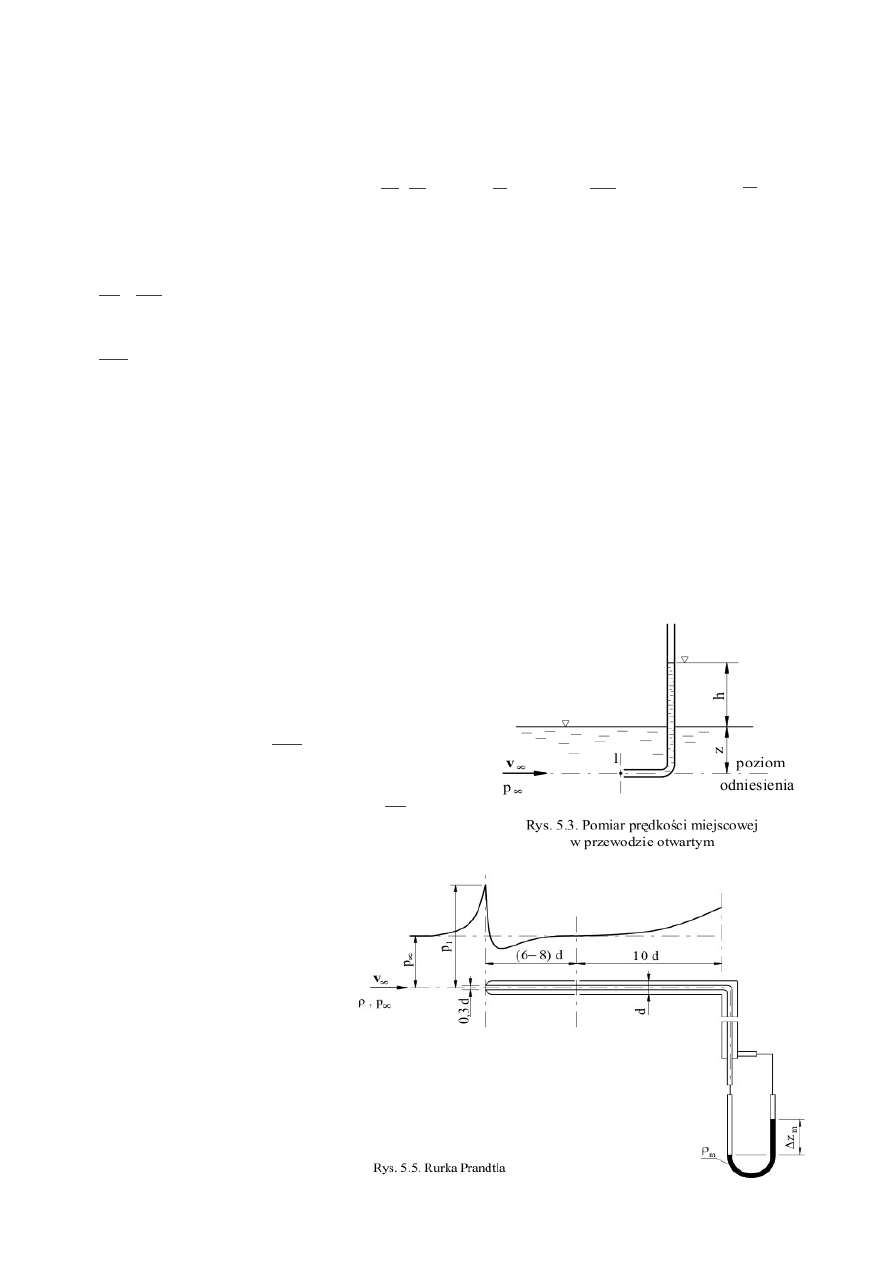
a) Pomiar prędkości miejscowej
•
Rurka Pitota - najprostszy przyrząd służący do
pomiaru prędkości miejscowej. Jest to rurka zagięta
pod kątem 90
o
, której jedno ramię znajduje się w
kanale, w którym dokonujemy pomiaru, a drugie jest
otwarte lub podłączone do manometru. Prędkość v
∞
wynosi:
v
∞
=
2gh
, ponieważ
ciśnienie
spiętrzenia
p
1
:
p
1
=
p
b
g hz = p
b
gz
v
∞
2
2g
. Podczas
pomiaru prędkości miejscowej powietrza należy
pamiętać, że posiada ono inną gęstość niż ciecz
manometryczna!
•
Rurka Prandtla - przyrząd
pomiarowy umożliwiający
bezpośredni pomiar różnicy
ciśnienia spiętrzenia i
ciśnienia
statycznego
przepływu niezakłóconego
jest rurka Prandtla (rys. 5.5).
Odbiór ciśnienia statycznego
p∞ odbywa się na
pobocznicy rurki za
pośrednictwem otworków,
których położenie zależy od
rozkładu ciśnienia wzdłuż
poziomej gałęzi rurki. Jak
wynika z wykresu (rys. 5.5), ciśnienie przed rurką wzrasta, osiągając maksimum bezpośrednio u
wlotu do rurki, potem raptownie maleje nieco poniżej wartości p∞, a następnie łagodnie wzrasta,
osiągając w odległości (6–8)d od wlotu1) wartość p∞. W tym przekroju powinien następować odbiór
ciśnienia statycznego.
Jeżeli różnica ciśnień mierzona jest za pomocą manometru różnicowego to:
p
1
– p
∞
= g ∆z
m
(ρ
m
– ρ) , więc:
v
∞
=
2 g z
m
m
−
1
.
Pomiary wykonywane za pomocą rurki Prandtla podłączonej do, np. mikromanometru mają
niedokładność do 1%. Rurka powinna być wprowadzana do odcinka prostego kanału (nie
mierzyć bezpośrednio za zwężkami, kolanami, zmianami średnic etc.).
b) Pomiar prędkości średniej i strumienia objętości metodą prędkościomierzową
[1.2. Mechanika płynów.pdf, str.125-126]
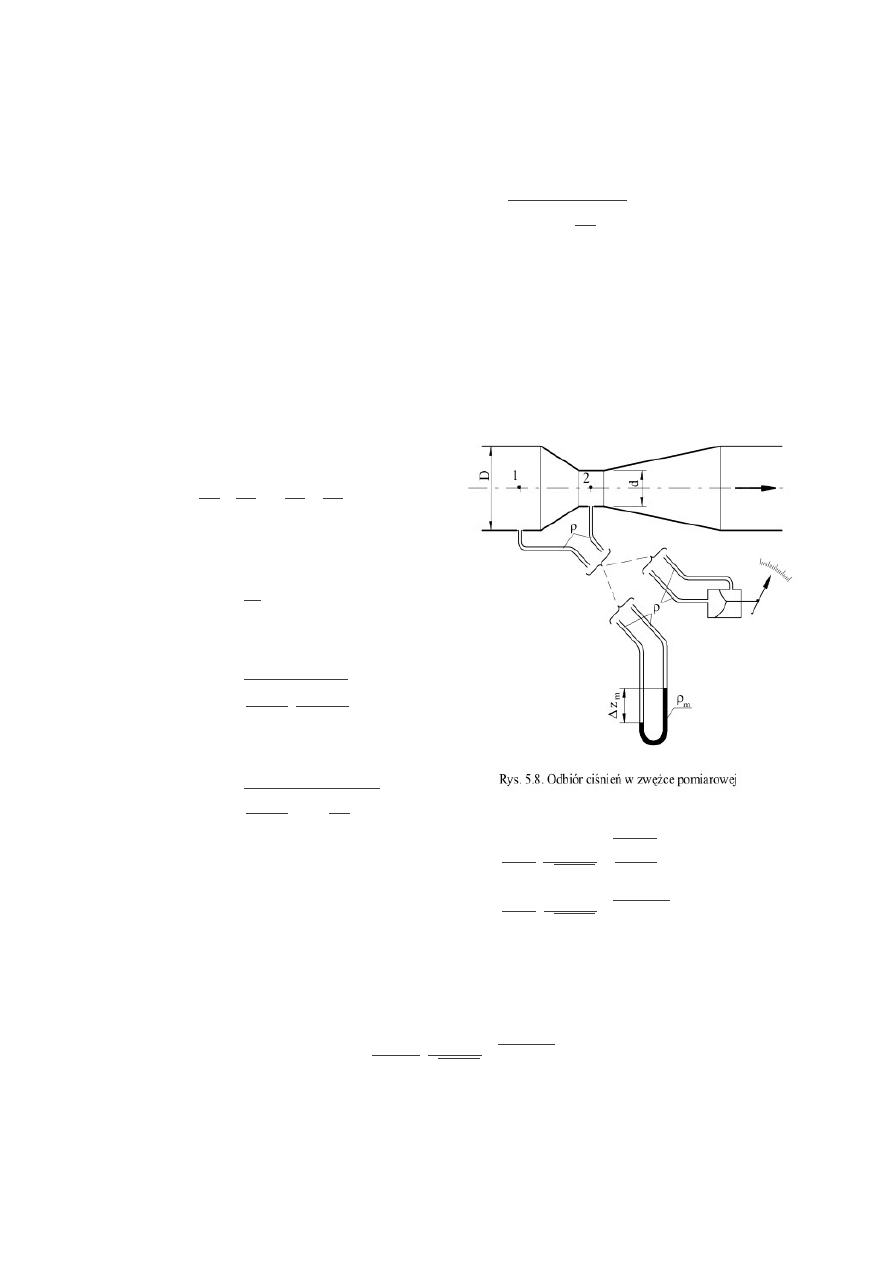
c) Pomiar strumienia objętości metodą zwężkową
Równanie Bernoulliego dla przekrojów 1 i 2:
v
1
2
2g
p
1
g
=
v
2
2
2g
p
2
g
A równanie ciągłości przepływu:
v
1
=
d
D
2
⋅
v
2
=
2
⋅
v
2
Rozwiązanie względem v
2
:
v
2
=
2g
1−
4
⋅
p
1
– p
2
g
Często mierzymy manometrem różnicowym, więc:
v
2
=
2g
1−
4
⋅
z
m
−
1
Z tego łatwo można policzyć strumień objętości:
q
v
=
d
2
4
⋅
1
1−
4
⋅
2 p
oraz masy:
q
v
=
d
2
4
⋅
1
1−
4
⋅
2 p⋅
W układach rzeczywistych należy jeszcze uwzględnić liczbę ekspansji ε, uwzględniającą spadek ciśnienia na
zwężce (dla płynów nieściśliwych ε=1, dla ściśliwych ε<1) oraz współczynnika przepływu C zależnego od
liczby Reynoldsa w zwężce. Ostatecznie dla układów rzeczywistych:
q
m
=
⋅
d
2
4
⋅
C
1−
4
⋅
2 p⋅
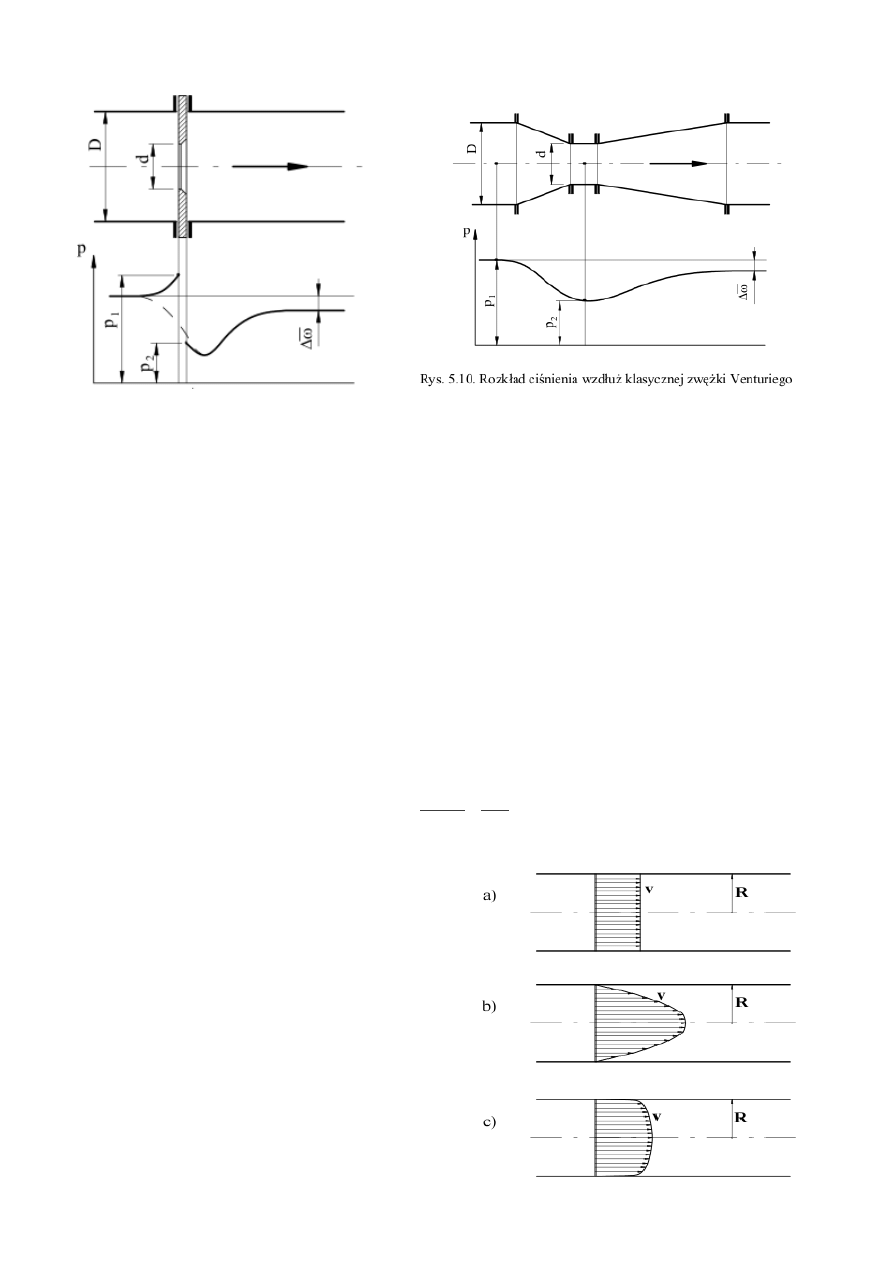
Na rysunkach pokazano schemat wraz z rozkładem ciśnienia zwężki pomiarowej (strona lewa) oraz zwężki
Venturiego (strona prawa). Zwężka Venturiego powoduje mniejsze straty hydrauliczne jednak w praktyce
stosuje się kryzy pomiarowe.
d) Wypływy przez otwory, przelewy etc. [1.2. Mechanika płynów.pdf, str.130]
1.3. Przepływy laminarne i turbulentne. Rozkład prędkości przepływu w
przewodzie.
Przepływ jest laminarny (uwarstwiony), gdy elementy płynu poruszają się w warstwach. W przepływie
turbulentnym (burzliwym), oprócz ruchu głównego (w kierunku przepływu), występują fluktuacje
parametrów hydrodynamicznych (prędkości, ciśnienia). Analizę przejścia przepływu laminarnego w
turbulentny przeprowadził Reynolds (1883), obserwując przepływ w przewodzie kołowym. Reynolds badał
właściwości przepływu laminarnego i turbulentnego, wprowadzając strugę barwnika (aniliny) wzdłuż osi
rury, którą przepływała woda z niewielką prędkością. W przepływie laminarnym nierozmyta struga barwnika
poruszała się wzdłuż osi, natomiast w przepływie turbulentnym barwnik był szybko rozpraszany. Reynolds
zauważył, że na charakter przepływu wpływają następujące parametry: prędkość średnia (v), gęstość (ρ) i
lepkość (μ) cieczy oraz średnica rury (d). Kryterium decydującym o rodzaju ruchu jest bezwymiarowa liczba
ρvd/μ utworzona z tych parametrów i nazwana później liczbą Reynoldsa (Re).
Re=
⋅
v⋅d
=
v⋅d
Umownie u przepływie laminarnym mówi, gdy Re<2300, jednak jest to wartość nieprecyzyjna, gdyż przy
zachowaniu odpowiednich warunków przepływu
(powolny przyrost prędkości) ruch laminarny może
utrzymywać się nawet przy Re wielokrotnie wyższej.
Przedstawione profile dotyczą przepływów
jednowymiarowych:
a) o płaskim rozkładzie prędkości ( jak w modelu płynu
nielepkiego, przyjmowany najczęściej w koncepcji
przepływu jednowymiarowego),
b) o parabolicznym rozkładzie prędkości ( przy przepływie
laminarnym),
c) o w pełni uformowanym profilu turbulentnym.
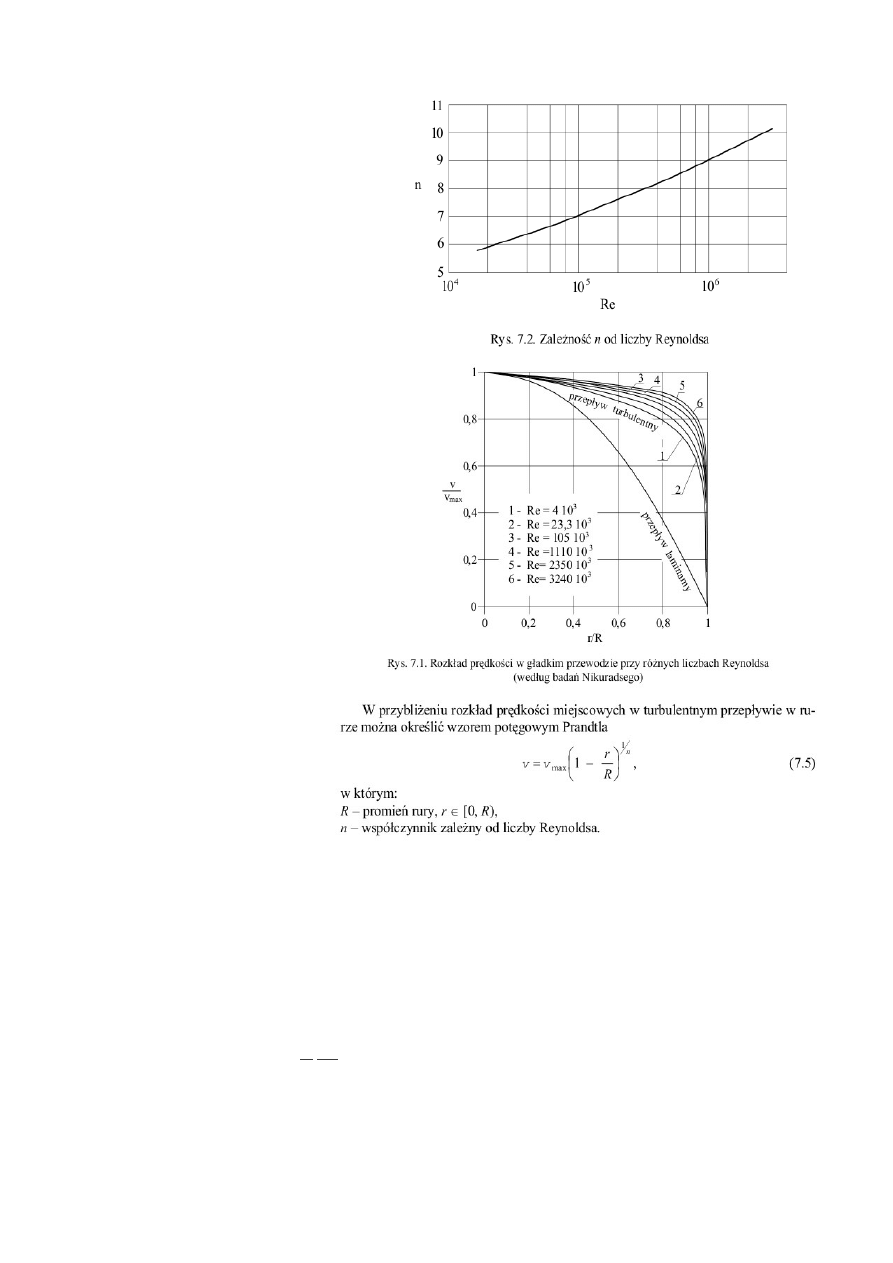
Przejście ruchu laminarnego w turbulentny
następuje wskutek utraty stateczności przepływu
laminarnego. Drobne wszechobecne zaburzenia
generujące fluktuacje elementów płynu
występują zawsze podczas przepływu. W
przepływie laminarnym, w którym siły
bezwładności są małe w porównaniu z siłami
lepkości, są one jednak tłumione przez te
ostatnie. Wzrost sił bezwładności, np. wskutek
przyrostu prędkości przepływu, powoduje, że
tłumiące
działanie
lepkości
jest
niewystarczające, co wywołuje utratę
stateczności ruchu laminarnego i jego przejście
w ruch turbulentny.
Rozróżnia się dolną wartość
krytyczną liczby Reynoldsa Re
kr d
(poniżej której nigdy nie występuje
ruch turbulentny) i górną wartość
krytyczną liczby Reynoldsa Re
kr g
( powyżej której nie występuje ruch
laminarny), przy czym tylko
pierwsza z nich jest dość dokładnie
określona, np. w przypadku
przepływu
przez
długą
cylindryczną rurę o przekroju
kołowym Re
kr d
2300. Górna
≅
wartość krytyczna liczby Reynoldsa
zależy od wielu czynników
ubocznych, jak np. kształtu wlotu
do przewodu, wstępnych zaburzeń
mechanicznych
płynu
wpływającego do przewodu,
stopnia gładkości ścian przewodu,
drgań przewodu. Wszystkie te
czynniki mogą spowodować, że
przejście przepływu laminarnego w
turbulentny może nastąpić przy
różnych wartościach liczby
Reynoldsa.
1.4. Charakterystyka przepływu w pojedynczym przewodzie i szeregowym systemie
hydraulicznym. Rozkład energii wzdłuż rurociągu – wykres Ancony.
1. Straty hydrauliczne wywołane tarciem.
•
Straty liniowe
Wysokość strat liniowych liczymy ze wzoru Darcy’ego–Weisbacha:
h
l
=
l
d
v
2
2g
, gdzie
– współczynnik oporuliniowego
l – długość przewodu
d – średnica przewodu
v – średnia prędkość przepływu
Współczynnik oporu liniowego jest w ogólnym przypadku funkcją liczby Reynoldsa Re i
chropowatości względnej k/d (k – średnia wysokość nierówności na ścianie rury). Wartość tego
współczynnika bywa najczęściej wyznaczana z wykresów opracowanych na podstawie badań
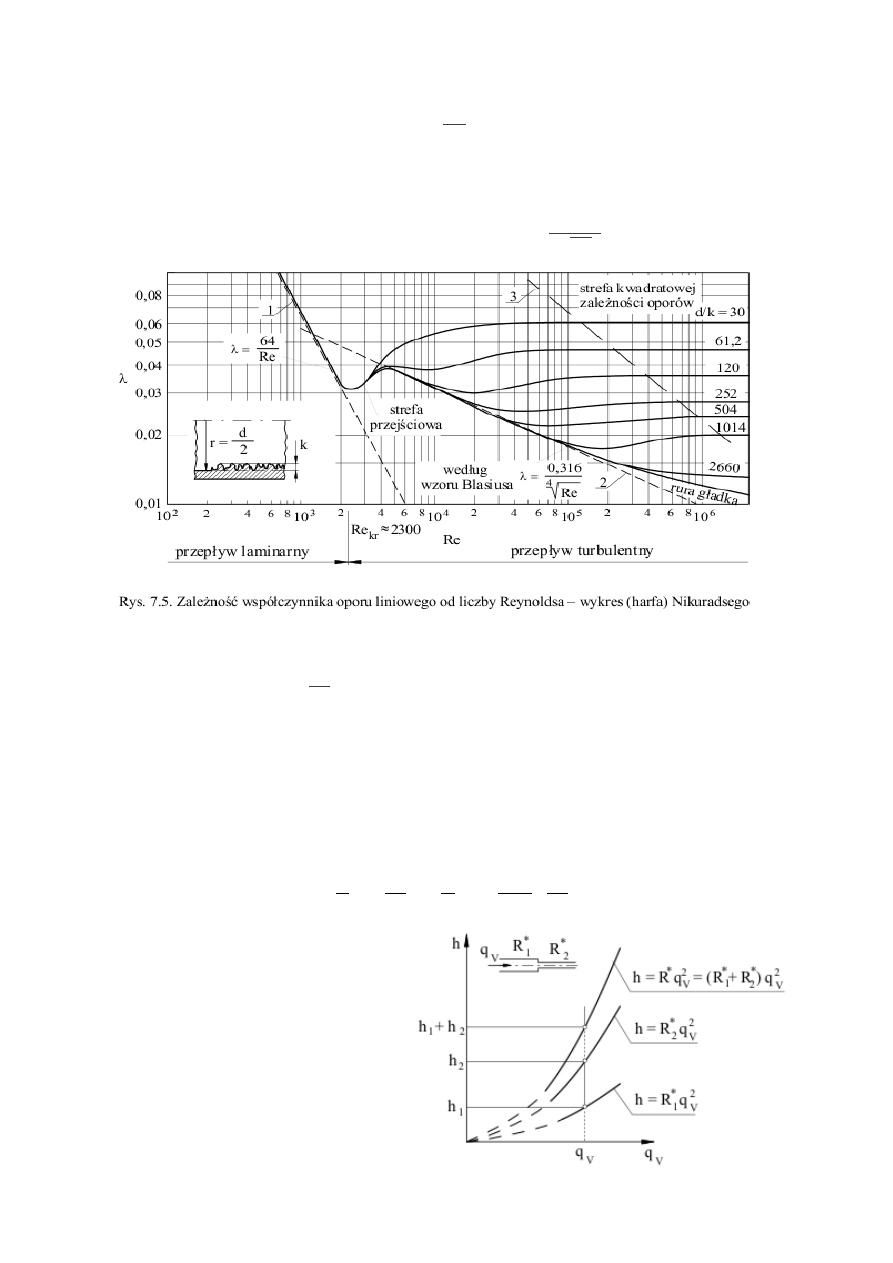
doświadczalnych, z formuł empirycznych lub pół-empirycznych. Jedynie w przypadku przepływu
laminarnego można teoretycznie ze wzoru:
=
64
Re
wyznaczyć zależność między λ i Re. Wynika
stąd, że w przepływie laminarnym przez przewody o przekroju kołowym współczynnik oporu liniowego jest
odwrotnie proporcjonalny do liczby Reynoldsa. Zależność (7.3) została potwierdzona licznymi wynikami
doświadczalnymi.
Dla Re < 100000 często stosuje się empiryczny wzór Blasiusa:
=
0,3614
4
Re
=
100 Re
−
0,25
•
Straty miejscowe
Wysokość strat miejscowych liczymy ze wzoru Darcy’ego–Weisbacha:
h
m
=
v
2
2g
, gdzie
– współczynnik oporuliniowego
v – średnia prędkość przepływu
ζ jest współczynnikiem strat miejscowych zależnych od liczby Reynoldsa i rodzaju przeszkody odniesiony
najczęściej do średniej prędkości za nią. Współczynnik strat miejscowych najczęściej wyznaczany jest
doświadczalnie.
2. Pojedynczy przewód.
Dla pojedynczego przewodu zawierającego opory miejscowe można napisać równanie na wysokość strat
hydraulicznych:
h
s
=
l
d
v
2
2g
=
l
d
4q
v
d
2
2
1
2g
=
R
∗
q
v
2
, gdzie R
8
jest opornością hydrauliczną
przewodu.
3. Szeregowy system
hydrauliczny
jest to współczynnik
Coriolisa uwzględniający
nierównomierny rozkład
prędkości w przekroju
poprzecznym strugi. Dla
przepływu laminarnego jest on 2
a dla turbulentnego >1.
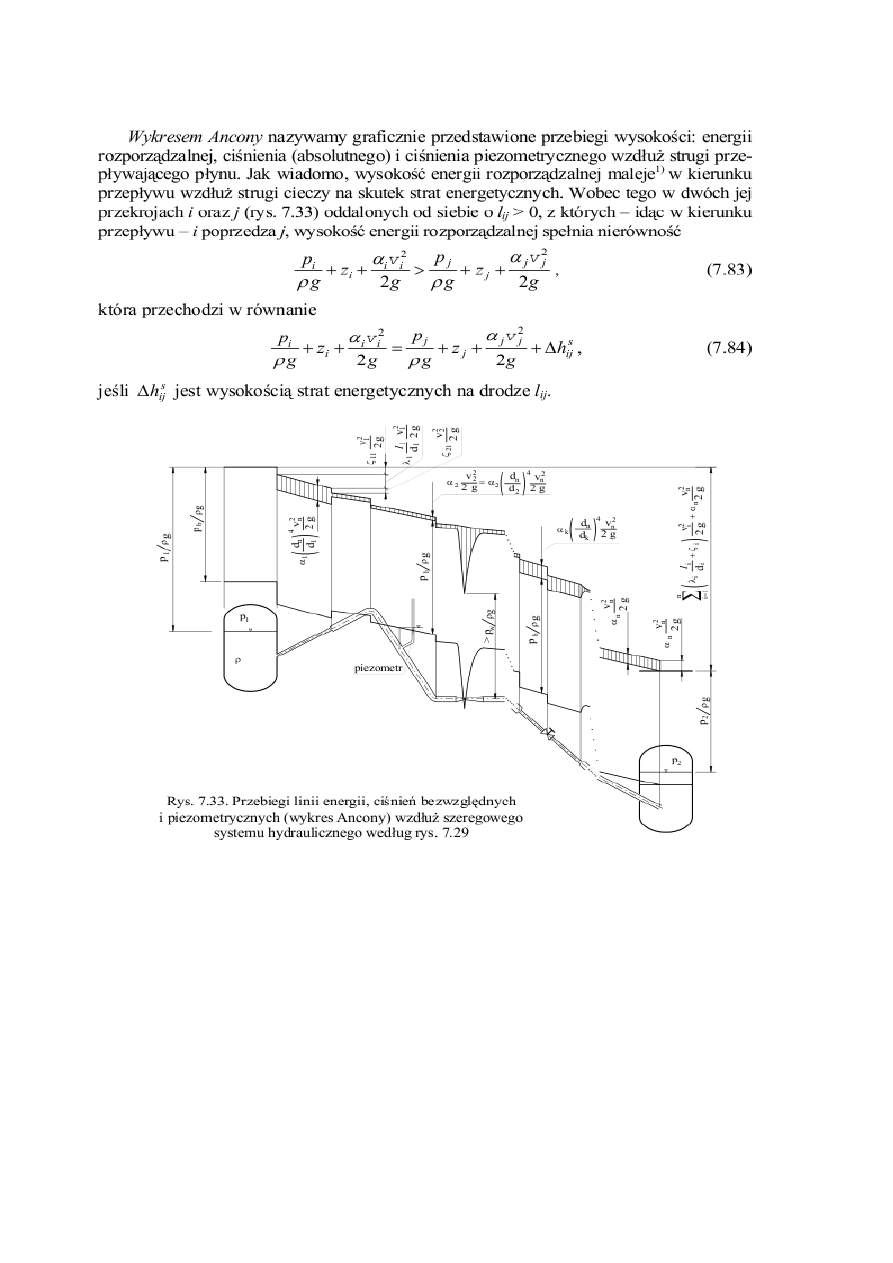
4. Wykres Ancony
Znając zatem wartość energii w pewnym przekroju strugi, możemy znaleźć tę wartość w dowolnym jej
przekroju, jeśli potrafimy obliczyć straty energetyczne między tymi przekrojami. Pozwoli to uzyskać linię
energii, która nie może nigdzie wznosić się w kierunku przepływu płynu. Przeciwnie, podczas przepływu
płynów lepkich linia energii zawsze opada w kierunku przepływu. Wysokość ciśnienia (absolutnego) w
dowolnym przekroju strugi otrzymujemy, odejmując – od wysokości energii – wysokość prędkości. Znając
wysokość ciśnienia w każdym przekroju strugi, możemy wykreślić linię ciśnień i linię ciśnień
piezometrycznych, która przebiega równolegle do linii ciśnień, ale niżej od niej o wysokość ciśnienia
barometrycznego pb /ρ g. Linie ciśnień i ciśnień piezometrycznych kształtują się w zależności od wymiarów
geometrycznych przewodu i strumienia objętości, ale nie muszą opadać w kierunku ruchu. Na rysunku 7.33
przedstawiono wykres Ancony ilustrujący przebieg wysokości energii i ciśnień między zbiornikami
rozważanymi w poprzednich punktach. Łatwo spostrzec, że linie energii i ciśnień nie mogą przecinać
rurociągu1), a dla zapobieżenia odparowaniu cieczy ciśnienie w rurze musi przekraczać ciśnienie parowania
pw. Wynika stąd, że linia ciśnień piezometrycznych nie może przebiegać pod rurociągiem niżej
niż (pb – pw)/ρ g.

1.5. Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne i
nieodwracalne).
1. Pierwsza zasada termodynamiki – jedno z podstawowych praw termodynamiki, jest
sformułowaniem zasady zachowania energii dla układów termodynamicznych. Zasada stanowi
podsumowanie równoważności ciepła i pracy oraz stałości energii układu izolowanego.
Dla układu zamkniętego (nie wymienia masy z otoczeniem, może wymieniać energię) zasadę można
sformułować w postaci: zmiana energii wewnętrznej układu zamkniętego jest równa energii, która przepływa
przez jego granice na sposób ciepła lub pracy.
,
gdzie:
ΔU – zmiana energii wewnętrznej układu,
Q – energia przekazana do układu jako ciepło,
W – praca wykonana na układzie.
W powyższym sformułowaniu przyjmuje się konwencję, że gdy:
•
W > 0 – do układu przepływa energia na sposób pracy,
•
W < 0 – układ traci energię na sposób pracy,
•
Q > 0 – do układu przepływa energia na sposób ciepła,
•
Q < 0 – układ traci energię na sposób ciepła.
W przypadku układu termodynamicznie izolowanego układ nie wymienia energii z otoczeniem na sposób
pracy (W = 0) ani na sposób ciepła (Q = 0), wówczas:
W układzie zamkniętym zawierającym ciało proste zmiana energii wewnętrznej równa jest sumie
algebraicznej pracy oraz ciepła wymienianego z otoczeniem, o ile nie występuje zmiana energii kinetycznej
oraz energii położenia układu. Pierwsza zasada termodynamiki stwierdza możliwość zamiany ciepła na
pracę.
Energia wewnętrzna ciała jest sumą energii cząstek oraz energii ich wzajemnego oddziaływania. Energia
wewnętrzna zawsze rośnie wraz ze wzrostem temperatury.
Przemiana termodynamiczna jest zbiorem kolejnych stanów substancji, ciała lub układu
termodynamicznego. Przemiana jest odwracalna, jeżeli od jej stanu końcowego do początkowego można
powrócić w taki sposób, że i otoczeniu przywrócony będzie stan pierwotny. Nieodwracalność przemiany
związana jest z rozpraszaniem energii w takich zjawiskach, jak tarcie czy wydzielanie ciepła Joule'a w
przepływie prądu.
Praca zewnętrzna jest pracą sił zewnętrznych jakimi działa otoczenie na układ.
∫
=
2
1
V
V
1,2
dV
p(V)
L
.
Jeżeli we wzorze określającym I zasadę termodynamiki zastąpić zmianę energii wewnętrznej zmianą entalpii
to zamiast pracy zewnętrznej W we wzorze pojawi się praca techniczna W
tech
L
t1,2
=
∫
−
2
1
p
p
dp
V(p)
Entalpię definiuję się jako:
I =U pV
,
czyli entalpia jest sumą energii wewnętrznej układu i pracy zewnętrznej.
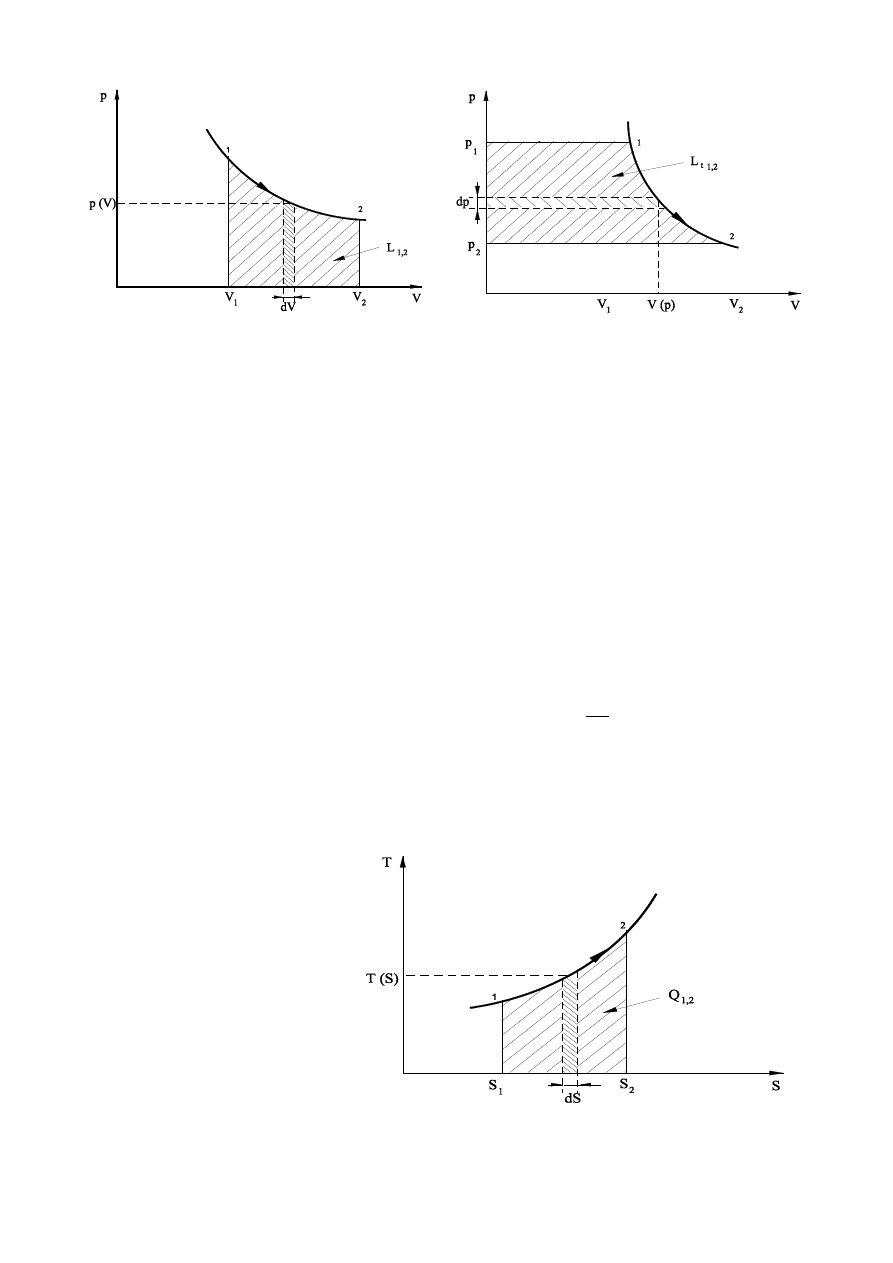
Rys.1. Interpretacja graficzna pracy zewnętrznej.
Rys. 2. Interpretacja graficzna pracy technicznej.
2. Druga zasada termodynamiki
Pierwsza zasada termodynamiki stwierdza, że w ogóle można zamienić ciepło na pracę, natomiast druga
zasada podaje warunki, w jakich można zamienić ciepło na pracę oraz jak należy przeprowadzić proces, aby
z danej ilości ciepła uzyskać maksymalną pracę.
Trzy sformułowania II zasady termodynamiki:
a) aby zamienić ciepło na pracę muszą istnieć dwa źródła ciepła o różnych
temperaturach,
b) sprawność termiczna procesu (obiegu silnika) nie może osiągnąć jedności,
c) w przyrodzie możliwe są tylko takie przemiany, podczas których entropia
układu wzrasta.
Praktycznie oznacza to, że entropia układu zamkniętego i izolowanego nie może maleć podczas dowolnej
przemiany i wzrasta przy przemianach nieodwracalnych. W praktyce stosuje się najczęściej przyrosty
entropii lub względne wartości entropii ponad stan przyjęty umownie za zerowy.
Przyrost entropii dla substancji stałych i ciekłych o stałym cieple właściwym
cpcv =c=const
można zapisać w postaci:
1
2
1
2
T
T
ln
Mc
S
-
S
=
.
Ze wzoru na entropię ciepło przemiany jest równe:
∫
=
2
1
S
S
1,2
dS
T(S)
Q
.
Rys.3. Interpretacja ciepła przemiany
na wykresie T-S
Może ono być przedstawione na
wykresie o współrzędnych T – S (rys.
3) w taki sam sposób jak praca
zewnętrzna przemiany na wykresie o
współrzędnych p – V (rys.1). Ciepło
przemiany jest dodatnie, gdy entropia
rośnie, a ujemne gdy entropia maleje.
Podstyczna na wykresie o
współrzędnych T –S przedstawia
rzeczywiste ciepło właściwe przemiany
w stanie odpowiadającym punktowi
styczności. Ponieważ dla gazów i par c
p
> c
v
, na wykresie o współrzędnych T-S izobara przebiega łagodniej od izochory. Podobnie jak pracę
przedstawia pole pod krzywą przemiany na wykresie p-V, ciepło może być przedstawione w postaci pola pod
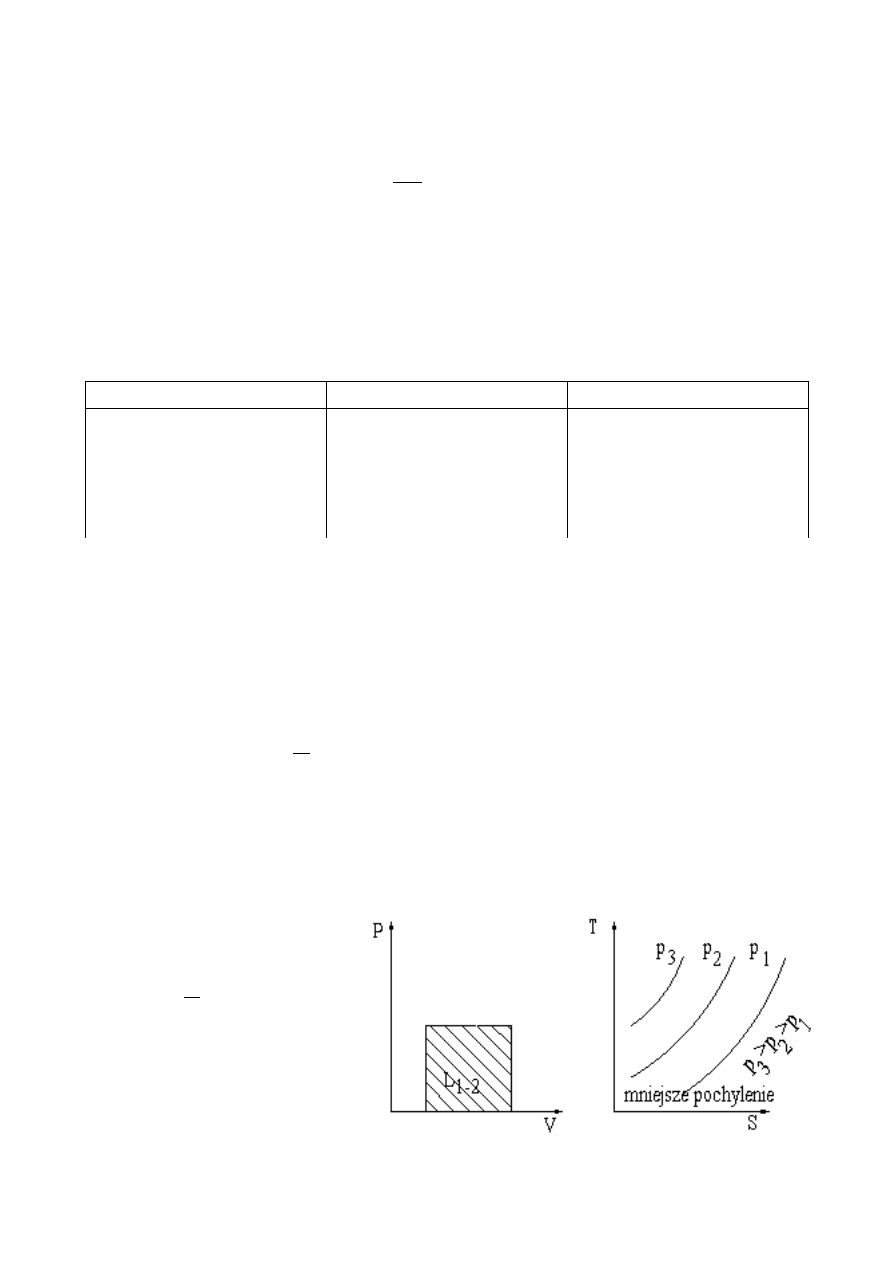
krzywą przemiany na wykresie T-S. W przemianach odwracalnych pole to jest miarą ciepła wymienianego z
otoczeniem, natomiast dla przemian nieodwracalnych z tarciem przedstawia sumę ciepła wymienianego z
otoczeniem oraz ciepła Q
f
doprowadzonego nieodwracalnie. Przyrost entropii układu można rozdzielić na
część spowodowaną wymianą ciepła z otoczeniem:
0
T
dQ
dS
≥
=
gdzie: dQ – ciepło wymienione z otoczeniem oraz zawsze dodatnie wytworzenie entropii wewnątrz
rozpatrywanej części układu spowodowane zjawiskami nieodwracalnymi np. praca tarcia zostaje zamieniona
na ciepło tarcia (dQ
f
= dL
f
). Entropia układu adiabatycznego na skutek przemian nieodwracalnych wzrastaa
w przypadku przemian odwracalnych nie zmienia się.
1.6. Przemiany charakterystyczne gazu doskonałego. Równanie stanu gazu.
1. Równanie stanu gazu.
Gaz doskonały
Gaz półdoskonały
Gaz rzeczywisty
- drobiny nie oddziałują między
sobą,
- drobiny mają zerową objętość,
- drobiny są sztywne (nie drgają),
-stałe ciepło właściwe
c
p
i
c
v
- drobiny posiadają energię
kinetyczną (ruch postępowy,
obrotowy, oscylacyjny,
- drobiny mogą drgać,
- ciepło właściwe
c
p
i
c
v
zależne od temperatury
- drobiny oddziałują na siebie,
- drobiny mają własną objętość,
- drobiny w ciągłym ruchu,
- stanu nie opisuje równanie
Clapeyrona
Równaniem stanu gazu doskonałego i półdoskonałego jest równanie Clapeyrona postaci:
p⋅V =m⋅R⋅T
lub
p⋅V =n⋅M⋅R⋅T
gdzie:
R
- indywidualna stała gazowa,
J / kg⋅K
,
M⋅R
- uniwersalna stała gazowa,
J / kg⋅K
,
n
- liczba moli.
Równaniem stanu gazu rzeczywistego jest równanie:
–
van der Waalsa
p
a
v
2
⋅
v−b=R⋅T
,
–
Redlicha - Kwanga,
–
wirialne (szereg potęgowy) - grupa równań
2. Przemiany termodynamiczne.
•
izobaryczna
p = idem
–
równanie przemiany (prawo
Gay-Lusaca):
p=
V
T
=
idem
–
przemiany izobaryczne:
ekspansja, kompresja
–
praca zewnętrzna:
L= p⋅V
2
– V
1
=
M⋅R⋅T
2
– T
1
–
praca techniczna:
L
t
=
V⋅ p
1
– p
2
=
0
–
ciepło:
Q=M⋅c
p
⋅
T
2
−
T
1
–
sprawność termiczna:
=
−
1
–
przyrost entropii:
S
2
−
S
1
=
M⋅c
p
⋅
ln
T
2
T
1
•
izochoryczna
V = idem
–
równanie przemiany (prawo
Charlesa):
V =
p
T
=
idem
–
przemiany izochoryczne:
sprężanie, rozprężanie
–
praca zewnętrzna:
L=0
, bo
dV =0
–
praca techniczna:
L
t
=
V⋅ p
1
−
p
2
–
ciepło:
Q=M⋅c
v
⋅
T
2
−
T
1
–
przyrost entropii:
S
2
−
S
1
=
M⋅c
V
⋅
ln
T
2
T
1
•
izotermiczna
T = idem
–
równanie przemiany (prawo Boyla-
Mariotta):
T = p⋅V =idem
–
przemiany izotermiczne:
ekspansja=rozprężanie,
kompresja=sprężanie
–
praca zewnętrzna:
L= p
1
⋅
V
1
⋅
ln
V
2
V
1
=
p
1
⋅
V
1
⋅
ln
p
1
p
2
–
praca techniczna:
L
t
=
L=M⋅R⋅T
1
⋅
ln
p
1
p
2
–
ciepło:
Q= L= p
1
⋅
V
1
⋅
ln
V
2
V
1
=−
p
1
⋅
V
1
⋅
ln
p
2
p
1
=
p
1
⋅
V
1
⋅
ln
p
1
p
2
–
przyrost entropii:
S
2
−
S
1
=
M⋅R⋅ln
V
2
V
1
=
M⋅R⋅ln
p
1
p
2
•
adiabatyczna
= idem
–
równanie przemiany:
p⋅V
=
idem
,
T⋅V
−
1
=
idem
,
T⋅p
1−
=
idem
–
wykładnik izentropy
=
c
p
c
v
=
idem
.
–
charakteryzuje się brakiem wymiany
ciepła pomiędzy czynnikiem a źródłami
zewnętrznymi,
–
wytworzone ciepło tarcia powoduje podwyższenie energii wewnętrznej czynnika,
–
praca zewnętrzna:
L=U
1
−
U
2
=
M⋅c
V
⋅
T
1
−
T
2
–
praca techniczna:
L
t
=⋅
L=I
1
−
I
2
=
M⋅c
p
⋅
T
1
−
T
2
=
M⋅⋅c
v
⋅
T
1
−
T
2
•
izentropowa
S = idem
–
jest przemianą adiabatyczną odwracalną, podczas której entropia jest stała
(
dQ=0
i
Q=0
, a przy
T 0
dS =0
i
S=idem
)
•
izentalpowa
I = const
•
politropowa
n = const
–
równanie przemiany:
p⋅V
n
=
idem
,
p
2
p
1
=
V
1
V
2
n
=
T
2
T
1
n
n−1
T⋅V
n−1
=
idem ,
,
T⋅p
1−n
n
=
idem
–
wykładnik politropy n - stały dla danej rodziny
przemian, może być dowolną liczbą rzeczywistą
większą lub mniejszą od
,
n=idem
–
istnieje wymiana ciepła
dQ=M⋅c⋅dT
, przy czym średnie ciepło właściwe „c” dla danej
politropy jest stałe i równe:
c=c
v
p⋅dV
dt
=
c
v
⋅
n−
n−1
–
praca techniczna:
L
t
=
n⋅L=I
1
−
I
2
–
ciepło:
Q=M⋅c⋅T
2
−
T
1
–
przyrost entropii:
S
2
−
S
1
=
M⋅c⋅ln
T
2
T
1
–
wykładnik politropy można wyznaczyć analitycznie:
n=lg
p
2
p
1
/
lg
V
1
V
2
–
typowe przemiany politropowe:
Wykładnik
politropy
Ciepło
właściwe
Równanie
przemiany
Przemiany
0
1
∞
c
p
∞
0
c
v
p = const
pV=RT=const
pV
= const
V = const
izobaryczne substancji dowolnych
izotermiczne gazów doskonałych
izentropowe gazów doskonałych
izochoryczne substancji dowolnych
3. Gaz wilgotny.
Teoria gazów wilgotnych dotyczy gazów, które w sąsiedztwie cieczy wchłaniają pary cieczy i stają
się wilgotne. Zmiana warunków powoduje, że część pary ulega skropleniu.
Najbardziej typowym przykładem jest powietrze wilgotne – mieszanina gazów i par (gaz suchy - nie
skroplone w atmosferze cząstki azotu, tlenu, argonu + woda występująca w powietrzu w różnych stanach
fazowych).
Ciśnienie cząstkowe pary wodnej w powietrzu jest nieznaczne i dlatego można z pewnym
ograniczeniem stosować w tym przypadku prawa gazów doskonałych i prawo Daltona (każdy składnik w
roztworze gazowym zachowuje się tak, jakby znajdował się sam w przestrzeni zajętej przez roztwór). Zatem
ciśnienie cząstkowe pary wodnej w powietrzu wilgotnym jest równe:
p
p
=
p
a
−
p
s
gdzie:
p
p
– ciśnienie cząstkowe pary wodnej,
p
a
– ciśnienie atmosferyczne,
p
s
- ciśnienie cząstkowe gazu suchego.
Wyróżnia się powietrze:
–
suche nienasycone wilgocią, zawierające parę wodną przegrzaną, zdolne do wchłonięcia pary
wodnej w danej temperaturze
–
wilgotne nasycone wilgocią, zawierające suchą parę nasyconą,
–
wilgotne przesycone wilgocią (zamglone), zawierające parę mokrą.
Gaz suchy oraz parę wodną w gazie wilgotnym (niskie ciśnienie pary) można traktować jak gaz doskonały.
Stan powietrza wilgotnego określają:
•
wilgotność bezwzględna
ρ
p
=
m
p
V
- masa pary wodnej zawarta w jednym metrze sześciennym
powietrza wilgotnego, co jednoznacznie odpowiada gęstości pary,
•
wilgotność względna
=
p
nas
p ,T
=
p
p
p
nas
T
– stosunek gęstości pary wodnej do gęstości pary
suchej nasyconej,
•
stopień suchości
x=
m
p
m
p
m
c
- masa pary wodnej (nasyconej suchej) zawartej w parze mokrej
(ciecz nasycona + para nasycona),
•
stopień zawilżenia
X =
m
p
m
gs
- masa pary zawartej w gazie suchym,
•
przedstawienie graficzne - wykres Moliera (i - X),
•
równanie Clapeyrona:
p⋅V =m
gs
⋅
1 X ⋅R⋅T
.
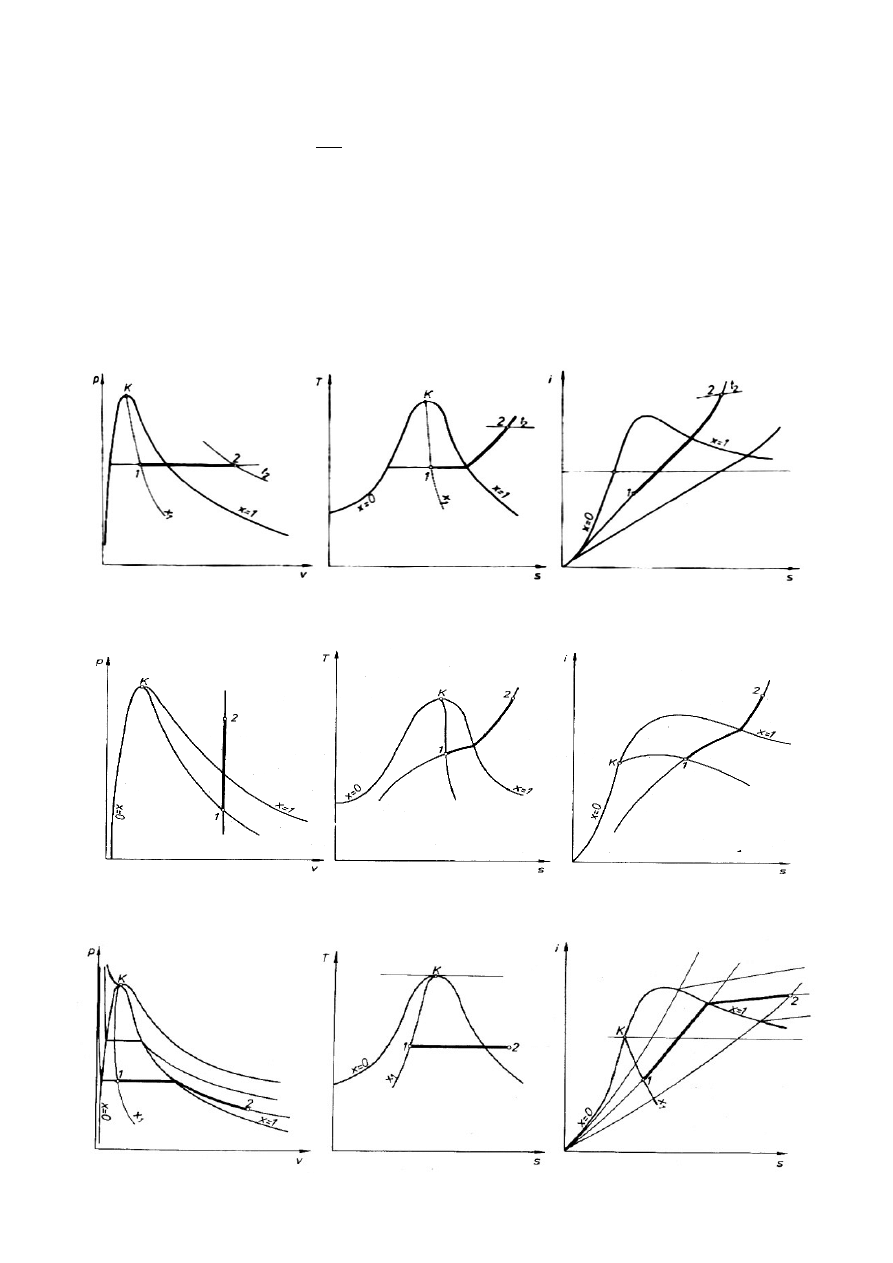
1.7. Przemiany charakterystyczne pary wodnej (układ p-v, T-s, i-s)
•
przemiana izobaryczna p = idem
•
przemiana izochoryczna V = idem
•
przemiana izotermiczna T = idem
•
przemiana izentropowa (adiabatyczna bez tarcia)
p⋅V
=
idem
1.8. Obieg Clausiusa - Rankine'a. Metody podwyższania sprawności obiegu C-R.
[Pawlik, Strzelczyk, Elektrownie. str. 32]
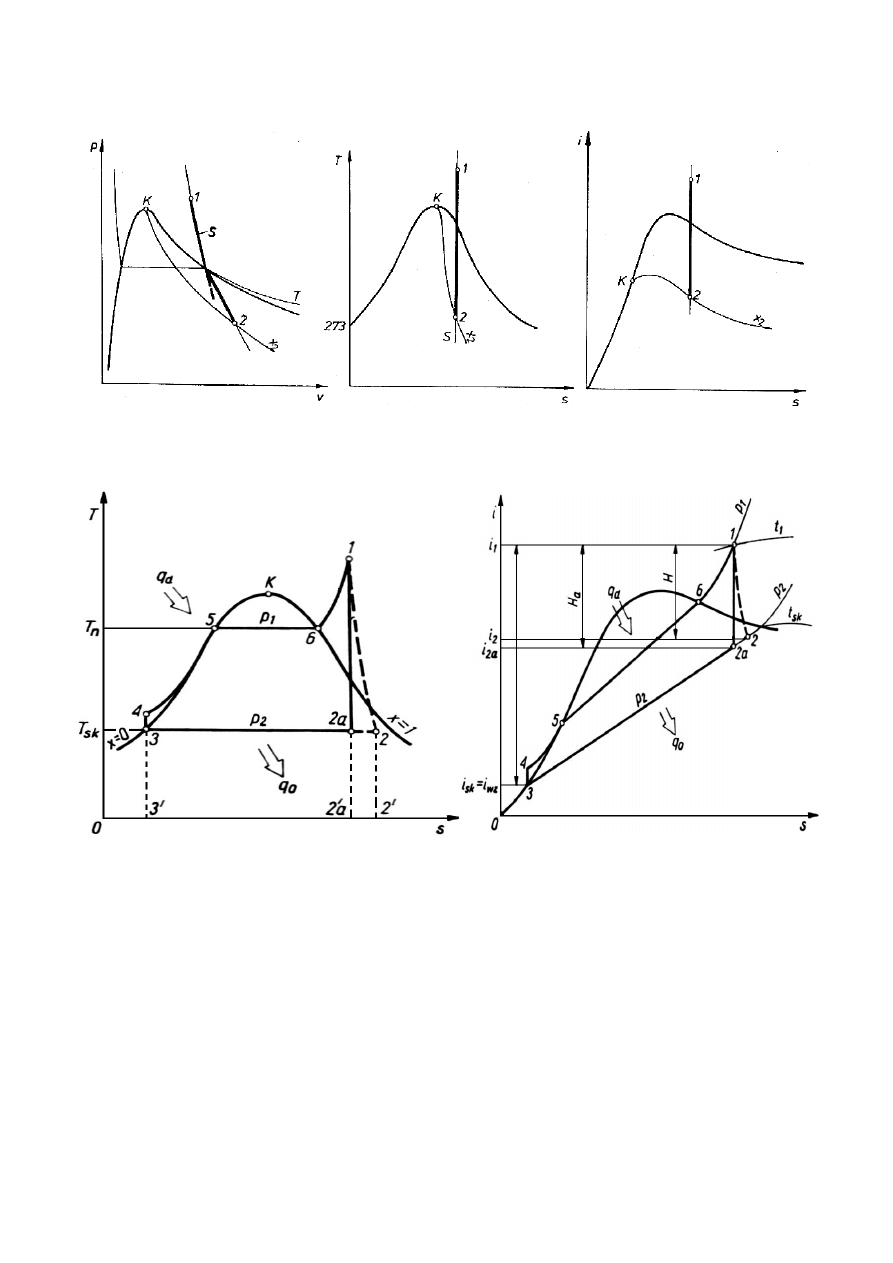
Obieg Rankine’a elektrowni parowej
kondensacyjnej: a) w układzie T-s; b) w układzie i-s
gdzie: 3 – 4 izentropowe sprężanie wody zasilającej przez pompę wody zasilającej;
4 – 5 podgrzewanie wody w kotle;
5 – 6 odparowanie wody;
6 – 1 przegrzewanie pary;
1 – 2 rozprężanie pary w turbinie;
2 – 3 skraplanie pary w skraplaczu;
qd – ciepło doprowadzone do obiegu;
qo – ciepło odprowadzone z obiegu.
Obieg Rankine’a jest obiegiem idealnej siłowni parowej i służy on do oceny pracy rzeczywistej siłowni.
Idealna siłownia parowa jest to taka, w której:
•
nie występuje tarcie, nie ma spadu ciśnienia podczas przepływu płynu rurociągiem i nie ma strat
pracy przez tarcie w silniku i pompie;
•
nie występują straty ciepła, ponieważ izolacja turbiny i rurociągów jest idealna;
•
występuje izentropowa ekspansja, ponieważ turbina jest idealna;
•
pompa zasilająca spręża kondensat izentropowo do ciśnienia kotłowego, nie występuje dławienie;
•
całe ciepło spalania paliwa jest przekazywane czynnikowi obiegowemu, ponieważ kocioł jest
idealny.
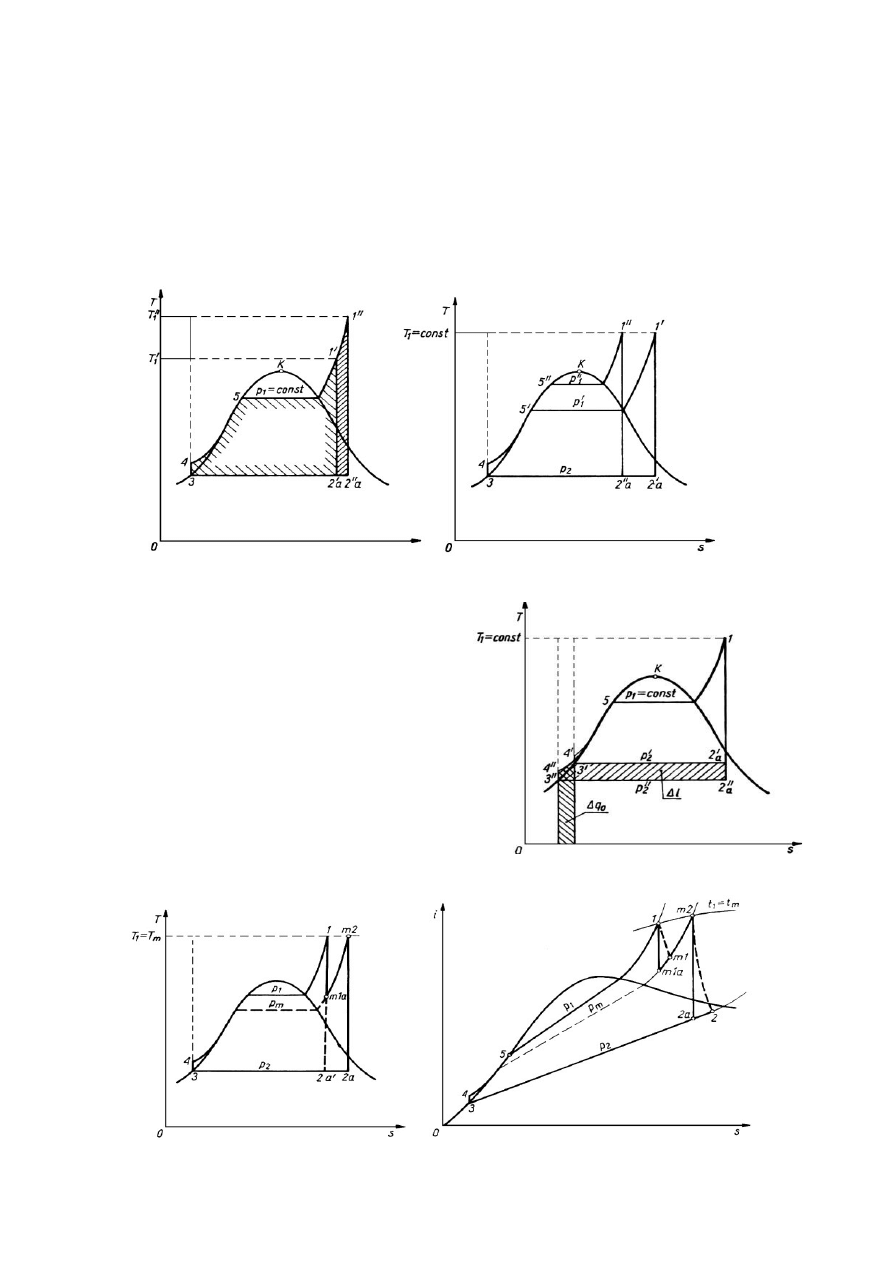
Ogólnie zwiększenie sprawności realizuje się przez: zwiększenie sprawności termicznej obiegu, zwiększenie
sprawności poszczególnych urządzeń, zmniejszenie zużycia energii na potrzeby własne. Sposoby
zwiększania sprawności obiegu CR:
•
zwiększenie parametrów pary świeżej doprowadzonej do turbiny = większa sprawność obiegu i
mniejsze jednostkowe zużycie paliwa.
•
obniżenie parametrów w skraplaczu (ciśnienia pary wylotowej), realizowane przez:
- zwiększenie powierzchni kondensatora;
- zwiększenia przepływu wody przez
kondensator;
- obniżenie temperatury wody chłodzącej.
•
międzystopniowe przegrzewanie pary
•
regeneracyjne podgrzewanie wody zasilającej - podgrzewanie kondensatu i wody zasilającej parą,
która już częściowo wykonała pracę w turbinie. Liczba stopni podgrzewania = 7 - 9.
•
zwiększenie sprawności wewnętrznej turbiny,
•
zwiększenie sprawności kotła,
•
skojarzone wytwarzanie energii elektrycznej i cieplnej,
•
zmniejszenie zużycia energii na potrzeby własne,
•
skojarzenie obiegów o różnych czynnikach roboczych.
1.9. Przewodzenie i przenikanie ciepła. Promieniowanie cieplne. Rodzaje
wymiany ciepła – równania. Przekazywanie ciepła.
1. Przewodzenie ciepła - wymiana ciepła między bezpośrednio stykającymi się częściami ciał, brak
makroskopowego ruchu substancji.
Prawo Fouriera - gęstość strumienia przewodzonego ciepła jest wprost proporcjonalna do gradientu
temperatury w kierunku prostopadłym do powierzchni izotermicznej.
q=−⋅grad⋅t=−⋅
dt
dn
, gdzie
- współczynnik przewodzenia ciepła,
W
m⋅K
.
Największa wartość
mają metale (srebro, złoto, miedź), im lepszy przewodnik tym wartość
rośnie. Izolatory, mają strukturę porowatą, duży udział gazu, np. dla styropianu rzędu setnych części
W / m⋅K
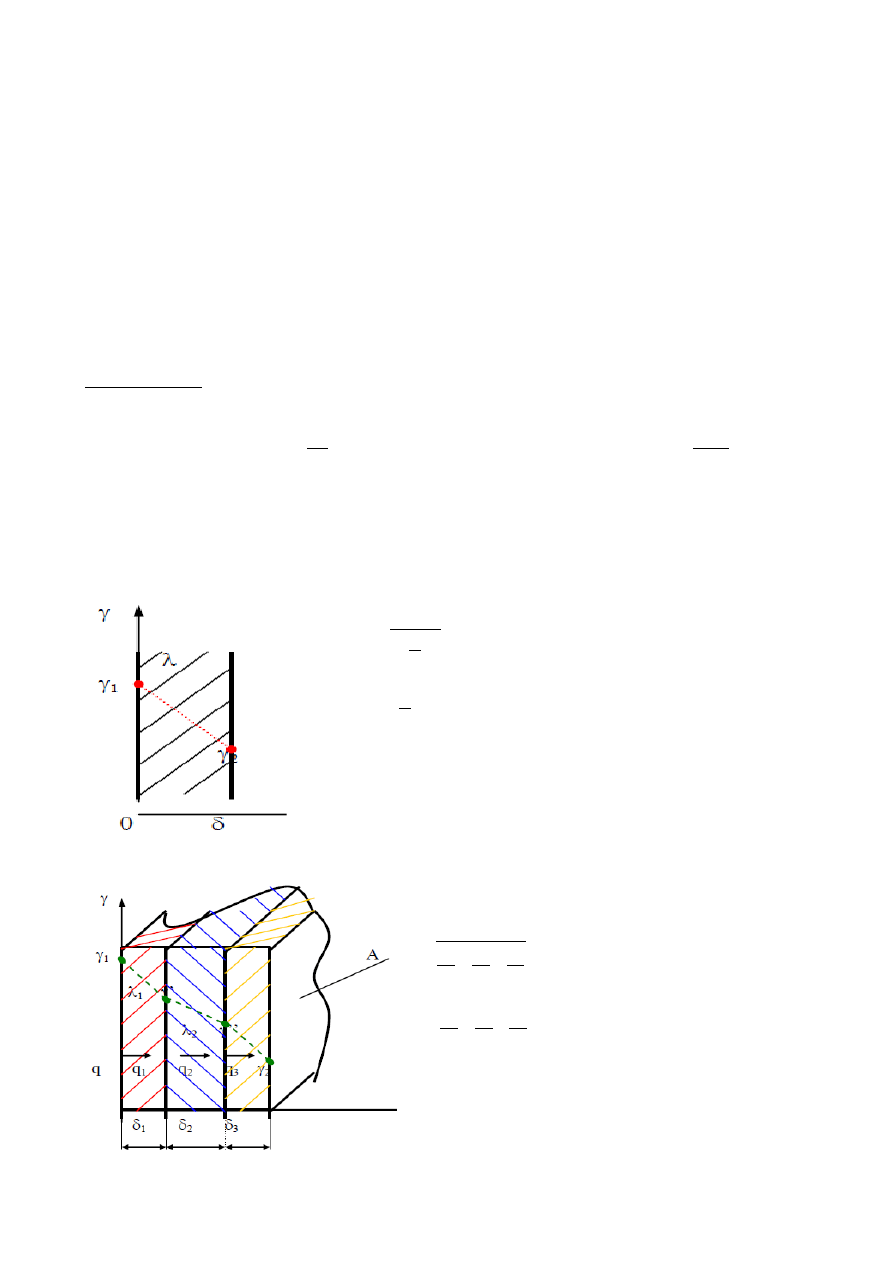
a) jednowymiarowe, ustalone przewodzenie przez ścianę płaską.
q=
1
−
2
- gęstość strumienia ciepła
R
=
- opór przewodzenia
b) przewodzenie przez warstwy o różnych
i różnych
.
q=
1
−
2
1
1
2
2
3
3
- gęstość strumienia ciepła
r
=
1
1
2
2
3
3
- opór przewodzenia
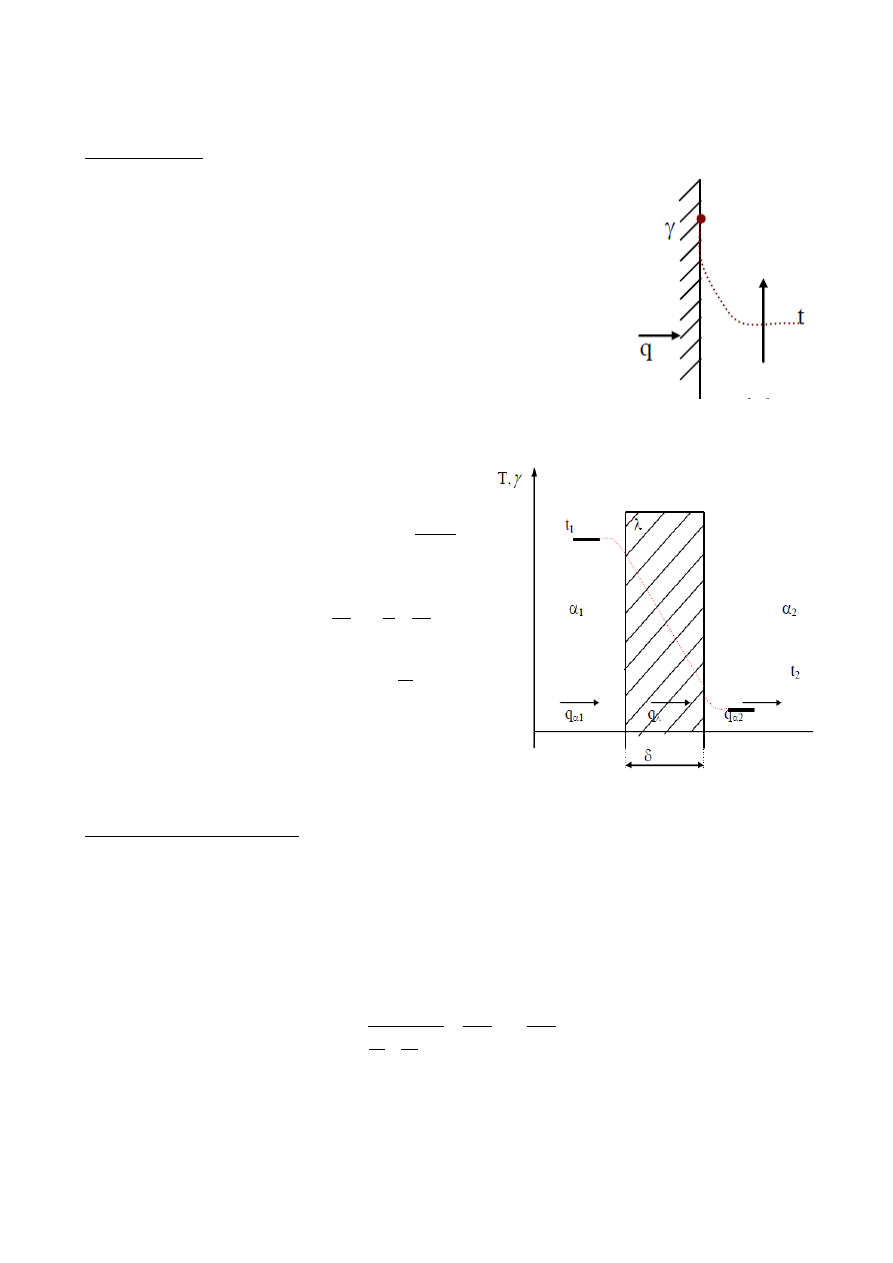
2. Przejmowanie ciepła (wnikanie) - wymiana ciepłą między powierzchnią ciała stałego a omywającym go
płynem.
Prawo Newtona - gęstość strumienia przejmowanego ciepła jest wprost proporcjonalny do różnicy
temperatur powierzchni ciała stałego i płynu.
q=⋅t
s
−
t
p
, gdzie
- wsp. przejmowania ciepła,
W /m
2
zależny od charakteru przepływu (liczba Reynoldsa, liczba Prandtla),
rodzaju płynu, kształtu opływanej powierzchni.
Największe
- przepływ ze zmienną fazą (wrzenie, skraplanie), najmniejsze
- konwekcja naturalna, gdy czynnikiem jest gaz,
(5,6 W/m
2
).
3. Przenikanie ciepła - wymiana ciepła między dwoma płynami rozdzielonymi ścianką (ściankę płaską i
walcową).
•
gęstość strumienia ciepła przenikającego przez
ściankę płaską rozdzielającą płyny:
q=
t
1
−
t
2
R
p
•
opór przenikania = suma oporów przejmowania i
przewodzenia ciepła:
R
p
=
1
1
1
2
•
współczynnik przenikania ciepła
k =
1
R
•
strumień ciepła:
Q= A⋅q= A⋅k⋅t
1
−
t
2
4. Promieniowanie cieplne (fale elektromagnetyczne).
Prawo Stefana
–
Boltzmanna
– wielkość strumienia energii przenoszonego w wyniku promieniowania
cieplnego jest proporcjonalna do temperatury w czwartej potędze:
=⋅⋅
T
4
,
W /m
2
, gdzie:
- stała Stefana - Bolzmanna (promieniowania ciała doskonale czarnego
5,67⋅10
−
8
W /m
2
⋅
K
4
),
= 0 – 1 – emisyjność (0 – ciało białe; 1 – ciało doskonale czarne).
•
gęstość strumienia ciepła wymienianego przez promieniowanie pomiędzy równoległymi
powierzchniami płaskimi:
q
1,2
=
C
0
1
1
1
2
−
1
⋅[
T
1
100
4
−
T
2
100
4
]
,
gdzie
C
0
- stała promieniowania powierzchni doskonale czarnej,
- emisyjność względna.
•
temperaturę płomienia wylicza się z średniej temperatury w całym palenisku.
1.10. Spalanie paliw stałych, ciekłych, gazowych - specyfika spalania,
stechiometria.
Zapłon - intensywna reakcja egzotermiczna wywołana w mieszaninie palnej, najpowszechniejszy sposób
doprowadzania mieszaniny palnej do procesu spalania. Wyróżnia się:
zapłon wymuszony - iskra elektryczna, płomień pilotujący, gorące ścianki lub spaliny,
samozapłon - równomierne podgrzewania całej masy mieszaniny palnej.
1.10.1. Paliwa stałe (1.10. A. pdf).w energetyce: węgiel, muły węglowe, koks petrochemiczny, biomasa,
odpady.
Organizacja spalania węgla (1.10.A str. 1 -2):
a) paleniska rusztowe:
•
z rusztem stałym (muł, miał, drobny groszek, orzech, gruby),
•
z rusztem ruchomym (groszek, orzech 10 - 30 mm),
b) złoże fluidalne:
•
pęcherzykowe (< 25 mm) - kotły mniejszej mocy,
•
cyrkulujące (< 6 mm) - energetyka zawodowa,
c)płomień pyłowy (węgiel kamienny: R
90
= 25-30%, R
200
< 8%, węgiel brunatny: R
90
= 48-55%, R
200
= 25-
32%, R
1000
= 3-5%)
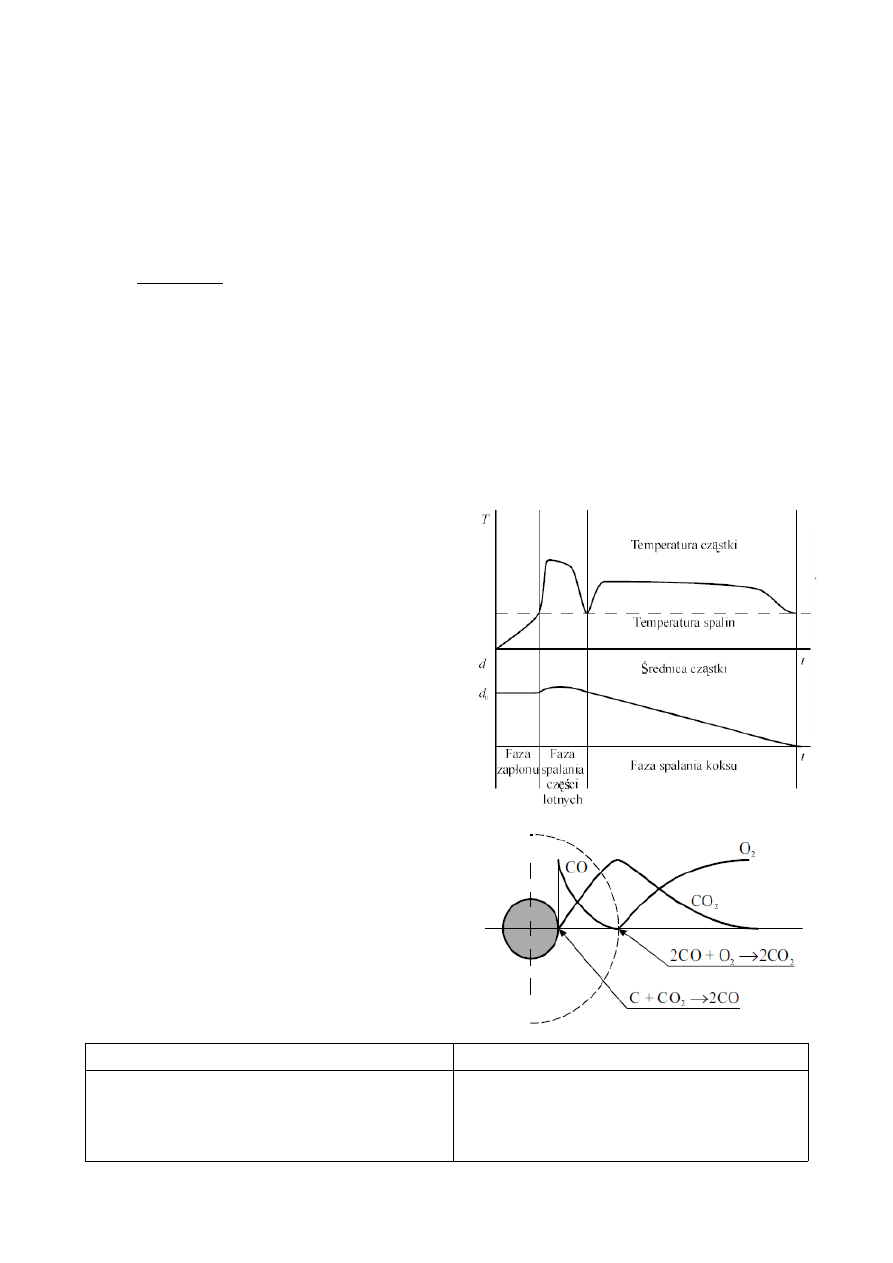
1. Spalanie pojedynczej cząstki węgla, etapy:
•
nagrzewanie - po utracie wody temperatura
cząstki wzrasta, aż do zapoczątkowania
termicznego rozkładu węgla (pirolizy). Czas
potrzebny do uzyskania temperatury zapłonu -
czas indukcji zapłonu.
•
zapłon części lotnych
•
wydzielenie i spalenie części lotnych -
wydzielone z węgla części lotne ulegają
zapłonowi i spalają się w płomieniu gazowym, a
przekazywane od płomienia ciepło przyspiesza
pirolizę węgla.
•
spalanie pozostałości koksowej - pozostałość
koksowa po odgazowaniu węgla,
bezpłomieniowy charakter reagowania z
tlenem z powietrza, spala się powoli czas
spalania pozostałości koksowej jest o rząd
wielkości większy od czasu spalania części
lotnych), temperatura spalania cząstki węgla:
1300-1700
o
C.
Procesy fizyczne
Procesy chemiczne
•
parowanie wody (suszenie)
•
pęcznienie (dylatacja) cząstek węgla
•
powstawanie porowatej struktury karbonizatu
•
przemiany fizyczne substancji mineralnej
•
piroliza węgla
•
spalanie części lotnych
•
spalanie pozostałości koksowej
•
przemiany chemiczne substancji mineralnej
2. Spalanie pyłu węglowego (1.10.A str. 19).
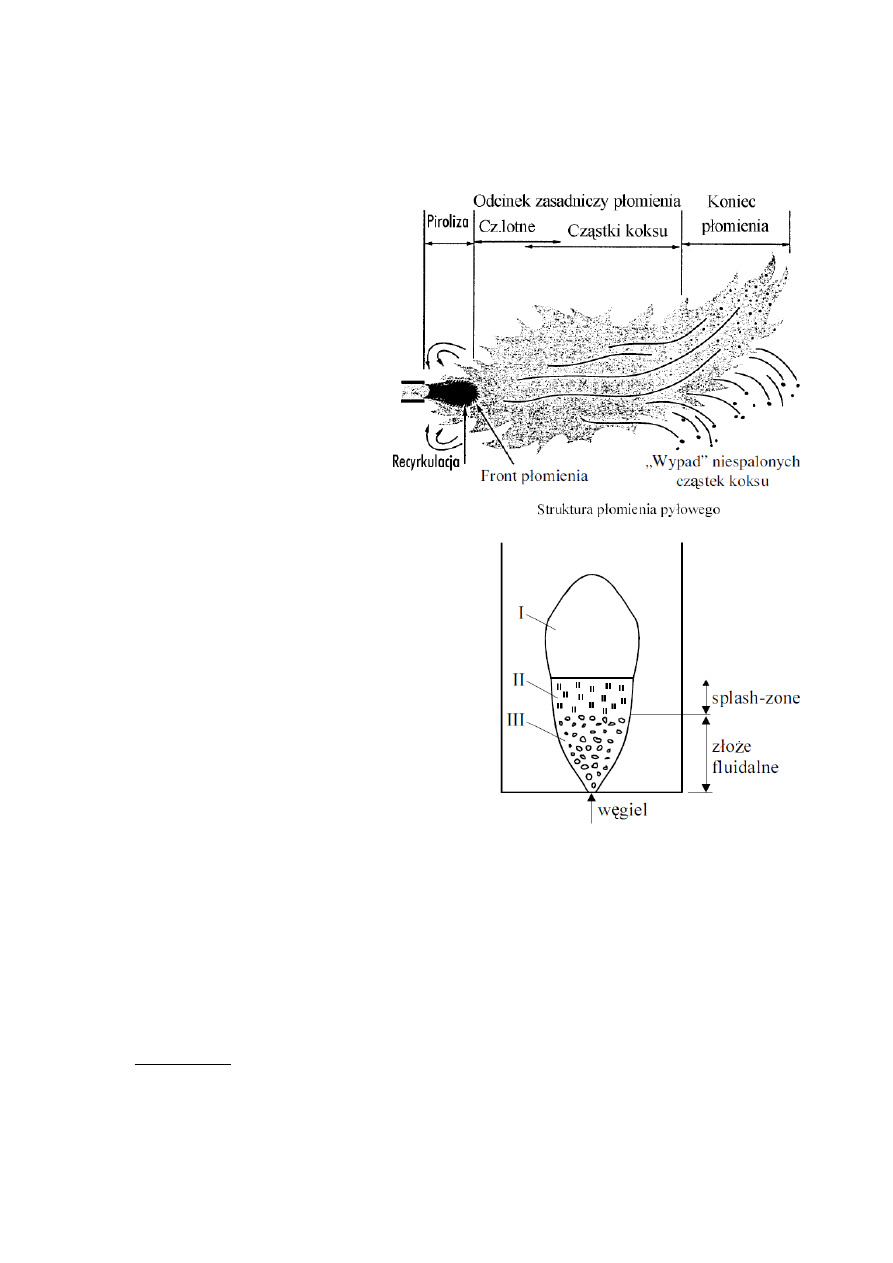
Płomień pyłowy - wypływające z dyszy palnika pyłowego turbulentna struga mieszanki pyłowo-gazowej.
Wstępujące do warstwy granicznej gorące spaliny mieszają się ze świeżą mieszanką, przyczyniając się do
zapłonu cząstek węgla.
I - rdzeń gęstej strugi mieszanki, w której
następuje wydzielenie części lotnych, na
którego brzegu formuje się front spalania
części lotnych i mikronowych cząstek
węgla.
II - strefa spalania części lotnych,
charakteryzujący się silnym promieniem.
Strefy spalania części lotnych i pozostałości
koksowej stanowią zasadniczy odcinek
płomienia pyłowego.
III - koniec tworzy strefa dopalania
większych cząstek węgla.
3. Spalanie w warstwie fluidalnej (1.10.A
str. 28).
Zróżnicowanie uziarnienie złoża = segregacja złoża. Dolną
gęstą część warstwy fluidalnej o charakterze
pęcherzykowym tworzą grubsze frakcje cząstek, drobniejsze
frakcje - część górną, a frakcje najdrobniejsze - wynoszone
do górnej części paleniska zakończonego separatorem pyłu,
z którego cząstki są zawracane do dolnej części kotła.
Materiał złoża składa się z:
•
węgla (3% na dole, 5% u góry),
•
popiołu,
•
sorbentu wapniowego,
•
piasku (krzemionki) tworzącego złoże pierwotne.
Budowa złoża:
I - gęsta część, nagrzewanie i odgazowanie węgla, spalanie
części lotnych w formie pęcherzy, spalanie większych
cząstek pozostałości koksowej (charakter dyfuzyjny).
II - splash-zone, rzadka strefa pośrednia, kinetyczne spalanie części lotnych,
III - dyfuzyjne spalanie części lotnych.
Zalety:
•
czas przebywania cząstek węgla w złożu zależny od wypalenia,
•
niska temperatura w warstwie (750-950
O
C), niższa od temp. mięknięcia popiołu; wiązanie SO
2
przez
sorbenty wapniowe w 850
O
C.
•
czas indukcji zapłonu o 50% krótszy niż w płomieniu pyłowym.
•
duża sprawność spalania, małą emisja NO
x
, SO
2
, możliwość spalania paliw odpadowych.
1.10.2. Paliwa ciekłe (1.10. B. pdf).
Fazy spalania paliwa ciekłego:
•
odparowanie,
•
spalanie par.
1. Spalanie pojedynczej kropli paliwa.
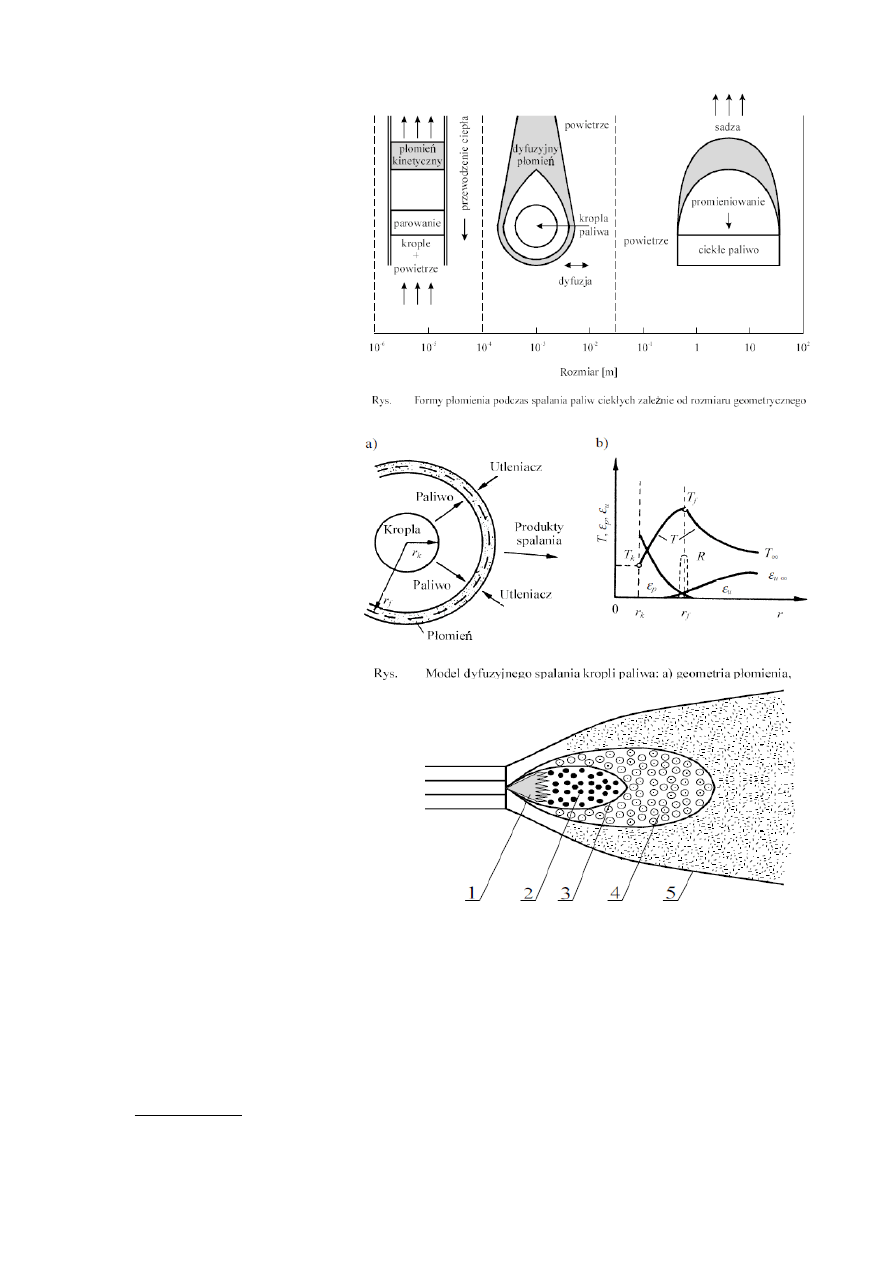
Spalanie paliwa ciekłego polega
głównie na rozpyleniu i spaleniu zbioru
kropel, wg modelu sferyczno -
symetrycznego.
a) małe krople szybko parują, a
pary tworzą z powietrzem
homogeniczną mieszaninę palną.
Płomień ma charakter kinetyczny.
Szybkość spalania = prędkość
propagacji płomienia.
b) większe krople spalają się
indywidualnie. Wokół kropli tworzy się
dyfuzyjny płomień, do którego tlen
dopływa z otoczenia, a pary dopływają
z powierzchni kropli. Szybkość
spalania = szybkość parowania.
c) największe krople: unoszące
się gorące produkty spalania powodują
napływ na powierzchnię cieczy
chłodniejszego powietrza zmniejszając
gradient temperatury. Dostęp powietrza
do par jest utrudniony, dlatego płomień
jest bogaty i produkuje szadzę. Ciepło
od płomienia do paliwa przekazywane
głównie przez promieniowanie.
2. Płomień rozpylonego paliwa.
1 - strefa rozpylonej cieczy,
2 - strefa parowania -duża koncentracja kropel,
brak spalania, płomień na granicy strefy,
3 - strefa zapłonu (zapłon par i spalanie
homogeniczne),
4 - strefa spalania indywidualnego kropel
(heterogeniczne),
5 - granice płomienia.
W celu zwiększenia szybkości spalania i poprawy stabilności płomienia tworzy się wewnętrzne strefy
recyrkulacji spalin wzbogaconych paliwem poprzez zawirowanie strugi powietrza. Rozpylanie paliw
ciekłych za pomocą rozpylaczy:
•
strumieniowych,
•
wirowych,
•
strumieniowo - wirowych,
•
pneumatycznych,
•
rotacyjnych.
1.10.3. Paliwa gazowe (1.10. C. pdf).

1.10.4. Stechiometria.
1. Znajomość składu paliwa oraz mas molowych podstawowych pierwiastków i ich związków (C,
H, N, S, O, CH4, C2H6, SO2, etc.)
a) Paliwa gazowe: metan, etan, propan, butan – wzór C
n
H
2n+2
2. Umiejętność zapisu i uzgodnienia reakcji spalania
a) Reakcje utleniania wszystkich składników palnych paliwa w celu wyznaczenia teoretycznego
zapotrzebowania na tlen
m
O2
=
∑
m
i
⋅
X
i
– udział masowy O
2
w paliwie
,
gdzie:
m
i
– ilość tlenu potrzebna do spalenia składnika i
X
i
−
udział składnika i w paliwie
b) Uogólnione równanie spalanie:
1 mol paliwamO
2
3,76⋅N
2
=
n
1
⋅
CO
2
n
2
⋅
H
2
On
3
⋅
COn
4
⋅
H
2
n
5
⋅
O
2
n
6
⋅
N
2
n
7
⋅
SO
2
Należy zapamiętać, że dla paliwa gazowego podawane są udziały objętościowe, które są
równoważne udziałom molowym, natomiast dla paliwa stałego podaje się udziały masowe, które w
uogólnionym równaniu spalania należy podzielić przez masy molowe poszczególnych
pierwiastków.
c) W zależności od warunków spalania:
•
λ<1 nie występuje człon n
5
O
2
•
λ=1 nie występują człony n
5
O
2
,
n
3
CO, n
4
H
2
•
λ>1 nie występują człony n
3
CO, n
4
H
2
Wyszukiwarka
Podobne podstrony:
Zagadnienia teoretyczneAcw
ZAGADNIENIA TEORETYCZNE ĆW.7-8, Studia TOŚ, chemia analityczna-labor. semestr III
WHEATSTO, Zagadnienia teoretyczne
ask zagadnienia teoretyczne
ZAGADNIENIA TEORETYCZNE DO SAMODZIELNEGO PRZYGOTOWANIA NA KOLOKWIUM 20, uniwersytet warmińsko-mazurs
zagadnie z teoretycznych na egzamin 2 wersja, Edukacja Przedszkolna I, II i III rok (notatki), Teore
32 opis zagadnien, OMÓWIENIE ZAGADNIEŃ TEORETYCZNYCH
SPEKTROS, Zagadnienia teoretyczne
czcionki szkolne, LAB2, I. Zagadnienia teoretyczne
PRAWO OH, ZAGADNIENIA TEORETYCZNE
Zagadnienia teoretyczne, Studia, Pracownie, I pracownia, 59 Rezonans elektromagnetyczny, Marek
ZAGADNIENIA TEORETYCZNE ĆW.1-3, Studia TOŚ, chemia analityczna-labor. semestr III
,laboratorium podstaw fizyki,wyznaczenie składowej poziomej magnetyzmu ziemskiego za pomocą busoli s
Zagadnienia teoretyczne do ćwiczeń, Spektrofotometria
Modul 1 Tworczosc zagadnienia teoretyczne(1)
Zagadnienia teoretyczne 41, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr
ZAGADNIENIA TEORETYCZNE ĆW. 4-6, Studia TOŚ, chemia analityczna-labor. semestr III
Zagadnienia teoretyczne
więcej podobnych podstron